Versuchsprotokoll. Luminol Kaltes Feuerwerk
|
|
|
- Irmela Weiß
- vor 5 Jahren
- Abrufe
Transkript
1 Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/ Schulversuche Assistentin: Katrin Hohmann Versuchsprotokoll Luminol Kaltes Feuerwerk Gruppe 12, Typ: Eigenversuch 1. Reaktionsgleichung H 2 H 2 H H 2 ah 2 H H 2 2. Zeitbedarf Vorbereitung Durchführung achbearbeitung Teil 1 30 min 20 min 5 min 3. Chemikalien Einsatz in ame Summenformel Gefahrensymbol R-Sätze S-Sätze der Schule Luminol C 8 H Xi 36/37/38 26, 36 S I Wasser H S I atronlauge ah C 35 26, S I (w = 0,1) 37/39, 45 Kaliumhexacyanoferrat K 3 [Fe(C) 6 ] Xi 32, 26, 36 S I (III) (w = 0,3) 36/37/38 Wasserstoffperoxid (w = 0,3) H 2 2 C 22,41 17, 26, 28, 36/37/39, 45 S I Fluorescein C 10 H , 24/25 S I 1
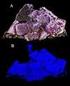
2 Gefahrensymbole 4. Materialien/Geräte 3 Bechergläser, Spatel, Messzylinder, Glasrohr, Stopfen mit Loch, Erlenmeyerkolben 5. Versuchsaufbau Abb. 1: Die chemolumineszierende Flüssigkeit wird zur floureszierenden Lösung gegeben 6. Versuchsdurchführung Man löst 0,1 g Luminol in 45 ml Wasser und gibt 5 ml 10 %ige atronlauge hinzu. In einem zweiten Becherglas löst man 1,5 g Kaliumhexacyanoferrat (III) in 48, 5 ml Wasser. un gibt man die Lösungen in ein, mit 700 ml Wasser gefülltes, großes Becherglas und fügt 3 ml 30 %ige Wasserstoffperoxid-Lösung hinzu. Anschließend wird diese Lösung durch das Glasrohr (beserer Showeffekt) in den Erelenmeyerkolben geschüttetet, in dem sich eine fluoreszierende Flüssigkeit befindet (z.b. Fluorescein). 7. Beobachtung Die Lösung in Becherglas 1 ist farblos und klar, die in Becherglas 2 gelb und klar. Gibt man diese beiden Lösungen in 700 ml Wasser so leuchtet dieses auf den ersten Blick hellgelb. Schaut man sich die Lösung jedoch in völliger Dunkelheit an, so ist kein Leuchten zu beobachten. Sobald man jedoch Wasserstoffperoxid-Lösung hinzu gibt, leuchtet die Lösungen blau auf (Abb. 2). Das Leuchten ist auch in völliger Dunkelheit zu sehen, wenn auch nur schwach. Überführt man nun diese Lösung in den Erlenmeyerkolben mit der farblosen Fluorescein-Lösung, so leuchtet diese in Dunkelheit hellgelb (Abb. 3). 2
3 Abb. 2: Lösung nach Zugabe von Wasserstoffperoxid Abb. 3: Fluorescein-Lösung nach Zugabe der Lösung aus Abb Entsorgung Die Lösungen werden ausgekocht und im Behälter für organische Lösungsmittel entsorgt. 9. Fachliche Analyse Im ersten Schritt wird Luminol mit atronlauge versetzt. Dabei bindet je eine Hydroxid-Gruppe der atronlauge ein Wasserstoffatom der beiden Stickstoffatome und spaltet sich als Wasser ab. Die Doppelbindung der Sauerstoffatome bricht auf, es bildet sich eine Einfachbindung aus, wodurch die Sauerstoffatome eine negative Ladung bekommen, die von den zwei a-ionen ausgeglichen wird. Die Bindungen der Stickstoffatome zu den Wasserstoffatomen bleiben am Stickstoff zurück und bilden eine neue Bindung aus, wodurch die beiden Doppelbindungen entstehen. H 2 H 2 - a + H + 2 ah H H 2 a + [6] Wasserstoffperoxid wird durch die Metallionen des roten Blutlaugensalzes, die als Katalysator dienen, zersetzt in Wasser und Sauerstoff. (Fe III ) 2 H H Der Sauerstoff greift im nächsten Schritt das Dianion an. Die Doppelbindung des Sauerstoffatoms bricht auf und es bildet sich eine Einfachbindung aus. Eines der Sauerstoffatome greift das Kohlenstoffatom des Dianions an und bindet sich an dieses. Das andere Sauerstoffatom bindet sich an das andere Kohlenstoffatom, nimmt dabei jedoch noch die zwei Elektronen der ehemaligen 3
4 Kohlenstoff-Stickstoff-Bindung auf. un spaltet sich Stickstoff ab. Dabei brechen die Bindungen der Stickstoffatome zu den Kohlenstoffatomen, wobei die Elektronen einer Bindung bei einem Stickstoffatom bleiben und für die Ausbildung der Dreifachbindung zwischen den Stickstoffmolekülen verantwortlich sind. Die anderen Elektronen der ehemaligen Kohlenstoff-Stickstoff-Bindung werden auf das Sauerstoffatom übertragen, wodurch dieses die Bindung zum anderen Sauerstoffatom bricht und eine negative Ladung erhält. Die Bindungselektronen wandern mit zum anderen Sauerstoffatom, werden dort zum freien Elektronenpaar und geben diesem Sauerstoff ebenfalls eine negative Ladung. Je ein freies Elektronenpaar der Sauerstoffatome des ehemaligen Luminols klappen rum zum benachbarten Kohlenstoffatom und bilden somit die neuen Doppelbindungen aus. H 2 - H 2 - H Korrekterweise sei hier angemerkt, dass die oben angeführte Valenzschreibweise des Sauerstoffs nicht korrekt ist. Sie bringt zwar den Doppelbindungscharakter des Moleküls zum Ausdruck, missachtet jedoch die die besetzten antibindenden rbitale und den Radikalcharakter des Sauerstoffs. Bis heute ist noch keine richtige Valenzschreibweise für das Sauerstoffmolekül gefunden worden. Beim letzten Reaktionsschritt, der Abspaltung des Stickstoffs, wird Energie in Form von Licht frei. ur sehr wenig Energie geht in Form von Wärme verloren. Da die Temperatur der Lösung weit unter den Glühtemperaturen der beteiligten Stoffe liegt, spricht man auch von Kaltem Licht. Damit ein System chemoluminesziert, also Licht emittiert, muss die Reaktion exergonisch verlaufen, es muss also logischerweise Energie vom System abgegeben werden. Bei dieser Reaktion beträgt die freiwerdende Energie ca. 254 kj/mol betragen, da blaues Licht mit der Wellenlänge von 450 nm emittiert wird. An der Reaktion müssen außerdem Atome oder Moleküle beteiligt sein, die sich unter den gegebenen Bedingungen in einen elektronisch angeregten Zustand überführen lassen, damit sie beim Rückfall in den Grundzustand ihre Energie in Form von Licht abgeben können. Die bei der Reaktion frei werdende Energie wird beim Zusammentreffen der chemolumineszierenden Lösung mit der fluoreszierenden Lösung übertragen, d.h. die Atome bzw. Moleküle dieser Substanz werden durch die frei werdende Energie angeregt und anschließend in Form von Licht einer für den Farbstoff charakteristischen Wellenlänge emittiert. Bei diesem Versuch war im Erlenmeyerkolben Fluorescein, welches durch Zugabe der blau-chemolumineszierenden Lösung gelbgrün chemolumineszierte. Das Fluoressein hat dabei das Licht der Chemolumineszenz absorbiert und schließlich in Form von gelbgrüner Fluoreszenz emittiert. 4
5 Die Chemolumineszenz ist eine Art der Lumineszenz. Hier entsteht die Anregung durch eine chemische Reaktion. Es gibt aber noch andere Arten der Lumineszenz, wie z.b. die Biolumineszenz, als Spezialform und Chemolumineszenz, oder, die Photolumineszenz mit den beiden Formen der Fluoreszenz und der Phosphoreszenz. Die Biolumineszenz verläuft wie die Chemolumineszenz, nur eben durch biochemische Reaktionen. Der bekannteste Vertreter ist wohl das Glühwürmchen. Als Startsubstanz dient das Luciferin, welches enzymatisch oxydiert wird, wobei die Energie in Form von Licht frei gesetzt wird. Abb. 4: Glühwürmchen [8] Ein weiterer großer Bereich der Lumineszenz ist die Photolumineszenz. Unterschieden werden die Fluoreszenz und die Phophoreszenz. Die Substanz wird dabei mit Licht oder UV-Strahlung bestrahlt, wodurch Elektronen auf einen höheren Energie-Zustand angehoben werden. Sobald diese von diesem Zustand zurück fallen emittieren sie die Energie in Form von Licht. Abb. 5: Das Elektron wird durch Anregungslicht (UV-Licht) in den angeregten Zustand überführt. Da sich das Elektron aus energetischen Gründen hier nicht halten kann, fällt es unter Emmission von längerwelligem Licht in den Grundzustand zurück, was der Mensch als Fluoreszenz wahrnimmt. [5] Von Fluoreszenz spricht man jedoch nur dann, wenn das Licht innerhalb von 10 sek. nach der Bestrahlung emittiert wird. Wird das Licht nach mehr als 10 sek. emittiert, spricht man von Phosphoreszenz. Das achleuchten kann in diesem Fall bis zu mehreren Stunden andauern. Die Chemolumineszenz begegnet uns im Alltag in Form der Knicklichter. Diese bestehen sozusagen aus zwei Röhren. In der äußeren befindet sich meist Diphenyloxalat und ein Farbstoff, in dem inneren Röhrchen befindet sich Wasserstoffperoxid. Wird das innere Röhrchen, welches aus Glas besteht, zerbrochen, so tritt die Wasserstoffperoxid-Lösung aus. 5
6 1) Ein Knicklicht besteht aus einem äußeren Röhrchen aus Plastik. 2) Das innere Glasröhrchen enthält eine Wasserstoffperoxid- Lösung. 3) Die Flüssigkeit im äußeren Röhrchen enthält einen Farbstoff (z.b. 9,10-Bis(phenylethynyl)anthracen) und Diphenyloxalat. 4) Durch Knicken wird das Glasröhrchen zerbrochen, die Wasserstoffperoxid-Lösung tritt aus 5) und reagiert mit dem Diphenyoxalat, wobei Chemolumineszenz auftritt. Abb. 6: Funktionsweise eines Knicklichts [9] Die Reaktionsgleichung lässt sich dementsprechend folgendermaßen zusammenfassen: + H 2 2 H Farbstoff 2 C 2 + Farbstoff* Farbstoff* Farbstoff + hv [9] Das Sternchen steht für den angeregten Zustand. Der Farbstoff wird durch die Energie, die beim Zerfall des Esters zu Kohlenstoffdioxid frei wird, auf einen höheren elektronischen Zustand angeregt. Das dieses iveau energetisch sehr instabil ist, fällt das Molekül jedoch wieder zurück in den Ausgangszustand und emittiert dabei Licht. Die Knicklichter kennen wir zwar heute vor allem von Partys, ihre eigentliche Verwendung ist jedoch eine sehr sinnvolle. Sie dienen z.b. als otbeleuchtung oder Markierung von zu transportierenden Gütern, weil sie leicht mitzunehmen und gut zu verwenden sind. Ebenso dienen sie Fischern, um die Spitze der Angel im Wasser erkennen zu können. 10. Didaktische Analyse Die Lumineszenz wird im Lehrplan nicht explizit erwähnt und passt daher am besten in die Jahrgangstufe 12 unter das Thema Farbstoffe. Bei den Schülern wird durch die leuchtende Flüssigkeit sicherlich Interesse geweckt, zumal sie gleich eine Verknüpfung zu den Knicklichtern schlagen werden, die sie von Partys kennen. Sie werden dadurch nicht nur verstehen warum Flüssigkeiten von sich aus Leuchten können, sondern auch in der Lage sein nach zu vollziehen, 6
7 woher die unterschiedlichen Farben stammen. Das Ergebnis des Luminol-Versuches ist vor alllem in Dunkelheit sehr gut sichtbar. Da die Substanz Luminol jedoch mit 5 g für 43 Euro sehr teuer ist, empfiehlt sich der Versuch nicht als Gruppenversuch für Schüler. Man könnte jedoch die verschiedenen Lösungen von je zwei Schülern herstellen lassen und schließlich auch das Überführen in die fluoreszierende Lösung von einem Schüler durchführen lassen. Der Materialaufwand ist alles andere als hoch, lediglich die Herstellung der Lösung nimmt etwas Zeit in Anspruch. Das Thema Lumineszenz eignet sich hervorragend um Referate für stillere Schüler zu verteilen. Vorher sollten sie jedoch wissen worauf die Farbigkeit von Feststoffen beruht. Bevor die Chemolumineszenz besprochen wird, sollte die Fluoreszenz besprochen werden, z.b. mit dem achweis von Vitamin B1 und B2, denn bei dem Versuch spielt lediglich die Emission von Licht eine Rolle und noch nicht die chemische Reaktion, die auch in der Lage sein kann Elektronen anzuregen. 11. Literatur Versuchsquelle: [1] Seilnacht, T., Kaltes Feuerwerk, (letzter Zugriff: , 15:09 Uhr) Fachquellen: [2] Andrade, A., Chemolumineszenz und Farbstoffe, Eberhard Karls Universität Tübingen, Fakultät für Chemie und Pharmazie, 2008, (letzter Zugriff: , 15:09 Uhr) [3] Dörfler, A., Chemolumineszenz, Universität Bayreuth, Didaktik der Chemie, molumineszenz, (letzter Zugriff: , 15:09 Uhr) [4] Lehrplan Chemie für die Jahrgansstufen G7 bis G12 des hessischen Kultusministeriums, 2005 ( [5] PAS-Tech Gasanalytik GmbH, Hamburg, Photo Akustische Spektroskopie, (letzter Zugriff: , 15:09 Uhr) [6] Rother, I., Chemilumineszenz, Phillips-Universität Marburg, Fachbereich Chemie, 1980, (letzter Zugriff: , 15:09 Uhr) [7] Unfallkasse Hesse (UKH), Hessisches Kultusministerium, Hessisches GefahrstoffInformations System Schule (HessGISS), Version 11.0, 2006/2007 [8] Westdeutscher Rundfunkt Köln, Jetzt ist Glühwürmchen-Zeit, (letzter Zugriff: , 15:09 Uhr) [9] Wikimedia Foundation Inc., (letzter Zugriff: , 15:09 Uhr) 7
Versuchsprotokoll. Züchtung von Kandiszucker-Kristallen
 Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 15.1.09 Schulversuche Assistentin: Katrin Hohmann Versuchsprotokoll Züchtung von Kandiszucker-Kristallen
Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 15.1.09 Schulversuche Assistentin: Katrin Hohmann Versuchsprotokoll Züchtung von Kandiszucker-Kristallen
Versuchsprotokoll. Maillard-Reaktion
 Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 15.1.08 Schulversuche Assistentin: Katrin ohmann Versuchsprotokoll Maillard-Reaktion Gruppe 10,
Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 15.1.08 Schulversuche Assistentin: Katrin ohmann Versuchsprotokoll Maillard-Reaktion Gruppe 10,
Versuchsprotokoll. Gummibärchen-Indikator
 Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 19.12.08 Schulversuche Assistentin: Katrin Hohmann Versuchsprotokoll Gummibärchen-Indikator Gruppe
Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 19.12.08 Schulversuche Assistentin: Katrin Hohmann Versuchsprotokoll Gummibärchen-Indikator Gruppe
Versuchsprotokoll. Reaktivität von Alkylbromiden. Gruppe 5, Typ: Pflichtversuch. AgBr + HNO 3 + H 3 C C C C. AgBr + HNO 3 +
 Anna-Lena Eicke Philipps-Universität Marburg rganisch-hemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 20.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll Reaktivität von Alkylbromiden Gruppe
Anna-Lena Eicke Philipps-Universität Marburg rganisch-hemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 20.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll Reaktivität von Alkylbromiden Gruppe
Versuchsprotokoll. Kernbromierung und Seitenkettenbromierung von Xylol. Gruppe 4, Typ: Assiversuch KKK SSS
 Anna-Lena Eicke Philipps-Universität Marburg Organisch-Chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 19.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll Kernbromierung und Seitenkettenbromierung
Anna-Lena Eicke Philipps-Universität Marburg Organisch-Chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 19.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll Kernbromierung und Seitenkettenbromierung
Versuchsprotokoll. Nitrierung von Phenol. Gruppe 4, Typ: Pflichtversuch O O - N
 Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 19.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll itrierung von Phenol Gruppe 4,
Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 19.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll itrierung von Phenol Gruppe 4,
Versuchsprotokoll. Synthese von Aromastoffen. Gruppe 7, Typ: Pflichtversuch O OH H 3 C C C C C CH 3 H H 3 C C C C C O C C OH
 Anna-Lena Eicke Philipps-Universität Marburg rganisch-hemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 26.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll Synthese von Aromastoffen Gruppe
Anna-Lena Eicke Philipps-Universität Marburg rganisch-hemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 26.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll Synthese von Aromastoffen Gruppe
Versuchsprotokoll. Mischbarkeit von Alkoholen
 Anna-Lena Eicke Philipps-Universität Marburg Organisch-Chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 20.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll Mischbarkeit von Alkoholen Gruppe
Anna-Lena Eicke Philipps-Universität Marburg Organisch-Chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 20.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll Mischbarkeit von Alkoholen Gruppe
Versuchsprotokoll. Nachweis von Tensiden in Kernseife, Spülmittel und Waschmittel
 Anna-Lena Eicke Philipps-Universität Marburg Organisch-Chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 5.12.08 Schulversuche Assistentin: Katrin Hohmann Versuchsprotokoll Nachweis von Tensiden in
Anna-Lena Eicke Philipps-Universität Marburg Organisch-Chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 5.12.08 Schulversuche Assistentin: Katrin Hohmann Versuchsprotokoll Nachweis von Tensiden in
Versuchsprotokoll. Herstellung von Plexiglas
 Anna-Lena Eicke Philipps-Universität Marburg rganisch-hemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 21.01.09 Schulversuche Assistentin: Katrin ohmann Versuchsprotokoll erstellung von Plexiglas Gruppe
Anna-Lena Eicke Philipps-Universität Marburg rganisch-hemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 21.01.09 Schulversuche Assistentin: Katrin ohmann Versuchsprotokoll erstellung von Plexiglas Gruppe
Organisch-chemisches Praktikum für Studierende des Lehramts WS 06/07 Leitung: Prof. Hilt/ Dr. Reiß. Schulversuch-Protokoll Jan gr.
 rganisch-chemisches Praktikum für Studierende des Lehramts WS 06/07 Leitung: Prof. ilt/ Dr. Reiß Schulversuch-Protokoll 26.12.2007 Jan gr. Austing 1) Versuchsbezeichnung: Darstellung von β-aphtholorange
rganisch-chemisches Praktikum für Studierende des Lehramts WS 06/07 Leitung: Prof. ilt/ Dr. Reiß Schulversuch-Protokoll 26.12.2007 Jan gr. Austing 1) Versuchsbezeichnung: Darstellung von β-aphtholorange
Versuchsprotokoll. Gruppe 12, Typ: Pflichtversuch - H + Einsatz in der Schule Sulfanilsäure NH 2 C 6 H 4 SO 3 H Xi 36/38, 43 24, 37 S I
 Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 13.01.09 Schulversuche Assistentin: Katrin ohmann Versuchsprotokoll Synthese von β-aphtolorange
Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 13.01.09 Schulversuche Assistentin: Katrin ohmann Versuchsprotokoll Synthese von β-aphtolorange
Fluoreszierende Verbindungen
 Thema: Fluoreszierende Verbindungen Klasse 11 / 12 Schulversuchspraktikum Bastian Hollemann Sommersemester 2015 Klassenstufen 11 & 12 Fluoreszierende Verbindungen Thema: Fluoreszierende Verbindungen Klasse
Thema: Fluoreszierende Verbindungen Klasse 11 / 12 Schulversuchspraktikum Bastian Hollemann Sommersemester 2015 Klassenstufen 11 & 12 Fluoreszierende Verbindungen Thema: Fluoreszierende Verbindungen Klasse
Versuchsprotokoll. ph-abhängigkeit der Getränkefarben
 AnnaLena Eicke PhilippsUniversität Marburg OrganischChemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 15.1.09 Schulversuche Assistentin: Katrin Hohmann Versuchsprotokoll phabhängigkeit der Getränkefarben
AnnaLena Eicke PhilippsUniversität Marburg OrganischChemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 15.1.09 Schulversuche Assistentin: Katrin Hohmann Versuchsprotokoll phabhängigkeit der Getränkefarben
Darstellung von Phenolphthalein und Fluorescein
 Philipps-Universität Marburg 04. Juli 2007 Fachbereich 15: Chemie rganisch-chemisches Grundpraktikum für Lehramtskandidaten Praktikumsleiter: Dr. Philipp Reiß SS 2007 Mario Gerwig Versuch: Darstellung
Philipps-Universität Marburg 04. Juli 2007 Fachbereich 15: Chemie rganisch-chemisches Grundpraktikum für Lehramtskandidaten Praktikumsleiter: Dr. Philipp Reiß SS 2007 Mario Gerwig Versuch: Darstellung
Schulversuch-Protokoll Jan gr. Austing
 rganisch-chemisches Praktikum für Studierende des Lehramts WS 06/07 Leitung: Prof. ilt/ Dr. Reiß Schulversuch-Protokoll 6.1.007 Jan gr. Austing 1) Versuchsbezeichnung: xidation von Milchsäure ) Reaktionsgleichung:
rganisch-chemisches Praktikum für Studierende des Lehramts WS 06/07 Leitung: Prof. ilt/ Dr. Reiß Schulversuch-Protokoll 6.1.007 Jan gr. Austing 1) Versuchsbezeichnung: xidation von Milchsäure ) Reaktionsgleichung:
Versuchsprotokoll. Herstellung von Polyurethanschaum
 Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. eiß WS 08/09 15.1.09 Schulversuche Assistentin: Katrin ohmann Versuchsprotokoll erstellung von Polyurethanschaum
Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. eiß WS 08/09 15.1.09 Schulversuche Assistentin: Katrin ohmann Versuchsprotokoll erstellung von Polyurethanschaum
Schulversuchspraktikum. Isabel Großhennig. Sommersemester Klassenstufen 11 & 12. Farbstoffe. Kurzprotokoll
 Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 11 & 12 Farbstoffe Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll für die Klassenstufen 11 und 12 zum Thema Farbstoffe enthält
Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 11 & 12 Farbstoffe Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll für die Klassenstufen 11 und 12 zum Thema Farbstoffe enthält
Demonstrationsversuch Chemilumineszenz
 Demonstrationsversuch Chemilumineszenz Einleitung Als Chemilumineszenz wird eine mit einer chemischen Reaktion verbundene Lumineszenz bezeichnet, d. h. die Emission von Licht, meist im sichtbaren Bereich
Demonstrationsversuch Chemilumineszenz Einleitung Als Chemilumineszenz wird eine mit einer chemischen Reaktion verbundene Lumineszenz bezeichnet, d. h. die Emission von Licht, meist im sichtbaren Bereich
Bromierung von Hexan G2 Pflichtversuch Bromierung von Cyclohexan und Cyclohexen G3 Pflichtversuch
 Anna-Lena Eicke Philipps-Universität Marburg Organisch-hemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 13.11.08 Schulversuche Assistentin: Beate Abé omierung von exan G2 Pflichtversuch omierung von
Anna-Lena Eicke Philipps-Universität Marburg Organisch-hemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 13.11.08 Schulversuche Assistentin: Beate Abé omierung von exan G2 Pflichtversuch omierung von
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Beate Abé Name: Johannes Hergt Datum: 30.11.2010 Gruppe 6: Alkohole Versuch (Mischbarkeit):
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Beate Abé Name: Johannes Hergt Datum: 30.11.2010 Gruppe 6: Alkohole Versuch (Mischbarkeit):
Versuchsprotokoll. Springende Bällchen
 Anna-Lena Eicke Philipps-Universität Marburg Organisch-Chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 15.1.09 Schulversuche Assistentin: Katrin ohmann Versuchsprotokoll Springende Bällchen Gruppe
Anna-Lena Eicke Philipps-Universität Marburg Organisch-Chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 15.1.09 Schulversuche Assistentin: Katrin ohmann Versuchsprotokoll Springende Bällchen Gruppe
Versuch: Qualitativer Nachweis von Kohlenstoff und Wasserstoff
 Philipps-Universität Marburg 20.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 1, Einführung in die OC Versuch: Qualitativer Nachweis
Philipps-Universität Marburg 20.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 1, Einführung in die OC Versuch: Qualitativer Nachweis
Versuch: Isolierung von Citronensäure aus Zitronen
 Philipps-Universität Marburg 10.02.2008 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 11, Naturstoffe und Lebensmittel Versuch: Isolierung
Philipps-Universität Marburg 10.02.2008 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 11, Naturstoffe und Lebensmittel Versuch: Isolierung
Arbeitsblatt Wie entstehen Farben?
 Arbeitsblatt Wie entstehen Farben? Der für das menschliche Auge sichtbare Wellenlängenbereich liegt bei 380-750 nm. Farbstoffe sind in der Lage bestimmte Wellenlängen des Lichts zu absorbieren und eine
Arbeitsblatt Wie entstehen Farben? Der für das menschliche Auge sichtbare Wellenlängenbereich liegt bei 380-750 nm. Farbstoffe sind in der Lage bestimmte Wellenlängen des Lichts zu absorbieren und eine
Versuchsprotokoll. Oxidation von Brenztraubensäure. Gruppe 7, Typ: Assiversuch. Cr 2 O 7 SO 4 /H 2
 Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 27.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll xidation von Brenztraubensäure
Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 27.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll xidation von Brenztraubensäure
Versuchsprotokoll. Herstellung von Seife
 Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. eiß WS 08/09 5.12.08 Schulversuche Assistentin: Katrin Hohmann Versuchsprotokoll Herstellung von Seife Gruppe
Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. eiß WS 08/09 5.12.08 Schulversuche Assistentin: Katrin Hohmann Versuchsprotokoll Herstellung von Seife Gruppe
Schulversuch-Protokoll Jan gr. Austing
 rganisch-chemisches Praktikum für Studierende des Lehramts WS 06/07 Leitung: Prof. Hilt/ Dr. Reiß Schulversuch-Protokoll 26.12.2007 Jan gr. Austing 1) Versuchsbezeichnung: Darstellung von Nitroglycerin
rganisch-chemisches Praktikum für Studierende des Lehramts WS 06/07 Leitung: Prof. Hilt/ Dr. Reiß Schulversuch-Protokoll 26.12.2007 Jan gr. Austing 1) Versuchsbezeichnung: Darstellung von Nitroglycerin
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr Reiß Assistent(in): Jan Schäfer Name: Johannes Hergt Datum: 23112010 Gruppe 4: Aromaten Assi-Versuch: Reaktion
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr Reiß Assistent(in): Jan Schäfer Name: Johannes Hergt Datum: 23112010 Gruppe 4: Aromaten Assi-Versuch: Reaktion
Versuchsprotokoll. Alkoholische Gärung von Traubensaft
 Anna-Lena Eicke Philipps-Universität Marburg Organisch-Chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 27.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll Alkoholische Gärung von Traubensaft
Anna-Lena Eicke Philipps-Universität Marburg Organisch-Chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 27.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll Alkoholische Gärung von Traubensaft
Merkmale chemischer Reaktionen
 Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 7 & 8 Merkmale chemischer Reaktionen Kurzprotokoll Auf einen Blick: Im Folgenden werden weitere Versuche zum Thema Merkmale einer
Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 7 & 8 Merkmale chemischer Reaktionen Kurzprotokoll Auf einen Blick: Im Folgenden werden weitere Versuche zum Thema Merkmale einer
Versuch: Reaktivität von primären, sekundären und tertiären Alkylbromiden gegenüber ethanolischer Silbernitratlösung. keine Reaktion.
 Philipps-Universität Marburg 15.01.2008 rganisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 5, Halogenalkane Versuch: Reaktivität von primären, sekundären
Philipps-Universität Marburg 15.01.2008 rganisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 5, Halogenalkane Versuch: Reaktivität von primären, sekundären
Versuch: Bromierung von n-hexan. Chemikalien Menge R-Sätze S-Sätze Gefahrensymbol Bemerkung
 Philipps-Universität Marburg 25.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 2: Alkane Versuch: omierung von n-hexan Zeitbedarf: Vorbereitung:
Philipps-Universität Marburg 25.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 2: Alkane Versuch: omierung von n-hexan Zeitbedarf: Vorbereitung:
Versuchsprotokoll. Weißer Zucker schwarze Kohle
 Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 11.12.08 Schulversuche Assistentin: Katrin Hohmann Versuchsprotokoll Weißer Zucker schwarze Kohle
Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 11.12.08 Schulversuche Assistentin: Katrin Hohmann Versuchsprotokoll Weißer Zucker schwarze Kohle
Bilder Ton Zeit [s] Vorspann
![Bilder Ton Zeit [s] Vorspann Bilder Ton Zeit [s] Vorspann](/thumbs/62/47191146.jpg) Bilder Ton Zeit [s] Vorspann 4 Intro Man kennt es aus dem Alltag: 5 Gegenstände die unter Schwarzlicht leuchten. Aber welche Eigenschaften muss ein Stoff haben, um in Schwarzlicht leuchten zu können? 6
Bilder Ton Zeit [s] Vorspann 4 Intro Man kennt es aus dem Alltag: 5 Gegenstände die unter Schwarzlicht leuchten. Aber welche Eigenschaften muss ein Stoff haben, um in Schwarzlicht leuchten zu können? 6
Einige Anwendungsfelder im Überblick:
 www.lumimax.de en kommen immer dann Einsatz, wenn Materialien Leuchten angeregt werden sollen. Die Anregungswellenlänge ist dabei abhängig von dem verwendeten mittel, kann sich aber im kompletten Spektrum
www.lumimax.de en kommen immer dann Einsatz, wenn Materialien Leuchten angeregt werden sollen. Die Anregungswellenlänge ist dabei abhängig von dem verwendeten mittel, kann sich aber im kompletten Spektrum
Schuleinsatz Calciumfluorid CaF 2 (s) 22-24/ S1 Schwefelsäure, (konz., w = 96 %)
 Reaktionsgleichungen F + (aq ) + H (aq ) HF (g) 4 HF (g) + SiO 2 (s) SiF 4 g + 2 H 2 O (l) Zeitbedarf Vorbereitung: 5min. Durchführung: 5 min. Nachbereitung: 5 min. Chemikalienliste Edukte Chemikalien
Reaktionsgleichungen F + (aq ) + H (aq ) HF (g) 4 HF (g) + SiO 2 (s) SiF 4 g + 2 H 2 O (l) Zeitbedarf Vorbereitung: 5min. Durchführung: 5 min. Nachbereitung: 5 min. Chemikalienliste Edukte Chemikalien
Versuchsprotokoll. Untersuchung der Waschwirkung
 Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 17.12.08 Schulversuche Assistentin: Katrin Hohmann Versuchsprotokoll Untersuchung der Waschwirkung
Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 17.12.08 Schulversuche Assistentin: Katrin Hohmann Versuchsprotokoll Untersuchung der Waschwirkung
Gruppe 05: Alkylchloride gegenüber AgNO 3
 Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 05: Alkylchloride gegenüber AgNO 3 Reaktion: am Beispiel des sekundären
Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 05: Alkylchloride gegenüber AgNO 3 Reaktion: am Beispiel des sekundären
Gruppe 13 vorgegebener Versuch. Polyelektrolyte im Haargel
 Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: Herr Dr. Reiß Datum: 17.06.09 SS 09 Gruppe 13 vorgegebener Versuch Polyelektrolyte
Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: Herr Dr. Reiß Datum: 17.06.09 SS 09 Gruppe 13 vorgegebener Versuch Polyelektrolyte
+ MnO MnO 3. Oxidierbarkeit primärer, sekundärer und tertiärer Alkohole. Chemikalien. Materialien
 DaChS xidierbarkeit primärer, sekundärer und tertiärer Alkohole 1 Versuch Nr. 005 xidierbarkeit primärer, sekundärer und tertiärer Alkohole C 3 Mn - 4 (violett) 3 C Mn 2 (braun) 3 C C 3 Mn - 4 (violett)
DaChS xidierbarkeit primärer, sekundärer und tertiärer Alkohole 1 Versuch Nr. 005 xidierbarkeit primärer, sekundärer und tertiärer Alkohole C 3 Mn - 4 (violett) 3 C Mn 2 (braun) 3 C C 3 Mn - 4 (violett)
Versuch: Hydrolyse von Stärke mit Speichel
 Philipps-Universität Marburg 27.01.2008 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 9, Kohlenhydrate Versuch: Hydrolyse von Stärke mit
Philipps-Universität Marburg 27.01.2008 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 9, Kohlenhydrate Versuch: Hydrolyse von Stärke mit
Anorganische Peroxide und Radikale. von Benjamin Scharbert
 Anorganische Peroxide und Radikale von Benjamin Scharbert Inhalt: 1. Anorganische Peroxide: 2. Radikale: 1.1 Grundsätzliches 1.2 Na 2 O 2 1.3 BaO 2 1.4 H 2 O 2 2.1 Grundsätzliches 2.2 Sauerstoff 2.3 Stickstoffmonoxid
Anorganische Peroxide und Radikale von Benjamin Scharbert Inhalt: 1. Anorganische Peroxide: 2. Radikale: 1.1 Grundsätzliches 1.2 Na 2 O 2 1.3 BaO 2 1.4 H 2 O 2 2.1 Grundsätzliches 2.2 Sauerstoff 2.3 Stickstoffmonoxid
Sublimation & Resublimation
 Reaktionsgleichung I 2 (s) I2 (g) I 2 (s) Zeitbedarf Vorbereitung: 15 min. Durchführung: 7 Std. Nachbereitung: 20 min. Chemikalienliste Edukte Chemikalien Summenformel R-Sätze S-Sätze Gefahrensymbole Schuleinsatz
Reaktionsgleichung I 2 (s) I2 (g) I 2 (s) Zeitbedarf Vorbereitung: 15 min. Durchführung: 7 Std. Nachbereitung: 20 min. Chemikalienliste Edukte Chemikalien Summenformel R-Sätze S-Sätze Gefahrensymbole Schuleinsatz
Versuchsprotokoll: Ampel-Bottle - Experiment
 Versuchsprotokoll: Ampel-Bottle - Experiment Zeitaufwand: Aufbau: 5 Minuten Durchführung: 1 Minuten Entsorgung/Abbau: 5 Minuten Chemikalien: Chemikalien Menge R-Sätze S-Sätze Gefahrensymbol Schuleinsatz
Versuchsprotokoll: Ampel-Bottle - Experiment Zeitaufwand: Aufbau: 5 Minuten Durchführung: 1 Minuten Entsorgung/Abbau: 5 Minuten Chemikalien: Chemikalien Menge R-Sätze S-Sätze Gefahrensymbol Schuleinsatz
Versuch: Blitze unter Wasser
 Philipps-Universität Marburg 25.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 1, Einführung in die OC Versuch: Blitze unter Wasser
Philipps-Universität Marburg 25.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 1, Einführung in die OC Versuch: Blitze unter Wasser
Lösungsenthalpie / Lösungswärme unterschiedlicher Zinksulfat-Hydrate
 Lösungsenthalpie / Lösungswärme unterschiedlicher Zinksulfat-Hydrate Zeitbedarf für die Versuchsdurchführung: ca. 10 Min. Geräte: Magnetrührer mit Magnetrührstäbchen Thermometer (min. 0,5 C Genauigkeit)
Lösungsenthalpie / Lösungswärme unterschiedlicher Zinksulfat-Hydrate Zeitbedarf für die Versuchsdurchführung: ca. 10 Min. Geräte: Magnetrührer mit Magnetrührstäbchen Thermometer (min. 0,5 C Genauigkeit)
Fluoreszenzlampenl. René Riedel. Bettina Haves
 Leuchtstoffe in Fluoreszenzlampenl René Riedel Bettina Haves Inhalt 1) Fluoreszenzlampen 2) Fluoreszenz 3) Geschichte der Leuchtstoffe 4) Leuchtstoffe in Fluoreszenzlampen 5) Weitere Anwendungsbereiche
Leuchtstoffe in Fluoreszenzlampenl René Riedel Bettina Haves Inhalt 1) Fluoreszenzlampen 2) Fluoreszenz 3) Geschichte der Leuchtstoffe 4) Leuchtstoffe in Fluoreszenzlampen 5) Weitere Anwendungsbereiche
Versuchsprotokoll. Synthese und Nachweis eines Aldehyds. Gruppe 7, Typ: Eigenversuch
 Anna-Lena Eicke Philipps-Universität Marburg rganisch-hemisches Praktikum (LA) Leitung: Dr. eiß WS 08/09 28.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll Synthese und Nachweis eines Aldehyds
Anna-Lena Eicke Philipps-Universität Marburg rganisch-hemisches Praktikum (LA) Leitung: Dr. eiß WS 08/09 28.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll Synthese und Nachweis eines Aldehyds
Gruppe 01: Elementarnachweis: Kohlenstoff- und Wasserstoffnachweis
 Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 01: Elementarnachweis: Kohlenstoff- und Wasserstoffnachweis Reaktion:
Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 01: Elementarnachweis: Kohlenstoff- und Wasserstoffnachweis Reaktion:
Versuchsprotokoll:Stärkespaltung
 Versuchsprotokoll:Stärkespaltung Zeitaufwand: Aufbau: 5 Minuten Durchführung: 20 Minuten Abbau/Entsorgung:: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol Schuleinsatz Pentahydrat
Versuchsprotokoll:Stärkespaltung Zeitaufwand: Aufbau: 5 Minuten Durchführung: 20 Minuten Abbau/Entsorgung:: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol Schuleinsatz Pentahydrat
Versuchsprotokoll. Atemalkoholtest
 Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 28.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll Atemalkoholtest Gruppe 6, Typ:
Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 28.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll Atemalkoholtest Gruppe 6, Typ:
Chemie-Labothek zur Photochemie
 Fluoreszenz und Phosphoreszenz, Echtfarbenemissionsspektren (EFES) V1: Fluoreszenz und Phosphoreszenz Arbeitsmaterialien: Waage Mörser mit Pistill Porzellanschale Bunsenbrenner UV-Handlampe 7 Reagenzgläser
Fluoreszenz und Phosphoreszenz, Echtfarbenemissionsspektren (EFES) V1: Fluoreszenz und Phosphoreszenz Arbeitsmaterialien: Waage Mörser mit Pistill Porzellanschale Bunsenbrenner UV-Handlampe 7 Reagenzgläser
Versuch: Darstellung eines Azofarbstoffes (Methylorange)
 PhilippsUniversität Marburg 02.02.2008 rganisches Grundpraktikum (LA) Katrin ohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß W 2007/08 Gruppe 12, Farbstoffe, Wirkstoffe Versuch: Darstellung eines
PhilippsUniversität Marburg 02.02.2008 rganisches Grundpraktikum (LA) Katrin ohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß W 2007/08 Gruppe 12, Farbstoffe, Wirkstoffe Versuch: Darstellung eines
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Beate Abé Name: Johannes Hergt Datum: 30.11.2010 Gruppe 6: Alkohole Versuch (Alkoholtest):
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Beate Abé Name: Johannes Hergt Datum: 30.11.2010 Gruppe 6: Alkohole Versuch (Alkoholtest):
Material 1. Fluoreszenz von Flussspat
 Material 1 Fluoreszenz von Flussspat In der Natur kommt Calcium-Fluorit in Form von Flussspat vor, der im ultravioletten (UV-) Licht eine starke, blaue Fluoreszenz zeigt. Anzumerken ist dabei, dass nicht
Material 1 Fluoreszenz von Flussspat In der Natur kommt Calcium-Fluorit in Form von Flussspat vor, der im ultravioletten (UV-) Licht eine starke, blaue Fluoreszenz zeigt. Anzumerken ist dabei, dass nicht
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Beate Abé Name: Johannes Hergt Datum: 30.11.2010 Gruppe 6: Alkohole Versuch: Reaktivität
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Beate Abé Name: Johannes Hergt Datum: 30.11.2010 Gruppe 6: Alkohole Versuch: Reaktivität
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Jan Schäfer Name: Johannes Hergt Datum: 24.11.2010 Gruppe 4: Aromaten Versuch (selbst):
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Jan Schäfer Name: Johannes Hergt Datum: 24.11.2010 Gruppe 4: Aromaten Versuch (selbst):
2-01. Das Ethen-Molekül. Perspektivische Darstellung des Ethen-Moleküls.
 Das Ethen-Molekül 2-01 Perspektivische Darstellung des Ethen-Moleküls. Rot: Sigma-Bindungen σ mit je zwei Bindungselektronen Blau: pz-orbitale mit je einem Elektron Die C-Atome sind sp 2 -hybridisiert,
Das Ethen-Molekül 2-01 Perspektivische Darstellung des Ethen-Moleküls. Rot: Sigma-Bindungen σ mit je zwei Bindungselektronen Blau: pz-orbitale mit je einem Elektron Die C-Atome sind sp 2 -hybridisiert,
Schulversuch-Protokoll Jan gr. Austing
 Organisch-chemisches Praktikum für Studierende des Lehramts WS 06/07 Leitung: Prof. Hilt/ Dr. Reiß Schulversuch-Protokoll 6.1.007 Jan gr. Austing 1) Versuchsbezeichnung: Bromierung von Butan ) Reaktionsgleichung:
Organisch-chemisches Praktikum für Studierende des Lehramts WS 06/07 Leitung: Prof. Hilt/ Dr. Reiß Schulversuch-Protokoll 6.1.007 Jan gr. Austing 1) Versuchsbezeichnung: Bromierung von Butan ) Reaktionsgleichung:
Versuch: Emulgierende und dispergierende Wirkung von Tensiden
 Philipps-Universität Marburg 18.01.2008 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 8, Ester, Fette, Seifen, Tenside Versuch: Emulgierende
Philipps-Universität Marburg 18.01.2008 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 8, Ester, Fette, Seifen, Tenside Versuch: Emulgierende
Lernziele zu Farbigkeit von Stoffen
 Farbstoffe Lernziele zu Farbigkeit von Stoffen du verstehst, wie Farbigkeit mit der Absorption von EM-Strahlung zusammenhängt. du verstehst die Unterschiede zwischen Feuerwerksfarben und Textilfarbstoffen.
Farbstoffe Lernziele zu Farbigkeit von Stoffen du verstehst, wie Farbigkeit mit der Absorption von EM-Strahlung zusammenhängt. du verstehst die Unterschiede zwischen Feuerwerksfarben und Textilfarbstoffen.
Chemie-Labothek Innovative Kunststoffe & Funktionelle Farbstoffe
 Versuch 1 Herstellung einer fluoreszierenden Kunststoffscheibe Sicherheitshinweise Schutzbrille! VERSUCHSAUFBAU Chemikalien Photolack Aceton 2 Textmarker Schlifffett / Öl Material 2 Bechergläser 50 ml
Versuch 1 Herstellung einer fluoreszierenden Kunststoffscheibe Sicherheitshinweise Schutzbrille! VERSUCHSAUFBAU Chemikalien Photolack Aceton 2 Textmarker Schlifffett / Öl Material 2 Bechergläser 50 ml
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Julia Konen Name: Johannes Hergt Datum: 14.12.2010 Gruppe 9: Kohlenhydrate Versuch (Assi):
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Julia Konen Name: Johannes Hergt Datum: 14.12.2010 Gruppe 9: Kohlenhydrate Versuch (Assi):
Gruppe 03: Umsetzung von Hexan und Hexen mit Bromwasser
 Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 03: Umsetzung von Hexan und Hexen mit Bromwasser Reaktion: Chemikalien:
Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 03: Umsetzung von Hexan und Hexen mit Bromwasser Reaktion: Chemikalien:
Versuch: Alkoholtest mit Dichromat. Chemikalien: Menge: R-Sätze: S-Sätze: Gefahrensymbol: Schuleinsatz:
 Philipps-Universität Marburg 03.01.2008 rganisches Grundpraktikum (LA) Katrin ohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 6, Alkohole Versuch: Alkoholtest mit Dichromat Zeitbedarf:
Philipps-Universität Marburg 03.01.2008 rganisches Grundpraktikum (LA) Katrin ohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 6, Alkohole Versuch: Alkoholtest mit Dichromat Zeitbedarf:
Versuchsprotokoll. Dünnschichtchromatographie von Aminosäuren
 Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. eiß WS 08/09 17.12.08 Schulversuche Assistentin: Katrin ohmann Versuchsprotokoll Dünnschichtchromatographie
Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. eiß WS 08/09 17.12.08 Schulversuche Assistentin: Katrin ohmann Versuchsprotokoll Dünnschichtchromatographie
Die Natriumlinie. und Absorption, Emission, Dispersion, Spektren, Resonanz Fluoreszenz, Lumineszenz
 Die Natriumlinie und Absorption, Emission, Dispersion, Spektren, Resonanz Fluoreszenz, Lumineszenz Absorption & Emissionsarten Absorption (Aufnahme von Energie) Atome absorbieren Energien, z.b. Wellenlängen,
Die Natriumlinie und Absorption, Emission, Dispersion, Spektren, Resonanz Fluoreszenz, Lumineszenz Absorption & Emissionsarten Absorption (Aufnahme von Energie) Atome absorbieren Energien, z.b. Wellenlängen,
Versuch: Fäden spinnen Polymer aus Citronensäure und Glycerin
 Philipps-Universität Marburg 16.02.2008 rganisches Grundpraktikum (LA) Katrin Hohmann Assistent: alph Wieneke Leitung: Dr. Ph. eiß WS 2007/08 Gruppe 13, Polymere Versuch: Fäden spinnen Polymer aus Citronensäure
Philipps-Universität Marburg 16.02.2008 rganisches Grundpraktikum (LA) Katrin Hohmann Assistent: alph Wieneke Leitung: Dr. Ph. eiß WS 2007/08 Gruppe 13, Polymere Versuch: Fäden spinnen Polymer aus Citronensäure
Schulversuch (Gruppe 6/Assistentenversuch): Vergleich aliphatischer Alkohole und Phenole
 Philipps-Universität Marburg 26.11.2008 rganisch-chemisches Praktikum für das Lehramt (LA) Torsten Lasse Leitung: Dr. P. Reiß WS 2008/09 Assistentin: Beate Abé Schulversuch (Gruppe 6/Assistentenversuch):
Philipps-Universität Marburg 26.11.2008 rganisch-chemisches Praktikum für das Lehramt (LA) Torsten Lasse Leitung: Dr. P. Reiß WS 2008/09 Assistentin: Beate Abé Schulversuch (Gruppe 6/Assistentenversuch):
Standardeletrodenpotential E 0 [V] Oxidationsmittel (ph-wert=0)
![Standardeletrodenpotential E 0 [V] Oxidationsmittel (ph-wert=0) Standardeletrodenpotential E 0 [V] Oxidationsmittel (ph-wert=0)](/thumbs/50/27334556.jpg) Grundlagen der chemischen xidation 10 2 Grundlagen der chemischen xidation 2.1 xidationsmittel Bei der xidation erfolgt eine Abgabe von Elektronen aus Atomen, Ionen oder olekülen in Anwesenheit eines xidationsmittels.
Grundlagen der chemischen xidation 10 2 Grundlagen der chemischen xidation 2.1 xidationsmittel Bei der xidation erfolgt eine Abgabe von Elektronen aus Atomen, Ionen oder olekülen in Anwesenheit eines xidationsmittels.
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Julia Konen Name: Johannes Hergt Datum: 17.12.2010 Gruppe 9: Kohlenhydrate Versuch (Nachweis):
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Julia Konen Name: Johannes Hergt Datum: 17.12.2010 Gruppe 9: Kohlenhydrate Versuch (Nachweis):
Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09
 Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah enkel Datum: 19.11.2008 Gruppe 2: Alkane Versuch: alogenierung von Alkanen
Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah enkel Datum: 19.11.2008 Gruppe 2: Alkane Versuch: alogenierung von Alkanen
Gruppe 05: Darstellung von 2-Chlor-2 Methylpropan
 Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 05: Darstellung von 2-Chlor-2 Methylpropan Reaktion: Chemikalien:
Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 05: Darstellung von 2-Chlor-2 Methylpropan Reaktion: Chemikalien:
Chemische Bindungen Atombindung
 Atombindung Das Lewis Modell der kovalenten Bindung Die Entstehung von Molekülen beruht auf der Bildung von gemeinsamen, bindenden Elektronenpaaren in dem Bestreben der Atome, eine energetisch stabile
Atombindung Das Lewis Modell der kovalenten Bindung Die Entstehung von Molekülen beruht auf der Bildung von gemeinsamen, bindenden Elektronenpaaren in dem Bestreben der Atome, eine energetisch stabile
Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09. Name: Sarah Henkel Datum:
 Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah enkel Datum: 19.11.2008 Gruppe 5: alogenalkane Versuch: Reaktivität von
Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah enkel Datum: 19.11.2008 Gruppe 5: alogenalkane Versuch: Reaktivität von
5 Elektronenübergänge im Festkörper
 5 Elektronenübergänge im Festkörper 5.1 Übersicht und Lernziele Übersicht Die Bindung in einem Molekül erfolgt durch gemeinsame Elektronenpaare, die jeweils zwei Atomen angehören (Atombindung, Elektronenpaarbindung).
5 Elektronenübergänge im Festkörper 5.1 Übersicht und Lernziele Übersicht Die Bindung in einem Molekül erfolgt durch gemeinsame Elektronenpaare, die jeweils zwei Atomen angehören (Atombindung, Elektronenpaarbindung).
Versuchsprotokoll. Nachweis von Kohlenstoff und Wasserstoff in Spagetti
 Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 12.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll Nachweis von Kohlenstoff und Wasserstoff
Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 12.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll Nachweis von Kohlenstoff und Wasserstoff
Fluoreszierende organische Verbindungen
 Schulversuchspraktikum Moritz Pemberneck Sommersemester 2016 Klassenstufen 11, 12 und 13 Fluoreszierende organische Verbindungen 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem
Schulversuchspraktikum Moritz Pemberneck Sommersemester 2016 Klassenstufen 11, 12 und 13 Fluoreszierende organische Verbindungen 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem
113 Estersynthese GEFAHRENSYMBOLE SICHERHEITSRATSCHLÄGE
 113 Estersynthese GUT ZU WISSEN Die Ester sind eine große Stoffgruppe in der organischen Chemie und auch im Alltag finden haben wir häufig mit ihnen zu tun. Bekannteste Vertreter dürften wohl die Polyester
113 Estersynthese GUT ZU WISSEN Die Ester sind eine große Stoffgruppe in der organischen Chemie und auch im Alltag finden haben wir häufig mit ihnen zu tun. Bekannteste Vertreter dürften wohl die Polyester
Versuchsprotokoll. Nachweis von Stickstoff in Eiweißen. Gruppe 1, Typ: Eigenversuch. Na + O -
 Anna-Lena Eicke Philipps-Universität Marburg rganisch-hemisches Praktikum (LA) Leitung: Dr. eiß WS 08/09 13.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll Nachweis von Stickstoff in Eiweißen
Anna-Lena Eicke Philipps-Universität Marburg rganisch-hemisches Praktikum (LA) Leitung: Dr. eiß WS 08/09 13.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll Nachweis von Stickstoff in Eiweißen
Gruppe 2 eigener Versuch. Veränderung einer Kerzenflamme in Feuerzeuggas
 Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: Herr Dr. Reiß Datum: 20.05.09 SS 09 Gruppe 2 eigener Versuch Veränderung einer Kerzenflamme
Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: Herr Dr. Reiß Datum: 20.05.09 SS 09 Gruppe 2 eigener Versuch Veränderung einer Kerzenflamme
Fluoreszenz. Abb. 1: Möglicher Versuchsaufbau
 Fluoreszenz Abb. 1: Möglicher Versuchsaufbau Geräteliste: UV-Lampe Geldscheintester, Schwarzlicht-Leuchtstofflampe, Halogenlampe, UV- Bandpass, Granulat mit fluoreszierendem Farbstoff, Fluoreszenzproben,
Fluoreszenz Abb. 1: Möglicher Versuchsaufbau Geräteliste: UV-Lampe Geldscheintester, Schwarzlicht-Leuchtstofflampe, Halogenlampe, UV- Bandpass, Granulat mit fluoreszierendem Farbstoff, Fluoreszenzproben,
+ 30,5 O 2 (g) 20 CO 2 (g) + 21 H 2 O
 Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah Henkel Datum: 11.11.2008 Gruppe 1: Einführung der OC Versuch: Nachweis
Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah Henkel Datum: 11.11.2008 Gruppe 1: Einführung der OC Versuch: Nachweis
Versuchsprotokoll: Reaktion von Zucker mit Schwefelsäure
 Versuchsprotokoll: Reaktion von Zucker mit Schwefelsäure Zeitaufwand: Aufbau: Durchführung: Abbau/Entsorgung: 5 Minuten 10 Minuten 5 Minuten Chemikalien: Chemikalie Menge RSätze SSätze Gefahrensymbol Schwefelsäure
Versuchsprotokoll: Reaktion von Zucker mit Schwefelsäure Zeitaufwand: Aufbau: Durchführung: Abbau/Entsorgung: 5 Minuten 10 Minuten 5 Minuten Chemikalien: Chemikalie Menge RSätze SSätze Gefahrensymbol Schwefelsäure
Gruppe 06: pulsierende Amöben
 Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 06: pulsierende Amöben Reaktion: Chemikalien: Eingesetzte Stoffe Gefahrensymbole
Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 06: pulsierende Amöben Reaktion: Chemikalien: Eingesetzte Stoffe Gefahrensymbole
+ 2 [Ag(NH 3 ) 2 ]+ + 2 OH - 2 Ag + 4 NH 3. Versuch: Tollensprobe mit Glucose und Saccharose
![+ 2 [Ag(NH 3 ) 2 ]+ + 2 OH - 2 Ag + 4 NH 3. Versuch: Tollensprobe mit Glucose und Saccharose + 2 [Ag(NH 3 ) 2 ]+ + 2 OH - 2 Ag + 4 NH 3. Versuch: Tollensprobe mit Glucose und Saccharose](/thumbs/54/33374656.jpg) Philipps-Universität Marburg 27.01.2008 rganisches Grundpraktikum (LA) Katrin ohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 9, Kohlenhydrate Versuch: Tollensprobe mit Glucose
Philipps-Universität Marburg 27.01.2008 rganisches Grundpraktikum (LA) Katrin ohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 9, Kohlenhydrate Versuch: Tollensprobe mit Glucose
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Sarah Henkel Name: Johannes Hergt Datum: 17.12.2010 Gruppe 8: Ester, Fette, Seifen und
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Sarah Henkel Name: Johannes Hergt Datum: 17.12.2010 Gruppe 8: Ester, Fette, Seifen und
Wechselwirkung zwischen Licht und chemischen Verbindungen
 Photometer Zielbegriffe Photometrie. Gesetz v. Lambert-Beer, Metallkomplexe, Elektronenanregung, Flammenfärbung, Farbe Erläuterungen Die beiden Versuche des 4. Praktikumstages sollen Sie mit der Photometrie
Photometer Zielbegriffe Photometrie. Gesetz v. Lambert-Beer, Metallkomplexe, Elektronenanregung, Flammenfärbung, Farbe Erläuterungen Die beiden Versuche des 4. Praktikumstages sollen Sie mit der Photometrie
Gymnasium / Realschule. Atomphysik 2. Klasse / G8. Aufnahme und Abgabe von Energie (Licht)
 Aufnahme und Abgabe von Energie (Licht) 1. Was versteht man unter einem Elektronenvolt (ev)? 2. Welche physikalische Größe wird in Elektronenvolt gemessen? Definiere diese Größe und gib weitere Einheiten
Aufnahme und Abgabe von Energie (Licht) 1. Was versteht man unter einem Elektronenvolt (ev)? 2. Welche physikalische Größe wird in Elektronenvolt gemessen? Definiere diese Größe und gib weitere Einheiten
Nanotechnologie. Schüler- unterlagen. (9-10 Jg.) Bildung für nachhaltige. Entwicklung
 Nanotechnologie Bildung für nachhaltige Entwicklung Schüler- unterlagen (9-10 Jg.) Versuch 1 Herstellung von Zinkoxid (ZnO)-Nanopartikel Materialien: 2 Bechergläser (50 ml, 100 ml), Heizrührer, Magnetrührstäbchen,
Nanotechnologie Bildung für nachhaltige Entwicklung Schüler- unterlagen (9-10 Jg.) Versuch 1 Herstellung von Zinkoxid (ZnO)-Nanopartikel Materialien: 2 Bechergläser (50 ml, 100 ml), Heizrührer, Magnetrührstäbchen,
 hemie-protokoll 11.11.02, Seite 1 von 5 Lukman Iwan, 12.11.02 Stundenprotokoll vom Montag, 11. ovember 2002 Es fehlen: Janine und Jeannette Zettel 1&2: Aromatische eterocyclen http://www.oci.unizh.ch/edu/lectures/material/a_bii/kap6/kap6.html
hemie-protokoll 11.11.02, Seite 1 von 5 Lukman Iwan, 12.11.02 Stundenprotokoll vom Montag, 11. ovember 2002 Es fehlen: Janine und Jeannette Zettel 1&2: Aromatische eterocyclen http://www.oci.unizh.ch/edu/lectures/material/a_bii/kap6/kap6.html
Schulversuchspraktikum. Johanna Osterloh. Sommersemester Klassenstufen 9 & 10. Stoffkreisläufe. Kurzprotokoll
 Schulversuchspraktikum Johanna Osterloh Sommersemester 2015 Klassenstufen 9 & 10 Stoffkreisläufe Kurzprotokoll Auf einen Blick: Dieses Protokoll enthält vier Schülerversuche, die zum Thema Kohlenstoffdioxidkreislauf
Schulversuchspraktikum Johanna Osterloh Sommersemester 2015 Klassenstufen 9 & 10 Stoffkreisläufe Kurzprotokoll Auf einen Blick: Dieses Protokoll enthält vier Schülerversuche, die zum Thema Kohlenstoffdioxidkreislauf
Versuchsprotokoll: Stärkefolie
 Versuchsprotokoll: Stärkefolie Zeitaufwand: Aufbau: 10 Minuten Durchführung: 30 Minuten + 1 Tag trocknen Abbau: 10 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol Schuleinsatz Kartoffel-
Versuchsprotokoll: Stärkefolie Zeitaufwand: Aufbau: 10 Minuten Durchführung: 30 Minuten + 1 Tag trocknen Abbau: 10 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol Schuleinsatz Kartoffel-
Versuch: Thermisches Cracken von Paraffinöl
 Philipps-Universität Marburg 21.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 2, Alkane Versuch: Thermisches Cracken von Paraffinöl
Philipps-Universität Marburg 21.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 2, Alkane Versuch: Thermisches Cracken von Paraffinöl
Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09
 rganisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah Henkel Datum: 18.11.2008 Gruppe 4: Aromaten Versuch: Herstellung von Fluorescein
rganisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah Henkel Datum: 18.11.2008 Gruppe 4: Aromaten Versuch: Herstellung von Fluorescein
Versuchsprotokoll: Fehling- Spaltung von Saccharose
 Versuchsprotokoll: Fehling- Spaltung von Saccharose Zeitaufwand: Vorbereitung: 5 Minuten Durchführung: 15 Minuten Abbau/Entsorgung: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol
Versuchsprotokoll: Fehling- Spaltung von Saccharose Zeitaufwand: Vorbereitung: 5 Minuten Durchführung: 15 Minuten Abbau/Entsorgung: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol
Versuch: Fehling- und Biuretprobe mit Gummibärchen
 Philipps-Universität Marburg 27.01.2008 rganisches Grundpraktikum (LA) Katrin ohmann Assistent: alph Wieneke Leitung: Dr. Ph. eiß WS 2007/08 Gruppe 9, Kohlenhydrate Versuch: Fehling- und Biuretprobe mit
Philipps-Universität Marburg 27.01.2008 rganisches Grundpraktikum (LA) Katrin ohmann Assistent: alph Wieneke Leitung: Dr. Ph. eiß WS 2007/08 Gruppe 9, Kohlenhydrate Versuch: Fehling- und Biuretprobe mit
Philipps-Universität Marburg Organisch-chemisches Praktikum für das Lehramt (LA) Torsten Lasse Leitung: Dr. P. Reiß Assistentin: Beate Abé
 Philipps-Universität Marburg 14.11.2008 rganisch-chemisches Praktikum für das Lehramt (LA) Torsten Lasse Leitung: Dr. P. Reiß WS 2008/09 Assistentin: Beate Abé Schulversuch (Gruppe 4/Assistentenversuch):
Philipps-Universität Marburg 14.11.2008 rganisch-chemisches Praktikum für das Lehramt (LA) Torsten Lasse Leitung: Dr. P. Reiß WS 2008/09 Assistentin: Beate Abé Schulversuch (Gruppe 4/Assistentenversuch):
Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09
 rganisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah enkel Datum: 12.11.2008 Gruppe 3: Alkene, Alkine Versuch: erstellung und
rganisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah enkel Datum: 12.11.2008 Gruppe 3: Alkene, Alkine Versuch: erstellung und
