Grundwissen Chemie 11
|
|
|
- Klaudia Winkler
- vor 8 Jahren
- Abrufe
Transkript
1 Grundwissen hemie 11 Begriffe Aromaten Delokalisiertes Elektronensystem Mesomerie Inhalt Aromatische Kohlenwasserstoffe Planare Moleküle mit cyclischem, delokalisierten Elektronensystem. Die Bindungselektronen sind nicht zw. 2 Atomen lokalisiert, sondern sind über das ganze System verteilt. Beschreibt die tatsächlich vorliegende Elektronenverteilung eines Moleküls, die nur durch sogenannte Grenzstrukturen beschrieben werden kann. mesomere Grenzstrukturen von Benzol - - mesomere Grenzstrukturen des arboxylat-ions Elektrophile Substitution Phenole Anilin eaktionsmechanismus, bei dem ein Austausch eines Wasserstoffatoms gegen ein anderes Atom oder funktionelle Gruppe am Benzolring stattfindet. Dabei bleibt das delokalisierte Elektronensystem erhalten Läuft in 3 Schritten ab: 1. Darstellung des Elektrophils (Kation oder positiv polarisiertes Teilchen) 2. elektrophiler Angriff (unter Bildung eines mesomeristabilisiertem Kations, dem Zwischenprodukt) 3. earomatisierung (unter Abspaltung eines Protons) Aromaten mit mindestens einer ydroxylgruppe am aromatischen ing, z.b. Phenol = ydroxybenzol; Phenole reagieren trotz ydroxylgruppe nicht wie aliphatische Alkohole Aromat, mit einer polaren Aminogruppe am aromatischen ing, nicht basisch. Anilin = Phenylamin 2 Mesomerie-Effekte Zweitsubstitution M-Effekt: Elektronendichte im aromatischen System wird durch Substituent erhöht elektronenschiebend z.b. 2 ; - -M-Effekt: Elektronendichte im aromatischen System wird durch Substituent erniedrigt elektronenziehend z.b. 2 ; - Ein bereits substituierter Benzolring kann mit einem weiteren Substituenten reagieren. Dabei sind drei isomere Strukturen möglich: ortho-, meta- und para- Position. Anhand der Grenzstrukturformeln des Edukts kann die bevorzugte Positionierung des Zweitsubstituenten ersehen werden.
2 Fette und Tenside Fette sind dreifache Ester aus Glycerin (Propan-1,2,3-triol) und Fettsäuren. Man nennt sie daher auch Triglyceride. Fette Fettsäuren Schmelzbereich des FS Fetthärtung Seifen und Verseifung Amphiphil: Jedes Molekül eines natürlichen Fetts enthält verschiedene Fettsäurereste. Fette haben deshalb einen Schmelzbereich. Aufgrund der langen KW-Ketten sind Fette in unpolaren LM löslich. Bedeutung als ährstoff, Energieträger und nachwachsender ohstoff. Gesättigte FS: keine Doppelbindungen; einh. Bindungswinkel ca. 109 Ungesättigte FS: Doppelbindungen; an den Doppelbindungen Bindungswinkel von ca. 120 ; natürliche ungesättigte FS mit Z- Konfiguration sperriger Bau Der abweichende Bindungswinkel bei ungesättigten FS verhindert eine gleichmäßige, dichte Anordnung der KW-Ketten. Daher bestimmt der Anteil der ungesättigten FS den Schmelzbereich des Fettes: je höher dieser Anteil, desto niedriger liegt er. Der Schmelzbereich wird von der Anzahl der Doppelbindungen und der Kettenlänge der FS-este (V.d.W.-Kräfte) bestimmt. Umwandlung flüssiger fetter Öle in feste Fette. Dies geschieht durch ydrierung (Addition von 2 ) der in den Fettsäureresten enthaltenen Doppelbindungen. Seifen: Alkalisalze der Fettsäuren Bildung durch basische ydrolyse von Fetten. achteile: säureempfindlich, härteempfindlich, starke Basen Basische Verseifung: Fett Lauge Fettsäuresalz Glycerin Teilchen, das sowohl hydrophile als auch hydrophobe Eigenschaften hat. Amphiphile, grenzflächenaktive Verbindungen heißen Tenside. Tenside Eigenschaften von Tensiden Waschwirkung von Tensiden Synthetische Tenside - Erniedrigung der berflächenspannung - Stabilisierung von Emulsionen - Dispergiervermögen - Tyndall-Effekt durch Micellenbildung (Zusammenlagerung von Teilchen mit amphiphilen Eigenschaften) 1. Benetzung der Faser durch herabgesetzte berflächenspannung möglich. 2. Faser und Schmutzpartikel werden durch Seifenanionen aufgeladen und stoßen sich ab. 3. Die Schmutzpartikel werden in Micellen eingelagert und in Lösung gehalten. 4 Typen: anionische, kationische, zwitterionische und nichtionische Tenside; Vorteile: nicht säureempfindlich, neutrale eaktion in wässriger Lösung, kaum härteempfindlich
3 ptische Aktivität Kohlenhydrate Drehung der Schwingungsebene von linear polarisiertem Licht um einen bestimmten Winkel durch eine optisch aktive Substanz. Dieser wird Drehwinkel genannt und kann durch ein Polarimeter bestimmt werden. z.b.: Milchsäure (s. unten) bjekte, die mit ihrem Spiegelbild nicht zur Deckung gebracht werden können, sind chiral. hirales Molekül: Verbindungen mit hiralitätszentrum (= asymmetrisches Atom; Kohlenstoffatom mit 4 verschiedenen Substituenten: *) z.b.: Milchsäure Spiegelebene hiralität Stereoisomere Enantiomere Diastereomere L-Milchsäure Zwei oder mehr Moleküle, die sich ausschließlich in der räumlichen Ausrichtung einzelner Atome unterscheiden. Sie verfügen über die gleich Summen- und Strukturformel. Unterscheidung von Enantiomeren und Diastereomeren. Enantiomere sind chirale Moleküle, die sich zueinander verhalten wie Bild und Spiegelbild. - unterschiedliche Vorzeichen des spezifischen Drehwinkels - unterschiedliches Verhalten nur gegenüber ebenfalls chiralen Teilchen chemische eaktion chiraler Moleküle kein Unterschied Unterschied z.b.: ontergan: -Thalidomid (Schlafmittel) S-Thalidomid (teratogen) Diastereomere sind Stereoisomere, die sich zueinander nicht wie Bild und Spiegelbild verhalten. z.b.: ()-Weinsäure und meso-weinsäure 3 mit nicht-chiralen Molekülen * * mit chiralen Molekülen 3 D-Milchsäure Ein acemat ist ein äquimolares Gemisch zweier Enantiomere. Ein acemat ist optisch nicht aktiv. Beispiel: L-()-Weinsäure D-(-)-Weinsäure acemat
4 Fischer-Projektion Monosaccharide Glukose (Traubenzucker): 1. In der Fischer-Projektion steht die --Kette senkrecht und das höchstoxidierte Kohlenstoffatom steht oben. 2. Alle vertikalen Bindungen stehen nach hinten, alle horizontalen nach vorne. 3. Die Stellung des ydroxy-substituenten des unteren * ist für die amensgebung entscheidend: D = rechts; L= links. D- und L- Weinsäure sind zueinander enantiomer. Beispiel: L- Weinsäure D-Weinsäure 2 * * * * = Polyhydroxycarbonylverbindungen Bildung einer ingform durch nukleophile Addition; Mutarotation zwischen α- und β-form - häufigstes Biomolekül - enthält eine Aldehydgruppe (Aldose) - liegt überwiegend als sechsgliedriger ing (Pyranose-Struktur) und nicht in offenkettiger Form vor - die Stellung der -Gruppen kann man sich mit ta tü ta ta merken α-glukose 2 ta tü ta ta 2 β-glukose - enthält eine Ketogruppe (Ketose) - bildet Fünfring (Furanose-Struktur) Fruktose (Fruchtzucker): 2 2 α-fruktose β -Fruktose ing-ketten-tautomerie Anomere Mutarotation In wässriger Lösung: Umlagerung zwischen offenkettiger Form und ingform. Isomere, die sich in ihrer Konfiguration an ihrem anomeren -Atom unterscheiden. Dieses ist ein hiralitätszentrum, dass erst durch ingbildung entsteht. z.b.: α-d-glucopyranose und β-d-glucopyranose Änderung des Drehwinkels einer optisch aktiven Lösung durch Gleichgewichtseinstellung zwischen Stereoisomeren.
5 Keto-Enol-Tautomerie Fruktose kann in basischer Lösung in Glukose umgewandelt werden D-Fruktose Endiol-Form D-Glukose D-Mannose aworth-projektion Die aworth-projektion erlaubt die einfache Darstellung ringförmiger Moleküle unter Berücksichtigung der Anordnung der Substituenten an asymmetrischen Kohlenstoffatomen (FL-egel: Fischer links oben aworth) Fischer-Projektion: D-Glukose aworth-projektion: α-d-glukose Kondensationsprodukt zweier Monosaccharide unter Wasserabspaltung. Man nennt eine derartige Bindung zwischen zwei Monosaccharid- Molekülen glykosidische Bindung. Disaccharide eduzierende / ichtreduzierende Zucker Polysaccharide z.b.: Maltose (α-1,4-glykosidische Bindung von Glukosemolekülen); ellobiose (β-1,4-glykosidische Bindung von Glukosemolekülen), Saccharose (α-1,2-β-glykosidische Bindung von α-glukose und β- Fruktose) eduzierende Zucker: ein anomeres -Atom ist nicht an der glykosidischen Bindung beteiligt Fehling-Probe / Silberspiegelprobe positiv z.b.: ellobiose icht-reduzierende Zucker: beide anomeren -Atome sind an der glykosidischen Bindung beteiligt Fehling-Probe / Silberspiegelprobe negativ z.b.: Saccharose Kondensationsprodukt vieler Monosaccharide Stärke: Besteht aus Amylose (spiralförmige Makromoleküle aus α-1-4- Glukosemolekülen) sowie Amylopektin (α-1-4- und α-1-6-verzweigung). ellulose: lineare Makromoleküle aus β-1-4-glukosemolekülen
6 α -Aminocarbonsäuren Zwitterionenstruktur Isoelektrischer Punkt (IEP) Elektrophorese Aminosäuren und Proteine Alle Proteine sind aus 20 verschiedenen L-AS aufgebaut (8 davon essentiell). In der Fischer-Projektion zeigt die Aminogruppe daher nach links. arboxygruppe Aminogruppe AS sind Ampholyte intramolekulare Protolyse Zwitterion kristalline Feststoffe - Der IEP ist der p-wert, bei dem eine AS nahezu ausschließlich als Zwittterion vorliegt. Die Elektrophorese ist ein Trennverfahren, bei dem durch Anlegen einer Gleichspannung Stoffe (z.b.: AS, DA, Proteine) aufgrund ihrer unterschiedlichen Ladung und Größe getrennt werden. Kondensat von AS unter Wasserabspaltung - 2 Peptid AS 1 AS 2 Peptid Peptidbindung achweisreaktionen Proteine Entsteht bei eaktion der Aminogruppe einer AS mit der arboxygruppe einer zweiten AS unter Wasserabspaltung. Die Verknüpfung heißt Peptidbindung. Bildung: Dipeptide (2) bis zu Proteine (>100) keine freie Drehbarkeit planar aufgrund der Mesomerie (Grenzstrukturen siehe Zeichnung) Biuret-eaktion: Protein a us 4 violette Färbung inhydrin-eaktion: Protein inhydrin blau-violette Färbung Xanthoprotein-eaktion: Protein konz. 3 gelbe Färbung Struktur: Primärstruktur: eihenfolge der AS Sekundärstruktur: -Brücken zwischen Peptidbindungen (α-elices oder β-faltblätter) Tertiärstruktur: räumlicher Bau des Proteinmoleküls durch WW zwischen den AS-esten (-Brücken, kovalent, ionisch, van der Waals) Quartärstruktur: Zwei oder mehrere Polypeptide lagern sich zusammen und bilden größere Proteinmoleküle. Bedeutung: unterschiedlichste Bedeutung in Abhängigkeit von der Struktur z.b.: aut: Schutz / Festigung, Immunsystem: AK,
7 Polymere adikalische Polymerisation Polykondensation Polyaddition Thermoplaste Duroplaste / Elastomere Kunststoffe Polymere werden durch vielfache Aneinanderreihung (Polyreaktion) kleiner Einheiten (Monomere) synthetisiert. Man spricht daher von Polymeren. Sie bestehen aus Makromolekülen Monomere mit Mehrfachbindungen verknüpfen sich zu Polymer Startreaktion: homolytische Spaltung des adikalbildners Kettenstart: Anlagerung von Startradikal an Monomer Kettenwachstum: Anlagerung weiterer Monomere Kettenabbruch: zwei adikale verbinden sich z.b.: Polyethen aus Ethenmolekülen Monomere mit mind. zwei funktionellen Gruppen verbinden sich unter Abspaltung von ebenprodukten (oft 2 ). z.b.: Polyester: arboxy- und ydroxygruppe reagieren unter Esterbildung (z.b.: PET) z.b.: Polyamide: arboxy- und Aminogruppe reagieren unter Amidbildung (z.b.: ylon) Monomere mit mind. zwei funktionellen Gruppen verbinden sich ohne Abspaltung von ebenprodukten. z.b.: Polyurethan (PU) durch Addition von Diisocyanaten mit Diolen Thermoplaste: z.b. PE, PV Unvernetzte Polymerketten, nur zwischenmolekulare Kräfte Erweichen bei Erwärmen und werden plastisch verformbar Ursache; Überwindung der zwischenmol. Kräfte bei E-Zufuhr Duroplaste: z.b. ABS-Kunststoff (Lego-Steine) Durch Atombindungen eng vernetzte Polymerketten zersetzen sich bei hohen T ohne vorheriges Erweichen Ursache: Bruch der Atombindungen bei hoher E-Zufuhr Elastomere: z.b. Gummi Weitmaschig vernetzte Polymerketten gummielastisches Verhalten bei Zugbelastung Thermoplast Duroplast Elastomer Thermopl Duroplast Elastomer
8 Licht Farbstoff Lichtabsorption: Farbstoffe Elektromagnetische Strahlung; sichtbares Licht: Wellenlängenbereich von nm Löslicher organischer Stoff, der bei Bestrahlung mit weißem Licht farbig erscheint. Anregung von Elektronen: Aufnahme von Strahlungsenergie, Elektronen gelangen vom Grundzustand in angeregten Zustand. Die Anregungsenergie entspricht der absorbierten Wellenlänge. Komplementärfarbe: Vom menschl. Auge wird der nicht absorbierte, reflektierte Teil des Spektrums wahrgenommen. Dieser Teil entspricht der Komplementärfarbe des absorbierten Lichtes Farbe des Farbstoffes. hromophor Auxochrome und Antiauxochrome Delokalisiertes Elektronensystem des Farbstoffmoleküls ( Farbträger ). Auxochrome (Elektronendonatoren): Vergrößerung des delokalisierten Elektronensystems farbvertiefende Wirkung Antiauxochrome (Elektronenakzeptoren) Auxochrome: Gruppen mit I bzw. M-Effekt (z.b.: - 2, -) Antiauxochrome: Gruppen mit I bzw. M-Effekt (z.b.: -, - 2 ) aturfarbstoff; Grüner Farbstoff in den hloroplasten von Pflanzenzellen. 1 2 hlorophyll: 3 3 hlorophyll a 1 : = 2 2 : 3 b 1 : = 2 2 : d 1 : 2 : 3 Mg Azofarbstoffe Säure-Base-Indikatoren Azofarbstoffe enthalten die sog. Azogruppe (-=-) als hromophor. Säure-Base-Indikatoren sind organische Farbstoffe, die je nach p-wert als Säure oder Base reagieren und mit unterschiedlicher Struktur vorliegen. Die Struktur beeinflusst ihr Absorptionsverhalten und damit ihre Farbe. z.b.: Methylorange 3 p >4.4 gelb 3 S S 3 - p < 3 1. Diazotierung: aromatisches Amin reagiert mit itrosylkation zum mesomeriestabilisierten Diazoniumion. rot Azofarbstoff-Synthese 2
9 2. Azokupplung: Diazoniumion reagiert in elektrophiler Substitution mit anderem Aromat. 2 Küpenfärbung bei Indigo Indigo: blauer Farbstoff Küpenfärbung: 1. Umwandlung von wasserunlöslichem, blauem Indigo in wasserlösliche, farblose Leukoform durch eduktion in basischer Lösung. 2. Aufziehen der Leukoform auf Baumwolle. 3. ückgewinnung des blauen Farbstoffs durch xidation
10 Definition eaktionsgeschwindigkeit und Enzymkatalyse V = n(produkt) = - n(edukt) t t Mittlere eaktionsgeschwindigkeit: beschreibt die Änderung der Stoffmenge für einen bestimmten Zeitabschnitt. Momentane eaktionsgeschwindigkeit: beschreibt die Änderung der Stoffmenge für einen bestimmten Zeitpunkt. Stoßtheorie Abhängigkeit der eaktionsgeschwindigkeit Katalyse Enzyme Enzymwirkung emmstoffe ach der Stoßtheorie findet eine eaktion nur unter bestimmten Bedingungen statt: 1. die miteinander reagierenden Teilchen müssen aufeinander stoßen. 2. die Teilchen müssen in einer für sie günstigen Position kollidieren. 3. Die Teilchen müssen eine Mindestenergie besitzen. eaktionsgeschwindigkeit nimmt zu bei: - Einsatz eines Katalysators - Erhöhung der Eduktkonzentration - Erhöhung der berfläche (Zerteilungsgrad) - Erhöhung der Temperatur (GT-egel: eaktionsgeschwindigkeitstemperaturregel) omogene Katalyse: Katalysator und Edukte liegen in der gleichen Phase z.b. flüssig vor; euer eaktionsweg durch Bildung eines Zwischenproduktes. eterogene Katalyse: Katalysator und Edukte liegen in verschiedenen Phasen vor - häufig: Gasförmige Edukte / Metalloberfläche als Katalysator; Veränderung des eaktionsweges durch Adsorption auf der berfläche Enzyme sind proteinogene Biokatalysatoren senken die Aktivierungsenergie, werden nicht verbraucht Aktivität abhängig von Substratkonzentration, Temperatur, p Schlüssel-Schloss-Prinzip: Substrat und Enzym passen zueinander wie ein Schlüssel (Substrat) zu einem bestimmten Schloss (Enzym). Enzyme sind hochspezifisch, d.h. sie setzen nur ein bestimmtes Substrat (Substratspezifität) auf eine ganz bestimmte Weise (Wirkungsspezifität) um. emmstoffe verringern die Aktivität von Enzymen kompetitive emmung: emmstoff ist Substrat ähnlich, bindet reversibel an aktives Zentrum, Verdrängung durch Substrat möglich allosterische emmung: emmstoff Substrat nicht ähnlich, reversible Bindung an allosterisches Zentrum Veränderung von aktivem Zentrum, Verdrängung durch Substrat nicht möglich; Bedeutung: Stoffwechselregulation durch Endprodukthemmung. Schwermetall-Ionen: Veränderung des räumlichen Baus der Enzyme, meist irreversible Bindung an das Enzym ( Giftwirkung )
GRUNDWISSEN CHEMIE 10. KLASSE
 Grundwissen der 10. Klasse hemie GRUNDWISSEN EMIE 10. KLASSE (LS Marquartstein Sept. 2013) 2009 Zannantonio/Wagner LS Marquartstein 1 Grundwissen der 10. Klasse hemie Alkane= gesättigte KW: In ihren Molekülen
Grundwissen der 10. Klasse hemie GRUNDWISSEN EMIE 10. KLASSE (LS Marquartstein Sept. 2013) 2009 Zannantonio/Wagner LS Marquartstein 1 Grundwissen der 10. Klasse hemie Alkane= gesättigte KW: In ihren Molekülen
Homologe Reihe. Alkane. Alkene. Alkine
 GW Chemie 8.-10. NTG GA omologe eihe eihung von Stoffen, deren Moleküle sich durch eine sich wiederholende Einheit unterscheiden. Bsp.: Methan Ethan Propan Butan usw. unterscheiden sich durch je eine C
GW Chemie 8.-10. NTG GA omologe eihe eihung von Stoffen, deren Moleküle sich durch eine sich wiederholende Einheit unterscheiden. Bsp.: Methan Ethan Propan Butan usw. unterscheiden sich durch je eine C
Beschreiben Sie den Aufbau und die Eigenschaften der Kohlenwasserstoffe. Beschreiben Sie die Alkane allgemein.
 den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
Organische Chemie I Chemie am 16.11.2012. Inhaltsverzeichnis Lewisformeln von Kohlenstoffverbindungen korrekt zeichnen!... 2
 Organische Chemie I Inhaltsverzeichnis Lewisformeln von Kohlenstoffverbindungen korrekt zeichnen!... 2 Verstehen was Organische Chemie heisst und die Entstehung von Kohlenstoffverbindungen kennen!... 2
Organische Chemie I Inhaltsverzeichnis Lewisformeln von Kohlenstoffverbindungen korrekt zeichnen!... 2 Verstehen was Organische Chemie heisst und die Entstehung von Kohlenstoffverbindungen kennen!... 2
COOH. Die Aminosäuren tragen laborübliche Abkürzungen, so stehen z. B. Gly für Glycin oder Phe für Phenylalanin.
 Aminosäuren 1. Textentwurf Allgemeine Formel der Aminosäuren Aminosäuren sind die Grundbestandteile der Proteine. Neben der -Gruppe 1 enthalten sie als charakteristisches Merkmal die Aminogruppe N. Zwei
Aminosäuren 1. Textentwurf Allgemeine Formel der Aminosäuren Aminosäuren sind die Grundbestandteile der Proteine. Neben der -Gruppe 1 enthalten sie als charakteristisches Merkmal die Aminogruppe N. Zwei
Einführung in die Chemie der Kunststoffe
 Einführung in die Chemie der Kunststoffe Handout zur Powerpoint-Präsentation von Lena Großjung und Noreen Lange Der Bergiff Kunststoffe umfasst im weitesten Sinne: Organische Werkstoffe, die als Makromoleküle
Einführung in die Chemie der Kunststoffe Handout zur Powerpoint-Präsentation von Lena Großjung und Noreen Lange Der Bergiff Kunststoffe umfasst im weitesten Sinne: Organische Werkstoffe, die als Makromoleküle
P9 Kunststoffe Moleküle ohne Ende
 SLZB Fachbereich Naturwissenschaften Fachinternes Curriculum für das Fach Chemie Klasse 10 2014/15 P9 Kunststoffe Moleküle ohne Ende 10 Bedeutung Kunststoffe Monomer, Polymer, Makromoleküle Polymerisation
SLZB Fachbereich Naturwissenschaften Fachinternes Curriculum für das Fach Chemie Klasse 10 2014/15 P9 Kunststoffe Moleküle ohne Ende 10 Bedeutung Kunststoffe Monomer, Polymer, Makromoleküle Polymerisation
Studiengang Biowissenschaften Modulbegleitende Prüfung zum Praktikum in Organischer Chemie (gemäß MPO vom 12.09.2005) 21.07.2015
 Studiengang Biowissenschaften Modulbegleitende Prüfung zum Praktikum in Organischer Chemie (gemäß MPO vom 12.09.2005) 21.07.2015 Name: Vorname: Matrikel-Nr.: geborenam: in: Wiederholer dieser Klausur:
Studiengang Biowissenschaften Modulbegleitende Prüfung zum Praktikum in Organischer Chemie (gemäß MPO vom 12.09.2005) 21.07.2015 Name: Vorname: Matrikel-Nr.: geborenam: in: Wiederholer dieser Klausur:
Chemie der Kohlenwasserstoffe
 hemie der Kohlenwasserstoffe Alkane Gesättigte, kettenförmige Kohlenwasserstoffe gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane
hemie der Kohlenwasserstoffe Alkane Gesättigte, kettenförmige Kohlenwasserstoffe gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane
im Molekül eine Dreifachbindung (eine σ-bindung,
 1 14.03.2006 0.1 Grundwissen Alkane Gesättigte Kohlenwasserstoffe, die keine Mehrfachbindungen, sondern nur Einfachbindungen (σ-bindungen) zwischen den Kohlenstoffatomen im Molekül aufweisen. Die allgemeine
1 14.03.2006 0.1 Grundwissen Alkane Gesättigte Kohlenwasserstoffe, die keine Mehrfachbindungen, sondern nur Einfachbindungen (σ-bindungen) zwischen den Kohlenstoffatomen im Molekül aufweisen. Die allgemeine
Die Einheit der Atommasse m ist u. Das ist der 12. Teil der Masse eines Kohlenstoffatoms. 1 u = 1,6608 * 10-27 kg m(h) = 1 u
 Analytische Chemie Stöchiometrie Absolute Atommasse Die Einheit der Atommasse m ist u. Das ist der 12. Teil der Masse eines Kohlenstoffatoms. 1 u = 1,6608 * 10-27 kg m() = 1 u Stoffmenge n Die Stoffmenge
Analytische Chemie Stöchiometrie Absolute Atommasse Die Einheit der Atommasse m ist u. Das ist der 12. Teil der Masse eines Kohlenstoffatoms. 1 u = 1,6608 * 10-27 kg m() = 1 u Stoffmenge n Die Stoffmenge
Übungsblatt zu Säuren und Basen
 1 Übungsblatt zu Säuren und Basen 1. In einer wässrigen Lösung misst die Konzentration der Oxoniumionen (H 3 O + ) 10 5 M. a) Wie gross ist der ph Wert? b) Ist die Konzentration der OH Ionen grösser oder
1 Übungsblatt zu Säuren und Basen 1. In einer wässrigen Lösung misst die Konzentration der Oxoniumionen (H 3 O + ) 10 5 M. a) Wie gross ist der ph Wert? b) Ist die Konzentration der OH Ionen grösser oder
Spektroskopie. im IR- und UV/VIS-Bereich. Optische Rotationsdispersion (ORD) und Circulardichroismus (CD) http://www.analytik.ethz.
 Spektroskopie im IR- und UV/VIS-Bereich Optische Rotationsdispersion (ORD) und Circulardichroismus (CD) Dr. Thomas Schmid HCI D323 schmid@org.chem.ethz.ch http://www.analytik.ethz.ch Enantiomere sind Stereoisomere,
Spektroskopie im IR- und UV/VIS-Bereich Optische Rotationsdispersion (ORD) und Circulardichroismus (CD) Dr. Thomas Schmid HCI D323 schmid@org.chem.ethz.ch http://www.analytik.ethz.ch Enantiomere sind Stereoisomere,
Stoff, Reinstoff, Gemisch, homogenes Gemisch, heterogenes Gemisch. Reinstoff, Element, Verbindung. Zweiatomige Elemente.
 1 1 Einteilung der Stoffe: Stoff, Reinstoff, Gemisch, homogenes Gemisch, heterogenes Gemisch Stoff Reinstoff Mischen Gemisch Bei gleichen Bedingungen (Temperatur, Druck) immer gleiche Eigenschaften (z.b.
1 1 Einteilung der Stoffe: Stoff, Reinstoff, Gemisch, homogenes Gemisch, heterogenes Gemisch Stoff Reinstoff Mischen Gemisch Bei gleichen Bedingungen (Temperatur, Druck) immer gleiche Eigenschaften (z.b.
Organische Chemie. Kohlenwasserstoffe. Alkane. Alkane
 1 1 Organische Chemie beschäftigt sich mit Verbindungen, die C- Atome enthalten 2 2 Kohlenwasserstoffe bestehen ausschließlich aus C- und H- Atomen 3 3 es existieren nur C-H Einfachbindungen C-C Einfachbindung
1 1 Organische Chemie beschäftigt sich mit Verbindungen, die C- Atome enthalten 2 2 Kohlenwasserstoffe bestehen ausschließlich aus C- und H- Atomen 3 3 es existieren nur C-H Einfachbindungen C-C Einfachbindung
Funktionelle Gruppen Alkohol
 Alkohol Unter Alkohol versteht man (als hemiker) alle Verbindungen, in denen eine ydroxyl-gruppe an ein aliphatisches oder alicyclisches Kohlenstoffgerüst gebunden ist. ydroxylgruppe: funktionelle Gruppe
Alkohol Unter Alkohol versteht man (als hemiker) alle Verbindungen, in denen eine ydroxyl-gruppe an ein aliphatisches oder alicyclisches Kohlenstoffgerüst gebunden ist. ydroxylgruppe: funktionelle Gruppe
Chemie der Kohlenhydrate
 Chemie der Kohlenhydrate Grundlegendes Der Begriff Kohlenhydrate: Wurde ursprünglich aus der Formel für Glukose abgeleitet. C 6 H 12 O 6 = C 6 (H 2 O) 6 Bzw. allgemein: C n (H 2 O) m Diese missleitende
Chemie der Kohlenhydrate Grundlegendes Der Begriff Kohlenhydrate: Wurde ursprünglich aus der Formel für Glukose abgeleitet. C 6 H 12 O 6 = C 6 (H 2 O) 6 Bzw. allgemein: C n (H 2 O) m Diese missleitende
Grundwissen Chemie 10. Jahrgangsstufe
 Grundwissen Chemie 10. Jahrgangsstufe 1. Kohlenwasserstoffe - Alkane gesättigte Kohlenwasserstoffe (nur Einfachbindungen) mit der allgemeinen Summenformel C n H 2n+2 homologe Reihe (= Gruppe chemisch verwandter
Grundwissen Chemie 10. Jahrgangsstufe 1. Kohlenwasserstoffe - Alkane gesättigte Kohlenwasserstoffe (nur Einfachbindungen) mit der allgemeinen Summenformel C n H 2n+2 homologe Reihe (= Gruppe chemisch verwandter
6. Reaktionsgleichungen 6.1 Chemisches Reaktionsschema Wortschema Reaktionsschema Beispiel 1: Kupfer und Schwefel Vorzahlen
 6. Reaktionsgleichungen 6.1 Chemisches Reaktionsschema Das Wortschema benennt die Ausgangsstoffe und die Reaktionsprodukte einer chemischen Reaktion. Das Reaktionsschema sagt zusätzlich etwas über das
6. Reaktionsgleichungen 6.1 Chemisches Reaktionsschema Das Wortschema benennt die Ausgangsstoffe und die Reaktionsprodukte einer chemischen Reaktion. Das Reaktionsschema sagt zusätzlich etwas über das
0.1 Eiweißstoffe (Proteine)
 1 22.06.2006 0.1 Eiweißstoffe (Proteine) 0.1.1 Die Aminosäuren Bausteine der Proteine Proteine sind aus einer Vielzahl (bis Tausende) von Baueinheiten zusammengesetzte Makromoleküle. Die einzelnen Bausteine,
1 22.06.2006 0.1 Eiweißstoffe (Proteine) 0.1.1 Die Aminosäuren Bausteine der Proteine Proteine sind aus einer Vielzahl (bis Tausende) von Baueinheiten zusammengesetzte Makromoleküle. Die einzelnen Bausteine,
Organische Moleküle. Verschiedene Ansichten des Methans
 Organische Räumlicher Bau, Elektronendichteverteilungen Verschiedene Ansichten des Methans Ansicht des Methans mit seiner Elektronenhülle (Solid-Darstellung) Ansicht des Methans mit seiner Elektronenhülle
Organische Räumlicher Bau, Elektronendichteverteilungen Verschiedene Ansichten des Methans Ansicht des Methans mit seiner Elektronenhülle (Solid-Darstellung) Ansicht des Methans mit seiner Elektronenhülle
Beispiele zur Multiple-Choice Prüfung in OC
 1 Beispiele zur Multiple-Choice Prüfung in C 10 Fragen Typ A Einfachauswahl Bezeichnen Sie nur eine Wahlantwort durch Umkreisen des betreffenden Buchstabens: - bei positiver Formulierung die einzig richtige
1 Beispiele zur Multiple-Choice Prüfung in C 10 Fragen Typ A Einfachauswahl Bezeichnen Sie nur eine Wahlantwort durch Umkreisen des betreffenden Buchstabens: - bei positiver Formulierung die einzig richtige
Musterprüfung Chemie Klassen: MPL 09 Datum: 14. 16. April 2010
 1 Musterprüfung Chemie Klassen: MPL 09 Datum: 14. 16. April 2010 Themen: Metallische Bindungen (Skript S. 51 53, inkl. Arbeitsblatt) Reaktionsverlauf (Skript S. 54 59, inkl. Arbeitsblatt, Merke, Fig. 7.2.1
1 Musterprüfung Chemie Klassen: MPL 09 Datum: 14. 16. April 2010 Themen: Metallische Bindungen (Skript S. 51 53, inkl. Arbeitsblatt) Reaktionsverlauf (Skript S. 54 59, inkl. Arbeitsblatt, Merke, Fig. 7.2.1
Lösungsblatt zu Aufbau von Aminosäuren
 Lösungsblatt zu Aufbau von Aminosäuren 1. Zeichnen Sie die allgemeine Formel einer α-aminosäure, welche am α-c- Atom eine Seitenkette R trägt. 2. Welche der zwanzig natürlich vorkommenden L-α-Aminosäuren
Lösungsblatt zu Aufbau von Aminosäuren 1. Zeichnen Sie die allgemeine Formel einer α-aminosäure, welche am α-c- Atom eine Seitenkette R trägt. 2. Welche der zwanzig natürlich vorkommenden L-α-Aminosäuren
Aminosäuren - Proteine
 Aminosäuren - Proteine ÜBERBLICK D.Pflumm KSR / MSE Aminosäuren Überblick Allgemeine Formel für das Grundgerüst einer Aminosäure Carboxylgruppe: R-COOH O Aminogruppe: R-NH 2 einzelnes C-Atom (α-c-atom)
Aminosäuren - Proteine ÜBERBLICK D.Pflumm KSR / MSE Aminosäuren Überblick Allgemeine Formel für das Grundgerüst einer Aminosäure Carboxylgruppe: R-COOH O Aminogruppe: R-NH 2 einzelnes C-Atom (α-c-atom)
2 Physikalische Eigenschaften von Fettsäuren: Löslichkeit, Dissoziationsverhalten, Phasenzustände
 2 Physikalische Eigenschaften von Fettsäuren: Löslichkeit, Dissoziationsverhalten, Phasenzustände Als Fettsäuren wird die Gruppe aliphatischer Monocarbonsäuren bezeichnet. Der Name Fettsäuren geht darauf
2 Physikalische Eigenschaften von Fettsäuren: Löslichkeit, Dissoziationsverhalten, Phasenzustände Als Fettsäuren wird die Gruppe aliphatischer Monocarbonsäuren bezeichnet. Der Name Fettsäuren geht darauf
Übungen zur VL Chemie für Biologen und Humanbiologen 18.11.2011 Lösung Übung 3
 Übungen zur VL Chemie für Biologen und Humanbiologen 18.11.2011 Lösung Übung 3 Teil 1: Die Geometrie organischer Verbindungen 1. Welche Form hat ein s-orbital? Welche Form haben p-orbitale? Skizzieren
Übungen zur VL Chemie für Biologen und Humanbiologen 18.11.2011 Lösung Übung 3 Teil 1: Die Geometrie organischer Verbindungen 1. Welche Form hat ein s-orbital? Welche Form haben p-orbitale? Skizzieren
n Pentan 2- Methylbutan 2,2, dimethylpropan ( Wasserstoffatome sind nicht berücksichtigt )
 Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Kohlenhydrate Aminosäuren Peptide
 Kohlenhydrate Aminosäuren Peptide Kohlenhydrate Kohlenhydrate = Saccharide Sie stellen zusammen mit Fetten und Proteinen den quantitativ größten verwertbaren (z.b. Stärke) und nicht-verwertbaren (Ballaststoffe)
Kohlenhydrate Aminosäuren Peptide Kohlenhydrate Kohlenhydrate = Saccharide Sie stellen zusammen mit Fetten und Proteinen den quantitativ größten verwertbaren (z.b. Stärke) und nicht-verwertbaren (Ballaststoffe)
1) Welche Aussagen über die Hauptgruppenelemente im Periodensystem sind richtig?
 1) Welche Aussagen über die Hauptgruppenelemente im Periodensystem sind richtig? 1) Es sind alles Metalle. 2) In der äußeren Elektronenschale werden s- bzw. s- und p-orbitale aufgefüllt. 3) Sie stimmen
1) Welche Aussagen über die Hauptgruppenelemente im Periodensystem sind richtig? 1) Es sind alles Metalle. 2) In der äußeren Elektronenschale werden s- bzw. s- und p-orbitale aufgefüllt. 3) Sie stimmen
GRUNDWISSEN CHEMIE 9 - MuG erstellt von der Fachschaft Chemie
 Christian-Ernst-Gymnasium Am Langemarckplatz 2 91054 ERLANGEN GRUNDWISSEN CHEMIE 9 - MuG erstellt von der Fachschaft Chemie C 9.1 Stoffe und Reaktionen Reinstoff Element Kann chemisch nicht mehr zerlegt
Christian-Ernst-Gymnasium Am Langemarckplatz 2 91054 ERLANGEN GRUNDWISSEN CHEMIE 9 - MuG erstellt von der Fachschaft Chemie C 9.1 Stoffe und Reaktionen Reinstoff Element Kann chemisch nicht mehr zerlegt
Material zur Vorbereitung der Prüfung im Fach Chemie
 Material zur Vorbereitung der Prüfung im Fach Chemie 1 Empfohlene Literatur Duden Basiswissen Schule: Abitur Chemie Schulbücher für die Sekundarstufe II: - Chemie im Kontext, CVK Verlag - Elemente Chemie
Material zur Vorbereitung der Prüfung im Fach Chemie 1 Empfohlene Literatur Duden Basiswissen Schule: Abitur Chemie Schulbücher für die Sekundarstufe II: - Chemie im Kontext, CVK Verlag - Elemente Chemie
Bereich der 1 H-chemischen Verschiebung (Abb. nach: Friebolin)
 Bereich der 1 -chemischen Verschiebung (Abb. nach: Friebolin) 1 -NM-Spektroskopie 1 Der esonanzbereich der Protonen in organischen Molekülen ist ca. 10 ppm breit. Nur saure Protonen (z.b. COO oder SO 3
Bereich der 1 -chemischen Verschiebung (Abb. nach: Friebolin) 1 -NM-Spektroskopie 1 Der esonanzbereich der Protonen in organischen Molekülen ist ca. 10 ppm breit. Nur saure Protonen (z.b. COO oder SO 3
Homologe Reihe der Alkane. Benennung der Alkane. Konstitutionsisomerie. Isomerie. Was versteht man unter der Homologen Reihe der Alkane?
 Grundwissen hemie: NTG 10 1/24 omologe eihe der Alkane Was versteht man unter der omologen eihe der Alkane? Grundwissen hemie: NTG 10 2/24 Benennung der Alkane Benenne die ersten zwölf Vertreter aus der
Grundwissen hemie: NTG 10 1/24 omologe eihe der Alkane Was versteht man unter der omologen eihe der Alkane? Grundwissen hemie: NTG 10 2/24 Benennung der Alkane Benenne die ersten zwölf Vertreter aus der
SUPERABSORBER. Eine Präsentation von Johannes Schlüter und Thomas Luckert
 SUPERABSORBER Eine Präsentation von Johannes Schlüter und Thomas Luckert Inhalt: Die Windel Die Technik des Superabsorbers Anwendungsgebiete des Superabsorbers Ein kurzer Abriss aus der Geschichte der
SUPERABSORBER Eine Präsentation von Johannes Schlüter und Thomas Luckert Inhalt: Die Windel Die Technik des Superabsorbers Anwendungsgebiete des Superabsorbers Ein kurzer Abriss aus der Geschichte der
Chemische Gleichgewichte
 Kompetenzen und Inhalte des Bildungsplans Unterrichtsinhalte Schulcurriculum und Hinweise Chemische Gleichgewichte An Beispielen die Bedingungen für die Einstellung eines chemischen Gleichgewichts erklären
Kompetenzen und Inhalte des Bildungsplans Unterrichtsinhalte Schulcurriculum und Hinweise Chemische Gleichgewichte An Beispielen die Bedingungen für die Einstellung eines chemischen Gleichgewichts erklären
Redoxreaktionen. Redoxreaktionen: Reaktionen bei denen Elektronen zwischen den Komponenten übertragen werden
 Nach Lavoisier: : Redoxreaktionen Redoxreaktionen: Reaktionen bei denen Elektronen zwischen den Komponenten übertragen werden Aufnahme von Sauerstoff zb.: Verbrennen von Magnesium : Abgabe von Sauerstoff
Nach Lavoisier: : Redoxreaktionen Redoxreaktionen: Reaktionen bei denen Elektronen zwischen den Komponenten übertragen werden Aufnahme von Sauerstoff zb.: Verbrennen von Magnesium : Abgabe von Sauerstoff
Christian-Ernst-Gymnasium
 Christian-Ernst-Gymnasium Am Langemarckplatz 2 91054 ERLANGEN GRUNDWISSEN CHEMIE 9 - MuG erstellt von der Fachschaft Chemie C 9.1 Stoffe und en Element kann chemisch nicht mehr zerlegt werden Teilchen
Christian-Ernst-Gymnasium Am Langemarckplatz 2 91054 ERLANGEN GRUNDWISSEN CHEMIE 9 - MuG erstellt von der Fachschaft Chemie C 9.1 Stoffe und en Element kann chemisch nicht mehr zerlegt werden Teilchen
Grundlagen. Maximilian Ernestus Waldorfschule Saarbrücken
 Grundlagen Maximilian Ernestus Waldorfschule Saarbrücken 2008/2009 Inhaltsverzeichnis 1 Chemische Elemente 2 2 Das Teilchenmodell 3 3 Mischungen und Trennverfahren 4 4 Grundgesetze chemischer Reaktionen
Grundlagen Maximilian Ernestus Waldorfschule Saarbrücken 2008/2009 Inhaltsverzeichnis 1 Chemische Elemente 2 2 Das Teilchenmodell 3 3 Mischungen und Trennverfahren 4 4 Grundgesetze chemischer Reaktionen
Welche wichtigen Begriffe gibt es?
 Welche wichtigen Begriffe gibt es? Moleküle Beispiel: Kohlendioxid CO 2 bestehen aus Protonen (+) bestehen aus Atomkerne Chemische Elemente bestehen aus Atome bestehen aus Neutronen Beispiele: Kohlenstoff
Welche wichtigen Begriffe gibt es? Moleküle Beispiel: Kohlendioxid CO 2 bestehen aus Protonen (+) bestehen aus Atomkerne Chemische Elemente bestehen aus Atome bestehen aus Neutronen Beispiele: Kohlenstoff
UV/VIS-Spektroskopie
 UV/VIS-Spektroskopie Dies ist die älteste spektroskopische Methode, die aber wegen begrenzter Aussagekraft heute in der Praxis keine allzu große Rolle mehr spielt. Es werden elektronische Übergänge angeregt,
UV/VIS-Spektroskopie Dies ist die älteste spektroskopische Methode, die aber wegen begrenzter Aussagekraft heute in der Praxis keine allzu große Rolle mehr spielt. Es werden elektronische Übergänge angeregt,
Schriftlicher Leistungsnachweis. Fette und Glucose
 Name: Kurs: Schriftlicher Leistungsnachweis Datum Fette und Glucose Material I Das Molekül eines Reinstoffes, der aus einem natürlichen Fett gewonnen wurde, wird mit der Formel C 3 H 5 (C 16 H 31 2 )(C
Name: Kurs: Schriftlicher Leistungsnachweis Datum Fette und Glucose Material I Das Molekül eines Reinstoffes, der aus einem natürlichen Fett gewonnen wurde, wird mit der Formel C 3 H 5 (C 16 H 31 2 )(C
Versuch: Denaturierung von Eiweiß
 Philipps-Universität Marburg 29.01.2008 rganisches Grundpraktikum (LA) Katrin Hohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 10, Amine, Aminosäuren, Peptide Versuch: Denaturierung
Philipps-Universität Marburg 29.01.2008 rganisches Grundpraktikum (LA) Katrin Hohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 10, Amine, Aminosäuren, Peptide Versuch: Denaturierung
Zeichen bei Zahlen entschlüsseln
 Zeichen bei Zahlen entschlüsseln In diesem Kapitel... Verwendung des Zahlenstrahls Absolut richtige Bestimmung von absoluten Werten Operationen bei Zahlen mit Vorzeichen: Addieren, Subtrahieren, Multiplizieren
Zeichen bei Zahlen entschlüsseln In diesem Kapitel... Verwendung des Zahlenstrahls Absolut richtige Bestimmung von absoluten Werten Operationen bei Zahlen mit Vorzeichen: Addieren, Subtrahieren, Multiplizieren
Name: Klasse: Datum:
 Arbeitsblatt 10.1 Versuch 1: Man füllt eine mittelgroße Glasschale mit Wasser und legt vorsichtig eine Büroklammer auf die Oberfläche des Wassers. Anschließend gibt man mit einer Pipette am Rand der Glasschale
Arbeitsblatt 10.1 Versuch 1: Man füllt eine mittelgroße Glasschale mit Wasser und legt vorsichtig eine Büroklammer auf die Oberfläche des Wassers. Anschließend gibt man mit einer Pipette am Rand der Glasschale
Grundwissen Chemie Mittelstufe (10 MNG)
 Grundwissen hemie Mittelstufe (10 MNG) Marie-Therese-Gymnasium Erlangen Einzeldateien: GW8 Grundwissen für die 8. Jahrgangsstufe GW9 Grundwissen für die 9. Jahrgangsstufe (MNG) GW9a Grundwissen für die
Grundwissen hemie Mittelstufe (10 MNG) Marie-Therese-Gymnasium Erlangen Einzeldateien: GW8 Grundwissen für die 8. Jahrgangsstufe GW9 Grundwissen für die 9. Jahrgangsstufe (MNG) GW9a Grundwissen für die
Allotrope Kohlenstoffmodifikationen. Ein Vortrag von Patrick Knicknie. Datum: 04.05.06 Raum:112
 Allotrope Kohlenstoffmodifikationen Ein Vortrag von Patrick Knicknie Datum: 04.05.06 Raum:112 Themen: 1. Was ist Allotrop? 2. Unterschiedliche Kohlenstoffmodifikationen 3. Der Graphit 4. Der Diamant 5.
Allotrope Kohlenstoffmodifikationen Ein Vortrag von Patrick Knicknie Datum: 04.05.06 Raum:112 Themen: 1. Was ist Allotrop? 2. Unterschiedliche Kohlenstoffmodifikationen 3. Der Graphit 4. Der Diamant 5.
Der Chemielehrplan der Jahrgangsstufe 11
 Der hemielehrplan der Jahrgangsstufe 11 Fortbildungsveranstaltung im Rahmen der Regionalen Lehrerfortbildung September-ovember 2011 1 Liebe Kolleginnen und Kollegen, diese Veranstaltung möchte an die
Der hemielehrplan der Jahrgangsstufe 11 Fortbildungsveranstaltung im Rahmen der Regionalen Lehrerfortbildung September-ovember 2011 1 Liebe Kolleginnen und Kollegen, diese Veranstaltung möchte an die
4-Butyl-2,5-dimethylheptan 5-Ethyl-4,8-dimethylundecan
 Übungsaufgaben zur Vorlesung Chemie für Biologen, WS 2005/2006 Themenbereich rganische Chemie 1. Warum ist der Kohlenstoff mehr als jedes andere Element dafür prädestiniert, komplexe Molekülverbindungen
Übungsaufgaben zur Vorlesung Chemie für Biologen, WS 2005/2006 Themenbereich rganische Chemie 1. Warum ist der Kohlenstoff mehr als jedes andere Element dafür prädestiniert, komplexe Molekülverbindungen
Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1. Grundwissen 10.Klasse NTG 2 Grundwissen 10.Klasse NTG 2
 Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1 Homologe Reihe: Reihe von Kohlenwasserstoffen, bei der jedes Molekül eine CH 2 -Gruppe mehr enthält als das vorhergehende. Gesättigte Kohlenwasserstoffe
Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1 Homologe Reihe: Reihe von Kohlenwasserstoffen, bei der jedes Molekül eine CH 2 -Gruppe mehr enthält als das vorhergehende. Gesättigte Kohlenwasserstoffe
Chemische Reaktionen
 Ein paar Worte zuvor 7 Stoffe und ihre Eigenschaften 1 Reine Stoffe und Gemische 10 2 Aggregatzustände, Dichte, Löslichkeit, Brennbarkeit und Leitfähigkeit 12 3 Trennverfahren 19 Auf einen Blick: Stoffe
Ein paar Worte zuvor 7 Stoffe und ihre Eigenschaften 1 Reine Stoffe und Gemische 10 2 Aggregatzustände, Dichte, Löslichkeit, Brennbarkeit und Leitfähigkeit 12 3 Trennverfahren 19 Auf einen Blick: Stoffe
Element. Verbindung. Reinstoff. Gemisch
 Element Reinstoff, der chemisch nicht mehr zersetzt werden kann dessen Teilchen (Atome oder Moleküle) aus einer einzigen Atomart (gleiche Ordnungszahl) besteht Verbindung = Reinstoff, der sich in Elemente
Element Reinstoff, der chemisch nicht mehr zersetzt werden kann dessen Teilchen (Atome oder Moleküle) aus einer einzigen Atomart (gleiche Ordnungszahl) besteht Verbindung = Reinstoff, der sich in Elemente
PO Doppelbrechung und elliptisch polarisiertes Licht
 PO Doppelbrechung und elliptisch polarisiertes Licht Blockpraktikum Herbst 27 (Gruppe 2b) 24. Oktober 27 Inhaltsverzeichnis 1 Grundlagen 2 1.1 Polarisation.................................. 2 1.2 Brechung...................................
PO Doppelbrechung und elliptisch polarisiertes Licht Blockpraktikum Herbst 27 (Gruppe 2b) 24. Oktober 27 Inhaltsverzeichnis 1 Grundlagen 2 1.1 Polarisation.................................. 2 1.2 Brechung...................................
Eliminierungsreaktionen: E1- und E2- Mechanismen; Olefine
 Eliminierungsreaktionen: E1 und E2 chanismen; lefine Allgemeine Gleichung der Eliminierung: Base X X Die Bindung wird am Atom gebrochen. Für die Qualität der Abgangsgruppe X gelten die selben egeln wie
Eliminierungsreaktionen: E1 und E2 chanismen; lefine Allgemeine Gleichung der Eliminierung: Base X X Die Bindung wird am Atom gebrochen. Für die Qualität der Abgangsgruppe X gelten die selben egeln wie
Durchführung einer Gel-Elektrophorese mit einem DNA-Gemisch
 Durchführung einer Gel-Elektrophorese mit einem DNA-Gemisch (Fotos vom 6. März 2013 Molekularbiologisches Praktikum 12 G-Kurs Biologie Herr Korne - am KOMM Homburg/Saar unter Anleitung von Frau Dr. Amoroso)
Durchführung einer Gel-Elektrophorese mit einem DNA-Gemisch (Fotos vom 6. März 2013 Molekularbiologisches Praktikum 12 G-Kurs Biologie Herr Korne - am KOMM Homburg/Saar unter Anleitung von Frau Dr. Amoroso)
1. Einleitung und Aufgabenstellung
 1. Einleitung und Aufgabenstellung 1 1. Einleitung und Aufgabenstellung Reaktionen von starken Elektronenakzeptoren mit Amidinen und Aminen sind seit den Arbeiten von Rappoport et al. [1] in den 60-er
1. Einleitung und Aufgabenstellung 1 1. Einleitung und Aufgabenstellung Reaktionen von starken Elektronenakzeptoren mit Amidinen und Aminen sind seit den Arbeiten von Rappoport et al. [1] in den 60-er
Kern-Hülle-Modell. Modellvorstellung. zum elektrischen Strom. Die Ladung. Die elektrische Stromstärke. Die elektrische Spannung
 Kern-Hülle-Modell Ein Atom ist in der Regel elektrisch neutral: das heißt, es besitzt gleich viele Elektronen in der Hülle wie positive Ladungen im Kern Modellvorstellung zum elektrischen Strom - Strom
Kern-Hülle-Modell Ein Atom ist in der Regel elektrisch neutral: das heißt, es besitzt gleich viele Elektronen in der Hülle wie positive Ladungen im Kern Modellvorstellung zum elektrischen Strom - Strom
ORGANISCHE CHEMIE-ÜBUNGEN für Studierende mit Chemie als Nebenfach
 Prof. Dr. Th. K. Lindhorst RGAISCE CEMIE-ÜBUGE für Studierende mit Chemie als ebenfach 1. a) Alanin ist 2-Aminopropansäure. Wählen Sie für die Darstellung der beiden enantiomeren Formen von Alanin eine
Prof. Dr. Th. K. Lindhorst RGAISCE CEMIE-ÜBUGE für Studierende mit Chemie als ebenfach 1. a) Alanin ist 2-Aminopropansäure. Wählen Sie für die Darstellung der beiden enantiomeren Formen von Alanin eine
Grundwissen Chemie. 8. Jahrgangsstufe, Gruppe I
 Grundwissen Chemie 8. Jahrgangsstufe, Gruppe I Stoffe, Experimente - Stoffe und Stoffgemische unterscheiden Stoffeigenschaften, Reinstoffe, Gemische, Trennverfahren - Teilchenmodell: Atome und Moleküle
Grundwissen Chemie 8. Jahrgangsstufe, Gruppe I Stoffe, Experimente - Stoffe und Stoffgemische unterscheiden Stoffeigenschaften, Reinstoffe, Gemische, Trennverfahren - Teilchenmodell: Atome und Moleküle
Kapitel 13: Laugen und Neutralisation
 Kapitel 13: Laugen und Neutralisation Alkalimetalle sind Natrium, Kalium, Lithium (und Rubidium, Caesium und Francium). - Welche besonderen Eigenschaften haben die Elemente Natrium, Kalium und Lithium?
Kapitel 13: Laugen und Neutralisation Alkalimetalle sind Natrium, Kalium, Lithium (und Rubidium, Caesium und Francium). - Welche besonderen Eigenschaften haben die Elemente Natrium, Kalium und Lithium?
Chemische Bindung. Chemische Bindung
 Chemische Bindung Atome verbinden sich zu Molekülen oder Gittern, um eine Edelgaskonfiguration zu erreichen. Es gibt drei verschiedene Arten der chemischen Bindung: Atombindung Chemische Bindung Gesetz
Chemische Bindung Atome verbinden sich zu Molekülen oder Gittern, um eine Edelgaskonfiguration zu erreichen. Es gibt drei verschiedene Arten der chemischen Bindung: Atombindung Chemische Bindung Gesetz
Fällungsreaktion. Flammenfärbung. Fällungsreaktion:
 2 Fällungsreaktion: 2 Fällungsreaktion Entsteht beim Zusammengießen zweier Salzlösungen ein Niederschlag eines schwer löslichen Salzes, so spricht man von einer Fällungsreaktion. Bsp: Na + (aq) + Cl -
2 Fällungsreaktion: 2 Fällungsreaktion Entsteht beim Zusammengießen zweier Salzlösungen ein Niederschlag eines schwer löslichen Salzes, so spricht man von einer Fällungsreaktion. Bsp: Na + (aq) + Cl -
Referat : Aufbau v. Proteinen u. ihre Raumstruktur
 Referat : Aufbau v. Proteinen u. ihre Raumstruktur 1. Einleitung Unsere Körperzellen enthalten einige Tausend verschiedene Proteine wobei man schätzt, das insgesamt über 50 000 verschiedene Eiweißstoffe
Referat : Aufbau v. Proteinen u. ihre Raumstruktur 1. Einleitung Unsere Körperzellen enthalten einige Tausend verschiedene Proteine wobei man schätzt, das insgesamt über 50 000 verschiedene Eiweißstoffe
Endstoffe (Produkte) Aus dem Reaktionsgemisch entweichendes Gas, z. B. 2 Welche Informationen kann man einer Reaktionsgleichung entnehmen?
 Reaktionsgleichungen Reaktionsgleichungen Blatt 1/5 1 Was ist eine Reaktionsgleichung? Eine Reaktionsgleichung beschreibt die Umwandlung von Stoffen, also einen chemischen Prozeß. Auf der einen Seite steht,
Reaktionsgleichungen Reaktionsgleichungen Blatt 1/5 1 Was ist eine Reaktionsgleichung? Eine Reaktionsgleichung beschreibt die Umwandlung von Stoffen, also einen chemischen Prozeß. Auf der einen Seite steht,
Erftgymnasium der Stadt Bergheim. Schulinternes Curriculum für das Fach Chemie in der Sekundarstufe II
 Erftgymnasium der Stadt Bergheim Schulinternes Curriculum für das Fach Chemie in der Sekundarstufe II Als Fortführung des Unterrichts in der Sekundarstufe I wird Schülerinnen und Schülern ein anwendungs-
Erftgymnasium der Stadt Bergheim Schulinternes Curriculum für das Fach Chemie in der Sekundarstufe II Als Fortführung des Unterrichts in der Sekundarstufe I wird Schülerinnen und Schülern ein anwendungs-
1 Zwei Teilchen in einem Kastenpotenzial
 1 Zwei Teilchen in einem Kastenpotenzial Es geht hier darum herauszu nden, welche prinzipiellen Eigenschaften die Wellenfunktion für mehrere Teilchen im gleichen Potenzial aufweisen muss. Wir unterscheiden
1 Zwei Teilchen in einem Kastenpotenzial Es geht hier darum herauszu nden, welche prinzipiellen Eigenschaften die Wellenfunktion für mehrere Teilchen im gleichen Potenzial aufweisen muss. Wir unterscheiden
SPEYER-KOLLEG AUGUST 2003 FACHKONFERENZ CHEMIE / BIOLOGIE
 STOFFPLAN CHEMIE GRUNDKURS 1. Halbjahr (K 1) 1. ATOMMODELL Kern- / Hülle-Modell (nach Bohr / Sommerfeld vereinfacht) Ergebnisse des "Wellenmechanischen Atommodells" Quantenzahlen, "Orbitale"(s-, p-, d-)
STOFFPLAN CHEMIE GRUNDKURS 1. Halbjahr (K 1) 1. ATOMMODELL Kern- / Hülle-Modell (nach Bohr / Sommerfeld vereinfacht) Ergebnisse des "Wellenmechanischen Atommodells" Quantenzahlen, "Orbitale"(s-, p-, d-)
Überstrukturen von Polymeren
 Überstrukturen von Polymeren Die Vielfalt der molekularen Architektur von Kunststoffen wird durch d die verschiedenen möglichen Überstrukturen, in denen Polymerketten en vorliegen können, noch erweitert.
Überstrukturen von Polymeren Die Vielfalt der molekularen Architektur von Kunststoffen wird durch d die verschiedenen möglichen Überstrukturen, in denen Polymerketten en vorliegen können, noch erweitert.
Vorlesung Anorganische Chemie
 Vorlesung Anorganische Chemie Prof. Ingo Krossing WS 2007/08 B.Sc. Chemie Lernziele Block 6 Entropie und Gibbs Enthalpie Gibbs-elmholtz-Gleichung Absolute Entropien Gibbs Standardbildungsenthalpien Kinetik
Vorlesung Anorganische Chemie Prof. Ingo Krossing WS 2007/08 B.Sc. Chemie Lernziele Block 6 Entropie und Gibbs Enthalpie Gibbs-elmholtz-Gleichung Absolute Entropien Gibbs Standardbildungsenthalpien Kinetik
EINE KERZE INTERPRETATIONEN BEOBACHTUNGEN FLAMME REAKTIONEN WACHS DOCHT GASE. Reaktionsgleichungen Prozesse. Theorien
 Reaktionsgleichungen Prozesse INTERPRETATIONEN BEOBACHTUNGEN Theorien Licht Produkte Reaktionsgleichungen Thermodynamik Geschwindigkeit REAKTIONEN EINE KERZE FLAMME Farbe Form Bewegung Einflüsse WACHS
Reaktionsgleichungen Prozesse INTERPRETATIONEN BEOBACHTUNGEN Theorien Licht Produkte Reaktionsgleichungen Thermodynamik Geschwindigkeit REAKTIONEN EINE KERZE FLAMME Farbe Form Bewegung Einflüsse WACHS
1 mm 20mm ) =2.86 Damit ist NA = sin α = 0.05. α=arctan ( 1.22 633 nm 0.05. 1) Berechnung eines beugungslimitierten Flecks
 1) Berechnung eines beugungslimitierten Flecks a) Berechnen Sie die Größe eines beugungslimitierten Flecks, der durch Fokussieren des Strahls eines He-Ne Lasers (633 nm) mit 2 mm Durchmesser entsteht.
1) Berechnung eines beugungslimitierten Flecks a) Berechnen Sie die Größe eines beugungslimitierten Flecks, der durch Fokussieren des Strahls eines He-Ne Lasers (633 nm) mit 2 mm Durchmesser entsteht.
Farbtypen. Bedeutung von Farben 1. Drucken. Arbeiten mit Farben. Papierhandhabung. Wartung. Problemlösung. Verwaltung. Index
 Bedeutung von Farben 1 Ihr Drucker bietet Ihnen die Möglichkeit, Farben als Kommunikationsmittel einzusetzen. Farben wecken die Aufmerksamkeit, schaffen Respekt und verleihen Ihren Ausdrucken oder sonstigen
Bedeutung von Farben 1 Ihr Drucker bietet Ihnen die Möglichkeit, Farben als Kommunikationsmittel einzusetzen. Farben wecken die Aufmerksamkeit, schaffen Respekt und verleihen Ihren Ausdrucken oder sonstigen
Organische Chemie 10C1. Funktionelle Gruppen 10C2. Homologe Reihe der Alkane 10C3. Nomenklatur der Alkane (gesättigte Kohlenwasserstoffe) 10C4
 Organische Chemie 10C1 Chemie der Kohlenstoffverbindungen (C und v.a. H, N, O, S) C-Atome immer vierbindig Funktionelle Gruppen 10C2 Alkan: nur Einfachbindungen Alken: mindestens eine Doppelbindung Alkin:
Organische Chemie 10C1 Chemie der Kohlenstoffverbindungen (C und v.a. H, N, O, S) C-Atome immer vierbindig Funktionelle Gruppen 10C2 Alkan: nur Einfachbindungen Alken: mindestens eine Doppelbindung Alkin:
Farbstoffe Zusammenfassung Klausur K2
 Farbstoffe Zusammenfassung Klausur K2 aphael Michel 10. März 2013 Inhaltsverzeichnis 1 Allgemeines 1 1.1 Mesomeriemodell und Absorption.............................. 1 2 Farbstoffklassen 2 2.1 Indigo.............................................
Farbstoffe Zusammenfassung Klausur K2 aphael Michel 10. März 2013 Inhaltsverzeichnis 1 Allgemeines 1 1.1 Mesomeriemodell und Absorption.............................. 1 2 Farbstoffklassen 2 2.1 Indigo.............................................
Schulinterne Richtlinien. Fach: Chemie Fachbuch: Chemie 2000 + Sekundarstufe II
 Schulinterne Richtlinien Fach: Chemie Fachbuch: Chemie 2000 + Sekundarstufe II Der Unterricht in der Oberstufe orientiert sich im Rahmen des Lehrplans an der für das Zentralabitur NRW vorgesehenen und
Schulinterne Richtlinien Fach: Chemie Fachbuch: Chemie 2000 + Sekundarstufe II Der Unterricht in der Oberstufe orientiert sich im Rahmen des Lehrplans an der für das Zentralabitur NRW vorgesehenen und
GRUNDWISSEN CHEMIE DER 9. JAHRGANGSSTUFE (SG)
 Auszug aus dem Lehrplan: Die Schüler können das Stoff-Teilchen Konzept auf Stoffe aus ihrer Lebenswelt anwenden. Sie können chemische Formeln und Reaktionsgleichungen erstellen und interpretieren. Sie
Auszug aus dem Lehrplan: Die Schüler können das Stoff-Teilchen Konzept auf Stoffe aus ihrer Lebenswelt anwenden. Sie können chemische Formeln und Reaktionsgleichungen erstellen und interpretieren. Sie
Seminarplan zum. Chemischen Praktikum für Biologen ohne Prüfungsfach Chemie. (Lehramt) TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE
 Seminarplan zum Chemischen Praktikum für Biologen ohne Prüfungsfach Chemie (Lehramt) TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE TEIL II: ORGANISCHE CHEMIE 1 TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE Einführung
Seminarplan zum Chemischen Praktikum für Biologen ohne Prüfungsfach Chemie (Lehramt) TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE TEIL II: ORGANISCHE CHEMIE 1 TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE Einführung
Die Löslichkeit ist die Lösung. BELLAND alkalisch lösliche Polymere Applikationen und Handhabung
 Das Unternehmen Die Löslichkeit ist die Lösung BELLAND alkalisch lösliche Polymere Applikationen und Handhabung BellandTechnology AG ist ein Polymertechnologie-Unternehmen, das ursprünglich 1983 in der
Das Unternehmen Die Löslichkeit ist die Lösung BELLAND alkalisch lösliche Polymere Applikationen und Handhabung BellandTechnology AG ist ein Polymertechnologie-Unternehmen, das ursprünglich 1983 in der
Analytische Chemie (für Biol. / Pharm. Wiss.)
 Analytische Chemie (für Biol. / Pharm. Wiss.) Teil: Trenntechniken (Chromatographie, Elektrophorese) Dr. Thomas Schmid HCI D323 schmid@org.chem.ethz.ch http://www.analytik.ethz.ch/ Elektrophorese 2 Elektrophorese
Analytische Chemie (für Biol. / Pharm. Wiss.) Teil: Trenntechniken (Chromatographie, Elektrophorese) Dr. Thomas Schmid HCI D323 schmid@org.chem.ethz.ch http://www.analytik.ethz.ch/ Elektrophorese 2 Elektrophorese
Schulcurriculum für die Qualifikationsphase im Fach Chemie
 Schulcurriculum für die Qualifikationsphase im Fach Chemie Fach: Chemie Klassenstufe: 11/12 Anzahl der zu unterrichtenden Wochenstunden: 3 Die Inhalte des Kerncurriculums wurden in Absprache mit den anderen
Schulcurriculum für die Qualifikationsphase im Fach Chemie Fach: Chemie Klassenstufe: 11/12 Anzahl der zu unterrichtenden Wochenstunden: 3 Die Inhalte des Kerncurriculums wurden in Absprache mit den anderen
Abgestufte Lernhilfen
 Abgestufte Lernhilfen Checkliste für die Beobachtungen: o o o o o Farbe des Indikators bei bei Zugabe zu Natronlauge Temperatur vor Zugabe der Salzsäure Farbveränderungen bei Zugabe der Salzsäure Temperaturveränderungen
Abgestufte Lernhilfen Checkliste für die Beobachtungen: o o o o o Farbe des Indikators bei bei Zugabe zu Natronlauge Temperatur vor Zugabe der Salzsäure Farbveränderungen bei Zugabe der Salzsäure Temperaturveränderungen
Hydrierung von Kohlenmonoxid zu Methanol Kataly?sche Umsetzung von Ethen mit Wasser zu Ethanol
 Oxida&onsreak&onen Von Alkenen und Alkokolen zu Aldehyden, Ketonen und Carbonsäuren H. Wünsch 2012 1 Vorbemerkung Grundlage der hier betrachteten Reak?onen sind Alkene und Alkohole. Alkohole sind Produkte
Oxida&onsreak&onen Von Alkenen und Alkokolen zu Aldehyden, Ketonen und Carbonsäuren H. Wünsch 2012 1 Vorbemerkung Grundlage der hier betrachteten Reak?onen sind Alkene und Alkohole. Alkohole sind Produkte
APP-GFP/Fluoreszenzmikroskop. Aufnahmen neuronaler Zellen, mit freund. Genehmigung von Prof. Stefan Kins, TU Kaiserslautern
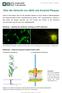 Über die Herkunft von Aβ42 und Amyloid-Plaques Heute ist sicher belegt, dass sich die amyloiden Plaques aus einer Vielzahl an Abbaufragmenten des Amyloid-Vorläufer-Proteins (amyloid-precursor-protein,
Über die Herkunft von Aβ42 und Amyloid-Plaques Heute ist sicher belegt, dass sich die amyloiden Plaques aus einer Vielzahl an Abbaufragmenten des Amyloid-Vorläufer-Proteins (amyloid-precursor-protein,
Welche Lagen können zwei Geraden (im Raum) zueinander haben? Welche Lagen kann eine Gerade bezüglich einer Ebene im Raum einnehmen?
 Welche Lagen können zwei Geraden (im Raum) zueinander haben? Welche Lagen können zwei Ebenen (im Raum) zueinander haben? Welche Lagen kann eine Gerade bezüglich einer Ebene im Raum einnehmen? Wie heiÿt
Welche Lagen können zwei Geraden (im Raum) zueinander haben? Welche Lagen können zwei Ebenen (im Raum) zueinander haben? Welche Lagen kann eine Gerade bezüglich einer Ebene im Raum einnehmen? Wie heiÿt
Grundwissen Chemie - 9. Jahrgangsstufe
 1. Betrachtungsebenen: Stoffebene Teilchenebene Charakteristisch für die Denkweise der Chemie sind zwei Betrachtungsebenen Stoffportion: Reinstoff: Beobachtungen an Stoffportionen und Reaktionen (Fakten,
1. Betrachtungsebenen: Stoffebene Teilchenebene Charakteristisch für die Denkweise der Chemie sind zwei Betrachtungsebenen Stoffportion: Reinstoff: Beobachtungen an Stoffportionen und Reaktionen (Fakten,
Chemie Zusammenfassung KA 2
 Chemie Zusammenfassung KA 2 Wärmemenge Q bei einer Reaktion Chemische Reaktionen haben eine Gemeinsamkeit: Bei der Reaktion wird entweder Energie/Wärme frei (exotherm). Oder es wird Wärme/Energie aufgenommen
Chemie Zusammenfassung KA 2 Wärmemenge Q bei einer Reaktion Chemische Reaktionen haben eine Gemeinsamkeit: Bei der Reaktion wird entweder Energie/Wärme frei (exotherm). Oder es wird Wärme/Energie aufgenommen
Die Übereckperspektive mit zwei Fluchtpunkten
 Perspektive Perspektive mit zwei Fluchtpunkten (S. 1 von 8) / www.kunstbrowser.de Die Übereckperspektive mit zwei Fluchtpunkten Bei dieser Perspektivart wird der rechtwinklige Körper so auf die Grundebene
Perspektive Perspektive mit zwei Fluchtpunkten (S. 1 von 8) / www.kunstbrowser.de Die Übereckperspektive mit zwei Fluchtpunkten Bei dieser Perspektivart wird der rechtwinklige Körper so auf die Grundebene
e LEARNING Kurz-Anleitung zum Erstellen eines Wikis 1. Wiki erstellen
 Kurz-Anleitung zum Erstellen eines Wikis Die Aktivität Wiki verschafft Ihnen die Möglichkeit, Wissen zu sammeln und zu strukturieren. Dabei können Sie die Teilnehmer Ihres Kurses an der Erstellung des
Kurz-Anleitung zum Erstellen eines Wikis Die Aktivität Wiki verschafft Ihnen die Möglichkeit, Wissen zu sammeln und zu strukturieren. Dabei können Sie die Teilnehmer Ihres Kurses an der Erstellung des
1.4 Die elektrophile aromatische Substitution
 1.4 Die elektrophile aromatische Substitution Versuch: Bromierung von Toluol mit Eisen V In einem RG werden 2ml Toluol mit 0,5 g Eisenspänen gemischt. Hierzu werden 5 Tropfen Brom gegeben B Es bildet sich
1.4 Die elektrophile aromatische Substitution Versuch: Bromierung von Toluol mit Eisen V In einem RG werden 2ml Toluol mit 0,5 g Eisenspänen gemischt. Hierzu werden 5 Tropfen Brom gegeben B Es bildet sich
3.2 Spiegelungen an zwei Spiegeln
 3 Die Theorie des Spiegelbuches 45 sehen, wenn die Person uns direkt gegenüber steht. Denn dann hat sie eine Drehung um die senkrechte Achse gemacht und dabei links und rechts vertauscht. 3.2 Spiegelungen
3 Die Theorie des Spiegelbuches 45 sehen, wenn die Person uns direkt gegenüber steht. Denn dann hat sie eine Drehung um die senkrechte Achse gemacht und dabei links und rechts vertauscht. 3.2 Spiegelungen
Ringvorlesung Bio(an)organische Chemie. Kofaktoren und Vitamine Die Moleküle des Lebens. Armin Geyer. Fachbereich Chemie Philipps-Universität
 Ringvorlesung Bio(an)organische Chemie Kofaktoren und Vitamine Die Moleküle des Lebens Armin Geyer Fachbereich Chemie Philipps-Universität 15. Apr. 2005 Inhalt Definition und Übersicht Antioxidantien:
Ringvorlesung Bio(an)organische Chemie Kofaktoren und Vitamine Die Moleküle des Lebens Armin Geyer Fachbereich Chemie Philipps-Universität 15. Apr. 2005 Inhalt Definition und Übersicht Antioxidantien:
Aufgabe 2: (Aminosäuren)
 Aufgabe 2: (Aminosäuren) Aufgabenstellung Die 20 Aminosäuren (voller Name, 1- und 3-Buchstaben-Code) sollen identifiziert und mit RasMol grafisch dargestellt werden. Dann sollen die AS sinnvoll nach ihren
Aufgabe 2: (Aminosäuren) Aufgabenstellung Die 20 Aminosäuren (voller Name, 1- und 3-Buchstaben-Code) sollen identifiziert und mit RasMol grafisch dargestellt werden. Dann sollen die AS sinnvoll nach ihren
Grundkurs (ch-2): Die Welt ist bunt Chemie am Menschen
 SCHULINTERNES CURRICULUM Chemie SEK II Grundkurs (ch-1): Von Atomen zu Makromolekülen Chemie im Menschen 1. Wiederholung der Stoffgruppen Alkanole, Alkanale, Alkansäuren und Ester 2. Polysaccharide Monosaccharide
SCHULINTERNES CURRICULUM Chemie SEK II Grundkurs (ch-1): Von Atomen zu Makromolekülen Chemie im Menschen 1. Wiederholung der Stoffgruppen Alkanole, Alkanale, Alkansäuren und Ester 2. Polysaccharide Monosaccharide
mentor Grundwissen Chemie. 5. bis 10. Klasse Usedom
 mentor Grundwissen mentor Grundwissen Chemie. 5. bis 10. Klasse Alle wichtigen Themen von Andreas Usedom 1. Auflage mentor Grundwissen Chemie. 5. bis 10. Klasse Usedom schnell und portofrei erhältlich
mentor Grundwissen mentor Grundwissen Chemie. 5. bis 10. Klasse Alle wichtigen Themen von Andreas Usedom 1. Auflage mentor Grundwissen Chemie. 5. bis 10. Klasse Usedom schnell und portofrei erhältlich
Säure-Base Titrationen. (Seminar zu den Übungen zur quantitativen Bestimmung von Arznei-, Hilfs- und Schadstoffen)
 Säure-Base Titrationen (Seminar zu den Übungen zur quantitativen Bestimmung von Arznei-, Hilfs- und Schadstoffen) 1. Gehaltsbestimmung von Salzsäure HCl ist eine starke Säure (fast zu 100% dissoziiert)
Säure-Base Titrationen (Seminar zu den Übungen zur quantitativen Bestimmung von Arznei-, Hilfs- und Schadstoffen) 1. Gehaltsbestimmung von Salzsäure HCl ist eine starke Säure (fast zu 100% dissoziiert)
Farbigkeit und Theorien
 Farbigkeit und Theorien Farbigkeit von Dinah Shafry Licht ist elektromagnetische Strahlung, bei der jede Farbe eine einzelne Wellenlänge besitzt, die als unterschiedliche Farben vom Menschen wahrgenommen
Farbigkeit und Theorien Farbigkeit von Dinah Shafry Licht ist elektromagnetische Strahlung, bei der jede Farbe eine einzelne Wellenlänge besitzt, die als unterschiedliche Farben vom Menschen wahrgenommen
Element. Reinstoff. Verbindung. Atom. Salze. Verhältnisformel. Molekül. Molekülformelformel. heterogenes Gemisch.
 Reinstoff heterogenes Gemisch homogenes Gemisch Reinstoffe haben bei gleichen Bedingungen (Temperatur, Druck) bestimmte qualitative und quantitative Eigenschaften (z.b. Farbe, Geruch, Geschmack, Aggregatzustand,
Reinstoff heterogenes Gemisch homogenes Gemisch Reinstoffe haben bei gleichen Bedingungen (Temperatur, Druck) bestimmte qualitative und quantitative Eigenschaften (z.b. Farbe, Geruch, Geschmack, Aggregatzustand,
1 Mathematische Grundlagen
 Mathematische Grundlagen - 1-1 Mathematische Grundlagen Der Begriff der Menge ist einer der grundlegenden Begriffe in der Mathematik. Mengen dienen dazu, Dinge oder Objekte zu einer Einheit zusammenzufassen.
Mathematische Grundlagen - 1-1 Mathematische Grundlagen Der Begriff der Menge ist einer der grundlegenden Begriffe in der Mathematik. Mengen dienen dazu, Dinge oder Objekte zu einer Einheit zusammenzufassen.
Grundlagen der Elektronik
 Grundlagen der Elektronik Wiederholung: Elektrische Größen Die elektrische Stromstärke I in A gibt an,... wie viele Elektronen sich pro Sekunde durch den Querschnitt eines Leiters bewegen. Die elektrische
Grundlagen der Elektronik Wiederholung: Elektrische Größen Die elektrische Stromstärke I in A gibt an,... wie viele Elektronen sich pro Sekunde durch den Querschnitt eines Leiters bewegen. Die elektrische
Polarisation des Lichts
 PeP Vom Kerzenlicht zum Laser Versuchsanleitung Versuch 4: Polarisation des Lichts Polarisation des Lichts Themenkomplex I: Polarisation und Reflexion Theoretische Grundlagen 1.Polarisation und Reflexion
PeP Vom Kerzenlicht zum Laser Versuchsanleitung Versuch 4: Polarisation des Lichts Polarisation des Lichts Themenkomplex I: Polarisation und Reflexion Theoretische Grundlagen 1.Polarisation und Reflexion
