Nationalkonferenz zu Seltenen Erkrankungen
|
|
|
- Viktoria Wagner
- vor 5 Jahren
- Abrufe
Transkript
1 Berlin 13./14. Oktober 2010 Nationalkonferenz zu Seltenen Erkrankungen Welche Rahmenbedingungen braucht die Forschung der pharmazeutischen Industrie was soll ein Nationalplan verbessern? Dr. Christian Fritsch, Manager New Products, Novartis Pharma GmbH
2 Orphan Drug-Zuerkennungen und Orphan Drug Zulassungen Seite 2
3 Status der Orphan Drug-Zuerkennungen davon bis 09/ 2010 Eingereichte Anträge Positive COMP-Empfehlung Negative COMP-Empfehlung 17 3 Zuerkennung des Orphan Status durch die Kommission Zurückgezogene Zuerkennungsanträge EU-Zulassungen durch die Kommission seit Quelle: EMA-Website, Stand Seite 3
4 Die meisten EU-Orphan Drug Entwicklungssubstanzen befinden sich in klinischer Phase II Phase I 27 am Markt 60 Phase II 83 in Zulassung 20 In klinischer Entwicklung gesamt : 177 Phase III 46 Quelle: Zusammenfassung diverser internet-basierter Daten-Quellen, Stand September 2010 Seite 4
5 Orphan Drug-Zuerkennungen nach Therapiegebieten (COMP Empfehlungen) Quelle: Orphan medicines in numbers, The success of ten years of orphan legislation, EMA/279601/2010 Seite 5
6 Gegenwärtige Orphan Drug Entwicklungen betreffen hauptsächlich onkologische Indikationen (44%) Oncology Hereditary Nervous System Anti-Infectious Immunology Respiratory Other Metabolism Ophtalmology Cardiovascular Musculoskeletal Summe: 197 Indikationen inkl. der Mehrfachentwicklungen in den selben Indikationen No. of development projects with orphan designation Quelle: Zusammenfassung diverser internet-basierter Daten-Quellen, Stand September 2010 Seite 6
7 Zulassungen für Medikamente gegen seltene Krankheiten in der EU Seit 2000 europäische Orphan-Drug-Verordnung in Kraft Quelle: vfa, September 2010 Seite 7
8 Orphan Zulassungen in der EU: 57 Wirkstoffe gegen 67 Erkrankungen Muskel-/Skeletterkrankungen und Nervensystem 10.4 % Herz- Kreislauf 7.5 % Immunologie 4.5 % Antiinfektiva 1,5 % Seltene Krebserkrankungen 45 % Sonstige 11.9 % Quelle: vfa, Stand September 2010 Stoffwechse l 19 % Seite 8
9 Wer entwickelt Orphan Drugs und bringt sie zur Zulassung? Big Biotech Quelle: Diplomarbeit C. Haufe Der EU-Rahmen zur Forderung von Orphan Drugs: Kritische Analyse und Ausblick KMU-Definition der EU s. Seite 9
10 F&E von Orphan Drugs Herausforderungen und Lösungsansätze Seite 10
11 Welches Umfeld ist bei der Entwicklung von neuen Medikamenten zu beachten? Vorhandenes medizinisches Umfeld Forschung Klinische Studien Zulassung und Markteintritt Bedarf nach (neuen) Therapien Wissenschaftliche Hürden Strukturelle Gegebenheiten Translation Patienten Ärzteschaft (Prüfer) Behörden & Regularien Gesundheitswesen Politik Behörden & Regularien => Besonderheiten bei den Seltenen Erkrankungen (SE) Ärzteschaft (behandelnde Ärzte) Seite 11
12 Bisher bei den Orphan Drugs Erreichtes Orphan Drug-Verordnung seit 2000 Etablierung des Orphan-Status (EMA / FDA) und einheitliches Antragsformular von EMA und FDA Harmonisierung der Verpflichtungen nach Zuerkennung: einheitlicher jährlicher Fortschrittsbericht bei EMA und FDA möglich EMA-Leitlinie für Studien mit kleinen Patientenpopulationen Beschleunigtes Zulassungsverfahren Datenbank Orphanet europäisches Informationssystem für SE Viele Patientenorganisationen Erkenntnisse aus der Genomforschung Einige weltweite Patientenregister Steigende Zahlen: Firmen mit Orphan Drug-Aktivitäten und Orphan Drug-Projekte Seite 12
13 Medizinisches Umfeld Herausforderungen Sehr kleine Patientenzahlen (vage Epidemiologie) Wenige Patienten und Experten sind geographisch weit verteilt Kaum Gemeinsamkeiten zwischen den SE (Heterogenität) Häufig keine etablierte interdisziplinäre Zusammenarbeit Häufig noch keine gesicherten Indikatoren für Therapieerfolg Datenbanken, Register und Materialbanken sind oft klein, lokal und nicht allgemein zugänglich oder standardisiert Nur 250 von ca SE haben bisher einen ICD-10-Code Seite 13
14 Medizinisches Umfeld Lösungsansätze Förderung der Ausbildung von Experten Spezielle Förderung von nationalen und internationalen Netzwerken sowie der interdiziplinären Zusammenarbeit Deutliche Erhöhung der ICD-10-Codierungen, um SE innerhalb des Gesundheitssystems verfolgbar, auswertbar und bewertbar zu machen Seite 14
15 Forschung Herausforderungen Häufiges Fehlen geeigneter Biomarker und Zellkultur-Systeme Diagnostische Möglichkeiten unzureichend erforscht Häufig fehlende Grundlagenforschung bei genetisch bedingten SE Targets (Angriffspunkte) häufig unzureichend erforscht Häufig keine gesicherten Indikatoren für Behandlungserfolg Häufig niedrige Priorität der SE in Forschungseinrichtungen Schwierigkeit der Translation von Grundlagenforschung in die klinische Entwicklung (Ressourcen, Know-how, Partnering) Seite 15
16 Forschung Lösungsansätze Erforschung neuer diagnostischer Möglichkeiten Förderung der Grundlagenforschung in Universitäten & kleineren Unternehmen Erforschung von Indikatoren, auch wenn noch keine Therapie vorhanden ist Höherstufung der Priorität für SE in Forschungseinrichtungen Kontaktbörsen für Translation Seite 16
17 Klinische Studien Herausforderungen Rekrutierung für klinische Studien schwierig/langwierig Schlecht definierte klinische Endpunkte Vorbehalte bei Studien mit Kindern Bei Studien, die eine Untersuchung mit radioaktiven Stoffen oder ionisierender Strahlung (einschließlich Röntgenstrahlen) erforderlich machen, kann die Zeit bis zum Erhalt der Genehmigung durch das Bundesamt für Strahlenschutz (BfS) bis zu 9 Monate betragen. Seite 17
18 Klinische Studien Lösungsansätze Verbesserung der Rekrutierung durch virtuelle Netzwerke Aufklärung über die Vorteile einer Teilnahme an klinischen Prüfungen auch behördlicherseits (z.b. über Bundeszentrale für gesundheitliche Aufklärung) Verkürzung und Vereinfachung des Strahlenschutz- Genehmigungsverfahrens (Umsetzung in der gegenwärtig laufenden Novellierung der Röntgenverordnung und Strahlenschutzverordnung) Seite 18
19 Eckpunkte für einen deutschen nationalen Aktionsplan für seltene Krankheiten 1 Etablierung eines deutschen Expertenkomitees für seltene Krankheiten 2 Deutsche Exzellenzzentren für seltene Krankheiten als Bestandteil europäischer Netzwerke 3 Verbesserung von Diagnose-Programmen und Erhöhung des Bewusstseins für seltene Krankheiten 4 Adäquate Codierung seltener Krankheiten 5 Schneller und unbürokratischer Zugang zu Orphan Drugs Seite 19
Rahmenbedingungen und Herausforderungen bei der Entwicklung von Orphan Drugs
 Rahmenbedingungen und Herausforderungen bei der Entwicklung von Orphan Drugs Dr. Siegfried Throm, Geschäftsführer Forschung/Entwicklung/Innovation Rahmenbedingungen/Herausforderungen bei der Entwicklung
Rahmenbedingungen und Herausforderungen bei der Entwicklung von Orphan Drugs Dr. Siegfried Throm, Geschäftsführer Forschung/Entwicklung/Innovation Rahmenbedingungen/Herausforderungen bei der Entwicklung
Mitteilung der Europäischen Kommission «Seltene Erkrankungen eine Herausforderung für Europa» und Empfehlungen des Rates für eine Maßnahme im Bereich
 Mitteilung der Europäischen Kommission «Seltene Erkrankungen eine Herausforderung für Europa» und Empfehlungen des Rates für eine Maßnahme im Bereich Seltener Krankheiten Pläne und Strategien für Europa
Mitteilung der Europäischen Kommission «Seltene Erkrankungen eine Herausforderung für Europa» und Empfehlungen des Rates für eine Maßnahme im Bereich Seltener Krankheiten Pläne und Strategien für Europa
Kinder mit seltenen Erkrankungen in klinischen Prüfungen-was gibt es aus ärztlicher Sicht zu beachten
 Kinder mit seltenen Erkrankungen in klinischen Prüfungen-was gibt es aus ärztlicher Sicht zu beachten Dr. med. Christina Lampe Zentrum für seltene Erkrankungen Helios Horst Schmidt Kliniken, (HSK) Wiesbaden,
Kinder mit seltenen Erkrankungen in klinischen Prüfungen-was gibt es aus ärztlicher Sicht zu beachten Dr. med. Christina Lampe Zentrum für seltene Erkrankungen Helios Horst Schmidt Kliniken, (HSK) Wiesbaden,
Inwiefern sind Menschen mit Seltenen Erkrankungen nicht bedarfsgerecht versorgt?
 Inwiefern sind Menschen mit Seltenen Erkrankungen nicht bedarfsgerecht versorgt? Parlamentarische Begegnung der ACHSE 29. September 2010 Birgit Dembski Mukoviszidose e.v. Seltene Erkrankungen EU: Prävalenz:
Inwiefern sind Menschen mit Seltenen Erkrankungen nicht bedarfsgerecht versorgt? Parlamentarische Begegnung der ACHSE 29. September 2010 Birgit Dembski Mukoviszidose e.v. Seltene Erkrankungen EU: Prävalenz:
Indikatoren EUROPLAN und Monitoringempfehlungen
 Indikatoren EUROPLAN und Monitoringempfehlungen Workshop Monitoring / Erfolgsindikatoren Nationale Konferenz für Seltene Erkrankungen Daniela Eidt-Koch Martin Frank Berlin, 13. und 14. Oktober 2010 Wie
Indikatoren EUROPLAN und Monitoringempfehlungen Workshop Monitoring / Erfolgsindikatoren Nationale Konferenz für Seltene Erkrankungen Daniela Eidt-Koch Martin Frank Berlin, 13. und 14. Oktober 2010 Wie
Novellierung der Strahlenschutz- und Röntgenverordnung
 1 Novellierung der Strahlenschutz- und Röntgenverordnung Klinische Studienzentrale (CSC) Antje Wiede Neuregelung: Genehmigungsbedürftigkeit radiologischer Untersuchungen bei palliativen medikamentösen
1 Novellierung der Strahlenschutz- und Röntgenverordnung Klinische Studienzentrale (CSC) Antje Wiede Neuregelung: Genehmigungsbedürftigkeit radiologischer Untersuchungen bei palliativen medikamentösen
SMA-TREFFEN IM HOTEL AM SEE HAUS RHEINSBERG
 CAMPUS INNENSTADT SMA-TREFFEN IM HOTEL AM SEE HAUS RHEINSBERG 14.-17.05.2015 Patientenregister SMA-PATIENTENREGISTER: DIE IDEE Start des EU Netzwerks TREAT-NMD am 01.01.2007 Ende der Förderphase am 31.12.2011
CAMPUS INNENSTADT SMA-TREFFEN IM HOTEL AM SEE HAUS RHEINSBERG 14.-17.05.2015 Patientenregister SMA-PATIENTENREGISTER: DIE IDEE Start des EU Netzwerks TREAT-NMD am 01.01.2007 Ende der Förderphase am 31.12.2011
Merkblatt zum medizinischwissenschaftlichen. diagnostischer Anträge (Formblatt D-BD bzw. D-AD) gemäß 23 StrlSchV bzw. 28a RöV
 1 von 5 Vorbemerkung: Im Folgenden werden zwecks besserer Lesbarkeit alle Anwendungen von ionisierender Strahlung (einschließlich Röntgenstrahlung) und radioaktiven Stoffen unter dem Begriff Strahlenanwendungen
1 von 5 Vorbemerkung: Im Folgenden werden zwecks besserer Lesbarkeit alle Anwendungen von ionisierender Strahlung (einschließlich Röntgenstrahlung) und radioaktiven Stoffen unter dem Begriff Strahlenanwendungen
vfa-positionspapier Orphan Drugs ZUSAMMENFASSUNG
 vfa-positionspapier Orphan Drugs ZUSAMMENFASSUNG Die forschenden Pharma-Unternehmen haben den Patienten und dessen Krankheit in den Mittelpunkt ihrer Aktivitäten gestellt. Das gilt nicht nur für die weit
vfa-positionspapier Orphan Drugs ZUSAMMENFASSUNG Die forschenden Pharma-Unternehmen haben den Patienten und dessen Krankheit in den Mittelpunkt ihrer Aktivitäten gestellt. Das gilt nicht nur für die weit
Als Krebspatient an einer Studie teilnehmen was sollte man wissen?
 Als Krebspatient an einer Studie teilnehmen was sollte man wissen? Krebsinformationsdienst, Heidelberg Dr. Susanne Weg-Remers Seite 2 Grundlage für evidenzbasiertes medizinisches Wissen sind klinische
Als Krebspatient an einer Studie teilnehmen was sollte man wissen? Krebsinformationsdienst, Heidelberg Dr. Susanne Weg-Remers Seite 2 Grundlage für evidenzbasiertes medizinisches Wissen sind klinische
Behandlungs- und Forschungs- Zentrum für Seltene Erkrankungen Tübingen
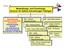 Behandlungs- und Forschungs- Zentrum für Seltene Erkrankungen Tübingen Patientenportal Zentrale und und dezentrale Koordination Patientenregister Biobank Informationsportal Öffentlichkeitsarbeit Koordination
Behandlungs- und Forschungs- Zentrum für Seltene Erkrankungen Tübingen Patientenportal Zentrale und und dezentrale Koordination Patientenregister Biobank Informationsportal Öffentlichkeitsarbeit Koordination
Neugründung ZSE Ulm: Weiterer Ausbau von patientenspezifischen Netzwerken ist dringend notwendig
 Presseinformation (Bildmaterial ab S. 6) Seite 1 von 6 Erforschung seltener Krankheiten Neugründung ZSE Ulm: Weiterer Ausbau von patientenspezifischen Netzwerken ist dringend notwendig Selbsthilfeorganisationen
Presseinformation (Bildmaterial ab S. 6) Seite 1 von 6 Erforschung seltener Krankheiten Neugründung ZSE Ulm: Weiterer Ausbau von patientenspezifischen Netzwerken ist dringend notwendig Selbsthilfeorganisationen
VFA Bio Für eine starke Biotechnologie in Deutschland
 Für eine starke Biotechnologie in Deutschland VFA Bio vertritt die Biotechnologie im Verband Forschender Arzneimittelhersteller e.v. (VFA), der sich für die Belange seiner 45 weltweit führenden Hersteller
Für eine starke Biotechnologie in Deutschland VFA Bio vertritt die Biotechnologie im Verband Forschender Arzneimittelhersteller e.v. (VFA), der sich für die Belange seiner 45 weltweit führenden Hersteller
Versorgungsforschung Erfahrung mit Netzwerken in Österreich. Dr. Christian Baumgartner
 Versorgungsforschung Erfahrung mit Netzwerken in Österreich Dr. Christian Baumgartner Fahrplan Definition Traumstudie Realität Herausforderungen Praxiserfahrung Regulatorisches Lösungsansätze - Zukunftsperspektiven
Versorgungsforschung Erfahrung mit Netzwerken in Österreich Dr. Christian Baumgartner Fahrplan Definition Traumstudie Realität Herausforderungen Praxiserfahrung Regulatorisches Lösungsansätze - Zukunftsperspektiven
NAP.se Österreich. Der nationale Aktionsplan für Seltene Erkrankungen Wunsch oder Wirklichkeit? Careum Congress und 18.
 NAP.se Österreich Der nationale Aktionsplan für Seltene Erkrankungen Wunsch oder Wirklichkeit? Careum Congress 2014 17. und 18. März 2014, Basel Rückblick 2008: Petition mit 9 Forderungen ans BMG 2009
NAP.se Österreich Der nationale Aktionsplan für Seltene Erkrankungen Wunsch oder Wirklichkeit? Careum Congress 2014 17. und 18. März 2014, Basel Rückblick 2008: Petition mit 9 Forderungen ans BMG 2009
Orphan Drugs. Arzneimitteltherapie seltener Krankheiten
 Orphan Drugs Arzneimitteltherapie seltener Krankheiten Seltene Krankheiten 30 Millionen Europäer, davon etwa 4 Millionen Deutsche, leiden an seltenen Krankheiten. Als selten gilt hier eine Krankheit, wenn
Orphan Drugs Arzneimitteltherapie seltener Krankheiten Seltene Krankheiten 30 Millionen Europäer, davon etwa 4 Millionen Deutsche, leiden an seltenen Krankheiten. Als selten gilt hier eine Krankheit, wenn
Nationales Konzept Seltene Krankheiten: Stand der Arbeiten
 Nationales Konzept Seltene Krankheiten: Stand der Arbeiten Stakeholder-Informationsanlass Bern, 23. Mai 2017 Thomas Christen, Bundesamt für Gesundheit Vizedirektor, Leiter Direktionsbereich Kranken-und
Nationales Konzept Seltene Krankheiten: Stand der Arbeiten Stakeholder-Informationsanlass Bern, 23. Mai 2017 Thomas Christen, Bundesamt für Gesundheit Vizedirektor, Leiter Direktionsbereich Kranken-und
Gesetzliche Grundlagen der Arzneimittelentwicklung national/ international
 Gesetzliche Grundlagen der Arzneimittelentwicklung national/ international Dr. med. Dirk Mentzer Referatsleiter Arzneimittelsicherheit Facharzt für Kinder- und Jugendmedizin Paul-Ehrlich-Institut Bundesinstitut
Gesetzliche Grundlagen der Arzneimittelentwicklung national/ international Dr. med. Dirk Mentzer Referatsleiter Arzneimittelsicherheit Facharzt für Kinder- und Jugendmedizin Paul-Ehrlich-Institut Bundesinstitut
Patiententreffen lysosuisse/ Fabrysuisse
 Perspektiven der neuen Strategie zur Verbesserung der gesundheitlichen Situation von Menschen mit seltenen Erkrankungen Patiententreffen lysosuisse/ Fabrysuisse 8. September 2012 Sorell Hotel Zürichberg,
Perspektiven der neuen Strategie zur Verbesserung der gesundheitlichen Situation von Menschen mit seltenen Erkrankungen Patiententreffen lysosuisse/ Fabrysuisse 8. September 2012 Sorell Hotel Zürichberg,
BfArM Zukunft gestalten: Erwartungen der Industrie. Dr. Thor Voigt, VfA (Boehringer Ingelheim) 15. September 2015 Bonn Wasserwerk
 BfArM 2025 Zukunft gestalten: Erwartungen der Industrie Dr. Thor Voigt, VfA (Boehringer Ingelheim) 15. September 2015 Bonn Wasserwerk Zulassungsbehörde ist für forschende Firmen wichtiger Standortfaktor
BfArM 2025 Zukunft gestalten: Erwartungen der Industrie Dr. Thor Voigt, VfA (Boehringer Ingelheim) 15. September 2015 Bonn Wasserwerk Zulassungsbehörde ist für forschende Firmen wichtiger Standortfaktor
RCT vs. Real World - Klinische Studien und onkologischer Alltag
 RCT vs. Real World - Klinische Studien und onkologischer Alltag Wolf-Dieter Ludwig Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ); Poliklinik am HELIOS Klinikum Berlin-Buch Viele Fragen können
RCT vs. Real World - Klinische Studien und onkologischer Alltag Wolf-Dieter Ludwig Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ); Poliklinik am HELIOS Klinikum Berlin-Buch Viele Fragen können
Kompetenznetze als Informationssysteme
 Kompetenznetze als Informationssysteme Dr. med. Tim M. Jaeger, Head of Research and Development Services interactive Systems, tim.jaeger@brainmedia.de Daten Information Wissen Wissen entsteht bei der handlungsorientierten
Kompetenznetze als Informationssysteme Dr. med. Tim M. Jaeger, Head of Research and Development Services interactive Systems, tim.jaeger@brainmedia.de Daten Information Wissen Wissen entsteht bei der handlungsorientierten
Forderungen der DGHO unter Berücksichtigung der Rolle von Ethik-Kommissionen und des Bundesamts für Strahlenschutz (BfS) bei Klinischen Studien
 Berlin, 17.6.2014: Pressekonferenz: Die neue EU-Verordnung zu klinischen Studien eine Chance für den Forschungsstandort Deutschland Forderungen der DGHO unter Berücksichtigung der Rolle von Ethik-Kommissionen
Berlin, 17.6.2014: Pressekonferenz: Die neue EU-Verordnung zu klinischen Studien eine Chance für den Forschungsstandort Deutschland Forderungen der DGHO unter Berücksichtigung der Rolle von Ethik-Kommissionen
Market Access. PharmaPraxis 2017 Von Praktikern für Praktiker
 PharmaPraxis 2017 Von Praktikern für Praktiker Market Access 2017 Das praxisnahe Seminar von Dr. Sven Seitz, Pfizer AG Lorenz Borer, Novartis Pharma Schweiz AG Cornelia Gnädinger, Novartis Pharma Schweiz
PharmaPraxis 2017 Von Praktikern für Praktiker Market Access 2017 Das praxisnahe Seminar von Dr. Sven Seitz, Pfizer AG Lorenz Borer, Novartis Pharma Schweiz AG Cornelia Gnädinger, Novartis Pharma Schweiz
Der Zugang zu Informationen ist ein fundamentales Recht, unabhängig davon, ob die Krankheit häufig oder selten ist. EURORDIS Leitlinien
 Der Zugang zu Informationen ist ein fundamentales Recht, unabhängig davon, ob die Krankheit häufig oder selten ist. EURORDIS Leitlinien Wo steht Deutschland? die BMG Studie Maßnahmen zur Verbesserung der
Der Zugang zu Informationen ist ein fundamentales Recht, unabhängig davon, ob die Krankheit häufig oder selten ist. EURORDIS Leitlinien Wo steht Deutschland? die BMG Studie Maßnahmen zur Verbesserung der
AMNOG-Fachtagung des G-BA Besondere Therapiesituationen Bedingte Zulassung, Kinderarzneimittel und Orphan Drugs
 AMNOG-Fachtagung des G-BA Besondere Therapiesituationen Bedingte Zulassung, Kinderarzneimittel und Orphan Drugs Martin Völkl, Director Market Access & Public Affairs, Celgene GmbH Warum forschen Pharmaunternehmen?
AMNOG-Fachtagung des G-BA Besondere Therapiesituationen Bedingte Zulassung, Kinderarzneimittel und Orphan Drugs Martin Völkl, Director Market Access & Public Affairs, Celgene GmbH Warum forschen Pharmaunternehmen?
Verbändeanhörung zum Entwurf eines Gesetzes zur Neuordnung des Rechts zum Schutz vor der schädlichen Wirkung ionisierender Strahlung
 Verbändeanhörung zum Entwurf eines Gesetzes zur Neuordnung des Rechts zum Schutz vor der schädlichen Wirkung ionisierender Strahlung Verband: BIO Deutschland e. V. Ansprechpartner: Cay F. Horstmann Adresse:
Verbändeanhörung zum Entwurf eines Gesetzes zur Neuordnung des Rechts zum Schutz vor der schädlichen Wirkung ionisierender Strahlung Verband: BIO Deutschland e. V. Ansprechpartner: Cay F. Horstmann Adresse:
Zentrales Informationsportal über seltene Erkrankungen (ZIPSE)
 Zentrales Informationsportal über seltene Erkrankungen (ZIPSE) Ärztliche Informationsbedarfe bei der Versorgung von Menschen mit seltenen Erkrankungen So selten und doch so zahlreich V. Lührs 1, T. Neugebauer
Zentrales Informationsportal über seltene Erkrankungen (ZIPSE) Ärztliche Informationsbedarfe bei der Versorgung von Menschen mit seltenen Erkrankungen So selten und doch so zahlreich V. Lührs 1, T. Neugebauer
Kooperationsprojekt zwischen dem European LeukemiaNet und der Novartis AG seit einem Jahr erfolgreich
 Kooperationsprojekt zwischen dem European LeukemiaNet und der Novartis AG seit einem Jahr erfolgrei Kooperationsprojekt zwischen dem European LeukemiaNet und der Novartis AG seit einem Jahr erfolgreich
Kooperationsprojekt zwischen dem European LeukemiaNet und der Novartis AG seit einem Jahr erfolgrei Kooperationsprojekt zwischen dem European LeukemiaNet und der Novartis AG seit einem Jahr erfolgreich
TVT-Therapie. Bayer HealthCare: Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Präventio
 Bayer HealthCare: Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Präventio Bayer HealthCare Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Prävention
Bayer HealthCare: Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Präventio Bayer HealthCare Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Prävention
Aktualisierung der Fachkunde / Kenntnisse im Strahlenschutz
 Aktualisierung der Fachkunde / Kenntnisse im Strahlenschutz Rechtfertigende Indikation 23 der Röntgenverordnung (RöV) REFERENT: Matthias Schneider THEMA: Aktualisierung Fachkunde / Kenntnisse im Strahlenschutz
Aktualisierung der Fachkunde / Kenntnisse im Strahlenschutz Rechtfertigende Indikation 23 der Röntgenverordnung (RöV) REFERENT: Matthias Schneider THEMA: Aktualisierung Fachkunde / Kenntnisse im Strahlenschutz
Wie kann die Lebensqualität bei der Entwicklung von Arzneimitteln besser berücksichtigt werden?
 vfa/vfabio/achse Veranstaltung Stellenwert der Lebensqualität bei Arzneimitteln ein 360 -Blick Wie kann die Lebensqualität bei der Entwicklung von Arzneimitteln besser berücksichtigt werden? Berlin, 02.
vfa/vfabio/achse Veranstaltung Stellenwert der Lebensqualität bei Arzneimitteln ein 360 -Blick Wie kann die Lebensqualität bei der Entwicklung von Arzneimitteln besser berücksichtigt werden? Berlin, 02.
Zusammenarbeit von Zentren und Netzwerken in der Onkologie
 Zusammenarbeit von Zentren und Netzwerken in der Onkologie Was sind zertifizierte Zentren? Definition: Ein Netz von qualifizierten und gemeinsam zertifizierten, interdisziplinären und transsektoralen [
Zusammenarbeit von Zentren und Netzwerken in der Onkologie Was sind zertifizierte Zentren? Definition: Ein Netz von qualifizierten und gemeinsam zertifizierten, interdisziplinären und transsektoralen [
Für die medizinische Forschung relevante Neuerungen im Strahlenschutzrecht
 Für die medizinische Forschung relevante Neuerungen im Strahlenschutzrecht 36. Jahrestagung des Arbeitskreises Medizinischer Ethik-Kommissionen in der Bundesrepublik Deutschland e.v. Berlin, 8. November
Für die medizinische Forschung relevante Neuerungen im Strahlenschutzrecht 36. Jahrestagung des Arbeitskreises Medizinischer Ethik-Kommissionen in der Bundesrepublik Deutschland e.v. Berlin, 8. November
6. Int. Tag der Seltenen Krankheiten Den ersten Schritt wagen Public Private Partnership bei der Entwicklung transformativer Therapien
 6. Int. Tag der Seltenen Krankheiten Den ersten Schritt wagen Public Private Partnership bei der Entwicklung transformativer Therapien Reto Kessler, PhD Country Manager, Vertex Pharmaceuticals (CH) GmbH
6. Int. Tag der Seltenen Krankheiten Den ersten Schritt wagen Public Private Partnership bei der Entwicklung transformativer Therapien Reto Kessler, PhD Country Manager, Vertex Pharmaceuticals (CH) GmbH
Ethische Aspekte der Forschung in der Onkologie
 Medizin-Ethik 19 Ethische Aspekte der Forschung in der Onkologie von Georg Marckmann, Johannes Meran 1. Auflage Ethische Aspekte der Forschung in der Onkologie Marckmann / Meran schnell und portofrei erhältlich
Medizin-Ethik 19 Ethische Aspekte der Forschung in der Onkologie von Georg Marckmann, Johannes Meran 1. Auflage Ethische Aspekte der Forschung in der Onkologie Marckmann / Meran schnell und portofrei erhältlich
IST DER ZUGANG VON INNOVATIONEN ZUM GESUNDHEITSWESEN ZU LANGSAM UND ZU BÜROKRATISCH?
 IST DER ZUGANG VON INNOVATIONEN ZUM GESUNDHEITSWESEN ZU LANGSAM UND ZU BÜROKRATISCH? Dr. Michael Lauk Vorstand Bereich ehealth bwcon e.v. CHANCEN UND HÜRDEN DER WEG ZU EINER NEUEN DIAGNOSTIK ODER THERAPIE
IST DER ZUGANG VON INNOVATIONEN ZUM GESUNDHEITSWESEN ZU LANGSAM UND ZU BÜROKRATISCH? Dr. Michael Lauk Vorstand Bereich ehealth bwcon e.v. CHANCEN UND HÜRDEN DER WEG ZU EINER NEUEN DIAGNOSTIK ODER THERAPIE
ONKOLEIT. Ein medizinisches Expertensystem zum Therapiemonitoring von Krebserkrankungen. ITG-Workshop Usability,
 ONKOLEIT Ein medizinisches Expertensystem zum Therapiemonitoring von Krebserkrankungen ITG-Workshop Usability, 03.06.2016 Dr.-Ing. Yvonne Fischer yvonne.fischer@iosb.fraunhofer.de +49 (0)721 6091-571 Prof.
ONKOLEIT Ein medizinisches Expertensystem zum Therapiemonitoring von Krebserkrankungen ITG-Workshop Usability, 03.06.2016 Dr.-Ing. Yvonne Fischer yvonne.fischer@iosb.fraunhofer.de +49 (0)721 6091-571 Prof.
Erreichtes und Erreichbares
 Die Patientensicht Erreichtes und Erreichbares Dr. Christine Mundlos Was dem einzelnen nicht möglich ist, das vermögen viele. F.W. Raiffeisen Allianz Chronischer Seltener Erkrankungen Derzeit sind 117
Die Patientensicht Erreichtes und Erreichbares Dr. Christine Mundlos Was dem einzelnen nicht möglich ist, das vermögen viele. F.W. Raiffeisen Allianz Chronischer Seltener Erkrankungen Derzeit sind 117
Off-Label Use in der Rheumatherapie
 Abseits der Wege: Off-Label Use in der Rheumatherapie Statement von Prof. Dr. med. Klaus Krüger Köln (23. September 2009) - Laut deutschem Sozialgesetzbuch ( 70) ist der behandelnde Arzt verpflichtet,
Abseits der Wege: Off-Label Use in der Rheumatherapie Statement von Prof. Dr. med. Klaus Krüger Köln (23. September 2009) - Laut deutschem Sozialgesetzbuch ( 70) ist der behandelnde Arzt verpflichtet,
AMNOG: Wenn Innovation aufs System trifft: Ist das AMNOG System fit für Innovation- Beispiel Onkologie
 AMNOG: Wenn Innovation aufs System trifft: Ist das AMNOG System fit für Innovation- Beispiel Onkologie Dr. Jutta Wendel-Schrief Direktor Market Access MSD SHARP & DOHME GMBH Was sind Innovationen? Neue
AMNOG: Wenn Innovation aufs System trifft: Ist das AMNOG System fit für Innovation- Beispiel Onkologie Dr. Jutta Wendel-Schrief Direktor Market Access MSD SHARP & DOHME GMBH Was sind Innovationen? Neue
Personalisierte Medizin
 Georg Marckmann Institut für Ethik, Geschichte und Theorie der Medizin Personalisierte Medizin ethische Implikationen Neue Aspekte in der Versorgung von Patienten: Personalisierte Medizin Gesundheitskongress
Georg Marckmann Institut für Ethik, Geschichte und Theorie der Medizin Personalisierte Medizin ethische Implikationen Neue Aspekte in der Versorgung von Patienten: Personalisierte Medizin Gesundheitskongress
Zulassungsüberschreitende Anwendung von Arzneimitteln im Rahmen klinischer Studien ( 35c SGB V)
 Zulassungsüberschreitende Anwendung von Arzneimitteln im Rahmen klinischer Studien ( 35c SGB V) Berlin, 22. September 2009 Dr. Regina Skavron Abteilung Arzneimittel, Gemeinsamer Bundesausschuss Zulassungsüberschreitende
Zulassungsüberschreitende Anwendung von Arzneimitteln im Rahmen klinischer Studien ( 35c SGB V) Berlin, 22. September 2009 Dr. Regina Skavron Abteilung Arzneimittel, Gemeinsamer Bundesausschuss Zulassungsüberschreitende
Forschung für bessere Therapie chronischer Schmerzen
 Europain-Netzwerk Forschung für bessere Therapie chronischer Schmerzen München (21. April 2010) - Europain, eine öffentlich-private Partnerschaft, die von der Innovative Medicines Initiative (IMI) gefördert
Europain-Netzwerk Forschung für bessere Therapie chronischer Schmerzen München (21. April 2010) - Europain, eine öffentlich-private Partnerschaft, die von der Innovative Medicines Initiative (IMI) gefördert
Zur Anwendung radioaktiver Stoffe oder ionisierender Strahlen in der medizinischen Forschung Genehmigungsverfahren nach 28a RöV und 23 StrlSchV
 Strahlenschutzkommission Geschäftsstelle der Strahlenschutzkommission Postfach 12 06 29 D-53048 Bonn http://www.ssk.de Zur Anwendung radioaktiver Stoffe oder ionisierender Strahlen in der medizinischen
Strahlenschutzkommission Geschäftsstelle der Strahlenschutzkommission Postfach 12 06 29 D-53048 Bonn http://www.ssk.de Zur Anwendung radioaktiver Stoffe oder ionisierender Strahlen in der medizinischen
Roche in Deutschland Strategie in der Zusammenarbeit mit Forschern und Kliniken Gerd Maass, Leiter Translational Research Office
 Roche in Deutschland Strategie in der Zusammenarbeit mit Forschern und Kliniken Gerd Maass, Leiter Translational Research Office München, 17. Juni 2013 Roche Ansatz zur Pharma Innovation Diversität in
Roche in Deutschland Strategie in der Zusammenarbeit mit Forschern und Kliniken Gerd Maass, Leiter Translational Research Office München, 17. Juni 2013 Roche Ansatz zur Pharma Innovation Diversität in
Pilotprojekt Überregionales Prüfzentrum Rhein-Ruhr in der Pädiatrischen Onkologie
 Pilotprojekt Überregionales Prüfzentrum Rhein-Ruhr in der Pädiatrischen Onkologie Beate Wulff, Katharina Waack-Buchholz, Dirk Reinhardt Klinik für Kinderheilkunde III, Pädiatrische Hämatologie-Onkologie
Pilotprojekt Überregionales Prüfzentrum Rhein-Ruhr in der Pädiatrischen Onkologie Beate Wulff, Katharina Waack-Buchholz, Dirk Reinhardt Klinik für Kinderheilkunde III, Pädiatrische Hämatologie-Onkologie
Off-label-use von Arzneimittel in der Palliativmedizin
 Off-label-use von Arzneimittel in der Palliativmedizin Kurzvorstellung des Dissertationsvorhabens Katrin Seibold April 2008 Ausgangssituation Projekt betacare Schmerz & Palliativ Ziel: Aufbau eines umfassenden,
Off-label-use von Arzneimittel in der Palliativmedizin Kurzvorstellung des Dissertationsvorhabens Katrin Seibold April 2008 Ausgangssituation Projekt betacare Schmerz & Palliativ Ziel: Aufbau eines umfassenden,
Rolle des HMEC bei der Zulassung neuer Arzneimittel in der Schweiz
 Rolle des HMEC bei der Zulassung neuer Arzneimittel in der Schweiz Stephan Krähenbühl Klinische Pharmakologie & Toxikologie Universitätsspital Basel kraehenbuehl@uhbs.ch In der Schweiz registrierte Medikamente
Rolle des HMEC bei der Zulassung neuer Arzneimittel in der Schweiz Stephan Krähenbühl Klinische Pharmakologie & Toxikologie Universitätsspital Basel kraehenbuehl@uhbs.ch In der Schweiz registrierte Medikamente
openmedicine Ein europäischer Ansatz zur ein-eindeutigen Identifizierung medizinischer Produkte in globalen Kontexten
 Meeting the global challenge of unique identification of medicinal products openmedicine Ein europäischer Ansatz zur ein-eindeutigen Identifizierung medizinischer Produkte in globalen Kontexten Jonas Rennoch,
Meeting the global challenge of unique identification of medicinal products openmedicine Ein europäischer Ansatz zur ein-eindeutigen Identifizierung medizinischer Produkte in globalen Kontexten Jonas Rennoch,
Forschungscluster E-Health
 Forschungscluster E-Health Vorschlag zu einem Cluster aus Forschung und Industrie/Gewerbe zur Förderung der E-Health-Forschung & -Entwicklung W. Dorda Institut für Medizinische Informations- und Auswertesysteme
Forschungscluster E-Health Vorschlag zu einem Cluster aus Forschung und Industrie/Gewerbe zur Förderung der E-Health-Forschung & -Entwicklung W. Dorda Institut für Medizinische Informations- und Auswertesysteme
Ein langer Weg: Von der Idee zum Medikament
 Ein langer Weg: Von der Idee zum Medikament 7 Die Entwicklung von Medikamenten ist ein langwieriger und aufwendiger Prozess, der mit enormen Kosten für den Hersteller verbunden ist. Nur ein funktionierender
Ein langer Weg: Von der Idee zum Medikament 7 Die Entwicklung von Medikamenten ist ein langwieriger und aufwendiger Prozess, der mit enormen Kosten für den Hersteller verbunden ist. Nur ein funktionierender
Das Krankheitsspektrum der Zukunft
 Pressekonferenz Das Krankheitsspektrum der Zukunft Expertenumfrage unter 100 führenden deutschen Forschern 10. August 2005 Berlin Das Krankheitsspektrum der Zukunft Herausforderung für die forschende Arzneimittelindustrie
Pressekonferenz Das Krankheitsspektrum der Zukunft Expertenumfrage unter 100 führenden deutschen Forschern 10. August 2005 Berlin Das Krankheitsspektrum der Zukunft Herausforderung für die forschende Arzneimittelindustrie
UNSER ANTRIEB: KREBS HEILEN
 UNSER ANTRIEB: KREBS HEILEN Unser Antrieb Bild: Gefärbte rasterelektronenmikroskopische Aufnahme (REM) einer Prostatakrebszelle. Wir sind Takeda Oncology, der Spezialbereich für Krebserkrankungen des Pharmaunternehmens
UNSER ANTRIEB: KREBS HEILEN Unser Antrieb Bild: Gefärbte rasterelektronenmikroskopische Aufnahme (REM) einer Prostatakrebszelle. Wir sind Takeda Oncology, der Spezialbereich für Krebserkrankungen des Pharmaunternehmens
Therapeutische Indikationen. Anwendungsfälle in europäischen Bereichen
 Therapeutische Indikationen Anwendungsfälle in europäischen Bereichen Dr. med. Hans-Peter Dauben Mannheim, 09.Sep 2010 Inhalt Therapeutische Indikationen - die medizinische und die autorisierte Indikation
Therapeutische Indikationen Anwendungsfälle in europäischen Bereichen Dr. med. Hans-Peter Dauben Mannheim, 09.Sep 2010 Inhalt Therapeutische Indikationen - die medizinische und die autorisierte Indikation
Institut für Medizinische Physik im Klinikum Nürnberg
 Empfehlungen der Strahlenschutzkommission Michael Wucherer Institut für Medizinische Physik im Klinikum Nürnberg Strahlenschutz-Regelwerke Atomgesetz (AtG) > Strahlenschutzverordnung (StrlSchV) > Röntgenverordnung
Empfehlungen der Strahlenschutzkommission Michael Wucherer Institut für Medizinische Physik im Klinikum Nürnberg Strahlenschutz-Regelwerke Atomgesetz (AtG) > Strahlenschutzverordnung (StrlSchV) > Röntgenverordnung
Von der Idee zum Medikament Forschung & Entwicklung
 Backgrounder Von der Idee zum Medikament Forschung & Entwicklung Inhalt 1. Wie wird ein Wirkstoffkandidat gefunden? 2. Welche Phasen der klinischen Prüfung gibt es? 3. Was sind die Ziele der Forschung
Backgrounder Von der Idee zum Medikament Forschung & Entwicklung Inhalt 1. Wie wird ein Wirkstoffkandidat gefunden? 2. Welche Phasen der klinischen Prüfung gibt es? 3. Was sind die Ziele der Forschung
Zuverlässige Diagnostik mittels der Proteomanalyse im Urin
 Zuverlässige Diagnostik mittels der Proteomanalyse im Urin Der neuartige und nicht invasive DiaPat -Urintest ermöglicht die zuverlässige Früherkennung von Erkrankungen. Darüber hinaus erlaubt die DiaPat
Zuverlässige Diagnostik mittels der Proteomanalyse im Urin Der neuartige und nicht invasive DiaPat -Urintest ermöglicht die zuverlässige Früherkennung von Erkrankungen. Darüber hinaus erlaubt die DiaPat
Forschungsbericht. Maßnahmen zur Verbesserung der gesundheitlichen Situation von Menschen mit seltenen Erkrankungen in Deutschland
 Maßnahmen zur Verbesserung der gesundheitlichen Situation von Menschen mit seltenen Erkrankungen in Deutschland Forschungsbericht Studie im Auftrag des Bundesministeriums für Gesundheit www.bmg.bund.de
Maßnahmen zur Verbesserung der gesundheitlichen Situation von Menschen mit seltenen Erkrankungen in Deutschland Forschungsbericht Studie im Auftrag des Bundesministeriums für Gesundheit www.bmg.bund.de
Qualitätssicherung in der Klinischen Forschung / SOPs, Audits und Inspektionen Katharina Thorn Vorsitzende DVMD e.v.
 Qualitätssicherung in der Klinischen Forschung / SOPs, Audits und Inspektionen Katharina Thorn Vorsitzende DVMD e.v. DVMD-Symposium Hannover / K. Thorn Warum Qualitätssicherung in der Klinischen Forschung?
Qualitätssicherung in der Klinischen Forschung / SOPs, Audits und Inspektionen Katharina Thorn Vorsitzende DVMD e.v. DVMD-Symposium Hannover / K. Thorn Warum Qualitätssicherung in der Klinischen Forschung?
Erkenntnisse aus nicht-interventionellen Studien (NIS) und Transparenz Pressekonferenz des VFA 23. April 2007
 Erkenntnisse aus nicht-interventionellen Studien (NIS) und Transparenz Pressekonferenz des VFA 23. April 2007 Prof. Dr. Torsten Strohmeyer NIS haben hohe medizinische Bedeutung Nicht-interventionelle Studien
Erkenntnisse aus nicht-interventionellen Studien (NIS) und Transparenz Pressekonferenz des VFA 23. April 2007 Prof. Dr. Torsten Strohmeyer NIS haben hohe medizinische Bedeutung Nicht-interventionelle Studien
FungiResearch - Europäische Forschungsplattform für klinische Antimykotika-Entwicklung
 FungiResearch - Europäische Forschungsplattform für klinische Antimykotika-Entwicklung Dr. Endrik Limburg Zentrum für Klinische Studien der Universität zu Köln www.zks-koeln.de Hintergrund Zahl invasiver
FungiResearch - Europäische Forschungsplattform für klinische Antimykotika-Entwicklung Dr. Endrik Limburg Zentrum für Klinische Studien der Universität zu Köln www.zks-koeln.de Hintergrund Zahl invasiver
Nationales Konzept Seltene Krankheiten: Stand der Arbeiten
 Nationales Konzept Seltene Krankheiten: Stand der Arbeiten 7. Internationaler Tag der Seltenen Krankheiten in der Schweiz Centre hospitalier universitaire vaudois, Lausanne, 4. März 2017 Esther Neiditsch,
Nationales Konzept Seltene Krankheiten: Stand der Arbeiten 7. Internationaler Tag der Seltenen Krankheiten in der Schweiz Centre hospitalier universitaire vaudois, Lausanne, 4. März 2017 Esther Neiditsch,
Was sind klinische Prüfungen Eine Einführung. Dr. Thorsten Ruppert Senior Referent Grundsatzfragen Forschung/Entwicklung/Innovation, vfa
 Was sind klinische Prüfungen Eine Einführung Dr. Thorsten Ruppert Senior Referent Grundsatzfragen Forschung/Entwicklung/Innovation, vfa Berlin, 28. Januar 2016 Klinische Studie vs. Klinische Prüfung Wie
Was sind klinische Prüfungen Eine Einführung Dr. Thorsten Ruppert Senior Referent Grundsatzfragen Forschung/Entwicklung/Innovation, vfa Berlin, 28. Januar 2016 Klinische Studie vs. Klinische Prüfung Wie
PATIENTENREGISTER FÜR NEUROMUSKULÄRE ERKRANKUNGEN NUTZEN UND ERFORDERNISSE
 CAMPUS INNENSTADT PATIENTENREGISTER FÜR NEUROMUSKULÄRE ERKRANKUNGEN NUTZEN UND ERFORDERNISSE SMA-Treffen, 07. Mai 2016, Mainz Simone Thiele, Friedrich-Baur-Institut, LMU München ORPHAN DISEASES WAISENKINDER
CAMPUS INNENSTADT PATIENTENREGISTER FÜR NEUROMUSKULÄRE ERKRANKUNGEN NUTZEN UND ERFORDERNISSE SMA-Treffen, 07. Mai 2016, Mainz Simone Thiele, Friedrich-Baur-Institut, LMU München ORPHAN DISEASES WAISENKINDER
KLINISCHE STUDIEN KOMPAKT
 KLINISCHE STUDIEN KOMPAKT VORWORT Vom Labor zum Medikament ist es ein langer Weg klinische Studien leisten einen wertvollen Beitrag zur Wirkstoffentwicklung. Doch was verbirgt sich hinter dem Begriff?
KLINISCHE STUDIEN KOMPAKT VORWORT Vom Labor zum Medikament ist es ein langer Weg klinische Studien leisten einen wertvollen Beitrag zur Wirkstoffentwicklung. Doch was verbirgt sich hinter dem Begriff?
ORPHAN DRUGS. Dr. Martina Schmidt, Actelion Pharmaceuticals Austria GmbH. Copyright 2012 Martina Schmidt
 ORPHAN DRUGS Dr. Martina Schmidt, Actelion Pharmaceuticals Austria GmbH Copyright WER UND WAS IST ACTELION? Biopharmazeutisches Unternehmen mit Sitz in der Schweiz, gegründet 1997 ca. 2.500 Mitarbeiter
ORPHAN DRUGS Dr. Martina Schmidt, Actelion Pharmaceuticals Austria GmbH Copyright WER UND WAS IST ACTELION? Biopharmazeutisches Unternehmen mit Sitz in der Schweiz, gegründet 1997 ca. 2.500 Mitarbeiter
Statement von Edelgard Bulmahn, Bundesministerin für Bildung und Forschung
 Statement von Edelgard Bulmahn, Bundesministerin für Bildung und Forschung Meine Herren und Damen, kann man mit Vitaminen der Krebsentstehung vorbeugen? Welche Kombination von Medikamenten bei AIDS ist
Statement von Edelgard Bulmahn, Bundesministerin für Bildung und Forschung Meine Herren und Damen, kann man mit Vitaminen der Krebsentstehung vorbeugen? Welche Kombination von Medikamenten bei AIDS ist
Europäische Verfahren
 Europäische Verfahren Zur Zeit existieren 3 verschieden Zulassungsverfahren in der EU: Verfahren der gegenseitigen Anerkennung (MRP) dezentrales Verfahren (DCP) zentrales Verfahren Alle Biotech Produkte
Europäische Verfahren Zur Zeit existieren 3 verschieden Zulassungsverfahren in der EU: Verfahren der gegenseitigen Anerkennung (MRP) dezentrales Verfahren (DCP) zentrales Verfahren Alle Biotech Produkte
Personalisierte Medizin Status Quo und Perspektiven aus Sicht der pharmazeutischen Industrie
 Personalisierte Medizin Status Quo und Perspektiven aus Sicht der pharmazeutischen Industrie Dr. Thorsten Ruppert Seite 1 Personalisierte Medizin Bei der Personalisierte Medizin geht es also um: Therapieverfahren,
Personalisierte Medizin Status Quo und Perspektiven aus Sicht der pharmazeutischen Industrie Dr. Thorsten Ruppert Seite 1 Personalisierte Medizin Bei der Personalisierte Medizin geht es also um: Therapieverfahren,
Methoden der evidenzbasierten Medizin und des Qualitätsmanagements im Kontext der Aufgaben des Gemeinsamen Bundesausschusses
 Methoden der evidenzbasierten Medizin und des Qualitätsmanagements im Kontext der Aufgaben des Gemeinsamen Bundesausschusses Dr. Barbara Pietsch Gemeinsamer Bundesausschuss, Fachberatung Medizin 8. Jahrestagung
Methoden der evidenzbasierten Medizin und des Qualitätsmanagements im Kontext der Aufgaben des Gemeinsamen Bundesausschusses Dr. Barbara Pietsch Gemeinsamer Bundesausschuss, Fachberatung Medizin 8. Jahrestagung
DMP-Realität nach 10 Jahren
 DMP-Realität nach 10 Jahren Dr. Maximilian Gaßner Präsident des Bundesversicherungsamtes Übersicht 1. Einführung der DMP 2. DMP in der Praxis Kritik und Würdigung 3. Ausblick in die Zukunft von DMP 4.
DMP-Realität nach 10 Jahren Dr. Maximilian Gaßner Präsident des Bundesversicherungsamtes Übersicht 1. Einführung der DMP 2. DMP in der Praxis Kritik und Würdigung 3. Ausblick in die Zukunft von DMP 4.
Bundesfachgruppe Radiologie Österreichische Röntgengesellschaft R ADIOLOGIE
 Bundesfachgruppe Radiologie Österreichische Röntgengesellschaft R ADIOLOGIE Was ist Radiologie? Das Fachgebiet Radiologie umfasst die Erkennung von Erkrankungen mittels ionisierender Strahlen wie die analoge
Bundesfachgruppe Radiologie Österreichische Röntgengesellschaft R ADIOLOGIE Was ist Radiologie? Das Fachgebiet Radiologie umfasst die Erkennung von Erkrankungen mittels ionisierender Strahlen wie die analoge
m 4 Personalisierte Medizin Den Mehrwert in der Medizin von morgen mitgestalten
 m 4 Personalisierte Medizin Den Mehrwert in der Medizin von morgen mitgestalten Personalisierte Medizin - was ist das? Ein Zweig/Bereich der Medizin, der Informationen über die Gene, Proteine und das Lebensumfeld
m 4 Personalisierte Medizin Den Mehrwert in der Medizin von morgen mitgestalten Personalisierte Medizin - was ist das? Ein Zweig/Bereich der Medizin, der Informationen über die Gene, Proteine und das Lebensumfeld
Swissmedic Regulatory News aus dem Bereich Zulassung Stade de Suisse, 1. Dez Vergleich Zulassungsentscheide SMC / EMA / FDA
 Swissmedic Regulatory News aus dem Bereich Zulassung Stade de Suisse, 1. Dez. 2016 Vergleich Zulassungsentscheide SMC / EMA / FDA 2005-2014 Simon Dalla Torre, Prozessentwicklungs-Manager, Bereich Zulassung
Swissmedic Regulatory News aus dem Bereich Zulassung Stade de Suisse, 1. Dez. 2016 Vergleich Zulassungsentscheide SMC / EMA / FDA 2005-2014 Simon Dalla Torre, Prozessentwicklungs-Manager, Bereich Zulassung
Versorgungsrechtliche Grundlagen von Qualitätssicherung und Evaluation 3. Symposium der BAG BKOM und DVfR 01. Oktober 2010 Frankfurt/Main
 Versorgungsrechtliche Grundlagen von Qualitätssicherung und Evaluation 3. Symposium der BAG BKOM und DVfR 01. Oktober 2010 Frankfurt/Main Dipl. Ing. Norbert Kamps Referent Hilfsmittelversorgung, Fachgebiet
Versorgungsrechtliche Grundlagen von Qualitätssicherung und Evaluation 3. Symposium der BAG BKOM und DVfR 01. Oktober 2010 Frankfurt/Main Dipl. Ing. Norbert Kamps Referent Hilfsmittelversorgung, Fachgebiet
Klinische Forschung ein Spannungsfeld zwischen Wissenschaft, Patientensicherheit und Sponsor-
 MEDIDATA GmbH Klinische Forschung ein Spannungsfeld zwischen Wissenschaft, Zulassungsanforderungen, Patientensicherheit und Sponsor- Interessen? Prof. Dr. med. Thomas D. Bethke, MBA, FFPM Medical Director,
MEDIDATA GmbH Klinische Forschung ein Spannungsfeld zwischen Wissenschaft, Zulassungsanforderungen, Patientensicherheit und Sponsor- Interessen? Prof. Dr. med. Thomas D. Bethke, MBA, FFPM Medical Director,
Treffen der Kontaktgruppe Neurale Muskelatrophie der DGM e.v. Bad Sooden-Allendorf,
 CAMPUS INNENSTADT : Warum braucht man so was? Treffen der Kontaktgruppe Neurale Muskelatrophie der DGM e.v. Bad Sooden-Allendorf, Dr. med. Olivia Schreiber-Katz, Friedrich-Baur-Institut, München www.cmt-register.de
CAMPUS INNENSTADT : Warum braucht man so was? Treffen der Kontaktgruppe Neurale Muskelatrophie der DGM e.v. Bad Sooden-Allendorf, Dr. med. Olivia Schreiber-Katz, Friedrich-Baur-Institut, München www.cmt-register.de
Empfehlungen zum Aufbau und Betrieb von gesundheitsbezogenen Registern. Register in der Medizin: Wo steht die Schweiz? Bern, 1.
 Empfehlungen zum Aufbau und Betrieb von gesundheitsbezogenen Registern Register in der Medizin: Wo steht die Schweiz? Bern, 1. Februar 2018 Herausgeber-Organisationen Empfehlungen 2 Gesundheitsbezogene
Empfehlungen zum Aufbau und Betrieb von gesundheitsbezogenen Registern Register in der Medizin: Wo steht die Schweiz? Bern, 1. Februar 2018 Herausgeber-Organisationen Empfehlungen 2 Gesundheitsbezogene
PMS-Workshop, Berlin am 12. Mai 2009
 PMS-Workshop, Berlin am 12. Mai 2009 Enzymersatz-Therapien bei seltenen Stoffwechselstörungen Insert Picture Here Herausforderungen und Chancen Sicht der Industrie Dr. Hans-Peter Schulz Direktor Lysosomale
PMS-Workshop, Berlin am 12. Mai 2009 Enzymersatz-Therapien bei seltenen Stoffwechselstörungen Insert Picture Here Herausforderungen und Chancen Sicht der Industrie Dr. Hans-Peter Schulz Direktor Lysosomale
Auswirkungen der 12. AMG-Novelle auf die klinische Forschung in Deutschland, Bilanz nach einem Jahr:
 Auswirkungen der 12. AMG-Novelle auf die klinische Forschung in Deutschland, Bilanz nach einem Jahr: Bilanz der Neuregelungen aus Sicht der forschenden Arzneimittelhersteller Dr. Dieter Götte 1 Erwartungen
Auswirkungen der 12. AMG-Novelle auf die klinische Forschung in Deutschland, Bilanz nach einem Jahr: Bilanz der Neuregelungen aus Sicht der forschenden Arzneimittelhersteller Dr. Dieter Götte 1 Erwartungen
Weltweit führend: Die deutsche Lymphomforschung. Vernetzung als Erfolgsmodell
 Weltweit führend: Die deutsche Lymphomforschung Vernetzung als Erfolgsmodell Michael Hallek Michael Hallek (Köln) 10 Jahre Kompetenznetze in der Medizin Festvortrag am 11. Juni 2009 Seite 1 Inzidenz und
Weltweit führend: Die deutsche Lymphomforschung Vernetzung als Erfolgsmodell Michael Hallek Michael Hallek (Köln) 10 Jahre Kompetenznetze in der Medizin Festvortrag am 11. Juni 2009 Seite 1 Inzidenz und
Wissen, worauf es ankommt
 Wissen, worauf es ankommt www.tuev-sued.de/akademie GmbH Westendstraße 160 80339 München Telefon: 089 5791 2389 E-Mail: akademie@tuev-sued.de Bleiben wir in Kontakt! AC46-Pharma-fly-210x297-w-15-07-03
Wissen, worauf es ankommt www.tuev-sued.de/akademie GmbH Westendstraße 160 80339 München Telefon: 089 5791 2389 E-Mail: akademie@tuev-sued.de Bleiben wir in Kontakt! AC46-Pharma-fly-210x297-w-15-07-03
Frühe Nutzenbewertung neuer Arzneimittel. Quo vadis? Prof. Dr. med. Bernhard Wörmann
 Frühe Nutzenbewertung neuer Arzneimittel Quo vadis? Prof. Dr. med. Bernhard Wörmann AWMF, 8. 7. 2016 Frühe Nutzenbewertung Inhalte Ergebnisse Methodik Subgruppen Endpunkte Beteiligung der Fachgesellschaften
Frühe Nutzenbewertung neuer Arzneimittel Quo vadis? Prof. Dr. med. Bernhard Wörmann AWMF, 8. 7. 2016 Frühe Nutzenbewertung Inhalte Ergebnisse Methodik Subgruppen Endpunkte Beteiligung der Fachgesellschaften
Transparenz in der Zusammenarbeit mit Ärzten
 Transparenz in der Zusammenarbeit mit Ärzten Offenlegung von Zahlungen an Ärzte und andere Heilberufe Die Pharmaindustrie und Angehörige medizinischer Fachkreise arbeiten in vielen Bereichen zusammen:
Transparenz in der Zusammenarbeit mit Ärzten Offenlegung von Zahlungen an Ärzte und andere Heilberufe Die Pharmaindustrie und Angehörige medizinischer Fachkreise arbeiten in vielen Bereichen zusammen:
Translationale Zentren Ein Weg für Innovationen? Brennpunkt Onkologie. Berlin, Bernhard Egger GKV-Spitzenverband
 Translationale Zentren Ein Weg für Innovationen? Brennpunkt Onkologie Berlin, 30.11.2016 Bernhard Egger GKV-Spitzenverband 2 Abs. (1) Satz 3 SGB V Qualität und Wirksamkeit der Leistungen haben dem anerkannten
Translationale Zentren Ein Weg für Innovationen? Brennpunkt Onkologie Berlin, 30.11.2016 Bernhard Egger GKV-Spitzenverband 2 Abs. (1) Satz 3 SGB V Qualität und Wirksamkeit der Leistungen haben dem anerkannten
Die Realisierung von Evidenz-basierter Medizin im deutschen Gesundheitssystem
 Die Realisierung von Evidenz-basierter Medizin im deutschen Gesundheitssystem G.Ollenschläger Ärztliche Zentralstelle Qualitätssicherung (Gemeinsame Einrichtung von Bundesärztekammer und Kassenärztlicher
Die Realisierung von Evidenz-basierter Medizin im deutschen Gesundheitssystem G.Ollenschläger Ärztliche Zentralstelle Qualitätssicherung (Gemeinsame Einrichtung von Bundesärztekammer und Kassenärztlicher
Klinische Prüfung von Arzneimitteln: Öffentliche Informationen in PharmNet.Bund Clinical Trials (CT)
 Klinische Prüfung von Arzneimitteln: Öffentliche Informationen in PharmNet.Bund Clinical Trials (CT) Nutzertreffen, Köln 8. November 2011 Dr. Barbara Höfgen, Dr. Irina Bosman PharmNet.Bund-CT Gesetzliche
Klinische Prüfung von Arzneimitteln: Öffentliche Informationen in PharmNet.Bund Clinical Trials (CT) Nutzertreffen, Köln 8. November 2011 Dr. Barbara Höfgen, Dr. Irina Bosman PharmNet.Bund-CT Gesetzliche
Risikoüberwachung von Arzneimitteln - Aktuelle Situation
 Risikoüberwachung von Arzneimitteln - Aktuelle Situation U. Hagemann Bundesinstitut für Arzneimittel und Medizinprodukte Abteilung Pharmakovigilanz Fortbildung für den Öffentlichen Dienst Berlin, 2. April
Risikoüberwachung von Arzneimitteln - Aktuelle Situation U. Hagemann Bundesinstitut für Arzneimittel und Medizinprodukte Abteilung Pharmakovigilanz Fortbildung für den Öffentlichen Dienst Berlin, 2. April
Fachgespräch zum Tag der Seltenen Erkrankungen Der steinige Weg zur richtigen Diagnose Herausforderungen und Lösungen bei seltenen Erkrankungen
 BERICHT Fachgespräch zum Tag der Seltenen Erkrankungen Der steinige Weg zur richtigen Diagnose Herausforderungen und Lösungen bei seltenen Erkrankungen FREITAG, 03. MÄRZ 2017 AXICA SKY LOBBY BERLIN Der
BERICHT Fachgespräch zum Tag der Seltenen Erkrankungen Der steinige Weg zur richtigen Diagnose Herausforderungen und Lösungen bei seltenen Erkrankungen FREITAG, 03. MÄRZ 2017 AXICA SKY LOBBY BERLIN Der
Die Rolle von Patientenorganisationen bei Seltenen Erkrankungen
 Die Rolle von Patientenorganisationen bei Seltenen Erkrankungen Dr. Andreas L.G. Reimann, MBA Stellvertretender Vorsitzender, ACHSE e.v., Berlin Geschäftsführer, Mukoviszidose e.v., Bonn Was ist die ACHSE?
Die Rolle von Patientenorganisationen bei Seltenen Erkrankungen Dr. Andreas L.G. Reimann, MBA Stellvertretender Vorsitzender, ACHSE e.v., Berlin Geschäftsführer, Mukoviszidose e.v., Bonn Was ist die ACHSE?
V I N VerordnungsInfo Nordrhein
 V I N VerordnungsInfo Nordrhein Off-Label Verordnung von Arzneimitteln außerhalb ihrer Zulassung Für die Verordnung eines Arzneimittels zu Lasten der gesetzlichen Krankenkasse müssen die Präparate in der
V I N VerordnungsInfo Nordrhein Off-Label Verordnung von Arzneimitteln außerhalb ihrer Zulassung Für die Verordnung eines Arzneimittels zu Lasten der gesetzlichen Krankenkasse müssen die Präparate in der
467/J. vom (XXVI.GP) Anfrage. an die Bundesministerin für Arbeit, Soziales, Gesundheit und Konsumentenschutz
 467/J vom 12.03.2018 (XXVI.GP) 1 von 5 Anfrage der Abgeordneten Gerald Loacker, Kolleginnen und Kollegen an die Bundesministerin für Arbeit, Soziales, Gesundheit und Konsumentenschutz betreffend Maßnahmen
467/J vom 12.03.2018 (XXVI.GP) 1 von 5 Anfrage der Abgeordneten Gerald Loacker, Kolleginnen und Kollegen an die Bundesministerin für Arbeit, Soziales, Gesundheit und Konsumentenschutz betreffend Maßnahmen
EU-Verordnung 536/ Sicht der pharmazeutischen Industrie Dr. Harald Tietz, Director Medical Affairs, Lilly Deutschland GmbH Bonn, 16.
 EU-Verordnung 536/2014 - Sicht der pharmazeutischen Industrie Dr. Harald Tietz, Director Medical Affairs, Lilly Deutschland GmbH Bonn, 16. Juni 2016 16.06.2016 DGRA 2016, Bonn 1 Anwendung der EU-CTR es
EU-Verordnung 536/2014 - Sicht der pharmazeutischen Industrie Dr. Harald Tietz, Director Medical Affairs, Lilly Deutschland GmbH Bonn, 16. Juni 2016 16.06.2016 DGRA 2016, Bonn 1 Anwendung der EU-CTR es
Initiative Gesundheitsindustrie Hessen Projektbüro
 Bericht Werkstatt Wissenschaft und Forschung zur Sitzung des Lenkungskreises am 19. Januar 2017 Methodenkatalog Der Methodenkatalog wurde in Kooperation mit dem House of Pharma and Healthcare erstellt
Bericht Werkstatt Wissenschaft und Forschung zur Sitzung des Lenkungskreises am 19. Januar 2017 Methodenkatalog Der Methodenkatalog wurde in Kooperation mit dem House of Pharma and Healthcare erstellt
Weltweiter Lyme Protest
 Weltweiter Lyme Protest BESSERE MEDIZINISCHE VERSORGUNG ZUVERLÄSSIGE DIAGNOSTIK WIRKSAME THERAPIEN Die Borreliose-Problematik Die Lyme-Borreliose kann labortechnisch nicht einwandfrei nachgewiesen werden.
Weltweiter Lyme Protest BESSERE MEDIZINISCHE VERSORGUNG ZUVERLÄSSIGE DIAGNOSTIK WIRKSAME THERAPIEN Die Borreliose-Problematik Die Lyme-Borreliose kann labortechnisch nicht einwandfrei nachgewiesen werden.
Die frühe Nutzenbewertung und ihre rechtlichen Herausforderungen
 und ihre rechtlichen Herausforderungen Rechtssymposium Die frühe Nutzenbewertung von Arzneimitteln nach AMNOG G-BA, Berlin Referent: Dr. jur. Rainer Hess, G-BA Seite 1 16. November 2010 Rechtssymposium
und ihre rechtlichen Herausforderungen Rechtssymposium Die frühe Nutzenbewertung von Arzneimitteln nach AMNOG G-BA, Berlin Referent: Dr. jur. Rainer Hess, G-BA Seite 1 16. November 2010 Rechtssymposium
Patientenempowerment: Pharmakommunikation für eine individuelle Patientenansprache
 Patientenempowerment: Pharmakommunikation für eine individuelle Patientenansprache Referent: Dr. Dr. Fred Harms, Ass Prof Wort & Bild Verlag Baierbrunn, 17. November 2006 Gliederung Vortrag Patientenempowerment:
Patientenempowerment: Pharmakommunikation für eine individuelle Patientenansprache Referent: Dr. Dr. Fred Harms, Ass Prof Wort & Bild Verlag Baierbrunn, 17. November 2006 Gliederung Vortrag Patientenempowerment:
