AGO-OVAR 20 / PAOLA-1 Deutsche SYNOPSE
|
|
|
- Birgit Salzmann
- vor 8 Jahren
- Abrufe
Transkript
1 AGO-OVAR 20 / PAOLA-1 Deutsche SYNOPSE TITEL SPONSOR INTERNATIONALER STUDIENLEITER LEITER DER KLINISCHEN PRÜFUNG (LKP) ANZAHL DER PATIENTINNEN & TEILNEHMENDE ZENTREN VERSION DES AKTUELLEN PRÜFPLANS INDIKATION STUDIENDESIGN Randomisierte, doppel-blinde, Phase III-Studie mit Olaparib vs. Placebo bei Patientinnen mit fortgeschrittenem FIGO IIIB-IV high-grade serösem oder endometrioidem Ovarial-, Tuben- oder primärem Peritonealkarzinom in der Erstlinientherapie in der Kombination mit einer platintaxan-bevacizumab-haltigen Chemotherapie und Bevacizumab als Erhaltungstherapie. PAOLA-1: Platin, Avastin und Olaparib in der 1. Linie ARCAGY-GINECO, Paris, Frankreich Prof. Isabelle Ray-Coquard, Lyon, Frankreich Dr. med. Philipp Harter, Essen, Deutschland Europa: 612 Patientinnen in ca. 200 Zentren Spezielle japanische Kohorte: 24 zusätzliche Patientinnen in ca. 10 Zentren Version 1.2 vom Patientinnen mit fortgeschrittenem FIGO IIIB-IV high-grade serösem oder endometrioiden Ovarial-, Tuben- oder primären Peritonealkarzinom behandelt mit der Standard- Erstlinientherapie in der Kombination mit einer platintaxan-bevacizumab-haltigen Chemotherapie und Bevacizumab als Erhaltungstherapie Randomisierte, doppel-blinde, multizentrische Phase III- Studie AGO-OVAR 20/PAOLA 1-1 von 16 - EudraCT-Nr
2 STUDIENKALENDER Studienstart: Q Rekrutierungszeitraum: 18 Monate Behandlungszeitraum: 24 Monate geschätztes Behandlungsende der letzten Patientin: Q geschätzter Zeitpunkt des letzten Follow-up: Q STUDIENENDPUNKTE Primärer Endpunkt: Ermittlung der Wirksamkeit mittels des progressionsfreie Überlebens (PSF1) basierend auf der Einschätzung des Prüfarztes gemäß den modifizierten Response Evaluation Criteria in Solid Tumors (RECIST Version 1.1) für die Erhaltungstherapie mit Olaparib im Vergleich zu Placebo bei Patientinnen mit high-grade Ovarial-, Tuben- oder Peritonealkarzinom, die ein klinisch vollständiges oder teilweises Ansprechen nach der Erstlinien-, platin-taxan-haltigen Chemotherapie und Bevacizumab zeigen, und bei denen eine nachfolgende Erhaltungstherapie mit Bevacizumab bis zu 15 Monaten geplant ist. Sekundäre Endpunkte: 1. Evaluierung von: Zeit bis zum frühesten Progress nach RECIST oder CA-125 oder Tod Zeit von der Randomisierung bis zur ersten anschließenden Therapie oder Tod (TFST) Zeit von der Randomisierung bis zum zweiten Progress (PFS2) Zeit von der Randomisierung bis zur zweiten anschließenden Therapie oder Tod (TSST) Gesamtüberleben (OS) 2. Beurteilung der Sicherheit und der Verträglichkeit von Olaparib in der Erhaltungstherapie im Vergleich zu Placebo. 3. Vergleich der Wirkungen von Olaparib in der Erhaltungstherapie zu Placebo in der gesundheitsbezogenen Lebensqualität (HRQoL) und der patient reported outcomes (PROs), unter Berücksichtigung der Patientenpräferenz. 4. Bewertung der Wirkung dieser Behandlung und des Ressourcenverbrauchs bei der Erkrankung. Explorative Endpunkte: 1. Untersuchung von vorher geplanten Subgruppenauswertungen für die Wirksamkeit (PFS1 & OS) basierend auf den relevanten potentiellen prognostischen Faktoren inkl. der Stratifizierungsfaktoren. AGO-OVAR 20/PAOLA 1-2 von 16 - EudraCT-Nr
3 EINSCHLUSSKRITERIEN 2. Untersuchung des Zusammenhangs zwischen den geriatrischen Beurteilungen sowie der Wirksamkeit und Verträglichkeit von Olaparib gegenüber Placebo bei Patientinnen 70 Jahre. 3. Untersuchung der Wirksamkeit von Olaparib bei der Beurteilung des Gesamtüberlebens (OS), angepasst an den Einfluss von spontanen Therapiewechseln (außerhalb des Studiendesigns) zu Polyadenosine 5 diphosporibose [poly (ADP ribose)] Polymerization (PARP) Inhibitoren oder anderen potentiell aktiven Prüfsubstanzen. 4. Biologische Biomarkerauswertung: Bestimmung der Häufigkeit von somatischen BRCA-Mutationen (sbr- CAm) in Tumorproben und Vergleich dieser mit dem Keimbahn BRCA-Mutationsstatus (gbrcam). Bestimmung einer homologen Rekombination (HR)- Mangel-Signatur bezogen auf die Wirkung von Olaparib in Kombination mit Bevacizumab. 5. Untersuchung, ob resistente Mechanismen vom Olaparib durch die Auswertung von Tumor- und Blutproben identifiziert werden können archivierte Tumorproben und Blutproben zur Baseline (verbindlich), Tumorbiopsie und Blutproben bei einem Progress (optional). 6. Künftige exploratorische Forschung zu Faktoren, die das Ansprechen der Studienbehandlung beeinflussen können (wobei das Ansprechen breit definiert ist und die Wirksamkeit, Verträglichkeit und Sicherheit einschließt) und die an den gesammelten, archivierten Tumorproben durchgeführt werden können, welche für den Einschluss in die Studie vorgeschrieben waren, oder an den optionalen Tumorbiopsieproben, die während des Studienverlaufs gewonnen wurden. 7. Sammlung und Aufbewahrung von DNA (gemäß den lokalen und ethischen Vorschriften jedes Landes) für zukünftige exploratorische Forschung an den Genen/ genetischen Variationen, die einen Einfluss auf das Ansprechen der Studienbehandlung haben (z.b. Verteilung, Sicherheit, Verträglichkeit und Wirksamkeit) und/oder die Prädisposition für die Erkrankung beeinflussen können. 1. Patientin muss 18 Jahre sein. 2. Unterschriebene Patienteninformation und die Fähigkeit, die Behandlung und das Follow-Up einhalten zu können. 3. Patientinnen mit neu diagnostiziertem Ovarialkarzinom, primärem Peritonealkarzinom und/oder Tubenkarzinom, histologisch bestätigt (basierend auf dem lokalen histo-pathologischem Befund): o high-grade serös oder AGO-OVAR 20/PAOLA 1-3 von 16 - EudraCT-Nr
4 o o high-grade endometrioid oder anderes epitheliales nicht-muzinöses Ovarialkarzinom bei Patientinnen mit schädlicher BRCA 1- oder BRCA 2-Keimbahnmutation im fortgeschrittenen Stadium: FIGO-Stadium IIIB, IIIC oder IV der FIGO-Klassifikation von Patientin, die vor der Randomisierung eine Erstlinien-platin-taxan-haltige-Chemotherapie vollständig erhalten hat: a. Platin-taxan basierte Regime müssen aus mind. 6 und höchsten 9 Behandlungszyklen bestanden haben. Sollte die platin-haltige Therapie aufgrund nicht-hämatologischer Toxizität, die definitiv mit dem Platinregime zusammenhängt (z. B. Neurotoxizität, Überempfindlichkeit etc.), abgebrochen worden sein muss die Patientin mind. 4 Zyklen des platinhaltigen Regimes erhalten haben. b. Intravenöse, intraperitoneale oder neoadjuvante platin-haltige Chemotherapien sind erlaubt; für wöchentliche Therapien werden drei Wochen als ein Zyklus gezählt; Intervalloperationen sind erlaubt. 5. Patientin muss vor der Randomisierung mind. 3 Zyklen Bevacizumab in Kombination mit den 3 letzten Zyklen der platin-haltigen Chemotherapie erhalten haben. Die Bevacizumabbehandlung sollte mit einer Dosis von 15 mg/kg q3w für bis zu 15 Monaten als anschließende Erhaltungstherapie verabreicht werden. 6. Patientin muss vor der Randomisierung ohne Nachweis der Erkrankung (NED) sein oder ein komplettes Ansprechen (CR) oder teilweises Ansprechen (PR) zu ihrer Erstlinientherapie haben. Es dürfen keine klinischen Nachweise einer Krankheitsprogression (körperliche Untersuchung, Bildgebung, CA125) während ihrer Erstlinientherapie und vor der Randomisierung vorliegen. 7. Patientin muss mindestens 3 Wochen und nicht mehr als 9 Wochen nach ihrer letzten Dosis Chemotherapie randomisiert werden (letzte Dosis ist der Tag der letzten Infusion) und alle relevanten Nebenwirkungen der vorherigen Chemotherapie müssen sich auf CTCAE Grad 1 gebessert haben (Ausnahme: Alopezie und periphere Neuropathie). 8. Patientin muss normale Organ- und Knochenmarksfunktionen haben: a. Hämoglobin 10.0d/dL b. Absolute Neutrophilenanzahl (ANC) 1.5 x 10 9 /L c. Thrombozyten (PLT) 100 x 10 9 /L d. Gesamt-Bilirubin 1,.5 x ULN e. Serum-Transaminasen (ASAT/SGOT & ALAT/SGPT) 2.5 x ULN, wenn Lebermetastasen vorhanden sind 5 x ULN. f. Serum-Kreatinin 1.25 x ULN und Kreatinin Clearance > 50 ml/min. g. Patientin, die eine International Normalized Ratio (INR) 1,5 und eine aktivierte partielle Thrombo- AGO-OVAR 20/PAOLA 1-4 von 16 - EudraCT-Nr
5 plastinzeit (aptt) 1,5 x ULN hat und die keine Gerinnungshemmer einnimmt. Die Einnahme einer Dosis oraler oder parenteraler Antikoagulation ist erlaubt, solange der INR oder das aptt im therapeutischen Grenzbereich ist (gemäß medizinischem Standard der Institution) und die Patientin mindestens 2 Wochen vor der Randomisierung auf eine stabile Dosis Antikoagulantien eingestellt wurde. h. Urinteststreifen zur Bestimmung von Proteinurie < 2+. Wenn der Urinteststreifen einen Wert 2+ anzeigt, muss durch einen 24 Stunden- Sammelurin 1 g Protein in 24 Stunden nachgewiesen werden. i. Normaler Blutdruck oder adäquat behandelter und kontrollierter Bluthochdruck (systolisch 140 mmhg und/oder diastolisch 90 mmhg). 9. ECOG Status Formalinfixierte, in Paraffin eingebettete (FFPE) Tumorproben vom Primärkarzinom müssen für die zentrale BRCA-Testung verfügbar sein und das Testergebnis muss für die Stratifizierung vorliegen. 11. Postmenopausale Patientinnen; oder nachweisliche Nicht-Gebärfähigkeit für Frauen im gebärfähigen Alter vor der ersten Dosis der Studienbehandlung AUSSCHLUSSKRITERIEN Die Patientin darf nicht in die Studie eingeschlossen werden, wenn eine der folgenden Ausschlusskriterien erfüllt ist: 1. Nicht-epitheliales Karzinom der Eierstöcke, der Eileiter oder des Bauchfells (z. B. Keimzelltumore). 2. Ovarialtumore mit niedrigmalignem Potential (z. B. Borderlinetumore) oder muzinöse Karzinome. 3. Patientin mit synchronem primärem Endometriumkarzinom, sofern nicht beide folgenden Kriterien zutreffen: a. Stadium < II b. Jünger als 60 Jahre zum Zeitpunkt der Diagnose des Endometriumkarzinoms mit dem Stadium IA oder IB Grad 1 oder 2, oder dem Stadium IA Grad III eines endometrioidem Adenokariznom ODER 60 Jahre zum Zeitpunkt der Diagnose eines Endometriumkarzinoms mit dem Stadium IA Grad 1 oder 2 eines endometrioidem Adenokarzinom. Patientin mit serösem oder klarzelligem Adenokarzinom oder Karzinosarkoms des Endometriums kann nicht eingeschlossen werden. 4. Andere maligne Tumore in den letzten 5 Jahren außer: adäquat behandelter nicht-melanöser Hautkrebs, kurativ behandelter carcinoma in-situ der Zervix, duktale Karzinome in-situ (DCIS). Patientin mit einer vor über 5 Jahren diagnostizierten Vorgeschichte von lokalisierten Malignomen kann geeignet sein, vorausgesetzt sie hat ihre adjuvante systemische Therapie vor der Randomisierung beendet und AGO-OVAR 20/PAOLA 1-5 von 16 - EudraCT-Nr
6 die Patientin ist rezidivfrei, bzw. hat keine metastasierenden Erkrankungen. Patientin mit einer Vorgeschichte eines primären triple-negativen Brustkrebs kann geeignet sein, vorausgesetzt sie beendete ihre maßgebliche Antikrebstherapie vor mehr als 3 Jahren und bleibt bis zur Randomisierung rezidivfrei bezugnehmend zur Brustkrebserkrankung. 5. Patientin mit myelodysplastischem Syndrom / akuter myeloischer Leukämie in der Vorgeschichte. 6. Patientin, die eine Verschiebung von > 2 Wochen wegen anhaltender hämatologischer Nebenwirkungen von mind. 1 Zyklus während der Erstlinientherapie hatte. 7. Patientin, die innerhalb von 6 Wochen vor der Studienbehandlung eine Radiotherapie erhalten hat. 8. Große Operationen innerhalb von 4 Wochen vor Beginn der Studienbehandlung und Patientinnen, die sich von jeglichen Folgen einer großen Operation erholen müssen. 9. Vorhergehende allogene Knochenmarkstransplantation. 10. Jede vorhergehende Behandlung mit einem PARP- Inhibitor, einschließlich Olaparib. 11. Verabreichung von gleichzeitig anderen Chemotherapeutika, jegliche andere Krebstherapie oder antineoplastische Hormontherapie oder gleichzeitige Radiotherapie während der Studienbehandlung (Hormonersatztherapie und steroidhaltige Antiemetika sind erlaubt). 12. Regelmäßige Einnahme von Aspirin (innerhalb von 10 Tagen vor Randomisierung) > 325 mg/tag. 13. Gleichzeitige Benutzung von bekannten potenten CYP3A4 Inhibitoren wie z.b. Ketokonazole, Itrakonazol, Ritonavir, Indinavir, Saquinavir, Telithromycin, Clarithromycin und Nelfinavir. 14. Hypertensive Krise (CTCAE Grad 4) oder hypertensive Enzephalopathie in der Anamnese. 15. Klinisch signifikante kardiovaskuläre Erkrankung, einschließlich: a- Myokardinfarkt oder instabile Angina pectoris 6 Monate vor Randomisierung, b- Kongestive Herzinsuffizienz (CHF) New York Heart Association (NYHA) Klasse II, c- schlecht kontrollierte Arrhythmie trotz Medikation (Patientinnen mit frequenzkontrolliertem Vorhofflimmern können eingeschlossen werden) oder jegliche klinisch signifikante unnormale Befunde im Ruhe-EKG, d- Periphere Gefäßerkrankungen Grad 3 (symptomatisch und die Aktivität des täglichen Lebens [ADL] beeinträchtigend, die eine Intervention oder Revision notwendig macht). 16. Apoplexie (CVA), transiente ischämische Attacke (TIA) oder Subarachnoidalblutung (SAH) innerhalb von 6 Monaten vor Randomisierung. 17. Anamnese oder Nachweis von hämorrhagischen AGO-OVAR 20/PAOLA 1-6 von 16 - EudraCT-Nr
7 Störungen innerhalb von 6 Monaten vor Randomisierung. 18. Anzeichen einer hämorrhagischen Diathese oder signifikanter Gerinnungsstörung (ohne therapeutische Koagulation). 19. Nachweis von Gehirnmetastasen oder Rückenmarkskompression. Bei einem Verdacht auf Gehirnmetastasen ist ein CT/MRT des Gehirns erforderlich (innerhalb von 4 Wochen vor Randomisierung). Eine Rückenmarkstomographie ist erforderlich bei einem Verdacht auf einer Rückenmarkskompression (innerhalb von 4 Wochen vor Randomisierung). 20. Anamnese oder Nachweis einer Erkrankung des zentralen Nervensystems (CNS) außer, wenn diese mit der entsprechenden Standardtherapie behandelt wird (z. B. unkontrollierte Krampfanfälle). 21. Signifikante traumatische Verletzung innerhalb von 4 Wochen vor Randomisierung. 22. Wundheilungsstörungen, bestehende Ulzerationen oder Knochenfrakturen. Patientin mit granulierten Inzisionen ohne Zeichen von faszialer Dehiszenz oder Infektionen kann eingeschlossen werden; Wundkontrolle ist alle 3 Wochen erforderlich. 23. Abdominale Fisteln oder gastrointestinale Perforation in Zusammenhang mit in einer vorherigen VEGF- Therapie innerhalb von 6 Monaten vor der ersten Studienbehandlung. 24. aktuell klinisch relevanter Darmverschluss, einschließlich einer subokklusiven Erkrankung, die auf die Grunderkrankung zurückzuführen ist. 25. Patientin mit nachgewiesener freier abdominaler Luft, die nicht auf eine Parazentese oder einen kürzlich durchgeführten chirurgischen Eingriff zurückzuführen ist. 26. Hinweis auf andere Erkrankungen, metabolische Dysfunktion, pathologische Befunde nach körperlicher Untersuchung oder Laboruntersuchungen, die den Verdacht einer Krankheit oder eines Zustandes nahe legen, welche eine Kontraindikation für den Gebrauch der Prüfmedikation darstellen oder die Patientin behandlungsbedingten Risiken aussetzt. 27. Schwangere oder stillende Frauen. 28. Teilnahme in einer anderen klinischen Studie mit einem Prüfmedikament während der Chemotherapie unmittelbar vor der Randomisierung. 29. Patientin, die oral verabreichte Medikamente nicht schlucken kann und Patientin mit gastrointestinalen Erkrankungen, die wahrscheinlich eine Resorption der Studienmedikation beeinträchtigen. 30. Patientin mit bekannter Überempfindlichkeit zu Olaparib oder irgendeines anderen Bestandteils des Produktes 31. Immungeschwächte Patientin, z. B. mit bekannter aktiver Hepatitis (z. B. Hepatitis B oder C) aufgrund des Risikos der Übertragung der Infektion durch Blut oder andere Körperflüssigkeiten, oder Patientin, bei der eine serologisch nachgewiesene HIV-Infektion be- AGO-OVAR 20/PAOLA 1-7 von 16 - EudraCT-Nr
8 kannt ist. STUDIENDESIGN Dies ist eine Phase III, randomisierte, doppel-blinde, Placebo-kontrollierte, multizentrische Studie zur Beurteilung der Wirksamkeit von Olaparib in der Erhaltungstherapie bei Patientinnen, die ein high-grade seröses oder endometrioides fortgeschrittenes Ovarialkarzinom aufweisen (einschließlich Patientinnen mit primärem Peritonealund/oder Tubenkarziom), die auf eine Erstlinien-platintaxan-haltige Chemotherapie plus Bevacizumab angesprochen haben und die eine Erhaltungstherapie mit Bevacizumab für insgesamt 15 Monate erhalten. Etwa 612 Patientinnen werden in einem 2:1 Verhältnis mittels eines IVR/IWR-Systems für die Behandlung randomisiert:: Olaparib Tabletten: oral 300 mg zweimal täglich Placebo Tabletten: oral 300 mg zweimal täglich Geeignete Patientinnen sind solche Patientinnen mit neu diagnostiziertem, histologisch gesichertem, fortgeschrittenem (FIGO Stadium IIIB IV) high-grade serösem oder high-grade endometrioide, (basierend auf den lokalen histologischen Befunden) Ovarial-, primärem Peritonealund/oder Tubenkarzinom haben, die ohne Nachweis der Erkrankung (NED) oder einem klinischen kompletten Ansprechen oder partiellem Ansprechen nach einer abgeschlossenen Erstlinien-platin-taxan-haltigen Chemotherapie plus Bevacizumab zeigen und für die eine Erhaltungstherapie mit Bevacizumab bis zu 15 Monaten geplant ist. Vor der Randomisierung in die Studie: Patientin sollte ohne Nachweis der Erkrankung (NED) sein oder ein vollständiges oder teilweises Ansprechen zeigen. Patientin muss mindestens 6 und maximal 9 Zyklen der Erstlinien-Chemotherapie mit Platin/Paclitaxel beendet haben, einschließlich von mindestens 3 Zyklen Bevacizumab in Kombination mit den letzten 3 Zyklen der Chemotherapie. Sollte die platinhaltige Therapie als Folge einer nichthämatologischen Toxizität vorher beendet werden, die im Zusammenhang mit dem platinhaltigen Regime steht (z.b. Neurotoxizität, Hypersensitivität etc.), muss die Patientin mindestens 4 Zyklen der Platintherapie bekommen haben. Die Patientin wird mindestens 3 Wochen und nicht mehr als 9 Wochen nach der letzten Dosis der Chemotherapie AGO-OVAR 20/PAOLA 1-8 von 16 - EudraCT-Nr
9 randomisiert (letzte Dosis ist der Tag der letzten Infusion) und alle relevanten Nebenwirkungen der vorhergehenden Chemotherapie müssen bis auf einen CTCAE Grad 1 (außer Alopezie und periphere Neuropathie) rückläufig sein. Randomisierungen werden stratifiziert nach: Ergebnis der Erstlinientherapie beim Screening wie nachstehend definiert: kein Nachweis der Erkrankung, NED (*) mit vollständiger makroskopischer Resektion bei der primären Debulking Operation kein Nachweis der Erkrankung, NED/vollständiges Ansprechen (*) mit vollständiger makroskopischer Resektion bei der Intervall Debulking-Operation kein Nachweis der Erkrankung, NED (*) / vollständiges Ansprechen im Screening bei der Patientin, die entweder eine nichtvollständige (bei der primären Debulking- Operation) oder keine Debulking- Operation (**) hatte teilweises Ansprechen tbrca Status im Tumorgewebe: Schädliche Mutationen vorhanden Fehlen einer schädlichen Mutation PRÜFRODUKT, DOSIERUNG UND DARREICHUNGSFORM Anmerkungen: (*) Patientin, die nach der initialen Debulking-Operation ohne beurteilbare Erkrankung ist, wird betrachtet, als habe sie keinen Nachweis der Erkrankung (NED) zum Abschluss der Erstlinien-Chemotherapie und der Operationsstrategie, sofern die Erkrankung nicht progredient ist. Patientin mit messbaren oder beurteilbaren Erkrankungen nach der primären Operation oder zu Beginn einer neoadjuvanten Chemotherapie und solche, deren Erkrankung am Ende der Chemotherapie und der Operationsstrategie nicht mehr nachweisbar ist, wird betrachtet, als hätte sie ein komplettes Ansprechen (CR) erreicht. (**) Debulking-Operation wird als nicht durchführbar betrachtet. Olaparib ist als grüne Filmtablette erhältlich entweder mit 150 mg oder 100 mg Olaparib. Der Patientin wird die Studienmedikation oral verabreicht bei einer Dosierung von 300 mg zweimal am Tag (bid). Die geplante Dosis von 300 mg bid wird aus zwei 150 mg Tabletten bid zusammengesetzt. 100 mg Tabletten werden bei Dosisreduktion ver- AGO-OVAR 20/PAOLA 1-9 von 16 - EudraCT-Nr
10 wendet. Olaparib wird als Studienware zur Verfügung gestellt VERGLEICHSPRÄPARAT; DOSIS UND DARREICHUNGSFORM BEHANDLUNGSDAUER STATISTISCHE AUSWERTUNG Das Placebo wird als grüne Filmtablette angepasst an die Olaparib-Tablette erhältlich sein. Diese soll analog den Anweisungen für die Olaparib-Tabletten eingenommen werden. Placebo wird als Studienware zur Verfügung gestellt. Die Patientin soll die Studienmedikation für bis zu 2 Jahre erhalten oder bis ein radiologisches Fortschreiten der Erkrankung nach RECIST vom Prüfarzt bewertet wurde oder nicht irgendwelche anderen Abbruchkriterien erfüllt werden. Die Patientin kann die Therapie bis zum RECIST- Progress ungeachtet eines Anstiegs des CA-125 fortführen. Sobald die Patientin die Studienbehandlung abgebrochen hat, liegen andere Behandlungsmöglichkeiten im Ermessen des Prüfarztes. Eine Entblindung ist weder für die Patientin noch für Prüfärzte routinemäßig vor der finalen Auswertung zum Gesamtüberleben (OS) vorgesehen. 1 Primäre Wirksamkeitsauswertung Der primäre Endpunkt ist das progressionsfreie Überleben (PFS1) definiert als Zeit zwischen der Randomisierung bis zum ersten dokumentierten Progress (gemäß RECIST 1.1) oder Tod jeglicher Ursache, je nachdem was zuerst zutrifft. PFS1 wird nach der Kaplan-Meier-Methode berechnet und wird für das mediane PFS1 je Arm, sowie die Hazard Ratio für die Progression zwischen den beiden Armen beschrieben. Ein assoziiertes 2-seitiges 95% Konfidenzintervall (CI) ist vorgesehen. Die PFS1-Verteilung wird zwischen den 2 Studienarmen unter Hinzunahme eines zweiseitigen Log-Rank-Tests (Signifikanzniveau von 5 %) stratifiziert nach dem Ansprechen auf die Erstlinienbehandlung und den BRCA-Status, mit Unterstützung eines stratifizierten Cox- Regressionsmodells verglichen. Diese finale Auswertung wird durchgeführt, wenn 372 PFS1-- Ereignisse aufgetreten sind. 2 Zwischenauswertung Sicherheit Das Verträglichkeitsprofil wird bei den ersten 42 eingeschlossenen Patientinnen evaluiert, die in einer 2:1 Randomisierung kontinuierlich zweimal täglich oral Olaparib AGO-OVAR 20/PAOLA 1-10 von 16 - EudraCT-Nr
11 (300 mg Tabletten zweimal täglich) oder Placebo erhalten und in der Erhaltungstherapie mit intravenösem Bevacizumab bei einer festen Dosis (15 mg/kg) alle 21 Tage behandelt werden. Die Sicherheits-Zwischenauswertung wird nach 42 Patientinnen durchgeführt, die 2 Behandlungszyklen erhalten haben (dreiwöchentlicher Zyklus). Die Daten der Zwischenauswertung werden vom IDMC geprüft, welches Empfehlungen zur Fortführung der klinischen Prüfung bezüglich der Sicherheit an den Sponsor ARCAGY-GINECO geben wird, Wirksamkeit Eine Zwischenauswertung für PSF1 wird durchgeführt, wenn ungefähr 50% (187 Ereignisse) der finalen PFS1- Ereignisse erreicht worden sind. Die Zwischenauswertung und der Datenreview werden vom Independent Data Management Committee (IDMC) durchgeführt; Details dazu sind in der IDMC Charta beschrieben. Das IDMC verwendet die durch die Interims-p-Werte definierten Schranken für die Wirksamkeit als Richtlinien, um unter Berücksichtigung aller weiteren relevanten Studieninformationen, einschließlich der Sicherheitsdaten, zu entscheiden ob die Studie wie geplant fortgeführt werden kann. Um für die Überlegenheitszwischenauswertung zu adjustieren, wird die Methodik von Lan und DeMets herangezogen, welche die O Brien und Fleming alpha-spending function approximiert (Lan and DeMets 1983), um den Typ I- Fehler zu kontrollieren. Das zweiseitige Signifikanzniveau in der Zwischenauswertung wird basierend auf der Anzahl der zur Zwischenauswertung beobachteten Ereignisse berechnet. Als Beispiel: wenn genau 50% der finalen Anzahl an Todesfällen zur Zwischenauswertung erreicht sind, dann wird das Signifikanzniveau bei der Zwischenauswertung bei 0.3% liegen. Unter Berücksichtigung der erwartete Korrelation zwischen den Anteilen der Ereignisse zur Zwischen- und finalen Auswertung wird dann das zweiseitige Signifikanzniveau für die finale Auswertung bei ca. 4,9% liegen (das finale Signifikanzniveau wird ermittelt werden, wenn die genaue Korrelation bekannt ist). 3 - Sekundärauswertung Zeit von der Randomisierung bis zur zweiten Progression (PFS2) und Auswertung des Gesamtüberlebens Das PFS2 und das Gesamtüberleben (OS) wird durch die Kaplan-Meier Methode ermittelt werden, und wird zwischen den beiden Armen mit einem zweiseitigen Signifikanzniveau von 5% (Log-Ranktest unterstützt von einer stratifizierten Cox Regression) verglichen -. Um den Typ I-Fehler stärker zu kontrollieren, wird ein AGO-OVAR 20/PAOLA 1-11 von 16 - EudraCT-Nr
12 mehrfaches Testverfahren angewendet: einer hierarchisch getesteten Strategie folgend; wird PFS zuerst getestet, das PSF2 wird nur getestet, wenn die Null Hypothese für das PFS verworfen wird, und dann wird das Gesamtüberleben (OS) nur getestet, wenn die statistische Signifikanz für PFS und PFS2 gezeigt ist. In der gleichen Weise wie für die PFS1-Auswertung wird für alle geplanten Zwischen- und Endauswertungen für das PFS2 und das Gesamtüberleben (OS), die Herangehensweise von Lan und DeMet Herangehensweise mit den O Brien-Fleming- Grenzen (konservatives Konzept) verwendet werden, um den Typ I-Fehler stärker zu kontrollieren. Eine Zwischenauswertung für das PFS2 und das Gesamtüberleben (OS) wird zum Zeitpunkt der finalen PFS1- Auswertung durchgeführt (372 PFS Ereignisse, ca. 289 PFS2 Ereignisse werden zu diesem Zeitpunkt erwartet) unter Verwendung einer Lan-DeMets alpha aufwendenden Funktionsweise mit O Brien-Fleming Grenzen (konservatives Konzept). Eine weitere Auswertung des PFS2- und des Gesamtüberlebens wird durchgeführt, wenn die PFS2-Daten zu ca. 54% erreicht sind (ca. 329 Ereignisse); dies wird bei etwa 52 Monaten nach Einschluss der ersten Patientin in die Studie (FSI) erwartet. Eine finale Aktualisierung der Gesamtüberlebensergebnisse wird durchgeführt, wenn ca. 60% der Gesamtüberlebensdaten erreicht sind. Auswertung der Zeit bis zum frühesten Progress oder Tod, TFST, TSST Die Zeit bis zum ersten Progress nach RECIST oder CA- 125 oder Tod, TFST und TSST wird analysiert unter Verwendung der gleichen Methoden wie für die finale Haupt- PSF1-Auswertung beschrieben. Es werden keine mehrfachen Anpassungen durchgeführt, da diese Kriterien als unterstützende sekundäre Endpunkte betrachtet werden. Auswertung der Patient Reported Outcomes Lebensqualität (QoL) wird deskriptiv analysiert. Deskriptive Statistiken, Grafiken und Listen werden erstellt, um die Wirkung der Olaparib-Erhaltungstherapie nach Symptomen, HRQoL und PROs zu bewerten. Die Relation zwischen Patient Reported Outcomes, dem Fortschreiten der Erkrankung und den unerwünschten Ereignissen (AE) wird evaluiert. AGO-OVAR 20/PAOLA 1-12 von 16 - EudraCT-Nr
13 Pharmaökonomische Auswertung Geeignete Auswertungen zur Ressourcennutzung, einschließlich der Hospitalisierungen und deren Gründe, werden vorgenommen, um den Einfluss der Erkrankung und der Behandlung nach der Ressourcennutzung zur primären Unterstützung der ökonomischen Auswertung von Olaparib plus Bevacizumab zu untersuchen. Auswertung der Sicherheitsdaten Die Beurteilung der Sicherheit wird hauptsächlich auf der Häufigkeit der unerwünschten Ereignisse (AE) basieren. Deskriptive Statistiken werden für die Charakterisierung und beurteilende Patiententoleranz zur Behandlung erstellt. Unerwünschte Ereignisse von besonderem Interesse speziell für Olaparib sollten zusammen mit der auf der Sicherheitsauswertung basierenden Zuordnung der Organsystemklassen analysiert werden. Die Dauer der Sicherheitsauswertung wird festgelegt als Zeitraum von der ersten Dosis der Studienmedikation bis 30 Tage nach dem Ende der letzten Studienbehandlung. AGO-OVAR 20/PAOLA 1-13 von 16 - EudraCT-Nr
14 ÜBERSICHT: Screening und Behandlungsbeginn vor Screening- Beginn innerhalb 28 Tage vor Randomisierung Aufklärung/ Einholung der Einwilligungserklärung a Anamnese b innerhalb 7 Tage vor Randomisierung vor der 1. Dosisgabe Ein-/ Ausschlusskriterien FIGO-Stadium (Klassifikation von 1988) Zeitpunkt der Debulking- Operation (initial oder Intervall) Makroskopischer c Resttumor (ja oder nein) nach Debulking-Operation archivierte Tumorprobe (verpflichtend) BRCA-Mutationsstatus des Tumors Tumorbeurteilung (CT o- der MRT der Brust und des Abdomens/Beckens) und Beurteilung nach der Erstlinientherapie (NED, CR, PR) Körpergewicht, Größe, Blutdruck körperliche Untersuchung, ECOG Performance Status (0-1) EKG Hämatologie / Koagulation d / Serum-Biochemie e CA-125 RANDOMISIEURNG BEHANDLUNG Urinanalyse Kondition zur Baseline (Pathologie, Symptome, zurückgehende Toxizitäten) Behandlungen, die sich auf ein SAE beziehen Begleitmedikation (einschließlich CYP3A4- Inhibitoren und Induktoren) Schwangerschaftstest (sofern zutreffend) Blutprobe für die Biomarkerauswertung (verpflichtend) Lebensqualität (EQ-5D- 5L) Blutentnahme für Metabolom-Substudie Onkogeriatrische Fragebögen (ADL, IADL, HADS), für Patientin > 70 Jahre a einschließlich Patienteninformation und Einwilligungserklärung für die Metabolom-Substudie b einschließlich prolongierter Hämatotoxizitäten (> 2 Wochen) während der Erstlinien-Chemotherapie, myelodysplastisches Syndrom oder akut myeloische Leukämie in der Anamnese c Makroskopisch: für den Operateur sichtbar c Koagulation: aptt, INR e Biochemische Tests: Albumin, Kreatinin, Gesamt-Bilirubin, Laktat-Dehydrogenase (LDH), Aspartat- (AST) und Alanin-Aminotransferase (ALT), Alkalische Phosphatase (ALP) AGO-OVAR 20/PAOLA 1-14 von 16 - EudraCT-Nr
15 ÜBERSICHT: Zeitplan der Untersuchungen nach der Randomisierung Visiten Nummer Randomisierung Tag Studienbehandlung Folgende Behandlungsbesuche Tag 1 des nächsten Besuchs alle 3 Wochen während der ersten 6 Monate oder bei Behandlungsende Tag 1 des nächsten Besuchs alle 6 Wochen von Monat 6 bis zu 2 Jahren oder bei Behandlungsende Nach der Studienbehandlung Ende der Studienbehandlung Sicherheits- Follow-Up- Besuch Follow-Up für PFS 1 Besuche alle 12 Wochen bis zu 3 Jahren Progression 1 (PFS1) Tests (optional) Follow- Up für PFS Tage nach der letzten Behandlung Follow- Up im Ermessen des Prüfers PFS2 Follow-Up für das Gesamtüberleben Follow-Up im Ermessen des Prüfers Zeitfenster ± 1Tag ± 3 Tage ± 7 Tage ± 7 Tage ± 3 Tage ± 7 Tage ± 7 Tage ± 7 Tage Körperliche Untersuchung, ECOG Vitalzeichen (einschließlich Blutdruck), Körpergewicht EKG ab Urinanalyse c a Hämatologie/ a Blutproben für die Biomarkerauswertung vor Behandlungsbeginn (verpflichtend) Unerwünschte Ereignisse CTCAE Grad 2 oder klinisch signifikant Grad 1 a Tumorbeurteilung Bestimmung der Lebensqualität (EQ-5D-5L, EORTC QLQ-C30 und OV-28)) CA-125 a alle 12 Wo. alle 12 Wo. alle 12 Wo. erheben CT/MRT alle 24 Wo. f alle 24 Wo f alle 24 Wo. f erheben h alle 12 Wo. h alle 12 Wo. h alle 12 für für 2 Jahre Wo. h für der 2 Jahre 2 Jahre alle 12 Wo. h für 2 Jahre AGO-OVAR 20/PAOLA 1-15 von 16 - EudraCT-Nr
16 Onkogeriatrische Fragebögen (ADL, IADL, HADS), wenn Patientinnen 70 Jahre Pharmakoökonomie (Hospitalisierungen, medizinische Besuche) l für 2 Jahre für 2 Jahre Begleitmedikation Olaparib/ Placebo j zweimal täglich Toxizitäten von Interesse (Myelodysplastisches Syndrome, akute Leukämie, Zweitmalignom) Blutproben für Metabolom- Substudie l Tumor-/Aszitesproben 'nach Progress (optional) k Blutproben nach Progress (optional) Weitere Krebstherapien Gesamtüberleben für 2 Jahre für 2 Jahre a Untersuchungen, die wiederholt werden müssen, wenn sie nicht 7 Tage vor Behandlungsbeginn gemacht wurden. b Untersuchungen, die während der Behandlung wiederholt werden müssen, falls klinisch indiziert. c Zur Baseline, während der Bevacizumab-Behandlung und nach dem Behandlungsende von Bevacizumab, falls klinisch indiziert d Koagulation: aptt, INR e Biochemische Test: - nur beim Screening: Albumin und Laktat-Dehydrogenase (LDH) - beim Screening und während der Studienbehandlung: Kreatinin, Gesamt-Bilirubin, Alkalische Phosphatase (ALP), Aspartat-Aminotransferase (AST) und Alanin-Aminotransferase (ALT)) f CT/MRT muss systematisch alle 24 Wochen gemacht werden oder an den geplanten 12-wöchigen Intervallbesuchen, wenn es einen Verdacht auf Progression (PD) gibt, wie klinischer Progress und/oder CA-125 Anstieg nach GCIG Kriterien, z.b. wenn der CA-125 sich zum Ausgangswert verdoppelt oder über den Normalwert steigt. Es wird nicht empfohlen, den CA-125 Wert außerhalb der Besuche zur Tumorbeurteilung zu bewerten. g Nach 3 Jahren sollen die körperliche Untersuchung, der CA-125, CT /MRT, wie nachfolgend beschrieben, durchgeführt werden: - alle 6 Monate von Jahr 3 bis Jahr 5 - jährlich von Jahr 5 bis zum Studienende h Fragebögen werden alle 12 Wochen eingesammelt, am besten bevor die Patientin die Ergebnisse der Tumorbeurteilung erhält, innerhalb von 2 Jahren gerechnet ab der ersten Gabe der Studienmedikation. i Fragebögen sollen vor dem Behandlungsbeginn ausgefüllt werden. j Die Studienbehandlung muss innerhalb von 7 Tagen nach Randomisierung beginnen. k bei Indikation zu Aszitespunktion/-drainage oder Gewinnung von Tumorgewebeproben (z.b. Biopsie für die Diagnose eines Rezidivs oder bei Rezidiv-OP) l 6 Wochen und 6 Monate nach Beginn der Therapie AGO-OVAR 20/PAOLA 1-16 von 16 - EudraCT-Nr
1. Neoadjuvante Therapie. 2. Adjuvante Therapie. 3. Metastasiertes Mamma-Ca. 4. Mamma-Ca. in der Schwangerschaft. 5. Nicht-interventionelle Studien
 1. Neoadjuvante Therapie GeparOcto-Studie Penelope-Studie 2. Adjuvante Therapie GAIN II-Studie Katherine-Studie TREAT CTC-Studie OLYMPIA Studie 3. Metastasiertes Mamma-Ca. First-line Therapie: Ab Second-line
1. Neoadjuvante Therapie GeparOcto-Studie Penelope-Studie 2. Adjuvante Therapie GAIN II-Studie Katherine-Studie TREAT CTC-Studie OLYMPIA Studie 3. Metastasiertes Mamma-Ca. First-line Therapie: Ab Second-line
AGO-OVAR 19 / TRUST. (platinfreies Intervall 6-12 Monate) Intermediär-platinsensibles Rezidiv. Erstdiagnose FIGO IIIB-IV
 Ovarialkarzinom Aktuelle Studien in der Klinik für Gynäkologie des UKE Kontakt Studiensekretariat: Sylke Krenkel (040/7410-57970, skrenkel@uke.de) Stand juni 2017 Intermediär-platinsensibles Rezidiv (platinfreies
Ovarialkarzinom Aktuelle Studien in der Klinik für Gynäkologie des UKE Kontakt Studiensekretariat: Sylke Krenkel (040/7410-57970, skrenkel@uke.de) Stand juni 2017 Intermediär-platinsensibles Rezidiv (platinfreies
Aktuelle Aspekte der PARP-Inhibition: Wer profitiert, wer nicht?
 Ovarialkarzinom State of the Art AGO-Symposium Aktuelle Aspekte der PARP-Inhibition: Wer profitiert, wer nicht? Pauline Wimberger Klinik und Poliklinik für Gynäkologie und Geburtshilfe Technische Universität
Ovarialkarzinom State of the Art AGO-Symposium Aktuelle Aspekte der PARP-Inhibition: Wer profitiert, wer nicht? Pauline Wimberger Klinik und Poliklinik für Gynäkologie und Geburtshilfe Technische Universität
Ausfüllanleitung. zum indikationsspezifischen Datensatz. für das strukturierte Behandlungsprogramm KHK
 Ausfüllanleitung zum indikationsspezifischen Datensatz für das strukturierte Behandlungsprogramm KHK Stand der letzten Bearbeitung: 10-11-2014 Version 4.1 Anamnese- und Befunddaten Angina pectoris Bitte
Ausfüllanleitung zum indikationsspezifischen Datensatz für das strukturierte Behandlungsprogramm KHK Stand der letzten Bearbeitung: 10-11-2014 Version 4.1 Anamnese- und Befunddaten Angina pectoris Bitte
Rezidiv eines invasiven eptihelialem Ovarial-, Tuben- oder primären Peritonealkarzinom
 STUDIENÜBERSICHT Laufende Studien Sphero NEO: (Brustzentrum) Neoadjuvant Mamma-CA Kurzbeschreibung: prospektive Kohortenstudie zur Prädiktion des Effektes der medikamentösen Therapie am multizellulären
STUDIENÜBERSICHT Laufende Studien Sphero NEO: (Brustzentrum) Neoadjuvant Mamma-CA Kurzbeschreibung: prospektive Kohortenstudie zur Prädiktion des Effektes der medikamentösen Therapie am multizellulären
Ovarialkarzinom Aktuelle Studien in der Klinik für Gynäkologie des UKE Kontakt Studiensekretariat: Sylke Krenkel (040/ ,
 Ovarialkarzinom Aktuelle Studien in der Klinik für Gynäkologie des UKE Kontakt Studiensekretariat: Sylke Krenkel (040/7410-57970, skrenkel@uke.de) Stand Dezember 2017, A.Jaeger 1 Erstdiagnose FIGO IIIB-IV
Ovarialkarzinom Aktuelle Studien in der Klinik für Gynäkologie des UKE Kontakt Studiensekretariat: Sylke Krenkel (040/7410-57970, skrenkel@uke.de) Stand Dezember 2017, A.Jaeger 1 Erstdiagnose FIGO IIIB-IV
Screening Das Programm. zur Früherkennung von Brustkrebs
 Mammographie Screening Das Programm zur Früherkennung von Brustkrebs das Mammographie Screening Programm Wenn Sie zwischen 50 und 69 Jahre alt sind, haben Sie alle zwei Jahre Anspruch auf eine Mammographie-Untersuchung
Mammographie Screening Das Programm zur Früherkennung von Brustkrebs das Mammographie Screening Programm Wenn Sie zwischen 50 und 69 Jahre alt sind, haben Sie alle zwei Jahre Anspruch auf eine Mammographie-Untersuchung
Avastin First-Line Überzeugendes Therapiekonzept bei fortgeschrittenem Nierenzellkarzinom
 Prof. Dr. Gerald Mickisch: Avastin First-Line - Überzeugendes Therapiekonzept bei fortgeschrittenem Ni Avastin First-Line Überzeugendes Therapiekonzept bei fortgeschrittenem Nierenzellkarzinom Von Prof.
Prof. Dr. Gerald Mickisch: Avastin First-Line - Überzeugendes Therapiekonzept bei fortgeschrittenem Ni Avastin First-Line Überzeugendes Therapiekonzept bei fortgeschrittenem Nierenzellkarzinom Von Prof.
WAS finde ich WO im Beipackzettel
 WAS finde ich WO im Beipackzettel Sie haben eine Frage zu Ihrem? Meist finden Sie die Antwort im Beipackzettel (offiziell "Gebrauchsinformation" genannt). Der Aufbau der Beipackzettel ist von den Behörden
WAS finde ich WO im Beipackzettel Sie haben eine Frage zu Ihrem? Meist finden Sie die Antwort im Beipackzettel (offiziell "Gebrauchsinformation" genannt). Der Aufbau der Beipackzettel ist von den Behörden
Erläutern Sie, wie Sie eine klinische Untersuchung der weiblichen Brust durchführen würden!
 1 Tumor Übungsfall 00444 Fallbeschreibung 63-jährige Patientin. Ihr war eine Veränderung an der linken Mamille erstmalig vor zwölf Monaten aufgefallen, die mit einer leichten Rötung und gelegentlicher
1 Tumor Übungsfall 00444 Fallbeschreibung 63-jährige Patientin. Ihr war eine Veränderung an der linken Mamille erstmalig vor zwölf Monaten aufgefallen, die mit einer leichten Rötung und gelegentlicher
Patienteninformation: Gentestung bei familiärem Brust- und Eierstockkrebs (Basis-Information):
 Frauenklinik Gynäkologie und Gynäkologische Onkologie Patienteninformation: Gentestung bei familiärem Brust- und Eierstockkrebs (Basis-Information): Universitätsspital Basel Frauenklinik PD Dr. med. Nicole
Frauenklinik Gynäkologie und Gynäkologische Onkologie Patienteninformation: Gentestung bei familiärem Brust- und Eierstockkrebs (Basis-Information): Universitätsspital Basel Frauenklinik PD Dr. med. Nicole
CHECKLISTE zur Beauftragung einer BRCA1/2-Mutationsanalyse bei gesetzlich krankenversicherten Patientinnen
 Dr. med. Markus Tiemann Dr. med. Christoph Schulte Prof. Dr. med. Katharina Tiemann Fachärzte für Pathologie und Molekularpathologie Institut für Hämatopathologie Postfach 54 06 40 22506 Hamburg CHECKLISTE
Dr. med. Markus Tiemann Dr. med. Christoph Schulte Prof. Dr. med. Katharina Tiemann Fachärzte für Pathologie und Molekularpathologie Institut für Hämatopathologie Postfach 54 06 40 22506 Hamburg CHECKLISTE
Corpus uteri. 3.4 Corpus uteri
 77 Corpus uteri 3.4 Corpus uteri Das Korpuskarzinom ist nach Brust- und Darmkrebs gleich häufig wie Tumoren der Atmungsorgane und somit die dritthäufigste Krebserkrankung der Frau in Deutschland, die allerdings
77 Corpus uteri 3.4 Corpus uteri Das Korpuskarzinom ist nach Brust- und Darmkrebs gleich häufig wie Tumoren der Atmungsorgane und somit die dritthäufigste Krebserkrankung der Frau in Deutschland, die allerdings
Patientenleitfaden für das Gespräch mit dem Arzt. Liebe Patientin, lieber Patient!
 Patientenleitfaden für das Gespräch mit dem Arzt Liebe Patientin, lieber Patient! Je besser Sie sich auf das Gespräch mit Ihrem Arzt vorbereiten, desto leichter wird es für sie/ihn sein, eine Diagnose
Patientenleitfaden für das Gespräch mit dem Arzt Liebe Patientin, lieber Patient! Je besser Sie sich auf das Gespräch mit Ihrem Arzt vorbereiten, desto leichter wird es für sie/ihn sein, eine Diagnose
Diese Broschüre fasst die wichtigsten Informationen zusammen, damit Sie einen Entscheid treffen können.
 Aufklärung über die Weiterverwendung/Nutzung von biologischem Material und/oder gesundheitsbezogen Daten für die biomedizinische Forschung. (Version V-2.0 vom 16.07.2014, Biobanken) Sehr geehrte Patientin,
Aufklärung über die Weiterverwendung/Nutzung von biologischem Material und/oder gesundheitsbezogen Daten für die biomedizinische Forschung. (Version V-2.0 vom 16.07.2014, Biobanken) Sehr geehrte Patientin,
Antikoagulation 2012: alles anders?
 Antikoagulation 2012: alles anders? Ärztekongress Arosa 24. März 2012 (Etzel Gysling) Neue Antikoagulantien Wo und wofür sind sie aktuell zugelassen? Seit 2011 sind neue Studienresultate und eine neue
Antikoagulation 2012: alles anders? Ärztekongress Arosa 24. März 2012 (Etzel Gysling) Neue Antikoagulantien Wo und wofür sind sie aktuell zugelassen? Seit 2011 sind neue Studienresultate und eine neue
Brust- oder Eierstockkrebs in der Familie
 Brust- oder Eierstockkrebs in der Familie Informieren Sie sich über Ihr Risiko, an erblich bedingtem Brust- oder Eierstockkrebs zu erkranken und erfahren Sie, wie Sie das Risiko reduzieren können. Gibt
Brust- oder Eierstockkrebs in der Familie Informieren Sie sich über Ihr Risiko, an erblich bedingtem Brust- oder Eierstockkrebs zu erkranken und erfahren Sie, wie Sie das Risiko reduzieren können. Gibt
Patienteninformationsbroschüre Valproat
 Patienteninformationsbroschüre Valproat Informationen für Patientinnen Die Informationen in dieser Broschüre sind für Frauen bestimmt, denen Valproat verschrieben wird und die schwanger werden können (Frauen
Patienteninformationsbroschüre Valproat Informationen für Patientinnen Die Informationen in dieser Broschüre sind für Frauen bestimmt, denen Valproat verschrieben wird und die schwanger werden können (Frauen
Minimale Resterkrankung, Hochdurchsatz-Sequenzierung und Prognose beim multiplen Myelom
 Minimale Resterkrankung, Hochdurchsatz-Sequenzierung und Prognose beim multiplen Myelom Von Navneet Ramesh und Maike Haehle, übersetzt von Sabine Schock Vom 8. Apr 2014 7:41 Uhr; aktualisiert am 8. Apr
Minimale Resterkrankung, Hochdurchsatz-Sequenzierung und Prognose beim multiplen Myelom Von Navneet Ramesh und Maike Haehle, übersetzt von Sabine Schock Vom 8. Apr 2014 7:41 Uhr; aktualisiert am 8. Apr
Monitoring adjuvanter Therapiekonzepte des Mammakarzinoms durch ein Klinisches Krebsregister
 Monitoring adjuvanter Therapiekonzepte des Mammakarzinoms durch ein G. Wegener 1, H. Umgelter 1, F. Papendorf 1, B. Günther 1, G. Unger 3, B. Dlugosch 3, H. Kühnle 2 1:, Tumorzentrum, 2:, Frauenklinik,
Monitoring adjuvanter Therapiekonzepte des Mammakarzinoms durch ein G. Wegener 1, H. Umgelter 1, F. Papendorf 1, B. Günther 1, G. Unger 3, B. Dlugosch 3, H. Kühnle 2 1:, Tumorzentrum, 2:, Frauenklinik,
Häufig wiederkehrende Fragen zur mündlichen Ergänzungsprüfung im Einzelnen:
 Mündliche Ergänzungsprüfung bei gewerblich-technischen und kaufmännischen Ausbildungsordnungen bis zum 31.12.2006 und für alle Ausbildungsordnungen ab 01.01.2007 Am 13. Dezember 2006 verabschiedete der
Mündliche Ergänzungsprüfung bei gewerblich-technischen und kaufmännischen Ausbildungsordnungen bis zum 31.12.2006 und für alle Ausbildungsordnungen ab 01.01.2007 Am 13. Dezember 2006 verabschiedete der
Intraoperative Strahlentherapie bei Brustkrebs
 Intraoperative Strahlentherapie bei Brustkrebs Uniklinik Köln 1 Kein Grund für Verzweiflung Wenn die Diagnose Brustkrebs festgestellt wird, ist erst einmal die Sorge groß. Beruhigend zu wissen, dass es
Intraoperative Strahlentherapie bei Brustkrebs Uniklinik Köln 1 Kein Grund für Verzweiflung Wenn die Diagnose Brustkrebs festgestellt wird, ist erst einmal die Sorge groß. Beruhigend zu wissen, dass es
Indikationserweiterungen für JANUVIA (Sitagliptin, MSD) in der EU - Kombination mit Sulfonylharnstoff n
 Indikationserweiterungen für JANUVIA (Sitagliptin, MSD) in der EU Kombination mit Sulfonylharnstoff nun ebenfalls zugelassen Haar (März 2008) - Die europäische Arzneimittelbehörde EMEA hat JANUVIA für
Indikationserweiterungen für JANUVIA (Sitagliptin, MSD) in der EU Kombination mit Sulfonylharnstoff nun ebenfalls zugelassen Haar (März 2008) - Die europäische Arzneimittelbehörde EMEA hat JANUVIA für
Ausfüllanleitung. zum indikationsspezifischen Datensatz. für das strukturierte Behandlungsprogramm. Asthma bronchiale
 Ausfüllanleitung zum indikationsspezifischen Datensatz für das strukturierte Behandlungsprogramm Asthma bronchiale Stand der letzten Bearbeitung: 20.11.2012 Version 4.2 Anamnese- und Befunddaten Häufigkeit
Ausfüllanleitung zum indikationsspezifischen Datensatz für das strukturierte Behandlungsprogramm Asthma bronchiale Stand der letzten Bearbeitung: 20.11.2012 Version 4.2 Anamnese- und Befunddaten Häufigkeit
Medikament zur Behandlung der Muskeldystrophie Duchenne jetzt in Deutschland VERFÜGBAR:
 München, den 08.01.2015 Medikament zur Behandlung der Muskeldystrophie Duchenne jetzt in Deutschland VERFÜGBAR: TRANSLARNA TM mit dem Wirkstoff Ataluren Liebe Patienten, liebe Eltern, In einem Schreiben
München, den 08.01.2015 Medikament zur Behandlung der Muskeldystrophie Duchenne jetzt in Deutschland VERFÜGBAR: TRANSLARNA TM mit dem Wirkstoff Ataluren Liebe Patienten, liebe Eltern, In einem Schreiben
BAnz AT 25.04.2014 B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Sandoz Pharmaceuticals AG
 Die Pille danach. Was ist eine Notfallverhütung oder die sogenannte «Pille danach»? 1 Wann wird NorLevo Uno eingenommen? 2 Bei der «Pille danach» handelt es sich um eine Notfallverhütung, die eine unerwünschte
Die Pille danach. Was ist eine Notfallverhütung oder die sogenannte «Pille danach»? 1 Wann wird NorLevo Uno eingenommen? 2 Bei der «Pille danach» handelt es sich um eine Notfallverhütung, die eine unerwünschte
NUB Antrag 2018/2019 Olaparib
 Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? Dieser Antrag wurde durch die deutsche Gesellschaft für Hämatologie
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? Dieser Antrag wurde durch die deutsche Gesellschaft für Hämatologie
Übersicht Verständnisfragen
 Übersicht Verständnisfragen Herz-Kreislauf-Erkrankungen Chronisch-obstruktive Lungenerkrankung (COPD) Übergewicht und Adipositas Diabetes mellitus Krebserkrankungen HIV und AIDS Rheumatische Erkrankungen
Übersicht Verständnisfragen Herz-Kreislauf-Erkrankungen Chronisch-obstruktive Lungenerkrankung (COPD) Übergewicht und Adipositas Diabetes mellitus Krebserkrankungen HIV und AIDS Rheumatische Erkrankungen
Postfach 1660. 61406 Oberursel. Versicherungs-Nr.: Zu versichernde Person: Geburtsdatum:
 ALTE LEIPZIGER Leben Postfach 1660 Absender: 61406 Oberursel Versicherungs-Nr.: Zu versichernde Person: Geburtsdatum: Fragebogen zu psychosomatischen und psychischen Störungen/Erkrankungen 1. Welche Erkrankungen
ALTE LEIPZIGER Leben Postfach 1660 Absender: 61406 Oberursel Versicherungs-Nr.: Zu versichernde Person: Geburtsdatum: Fragebogen zu psychosomatischen und psychischen Störungen/Erkrankungen 1. Welche Erkrankungen
Was ist eine gute Klinische Studie - die Sicht der Statistik. Peter Martus Institut für Biometrie und Klinische Epidemiologie
 Was ist eine gute Klinische Studie - die Sicht der Statistik Peter Martus Institut für Biometrie und Klinische Epidemiologie Historisches Beispiel James Lind (1716-1794) entwickelte 1747 als britischer
Was ist eine gute Klinische Studie - die Sicht der Statistik Peter Martus Institut für Biometrie und Klinische Epidemiologie Historisches Beispiel James Lind (1716-1794) entwickelte 1747 als britischer
Welche Unterschiede gibt es zwischen einem CAPAund einem Audiometrie- Test?
 Welche Unterschiede gibt es zwischen einem CAPAund einem Audiometrie- Test? Auch wenn die Messungsmethoden ähnlich sind, ist das Ziel beider Systeme jedoch ein anderes. Gwenolé NEXER g.nexer@hearin gp
Welche Unterschiede gibt es zwischen einem CAPAund einem Audiometrie- Test? Auch wenn die Messungsmethoden ähnlich sind, ist das Ziel beider Systeme jedoch ein anderes. Gwenolé NEXER g.nexer@hearin gp
Sumatriptan Antrag auf Freistellung von der Verschreibungspflicht mit Beschränkungen
 Sumatriptan Antrag auf Freistellung von der Verschreibungspflicht mit Beschränkungen Sachverständigen-Ausschuss für Verschreibungspflicht 62. Sitzung am 13.01.2009 im Bundesinstitut für Arzneimittel- und
Sumatriptan Antrag auf Freistellung von der Verschreibungspflicht mit Beschränkungen Sachverständigen-Ausschuss für Verschreibungspflicht 62. Sitzung am 13.01.2009 im Bundesinstitut für Arzneimittel- und
Berechnung der Erhöhung der Durchschnittsprämien
 Wolfram Fischer Berechnung der Erhöhung der Durchschnittsprämien Oktober 2004 1 Zusammenfassung Zur Berechnung der Durchschnittsprämien wird das gesamte gemeldete Prämienvolumen Zusammenfassung durch die
Wolfram Fischer Berechnung der Erhöhung der Durchschnittsprämien Oktober 2004 1 Zusammenfassung Zur Berechnung der Durchschnittsprämien wird das gesamte gemeldete Prämienvolumen Zusammenfassung durch die
Vertrag zwischen. der AOK Berlin - Die Gesundheitskasse - und der Kassenärztlichen Vereinigung Berlin (KV)
 Vertrag zwischen der AOK Berlin - Die Gesundheitskasse - und der Kassenärztlichen Vereinigung Berlin (KV) über die Abgrenzung, Vergütung und Abrechnung der stationären vertragsärztlichen Tätigkeit 1) Dem
Vertrag zwischen der AOK Berlin - Die Gesundheitskasse - und der Kassenärztlichen Vereinigung Berlin (KV) über die Abgrenzung, Vergütung und Abrechnung der stationären vertragsärztlichen Tätigkeit 1) Dem
Behandlung von Krebsvorstufen. Dr. K. Röder Klinik für Frauenheilkunde und Geburtshilfe
 Behandlung von Krebsvorstufen Dr. K. Röder Klinik für Frauenheilkunde und Geburtshilfe Krebsvorstufen - Was sind Vorstufen von Brustkrebs? - Wie fallen die Krebsvorstufen in der Diagnostik auf? - Welche
Behandlung von Krebsvorstufen Dr. K. Röder Klinik für Frauenheilkunde und Geburtshilfe Krebsvorstufen - Was sind Vorstufen von Brustkrebs? - Wie fallen die Krebsvorstufen in der Diagnostik auf? - Welche
2. Anzahl der Patienten bzw. Abgrenzung der für die Behandlung infrage kommenden Patientengruppen
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Surveillance-Begleitforschungsprojekt des Robert Koch-Instituts: Diagnostik von gleichzeitigen Erkrankungen an HIV/AIDS und Tuberkulose
 Surveillance-Begleitforschungsprojekt des Robert Koch-Instituts: Diagnostik von gleichzeitigen Erkrankungen an HIV/AIDS und Tuberkulose Leitfaden zur Erhebung Ziel der Erhebung Ziel dieser Erhebung ist
Surveillance-Begleitforschungsprojekt des Robert Koch-Instituts: Diagnostik von gleichzeitigen Erkrankungen an HIV/AIDS und Tuberkulose Leitfaden zur Erhebung Ziel der Erhebung Ziel dieser Erhebung ist
Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen:
 BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 06.11.2014 Veronika Iro REGA +43 (0) 505 55 36247 pv-implementation@ages.at
BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 06.11.2014 Veronika Iro REGA +43 (0) 505 55 36247 pv-implementation@ages.at
3.9 Brustdrüse der Frau
 ICD-10 C50 Ergebnisse zur 77 3.9 Brustdrüse der Frau Kernaussagen Inzidenz und Mortalität: Die altersstandardisierte Inzidenz von Krebserkrankungen der weiblichen Brustdrüse (Mammakarzinom) ist seit den
ICD-10 C50 Ergebnisse zur 77 3.9 Brustdrüse der Frau Kernaussagen Inzidenz und Mortalität: Die altersstandardisierte Inzidenz von Krebserkrankungen der weiblichen Brustdrüse (Mammakarzinom) ist seit den
O f f e n e S t u d i e n - August 2013 -
 Sehr geehrte Patientinnen und Angehörige, sehr geehrte Ärztinnen und Ärzte, Klinische Studien zur Behandlung des Ovarial-, Tuben-, Endometrium- und Peritonealkarzinoms: bevor antihormonelle, chemotherapeutische
Sehr geehrte Patientinnen und Angehörige, sehr geehrte Ärztinnen und Ärzte, Klinische Studien zur Behandlung des Ovarial-, Tuben-, Endometrium- und Peritonealkarzinoms: bevor antihormonelle, chemotherapeutische
Task: Nmap Skripte ausführen
 Task: Nmap Skripte ausführen Inhalt Einfache Netzwerkscans mit NSE Ausführen des Scans Anpassung der Parameter Einleitung Copyright 2009-2015 Greenbone Networks GmbH Herkunft und aktuellste Version dieses
Task: Nmap Skripte ausführen Inhalt Einfache Netzwerkscans mit NSE Ausführen des Scans Anpassung der Parameter Einleitung Copyright 2009-2015 Greenbone Networks GmbH Herkunft und aktuellste Version dieses
SGMO - Schweizerische Gesellschaft für medizinische Onkologie
 SGMO - Schweizerische Gesellschaft für medizinische Onkologie Seminar: Neue Medikamente neue Nebenwirkungen Kardiovaskuläre Nebenwirkungen Prof. Thomas M. Suter, Leitender Arzt, Universitätsklink für Kardiologie,
SGMO - Schweizerische Gesellschaft für medizinische Onkologie Seminar: Neue Medikamente neue Nebenwirkungen Kardiovaskuläre Nebenwirkungen Prof. Thomas M. Suter, Leitender Arzt, Universitätsklink für Kardiologie,
Sentinel-Lymphknotenbiopsie beim Korpuskarzinom
 Sentinel-Lymphknotenbiopsie beim Korpuskarzinom Dr. med. Alexander Markus Frauenklinik Kantonsspital St. Gallen Einleitung Typ I: östrogenabhängig (ca. 80%) Endometrioides Adeno-Ca (60% aller Ca) Typ II:
Sentinel-Lymphknotenbiopsie beim Korpuskarzinom Dr. med. Alexander Markus Frauenklinik Kantonsspital St. Gallen Einleitung Typ I: östrogenabhängig (ca. 80%) Endometrioides Adeno-Ca (60% aller Ca) Typ II:
APOTHEKIA SPECIAL DIE PILLE DANACH
 APOTHEKIA SPECIAL DIE PILLE DANACH Die zwei Pillen danach In Deutschland sind aktuell zwei Wirkstoffe für die Pille danach zugelassen, Ulipristalacetat (Handelsname ellaone) und Levonorgestrel (Handelsname
APOTHEKIA SPECIAL DIE PILLE DANACH Die zwei Pillen danach In Deutschland sind aktuell zwei Wirkstoffe für die Pille danach zugelassen, Ulipristalacetat (Handelsname ellaone) und Levonorgestrel (Handelsname
Labortests für Ihre Gesundheit. Therapie nach Maß 26
 Labortests für Ihre Gesundheit Therapie nach Maß 26 01IPF Labortests für Ihre Gesundheit Therapie nach Maß Die individuelle Dosis finden Jeder Mensch ist einzigartig. Keiner gleicht dem anderen nicht nur
Labortests für Ihre Gesundheit Therapie nach Maß 26 01IPF Labortests für Ihre Gesundheit Therapie nach Maß Die individuelle Dosis finden Jeder Mensch ist einzigartig. Keiner gleicht dem anderen nicht nur
B0200 Bösartige Neubildungen (C00 C97)
 B0200 Ambulante Kodierrichtlinien Version 2010 B02 NEUBILDUNGEN B0200 Bösartige Neubildungen (C00 C97) Die Schlüsselnummer(n) für den Primärtumor, den Rezidivtumor und/oder die Metastase(n) sind immer
B0200 Ambulante Kodierrichtlinien Version 2010 B02 NEUBILDUNGEN B0200 Bösartige Neubildungen (C00 C97) Die Schlüsselnummer(n) für den Primärtumor, den Rezidivtumor und/oder die Metastase(n) sind immer
GEVITAS Farben-Reaktionstest
 GEVITAS Farben-Reaktionstest GEVITAS Farben-Reaktionstest Inhalt 1. Allgemeines... 1 2. Funktionsweise der Tests... 2 3. Die Ruhetaste und die Auslösetaste... 2 4. Starten der App Hauptmenü... 3 5. Auswahl
GEVITAS Farben-Reaktionstest GEVITAS Farben-Reaktionstest Inhalt 1. Allgemeines... 1 2. Funktionsweise der Tests... 2 3. Die Ruhetaste und die Auslösetaste... 2 4. Starten der App Hauptmenü... 3 5. Auswahl
Fragen und Antworten zur hämatopoetischen Stammzelle
 Fragen und Antworten zur hämatopoetischen Stammzelle Grundlagen, Indikationen, therapeutischer Nutzen von Rainer Haas, Ralf Kronenwett 1. Auflage Fragen und Antworten zur hämatopoetischen Stammzelle Haas
Fragen und Antworten zur hämatopoetischen Stammzelle Grundlagen, Indikationen, therapeutischer Nutzen von Rainer Haas, Ralf Kronenwett 1. Auflage Fragen und Antworten zur hämatopoetischen Stammzelle Haas
Das große ElterngeldPlus 1x1. Alles über das ElterngeldPlus. Wer kann ElterngeldPlus beantragen? ElterngeldPlus verstehen ein paar einleitende Fakten
 Das große x -4 Alles über das Wer kann beantragen? Generell kann jeder beantragen! Eltern (Mütter UND Väter), die schon während ihrer Elternzeit wieder in Teilzeit arbeiten möchten. Eltern, die während
Das große x -4 Alles über das Wer kann beantragen? Generell kann jeder beantragen! Eltern (Mütter UND Väter), die schon während ihrer Elternzeit wieder in Teilzeit arbeiten möchten. Eltern, die während
Dieser Ablauf soll eine Hilfe für die tägliche Arbeit mit der SMS Bestätigung im Millennium darstellen.
 Millennium SMS Service Schnellübersicht Seite 1 von 6 1. Tägliche Arbeiten mit der SMS Bestätigung Dieser Ablauf soll eine Hilfe für die tägliche Arbeit mit der SMS Bestätigung im Millennium darstellen.
Millennium SMS Service Schnellübersicht Seite 1 von 6 1. Tägliche Arbeiten mit der SMS Bestätigung Dieser Ablauf soll eine Hilfe für die tägliche Arbeit mit der SMS Bestätigung im Millennium darstellen.
Fragebogen zu gynäkologischen Erkrankungen
 Stand 03.2014 ALTE LEIPZIGER ALTE LEIPZIGER Leben Postfach 1660 Absender: 61406 Oberursel Versicherungs-Nr.: Zu versichernde Person: Geburtsdatum: Fragebogen zu gynäkologischen Erkrankungen 1. Welche Erkrankungen
Stand 03.2014 ALTE LEIPZIGER ALTE LEIPZIGER Leben Postfach 1660 Absender: 61406 Oberursel Versicherungs-Nr.: Zu versichernde Person: Geburtsdatum: Fragebogen zu gynäkologischen Erkrankungen 1. Welche Erkrankungen
Richtlinie. des Gemeinsamen Bundesausschusses. zur Umsetzung der Regelungen in 62 für schwerwiegend chronisch Erkrankte ( Chroniker-Richtlinie )
 Richtlinie des Gemeinsamen Bundesausschusses zur Umsetzung der Regelungen in 62 für schwerwiegend chronisch Erkrankte ( Chroniker-Richtlinie ) in der Fassung vom 22. Januar 2004 veröffentlicht im Bundesanzeiger
Richtlinie des Gemeinsamen Bundesausschusses zur Umsetzung der Regelungen in 62 für schwerwiegend chronisch Erkrankte ( Chroniker-Richtlinie ) in der Fassung vom 22. Januar 2004 veröffentlicht im Bundesanzeiger
Untersuchung, Beratung und Vorsorge bei familiärem Brustkrebs
 Untersuchung, Beratung und Vorsorge bei familiärem Brustkrebs 20. Onkologisches Symposium Tumorzentrum Regensburg e.v. Teresa Neuhann MGZ München Einführung Brustkrebs häufigste Tumorerkrankung der Frau
Untersuchung, Beratung und Vorsorge bei familiärem Brustkrebs 20. Onkologisches Symposium Tumorzentrum Regensburg e.v. Teresa Neuhann MGZ München Einführung Brustkrebs häufigste Tumorerkrankung der Frau
Einleitende Bemerkungen
 Einleitende Bemerkungen EU-FORMBLATT LENKFREIE TAGE / KONTROLLGERÄT MANUELLER NACHTRAG ENTSCHEIDUNGSHILFE FÜR FAHRPERSONAL VON VERORDNUNGS-FAHRZEUGEN 1 BEI TÄTIGKEITEN IM INNERSTAATLICHEN VERKEHR Zur Frage,
Einleitende Bemerkungen EU-FORMBLATT LENKFREIE TAGE / KONTROLLGERÄT MANUELLER NACHTRAG ENTSCHEIDUNGSHILFE FÜR FAHRPERSONAL VON VERORDNUNGS-FAHRZEUGEN 1 BEI TÄTIGKEITEN IM INNERSTAATLICHEN VERKEHR Zur Frage,
Moderne MRT-Bildauswertung mit appmri Hippocampus Volume Analyser.
 APPMRI HIPPOCAMPUS VOLUME Moderne MRT-Bildauswertung mit appmri Hippocampus Volume Analyser. Quantitative und zuverlässige Informationen zur Unterstützung bei der Diagnose von Alzheimer Unser Schwerpunkt
APPMRI HIPPOCAMPUS VOLUME Moderne MRT-Bildauswertung mit appmri Hippocampus Volume Analyser. Quantitative und zuverlässige Informationen zur Unterstützung bei der Diagnose von Alzheimer Unser Schwerpunkt
Moderne Behandlung des Grauen Stars
 Katarakt Moderne Behandlung des Grauen Stars Sehr geehrte Patientin, sehr geehrter Patient, Bei Ihnen wurde eine Trübung der Augenlinse festgestellt, die umgangssprachlich auch Grauer Star genannt wird.
Katarakt Moderne Behandlung des Grauen Stars Sehr geehrte Patientin, sehr geehrter Patient, Bei Ihnen wurde eine Trübung der Augenlinse festgestellt, die umgangssprachlich auch Grauer Star genannt wird.
Das BASG / AGES PharmMed
 CMI-WORKSHOP Dipl.-Ing. Meinrad Guggenbichler Institut Inspektionen, Medizinprodukte und Hämovigilanz Das BASG / AGES PharmMed Das Bundesamt für Sicherheit im Gesundheitswesen (BASG) ist die Aufsichtsbehörde
CMI-WORKSHOP Dipl.-Ing. Meinrad Guggenbichler Institut Inspektionen, Medizinprodukte und Hämovigilanz Das BASG / AGES PharmMed Das Bundesamt für Sicherheit im Gesundheitswesen (BASG) ist die Aufsichtsbehörde
Der Gesundheitskompass für die junge Frau
 Haarausfall? Blutentnahme zu Hormonlabor, Eisenwerte, Schilddrüsenwerte, Biotin und Zink 86,87 EURO Wiederholte Scheideninfektionen? Mit dem Vaginalstatus können Infektionen durch spezielle Kulturen auf
Haarausfall? Blutentnahme zu Hormonlabor, Eisenwerte, Schilddrüsenwerte, Biotin und Zink 86,87 EURO Wiederholte Scheideninfektionen? Mit dem Vaginalstatus können Infektionen durch spezielle Kulturen auf
Was ist die XML-OncoBox? Warum brauchen wir sie?
 Was ist die XML-OncoBox? Warum brauchen wir sie? Ausgangspunkt 276 DKG zertifizierte Darmkrebszentren (Stand: 30.09.14) Erfassungssystematik Algorithmen Schutzmechanismen Kennzahlenbogen Matrix Ergebnisqualität
Was ist die XML-OncoBox? Warum brauchen wir sie? Ausgangspunkt 276 DKG zertifizierte Darmkrebszentren (Stand: 30.09.14) Erfassungssystematik Algorithmen Schutzmechanismen Kennzahlenbogen Matrix Ergebnisqualität
Wenn Sie möchten, können Sie den Bogen auch anonym ausfüllen und an folgende Adresse senden:
 Der folgende Fragebogen ist bezogen auf das Krankheitsbild Netzhautablösung / Netzhautabspaltung sowie Riss- oder Lochbildung in der NH. Falls Sie noch keine NHA hatten, sondern nur Risse oder Löcher in
Der folgende Fragebogen ist bezogen auf das Krankheitsbild Netzhautablösung / Netzhautabspaltung sowie Riss- oder Lochbildung in der NH. Falls Sie noch keine NHA hatten, sondern nur Risse oder Löcher in
Osteoporose, Spondylarthropathien
 KLINIK UND POLIKLINIK FÜR INNERE MEDIZIN I Osteoporose, Spondylarthropathien Dr. med. Nadine Schneider Teriparatid oder Alendronat bei Glukokortikoidinduzierter Osteoporose? (Saag et al. NEJM 2007; 357:2028-39)
KLINIK UND POLIKLINIK FÜR INNERE MEDIZIN I Osteoporose, Spondylarthropathien Dr. med. Nadine Schneider Teriparatid oder Alendronat bei Glukokortikoidinduzierter Osteoporose? (Saag et al. NEJM 2007; 357:2028-39)
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Legalon SIL - Trockensubstanz zur Infusionsbereitung
 PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Legalon SIL - Trockensubstanz zur Infusionsbereitung Wirkstoff: Silibinin-C-2,3-bis(hydrogensuccinat), Dinatriumsalz Lesen Sie die gesamte
PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Legalon SIL - Trockensubstanz zur Infusionsbereitung Wirkstoff: Silibinin-C-2,3-bis(hydrogensuccinat), Dinatriumsalz Lesen Sie die gesamte
Tutorial: Homogenitätstest
 Tutorial: Homogenitätstest Eine Bank möchte die Kreditwürdigkeit potenzieller Kreditnehmer abschätzen. Einerseits lebt die Bank ja von der Vergabe von Krediten, andererseits verursachen Problemkredite
Tutorial: Homogenitätstest Eine Bank möchte die Kreditwürdigkeit potenzieller Kreditnehmer abschätzen. Einerseits lebt die Bank ja von der Vergabe von Krediten, andererseits verursachen Problemkredite
IHR PATIENTENDOSSIER IHRE RECHTE
 IHR PATIENTENDOSSIER IHRE RECHTE Im Spital, in der Klinik bestimmen Sie, wie Sie über Ihre Krankheit und deren Behandlung informiert werden wollen und wer informiert werden darf Information Patientendossier
IHR PATIENTENDOSSIER IHRE RECHTE Im Spital, in der Klinik bestimmen Sie, wie Sie über Ihre Krankheit und deren Behandlung informiert werden wollen und wer informiert werden darf Information Patientendossier
Für Patientinnen und Patienten. Blutdruckpass. Die mit dem Regenbogen
 Für Patientinnen und Patienten Blutdruckpass Die mit dem Regenbogen Patientendaten Vorname Name Geburtsdatum Adresse Strasse Hausnummer PLZ Stadt Tel. Nr. Allergien Medikamentenunverträglichkeit Andere
Für Patientinnen und Patienten Blutdruckpass Die mit dem Regenbogen Patientendaten Vorname Name Geburtsdatum Adresse Strasse Hausnummer PLZ Stadt Tel. Nr. Allergien Medikamentenunverträglichkeit Andere
Malignes Melanom. Aktuelles vom amerikanischen Krebskongress 2013
 Malignes Melanom Aktuelles vom amerikanischen Krebskongress 2013 Peter Kurschat Klinik für Dermatologie und Venerologie Centrum für Integrierte Onkologie CIO Mittwoch, 26.06.2013, Köln Wo standen wir vor
Malignes Melanom Aktuelles vom amerikanischen Krebskongress 2013 Peter Kurschat Klinik für Dermatologie und Venerologie Centrum für Integrierte Onkologie CIO Mittwoch, 26.06.2013, Köln Wo standen wir vor
Karten-Freischaltung mit dem UNLOCK MANAGER
 Karten-Freischaltung mit dem UNLOCK MANAGER WICHTIGE INFORMATION 1. Anzahl der Freischaltungen Die Karten können zweimal freigeschaltet werden. (z. B. Map Manager auf PC plus Map Manager auf Laptop oder
Karten-Freischaltung mit dem UNLOCK MANAGER WICHTIGE INFORMATION 1. Anzahl der Freischaltungen Die Karten können zweimal freigeschaltet werden. (z. B. Map Manager auf PC plus Map Manager auf Laptop oder
Künstlicher Hüftgelenksersatz
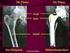 Künstlicher Hüftgelenksersatz Künstlicher Hüftgelenksersatz Was ist eine Hüftgelenk-Arthrose? Das Hüftgelenk ist eine bewegliche Verbindung zwischen dem Becken- und dem Oberschenkelknochen. Die am Gelenk
Künstlicher Hüftgelenksersatz Künstlicher Hüftgelenksersatz Was ist eine Hüftgelenk-Arthrose? Das Hüftgelenk ist eine bewegliche Verbindung zwischen dem Becken- und dem Oberschenkelknochen. Die am Gelenk
Auszug (Seite 16 bis 20)
 Auszug (Seite 16 bis 20) aus der Richtlinie des Gemeinsamen Bundesauschusses zur Regelung von Anforderungen an die Ausgestaltung von Strukturierten Behandlungsprogrammen nach 137f Abs. 2 SGB V (DMP-Richtlinie/DMP-RL)
Auszug (Seite 16 bis 20) aus der Richtlinie des Gemeinsamen Bundesauschusses zur Regelung von Anforderungen an die Ausgestaltung von Strukturierten Behandlungsprogrammen nach 137f Abs. 2 SGB V (DMP-Richtlinie/DMP-RL)
Konfiguration VLAN's. Konfiguration VLAN's IACBOX.COM. Version 2.0.1 Deutsch 01.07.2014
 Konfiguration VLAN's Version 2.0.1 Deutsch 01.07.2014 In diesem HOWTO wird die Konfiguration der VLAN's für das Surf-LAN der IAC-BOX beschrieben. Konfiguration VLAN's TITEL Inhaltsverzeichnis Inhaltsverzeichnis...
Konfiguration VLAN's Version 2.0.1 Deutsch 01.07.2014 In diesem HOWTO wird die Konfiguration der VLAN's für das Surf-LAN der IAC-BOX beschrieben. Konfiguration VLAN's TITEL Inhaltsverzeichnis Inhaltsverzeichnis...
zum Vertrag zur Integrierten Versorgung von Patienten mit der Diagnose Osteoporose im Rheinland gemäß 3 Abs. 5 Buchst. e
 Der Prozess der Ausschreibung eines Versicherten aus diesem Vertrag kann von zwei Akteuren vorgenommen werden. Zum einen vom Vertragsarzt zum anderen von der Krankenkasse. In beiden Fällen muss eine Mitteilung
Der Prozess der Ausschreibung eines Versicherten aus diesem Vertrag kann von zwei Akteuren vorgenommen werden. Zum einen vom Vertragsarzt zum anderen von der Krankenkasse. In beiden Fällen muss eine Mitteilung
NEUE FRAUENKLINIK LUZERN. Brustzentrum Luzern. Herzlich willkommen. Kompetenz, die lächelt.
 NEUE FRAUENKLINIK LUZERN Brustzentrum Luzern Herzlich willkommen Kompetenz, die lächelt. Herzlich willkommen im Brustzentrum! Die weibliche Brust gilt in erster Linie als Symbol der Weiblichkeit und der
NEUE FRAUENKLINIK LUZERN Brustzentrum Luzern Herzlich willkommen Kompetenz, die lächelt. Herzlich willkommen im Brustzentrum! Die weibliche Brust gilt in erster Linie als Symbol der Weiblichkeit und der
Herz in Fahrt: Wer darf noch ans Steuer? Dr. med. D. Enayat Kardiologische Praxis Prof. Reifart & Partner Bad Soden/Hofheim
 Herz in Fahrt: Wer darf noch ans Steuer? Dr. med. D. Enayat Kardiologische Praxis Prof. Reifart & Partner Bad Soden/Hofheim Beurteilung der Fahreignung Kompromiss zwischen dem Wunsch nach Mobilität und
Herz in Fahrt: Wer darf noch ans Steuer? Dr. med. D. Enayat Kardiologische Praxis Prof. Reifart & Partner Bad Soden/Hofheim Beurteilung der Fahreignung Kompromiss zwischen dem Wunsch nach Mobilität und
Interventionelle Behandlung der Aortenklappenstenose
 Innovationsgipfel 07.05.2009 Interventionelle Behandlung der Aortenklappenstenose Prof. Dr. H. Drexler Aortenstenose Aortenstenose: Verengung des Auslassventils der linken Herzkammer Aortenstenose Aortenstenose
Innovationsgipfel 07.05.2009 Interventionelle Behandlung der Aortenklappenstenose Prof. Dr. H. Drexler Aortenstenose Aortenstenose: Verengung des Auslassventils der linken Herzkammer Aortenstenose Aortenstenose
Einrichten einer Festplatte mit FDISK unter Windows 95/98/98SE/Me
 Einrichten einer Festplatte mit FDISK unter Windows 95/98/98SE/Me Bevor Sie die Platte zum ersten Mal benutzen können, muss sie noch partitioniert und formatiert werden! Vorher zeigt sich die Festplatte
Einrichten einer Festplatte mit FDISK unter Windows 95/98/98SE/Me Bevor Sie die Platte zum ersten Mal benutzen können, muss sie noch partitioniert und formatiert werden! Vorher zeigt sich die Festplatte
Erratum Benkert, Pocket Guide, Psychopharmaka von A bis Z. 3.Aufl. ISBN (print): 978-3-642-54766-9/ DOI 10.1007/978-3-642-54767-6
 Erratum Benkert, Pocket Guide, Psychopharmaka von A bis Z. 3.Aufl. ISBN (print): 978-3-642-54766-9/ DOI 10.1007/978-3-642-54767-6 Trotz sorgfältiger Erstellung des Buchs Benkert, Pocket Guide, Psychopharmaka
Erratum Benkert, Pocket Guide, Psychopharmaka von A bis Z. 3.Aufl. ISBN (print): 978-3-642-54766-9/ DOI 10.1007/978-3-642-54767-6 Trotz sorgfältiger Erstellung des Buchs Benkert, Pocket Guide, Psychopharmaka
Richtlinie zur Feststellung und Überwachung des PRRS-Status von Schweinebeständen (PRRS-Richtlinie) Rd. Erl. des MLU vom 27.
 Richtlinie zur Feststellung und Überwachung des PRRS-Status von Schweinebeständen (PRRS-Richtlinie) Rd. Erl. des MLU vom 27. Februar 2004 Anlagen 1. Einleitung Das PRRS-Virus wurde Anfang der 90-iger Jahre
Richtlinie zur Feststellung und Überwachung des PRRS-Status von Schweinebeständen (PRRS-Richtlinie) Rd. Erl. des MLU vom 27. Februar 2004 Anlagen 1. Einleitung Das PRRS-Virus wurde Anfang der 90-iger Jahre
Betroffenes Produkt: PRI Femureinschlägerkopf, 00-5901-032-00 (vollständige Liste der betroffenen Chargen siehe Anhang 1)
 22. Mai 2015 An: Betrifft: Risikomanager und Chirurgen DRINGENDER CHARGENSPEZIFISCHER RÜCKRUF EINES MEDIZINPRODUKTES Betroffenes Produkt: PRI Femureinschlägerkopf, 00-5901-032-00 (vollständige Liste der
22. Mai 2015 An: Betrifft: Risikomanager und Chirurgen DRINGENDER CHARGENSPEZIFISCHER RÜCKRUF EINES MEDIZINPRODUKTES Betroffenes Produkt: PRI Femureinschlägerkopf, 00-5901-032-00 (vollständige Liste der
Prüfungsregeln und Beispiele. Certified Professional for Software Architecture. Foundation Level
 Prüfungsregeln und Beispiele Certified Professional for Software Architecture Foundation Level International Software Architecture Qualification Board e. V. Version: 1.2 Datum: 2011-01-14 Verteilung: öffentlich
Prüfungsregeln und Beispiele Certified Professional for Software Architecture Foundation Level International Software Architecture Qualification Board e. V. Version: 1.2 Datum: 2011-01-14 Verteilung: öffentlich
Zeichen bei Zahlen entschlüsseln
 Zeichen bei Zahlen entschlüsseln In diesem Kapitel... Verwendung des Zahlenstrahls Absolut richtige Bestimmung von absoluten Werten Operationen bei Zahlen mit Vorzeichen: Addieren, Subtrahieren, Multiplizieren
Zeichen bei Zahlen entschlüsseln In diesem Kapitel... Verwendung des Zahlenstrahls Absolut richtige Bestimmung von absoluten Werten Operationen bei Zahlen mit Vorzeichen: Addieren, Subtrahieren, Multiplizieren
Fragebogen zur Anforderungsanalyse
 Fragebogen zur Anforderungsanalyse Geschäftsprozess Datum Mitarbeiter www.seikumu.de Fragebogen zur Anforderungsanalyse Seite 6 Hinweise zur Durchführung der Anforderungsanalyse Bevor Sie beginnen, hier
Fragebogen zur Anforderungsanalyse Geschäftsprozess Datum Mitarbeiter www.seikumu.de Fragebogen zur Anforderungsanalyse Seite 6 Hinweise zur Durchführung der Anforderungsanalyse Bevor Sie beginnen, hier
10 Antworten zum Thema Generika
 10 Antworten zum Thema Generika Die mit dem Regenbogen Liebe Leserin, Lieber Leser Immer mehr Schweizerinnen und Schweizer leiden unter den jährlich steigenden Gesundheitskosten und Krankenkassenprämien.
10 Antworten zum Thema Generika Die mit dem Regenbogen Liebe Leserin, Lieber Leser Immer mehr Schweizerinnen und Schweizer leiden unter den jährlich steigenden Gesundheitskosten und Krankenkassenprämien.
Medizin, Recht, Ethik
 Medizin, Recht, Ethik zwischen Konflikt und Kooperation 17./18. März 2010 Beendigung lebensverlängernder Maßnahmen Dr. Thomas Binsack, München Aufgabe des Arztes ist es, unter Beachtung des Selbstbestimmungsrechtes
Medizin, Recht, Ethik zwischen Konflikt und Kooperation 17./18. März 2010 Beendigung lebensverlängernder Maßnahmen Dr. Thomas Binsack, München Aufgabe des Arztes ist es, unter Beachtung des Selbstbestimmungsrechtes
Ohne Fehler geht es nicht Doch wie viele Fehler sind erlaubt?
 Ohne Fehler geht es nicht Doch wie viele Fehler sind erlaubt? Behandelte Fragestellungen Was besagt eine Fehlerquote? Welche Bezugsgröße ist geeignet? Welche Fehlerquote ist gerade noch zulässig? Wie stellt
Ohne Fehler geht es nicht Doch wie viele Fehler sind erlaubt? Behandelte Fragestellungen Was besagt eine Fehlerquote? Welche Bezugsgröße ist geeignet? Welche Fehlerquote ist gerade noch zulässig? Wie stellt
QR-FUNKTION. Informationen über zu erledigende Aufgaben an das Reinigungspersonal senden.
 QR-FUNKTION Informationen über zu erledigende Aufgaben an das Reinigungspersonal senden. Informationen über erledigte Aufgaben vom Reinigungspersonal erhalten. Verwaltung regelmäßiger Aufgaben Der Hauptzweck
QR-FUNKTION Informationen über zu erledigende Aufgaben an das Reinigungspersonal senden. Informationen über erledigte Aufgaben vom Reinigungspersonal erhalten. Verwaltung regelmäßiger Aufgaben Der Hauptzweck
Synopse AGO OVAR OP.7 TRUST/AGO OVAR 19 nationaler Part / Deutschland
 Synopse Protokolltitel Studie zur primären radikalen Operation bei fortgeschrittenem Ovarialkarzinom Erweiterung für Deutschland mit Evaluation von Fragilität und Langzeit Lebensqualität Protokollnummer
Synopse Protokolltitel Studie zur primären radikalen Operation bei fortgeschrittenem Ovarialkarzinom Erweiterung für Deutschland mit Evaluation von Fragilität und Langzeit Lebensqualität Protokollnummer
Gibt es einen Geschmacksunterschied zwischen Coca Cola und Cola Zero?
 Gibt es einen Geschmacksunterschied zwischen Coca Cola und Cola Zero? Manche sagen: Ja, manche sagen: Nein Wie soll man das objektiv feststellen? Kann man Geschmack objektiv messen? - Geschmack ist subjektiv
Gibt es einen Geschmacksunterschied zwischen Coca Cola und Cola Zero? Manche sagen: Ja, manche sagen: Nein Wie soll man das objektiv feststellen? Kann man Geschmack objektiv messen? - Geschmack ist subjektiv
Diabetes mellitus : Folgeschäden
 Diabetes mellitus : Folgeschäden Warum ist der Diabetes mellitus eine wichtige Erkrankung? a. Akute Probleme: Hypoglykämie Hyperglykämie Ketoazidose b. Chronische Probleme: Folgeschäden: Typische Schäden:
Diabetes mellitus : Folgeschäden Warum ist der Diabetes mellitus eine wichtige Erkrankung? a. Akute Probleme: Hypoglykämie Hyperglykämie Ketoazidose b. Chronische Probleme: Folgeschäden: Typische Schäden:
Studie über die Bewertung von Wissen in kleinen und mittleren Unternehmen in Schleswig-Holstein
 Studie über die Bewertung von Wissen in kleinen und mittleren Unternehmen in Schleswig-Holstein Sehr geehrte Damen und Herren, in der heutigen Wissensgesellschaft sind die zentralen Ressourcen erfolgreicher
Studie über die Bewertung von Wissen in kleinen und mittleren Unternehmen in Schleswig-Holstein Sehr geehrte Damen und Herren, in der heutigen Wissensgesellschaft sind die zentralen Ressourcen erfolgreicher
INFORMATIONEN ZUR NACHSORGE VON ZAHNIMPLANTATEN
 INFORMATIONEN ZUR NACHSORGE VON ZAHNIMPLANTATEN WORIN BESTEHT DIE NACHSORGE? Straumann-Implantate sind eine moderne Möglichkeit für Zahnersatz, wenn ein oder mehrere Zähne fehlen. Diese bekannte und hochwertige
INFORMATIONEN ZUR NACHSORGE VON ZAHNIMPLANTATEN WORIN BESTEHT DIE NACHSORGE? Straumann-Implantate sind eine moderne Möglichkeit für Zahnersatz, wenn ein oder mehrere Zähne fehlen. Diese bekannte und hochwertige
Wie erleben Verbraucher IGeL? Ergebnisse einer Umfrage der Verbraucherzentralen
 Wie erleben Verbraucher IGeL? Ergebnisse einer Umfrage der Verbraucherzentralen Sperrfrist: 15.10.2012, 10 Uhr Berlin, 11.10.2012 Was sind IGeL? Individuelle Gesundheits-Leistungen (IGeL) sind medizinische
Wie erleben Verbraucher IGeL? Ergebnisse einer Umfrage der Verbraucherzentralen Sperrfrist: 15.10.2012, 10 Uhr Berlin, 11.10.2012 Was sind IGeL? Individuelle Gesundheits-Leistungen (IGeL) sind medizinische
Augenarztpraxis Dr. med. Stefan Bodanowitz & Dr. med. univ. Erwin Ertel. Innovative Therapiemöglichkeiten bei Grauem Star
 & Innovative Therapiemöglichkeiten bei Grauem Star Inhalte dieser Darstellung Aufbau und Funktion des Auges Was ist Grauer Star? Wie wird Grauer Star behandelt? Premium-Linsen mit Zusatzfunktionen Wie
& Innovative Therapiemöglichkeiten bei Grauem Star Inhalte dieser Darstellung Aufbau und Funktion des Auges Was ist Grauer Star? Wie wird Grauer Star behandelt? Premium-Linsen mit Zusatzfunktionen Wie
Prozessbewertung und -verbesserung nach ITIL im Kontext des betrieblichen Informationsmanagements. von Stephanie Wilke am 14.08.08
 Prozessbewertung und -verbesserung nach ITIL im Kontext des betrieblichen Informationsmanagements von Stephanie Wilke am 14.08.08 Überblick Einleitung Was ist ITIL? Gegenüberstellung der Prozesse Neuer
Prozessbewertung und -verbesserung nach ITIL im Kontext des betrieblichen Informationsmanagements von Stephanie Wilke am 14.08.08 Überblick Einleitung Was ist ITIL? Gegenüberstellung der Prozesse Neuer
