5. Kinetische Untersuchungen zur Hydrolyse der 1,3,2-Dioxaborine
|
|
|
- Gretel Kuntz
- vor 5 Jahren
- Abrufe
Transkript
1 54 5. Kinetische Untersuchungen zur ydrolyse der 1,3,2Dioxaborine 1,3,2Dioxaborine sind in basisch wässrigen dien größtenteils hydrolyseempfindlich. Durch die kinetische Untersuchung der ydrolyse sind verschiedene Informationen zugänglich. Zum einen ist es möglich, Aussagen zum Zersetzungsmechanismus zu machen. Weiterhin sind Angaben über die Elektronenstruktur der 1,3,2Dioxaborine möglich. Zwar lassen sich keine direkten und genauen Angaben zur Elektronenverteilung machen, jedoch sind Trends und Tendenzen erkennbar. Und nicht zuletzt ist die ydrolysestabilität ein wichtiges Kriterium für eine eventuelle Anwendung der betreffenden Verbindung. Durch UVVISspektroskopische Verfolgung der ydrolyse der Dioxaborine wurde untersucht, welchen Einfluß die verschiedenen Coliganden und die unterschiedlichen Donatoren auf die ydrolysegeschwindigkeit haben () 3 2 D D Abbildung 40: ydrolyse von 1,3,2Dioxaborinen Produkt 35 und Edukt 34 der Reaktion in Abbildung 40 haben deutlich unterschiedliche Maxima im Absorptionsspektrum. Dadurch wird es möglich, die Abnahme der Extinktion des Edukts als konzentrationsanaloge Größe in periodischen Abständen zu verfolgen (Abb. 41). Die Geschwindigkeitskonstante der Reaktion wurde mit Triethylamin als ase in Dimethylformamid/Wasser bestimmt. Da die ase in großem Überschuß zugesetzt wurde, konnte die Auswertung der Reaktionsdaten nach einem Geschwindigkeitsgesetz pseudoerster rdnung erfolgen [77]. Dazu wurde die logarithmierte Extinktion des Absorptionsmaximums gegen die Zeit aufgetragen (Abb. 42). Aus dem Anstieg der Geraden konnte so die Geschwindigkeitskonstante der ydrolyse ermittelt werden.
2 1,2 1,0 E 0,8 0,6 0,4 0,2 0, Abbildung 41: cyclisches AbsorptionsZeitSpektrum der ydrolyse von Verbindung 40dD nm 1,0 0,70 0,65 Eε 0,60 0,8 ln E 0,55 0,50 0,6 0, Zeit [s] 0, Zeit [s] Abbildung 42: inearisierung der Extinktionswerte von 40dD 5.1 Kinetische Untersuchungen zur ydrolyse der 1,3,2Dioxaborine mit unterschiedlichen Donatoren Als ydrolysemechanismus wurde ein nucleophiler Angriff der ase am oratom angenommen (Abbildung 44). Um zu bestimmen, welchen Einfluß die Elektronendichte am oratom auf die ydrolysegeschwindigkeit der Dioxaborine hat, wurden 1,3,2Dioxaborinfarbstoffen mit unterschiedlichen Donatoren untersucht.
3 56 Tabelle 11: Elektronendichte am oratom bei verschiedenen starken Donatoren am eispiel der Verbindungsklasse 38aX AM1 EEKTR DICTE 11 VERSCIEU G [PPM] 1 5 a VERSCIEU G [PPM] 19 VERSCIEU G [PPM] ASRPTIS WEEZA ν [CM 1 ] 2,629 2,06 7,06 138, a 2,628 2,07 7,08 138, aP S 2,630 1,99 6,87 140, Cl Cl 38a Cl 2,631 2,00 6,91 140, aA 2,632 1,99 6,87 140, a 2 38aJ a siehe Abb. 21 Pen 2,632 1,96 6,73 141, Wie aus Tabelle 11 ersichtlich ist, erhöhen die Stärke der Donorfragmente (Absorptionswellenzahl) die Elektronendichte im Dioxaborinring ( 1 5 Werte). Damit steigt die Elektronendichte am oratom. Die chemische Verschiebung der 11 ssung korreliert nicht in jedem all mit den berechneten Elektronendichten. Da der Trend bei den 19 ssungen jedoch mit den AM1Elektronendichten übereinstimmt, ist anzunehmen, daß aufgrund der großen albwertbreite der 11 Signale (15 bis 20 z) diese ssung mit ehlern behaftet ist. ei höheren Elektronendichten am oratom sollte die ydrolyse langsamer verlaufen. Diese Annahme stimmt mit den Ergebnissen der kinetischen ssungen überein
4 57 (Tabelle 12). Die Geschwindigkeitskonstanten nehmen mit steigender Donatorstärke, also steigender Elektronendichte am oratom ab. Tabelle 12: Geschwindigkeitskonstante k und Korrelationskoeffizient r der ydrolyse bei unterschiedlichen Donatoren k [s 1 ] r R k [s 1 ] r 2 38aX 2 R 38gX P S 36.8*10 5 a 33.3*10 5 Cl Cl Cl 13.05*10 5 A 1.07* *10 5 G Pen 0.965* * *10 5 C Prop Prop * D u u 0.665* *10 5 E Pen Pen 0.312* *10 5
5 58 J Pen 10.25* Ac a) Verbindungen nicht synthetisiert (820.0*10 5 ) * Kinetische Untersuchungen zur ydrolyse der 1,3,2Dioxaborine mit unterschiedlichen Coliganden Um festzustellen, welchen Einfluß die Coliganden auf die ydrolysegeschwindigkeit der 1,3,2Dioxaborine haben, wurden zahlreiche Verbindungen mit unterschiedlichen Coliganden untersucht. In Tabelle 13 sind die ßergebnisse angegeben. Tabelle 13: Geschwindigkeitskonstanten k und Korrelationskoeffizient r der ydrolyse bei unterschiedlichen Coliganden k [s 1 ] r k [s 1 ] r k [s 1 ] r 36x 2 38xD u u 40xD u u c >1000* * >1654*10 5 k 96*10 5 0,99 a l 57,3*10 5 0,99
6 59 m 10,6*10 5 0,99 n 4,5*10 5 0,99 o 2,5*10 5 0,94 d 8.4* *10 5 g h 6.6* * * b Ac Ac 4.2* *10 5 e 3.1* * * a 0.82* * *10 5 i 0.568* *10 5 a) Verbindungen nicht synthetisiert
7 60 Eine Systematik in der Reihenfolge ist auf den ersten lick nicht zu erkennen. Die Geschwindigkeit der ydrolyse folgt nicht der Elektronendichte am oratom (Abb. 43). 10 >1000 Geschwindigkeitskonstante k [s 1 ] Verschiebung [ppm] Abbildung 43: Abhängigkeit der Geschwindigkeitskonstante k von der 11 Verschiebung für die Verbindungsgruppe 36x Die Elektronendichte am oratom steigt vom luor zum renzkatechin hin an (Tabelle 14), daher wäre eine andere Reihenfolge der Geschwindigkeitskonstanten zu erwarten. Tabelle 14: Elektronendichten am oratom bei unterschiedlichen Coliganden AM1 EEKTR DICTE 11 VERSCIEUG [ppm] 1 5 VERSCIEUG [ppm] a 2,62 2,23 7,52 b Ac Ac 2,70 3,26 7,56 k 2,71 4,95 7,63
8 61 d 2,73 5,22 7,61 g 2,77 8,68 7,61 c 2,78 6,91 7,72 e 2,78 10,68 7,61 R= Phenyl etrachtet man jedoch den sterischen Anspruch der einzelnen Coliganden, so ist deutlich zu erkennen, daß die Reaktion sterischen inderungen unterworfen ist. Wenn durch voluminöse Substituenten die Annäherung der Reaktionspartner erschwert wird, ist eine höhere Aktivierungsenergie erforderlich, um diesen Einfluß zu überwinden. Deshalb verläuft die Reaktion bei sterisch anspruchsvollen Coliganden langsamer. In der Tabelle 15 sind die Moleküle mit unterschiedlichen Coliganden mit ihren VA DER WAASRadien dargestellt. eim xalatokomplex c, der eine hohe Elektronendichte am oratom aufweist, ist ersichtlich, daß ein Angriff der ase von allen Seiten möglich ist. eim Diacetatokomplex b ist der sterische Anspruch größer, daher ist die Geschwindigkeitskonstante geringer als beim xalatokomplex c, obwohl die Elektronendichte am or geringer ist und somit ein nucleophiler Angriff der ase schneller erfolgen müßte. Am langsamsten verläuft die ydrolyse bei den inaphtholatokomplexen i, da der inaphtholcoligand i zweifellos den größten Platzbedarf von allen verwendeten Coliganden hat.
9 Tabelle 15: Größe der Coliganden am eispiel der Verbindungsklasse 36x 36a(Difluoro) 36b(Diacetato) 36c(xalato) 36d(Salizylato) 36e(renzkatechinato) 36g(Mandelato) 36i(inaphtolato) 36k(Malonato) 36l(Glutarato) 36m(Phthalato) 36n(Succinato) 36o(Adipato)
10 63 Sehr gut zu sehen ist der Effekt auch in der Reihe der Dicarbonsäurecoliganden. bwohl die Winkel der Chelatbindung, wie im Kapitel 4 gezeigt wurde, einen Einfluß auf die Stabilität haben, fallen diese bei der ydrolysestabilität nicht ins Gewicht. Einzig der Platzbedarf des Coliganden ist bei der Zersetzung der Dioxaborine durch asen ausschlaggebend. Der geschwindigkeitsbestimmende Schritt ist also der Angriff der ase am oratom (Abb. 44: k 1 ). Eine Ausnahme stellt der luorokomplex a dar. Da die Elektronendichte am oratom am geringsten ist, müßte eine viel schnellere Reaktion resultieren, zumal auch der Platzbedarf der luoratome vergleichsweise gering ausfällt. Die orsauerstoffindung der Verbindung 11 ist im alle des luorocoliganden jedoch viel polarer als bei Dioxycoliganden (Abb. 44), bedingt durch den stärkeren I Effekt des luor. Die indungsenergie einer polaren indung ergibt sich aus [78]: E A = 0.5 [ E AA + E ] + D A D A» C A C Gleichung g D A Maß für die Elektronegativitätsdifferenz der Elemente A und E A indungsenergie der polaren indung A d + d E AA indungsenergie der kovalenten indung A A E indungsenergie der kovalenten indung Durch den etrag D A wird die indung A zusätzlich stabilisiert. D A wird durch den I Effekt des luors größer.
11 64 k k 2 R 3 R R 3 () R 3 9 Abbildung 44: chanismus der ydrolyse der 1,3,2Dioxaborine
Grundlagen der Kinetik
 Kapitel 1 Grundlagen der Kinetik In diesem Kapitel werden die folgenden Themen kurz wiederholt: Die differenziellen und integralen Geschwindigkeitsgesetze von irreversiblen Reaktionen., 1., und. Ordnung
Kapitel 1 Grundlagen der Kinetik In diesem Kapitel werden die folgenden Themen kurz wiederholt: Die differenziellen und integralen Geschwindigkeitsgesetze von irreversiblen Reaktionen., 1., und. Ordnung
Reaktionskinetik. bimolekularen Reaktion. Für die Konzentraton des Dinitrochlorbenzols [a] gilt: = k
![Reaktionskinetik. bimolekularen Reaktion. Für die Konzentraton des Dinitrochlorbenzols [a] gilt: = k Reaktionskinetik. bimolekularen Reaktion. Für die Konzentraton des Dinitrochlorbenzols [a] gilt: = k](/thumbs/42/22840880.jpg) Versuche des Kapitel 7 Reaktionskinetik Einleitung Die Reaktion von Piperidin mit Dinitrochlorbenzol zum gelben Dinitrophenylpiperidin soll auf die Geschwindigkeitskonstante und die Arrheniusparameter
Versuche des Kapitel 7 Reaktionskinetik Einleitung Die Reaktion von Piperidin mit Dinitrochlorbenzol zum gelben Dinitrophenylpiperidin soll auf die Geschwindigkeitskonstante und die Arrheniusparameter
ATTO 565 und ATTO 590
 ATTO 565 und ATTO 590 Allgemeine Informationen ATTO 565 und ATTO 590 sind Fluoreszenzmarker aus der Familie der Rhodamin-Farbstoffe. Diese Farbstoffe besitzen als gemeinsames Strukturelement einen Carboxyphenyl-
ATTO 565 und ATTO 590 Allgemeine Informationen ATTO 565 und ATTO 590 sind Fluoreszenzmarker aus der Familie der Rhodamin-Farbstoffe. Diese Farbstoffe besitzen als gemeinsames Strukturelement einen Carboxyphenyl-
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Grundpraktikum Physikalische Chemie. Versuch 16 Kinetischer Salzeffekt
 Grundpraktikum Physikalische Chemie Versuch 16 Kinetischer Salzeffekt Version: März 2016 1. Theorie 1.1. Kinetischer Salzeffekt Eine bimolekulare chemische Reaktion lässt sich mithilfe von Konzepten der
Grundpraktikum Physikalische Chemie Versuch 16 Kinetischer Salzeffekt Version: März 2016 1. Theorie 1.1. Kinetischer Salzeffekt Eine bimolekulare chemische Reaktion lässt sich mithilfe von Konzepten der
Übungen zur VL Chemie für Biologen und Humanbiologen Lösung Übung 9
 Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
= Durchschnittliche Bildungs- Geschwindigkeit [mol/s] = Durchschnittliche Verbrauchs- Geschwindigkeit [mol/s]
![= Durchschnittliche Bildungs- Geschwindigkeit [mol/s] = Durchschnittliche Verbrauchs- Geschwindigkeit [mol/s] = Durchschnittliche Bildungs- Geschwindigkeit [mol/s] = Durchschnittliche Verbrauchs- Geschwindigkeit [mol/s]](/thumbs/94/122358469.jpg) Ache2 Kapitel 14: Chemische Kinetik (Geschwindigkeit) Reaktionsgeschwindigkeit Beeinflussung: 1. Aggregatszustände der Reaktanten: Je öfters Moleküle zusammenstossen, desto schneller reagieren sie. (Oberflächenvergrösserung
Ache2 Kapitel 14: Chemische Kinetik (Geschwindigkeit) Reaktionsgeschwindigkeit Beeinflussung: 1. Aggregatszustände der Reaktanten: Je öfters Moleküle zusammenstossen, desto schneller reagieren sie. (Oberflächenvergrösserung
Institut für Physikalische und Theoretische Chemie Physikalisch-Chemisches Praktikum für Studenten L2
 Institut für Physikalische und Theoretische Chemie Physikalisch-Chemisches Praktikum für Studenten L2 10. Temperaturabhängigkeit der Reaktionsgeschwindigkeit: Arrhenius-Beziehung Thema In diesem Versuch
Institut für Physikalische und Theoretische Chemie Physikalisch-Chemisches Praktikum für Studenten L2 10. Temperaturabhängigkeit der Reaktionsgeschwindigkeit: Arrhenius-Beziehung Thema In diesem Versuch
Richtung von spontanem Prozeßablauf und Veränderung der G in Abhängigkeit vom Vorzeichen der Enthalpie und der Entropie
 Richtung von spontanem Prozeßablauf und Veränderung der G in Abhängigkeit vom Vorzeichen der Enthalpie und der Entropie H S G= H-T S Prozeß 1. (-) (+) (-) immer exergonisch, erfolgt spontan bei allen Temperaturen
Richtung von spontanem Prozeßablauf und Veränderung der G in Abhängigkeit vom Vorzeichen der Enthalpie und der Entropie H S G= H-T S Prozeß 1. (-) (+) (-) immer exergonisch, erfolgt spontan bei allen Temperaturen
Schriftliche Leistungsüberprüfung PC/CBI
 Abschlusstest - Physikalische Chemie CBI/LSE - SS09 - Blatt 1 Schriftliche Leistungsüberprüfung PC/CBI SS08-31.07.2009 Hörsaal H1/H2/H3 Name: Vorname: geb. am: in: Matrikelnummer: Studienfach: Unterschrift:
Abschlusstest - Physikalische Chemie CBI/LSE - SS09 - Blatt 1 Schriftliche Leistungsüberprüfung PC/CBI SS08-31.07.2009 Hörsaal H1/H2/H3 Name: Vorname: geb. am: in: Matrikelnummer: Studienfach: Unterschrift:
Lösung 11. Allgemeine Chemie I Herbstsemester d[a] t. = k (1) Trennung der Variablen und Integration in den Randbedingungen führt auf: [A]
![Lösung 11. Allgemeine Chemie I Herbstsemester d[a] t. = k (1) Trennung der Variablen und Integration in den Randbedingungen führt auf: [A] Lösung 11. Allgemeine Chemie I Herbstsemester d[a] t. = k (1) Trennung der Variablen und Integration in den Randbedingungen führt auf: [A]](/thumbs/78/76746487.jpg) Lösung Allgemeine Chemie I Herbstsemester 20. Aufgabe Die Geschwindigkeitsgesetze finden Sie im Skript der Vorlesung und im Mortimer, p. 26-27. Für eine Reaktion, die Species A verbraucht, gilt bei einer
Lösung Allgemeine Chemie I Herbstsemester 20. Aufgabe Die Geschwindigkeitsgesetze finden Sie im Skript der Vorlesung und im Mortimer, p. 26-27. Für eine Reaktion, die Species A verbraucht, gilt bei einer
1 Lambert-Beersches Gesetz
 Physikalische Chemie II Lösung 6 23. Oktober 205 Lambert-Beersches Gesetz Anhand des idealen Gasgesetzes lässt sich die Teilchenkonzentration C wie folgt ausrechnen: C = N V = n N A V pv =nrt = N A p R
Physikalische Chemie II Lösung 6 23. Oktober 205 Lambert-Beersches Gesetz Anhand des idealen Gasgesetzes lässt sich die Teilchenkonzentration C wie folgt ausrechnen: C = N V = n N A V pv =nrt = N A p R
[ A] [ B] [ ] [ ] Chemische Reaktionen in homogenen Systemen [ ] ( C D a a = = Aktivitäten a x für ideale Systeme: Aktivitätskoeffizient γ
![[ A] [ B] [ ] [ ] Chemische Reaktionen in homogenen Systemen [ ] ( C D a a = = Aktivitäten a x für ideale Systeme: Aktivitätskoeffizient γ [ A] [ B] [ ] [ ] Chemische Reaktionen in homogenen Systemen [ ] ( C D a a = = Aktivitäten a x für ideale Systeme: Aktivitätskoeffizient γ](/thumbs/95/126253665.jpg) Chemische Reaktionen in homogenen Systemen aa + bb cc + dd K T c d c d C D a b a b aa ab C D a a = = [ A] [ B] Aktivitäten a x für ideale Systeme: ideale Gase: ax px p verdünnte Lösungen: Fugazitätskoeffizient
Chemische Reaktionen in homogenen Systemen aa + bb cc + dd K T c d c d C D a b a b aa ab C D a a = = [ A] [ B] Aktivitäten a x für ideale Systeme: ideale Gase: ax px p verdünnte Lösungen: Fugazitätskoeffizient
(Anmerkung: Es sind weitere möglich. Spektren zeigen Diradikal.)
 eispielaufgaben IChO 2. Runde 2017 Aromaten, Lösungen Aromaten eispiel 1: a) b) (Zeichnungen hier und unten teilweise ohne Wasserstoff-Atome) c) Das Anion ist planar und hat ein cyclisch konjugiertes π-elektronensystem
eispielaufgaben IChO 2. Runde 2017 Aromaten, Lösungen Aromaten eispiel 1: a) b) (Zeichnungen hier und unten teilweise ohne Wasserstoff-Atome) c) Das Anion ist planar und hat ein cyclisch konjugiertes π-elektronensystem
Versuch: Reaktionskinetik
 Versuch: Reaktionskinetik Befindet sich eine chemische Reaktion im thermodynamischen Gleichgewicht, so lassen sich die Bedingungen für diesen Zustand durch eine energetische Betrachtungsweise mithilfe
Versuch: Reaktionskinetik Befindet sich eine chemische Reaktion im thermodynamischen Gleichgewicht, so lassen sich die Bedingungen für diesen Zustand durch eine energetische Betrachtungsweise mithilfe
Praktikum Physikalische Chemie I 30. Januar Aktivierungsenergie. Guido Petri Anastasiya Knoch PC111/112, Gruppe 11
 Praktikum Physikalische Chemie I 30. Januar 2016 Aktivierungsenergie Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 1 Aufgabenstellung Für die Reaktion von Saccharose mit Wasser zu Glucose und Fructose
Praktikum Physikalische Chemie I 30. Januar 2016 Aktivierungsenergie Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 1 Aufgabenstellung Für die Reaktion von Saccharose mit Wasser zu Glucose und Fructose
Lösungen 10 (Kinetik)
 Chemie I WS 2003/2004 Lösungen 10 (Kinetik) Aufgabe 1 Verschiedenes 1.1 Als Reaktionsgeschwindigkeit v c wird die Ableitung der Konzentration eines Reaktanden A nach der Zeit t, dividiert durch dessen
Chemie I WS 2003/2004 Lösungen 10 (Kinetik) Aufgabe 1 Verschiedenes 1.1 Als Reaktionsgeschwindigkeit v c wird die Ableitung der Konzentration eines Reaktanden A nach der Zeit t, dividiert durch dessen
3 Elektronengas-Modell und Polyene
 3.1 Lernziele 1. Sie können die Anregungsenergie ΔE für den Ügang vom höchsten besetzten (HOMO) zum niedrigsten unbesetzten (LUMO) Niveau von Polyenen mit dem Elektronengas-Modell echnen. 2. Sie sind in
3.1 Lernziele 1. Sie können die Anregungsenergie ΔE für den Ügang vom höchsten besetzten (HOMO) zum niedrigsten unbesetzten (LUMO) Niveau von Polyenen mit dem Elektronengas-Modell echnen. 2. Sie sind in
Klausur Bachelorstudiengang CBI / LSE. Physikalische Chemie
 Bachelorstudiengang CBI / LSE - Teil Physikalische Chemie SS10 - Blatt 1 / 15 Klausur Bachelorstudiengang CBI / LSE Physikalische Chemie 27.09.2010 Name: Vorname: geb. am: in: Studienfach: Matrikelnummer:
Bachelorstudiengang CBI / LSE - Teil Physikalische Chemie SS10 - Blatt 1 / 15 Klausur Bachelorstudiengang CBI / LSE Physikalische Chemie 27.09.2010 Name: Vorname: geb. am: in: Studienfach: Matrikelnummer:
Praktikum Optische Technologien, Protokoll Versuch Absorptionsmessung
 Praktikum Optische Technologien, Protokoll Versuch Absorptionsmessung 09.0.204 Ort: Laserlabor der Fachhochschule Aachen Campus Jülich Inhaltsverzeichnis Einleitung 2 Fragen zur Vorbereitung 2 3 Geräteliste
Praktikum Optische Technologien, Protokoll Versuch Absorptionsmessung 09.0.204 Ort: Laserlabor der Fachhochschule Aachen Campus Jülich Inhaltsverzeichnis Einleitung 2 Fragen zur Vorbereitung 2 3 Geräteliste
K1: Lambert-Beer`sches Gesetz
 K1: Lambert-Beer`sches Gesetz Einleitung In diesem Versuch soll die Entfärbung von Kristallviolett durch atronlauge mittels der Absorptionsspektroskopie untersucht werden. Sowohl die Reaktionskinetik als
K1: Lambert-Beer`sches Gesetz Einleitung In diesem Versuch soll die Entfärbung von Kristallviolett durch atronlauge mittels der Absorptionsspektroskopie untersucht werden. Sowohl die Reaktionskinetik als
Chemie Protokoll. Versuch 2 3 (RKV) Reaktionskinetik Esterverseifung. Stuttgart, Sommersemester 2012
 Chemie Protokoll Versuch 2 3 (RKV) Reaktionskinetik Esterverseifung Stuttgart, Sommersemester 202 Gruppe 0 Jan Schnabel Maximilian Möckel Henri Menke Assistent: Durmus 20. Mai 202 Inhaltsverzeichnis Theorie
Chemie Protokoll Versuch 2 3 (RKV) Reaktionskinetik Esterverseifung Stuttgart, Sommersemester 202 Gruppe 0 Jan Schnabel Maximilian Möckel Henri Menke Assistent: Durmus 20. Mai 202 Inhaltsverzeichnis Theorie
3. Klausur zum Praktikum Organische Chemie I für Studierende der Chemie und der Biochemie im SS 2000
 Prof. Dr. B. König Prof. Dr. Th. Troll 3. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 2000 am Donnerstag, dem 27. Juli 2000 ame: Mustermann...Vorname: Max...
Prof. Dr. B. König Prof. Dr. Th. Troll 3. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 2000 am Donnerstag, dem 27. Juli 2000 ame: Mustermann...Vorname: Max...
Gefühl*** vorher / nachher. Situation* Essen (was und wie viel?) Ess- Motiv** Tag Datum Frühstück Zeit: Allgemeines Befinden
 Name: Größe: cm Gewicht: kg Alter: Jahre Situation* Essen Ess- Situation* Essen Ess- Situation* Essen Ess- Situation* Essen Ess- Situation* Essen Ess- Situation* Essen Ess- Situation* Essen Ess- Situation*
Name: Größe: cm Gewicht: kg Alter: Jahre Situation* Essen Ess- Situation* Essen Ess- Situation* Essen Ess- Situation* Essen Ess- Situation* Essen Ess- Situation* Essen Ess- Situation* Essen Ess- Situation*
5 Die Photolyse von Methyl-Semiquadratsäureamid
 44 5 Die Photolyse von Methyl-Semiquadratsäureamid 5 Die Photolyse von Methyl-Semiquadratsäureamid 5.1 Vorbemerkungen: Methylsemiquadratsäureamid (53) unterscheidet sich von Semiquadratsäureamid (48) nur
44 5 Die Photolyse von Methyl-Semiquadratsäureamid 5 Die Photolyse von Methyl-Semiquadratsäureamid 5.1 Vorbemerkungen: Methylsemiquadratsäureamid (53) unterscheidet sich von Semiquadratsäureamid (48) nur
N H H. Carbanionen Lewis-Basen Olefine (Alkane) Die Stärke der Nucleophilie wird von versch. Faktoren beeinflußt z.b.
 Organische hemie Nucleophil = kernliebend Nucleophil = Teilchen oder Gruppe, die Lewis-basische Eigenschaften aufweist (also mind. ein freies Elektronenpaar besitzt), es gibt neutrale Nucleophile sowie
Organische hemie Nucleophil = kernliebend Nucleophil = Teilchen oder Gruppe, die Lewis-basische Eigenschaften aufweist (also mind. ein freies Elektronenpaar besitzt), es gibt neutrale Nucleophile sowie
Fragen zum Versuch Kinetik:
 Fragen zum Versuch Kinetik: 1. Die Inversion von Rohrzucker ist: a. Die Umwandlung von Rohrzucker in Saccharose b. Die katalytische Spaltung in Glucose und Fructose c. Das Auflösen von Rohrzucker im Wasser
Fragen zum Versuch Kinetik: 1. Die Inversion von Rohrzucker ist: a. Die Umwandlung von Rohrzucker in Saccharose b. Die katalytische Spaltung in Glucose und Fructose c. Das Auflösen von Rohrzucker im Wasser
Fragen zum Versuch 11a Kinetik Rohrzuckerinversion:
 Fragen zum Versuch 11a Kinetik Rohrzuckerinversion: 1. Die Inversion von Rohrzucker ist: a. Die Umwandlung von Rohrzucker in Saccharose b. Die katalytische Spaltung in Glucose und Fructose c. Das Auflösen
Fragen zum Versuch 11a Kinetik Rohrzuckerinversion: 1. Die Inversion von Rohrzucker ist: a. Die Umwandlung von Rohrzucker in Saccharose b. Die katalytische Spaltung in Glucose und Fructose c. Das Auflösen
23. Mai 2000 Physikalisch-Chemisches Praktikum Versuch Nr. 2
 23. Mai 2000 Physikalisch-Chemisches Praktikum Versuch Nr. 2 Thema: Aufgabenstellung: Material: ph-abhängigkeit einer Solvolysereaktion 1. Bestimmung der Geschwindigkeitskonstanten für die Reaktion von
23. Mai 2000 Physikalisch-Chemisches Praktikum Versuch Nr. 2 Thema: Aufgabenstellung: Material: ph-abhängigkeit einer Solvolysereaktion 1. Bestimmung der Geschwindigkeitskonstanten für die Reaktion von
In den Versuchen "Hydrolyse von Chlormethylsilanen" und "Geschwindigkeit der Hydrolyse von Chlormethylsilanen" sind bei den drei Chlormethylsilanen
 Arbeitsblatt 7.1 In den Versuchen "ydrolyse von " und "Geschwindigkeit der ydrolyse von " sind bei den drei Chlortrimethylsilan Dichlordimethylsilan Trichlormethylsilan Gemeinsamkeiten und Unterschiede
Arbeitsblatt 7.1 In den Versuchen "ydrolyse von " und "Geschwindigkeit der ydrolyse von " sind bei den drei Chlortrimethylsilan Dichlordimethylsilan Trichlormethylsilan Gemeinsamkeiten und Unterschiede
5 Elektronengas-Modell und Polyene
 5.1 Übersicht und Lernziele Übersicht Im vorherigen Kapitel haben Sie gelernt, das Elektronengas-Modell am Beispiel der Cyanin-Farbstoffe anzuwenden. Sie konnten überprüfen, dass die Berechnungen für die
5.1 Übersicht und Lernziele Übersicht Im vorherigen Kapitel haben Sie gelernt, das Elektronengas-Modell am Beispiel der Cyanin-Farbstoffe anzuwenden. Sie konnten überprüfen, dass die Berechnungen für die
Bestimmung der Geschwindigkeitskonstanten einer Esterverseifung
 Versuchsprotokoll: Bestimmung der Geschwindigkeitskonstanten einer Esterverseifung Gruppe 10 29.06.2013 Patrik Wolfram TId:20 Alina Heidbüchel TId:19 1 Inhaltsverzeichnis 1 Einleitung... 3 2 Theorie...
Versuchsprotokoll: Bestimmung der Geschwindigkeitskonstanten einer Esterverseifung Gruppe 10 29.06.2013 Patrik Wolfram TId:20 Alina Heidbüchel TId:19 1 Inhaltsverzeichnis 1 Einleitung... 3 2 Theorie...
Reaktionskinetik: - Geschwindigkeit chemischer Reaktionen - Untersuchung (bzw. Bestimmung) der Reaktionsmechanismen. c(a) t. v = -
 REAKTIONSKINETIK 1 Reaktionskinetik Reaktionskinetik: - Geschwindigkeit chemischer Reaktionen - Untersuchung (bzw. Bestimmung) der Reaktionsmechanismen Anwendung: - Vorgänge in den lebenden Organismen
REAKTIONSKINETIK 1 Reaktionskinetik Reaktionskinetik: - Geschwindigkeit chemischer Reaktionen - Untersuchung (bzw. Bestimmung) der Reaktionsmechanismen Anwendung: - Vorgänge in den lebenden Organismen
4 Zusammenfassung und Ausblick
 KAITEL 4 ZUSAMMEFASSUG UD AUSBLICK 91 4 Zusammenfassung und Ausblick Bei einem selbstreplizierenden System ist im Allgemeinen die Stabilität des termolekularen Komplexes (aus Templat und den beiden Eduktmolekülen)
KAITEL 4 ZUSAMMEFASSUG UD AUSBLICK 91 4 Zusammenfassung und Ausblick Bei einem selbstreplizierenden System ist im Allgemeinen die Stabilität des termolekularen Komplexes (aus Templat und den beiden Eduktmolekülen)
Kapitel 3. Nucleophile Substitution
 Kapitel 3. Nucleophile Substitution Reaktionsmechanismen - S N 1-Reaktion: Reaktionskoordinate-Energie-Diagramm; Kinetik, Struktur-Reaktivitätsbeziehungen (stabiles Carbokation, schwaches Nucleophil, gute
Kapitel 3. Nucleophile Substitution Reaktionsmechanismen - S N 1-Reaktion: Reaktionskoordinate-Energie-Diagramm; Kinetik, Struktur-Reaktivitätsbeziehungen (stabiles Carbokation, schwaches Nucleophil, gute
Kernmagnetische Resonanzspektroskopie (NMR) Spektroskopische Methoden
 Kernmagnetische Resonanzspektroskopie (NMR) Spektroskopische Methoden Grundlagen Die meisten Atomkerne führen eine Drehbewegung um die eigene Achse aus ("Spin"). Da sie geladene Teilchen (Protonen) enthalten,
Kernmagnetische Resonanzspektroskopie (NMR) Spektroskopische Methoden Grundlagen Die meisten Atomkerne führen eine Drehbewegung um die eigene Achse aus ("Spin"). Da sie geladene Teilchen (Protonen) enthalten,
Klausur Bachelorstudiengang CBI / LSE Prüfung Modul Physikalische Chemie und Thermodynamik. Physikalische Chemie
 Bachelorstudiengang CBI / LSE - Teil Physikalische Chemie - SS09 - Blatt 1 / 15 Klausur Bachelorstudiengang CBI / LSE Prüfung Modul Physikalische Chemie und Thermodynamik Physikalische Chemie 25.03.2010
Bachelorstudiengang CBI / LSE - Teil Physikalische Chemie - SS09 - Blatt 1 / 15 Klausur Bachelorstudiengang CBI / LSE Prüfung Modul Physikalische Chemie und Thermodynamik Physikalische Chemie 25.03.2010
PRAKTIKUM DER TECHNISCHEN CHEMIE I PRAKTIKUMSPROTOKOLL. WiSe 2015/2016. Versuch 6. Adiabatischer Batch-Reaktor
 PRAKTIKUM DER TECHNISCHEN CHEMIE I PRAKTIKUMSPROTOKOLL WiSe 2015/2016 Versuch 6 Adiabatischer Batch-Reaktor Rami Saoudi (356563) Guido Petri (364477) Gruppe 29 1. EINFÜHRUNG Es wurde der Temperaturverlauf
PRAKTIKUM DER TECHNISCHEN CHEMIE I PRAKTIKUMSPROTOKOLL WiSe 2015/2016 Versuch 6 Adiabatischer Batch-Reaktor Rami Saoudi (356563) Guido Petri (364477) Gruppe 29 1. EINFÜHRUNG Es wurde der Temperaturverlauf
Einführung in die Chemische Kinetik (Formale Reaktionskinetik)
 Einführung in die Chemische Kinetik (Formale Reaktionskinetik) 1 Einführung 2 Formale Reaktionskinetik einfacher Reaktionen 2.1 Reaktionsgeschwindigkeit einfacher Reaktionen 2.2 Bestimmung des Geschwindigkeitsgesetzes
Einführung in die Chemische Kinetik (Formale Reaktionskinetik) 1 Einführung 2 Formale Reaktionskinetik einfacher Reaktionen 2.1 Reaktionsgeschwindigkeit einfacher Reaktionen 2.2 Bestimmung des Geschwindigkeitsgesetzes
Reaktionstypen der Aliphate
 Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
-Reaktionsordnung- Referat zur Vorlesung Reaktionsdynamik. 31. Oktober 2012 Nils Wilharm Reaktionsordnung Seite 1
 -Reaktionsordnung- Referat zur Vorlesung Reaktionsdynamik 31. Oktober 2012 Nils Wilharm Reaktionsordnung Seite 1 Reaktionsordnung Allgemeines Reaktionsgeschwindigkeit/-ordnung 0. Ordnung 1. Ordnung 2.
-Reaktionsordnung- Referat zur Vorlesung Reaktionsdynamik 31. Oktober 2012 Nils Wilharm Reaktionsordnung Seite 1 Reaktionsordnung Allgemeines Reaktionsgeschwindigkeit/-ordnung 0. Ordnung 1. Ordnung 2.
APPLICATION NOTE. Einfache Handhabung bis hin zur leistungsfähigen Auswertung: TG-FT-IR-Messung an Diclofenac-Natrium. Claire Strasser.
 APPLICATION NOTE Einfache Handhabung bis hin zur leistungsfähigen Auswertung: TG-FT-IR-Messung an Claire Strasser Messergebnisse 1 Chemische Formel von [1] Einleitung Diclofenac ist ein entzündungshemmendes
APPLICATION NOTE Einfache Handhabung bis hin zur leistungsfähigen Auswertung: TG-FT-IR-Messung an Claire Strasser Messergebnisse 1 Chemische Formel von [1] Einleitung Diclofenac ist ein entzündungshemmendes
Vorlesung Anorganische Chemie
 Vorlesung Anorganische Chemie Prof. Ingo Krossing WS 2007/08 B.Sc. Chemie Lernziele Block 5 Verhalten von Lösungen Konzentrationen Solvatation und Solvatationsenthalpie Kolligative Eigenschaften Kryoskopie/Ebullioskopie
Vorlesung Anorganische Chemie Prof. Ingo Krossing WS 2007/08 B.Sc. Chemie Lernziele Block 5 Verhalten von Lösungen Konzentrationen Solvatation und Solvatationsenthalpie Kolligative Eigenschaften Kryoskopie/Ebullioskopie
1 Relaxationskinetik der Neutralisationsreaktion in Wasser
 Physikalische Chemie II Lösung 6 28. Oktober 206 Relaxationskinetik der Neutralisationsreaktion in Wasser. Für die Reaktion A + B definiert man die Auslenkungsvariable x so, dass gilt k a kb 2P [A] = [A]
Physikalische Chemie II Lösung 6 28. Oktober 206 Relaxationskinetik der Neutralisationsreaktion in Wasser. Für die Reaktion A + B definiert man die Auslenkungsvariable x so, dass gilt k a kb 2P [A] = [A]
Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09. Name: Sarah Henkel Datum:
 Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah enkel Datum: 19.11.2008 Gruppe 5: alogenalkane Versuch: Reaktivität von
Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah enkel Datum: 19.11.2008 Gruppe 5: alogenalkane Versuch: Reaktivität von
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten!
 Übung Nr. 9 Mi. 02.05.2012 bzw. Fr. 04.05.2012 1. Aromatensynthese a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten! b) Was passiert bei der Umsetzung von
Übung Nr. 9 Mi. 02.05.2012 bzw. Fr. 04.05.2012 1. Aromatensynthese a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten! b) Was passiert bei der Umsetzung von
1 Innere Rotation von Alkanen
 1 Innere Rotation von Alkanen a Unter Verwendung der Energieniveaus des harmonischen Oszillators schreibt sich die Zustandssumme Q = g n e εn/kbt = = e hω/2k BT = a 0 x n e hωn+ 1 2 /k BT e hωn/kbt = e
1 Innere Rotation von Alkanen a Unter Verwendung der Energieniveaus des harmonischen Oszillators schreibt sich die Zustandssumme Q = g n e εn/kbt = = e hω/2k BT = a 0 x n e hωn+ 1 2 /k BT e hωn/kbt = e
Grundlagen: Die Zersetzung von Ameisensäure in konzentrierter Schwefelsäure verläuft nach folgendem Mechanismus:
 A 35: Zersetzung von Ameisensäure Aufgabe: Für die Zersetzung von Ameisensäure in konzentrierter Schwefelsäure sind die Geschwindigkeitskonstante bei 30 und 40 C sowie der präexponentielle Faktor und die
A 35: Zersetzung von Ameisensäure Aufgabe: Für die Zersetzung von Ameisensäure in konzentrierter Schwefelsäure sind die Geschwindigkeitskonstante bei 30 und 40 C sowie der präexponentielle Faktor und die
Geben Sie an, wie die Anzahl der Nullstellen einer quadratischen Funktion von den Parametern a und b der Funktion abhängt!
 Aufgabe 3 Quadratische Funktion und ihre Nullstellen Gegeben ist eine quadratische Funktion f mit der Gleichung f(x) = a x 2 + b mit a 0 und a, b. Skizzieren Sie den Graphen einer möglichen quadratischen
Aufgabe 3 Quadratische Funktion und ihre Nullstellen Gegeben ist eine quadratische Funktion f mit der Gleichung f(x) = a x 2 + b mit a 0 und a, b. Skizzieren Sie den Graphen einer möglichen quadratischen
Gegenstand der letzten Vorlesung
 Gegenstand der letzten Vorlesung Reaktionsgeschwindigkeit Reaktionsordnung Molekularität Reaktion 0., 1.,. Ordnung Reaktion pseudo-erster Ordnung Aktivierungsenergie Temperaturabhängigkeit der Geschwindigkeitskonstanten
Gegenstand der letzten Vorlesung Reaktionsgeschwindigkeit Reaktionsordnung Molekularität Reaktion 0., 1.,. Ordnung Reaktion pseudo-erster Ordnung Aktivierungsenergie Temperaturabhängigkeit der Geschwindigkeitskonstanten
1 Halbwertszeit einer allgemeinen Reaktion m-ter Ordnung
 Physikalische Chemie II Lösung 5 6. Oktober 25 Halbwertszeit einer allgemeinen Reaktion m-ter Ordnung Für c = c B =... = c gilt c (t) = c B (t) =... = c(t) und das Geschwindigkeitsgesetz lautet dc(t) =
Physikalische Chemie II Lösung 5 6. Oktober 25 Halbwertszeit einer allgemeinen Reaktion m-ter Ordnung Für c = c B =... = c gilt c (t) = c B (t) =... = c(t) und das Geschwindigkeitsgesetz lautet dc(t) =
Kapitel 4. Die Grundlagen der Kinetik
 Kapitel 4. Die Grundlagen der Kinetik Monomolekulare Reaktion erster rdnung A Produkte; v = k [A] (S N 1) bimolekulare Reaktion zweiter rdnung (S N 2) A + B Produkte; v = k [A] [B] Einfluss der Aktivierungsbarrieren
Kapitel 4. Die Grundlagen der Kinetik Monomolekulare Reaktion erster rdnung A Produkte; v = k [A] (S N 1) bimolekulare Reaktion zweiter rdnung (S N 2) A + B Produkte; v = k [A] [B] Einfluss der Aktivierungsbarrieren
Physikalisch-Chemisches Grundpraktikum Kinetik und Transportphänomene. Reaktionskinetik
 Physikalisch-Chemisches Grundpraktikum Kinetik und Transportphänomene Reaktionskinetik verantwortlich: Prof. Dr. R. Strey Lehrstuhl für Physikalische Chemie I der Universität Köln 2009 1 1. Reaktionskinetik
Physikalisch-Chemisches Grundpraktikum Kinetik und Transportphänomene Reaktionskinetik verantwortlich: Prof. Dr. R. Strey Lehrstuhl für Physikalische Chemie I der Universität Köln 2009 1 1. Reaktionskinetik
PRAKTIKUM DER TECHNISCHEN CHEMIE I PRAKTIKUMSPROTOKOLL. WiSe 2015/2016. Versuch 4. Betriebspunkte des indirekt gekühlten CSTR
 PRAKTIKUM DER TECHNISCHEN CHEMIE I PRAKTIKUMSPROTOKOLL WiSe 2015/2016 Versuch 4 Betriebspunkte des indirekt gekühlten CSTR Rami Saoudi (356563) Guido Petri (364477) Gruppe 29 1. EINFÜHRUNG Ziel ist es,
PRAKTIKUM DER TECHNISCHEN CHEMIE I PRAKTIKUMSPROTOKOLL WiSe 2015/2016 Versuch 4 Betriebspunkte des indirekt gekühlten CSTR Rami Saoudi (356563) Guido Petri (364477) Gruppe 29 1. EINFÜHRUNG Ziel ist es,
Skiunfälle der Saison 2000/2001
 Skiunfälle der Saison 2000/2001 H. Gläser Auswertungsstelle für Skiunfälle der ARAG Sportversicherung (ASU Ski) Die Auswertung der Skiunfälle der Saison 2000/2001 läßt wie schon in den vergangenen Jahren
Skiunfälle der Saison 2000/2001 H. Gläser Auswertungsstelle für Skiunfälle der ARAG Sportversicherung (ASU Ski) Die Auswertung der Skiunfälle der Saison 2000/2001 läßt wie schon in den vergangenen Jahren
Wärmeleitung und thermoelektrische Effekte Versuchsauswertung
 Versuch P2-32 Wärmeleitung und thermoelektrische Effekte Versuchsauswertung Marco A., Gruppe: Mo-3 Karlsruhe Institut für Technologie, Bachelor Physik Versuchstag: 30.05.2011 1 Inhaltsverzeichnis 1 Bestimmung
Versuch P2-32 Wärmeleitung und thermoelektrische Effekte Versuchsauswertung Marco A., Gruppe: Mo-3 Karlsruhe Institut für Technologie, Bachelor Physik Versuchstag: 30.05.2011 1 Inhaltsverzeichnis 1 Bestimmung
endotherme Reaktionen
 Exotherme/endotherme endotherme Reaktionen Edukte - H Produkte Exotherme Reaktion Edukte Produkte + H Endotherme Reaktion 101 Das Massenwirkungsgesetz Das Massenwirkungsgesetz Gleichgewicht chemischer
Exotherme/endotherme endotherme Reaktionen Edukte - H Produkte Exotherme Reaktion Edukte Produkte + H Endotherme Reaktion 101 Das Massenwirkungsgesetz Das Massenwirkungsgesetz Gleichgewicht chemischer
Kinetik: a) Reaktionsgeschwindigkeit (zeitlicher Verlauf) b) Reaktionsweg (Mechanismus)
 Kinetik Kinetik: a) Reaktionsgeschwindigkeit (zeitlicher Verlauf) b) Reaktionsweg (Mechanismus) Klassifizierung chem. Reaktionen nach kinetischen Aspekten a) Reaktionsmolekularität: wie viele Teilchen
Kinetik Kinetik: a) Reaktionsgeschwindigkeit (zeitlicher Verlauf) b) Reaktionsweg (Mechanismus) Klassifizierung chem. Reaktionen nach kinetischen Aspekten a) Reaktionsmolekularität: wie viele Teilchen
Reaktionsmechanismen nach dem gleichnahmigen Buch von R. Brückner
 eaktionsmechanismen nach dem gleichnahmigen Buch von. Brückner Kap. 9 Addition von eteroatom-cleophilen an Carbonylverbindungen & Folgereaktionen... Dr. ermann A. Wegner hermann.wegner@unibas.ch Gleichgewicht
eaktionsmechanismen nach dem gleichnahmigen Buch von. Brückner Kap. 9 Addition von eteroatom-cleophilen an Carbonylverbindungen & Folgereaktionen... Dr. ermann A. Wegner hermann.wegner@unibas.ch Gleichgewicht
Doppler-Effekt und Bahngeschwindigkeit der Erde
 Astronomisches Praktikum Aufgaben für eine Schlechtwetter-Astronomie U. Backhaus, Universität Duisburg-Essen Doppler-Effekt und Bahngeschwindigkeit der Erde 1 Einleitung Nimmt man im Laufe eines Jahres
Astronomisches Praktikum Aufgaben für eine Schlechtwetter-Astronomie U. Backhaus, Universität Duisburg-Essen Doppler-Effekt und Bahngeschwindigkeit der Erde 1 Einleitung Nimmt man im Laufe eines Jahres
6. Ausgewählte Aufgabenstellungen Mathematik
 6. Ausgewählte Aufgabenstellungen Mathematik Bevölkerungsprognose (Teil-1-Aufgabe) In der angegebenen Tabelle der Statistik Austria ist die Bevölkerungsprognose für die österreichischen Bundesländer bis
6. Ausgewählte Aufgabenstellungen Mathematik Bevölkerungsprognose (Teil-1-Aufgabe) In der angegebenen Tabelle der Statistik Austria ist die Bevölkerungsprognose für die österreichischen Bundesländer bis
Auswahlverfahren zur ChemieOlympiade Aufgaben 2. Runde
 Auswahlverfahren zur Chemielympiade 2012 - Aufgaben 2. Runde Abgabe über die Schule beim Landesbeauftragten. Abgabetermine und Liste der Landesbeauftragten unter www.icho.de Die Auswahl der Mannschaft
Auswahlverfahren zur Chemielympiade 2012 - Aufgaben 2. Runde Abgabe über die Schule beim Landesbeauftragten. Abgabetermine und Liste der Landesbeauftragten unter www.icho.de Die Auswahl der Mannschaft
1 Michaelis-Menten-Kinetik
 Physikalische Chemie II Lösung 2 9. Dezember 206 Michaelis-Menten-Kinetik. Das Geschwindigkeitsgesetz für die zeitliche Änderung der ES-Konzentration ist durch folgendes Geschwindigkeitsgesetz beschrieben:
Physikalische Chemie II Lösung 2 9. Dezember 206 Michaelis-Menten-Kinetik. Das Geschwindigkeitsgesetz für die zeitliche Änderung der ES-Konzentration ist durch folgendes Geschwindigkeitsgesetz beschrieben:
1.2 Vergleichen Sie die Reaktionsbedingungen für die Bromierung von A und B und begründen Sie unter Mitverwendung von Grenzformeln den Unterschied!
 Aufgabe II Die aromatischen Ringsysteme folgender Verbindungen sollen zu Monobromderivaten umgesetzt werden: Benzol (A), Anilin (B) und Aniliniumchlorid (C). 1.1 Erläutern Sie unter Mitverwendung von Strukturformeln
Aufgabe II Die aromatischen Ringsysteme folgender Verbindungen sollen zu Monobromderivaten umgesetzt werden: Benzol (A), Anilin (B) und Aniliniumchlorid (C). 1.1 Erläutern Sie unter Mitverwendung von Strukturformeln
[A] = c(a) in den Einheiten mol/l (1) Eine tiefgestellte Null wie bei [A] 0 zeigt an, dass es sich um eine Anfangskonzentration
![[A] = c(a) in den Einheiten mol/l (1) Eine tiefgestellte Null wie bei [A] 0 zeigt an, dass es sich um eine Anfangskonzentration [A] = c(a) in den Einheiten mol/l (1) Eine tiefgestellte Null wie bei [A] 0 zeigt an, dass es sich um eine Anfangskonzentration](/thumbs/66/55829074.jpg) 1 Ableitung des Massenwirkungsgesetzes Mit dem Umfüllexperiment haben wir herausgefunden, dass die Stoffmengen oder die Stoffmengenkonzentrationen im Gleichgewicht auf einen Grenzwert zulaufen. Außerdem
1 Ableitung des Massenwirkungsgesetzes Mit dem Umfüllexperiment haben wir herausgefunden, dass die Stoffmengen oder die Stoffmengenkonzentrationen im Gleichgewicht auf einen Grenzwert zulaufen. Außerdem
MATHEMATIK K1. Gesamtpunktzahl /30 Notenpunkte
 MATHEMATIK K1 21.11.2013 Aufgabe 1 2 3 4 5 6 7 Punkte (max) 6 3 4 4 2 10 1 Punkte Gesamtpunktzahl /30 Notenpunkte Der GTR ist nur für die Lösung der Textaufgabe (und zur Kontrolle der andern) zugelassen.
MATHEMATIK K1 21.11.2013 Aufgabe 1 2 3 4 5 6 7 Punkte (max) 6 3 4 4 2 10 1 Punkte Gesamtpunktzahl /30 Notenpunkte Der GTR ist nur für die Lösung der Textaufgabe (und zur Kontrolle der andern) zugelassen.
Orbital. Atombindung, Bindung. Elektronegativität. Dipol
 GW Chemie 10. SG GA rbital aum, in dem sich Elektronen mit 99%iger Wahrscheinlichkeit aufhalten; in einem rbital halten sich maximal 2 Elektronen auf; man unterscheidet Atom- und Molekülorbitale Atombindung,
GW Chemie 10. SG GA rbital aum, in dem sich Elektronen mit 99%iger Wahrscheinlichkeit aufhalten; in einem rbital halten sich maximal 2 Elektronen auf; man unterscheidet Atom- und Molekülorbitale Atombindung,
Universität Ulm Grundpraktikum Physikalische Chemie Versuch Nr. 24 Temperaturabhängigkeit von Gleichgewichts- und Geschwindigkeitskonstanten
 Universität Ulm Grundpraktikum Physikalische Chemie Versuch Nr. 24 Temperaturabhängigkeit von Gleichgewichts- und Geschwindigkeitskonstanten 1. Grundlagen 1.1. Vorkenntnisse Informieren Sie sich vor Durchführung
Universität Ulm Grundpraktikum Physikalische Chemie Versuch Nr. 24 Temperaturabhängigkeit von Gleichgewichts- und Geschwindigkeitskonstanten 1. Grundlagen 1.1. Vorkenntnisse Informieren Sie sich vor Durchführung
Einführung. Ablesen von einander zugeordneten Werten
 Einführung Zusammenhänge zwischen Größen wie Temperatur, Geschwindigkeit, Lautstärke, Fahrstrecke, Preis, Einkommen, Steuer etc. werden mit beschrieben. Eine Zuordnung f, die jedem x A genau ein y B zuweist,
Einführung Zusammenhänge zwischen Größen wie Temperatur, Geschwindigkeit, Lautstärke, Fahrstrecke, Preis, Einkommen, Steuer etc. werden mit beschrieben. Eine Zuordnung f, die jedem x A genau ein y B zuweist,
CHE 102.1: Grundlagen der Chemie - Organische Chemie
 CE 102.1: Grundlagen der Chemie - Organische Chemie Prof Dr. E. Landau und Prof. Dr. J.. Robinson 3. Organische Reaktionen - Einordung nach chanismen. lkene : Kohlenwasserstoffe mit Doppelbindungen. 3.1
CE 102.1: Grundlagen der Chemie - Organische Chemie Prof Dr. E. Landau und Prof. Dr. J.. Robinson 3. Organische Reaktionen - Einordung nach chanismen. lkene : Kohlenwasserstoffe mit Doppelbindungen. 3.1
1 Molekularität vs. Reaktionsordnung
 Molekularität vs. Reaktionsordnung Wir diskutieren die in der Aufgabenstellung angegebenen Reaktionen bezüglich a) der Molekularität () Bimolekular. Rekombinationsreaktion der beiden OH-Radikale zu H 2
Molekularität vs. Reaktionsordnung Wir diskutieren die in der Aufgabenstellung angegebenen Reaktionen bezüglich a) der Molekularität () Bimolekular. Rekombinationsreaktion der beiden OH-Radikale zu H 2
Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) OH H + - H 2 O. (aus H 3 PO 4 H 2 SO 4 ) - H + Stichpunkte zum E1-Mechanismus:
 Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) + (aus 3 P 4 2 S 4 ) - 2 - + Stichpunkte zum E1-Mechanismus: 2-Schritt-eaktion über ein Carbenium-Ion (1. Schritt ist Abspaltung der Abgangsgruppe (im
Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) + (aus 3 P 4 2 S 4 ) - 2 - + Stichpunkte zum E1-Mechanismus: 2-Schritt-eaktion über ein Carbenium-Ion (1. Schritt ist Abspaltung der Abgangsgruppe (im
Schriftliche Leistungsüberprüfung PC/CBI
 Abschlusstest - Physikalische Chemie für CBI - WS0506 - Blatt 1 von 11 Schriftliche Leistungsüberprüfung PC/CBI WS0506-09.03.2006 Hörsaal H3 Name:. (Blockschrift!) A Vorname: (Blockschrift!)geb. am:. in:
Abschlusstest - Physikalische Chemie für CBI - WS0506 - Blatt 1 von 11 Schriftliche Leistungsüberprüfung PC/CBI WS0506-09.03.2006 Hörsaal H3 Name:. (Blockschrift!) A Vorname: (Blockschrift!)geb. am:. in:
Spinsysteme. AX 3 -Spinsystem
 Spinsysteme Eine Gruppe aus zwei oder mehreren Kernspins, die miteinander eine magnetische Wechselwirkung eingehen, bezeichnet man als ein Spinsystem. Die Struktur eines hochaufgelösten NMR-Spektrums und
Spinsysteme Eine Gruppe aus zwei oder mehreren Kernspins, die miteinander eine magnetische Wechselwirkung eingehen, bezeichnet man als ein Spinsystem. Die Struktur eines hochaufgelösten NMR-Spektrums und
Versuch: Reaktivität von primären, sekundären und tertiären Alkylbromiden gegenüber ethanolischer Silbernitratlösung. keine Reaktion.
 Philipps-Universität Marburg 15.01.2008 rganisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 5, Halogenalkane Versuch: Reaktivität von primären, sekundären
Philipps-Universität Marburg 15.01.2008 rganisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 5, Halogenalkane Versuch: Reaktivität von primären, sekundären
Das chemische Gleichgewicht
 Das chemische Gleichgewicht Modell: Geschlossenes Gefäß mit Flüssigkeit, die verdampft ( T=const ) Moleküle treten über in die Dampfphase H 2 O (l) H 2 O (g) H 2 O (g) Dampfdruck p H 2 O (l) T = const.
Das chemische Gleichgewicht Modell: Geschlossenes Gefäß mit Flüssigkeit, die verdampft ( T=const ) Moleküle treten über in die Dampfphase H 2 O (l) H 2 O (g) H 2 O (g) Dampfdruck p H 2 O (l) T = const.
Die Freie Aktivierungsenthalpie
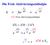 Die Freie Aktivierungsenthalpie E A G k Ae RT e = = RT G: Freie Aktivierungsenthalpie G = H T S e G RT = e S R e H RT e S R A H E A Katalyse: der aktivierte Übergangskomplex H E A Katalysatoren beeinflussen
Die Freie Aktivierungsenthalpie E A G k Ae RT e = = RT G: Freie Aktivierungsenthalpie G = H T S e G RT = e S R e H RT e S R A H E A Katalyse: der aktivierte Übergangskomplex H E A Katalysatoren beeinflussen
Dabei bezeichnet x die Einflussgrösse (Regressor), y die Zielvariable (die eine Folge der Ursache x ist) und die Störung. Die n = 3 Beobachtungen
 Lineare Regression und Matrizen. Einführendes Beispiel Der im Kapitel Skalarprodukt gewählte Lösungsweg für das Problem der linearen Regression kann auch mit Matrizen formuliert werden. Die Idee wird zunächst
Lineare Regression und Matrizen. Einführendes Beispiel Der im Kapitel Skalarprodukt gewählte Lösungsweg für das Problem der linearen Regression kann auch mit Matrizen formuliert werden. Die Idee wird zunächst
Stabilitätsuntersuchungen
 Stabilitätsuntersuchungen 52 3 Stabilitätsuntersuchungen 3 Stabilitätsuntersuchungen 3.1 Hydrolyse von 2-Imidazolinen 2-Imidazoline hydrolysieren im wässrigen Milieu unter Ringöffnung zu Formamiden (Abb.
Stabilitätsuntersuchungen 52 3 Stabilitätsuntersuchungen 3 Stabilitätsuntersuchungen 3.1 Hydrolyse von 2-Imidazolinen 2-Imidazoline hydrolysieren im wässrigen Milieu unter Ringöffnung zu Formamiden (Abb.
Physik III - Anfängerpraktikum- Versuch 601
 Physik III - Anfängerpraktikum- Versuch 601 Sebastian Rollke (103095) und Daniel Brenner (105292) 21. September 2005 Inhaltsverzeichnis 1 Theorie 2 1.1 Grundlagen.......................................
Physik III - Anfängerpraktikum- Versuch 601 Sebastian Rollke (103095) und Daniel Brenner (105292) 21. September 2005 Inhaltsverzeichnis 1 Theorie 2 1.1 Grundlagen.......................................
M_G7 EF Pvn Klausurvorbereitung: Lösungen 13. Oktober Klausurvorbereitung. Lösungen
 Klausurvorbereitung Lösungen I. Funktionen Funktionen und ihre Eigenschaften S. 14 Aufg. 2 f(-2)=0,5 f(0,1)=-10 f(78)= 1 78 g(-2)=-7 g(0,1)=-2,8 g(78)=153 h(-2)=57 h(0,1)=23,82 h(78)=11257 D f = R/{0}
Klausurvorbereitung Lösungen I. Funktionen Funktionen und ihre Eigenschaften S. 14 Aufg. 2 f(-2)=0,5 f(0,1)=-10 f(78)= 1 78 g(-2)=-7 g(0,1)=-2,8 g(78)=153 h(-2)=57 h(0,1)=23,82 h(78)=11257 D f = R/{0}
Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2005/
 Nachklausur zum Anorganisch-Chemischen Grundpraktikum vom 21.04.06 Seite 1 von 10 Punkte: von 98 Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2005/2006 21.04.2006 Matrikelnummer:
Nachklausur zum Anorganisch-Chemischen Grundpraktikum vom 21.04.06 Seite 1 von 10 Punkte: von 98 Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2005/2006 21.04.2006 Matrikelnummer:
0.1 Geschwindigkeit bei Reaktionen
 1 0.1 Geschwindigkeit bei Reaktionen Salzsäure reagiert mit Magnesium Erklärung 2HCl + Mg MgCl 2 + H 2 Das M g-pulver reagiert schneller mit der Salzsäure als die Mg-Späne. Definition: Reaktionsgeschwindigkeit
1 0.1 Geschwindigkeit bei Reaktionen Salzsäure reagiert mit Magnesium Erklärung 2HCl + Mg MgCl 2 + H 2 Das M g-pulver reagiert schneller mit der Salzsäure als die Mg-Späne. Definition: Reaktionsgeschwindigkeit
Schriftliche Leistungsüberprüfung PC/CBI
 Abschlusstest - Physikalische Chemie für CBI - SS07 - Blatt 1 von 12 Schriftliche Leistungsüberprüfung PC/CBI SS07-17.10.2007 Hörsaal H2 Name: Vorname: geb. am: in: Matrikelnummer: Unterschrift: Für die
Abschlusstest - Physikalische Chemie für CBI - SS07 - Blatt 1 von 12 Schriftliche Leistungsüberprüfung PC/CBI SS07-17.10.2007 Hörsaal H2 Name: Vorname: geb. am: in: Matrikelnummer: Unterschrift: Für die
Klausur Bachelorstudiengang Prüfung Modul Physikalische Chemie und Thermodynamik. Teil 1: Physikalische Chemie
 Bachelorstudiengang / Diplomstudiengang CBI - Teil Physikalische Chemie - WS0809 - Blatt 1 / 16 Klausur Bachelorstudiengang Prüfung Modul Physikalische Chemie und Thermodynamik Teil 1: Physikalische Chemie
Bachelorstudiengang / Diplomstudiengang CBI - Teil Physikalische Chemie - WS0809 - Blatt 1 / 16 Klausur Bachelorstudiengang Prüfung Modul Physikalische Chemie und Thermodynamik Teil 1: Physikalische Chemie
Aufgabe: Man bestimme die Geschwindigkeitskonstante für den Zerfall des Diacetonalkohols bei 293 und 303 K.
 A 31 Zersetzung von Diacetonalkohol Aufgabe: Man bestimme die Geschwindigkeitskonstante für den Zerfall des Diacetonalkohols bei 293 und 303 K. Grundlagen: Diacetonalkohol (ρ (20 C) = 0,931 g/cm 3 ) zerfällt
A 31 Zersetzung von Diacetonalkohol Aufgabe: Man bestimme die Geschwindigkeitskonstante für den Zerfall des Diacetonalkohols bei 293 und 303 K. Grundlagen: Diacetonalkohol (ρ (20 C) = 0,931 g/cm 3 ) zerfällt
Frank-Hertz-Versuch. Praktikumsversuch am Gruppe: 18. Thomas Himmelbauer Daniel Weiss
 Frank-Hertz-Versuch Praktikumsversuch am 13.04.2011 Gruppe: 18 Thomas Himmelbauer Daniel Weiss Abgegeben am: 04.04.2011 Inhaltsverzeichnis 1 Einleitung 2 2 Versuchsaufbau 2 3 Vorbemerkungen 2 3.1 Vermutlicher
Frank-Hertz-Versuch Praktikumsversuch am 13.04.2011 Gruppe: 18 Thomas Himmelbauer Daniel Weiss Abgegeben am: 04.04.2011 Inhaltsverzeichnis 1 Einleitung 2 2 Versuchsaufbau 2 3 Vorbemerkungen 2 3.1 Vermutlicher
KOMPETENZHEFT ZU STAMMFUNKTIONEN
 KOMPETENZHEFT ZU STAMMFUNKTIONEN 1. Aufgabenstellungen Aufgabe 1.1. Finde eine Funktion F (x), die F (x) = f(x) erfüllt. a) f(x) = 5 x 2 2 x + 8 e) f(x) = 1 + x x 2 b) f(x) = 1 x4 10 f) f(x) = e x + 2
KOMPETENZHEFT ZU STAMMFUNKTIONEN 1. Aufgabenstellungen Aufgabe 1.1. Finde eine Funktion F (x), die F (x) = f(x) erfüllt. a) f(x) = 5 x 2 2 x + 8 e) f(x) = 1 + x x 2 b) f(x) = 1 x4 10 f) f(x) = e x + 2
Das Iod-Verteilungsgleichgewicht. Online-Ergänzung
 Das Iod-Verteilungsgleichgewicht Ein problemorientierter Zugang zum chemischen Gleichgewicht zur Schulung der naturwissenschaftlichen Arbeitsweise im Chemieunterricht S. I S. I + II S. II HOLGER FLEISCHER
Das Iod-Verteilungsgleichgewicht Ein problemorientierter Zugang zum chemischen Gleichgewicht zur Schulung der naturwissenschaftlichen Arbeitsweise im Chemieunterricht S. I S. I + II S. II HOLGER FLEISCHER
2.Präparat: 1,2 Dibrom -1-phenylethan
 Marcus Wolf 04.06.3 2.Präparat: 1,2 Dibrom -1-phenylethan Literatur: Autorenkollektiv; Organikum; VEB Deutscher Verlag der Wissenschaften Berlin;7. Auflage; 1967; Seite 246 Streitwieser/eathcock ; Organische
Marcus Wolf 04.06.3 2.Präparat: 1,2 Dibrom -1-phenylethan Literatur: Autorenkollektiv; Organikum; VEB Deutscher Verlag der Wissenschaften Berlin;7. Auflage; 1967; Seite 246 Streitwieser/eathcock ; Organische
mathphys-online Abschlussprüfung Berufliche Oberschule 2011 Mathematik 12 Technik - A II - Lösung Teilaufgabe 1.0
 Abschlussprüfung Berufliche Oberschule Mathematik Technik - A II - Lösung Teilaufgabe. Gegeben sind die reellen Funktionen f( x) mit x IR. Teilaufgabe. (5 BE) Untersuchen Sie das Verhalten der Funktionswerte
Abschlussprüfung Berufliche Oberschule Mathematik Technik - A II - Lösung Teilaufgabe. Gegeben sind die reellen Funktionen f( x) mit x IR. Teilaufgabe. (5 BE) Untersuchen Sie das Verhalten der Funktionswerte
Verseifungsgeschwindigkeit eines Esters
 A 32 Verseifungsgeschwindigkeit eines Esters Aufgabe: Man bestimme die Geschwindigkeitskonstante k der Methylacetatverseifung bei 2 verschiedenen Temperaturen und berechne daraus den Vorfaktor sowie die
A 32 Verseifungsgeschwindigkeit eines Esters Aufgabe: Man bestimme die Geschwindigkeitskonstante k der Methylacetatverseifung bei 2 verschiedenen Temperaturen und berechne daraus den Vorfaktor sowie die
Schriftliche Leistungsüberprüfung PC/CBI
 Abschlusstest - Physikalische Chemie für CBI - SS07 - Blatt 1 von 14 Schriftliche Leistungsüberprüfung PC/CBI SS07-24.07.2007 Hörsaal H1 Name: Vorname: geb. am: in: Matrikelnummer: Unterschrift: Für die
Abschlusstest - Physikalische Chemie für CBI - SS07 - Blatt 1 von 14 Schriftliche Leistungsüberprüfung PC/CBI SS07-24.07.2007 Hörsaal H1 Name: Vorname: geb. am: in: Matrikelnummer: Unterschrift: Für die
Abschlussbericht zu Kennziffer 2472: Experimentelle Bestimmung von Grenzaktivitätskoeffizienten in ternären und höheren Elektrolytsystemen
 Abschlussbericht zu Kennziffer 2472: Experimentelle Bestimmung von Grenzaktivitätskoeffizienten in ternären und höheren Elektrolytsystemen Während es bei Nichtelektrolytsystemen möglich ist, mit Hilfe
Abschlussbericht zu Kennziffer 2472: Experimentelle Bestimmung von Grenzaktivitätskoeffizienten in ternären und höheren Elektrolytsystemen Während es bei Nichtelektrolytsystemen möglich ist, mit Hilfe
2. Übungsblatt. Organische Chemie für Studierende mit Nebenfach Chemie
 Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
Ergebnisse und Interpretation 54
 Ergebnisse und Interpretation 54 4 Ergebnisse In den Abbildungen 24/4.1 bis 29/4.1 werden die Laktat-Geschwindigkeits-Kurve und die Herzfrequenzwerte der beiden Schwimmgruppen (Männer: n=6, Frauen: n=8)
Ergebnisse und Interpretation 54 4 Ergebnisse In den Abbildungen 24/4.1 bis 29/4.1 werden die Laktat-Geschwindigkeits-Kurve und die Herzfrequenzwerte der beiden Schwimmgruppen (Männer: n=6, Frauen: n=8)
Übungsklausur Analysis & Geometrie Stausee & Personenaufzug Pflichtteil (ohne Hilfsmittel)
 Pflichtteil (ohne Hilfsmittel) ) Berechne die. Ableitung. a) f(x) 3x sin( x ) b) f(x) 3x sin( x ) (VP) 3 ) Berechne und vereinfache x 3) Bestimme die Lösungsmenge der Gleichung sin( x) dx. (3VP) cos(x)
Pflichtteil (ohne Hilfsmittel) ) Berechne die. Ableitung. a) f(x) 3x sin( x ) b) f(x) 3x sin( x ) (VP) 3 ) Berechne und vereinfache x 3) Bestimme die Lösungsmenge der Gleichung sin( x) dx. (3VP) cos(x)
8 Kristallisation von Propen Copolymeren und Ethen-1-Hexen Copolymeren
 60 Einleitung 8 Kristallisation von Propen Copolymeren und Ethen-1-Hexen Copolymeren 8.1 Einleitung Die Untersuchung der Kristallisation von Polymeren ist ein dynamisches Wissenschaftsgebiet, erst mit
60 Einleitung 8 Kristallisation von Propen Copolymeren und Ethen-1-Hexen Copolymeren 8.1 Einleitung Die Untersuchung der Kristallisation von Polymeren ist ein dynamisches Wissenschaftsgebiet, erst mit
