Nr. Aufgabe Pkt. 2.2 Erklären Sie die ungewöhnliche Stabilität aromatischer Systeme gegenüber Additionsversuchen!
|
|
|
- Hinrich Egger
- vor 5 Jahren
- Abrufe
Transkript
1 aromatische Kohlenwasserstoffe Jahrgang Index Nr. Aufgabe Pkt 15/IV 1 o-bromtoluol soll aus Benzol, Methan und Brom mit geeigneten Katalysatoren hergestellt werden. Beschreiben Sie unter Verwendung von Gleichungen (kein Mechanismus) und Angabe der jeweiligen Reaktionsbedingungen einen möglichen Syntheseweg 11 2 Etyhlbenzol wird in der Hitze bei Abwesenheit eines Katalysators mit Brom zur Reaktion gebracht.geben Sie die Strukturformeln der unter diesen Bedingungen entstehenden Monobromderivate an! Begründen Sie unter Mitverwendung von Grenzformeln, welche dieser Verbindungen bevorzugt gebildet wird! 1/II Toluol (Methylbenzol) wird bei unterschiedlichen Bedingungen mit Brom zur Reaktion gebracht: a) Brom wirkt bei starker Belichtung und unter Luftabschluß auf Toluol ein; b) Brom wird im Dunkeln zu Toluol, dem etwas Aluminiumbromid zuge-setzt ist, zugegeben..1 Vergleichen Sie die Reaktionsabläufe bei a und b, und arbeiten Sie die Unterschiede in den Reaktionsmechanismen heraus! Erstellen Sie dazu die entsprechenden Reaktionsgleichungen!.2 Erläutern Sie, weshalb bei Phenol die Bromierung leichter als bei Toluol gelingt! Stellen Sie eine mögliche Reaktionsgleichung auf! 17/IV 2 Zwei Mol Benzol bzw. drei Mol 1,-Cyclohexadien bzw. sechs Mol Cyclohexen werden jeweils durch sechs Mol Wasserstoffgas zu Cyclohexan hydriert. Dabei werden folgende Energiebeträge freigesetzt: 1 kj; 71 kj; kj.stellen Sie die drei Reaktionsgleichungen auf, und ordnen Sie den jeweiligen Reaktionen die angegebenen Energiebeträge zu!begründen Sie Ihre Entscheidung! 1/I 2 Kennzeichnend für den aromatischen Charakter einer organischen Verbindung sind Substitutions- und nicht Additionsreaktionen. 2.1 Beschreiben Sie in allgemeiner Form den prinzipiellen Ablauf einer aromatischen Substitution, und fertigen Sie ein zugehöriges Energiediagramm an! 2.2 Erklären Sie die ungewöhnliche Stabilität aromatischer Systeme gegenüber Additionsversuchen! 2. Stellen Sie das Verhalten des aromatisch-aliphatischen Kohlenwasserstoffs Toluol gegenüber elementarem Brom einerseits bei kräftiger Belichtung und andererseits bei Zusatz von Eisenfeilspänen zum elementaren Brom mit je einer Strukturformelgleichung dar! 10 2
2 2. Geben Sie mit Strukturformeln die Reaktionsschritte der Halogenierung von Benzol mit Bromchlorid an!welche Beweisführung ist durch die Reaktion von Benzol mit dieser Interhalogenverbindung 1/IV 1 Bei der vollständigen Hydrierung von 2 mol Benzol bzw. mol 1,-Butadien bzw. mol 1-Buten benötigt man jeweils mol Wasserstoff (H2). Trotzdem unterscheiden sich die bei den Reaktionen jeweils freigesetzten Gesamtenergiebeträge voneinander:reaktionsenthalpie HR : 75 kj, 70 kj, 17 kj.stellen Sie die Reaktionsgleichung auf, ordnen Sie den einzelnen Reaktionen die entsprechenden Reaktionsenthalphien zu, und begründen Sie Ihre Entscheidung! 1.2 Zu 1-Buten bzw. Benzol wird bei Zimmertemperatur etwas Brom gegeben.beschreiben Sie die möglichen Beobachtungen, und stellen Sie gegebenenfalls die Reaktionsgleichung mit Strukturformeln auf (kein Mechanismus)! 1. Unter den gleichen Bedingungen wie in 1.2 wird Anilin (Aminobenzol) mit Brom versetzt. Erörtern Sie die Reaktion zwischen Brom und Anilin unter Mitverwendung des Reaktionsmechanismus bis zur Stufe des Monobromderivates! 1. Der pk B -Wert des aromatischen Amins Anilin beträgt,, der für das aliphatische Amin Methylamin (CH NH 2 ),. Leiten Sie aus den Molekülstrukturen den Unterschied in der Basiszität der beiden Verbindungen ab! 10/I 1 Gegeben sind die Stoffe Cyclohexan, Cyclohexen und Benzol. 1.1 Beschreiben Sie anhand des Orbitalmodells unter Mitverwendung einer Skizze die Bindungsverhältnisse im Benzolmolekül! 1.2 Die drei unter Nummer 1 genannten Stoffe sollen mit jeweils der gleichen Stoffmenge Brom zur Reaktion gebracht werden Geben Sie die Reaktionsbedingungen an, und stellen Sie die drei Reaktionsgleichungen mit Strukturformeln auf! Formulieren Sie den Mechanismus der Reaktion zwischen Brom und Benzol bis zur Bildung des Monobrombenzols! 11/I Benzol, Phenol und Nitrobenzol lassen sich nitrieren. Dabei erfolgt die Nitrierung von Phenol rascher als die von Benzol, die Nitrierung von Nitrobenzol dagegen langsamer als die von Benzol..1 Erläutern Sie den Reaktionsmechnismus der Nitrierung von Benzol unter Mitverwendung von Strukturformelgleichungen! 7
3 .2 Begründen Sie unter Mitverwendung von Strukturformeln die unterschiedlichen Geschwindigkeiten der unter Nummer genannten Nitrierungen, und erläutern Sie die dirigierende Wirkung der Erstsubstituenten bei der Nitrierung von Phenol und Nitrobenzol! 12/I Schüttelt man Bromwasser (bei Zimmertemperatur) mit Benzol und läßt die Emulsion anschließend stehen, dann trennen sich die beiden Phasen Wasser und Benzol wieder.man beobachtet, daß Brom aus der wäßrigen in die organische Phase übergegangen ist, eine Entfärbung aber nicht stattgefunden hat. Gibt man zur benzolischen Bromlösung noch Cyclohexen, so verschwindet nach kurzem Schütteln die auf Brom zurückgehende Farbe..1 Erklären Sie alle angeführten Beobachtungen! (Kein Reaktionsmechanismus!).2 Um auch Benzol zur Reaktion zubringen, wird dem Brom-Benzol-Gemisch Eisen(III)-bromid zugesetzt.stellen Sie den Reaktionsmechanismus unter Mitverwendung von Strukturformeln dar! 1/III Die Xanthoproteinreaktion von Eiweißstoffen mit konzentrierter Salpeter-säure tritt ein, wenn in diesen aromatische Aminosäuren, z. B. Tyrosin, gebunden sind. Hierbei erfolgt eine Nitrierung des aromatischen Ringsystems. Stellen Sie den Mechanismus der Nitrierung von Phenol unter Mitverwen-dung von Strukturformelgleichungen bis zu den bevorzugten Monosubstitutionsprodukten dar! 1/II Anilin (Aminobenzol), ein wichtiger Grundstoff der Farbstoffchemie, kann aus Benzol über Nitrobenzol hergestellt werden..1 Beschreiben Sie die Durchführung der Nitrierung von Benzol, und erläutern Sie unter Mitverwendung von Strukturformeln den Mechanismus dieser Reaktion!.2 Erklären Sie unter Mitverwendung einer Gleichung, warum sich Anilin in Salzsäure besser löst als in Wasser! 15/II 1 Kekulé schlug 15 für das Benzolmolekül eine heute nach ihm benannte Strukturformel vor, die Benzol als Cyclohexatrien beschrieb. Hätte das Benzol-Molekül jedoch diese Kekulé-Struktur, müßte bei der Totalhydrierung eine Enthalpie von ca. 0 kj /mol frei werden. Tatsächlich mißt man aber eine Hydrierungsenthalpie von etwa 20 kj /mol. 1.1 Erklären Sie den Unterschied zwischen erwartetem und gefundenem Wert der Hydrierungsenthalpie! 1.2 Sowohl Benzol als auch Phenol können nitriert werden Benennen und formulieren Sie unter Mitverwendung von Strukturformeln den Mechanismus der Nitrierung von Benzol bis zum Nitrobenzol! 5 7
4 1.2.2 Während sich Phenol leicht zu Trinitrophenol nitrieren läßt, führt die Nitrierung von Benzol nur unter Extrembedingungen zu Trinitrobenzol.Erklären Sie das unterschiedliche Reaktionsverhalten der beiden Edukte! 1.2. Phenol und 2,,-Trinitrophenol unterscheiden sich erheblich in der Säurestärke.Ordnen Sie die pks-werte 0,22 und, den Verbindungen zu, und begründen Sie die Zuordnung! 1/II 2 Sowohl bei Alkenen als auch bei Benzol sind Substitutionen und Additionen möglich. 2.1 Bei der Reaktion von Propen mit Wasserstoffchlorid (Chlorwasserstoff) entsteht ausschließlich 2- Chlorpropan.Erklären Sie diesen Befund anhand der Vorstellungen über den Ablauf dieser Addition! Strukturformeln möglicher Zwischenprodukte sind mitzuverwenden. 2.2 Die Reaktion von Wasserstoffbromid (Bromwasserstoff) an trans-2-penten liefert ein Gemisch aus zwei sich in ihrer Konstitution unterscheidenden Additionsprodukten Formulieren Sie die Strukturformelgleichungen der beiden Reaktionen, und benennen Sie diese Produkte! Erklären Sie diesen Befund aufgrund eines Vergleichs der Zwischenprodukte beider Reaktionen! Geben Sie dabei die Strukturformeln beider Zwischenprodukte an! 2. Die Chlorierung von Ethen bzw. Benzol bei Raumtemperatur läuft über analoge Zwischenprodukte ab, ist jedoch verschiedenen Reaktionstypen zuzuordnen.erklären Sie unter Mitverwendung von Energiediagrammen das unterschiedliche Verhalten der Zwischenprodukte bei beiden Reaktionen! 5 1/III 2 Ethin gewinnt man in großem Maßstab aus Methan im elektrischen Licht-bogen; dabei entsteht neben Ethin auch Wasserstoff. Ethin kann als Ausgangsstoff für eine Synthese des Benzols dienen. 2.1 Stellen Sie die Strukturformelgleichungen für die beiden Synthesen auf! 2.2 Beschreiben Sie a) die Molekülgeometrie des Ethins bzw. Benzols sowie b) auf der Grundlage des Orbitalmodells die Bindungsverhältnisse in beiden Molekülen! 2. Sowohl Benzol als auch die Benzolderivate Phenol (Hydroxybenzol) und Toluol (Methylbenzol) können mit Brom zur Reaktion gebracht werden.legen Sie den Zusammenhang zwischen den Reaktionsbedingungen und den Mechanismen der Substitutionsreaktionen an diesen drei Verbindungen dar, und zeichnen Sie die Strukturformeln der Monobromierungsprodukte! 2
5 17/II 2 Die Reaktion von Brom mit Methylbenzol kann je nach Reaktionsbedingungen zu verschiedenen Monobromderivaten führen. 2.1 Legen Sie den Zusammenhang zwischen den Reaktionsbedingungen und den ent-stehenden Produkten dar! 2.2 Beschreiben Sie unter Mitverwendung von Strukturformeln die zugehörigen Reaktionsmechanismen! 2000/II 1 Die aromatischen Ringsysteme folgender Verbindungen sollen zu Monobromderivaten umgesetzt werden. Benzol (A), Anilin (B) und Aniliniumchlorid(C) 1.1 Erläutern Sie unter Mitverwendung von Strukturformeln den Reaktionsmechanismus der Bromierung von Benzol! 1.2 Vergleichen Sie die Reaktionsbedingungen für die Bromierung von A und B und begründen Sie unter Mitverwendung von Grenzformeln den Unterschied! 1. Bei der Bromierung von Aniliniumchlorid entsteht als organisches Produkt fast ausschließlich - Bromaniliniumchlorid.Begründen Sie diesen Reaktionsverlauf unter Mitverwendung von Grenzformeln und vergleichen Sie die Geschwindigkeit dieser Reaktion mit den Geschwindigkeiten der Reaktionen von A und B! 1. Toluol wird in der Seitenkette monobromiert. Vergleichen Sie die Geschwindigkeit dieser Reaktion mit der Monobromierung von Methan und begründen Sie Ihre Aussagen unter Mitverwendung von Grenzformeln! 2001/III Die Synthese von Harzen aus Phenol und Methanal kann über 2- oder -Hydroxymethylphenol (HO-C H - CH 2 OH) bzw. 2- oder -Hydroxy-methy1phenolat ablaufen. Diese Zwischenprodukte können aus Phenol und Methanal unter Säure- bzw. unter Basenkatalyse entstehen..1 Erörtern Sie, weshalb hier sowohl Säuren als auch Basen als Katalysatoren dienen können!.2 Formulieren Sie den Mechanismus der basenkatalysierten Bildung eines Hydroxymethylphenolats mit Strukurformelgleichungen! 2002/III 2 Nitrobenzol ist ein wichtiger Ausgangsstoff für die industrielle Gewinnung von Anilin. 2.1 Formulieren Sie unter Verwendung von Strukturformeln den Reaktionsmechanismus für die Nitrierung von Benzol! Erstellen Sie auch die Reaktionsgleichung für die Bildung des Elektrophils! 2.2 C,H-Bindungen werden schneller gespalten als C,D- Bindungen (D = Deuterium; schwerer Wasserstoff).Begründen Sie, weshalb die Reaktionsgeschwindigkeiten der Nitrierung von Deuterobenzol C D und Benzol C H trotzdem gleich groß sind! 5
6 2. Bei der Nitrierung von Phenol entstehen drei verschiedene organische Monosubstitutionsprodukte in sehr unterschiedlicher Menge. Begründen Sie unter Mitverwendung von Grenzformeln, warum eines der Produkte nur in sehr geringer, die beiden anderen dagegen in deutlich höherer Ausbeute entstehen! 200/I 2 Durch die Wahl der Reaktionsbedingungen können in der präparativen organischen Chemie bestimmte Reaktionswege begünstigt werden. Dies gilt z. B. auch für die Monobromierung von Ethylbenzol. 2.1 Legen Sie dar, unter welchen Bedingungen die Bromierung im Ring bzw. in der Seitenkette erfolgt!bei der Monobromierung der Seitenkette entsteht ein organisches Produkt bevorzugt. Formulieren Sie für dessen Bildung den Reaktionsmechanismus mit Strukturformeln! 2.2 Das unter Nr. 2.l bei der Seitenkettenbromierung erhaltene organische Produkt kann man auch aus Ethenylbenzol (Styrol) herstellen.stellen Sie den Mechanismus dieser Reaktion mit Strukturformeln dar und benennen Sie ihn! 2. Begründen Sie unter Verwendung von Grenzstrukturformeln für die Teilaufgaben 2.1 und 2.2, warum von den jeweils zwei denkbaren Produkten eines bevorzugt entsteht 200/I 2.2 Formulieren Sie die Redoxgleichung für die Darstellung von Benzoesäure aus Toluol und Kaliumpermanganat in schwefelsaurer Lösung! 200/III 1 Cyclohexen, Cyclohexa-l,-dien und Benzol werden jeweils zu Cyclohexan hydriert. Die freigesetzte Hydrierungsenthalpie pro Mol Wasserstoffbeträgt für Cyclohexen 120 kj, für Cyclohexa-l,-dien 115 kj und für Benzol,7 kj. 1.1 Formulieren Sie für die drei Hydrierungen zu Cyclohexan die Strukturformelgleichungen und geben Sie jeweils den Energieumsatz pro Mol Kohlenwasserstoff an! 1.2 Vergleichen Sie unter Mitverwendung von Strukturformeln bzw. Grenzstrukturformeln die Mechanismen der Bromierung von Cyclohexen und der Bromierung von Benzol! Erörtern Sie Gemeinsamkeiten und Unterschiede der Mechanismen! 7 12
Abituraufgaben Benzol und Derivate 1978/II 1979/II/3 1983/II/2 1985/IV/1 1986/II/4
 Abituraufgaben Benzol und Derivate 1978/II 1. Welche Experimentalbefunde (Isomerieverhältnisse betreffend) stützen die als Lösung des "Benzolproblems" von Kekule vorgeschlagene Beschreibung des Benzolmoleküls?
Abituraufgaben Benzol und Derivate 1978/II 1. Welche Experimentalbefunde (Isomerieverhältnisse betreffend) stützen die als Lösung des "Benzolproblems" von Kekule vorgeschlagene Beschreibung des Benzolmoleküls?
Grundkurs Chemie Alkane
 Grundkurs Chemie Alkane Abituraufgaben 1975/I Monobrompropan soll auf zwei verschiedenen Synthesewegen aus zwei verschiedenen Kohlenwasserstoffen hergestellt werden. 1. Bennen Sie die dafür geeigneten
Grundkurs Chemie Alkane Abituraufgaben 1975/I Monobrompropan soll auf zwei verschiedenen Synthesewegen aus zwei verschiedenen Kohlenwasserstoffen hergestellt werden. 1. Bennen Sie die dafür geeigneten
Alkene 1975/III Äthan und Athen reagieren mit Brom! a) Unter welchen Versuchsbedingungen laufen diese Reaktionen ab? b) Formulieren Sie die
 Alkene 1975/III Äthan und Athen reagieren mit Brom! a) Unter welchen Versuchsbedingungen laufen diese Reaktionen ab? b) Formulieren Sie die Reaktionsgleichungen und benennen Sie die Reaktionsprodukte!
Alkene 1975/III Äthan und Athen reagieren mit Brom! a) Unter welchen Versuchsbedingungen laufen diese Reaktionen ab? b) Formulieren Sie die Reaktionsgleichungen und benennen Sie die Reaktionsprodukte!
1.2 Vergleichen Sie die Reaktionsbedingungen für die Bromierung von A und B und begründen Sie unter Mitverwendung von Grenzformeln den Unterschied!
 Aufgabe II Die aromatischen Ringsysteme folgender Verbindungen sollen zu Monobromderivaten umgesetzt werden: Benzol (A), Anilin (B) und Aniliniumchlorid (C). 1.1 Erläutern Sie unter Mitverwendung von Strukturformeln
Aufgabe II Die aromatischen Ringsysteme folgender Verbindungen sollen zu Monobromderivaten umgesetzt werden: Benzol (A), Anilin (B) und Aniliniumchlorid (C). 1.1 Erläutern Sie unter Mitverwendung von Strukturformeln
3.2.2 Beschreiben Sie für jedes der beiden Moleküle die räumliche Anordnung der
 Abituraufgaben Alkene 1979/II/2 2.1 Chlorwasserstoff reagiert mit Buten -(1). Formulieren und begründen Sie den Ablauf der Reaktion. 2.2 Chlorwasserstoff reagiert mit Butadien -(1,3). Formulieren Sie die
Abituraufgaben Alkene 1979/II/2 2.1 Chlorwasserstoff reagiert mit Buten -(1). Formulieren und begründen Sie den Ablauf der Reaktion. 2.2 Chlorwasserstoff reagiert mit Butadien -(1,3). Formulieren Sie die
Abituraufgaben Grundkurs Chemie. Benzol. 1. a) Erklären Sie am Beispiel der. Benzols den Begriff der Mesomeriestabilsierung!
 Abituraufgaben Grundkurs Chemie Benzol 1975/V 1. a) Erklären Sie am Beispiel der. Benzols den Begriff der Mesomeriestabilsierung! b) Zeigen Sie, wie die Mesomerieenergie des Benzols ermittelt werden kann!
Abituraufgaben Grundkurs Chemie Benzol 1975/V 1. a) Erklären Sie am Beispiel der. Benzols den Begriff der Mesomeriestabilsierung! b) Zeigen Sie, wie die Mesomerieenergie des Benzols ermittelt werden kann!
Abituraufgaben Alkane 1980/II/3 1981/II/1
 Abituraufgaben Alkane 1980/II/3 3 Skizzieren Sie das Energiediagramm für die Konformationen des n-butans bei der Rotation (Rotationswinkel 0 bis 180 ) um die Bindung zwischen dem zweiten und dritten Kohlenstoffatom.
Abituraufgaben Alkane 1980/II/3 3 Skizzieren Sie das Energiediagramm für die Konformationen des n-butans bei der Rotation (Rotationswinkel 0 bis 180 ) um die Bindung zwischen dem zweiten und dritten Kohlenstoffatom.
Aufgabe S. 2/a (6 Punkte) Zeichnen Sie die Strukturformeln der folgenden Verbindungen! 3-Ethylheptan-2-on
 15-2 2 Aufgabe S. 2/a (6 Punkte) Zeichnen Sie die Strukturformeln der folgenden Verbindungen! Pyridin Acetylchlorid p-xylol 3-Ethylheptan-2-on Glycol Ölsäure Aufgabe S. 2/b (6 Punkte) Zeichnen Sie jeweils
15-2 2 Aufgabe S. 2/a (6 Punkte) Zeichnen Sie die Strukturformeln der folgenden Verbindungen! Pyridin Acetylchlorid p-xylol 3-Ethylheptan-2-on Glycol Ölsäure Aufgabe S. 2/b (6 Punkte) Zeichnen Sie jeweils
Lösung :Aromatische Kohlenwasserstoffe Kursleiter Klaus Bentz/ Kollegiat Andreas Maier Abiturjahrgang
 Lösung :Aromatische Kohlenwasserstoffe Kursleiter Klaus Bentz/ Kollegiat Andreas Maier Abiturjahrgang 2004 1985/IV/1 Zunächst wird Methan bei Licht bromiert: 4 2 3 Gemäß der FriedelraftSynthese unter Verwendung
Lösung :Aromatische Kohlenwasserstoffe Kursleiter Klaus Bentz/ Kollegiat Andreas Maier Abiturjahrgang 2004 1985/IV/1 Zunächst wird Methan bei Licht bromiert: 4 2 3 Gemäß der FriedelraftSynthese unter Verwendung
SCHRIFTLICHE ABITURPRÜFUNG 2006 CHEMIE (Grundkursniveau)
 CHEMIE (Grundkursniveau) Einlesezeit: Bearbeitungszeit: 30 Minuten 210 Minuten Der Prüfling wählt je ein Thema aus den Gebieten G (Grundlagen) und V (Vertiefung) zur Bearbeitung aus. Die zwei zur Bewertung
CHEMIE (Grundkursniveau) Einlesezeit: Bearbeitungszeit: 30 Minuten 210 Minuten Der Prüfling wählt je ein Thema aus den Gebieten G (Grundlagen) und V (Vertiefung) zur Bearbeitung aus. Die zwei zur Bewertung
Abiturprüfung 1995 (Bayern) CHEMIE als Grundkursfach Arbeitszeit 180 Minuten
 Abiturprüfung 1995 (Bayern) CHEMIE als Grundkursfach Arbeitszeit 180 Minuten I BE 1 Isomere Alkane unterscheiden sich in physikalischen Eigenschaften. 1.1 Geben Sie die Strukturformeln der drei isomeren
Abiturprüfung 1995 (Bayern) CHEMIE als Grundkursfach Arbeitszeit 180 Minuten I BE 1 Isomere Alkane unterscheiden sich in physikalischen Eigenschaften. 1.1 Geben Sie die Strukturformeln der drei isomeren
1.4 Die elektrophile aromatische Substitution
 1.4 Die elektrophile aromatische Substitution Versuch: Bromierung von Toluol mit Eisen V In einem RG werden 2ml Toluol mit 0,5 g Eisenspänen gemischt. Hierzu werden 5 Tropfen Brom gegeben B Es bildet sich
1.4 Die elektrophile aromatische Substitution Versuch: Bromierung von Toluol mit Eisen V In einem RG werden 2ml Toluol mit 0,5 g Eisenspänen gemischt. Hierzu werden 5 Tropfen Brom gegeben B Es bildet sich
Chemie für Biologen, 2017
 Chemie für Biologen, 2017 Übung 11 Organisch chemische Reaktionen (Thema 12.1 12.6) Aufgabe 1: a) Erklären Sie folgende Begriffe: i) Übergangszustand Zustand der höchsten Energie in einer Reaktion, kann
Chemie für Biologen, 2017 Übung 11 Organisch chemische Reaktionen (Thema 12.1 12.6) Aufgabe 1: a) Erklären Sie folgende Begriffe: i) Übergangszustand Zustand der höchsten Energie in einer Reaktion, kann
Aufgabe S. 2/a (6 Punkte) Zeichnen Sie die Strukturformeln der folgenden Verbindungen! 3-Ethylheptan-2-on
 15-3 2 Aufgabe S. 2/a (6 Punkte) Zeichnen Sie die Strukturformeln der folgenden Verbindungen! Anilin Propionsäure Phenol 3-Ethylheptan-2-on Glycerin Formaldehyd Aufgabe S. 2/b (6 Punkte) Zeichnen Sie jeweils
15-3 2 Aufgabe S. 2/a (6 Punkte) Zeichnen Sie die Strukturformeln der folgenden Verbindungen! Anilin Propionsäure Phenol 3-Ethylheptan-2-on Glycerin Formaldehyd Aufgabe S. 2/b (6 Punkte) Zeichnen Sie jeweils
Übungen Kapitel 1 Alkane- Radikalische Substitution
 Übungen Kapitel 1 Alkane- Radikalische Substitution 1. Ein Gemisch aus Halogen und Alkan reagiert bei Bestrahlung mit UV- Licht oder höheren Temperaturen (Bsp. die Gase Methan und Chlor erst bei 250-400
Übungen Kapitel 1 Alkane- Radikalische Substitution 1. Ein Gemisch aus Halogen und Alkan reagiert bei Bestrahlung mit UV- Licht oder höheren Temperaturen (Bsp. die Gase Methan und Chlor erst bei 250-400
Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag)
 Pharmazeutische Chemie Seite 1 Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag) Fragen zu der sp³ Hybridisierung (S. 124-128): 1.) Notieren Sie die Elektronenverteilung
Pharmazeutische Chemie Seite 1 Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag) Fragen zu der sp³ Hybridisierung (S. 124-128): 1.) Notieren Sie die Elektronenverteilung
Lösungen zu Übungsaufgaben Mechanismen 1 LK 12/1 Chemie
 1. Die radikalische Substitution 2-Methylbutan soll mit Brom im Sinne einer radikalischen Substitution reagieren. Betrachtet sei zunächst nur die Monobromierung. a) Formulieren Sie die Summengleichung
1. Die radikalische Substitution 2-Methylbutan soll mit Brom im Sinne einer radikalischen Substitution reagieren. Betrachtet sei zunächst nur die Monobromierung. a) Formulieren Sie die Summengleichung
Dritte Klausur zur Vorlesung Grundlagen der Organischen Chemie
 Prof. Dr. Jens Christoffers 10. März 2008 Universität Oldenburg Dritte Klausur zur Vorlesung Grundlagen der Organischen Chemie (für Studierende der Chemie ist dies die zweite Klausur, für Umweltwissenschaftler
Prof. Dr. Jens Christoffers 10. März 2008 Universität Oldenburg Dritte Klausur zur Vorlesung Grundlagen der Organischen Chemie (für Studierende der Chemie ist dies die zweite Klausur, für Umweltwissenschaftler
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Halogenierung von gesättigten Kohlenwaserstoffen
 Halogenierung von gesättigten Kohlenwaserstoffen Reaktivität Halogene: F 2 > Cl 2 > Br 2 > J 2 Reaktivität CH-Gruppen: primäre CH < sekundäre CH < tertiäre CH Bei Temperatursteigerung verringern sich die
Halogenierung von gesättigten Kohlenwaserstoffen Reaktivität Halogene: F 2 > Cl 2 > Br 2 > J 2 Reaktivität CH-Gruppen: primäre CH < sekundäre CH < tertiäre CH Bei Temperatursteigerung verringern sich die
Aufgabe S. 2/a (2 Punkte) Wodurch können Sie Cyclopenten von Benzol unterscheiden?
 14-1 2 Zur Punktevergabe bei multiple choice-aufgaben: Meist gibt es 5 Antwortmöglichkeiten, und 2 Punkte können pro Aufgabe erreicht werden. Pro falscher Antwort (Kreuz zu viel, aber auch fehlend) wird
14-1 2 Zur Punktevergabe bei multiple choice-aufgaben: Meist gibt es 5 Antwortmöglichkeiten, und 2 Punkte können pro Aufgabe erreicht werden. Pro falscher Antwort (Kreuz zu viel, aber auch fehlend) wird
Beispielaufgaben IChO 2. Runde 2019 Säurederivate. H2, Pd/C
 Beispielaufgaben Ih 2. Runde 2019 Säurederivate Beispiel 1 ligocarbonsäuren Gegeben sei folgendes Reaktionsschema: A H2, Pd/ H 2, Lindlar Na/NH 3(l) B D Base E A hat eine molare Masse von 118,09 g mol
Beispielaufgaben Ih 2. Runde 2019 Säurederivate Beispiel 1 ligocarbonsäuren Gegeben sei folgendes Reaktionsschema: A H2, Pd/ H 2, Lindlar Na/NH 3(l) B D Base E A hat eine molare Masse von 118,09 g mol
Klausur Organische Chemie II für Biotechnoligen Prüfung 32330/32231
 Klausur Organische Chemie II für Biotechnoligen Prüfung 32330/32231 Fachhochschule Aachen, Campus Jülich Fachprüfung 32330/32231 Organische Chemie für Biotechnologen II Prüfungsdatum: 10.07.2013 Prüfungsdauer:
Klausur Organische Chemie II für Biotechnoligen Prüfung 32330/32231 Fachhochschule Aachen, Campus Jülich Fachprüfung 32330/32231 Organische Chemie für Biotechnologen II Prüfungsdatum: 10.07.2013 Prüfungsdauer:
Chemie für Biologen, a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride?
 Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
Chemisches Praktikum für Studierende der Humanmedizin, der Zahnheilkunde und Biologie/Lehramt
 Chemisches Praktikum für Studierende der Humanmedizin, der Zahnheilkunde und Biologie/Lehramt Fachbereich Chemie der Philipps-Universität Marburg 1. Klausur zum 2. Praktikumsteil (OC) vom 06.07.2013 NAME;
Chemisches Praktikum für Studierende der Humanmedizin, der Zahnheilkunde und Biologie/Lehramt Fachbereich Chemie der Philipps-Universität Marburg 1. Klausur zum 2. Praktikumsteil (OC) vom 06.07.2013 NAME;
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Teil 1 Aufgaben zum Stoff der Vorlesung OC1a (Grundvorlesung Organische Chemie) Maximale Punktezahl: 20 Notwendige Mindestpunkte: 8
 2. Klausur OC1 (BA-Studiengang) PIN: 12.03.2014 13:00 16:00 Uhr N2 Name: Punkte: Matrikel Nr. Note: Notenskala: 80-78=1.0 77-75=1.3 74-71=1.5 70-67=1.7 66-63=2.0 62-59=2.3 58-56=2.5 55-53=2.7 52-50=3.0
2. Klausur OC1 (BA-Studiengang) PIN: 12.03.2014 13:00 16:00 Uhr N2 Name: Punkte: Matrikel Nr. Note: Notenskala: 80-78=1.0 77-75=1.3 74-71=1.5 70-67=1.7 66-63=2.0 62-59=2.3 58-56=2.5 55-53=2.7 52-50=3.0
Organische Chemie. Schreiben Sie bitte Ihre Lösungen ausschließlich auf diese Aufgabenblätter!
 Organische Chemie Name: Fachprüfung Vorname: 11. März 2002, 8 00-10 00 h Matr.-Nr.: Raum 204 + 206 Schreiben Sie bitte Ihre Lösungen ausschließlich auf diese Aufgabenblätter! Jede Aufgabe wird mit 10 Punkten
Organische Chemie Name: Fachprüfung Vorname: 11. März 2002, 8 00-10 00 h Matr.-Nr.: Raum 204 + 206 Schreiben Sie bitte Ihre Lösungen ausschließlich auf diese Aufgabenblätter! Jede Aufgabe wird mit 10 Punkten
Bitte verwenden Sie Konzeptpapier und schreiben Sie dann Ihre Antworten geordnet unter der
 1 Institut für Organische Chemie 9.10.2014 Prof. Dr. Stefan Bräse Punkte: 1. (16). Nachholklausur zur OC-I-Vorlesung für Chemiker, Lebensmittelchemiker, Biologen, Chemische Biologen und Studierende des
1 Institut für Organische Chemie 9.10.2014 Prof. Dr. Stefan Bräse Punkte: 1. (16). Nachholklausur zur OC-I-Vorlesung für Chemiker, Lebensmittelchemiker, Biologen, Chemische Biologen und Studierende des
Aromatische Kohlenwasserstoffe.
 Aromatische Kohlenwasserstoffe. Benzol und dessen Homologe. Mechanismus der S E 2-Ar-Reaktion. Orientierung in aromatischem Kern, abhängig vom ersten Substituent. Elektrophiler Mechanismus der Substitutionsreaktionen.
Aromatische Kohlenwasserstoffe. Benzol und dessen Homologe. Mechanismus der S E 2-Ar-Reaktion. Orientierung in aromatischem Kern, abhängig vom ersten Substituent. Elektrophiler Mechanismus der Substitutionsreaktionen.
Kohlenstoffverbindungen und Gleichgewichtsreaktionen (EF)
 Kohlenstoffverbindungen und Gleichgewichtsreaktionen (EF)... beschreiben Zusammenhänge zwischen Vorkommen, Verwendung und Eigenschaften wichtiger Vertreter der Stoffklassen der Alkohole, Aldehyde, Ketone,
Kohlenstoffverbindungen und Gleichgewichtsreaktionen (EF)... beschreiben Zusammenhänge zwischen Vorkommen, Verwendung und Eigenschaften wichtiger Vertreter der Stoffklassen der Alkohole, Aldehyde, Ketone,
Chemie für Biologen, Carbonylverbindungen / Carbonsäuren und ihre Derivate (Thema ) iii) Carbonsäure iv) Dicarbonsäure
 Chemie für Biologen, 2017 Übung 12 Carbonylverbindungen / Carbonsäuren und ihre Derivate (Thema 13.1 14.3) Aufgabe 1: a) Es gibt verschiedene Klassen von Carbonylverbindungen. Zeichnen Sie zu folgenden
Chemie für Biologen, 2017 Übung 12 Carbonylverbindungen / Carbonsäuren und ihre Derivate (Thema 13.1 14.3) Aufgabe 1: a) Es gibt verschiedene Klassen von Carbonylverbindungen. Zeichnen Sie zu folgenden
Zweite Klausur zum Organisch-Chemischen Grundpraktikum
 Prof. Dr. Jens Christoffers 12. Juni 2006 Universität ldenburg Zweite Klausur zum rganisch-chemischen Grundpraktikum Vorname: Name: Matrikelnummer: Studiengang: Falls Sie zusätzliche Seiten verwenden,
Prof. Dr. Jens Christoffers 12. Juni 2006 Universität ldenburg Zweite Klausur zum rganisch-chemischen Grundpraktikum Vorname: Name: Matrikelnummer: Studiengang: Falls Sie zusätzliche Seiten verwenden,
Organische Chemie für MST 5. Lienkamp/ Prucker/ Rühe
 Organische Chemie für MST 5 Lienkamp/ Prucker/ Rühe Inhalt 5 Aromaten Struktur und Bindung im Benzol, Hückel-Regel, mesomeregrenzstrukturen, ortho-, meta-, para-substitution, elektrophile Substitution
Organische Chemie für MST 5 Lienkamp/ Prucker/ Rühe Inhalt 5 Aromaten Struktur und Bindung im Benzol, Hückel-Regel, mesomeregrenzstrukturen, ortho-, meta-, para-substitution, elektrophile Substitution
3. Übungsblatt. Organische Chemie für Studierende mit Nebenfach Chemie
 Allgemeine und Anorganische Chemie 3. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Beschreiben Sie den Reaktionsmechanismus einer S N 1- und einer S N 2- Reaktion. 2.
Allgemeine und Anorganische Chemie 3. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Beschreiben Sie den Reaktionsmechanismus einer S N 1- und einer S N 2- Reaktion. 2.
Aufgabe S. 2/a (2 Punkte) Wodurch können Sie Cyclohexan von Cyclohexen unterscheiden?
 16-1 2 Zur Punktevergabe bei multiple choice-aufgaben: Es gibt meist 5 Antwortmöglichkeiten, und 2 Punkte können pro Aufgabe erreicht werden. Pro falscher Antwort (Kreuz zu viel, aber auch fehlend) wird
16-1 2 Zur Punktevergabe bei multiple choice-aufgaben: Es gibt meist 5 Antwortmöglichkeiten, und 2 Punkte können pro Aufgabe erreicht werden. Pro falscher Antwort (Kreuz zu viel, aber auch fehlend) wird
Aldehyde und Ketone 1978/IV 1979/II 1981/II/3 1983/IV/1
 1 Aldehyde und Ketone 1978/IV 2. Tertiäres Butylchlorid (2-Chlor-2-methylpropan) wird hydrolysiert. 2.1 Formulieren Sie die Reaktionsgleichung für die Hydrolyse in Wasser und benennen Sie die Reaktionsprodukte.
1 Aldehyde und Ketone 1978/IV 2. Tertiäres Butylchlorid (2-Chlor-2-methylpropan) wird hydrolysiert. 2.1 Formulieren Sie die Reaktionsgleichung für die Hydrolyse in Wasser und benennen Sie die Reaktionsprodukte.
Schriftliche Abiturprüfung Leistungskursfach Chemie
 Sächsisches Staatsministerium für Kultus Schuljahr 1999/2000 Geltungsbereich: - Allgemein bildendes Gymnasium - Abendgymnasium und Kolleg - Schulfremde Prüfungsteilnehmer Schriftliche Abiturprüfung Leistungskursfach
Sächsisches Staatsministerium für Kultus Schuljahr 1999/2000 Geltungsbereich: - Allgemein bildendes Gymnasium - Abendgymnasium und Kolleg - Schulfremde Prüfungsteilnehmer Schriftliche Abiturprüfung Leistungskursfach
7. Studieneinheit. Siebte Studieneinheit
 86 Siebte Studieneinheit 7. Studieneinheit Lernziele Löslichkeit organisch-chemischer Substanzen unter verschiedenen Bedingungen Charakteristische Reaktionen ausgewählter organisch-chemischer Stoffklassen
86 Siebte Studieneinheit 7. Studieneinheit Lernziele Löslichkeit organisch-chemischer Substanzen unter verschiedenen Bedingungen Charakteristische Reaktionen ausgewählter organisch-chemischer Stoffklassen
3. Aromatische Verbindungen Benzol(en)
 3. Aromatische Verbindungen Benzol(en) Benzol erweist sich merkwürdigerweise als ungewöhnlich stabil gegen viele angreifende Reagenzien. So finden die typischen Additionen an die Doppelbindungen nicht
3. Aromatische Verbindungen Benzol(en) Benzol erweist sich merkwürdigerweise als ungewöhnlich stabil gegen viele angreifende Reagenzien. So finden die typischen Additionen an die Doppelbindungen nicht
2. Übungsblatt. Organische Chemie für Studierende mit Nebenfach Chemie
 Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
GK Chemie Carbonsaeuren Ester 1975//II 1. Wie kann man Essigsäure (Ethansäure) aus anorganischen Grundstoffen hergestellt werden? Beschreiben Sie die
 GK Chemie Carbonsaeuren Ester 1975//II 1. Wie kann man Essigsäure (Ethansäure) aus anorganischen Grundstoffen hergestellt werden? Beschreiben Sie die Reaktionsschritte mit Hilfe von Gleichungen! 2. Welche
GK Chemie Carbonsaeuren Ester 1975//II 1. Wie kann man Essigsäure (Ethansäure) aus anorganischen Grundstoffen hergestellt werden? Beschreiben Sie die Reaktionsschritte mit Hilfe von Gleichungen! 2. Welche
Ester 1979/II/4 Äthanol reagiert mit Essigsäure. 4.1 Stellen Sie die Reaktion in einer Gleichung dar und wenden Sie auf diese Reaktion das
 Ester 1979/II/4 Äthanol reagiert mit Essigsäure. 4.1 Stellen Sie die Reaktion in einer Gleichung dar und wenden Sie auf diese Reaktion das Massenwirkungsgesetz an. 2BE 4.2 Berechnen Sie die Gleichgewichtskonstante
Ester 1979/II/4 Äthanol reagiert mit Essigsäure. 4.1 Stellen Sie die Reaktion in einer Gleichung dar und wenden Sie auf diese Reaktion das Massenwirkungsgesetz an. 2BE 4.2 Berechnen Sie die Gleichgewichtskonstante
Teil 1 Aufgaben zum Stoff der Vorlesung OC1a (Grundvorlesung Organische Chemie) Maximale Punktezahl: 20 Notwendige Mindestpunkte: 8
 1. Klausur OC1 (BSc-Studiengang) PIN: 18.02.2016 11:00 14:00 Uhr N6 Name: Punkte: Matrikel Nr. Note: Notenskala: 80-78=1.0 77-75=1.3 74-71=1.5 70-67=1.7 66-63=2.0 62-59=2.3 58-56=2.5 55-53=2.7 52-50=3.0
1. Klausur OC1 (BSc-Studiengang) PIN: 18.02.2016 11:00 14:00 Uhr N6 Name: Punkte: Matrikel Nr. Note: Notenskala: 80-78=1.0 77-75=1.3 74-71=1.5 70-67=1.7 66-63=2.0 62-59=2.3 58-56=2.5 55-53=2.7 52-50=3.0
Name, Vorname: Matrikelnummer: Studienrichtung: Fragen auf den folgenden Seiten: Musterlösung zur Klausur zur Experimentalvorlesung Organische Chemie
 rganisch-chemisches nstitut Fakultät für Chemie und Geowissenschaften Universität eidelberg 23. Juni 2015 Musterlösung zur Klausur zur Experimentalvorlesung rganische Chemie von Prof. Stephen ashmi Name,
rganisch-chemisches nstitut Fakultät für Chemie und Geowissenschaften Universität eidelberg 23. Juni 2015 Musterlösung zur Klausur zur Experimentalvorlesung rganische Chemie von Prof. Stephen ashmi Name,
alte Klausur; von 1999 ÜBUNGSKLAUSUR
 alte Klausur; von 1999 ÜBUNGSKLAUSUR Name: Bitte nicht mit Bleistift und nicht mit Rotstift ausfüllen! Telefonnummer: Studienfach: Fachsemester: Matrikelnummer: Ausweisnummer: Unterschrift:...... Diese
alte Klausur; von 1999 ÜBUNGSKLAUSUR Name: Bitte nicht mit Bleistift und nicht mit Rotstift ausfüllen! Telefonnummer: Studienfach: Fachsemester: Matrikelnummer: Ausweisnummer: Unterschrift:...... Diese
Kohlenstoffverbindungen und Gleichgewichtsreaktionen (EF)
 Kohlenstoffverbindungen und Gleichgewichtsreaktionen (EF)... interpretieren den zeitlichen Ablauf chemischer Reaktionen in Abhängigkeit von verschiedenen Parametern (u.a. Oberfläche, Konzentration, Temperatur)
Kohlenstoffverbindungen und Gleichgewichtsreaktionen (EF)... interpretieren den zeitlichen Ablauf chemischer Reaktionen in Abhängigkeit von verschiedenen Parametern (u.a. Oberfläche, Konzentration, Temperatur)
Klausur zur Vorlesung Organische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler
 Prof. Dr. Jens Christoffers 13. ktober 2005 Universität Stuttgart Klausur zur Vorlesung rganische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler Vorname: ame: Matrikelnummer:
Prof. Dr. Jens Christoffers 13. ktober 2005 Universität Stuttgart Klausur zur Vorlesung rganische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler Vorname: ame: Matrikelnummer:
Zweite Klausur zur Vorlesung Grundlagen der Organischen Chemie
 Prof. Dr. Jens Christoffers 28. Februar 2011 Universität ldenburg Zweite Klausur zur Vorlesung Grundlagen der rganischen Chemie für Studierende der Chemie (Fach-Bachelor und Zwei-Fächer-Bachelor, Wert:
Prof. Dr. Jens Christoffers 28. Februar 2011 Universität ldenburg Zweite Klausur zur Vorlesung Grundlagen der rganischen Chemie für Studierende der Chemie (Fach-Bachelor und Zwei-Fächer-Bachelor, Wert:
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Stundenübersicht über das IHF Organische Produkte Werkstoffe und Farbstoffe
 Stundenübersicht über das IHF Organische Produkte Werkstoffe und Farbstoffe Unterrichtsvorhaben I Inhaltlicher Schwerpunkt Organische Verbindungen und Reaktionswege Kontext Vom fossilen Rohstoff zum Anwendungsprodukt
Stundenübersicht über das IHF Organische Produkte Werkstoffe und Farbstoffe Unterrichtsvorhaben I Inhaltlicher Schwerpunkt Organische Verbindungen und Reaktionswege Kontext Vom fossilen Rohstoff zum Anwendungsprodukt
Organisch-Chemisches Institut Fakultät für Chemie und Geowissenschaften Universität Heidelberg 4. September 2015
 Organisch-Chemisches Institut Fakultät für Chemie und Geowissenschaften Universität Heidelberg 4. September 2015 Musterlösung Zwischennachklausur II zur Experimentalvorlesung Organische Chemie von Prof.
Organisch-Chemisches Institut Fakultät für Chemie und Geowissenschaften Universität Heidelberg 4. September 2015 Musterlösung Zwischennachklausur II zur Experimentalvorlesung Organische Chemie von Prof.
Inhaltsverzeichnis VII. Vorwort... V
 VII Vorwort... V 1 Einleitung... 1 1.1 Der Begriff der Organischen Chemie... 1 1.2 Vielfalt organischer Verbindungen... 1 1.3 Ordnung in der Vielfalt... 2 2 Grundlegendes... 3 2.1 Kohlenstoff hat vier
VII Vorwort... V 1 Einleitung... 1 1.1 Der Begriff der Organischen Chemie... 1 1.2 Vielfalt organischer Verbindungen... 1 1.3 Ordnung in der Vielfalt... 2 2 Grundlegendes... 3 2.1 Kohlenstoff hat vier
Ich wünsche Ihnen viel Erfolg!
 0 GYMNASIUM MUTTENZ MATURITÄTSPRÜFUNGEN 2010 FACH: Chemie SPF: Biologie/Chem KLASSE/N: 4BA und 4B Examinator/Examinatorin: Experte/Expertin: Bitte lesen Sie die folgenden Hinweise sorgfältig durch bevor
0 GYMNASIUM MUTTENZ MATURITÄTSPRÜFUNGEN 2010 FACH: Chemie SPF: Biologie/Chem KLASSE/N: 4BA und 4B Examinator/Examinatorin: Experte/Expertin: Bitte lesen Sie die folgenden Hinweise sorgfältig durch bevor
Organische Chemie I/II. Schreiben Sie bitte Ihre Lösungen ausschließlich auf diese Aufgabenblätter!
 Organische Chemie I/II Name: Fachprüfung Vorname: 5. Februar 2003, 15 30-18 30 h Matr.-Nr.: Raum 250 Schreiben Sie bitte Ihre Lösungen ausschließlich auf diese Aufgabenblätter! Jede Aufgabe wird mit 10
Organische Chemie I/II Name: Fachprüfung Vorname: 5. Februar 2003, 15 30-18 30 h Matr.-Nr.: Raum 250 Schreiben Sie bitte Ihre Lösungen ausschließlich auf diese Aufgabenblätter! Jede Aufgabe wird mit 10
1 zwischen Wasser und Natriumethanolat 2.3 Begründen Sie ausführlich das unter Ziffer 2.
 Carbonsäuren Jahrgang Index Nr. Pkt 1982 2 Versetzt man Ethansäure a) mit Natronlauge oder b) mit Natrium, so erhält man in beiden Fällen Natrium-ethanoat (Natriumacetat). Ersetzt man in den Versuchen
Carbonsäuren Jahrgang Index Nr. Pkt 1982 2 Versetzt man Ethansäure a) mit Natronlauge oder b) mit Natrium, so erhält man in beiden Fällen Natrium-ethanoat (Natriumacetat). Ersetzt man in den Versuchen
Zweite Klausur zur Vorlesung Grundlagen der Organischen Chemie
 Prof. Dr. Jens Christoffers 27. Februar 2017 Universität Oldenburg Zweite Klausur zur Vorlesung Grundlagen der Organischen Chemie Vorname: Name: Matrikelnummer: Studiengang: 1,0 1,3 1,7 2,0 2,3 2,7 3,0
Prof. Dr. Jens Christoffers 27. Februar 2017 Universität Oldenburg Zweite Klausur zur Vorlesung Grundlagen der Organischen Chemie Vorname: Name: Matrikelnummer: Studiengang: 1,0 1,3 1,7 2,0 2,3 2,7 3,0
Reaktionstypen der Aromate
 Radikalische Reaktionspartner sind Atome bzw. Atomgruppen mit einem ungepaarten Elektron, wie z. B. das Chlorradikal Cl oder das Ethylradikal C 3 C 2. Radikale sind in der Regel sehr unbeständig, kurzlebig
Radikalische Reaktionspartner sind Atome bzw. Atomgruppen mit einem ungepaarten Elektron, wie z. B. das Chlorradikal Cl oder das Ethylradikal C 3 C 2. Radikale sind in der Regel sehr unbeständig, kurzlebig
Zweite Klausur zur Vorlesung Grundlagen der Organischen Chemie
 Prof. Dr. Jens Christoffers 18. Februar 2008 Universität Oldenburg Zweite Klausur zur Vorlesung Grundlagen der Organischen Chemie (für Studierende der Chemie ist dies die erste Klausur, für Umweltwissenschaftler
Prof. Dr. Jens Christoffers 18. Februar 2008 Universität Oldenburg Zweite Klausur zur Vorlesung Grundlagen der Organischen Chemie (für Studierende der Chemie ist dies die erste Klausur, für Umweltwissenschaftler
Grundkurs Optische Aktivität 1983/I/1 1992/I/1 1994/III/3 1998/I/1
 Grundkurs Optische Aktivität 1983/I/1 1.1 Definieren Sie den Begriff "optische Aktivität"! 2BE 1.2 Erläutern Sie am Beispiel des Bromchloriodmethans, welche Form von Isomerie bei dieser Verbindung auftritt
Grundkurs Optische Aktivität 1983/I/1 1.1 Definieren Sie den Begriff "optische Aktivität"! 2BE 1.2 Erläutern Sie am Beispiel des Bromchloriodmethans, welche Form von Isomerie bei dieser Verbindung auftritt
Versuch: Bromierung von Phenol
 Philipps-Universität Marburg 01.12.2007 Organisches Grundpraktikum (LA) Katrin ohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 4, Aromaten Versuch: omierung von Phenol Zeitbedarf: Vorbereitung:
Philipps-Universität Marburg 01.12.2007 Organisches Grundpraktikum (LA) Katrin ohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 4, Aromaten Versuch: omierung von Phenol Zeitbedarf: Vorbereitung:
KULTUSMINISTERIUM DES LANDES SACHSEN-ANHALT. Abitur Chemie (Leistungskurs) Arbeitszeit: 300 Minuten. Thema 1. Aluminium.
 KULTUSMINISTERIUM DES LANDES SACHSEN-ANHALT Abitur 2001 Chemie (Leistungskurs) Arbeitszeit: 300 Minuten Thema 1 Aluminium Thema 2 Kohlenwasserstoffe Thema 3 Verlauf chemischer Reaktionen Katalyse Thema
KULTUSMINISTERIUM DES LANDES SACHSEN-ANHALT Abitur 2001 Chemie (Leistungskurs) Arbeitszeit: 300 Minuten Thema 1 Aluminium Thema 2 Kohlenwasserstoffe Thema 3 Verlauf chemischer Reaktionen Katalyse Thema
Aufgabe S. 2/a (2 Punkte) Wodurch können Sie 2-Hexen von 2-Methylpentan unterscheiden?
 16-2 2 Zur Punktevergabe bei multiple choice-aufgaben: Es gibt meist 5 Antwortmöglichkeiten, und 2 Punkte können pro Aufgabe erreicht werden. Pro falscher Antwort (Kreuz zu viel, aber auch fehlend) wird
16-2 2 Zur Punktevergabe bei multiple choice-aufgaben: Es gibt meist 5 Antwortmöglichkeiten, und 2 Punkte können pro Aufgabe erreicht werden. Pro falscher Antwort (Kreuz zu viel, aber auch fehlend) wird
Klausur: Chemie für Mediziner und Zahnmediziner SS
 Klausur: Chemie für Mediziner und Zahnmediziner SS 04 24.05.2005 Name:. Unterschrift:... Vorname:.. Matrikel-Nr.: Bitte ankreuzen: Medizien Zahnmedizin: Schreiben Sie bitte deutlich. Alle für die Korrektur
Klausur: Chemie für Mediziner und Zahnmediziner SS 04 24.05.2005 Name:. Unterschrift:... Vorname:.. Matrikel-Nr.: Bitte ankreuzen: Medizien Zahnmedizin: Schreiben Sie bitte deutlich. Alle für die Korrektur
Bachelorprüfung im Fach Biologie, Teilfach Chemie am a) Zeichnen Sie bitte unten die Strukturformel einer Verbindung der Summenformel
 Bachelorprüfung im Fach Biologie, Teilfach Chemie am 30.07.2018 2 Aufgabe 1 a) Zeichnen Sie bitte unten die Strukturformel einer Verbindung der Summenformel CH 2 O ein, die die folgenden Eigenschaften
Bachelorprüfung im Fach Biologie, Teilfach Chemie am 30.07.2018 2 Aufgabe 1 a) Zeichnen Sie bitte unten die Strukturformel einer Verbindung der Summenformel CH 2 O ein, die die folgenden Eigenschaften
Bachelorprüfung im Fach Biologie, Teilfach Chemie am a) Zeichnen Sie bitte unten die Strukturformel einer Verbindung der Summenformel
 Bachelorprüfung im Fach Biologie, Teilfach Chemie am 26.02.2018 2 Aufgabe 1 a) Zeichnen Sie bitte unten die Strukturformel einer Verbindung der Summenformel C 2 H 4 O 2 ein, die die folgenden Eigenschaften
Bachelorprüfung im Fach Biologie, Teilfach Chemie am 26.02.2018 2 Aufgabe 1 a) Zeichnen Sie bitte unten die Strukturformel einer Verbindung der Summenformel C 2 H 4 O 2 ein, die die folgenden Eigenschaften
Übungsbeispiele Kapitel Organische Verbindungen
 Übungsbeispiele 26. 1. 2016 Kapitel rganische Verbindungen 10) (9 Punkte) Schreiben Sie Valenzstrichformeln für folgende Substanzen: 3-Methyl-1-hepten, 2E-Nonen-4,5-diol-6-on, 2,3-Dihydroxybutandisäure,
Übungsbeispiele 26. 1. 2016 Kapitel rganische Verbindungen 10) (9 Punkte) Schreiben Sie Valenzstrichformeln für folgende Substanzen: 3-Methyl-1-hepten, 2E-Nonen-4,5-diol-6-on, 2,3-Dihydroxybutandisäure,
Bachelorprüfung im Fach Biologie, Teilfach Chemie am a) Zeichnen Sie bitte unten die Strukturformel einer Verbindung der Summenformel
 Bachelorprüfung im Fach Biologie, Teilfach Chemie am 16.05.2014 2 Aufgabe 1 a) Zeichnen Sie bitte unten die Strukturformel einer Verbindung der Summenformel C 3 H 6 O 3 ein, die die folgenden Eigenschaften
Bachelorprüfung im Fach Biologie, Teilfach Chemie am 16.05.2014 2 Aufgabe 1 a) Zeichnen Sie bitte unten die Strukturformel einer Verbindung der Summenformel C 3 H 6 O 3 ein, die die folgenden Eigenschaften
Nicht vergessen: Wenn nach dem Mechanismus gefragt ist, dann die ganze Molekülstruktur und alle Elektronen sowie die Reaktionspfeile einzeichnen!
 rganische Chemie Name: Fachprüfung Vorname: 14. Juli 2003, 14 30-17 30 h Matr.-Nr.: Raum 180 Schreiben Sie bitte Ihre Lösungen ausschließlich auf diese Aufgabenblätter! Jede Aufgabe wird mit 10 Punkten
rganische Chemie Name: Fachprüfung Vorname: 14. Juli 2003, 14 30-17 30 h Matr.-Nr.: Raum 180 Schreiben Sie bitte Ihre Lösungen ausschließlich auf diese Aufgabenblätter! Jede Aufgabe wird mit 10 Punkten
Chemie Stufe 13 / Aromaten / Phenol Folie 01. Das Phenol-Molekül. δ δ+ sp 3. sp 2
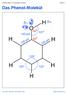 Chemie Stufe 13 / Aromaten / Phenol Folie 01 Das Phenol-Molekül δ δ+ sp 3 sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 02 Das Phenolat-Ion sp 3 H + sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 03 Grenzstrukturen
Chemie Stufe 13 / Aromaten / Phenol Folie 01 Das Phenol-Molekül δ δ+ sp 3 sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 02 Das Phenolat-Ion sp 3 H + sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 03 Grenzstrukturen
Organische Chemie der Freien Universität Berlin. Klausur SS 2007 Teil 2
 rganische Chemie der Freien Universität Berlin C I Grundlagen der rganischen Chemie (LV 21 21a) Klausur SS 27 Teil 2 Verfasser: Prof. Dr..-U. Reißig Datum: 21.7.27 Semester: SS 7 öchstpunktzahl: 2 (in
rganische Chemie der Freien Universität Berlin C I Grundlagen der rganischen Chemie (LV 21 21a) Klausur SS 27 Teil 2 Verfasser: Prof. Dr..-U. Reißig Datum: 21.7.27 Semester: SS 7 öchstpunktzahl: 2 (in
G8 Abituraufgaben Chemie aromatische Kohlenwasserstoffe
 G8 Abituraufgaben Chemie aromatische Kohlenwasserstoffe 2011/B1 2.2 Bereits 1826 gelang dem Kaufmann und Apotheker Otto Unverdorben die Darstellung von Anilin aus Indigo. Seit 1873 wird Anilin großtechnisch
G8 Abituraufgaben Chemie aromatische Kohlenwasserstoffe 2011/B1 2.2 Bereits 1826 gelang dem Kaufmann und Apotheker Otto Unverdorben die Darstellung von Anilin aus Indigo. Seit 1873 wird Anilin großtechnisch
Kernlehrpläne ab Schuljahr 2014/15 Schuleigener Lehrplan / FMG / Sekundarstufe II CHEMIE
 CHEMIE QUALIFIKATIONSSPHASE 2 LEISTUNGSKURS Konkretisierung der Unterrichtsvorhaben Unterrichtsvorhaben I: Vom fossilen Rohstoff zum Anwendungsprodukt Organische Reaktionsabläufe Oxidationsreihe der Alkohole
CHEMIE QUALIFIKATIONSSPHASE 2 LEISTUNGSKURS Konkretisierung der Unterrichtsvorhaben Unterrichtsvorhaben I: Vom fossilen Rohstoff zum Anwendungsprodukt Organische Reaktionsabläufe Oxidationsreihe der Alkohole
2. Übungsblatt. Organische Chemie für Studierende mit Nebenfach Chemie
 Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
Fragen zum Thema funktionelle Gruppen Alkohol und Phenol
 1. Was sind Derivate? 2. Was sind Substituenten? 3. Wann werden neu angehängte Atome oder Gruppen als Substituent bezeichnet? 4. Warum sind Substituenten so wichtig für organische Verbindungen? Alkohol
1. Was sind Derivate? 2. Was sind Substituenten? 3. Wann werden neu angehängte Atome oder Gruppen als Substituent bezeichnet? 4. Warum sind Substituenten so wichtig für organische Verbindungen? Alkohol
Übungen zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe. 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit
 O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
Klausur zur Vorlesung Grundlagen der Organischen Chemie
 Prof. Dr. Jens Christoffers 16. Februar 2017 Universität Oldenburg Klausur zur Vorlesung Grundlagen der Organischen Chemie Vorname: Name: Matrikelnummer: Studiengang: 1,0 1,3 1,7 2,0 2,3 2,7 3,0 3,3 3,7
Prof. Dr. Jens Christoffers 16. Februar 2017 Universität Oldenburg Klausur zur Vorlesung Grundlagen der Organischen Chemie Vorname: Name: Matrikelnummer: Studiengang: 1,0 1,3 1,7 2,0 2,3 2,7 3,0 3,3 3,7
Organische Chemie. 11. Juli 2002, h Matr.-Nr.: Raum 183. Schreiben Sie bitte Ihre Lösungen ausschließlich auf diese Aufgabenblätter!
 Organische Chemie Name: Fachprüfung Vorname: 11. Juli 2002, 8 00-10 00 h Matr.-Nr.: Raum 183 Schreiben Sie bitte Ihre Lösungen ausschließlich auf diese Aufgabenblätter! Jede Aufgabe wird mit 10 Punkten
Organische Chemie Name: Fachprüfung Vorname: 11. Juli 2002, 8 00-10 00 h Matr.-Nr.: Raum 183 Schreiben Sie bitte Ihre Lösungen ausschließlich auf diese Aufgabenblätter! Jede Aufgabe wird mit 10 Punkten
Grundkurs Farbstoffe 1983/II 1984/I 1984/IV 1985/IV
 Grundkurs Farbstoffe 1983/II 3. Der Farbstoff Chrysoidin wird unter anderem zum Färben von Leder und Papier verwendet. 3.1 Als Ausgangsstoffe für die Darstellung dieses Farbstoffes dienen Anilin, Natriumnitrit
Grundkurs Farbstoffe 1983/II 3. Der Farbstoff Chrysoidin wird unter anderem zum Färben von Leder und Papier verwendet. 3.1 Als Ausgangsstoffe für die Darstellung dieses Farbstoffes dienen Anilin, Natriumnitrit
Organische Chemie 2 SPF BCH am Inhaltsverzeichnis Sie kennen alle Karteikärtchen zum Thema... 2
 Organische Chemie 2 Inhaltsverzeichnis Sie kennen alle Karteikärtchen zum Thema.... 2 Sie kennen vier Grundtypen von Reaktionen mit ihren Mechanismen (S. 239) mit aliphatischen, organischen Stoffen und
Organische Chemie 2 Inhaltsverzeichnis Sie kennen alle Karteikärtchen zum Thema.... 2 Sie kennen vier Grundtypen von Reaktionen mit ihren Mechanismen (S. 239) mit aliphatischen, organischen Stoffen und
Summenformel Elektronenstrichformel Name Siedepunkt
 Die homologe Reihe der Alkene Summenformel Elektronenstrichformel Name Siedepunkt C 2 H 4 Ethen -104 C C 3 H 6 Propen -47 C C 4 H 8 1-Buten -6 C C 5 H 10 (...) 1-Penten 30 C C 6 H 12 (...) 1-Hexen 63 C
Die homologe Reihe der Alkene Summenformel Elektronenstrichformel Name Siedepunkt C 2 H 4 Ethen -104 C C 3 H 6 Propen -47 C C 4 H 8 1-Buten -6 C C 5 H 10 (...) 1-Penten 30 C C 6 H 12 (...) 1-Hexen 63 C
Technische Universität Dresden Fachrichtung Chemie Modul OC II
 Name: Matrikelnummer: Fachsemester Studienfach: LC Chemie-Bachelor Lehramt-Staatsex. Lehramt-Master Praktikumsteilnehmer und Nachschreiber Praktikumsteilnahme (bitte deutlich lesbar ausfüllen) SoSe 2016
Name: Matrikelnummer: Fachsemester Studienfach: LC Chemie-Bachelor Lehramt-Staatsex. Lehramt-Master Praktikumsteilnehmer und Nachschreiber Praktikumsteilnahme (bitte deutlich lesbar ausfüllen) SoSe 2016
Studiengang Bsc Biowissenschaften. Modul-begleitende Prüfung. Organische Chemie
 Studiengang Bsc Biowissenschaften Modul-begleitende Prüfung Organische Chemie 26.07.2016 Name: Vorname: Matrikelnummer: Geboren am: in: Wiederholer/in dieser Klausur: Ja Nein Dauer der Klausur: 90 Minuten
Studiengang Bsc Biowissenschaften Modul-begleitende Prüfung Organische Chemie 26.07.2016 Name: Vorname: Matrikelnummer: Geboren am: in: Wiederholer/in dieser Klausur: Ja Nein Dauer der Klausur: 90 Minuten
Gruppe 03: Umsetzung von Hexan und Hexen mit Bromwasser
 Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 03: Umsetzung von Hexan und Hexen mit Bromwasser Reaktion: Chemikalien:
Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 03: Umsetzung von Hexan und Hexen mit Bromwasser Reaktion: Chemikalien:
Organische Chemie 1 SS2011 Tutorium Übungsblatt 12 Seite 1
 Organische Chemie 1 SS2011 Tutorium Übungsblatt 12 Seite 1 1) Ordnen Sie die folgenden aromatischen Verbindungen nach steigender Reaktivität in der elektrophilen aromatischen Substitution. Chlorbenzol,
Organische Chemie 1 SS2011 Tutorium Übungsblatt 12 Seite 1 1) Ordnen Sie die folgenden aromatischen Verbindungen nach steigender Reaktivität in der elektrophilen aromatischen Substitution. Chlorbenzol,
Chemie im Realgymnasium mit LS, 6-stündig Themenbereiche für die Reifeprüfung
 Chemie RG mit LS, Themenbereiche, Seite 1 von 5 Chemie im Realgymnasium mit LS, 6-stündig Themenbereiche für die Reifeprüfung 1. Atombau und Periodensystem Die geschichtliche Entwicklung der Atommodelle
Chemie RG mit LS, Themenbereiche, Seite 1 von 5 Chemie im Realgymnasium mit LS, 6-stündig Themenbereiche für die Reifeprüfung 1. Atombau und Periodensystem Die geschichtliche Entwicklung der Atommodelle
ORGANISCHE CHEMIE. Katherina Standhartinger. für Ahnungslose Eine Einstiegshilfe für Studierende. von Katherina Standhartinger, Memmingen
 Katherina Standhartinger ORGANISCHE CHEMIE für Ahnungslose Eine Einstiegshilfe für Studierende von Katherina Standhartinger, Memmingen Mit 150 Abbildungen und 35 Tabellen S. Hirzel Verlag Stuttgart r VII
Katherina Standhartinger ORGANISCHE CHEMIE für Ahnungslose Eine Einstiegshilfe für Studierende von Katherina Standhartinger, Memmingen Mit 150 Abbildungen und 35 Tabellen S. Hirzel Verlag Stuttgart r VII
IUPAC muss das denn sein?
 IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
Praktikum Chemie für Biologen SS Kurse SS
 1 Praktikum Chemie für Biologen SS 2001 - Kurse SS Klausur in Organischer Chemie (KlOC) Sa 28.07.2001 Name:... Vorname:... Wenn Nachschreiber aus einem der Vorkurse, bitte eintragen: Matrikel-Nr. Semester
1 Praktikum Chemie für Biologen SS 2001 - Kurse SS Klausur in Organischer Chemie (KlOC) Sa 28.07.2001 Name:... Vorname:... Wenn Nachschreiber aus einem der Vorkurse, bitte eintragen: Matrikel-Nr. Semester
p-hydoxyazobenzol ist ein Farbstoff.
 Abituraufgaben Farbstoffe 1980/IV 2.2 Beschreiben Sie in Gleichungen, wie man ausgehend vom Benzol Anilin (Aminobenzol) herstellen kann. Für die erste Stufe der Reaktion am aromatischen Bing ist der Mechanismus
Abituraufgaben Farbstoffe 1980/IV 2.2 Beschreiben Sie in Gleichungen, wie man ausgehend vom Benzol Anilin (Aminobenzol) herstellen kann. Für die erste Stufe der Reaktion am aromatischen Bing ist der Mechanismus
Aufgabe S. 2/a (2 Punkte) Wodurch können Sie Acetaldehyd von Pentan unterscheiden?
 14-2 2 Zur Punktevergabe bei multiple choice-aufgaben: Meist gibt es 5 Antwortmöglichkeiten, und 2 Punkte können pro Aufgabe erreicht werden. Pro falscher Antwort (Kreuz zu viel, aber auch fehlend) wird
14-2 2 Zur Punktevergabe bei multiple choice-aufgaben: Meist gibt es 5 Antwortmöglichkeiten, und 2 Punkte können pro Aufgabe erreicht werden. Pro falscher Antwort (Kreuz zu viel, aber auch fehlend) wird
Bundesrealgymnasium Imst. Chemie Klasse 8. Aromaten und deren Reaktionen
 Bundesrealgymnasium Imst Chemie 2010-11 und deren Reaktionen Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter
Bundesrealgymnasium Imst Chemie 2010-11 und deren Reaktionen Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter
KW Alkene. Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1
 KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
Reaktionstypen der Aliphate
 Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Carbonyle. Inhalt des Tutoriums
 Carbonyle Inhalt des Tutoriums a. Welche funktionellen Gruppen werden unter dem Begriff Carbonyle zusammengefasst? Welche allgemeinen Eigenschaften (Elektronendichte, Oxidationsstufen) besitzen diese Verbindungen?
Carbonyle Inhalt des Tutoriums a. Welche funktionellen Gruppen werden unter dem Begriff Carbonyle zusammengefasst? Welche allgemeinen Eigenschaften (Elektronendichte, Oxidationsstufen) besitzen diese Verbindungen?
Name: Matrikelnummer: Geburtsdatum: Hilfsmittel: Formelsammlung (beigefügt), Periodensystem (beigefügt), Taschenrechner
 Chemie für Physiker B. Sc. Physikalische Technik XXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXX Prof. Dr. Thomas Jüstel / Stephanie Möller M. Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe
Chemie für Physiker B. Sc. Physikalische Technik XXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXX Prof. Dr. Thomas Jüstel / Stephanie Möller M. Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe
