ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
|
|
|
- Nadja Steinmann
- vor 8 Jahren
- Abrufe
Transkript
1 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1
2 1. BEZEICHNUNG DES ARZNEIMITTELS Humalog 100 E/ml, Injektionslösung in Durchstechflasche. 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 2.1 Allgemeine Beschreibung Humalog ist eine sterile, klare, farblose, wässrige Lösung. 2.2 Qualitative and quantitative Zusammensetzung 1 ml enthält 100U (äquivalent zu 3,5 mg) Insulin lispro (über rekombinante DNA hergestellt aus E. coli). Jedes Behältnis enthält 10 ml äquivalent zu 1000U Insulin lispro. Die vollständige Auflistung der sonstigen Bestandteile siehe unter Abschnitt DARREICHUNGSFORM Injektionslösung. 4. KLINISCHE ANGABEN 4.1 Anwendungsgebiete Zur Behandlung von Erwachsenen und Kindern mit Diabetes mellitus, die Insulin für die Aufrechterhaltung eines normalen Glukosehaushaltes benötigen. Humalog ist ebenfalls angezeigt bei der Ersteinstellung des Diabetes mellitus. 4.2 Dosierung, Art und Dauer der Anwendung Die Dosierung muss vom Arzt entsprechend den Bedürfnissen des Patienten festgesetzt werden. Humalog kann unmittelbar vor einer Mahlzeit gegeben werden. Falls notwendig kann Humalog auch unmittelbar nach einer Mahlzeit angewendet werden. Humalog wird normalerweise subkutan injiziert oder im Rahmen einer kontinuierlichen subkutanen Infusionstherapie mittels einer Pumpe infundiert (siehe Abschnitt 4.2), kann aber auch - obwohl nicht empfohlen - intramuskulär injiziert werden. Falls notwendig kann Humalog auch intravenös angewendet werden. Zum Beispiel für die Korrektur von Blutglucosespiegeln während einer Ketoazidose, einer akuten Erkrankung oder während intra- und postoperativen Phasen. Die subkutane Anwendung soll in Oberarm, Oberschenkel, Gesäß oder Abdomen erfolgen. Die Injektion sollte immer an verschiedenen Stellen stattfinden, so dass dieselbe Einstichstelle nicht öfter als ca. einmal im Monat verwendet wird. Bei subkutaner Injektion von Humalog muss darauf geachtet werden, dass kein Blutgefäß getroffen wird. Nach der Injektion darf die Injektionsstelle nicht massiert werden. Die Patienten müssen auf geeignete Injektionstechniken geschult werden. Humalog ist, verglichen mit Normalinsulin, bei subkutaner Anwendung ein Präparat mit rascherem Wirkungseintritt und kürzerer Wirkdauer (2 bis 5 Stunden). Aufgrund des sehr raschen Wirkungseintritts kann eine Humalog Injektion (oder ein Humalog Bolus im Falle der Anwendung mittels subkutaner 2
3 Insulinpumpentherapie) unmittelbar vor oder nach den Mahlzeiten appliziert werden. Wie bei jedem Insulin kann der Wirkungsverlauf intra- und interindividuell unterschiedlich sein. Der rasche Wirkeintritt von Humalog im Vergleich mit Normalinsulin ist unabhängig vom Injektionsort. Wie bei allen Insulinpräparaten hängt die Wirkdauer bei Humalog von der Dosis, der Injektionsstelle, der Durchblutung, der Temperatur und der körperlichen Aktivität ab. Gemäß der Anweisung des Arztes kann Humalog in Verbindung mit einem länger wirksamen Insulin oder mit oralen Sulfonylharnstoff- Präparaten angewendet werden. Anwendung von Humalog mittels einer Insulin-Infusionspumpe Zur Infusion von Insulin lispro können nur bestimmte CE zertifizierte Insulin-Infusionspumpen verwendet werden. Bevor Sie Insulin lispro infundieren, studieren Sie die Bedienungsanleitungen des Herstellers, um sicher zu sein, ob sich Ihre Pumpe eignet oder nicht. Lesen und befolgen Sie die den Infusionspumpen beigelegten Anweisungen. Benutzen Sie die für diese Pumpe vorgesehenen Vorratsbehälter und Katheter. Das Infusionsset (Schlauch und Nadel) muss gemäß den Anweisungen in der Bedienungsanleitung des Infusionssets gewechselt werden. Im Falle einer hypoglykämischen Episode sollte die Infusion unterbrochen werden, bis die Episode behoben ist. Falls wiederholte oder schwere niedrige Blutzuckerspiegel auftreten, informieren Sie bitte Ihren Arzt oder Ihr Krankenhaus und ziehen Sie die Notwendigkeit einer Reduktion oder einer Unterbrechung der Insulininfusion in Betracht. Ein Defekt an der Pumpe oder ein Verschluss des Infusionssets kann zu einem raschen Anstieg des Glukosespiegels führen. Falls Sie vermuten, dass der Insulinfluss unterbrochen ist, folgen Sie den Hinweisen in der Gebrauchsanleitung und informieren Sie - wenn nötig - Ihren Arzt oder Ihr Krankenhaus. Wenn Humalog mittels einer Insulin Infusionspumpe verabreicht wird, sollte es nicht mit einem anderen Insulin gemischt werden. Intravenöse Anwendung von Insulin Die intravenöse Injektion von Insulin lispro muss gemäß der üblichen klinischen Praxis für intravenöse Injektionen erfolgen, zum Beispiel durch einen intravenösen Bolus oder durch ein Infusionssystem. Regelmäßige Messungen des Blutglucosespiegels sind dabei erforderlich. Infusionssysteme sind bei Konzentrationen von 0,1U/ml bis 1,0 U/ml Insulin lispro in 0,9% iger Natriumchlorid- oder 5% iger Dextroselösung bei Raumtemperatur für 48 Stunden stabil. Es wird empfohlen, das System vor Beginn der Infusion zu spülen. 4.3 Gegenanzeigen Überempfindlichkeit gegen Insulin lispro oder einen sonstigen Bestandteil. Hypoglykämie. 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Die Umstellung eines Patienten auf einen anderen Insulintyp oder ein Insulin eines anderen Herstellers muss unter strenger ärztlicher Aufsicht erfolgen. Jede Änderung hinsichtlich Stärke, Marke (Hersteller), Insulintyp (Normal, Basal (NPH), Long etc), Art des Insulins (tierisches Insulin, Humaninsulin, Humaninsulin-Analogon) und/oder Herstellungsmethode (rekombinante DNA -Technologie bzw. tierisches Insulin) kann eine Veränderung des Insulinbedarfs nach sich ziehen. Bei schnell wirkenden Insulinen muss jeder Patient, der auch Basal-Insuline verwendet, die Dosierung beider Insuline optimieren, um eine Glucose-Kontrolle über den ganzen Tag hinweg zu erzielen, insbesondere in der Nacht und im nüchternen Zustand. Das kürzer wirksame Humalog muss zuerst in die Spritze aufgezogen werden, um eine Verunreinigung der Durchstechflasche durch das länger wirksame Insulin zu vermeiden. Das Mischen der Insuline im voraus 3
4 oder direkt vor der Injektion muss gemäß der Anweisung des Arztes erfolgen. Es ist jedoch einer gleichbleibenden Gewohnheit zu folgen. Bestimmte Umstände wie lange Diabetes-Dauer, intensivierte Insulintherapie, diabetische Nervenerkrankung oder Medikation mit Beta-Blockern können die frühen Warnsymptome einer Hypoglykämie unterschiedlich oder weniger ausgeprägt erscheinen lassen. Einige Patienten, bei denen hypoglykämische Reaktionen nach einem Wechsel von tierischem auf menschliches Insulin auftraten, berichteten, dass die frühen Warnsymptome einer Hypoglykämie weniger ausgeprägt oder anders als bei ihrem vorhergehenden Insulin waren. Eine unbehandelte Hypoglykämie oder nicht korrigierte hyperglykämische Reaktionen können zu Bewusstlosigkeit, Koma oder zum Tod führen. Die Gabe einer unzureichenden Dosis, bzw. die Unterbrechung einer Behandlung, insbesondere bei Patienten mit einem insulinpflichtigen Diabetes, kann zu einer Hyperglykämie und einer diabetischen Ketoazidose führen; diese Zustände sind potentiell lebensbedrohlich. Der Insulinbedarf kann bei bestehender Nierenschädigung vermindert sein. Der Insulinbedarf kann bei Patienten mit eingeschränkter Leberfunktion aufgrund einer reduzierten Fähigkeit zur Glukoneogenese und aufgrund eines geringeren Insulinabbaus vermindert sein; allerdings kann bei Patienten mit einer chronischen Leberfunktionsstörung eine erhöhte Insulinresistenz auch zu einem erhöhten Insulinbedarf führen. Der Insulinbedarf kann während einer Krankheit oder bei seelischer Belastung erhöht sein. Eine Anpassung der Dosierung kann auch bei einer starken körperlichen Belastung des Patienten oder bei einer Änderung der Ernährungsgewohnheiten notwendig sein. Körperliche Belastung unmittelbar nach der Mahlzeit kann das Risiko einer Hypoglykämie erhöhen. Eine Folge der pharmakodynamischen Eigenschaften schnell wirksamer Insulin-Analoga besteht darin, dass nach der Injektion im Vergleich zu Normalinsulin eine Hypoglykämie rascher auftreten kann. Humalog darf Kindern an Stelle von Normalinsulin nur dann verabreicht werden, wenn ein schneller Wirkungseintritt von Vorteil sein kann, beispielsweise bei der Wahl des passenden Injektionszeitpunkts im Zusammenhang mit einer Mahlzeit. Kombination von Humalog und Pioglitazon Unter einer Kombinationstherapie von Pioglitazon und Insulin wurden Fälle von Herzinsuffizienz berichtet. Besonders waren Patienten betroffen, bei denen ein erhöhtes Risiko für das Auftreten einer Herzinsuffizienz bestand. Sollte die Kombination von Pioglitazon und Humalog erwogen werden, ist dies zu beachten. Im Fall einer Kombinationsbehandlung sind bei den Patienten Anzeichen und Symptome einer Herzinsuffizienz, Gewichtszunahme und Ödeme zu überwachen. Pioglitazon muss abgesetzt werden, falls sich die kardiale Symtomatik verschlechtert. 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Der Insulinbedarf kann sich durch Arzneimittel mit hyperglykämischer Wirkung wie z. B. orale Kontrazeptiva, Kortikosteroide, Schilddrüsenhormone, Danazol oder Beta 2-Sympathomimetika (wie Ritodrin, Salbutamol, Terbutalin) erhöhen. Der Insulinbedarf kann sich durch die zusätzliche Anwendung von Arzneimitteln mit hypoglykämischer Wirksamkeit wie z. B. orale Antidiabetika, Salicylate (z. B. Acetylsalicylsäure), Sulfonamide, bestimmte Antidepressiva (Monoaminoxidaseinhibitoren, selektive Serotoninwiederaufnahmehemmer), bestimmte ACE-Hemmer (Captopril, Enalapril), Angiotensin II Rezeptorblocker, Beta-Blocker, Octreotid oder Alkohol reduzieren. Die zusätzliche Anwendung weiterer Arzneimittel neben Humalog muss mit dem Arzt abgestimmt werden (siehe Abschnitt 4.4). 4
5 4.6 Fertilität, Schwangerschaft und Stillzeit Die Daten von einer großen Anzahl von Anwendungen während Schwangerschaften zeigen keine Nebenwirkungen von Insulin lispro auf die Schwangerschaft oder auf die Gesundheit des Fötus/Neugeborenen. Es ist unbedingt notwendig, dass die gute Blutzuckerkontrolle bei einer mit Insulin behandelten Patientin (insulinabhängig oder mit Schwangerschaftsdiabetes) während der Schwangerschaft beibehalten wird. Der Insulinbedarf sinkt meistens während der ersten drei Schwangerschaftsmonate und steigt ab dem vierten Schwangerschaftsmonat an. Patientinnen mit Diabetes sollten unbedingt ärztlichen Rat einholen, wenn eine Schwangerschaft geplant wird oder eingetreten ist. Eine genaue Blutzuckerkontrolle sowie ein allgemein guter Gesundheitszustand sind bei Schwangeren mit Diabetes besonders wichtig. Während der Stillzeit kann eine neue Einstellung der Insulindosierung und der Diät oder beides notwendig sein. 4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen Eine Hypoglykämie kann die Konzentrations- und Reaktionsfähigkeit eines Patienten herabsetzen. Dies kann in Situationen, in denen diese Fähigkeiten von besonderer Bedeutung sind (z. B. beim Fahren eines Autos oder beim Bedienen von Maschinen), ein Risiko darstellen. Dem Patienten sollte geraten werden, Vorsichtsmaßnahmen zur Vermeidung von Hypoglykämien beim Führen von Kraftfahrzeugen zu treffen. Dieses ist bei Patienten mit häufigen Hypoglykämie-Episoden oder verringerter oder fehlender Wahrnehmung von Hypoglykämie-Warnsymptomen besonders wichtig. In diesen Fällen muss überlegt werden, ob das Führen eines Kraftfahrzeugs überhaupt ratsam ist. 4.8 Nebenwirkungen Die häufigste Nebenwirkung jeder Insulinbehandlung ist die Hypoglykämie. Schwere Hypoglykämien können zu Bewusstlosigkeit und im Extremfall zum Tod führen. Eine genaue Häufigkeitsangabe zum Auftreten von Hypoglykämien erfolgt nicht, da das Auftreten einer Hypoglykämie aus dem Zusammenspiel zwischen Insulindosis und anderen Faktoren wie Ernährung und körperlicher Betätigung resultiert. Lokale allergische Reaktionen kommen bei Patienten häufig vor (1/100 bis 1/10). Hautrötungen, Schwellungen oder Juckreiz können an der Injektionsstelle auftreten. Sie verschwinden gewöhnlich innerhalb weniger Tage bis weniger Wochen von selbst. In einigen Fällen können diese Erscheinungen durch andere Faktoren als Insulin verursacht werden, z. B. durch Hautdesinfektionsmittel oder mangelhafte Injektionstechnik. Eine systemische Allergie ist selten (1/ bis 1/1.000), aber potentiell gefährlicher und stellt eine generalisierte Insulinallergie dar. Sie kann Hautausschlag am ganzen Körper, Kurzatmigkeit, keuchenden Atem, Blutdruckabfall, schnellen Puls oder Schwitzen hervorrufen. Schwere generalisierte allergische Reaktionen können lebensbedrohlich sein. An der Injektionsstelle kann gelegentlich eine Lipodystrophie auftreten (1/1.000 bis 1/100). Im Zusammenhang mit Insulin-Therapie wurde über Ödeme berichtet, insbesondere wenn eine schlechte metabolische Kontrolle durch intensivierte Insulintherapie verbessert wurde. Meldung des Verdachts auf Nebenwirkungen Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das in Anhang V aufgeführte nationale Meldesystem* anzuzeigen. 5
6 4.9 Überdosierung Es existiert keine spezielle Definition für eine Überdosierung von Insulin, da die Blutglukosekonzentration das Resultat einer komplexen Interaktion von Insulinspiegel, Glukoseverfügbarkeit und anderen metabolischen Prozessen ist. Eine Hypoglykämie kann aus einer unangemessen hohen Dosis Insulin im Verhältnis zur Nahrungsaufnahme oder zum Energieverbrauch resultieren. Eine Hypoglykämie kann einhergehen mit Teilnahmslosigkeit, Verwirrung, Herzklopfen, Kopfweh, Schwitzen und Erbrechen. Eine leichte Form der Hypoglykämie kann durch Aufnahme von Glukose oder anderen zuckerhaltigen Produkten behoben werden. Schwerere Fälle von Hypoglykämie können durch intramuskuläre oder subkutane Glucagoninjektionen behandelt werden, wobei der Patient nach der Injektion Kohlenhydrate zu sich nehmen sollte, sobald er sich ausreichend erholt hat. Patienten, die nicht auf Glucagon ansprechen, muss eine Glukoselösung intravenös verabreicht werden. Befindet sich der Patient im Koma, sollte Glucagon intramuskulär oder subkutan verabreicht werden. Ist kein Glucagon verfügbar oder spricht der Patient nicht auf Glucagon an, muss eine Glukoselösung intravenös verbreicht werden. Sobald der Patient wieder bei Bewußtsein ist, sollte er Nahrung zu sich nehmen. Es kann notwendig sein, Kohlenhydrat-Aufnahme und Beobachtung fortzuführen, da eine Hypoglykämie nach nur scheinbarer Genesung nochmals auftreten kann. 5. PHARMAKOLOGISCHE EIGENSCHAFTEN 5.1 Pharmakodynamische Eigenschaften Pharmakotherapeutische Gruppe: Humaninsulin-Analogon mit raschem Wirkungseintritt, ATC Code: A10A B04 Die Hauptwirkung von Insulin lispro ist die Regulierung des Glukosestoffwechsels. Außerdem haben Insuline zahlreiche anabole und anti-katabole Wirkungen in zahlreichen verschiedenen Geweben. Im Muskelgewebe bedeutet dies eine Steigerung der Glykogen-, Fettsäure-, Glycerol- und Proteinsynthese und der Aminosäureaufnahme; gleichzeitig werden die Glykogenolyse, die Glukoneogenese, die Ketogenese, die Lipolyse, der Proteinkatabolismus und der Aminosäuretransport aus der Zelle vermindert. Insulin lispro hat einen raschen Wirkungseintritt (ca. 15 Minuten), was eine zeitlich nähere Applikation in Bezug auf die Mahlzeit erlaubt (innerhalb von 15 Minuten vor oder nach der Mahlzeit) als bei Normalinsulin (30-45 Minuten vor der Mahlzeit). Im Vergleich zu Normalinsulin tritt die Wirkung von Insulin lispro schneller ein und hält kürzer an (Wirkdauer 2-5 Stunden). Bei Typ 1- und bei Typ 2- Diabetikern konnte in klinischen Untersuchungen mit Insulin lispro im Vergleich zu Normalinsulin eine reduzierte postprandiale Hyperglykämie nachgewiesen werden. Wie bei jedem Insulin kann der Wirkungsverlauf von Insulin lispro bei verschiedenen Individuen und zu verschiedenen Zeitpunkten bei denselben Individuen unterschiedlich sein und hängt von der Dosis, der Injektionsstelle, der Durchblutung, der Temperatur und der körperlichen Aktivität ab. Der typische Wirkungsverlauf nach einer subkutanen Injektion ist in der folgenden Graphik dargestellt: 6
7 Insulin lispro Huminsulin Normal Hypoglykämische Aktivität Zeit (Stunden) Die obige Graphik zeigt die relative Glukosemenge, die notwendig ist, um den Blutglukosespiegel des Probanden nahe den Nüchternwerten zu halten, aufgetragen gegen die Zeit. Sie ist ein Maß für die Wirkung dieser Insuline auf den Glukosestoffwechsel über einen bestimmten Zeitraum. In klinischen Studien wurde die Behandlung von Kindern (61 Patienten zwischen 2 und 11 Jahren) sowie Kindern und Jugendlichen (481 Patienten zwischen 9 und 19 Jahren) untersucht, wobei Insulin lispro mit Normalinsulin verglichen wurde. Das pharmakodynamische Profil von Insulin lispro bei Kindern ist ähnlich dem bei Erwachsenen beobachteten. Für die Anwendung von Insulin lispro im Rahmen einer subkutanen Pumpentherapie wurde gezeigt, dass - verglichen mit Normalinsulin - niedrigere Spiegel an glycosyliertem Hämoglobin erhalten werden. In einer doppelblinden cross-over Studie reduzierte Insulin lispro nach 12-wöchiger Anwendung den Spiegel an glykosyliertem Hämoglobin um 0,37 Prozentpunkte im Vergleich zu 0,03 Prozentpunkten bei Normalinsulin-Gabe (P = 0,004). Studien haben gezeigt, dass bei Typ 2 Diabetikern, die mit Höchstdosen eines Sulfonylharnstoff- Präparates behandelt werden, durch zusätzliche Anwendung von Insulin lispro der HbA1c Wert signifikant reduziert wird, verglichen mit der alleinigen Gabe des Sulfonylharnstoff-Präparates. Die Reduzierung des HbA1c Werts ist auch bei der Verwendung anderer Insulinprodukte wie lösliche oder Isophan-Insuline zu erwarten. Klinische Studien mit Typ 1 und Typ 2 Diabetikern zeigten eine kleinere Anzahl nächtlicher Hypoglykämien unter Insulin lispro verglichen mit Insulin human. In einigen Studien war die Reduzierung nächtlicher Hypoglykämien verbunden mit vermehrten Hypoglykämien während des Tages. Die glucodynamische Reaktion auf Insulin lispro wird von einer Nieren- oder Leberfunktionsstörung nicht beeinflußt. Glucodynamische Unterschiede zwischen Insulin lispro und löslichem Humaninsulin, wie sie während eines Glucose clamp gemessen wurden, bleiben über einen weiten Nierenfunktionsbereich bestehen. Es wurde nachgewiesen, dass Insulin lispro auf molarer Basis äquipotent zu Humaninsulin ist, dass es aber einen rascheren Wirkungseintritt und eine kürzere Wirkungsdauer besitzt. 5.2 Pharmakokinetische Eigenschaften Die Pharmakokinetik von Insulin lispro weist auf eine Substanz hin, die sehr schnell resorbiert wird und Plasmaspitzenspiegel innerhalb von Minuten nach der subkutanen Injektion erzielt. Wenn man die klinische Relevanz dieser Kinetik bedenkt, ist es wohl eher angebracht, die Glukoseutilisationskurve zu studieren (im Abschnitt 5.1 diskutiert). 7
8 Die schnellere Absorption von Insulin lispro im Vergleich zu löslichem Humaninsulin bleibt bei Patienten mit Nierenfunktionsstörung unverändert. Im Regelfall bleiben bei Patienten mit Typ 2 Diabetes über einen weiten Nierenfunktionsbereich die pharmakokinetischen Unterschiede zwischen Insulin lispro und löslichem Insulin bestehen und zeigen sich unabhängig von der Nierenfunktion. Die schnellere Absorption und Elimination von Insulin lispro im Vergleich zu löslichem Humaninsulin bleibt bei Patienten mit Leberfunktionsstörung unverändert. 5.3 Präklinische Daten zur Sicherheit In in-vitro Studien waren die Wirkungen von Insulin lispro denen von Humaninsulin sehr ähnlich, einschließlich der Bindung an Insulinrezeptoren und der Wirkung auf wachsende Zellen. Studien belegen ebenfalls, dass die Dissoziation vom Insulinrezeptor für Insulin lispro und Humaninsulin equivalent ist. In Studien zur akuten Toxizität und zur Toxizität nach wiederholter Anwendung - über einen Zeitraum von einem und zwölf Monaten - wurden keine nennenswerten toxikologischen Befunde erhoben. Insulin lispro verursachte in Studien am Tier keine Fertilitätseinschränkungen, Embryotoxizität oder Teratogenität. 6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile m-cresol (3,15 mg/ml) Glycerol Natriummonohydrogenphosphat 7 H 2 O Zinkoxid Wasser für Injektionszwecke Salzsäure und Natriumhydroxid können für die Einstellung des ph auf 7,0 bis 7,8 eingesetzt werden. 6.2 Inkompatibilitäten Humalog-Präparate dürfen nicht mit Insulinen anderer Hersteller oder mit tierischen Insulinen gemischt werden. Dieses Arzneimittel darf nicht mit einem anderen Arzneimittel mit Ausnahme der unter Abschnitt 6.6 aufgeführten gemischt werden. 6.3 Dauer der Haltbarkeit Ungeöffnete Durchstechflaschen 3 Jahre. Nach erstmaligem Gebrauch 28 Tage 6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Nicht einfrieren. Nicht starker Hitze oder direktem Sonnenlicht aussetzen. Ungeöffnete Durchstechflaschen Im Kühlschrank lagern (2 C 8 C). Nach erstmaligem Gebrauch Im Kühlschrank (2 C 8 C) oder unter 30 C lagern. 8
9 6.5 Art und Inhalt des Behältnisses und spezielles Zubehör für den Gebrauch, die Anwendung oder die Implantation Die Lösung befindet sich in Typ I Klarglasflaschen, die mit Butyl- oder Halobutylstopfen verschlossen und mit Aluminiumkappen gesichert sind. Dimeticon- oder Silikonemulsionen können verwendet werden, um den Flaschenstopfen zu behandeln. Es sind möglicherweise nicht alle Packungsgrößen erhältlich. 1 x 10 ml Humalog Durchstechflasche 2 x 10 ml Humalog Durchstechflaschen 5 x (1 x 10 ml) Humalog Durchstechflaschen 6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen. Hinweise für die Handhabung Die Durchstechflasche muss zusammen mit einer passenden Spritze (markiert für 100 Einheiten) verwendet werden. a) Vorbereitung einer Dosierung Überprüfen Sie die Humalog-Lösung. Sie sollte klar und farblos sein. Verwenden Sie Humalog nicht, wenn Trübungen, Dickflüssigkeit, eine leichte Farbveränderung oder Substanzablagerungen zu erkennen sind. I) Humalog 1. Waschen Sie Ihre Hände. 2. Wenn Sie eine neue Flasche verwenden, nehmen Sie die Plastikschutzkappe ab, aber entfernen Sie nicht den Stopfen. 3. Wenn das Therapieschema die gleichzeitige Injektion von Verzögerungsinsulin und Humalog erfordert, können beide in der Spritze gemischt werden. Wenn Sie Insuline mischen, befolgen Sie die im Abschnitt II) und 6.2 aufgeführten Anweisungen für das Mischen. 4. Ziehen Sie die der verschriebenen Humalog-Menge entsprechende Menge Luft in die Spritze. Reinigen Sie den oberen Teil der Flasche mit einem Alkoholtupfer. Durchstechen Sie mit der Nadel den Gummiverschluss der Humalog -Flasche und injizieren Sie die Luft in die Flasche. 5. Stellen Sie Flasche und Spritze auf den Kopf. Halten Sie Flasche und Spritze fest in einer Hand. 6. Überprüfen Sie, dass die Spitze der Nadel in Humalog eingetaucht ist und ziehen Sie die korrekte Dosis in die Spritze auf. 7. Überprüfen Sie, ob sich Luftblasen in der Spritze befinden, welche die aufgezogene Menge Humalog reduzieren könnten, bevor Sie die Nadel aus der Flasche ziehen. Sollten Luftblasen vorhanden sein, halten Sie die Spritze aufrecht und klopfen Sie solange an die Seite der Spritze, bis die Luftblasen an die Oberfläche steigen. Drücken Sie sie mit dem Kolben aus der Spritze heraus und ziehen Sie die korrekte Menge des Arzneimittels auf. 8. Entfernen Sie die Nadel aus der Flasche und legen Sie die Spritze so ab, dass die Nadel nicht mit irgendwelchen Gegenständen in Berührung kommt. 9
10 II) Mischen mit länger wirksamen Humaninsulinen (siehe Abschnitt 6.2) 1. Humalog sollte mit länger wirksamen Humaninsulinen nur nach Anleitung des Arztes gemischt werden. 2. Ziehen Sie die der länger wirksamen Humaninsulinmenge entsprechende Menge Luft in die Spritze auf. Führen Sie die Spritze in die Flasche mit länger wirksamem Insulin ein und injizieren Sie die Luft. Ziehen Sie die Spritze wieder heraus. 3. Injizieren Sie nun in der gleichen Art und Weise Luft in die Humalog-Flasche, aber ziehen Sie die Spritze nicht heraus. 4. Stellen Sie Spritze und Flasche auf den Kopf. 5. Stellen Sie sicher, dass die Spitze der Nadel in Humalog eingetaucht ist und ziehen Sie die korrekte Menge Humalog in die Spritze auf. 6. Überprüfen Sie, ob sich Luftblasen in der Spritze befinden, welche die aufgezogene Menge Humalog reduzieren könnten, bevor Sie die Nadel aus der Flasche herausziehen. Sollten Luftblasen vorhanden sein, halten Sie die Spritze aufrecht und klopfen Sie solange auf die Seite der Spritze, bis die Luftblasen an die Oberfläche steigen. Drücken Sie sie mit dem Kolben aus der Spritze heraus und ziehen Sie die korrekte Menge des Arzneimittels auf. 7. Entfernen Sie die Nadel und führen Sie sie in die Flasche mit dem länger wirksamen Insulin ein. Stellen Sie Spritze und Flasche auf den Kopf. Halten Sie Flasche und Spritze fest in einer Hand und schütteln Sie sie leicht. Überprüfen Sie, dass die Spitze der Nadel in das Insulin eingetaucht ist und ziehen Sie die benötigte Menge länger wirksames Insulin auf. 8. Entsorgen Sie die Nadel und legen Sie die Spritze so ab, dass die Nadel nicht mit irgendwelchen Gegenständen in Berührung kommt. b) Injektion einer Dosis 1. Wählen Sie eine Injektionsstelle aus. 2. Reinigen Sie die Haut gemäß den Instruktionen. 3. Stabilisieren Sie die Haut, indem Sie sie spannen oder eine größere Fläche zusammen-drücken. Führen Sie die Nadel gemäß den Instruktionen ein und injizieren Sie entsprechend. 4. Ziehen Sie die Nadel heraus und üben Sie auf die Injektionsstelle für ein paar Sekunden leichten Druck aus. Reiben Sie die Stelle nicht. 5. Entsorgen Sie Spritze und Nadel sachgerecht. 6. Die Injektionsstelle sollte immer wieder gewechselt werden, so dass dieselbe Stelle nicht öfter als ca. einmal im Monat benutzt wird. c) Mischen von Insulinen Mischen Sie keine Insuline in Durchstechflaschen mit Insulinen in Patronen. Siehe Abschnitt INHABER DER ZULASSUNG Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Niederlande 10
11 8. ZULASSUNGSNUMMERN EU/1/96/007/002 EU/1/96/007/020 EU/1/96/007/021 1 x 10 ml Humalog Durchstechflasche 2 x 10ml Humalog Durchstechflaschen 5 x (1 x 10ml) Humalog Durchstechflaschen 9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG Datum der Erteilung der Zulassung: 30. April 1996 Datum der Verlängerung der Zulassung: 30. April STAND DER INFORMATION 11
12 1. BEZEICHNUNG DES ARZNEIMITTELS Humalog 100 E/ml, Injektionslösung in Patrone. 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 2.1 Allgemeine Beschreibung Humalog ist eine sterile, klare, farblose, wässrige Lösung. 2.2 Qualitative and quantitative Zusammensetzung 1 ml enthält 100U (äquivalent zu 3,5 mg) Insulin lispro (über rekombinante DNA hergestellt aus E. coli). Jedes Behältnis enthält 3 ml äquivalent zu 300U Insulin lispro. Die vollständige Auflistung der sonstigen Bestandteile siehe unter Abschnitt DARREICHUNGSFORM Injektionslösung. 4. KLINISCHE ANGABEN 4.1 Anwendungsgebiete Zur Behandlung von Erwachsenen und Kindern mit Diabetes mellitus, die Insulin für die Aufrechterhaltung eines normalen Glukosehaushaltes benötigen. Humalog ist ebenfalls angezeigt bei der Ersteinstellung des Diabetes mellitus. 4.2 Dosierung, Art und Dauer der Anwendung Die Dosierung muss vom Arzt entsprechend den Bedürfnissen des Patienten festgesetzt werden. Humalog kann unmittelbar vor einer Mahlzeit gegeben werden. Falls notwendig kann Humalog auch unmittelbar nach einer Mahlzeit angewendet werden. Humalog wird normalerweise subkutan injiziert oder im Rahmen einer kontinuierlichen subkutanen Infusionstherapie mittels einer Pumpe infundiert (siehe Abschnitt 4.2), kann aber auch - obwohl nicht empfohlen - intramuskulär injiziert werden. Falls notwendig kann Humalog auch intravenös angewendet werden. Zum Beispiel für die Korrektur von Blutglucosespiegeln während einer Ketoazidose, einer akuten Erkrankung oder intra- und postoperativen Phasen. Die subkutane Anwendung soll in Oberarm, Oberschenkel, Gesäß oder Abdomen erfolgen. Die Injektion sollte immer an verschiedenen Stellen stattfinden, so dass dieselbe Einstichstelle nicht öfter als ca. einmal im Monat verwendet wird. Bei subkutaner Injektion von Humalog muss darauf geachtet werden, dass kein Blutgefäß getroffen wird. Nach der Injektion darf die Injektionsstelle nicht massiert werden. Die Patienten müssen auf geeignete Injektionstechniken geschult werden. Humalog ist, verglichen mit Normalinsulin, bei subkutaner Anwendung ein Präparat mit rascherem Wirkungseintritt und kürzerer Wirkdauer (2 bis 5 Stunden). Aufgrund des sehr raschen Wirkungseintritts kann eine Humalog Injektion (oder ein Humalog Bolus im Falle der Anwendung mittels subkutaner Insulinpumpentherapie) unmittelbar vor oder nach den Mahlzeiten appliziert werden. Wie bei jedem Insulin 12
13 kann der Wirkungsverlauf intra- und interindividuell unterschiedlich sein. Der rasche Wirkeintritt von Humalog im Vergleich mit Normalinsulin ist unabhängig vom Injektionsort. Wie bei allen Insulinpräparaten hängt die Wirkdauer bei Humalog von der Dosis, der Injektionsstelle, der Durchblutung, der Temperatur und der körperlichen Aktivität ab. Gemäß der Anweisung des Arztes kann Humalog in Verbindung mit einem länger wirksamen Insulin oder mit oralen Sulfonylharnstoff- Präparaten angewendet werden. Anwendung von Humalog mittels einer Insulin-Infusionspumpe Zur Infusion von Insulin lispro können nur bestimmte CE zertifizierte Insulin-Infusionspumpen verwendet werden. Bevor Sie Insulin lispro infundieren, studieren Sie die Bedienungsanleitungen des Herstellers, um sicher zu sein, ob sich Ihre Pumpe eignet oder nicht. Lesen und befolgen Sie die den Infusionspumpen beigelegten Anweisungen. Benutzen Sie die für diese Pumpe vorgesehenen Vorratsbehälter und Katheter. Das Infusionsset (Schlauch und Nadel) muss gemäß den Anweisungen in der Bedienungsanleitung des Infusionssets gewechselt werden. Im Falle einer hypoglykämischen Episode sollte die Infusion unterbrochen werden, bis die Episode behoben ist. Falls wiederholte oder schwere niedrige Blutzuckerspiegel auftreten, informieren Sie bitte Ihren Arzt oder Ihr Krankenhaus und ziehen Sie die Notwendigkeit einer Reduktion oder einer Unterbrechung der Insulininfusion in Betracht. Ein Defekt an der Pumpe oder ein Verschluss des Infusionssets kann zu einem raschen Anstieg des Glukosespiegels führen. Falls Sie vermuten, dass der Insulinfluss unterbrochen ist, folgen Sie den Hinweisen in der Gebrauchsanleitung und informieren Sie - wenn nötig - Ihren Arzt oder Ihr Krankenhaus. Wenn Humalog mittels einer Insulin Infusionspumpe verabreicht wird, sollte es nicht mit einem anderen Insulin gemischt werden. Intravenöse Anwendung von Insulin Die intravenöse Injektion von Insulin lispro muss gemäß der üblichen klinischen Praxis für intravenöse Injektionen erfolgen, zum Beispiel durch einen intravenösen Bolus oder durch ein Infusionssystem. Regelmäßige Messungen des Blutglucosespiegels sind dabei erforderlich. Infusionssysteme sind bei Konzentrationen von 0,1U/ml bis 1,0 U/ml Insulin lispro in 0,9% iger Natriumchlorid- oder 5% iger Dextroselösung bei Raumtemperatur für 48 Stunden stabil. Es wird empfohlen, das System vor Beginn der Infusion zu spülen. 4.3 Gegenanzeigen Überempfindlichkeit gegen Insulin lispro oder einen sonstigen Bestandteil. Hypoglykämie. 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Die Umstellung eines Patienten auf einen anderen Insulintyp oder ein Insulin eines anderen Herstellers muss unter strenger ärztlicher Aufsicht erfolgen. Jede Änderung hinsichtlich Stärke, Marke (Hersteller), Insulintyp (Normal, Basal (NPH), Long etc), Art des Insulins (tierisches Insulin, Humaninsulin, Humaninsulin-Analogon) und/oder Herstellungsmethode (rekombinante DNA -Technologie bzw. tierisches Insulin) kann eine Veränderung des Insulinbedarfs nach sich ziehen. Bei schnell wirkenden Insulinen muss jeder Patient, der auch Basal-Insuline verwendet, die Dosierung beider Insuline optimieren, um eine Glucose-Kontrolle über den ganzen Tag hinweg zu erzielen, insbesondere in der Nacht und im nüchternen Zustand. Bestimmte Umstände wie lange Diabetes-Dauer, intensivierte Insulintherapie, diabetische Nervenerkrankung oder Medikation mit Beta-Blockern können die frühen Warnsymptome einer Hypoglykämie unterschiedlich oder weniger ausgeprägt erscheinen lassen. 13
14 Einige Patienten, bei denen hypoglykämische Reaktionen nach einem Wechsel von tierischem auf menschliches Insulin auftraten, berichteten, dass die frühen Warnsymptome einer Hypoglykämie weniger ausgeprägt oder anders als bei ihrem vorhergehenden Insulin waren. Eine unbehandelte Hypoglykämie oder nicht korrigierte hyperglykämische Reaktionen können zu Bewusstlosigkeit, Koma oder zum Tod führen. Die Gabe einer unzureichenden Dosis, bzw. die Unterbrechung einer Behandlung, insbesondere bei Patienten mit einem insulinpflichtigen Diabetes, kann zu einer Hyperglykämie und einer diabetischen Ketoazidose führen; diese Zustände sind potentiell lebensbedrohlich. Der Insulinbedarf kann bei bestehender Nierenschädigung vermindert sein. Der Insulinbedarf kann bei Patienten mit eingeschränkter Leberfunktion aufgrund einer reduzierten Fähigkeit zur Glukoneogenese und aufgrund eines geringeren Insulinabbaus vermindert sein; allerdings kann bei Patienten mit einer chronischen Leberfunktionsstörung eine erhöhte Insulinresistenz auch zu einem erhöhten Insulinbedarf führen. Der Insulinbedarf kann während einer Krankheit oder bei seelischer Belastung erhöht sein. Eine Anpassung der Dosierung kann auch bei einer starken körperlichen Belastung des Patienten oder bei einer Änderung der Ernährungsgewohnheiten notwendig sein. Körperliche Belastung unmittelbar nach der Mahlzeit kann das Risiko einer Hypoglykämie erhöhen. Eine Folge der pharmakodynamischen Eigenschaften schnell wirksamer Insulin-Analoga besteht darin, dass nach der Injektion im Vergleich zu Normalinsulin eine Hypoglykämie rascher auftreten kann. Wenn normalerweise Durchstechflaschen zu 40 E/ml verordnet werden, so darf kein Insulin aus Patronen zu 100 E/ml entnommen und in einer Spritze zu 40 E/ml verwendet werden. Humalog darf Kindern an Stelle von Normalinsulin nur dann verabreicht werden, wenn ein schneller Wirkungseintritt von Vorteil sein kann, beispielsweise bei der Wahl des passenden Injektionszeitpunkts im Zusammenhang mit einer Mahlzeit. Kombination von Humalog und Pioglitazon Unter einer Kombinationstherapie von Pioglitazon und Insulin wurden Fälle von Herzinsuffizienz berichtet. Besonders waren Patienten betroffen, bei denen ein erhöhtes Risiko für das Auftreten einer Herzinsuffizienz bestand. Sollte die Kombination von Pioglitazon und Humalog erwogen werden, ist dies zu beachten. Im Fall einer Kombinationsbehandlung sind bei den Patienten Anzeichen und Symptome einer Herzinsuffizienz, Gewichtszunahme und Ödeme zu überwachen. Pioglitazon muss abgesetzt werden, falls sich die kardiale Symtomatik verschlechtert. Hinweise für die Handhabung Um die mögliche Übertragung von Krankheiten zu vermeiden, darf jede Patrone nur von einem Patienten angewendet werden, auch wenn die Nadel des Injektionsgeräts gewechselt wurde. 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Der Insulinbedarf kann sich durch Arzneimittel mit hyperglykämischer Wirkung wie z. B. orale Kontrazeptiva, Kortikosteroide, Schilddrüsenhormone, Danazol oder Beta 2-Sympathomimetika (wie Ritodrin, Salbutamol, Terbutalin) erhöhen. Der Insulinbedarf kann sich durch die zusätzliche Anwendung von Arzneimitteln mit hypoglykämischer Wirksamkeit wie z. B. orale Antidiabetika, Salicylate (z. B. Acetylsalicylsäure), Sulfonamide, bestimmte Antidepressiva (Monoaminoxidaseinhibitoren, selektive Serotoninwiederaufnahmehemmer), bestimmte ACE-Hemmer (Captopril, Enalapril), Angiotensin II Rezeptorblocker, Beta-Blocker, Octreotid oder Alkohol reduzieren. Die zusätzliche Anwendung weiterer Arzneimittel neben Humalog muss mit dem Arzt abgestimmt werden (siehe Abschnitt 4.4). 14
15 4.6 Fertilität, Schwangerschaft und Stillzeit Die Daten von einer großen Anzahl von Anwendungen während Schwangerschaften zeigen keine Nebenwirkungen von Insulin lispro auf die Schwangerschaft oder auf die Gesundheit des Fötus/Neugeborenen. Es ist unbedingt notwendig, dass die gute Blutzuckerkontrolle bei einer mit Insulin behandelten Patientin (insulinabhängig oder mit Schwangerschaftsdiabetes) während der Schwangerschaft beibehalten wird. Der Insulinbedarf sinkt meistens während der ersten drei Schwangerschaftsmonate und steigt ab dem vierten Schwangerschaftsmonat an. Patientinnen mit Diabetes sollten unbedingt ärztlichen Rat einholen, wenn eine Schwangerschaft geplant wird oder eingetreten ist. Eine genaue Blutzuckerkontrolle sowie ein allgemein guter Gesundheitszustand sind bei Schwangeren mit Diabetes besonders wichtig. Während der Stillzeit kann eine neue Einstellung der Insulindosierung und der Diät oder beides notwendig sein. 4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen Eine Hypoglykämie kann die Konzentrations- und Reaktionsfähigkeit eines Patienten herabsetzen. Dies kann in Situationen, in denen diese Fähigkeiten von besonderer Bedeutung sind (z. B. beim Fahren eines Autos oder beim Bedienen von Maschinen), ein Risiko darstellen. Dem Patienten sollte geraten werden, Vorsichtsmaßnahmen zur Vermeidung von Hypoglykämien beim Führen von Kraftfahrzeugen zu treffen. Dieses ist bei Patienten mit häufigen Hypoglykämie-Episoden oder verringerter oder fehlender Wahrnehmung von Hypoglykämie-Warnsymptomen besonders wichtig. In diesen Fällen muss überlegt werden, ob das Führen eines Kraftfahrzeugs überhaupt ratsam ist. 4.8 Nebenwirkungen Die häufigste Nebenwirkung jeder Insulinbehandlung ist die Hypoglykämie. Schwere Hypoglykämien können zu Bewusstlosigkeit und im Extremfall zum Tod führen. Eine genaue Häufigkeitsangabe zum Auftreten von Hypoglykämien erfolgt nicht, da das Auftreten einer Hypoglykämie aus dem Zusammenspiel zwischen Insulindosis und anderen Faktoren wie Ernährung und körperlicher Betätigung resultiert. Lokale allergische Reaktionen kommen bei Patienten häufig vor (1/100 bis 1/10). Hautrötungen, Schwellungen oder Juckreiz können an der Injektionsstelle auftreten. Sie verschwinden gewöhnlich innerhalb weniger Tage bis weniger Wochen von selbst. In einigen Fällen können diese Erscheinungen durch andere Faktoren als Insulin verursacht werden, z. B. durch Hautdesinfektionsmittel oder mangelhafte Injektionstechnik. Eine systemische Allergie ist selten (1/ bis 1/1.000), aber potentiell gefährlicher und stellt eine generalisierte Insulinallergie dar. Sie kann Hautausschlag am ganzen Körper, Kurzatmigkeit, keuchenden Atem, Blutdruckabfall, schnellen Puls oder Schwitzen hervorrufen. Schwere generalisierte allergische Reaktionen können lebensbedrohlich sein. An der Injektionsstelle kann gelegentlich eine Lipodystrophie auftreten (1/1.000 bis 1/100). Im Zusammenhang mit Insulin-Therapie wurde über Ödeme berichtet, insbesondere wenn eine schlechte metabolische Kontrolle durch intensivierte Insulintherapie verbessert wurde. Meldung des Verdachts auf Nebenwirkungen Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das in Anhang V aufgeführte nationale Meldesystem* anzuzeigen. 4.9 Überdosierung 15
16 Es existiert keine spezielle Definition für eine Überdosierung von Insulin, da die Blutglukosekonzentration das Resultat einer komplexen Interaktion von Insulinspiegel, Glukoseverfügbarkeit und anderen metabolischen Prozessen ist. Eine Hypoglykämie kann aus einer unangemessen hohen Dosis Insulin im Verhältnis zur Nahrungsaufnahme oder zum Energieverbrauch resultieren. Eine Hypoglykämie kann einhergehen mit Teilnahmslosigkeit, Verwirrung, Herzklopfen, Kopfweh, Schwitzen und Erbrechen. Eine leichte Form der Hypoglykämie kann durch Aufnahme von Glukose oder anderen zuckerhaltigen Produkten behoben werden. Schwerere Fälle von Hypoglykämie können durch intramuskuläre oder subkutane Glucagoninjektionen behandelt werden, wobei der Patient nach der Injektion Kohlenhydrate zu sich nehmen sollte, sobald er sich ausreichend erholt hat. Patienten, die nicht auf Glucagon ansprechen, muss eine Glukoselösung intravenös verabreicht werden. Befindet sich der Patient im Koma, sollte Glucagon intramuskulär oder subkutan verabreicht werden. Ist kein Glucagon verfügbar oder spricht der Patient nicht auf Glucagon an, muss eine Glukoselösung intravenös verbreicht werden. Sobald der Patient wieder bei Bewußtsein ist, sollte er Nahrung zu sich nehmen. Es kann notwendig sein, Kohlenhydrat-Aufnahme und Beobachtung fortzuführen, da eine Hypoglykämie nach nur scheinbarer Genesung nochmals auftreten kann. 5. PHARMAKOLOGISCHE EIGENSCHAFTEN 5.1 Pharmakodynamische Eigenschaften Pharmakotherapeutische Gruppe: Humaninsulin-Analogon mit raschem Wirkungseintritt, ATC Code: A10A B04 Die Hauptwirkung von Insulin lispro ist die Regulierung des Glukosestoffwechsels. Außerdem haben Insuline zahlreiche anabole und anti-katabole Wirkungen in zahlreichen verschiedenen Geweben. Im Muskelgewebe bedeutet dies eine Steigerung der Glykogen-, Fettsäure-, Glycerol- und Proteinsynthese und der Aminosäureaufnahme; gleichzeitig werden die Glykogenolyse, die Glukoneogenese, die Ketogenese, die Lipolyse, der Proteinkatabolismus und der Aminosäuretransport aus der Zelle vermindert. Insulin lispro hat einen raschen Wirkungseintritt (ca. 15 Minuten), was eine zeitlich nähere Applikation in Bezug auf die Mahlzeit erlaubt (innerhalb von 15 Minuten vor oder nach der Mahlzeit) als bei Normalinsulin (30-45 Minuten vor der Mahlzeit). Im Vergleich zu Normalinsulin tritt die Wirkung von Insulin lispro schneller ein und hält kürzer an (Wirkdauer 2-5 Stunden). Bei Typ 1- und bei Typ 2- Diabetikern konnte in klinischen Untersuchungen mit Insulin lispro im Vergleich zu Normalinsulin eine reduzierte postprandiale Hyperglykämie nachgewiesen werden. Wie bei jedem Insulin kann der Wirkungsverlauf von Insulin lispro bei verschiedenen Individuen und zu verschiedenen Zeitpunkten bei denselben Individuen unterschiedlich sein und hängt von der Dosis, der Injektionsstelle, der Durchblutung, der Temperatur und der körperlichen Aktivität ab. Der typische Wirkungsverlauf nach einer subkutanen Injektion ist in der folgenden Graphik dargestellt: 16
17 Insulin lispro Huminsulin Normal Hypoglykämische Aktivität Zeit (Stunden) Die obige Graphik zeigt die relative Glukosemenge, die notwendig ist, um den Blutglukosespiegel des Probanden nahe den Nüchternwerten zu halten, aufgetragen gegen die Zeit. Sie ist ein Maß für die Wirkung dieser Insuline auf den Glukosestoffwechsel über einen bestimmten Zeitraum. In klinischen Studien wurde die Behandlung von Kindern (61 Patienten zwischen 2 und 11 Jahren) sowie Kindern und Jugendlichen (481 Patienten zwischen 9 und 19 Jahren) untersucht, wobei Insulin lispro mit Normalinsulin verglichen wurde. Das pharmakodynamische Profil von Insulin lispro bei Kindern ist ähnlich dem bei Erwachsenen beobachteten. Für die Anwendung von Insulin lispro im Rahmen einer subkutanen Pumpentherapie wurde gezeigt, dass - verglichen mit Normalinsulin - niedrigere Spiegel an glycosyliertem Hämoglobin erhalten werden. In einer doppelblinden cross-over Studie reduzierte Insulin lispro nach 12-wöchiger Anwendung den Spiegel an glykosyliertem Hämoglobin um 0,37 Prozentpunkte im Vergleich zu 0,03 Prozentpunkten bei Normalinsulin-Gabe (P = 0,004). Studien haben gezeigt, dass bei Typ 2 Diabetikern, die mit Höchstdosen eines Sulfonylharnstoff- Präparates behandelt werden, durch zusätzliche Anwendung von Insulin lispro der HbA1c Wert signifikant reduziert wird, verglichen mit der alleinigen Gabe des Sulfonylharnstoff-Präparates. Die Reduzierung des HbA1c Werts ist auch bei der Verwendung anderer Insulinprodukte wie lösliche oder Isophan-Insuline zu erwarten. Klinische Studien mit Typ 1 und Typ 2 Diabetikern zeigten eine kleinere Anzahl nächtlicher Hypoglykämien unter Insulin lispro verglichen mit Insulin human. In einigen Studien war die Reduzierung nächtlicher Hypoglykämien verbunden mit vermehrten Hypoglykämien während des Tages. Die glucodynamische Reaktion auf Insulin lispro wird von einer Nieren- oder Leberfunktionsstörung nicht beeinflußt. Glucodynamische Unterschiede zwischen Insulin lispro und löslichem Humaninsulin, wie sie während eines Glucose clamp gemessen wurden, bleiben über einen weiten Nierenfunktionsbereich bestehen. Es wurde nachgewiesen, dass Insulin lispro auf molarer Basis äquipotent zu Humaninsulin ist, dass es aber einen rascheren Wirkungseintritt und eine kürzere Wirkungsdauer besitzt. 5.2 Pharmakokinetische Eigenschaften Die Pharmakokinetik von Insulin lispro weist auf eine Substanz hin, die sehr schnell resorbiert wird und Plasmaspitzenspiegel innerhalb von Minuten nach der subkutanen Injektion erzielt. Wenn man die klinische Relevanz dieser Kinetik bedenkt, ist es wohl eher angebracht, die Glukoseutilisationskurve zu studieren (im Abschnitt 5.1 diskutiert). 17
18 Die schnellere Absorption von Insulin lispro im Vergleich zu löslichem Humaninsulin bleibt bei Patienten mit Nierenfunktionsstörung unverändert. Im Regelfall bleiben bei Patienten mit Typ 2 Diabetes über einen weiten Nierenfunktionsbereich die pharmakokinetischen Unterschiede zwischen Insulin lispro und löslichem Insulin bestehen und zeigen sich unabhängig von der Nierenfunktion. Die schnellere Absorption und Elimination von Insulin lispro im Vergleich zu löslichem Humaninsulin bleibt bei Patienten mit Leberfunktionsstörung unverändert. 5.3 Präklinische Daten zur Sicherheit In in-vitro Studien waren die Wirkungen von Insulin lispro denen von Humaninsulin sehr ähnlich, einschließlich der Bindung an Insulinrezeptoren und der Wirkung auf wachsende Zellen. Studien belegen ebenfalls, dass die Dissoziation vom Insulinrezeptor für Insulin lispro und Humaninsulin equivalent ist. In Studien zur akuten Toxizität und zur Toxizität nach wiederholter Anwendung - über einen Zeitraum von einem und zwölf Monaten - wurden keine nennenswerten toxikologischen Befunde erhoben. Insulin lispro verursachte in Studien am Tier keine Fertilitätseinschränkungen, Embryotoxizität oder Teratogenität. 6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile m-cresol (3,15 mg/ml) Glycerol Natriummonohydrogenphosphat 7 H 2 O Zinkoxid Wasser für Injektionszwecke Salzsäure und Natriumhydroxid können für die Einstellung des ph auf 7,0 bis 7,8 verwendet werden. 6.2 Inkompatibilitäten Humalog-Präparate dürfen nicht mit Insulinen anderer Hersteller oder mit tierischen Insulinen gemischt werden. 6.3 Dauer der Haltbarkeit Unbenutzte Patronen 3 Jahre. Nach Einlegen der Patrone 28 Tage 6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Unbenutzte Patronen Im Kühlschrank lagern (2 C 8 C). Nicht einfrieren. Nicht starker Hitze oder direktem Sonnenlicht aussetzen. Nach Einlegen der Patrone Unter 30 C lagern. Nicht einfrieren. Nach Einlegen der Patrone darf der Pen nicht mit aufgesetzter Nadel gelagert werden. 18
19 6.5 Art und Inhalt des Behältnisses und spezielles Zubehör für den Gebrauch, die Anwendung oder die Implantation Die Lösung befindet sich in Typ I Klarglaspatronen, die mit Butyl- oder Halobutylscheibenstopfen und Patronenkolben verschlossen und mit Aluminiumkappen gesichert sind. Dimeticon- oder Silikonemulsionen können verwendet werden, um den Kolben der Patrone und/oder die Glaspatrone zu behandeln. Es sind möglicherweise nicht alle Packungsgrößen erhältlich. 5 x 3 ml Humalog Patronen für einen 3 ml Pen. 2 x (5 x 3 ml) Humalog Patronen für einen 3 ml Pen. 6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen. Hinweise für die Handhabung Um die mögliche Übertragung von Krankheiten zu vermeiden, darf jede Patrone nur von einem Patienten angewendet werden, auch wenn die Nadel des Injektionsgeräts gewechselt wurde. Humalog Patronen müssen mit einem CE zertifizierten Pen entsprechend den vom Pen-Hersteller beigelegten Instruktionen verwendet werden. a) Vorbereitung einer Dosierung Überprüfen Sie die Humalog-Lösung. Sie sollte klar und farblos sein. Verwenden Sie Humalog nicht, wenn Trübungen, Dickflüssigkeit, eine leichte Farbveränderung oder Substanzablagerungen zu erkennen sind. Die folgende Beschreibung ist allgemein gehalten. Die Herstellerinstruktionen für den jeweiligen Pen müssen hinsichtlich des Einlegens der Patrone, des Aufsetzens der Nadel und der Verabreichung der Insulininjektion befolgt werden. b) Injektion einer Dosis 1. Waschen Sie Ihre Hände. 2. Wählen Sie eine Injektionsstelle aus. 3. Reinigen Sie die Haut gemäß den Instruktionen. 4. Nehmen Sie die Schutzkappe von der Nadel ab. 5. Stabilisieren Sie die Haut, indem Sie sie spannen oder eine größere Fläche zusammendrücken. Führen Sie die Nadel gemäß den Instruktionen ein. 6. Drücken Sie den Knopf. 7. Ziehen Sie die Nadel heraus und üben Sie auf die Injektionsstelle für ein paar Sekunden leichten Druck aus. Reiben Sie die Stelle nicht. 8. Schrauben Sie die Nadel mit Hilfe der Schutzkappe ab und entsorgen Sie sie sicher. 9. Die Injektionsstelle sollte immer wieder gewechselt werden, so dass dieselbe Stelle nicht öfter als ca. einmal im Monat benutzt wird. c) Mischen von Insulinen 19
20 Mischen Sie keine Insuline in Durchstechflaschen mit Insulinen in Patronen. Siehe Abschnitt INHABER DER ZULASSUNG Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Niederlande 8. ZULASSUNGSNUMMERN EU/1/96/007/004 EU/1/96/007/023 5 x 3 ml Humalog Patronen für einen 3 ml Pen. 2 x (5 x 3 ml) Humalog Patronen für einen 3 ml Pen. 9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG Datum der Erteilung der Zulassung: 30. April 1996 Datum der Verlängerung der Zulassung: 30. April STAND DER INFORMATION 20
Humalog 100 E/ml-Injektionslösung in Durchstechflasche 2. Qualitative und quantitative Zusammensetzung 2.1 Allgemeine Beschreibung Humalog ist eine
 Humalog 100 E/ml-Injektionslösung in Durchstechflasche 2. Qualitative und quantitative Zusammensetzung 2.1 Allgemeine Beschreibung Humalog ist eine sterile, klare, farblose, wäßrige Lösung. 2.2 Qualitative
Humalog 100 E/ml-Injektionslösung in Durchstechflasche 2. Qualitative und quantitative Zusammensetzung 2.1 Allgemeine Beschreibung Humalog ist eine sterile, klare, farblose, wäßrige Lösung. 2.2 Qualitative
Humalog 100 E/ml-Injektionslösung in Patrone 2. Qualitative und quantitative Zusammensetzung Humalog ist eine sterile, klare, farblose, wäßrige
 Humalog 100 E/ml-Injektionslösung in Patrone 2. Qualitative und quantitative Zusammensetzung Humalog ist eine sterile, klare, farblose, wäßrige Lösung. 2.2 Qualitative and quantitative Zusammensetzung
Humalog 100 E/ml-Injektionslösung in Patrone 2. Qualitative und quantitative Zusammensetzung Humalog ist eine sterile, klare, farblose, wäßrige Lösung. 2.2 Qualitative and quantitative Zusammensetzung
Humalog Mix25 100 E/ml-Injektionssuspension in Patronen 2. Qualitative und quantitative Zusammensetzung 2.1 Allgemeine Beschreibung Humalog Mix25 ist
 Humalog Mix25 100 E/ml-Injektionssuspension in Patronen 2. Qualitative und quantitative Zusammensetzung 2.1 Allgemeine Beschreibung Humalog Mix25 ist eine weiße, sterile Suspension. 2.2 Qualitative and
Humalog Mix25 100 E/ml-Injektionssuspension in Patronen 2. Qualitative und quantitative Zusammensetzung 2.1 Allgemeine Beschreibung Humalog Mix25 ist eine weiße, sterile Suspension. 2.2 Qualitative and
Anleitung zur Handhabung von Durchstechflasche und Einmalspritze (für Patienten, Ärzte, Diabetesberater und Apotheker)
 Anleitung zur Handhabung von Durchstechflasche und Einmalspritze (für Patienten, Ärzte, Diabetesberater und Apotheker) EIN LEITFADEN ZUR ERSTEN VERWENDUNG VON APIDRA in 10ml- DURCHSTECHFLASCHEN Apidra
Anleitung zur Handhabung von Durchstechflasche und Einmalspritze (für Patienten, Ärzte, Diabetesberater und Apotheker) EIN LEITFADEN ZUR ERSTEN VERWENDUNG VON APIDRA in 10ml- DURCHSTECHFLASCHEN Apidra
ANHANG I ZUSAMMENFASSUNG DER PRODUKTMERKMALE
 ANHANG I ZUSAMMENFASSUNG DER PRODUKTMERKMALE 4 Zusammenfassung der Merkmale des Arzneimittels 1. Bezeichnung des Arzneimittels HUMALOG Durchstichflasche (40 E/ml, 10 ml) Insulin lispro 2. Arzneilich wirksame
ANHANG I ZUSAMMENFASSUNG DER PRODUKTMERKMALE 4 Zusammenfassung der Merkmale des Arzneimittels 1. Bezeichnung des Arzneimittels HUMALOG Durchstichflasche (40 E/ml, 10 ml) Insulin lispro 2. Arzneilich wirksame
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Legalon SIL - Trockensubstanz zur Infusionsbereitung
 PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Legalon SIL - Trockensubstanz zur Infusionsbereitung Wirkstoff: Silibinin-C-2,3-bis(hydrogensuccinat), Dinatriumsalz Lesen Sie die gesamte
PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Legalon SIL - Trockensubstanz zur Infusionsbereitung Wirkstoff: Silibinin-C-2,3-bis(hydrogensuccinat), Dinatriumsalz Lesen Sie die gesamte
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Viscosan - Augentropfen Wirkstoff: Hypromellose
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Viscosan - Augentropfen Wirkstoff: Hypromellose Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Viscosan - Augentropfen Wirkstoff: Hypromellose Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Humalog 100 E/ml, Injektionslösung in Durchstechflasche. 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 2.1 Allgemeine
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Humalog 100 E/ml, Injektionslösung in Durchstechflasche. 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 2.1 Allgemeine
Wie unsere Augen Erfahren Sie, wie wir sehen, und wie Sie Ihre Vision zu schützen.
 Wie unsere Augen Erfahren Sie, wie wir sehen, und wie Sie Ihre Vision zu schützen. Levobunolol ist ein Beta-Blocker, der den Druck im Inneren des Auges reduziert. Levobunolol Augen (Auge) ist für die Behandlung
Wie unsere Augen Erfahren Sie, wie wir sehen, und wie Sie Ihre Vision zu schützen. Levobunolol ist ein Beta-Blocker, der den Druck im Inneren des Auges reduziert. Levobunolol Augen (Auge) ist für die Behandlung
Gebrauchsinformation: Information für Anwender. LOMUSOL Augentropfen. Wirkstoff: Dinatriumcromoglicat
 Gebrauchsinformation: Information für Anwender LOMUSOL Augentropfen Wirkstoff: Dinatriumcromoglicat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für Anwender LOMUSOL Augentropfen Wirkstoff: Dinatriumcromoglicat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Nasa Rhinathiol 0,1 %ige Nasenspray, Lösung Xylometazolinhydrochlorid
 Seite 1/5 Packungsbeilage Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mir der Anwendung dieses Arzneimittels beginnen. Sie enthält wichtige Informationen für Ihre Behandlung. Wenn
Seite 1/5 Packungsbeilage Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mir der Anwendung dieses Arzneimittels beginnen. Sie enthält wichtige Informationen für Ihre Behandlung. Wenn
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Protagent-Einmalaugentropfen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 ml Lösung (= ca. 30 Tropfen) enthält 20 mg
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Protagent-Einmalaugentropfen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 ml Lösung (= ca. 30 Tropfen) enthält 20 mg
Fachinformation. sicher zu sein, ob sich Ihre Pumpe eignet oder nicht. Lesen und befolgen Sie die den Infusionspumpen beigelegten Anweisungen.
 1. Bezeichnung der Arzneimittel 100 E/ml, Injektionslösung 100 E/ml, Injektionslösung 100 E/ml KwikPen, Injektionslösung 2. Qualitative und quantitative Zusammensetzung 2.1 Allgemeine Beschreibung Humalog
1. Bezeichnung der Arzneimittel 100 E/ml, Injektionslösung 100 E/ml, Injektionslösung 100 E/ml KwikPen, Injektionslösung 2. Qualitative und quantitative Zusammensetzung 2.1 Allgemeine Beschreibung Humalog
Packungsbeilage CORSODYL Mundspüllösung / Spray 03-2012 Seite 1/5 BE106802 / BE191764 Belgien GEBRAUCHINFORMATION: INFORMATION FÜR DEN ANWENDER
 Seite 1/5 BE106802 / BE191764 Belgien GEBRAUCHINFORMATION: INFORMATION FÜR DEN ANWENDER CORSODYL 200mg/100ml mundwasser CORSODYL 200mg/100ml spray zur Anwendung in der Mundhöhle Chlorhexidindigluconat
Seite 1/5 BE106802 / BE191764 Belgien GEBRAUCHINFORMATION: INFORMATION FÜR DEN ANWENDER CORSODYL 200mg/100ml mundwasser CORSODYL 200mg/100ml spray zur Anwendung in der Mundhöhle Chlorhexidindigluconat
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Tantum Verde 3 mg Pastillen mit Minzgeschmack Wirkstoff: Benzydaminhydrochlorid
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tantum Verde 3 mg Pastillen mit Minzgeschmack Wirkstoff: Benzydaminhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tantum Verde 3 mg Pastillen mit Minzgeschmack Wirkstoff: Benzydaminhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Heumann s Blasen- und Nierentee Solubitrat Wirkstoffe: Dickextrakt aus Birkenblättern, Dickextrakt aus Riesengoldrutenkraut Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Heumann s Blasen- und Nierentee Solubitrat Wirkstoffe: Dickextrakt aus Birkenblättern, Dickextrakt aus Riesengoldrutenkraut Lesen Sie die gesamte Packungsbeilage
Bijsluiter DE versie Imaverol 100 mg (glas) B. PACKUNGSBEILAGE 1
 B. PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION Imaverol 100 mg, Konzentrat zur örtlichen Anwendung 1.NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE
B. PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION Imaverol 100 mg, Konzentrat zur örtlichen Anwendung 1.NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE
FACHINFORMATION. Wenn Liprolog mittels einer Insulin-Infusionspumpe
 1. BEZEICHNUNG DER ARZNEIMITTEL 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 2.1 Allgemeine Beschreibung ist eine sterile, klare, farblose, wässrige Lösung. 2.2 Qualitative und quantitative Zusammensetzung
1. BEZEICHNUNG DER ARZNEIMITTEL 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 2.1 Allgemeine Beschreibung ist eine sterile, klare, farblose, wässrige Lösung. 2.2 Qualitative und quantitative Zusammensetzung
Diese Entscheidung ist an Eli Lilly and Company Limited, Kingsclere Road, Basingstoke, Hants, UK, RG21 6XA gerichtet.
 Diese Entscheidung ist an Eli Lilly and Company Limited, Kingsclere Road, Basingstoke, Hants, UK, RG21 6XA gerichtet. Brüssel, den 7. Mai 1997 Für die Kommission Martin BANGEMANN Mitglied der Kommission
Diese Entscheidung ist an Eli Lilly and Company Limited, Kingsclere Road, Basingstoke, Hants, UK, RG21 6XA gerichtet. Brüssel, den 7. Mai 1997 Für die Kommission Martin BANGEMANN Mitglied der Kommission
Gefährlich hohe Blutzuckerwerte
 Gefährlich hohe Blutzuckerwerte In besonderen Situationen kann der Blutzuckerspiegel gefährlich ansteigen Wenn in Ausnahmefällen der Blutzuckerspiegel sehr hoch ansteigt, dann kann das für Sie gefährlich
Gefährlich hohe Blutzuckerwerte In besonderen Situationen kann der Blutzuckerspiegel gefährlich ansteigen Wenn in Ausnahmefällen der Blutzuckerspiegel sehr hoch ansteigt, dann kann das für Sie gefährlich
Insulin same procedure as every year? Barbara Felix KliFo 2013 KSBL Standort Bruderholz
 Insulin same procedure as every year? Barbara Felix KliFo 2013 KSBL Standort Bruderholz -Zellfunktion (%) Verlust der - Zellfunktion 100 Diabetes mellitus 75 IGT 50 25 Postprandiale Hyperglykämie Phase
Insulin same procedure as every year? Barbara Felix KliFo 2013 KSBL Standort Bruderholz -Zellfunktion (%) Verlust der - Zellfunktion 100 Diabetes mellitus 75 IGT 50 25 Postprandiale Hyperglykämie Phase
Sumatriptan Antrag auf Freistellung von der Verschreibungspflicht mit Beschränkungen
 Sumatriptan Antrag auf Freistellung von der Verschreibungspflicht mit Beschränkungen Sachverständigen-Ausschuss für Verschreibungspflicht 62. Sitzung am 13.01.2009 im Bundesinstitut für Arzneimittel- und
Sumatriptan Antrag auf Freistellung von der Verschreibungspflicht mit Beschränkungen Sachverständigen-Ausschuss für Verschreibungspflicht 62. Sitzung am 13.01.2009 im Bundesinstitut für Arzneimittel- und
WAS finde ich WO im Beipackzettel
 WAS finde ich WO im Beipackzettel Sie haben eine Frage zu Ihrem? Meist finden Sie die Antwort im Beipackzettel (offiziell "Gebrauchsinformation" genannt). Der Aufbau der Beipackzettel ist von den Behörden
WAS finde ich WO im Beipackzettel Sie haben eine Frage zu Ihrem? Meist finden Sie die Antwort im Beipackzettel (offiziell "Gebrauchsinformation" genannt). Der Aufbau der Beipackzettel ist von den Behörden
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Kamillosan -Mundspray. Kamillenblütenauszug Pfefferminzöl Anisöl
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Kamillosan -Mundspray Kamillenblütenauszug Pfefferminzöl Anisöl Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Kamillosan -Mundspray Kamillenblütenauszug Pfefferminzöl Anisöl Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
FIT 1 Herzlich willkommen
 FIT 1 Herzlich willkommen Der Weg ist das Ziel! (Konfuzius) Quelle: leadion.de Funktionelle Insulintherapie = FIT Nahezu - normoglykämische Insulinsubstitution = NIS Basis - Bolus: Langzeit-Fasteninsulin
FIT 1 Herzlich willkommen Der Weg ist das Ziel! (Konfuzius) Quelle: leadion.de Funktionelle Insulintherapie = FIT Nahezu - normoglykämische Insulinsubstitution = NIS Basis - Bolus: Langzeit-Fasteninsulin
Screening Das Programm. zur Früherkennung von Brustkrebs
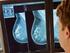 Mammographie Screening Das Programm zur Früherkennung von Brustkrebs das Mammographie Screening Programm Wenn Sie zwischen 50 und 69 Jahre alt sind, haben Sie alle zwei Jahre Anspruch auf eine Mammographie-Untersuchung
Mammographie Screening Das Programm zur Früherkennung von Brustkrebs das Mammographie Screening Programm Wenn Sie zwischen 50 und 69 Jahre alt sind, haben Sie alle zwei Jahre Anspruch auf eine Mammographie-Untersuchung
Behandlung von Diabetes
 04 Arbeitsanweisung Arbeitsauftrag Anhand des Foliensatzes werden die verschiedenen Behandlungsmethoden bei Diabetes Typ 1 und Typ 2 besprochen. Anschliessend werden noch kurz die Folgen bei einer Nichtbehandlung
04 Arbeitsanweisung Arbeitsauftrag Anhand des Foliensatzes werden die verschiedenen Behandlungsmethoden bei Diabetes Typ 1 und Typ 2 besprochen. Anschliessend werden noch kurz die Folgen bei einer Nichtbehandlung
Gut. Zu Wissen. Tipps und Tricks zur sicheren Insulininjektion. Diabetes
 Gut. Zu Wissen. Tipps und Tricks zur sicheren Insulininjektion Diabetes Tipp 1 Insulininjektion Das Leben mit dem Pieks Für eine optimale Insulininjektion ist nicht nur die Technik, sondern auch die Länge
Gut. Zu Wissen. Tipps und Tricks zur sicheren Insulininjektion Diabetes Tipp 1 Insulininjektion Das Leben mit dem Pieks Für eine optimale Insulininjektion ist nicht nur die Technik, sondern auch die Länge
INSULIN-ABC WAS ES IST UND WIE ES VERWENDET WIRD
 INSULIN-ABC WAS ES IST UND WIE ES VERWENDET WIRD DEDBT01426 Lilly Deutschland GmbH Werner-Reimers-Straße 2 4 61352 Bad Homburg Leben so normal wie möglich www.lilly-pharma.de www.lilly-diabetes.de Warum
INSULIN-ABC WAS ES IST UND WIE ES VERWENDET WIRD DEDBT01426 Lilly Deutschland GmbH Werner-Reimers-Straße 2 4 61352 Bad Homburg Leben so normal wie möglich www.lilly-pharma.de www.lilly-diabetes.de Warum
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. PROGESTOGEL 1 % Gel. Progesteron
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER PROGESTOGEL 1 % Gel Progesteron Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. Heben
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER PROGESTOGEL 1 % Gel Progesteron Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. Heben
Atronase 0,3 mg/ml Nasenspray, Lösung (Ipratropiumbromid)
 GEBRAUCHSINFORMATION ATRONASE 0,3 MG/ML NASENSPRAY, LÖSUNG Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses Arzneimittel ist auch ohne Verschreibung
GEBRAUCHSINFORMATION ATRONASE 0,3 MG/ML NASENSPRAY, LÖSUNG Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses Arzneimittel ist auch ohne Verschreibung
Wie oft soll ich essen?
 Wie oft soll ich essen? Wie sollen Sie sich als Diabetiker am besten ernähren? Gesunde Ernährung für Menschen mit Diabetes unterscheidet sich nicht von gesunder Ernährung für andere Menschen. Es gibt nichts,
Wie oft soll ich essen? Wie sollen Sie sich als Diabetiker am besten ernähren? Gesunde Ernährung für Menschen mit Diabetes unterscheidet sich nicht von gesunder Ernährung für andere Menschen. Es gibt nichts,
Bedienungsanleitung ClikSTAR Insulinpen
 ClikSTAR Wichtige Informationen zu Ihrem neuen Insulinpen Bedienungsanleitung ClikSTAR Insulinpen Bevor Sie den Pen verwenden Lesen Sie diese Bedienungsanleitung und befolgen Sie sie vollständig bei jeder
ClikSTAR Wichtige Informationen zu Ihrem neuen Insulinpen Bedienungsanleitung ClikSTAR Insulinpen Bevor Sie den Pen verwenden Lesen Sie diese Bedienungsanleitung und befolgen Sie sie vollständig bei jeder
Packungsbeilage GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. NUSO-SAN Menthol 1mg/ml Nasenspray, Lösung. Xylometazolinhydrochlorid
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER NUSO-SAN Menthol 1mg/ml Nasenspray, Lösung Xylometazolinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER NUSO-SAN Menthol 1mg/ml Nasenspray, Lösung Xylometazolinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige
Diese Broschüre fasst die wichtigsten Informationen zusammen, damit Sie einen Entscheid treffen können.
 Aufklärung über die Weiterverwendung/Nutzung von biologischem Material und/oder gesundheitsbezogen Daten für die biomedizinische Forschung. (Version V-2.0 vom 16.07.2014, Biobanken) Sehr geehrte Patientin,
Aufklärung über die Weiterverwendung/Nutzung von biologischem Material und/oder gesundheitsbezogen Daten für die biomedizinische Forschung. (Version V-2.0 vom 16.07.2014, Biobanken) Sehr geehrte Patientin,
Verschreibungsfreie Arzneimittel wieder in der Erstattung
 Satzungsleistungen Verschreibungsfreie Arzneimittel wieder in der Erstattung Was sind Satzungsleistungen? Der Rahmen für die Leistungen der gesetzlichen Krankenversicherung wird im Fünften Sozialgesetzbuch
Satzungsleistungen Verschreibungsfreie Arzneimittel wieder in der Erstattung Was sind Satzungsleistungen? Der Rahmen für die Leistungen der gesetzlichen Krankenversicherung wird im Fünften Sozialgesetzbuch
Labortests für Ihre Gesundheit. Therapie nach Maß 26
 Labortests für Ihre Gesundheit Therapie nach Maß 26 01IPF Labortests für Ihre Gesundheit Therapie nach Maß Die individuelle Dosis finden Jeder Mensch ist einzigartig. Keiner gleicht dem anderen nicht nur
Labortests für Ihre Gesundheit Therapie nach Maß 26 01IPF Labortests für Ihre Gesundheit Therapie nach Maß Die individuelle Dosis finden Jeder Mensch ist einzigartig. Keiner gleicht dem anderen nicht nur
INFORMATIONEN FÜR TYP-2-DIABETIKER. Warum der HbA 1c -Wert für Sie als Typ-2-Diabetiker so wichtig ist!
 INFORMATIONEN FÜR TYP-2-DIABETIKER Warum der HbA 1c -Wert für Sie als Typ-2-Diabetiker so wichtig ist! Liebe Leserin, lieber Leser, Wer kennt das nicht: Kurz vor dem nächsten Arztbesuch hält man sich besonders
INFORMATIONEN FÜR TYP-2-DIABETIKER Warum der HbA 1c -Wert für Sie als Typ-2-Diabetiker so wichtig ist! Liebe Leserin, lieber Leser, Wer kennt das nicht: Kurz vor dem nächsten Arztbesuch hält man sich besonders
Gestations- Diabetes. Referentin: Agnes Ruckstuhl
 Gestations- Diabetes Referentin: Agnes Ruckstuhl C1 Die wichtigsten Diabetestypen Typ1 - Diabetes autoimmune Erkrankung => verursacht einen absoluten Insulinmangel, d.h. Zerstörung der körpereigenen Beta-Zellen
Gestations- Diabetes Referentin: Agnes Ruckstuhl C1 Die wichtigsten Diabetestypen Typ1 - Diabetes autoimmune Erkrankung => verursacht einen absoluten Insulinmangel, d.h. Zerstörung der körpereigenen Beta-Zellen
Pflichttexte zur Verwendung in der Werbung für Arzneimittel in Deutschland gemäß Heilmittelwerbegesetz (HWG) Endverbraucher
 Cutasept F Pflichttexte Cutasept F: Wirkstoff: Propan-2-ol. Zusammensetzung: 100 g Lösung enthalten: Wirkstoff: Propan-2-ol 63,0 g, entspricht 72 Vol.%. Sonstige Bestandteile: Benzalkoniumchlorid, Gereinigtes
Cutasept F Pflichttexte Cutasept F: Wirkstoff: Propan-2-ol. Zusammensetzung: 100 g Lösung enthalten: Wirkstoff: Propan-2-ol 63,0 g, entspricht 72 Vol.%. Sonstige Bestandteile: Benzalkoniumchlorid, Gereinigtes
Lineargleichungssysteme: Additions-/ Subtraktionsverfahren
 Lineargleichungssysteme: Additions-/ Subtraktionsverfahren W. Kippels 22. Februar 2014 Inhaltsverzeichnis 1 Einleitung 2 2 Lineargleichungssysteme zweiten Grades 2 3 Lineargleichungssysteme höheren als
Lineargleichungssysteme: Additions-/ Subtraktionsverfahren W. Kippels 22. Februar 2014 Inhaltsverzeichnis 1 Einleitung 2 2 Lineargleichungssysteme zweiten Grades 2 3 Lineargleichungssysteme höheren als
Ein neues System für die Allokation von Spenderlungen. LAS Information für Patienten in Deutschland
 Ein neues System für die Allokation von Spenderlungen LAS Information für Patienten in Deutschland Ein neues System für die Allokation von Spenderlungen Aufgrund des immensen Mangels an Spenderorganen
Ein neues System für die Allokation von Spenderlungen LAS Information für Patienten in Deutschland Ein neues System für die Allokation von Spenderlungen Aufgrund des immensen Mangels an Spenderorganen
Gebrauchsinformation: Information für Patienten. Desloratadin Genericon 5 mg Filmtabletten. Wirkstoff: Desloratadin
 Gebrauchsinformation: Information für Patienten Desloratadin Genericon 5 mg Filmtabletten Wirkstoff: Desloratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
Gebrauchsinformation: Information für Patienten Desloratadin Genericon 5 mg Filmtabletten Wirkstoff: Desloratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
Downloadfehler in DEHSt-VPSMail. Workaround zum Umgang mit einem Downloadfehler
 Downloadfehler in DEHSt-VPSMail Workaround zum Umgang mit einem Downloadfehler Downloadfehler bremen online services GmbH & Co. KG Seite 2 Inhaltsverzeichnis Vorwort...3 1 Fehlermeldung...4 2 Fehlerbeseitigung...5
Downloadfehler in DEHSt-VPSMail Workaround zum Umgang mit einem Downloadfehler Downloadfehler bremen online services GmbH & Co. KG Seite 2 Inhaltsverzeichnis Vorwort...3 1 Fehlermeldung...4 2 Fehlerbeseitigung...5
Gebrauchsinformation: Information für Anwender. LIVOSTIN - Augentropfen Wirkstoff: Levocabastin-Hydrochlorid
 Gebrauchsinformation: Information für Anwender LIVOSTIN - Augentropfen Wirkstoff: Levocabastin-Hydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für Anwender LIVOSTIN - Augentropfen Wirkstoff: Levocabastin-Hydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Durchfall in der Pflege. Der kleine Ratgeber von Aplona
 Durchfallerkrankungen Durchfall in der Pflege Der kleine von Aplona Der kleine von Aplona 3 Fotos: Titel, Seite 2, 3 und 4: Fotolia.com Durchfall in der Pflege Akute Durchfallerkrankungen stellen eine
Durchfallerkrankungen Durchfall in der Pflege Der kleine von Aplona Der kleine von Aplona 3 Fotos: Titel, Seite 2, 3 und 4: Fotolia.com Durchfall in der Pflege Akute Durchfallerkrankungen stellen eine
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Humalog 100 Einheiten/ml, Injektionslösung in Durchstechflasche Humalog 100 Einheiten/ml, Injektionslösung in
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Humalog 100 Einheiten/ml, Injektionslösung in Durchstechflasche Humalog 100 Einheiten/ml, Injektionslösung in
Gebrauchsinformation: Information für Patienten. Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench)
 Gebrauchsinformation: Information für Patienten Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench) Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Gebrauchsinformation: Information für Patienten Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench) Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
PACKUNGSBEILAGE. CORSODYL Zahngel, 10 mg Chlorhexidin digluconat pro g Zahngel
 Seite 1/5 981 IS 153 F7 Belgien PACKUNGSBEILAGE Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Wenn Sie weitere Fragen haben, wenden Sie sich an
Seite 1/5 981 IS 153 F7 Belgien PACKUNGSBEILAGE Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Wenn Sie weitere Fragen haben, wenden Sie sich an
Gestationsdiabetes, insulinpflichtig. Intensivierte Insulin- Therapie und Insulinpumpentherapie. Konventionelle Insulin-
 Verordnung von Blutzuckerteststreifen Stand 2014 Grundsätzlich gilt, dass es sich bei den nachfolgenden Angaben um Empfehlungen und Orientierungsrahmen handelt. Ärzte können bedarfsgerecht jederzeit die
Verordnung von Blutzuckerteststreifen Stand 2014 Grundsätzlich gilt, dass es sich bei den nachfolgenden Angaben um Empfehlungen und Orientierungsrahmen handelt. Ärzte können bedarfsgerecht jederzeit die
Insulin aus den Langerhansschen Inseln
 Insulin Themen Insulinproduktion Insulinsekretion Insulinsorten Wirkprofile Lagerung und Anwendung von Insulinen Insulintherapieformen Pause und praktische Übung Insulindosisanpassung (BE, BE-Faktor, 30
Insulin Themen Insulinproduktion Insulinsekretion Insulinsorten Wirkprofile Lagerung und Anwendung von Insulinen Insulintherapieformen Pause und praktische Übung Insulindosisanpassung (BE, BE-Faktor, 30
Erratum Benkert, Pocket Guide, Psychopharmaka von A bis Z. 3.Aufl. ISBN (print): 978-3-642-54766-9/ DOI 10.1007/978-3-642-54767-6
 Erratum Benkert, Pocket Guide, Psychopharmaka von A bis Z. 3.Aufl. ISBN (print): 978-3-642-54766-9/ DOI 10.1007/978-3-642-54767-6 Trotz sorgfältiger Erstellung des Buchs Benkert, Pocket Guide, Psychopharmaka
Erratum Benkert, Pocket Guide, Psychopharmaka von A bis Z. 3.Aufl. ISBN (print): 978-3-642-54766-9/ DOI 10.1007/978-3-642-54767-6 Trotz sorgfältiger Erstellung des Buchs Benkert, Pocket Guide, Psychopharmaka
Patienteninformationsbroschüre Valproat
 Patienteninformationsbroschüre Valproat Informationen für Patientinnen Die Informationen in dieser Broschüre sind für Frauen bestimmt, denen Valproat verschrieben wird und die schwanger werden können (Frauen
Patienteninformationsbroschüre Valproat Informationen für Patientinnen Die Informationen in dieser Broschüre sind für Frauen bestimmt, denen Valproat verschrieben wird und die schwanger werden können (Frauen
Typ-1-Diabetes und Lebensstil
 Typ-1-Diabetes und Lebensstil Bayer Austria Ges.m.b.H Herbststraße 6-10 1160 Wien 0800/220 110 www.bayerdiabetes.at Diese Informationsbroschüre ist nicht als medizinischer Ratgeber zu betrachten und ist
Typ-1-Diabetes und Lebensstil Bayer Austria Ges.m.b.H Herbststraße 6-10 1160 Wien 0800/220 110 www.bayerdiabetes.at Diese Informationsbroschüre ist nicht als medizinischer Ratgeber zu betrachten und ist
10 Antworten zum Thema Generika
 10 Antworten zum Thema Generika Die mit dem Regenbogen Liebe Leserin, Lieber Leser Immer mehr Schweizerinnen und Schweizer leiden unter den jährlich steigenden Gesundheitskosten und Krankenkassenprämien.
10 Antworten zum Thema Generika Die mit dem Regenbogen Liebe Leserin, Lieber Leser Immer mehr Schweizerinnen und Schweizer leiden unter den jährlich steigenden Gesundheitskosten und Krankenkassenprämien.
InVo. Information zu Verordnungen in der GKV. Herstellung von Arzneimitteln durch Ärzte Anzeigepflicht bei Bezirksregierungen. Stand: Februar 2010
 Nr. 1 2010 InVo Information zu Verordnungen in der GKV Stand: Februar 2010 Herstellung von Arzneimitteln durch Ärzte Anzeigepflicht bei Bezirksregierungen Bisher konnten Sie als Arzt Arzneimittel (z. B.
Nr. 1 2010 InVo Information zu Verordnungen in der GKV Stand: Februar 2010 Herstellung von Arzneimitteln durch Ärzte Anzeigepflicht bei Bezirksregierungen Bisher konnten Sie als Arzt Arzneimittel (z. B.
Subkutane spezifische Immuntherapie. Eine Information für Patienten
 Subkutane spezifische Immuntherapie Eine Information für Patienten Spezifische Immuntherapie Die Allergietestung durch Ihren Arzt hat ergeben, dass Sie (oder Ihr Kind) an einer Allergie leiden. Allergische
Subkutane spezifische Immuntherapie Eine Information für Patienten Spezifische Immuntherapie Die Allergietestung durch Ihren Arzt hat ergeben, dass Sie (oder Ihr Kind) an einer Allergie leiden. Allergische
Faltschachtel. Unverkäufliches Muster (Eindruck auf Linie) Teil einer Klinikpackung, Einzelverkauf unzulässig (Eindruck auf Linie)
 Packmittelmanuskript Nr. 64000/009/94/6 Seite 2 Faltschachtel HEUMANN PHARMA GmbH & Co. Generica KG Südwestpark 50 90449 Nürnberg Urso 400 Heumann Filmtabletten mit 400 mg Ursodeoxycholsäure Zur Auflösung
Packmittelmanuskript Nr. 64000/009/94/6 Seite 2 Faltschachtel HEUMANN PHARMA GmbH & Co. Generica KG Südwestpark 50 90449 Nürnberg Urso 400 Heumann Filmtabletten mit 400 mg Ursodeoxycholsäure Zur Auflösung
Manager. von Peter Pfeifer, Waltraud Pfeifer, Burkhard Münchhagen. Spielanleitung
 Manager von Peter Pfeifer, Waltraud Pfeifer, Burkhard Münchhagen Spielanleitung Manager Ein rasantes Wirtschaftsspiel für 3 bis 6 Spieler. Das Glück Ihrer Firma liegt in Ihren Händen! Bestehen Sie gegen
Manager von Peter Pfeifer, Waltraud Pfeifer, Burkhard Münchhagen Spielanleitung Manager Ein rasantes Wirtschaftsspiel für 3 bis 6 Spieler. Das Glück Ihrer Firma liegt in Ihren Händen! Bestehen Sie gegen
Erfahrungen mit Hartz IV- Empfängern
 Erfahrungen mit Hartz IV- Empfängern Ausgewählte Ergebnisse einer Befragung von Unternehmen aus den Branchen Gastronomie, Pflege und Handwerk Pressegespräch der Bundesagentur für Arbeit am 12. November
Erfahrungen mit Hartz IV- Empfängern Ausgewählte Ergebnisse einer Befragung von Unternehmen aus den Branchen Gastronomie, Pflege und Handwerk Pressegespräch der Bundesagentur für Arbeit am 12. November
Krank durch Schlafstörungen
 Seite 1 von 6 I n f o r m a t i o n s m a t e r i a l v o m 1 2. 0 1. 2 0 1 2 Krank durch Schlafstörungen "Die meisten Menschen sterben an ihren Medikamenten und nicht an ihren Krankheiten", meinte der
Seite 1 von 6 I n f o r m a t i o n s m a t e r i a l v o m 1 2. 0 1. 2 0 1 2 Krank durch Schlafstörungen "Die meisten Menschen sterben an ihren Medikamenten und nicht an ihren Krankheiten", meinte der
Cytomegalie & Co. Häufige Virusinfektionen in der Schwangerschaft. Deutsches Grünes Kreuz e.v.
 Cytomegalie & Co Häufige Virusinfektionen in der Schwangerschaft Schwangerschaft Eine ganz besondere Zeit der Vorfreude Verantwortung Sorge Die werdenden Eltern möchten alles richtig machen für das Wohl
Cytomegalie & Co Häufige Virusinfektionen in der Schwangerschaft Schwangerschaft Eine ganz besondere Zeit der Vorfreude Verantwortung Sorge Die werdenden Eltern möchten alles richtig machen für das Wohl
Wirkstoffe: Trockenextrakt aus Birkenblättern, Trockenextrakt aus Goldrutenkraut
 Gebrauchsinformation: Information für Anwender HEUMANN Blasen- und Nierentee SOLUBITRAT uro Teeaufgusspulver Wirkstoffe: Trockenextrakt aus Birkenblättern, Trockenextrakt aus Goldrutenkraut Lesen Sie die
Gebrauchsinformation: Information für Anwender HEUMANN Blasen- und Nierentee SOLUBITRAT uro Teeaufgusspulver Wirkstoffe: Trockenextrakt aus Birkenblättern, Trockenextrakt aus Goldrutenkraut Lesen Sie die
IhreInsulinfunktionen
 Insulinfunktionen: Insulinfunktionen: Wichtige Wichtige Informationen BlutzuckerBlutzucker-und undketon-messsystem Keton-Messsystem Ihre IhreInsulinfunktionen Insulinfunktionen Die DieInsulineinstellungen
Insulinfunktionen: Insulinfunktionen: Wichtige Wichtige Informationen BlutzuckerBlutzucker-und undketon-messsystem Keton-Messsystem Ihre IhreInsulinfunktionen Insulinfunktionen Die DieInsulineinstellungen
Trockenes Auge. Haben Sie Trockene Augen?
 Trockenes Auge Jeder 3 bis 5 Patient, der den Augenarzt besucht, an der Krankheit Trockenes Auge leidet. Ein Trockenes Auge entsteht, wenn der Körper zu wenig Tränenflüssigkeit produziert oder die Zusammensetzung
Trockenes Auge Jeder 3 bis 5 Patient, der den Augenarzt besucht, an der Krankheit Trockenes Auge leidet. Ein Trockenes Auge entsteht, wenn der Körper zu wenig Tränenflüssigkeit produziert oder die Zusammensetzung
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Liprolog 100 Einheiten/ml, Injektionslösung in Durchstechflasche Liprolog 100 Einheiten/ml, Injektionslösung in
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Liprolog 100 Einheiten/ml, Injektionslösung in Durchstechflasche Liprolog 100 Einheiten/ml, Injektionslösung in
Vertrag zwischen. der AOK Berlin - Die Gesundheitskasse - und der Kassenärztlichen Vereinigung Berlin (KV)
 Vertrag zwischen der AOK Berlin - Die Gesundheitskasse - und der Kassenärztlichen Vereinigung Berlin (KV) über die Abgrenzung, Vergütung und Abrechnung der stationären vertragsärztlichen Tätigkeit 1) Dem
Vertrag zwischen der AOK Berlin - Die Gesundheitskasse - und der Kassenärztlichen Vereinigung Berlin (KV) über die Abgrenzung, Vergütung und Abrechnung der stationären vertragsärztlichen Tätigkeit 1) Dem
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Magnevist 2 mmol/l Injektionslösung. Gadopentetsäure, Dimeglumin
 1 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Magnevist 2 mmol/l Injektionslösung Gadopentetsäure, Dimeglumin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor dieses Arzneimittel bei
1 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Magnevist 2 mmol/l Injektionslösung Gadopentetsäure, Dimeglumin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor dieses Arzneimittel bei
Patientenleitfaden für das Gespräch mit dem Arzt. Liebe Patientin, lieber Patient!
 Patientenleitfaden für das Gespräch mit dem Arzt Liebe Patientin, lieber Patient! Je besser Sie sich auf das Gespräch mit Ihrem Arzt vorbereiten, desto leichter wird es für sie/ihn sein, eine Diagnose
Patientenleitfaden für das Gespräch mit dem Arzt Liebe Patientin, lieber Patient! Je besser Sie sich auf das Gespräch mit Ihrem Arzt vorbereiten, desto leichter wird es für sie/ihn sein, eine Diagnose
Indikationserweiterungen für JANUVIA (Sitagliptin, MSD) in der EU - Kombination mit Sulfonylharnstoff n
 Indikationserweiterungen für JANUVIA (Sitagliptin, MSD) in der EU Kombination mit Sulfonylharnstoff nun ebenfalls zugelassen Haar (März 2008) - Die europäische Arzneimittelbehörde EMEA hat JANUVIA für
Indikationserweiterungen für JANUVIA (Sitagliptin, MSD) in der EU Kombination mit Sulfonylharnstoff nun ebenfalls zugelassen Haar (März 2008) - Die europäische Arzneimittelbehörde EMEA hat JANUVIA für
Diabetes mellitus : Folgeschäden
 Diabetes mellitus : Folgeschäden Warum ist der Diabetes mellitus eine wichtige Erkrankung? a. Akute Probleme: Hypoglykämie Hyperglykämie Ketoazidose b. Chronische Probleme: Folgeschäden: Typische Schäden:
Diabetes mellitus : Folgeschäden Warum ist der Diabetes mellitus eine wichtige Erkrankung? a. Akute Probleme: Hypoglykämie Hyperglykämie Ketoazidose b. Chronische Probleme: Folgeschäden: Typische Schäden:
1. Was sind Dorithricin Halstabletten und wofür werden sie angewendet?
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Dorithricin - Halstabletten Wirkstoffe: Tyrothricin, Benzalkoniumchlorid, Benzocain Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Dorithricin - Halstabletten Wirkstoffe: Tyrothricin, Benzalkoniumchlorid, Benzocain Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
1 Mathematische Grundlagen
 Mathematische Grundlagen - 1-1 Mathematische Grundlagen Der Begriff der Menge ist einer der grundlegenden Begriffe in der Mathematik. Mengen dienen dazu, Dinge oder Objekte zu einer Einheit zusammenzufassen.
Mathematische Grundlagen - 1-1 Mathematische Grundlagen Der Begriff der Menge ist einer der grundlegenden Begriffe in der Mathematik. Mengen dienen dazu, Dinge oder Objekte zu einer Einheit zusammenzufassen.
GEVITAS Farben-Reaktionstest
 GEVITAS Farben-Reaktionstest GEVITAS Farben-Reaktionstest Inhalt 1. Allgemeines... 1 2. Funktionsweise der Tests... 2 3. Die Ruhetaste und die Auslösetaste... 2 4. Starten der App Hauptmenü... 3 5. Auswahl
GEVITAS Farben-Reaktionstest GEVITAS Farben-Reaktionstest Inhalt 1. Allgemeines... 1 2. Funktionsweise der Tests... 2 3. Die Ruhetaste und die Auslösetaste... 2 4. Starten der App Hauptmenü... 3 5. Auswahl
Fischer ANalysen Instrumente GmbH
 Fischer ANalysen Instrumente GmbH Zertifiziertes Managementsystem EN ISO 9001 EN ISO 13485 Gebrauchsanweisung Gasmustersystem (Bestell-Nr. HZ-GAMU) Ausgabe 2015 05 08 Packungsinhalt Gasschlauch (3) Flußrichtung
Fischer ANalysen Instrumente GmbH Zertifiziertes Managementsystem EN ISO 9001 EN ISO 13485 Gebrauchsanweisung Gasmustersystem (Bestell-Nr. HZ-GAMU) Ausgabe 2015 05 08 Packungsinhalt Gasschlauch (3) Flußrichtung
Sicherheitshinweise nach GHS
 Sicherheitshinweise nach GHS Bei den Sicherheitshinweisen nach GHS (den P-Sätzen) sind im Gegensatz zu den H-Sätzen Kombinationen in dem Maß gestattet, wie sie in der Anhang IV der EG- GHS-Verordnung angegeben
Sicherheitshinweise nach GHS Bei den Sicherheitshinweisen nach GHS (den P-Sätzen) sind im Gegensatz zu den H-Sätzen Kombinationen in dem Maß gestattet, wie sie in der Anhang IV der EG- GHS-Verordnung angegeben
LANSOYL Paraffine Gel zum Einnehmenv3.0_B2.0 1/5
 PIL September 2015 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER LANSOYL PARAFFINE 78,230 g/100 g Gel zum Einnehmen Paraffinöl Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
PIL September 2015 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER LANSOYL PARAFFINE 78,230 g/100 g Gel zum Einnehmen Paraffinöl Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
IMPLANON NXT Erläuternde Broschüre für Patientinnen
 Die Markteinführung von IMPLANON NXT wurde von den belgischen Gesundheitsbehörden an bestimmte Bedingungen geknüpft. Der vorgeschriebene Plan zur Risikominimierung in Belgien, der auch das vorliegende
Die Markteinführung von IMPLANON NXT wurde von den belgischen Gesundheitsbehörden an bestimmte Bedingungen geknüpft. Der vorgeschriebene Plan zur Risikominimierung in Belgien, der auch das vorliegende
Sanft und sicher spritzen. Tipps und Tricks zur Insulininjektion.
 Sanft und sicher spritzen. Tipps und Tricks zur Insulininjektion. Mehr Freiheit. Mehr Lebensfreude. Mit mylife. Sanft und sicher spritzen Korrekte Injektionstechnik Das Insulin wird in das Unterhautfettgewebe
Sanft und sicher spritzen. Tipps und Tricks zur Insulininjektion. Mehr Freiheit. Mehr Lebensfreude. Mit mylife. Sanft und sicher spritzen Korrekte Injektionstechnik Das Insulin wird in das Unterhautfettgewebe
Patienteninformation. AcrySof IQ Toric. GraueN star UND Hornhautverkrümmung
 Patienteninformation AcrySof IQ Toric GraueN star UND Hornhautverkrümmung in einem Schritt behandeln Während der Operation des Grauen Stars (Katarakt) wird die von der Katarakt betroffene körpereigene
Patienteninformation AcrySof IQ Toric GraueN star UND Hornhautverkrümmung in einem Schritt behandeln Während der Operation des Grauen Stars (Katarakt) wird die von der Katarakt betroffene körpereigene
Ausfüllanleitung. zum indikationsspezifischen Datensatz. für das strukturierte Behandlungsprogramm. Asthma bronchiale
 Ausfüllanleitung zum indikationsspezifischen Datensatz für das strukturierte Behandlungsprogramm Asthma bronchiale Stand der letzten Bearbeitung: 20.11.2012 Version 4.2 Anamnese- und Befunddaten Häufigkeit
Ausfüllanleitung zum indikationsspezifischen Datensatz für das strukturierte Behandlungsprogramm Asthma bronchiale Stand der letzten Bearbeitung: 20.11.2012 Version 4.2 Anamnese- und Befunddaten Häufigkeit
Anleitung über den Umgang mit Schildern
 Anleitung über den Umgang mit Schildern -Vorwort -Wo bekommt man Schilder? -Wo und wie speichert man die Schilder? -Wie füge ich die Schilder in meinen Track ein? -Welche Bauteile kann man noch für Schilder
Anleitung über den Umgang mit Schildern -Vorwort -Wo bekommt man Schilder? -Wo und wie speichert man die Schilder? -Wie füge ich die Schilder in meinen Track ein? -Welche Bauteile kann man noch für Schilder
Omnican Pen 31 Omnican Pen 32
 Omnican Pen 31 Omnican Pen 32 Gebrauchsanweisung Vor der Benutzung des Omnican Pen lesen Sie bitte diese Gebrauchsanweisung sorgfältig durch. Der Aufbau des Omnican Pen Gewinde für Penkanüle Restmengenskala
Omnican Pen 31 Omnican Pen 32 Gebrauchsanweisung Vor der Benutzung des Omnican Pen lesen Sie bitte diese Gebrauchsanweisung sorgfältig durch. Der Aufbau des Omnican Pen Gewinde für Penkanüle Restmengenskala
A Lösungen zu Einführungsaufgaben zu QueueTraffic
 A Lösungen zu Einführungsaufgaben zu QueueTraffic 1. Selber Phasen einstellen a) Wo im Alltag: Baustelle, vor einem Zebrastreifen, Unfall... 2. Ankunftsrate und Verteilungen a) poissonverteilt: b) konstant:
A Lösungen zu Einführungsaufgaben zu QueueTraffic 1. Selber Phasen einstellen a) Wo im Alltag: Baustelle, vor einem Zebrastreifen, Unfall... 2. Ankunftsrate und Verteilungen a) poissonverteilt: b) konstant:
Knochendichtemessung
 Knochendichtemessung im Krankenhaus Meran Dienst für Radiologie Primar Dr. Anton Wieser Tel. 0473 26 3070, E-Mail: rx-me@asbmeran-o.it Knochendichtemessung DEXA: Ab 21. Oktober 2013 auch in Meran durchführbar
Knochendichtemessung im Krankenhaus Meran Dienst für Radiologie Primar Dr. Anton Wieser Tel. 0473 26 3070, E-Mail: rx-me@asbmeran-o.it Knochendichtemessung DEXA: Ab 21. Oktober 2013 auch in Meran durchführbar
Verordnung über Medizinprodukte (Medizinprodukte-Verordnung - MPV)
 Verordnung über Medizinprodukte (Medizinprodukte-Verordnung - MPV) Vom 20. Dezember 2001, BGBl. I S. 3854 geändert am 4. Dezember 2002, BGBl I S. 4456 zuletzt geändert am 13. Februar 2004, BGBl I S. 216
Verordnung über Medizinprodukte (Medizinprodukte-Verordnung - MPV) Vom 20. Dezember 2001, BGBl. I S. 3854 geändert am 4. Dezember 2002, BGBl I S. 4456 zuletzt geändert am 13. Februar 2004, BGBl I S. 216
DAS PRODUKT. Zu dem Alarmsystem Safety Turtle gehören:
 DAS PRODUKT Zu Ihrer Beruhigung und zum Schutz Ihrer Kinder Safety Turtle trägt zum Schutz Ihrer Kinder bei. Safety Turtle ist das Sicherheitssystem, das Ihre Kinder vor dem Ertrinken bewahrt: sein Alarm
DAS PRODUKT Zu Ihrer Beruhigung und zum Schutz Ihrer Kinder Safety Turtle trägt zum Schutz Ihrer Kinder bei. Safety Turtle ist das Sicherheitssystem, das Ihre Kinder vor dem Ertrinken bewahrt: sein Alarm
Informationen zum sicheren Umgang mit Insulinpen-Nadeln bei der Insulininjektion
 Informationen zum sicheren Umgang mit Insulinpen-Nadeln bei der Insulininjektion Inhaltsverzeichnis 1. Auswahl der richtigen Injektionsstelle 2. Durchführung einer sicheren Injektionstechnik 3. Sichere
Informationen zum sicheren Umgang mit Insulinpen-Nadeln bei der Insulininjektion Inhaltsverzeichnis 1. Auswahl der richtigen Injektionsstelle 2. Durchführung einer sicheren Injektionstechnik 3. Sichere
Die östrogenfreie Pille
 Alle wichtigen Infos über Sexualität und Verhütung unter: www.frau-und-pille.de Mit bester Empfehlung Die östrogenfreie Pille Verhütung für Frauen mit besonderem Anspruch. Einscannen und mehr erfahren...
Alle wichtigen Infos über Sexualität und Verhütung unter: www.frau-und-pille.de Mit bester Empfehlung Die östrogenfreie Pille Verhütung für Frauen mit besonderem Anspruch. Einscannen und mehr erfahren...
Sidroga Blasentee akut Wirkstoffe: Bärentraubenblätter, Birkenblätter, Goldrutenkraut, Orthosiphonblätter
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Sidroga Blasentee akut Wirkstoffe: Bärentraubenblätter, Birkenblätter, Goldrutenkraut, Orthosiphonblätter Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Sidroga Blasentee akut Wirkstoffe: Bärentraubenblätter, Birkenblätter, Goldrutenkraut, Orthosiphonblätter Lesen Sie die gesamte Packungsbeilage sorgfältig
Insulin lispro Sanofi
 Fachinformation Insulin lispro Sanofi April 2018 336474 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit.
Fachinformation Insulin lispro Sanofi April 2018 336474 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit.
Erstellen von x-y-diagrammen in OpenOffice.calc
 Erstellen von x-y-diagrammen in OpenOffice.calc In dieser kleinen Anleitung geht es nur darum, aus einer bestehenden Tabelle ein x-y-diagramm zu erzeugen. D.h. es müssen in der Tabelle mindestens zwei
Erstellen von x-y-diagrammen in OpenOffice.calc In dieser kleinen Anleitung geht es nur darum, aus einer bestehenden Tabelle ein x-y-diagramm zu erzeugen. D.h. es müssen in der Tabelle mindestens zwei
Säuglingsanfangsnahrung und Folgenahrung Was ändert sich? Was bleibt?
 Säuglingsanfangsnahrung und Folgenahrung Was ändert sich? Was bleibt? Begleitinformationen: Handout für das Verkaufspersonal im Handel Bei Rückfragen sprechen Sie uns bitte gerne an: DIÄTVERBAND e. V.
Säuglingsanfangsnahrung und Folgenahrung Was ändert sich? Was bleibt? Begleitinformationen: Handout für das Verkaufspersonal im Handel Bei Rückfragen sprechen Sie uns bitte gerne an: DIÄTVERBAND e. V.
Reinigung... 2. Normale Reingung der CheckStab Leitfähigkeitselektrode... 2. Gründliche Reinigung der Leitfähigkeitselektrode... 2
 Diese Anleitung fasst einige Punkte zusammen, die für eine gute Funktion der CheckStab Geräte wichtig sind. Sie ist nicht als Ersatz für das Handbuch, sondern als Ergänzung zum Handbuch gedacht. Bitte
Diese Anleitung fasst einige Punkte zusammen, die für eine gute Funktion der CheckStab Geräte wichtig sind. Sie ist nicht als Ersatz für das Handbuch, sondern als Ergänzung zum Handbuch gedacht. Bitte
Elexis-BlueEvidence-Connector
 Elexis-BlueEvidence-Connector Gerry Weirich 26. Oktober 2012 1 Einführung Dieses Plugin dient dazu, den Status Hausarztpatient zwischen der BlueEvidence- Anwendung und Elexis abzugleichen. Das Plugin markiert
Elexis-BlueEvidence-Connector Gerry Weirich 26. Oktober 2012 1 Einführung Dieses Plugin dient dazu, den Status Hausarztpatient zwischen der BlueEvidence- Anwendung und Elexis abzugleichen. Das Plugin markiert
Inhalt. 1. Einleitung Seite 3. 2. Schritt für Schritt Seite 4. 3. Tipps und Tricks Seite 6
 Gebrauchsanleitung Inhalt 1. Einleitung Seite 3 2. Schritt für Schritt Seite 4 3. Tipps und Tricks Seite 6 2 Einleitung Vielen Dank, dass Sie einer GrooVi-Maschine den Vorzug gegeben haben! Diese Gebrauchsanleitung
Gebrauchsanleitung Inhalt 1. Einleitung Seite 3 2. Schritt für Schritt Seite 4 3. Tipps und Tricks Seite 6 2 Einleitung Vielen Dank, dass Sie einer GrooVi-Maschine den Vorzug gegeben haben! Diese Gebrauchsanleitung
