Lactose. Ein Kohlenhydrat. Jahresarbeit Q2 an der Freiherr-vom-Stein-Schule in Hessisch Lichtenau. Fach: Chemie bei Herr Orth
|
|
|
- Maja Färber
- vor 8 Jahren
- Abrufe
Transkript
1 Lactose Ein Kohlenhydrat Jahresarbeit in Chemie von Leon Grabka 1 Lactose Ein Kohlenhydrat Jahresarbeit Q2 an der Freiherr-vom-Stein-Schule in Hessisch Lichtenau Fach: Chemie bei Herr Orth Leon Grabka, Großalmerode,
2 Lactose Ein Kohlenhydrat Jahresarbeit in Chemie von Leon Grabka 2 Inhaltsverzeichnis 1 Einleitung 1.1 Fachwortverzeichnis Vorwort Kurze Einführung in die Kohlenhydrate 5 2 Monosaccharide 2.1 Zusammensetzung Stereoisomerie Nomenklatur Reduzierende und nicht reduzierende Zucker 8 3 Disaccharide 3.1 Zusammensetzung Glycosidische Bindung Nomenklatur Spaltung von Disacchariden Acetale und Halbacetale 10 4 Polysaccharide 4.1 Allgemeine Informationen 11 5 Lactose 5.1 Struktur der Lactose Nachweisversuch Glucose Nachweisversuch Galactose Eigenschaften von Lactose Nachweisversuch von Lactose in Milch 16 6 Laktoseintoleranz 6.1 Allgemeines Ursachen Diagnose Therapie 18 7 Schluss 8 Anhang 7.1 Nachwort Quellenverzeichnis Versicherung über die selbstständige Anfertigung der Arbeit Dokumentationsblatt zum Arbeitsprozess 23
3 Lactose Ein Kohlenhydrat Jahresarbeit in Chemie von Leon Grabka 3 1 Einleitung 1.1 Fachwortverzeichnis Anomer denaturieren Enzym hygroskopisch Saccharid eine Art Isomer Struktur verändern Biokatalysator, beschleunigt Reaktionen ohne selbst verbraucht zu werden die Luftfeuchtigkeit bzw. Wasser anziehen Zucker Die Erklärungen zu den Begriffen in dieser Farbe finden Sie hier im Fachwortverzeichnis.
4 Lactose Ein Kohlenhydrat Jahresarbeit in Chemie von Leon Grabka Vorwort Lactose oder auch Milchzucker, begegnet man im Alltag häufiger als man denkt. Es kommt nicht nur in Milchprodukten vor, sondern auch z. B. in Wurst oder Backpulver. Doch es ist ja nur ein gewöhnlicher Zucker wie vielleicht manche Menschen denken. Aber diejenigen die unter Laktoseintoleranz leiden, wissen, was dieser vermeintliche Zucker anrichten kann. Laktoseintoleranz ist heutzutage ein großes Thema, wenn es um Nahrungsmittelunverträglichkeiten geht. Viele Menschen leiden an Bauchschmerzen, Durchfall und anderen Symptomen nach dem Verzehr lactosehaltiger Nahrung. Der Laktoseintoleranz begegnet man wahrscheinlich genau so häufig wie der Lactose selbst, denn in sehr vielen Illustrierten stehen Artikel über Laktoseintoleranz. Und ständig hatte ich die Fragen im Kopf: Was ist Lactose überhaupt? Im Prinzip ist es doch nur ein Zucker, wieso leiden Menschen an so einer Intoleranz? Um endlich diese Fragen genau beantworten zu können, nutze ich die Gelegenheit der Jahresarbeit, da mir eine Erklärung wie Das ist der Zucker in der Milch, den manche einfach nicht vertragen nicht ausreicht. Doch hauptsächlich wird sich die folgende Facharbeit damit auseinandersetzen, was Lactose chemisch gesehen ist und zu welcher Gruppe dieser vermeintliche Zucker gehört. Um dem Thema nicht nur theoretisch zu begegnen, werde ich auch zwei Nachweisversuche durchführen, um das Thema besser und verständlicher erklären zu können. Die folgende Facharbeit wird bei weitem nicht alles über Kohlenhydrate erläutern, jedoch das Notwendige um das Thema Lactose verstehen zu können. Da diese Jahresarbeit im Fach Chemie geschrieben wird, wird sich diese Arbeit nicht direkt mit der Laktoseintoleranz beschäftigen, sondern hauptsächlich mit den Grundlagen für Kohlenhydrate und dem chemischen Aufbau von Lactose.
5 Lactose Ein Kohlenhydrat Jahresarbeit in Chemie von Leon Grabka Kurze Einführung in die Kohlenhydrate Kohlenhydrate unterteilen sich in drei Untergruppen. Den Monosacchariden, Disacchariden und Polysacchariden. Zu den Monosacchariden gehören z. B. Glucose (Traubenzucker) oder Fructose (Fruchtzucker). Zu den Disacchariden gehören Maltose (Maiszucker) und Saccharose (Haushaltszucker) und zu den Polysacchariden gehört z. B. Stärke. Die einfachste Form der Kohlenhydrate sind die Monosaccharide (Einfachzucker), dann folgen die Disaccharide (Zweifachzucker) und die komplexeren Kohlenhydrate sind die Polysaccharide (Vielfachzucker). 1 Kohlenhydrate lassen sich in folgender allgemeinen Summenformel darstellen: C n (H 2 O) n. Aufgrund dieser Schreibweise geht man von einem hydratisierten Kohlenstoff aus, wodurch der Name Kohlenhydrat entsteht. 2 2 Monosaccharide 2.1 Zusammensetzung Das Molekül eines Monosaccharides besteht aus einer Monomereinheit und stellt somit die einfachste Verbindungsklasse der Kohlenhydrate dar. Ein Monosaccharid ist eine Verbindung aus einem Keton oder einem Aldehyd und mindestens zwei Hydroxylgruppen. Die Verbindung aus einem Keton und mindestens zwei Hydroxylgruppen bezeichnet man als Ketosen und Verbindungen aus Aldehyden und Hydroxylgruppen als Aldosen. Besteht ein Kohlenhydrat aus drei Kohlenstoffatomen, nennt man diesen Zucker Triose, besteht dieser aus vier Kohlenstoffatomen wird er Tetrose genannt usw. 3 Aldosen werden dabei ausgehend von der Aldehydgruppe nummeriert und bei Ketosen erhält die Ketogruppe die Nummer zwei. 4 So ist z. B. Glucose (C 6 (H 2 O) 6 ein Pentahydroxyhexanal und somit eine Aldohexose, da Glucose aus insgesamt sechs Kohlenstoffatomen und vier Hydroxylgruppen besteht. Davon bildet ein Kohlenstoffatom in Verbindung mit einem Wasserstoff- und Sauerstoffatom die Aldehydgruppe. 5 1 Vollhardt, K. Peter C.; Schore, Neil E., Organische Chemie Dritte Auflage, New York, 2000, S Boldt, Roman, Monosaccharide, , 3 Vollhardt, K. Peter C.; Schore, Neil E., Organische Chemie Dritte Auflage, New York, 2000, S Boldt, Roman, Monosaccharide, , 5 Vollhardt, K. Peter C.; Schore, Neil E., Organische Chemie Dritte Auflage, New York, 2000, S.1182
6 Lactose Ein Kohlenhydrat Jahresarbeit in Chemie von Leon Grabka Stereoisomerie Außer dem Dihydroaceton sind alle Monosaccharide, Aldosen wie Ketosen, chiral. 1 Die Chiralität ist die Bedingung für ein Enantiomer. 2 Ein Enantiomer lässt sich aufgrund der Chiralität nicht in sein Spiegelbild überführen. 3 Beispiel: Die rechte Hand lässt sich nicht mit der linken Hand in Deckung bringen, woher auch der Name chiral (von griech. cheir, Hand) stammt. Der Grund für chirale Verbindungen sind asymmetrische C-Atome, die mit vier verschiedenen Substituenten verbunden sind. 4 Diese Isomere unterscheiden sich durch ihre räumliche Orientierung bzw. Drehung des Moleküls und stellen somit eine Untergruppe der Stereoisomere dar. Eine weitere Untergruppe der Stereoisomere sind die Diastereomere. Die Diastereomere unterscheiden sich nicht nur in der Drehung und Ausrichtung des Moleküls wie ein Enantiomer, sondern auch in weiteren Eigenschaften. 5 1 Boldt, Roman, Monosaccharide, , 2 Eisner, Werner; Gietz Paul; Glaser, Marianne; Justus, Axel; Laitenberger, Klaus; Liebenow, Klaus- Jürgen; Schierle, Werner; Stein-Bastuck, Rainer; Sternberg, Michael, Elemente Chemie II Gesamtband, Stuttgart, 2000, S Vollhardt, K. Peter C.; Schore, Neil E., Organische Chemie Dritte Auflage, New York, 2000, S.162 f. 4 Eisner, Werner; Gietz Paul; Glaser, Marianne; Justus, Axel; Laitenberger, Klaus; Liebenow, Klaus- Jürgen; Schierle, Werner; Stein-Bastuck, Rainer; Sternberg, Michael, Elemente Chemie II Gesamtband, Stuttgart, 2000, S Eisner, Werner; Gietz Paul; Glaser, Marianne; Justus, Axel; Laitenberger, Klaus; Liebenow, Klaus- Jürgen; Schierle, Werner; Stein-Bastuck, Rainer; Sternberg, Michael, Elemente Chemie II Gesamtband, Stuttgart, 2000, S.349
7 Lactose Ein Kohlenhydrat Jahresarbeit in Chemie von Leon Grabka Nomenklatur Um die Stereoisomere zu benennen, wird die D,L-Nomenklatur verwendet, bei der die C-Atome senkrecht angeordnet werden und das höchstoxidierte Ende nach oben zeigt. Die anderen Atome bzw. Substituenten stehen waagerecht zum C-Atom. Diese Darstellung wird Fischer-Projektion gennant. 1 Die Ausrichtung der Hydroxylgruppe an dem asymmetrischen C-Atom, das am weitesten von der Carbonylgruppe entfernt ist, bestimmt die Bezeichnung des Enantiomers. Zeigt die Hydroxylgruppe nach rechts, gehört das Monosaccharid zur D-Reihe, zeigt diese nach links zur L-Reihe. Monosaccharide der D-Reihe kommen natürlich am häufigsten vor. 2 Beispiel: In der nebenstehenden Abbildung sind D-Glucose, D- Mannose und D-Galactose dargestellt. Diese drei Monosaccharide sind Aldohexosen und unterscheiden sich von der D-Glucose nur an der Anordnung an einem C-Atom. Die D-Mannose unterscheidet Abbildung 1: Stereoisomere von D-Glucose 5 sich durch die Anordnung der Hydroxylgruppe am zweiten C-Atom und D-Galactose am vierten C-Atom. So stellen D-Mannose und D-Galactose Diastereomere, aber keine Enantiomere von D-Glucose dar, weil es sich nicht um das Spiegelbild handelt. 3 Die im Beispiel gezeigte Schreibweise entspricht aber nicht immer der Realität, da z. B. Abbildung 2: Nomenklatur und Haworth-Projektion 4 gelöste D-Glucose ein sechsgliedriges Halbacetal (Ringform) bildet, in dem die Substituenten äquatorial zu 1 Chriralitätszentrum, , 5_chiralitaetszentrum.pdf 2 Eisner, Werner; Gietz Paul; Glaser, Marianne; Justus, Axel; Laitenberger, Klaus; Liebenow, Klaus- Jürgen; Schierle, Werner; Stein-Bastuck, Rainer; Sternberg, Michael, Elemente Chemie II Gesamtband, Stuttgart, 2000, S Boldt, Roman, Monosaccharide, ,
8 Lactose Ein Kohlenhydrat Jahresarbeit in Chemie von Leon Grabka 8 den C-Atomen stehen. Bei der Bildung eines Halbacetals addiert sich die Hydroxylgruppe des beispielsweisen C 5 an die Carbonylgruppe des Aldehyds. 1 Das entstandene Halbacetal wird Pyranose genannt, da es sich um einen sechsgliedrigen Ether handelt. Fünfgliedrige Halbacetale nennt man Furanose, die nach dem sauerstoffhaltigen Fünfring, Furan, benannt wurden. Um eine weitere Differenzierung vornehmen zu können, verwendet man die sogenannte R, S- Nomenklatur. Da bei der Halbacetalbildung aus dem C 1 ein asymmetrisches C- Atom entsteht, welches dann ein neues Stereozentrum bzw. Chiralitätszentrum bildet. 2 Nun bestimmt man die Konfiguration des Acetalkohlenstoffs. Befindet sich die Hydroxylgruppe auf der rechten Seite, ist es R-konfiguriert. Bei einem Zucker mit R- Konfiguration spricht man von der α-form. Befindet sich die Hydroxylgruppe auf der linken Seite, ist es S-konfiguriert und man spricht von einer -Form. Die im Beispiel verwendete cyclische Schreibweise nennt man Haworth-Projektion Reduzierende und nicht reduzierende Zucker Man unterteilt Saccharide nicht nur in Ketosen und Aldosen, sondern auch in reduzierende und nicht reduzierende Zucker. Reduzierende Zucker sind Zucker, bei denen aufgrund der Aldehydgruppe oder Ketogruppe eine positive Fehlingprobe oder Tollensprobe durchgeführt werden kann. 4 1 Boldt, Roman, Monosaccharide, , 2 Vollhardt, K. Peter C.; Schore, Neil E., Organische Chemie Dritte Auflage, New York, 2000, S Vollhardt, K. Peter C.; Schore, Neil E., Organische Chemie Dritte Auflage, New York, 2000, S. 1183, S Vollhardt, K. Peter C.; Schore, Neil E., Organische Chemie Dritte Auflage, New York, 2000, S. 1192
9 Lactose Ein Kohlenhydrat Jahresarbeit in Chemie von Leon Grabka 9 3 Disaccharide 3.1 Zusammensetzung Ein Disaccharid besteht aus zwei Monosacchariden. Dabei müssen die beiden Monosaccharide nicht identisch sein. So besteht z. B. Lactose aus Glucose und Galactose. 1 Das wohl bekannteste Disaccharid ist Saccharose, unser Haushaltszucker. Er besteht aus Fructose und Glucose und wird aus Zuckerrüben gewonnen. Die Verbindung zweier Monosaccharide wird glycosidische Bindung genannt. 3.2 Glycosidische Bindung Bei der Bildung einer glycosidischen Bindung entsteht ein Disaccharid unter der Abspaltung von Wasser. Beispiel: In den nebenstehenden Abbildungen sind die beiden Edukte D-Glucopyranose. Kommen diese in Kontakt, bildet sich die glycosidische Bindung aus und es entsteht ein Disaccharid namens Maltose. Abbildung 3: 1. Schritt des Mechanismus Bei der Bildung eines Glycosids verbindet sich ein Sauerstoffatom der Hydroxylgruppe des ersten asymmetrischen C-Atoms mit z. B. dem vierten Kohlenstoffatom des zweiten Monosaccharids. Dadurch spaltet sich die Abbildung 4: 2. Schritt des Mechanismus Hydroxylgruppe des zweiten Monosaccharids ab und reagiert mit dem freigewordenen Wasserstoffatom der Hydroxylgruppe zu Wasser. Das Sauerstoffatom verbindet anschließend die beiden Monosaccharide. 2 1 Vollhardt, K. Peter C.; Schore, Neil E., Organische Chemie Dritte Auflage, New York, 2000, S Dücker, Simon Julius; Hoberock, Sven, Glykosidische Bindung, ,
10 Lactose Ein Kohlenhydrat Jahresarbeit in Chemie von Leon Grabka Nomenklatur Disaccharide werden mithilfe zweier Ziffern und den Namen der Edukte benannt. Die beiden Ziffern geben an, welche C-Atome durch das Sauerstoffatom verbunden werden. So wird im vorherigen Beispiel die entstandene Maltose auch 1- -D-Glycopyranosyl-4- -D-Glycopyranose genannt Spaltung von Disacchariden Durch H 3 O + - Ionen lassen sich Disaccharide wieder in ihre Bestandteile spalten. Diesen Vorgang nennt man Hydrolyse. So entstehen wieder die beiden Edukte in ausgeglichenen Stoffmengen. 3.5 Acetale und Halbacetale: Acetale sind nicht reduzierende Zucker und Halbacetale sind reduzierende Zucker. Saccharose ist ein nicht reduzierender Zucker, da bei einer Ringöffnung weder von Glucose noch von Fructose eine Aldehydgruppe gebildet wird und somit beide Monosaccharide Acetale sind. Maltose besteht aus zwei Glucosemolekülen, die beide bei der Ringöffnung eine Aldehydgruppe bilden und somit Halbacetale sind. Deswegen ist Maltose ein reduzierender Zucker. Es gibt jedoch auch reduzierende Disaccharide, die aus einem Acetal und einem Halbacetal bestehen. Auch diese Saccharide sind reduzierende Zucker, weil das Halbacetal eine Aldehydgruppe ausbilden kann. 2 1 Dücker, Simon Julius; Hoberock, Sven, Glykosidische Bindung, , 2 Eisner, Werner; Gietz Paul; Glaser, Marianne; Justus, Axel; Laitenberger, Klaus; Liebenow, Klaus- Jürgen; Schierle, Werner; Stein-Bastuck, Rainer; Sternberg, Michael, Elemente Chemie II Gesamtband, Stuttgart, 2000, S.352 f.
11 Lactose Ein Kohlenhydrat Jahresarbeit in Chemie von Leon Grabka 11 4 Polysaccharide 4.1 Allgemeine Informationen Polysaccharide sind Saccharide, die aus mehreren Monosacchariden bestehen. Die einzelnen Monosaccharide werden, wie auch bei den Disacchariden, durch glycosidische Bindungen verknüpft. Die natürlich am häufigsten vorkommenden Polysaccharide sind Cellulose, Stärke und Glykogen und alle drei Polysaccharide bestehen aus Glucose. Cellulose besteht aus etwa 3000 Monosacchariden, die 1,4- verknüpft ist und aufgrund der Molekülanordnung linear und sehr steif ist, weswegen sie in Pflanzen oft als Gerüstbau für deren Zellen verwendet wird. Durch eine Substitution einiger Hydroxylgruppen durch Nitratgruppen entsteht Celluloid, einer der ersten Kunststoffe, aus dem z. B. früher die Filme für Kameras hergestellt wurden. 1 Stärke besteht aus Amylosemolekülen und Amylopektinmolekülen. Ein Amylosemolekül besteht aus einigen hundert 1,4- -D-Glucoseeinheiten. Amylopektinmoleküle haben zusätzlich Seitenketten von etwa 20 -D- Glucosemolekülen, die über 1,6- -glycosidische Bindungen verknüpft sind. Stärke wird in viele Pflanzen als Energiereserve synthetisiert und oft in Knollen oder Samen eingelagert. 2 Das Glycogen ist dem Amylopektinmolekül recht ähnlich. Jedoch hat das Glycogen wesentlich mehr Abzweigungen und eine höhere Masse. Glycogen ist ein sehr wichtiger Energiespeicher für Menschen und Tiere, der in der Leber und ruhenden Muskeln stark angereichert ist. Glycogen ist im Körper oft verfügbar und dient als Glucosedepot. 3 1 Vollhardt, K. Peter C.; Schore, Neil E., Organische Chemie Dritte Auflage, New York, 2000, S.1212 f. 2 Eisner, Werner; Gietz Paul; Glaser, Marianne; Justus, Axel; Laitenberger, Klaus; Liebenow, Klaus- Jürgen; Schierle, Werner; Stein-Bastuck, Rainer; Sternberg, Michael, Elemente Chemie II Gesamtband, Stuttgart, 2000, S Vollhardt, K. Peter C.; Schore, Neil E., Organische Chemie Dritte Auflage, New York, 2000, S.1214 f.
12 Lactose Ein Kohlenhydrat Jahresarbeit in Chemie von Leon Grabka 12 5 Lactose 5.1 Struktur der Lactose Laktose (Milchzucker) ist ein Disaccharid aus einem Molekül Glukose und einem Molekül Galaktose 1 Um diese Aussage überprüfen zu können, führt man einen Nachweisversuch für Glucose und Galactose durch. 5.2 Nachweisversuch Glucose Material: 5 ml Lactoselösung, 5ml Salzsäure, 5ml Natronlauge, 1 Glucoseteststreifen, Wasserbad, 1 Reagenzglas Durchführung: Zuerst werden die 5ml Salzsäure und 5ml Lactoselösung zusammen in ein Reagenzglas gegeben und 5 Minuten im siedenden Wasserbad erhitzt. Anschließend werden 5ml Natronlauge in die Lösung gegeben. Nach dem Abkühlen der Lösung hält man einen Glucoseteststreifen in die Lösung. Beobachtung: Nach einiger Zeit hat sich der Glucoseteststreifen grün verfärbt und Glucose angezeigt. Auswertung: Die Salzsäure hat die Lactose gespalten und die Enzyme auf dem Glucoseteststreifen haben den Indikator verfärbt. Die Natronlauge war lediglich zur Neutralisierung der Lösung, damit die Enzyme nicht denaturieren. Somit ist bestätigt, dass Lactose aus Glucose besteht. Abbildung 5: Hydrolysierte Lactoselösung (Links), Glucoseteststreifen nach dem Versuch (Rechts) ,
13 Lactose Ein Kohlenhydrat Jahresarbeit in Chemie von Leon Grabka 13 C 12 (H 2 O) 11 HCl C 6 (H 2 O) 6 + C 6 (H 2 O) 6 Lactose Salzsäure Galactose + Glucose Abbildung 6: Hydrolytische Spaltung von Lactose Nachweisversuch Galactose Materialien: 5ml Lactoselösung, 5 Tropfen konzentrierte Natronlauge, 3 Tropfen konzentrierte Ammoniaklösung, Wasserbad, Reagenzglas, Pipette Durchführung: Die 5ml Lactoselösung zusammen mit 5 Tropfen konzentrierter Natronlauge und 3 Tropfen konzentrierter Ammoniaklösung in ein Reagenzglas geben und im Wasserbad bei 60 Celsius 15 Minuten erhitzen. Beobachtung: Nach 15 Minuten trat eine Rotfärbung der Lösung auf. Abbildung 7: Lactoselösung vor der Reaktion (Links), Lactoselösung nach der Reaktion (Rechts) Auswertung: Dissacharide lassen sich nicht nur durch Säuren spalten, sondern auch durch starke Laugen. Die Produkte sind Glucose und Galactose, da die Galactose zu Schleimsäure oxidiert ist und reagiert mit der Ammoniaklösung zu einem roten Farbstoff, namens Pyrrolrot. 1 Passerini,Therese, WHEN MILK MAKES YOU SICK, ,
14 Lactose Ein Kohlenhydrat Jahresarbeit in Chemie von Leon Grabka 14 C 12 (H 2 O) 11 NaOH C 6 (H 2 O) 6 + C 6 (H 2 O) 6 Lactose Natronlauge Glucose + Galactose C 6 (H 2 O) 6 + O 2 HOOC[C 4 H 8 O 4 ]COOH Galactose + Sauerstoff Schleimsäure 1 Abbildung 8: Oxidation von Galactose. Die Salpetersäure dient als Katalysator. 2 HOOC[C 4 H 8 O 4 ]COOH+ NH3 C 4 H 5 N + 2CO 2 + 4H 2 O Schleimsäure + Ammoniak Pyrrolrot + Kohlenstoffdioxid + Wasser 3 Die Aussage ist anhand der beiden Nachweisversuche bestätigt. Lactose ist ein Disaccharid, das aus einem Glucose- und einem Galactose-Molekül besteht. 1 Schunk, Axel, Wölksche Probe, , , ttp://dwb4.unl.edu/chem/chem869e/chem869elinks/ 2/nitric.gif 3 Synthese von Pyrrol, ,
15 Lactose Ein Kohlenhydrat Jahresarbeit in Chemie von Leon Grabka Eigenschaften von Lactose Lactose, auch Milchzucker genannt, ist ein leicht süßlich schmeckendes weißes Pulver und ist hygroskopisch. 1 Der biochemisch korrekte Name ist 1- -D-Galactopyranosyl-4- -D-glucopyranose. 2 Die Löslichkeit von Lactose in Wasser ist recht hoch, in Ethanol jedoch eher gering. Über dem Schmelzpunkt von 222,8 Celsius zerfällt Lactose unter einer Braunfärbung. Wegen der, im Gegensatz zur Saccharose, reaktionsfähigen Hydroxylgruppe am ersten C-Atom ist die Fehlingprobe durchführbar, was bedeutet, dass Lactose ein reduzierender Zucker ist. Es gibt -Lactose und -Lactose. Diese beiden Anomere unterscheiden sich in der Wasserlöslichkeit, da -Lactose nicht so gut in Wasser löslich ist wie - Lactose. Die in der Muttermilch enthaltene Lactose liefert durch deren Spaltprodukte, Glucose und Galactose, Abbildung 9: Anomere der Lactose 4 den jungen Säugetieren viel Energie. Gespalten wird die Lactose durch das Körpereigene Enzym Lactase. Außerdem unterstützt die Lactose die Aufnahme von Calcium und die Darmflora. Doch Lactose wird nicht nur zur Säuglingsernährung verwendet, sondern auch für die Herstellung von Sauermilch und Joghurt, denn dort wird die Lactose bakteriell zu Milchsäure oxidiert. Lactose findet man außerdem in Backmischungen, Bonbons und als Trägersubstanz in Tabletten. 3 1 Seilnacht, Thomas, Lactose, , 2 Dücker, Simon Julius; Hoberock, Sven, Glykosidische Bindung, , 3 Seilnacht, Thomas, Lactose, , 4
16 Lactose Ein Kohlenhydrat Jahresarbeit in Chemie von Leon Grabka Nachweisversuch von Lactose in Milch Lactose ist ein reduzierender Zucker und kann mithilfe der Fehlingprobe nachgewiesen werden. 1 Im folgenden Versuch wird mit dieser Probe Lactose in Milch nachgewiesen. Material: 2ml Fehling Reagenz I, 2ml Fehling Reagenz II, 5ml Milch, Bunsenbrenner, Reagenzglas Durchführung: Zu den 2ml Fehling Reagenz I gibt man 2ml Fehling Reagenz II, so dass eine blaue klare Lösung entsteht. Das jetzt entstandene Fehling-Reagenz wird mit Milch zusammen im Reagenzglas erhitzt. Beobachtung: Nach einiger Zeit ist eine Rotfärbung der Lösung zu beobachten. Auswertung: Die Lactose reduziert die Kupfer-(II)-Ionen und es entsteht rotes Kupferoxid. Abbildung 10: Fehling Reagenz, Fehling Reagenz mit Milch, reagiertes Fehling Reagenz mit Milch (von links) II 0 Reduktion: Cu e - 2CuO OH Oxidation: HO O H OH H H H H OH H HO I O H OH HO H H O H HO OH HO O H OH H H H H OH O H HO III HO H O H H OH OH OH + 2e - OH HO O H O H HO HO OH H OH H H H H H H O H OH OH OH OH O H H OH H H H OH O H HO O OH H H H OH OH OH + Cu 2+ 2 H + CuO + 2 O + 4H + Abbildung 11: Reaktionsgleichung des Versuchs 2 * Dieser Versuch bestätigt, dass Lactose in der Milch und somit auch in vielen Milchprodukten vorkommt. 1 Seilnacht, Thomas, Lactose, , 2 Seilnacht, Thomas, Kohlenhydrate, , Prof. Dr. J. Gasteiger; Dr. A. Schunk, Fehlingsche Lösung, ,
17 Lactose Ein Kohlenhydrat Jahresarbeit in Chemie von Leon Grabka 17 6 Laktoseintoleranz 6.1 Allgemeines Laktoseintoleranz oder auch Milchzuckerunverträglichkeit ist wie der Name schon sagt eine Unverträglichkeit der in der Milch vorkommenden Lactose. Bei Verzehr von Lactose trotz dieser Intoleranz kommt es meistens zu Blähungen und Durchfall. In Deutschland sind etwa 20% der Bevölkerung von Laktoseintoleranz betroffen. 1 Auf die gesamte Erdbevölkerung bezogen, leiden jedoch ca. 75% an Laktoseintoleranz. Die untenstehende Karte veranschaulicht die Verbreitung von Laktoseintoleranz. 2 Aus dieser Karte lässt sich entnehmen, dass die Laktoseintoleranz in den südlichen Ländern, mit Ausnahme von Australien, stärker vertreten ist als im Norden. Im Norden ist jedoch Abbildung 12: Verbreitung der Laktoseintoleranz 4 Grönland eine Ausnahme. 6.2 Ursachen Der Grund für diese Unverträglichkeit ist, dass das Enzym Laktase, welches für die Spaltung der Lactose im Körper verantwortlich ist, nicht mehr vorhanden ist, beziehungsweise nicht mehr ausreichend zur Verfügung steht. So wird die Lactose im Darm von Bakterien vergoren, wodurch Wasserstoff und andere Gase entstehen, die zu Blähungen, Magenschmerzen und Durchfall führen Als Säuglinge haben fast alle Menschen genügend Laktase im Körper und können ohne Probleme Lactose verdauen. Die Laktase ist auch wichtig, da die Hauptnahrungsquelle eines Säuglings die Muttermilch ist, in der jede Menge Lactose enthalten ist. Dem Säugling dient die Lactose als Energielieferant. 3 Da nach dem Säuglingsalter die Milch früher nicht mehr zur Nahrung gehörte, wurde somit auch die Laktaseproduktion gestoppt. 1 Von Knoblauch, Alexandra, Laktoseintoleranz, , 2 Doppelherz, , 3 Von Knoblauch, Alexandra, Laktoseintoleranz, , 4 Doppelherz, ,
18 Lactose Ein Kohlenhydrat Jahresarbeit in Chemie von Leon Grabka 18 Doch mit dem späteren häufigen Milchverzehr im Erwachsenenalter kam es zu einer Genmutation, wodurch wieder Laktase im Erwachsenenalter produziert wurde. Der häufige Milchverzehr fand aber hauptsächlich in den nördlichen Gebieten statt, weswegen die Länder im Süden eine höhere Laktoseintoleranzrate haben. Ausnahme, wie schon erwähnt, sind Grönland und Australien. 1 Doch trotz dieser Angepasstheit leiden auch Menschen in nördlichen Gebieten an Laktoseintoleranz. 6.3 Diagnose Da bei Laktoseintoleranz die Lactose von Bakterien vergoren wird und dabei Wasserstoff frei wird, wird mit dem Wasserstoffatemtest eine Laktoseintoleranz festgestellt. Der Patient nimmt auf nüchternen Magen eine Lactoselösung zu sich. Der im Darm entstehende Wasserstoff wird teilweise über Blut und Lunge abgesondert. Dieser Sauerstoff wird mit Hilfe des Wasserstoffatemtests nachgewiesen. Je höher die Wasserstoffkonzentration der Atemluft ist, desto stärker ist die Laktoseintoleranz Therapie Die Therapie der Laktoseintoleranz besteht hauptsächlich aus einer Diät beziehungsweise Ernährungsumstellung. Man muss jedoch nicht auf Milchprodukte verzichten, denn es gibt z. B. manche Käsesorten, die von Natur aus lactosefrei sind, da die Lactose von Bakterien zersetzt wird. Außerdem gibt es auch lactosefreie Produkte, wie lactosefreie Milch, Käse und Jogurt. Bei diesen Produkten wird schon bei der Herstellung die Lactose in Galactose und Glucose gespalten, da der Körper die beiden Monosaccharide verdauen kann. 3 Um auch einmal Produkte mit Lactose verzehren zu können, gibt es auch laktasehaltige Tabletten, die kurzzeitig den Laktasehaushalt des Körpers erhöhen, wodurch Lactose wieder problemlos verdaut werden kann. 4 1 Seilnacht, Thomas, Laktose, , 5 Doppelherz, , 2 Von Knoblauch, Alexandra, Laktoseintoleranz, , 3 Von Knoblauch, Alexandra, Laktoseintoleranz, , umschau.de/darm/laktoseintoleranz-milchzucker-unvertraeglichkeit-therapie-selbsthilfe _5.html 4 Grieving, Stefan, Was ist LactoStop, ,
19 Lactose Ein Kohlenhydrat Jahresarbeit in Chemie von Leon Grabka 19 7 Schluss 7.1 Nachwort Es ist bemerkenswert, wie viel es über Kohlenhydrate zu wissen gibt. Diese Jahresarbeit hat sich bei den Kohlenhydraten nur auf die Grundlagen bezogen um das eigentliche Thema Lactose zu verstehen. Dabei wurden z. B. die Mutarotation und optische Aktivität völlig außen vorgelassen. Es gibt noch weitaus mehr Informationen über die Kohlenhydrate. Die anfänglichen Fragen wurden im Laufe der Jahresarbeit zwar beantwortet, aber es kamen auch ständig neue Fragen auf, die sich wiederum im Laufe der Recherche geklärt haben. Am Anfang war es nicht einfach sich in das Thema einzuarbeiten, aber da ich persönlich einige Menschen mit dieser Problematik kenne, war es für mich ein interessantes Themengebiet. Am meisten beeindruckt war ich jedoch von den erfolgreichen Versuchen. Zu Beginn zweifelte ich etwas, ob diese funktionieren, da ich sie mir teilweise aus verschiedenen Versuchen zusammengestellt habe. Es war ein interessantes Thema und nun weiß ich mehr über Lactose und Laktoseintoleranz, womit ich mein Ziel der Jahresarbeit erreicht habe.
20 Lactose Ein Kohlenhydrat Jahresarbeit in Chemie von Leon Grabka 20 8 Anhang 8.1 Quellenverzeichnis Literarische Quellen Elemente Chemie II Gesamtband, Stuttgart, 2000, Eisner, Werner; Gietz Paul; Glaser, Marianne; Justus, Axel; Laitenberger, Klaus; Liebenow, Klaus-Jürgen; Schierle, Werner; Stein-Bastuck, Rainer; Sternberg, Michael, Organische Chemie Dritte Auflage, New York, 2000, Vollhardt, K. Peter C.; Schore, Neil E. Internetquellen: 5_chiralitaetszentrum.pdf ( ) Unvertraeglichkeit-Ursachen _2.html ( ) Unvertraeglichkeit-Diagnose _4.html ( ) Unvertraeglichkeit-Therapie-Selbsthilfe _5.html ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( )
21 Lactose Ein Kohlenhydrat Jahresarbeit in Chemie von Leon Grabka 21 Abbildungen: Abbildung Deckblatt: ( ) Abbildung 1: ( ) Abbildung 2: ( ) Abbildung 3,4: ( ) Abbildung 5, 7,10: Eigene Aufnahmen Abbildung 6: ( ) Abbildung 8: er/wood_chem/ch2/nitric.gif ( ) Abbildung 9: ( ) Abbildung 11: ( ) Aus diesen beiden Quellen und eigenen Kenntnissen mit dem Programm Chemsketch selbst erstellt. Abbildung 12: ( )
Lineargleichungssysteme: Additions-/ Subtraktionsverfahren
 Lineargleichungssysteme: Additions-/ Subtraktionsverfahren W. Kippels 22. Februar 2014 Inhaltsverzeichnis 1 Einleitung 2 2 Lineargleichungssysteme zweiten Grades 2 3 Lineargleichungssysteme höheren als
Lineargleichungssysteme: Additions-/ Subtraktionsverfahren W. Kippels 22. Februar 2014 Inhaltsverzeichnis 1 Einleitung 2 2 Lineargleichungssysteme zweiten Grades 2 3 Lineargleichungssysteme höheren als
Chemie der Kohlenhydrate
 Chemie der Kohlenhydrate Grundlegendes Der Begriff Kohlenhydrate: Wurde ursprünglich aus der Formel für Glukose abgeleitet. C 6 H 12 O 6 = C 6 (H 2 O) 6 Bzw. allgemein: C n (H 2 O) m Diese missleitende
Chemie der Kohlenhydrate Grundlegendes Der Begriff Kohlenhydrate: Wurde ursprünglich aus der Formel für Glukose abgeleitet. C 6 H 12 O 6 = C 6 (H 2 O) 6 Bzw. allgemein: C n (H 2 O) m Diese missleitende
Oxidation und Reduktion Redoxreaktionen Blatt 1/5
 Oxidation und Reduktion Redoxreaktionen Blatt 1/5 1 Elektronenübertragung, Oxidation und Reduktion Gibt Natrium sein einziges Außenelektron an ein Chloratom (7 Außenelektronen) ab, so entsteht durch diese
Oxidation und Reduktion Redoxreaktionen Blatt 1/5 1 Elektronenübertragung, Oxidation und Reduktion Gibt Natrium sein einziges Außenelektron an ein Chloratom (7 Außenelektronen) ab, so entsteht durch diese
Studiengang Biowissenschaften Modulbegleitende Prüfung zum Praktikum in Organischer Chemie (gemäß MPO vom 12.09.2005) 21.07.2015
 Studiengang Biowissenschaften Modulbegleitende Prüfung zum Praktikum in Organischer Chemie (gemäß MPO vom 12.09.2005) 21.07.2015 Name: Vorname: Matrikel-Nr.: geborenam: in: Wiederholer dieser Klausur:
Studiengang Biowissenschaften Modulbegleitende Prüfung zum Praktikum in Organischer Chemie (gemäß MPO vom 12.09.2005) 21.07.2015 Name: Vorname: Matrikel-Nr.: geborenam: in: Wiederholer dieser Klausur:
Material zur Vorbereitung der Prüfung im Fach Chemie
 Material zur Vorbereitung der Prüfung im Fach Chemie 1 Empfohlene Literatur Duden Basiswissen Schule: Abitur Chemie Schulbücher für die Sekundarstufe II: - Chemie im Kontext, CVK Verlag - Elemente Chemie
Material zur Vorbereitung der Prüfung im Fach Chemie 1 Empfohlene Literatur Duden Basiswissen Schule: Abitur Chemie Schulbücher für die Sekundarstufe II: - Chemie im Kontext, CVK Verlag - Elemente Chemie
PCD Europe, Krefeld, Jan 2007. Auswertung von Haemoccult
 Auswertung von Haemoccult Ist das positiv? Nein! Ja! Im deutschen Krebsfrüherkennungsprogramm haben nur etwa 1 % der Frauen und 1,5 % der Männer ein positives Haemoccult -Ergebnis, da dieser Test eine
Auswertung von Haemoccult Ist das positiv? Nein! Ja! Im deutschen Krebsfrüherkennungsprogramm haben nur etwa 1 % der Frauen und 1,5 % der Männer ein positives Haemoccult -Ergebnis, da dieser Test eine
Anleitung über den Umgang mit Schildern
 Anleitung über den Umgang mit Schildern -Vorwort -Wo bekommt man Schilder? -Wo und wie speichert man die Schilder? -Wie füge ich die Schilder in meinen Track ein? -Welche Bauteile kann man noch für Schilder
Anleitung über den Umgang mit Schildern -Vorwort -Wo bekommt man Schilder? -Wo und wie speichert man die Schilder? -Wie füge ich die Schilder in meinen Track ein? -Welche Bauteile kann man noch für Schilder
Einführung. KLASSE: 9TE NAME: Vorname: Datum: LTAM Naturwissenschaften 9e Chemische Gleichungen 1 -
 Einführung Ein Gärtner bestellt beim Großhändler Blumen. Dort werden Tulpen in Dreier-Sträußen und Vergissmeinnichtchen in Zweier-Sträußen angeboten. Für Valentinstag, möchte der Gärtner ein Sonderangebot
Einführung Ein Gärtner bestellt beim Großhändler Blumen. Dort werden Tulpen in Dreier-Sträußen und Vergissmeinnichtchen in Zweier-Sträußen angeboten. Für Valentinstag, möchte der Gärtner ein Sonderangebot
Kohlenhydrate und ihre Funktionen
 Kohlenhydrate und ihre Funktionen Gliederung Monosaccharide Aufbau Nomenklatur Stereoisomerie/Konfiguration Zyklisierung O-glykosidische Bindung N-glykosidische Bindung Disaccharide Kohlenhydrate im Überblick
Kohlenhydrate und ihre Funktionen Gliederung Monosaccharide Aufbau Nomenklatur Stereoisomerie/Konfiguration Zyklisierung O-glykosidische Bindung N-glykosidische Bindung Disaccharide Kohlenhydrate im Überblick
6. Reaktionsgleichungen 6.1 Chemisches Reaktionsschema Wortschema Reaktionsschema Beispiel 1: Kupfer und Schwefel Vorzahlen
 6. Reaktionsgleichungen 6.1 Chemisches Reaktionsschema Das Wortschema benennt die Ausgangsstoffe und die Reaktionsprodukte einer chemischen Reaktion. Das Reaktionsschema sagt zusätzlich etwas über das
6. Reaktionsgleichungen 6.1 Chemisches Reaktionsschema Das Wortschema benennt die Ausgangsstoffe und die Reaktionsprodukte einer chemischen Reaktion. Das Reaktionsschema sagt zusätzlich etwas über das
1 topologisches Sortieren
 Wolfgang Hönig / Andreas Ecke WS 09/0 topologisches Sortieren. Überblick. Solange noch Knoten vorhanden: a) Suche Knoten v, zu dem keine Kante führt (Falls nicht vorhanden keine topologische Sortierung
Wolfgang Hönig / Andreas Ecke WS 09/0 topologisches Sortieren. Überblick. Solange noch Knoten vorhanden: a) Suche Knoten v, zu dem keine Kante führt (Falls nicht vorhanden keine topologische Sortierung
Reizdarmsyndrom lindern
 MARIA HOLL Reizdarmsyndrom lindern Mit der Maria-Holl-Methode (MHM) Der ganzheitliche Ansatz 18 Wie Sie mit diesem Buch Ihr Ziel erreichen Schritt 1: Formulieren Sie Ihr Ziel Als Erstes notieren Sie Ihr
MARIA HOLL Reizdarmsyndrom lindern Mit der Maria-Holl-Methode (MHM) Der ganzheitliche Ansatz 18 Wie Sie mit diesem Buch Ihr Ziel erreichen Schritt 1: Formulieren Sie Ihr Ziel Als Erstes notieren Sie Ihr
Organische Chemie I Chemie am 16.11.2012. Inhaltsverzeichnis Lewisformeln von Kohlenstoffverbindungen korrekt zeichnen!... 2
 Organische Chemie I Inhaltsverzeichnis Lewisformeln von Kohlenstoffverbindungen korrekt zeichnen!... 2 Verstehen was Organische Chemie heisst und die Entstehung von Kohlenstoffverbindungen kennen!... 2
Organische Chemie I Inhaltsverzeichnis Lewisformeln von Kohlenstoffverbindungen korrekt zeichnen!... 2 Verstehen was Organische Chemie heisst und die Entstehung von Kohlenstoffverbindungen kennen!... 2
Kapitel 4: Chemische. Woher stammen die chemischen Symbole?
 Kapitel 4: Chemische Symbole Woher stammen die chemischen Symbole? Das sind die Anfangsbuchstaben (manchmal auch die ersten beiden Anfangsbuchstaben) der lateinischen oder griechischen Namen der Elemente.
Kapitel 4: Chemische Symbole Woher stammen die chemischen Symbole? Das sind die Anfangsbuchstaben (manchmal auch die ersten beiden Anfangsbuchstaben) der lateinischen oder griechischen Namen der Elemente.
Gutes Leben was ist das?
 Lukas Bayer Jahrgangsstufe 12 Im Hirschgarten 1 67435 Neustadt Kurfürst-Ruprecht-Gymnasium Landwehrstraße22 67433 Neustadt a. d. Weinstraße Gutes Leben was ist das? Gutes Leben für alle was genau ist das
Lukas Bayer Jahrgangsstufe 12 Im Hirschgarten 1 67435 Neustadt Kurfürst-Ruprecht-Gymnasium Landwehrstraße22 67433 Neustadt a. d. Weinstraße Gutes Leben was ist das? Gutes Leben für alle was genau ist das
Das sogenannte Beamen ist auch in EEP möglich ohne das Zusatzprogramm Beamer. Zwar etwas umständlicher aber es funktioniert
 Beamen in EEP Das sogenannte Beamen ist auch in EEP möglich ohne das Zusatzprogramm Beamer. Zwar etwas umständlicher aber es funktioniert Zuerst musst du dir 2 Programme besorgen und zwar: Albert, das
Beamen in EEP Das sogenannte Beamen ist auch in EEP möglich ohne das Zusatzprogramm Beamer. Zwar etwas umständlicher aber es funktioniert Zuerst musst du dir 2 Programme besorgen und zwar: Albert, das
Hydrierung von Kohlenmonoxid zu Methanol Kataly?sche Umsetzung von Ethen mit Wasser zu Ethanol
 Oxida&onsreak&onen Von Alkenen und Alkokolen zu Aldehyden, Ketonen und Carbonsäuren H. Wünsch 2012 1 Vorbemerkung Grundlage der hier betrachteten Reak?onen sind Alkene und Alkohole. Alkohole sind Produkte
Oxida&onsreak&onen Von Alkenen und Alkokolen zu Aldehyden, Ketonen und Carbonsäuren H. Wünsch 2012 1 Vorbemerkung Grundlage der hier betrachteten Reak?onen sind Alkene und Alkohole. Alkohole sind Produkte
Reaktionsgleichungen verstehen anhand der Verbrennung von Magnesium
 Reaktionsgleichungen verstehen anhand der Verbrennung von Magnesium Unterrichtsfach Themenbereich/e Schulstufe (Klasse) Fachliche Vorkenntnisse Sprachliche Kompetenzen Zeitbedarf Material- & Medienbedarf
Reaktionsgleichungen verstehen anhand der Verbrennung von Magnesium Unterrichtsfach Themenbereich/e Schulstufe (Klasse) Fachliche Vorkenntnisse Sprachliche Kompetenzen Zeitbedarf Material- & Medienbedarf
Löschen. 1. einen : Das Material muss sein. kein Feuer entstehen oder unterhalten werden. Zündtemperatur erreicht, kann ebenfalls kein Feuer
 Löschen 1. Was braucht man, damit ein Feuer brennt? Zum Entfachen eines Feuers braucht man: 1. einen : Das Material muss sein 2. : Ohne den notwendigen kann kein Feuer entstehen oder unterhalten werden
Löschen 1. Was braucht man, damit ein Feuer brennt? Zum Entfachen eines Feuers braucht man: 1. einen : Das Material muss sein 2. : Ohne den notwendigen kann kein Feuer entstehen oder unterhalten werden
Station 1: Säuren in Lebensmitteln (1)
 Station 1: Säuren in Lebensmitteln (1) An dieser Station testet ihr, welche Lebensmittel Säuren enthalten. Für den Säurenachweis benutzt man im Labor bestimmte chemische Stoffe, die man Indikatoren (Zeigerstoffe)
Station 1: Säuren in Lebensmitteln (1) An dieser Station testet ihr, welche Lebensmittel Säuren enthalten. Für den Säurenachweis benutzt man im Labor bestimmte chemische Stoffe, die man Indikatoren (Zeigerstoffe)
Gruppe 01: Verbesserung Weißer Zucker... Schwarze Kohle
 Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 01: Verbesserung Weißer Zucker... Schwarze Kohle Reaktion: Saccharose
Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 01: Verbesserung Weißer Zucker... Schwarze Kohle Reaktion: Saccharose
Säuglingsanfangsnahrung und Folgenahrung Was ändert sich? Was bleibt?
 Säuglingsanfangsnahrung und Folgenahrung Was ändert sich? Was bleibt? Begleitinformationen: Handout für das Verkaufspersonal im Handel Bei Rückfragen sprechen Sie uns bitte gerne an: DIÄTVERBAND e. V.
Säuglingsanfangsnahrung und Folgenahrung Was ändert sich? Was bleibt? Begleitinformationen: Handout für das Verkaufspersonal im Handel Bei Rückfragen sprechen Sie uns bitte gerne an: DIÄTVERBAND e. V.
Beschreiben Sie den Aufbau und die Eigenschaften der Kohlenwasserstoffe. Beschreiben Sie die Alkane allgemein.
 den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
Musterprüfung Chemie Klassen: MPL 09 Datum: 14. 16. April 2010
 1 Musterprüfung Chemie Klassen: MPL 09 Datum: 14. 16. April 2010 Themen: Metallische Bindungen (Skript S. 51 53, inkl. Arbeitsblatt) Reaktionsverlauf (Skript S. 54 59, inkl. Arbeitsblatt, Merke, Fig. 7.2.1
1 Musterprüfung Chemie Klassen: MPL 09 Datum: 14. 16. April 2010 Themen: Metallische Bindungen (Skript S. 51 53, inkl. Arbeitsblatt) Reaktionsverlauf (Skript S. 54 59, inkl. Arbeitsblatt, Merke, Fig. 7.2.1
Geld Verdienen im Internet leicht gemacht
 Geld Verdienen im Internet leicht gemacht Hallo, Sie haben sich dieses E-book wahrscheinlich herunter geladen, weil Sie gerne lernen würden wie sie im Internet Geld verdienen können, oder? Denn genau das
Geld Verdienen im Internet leicht gemacht Hallo, Sie haben sich dieses E-book wahrscheinlich herunter geladen, weil Sie gerne lernen würden wie sie im Internet Geld verdienen können, oder? Denn genau das
1: 9. Hamburger Gründerpreis - Kategorie Existenzgründer - 08.09.2010 19:00 Uhr
 1: 9. Hamburger Gründerpreis - Kategorie Existenzgründer - Sehr geehrter Herr Bürgermeister, sehr geehrter Herr Dr. Vogelsang, sehr geehrter Herr Strunz, und meine sehr geehrte Damen und Herren, meine
1: 9. Hamburger Gründerpreis - Kategorie Existenzgründer - Sehr geehrter Herr Bürgermeister, sehr geehrter Herr Dr. Vogelsang, sehr geehrter Herr Strunz, und meine sehr geehrte Damen und Herren, meine
Kreativ visualisieren
 Kreativ visualisieren Haben Sie schon einmal etwas von sogenannten»sich selbst erfüllenden Prophezeiungen«gehört? Damit ist gemeint, dass ein Ereignis mit hoher Wahrscheinlichkeit eintritt, wenn wir uns
Kreativ visualisieren Haben Sie schon einmal etwas von sogenannten»sich selbst erfüllenden Prophezeiungen«gehört? Damit ist gemeint, dass ein Ereignis mit hoher Wahrscheinlichkeit eintritt, wenn wir uns
Info: Blütenpflanzen. Narbe. Blütenkronblatt. Griffel. Staubblatt. Fruchtknoten. Kelchblatt
 Info: Blütenpflanzen Pflanzen sind viel unauffälliger als Tiere und Menschen und finden dadurch oft wenig Beachtung. Doch wer sich mit ihnen näher beschäftigt, erkennt schnell, welche große Bedeutung sie
Info: Blütenpflanzen Pflanzen sind viel unauffälliger als Tiere und Menschen und finden dadurch oft wenig Beachtung. Doch wer sich mit ihnen näher beschäftigt, erkennt schnell, welche große Bedeutung sie
1 Mathematische Grundlagen
 Mathematische Grundlagen - 1-1 Mathematische Grundlagen Der Begriff der Menge ist einer der grundlegenden Begriffe in der Mathematik. Mengen dienen dazu, Dinge oder Objekte zu einer Einheit zusammenzufassen.
Mathematische Grundlagen - 1-1 Mathematische Grundlagen Der Begriff der Menge ist einer der grundlegenden Begriffe in der Mathematik. Mengen dienen dazu, Dinge oder Objekte zu einer Einheit zusammenzufassen.
Gruppenrichtlinien und Softwareverteilung
 Gruppenrichtlinien und Softwareverteilung Ergänzungen zur Musterlösung Bitte lesen Sie zuerst die gesamte Anleitung durch! Vorbemerkung: Die Begriffe OU (Organizational Unit) und Raum werden in der folgenden
Gruppenrichtlinien und Softwareverteilung Ergänzungen zur Musterlösung Bitte lesen Sie zuerst die gesamte Anleitung durch! Vorbemerkung: Die Begriffe OU (Organizational Unit) und Raum werden in der folgenden
L10N-Manager 3. Netzwerktreffen der Hochschulübersetzer/i nnen Mannheim 10. Mai 2016
 L10N-Manager 3. Netzwerktreffen der Hochschulübersetzer/i nnen Mannheim 10. Mai 2016 Referentin: Dr. Kelly Neudorfer Universität Hohenheim Was wir jetzt besprechen werden ist eine Frage, mit denen viele
L10N-Manager 3. Netzwerktreffen der Hochschulübersetzer/i nnen Mannheim 10. Mai 2016 Referentin: Dr. Kelly Neudorfer Universität Hohenheim Was wir jetzt besprechen werden ist eine Frage, mit denen viele
Mehr Geld verdienen! Lesen Sie... Peter von Karst. Ihre Leseprobe. der schlüssel zum leben. So gehen Sie konkret vor!
 Peter von Karst Mehr Geld verdienen! So gehen Sie konkret vor! Ihre Leseprobe Lesen Sie...... wie Sie mit wenigen, aber effektiven Schritten Ihre gesteckten Ziele erreichen.... wie Sie die richtigen Entscheidungen
Peter von Karst Mehr Geld verdienen! So gehen Sie konkret vor! Ihre Leseprobe Lesen Sie...... wie Sie mit wenigen, aber effektiven Schritten Ihre gesteckten Ziele erreichen.... wie Sie die richtigen Entscheidungen
Professionelle Seminare im Bereich MS-Office
 Der Name BEREICH.VERSCHIEBEN() ist etwas unglücklich gewählt. Man kann mit der Funktion Bereiche zwar verschieben, man kann Bereiche aber auch verkleinern oder vergrößern. Besser wäre es, die Funktion
Der Name BEREICH.VERSCHIEBEN() ist etwas unglücklich gewählt. Man kann mit der Funktion Bereiche zwar verschieben, man kann Bereiche aber auch verkleinern oder vergrößern. Besser wäre es, die Funktion
Berechnung der Erhöhung der Durchschnittsprämien
 Wolfram Fischer Berechnung der Erhöhung der Durchschnittsprämien Oktober 2004 1 Zusammenfassung Zur Berechnung der Durchschnittsprämien wird das gesamte gemeldete Prämienvolumen Zusammenfassung durch die
Wolfram Fischer Berechnung der Erhöhung der Durchschnittsprämien Oktober 2004 1 Zusammenfassung Zur Berechnung der Durchschnittsprämien wird das gesamte gemeldete Prämienvolumen Zusammenfassung durch die
Wie bestimmt ein Chemiker Säuren und Laugen?
 Wie bestimmt ein Chemiker Säuren und Laugen? Mit den Zahlen von 0 14 wird der ph Wert angegeben. 1 ist eine sehr starke Säure, 14 ist eine sehr starke Lauge. Aus: onlineenzyklopaedie.de Das Forscherlabor
Wie bestimmt ein Chemiker Säuren und Laugen? Mit den Zahlen von 0 14 wird der ph Wert angegeben. 1 ist eine sehr starke Säure, 14 ist eine sehr starke Lauge. Aus: onlineenzyklopaedie.de Das Forscherlabor
Endstoffe (Produkte) Aus dem Reaktionsgemisch entweichendes Gas, z. B. 2 Welche Informationen kann man einer Reaktionsgleichung entnehmen?
 Reaktionsgleichungen Reaktionsgleichungen Blatt 1/5 1 Was ist eine Reaktionsgleichung? Eine Reaktionsgleichung beschreibt die Umwandlung von Stoffen, also einen chemischen Prozeß. Auf der einen Seite steht,
Reaktionsgleichungen Reaktionsgleichungen Blatt 1/5 1 Was ist eine Reaktionsgleichung? Eine Reaktionsgleichung beschreibt die Umwandlung von Stoffen, also einen chemischen Prozeß. Auf der einen Seite steht,
Kohlenhydrate. Diese Abbildung zeigt Strukturformeln von Zellulose und Stärke.
 Lerntext Ernährung Bisher haben sich fast alle Empfehlungen der Ernährungswissenschaftler als falsch erwiesen. Gültig blieben zwei Regeln, die Menschen schon lange vor den Wissenschaftlern kannten. Man
Lerntext Ernährung Bisher haben sich fast alle Empfehlungen der Ernährungswissenschaftler als falsch erwiesen. Gültig blieben zwei Regeln, die Menschen schon lange vor den Wissenschaftlern kannten. Man
Simulation LIF5000. Abbildung 1
 Simulation LIF5000 Abbildung 1 Zur Simulation von analogen Schaltungen verwende ich Ltspice/SwitcherCAD III. Dieses Programm ist sehr leistungsfähig und wenn man weis wie, dann kann man damit fast alles
Simulation LIF5000 Abbildung 1 Zur Simulation von analogen Schaltungen verwende ich Ltspice/SwitcherCAD III. Dieses Programm ist sehr leistungsfähig und wenn man weis wie, dann kann man damit fast alles
Handbuch Fischertechnik-Einzelteiltabelle V3.7.3
 Handbuch Fischertechnik-Einzelteiltabelle V3.7.3 von Markus Mack Stand: Samstag, 17. April 2004 Inhaltsverzeichnis 1. Systemvorraussetzungen...3 2. Installation und Start...3 3. Anpassen der Tabelle...3
Handbuch Fischertechnik-Einzelteiltabelle V3.7.3 von Markus Mack Stand: Samstag, 17. April 2004 Inhaltsverzeichnis 1. Systemvorraussetzungen...3 2. Installation und Start...3 3. Anpassen der Tabelle...3
Übungsblatt zu Säuren und Basen
 1 Übungsblatt zu Säuren und Basen 1. In einer wässrigen Lösung misst die Konzentration der Oxoniumionen (H 3 O + ) 10 5 M. a) Wie gross ist der ph Wert? b) Ist die Konzentration der OH Ionen grösser oder
1 Übungsblatt zu Säuren und Basen 1. In einer wässrigen Lösung misst die Konzentration der Oxoniumionen (H 3 O + ) 10 5 M. a) Wie gross ist der ph Wert? b) Ist die Konzentration der OH Ionen grösser oder
Persönliche Zukunftsplanung mit Menschen, denen nicht zugetraut wird, dass sie für sich selbst sprechen können Von Susanne Göbel und Josef Ströbl
 Persönliche Zukunftsplanung mit Menschen, denen nicht zugetraut Von Susanne Göbel und Josef Ströbl Die Ideen der Persönlichen Zukunftsplanung stammen aus Nordamerika. Dort werden Zukunftsplanungen schon
Persönliche Zukunftsplanung mit Menschen, denen nicht zugetraut Von Susanne Göbel und Josef Ströbl Die Ideen der Persönlichen Zukunftsplanung stammen aus Nordamerika. Dort werden Zukunftsplanungen schon
1. TEIL (3 5 Fragen) Freizeit, Unterhaltung 2,5 Min.
 EINFÜHRUNG 0,5 Min. THEMEN: Freizeit, Unterhaltung (T1), Einkaufen (T2), Ausbildung, Beruf (T3), Multikulturelle Gesellschaft (T4) Hallo/Guten Tag. (Nehmen Sie bitte Platz. Können Sie mir bitte die Nummer
EINFÜHRUNG 0,5 Min. THEMEN: Freizeit, Unterhaltung (T1), Einkaufen (T2), Ausbildung, Beruf (T3), Multikulturelle Gesellschaft (T4) Hallo/Guten Tag. (Nehmen Sie bitte Platz. Können Sie mir bitte die Nummer
Informationen zum Ambulant Betreuten Wohnen in leichter Sprache
 Informationen zum Ambulant Betreuten Wohnen in leichter Sprache Arbeiterwohlfahrt Kreisverband Siegen - Wittgenstein/ Olpe 1 Diese Information hat geschrieben: Arbeiterwohlfahrt Stephanie Schür Koblenzer
Informationen zum Ambulant Betreuten Wohnen in leichter Sprache Arbeiterwohlfahrt Kreisverband Siegen - Wittgenstein/ Olpe 1 Diese Information hat geschrieben: Arbeiterwohlfahrt Stephanie Schür Koblenzer
DAS PARETO PRINZIP DER SCHLÜSSEL ZUM ERFOLG
 DAS PARETO PRINZIP DER SCHLÜSSEL ZUM ERFOLG von Urs Schaffer Copyright by Urs Schaffer Schaffer Consulting GmbH Basel www.schaffer-consulting.ch Info@schaffer-consulting.ch Haben Sie gewusst dass... >
DAS PARETO PRINZIP DER SCHLÜSSEL ZUM ERFOLG von Urs Schaffer Copyright by Urs Schaffer Schaffer Consulting GmbH Basel www.schaffer-consulting.ch Info@schaffer-consulting.ch Haben Sie gewusst dass... >
Lerntext Pflanzen 1. Was sind Pflanzen?
 Was sind Pflanzen? Lerntext Pflanzen 1 Pleurotus_ostreatus Ausschnitt eines Photos von Tobi Kellner, das er unter der Lizenz CC BY-SA 3.0 zur Verfügung stellte Der Körper eines Pilzes ist ein Fadengeflecht
Was sind Pflanzen? Lerntext Pflanzen 1 Pleurotus_ostreatus Ausschnitt eines Photos von Tobi Kellner, das er unter der Lizenz CC BY-SA 3.0 zur Verfügung stellte Der Körper eines Pilzes ist ein Fadengeflecht
EINE KERZE INTERPRETATIONEN BEOBACHTUNGEN FLAMME REAKTIONEN WACHS DOCHT GASE. Reaktionsgleichungen Prozesse. Theorien
 Reaktionsgleichungen Prozesse INTERPRETATIONEN BEOBACHTUNGEN Theorien Licht Produkte Reaktionsgleichungen Thermodynamik Geschwindigkeit REAKTIONEN EINE KERZE FLAMME Farbe Form Bewegung Einflüsse WACHS
Reaktionsgleichungen Prozesse INTERPRETATIONEN BEOBACHTUNGEN Theorien Licht Produkte Reaktionsgleichungen Thermodynamik Geschwindigkeit REAKTIONEN EINE KERZE FLAMME Farbe Form Bewegung Einflüsse WACHS
Anleitung zum Erstellen eines Freihaltetermins
 Anleitung zum Erstellen eines Freihaltetermins Im Folgenden wird das Anlegen eines Freihaltetermins im DFB-Net anhand zweier Beispiele Schritt für Schritt erklärt. Die Beispiele sind folgende: Meine Oma
Anleitung zum Erstellen eines Freihaltetermins Im Folgenden wird das Anlegen eines Freihaltetermins im DFB-Net anhand zweier Beispiele Schritt für Schritt erklärt. Die Beispiele sind folgende: Meine Oma
Erfahrungen mit Hartz IV- Empfängern
 Erfahrungen mit Hartz IV- Empfängern Ausgewählte Ergebnisse einer Befragung von Unternehmen aus den Branchen Gastronomie, Pflege und Handwerk Pressegespräch der Bundesagentur für Arbeit am 12. November
Erfahrungen mit Hartz IV- Empfängern Ausgewählte Ergebnisse einer Befragung von Unternehmen aus den Branchen Gastronomie, Pflege und Handwerk Pressegespräch der Bundesagentur für Arbeit am 12. November
50. Mathematik-Olympiade 2. Stufe (Regionalrunde) Klasse 11 13. 501322 Lösung 10 Punkte
 50. Mathematik-Olympiade. Stufe (Regionalrunde) Klasse 3 Lösungen c 00 Aufgabenausschuss des Mathematik-Olympiaden e.v. www.mathematik-olympiaden.de. Alle Rechte vorbehalten. 503 Lösung 0 Punkte Es seien
50. Mathematik-Olympiade. Stufe (Regionalrunde) Klasse 3 Lösungen c 00 Aufgabenausschuss des Mathematik-Olympiaden e.v. www.mathematik-olympiaden.de. Alle Rechte vorbehalten. 503 Lösung 0 Punkte Es seien
Michael Geisler Magnesium Sulfuricum - Epsomit Bittersalz
 Michael Geisler Magnesium Sulfuricum - Epsomit Bittersalz Leseprobe Magnesium Sulfuricum - Epsomit Bittersalz von Michael Geisler Herausgeber: IHHF Verlag http://www.narayana-verlag.de/b3175 Im Narayana
Michael Geisler Magnesium Sulfuricum - Epsomit Bittersalz Leseprobe Magnesium Sulfuricum - Epsomit Bittersalz von Michael Geisler Herausgeber: IHHF Verlag http://www.narayana-verlag.de/b3175 Im Narayana
Kapiteltest 1.1. Kapiteltest 1.2
 Kapiteltest 1.1 a) Perchlorsäure hat die Formel HClO 4. Was geschieht bei der Reaktion von Perchlorsäure mit Wasser? Geben Sie zuerst die Antwort in einem Satz. Dann notieren Sie die Reaktionsgleichung.
Kapiteltest 1.1 a) Perchlorsäure hat die Formel HClO 4. Was geschieht bei der Reaktion von Perchlorsäure mit Wasser? Geben Sie zuerst die Antwort in einem Satz. Dann notieren Sie die Reaktionsgleichung.
Primzahlen und RSA-Verschlüsselung
 Primzahlen und RSA-Verschlüsselung Michael Fütterer und Jonathan Zachhuber 1 Einiges zu Primzahlen Ein paar Definitionen: Wir bezeichnen mit Z die Menge der positiven und negativen ganzen Zahlen, also
Primzahlen und RSA-Verschlüsselung Michael Fütterer und Jonathan Zachhuber 1 Einiges zu Primzahlen Ein paar Definitionen: Wir bezeichnen mit Z die Menge der positiven und negativen ganzen Zahlen, also
Bewertung des Blattes
 Bewertung des Blattes Es besteht immer die Schwierigkeit, sein Blatt richtig einzuschätzen. Im folgenden werden einige Anhaltspunkte gegeben. Man unterscheidet: Figurenpunkte Verteilungspunkte Längenpunkte
Bewertung des Blattes Es besteht immer die Schwierigkeit, sein Blatt richtig einzuschätzen. Im folgenden werden einige Anhaltspunkte gegeben. Man unterscheidet: Figurenpunkte Verteilungspunkte Längenpunkte
Schmerz warnt uns! Der Kopfschmerztyp Migräne. Was sind typische Merkmale des Migränekopfschmerzes?
 Check it out! - Trainingswoche 1 - Schmerz warnt uns! Schmerz hat eine Warnfunktion! Durch Schmerz bemerkst du, dass mit deinem Körper etwas nicht in Ordnung ist, dass du dich zum Beispiel verletzt hast
Check it out! - Trainingswoche 1 - Schmerz warnt uns! Schmerz hat eine Warnfunktion! Durch Schmerz bemerkst du, dass mit deinem Körper etwas nicht in Ordnung ist, dass du dich zum Beispiel verletzt hast
Ein Buch entsteht. Ein langer Weg
 Ein Buch entsteht ilo 2003 Ein langer Weg Wenn ein Schriftsteller oder eine Schriftstellerin eine Geschichte schreibt, dann ist das noch ein langer Weg bis daraus ein Buch wird. Der Autor Alles fängt damit
Ein Buch entsteht ilo 2003 Ein langer Weg Wenn ein Schriftsteller oder eine Schriftstellerin eine Geschichte schreibt, dann ist das noch ein langer Weg bis daraus ein Buch wird. Der Autor Alles fängt damit
! " # $ " % & Nicki Wruck worldwidewruck 08.02.2006
 !"# $ " %& Nicki Wruck worldwidewruck 08.02.2006 Wer kennt die Problematik nicht? Die.pst Datei von Outlook wird unübersichtlich groß, das Starten und Beenden dauert immer länger. Hat man dann noch die.pst
!"# $ " %& Nicki Wruck worldwidewruck 08.02.2006 Wer kennt die Problematik nicht? Die.pst Datei von Outlook wird unübersichtlich groß, das Starten und Beenden dauert immer länger. Hat man dann noch die.pst
vor 2 Tagen erhielt ich einen Anruf eines Ihrer Kundenberater (Herr Kirsch) mit dem Angebot der Vertragsverlängerung für meinen Mobilfunkvertrag.
 BERKEMEYER Unternehmensbegeisterung berkemeyer unternehmensbegeisterung ückendorfer str. 12 45886 gelsenkirchen vodafone GmbH Am Seestern 1 40547 Düsseldorf Gelsenkirchen, den 6.8.2014 Fragen zur Kündigung
BERKEMEYER Unternehmensbegeisterung berkemeyer unternehmensbegeisterung ückendorfer str. 12 45886 gelsenkirchen vodafone GmbH Am Seestern 1 40547 Düsseldorf Gelsenkirchen, den 6.8.2014 Fragen zur Kündigung
1. Standortbestimmung
 1. Standortbestimmung Wer ein Ziel erreichen will, muss dieses kennen. Dazu kommen wir noch. Er muss aber auch wissen, wo er sich befindet, wie weit er schon ist und welche Strecke bereits hinter ihm liegt.
1. Standortbestimmung Wer ein Ziel erreichen will, muss dieses kennen. Dazu kommen wir noch. Er muss aber auch wissen, wo er sich befindet, wie weit er schon ist und welche Strecke bereits hinter ihm liegt.
Was ist das Budget für Arbeit?
 1 Was ist das Budget für Arbeit? Das Budget für Arbeit ist ein Persönliches Geld für Arbeit wenn Sie arbeiten möchten aber nicht mehr in einer Werkstatt. Das gibt es bisher nur in Nieder-Sachsen. Und in
1 Was ist das Budget für Arbeit? Das Budget für Arbeit ist ein Persönliches Geld für Arbeit wenn Sie arbeiten möchten aber nicht mehr in einer Werkstatt. Das gibt es bisher nur in Nieder-Sachsen. Und in
AGROPLUS Buchhaltung. Daten-Server und Sicherheitskopie. Version vom 21.10.2013b
 AGROPLUS Buchhaltung Daten-Server und Sicherheitskopie Version vom 21.10.2013b 3a) Der Daten-Server Modus und der Tresor Der Daten-Server ist eine Betriebsart welche dem Nutzer eine grosse Flexibilität
AGROPLUS Buchhaltung Daten-Server und Sicherheitskopie Version vom 21.10.2013b 3a) Der Daten-Server Modus und der Tresor Der Daten-Server ist eine Betriebsart welche dem Nutzer eine grosse Flexibilität
Meine Entscheidung zur Wiederaufnahme der Arbeit
 Meine Entscheidung zur Wiederaufnahme der Arbeit Die nachfolgende Übersicht soll Sie dabei unterstützen, Ihre Wünsche und Vorstellungen zur Wiederaufnahme der Arbeit für sich selbst einzuordnen. Sie soll
Meine Entscheidung zur Wiederaufnahme der Arbeit Die nachfolgende Übersicht soll Sie dabei unterstützen, Ihre Wünsche und Vorstellungen zur Wiederaufnahme der Arbeit für sich selbst einzuordnen. Sie soll
Markus 13,24-33. Wie ist es, wenn die Welt aufhört? Und wenn die neue Welt von Gott anfängt.
 Markus 13,24-33 Leichte Sprache Jesus erzählt von der neuen Welt von Gott Einmal fragten die Jünger Jesus: Wie ist es, wenn die Welt aufhört? Und wenn die neue Welt von Gott anfängt. Jesus sagte: Wenn
Markus 13,24-33 Leichte Sprache Jesus erzählt von der neuen Welt von Gott Einmal fragten die Jünger Jesus: Wie ist es, wenn die Welt aufhört? Und wenn die neue Welt von Gott anfängt. Jesus sagte: Wenn
Handbuch. NAFI Online-Spezial. Kunden- / Datenverwaltung. 1. Auflage. (Stand: 24.09.2014)
 Handbuch NAFI Online-Spezial 1. Auflage (Stand: 24.09.2014) Copyright 2016 by NAFI GmbH Unerlaubte Vervielfältigungen sind untersagt! Inhaltsangabe Einleitung... 3 Kundenauswahl... 3 Kunde hinzufügen...
Handbuch NAFI Online-Spezial 1. Auflage (Stand: 24.09.2014) Copyright 2016 by NAFI GmbH Unerlaubte Vervielfältigungen sind untersagt! Inhaltsangabe Einleitung... 3 Kundenauswahl... 3 Kunde hinzufügen...
Katalysatoren - Chemische Partnervermittlung im virtuellen Labor
 Seite 1 von 6 Katalysatoren - Chemische Partnervermittlung im virtuellen Labor Katalysatoren Der Katalysator in der Großindustrie Was passiert im Inneren? Das virtuelle Labor. Katalysatoren Katalysatoren
Seite 1 von 6 Katalysatoren - Chemische Partnervermittlung im virtuellen Labor Katalysatoren Der Katalysator in der Großindustrie Was passiert im Inneren? Das virtuelle Labor. Katalysatoren Katalysatoren
Tipp III: Leiten Sie eine immer direkt anwendbare Formel her zur Berechnung der sogenannten "bedingten Wahrscheinlichkeit".
 Mathematik- Unterrichts- Einheiten- Datei e. V. Klasse 9 12 04/2015 Diabetes-Test Infos: www.mued.de Blutspenden werden auf Diabetes untersucht, das mit 8 % in der Bevölkerung verbreitet ist. Dabei werden
Mathematik- Unterrichts- Einheiten- Datei e. V. Klasse 9 12 04/2015 Diabetes-Test Infos: www.mued.de Blutspenden werden auf Diabetes untersucht, das mit 8 % in der Bevölkerung verbreitet ist. Dabei werden
Schnellstart - Checkliste
 Schnellstart - Checkliste http://www.ollis-tipps.de/schnellstart-in-7-schritten/ Copyright Olaf Ebers / http://www.ollis-tipps.de/ - Alle Rechte vorbehalten - weltweit Seite 1 von 6 Einleitung Mein Name
Schnellstart - Checkliste http://www.ollis-tipps.de/schnellstart-in-7-schritten/ Copyright Olaf Ebers / http://www.ollis-tipps.de/ - Alle Rechte vorbehalten - weltweit Seite 1 von 6 Einleitung Mein Name
Orientierungstest für angehende Industriemeister. Vorbereitungskurs Chemie
 Orientierungstest für angehende Industriemeister Vorbereitungskurs Chemie Production Technologies Erlaubte Hilfsmittel: Periodensystem der Elemente Maximale Bearbeitungszeit: 30 Minuten Provadis Partner
Orientierungstest für angehende Industriemeister Vorbereitungskurs Chemie Production Technologies Erlaubte Hilfsmittel: Periodensystem der Elemente Maximale Bearbeitungszeit: 30 Minuten Provadis Partner
Welches Übersetzungsbüro passt zu mir?
 1 Welches Übersetzungsbüro passt zu mir? 2 9 Kriterien für Ihre Suche mit Checkliste! Wenn Sie auf der Suche nach einem passenden Übersetzungsbüro das Internet befragen, werden Sie ganz schnell feststellen,
1 Welches Übersetzungsbüro passt zu mir? 2 9 Kriterien für Ihre Suche mit Checkliste! Wenn Sie auf der Suche nach einem passenden Übersetzungsbüro das Internet befragen, werden Sie ganz schnell feststellen,
Kohlenhydrate Einleitung
 Einleitung Kohlenhydrate (Saccharide) sind Polyhydroxycarbonyl-Verbindungen, die neben Kohlenstoff noch Wasserstoff und Sauerstoff im Stoffmengenverhältnis 2:1 enthalten. Der Begriff Kohlenhydrate ist
Einleitung Kohlenhydrate (Saccharide) sind Polyhydroxycarbonyl-Verbindungen, die neben Kohlenstoff noch Wasserstoff und Sauerstoff im Stoffmengenverhältnis 2:1 enthalten. Der Begriff Kohlenhydrate ist
ONLINE-AKADEMIE. "Diplomierter NLP Anwender für Schule und Unterricht" Ziele
 ONLINE-AKADEMIE Ziele Wenn man von Menschen hört, die etwas Großartiges in ihrem Leben geleistet haben, erfahren wir oft, dass diese ihr Ziel über Jahre verfolgt haben oder diesen Wunsch schon bereits
ONLINE-AKADEMIE Ziele Wenn man von Menschen hört, die etwas Großartiges in ihrem Leben geleistet haben, erfahren wir oft, dass diese ihr Ziel über Jahre verfolgt haben oder diesen Wunsch schon bereits
Chemie Zusammenfassung KA 2
 Chemie Zusammenfassung KA 2 Wärmemenge Q bei einer Reaktion Chemische Reaktionen haben eine Gemeinsamkeit: Bei der Reaktion wird entweder Energie/Wärme frei (exotherm). Oder es wird Wärme/Energie aufgenommen
Chemie Zusammenfassung KA 2 Wärmemenge Q bei einer Reaktion Chemische Reaktionen haben eine Gemeinsamkeit: Bei der Reaktion wird entweder Energie/Wärme frei (exotherm). Oder es wird Wärme/Energie aufgenommen
Hohe Kontraste zwischen Himmel und Landschaft abmildern
 PhotoLine-Bildbearbeitung Erstellt mit Version 16.11 In diesem Beispiel möchte ich zeigen, wie ich zur Zeit Landschaftsbilder mit hohen Kontrasten bearbeite. "Zur Zeit" deshalb, weil sich das natürlich
PhotoLine-Bildbearbeitung Erstellt mit Version 16.11 In diesem Beispiel möchte ich zeigen, wie ich zur Zeit Landschaftsbilder mit hohen Kontrasten bearbeite. "Zur Zeit" deshalb, weil sich das natürlich
Papierverbrauch im Jahr 2000
 Hier findest du Forschertipps. Du kannst sie allein oder in der kleinen Gruppe mit anderen Kindern bearbeiten! Gestaltet ein leeres Blatt, schreibt Berichte oder entwerft ein Plakat. Sprecht euch in der
Hier findest du Forschertipps. Du kannst sie allein oder in der kleinen Gruppe mit anderen Kindern bearbeiten! Gestaltet ein leeres Blatt, schreibt Berichte oder entwerft ein Plakat. Sprecht euch in der
Repetitionsaufgaben Wurzelgleichungen
 Repetitionsaufgaben Wurzelgleichungen Inhaltsverzeichnis A) Vorbemerkungen B) Lernziele C) Theorie mit Aufgaben D) Aufgaben mit Musterlösungen 4 A) Vorbemerkungen Bitte beachten Sie: Bei Wurzelgleichungen
Repetitionsaufgaben Wurzelgleichungen Inhaltsverzeichnis A) Vorbemerkungen B) Lernziele C) Theorie mit Aufgaben D) Aufgaben mit Musterlösungen 4 A) Vorbemerkungen Bitte beachten Sie: Bei Wurzelgleichungen
Didaktisches Material. Keine Werbung.
 LEERGUT TUT GUT! Didaktisches Material. Keine Werbung. WÄHL DIE MEHRWEGGLASFLASCHE Schau dir an, was sie alles kann: www.mehrwegglas.info Eine Initiative von: Verbund der Südtiroler Getränke- und Mineralwasserproduzenten
LEERGUT TUT GUT! Didaktisches Material. Keine Werbung. WÄHL DIE MEHRWEGGLASFLASCHE Schau dir an, was sie alles kann: www.mehrwegglas.info Eine Initiative von: Verbund der Südtiroler Getränke- und Mineralwasserproduzenten
Inhalt. 1. Einleitung Hilfe, mein Kind kann nicht richtig schreiben und lesen! Seite
 Inhalt 1. Einleitung Hilfe, mein Kind kann nicht richtig schreiben und lesen! 2. Praxisbeispiele Wie sieht ein Kind mit Legasthenie? Wie nimmt es sich wahr? 3. Begriffsklärung Was bedeuten die Bezeichnungen
Inhalt 1. Einleitung Hilfe, mein Kind kann nicht richtig schreiben und lesen! 2. Praxisbeispiele Wie sieht ein Kind mit Legasthenie? Wie nimmt es sich wahr? 3. Begriffsklärung Was bedeuten die Bezeichnungen
BROTTEIG. Um Brotteig zu machen, mischt ein Bäcker Mehl, Wasser, Salz und Hefe. Nach dem
 UNIT BROTTEIG BROTTEIG Um Brotteig zu machen, mischt ein Bäcker Mehl, Wasser, Salz und Hefe. Nach dem Mischen wird der Teig für mehrere Stunden in einen Behälter gegeben, um den Gärungsprozess zu ermöglichen.
UNIT BROTTEIG BROTTEIG Um Brotteig zu machen, mischt ein Bäcker Mehl, Wasser, Salz und Hefe. Nach dem Mischen wird der Teig für mehrere Stunden in einen Behälter gegeben, um den Gärungsprozess zu ermöglichen.
SEK II. Auf den Punkt gebracht!
 SEK II Profil- und Kurswahl Einbringungspflicht Abitur-Bestimmungen Gesamtqualifikation Auf den Punkt gebracht! 1 Inhaltsverzeichnis Sinn und Zweck dieses Dokuments...3 Profil- und Kurswahl für den 11.
SEK II Profil- und Kurswahl Einbringungspflicht Abitur-Bestimmungen Gesamtqualifikation Auf den Punkt gebracht! 1 Inhaltsverzeichnis Sinn und Zweck dieses Dokuments...3 Profil- und Kurswahl für den 11.
Kinderarmut. 1. Kapitel: Kinderarmut in der Welt
 Kinderarmut 1. Kapitel: Kinderarmut in der Welt Armut gibt es überall auf der Welt und Armut ist doch sehr unterschiedlich. Armut? Was ist das? Woher kommt das? wieso haben die einen viel und die anderen
Kinderarmut 1. Kapitel: Kinderarmut in der Welt Armut gibt es überall auf der Welt und Armut ist doch sehr unterschiedlich. Armut? Was ist das? Woher kommt das? wieso haben die einen viel und die anderen
Unser Projektablauf für das Projekt OMIRA MinusL Milchprodukte Viel Genuss ohne Laktose.
 Unser Projektablauf für das Projekt OMIRA MinusL Milchprodukte Viel Genuss ohne Laktose. Projektablauf: 1. Auspacken & freuen Nach erfolgter Teilnahmebestätigung durch die LISA Freundeskreis Redaktion
Unser Projektablauf für das Projekt OMIRA MinusL Milchprodukte Viel Genuss ohne Laktose. Projektablauf: 1. Auspacken & freuen Nach erfolgter Teilnahmebestätigung durch die LISA Freundeskreis Redaktion
Video-Thema Manuskript & Glossar
 DAS KIND ALS KONSUMENT Es gibt Forschungsinstitute, die die Wirkung von Werbung auf Kinder und Jugendliche untersuchen. Diese Zielgruppe kann 2009 insgesamt etwa 20 Milliarden Euro ausgeben. Marktforscherin
DAS KIND ALS KONSUMENT Es gibt Forschungsinstitute, die die Wirkung von Werbung auf Kinder und Jugendliche untersuchen. Diese Zielgruppe kann 2009 insgesamt etwa 20 Milliarden Euro ausgeben. Marktforscherin
Der echte Erfolg am Telefon
 praxis kompakt Sabin Bergmann Der echte Erfolg am Telefon Menschen ohne Callcenter- Floskeln erreichen Sabin Bergmann ist erfolgreiche Beraterin und Trainerin für Kundenzufriedenheit und Akquisition. Mit
praxis kompakt Sabin Bergmann Der echte Erfolg am Telefon Menschen ohne Callcenter- Floskeln erreichen Sabin Bergmann ist erfolgreiche Beraterin und Trainerin für Kundenzufriedenheit und Akquisition. Mit
Fernausbildung Fachberater/in für holistische Gesundheit. Modul 6
 Fernausbildung Fachberater/in für holistische Gesundheit Modul 6 Vorwort Liebe(r) Teilnehmer/in Herzlich willkommen in Modul 6 Mit dem 6. Modul beenden Sie nun Ihre Ausbildung, denn einmal muss schliesslich
Fernausbildung Fachberater/in für holistische Gesundheit Modul 6 Vorwort Liebe(r) Teilnehmer/in Herzlich willkommen in Modul 6 Mit dem 6. Modul beenden Sie nun Ihre Ausbildung, denn einmal muss schliesslich
Inhalt. Allgemeine Einführung. Argumentationsvermögen. Räumliches Vorstellungsvermögen. Begabungen und Fähigkeiten messen
 Beispielheft Inhalt Allgemeine Einführung Test Eins: Test Zwei: Test Drei: Test Vier: Test Fünf: Argumentationsvermögen Auffassungsvermögen Zahlenvermögen Sprachverständnis Räumliches Vorstellungsvermögen
Beispielheft Inhalt Allgemeine Einführung Test Eins: Test Zwei: Test Drei: Test Vier: Test Fünf: Argumentationsvermögen Auffassungsvermögen Zahlenvermögen Sprachverständnis Räumliches Vorstellungsvermögen
Qualität und Verlässlichkeit Das verstehen die Deutschen unter Geschäftsmoral!
 Beitrag: 1:43 Minuten Anmoderationsvorschlag: Unseriöse Internetanbieter, falsch deklarierte Lebensmittel oder die jüngsten ADAC-Skandale. Solche Fälle mit einer doch eher fragwürdigen Geschäftsmoral gibt
Beitrag: 1:43 Minuten Anmoderationsvorschlag: Unseriöse Internetanbieter, falsch deklarierte Lebensmittel oder die jüngsten ADAC-Skandale. Solche Fälle mit einer doch eher fragwürdigen Geschäftsmoral gibt
Parotis Pankreas. Dünndarm Bürstensaum. Amylose Amylopektin Glykogen. Maltose. Glucose. Isomaltose. Saccharose. Fructose. Lactose. Galaktose.
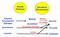 Parotis Pankreas Dünndarm Bürstensaum Amylose Amylopektin Glykogen Saccharose Lactose Maltose Isomaltose Saccharase (Sucrase) Lactase Maltase Isomaltase Glucose Fructose Galaktose Abbau von Stärke und
Parotis Pankreas Dünndarm Bürstensaum Amylose Amylopektin Glykogen Saccharose Lactose Maltose Isomaltose Saccharase (Sucrase) Lactase Maltase Isomaltase Glucose Fructose Galaktose Abbau von Stärke und
Wie halte ich Ordnung auf meiner Festplatte?
 Wie halte ich Ordnung auf meiner Festplatte? Was hältst du von folgender Ordnung? Du hast zu Hause einen Schrank. Alles was dir im Wege ist, Zeitungen, Briefe, schmutzige Wäsche, Essensreste, Küchenabfälle,
Wie halte ich Ordnung auf meiner Festplatte? Was hältst du von folgender Ordnung? Du hast zu Hause einen Schrank. Alles was dir im Wege ist, Zeitungen, Briefe, schmutzige Wäsche, Essensreste, Küchenabfälle,
Zwischenablage (Bilder, Texte,...)
 Zwischenablage was ist das? Informationen über. die Bedeutung der Windows-Zwischenablage Kopieren und Einfügen mit der Zwischenablage Vermeiden von Fehlern beim Arbeiten mit der Zwischenablage Bei diesen
Zwischenablage was ist das? Informationen über. die Bedeutung der Windows-Zwischenablage Kopieren und Einfügen mit der Zwischenablage Vermeiden von Fehlern beim Arbeiten mit der Zwischenablage Bei diesen
Woche 1: Was ist NLP? Die Geschichte des NLP.
 Woche 1: Was ist NLP? Die Geschichte des NLP. Liebe(r) Kursteilnehmer(in)! Im ersten Theorieteil der heutigen Woche beschäftigen wir uns mit der Entstehungsgeschichte des NLP. Zuerst aber eine Frage: Wissen
Woche 1: Was ist NLP? Die Geschichte des NLP. Liebe(r) Kursteilnehmer(in)! Im ersten Theorieteil der heutigen Woche beschäftigen wir uns mit der Entstehungsgeschichte des NLP. Zuerst aber eine Frage: Wissen
Alle gehören dazu. Vorwort
 Alle gehören dazu Alle sollen zusammen Sport machen können. In diesem Text steht: Wie wir dafür sorgen wollen. Wir sind: Der Deutsche Olympische Sport-Bund und die Deutsche Sport-Jugend. Zu uns gehören
Alle gehören dazu Alle sollen zusammen Sport machen können. In diesem Text steht: Wie wir dafür sorgen wollen. Wir sind: Der Deutsche Olympische Sport-Bund und die Deutsche Sport-Jugend. Zu uns gehören
Selbst-Test zur Vorab-Einschätzung zum Vorkurs Chemie für Mediziner
 Liebe Studierende der Human- und Zahnmedizin, mithilfe dieses Tests können Sie selbst einschätzen, ob Sie den Vorkurs besuchen sollten. Die kleine Auswahl an Aufgaben spiegelt in etwa das Niveau des Vorkurses
Liebe Studierende der Human- und Zahnmedizin, mithilfe dieses Tests können Sie selbst einschätzen, ob Sie den Vorkurs besuchen sollten. Die kleine Auswahl an Aufgaben spiegelt in etwa das Niveau des Vorkurses
2. Standortbestimmung / Äquivalenzprüfung. Chemie. Mittwoch, 20. Mai 2015, 18.40-20.10 Uhr
 Seite 1 von 6 2. Standortbestimmung / Äquivalenzprüfung Chemie Mittwoch, 20. Mai 2015, 18.40-20.10 Uhr Dauer der Prüfung: 90 Minuten Erlaubte Hilfsmittel: Eine gedruckte und/oder eine persönlich erstellte
Seite 1 von 6 2. Standortbestimmung / Äquivalenzprüfung Chemie Mittwoch, 20. Mai 2015, 18.40-20.10 Uhr Dauer der Prüfung: 90 Minuten Erlaubte Hilfsmittel: Eine gedruckte und/oder eine persönlich erstellte
SUPERABSORBER. Eine Präsentation von Johannes Schlüter und Thomas Luckert
 SUPERABSORBER Eine Präsentation von Johannes Schlüter und Thomas Luckert Inhalt: Die Windel Die Technik des Superabsorbers Anwendungsgebiete des Superabsorbers Ein kurzer Abriss aus der Geschichte der
SUPERABSORBER Eine Präsentation von Johannes Schlüter und Thomas Luckert Inhalt: Die Windel Die Technik des Superabsorbers Anwendungsgebiete des Superabsorbers Ein kurzer Abriss aus der Geschichte der
Wasserkraft früher und heute!
 Wasserkraft früher und heute! Wasserkraft leistet heute einen wichtigen Beitrag zur Stromversorgung in Österreich und auf der ganzen Welt. Aber war das schon immer so? Quelle: Elvina Schäfer, FOTOLIA In
Wasserkraft früher und heute! Wasserkraft leistet heute einen wichtigen Beitrag zur Stromversorgung in Österreich und auf der ganzen Welt. Aber war das schon immer so? Quelle: Elvina Schäfer, FOTOLIA In
Mobile Intranet in Unternehmen
 Mobile Intranet in Unternehmen Ergebnisse einer Umfrage unter Intranet Verantwortlichen aexea GmbH - communication. content. consulting Augustenstraße 15 70178 Stuttgart Tel: 0711 87035490 Mobile Intranet
Mobile Intranet in Unternehmen Ergebnisse einer Umfrage unter Intranet Verantwortlichen aexea GmbH - communication. content. consulting Augustenstraße 15 70178 Stuttgart Tel: 0711 87035490 Mobile Intranet
Persönlichkeit und Persönlichkeitsunterschiede
 9 Persönlichkeit und Persönlichkeitsunterschiede 1 Inhalt Die Beschäftigung mit der menschlichen Persönlichkeit spielt in unserem Alltag eine zentrale Rolle. Wir greifen auf das globale Konzept Persönlichkeit
9 Persönlichkeit und Persönlichkeitsunterschiede 1 Inhalt Die Beschäftigung mit der menschlichen Persönlichkeit spielt in unserem Alltag eine zentrale Rolle. Wir greifen auf das globale Konzept Persönlichkeit
Kapitel 13: Laugen und Neutralisation
 Kapitel 13: Laugen und Neutralisation Alkalimetalle sind Natrium, Kalium, Lithium (und Rubidium, Caesium und Francium). - Welche besonderen Eigenschaften haben die Elemente Natrium, Kalium und Lithium?
Kapitel 13: Laugen und Neutralisation Alkalimetalle sind Natrium, Kalium, Lithium (und Rubidium, Caesium und Francium). - Welche besonderen Eigenschaften haben die Elemente Natrium, Kalium und Lithium?
Zeichen bei Zahlen entschlüsseln
 Zeichen bei Zahlen entschlüsseln In diesem Kapitel... Verwendung des Zahlenstrahls Absolut richtige Bestimmung von absoluten Werten Operationen bei Zahlen mit Vorzeichen: Addieren, Subtrahieren, Multiplizieren
Zeichen bei Zahlen entschlüsseln In diesem Kapitel... Verwendung des Zahlenstrahls Absolut richtige Bestimmung von absoluten Werten Operationen bei Zahlen mit Vorzeichen: Addieren, Subtrahieren, Multiplizieren
Wir machen neue Politik für Baden-Württemberg
 Wir machen neue Politik für Baden-Württemberg Am 27. März 2011 haben die Menschen in Baden-Württemberg gewählt. Sie wollten eine andere Politik als vorher. Die Menschen haben die GRÜNEN und die SPD in
Wir machen neue Politik für Baden-Württemberg Am 27. März 2011 haben die Menschen in Baden-Württemberg gewählt. Sie wollten eine andere Politik als vorher. Die Menschen haben die GRÜNEN und die SPD in
Kurzanleitung. MEYTON Aufbau einer Internetverbindung. 1 Von 11
 Kurzanleitung MEYTON Aufbau einer Internetverbindung 1 Von 11 Inhaltsverzeichnis Installation eines Internetzugangs...3 Ist mein Router bereits im MEYTON Netzwerk?...3 Start des YAST Programms...4 Auswahl
Kurzanleitung MEYTON Aufbau einer Internetverbindung 1 Von 11 Inhaltsverzeichnis Installation eines Internetzugangs...3 Ist mein Router bereits im MEYTON Netzwerk?...3 Start des YAST Programms...4 Auswahl
