Sicherheitsvorschriften für Medizinprodukte
|
|
|
- Walther Schwarz
- vor 7 Jahren
- Abrufe
Transkript
1 Sicherheitsvorschriften für Medizinprodukte Kommentar zum MPG und zur MPBetreibV mit weiteren Vorschriften und Texten Begründet von Matthias Nöthlichs ehemals Ministerialdirigent im Bundesministerium für Arbeit und Sozialordnung Bearbeitet von Dr. Uwe Kage Kaufmännischer Geschäftsführer der Berufsgenossenschaftlichen Unfallklinik Frankfurt am Main SMP 35. Erg.-Lfg. III.14 ERICH SCHMIDT VERLAG
2 Bibliografische Information der Deutschen Nationalbibliothek Die Deutsche Nationalbibliothek verzeichnet diese Publikation in der Deutschen Nationalbibliografie; detaillierte bibliografische Daten sind im Internet über abrufbar. Weitere Informationen zu diesem Titel finden Sie im Internet unter ESV.info/ Die Wiedergabe von Gebrauchsnamen, Handelsnamen, Warenbezeichnungen usw. in diesem Werk berechtigt auch ohne Kennzeichnung nicht zu der Annahme, dass solche Namen im Sinne der Markenzeichen- und Markenschutzgesetzgebung als frei zu betrachten wären und daher von jedermann benutzt werden dürften Die Veröffentlichung erscheint als Sonderausgabe aus dem Handbuch Sicherheitstechnik herausgegeben von Schmatz/Nöthlichs. Zwecks Wahrung der Einheitlichkeit der Zitierweise werden die en aus dem Handbuch für diese Sonderausgabe beibehalten. ISBN ISSN X Alle Rechte vorbehalten Erich Schmidt Verlag GmbH & Co., Berlin Satz: schwarz auf weiss, Berlin Druck: Meta Systems, Wustermark
3 Inhaltsverzeichnis Medizinprodukte (Vorwort) Inhaltsverzeichnis Medizinprodukte Abkürzungsverzeichnis Stichwortverzeichnis Literatur Medizinproduktegesetz (Text und Kommentar) Gesetz über Medizinprodukte (Medizinproduktegesetz MPG) Erster Abschnitt: Zweck, Anwendungsbereich des Gesetzes, Begriffsbestimmungen 1 Zweck des Gesetzes Anwendungsbereich des Gesetzes Begriffsbestimmungen Zweiter Abschnitt: Anforderungen an Medizinprodukte und deren Betrieb 4 Verbote zum Schutz von Patienten, Anwendern und Dritten Verantwortlicher für das erstmalige Inverkehrbringen Voraussetzungen für das Inverkehrbringen und die Inbetriebnahme Grundlegende Anforderungen Harmonisierte Normen, Gemeinsame Technische Spezifikationen Bekanntmachung zum Europäischen Arzneibuch CE-Kennzeichnung Voraussetzungen für das erstmalige Inverkehrbringen und die Inbetriebnahme von Systemen und Behandlungseinheiten sowie für das Sterilisieren von Medizinprodukten Sondervorschriften für das Inverkehrbringen und die Inbetriebnahme Sonderanfertigungen, Medizinprodukte aus In-Haus- Herstellung, Medizinprodukte zur klinischen Prüfung oder für Leistungsbewertungszwecke, Ausstellen Klassifizierung von Medizinprodukten, Abgrenzung zu anderen Produkten SMP 35. Erg.-Lfg. III.14 1
4 14 Errichten, Betreiben, Anwenden und Instandhalten von Medizinprodukten Dritter Abschnitt: Benannte Stellen und Bescheinigungen 15 Benennung und Überwachung der Stellen, Anerkennung und Beauftragung von Prüflaboratorien a Benennung und Überwachung von Konformitätsbewertungsstellen für Drittstaaten a 1 16 Erlöschen, Rücknahme, Widerruf und Ruhen der Akkreditierung und Benennung Geltungsdauer von Bescheinigungen der Benannten Stellen Einschränkung, Aussetzung und Zurückziehung von Bescheinigungen, Unterrichtungspflichten Vierter Abschnitt: Klinische Bewertung, Leistungsbewertung, klinische Prüfung, Leistungsbewertungsprüfung Erläuterungen zum Vierten Abschnitt vor Klinische Bewertung, Leistungsbewertung Allgemeine Voraussetzungen zur Klinischen Prüfung Besondere Voraussetzungen zur klinischen Prüfung Verfahren bei der Ethik-Kommission a Genehmigungsverfahren bei der Bundesbehörde a 1 22b Rücknahme, Widerruf und Ruhen der Genehmigung oder der zustimmenden Bewertung b 1 22c Änderungen nach Genehmigung von klinischen Prüfungen c 1 23 Durchführung der klinischen Prüfung a Meldungen über Beendigung oder Abbruch von klinischen Prüfungen a 1 23b Ausnahmen zur klinischen Prüfung b 1 24 Leistungsbewertungsprüfung Fünfter Abschnitt: Überwachung und Schutz vor Risiken 25 Allgemeine Anzeigepflicht Durchführung der Überwachung Verfahren bei unrechtmäßiger und unzulässiger Anbringung der CE-Kennzeichnung Verfahren zum Schutz vor Risiken
5 29 Medizinprodukte-Beobachtungs- und -Meldesystem Sicherheitsbeauftragter für Medizinprodukte Medizinprodukteberater Sechster Abschnitt: Zuständige Behörden, Rechtsverordnungen, sonstige Bestimmungen 32 Zuständigkeitsabgrenzung zwischen Bundesoberbehörden Datenbankgeschütztes Informationssystem, Europäische Datenbank Ausfuhr Kosten Zusammenarbeit der Behörden und Benannten Stellen im Europäischen Wirtschaftsraum Verordnungsermächtigungen Siebter Abschnitt: Sondervorschriften für den Bereich der Bundeswehr 38 Anwendung und Vollzug des Gesetzes Ausnahmen Achter Abschnitt: Straf- und Bußgeldvorschriften 40 Strafvorschriften Strafvorschriften Bußgeldvorschriften Einziehung Neunter Abschnitt: Übergangsbestimmungen 44 Übergangsbestimmungen Sonstige Vorschriften zum Medizinprodukterecht Deutsches Recht Heilmittelwerbegesetz (HWG) Elektro- und Elektronikgerätegesetz (ElektroG) Auszug Gesetz über Funkanlagen und Telekommunikationseinrichtungen (FTEG) Gesetz über die Neuordnung des Geräte- und Produktsicherheitsrechts Verordnung über die Erfassung, Bewertung und Abwehr von Risiken bei Medizinprodukten Medizinprodukte-Sicherheitsplanverordnung (MPSV) Erster Abschnitt: Anwendungsbereich, Begriffsbestimmungen 1 Anwendungsbereich SMP 35. Erg.-Lfg. III.14 3
6 2 Begriffsbestimmungen Zweiter Abschnitt: Meldung von Vorkommnissen und Rückrufen 3 Meldepflichten Ausnahmen von der Meldepflicht und besondere Verfahren Fristen Meldung durch Vertreiber Modalitäten der Meldung Dritter Abschnitt: Risikobewertung durch die zuständige Bundesoberbehörde 8 Aufgaben der Behörde Ziel und Inhalt der Risikobewertung Verfahren der Risikobewertung Befugnisse der Behörde Mitwirkungspflichten Abschluss der Risikobewertung Vierter Abschnitt Korrektive Maßnahmen 14 Eigenverantwortliche korrektive Maßnahmen des Verantwortlichen nach 5 des Medizinproduktegesetzes a Eigenverantwortliche korrektive Maßnahmen des Sponsors von klinischen Prüfungen oder Leistungsbewertungsprüfungen a 1 15 Maßnahmen der zuständigen Behörden gegen Hersteller, Bevollmächtigte, Einführer oder Vertreiber Verpflichtung zur Mitwirkung an den korrektiven Maßnahmen Maßnahmen der zuständigen Behörden gegen Betreiber und Anwender Notfallplanung der zuständigen Behörden Fünfter Abschnitt Unterrichtungspflichten und Informationsaustausch 19 Unterrichtung des Bundesministeriums für Gesundheit durch die zuständige Bundesoberbehörde Informationsaustausch zwischen der zuständigen Bundesoberbehörde und den zuständigen Landesbehörden Europäischer und internationaler Informationsaustausch Unterrichtung sonstiger Behörden, Organisationen und Stellen
7 23 Wissenschaftliche Aufarbeitung der durchgeführten Risikobewertungen Veröffentlichung von Informationen über das Internet Bekanntmachung gem. 7 und 18 der MPSV Medizinprodukte-Gebührenverordnung (BKostV-MPG) Akkreditierungsstellengesetz (AkkStelleG) Akkreditierungssymbolverordnung (SymbolVO) Kostenverordnung der Akkreditierungsstelle (AkkStelleKostV) Verordnung über die Beleihung der Akkreditierungsstelle nach dem Akkreditierungsstellengesetz (AkkStelleG Beleihungsverordnung AkkStelleGBV) Abkommen über die Zentralstelle der Länder für Sicherheitstechnik Abkommen über die Zentralstelle der Länder für Gesundheitsschutz bei Arzneimitteln und Medizinprodukten Verordnungen und Richtlinien über das Inverkehrbringen von Medizinprodukten Verordnung über Medizinprodukte (Medizinprodukte-Verordnung MPV) Eingangsformel Abschnitt 1: Anwendungsbereich und Allgemeine Anforderungen an die Konformitätsbewertung 1 Anwendungsbereich Biologische Sicherheitsprüfung Allgemeine Vorschriften zur Durchführung der Konformitätsbewertung Abschnitt 2: Anforderungen an die Verfahren der Konformitätsbewertung 4 Konformitätsbewertungsverfahren für aktive implantierbare Medizinprodukte Konformitätsbewertungsverfahren für In-vitro-Diagnostika Konformitätsbewertungsverfahren für unter Verwendung von tierischem Gewebe hergestellte Medizinprodukte Konformitätsbewertungsverfahren für die sonstigen Medizinprodukte SMP 35. Erg.-Lfg. III.14 5
8 Abschnitt 3: Änderungen der Klassifizierung von Medizinprodukten 8 Brustimplantate Gelenkersatz für Hüfte, Knie und Schulter Abschnitt 4: Übergangsbestimmungen 11 Übergangsbestimmungen für Gelenkersatz für Hüfte, Knie und Schulter Brustimplantate-Verordnung (BrustImplV) EG-Richtlinie 2003/12/EG zur Neuklassifizierung von Brustimplantaten Verordnung über Vertriebswege für Medizinprodukte (MPVertrV) mit Kommentierung Verordnung über die Verschreibungspflicht von Medizinprodukten (MPVerschrV) Medizinprodukte Durchführungsvorschrift (MPGVwV) Verordnung über Grundlegende Anforderungen bei Medizinprodukten zum Schutz vor TSE (MPG-TSE-Verordnung) DIMDI-Verordnung (DIMDIV) Bekanntmachung zur DIMDI-Verordnung Bekanntmachung der zuständigen Behörden für die Anzeigen von klinischen Prüfungen nach 20 Abs. 6 des MPG und Leistungsbewertungsprüfungen nach 24 Abs. 2 des MPG Zuständige Behörden für das erstmalige Inverkehrbringen von Medizinprodukten Zuständige Bundesbehörden für klinische Prüfungen/Leistungsbewertungsprüfungen Verordnung über klinische Prüfungen von Medizinprodukten und zur Änderung medizinprodukterechtlicher Vorschriften Europäisches Recht Neues europäisches Medizinprodukterecht im EU-Rechtsetzungsverfahren... vor EU-Verordnung über Medizinprodukte (Entwurf) EU-Verordnung über In-vitro-Diagnostika (Vorschlag) EG-Richtlinie 93/42/EWG über Medizinprodukte EG-Richtlinie 2005/50/EG zur Neuklassifizierung von Gelenkersatz für Hüfte, Knie und Schulter EG-Richtlinie 90/385/EWG über aktive implantierbare medizinische Geräte Benannte Stellen für Medizinprodukte Akkreditierte Prüflaboratorien für Medizinprodukte Europäische Kommission: Leitlinien für ein Medizinprodukte- Beobachtungs- und Meldesystem EG-Richtlinie 98/79/EG über In-vitro-Diagnostika
9 EG-Entscheidung (2002/364/EG) über Gemeinsame Technische Spezifikationen für In-vitro-Diagnostika Verordnung (EU) Nr. 722/2012 der Kommission über besondere Anforderungen betreffend die in der Richtlinie 90/385/EWG bzw. 93/42/EWG des Rates festgelegten Anforderungen an unter Verwendung von Gewebe tierischen Ursprungs hergestellte aktive implantierbare medizinische Geräte und Medizinprodukte EG-Verordnung Nr. 765/2008 über die Vorschriften die Akkreditierung und Marktüberwachung im Zusammenhang mit der Vermarktung von Produkten und zur Aufhebung der Verordnung EG-Beschluss Nr. 768/2008/EG für die Vermarktung von Produkten und zur Aufhebung des Beschlusses 93/465/EWG des Rates EG-Verordnung Nr. 2007/2006 zur Durchführung der Verordnung (EG) Nr. 1774/2002 hinsichtlich der Einfuhr und Durchfuhr bestimmter aus Material der Kategorie 3 gewonnener Zwischenerzeugnisse für technische Verwendungszwecke in Medizinprodukten, In-vitro-Diagnostika und Laborreagenzien sowie zur Änderung der genannten Verordnung Europäische Datenbank für Medizinprodukte (Eudamed) Verordnung (EU) Nr. 207/2012 Der Kommission vom 9. März 2012 über elektronische Gebrauchsanweisungen für Medizinprodukte Empfehlung der Kommission vom 5. April 2013 über einen gemeinsamen Rahmen für ein System einmaliger Produktkennzeichnung für Medizinprodukte in der Union Harmonisierte Normen gem. 3 Nr Medical-Devices (MEDDEV) empfehlende Leitlinien zur Auslegung der Medizinprodukterichtlinien Clinical Investigations: Serious Adverse Event Reporting under Directives 90/385/EEC and 93/42/EEC Guidelines on Clinical Investigation: A Guide for Manufacturers and Notified Bodies MEDDEV Verordnungen, Richtlinien und Bekanntmachungen über den Betrieb von Medizinprodukten Medizinprodukte-Betreiberverordnung (MPBetreibV) Stichwortverzeichnis (MPBetreibV) SMP 35. Erg.-Lfg. III.14 7
10 Abschnitt 1: Anwendungsbereich und allgemeine Vorschriften 1 Anwendungsbereich Allgemeine Anforderungen Meldungen von Vorkommnissen Instandhaltung a Qualitätssicherung in medizinischen Laboratorien a 1 Richtlinie der Bundesärztekammer zur Qualitätssicherung quantitativer laboratoriumsmedizinischer Untersuchungen Abschnitt 2: Spezielle Vorschriften für aktive Medizinprodukte 5 Betreiben und Anwendungen Sicherheitstechnische Kontrollen Medizinproduktebuch Bestandsverzeichnis Aufbewahrung der Gebrauchsanweisungen und der Medizinproduktebücher Patienteninformation bei aktiven implantierbaren Medizinprodukten Abschnitt 3: Medizinprodukte mit Meßfunktion 11 Messtechnische Kontrollen Abschnitt 4: Vorschriften für die Bundeswehr 12 Medizinprodukte der Bundeswehr Abschnitt 5: Ordnungswidrigkeiten 13 Ordnungswidrigkeiten Abschnitt 6: Übergangs- und Schlußbestimmungen 14 Übergangsbestimmungen Sondervorschriften Gerätebuch Verzeichnis medizinisch-technischer Geräte nach der MedGV Anlage Richtlinie der Bundesärztekammer zur Qualitätssicherung laboratoriumsmedizinischer Untersuchungen Anforderungen an die Hygiene bei der Aufbereitung von Medizinprodukten Empfehlung für die Überwachung der Aufbereitung von Medizinprodukten Rahmenbedingungen für ein einheitliches Verwaltungshandeln
11 Unfallverhütungsvorschriften, Richtlinien und Regeln TRBA 250 Biologische Arbeitsstoffe im Gesundheitswesen und in der Wohlfahrtspflege Eichordnung Leitfaden zu messtechnischen Kontrollen von Medizinprodukten mit Messfunktionen (LMKM) Verordnung zum Schutz der Beschäftigten vor Gefährdungen durch künstliche optische Strahlung (OStrV) TRGS 526 Laboratorien SMP 35. Erg.-Lfg. III.14 9
12 10
1.1 Inhaltsverzeichnis
 Verzeichnisse Inhaltsverzeichnis 1.1 1.1 Inhaltsverzeichnis 1 Verzeichnisse 1.1 Inhaltsverzeichnis 1.2 Herausgeber- und Autorenverzeichnis 1.3 Stichwortverzeichnis 2 Aktuelles 2.1 Änderungen des europäischen
Verzeichnisse Inhaltsverzeichnis 1.1 1.1 Inhaltsverzeichnis 1 Verzeichnisse 1.1 Inhaltsverzeichnis 1.2 Herausgeber- und Autorenverzeichnis 1.3 Stichwortverzeichnis 2 Aktuelles 2.1 Änderungen des europäischen
Alles tot geregelt im Medizinprodukterecht? Was möchte der Gesetzgeber erreichen? Was riskiere ich bei Nichtbeachtung?
 Alles tot geregelt im Medizinprodukterecht? Was möchte der Gesetzgeber erreichen? Was riskiere ich bei Nichtbeachtung? Ein Vortrag von Dipl.-Ing. Thomas J. Pleiss, öffentlich bestellter und vereidigter
Alles tot geregelt im Medizinprodukterecht? Was möchte der Gesetzgeber erreichen? Was riskiere ich bei Nichtbeachtung? Ein Vortrag von Dipl.-Ing. Thomas J. Pleiss, öffentlich bestellter und vereidigter
Sicherheitsvorschriften für Medizinprodukte
 Sicherheitsvorschriften für Medizinprodukte Kommentar zum MPG und zur MPBetreibV mit weiteren Vorschriften, Texten und Arbeitshilfen Begründet von Matthias Nöthlichs ehemals Ministerialdirigent im Bundesministerium
Sicherheitsvorschriften für Medizinprodukte Kommentar zum MPG und zur MPBetreibV mit weiteren Vorschriften, Texten und Arbeitshilfen Begründet von Matthias Nöthlichs ehemals Ministerialdirigent im Bundesministerium
Medizinproduktegesetz - MPG
 ecomed Medizin Medizinproduktegesetz - MPG Kommentierungen - Arbeitshilfen - Rechtstexte Bearbeitet von Manfred Kindler, Wolfgang Menke Grundwerk mit 19. Ergänzungslieferung 2015. Loseblatt. In 2 Ordnern
ecomed Medizin Medizinproduktegesetz - MPG Kommentierungen - Arbeitshilfen - Rechtstexte Bearbeitet von Manfred Kindler, Wolfgang Menke Grundwerk mit 19. Ergänzungslieferung 2015. Loseblatt. In 2 Ordnern
Abschnitt 1 Anwendungsbereich und Allgemeine Anforderungen an die Konformitätsbewertung 1 Anwendungsbereich
 13.06.2007 Verordnung über Medizinprodukte - (Medizinprodukte-Verordnung - MPV)* vom 20. Dezember 2001 (BGBl. I S. 3854), zuletzt geändert durch Artikel 1 der Verordnung vom 16. Februar 2007 (BGBl. I S.
13.06.2007 Verordnung über Medizinprodukte - (Medizinprodukte-Verordnung - MPV)* vom 20. Dezember 2001 (BGBl. I S. 3854), zuletzt geändert durch Artikel 1 der Verordnung vom 16. Februar 2007 (BGBl. I S.
Verordnung über Medizinprodukte (Medizinprodukte-Verordnung - MPV)
 Verordnung über Medizinprodukte (Medizinprodukte-Verordnung - MPV) Vom 20. Dezember 2001, BGBl. I S. 3854 geändert am 4. Dezember 2002, BGBl I S. 4456 zuletzt geändert am 13. Februar 2004, BGBl I S. 216
Verordnung über Medizinprodukte (Medizinprodukte-Verordnung - MPV) Vom 20. Dezember 2001, BGBl. I S. 3854 geändert am 4. Dezember 2002, BGBl I S. 4456 zuletzt geändert am 13. Februar 2004, BGBl I S. 216
Verordnung über Medizinprodukte (Medizinprodukte-Verordnung - MPV)
 05.07.2005 Verordnung über Medizinprodukte (Medizinprodukte-Verordnung - MPV) vom 20. Dezember 2001 (BGBl. I S. 3854), zuletzt geändert durch Artikel 1 der Verordnung vom 13. Februar 2004 (BGBl. I S. 216)
05.07.2005 Verordnung über Medizinprodukte (Medizinprodukte-Verordnung - MPV) vom 20. Dezember 2001 (BGBl. I S. 3854), zuletzt geändert durch Artikel 1 der Verordnung vom 13. Februar 2004 (BGBl. I S. 216)
Verordnung zur Änderung medizinprodukterechtlicher Vorschriften vom 16. Februar 2007
 26.02.2007 Verordnung zur Änderung medizinprodukterechtlicher Vorschriften vom 16. Februar 2007 Auf Grund des 37 Abs. 1, 9, 10 und 11 Satz 1 des Medizinproduktegesetzes in der Fassung der Bekanntmachung
26.02.2007 Verordnung zur Änderung medizinprodukterechtlicher Vorschriften vom 16. Februar 2007 Auf Grund des 37 Abs. 1, 9, 10 und 11 Satz 1 des Medizinproduktegesetzes in der Fassung der Bekanntmachung
Inhaltsverzeichnis. Vorwort...
 Vorwort... V A. Einleitung... 1 1 Grundsätzliches... 3 2 Rechtsgrundlagen... 3 3 Begriffsbestimmungen,Definitionen... 5 3.1 Medizinprodukt... 5 3.1.1 AktiveMedizinprodukte... 7 3.1.2 Sonderproblem: Software
Vorwort... V A. Einleitung... 1 1 Grundsätzliches... 3 2 Rechtsgrundlagen... 3 3 Begriffsbestimmungen,Definitionen... 5 3.1 Medizinprodukt... 5 3.1.1 AktiveMedizinprodukte... 7 3.1.2 Sonderproblem: Software
Verordnung über Medizinprodukte (Medizinprodukte-Verordnung - MPV)
 Verordnung über Medizinprodukte (Medizinprodukte-Verordnung - MPV) MPV Ausfertigungsdatum: 20.12.2001 Vollzitat: "Medizinprodukte-Verordnung vom 20. Dezember 2001 (BGBl. I S. 3854), die zuletzt durch Artikel
Verordnung über Medizinprodukte (Medizinprodukte-Verordnung - MPV) MPV Ausfertigungsdatum: 20.12.2001 Vollzitat: "Medizinprodukte-Verordnung vom 20. Dezember 2001 (BGBl. I S. 3854), die zuletzt durch Artikel
Verordnung über Medizinprodukte (Medizinprodukte- Verordnung - MPV)
 Verordnung über Medizinprodukte (Medizinprodukte- Verordnung - MPV) vom 20. Dezember 2001 (BGBl. I. S. 3854) Auf Grund des 37 Abs. 1, 8 und 11 des Medizinproduktegesetzes vom 2. August 1994 (BGBl. I. S.
Verordnung über Medizinprodukte (Medizinprodukte- Verordnung - MPV) vom 20. Dezember 2001 (BGBl. I. S. 3854) Auf Grund des 37 Abs. 1, 8 und 11 des Medizinproduktegesetzes vom 2. August 1994 (BGBl. I. S.
0.2 Inhalt des Gesamtwerks 1
 1 Band 1 Vorwort Blick in die Zukunft Was ändert sich für Hersteller von Medizinprodukten? Die neue Verordnung (EU) Nr. 2017/745 über Medizinprodukte 1 Einführung 2 Anwendungsfristen und Übergangsbestimmungen
1 Band 1 Vorwort Blick in die Zukunft Was ändert sich für Hersteller von Medizinprodukten? Die neue Verordnung (EU) Nr. 2017/745 über Medizinprodukte 1 Einführung 2 Anwendungsfristen und Übergangsbestimmungen
Keine CE-Kennzeichnung ohne klinische Bewertung
 Seite 1 von 5 Keine CE-Kennzeichnung ohne klinische Bewertung Medizinprodukte können in der Regel nicht ohne klinische Daten und deren Bewertung auf den Markt gelangen. Zudem besteht für Medizinprodukte
Seite 1 von 5 Keine CE-Kennzeichnung ohne klinische Bewertung Medizinprodukte können in der Regel nicht ohne klinische Daten und deren Bewertung auf den Markt gelangen. Zudem besteht für Medizinprodukte
BUNDESGESETZBLATT FÜR DIE REPUBLIK ÖSTERREICH. Jahrgang 2004 Ausgegeben am 28. Jänner 2004 Teil II
 1 von 5 BUNDESGESETZBLATT FÜR DIE REPUBLIK ÖSTERREICH Jahrgang 2004 Ausgegeben am 28. Jänner 2004 Teil II 57. Verordnung: Konformitätsbewertung von Medizinprodukten [CELEX-Nr.: 32000L0070, 32001L0104,
1 von 5 BUNDESGESETZBLATT FÜR DIE REPUBLIK ÖSTERREICH Jahrgang 2004 Ausgegeben am 28. Jänner 2004 Teil II 57. Verordnung: Konformitätsbewertung von Medizinprodukten [CELEX-Nr.: 32000L0070, 32001L0104,
Änderungen durch das Gesetz zur Änderung medizinprodukterechtlicher Vorschriften (29.07.2009)
 Anlage 2 zum DKG-Rundschreiben Nr. 277/2009 vom 13.08.2009 Änderungen durch das Gesetz zur Änderung medizinprodukterechtlicher Vorschriften (29.07.2009) I. Änderungen des Medizinproduktegesetzes (Artikel
Anlage 2 zum DKG-Rundschreiben Nr. 277/2009 vom 13.08.2009 Änderungen durch das Gesetz zur Änderung medizinprodukterechtlicher Vorschriften (29.07.2009) I. Änderungen des Medizinproduktegesetzes (Artikel
Entwurf eines Gesetzes zur Änderung medizinprodukterechtlicher Vorschriften
 Deutscher Bundestag Drucksache 16/12258 16. Wahlperiode 16. 03. 2009 Gesetzentwurf der Bundesregierung Entwurf eines Gesetzes zur Änderung medizinprodukterechtlicher Vorschriften A. Problem und Ziel DiesesGesetzdientvornehmlichderUmsetzungderRichtlinie2007/47/EGdes
Deutscher Bundestag Drucksache 16/12258 16. Wahlperiode 16. 03. 2009 Gesetzentwurf der Bundesregierung Entwurf eines Gesetzes zur Änderung medizinprodukterechtlicher Vorschriften A. Problem und Ziel DiesesGesetzdientvornehmlichderUmsetzungderRichtlinie2007/47/EGdes
Dietmar Kirchberg Das Medizinproduktegesetz: Was Pflegende wissen müssen Bestimmungen Beispiele Konsequenzen
 Dietmar Kirchberg Das Medizinproduktegesetz: Was Pflegende wissen müssen Bestimmungen Beispiele Konsequenzen Bibliografische Information der Deutschen Bibliothek Die Deutsche Bibliothek verzeichnet diese
Dietmar Kirchberg Das Medizinproduktegesetz: Was Pflegende wissen müssen Bestimmungen Beispiele Konsequenzen Bibliografische Information der Deutschen Bibliothek Die Deutsche Bibliothek verzeichnet diese
Verteilung der Verantwortlichkeiten zuvor, Anzeigeverfahren
 Das BfArM ist ein Bundesinstitut im Geschäftsbereich des Bundesministeriums für Gesundheit 1 Verteilung der Verantwortlichkeiten zuvor, Anzeigeverfahren Politische Ebene Bundesbehörden Ministerien, insbesondere
Das BfArM ist ein Bundesinstitut im Geschäftsbereich des Bundesministeriums für Gesundheit 1 Verteilung der Verantwortlichkeiten zuvor, Anzeigeverfahren Politische Ebene Bundesbehörden Ministerien, insbesondere
8.5. Medizinproduktegesetz
 8.5. Medizinproduktegesetz 1 Zweck des Gesetzes http://bundesrecht.juris.de/bundesrecht/mpg/ 3 Begriffsbestimmungen Zweck dieses Gesetzes ist es, den Verkehr mit Medizinprodukten zu regeln und dadurch
8.5. Medizinproduktegesetz 1 Zweck des Gesetzes http://bundesrecht.juris.de/bundesrecht/mpg/ 3 Begriffsbestimmungen Zweck dieses Gesetzes ist es, den Verkehr mit Medizinprodukten zu regeln und dadurch
Anforderungen der Medizinprodukte- Richtlinie an die Entwicklung von Medizinprodukten
 Anforderungen der Medizinprodukte- Richtlinie an die Entwicklung von Medizinprodukten Alexander Fink Hochschule Mannheim SS 2013 A. Fink Seite 1 Steigen wir ein Wo und wie kommt der Medizintechnik-Ingenieur
Anforderungen der Medizinprodukte- Richtlinie an die Entwicklung von Medizinprodukten Alexander Fink Hochschule Mannheim SS 2013 A. Fink Seite 1 Steigen wir ein Wo und wie kommt der Medizintechnik-Ingenieur
Medizinprodukte-Sicherheitsplanverordnung
 Hygieneforum Sande 19.06.2014 Meldung von Vorkommnissen nach der Medizinproduke-Sicherheitsplanverordnung www.klinikum-bremen-ldw.de Klinikum Links der Weser Senator-Weßling-Str. 1 28277 Bremen Meldung
Hygieneforum Sande 19.06.2014 Meldung von Vorkommnissen nach der Medizinproduke-Sicherheitsplanverordnung www.klinikum-bremen-ldw.de Klinikum Links der Weser Senator-Weßling-Str. 1 28277 Bremen Meldung
Aufgaben der MP-Berater und Sicherheitsbeauftragten im Medizinprodukte-Beobachtungs- und Meldesystem
 Aufgaben der MP-Berater und Sicherheitsbeauftragten im Medizinprodukte-Beobachtungs- und Meldesystem Referent: Ralf Kitschmann Seite 1/ 09-2009 30 MPG*, Sicherheitsbeauftragter für Medizinprodukte * Achtung:
Aufgaben der MP-Berater und Sicherheitsbeauftragten im Medizinprodukte-Beobachtungs- und Meldesystem Referent: Ralf Kitschmann Seite 1/ 09-2009 30 MPG*, Sicherheitsbeauftragter für Medizinprodukte * Achtung:
Anlagen- und Betriebssicherheit
 Anlagen- und Betriebssicherheit Kommentar zur Betriebssicherheitsverordnung mit Technischen Regeln und Textsammlung von Hatto Mattes Ministerialrat im Bundesministerium für Wirtschaft und Technologie Ralph
Anlagen- und Betriebssicherheit Kommentar zur Betriebssicherheitsverordnung mit Technischen Regeln und Textsammlung von Hatto Mattes Ministerialrat im Bundesministerium für Wirtschaft und Technologie Ralph
Warum? Orthopäden; 5336. Dermatologen; 3342. Urologen; 2674. Chirurgen; 3976. Neurochirurgen; 491. Gynäkologen; 9875
 Können Medizinprodukte ohne CE-Kennzeichnung betrieben werden? Warum? Urologen; 2674 Neurochirurgen; 491 MKG; 1027 Allgemeinärzte/ praktische Ärzte; 40.246 Orthopäden; 5336 Chirurgen; 3976 Anästhesisten;
Können Medizinprodukte ohne CE-Kennzeichnung betrieben werden? Warum? Urologen; 2674 Neurochirurgen; 491 MKG; 1027 Allgemeinärzte/ praktische Ärzte; 40.246 Orthopäden; 5336 Chirurgen; 3976 Anästhesisten;
Explosionsschutz. Kommentar zur ExVo und BetrSichV
 Explosionsschutz Kommentar zur ExVo und BetrSichV Begründet von Wolfram Jeiter Präsident und Professor der Bundesanstalt für Arbeitsschutz und Arbeitsmedizin a. D. Matthias Nöthlichs ehemals Ministerialdirigent
Explosionsschutz Kommentar zur ExVo und BetrSichV Begründet von Wolfram Jeiter Präsident und Professor der Bundesanstalt für Arbeitsschutz und Arbeitsmedizin a. D. Matthias Nöthlichs ehemals Ministerialdirigent
Die Risiken von morgen: Anpassungen der EG-Richtlinien und ihre Folgen
 Die Risiken von morgen: Anpassungen der EG-Richtlinien und ihre Folgen Risiken erkennen, minimieren, finanzieren heute und morgen SAQ Fachgruppe Medizinprodukte Hersteller, 22.3.2007, Zofingen Monika Gattiker
Die Risiken von morgen: Anpassungen der EG-Richtlinien und ihre Folgen Risiken erkennen, minimieren, finanzieren heute und morgen SAQ Fachgruppe Medizinprodukte Hersteller, 22.3.2007, Zofingen Monika Gattiker
für die Aufbereitung von Medizinprodukten
 Die Bedeutung der Biokompatibilität für die Aufbereitung von Medizinprodukten Dr.-Ing. Ute Müller, Geschäftsführer BMP Labor für medizinische Materialprüfung GmbH, Aachen Inhalt Einordnung der Biokompatibilität
Die Bedeutung der Biokompatibilität für die Aufbereitung von Medizinprodukten Dr.-Ing. Ute Müller, Geschäftsführer BMP Labor für medizinische Materialprüfung GmbH, Aachen Inhalt Einordnung der Biokompatibilität
Verordnung über die Erfassung, Bewertung und Abwehr von Risiken bei Medizinprodukten (Medizinprodukte-Sicherheitsplanverordnung - MPSV)
 Verordnung über die Erfassung, Bewertung und Abwehr von Risiken bei Medizinprodukten (Medizinprodukte-Sicherheitsplanverordnung - MPSV) vom 24. Juni 2002 (BGBl. I S. 2131) Auf Grund des 37 Abs. 2, 5, 7
Verordnung über die Erfassung, Bewertung und Abwehr von Risiken bei Medizinprodukten (Medizinprodukte-Sicherheitsplanverordnung - MPSV) vom 24. Juni 2002 (BGBl. I S. 2131) Auf Grund des 37 Abs. 2, 5, 7
Erstes Kapitel: Einleitung 15
 Erstes Kapitel: Einleitung 15 A. Problemstellung 15 I. Relevanz von Medizinprodukten für die Gesundheitsversorgung 15 II. Zunehmende Verbreitung von medizinischen Einmalprodukten 17 III. Grundidee der
Erstes Kapitel: Einleitung 15 A. Problemstellung 15 I. Relevanz von Medizinprodukten für die Gesundheitsversorgung 15 II. Zunehmende Verbreitung von medizinischen Einmalprodukten 17 III. Grundidee der
Medizinprodukte recht und Apothekenbetriebsordnung
 Medizinprodukte recht und Apothekenbetriebsordnung Rechtstexte mit Einffihrang und Erläuterungen Von Dr. Gert Schorn, Meckenheim/Bonn Regierungsdirektor im Bundesministerium für Gesundheit I &O 1 Deutscher
Medizinprodukte recht und Apothekenbetriebsordnung Rechtstexte mit Einffihrang und Erläuterungen Von Dr. Gert Schorn, Meckenheim/Bonn Regierungsdirektor im Bundesministerium für Gesundheit I &O 1 Deutscher
Inhaltsverzeichnis. Inhaltsverzeichnis. Inhaltsübersicht. Rechtliche Grundlagen des Medizinprodukterechts 1
 Inhaltsverzeichnis Vorwort Inhaltsübersicht III X Rechtliche Grundlagen des Medizinprodukterechts 1 Richtlinie über Medizinprodukte 1 Rechtliche Grundlagen in der Europäischen Union (EU) 1 Rechtliche Grundlagen
Inhaltsverzeichnis Vorwort Inhaltsübersicht III X Rechtliche Grundlagen des Medizinprodukterechts 1 Richtlinie über Medizinprodukte 1 Rechtliche Grundlagen in der Europäischen Union (EU) 1 Rechtliche Grundlagen
Zweites Gesetz zur Änderung des Medizinproduktegesetzes (2. MPG-ÄndG)
 Zweites Gesetz zur Änderung des Medizinproduktegesetzes (2. MPG-ÄndG) Der Bundestag hat mit Zustimmung des Bundesrates das folgende Gesetz beschlossen: Artikel 1 Änderung des Medizinproduktegesetzes Das
Zweites Gesetz zur Änderung des Medizinproduktegesetzes (2. MPG-ÄndG) Der Bundestag hat mit Zustimmung des Bundesrates das folgende Gesetz beschlossen: Artikel 1 Änderung des Medizinproduktegesetzes Das
Gesetz über Medizinprodukte
 Ein Service der juris GmbH - www.juris.de - Seite 1 Gesetz über Medizinprodukte Datum: 2. August 1994 Fundstelle: BGBl I 1994, 1963 Textnachweis ab: 10. 8.1994 Amtliche Hinweise des Normgebers auf EG-Recht:
Ein Service der juris GmbH - www.juris.de - Seite 1 Gesetz über Medizinprodukte Datum: 2. August 1994 Fundstelle: BGBl I 1994, 1963 Textnachweis ab: 10. 8.1994 Amtliche Hinweise des Normgebers auf EG-Recht:
9.5 Medizinprodukte-Betreiberverordnung - MPBetreibV
 9.5 -Betreiberverordnung - MPBetreibV Die -Betreiberverordnung (MPBetreibV) regelt das Errichten, Betreiben und Anwenden von n und von Zubehör für. Zubehör sind Gegenstände, Stoffe, Zubereitungen aus Stoffen
9.5 -Betreiberverordnung - MPBetreibV Die -Betreiberverordnung (MPBetreibV) regelt das Errichten, Betreiben und Anwenden von n und von Zubehör für. Zubehör sind Gegenstände, Stoffe, Zubereitungen aus Stoffen
Arbeitsschutz und Arbeitssicherheit
 Arbeitsschutz und Arbeitssicherheit Ergånzbarer Kommentar zum Arbeitsschutzgesetz und zum Arbeitssicherheitsgesetz von Horst Peter Weber Ltd. Ministerialrat a. D. im Bayerischen Staatsministerium fuè r
Arbeitsschutz und Arbeitssicherheit Ergånzbarer Kommentar zum Arbeitsschutzgesetz und zum Arbeitssicherheitsgesetz von Horst Peter Weber Ltd. Ministerialrat a. D. im Bayerischen Staatsministerium fuè r
Selbstverwaltungsrecht der Sozialversicherung
 Selbstverwaltungsrecht der Sozialversicherung Kommentar von CLEMENS BECHER Ministerialrat a.d. FRANK PLATE Ministerialdirigent im Bundesministerium für Familie, Senioren, Frauen und Jugend SVS/27. Lfg.
Selbstverwaltungsrecht der Sozialversicherung Kommentar von CLEMENS BECHER Ministerialrat a.d. FRANK PLATE Ministerialdirigent im Bundesministerium für Familie, Senioren, Frauen und Jugend SVS/27. Lfg.
Anwendungsbereiche von Rechtsvorschriften
 Kapitel 26.11.2007 10:04 Uhr Seite 1 /1 Übersicht Wenn Rechtsvorschriften Regelungen für Medizinprodukte enthalten, so bedeutet dies noch nichts für ihre Verbindlichkeit. Maßgeblich ist, von welcher Personengruppe
Kapitel 26.11.2007 10:04 Uhr Seite 1 /1 Übersicht Wenn Rechtsvorschriften Regelungen für Medizinprodukte enthalten, so bedeutet dies noch nichts für ihre Verbindlichkeit. Maßgeblich ist, von welcher Personengruppe
Verordnung über das Errichten, Betreiben und Anwenden von Medizinprodukten (Medizinprodukte-Betreiberverordnung MP BetreibV)
 Z A H N Ä R Z T E K A M M E R B R E M E N KÖRPERSCHAFT DES ÖFFENTLICHEN RECHTS Verordnung über das Errichten, Betreiben und Anwenden von Medizinprodukten (Medizinprodukte-Betreiberverordnung MP BetreibV)
Z A H N Ä R Z T E K A M M E R B R E M E N KÖRPERSCHAFT DES ÖFFENTLICHEN RECHTS Verordnung über das Errichten, Betreiben und Anwenden von Medizinprodukten (Medizinprodukte-Betreiberverordnung MP BetreibV)
TÜV Rheinland Consulting GmbH. TÜV Rheinland Consulting GmbH Das neue Produktsicherheitsgesetz ProdSG
 TÜV Rheinland Consulting GmbH TÜV Rheinland Consulting GmbH Das neue Produktsicherheitsgesetz ProdSG Gesetz über die Bereitstellung von Produkten auf dem Markt Produktsicherheitsgesetz ProdSG in Kraft
TÜV Rheinland Consulting GmbH TÜV Rheinland Consulting GmbH Das neue Produktsicherheitsgesetz ProdSG Gesetz über die Bereitstellung von Produkten auf dem Markt Produktsicherheitsgesetz ProdSG in Kraft
Zertifizierung des QM-Systems bei der Aufbereitung von Kritisch-C Produkten
 Christian Witte Zertifizierung des QM-Systems bei der Aufbereitung von Kritisch-C Produkten Zur aktuellen Differenz zwischen MPBetreibV und KRINKO/BfArM-Empfehlung Verordnung über die Änderung der MPBetreibV
Christian Witte Zertifizierung des QM-Systems bei der Aufbereitung von Kritisch-C Produkten Zur aktuellen Differenz zwischen MPBetreibV und KRINKO/BfArM-Empfehlung Verordnung über die Änderung der MPBetreibV
Regulatorische Anforderungen an die Entwicklung von Medizinprodukten
 Regulatorische Anforderungen an die Entwicklung von Medizinprodukten Alexander Fink, Metecon GmbH Institut für Medizintechnik Reutlingen University Alteburgstraße 150 D-72762 Reutlingen Reutlingen, 04.03.2015
Regulatorische Anforderungen an die Entwicklung von Medizinprodukten Alexander Fink, Metecon GmbH Institut für Medizintechnik Reutlingen University Alteburgstraße 150 D-72762 Reutlingen Reutlingen, 04.03.2015
Wesentliche Inhalte des Geräte- und Produktsicherheitsgesetzes
 Wesentliche Inhalte des Geräte- und Produktsicherheitsgesetzes (GPSG) 16. März 2005 Tag der Arbeitssicherheit, Fellbach Rüdiger BGZ Gliederung Anforderungen an an Hersteller und Produkte Verbraucherschutz
Wesentliche Inhalte des Geräte- und Produktsicherheitsgesetzes (GPSG) 16. März 2005 Tag der Arbeitssicherheit, Fellbach Rüdiger BGZ Gliederung Anforderungen an an Hersteller und Produkte Verbraucherschutz
Medizinproduktebuch gemäß 7 MPBetreibV
 1 Stand: 12/2010 Inhalt 1 Vorwort 3 2 Bestandsverzeichnis 4 3 Geräte-Stammdaten 5 4 Funktionsprüfung und erstmalige Geräteeinweisung 6 4.1 Funktionsprüfung 6 4.2 Geräteeinweisung der vom Betreiber beauftragten
1 Stand: 12/2010 Inhalt 1 Vorwort 3 2 Bestandsverzeichnis 4 3 Geräte-Stammdaten 5 4 Funktionsprüfung und erstmalige Geräteeinweisung 6 4.1 Funktionsprüfung 6 4.2 Geräteeinweisung der vom Betreiber beauftragten
Arzneimittel Rezeptprüfung, Beratung und Regress
 Arzneimittel Rezeptprüfung, Beratung und Regress Ergänzbares Handbuch für Krankenkassen, Ärzte, Apotheker und Arzneimittelhersteller Von Dr. Werner Gerdelmann Diplom-Kaufmann Birger Rostalski Apotheker
Arzneimittel Rezeptprüfung, Beratung und Regress Ergänzbares Handbuch für Krankenkassen, Ärzte, Apotheker und Arzneimittelhersteller Von Dr. Werner Gerdelmann Diplom-Kaufmann Birger Rostalski Apotheker
Aktuelles aus dem Medizinprodukterecht
 KANZLEI DR. JÄKEL MEDIZINRECHT ARZNEIMITTELRECHT MEDIZINPRODUKTERECHT IN KOOPERATION MIT BERLIN DÜSSELDORF Aktuelles aus dem Medizinprodukterecht DGSV-Kongress 2014 Fulda 09.10.2014 Inhalt 1. AUSBLICK
KANZLEI DR. JÄKEL MEDIZINRECHT ARZNEIMITTELRECHT MEDIZINPRODUKTERECHT IN KOOPERATION MIT BERLIN DÜSSELDORF Aktuelles aus dem Medizinprodukterecht DGSV-Kongress 2014 Fulda 09.10.2014 Inhalt 1. AUSBLICK
Lukas Hechl. Bilanzrechtliche Probleme des Jahresabschlusses einer GmbH & Co KG. Diplomica Verlag
 Lukas Hechl Bilanzrechtliche Probleme des Jahresabschlusses einer GmbH & Co KG Diplomica Verlag Lukas Hechl Bilanzrechtliche Probleme des Jahresabschlusses einer GmbH & Co KG ISBN: 978-3-8428-3178-0 Herstellung:
Lukas Hechl Bilanzrechtliche Probleme des Jahresabschlusses einer GmbH & Co KG Diplomica Verlag Lukas Hechl Bilanzrechtliche Probleme des Jahresabschlusses einer GmbH & Co KG ISBN: 978-3-8428-3178-0 Herstellung:
Medizingeräte-Information 42/06
 Gewerbeaufsicht Medizingeräte-Information 42/06 Medizingeräte Aktion 2005 Überprüfung des sicherheitstechnischen Zustandes von aktiven, nicht implantierbaren Medizinprodukten bei HNO-Ärzten Impressum Herausgeber:
Gewerbeaufsicht Medizingeräte-Information 42/06 Medizingeräte Aktion 2005 Überprüfung des sicherheitstechnischen Zustandes von aktiven, nicht implantierbaren Medizinprodukten bei HNO-Ärzten Impressum Herausgeber:
Handbuch Kundenmanagement
 Handbuch Kundenmanagement Armin Töpfer (Herausgeber) Handbuch Kundenmanagement Anforderungen, Prozesse, Zufriedenheit, Bindung und Wert von Kunden Dritte, vollständig überarbeitete und erweiterte Auflage
Handbuch Kundenmanagement Armin Töpfer (Herausgeber) Handbuch Kundenmanagement Anforderungen, Prozesse, Zufriedenheit, Bindung und Wert von Kunden Dritte, vollständig überarbeitete und erweiterte Auflage
Wie ethisches Handeln Wettbewerbsvorteile schafft. James Bruton. Unternehmensstrategie. und Verantwortung
 James Bruton Unternehmensstrategie und Verantwortung Wie ethisches Handeln Wettbewerbsvorteile schafft Leseprobe, mehr zum Buch unter ESV.info/978 3 503 13001 6 ES erich schmidt verlag Unternehmensstrategie
James Bruton Unternehmensstrategie und Verantwortung Wie ethisches Handeln Wettbewerbsvorteile schafft Leseprobe, mehr zum Buch unter ESV.info/978 3 503 13001 6 ES erich schmidt verlag Unternehmensstrategie
Rüdiger Zarnekow Lutz Kolbe. Green IT. Erkenntnisse und Best Practices aus Fallstudien
 Rüdiger Zarnekow Lutz Kolbe Green IT Erkenntnisse und Best Practices aus Fallstudien Green IT Rüdiger Zarnekow Lutz Kolbe Green IT Erkenntnisse und Best Practices aus Fallstudien Rüdiger Zarnekow Fachgebiet
Rüdiger Zarnekow Lutz Kolbe Green IT Erkenntnisse und Best Practices aus Fallstudien Green IT Rüdiger Zarnekow Lutz Kolbe Green IT Erkenntnisse und Best Practices aus Fallstudien Rüdiger Zarnekow Fachgebiet
Kompakt: Anforderungen an Medizinprodukte, 01.12.2016 in Wiesbaden
 Kompakt: Anforderungen an Medizinprodukte, 01.12.2016 in Wiesbaden Ausblick auf die neue EU-Verordnung Überblick und Zusammenhänge der Regelwerke Weg zum CE-Kennzeichen Grundlagen für Verantwortliche und
Kompakt: Anforderungen an Medizinprodukte, 01.12.2016 in Wiesbaden Ausblick auf die neue EU-Verordnung Überblick und Zusammenhänge der Regelwerke Weg zum CE-Kennzeichen Grundlagen für Verantwortliche und
EUROPÄISCHE KOMMISSION
 24.1.2013 Amtsblatt der Europäischen Union C 22/1 IV (Informationen) INFORMATIONEN DER ORGANE, EINRICHTUNGEN UND SONSTIGEN STELLEN DER EUROPÄISCHEN UNION EUROPÄISCHE KOMMISSION Mitteilung der Kommission
24.1.2013 Amtsblatt der Europäischen Union C 22/1 IV (Informationen) INFORMATIONEN DER ORGANE, EINRICHTUNGEN UND SONSTIGEN STELLEN DER EUROPÄISCHEN UNION EUROPÄISCHE KOMMISSION Mitteilung der Kommission
(Veröffentlichung der Titel und der Bezugsnummern der harmonisierten Normen im Sinne der Harmonisierungsrechtsvorschriften
 C 14/36 DE Amtsblatt der Europäischen Union 16.1.2015 Mitteilung der Kommission im Rahmen der Durchführung der Richtlinie 90/385/EWG des Rates vom 20. Juni 1990 zur Angleichung der Rechtsvorschriften der
C 14/36 DE Amtsblatt der Europäischen Union 16.1.2015 Mitteilung der Kommission im Rahmen der Durchführung der Richtlinie 90/385/EWG des Rates vom 20. Juni 1990 zur Angleichung der Rechtsvorschriften der
Baustellenverordnung. Verordnung über Sicherheit und Gesundheitsschutz auf Baustellen. Bestell-Nr.: BaustellV Gültig ab 1.
 ... q Verordnung über Sicherheit und Gesundheitsschutz auf Baustellen Baustellenverordnung Bestell-Nr.: BaustellV Gültig ab 1. Juli 1998 Achtung, diese Vorschrift kann nicht über die Süddeutsche Metall-Berufsgenossenschaft
... q Verordnung über Sicherheit und Gesundheitsschutz auf Baustellen Baustellenverordnung Bestell-Nr.: BaustellV Gültig ab 1. Juli 1998 Achtung, diese Vorschrift kann nicht über die Süddeutsche Metall-Berufsgenossenschaft
Öffentliche Unternehmen
 Diplomica Verlag Reihe Unternehmensformen Band 10 Dirk Noll Öffentliche Unternehmen Optimierungsmöglichkeiten durch die Wahl der Rechtsform und Organisation Noll, Dirk: Öffentliche Unternehmen: Optimierungsmöglichkeiten
Diplomica Verlag Reihe Unternehmensformen Band 10 Dirk Noll Öffentliche Unternehmen Optimierungsmöglichkeiten durch die Wahl der Rechtsform und Organisation Noll, Dirk: Öffentliche Unternehmen: Optimierungsmöglichkeiten
zum Entwurf eines Gesetzes zur Änderung des Berufskraftfahrer-Qualifikations-Gesetzes
 Breitenbachstraße 1, 60487 Frankfurt am Main Telefon: (069) 7919-0 Telefax: (069) 7919-227 bgl@bgl-ev.de www.bgl-ev.de Stellungnahme zum Entwurf eines Gesetzes zur Änderung des Berufskraftfahrer-Qualifikations-Gesetzes
Breitenbachstraße 1, 60487 Frankfurt am Main Telefon: (069) 7919-0 Telefax: (069) 7919-227 bgl@bgl-ev.de www.bgl-ev.de Stellungnahme zum Entwurf eines Gesetzes zur Änderung des Berufskraftfahrer-Qualifikations-Gesetzes
Verordnung über klinische Prüfungen von Medizinprodukten (MPKPV)
 Verordnung über klinische Prüfungen von Medizinprodukten (MPKPV) MPKPV Ausfertigungsdatum: 10.05.2010 Vollzitat: "Verordnung über klinische Prüfungen von Medizinprodukten vom 10. Mai 2010 (BGBl. I S. 555),
Verordnung über klinische Prüfungen von Medizinprodukten (MPKPV) MPKPV Ausfertigungsdatum: 10.05.2010 Vollzitat: "Verordnung über klinische Prüfungen von Medizinprodukten vom 10. Mai 2010 (BGBl. I S. 555),
Kompakt: Anforderungen an Medizinprodukte, 26.04.2016 in Unna bei Dortmund
 Kompakt: Anforderungen an Medizinprodukte, 26.04.2016 in Unna bei Dortmund Ausblick auf die neue EU-Verordnung Überblick und Zusammenhänge der Regelwerke Weg zum CE-Kennzeichen Grundlagen für Verantwortliche
Kompakt: Anforderungen an Medizinprodukte, 26.04.2016 in Unna bei Dortmund Ausblick auf die neue EU-Verordnung Überblick und Zusammenhänge der Regelwerke Weg zum CE-Kennzeichen Grundlagen für Verantwortliche
Inhaltsverzeichnis. Ordner 1. Inhaltsverzeichnis. Vorwort. Wegweiser. Inhaltsverzeichnis. Stichwortverzeichnis. 1 Rechtsvorschriften
 Inhaltsverzeichnis Ordner 1 Vorwort Wegweiser Inhaltsverzeichnis Stichwortverzeichnis 1 Rechtsvorschriften 1.0 Gesetz über die Durchführung von Maßnahmen des Arbeitsschutzes zur Verbesserung der Sicherheit
Inhaltsverzeichnis Ordner 1 Vorwort Wegweiser Inhaltsverzeichnis Stichwortverzeichnis 1 Rechtsvorschriften 1.0 Gesetz über die Durchführung von Maßnahmen des Arbeitsschutzes zur Verbesserung der Sicherheit
Klinische Prüfungen mit Medizinprodukten
 1 Klinische Prüfungen mit Medizinprodukten Klinische Studienzentrale (CSC) Antje Wiede 2 Überblick Begriffe relevante Regularien und Gesetze GCP bei KP mit Medizinprodukten Antragstellung und Genehmigung
1 Klinische Prüfungen mit Medizinprodukten Klinische Studienzentrale (CSC) Antje Wiede 2 Überblick Begriffe relevante Regularien und Gesetze GCP bei KP mit Medizinprodukten Antragstellung und Genehmigung
Haushaltsrecht der Sozialversicherung
 Haushaltsrecht der Sozialversicherung Haushaltsaufstellung Haushaltsführung Rechnungslegung Begründet von Dr. jur. Hubert Brandts Hauptgeschäftsführer der Bergbau-Berufsgenossenschaft a. D. Dr. jur. Rüdiger
Haushaltsrecht der Sozialversicherung Haushaltsaufstellung Haushaltsführung Rechnungslegung Begründet von Dr. jur. Hubert Brandts Hauptgeschäftsführer der Bergbau-Berufsgenossenschaft a. D. Dr. jur. Rüdiger
Medizinische Grundlagen der Heilpädagogik
 Thomas Hülshoff Medizinische Grundlagen der Heilpädagogik 3., überarbeitete Auflage Mit 18 Abbildungen, 2 Tabellen und 34 Übungsfragen Ernst Reinhardt Verlag München Basel Prof. Dr. med. Thomas Hülshoff
Thomas Hülshoff Medizinische Grundlagen der Heilpädagogik 3., überarbeitete Auflage Mit 18 Abbildungen, 2 Tabellen und 34 Übungsfragen Ernst Reinhardt Verlag München Basel Prof. Dr. med. Thomas Hülshoff
Selbstverwaltungsrecht der Sozialversicherung
 Selbstverwaltungsrecht der Sozialversicherung Kommentar von CLEMENS BECHER Ministerialrat a.d. FRANK PLATE Ministerialrat im Bundesministerium für Familie, Senioren, Frauen und Jugend SVS/23. Lfg. IV/11
Selbstverwaltungsrecht der Sozialversicherung Kommentar von CLEMENS BECHER Ministerialrat a.d. FRANK PLATE Ministerialrat im Bundesministerium für Familie, Senioren, Frauen und Jugend SVS/23. Lfg. IV/11
Inhaltsverzeichnis. Ingolf Friederici. Produktkonformität. Grundlagen der DIN EN 10204 und anderer Konformitätsdokumente ISBN: 978-3-446-42181-3
 Inhaltsverzeichnis Ingolf Friederici Produktkonformität Grundlagen der DIN EN 10204 und anderer Konformitätsdokumente ISBN: 978-3-446-42181-3 Weitere Informationen oder Bestellungen unter http://www.hanser.de/978-3-446-42181-3
Inhaltsverzeichnis Ingolf Friederici Produktkonformität Grundlagen der DIN EN 10204 und anderer Konformitätsdokumente ISBN: 978-3-446-42181-3 Weitere Informationen oder Bestellungen unter http://www.hanser.de/978-3-446-42181-3
Verlagerung der Buchführung ins Ausland. 146 Abs. 2a AO
 Verlagerung der Buchführung ins Ausland 146 Abs. 2a AO Neufassung i.r. des JStG 2010 vereinfachende, entschlackende Regelungen praktikabel bei Nachweispflichten und Überprüfungsmöglichkeiten Stand der
Verlagerung der Buchführung ins Ausland 146 Abs. 2a AO Neufassung i.r. des JStG 2010 vereinfachende, entschlackende Regelungen praktikabel bei Nachweispflichten und Überprüfungsmöglichkeiten Stand der
Fachwörterbuch Sozialrecht und Arbeitsschutz
 Fachwörterbuch Sozialrecht und Arbeitsschutz Deutsch Englisch Französisch Italienisch Mit Internationaler Systematik der wirtschaftlichen Tätigkeiten und deutscher, britischer, französischer und italienischer
Fachwörterbuch Sozialrecht und Arbeitsschutz Deutsch Englisch Französisch Italienisch Mit Internationaler Systematik der wirtschaftlichen Tätigkeiten und deutscher, britischer, französischer und italienischer
Allgemeines Gleichbehandlungsgesetz (AGG)
 Allgemeines Gleichbehandlungsgesetz (AGG) Die Umsetzung des AGG im Betrieb mit Handlungsempfehlungen für die Praxis von Bernhard Steinkühler Rechtsanwalt Fachanwalt für Arbeitsrecht Berlin ERICH SCHMIDT
Allgemeines Gleichbehandlungsgesetz (AGG) Die Umsetzung des AGG im Betrieb mit Handlungsempfehlungen für die Praxis von Bernhard Steinkühler Rechtsanwalt Fachanwalt für Arbeitsrecht Berlin ERICH SCHMIDT
Medizinprodukte-Sicherheitsplanverordnung MPSV
 Medizinprodukte-Sicherheitsplanverordnung MPSV Verordnung über die Erfassung, Bewertung und Abwehr von Risiken bei Medizinprodukten vom 24. Juni 2002 (BGBI. I S. 2131) Auf Grund des 37 Abs. 2, 5, 7 und
Medizinprodukte-Sicherheitsplanverordnung MPSV Verordnung über die Erfassung, Bewertung und Abwehr von Risiken bei Medizinprodukten vom 24. Juni 2002 (BGBI. I S. 2131) Auf Grund des 37 Abs. 2, 5, 7 und
DIIR-SCHRIFTENREIHE. Band 43
 DIIR-SCHRIFTENREIHE Band 43 Zusammenarbeit der Internen Revision mit Risikocontrolling und Compliance Empfehlungen auf Basis der MaRisk VA Erarbeitet von Mitgliedern des Arbeitskreises Interne Revision
DIIR-SCHRIFTENREIHE Band 43 Zusammenarbeit der Internen Revision mit Risikocontrolling und Compliance Empfehlungen auf Basis der MaRisk VA Erarbeitet von Mitgliedern des Arbeitskreises Interne Revision
Ingenieurwissenschaftliche Studiengänge attraktiver
 Wibke Derboven Gabriele Winker Ingenieurwissenschaftliche Studiengänge attraktiver chläge für Hochschulen 4lJ Springer ieurwissenschaftliche Studiengänge ttver gestalten fegmnisü^e üilivchültät DAiiiviSTAÖT
Wibke Derboven Gabriele Winker Ingenieurwissenschaftliche Studiengänge attraktiver chläge für Hochschulen 4lJ Springer ieurwissenschaftliche Studiengänge ttver gestalten fegmnisü^e üilivchültät DAiiiviSTAÖT
POCKET POWER. Wissensmanagement. 4. Auflage
 POCKET POWER Wissensmanagement 4. Auflage Der Herausgeber Prof. Dr.-Ing. Gerd F. Kamiske, ehemals Leiter der Qualitätssicherung im Volkswagenwerk Wolfsburg und Universitätsprofessor für Quali - täts wissenschaft
POCKET POWER Wissensmanagement 4. Auflage Der Herausgeber Prof. Dr.-Ing. Gerd F. Kamiske, ehemals Leiter der Qualitätssicherung im Volkswagenwerk Wolfsburg und Universitätsprofessor für Quali - täts wissenschaft
Praktische Erfahrungen bei der Kontrolle der Aufbereitung von Medizinprodukten. Andreas Modes
 Praktische Erfahrungen bei der Kontrolle der Aufbereitung von Medizinprodukten Andreas Modes Landesdirektion Dresden Abteilung Arbeitsschutz Mail: andreas.modes@ldd.sachsen.de Tel.: 0375/3903282 Fax: 0375/3903220
Praktische Erfahrungen bei der Kontrolle der Aufbereitung von Medizinprodukten Andreas Modes Landesdirektion Dresden Abteilung Arbeitsschutz Mail: andreas.modes@ldd.sachsen.de Tel.: 0375/3903282 Fax: 0375/3903220
Unterweisungsmodul. Medizinprodukte
 Unterweisungsmodul Medizinprodukte Unterweisungsinhalte - Beispiele Rechtliche Grundlagen Was ist in der Praxis wichtig? Was heißt aktives Medizinprodukt? Aufgaben Prüfpflichten Bestandsverzeichnis Medizinproduktebuch
Unterweisungsmodul Medizinprodukte Unterweisungsinhalte - Beispiele Rechtliche Grundlagen Was ist in der Praxis wichtig? Was heißt aktives Medizinprodukt? Aufgaben Prüfpflichten Bestandsverzeichnis Medizinproduktebuch
Änderungen der MPBetreibV 2014
 Änderungen der MPBetreibV 2014 3 Instandhaltung von Medizinprodukten (1) Die Instandhaltung von Medizinprodukten umfasst insbesondere Instandhaltungsmaßnahmen und die Instandsetzung. Instandhaltungsmaßnahmen
Änderungen der MPBetreibV 2014 3 Instandhaltung von Medizinprodukten (1) Die Instandhaltung von Medizinprodukten umfasst insbesondere Instandhaltungsmaßnahmen und die Instandsetzung. Instandhaltungsmaßnahmen
Das neue HGB. Bilanzrechtsmodernisierungsgesetz (BilMoG) Kurzkommentierung
 Das neue HGB Bilanzrechtsmodernisierungsgesetz (BilMoG) Kurzkommentierung Von Prof. Dr. Carsten Padberg, Dr. Thomas Padberg und Prof. Dr. Thomas Werner 2., völlig neu bearbeitete und erweiterte Auflage
Das neue HGB Bilanzrechtsmodernisierungsgesetz (BilMoG) Kurzkommentierung Von Prof. Dr. Carsten Padberg, Dr. Thomas Padberg und Prof. Dr. Thomas Werner 2., völlig neu bearbeitete und erweiterte Auflage
Regulative Aspekte der Aufbereitung chirurgischer Implantate
 Regulative Aspekte der Aufbereitung chirurgischer Implantate 35.Veranstaltung des Arbeitskreis Infektionsprophylaxe 16. Oktober 2012 in Potsdam 17.Oktober 2012 in Leipzig 1 Person Anja Fechner Dipl.-Ing.
Regulative Aspekte der Aufbereitung chirurgischer Implantate 35.Veranstaltung des Arbeitskreis Infektionsprophylaxe 16. Oktober 2012 in Potsdam 17.Oktober 2012 in Leipzig 1 Person Anja Fechner Dipl.-Ing.
Sichere Medizinprodukte besser überwachen
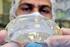 Gemeinsame Pressemitteilung Bonn, 20. März 2012 Sichere Medizinprodukte besser überwachen Im Zusammenhang mit Brustimplantaten des französischen Herstellers PIP (Poly Implant Prothèse) ist Kritik an der
Gemeinsame Pressemitteilung Bonn, 20. März 2012 Sichere Medizinprodukte besser überwachen Im Zusammenhang mit Brustimplantaten des französischen Herstellers PIP (Poly Implant Prothèse) ist Kritik an der
Thomas Meuser Hrsg. Promo-Viren. Zur Behandlung promotionaler Infekte und chronischer Doktoritis 3., kurierte Auflage
 Thomas Meuser Hrsg. Promo-Viren Zur Behandlung promotionaler Infekte und chronischer Doktoritis 3., kurierte Auflage Promo-Viren Thomas Meuser Herausgeber Promo-Viren Zur Behandlung promotionaler Infekte
Thomas Meuser Hrsg. Promo-Viren Zur Behandlung promotionaler Infekte und chronischer Doktoritis 3., kurierte Auflage Promo-Viren Thomas Meuser Herausgeber Promo-Viren Zur Behandlung promotionaler Infekte
1.1 Inhaltsverzeichnis
 Verzeichnisse Inhaltsverzeichnis 1.1 1.1 Inhaltsverzeichnis 1 Verzeichnisse 1.1 Inhaltsverzeichnis 1.2 Herausgeber- und Autorenverzeichnis 1.3 Stichwortverzeichnis 2 Aktuelles 2.1 Änderungen des europäischen
Verzeichnisse Inhaltsverzeichnis 1.1 1.1 Inhaltsverzeichnis 1 Verzeichnisse 1.1 Inhaltsverzeichnis 1.2 Herausgeber- und Autorenverzeichnis 1.3 Stichwortverzeichnis 2 Aktuelles 2.1 Änderungen des europäischen
Anhang V EG-Konformitätserklärung (Qualitätssicherung Produktion)
 Dieses Werk, einschließlich aller seiner Teile, ist urheberrechtlich geschützt. Jede Verwertung außerhalb der engen Grenzen des Urheberrechtsgesetzes ist ohne Zustimmung des Verlages unzulässig und strafbar.
Dieses Werk, einschließlich aller seiner Teile, ist urheberrechtlich geschützt. Jede Verwertung außerhalb der engen Grenzen des Urheberrechtsgesetzes ist ohne Zustimmung des Verlages unzulässig und strafbar.
Regeln für die Akkreditierung von EQAS-Organisationen nach Richtlinie 98/79/EG
 Regeln für die Akkreditierung von EQAS-Organisationen nach Richtlinie 98/79/EG Geltungsbereich: Die vorliegenden Akkreditierungsregeln legen Anforderungen an EQAS-Organisationen fest, die im Geltungsbereich
Regeln für die Akkreditierung von EQAS-Organisationen nach Richtlinie 98/79/EG Geltungsbereich: Die vorliegenden Akkreditierungsregeln legen Anforderungen an EQAS-Organisationen fest, die im Geltungsbereich
Verordnung über das Errichten, Betreiben und Anwenden von Medizinprodukten (Medizinprodukte-Betreiberverordnung - MPBetreibV)
 Verordnung über das Errichten, Betreiben und Anwenden von Medizinprodukten (Medizinprodukte-Betreiberverordnung - MPBetreibV) MPBetreibV Ausfertigungsdatum: 29.06.1998 Vollzitat: "Medizinprodukte-Betreiberverordnung
Verordnung über das Errichten, Betreiben und Anwenden von Medizinprodukten (Medizinprodukte-Betreiberverordnung - MPBetreibV) MPBetreibV Ausfertigungsdatum: 29.06.1998 Vollzitat: "Medizinprodukte-Betreiberverordnung
Sächsisches Sozialanerkennungsgesetz
 Gesetz über die staatliche Anerkennung von Absolventen mit Diplom oder Bachelor in den Fachgebieten des Sozialwesens, der Kindheitspädagogik oder der Heilpädagogik im Freistaat Sachsen (Sächsisches Sozialanerkennungsgesetz
Gesetz über die staatliche Anerkennung von Absolventen mit Diplom oder Bachelor in den Fachgebieten des Sozialwesens, der Kindheitspädagogik oder der Heilpädagogik im Freistaat Sachsen (Sächsisches Sozialanerkennungsgesetz
Know-How für die Medizintechnik
 CMI-WORKSHOP Know-How für die Medizintechnik Medizinprodukte Klasse I Vademecum für den Marktzugang Grundlegende Anforderungen Harmonisierte Normen Technische Dokumentation Regulatory Compliance Solutions
CMI-WORKSHOP Know-How für die Medizintechnik Medizinprodukte Klasse I Vademecum für den Marktzugang Grundlegende Anforderungen Harmonisierte Normen Technische Dokumentation Regulatory Compliance Solutions
MPG 2.4 Verordnung über das Errichten, Betreiben und Anwenden von Medizinprodukten (Medizinprodukte-Betreiberverordnung MPBetreibV) *)
 Verordnung über das Errichten, Betreiben und Anwenden von Medizinprodukten (Medizinprodukte-Betreiberverordnung MPBetreibV) *) Vom 21. August 2002 (BGBl. I S. 3396) zuletzt geändert am 25. November 2003
Verordnung über das Errichten, Betreiben und Anwenden von Medizinprodukten (Medizinprodukte-Betreiberverordnung MPBetreibV) *) Vom 21. August 2002 (BGBl. I S. 3396) zuletzt geändert am 25. November 2003
Ausländisches Wirtschaftsrecht
 Ausländisches Wirtschaftsrecht Systematischer Arbeitskatalog für die Praxis von Dr. jur. R. Böckl Rechtsanwalt in Bonn begründet von Dr. jur M. Wittenstein Rechtsanwalt und Notar in Frankfurt am Main AW
Ausländisches Wirtschaftsrecht Systematischer Arbeitskatalog für die Praxis von Dr. jur. R. Böckl Rechtsanwalt in Bonn begründet von Dr. jur M. Wittenstein Rechtsanwalt und Notar in Frankfurt am Main AW
Rehmann/Wagner Medizinproduktegesetz
 Rehmann/Wagner Medizinproduktegesetz Medizinproduktegesetz (MPG) mit Erläuterungen von Dr. Wolfgang A. Rehmann Rechtsanwalt und Dr. Susanne A. Wagner Rechtsanwältin 2. Auflage Verlag C. H. Beck München
Rehmann/Wagner Medizinproduktegesetz Medizinproduktegesetz (MPG) mit Erläuterungen von Dr. Wolfgang A. Rehmann Rechtsanwalt und Dr. Susanne A. Wagner Rechtsanwältin 2. Auflage Verlag C. H. Beck München
Energierecht. Betriebsaufnahmegenehmigung nach 4 EnWG. Anwendbarkeit der Regelung, Vereinbarkeit mit Europarecht, Vorschlag einer Neuregelung
 Tatjana Schmidt Energierecht Betriebsaufnahmegenehmigung nach 4 EnWG Anwendbarkeit der Regelung, Vereinbarkeit mit Europarecht, Vorschlag einer Neuregelung Diplomica Verlag Tatjana Schmidt Energierecht
Tatjana Schmidt Energierecht Betriebsaufnahmegenehmigung nach 4 EnWG Anwendbarkeit der Regelung, Vereinbarkeit mit Europarecht, Vorschlag einer Neuregelung Diplomica Verlag Tatjana Schmidt Energierecht
Tanja Hartwig genannt Harbsmeier. Up- und Cross-Selling
 Tanja Hartwig genannt Harbsmeier Up- und Cross-Selling Tanja Hartwig genannt Harbsmeier Up- und Cross-Selling Mehr Profit mit Zusatzverkäufen im Kundenservice Bibliografische Information der Deutschen
Tanja Hartwig genannt Harbsmeier Up- und Cross-Selling Tanja Hartwig genannt Harbsmeier Up- und Cross-Selling Mehr Profit mit Zusatzverkäufen im Kundenservice Bibliografische Information der Deutschen
Handbuch. Mit Informationen zur Unterstützung des Risikomanagers. von Medizinischen IT-Netzwerken. zur Umsetzung der DIN EN 80001-1
 Handbuch Mit Informationen zur Unterstützung des Risikomanagers eines Betreibers von Medizinischen IT-Netzwerken zur Umsetzung der DIN EN 80001-1 (Anwendung des Risikomanagements für IT-Netzwerke, die
Handbuch Mit Informationen zur Unterstützung des Risikomanagers eines Betreibers von Medizinischen IT-Netzwerken zur Umsetzung der DIN EN 80001-1 (Anwendung des Risikomanagements für IT-Netzwerke, die
Kompakt Edition: Immobilienfinanzierung
 Kompakt Edition: Immobilienfinanzierung Michael Trübestein Michael Pruegel Kompakt Edition: Immobilienfinanzierung Grundbegriffe und Definitionen Michael Trübestein Bad Orb, Deutschland Michael Pruegel
Kompakt Edition: Immobilienfinanzierung Michael Trübestein Michael Pruegel Kompakt Edition: Immobilienfinanzierung Grundbegriffe und Definitionen Michael Trübestein Bad Orb, Deutschland Michael Pruegel
der Richtlinie 98/79/EG über In-vitro-Diagnostika in der ab 1. Juli 2012 anzuwendenden
 In dem werden wichtige Fachbegriffe, die im Zusammenhang mit dem Medizinprodukterecht von Bedeutung sind, zusammengefasst und zum großen Teil erläutert. Zugrunde gelegt werden dabei Definitionen und Begriffsbestimmungen
In dem werden wichtige Fachbegriffe, die im Zusammenhang mit dem Medizinprodukterecht von Bedeutung sind, zusammengefasst und zum großen Teil erläutert. Zugrunde gelegt werden dabei Definitionen und Begriffsbestimmungen
GHS-Verordnung. Erich Schmidt Verlag. Praxisleitfaden zur Einführung des neuen Einstufungs- und Kennzeichnungssystems gefährlicher Stoffe
 GHS-Verordnung Praxisleitfaden zur Einführung des neuen Einstufungs- und Kennzeichnungssystems gefährlicher Stoffe von Dr. Ulrich Welzbacher Erich Schmidt Verlag Bibliografische Information der Deutschen
GHS-Verordnung Praxisleitfaden zur Einführung des neuen Einstufungs- und Kennzeichnungssystems gefährlicher Stoffe von Dr. Ulrich Welzbacher Erich Schmidt Verlag Bibliografische Information der Deutschen
(Veröffentlichung der Titel und der Bezugsnummern der harmonisierten Normen im Sinne der Harmonisierungsrechtsvorschriften
 C 14/74 DE Amtsblatt der Europäischen Union 16.1.2015 Mitteilung der Kommission im Rahmen der Durchführung der Richtlinie 98/79/EG des Europäischen Parlaments und des Rates vom 27. Oktober 1998 über In-vitro-Diagnostika
C 14/74 DE Amtsblatt der Europäischen Union 16.1.2015 Mitteilung der Kommission im Rahmen der Durchführung der Richtlinie 98/79/EG des Europäischen Parlaments und des Rates vom 27. Oktober 1998 über In-vitro-Diagnostika
Interaktive Whiteboards im Unterricht
 Stefan Hohlfeld Interaktive Whiteboards im Unterricht Wie kann guter Unterricht mit multimedialer Unterstützung aussehen? Bachelorarbeit BACHELOR + MASTER Publishing Hohlfeld, Stefan: Interaktive Whiteboards
Stefan Hohlfeld Interaktive Whiteboards im Unterricht Wie kann guter Unterricht mit multimedialer Unterstützung aussehen? Bachelorarbeit BACHELOR + MASTER Publishing Hohlfeld, Stefan: Interaktive Whiteboards
Qualitätsmanagementsysteme im Gesundheitswesen
 Paul Rudnick Qualitätsmanagementsysteme im Gesundheitswesen Anforderungen für die Zertifizierung von Medizinprodukten Diplomica Verlag Paul Rudnick Qualitätsmanagementsysteme im Gesundheitswesen: Anforderungen
Paul Rudnick Qualitätsmanagementsysteme im Gesundheitswesen Anforderungen für die Zertifizierung von Medizinprodukten Diplomica Verlag Paul Rudnick Qualitätsmanagementsysteme im Gesundheitswesen: Anforderungen
Grundmann Rathner Abschlussprüfungen Bankwirtschaft, Rechnungswesen und Steuerung, Wirtschafts- und Sozialkunde
 Grundmann Rathner Abschlussprüfungen Bankwirtschaft, Rechnungswesen und Steuerung, Wirtschafts- und Sozialkunde Prüfungstraining für Bankkaufleute Die Bücher der Reihe Prüfungstraining für Bankkaufleute
Grundmann Rathner Abschlussprüfungen Bankwirtschaft, Rechnungswesen und Steuerung, Wirtschafts- und Sozialkunde Prüfungstraining für Bankkaufleute Die Bücher der Reihe Prüfungstraining für Bankkaufleute
(Text von Bedeutung für den EWR) 9.8.2007 7.7.2010 9.10.1999. EN 12322:1999/A1:2001 31.7.2002 Anmerkung 3 Datum abgelaufen (30.4.2002) 19.8.
 C 22/30 Amtsblatt der Europäischen Union 24.1.2013 Mitteilung der Kommission im Rahmen der Durchführung der Richtlinie 98/79/EG des Europäischen Parlaments und des Rates vom 27. Oktober 1998 über In-vitro-Diagnostika
C 22/30 Amtsblatt der Europäischen Union 24.1.2013 Mitteilung der Kommission im Rahmen der Durchführung der Richtlinie 98/79/EG des Europäischen Parlaments und des Rates vom 27. Oktober 1998 über In-vitro-Diagnostika
SEO Strategie, Taktik und Technik
 SEO Strategie, Taktik und Technik Andre Alpar Markus Koczy Maik Metzen SEO Strategie, Taktik und Technik Online-Marketing mittels effektiver Suchmaschinenoptimierung Andre Alpar Maik Metzen Markus Koczy
SEO Strategie, Taktik und Technik Andre Alpar Markus Koczy Maik Metzen SEO Strategie, Taktik und Technik Online-Marketing mittels effektiver Suchmaschinenoptimierung Andre Alpar Maik Metzen Markus Koczy
Open Source Software als Medizinprodukt
 Open Source Software als Medizinprodukt 1 Begrüßung Innovativer PACS-Hersteller seit 1996 seit 2005 im OsiriX Projekt dabei Marktführer im DICOM Paperprinting 2 Themen Open Source Software (OSS) OsiriX
Open Source Software als Medizinprodukt 1 Begrüßung Innovativer PACS-Hersteller seit 1996 seit 2005 im OsiriX Projekt dabei Marktführer im DICOM Paperprinting 2 Themen Open Source Software (OSS) OsiriX
