Qualitätssicherung in der rheumatologischen Diagnostik. die Rheumatologie. Prof. Ulrich Sack Universitätsklinikum Leipzig
|
|
|
- Gert Amsel
- vor 7 Jahren
- Abrufe
Transkript
1 Qualitätssicherung in der rheumatologischen Diagnostik indikationsspezifische Ringversuche für die Rheumatologie Prof. Ulrich Sack Universitätsklinikum Leipzig Department für Diagnostik Institut für Klinische Immunologie Johannisallee 30, Leipzig Regularien für immunologische Labors Forschung? Regeln der Guten Wissenschaftlichen Praxis ; Anforderungen der Fachzeitschriften Routine? RiLiBÄK Produktkontrolle für Transfusionsmedizin/ Stammzelltherapien Herstellungserlaubnis Pharmaentwicklung? GLP Leistungsbewertungsprüfung? t Anerkennung (ZLG) Akkreditierung? analytisch? 17025; diagnostisch?
2 Gilt für medizinische Labordiagnostik: RiLiBÄK 3 Qualitätssicherung quantitativer laboratoriumsmedizinischer Untersuchungen nach RiLiBÄK Qualitätssicherung alle quantitativen Untersuchungen interne Qualitätskontrolle Untersuchungen der Tabelle B1 externe Qualitätskontrolle zeitnah retrospektiv Ringversuche Hinweis: Akkreditierung fordert externe QC auch für nicht-tabelle B1-Parameter
3 Bestimmung laborinterner Fehlergrenzen bei einem quantitativen Test, nicht in B1 enthalten 1. Hersteller gibt Zielwert und Fehlergrenzen vor 2. Versuchsplan wird dokumentiert 3. Kontrollen werden 15 mal gemessen 4. Eigene Grenzen werden bestimmt 5. QMDM wird bestimmt 6. Korrektheit wird überprüft 7. Werte werden in Labor-EDV eingepflegt 8. Protokoll wird erstellt und freigegeben (möglichst mit Graphen, auf jeden Fall mit klar verständlicher Aussage) 9. Archivierung mit Rohdaten 5 5 Besonderheiten Ermittlung der laboratoriumsinternen Fehlergrenzen für Messgrößen, die nicht in Tabelle B 1 aufgeführt sind 4. Für Kontrollproben mit einer Chargenlaufzeit von weniger als zwölf Wochen entfällt die Ermittlung von laboratoriumsinternen Fehlergrenzen. Es gelten die vom Hersteller der Kontrollproben angegebenen Bereiche Messgrößen mit geringen Analysenfrequenzen 1. Bei Messgrößen, die erwartungsgemäß an weniger als 15 Tagen in drei Monaten bestimmt werden, sind an jedem Tag, an dem Patientenproben untersucht werden, mindestens zwei Kontrollproben mit Zielwerten in unterschiedlichen Konzentrationsbereichen zu analysieren, soweit verfügbar. 2. Die Bewertung der Kontrollprobeneinzelmessungen und die daraus zu ziehenden Konsequenzen gemäß Abs. (2) erfolgen für beide Kontrollproben. Für Messgrößen, die nicht in Tabelle B1a-c aufgeführt sind, gilt Satz 1 entsprechend. Als Fehlergrenzen gelten die vom Hersteller der Kontrollproben angegebenen Bereiche. 3. Die Ermittlung und Bewertung des quadratischen Mittelwertes der Messabweichung gemäß entfällt. 6 3
4 Akkreditierte und anerkannte Labors: DIN/ISO/EN Forderungen der ISO Sicherstellung der Qualität der Untersuchungsverfahren Kontrollsysteme (interne und externe Q-Kontrolle) sind einzuführen Bestimmung der Meßunsicherheit Kalibrierung der Meßsysteme und Rückführung der Ergebnisse auf SI-Einheiten Teilnahme an Ringversuchen (RV) und Überwachung der Ergebnisse durch die Leitung wenn keine RV verfügbar, andere Arten externer Vergleichsprogramme anwenden gleiche Untersuchungen/Parameter mit verschiedenen Verfahren, Geräten oder Standorten durchgeführt werden, müssen bzgl. der Vergleichbarkeit verifiziert werden 8 4
5 Generelle Forderungen zur Qualitätssicherung 9 Gemeinsame Anforderungen Kompetenz & Autorisierung des Personals Räume, Zugang und Umgebungsbedingungen Ausrüstung, Wartung, Nachweise Reagenzien, Lagerlogistik Validierte Verfahren Interne & externe QC ( Etablierung neuer Ringversuche) Eigene Referenzwerte Relevante Interpretation Und alles schön dokumentieren! 10 5
6 Rheumatologische Diagnostik 11 Anforderung rheumatologischer Laboruntersuchungen Entnahmezeit für AAK unkritisch, aber nicht postprandial Korrektes Material (Serum, aber auch meist EDTA- (genetische/zytometrische Marker) oder Heparinblut (IGRA) Transport schnell & meist ungekühlt ins Labor ggf. Einwilligung nach GenDG beilegen Aussagekräftige Anforderung ( autoimmun? ) 12 6
7 Autoantikörperdiagnostik Mischung manueller/automatischer Methoden Geräte täglich kalibrieren und/oder Kontrollen mitführen welche Kontrollen?? 2 Kontrollniveaus?? Wiederholung am Serienende? Auswertung durch 2 Experten oder durch Gerätesystem und 1 Experten ( Aklides) Vergleich zw. Mitarbeitern CE-Label Kits/Geräte? Dokumentation im Längsschnitt 13 Häufige Fragen aus den Labors Allgemein Definition von Qualifizierung von Geräten, Validierung von Methoden Unterschied bzw. Definition von Laborzertifizierung/Akkreditierung; wie oft Reakkreditierung; gibt es Listen über die dabei relevanten und vorher abzuarbeitenden Themen? DAkkS-Homepage; Checkliste Immunologie; Beschlüsse SK5 Muss man ein CE Produkt nehmen, wenn eines bei einem Hersteller auf dem Markt ist, aber nicht beim üblichen Lieferanten? eigentlich ja, aber Validierung kann zeigen, dass anderes System besser läuft Verliert man den CE Status wenn man andere Reagenzien verwendet? validieren Effekt von eigenmächtigem Laden von Software auf Geräte (Probleme durch Virenscanner etc.): Wer haftet? Labor muss Software validieren (schwierig). 14 7
8 Häufige Fragen aus den Labors Reagenzien: Darf ich ein nicht CE zertifiziertes Reagenz in ein IVD zugelassenes Reagenz zupipettieren? validieren Wie lange darf ich angebrochene Antikörper benutzen, wenn die Haltbarkeit nur für das ungeöffnete Reagenz angegeben ist validieren Auswirkung von Reagenzienverdünnung auf Akkreditierung: validieren Validierung: Wieviele Messungen muss ich für Validierung durchführen? meist 3 X 3 und 5 im Längsschnitt Wie validiere ich meine Messungen auf einem neuen Gerät, wenn mir das alte Gerät mit den bisher validierten Methoden nicht zur Verfügung steht. Plan Daten Protokoll Freigabe 15 Häufige Qualitätsprobleme Unbekannte Blutentnahmezeit Keine Teilnahme an Ringversuchen Fehlende Dokumentation von Maßnahmen nach nicht bestandenen Ringversuchen und Ausreißern bei den Kontrollen Fehlende Bestimmung der Messunsicherheit Fehlende klinische Indikation von Untersuchungen Ungenügende Zugangsregelung und Nutzungsbefugnis Abgrenzung der Forschungsmessungen Qualifikation und Fortbildung 16 8
9 Besonders häufig reklamiert: Validierung von Tests 17 Validierung im Labor Verifizierung (ISO 9000:2000, 3.8.4): objektiver Nachweis, dass die Anforderungen erfüllt werden. Familiarisierung Validierung (ISO 9000:2000, 3.8.5): objektiver Nachweis, dass die Anforderungen für einen spezifischen Zweck erfüllt werden. Vertreiber eines diagnostischen Testkits müssen nach DIN EN 13612:2002, 2.8 bestätigen, dass der Testkit die Anforderungen für den Gebrauch in medizinischen diagnostischen Labors erfüllt. 18 9
10 Testvalidierung Grundsätzliches Vorgehen: 1. Validierungsplan: wieviele Proben, wann, welche, wie oft; welche Zielkriterien 2. Validierungsprotokolle (incl. Rohdaten) 3. Auswertung, Schlussfolgerungen und Freigabe Im Diagnostiklabor müssen bei Verwendung CE-gelabelter Testkits nur minimale Anforderungen erfüllt werden (Familiarisierung) Mitunter muss auf nicht-ce-gelabelte Reagenzien zurückgegriffen werden (wichtig: indiziert; keine geeignete Alternative) Mitunter Validierung sehr schwierig: zu wenige Proben, keine Standards, keine Referenzmethode verfügbar Zur Not kann auf publizierte Daten zurückgegriffen werden (muss aber begründet sein). 19 Methodenvergleich (Min ni Wright 1 - Wright 2) / Average % SD 27, Mean 0 2, SD -22, AVERAGE of Mini Wright 1 and Wright 2 Mini Wright Wright 1 Bland and Altman Plot Passing and Bablock Regression 20 10
11 Ringversuche und Laborvergleich 21 Ringversuche RiliBÄK: RfB, Instand (Mitteilung im Deutschen Ärzteblatt) Akkreditierung: RiLiBÄK andere Anbieter (Österreich, UK, Dänemark ) kommerzielle Anbieter (akkreditiert nach 17043) Laborvergleiche Frequenz: 4x/Jahr? 2x? 22 11
12 Was ist ein guter Ringversuch? 1. Es handelt sich um eine echte humane Probe. 2. Es besteht eine weitgehende Produktunabhängigkeit. 3. Die Abarbeitung erfolgt wie die Standardanalytik. 4. Die Fragestellung ist realitätsnah und erfordert eine korrekte Interpretation. 5. Die Auswertung erfolgt zeitnah. 23 Was ist ein guter Ringversuch? 1. Therapeutische/Prognostische Relevanz? oder wenigstens 2. Diagnostische Aussage? oder zumindest 3. Analytische Korrektheit? 24 12
13 Designs für klinisch relevante Ringversuche Einsendung einer Probe 1. zum Ausschluss einer rheumatologischen Genese bei unspezifischer Symptomatik 2. bei klinischem Verdacht auf Rheumatoid-Arthritis 3. bei bekanntem SLE zur Therapiekontrolle Unterschiedliche Prä-Test-Wahrscheinlichkeiten Unterschiedliche h diagnostische Spezifität und Sensitivität Unterschiedliche Ergebnisinterpretation 25 Vielen Dank für Ihre Aufmerksamkeit! 26 13
Überwachung der Qualitätssicherung laboratoriumsmedizinischer Untersuchungen nach der Richtlinie der Bundesärztekammer vom
 1. Grundsätze der Qualitätssicherung 1 (1) 1 (3) Wird für alle vom medizinischen Laboratorium durchgeführten quantitativen laboratoriumsmedizinischen Untersuchungen eine interne Qualitätssicherung durchgeführt?
1. Grundsätze der Qualitätssicherung 1 (1) 1 (3) Wird für alle vom medizinischen Laboratorium durchgeführten quantitativen laboratoriumsmedizinischen Untersuchungen eine interne Qualitätssicherung durchgeführt?
Landesamt für f r soziale Dienste - Abt. Gesundheitsschutz - Schleswig-Holstein. Erfahrungsbericht
 RiliBÄK 2008 Erfahrungsbericht 1 Zuständige Behörde in Ministerium für Soziales, Gesundheit, Familie, Jugend und Senioren Landesamt für soziale Dienste Schleswig- Holstein - Abteilung Gesundheitsschutz
RiliBÄK 2008 Erfahrungsbericht 1 Zuständige Behörde in Ministerium für Soziales, Gesundheit, Familie, Jugend und Senioren Landesamt für soziale Dienste Schleswig- Holstein - Abteilung Gesundheitsschutz
Landesamt für f r soziale Dienste - Abt. Gesundheitsschutz - Schleswig-Holstein. Erfahrungsbericht
 RiliBÄK 2008 Erfahrungsbericht Zuständige Behörde in Ministerium für Soziales, Gesundheit, Familie, Jugend und Senioren Landesamt für soziale Dienste Schleswig- Holstein - Abteilung Gesundheitsschutz -
RiliBÄK 2008 Erfahrungsbericht Zuständige Behörde in Ministerium für Soziales, Gesundheit, Familie, Jugend und Senioren Landesamt für soziale Dienste Schleswig- Holstein - Abteilung Gesundheitsschutz -
Rili-BÄK 2008 Wird es einfacher? Carmen Hansen, Bio-Rad Laboratories GmbH
 Rili-BÄK 2008 Wird es einfacher? Carmen Hansen, Bio-Rad Laboratories GmbH Warum ist der Teil B 1 erforderlich? Herausforderungen Rili-BÄK 2001 Prä-/ Postanalytik nicht erfasst Rili-BÄK pflichtige Analyte
Rili-BÄK 2008 Wird es einfacher? Carmen Hansen, Bio-Rad Laboratories GmbH Warum ist der Teil B 1 erforderlich? Herausforderungen Rili-BÄK 2001 Prä-/ Postanalytik nicht erfasst Rili-BÄK pflichtige Analyte
Das Labor in der Arztpraxis
 Landesamt für soziale Dienste Das Labor in der Arztpraxis Allgemeine Anforderungen, Qualitätssicherung, Hygiene Fortbildungsveranstaltung - Fachnachmittag 03. Juni 2015 13.00 Uhr bis 17.00 Uhr Landesamt
Landesamt für soziale Dienste Das Labor in der Arztpraxis Allgemeine Anforderungen, Qualitätssicherung, Hygiene Fortbildungsveranstaltung - Fachnachmittag 03. Juni 2015 13.00 Uhr bis 17.00 Uhr Landesamt
Neue RiliBÄK Teil B1. W.Vogt Heidelberg 14./15. September 2007
 Neue RiliBÄK Teil B1 W.Vogt Heidelberg 14./15. September 2007 RiliBÄK 2008 Begründung Vorgehen Bewertung (Tab. B1) Problemfelder der RiliBÄK 2001 Vorgehen in der Realität und in der RiliBÄK stimmen nicht
Neue RiliBÄK Teil B1 W.Vogt Heidelberg 14./15. September 2007 RiliBÄK 2008 Begründung Vorgehen Bewertung (Tab. B1) Problemfelder der RiliBÄK 2001 Vorgehen in der Realität und in der RiliBÄK stimmen nicht
Anforderungen an die interne und externe Qualitätskontrolle des POCT
 Anforderungen an die interne und externe Qualitätskontrolle des POCT Dr. rer. nat. Manfred Falck Zentrallabor Zentralinstitut für Klinische Chemie und Laboratoriumsdiagnostik Direktor Univ.-Prof. Dr. F.
Anforderungen an die interne und externe Qualitätskontrolle des POCT Dr. rer. nat. Manfred Falck Zentrallabor Zentralinstitut für Klinische Chemie und Laboratoriumsdiagnostik Direktor Univ.-Prof. Dr. F.
Checkliste Patientennahe Sofortdiagnostik mit Unit-use-Reagenzien. Mess- und Eichwesen Baden-Württemberg. Frage. Teil B1. Nein. n.z.
 2.1.5 Patientennahe Sofortdiagnostik mit Unit-use-Reagenzien 2.1.5 (1) Satz 1 und Satz 2 Satz 3 Werden Unit-use-Reagenzien und die entsprechenden Messsysteme in der patientennahen Sofortdiagnostik nach
2.1.5 Patientennahe Sofortdiagnostik mit Unit-use-Reagenzien 2.1.5 (1) Satz 1 und Satz 2 Satz 3 Werden Unit-use-Reagenzien und die entsprechenden Messsysteme in der patientennahen Sofortdiagnostik nach
RiliBÄK und Immundiagnostik
 RiliBÄK und Immundiagnostik 6. Immundiagnostisches Meeting Dresden 7.10.008 Dr. Christoph M. Niederau Labor Dr. Niederau und Kollegen GbR Medizinisches Versorgungszentrum für Labormedizin, Mikrobiologie
RiliBÄK und Immundiagnostik 6. Immundiagnostisches Meeting Dresden 7.10.008 Dr. Christoph M. Niederau Labor Dr. Niederau und Kollegen GbR Medizinisches Versorgungszentrum für Labormedizin, Mikrobiologie
Stand der Umsetzung der neuen RiliBÄK
 Stand der Umsetzung der neuen RiliBÄK Sybille Döring Landesamt für Mess- und Eichwesen Berlin-Brandenburg Berlin 3.12.2009 1 Landesamt für Mess- und Eichwesen Berlin - Brandenburg gemeinsames Landesamt
Stand der Umsetzung der neuen RiliBÄK Sybille Döring Landesamt für Mess- und Eichwesen Berlin-Brandenburg Berlin 3.12.2009 1 Landesamt für Mess- und Eichwesen Berlin - Brandenburg gemeinsames Landesamt
Erfahrungen bei der Umsetzung der DIN EN ISO 15189:2007
 Erfahrungen bei der Umsetzung der DIN EN ISO 15189:2007 DACH Deutsche Akkreditierungsstelle Chemie Gartenstraße 6 60594 Frankfurt Tel.: +49 69 663719-0 Fax: +49 69 663719-20 email: dach@dach-gmbh.de Internet:
Erfahrungen bei der Umsetzung der DIN EN ISO 15189:2007 DACH Deutsche Akkreditierungsstelle Chemie Gartenstraße 6 60594 Frankfurt Tel.: +49 69 663719-0 Fax: +49 69 663719-20 email: dach@dach-gmbh.de Internet:
Häufig gestellte Fragen zur Richtlinie der Bundesärztekammer zur Qualitätssicherung laboratoriumsmedizinischer Untersuchungen
 Allgemeine Fragen 1. Wer muss die Richtlinie anwenden? Gemäß 4a Absatz (1) Medizinprodukte-Betreiberverordnung (MPBetreibV) müssen alle Personen, die laboratoriumsmedizinische Untersuchungen durchführen,
Allgemeine Fragen 1. Wer muss die Richtlinie anwenden? Gemäß 4a Absatz (1) Medizinprodukte-Betreiberverordnung (MPBetreibV) müssen alle Personen, die laboratoriumsmedizinische Untersuchungen durchführen,
Messunsicherheit, Gerätevergleich & Co - einfach umgesetzt mittels QC-Datenmanagement
 Messunsicherheit, Gerätevergleich & Co - einfach umgesetzt mittels QC-Datenmanagement 1 Nürnberg, Köln, Hamburg, 2018 Wolfgang Riedl, Bio-Rad Laboratories Unity Real Time 2.0 & ISO 15189 Anforderungen
Messunsicherheit, Gerätevergleich & Co - einfach umgesetzt mittels QC-Datenmanagement 1 Nürnberg, Köln, Hamburg, 2018 Wolfgang Riedl, Bio-Rad Laboratories Unity Real Time 2.0 & ISO 15189 Anforderungen
Wichtige Aspekte der Qualitätskontrolle in der Infektionsserologie. Ilka Richert, Bio-Rad Laboratories GmbH
 Wichtige Aspekte der Qualitätskontrolle in der Infektionsserologie Ilka Richert, Bio-Rad Laboratories GmbH Hepatitis B Serokonversion Infektionsserologische Tests Sensitivität Spezifität Richtig pos. Ergebnisse
Wichtige Aspekte der Qualitätskontrolle in der Infektionsserologie Ilka Richert, Bio-Rad Laboratories GmbH Hepatitis B Serokonversion Infektionsserologische Tests Sensitivität Spezifität Richtig pos. Ergebnisse
Teil B 1 Rili-BÄK 2008 Vertiefungsmodul. Carmen Hansen und Olaf Kirchner, Bio-Rad Laboratories GmbH
 Teil B 1 Rili-BÄK 2008 Vertiefungsmodul Carmen Hansen und Olaf Kirchner, Bio-Rad Laboratories GmbH Rili-BÄK: Aktueller Stand der Dinge Rili-BÄK 2001: Rili-BÄK 2008: Qualitätskontrolle Qualitätssicherung
Teil B 1 Rili-BÄK 2008 Vertiefungsmodul Carmen Hansen und Olaf Kirchner, Bio-Rad Laboratories GmbH Rili-BÄK: Aktueller Stand der Dinge Rili-BÄK 2001: Rili-BÄK 2008: Qualitätskontrolle Qualitätssicherung
Umsetzung der Rili-BÄK 2008 Erfahrungen der Überwachungsbehörde in Sachsen
 Umsetzung der Rili-BÄK 2008 Erfahrungen der Überwachungsbehörde in Sachsen 1 22. November 2011 Gabriele Schmidt Rechtliche Grundlagen In 4a MPBetreibV Verankerung der Richtlinie der Bundesärztekammer zur
Umsetzung der Rili-BÄK 2008 Erfahrungen der Überwachungsbehörde in Sachsen 1 22. November 2011 Gabriele Schmidt Rechtliche Grundlagen In 4a MPBetreibV Verankerung der Richtlinie der Bundesärztekammer zur
Umsetzung der RiliBäk Teil B
 Umsetzung der RiliBäk Teil B Die Ausgangssituation: Die Übergangsfrist für die neue RiliBäk läuft am 31.03.2010 ab Der Teil A (QMS) wurde schon umgesetzt oder ist in Arbeit Das durchgeführte Update der
Umsetzung der RiliBäk Teil B Die Ausgangssituation: Die Übergangsfrist für die neue RiliBäk läuft am 31.03.2010 ab Der Teil A (QMS) wurde schon umgesetzt oder ist in Arbeit Das durchgeführte Update der
Sächsisches Landesamt für Mess- und Eichwesen. Bio-Rad Laboratories Fortbildungsprogramm Rili-BÄK 2008, Vertiefungsmodul.
 Bio-Rad Laboratories Fortbildungsprogramm Rili-BÄK 2008, Vertiefungsmodul Rili-BÄK 2008 aus der Sicht der Überwachungsbehörde in Sachsen Gabriele Schmidt Sächsisches Landesamt für Mess- und Eichwesen 11.11.2009
Bio-Rad Laboratories Fortbildungsprogramm Rili-BÄK 2008, Vertiefungsmodul Rili-BÄK 2008 aus der Sicht der Überwachungsbehörde in Sachsen Gabriele Schmidt Sächsisches Landesamt für Mess- und Eichwesen 11.11.2009
Das EliA System. nn Protokolle, QC- und Rohdaten leicht zugänglich nn Optionaler Anschluss an die Laborsoftware nn Detailliertes QC-Management
 CCP Das EliA System Mehr Zeit für s Wesentliche nn Vollständig automatisiert (echter Walk-away-Modus, Übernachtläufe) nn Einfaches Management des Instruments mit maßgefertigter Software nn Barcode-Lesegerät
CCP Das EliA System Mehr Zeit für s Wesentliche nn Vollständig automatisiert (echter Walk-away-Modus, Übernachtläufe) nn Einfaches Management des Instruments mit maßgefertigter Software nn Barcode-Lesegerät
Vergleich der Anforderungen der RiliBÄK K 2008 mit denen der DIN EN ISO 15189
 Vergleich der der K 2008 mit denen der Petra Möller und Gerd Hafner Zentrum für Labormedizin und Mikrobiologie, Essen 5.1 Das Labor muss unter fachlich qualifizierter Leitung stehen???????? Es besteht
Vergleich der der K 2008 mit denen der Petra Möller und Gerd Hafner Zentrum für Labormedizin und Mikrobiologie, Essen 5.1 Das Labor muss unter fachlich qualifizierter Leitung stehen???????? Es besteht
Neue Richtlinien der BÄK. W.Vogt, München 25. Oktober 2007
 Neue Richtlinien der BÄK W.Vogt, München 25. Oktober 2007 RiliBÄK 2007 Historie Begründung Vorgehen Bewertung (Tab. B1) Glukose-Ringversuch Belk, 1947 Historie West Eichgesetz vom 11. Juli 1969 Eichpflicht-Ausnahmeverordnung
Neue Richtlinien der BÄK W.Vogt, München 25. Oktober 2007 RiliBÄK 2007 Historie Begründung Vorgehen Bewertung (Tab. B1) Glukose-Ringversuch Belk, 1947 Historie West Eichgesetz vom 11. Juli 1969 Eichpflicht-Ausnahmeverordnung
Umsetzung der RiLi-BÄK für die Patientennahe Sofortdiagnostik Ein Erfahrungsbericht -
 Umsetzung der RiLi-BÄK für die Patientennahe Sofortdiagnostik Ein Erfahrungsbericht - Theresa Winter, Matthias Nauck Institut für Klinische Chemie und Laboratoriumsmedizin Universitätsmedizin Greifswald
Umsetzung der RiLi-BÄK für die Patientennahe Sofortdiagnostik Ein Erfahrungsbericht - Theresa Winter, Matthias Nauck Institut für Klinische Chemie und Laboratoriumsmedizin Universitätsmedizin Greifswald
Rili-BÄK Spezieller Teil B 3. Carmen Hansen, Bio-Rad Laboratories GmbH
 Rili-BÄK Spezieller Teil B 3 Carmen Hansen, Bio-Rad Laboratories GmbH Spezieller Teil B 3 Direkter Nachweis und Charakterisierung von Infektionserregern Deutsches Ärzteblatt, Jahrgang 110, Heft 12, 22.
Rili-BÄK Spezieller Teil B 3 Carmen Hansen, Bio-Rad Laboratories GmbH Spezieller Teil B 3 Direkter Nachweis und Charakterisierung von Infektionserregern Deutsches Ärzteblatt, Jahrgang 110, Heft 12, 22.
Teil A Rili-BÄK 2008 Vertiefungsmodul. Peter Ackermann, Bio-Rad Laboratories GmbH
 Teil A Rili-BÄK 2008 Vertiefungsmodul Peter Ackermann, Bio-Rad Laboratories GmbH Neue Rili-BÄK Teil A Beschreibt die grundlegenden Anforderungen an die Qualitätssicherung laboratoriumsmedizinischer Untersuchungen
Teil A Rili-BÄK 2008 Vertiefungsmodul Peter Ackermann, Bio-Rad Laboratories GmbH Neue Rili-BÄK Teil A Beschreibt die grundlegenden Anforderungen an die Qualitätssicherung laboratoriumsmedizinischer Untersuchungen
Anforderungen an die Kompetenz von Prüflaboratorien
 Anforderungen an die Kompetenz von Prüflaboratorien A. Loock Hygiene-Institut für Hygiene und der Öffentliche Universität Gesundheit Bonn der Universität Bonn Gliederung - Begleit- und Begründungstext
Anforderungen an die Kompetenz von Prüflaboratorien A. Loock Hygiene-Institut für Hygiene und der Öffentliche Universität Gesundheit Bonn der Universität Bonn Gliederung - Begleit- und Begründungstext
Anforderungen an die Qualitätssicherung quantitativer Laboranalytik gem. Medizinprodukterecht und RiliBÄK 2008
 Anforderungen an die Qualitätssicherung quantitativer Laboranalytik gem. Medizinprodukterecht und RiliBÄK 2008 Frankfurt, 07-10-2009 Kurzfassung 10.2009 Siggi Brilling Dez. 35.3 1 Inhaltliche Skizze II.
Anforderungen an die Qualitätssicherung quantitativer Laboranalytik gem. Medizinprodukterecht und RiliBÄK 2008 Frankfurt, 07-10-2009 Kurzfassung 10.2009 Siggi Brilling Dez. 35.3 1 Inhaltliche Skizze II.
POCT Point of care testing
 POCT Point of care testing Anke Urban POCT-Koordinatorin, Qualitätsmanagerin, Gesundheitsbetriebswirtin Institut für Labordiagnostik, Hygiene und Transfusionsmedizin Klinikum der Stadt Ludwigshafen ggmbh
POCT Point of care testing Anke Urban POCT-Koordinatorin, Qualitätsmanagerin, Gesundheitsbetriebswirtin Institut für Labordiagnostik, Hygiene und Transfusionsmedizin Klinikum der Stadt Ludwigshafen ggmbh
Unabhängige Qualitätskontrollen
 Bio-Rad Laboratories QUALITÄTSKONTROLLEN Unabhängige Qualitätskontrollen Für mehr Sicherheit Ihrer Patientenergebnisse Bio-Rad Laboratories QUALITÄTSKONTROLLEN Internationale Richtlinien und Normen enthalten
Bio-Rad Laboratories QUALITÄTSKONTROLLEN Unabhängige Qualitätskontrollen Für mehr Sicherheit Ihrer Patientenergebnisse Bio-Rad Laboratories QUALITÄTSKONTROLLEN Internationale Richtlinien und Normen enthalten
Informationsblatt. 2. Begriffe
 Informationsblatt Patientennahe Sofortdiagnostik (POCT) mit Unit-use-Reagenzien nach der Richtlinie der Bundesärztekammer zur Qualitätssicherung laboratoriumsmedizinischer Untersuchungen (Rili-BÄK 2014)
Informationsblatt Patientennahe Sofortdiagnostik (POCT) mit Unit-use-Reagenzien nach der Richtlinie der Bundesärztekammer zur Qualitätssicherung laboratoriumsmedizinischer Untersuchungen (Rili-BÄK 2014)
Abweichungen. AG 7 Abweichungsmanagement 16. August 2010, Dr. Andrea Behrenswerth
 2010 Abweichungen DIN ISO 15378 Primärpackmittel für Arzneimittel Besondere Anforderungen für die Anwendung von ISO 9001:2000 entsprechend der Guten Herstellungspraxis (GMP) AG 7 Abweichungsmanagement
2010 Abweichungen DIN ISO 15378 Primärpackmittel für Arzneimittel Besondere Anforderungen für die Anwendung von ISO 9001:2000 entsprechend der Guten Herstellungspraxis (GMP) AG 7 Abweichungsmanagement
Reicht positiv und negativ aus? Qualitätskontrolle bei qualitativen Untersuchungen
 Reicht positiv und negativ aus? Qualitätskontrolle bei qualitativen Untersuchungen 1 Nürnberg, Köln, Hamburg, 2018 Ilka Richert, Bio-Rad Laboratories FAQ s Rili-BÄK Wie sind hinsichtlich der Zuordnung
Reicht positiv und negativ aus? Qualitätskontrolle bei qualitativen Untersuchungen 1 Nürnberg, Köln, Hamburg, 2018 Ilka Richert, Bio-Rad Laboratories FAQ s Rili-BÄK Wie sind hinsichtlich der Zuordnung
Validierung in der Analytik
 Validierung in der Analytik Stavros Kromidas WILEY-VCH Weinheim New York Chichester Brisbane Singapore Toronto Inhalt 1 Grundsätze der Validierung in der Analytik und im Prüfwesen 1 1.1 Einführung 1 1.2
Validierung in der Analytik Stavros Kromidas WILEY-VCH Weinheim New York Chichester Brisbane Singapore Toronto Inhalt 1 Grundsätze der Validierung in der Analytik und im Prüfwesen 1 1.1 Einführung 1 1.2
7.5.1 Dokumentierte Informationen. Dokumentenübersicht Revision vom Ersteller/ in Verteiler Grund der letzten Änderung
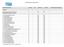 Handbuch Handbuch gesamt mit Kapitel 1 bis 10 0 QM QM Prozessbeschreibungen / Verfahren 6 1 0 Ermittlung Risiken Chancen 0 QM QM 6 2 0 Qualitätsziele 0 QM QM 6 3 0 Planung Änderungen 0 QM QM 7 1 3 Externe
Handbuch Handbuch gesamt mit Kapitel 1 bis 10 0 QM QM Prozessbeschreibungen / Verfahren 6 1 0 Ermittlung Risiken Chancen 0 QM QM 6 2 0 Qualitätsziele 0 QM QM 6 3 0 Planung Änderungen 0 QM QM 7 1 3 Externe
Rili-BÄK Spezieller Teil B 2. Carmen Hansen, Bio-Rad Laboratories GmbH
 Rili-BÄK Spezieller Teil B 2 Carmen Hansen, Bio-Rad Laboratories GmbH Rili-BÄK komplett Teil A: Grundlegende Anforderungen seit April 2010 Teil B 1: Quantitativ Teil B 2: Qualitativ Teil B 3: Infektionsserologie
Rili-BÄK Spezieller Teil B 2 Carmen Hansen, Bio-Rad Laboratories GmbH Rili-BÄK komplett Teil A: Grundlegende Anforderungen seit April 2010 Teil B 1: Quantitativ Teil B 2: Qualitativ Teil B 3: Infektionsserologie
Aktuelle Informationen und Anforderungen zur Akkreditierung von Trinkwasserlaboratorien nach ISO 17025
 Aktuelle Informationen und Anforderungen zur Akkreditierung von Trinkwasserlaboratorien nach ISO 17025 1 Jörg Unger Aktuelle Informationen und Anforderungen zur Akkreditierung von Konformitätsbewertung
Aktuelle Informationen und Anforderungen zur Akkreditierung von Trinkwasserlaboratorien nach ISO 17025 1 Jörg Unger Aktuelle Informationen und Anforderungen zur Akkreditierung von Konformitätsbewertung
Zulassung und Überprüfung von Trinkwasseruntersuchungsstellen in Niedersachsen - Erfahrungsbericht u. Fallbeispiele -
 Zulassung und Überprüfung von Trinkwasseruntersuchungsstellen in Niedersachsen - Erfahrungsbericht u. Fallbeispiele - 14. Jahrestagung Trinkwasserringversuche am 27. Februar 2013 in Osnabrück Frank Raulf
Zulassung und Überprüfung von Trinkwasseruntersuchungsstellen in Niedersachsen - Erfahrungsbericht u. Fallbeispiele - 14. Jahrestagung Trinkwasserringversuche am 27. Februar 2013 in Osnabrück Frank Raulf
Ringversuche in der Deutsches Akkreditie erungssystem Prüfwesen Gm mbh
 DACH-Jahrestagung 2008 in St.Gallen - Mo.3.A.1 Ringversuche in der Akkreditierung DACH-Jahrestagung 2008 Zerstörungsfreie Materialprüfung in St. Gallen vom 28.-30. April 2008 Univ.-Prof. Dr.-Ing. habil.
DACH-Jahrestagung 2008 in St.Gallen - Mo.3.A.1 Ringversuche in der Akkreditierung DACH-Jahrestagung 2008 Zerstörungsfreie Materialprüfung in St. Gallen vom 28.-30. April 2008 Univ.-Prof. Dr.-Ing. habil.
Blutzucker-Bestimmung (POCT) Vergleichbarkeit / Bias
 ÖQASTA Symposium 2014 12.11.2014 Salzburg Blutzucker-Bestimmung (POCT) Vergleichbarkeit / Bias Dr. R. Fried Institut für Klinische Chemie / Verein für med. Qualitätskontrolle Unispital Zürich www.mqzh.ch
ÖQASTA Symposium 2014 12.11.2014 Salzburg Blutzucker-Bestimmung (POCT) Vergleichbarkeit / Bias Dr. R. Fried Institut für Klinische Chemie / Verein für med. Qualitätskontrolle Unispital Zürich www.mqzh.ch
Genauigkeit und Präzision des Accu-Chek Compact Systems und des Accu-Chek Compact Plus Systems. Einleitung. Methode
 Genauigkeit und Präzision des Accu-Chek Compact Systems und des Accu-Chek Compact Plus Systems I. GENAUIGKEIT Die Genauigkeit des Systems wurde gemäß der Norm ISO 15197 untersucht. Einleitung Ziel dieser
Genauigkeit und Präzision des Accu-Chek Compact Systems und des Accu-Chek Compact Plus Systems I. GENAUIGKEIT Die Genauigkeit des Systems wurde gemäß der Norm ISO 15197 untersucht. Einleitung Ziel dieser
3 Jahre Zertifizierungen der Aufbereitung
 ÖGSV-wfhss-Congress 2007, Baden bei Wien, 05.05.2007 3 Jahre Zertifizierungen der Aufbereitung auf Basis der deutschen RKI/BfArM-Empfehlung Ein Erfahrungsbericht Dr. Thomas Kießling Sachverständiger für
ÖGSV-wfhss-Congress 2007, Baden bei Wien, 05.05.2007 3 Jahre Zertifizierungen der Aufbereitung auf Basis der deutschen RKI/BfArM-Empfehlung Ein Erfahrungsbericht Dr. Thomas Kießling Sachverständiger für
Untersuchung zur Gleichwertigkeit des LOVIBOND CSB vario Küvettentest mit dem Hach * CSB Küvettentest
 Untersuchung zur Gleichwertigkeit des LOVIBOND CSB vario Küvettentest mit dem CSB Küvettentest Inhaltsverzeichnis Seite Einleitung und Zielsetzung 1 Verwendete Methoden, Reagenzien und Geräte 1 Teil I
Untersuchung zur Gleichwertigkeit des LOVIBOND CSB vario Küvettentest mit dem CSB Küvettentest Inhaltsverzeichnis Seite Einleitung und Zielsetzung 1 Verwendete Methoden, Reagenzien und Geräte 1 Teil I
Erfahrungen der. DQS GmbH. bei der Zertifizierung von Medizinprodukteherstellern
 Erfahrungen der DQS GmbH bei der Zertifizierung von Medizinprodukteherstellern 2004-11-24, Seite 1 Normensituation Medizinprodukte DIN EN ISO 9001:94 DIN EN ISO 9001:2000 DIN EN 46001/2:1996 DIN EN ISO
Erfahrungen der DQS GmbH bei der Zertifizierung von Medizinprodukteherstellern 2004-11-24, Seite 1 Normensituation Medizinprodukte DIN EN ISO 9001:94 DIN EN ISO 9001:2000 DIN EN 46001/2:1996 DIN EN ISO
POCT Pflicht und Kür für den Krankenhausapotheker. Christoph Braun Leitung POCT-Synlab Deutschland / Österreich / Schweiz
 Christoph Braun Leitung POCT-Synlab Deutschland / Österreich / Schweiz Ohne den absoluten Rückhalt der Geschäftsführung des Krankenhauses und der Mitarbeit des Pflegepersonals, ist eine Umsetzung Point
Christoph Braun Leitung POCT-Synlab Deutschland / Österreich / Schweiz Ohne den absoluten Rückhalt der Geschäftsführung des Krankenhauses und der Mitarbeit des Pflegepersonals, ist eine Umsetzung Point
Häufige Abweichungen bei der Probennahme
 Häufige Abweichungen bei der Probennahme Dr. Monika Baecker-Baumeister Birkenweg 11 31303 Burgdorf e-mail: info@baecker-baumeister.de www.baecker-baumeister.de Mobil: 0170-3150558 M B - B Programm 1. Grundvoraussetzungen
Häufige Abweichungen bei der Probennahme Dr. Monika Baecker-Baumeister Birkenweg 11 31303 Burgdorf e-mail: info@baecker-baumeister.de www.baecker-baumeister.de Mobil: 0170-3150558 M B - B Programm 1. Grundvoraussetzungen
Qualitätsmanagement = Patientensicherheit?
 Qualitätsmanagement = Patientensicherheit? Was wollen wir nicht?!!! Erwartungen Qualität Auch die Politik hat erkannt, dass Qualität in der Medizin wichtig ist, denn schlechte Qualität kostet Geld und
Qualitätsmanagement = Patientensicherheit? Was wollen wir nicht?!!! Erwartungen Qualität Auch die Politik hat erkannt, dass Qualität in der Medizin wichtig ist, denn schlechte Qualität kostet Geld und
Grundlagen der Labormedizin. Die analytische Phase
 Grundlagen der Labormedizin Die analytische Phase Die analytische Phase im diagnostischen Prozess Begriffe analytischer Qualität - Richtigkeit - Präzision - Genauigkeit Definition der Richtigkeit Die Richtigkeit
Grundlagen der Labormedizin Die analytische Phase Die analytische Phase im diagnostischen Prozess Begriffe analytischer Qualität - Richtigkeit - Präzision - Genauigkeit Definition der Richtigkeit Die Richtigkeit
Rückführbarkeit & Interpretation von Kalibrierergebnissen Inhalte, Zusammenhänge & Konformität
 Rückführbarkeit & Interpretation von Kalibrierergebnissen Inhalte, Zusammenhänge & Konformität Testo Industrial Services - 2016 Arnt König 1 Agenda 1 Das Kalibrierzertifikat - Musterdokument der Testo
Rückführbarkeit & Interpretation von Kalibrierergebnissen Inhalte, Zusammenhänge & Konformität Testo Industrial Services - 2016 Arnt König 1 Agenda 1 Das Kalibrierzertifikat - Musterdokument der Testo
Rückführbarkeit & Interpretation von Kalibrierergebnissen Inhalte, Zusammenhänge & Konformität. Testo Industrial Services
 Rückführbarkeit & Interpretation von Kalibrierergebnissen Inhalte, Zusammenhänge & Konformität Testo Industrial Services - 2015 Arnt König 1 Agenda 1 Das Kalibrierzertifikat - Musterdokument der Testo
Rückführbarkeit & Interpretation von Kalibrierergebnissen Inhalte, Zusammenhänge & Konformität Testo Industrial Services - 2015 Arnt König 1 Agenda 1 Das Kalibrierzertifikat - Musterdokument der Testo
DIN EN (VDE ): EN 62304: A1:2015
 Inhalt Vorwort...2 Europäisches Vorwort zu A1...3 Einleitung...10 1 Anwendungsbereich...14 1.1 *Zweck...14 1.2 *Anwendungsgebiet...14 1.3 Beziehung zu anderen Normen...14 1.4 Einhaltung...14 2 *Normative
Inhalt Vorwort...2 Europäisches Vorwort zu A1...3 Einleitung...10 1 Anwendungsbereich...14 1.1 *Zweck...14 1.2 *Anwendungsgebiet...14 1.3 Beziehung zu anderen Normen...14 1.4 Einhaltung...14 2 *Normative
Rili-BÄK 2008 Qualitätssicherung in der patientennahen Sofortdiagnostik (POCT)
 Rili-BÄK 2008 Qualitätssicherung in der patientennahen Sofortdiagnostik (POCT) Gabriele Schmidt 1 Rili-BÄK 2008 Übergangszeit zur Einführung ist am 31.03.2010 abgelaufen. Stand? Laboratorien: - Teil A
Rili-BÄK 2008 Qualitätssicherung in der patientennahen Sofortdiagnostik (POCT) Gabriele Schmidt 1 Rili-BÄK 2008 Übergangszeit zur Einführung ist am 31.03.2010 abgelaufen. Stand? Laboratorien: - Teil A
Informationen zum Thema Qualitätssicherung laboratoriumsmedizinischer Untersuchungen
 Informationen zum Thema ( Ringversuche ) Stand April 2015 Begriff Alle Ärzte, die laboratoriumsmedizinische Untersuchungen durchführen, müssen für festgelegte Laborleistungen quartalsweise einen Nachweis
Informationen zum Thema ( Ringversuche ) Stand April 2015 Begriff Alle Ärzte, die laboratoriumsmedizinische Untersuchungen durchführen, müssen für festgelegte Laborleistungen quartalsweise einen Nachweis
Prüfmittelmanagement und Messtechnische Rückführung
 Prüfmittelmanagement und Messtechnische Rückführung Messtechnik in Unternehmen und Prüfmittelmanagement 21. Juni 2012 TÜV Thüringen Akkreditierungsurkunde, gültig bis 2015 Diese Urkunde wurde uns im November
Prüfmittelmanagement und Messtechnische Rückführung Messtechnik in Unternehmen und Prüfmittelmanagement 21. Juni 2012 TÜV Thüringen Akkreditierungsurkunde, gültig bis 2015 Diese Urkunde wurde uns im November
Statistik Klausur. 1. a) Wie erfolgt die Erkennung systematische Fehler im Labor? b) Wie erfolgt die Erkennung zufälliger Fehler im Labor?
 Statistik Klausur 1. a) Wie erfolgt die Erkennung systematische Fehler im Labor? b) Wie erfolgt die Erkennung zufälliger Fehler im Labor? a) durch Richtigkeitskontrolle b) durch Präzisionskontrolle 2.
Statistik Klausur 1. a) Wie erfolgt die Erkennung systematische Fehler im Labor? b) Wie erfolgt die Erkennung zufälliger Fehler im Labor? a) durch Richtigkeitskontrolle b) durch Präzisionskontrolle 2.
Konformitätsbewertung E 14
 Antworten und Beschlüsse des EK-Med Konformitätsbewertung 3.9.8 E 14 Richtlinie 98/79/EG über In-vitro-Diagnostika Überprüfung der hergestellten Produkte nach Anhang II Liste A Für die Überprüfung der
Antworten und Beschlüsse des EK-Med Konformitätsbewertung 3.9.8 E 14 Richtlinie 98/79/EG über In-vitro-Diagnostika Überprüfung der hergestellten Produkte nach Anhang II Liste A Für die Überprüfung der
Qualifikation zur fachgebundenen genetischen Beratung nach dem Gendiagnostikgesetz (GenDG) * - Verfahrensregelungen Stand: 20.02.
 Qualifikation zur fachgebundenen genetischen Beratung nach dem Gendiagnostikgesetz (GenDG) * - Verfahrensregelungen Stand: 20.02.2012 - Nach 7 Abs. 3 i. V. m. 27 Abs. 4 GenDG dürfen Ärzte ab dem 1. Februar
Qualifikation zur fachgebundenen genetischen Beratung nach dem Gendiagnostikgesetz (GenDG) * - Verfahrensregelungen Stand: 20.02.2012 - Nach 7 Abs. 3 i. V. m. 27 Abs. 4 GenDG dürfen Ärzte ab dem 1. Februar
Johann Harer ANFORDERUNGEN AN MEDIZINPRODUKTE. Praxisleitfaden für Hersteller und Zulieferer. 2., überarbeitete Auflage HANSER
 Johann Harer ANFORDERUNGEN AN MEDIZINPRODUKTE Praxisleitfaden für Hersteller und Zulieferer 2., überarbeitete Auflage HANSER Inhalt 1 QM-Systeme 1 1.1 Einleitung 1 1.2 Die wesentlichen Anforderungen der
Johann Harer ANFORDERUNGEN AN MEDIZINPRODUKTE Praxisleitfaden für Hersteller und Zulieferer 2., überarbeitete Auflage HANSER Inhalt 1 QM-Systeme 1 1.1 Einleitung 1 1.2 Die wesentlichen Anforderungen der
Häufig gestellte Fragen zur Richtlinie der Bundesärztekammer zur Qualitätssicherung laboratoriumsmedizinischer Untersuchungen
 Allgemeine Fragen 1. Wer muss die Richtlinie anwenden? Rechtsgrundlage für die Anwendung der Richtlinie der Bundesärztekammer zur Qualitätssicherung laboratoriumsmedizinischer Untersuchungen, kurz Rili-BÄK
Allgemeine Fragen 1. Wer muss die Richtlinie anwenden? Rechtsgrundlage für die Anwendung der Richtlinie der Bundesärztekammer zur Qualitätssicherung laboratoriumsmedizinischer Untersuchungen, kurz Rili-BÄK
Aktuelle Knackpunkte" bei der Begutachtung mikrobiologischer Laboratorien für die Trinkwasseruntersuchung
 Akkreditierungskonferenz 2016 Aktuelle Knackpunkte" bei der Begutachtung mikrobiologischer Laboratorien für die Trinkwasseruntersuchung Dipl.-Biol. Benedikt Schaefer Fachgebiet Mikrobiologie des Trink-
Akkreditierungskonferenz 2016 Aktuelle Knackpunkte" bei der Begutachtung mikrobiologischer Laboratorien für die Trinkwasseruntersuchung Dipl.-Biol. Benedikt Schaefer Fachgebiet Mikrobiologie des Trink-
Fachgespräch Emissionsüberwachung Merkblatt
 Merkblatt zur Kalibrierung von automatischen Messeinrichtungen für Stickoxide (NO x ) und Kohlenmonoxid (CO) nach EN 14181 Die DIN EN 14181 Qualitätssicherung für automatische Messeinrichtungen fordert
Merkblatt zur Kalibrierung von automatischen Messeinrichtungen für Stickoxide (NO x ) und Kohlenmonoxid (CO) nach EN 14181 Die DIN EN 14181 Qualitätssicherung für automatische Messeinrichtungen fordert
Was geht Qualitätsmanagement/ Qualitätsicherung die Physiotherapeutenan? Beispiel einer zertifizierten Abteilung
 Was geht Qualitätsmanagement/ Qualitätsicherung die Physiotherapeutenan? Beispiel einer zertifizierten Abteilung Angestellten Forum des ZVK Stuttgart 04.03.2016 Birgit Reinecke ZentraleEinrichtungPhysiotherapieund
Was geht Qualitätsmanagement/ Qualitätsicherung die Physiotherapeutenan? Beispiel einer zertifizierten Abteilung Angestellten Forum des ZVK Stuttgart 04.03.2016 Birgit Reinecke ZentraleEinrichtungPhysiotherapieund
Vorgaben der DIN ISO 13528 Statistische Verfahren für Eignungsprüfungen durch Ringversuche
 Konsens- oder Referenzwerte in Ringversuchen Möglichkeiten und Grenzen Dr.-Ing. Michael Koch Institut für Siedlungswasserbau, Wassergüte und Abfallwirtschaft der Universität Stuttgart Arbeitsbereich Hydrochemie
Konsens- oder Referenzwerte in Ringversuchen Möglichkeiten und Grenzen Dr.-Ing. Michael Koch Institut für Siedlungswasserbau, Wassergüte und Abfallwirtschaft der Universität Stuttgart Arbeitsbereich Hydrochemie
Softwareentwicklung nach der ISO9001?
 Agenda Softwareentwicklung nach der ISO9001? von Robert Woll Motivation Einige aktuelle Herausforderungen für Unternehmen heutzutage: zunehmende Konkurrenz höhere Kundenanforderungen stärkere Integration
Agenda Softwareentwicklung nach der ISO9001? von Robert Woll Motivation Einige aktuelle Herausforderungen für Unternehmen heutzutage: zunehmende Konkurrenz höhere Kundenanforderungen stärkere Integration
Erfahrungen eines Labors
 Erfahrungen eines Labors Beispiel Einbindung externer Probenehmer Beziehungsgeflecht Trinkwasserverordnung 2001 Stand 5.12.2012 Trinkwasserinstallation?? Überschreitungen?? Gesundheitsamt 2 Pflichten aus
Erfahrungen eines Labors Beispiel Einbindung externer Probenehmer Beziehungsgeflecht Trinkwasserverordnung 2001 Stand 5.12.2012 Trinkwasserinstallation?? Überschreitungen?? Gesundheitsamt 2 Pflichten aus
Selbstauskunft von VMPA Mitgliedern
 Selbstauskunft von VMPA Mitgliedern 1. Rechtliche Identifizierbarkeit /Rechtsform /Kooperationen Name: Anschrift: Verantwortliche Leiter: Rechtsform Teil einer größeren Einheit - Rechtsform der gesamten
Selbstauskunft von VMPA Mitgliedern 1. Rechtliche Identifizierbarkeit /Rechtsform /Kooperationen Name: Anschrift: Verantwortliche Leiter: Rechtsform Teil einer größeren Einheit - Rechtsform der gesamten
Richtlinien des FLI für die Zulassung von PCR-Diagnostika
 Richtlinien des FLI für die Zulassung von PCR-Diagnostika Jana Heidrich Zulassungsstelle FLI-Insel Riems Antrag auf Zulassung Zulassung (5 Jahre) Bundesanzeiger Antrag auf Chargenprüfung ja nein Antrag
Richtlinien des FLI für die Zulassung von PCR-Diagnostika Jana Heidrich Zulassungsstelle FLI-Insel Riems Antrag auf Zulassung Zulassung (5 Jahre) Bundesanzeiger Antrag auf Chargenprüfung ja nein Antrag
EN ISO/IEC 17025:2017 Neue Anforderungen an die Kontaminantenanalytik
 EN ISO/IEC 17025:2017 Neue Anforderungen an die Kontaminantenanalytik Ronald Stelzer Qualitätsmanagement Lebensmittelsicherheit Struktur 1 Anwendungsbereich 2 Normative Verweisungen 3 Begriffe 4 Allgemeine
EN ISO/IEC 17025:2017 Neue Anforderungen an die Kontaminantenanalytik Ronald Stelzer Qualitätsmanagement Lebensmittelsicherheit Struktur 1 Anwendungsbereich 2 Normative Verweisungen 3 Begriffe 4 Allgemeine
Alternative Verfahren nach TrinkwV 2001 in der Mikrobiologie Anwendung und Beurteilung in Ringversuchen
 7.0.05 Alternative Verfahren nach TrinkwV 00 in der Mikrobiologie Anwendung und Beurteilung in Ringversuchen Dr. Katrin Luden Roesebeckstr. -6 09 Hannover Fon 05/505-0 Fax 05/505-0 Lüchtenburger Weg 660
7.0.05 Alternative Verfahren nach TrinkwV 00 in der Mikrobiologie Anwendung und Beurteilung in Ringversuchen Dr. Katrin Luden Roesebeckstr. -6 09 Hannover Fon 05/505-0 Fax 05/505-0 Lüchtenburger Weg 660
Diagnostik bei Infektionskrankheiten: POCT, Mikrobiologie wann und wie?
 : Antibiotika-Verordnung in der ambulanten Versorgung Diagnostik bei Infektionskrankheiten: POCT, Mikrobiologie wann und Dr. POCT? Definition Eine einheitliche Definition von Point-of-Care-Testing existiert
: Antibiotika-Verordnung in der ambulanten Versorgung Diagnostik bei Infektionskrankheiten: POCT, Mikrobiologie wann und Dr. POCT? Definition Eine einheitliche Definition von Point-of-Care-Testing existiert
Checkliste Validierungsplan PeelVue selbstklebende Sterilisationsbeutel
 Checkliste Validierungsplan PeelVue selbstklebende Sterilisationsbeutel Erstvalidierung Revalidierung (turnusmäßig, nur erneute Leistungsbeurteilung) Verantwortlichkeiten Name der Einrichtung (Betreiber)
Checkliste Validierungsplan PeelVue selbstklebende Sterilisationsbeutel Erstvalidierung Revalidierung (turnusmäßig, nur erneute Leistungsbeurteilung) Verantwortlichkeiten Name der Einrichtung (Betreiber)
INFORMATIONEN FÜR DIE PRAXIS
 INFORMATIONEN FÜR DIE PRAXIS Labor September 2011 Qualitätssicherung laboratoriumsmedizinischer Untersuchungen: Erläuterungen zur Richtlinie der Bundesärztekammer Für Laboruntersuchungen gelten umfangreiche
INFORMATIONEN FÜR DIE PRAXIS Labor September 2011 Qualitätssicherung laboratoriumsmedizinischer Untersuchungen: Erläuterungen zur Richtlinie der Bundesärztekammer Für Laboruntersuchungen gelten umfangreiche
Die neue RiliBÄK 2008 Betreiberüberwachung aus der Sicht der Überwachungsbehörde
 Die neue RiliBÄK 2008 Betreiberüberwachung aus der Sicht der Überwachungsbehörde 22.09 2009 R. Schumacher 1 Rechtliche Vorgaben Medizinproduktegesetz 26: Durchführung der Überwachung...Einrichtungen, in
Die neue RiliBÄK 2008 Betreiberüberwachung aus der Sicht der Überwachungsbehörde 22.09 2009 R. Schumacher 1 Rechtliche Vorgaben Medizinproduktegesetz 26: Durchführung der Überwachung...Einrichtungen, in
Praxishandbuch. Kinder- und Jugendarztpraxis. Fürth
 Fürth 1. Einleitung Herzlich Willkommen Was wir unter menschlicher Kinderheilkunde verstehen, wie wir arbeiten, und was wir für Sie tun können, erfahren Sie auf den nächsten Seiten. Das Praxishandbuch
Fürth 1. Einleitung Herzlich Willkommen Was wir unter menschlicher Kinderheilkunde verstehen, wie wir arbeiten, und was wir für Sie tun können, erfahren Sie auf den nächsten Seiten. Das Praxishandbuch
(GEKO) für die Anforderungen an die Qualitätssicherung genetischer Analysen zu medizinischen Zwecken gemäß 23 Abs. 2 Nr. 4 GenDG
 Bundesgesundheitsbl 2013 56:163 168 DOI 10.1007/s00103-012-1574-4 Springer-Verlag Berlin Heidelberg 2013 Richtlinien der Gendiagnostik-Kommission Richtlinie der Gendiagnostik-Kommission (GEKO) für die
Bundesgesundheitsbl 2013 56:163 168 DOI 10.1007/s00103-012-1574-4 Springer-Verlag Berlin Heidelberg 2013 Richtlinien der Gendiagnostik-Kommission Richtlinie der Gendiagnostik-Kommission (GEKO) für die
Labororganisation - Qualitätsmanagement Rechtliche Bestimmungen
 Labororganisation - Qualitätsmanagement Rechtliche Bestimmungen Dr. Christoph Weisbrich Institut für Laboratoriumsmedizin, Klinische Chemie und Molekulare Diagnostik (Direktor: Prof. Dr. med. Joachim Thiery)
Labororganisation - Qualitätsmanagement Rechtliche Bestimmungen Dr. Christoph Weisbrich Institut für Laboratoriumsmedizin, Klinische Chemie und Molekulare Diagnostik (Direktor: Prof. Dr. med. Joachim Thiery)
Qualitätsmanagement in klinischen Prüfungen
 Qualitätsmanagement in klinischen Prüfungen Dr. Bärbel Witte und Medizinprodukte FG Klinische Prüfungen - GCP Inspektionen Themen Richtlinien, nach denen Qualitäts- Management in klinischen Prüfungen gefordert
Qualitätsmanagement in klinischen Prüfungen Dr. Bärbel Witte und Medizinprodukte FG Klinische Prüfungen - GCP Inspektionen Themen Richtlinien, nach denen Qualitäts- Management in klinischen Prüfungen gefordert
Wichtige Feldkorrekturmassnahme
 Wichtige Feldkorrekturmassnahme 11220075, Rev. A März 2015 ADVIA Klinisch - chemische Analysesysteme Empfohlene Wiederholungsbestimmungen für Lipase Gemäss unserer Dokumentation haben Sie folgendes Produkt
Wichtige Feldkorrekturmassnahme 11220075, Rev. A März 2015 ADVIA Klinisch - chemische Analysesysteme Empfohlene Wiederholungsbestimmungen für Lipase Gemäss unserer Dokumentation haben Sie folgendes Produkt
Wesentliche Änderung EN 9100:2016 / EN 9120: München/Hamburg Michael Rotzsche/ Wolfgang Bott
 Wesentliche Änderung EN 9100:2016 / EN 9120:2016 Wesentliche Änderung EN 9100:2016 / EN 9120:2016 15.-16.03.2017 München/Hamburg Michael Rotzsche/ Wolfgang Bott 4.3 Festlegung des Anwendungsbereiches des
Wesentliche Änderung EN 9100:2016 / EN 9120:2016 Wesentliche Änderung EN 9100:2016 / EN 9120:2016 15.-16.03.2017 München/Hamburg Michael Rotzsche/ Wolfgang Bott 4.3 Festlegung des Anwendungsbereiches des
DACH Deutsche Akkreditierungsstelle Chemie GmbH
 Anforderungen zur Messunsicherheit DIN EN 45001 Allgemeine Kriterien zum Betreiben von Prüflaboratorien Messungen müssen, soweit sinnvoll, auf internationale Messnormale rückgeführt werden. Die vorhandenen
Anforderungen zur Messunsicherheit DIN EN 45001 Allgemeine Kriterien zum Betreiben von Prüflaboratorien Messungen müssen, soweit sinnvoll, auf internationale Messnormale rückgeführt werden. Die vorhandenen
Grundlagen der metrologischen Rückführung. Marc Renz, Qualitätsmanager, esz AG calibration & metrology
 Grundlagen der metrologischen Rückführung Marc Renz, Qualitätsmanager, esz AG calibration & metrology Was ist Kalibrieren? Was ist Rückführung? Kalibrieren bedeutet das Bestimmen und Dokumentieren der
Grundlagen der metrologischen Rückführung Marc Renz, Qualitätsmanager, esz AG calibration & metrology Was ist Kalibrieren? Was ist Rückführung? Kalibrieren bedeutet das Bestimmen und Dokumentieren der
Rili-BÄK und mehr zukunftsfähiges Qualitätsmanagement rund um POCT Glukose
 Rili-BÄK und mehr zukunftsfähiges Qualitätsmanagement rund um POCT Glukose Qualitätssicherung, Qualitätsmanagement und moderne Prozessdokumentation rund um Patientennahe Sofortdiagnostik. Astrid Petersmann
Rili-BÄK und mehr zukunftsfähiges Qualitätsmanagement rund um POCT Glukose Qualitätssicherung, Qualitätsmanagement und moderne Prozessdokumentation rund um Patientennahe Sofortdiagnostik. Astrid Petersmann
Institut für Immunologie und Transfusionsmedizin
 Institut für Immunologie und Transfusionsmedizin 292 Leiter: Univ.-Prof. Dr. med. A. Greinacher Daten und Fakten 293 Abteilung für Transfusionsmedizin Ferdinand-Sauerbruch-Straße 17475 Greifswald Telefon:
Institut für Immunologie und Transfusionsmedizin 292 Leiter: Univ.-Prof. Dr. med. A. Greinacher Daten und Fakten 293 Abteilung für Transfusionsmedizin Ferdinand-Sauerbruch-Straße 17475 Greifswald Telefon:
Tools for Business Success WISSEN WERKZEUGE WEITERBILDUNGSMEDIEN. Design-Review. Sofort nutzbar Permanente Updates In der Praxis erprobt
 Tools for Business Success WISSEN WERKZEUGE WEITERBILDUNGSMEDIEN Sofort nutzbar Permanente Updates In der Praxis erprobt Projekt-Nr. Internes Review Externes Review Projekttitel (mit Ausgabestand) Sonstige:
Tools for Business Success WISSEN WERKZEUGE WEITERBILDUNGSMEDIEN Sofort nutzbar Permanente Updates In der Praxis erprobt Projekt-Nr. Internes Review Externes Review Projekttitel (mit Ausgabestand) Sonstige:
Vom 16.12.2010. Mit diesem Beschluss wird das Erweiterte Neugeborenen-Screening an die Regelungen des Gendiagnostikgesetzes (GenDG) angepasst.
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Kinder-Richtlinien: Anpassung des Erweiterten Neugeborenen-Screenings an das Gendiagnostikgesetz Vom 16.12.2010 Rechtsgrundlagen
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Kinder-Richtlinien: Anpassung des Erweiterten Neugeborenen-Screenings an das Gendiagnostikgesetz Vom 16.12.2010 Rechtsgrundlagen
Sie wendet sich sowohl an die KBS als auch an die Begutachter der DAkkS.
 Sektorspezifische Kriterien zur Teilnahme an Eignungsprüfungen für im Umweltbereich tätige Prüflaboratorien, die eine Akkreditierung auf Basis der Fachmodule beantragen oder besitzen 71 SD 4 035 Revision:
Sektorspezifische Kriterien zur Teilnahme an Eignungsprüfungen für im Umweltbereich tätige Prüflaboratorien, die eine Akkreditierung auf Basis der Fachmodule beantragen oder besitzen 71 SD 4 035 Revision:
Thema: Labor Oktober Qualitätssicherung laboratoriumsmedizinischer Untersuchungen: Erläuterungen zur Richtlinie der Bundesärztekammer
 Qualitätssicherung laboratoriumsmedizinischer : Erläuterungen zur Richtlinie der Bundesärztekammer Für Laboruntersuchungen gelten umfangreiche Vorgaben zur Qualitätssicherung. Grundlage bildet die Richtlinie
Qualitätssicherung laboratoriumsmedizinischer : Erläuterungen zur Richtlinie der Bundesärztekammer Für Laboruntersuchungen gelten umfangreiche Vorgaben zur Qualitätssicherung. Grundlage bildet die Richtlinie
Checkliste zur Überprüfung des QMS in der öffentlichen Apotheke
 Landesamt für soziale Dienste Schleswig-Holstein - Abt. Gesundheitsschutz - Checkliste zur Überprüfung des QMS in der öffentlichen Apotheke (ohne Versandhandel, Stellen/Verblistern, Krankenhaus-und Heimbelieferung,
Landesamt für soziale Dienste Schleswig-Holstein - Abt. Gesundheitsschutz - Checkliste zur Überprüfung des QMS in der öffentlichen Apotheke (ohne Versandhandel, Stellen/Verblistern, Krankenhaus-und Heimbelieferung,
Beurteilungen von Veränderungen in der Protein-Elektrophorese
 1 Beurteilungen von Veränderungen in der Protein-Elektrophorese Darstellung - Kurvenbild (Pherogramm) - Quantitative Veränderungen Interpretation - Bewertung der Relevanz - Kommentierung Protein-Elektrophorese
1 Beurteilungen von Veränderungen in der Protein-Elektrophorese Darstellung - Kurvenbild (Pherogramm) - Quantitative Veränderungen Interpretation - Bewertung der Relevanz - Kommentierung Protein-Elektrophorese
Kalibrierung als Grundlage für sichere Prüfergebnisse
 Prüfen mit Verstand Kalibrierung als Grundlage für sichere Prüfergebnisse Stephan Baumann Oktober 2016 Kalibrierung Das internationale Wörterbuch der Metrologie definiert Kalibrierung sehr präzise. Kalibrierung:
Prüfen mit Verstand Kalibrierung als Grundlage für sichere Prüfergebnisse Stephan Baumann Oktober 2016 Kalibrierung Das internationale Wörterbuch der Metrologie definiert Kalibrierung sehr präzise. Kalibrierung:
Sanktionierte Interpretationen ("SIs") Häufig gestellte Fragen ("FAQs")
 VDA Band 6 Teil 1 QM-Systemaudit Serienproduktion Sanktionierte Interpretationen ("SIs") und Häufig gestellte Fragen ("FAQs") Der VDA Band 6 Teil 1, QM-Systemaudit Serienproduktion (5. überarbeitete Ausgabe,
VDA Band 6 Teil 1 QM-Systemaudit Serienproduktion Sanktionierte Interpretationen ("SIs") und Häufig gestellte Fragen ("FAQs") Der VDA Band 6 Teil 1, QM-Systemaudit Serienproduktion (5. überarbeitete Ausgabe,
Pathobiochemie und klinisch-chemische Diagnostik. SS 2015 Stefan Wölfl
 Pathobiochemie und klinisch-chemische Diagnostik SS 2015 Stefan Wölfl Einführung in die allgemeine Klinische Chemie Überblick zur Vorlesung Allgemeine Klinische Chemie Patho-Biochemie Pathologische Veränderung
Pathobiochemie und klinisch-chemische Diagnostik SS 2015 Stefan Wölfl Einführung in die allgemeine Klinische Chemie Überblick zur Vorlesung Allgemeine Klinische Chemie Patho-Biochemie Pathologische Veränderung
Durchführung und Ergebnisse des Ringversuchs Salmonella - Nachweis in Geflügelkot 2009
 FEDERAL INSTITUTE FOR RISK ASSESSMENT Durchführung und Ergebnisse des Ringversuchs Salmonella - Nachweis in Geflügelkot 2009 Alexandra Friedrich, Christina Dorn, Christine Sommerfeld, Burkhard Malorny
FEDERAL INSTITUTE FOR RISK ASSESSMENT Durchführung und Ergebnisse des Ringversuchs Salmonella - Nachweis in Geflügelkot 2009 Alexandra Friedrich, Christina Dorn, Christine Sommerfeld, Burkhard Malorny
Rili-BÄK Fortbildungsprogramm: Neue Richtlinienteile und Erfahrungen. Peter Ackermann, Bio-Rad Laboratories GmbH
 Rili-BÄK Fortbildungsprogramm: Neue Richtlinienteile und Erfahrungen Peter Ackermann, Bio-Rad Laboratories GmbH Was ist passiert seit April 2010? oder www.bundesaerztekammer.de 11 FAQ Stand Juli 2011 2
Rili-BÄK Fortbildungsprogramm: Neue Richtlinienteile und Erfahrungen Peter Ackermann, Bio-Rad Laboratories GmbH Was ist passiert seit April 2010? oder www.bundesaerztekammer.de 11 FAQ Stand Juli 2011 2
Maschinensicherheit in der EU
 Maschinensicherheit in der EU Die Maschinenrichtlinie Karlsruhe, April 2015 Fritz Zoermer TÜV SÜD Industrie Service GmbH Maschinensicherheit in der EU Die Maschinenrichtlinie Folie 1 Inhalt 1 Die Richtlinie
Maschinensicherheit in der EU Die Maschinenrichtlinie Karlsruhe, April 2015 Fritz Zoermer TÜV SÜD Industrie Service GmbH Maschinensicherheit in der EU Die Maschinenrichtlinie Folie 1 Inhalt 1 Die Richtlinie
Zertifikat. Ringversuch: OB2/14 im Monat: September 2014 Teilnehmer-Nr.: ausgestellt am: Referenzinstitut für Bioanalytik
 Ringversuch: OB2/14 im Monat: September 214 Teilnehmer-Nr.: 72711 ausgestellt am: 2.9.14 Referenzinstitut für Bioanalytik Städt. Klinikum Braunschweig ggmbh Institut für Mikrobiologie Immunologie und Krankenhaushygiene
Ringversuch: OB2/14 im Monat: September 214 Teilnehmer-Nr.: 72711 ausgestellt am: 2.9.14 Referenzinstitut für Bioanalytik Städt. Klinikum Braunschweig ggmbh Institut für Mikrobiologie Immunologie und Krankenhaushygiene
Mindestanforderungen zur Akkreditierung der optischen Funkenemissionsspektrometrie (OES)
 Mindestanforderungen zur Akkreditierung der optischen Funkenemissionsspektrometrie (OES) 71 SD 1 005 Revision: 1.1 24. Februar 2014 Geltungsbereich: Diese Regel enthält verbindliche Anforderungen an Prüflaboratorien
Mindestanforderungen zur Akkreditierung der optischen Funkenemissionsspektrometrie (OES) 71 SD 1 005 Revision: 1.1 24. Februar 2014 Geltungsbereich: Diese Regel enthält verbindliche Anforderungen an Prüflaboratorien
Software gestützte Bildanalytik am Beispiel der Immunfluoreszenz an HEp-2 Zellen Rico Hiemann Senftenberg
 Software gestützte Bildanalytik am Beispiel der Immunfluoreszenz an HEp-2 Zellen Rico Senftenberg 1/20 HEp-2 aktuell HEp-2 Probleme HEp-2 Ziele Automatische Auswertung Probleme der Automatik Neue Ziele
Software gestützte Bildanalytik am Beispiel der Immunfluoreszenz an HEp-2 Zellen Rico Senftenberg 1/20 HEp-2 aktuell HEp-2 Probleme HEp-2 Ziele Automatische Auswertung Probleme der Automatik Neue Ziele
Probennahme Wasser DIN EN 19548
 Probennahme Wasser DIN EN 19548 Allgemein: Qualifikation der Probennehmer Die Probennahme muss nach den allgemein anerkannten Regeln der Technik erfolgen anerkannte Schulung der Probennehmer z.b. durch
Probennahme Wasser DIN EN 19548 Allgemein: Qualifikation der Probennehmer Die Probennahme muss nach den allgemein anerkannten Regeln der Technik erfolgen anerkannte Schulung der Probennehmer z.b. durch
Aktuelle Themen der Saatgutanerkennung
 Aktuelle Themen der anerkennung Sachsen-Anhalt am 14. April 2016 Sachsen-Anhalt Entwicklung der Vermehrung 2004-2015 Sachsen-Anhalt Potenziell (Sachsen-Anhalt) 26.000 Deutschland 19.425 260.000 23.000
Aktuelle Themen der anerkennung Sachsen-Anhalt am 14. April 2016 Sachsen-Anhalt Entwicklung der Vermehrung 2004-2015 Sachsen-Anhalt Potenziell (Sachsen-Anhalt) 26.000 Deutschland 19.425 260.000 23.000
Häufige Abweichungen bei Begutachtungen durch die Akkreditierungsstelle auf Grundlage der DIN EN ISO/IEC 17025:2018
 Häufige Abweichungen bei Begutachtungen durch die Akkreditierungsstelle auf Grundlage der DIN EN ISO/IEC 17025:2018 Vortrag vom 17.01.2019 Dipl.-Ing. Wolfgang Kamphuis 1 Regeln für den Begutachter DIN
Häufige Abweichungen bei Begutachtungen durch die Akkreditierungsstelle auf Grundlage der DIN EN ISO/IEC 17025:2018 Vortrag vom 17.01.2019 Dipl.-Ing. Wolfgang Kamphuis 1 Regeln für den Begutachter DIN
