Übungen zur Massenspektrometrie
|
|
|
- Fritz Otto
- vor 7 Jahren
- Abrufe
Transkript
1 Übungen zur Massenspektrometrie T.Lehmann, SS97 / WS Sie sehen nachfolgend das erste Massenspektrum, das Sie auswerten sollen. Die Ordinate ist eine Prozentskala, die dem intensivsten Peak die Intensität 100 % zuweist. Dieser Peak heißt Basispeak. Die Intensität aller anderen Peaks wird also als relative Intensität bezogen auf den Basispeak beschrieben. Massenspektren sind wie ein zu lösendes Puzzle. Es gibt kein Schema F zur Interpretation, sondern Sie müssen möglichst intelligent herumprobieren, bis alle Zuordnungen richtig passen. Der wichtigste Peak ist natürlich der Molpeak, der im Prinzip die Summenformel der Substanz repräsentiert. Gibt es im Molpeakbereich eine Gruppe von Peaks, so liegt der Verdacht nahe, dass eines oder mehrere Atome des Moleküls in mehreren Isotopen vorkommen. In diesem Fall sehen Sie 3 Peaks. Nehmen Sie die Abbildungen des esse, Meier, Zeeh zur Isotopenverteilung zu ilfe, um aus dem Intensitätsverhältnis herauszufinden, um welche Elemente es sich handeln könnte! 1 Die Spektren sind entnommen aus: SDBSWeb : (National Institute of Advanced Industrial Science and Technology, 2008) - 1 -
2 Die Spektren von isotopenhaltigen Verbindungen sind häufig sehr leicht zu interpretieren, weil auch den Peaks der Fragmentionen stets angesehen werden kann, ob das isotopenhaltige Element bereits abgespalten worden ist oder nicht. Analysieren Sie auch hier unter Zuhilfenahme des esse, Meier, Zeeh! Wenden Sie Ihr Augenmerk nach der Analyse des Molpeaks den Fragmentionen mit den höchsten Massenzahlen zu, da relativ sicher ist, dass diese Fragmentionen direkt durch Spaltung des Molekülions entstanden sind! Tasten Sie sich von dort immer weiter zu den niedrigeren Massenzahlen vor, bis das Spektrum interpretiert ist. Es wird Ihnen dabei nur selten gelingen, alle Peaks zu interpretieren. Je mehr Peaks Sie aber auswerten können, umso sicherer ist die Aussage, die Sie aus dem Spektrum entnehmen können. Wenn Sie keine weitere Zusatzinformationen haben, so ist eine Auswertung des Massenspektrums natürlich sehr schwer. Als ilfe sei Ihnen deshalb noch genannt, dass die hier herauszufindende Substanz nach dem Befund des 1-NMR-Spektrums nur eine Sorte Wasserstoffatome enthält. dass die Substanz halogenhaltig ist. (Analytisch kann man alogengehalt übrigens mit der Beilstein-Probe nachweisen, wobei man ein Stück Kupfer (Draht) mit der Probe tränkt und in die Bunsenflamme hält. Informieren Sie sich über Empfindlichkeit und Aussagekraft dieses andversuchs. Wenn Sie ein Massenspektrum interpretieren wollen, müssen Sie sich Zeit nehmen und sehr intensiv nachdenken! Rechnen Sie zur Auswertung dieses Spektrums mit mindestens 30 Minuten! Was Sie bei der Interpretation eines Massenspektrums beachten sollten: Wenn Sie ein Massenspektrum interpretieren, so formulieren Sie für die Zerfallsreaktion stets eine Reaktionsgleichung unter Verwendung von Strukturformeln. Es macht dabei zunächst nichts, wenn die von Ihnen hingeschriebenen Strukturen der Zerfallsprodukte mehr oder weniger hypothetisch sind. Sie erhalten so aber eine Vorstellung von der Struktur der Fragmente und können nur so beurteilen, ob z.b. ein CO-Verlust oder eine Onium-Reaktion im konkreten Fall möglich ist. Wenn Sie nur Summenformeln verwenden, so ist es dagegen fast sicher, dass Sie sich bei der Auswertung verhaspeln! Wenn Sie in ihren späteren wissenschaftlichen Ergebnisberichten massenspektroskopische Daten veröffentlichen, so werden Sie seriöserweise spekulative Strukturen durch Summenformeln ersetzen. Um Ihre Gedankengänge in den Versuchsprotokollen für das Praktikum nachvollziehen zu können, werden dort aber grundsätzlich Strukturformeln verlangt. Machen Sie sich strikt den folgenden schon im MS-Skript beschriebenen Sachverhalt klar: Das bei Elektronenbeschuss entstehende Radikalkation kann bei den nachfolgenden Zerfallsreaktionen die Eigenschaft ungerade Elektronenzahl und positive Ladung nur auf jeweils eines der beiden Zerfallsprodukte vererben. Aus dem Radikalkation können also entstehen: Ein Radikalkation + ein ungeladenes Teilchen mit geradzahliger Elektronenzahl oder Ein Radikal (Ein Elektron ist ungepaart) + ein Kation mit geradzahliger Elektronenzahl Dies gilt selbstverständlich auch für alle Zerfallsprodukte, bei denen es sich um ein Radikalkation handelt. at ein positiv geladenes Fragmention dagegen eine geradzahlige Elektronenzahl, so können daraus entstehen: Ein Kation + ein ungeladenes Teilchen mit geradzahliger Elektronenzahl oder - 2 -
3 Ein Radikalkation + ein Radikal (D.h. bei der Fragmentierung ist ein Elektronenpaar homolytisch gespalten worden!) Natürlich werden Fragmentionen das Bestreben haben, die Elektronen so weit als möglich zu paaren. Bei ungeladenen Teilchen mit geradzahliger Elektronenzahl wird es sich also häufig um Fragmente mit vollständig gepaarten Elektronen handeln. Solche Teilchen entsprechen am ehesten dem, was Sie bisher an Chemie außerhalb des Massenspektrometers gewohnt sind. Bei fortschreitender Fragmentierung ist die vollständige Paarung aber häufig nicht mehr möglich und es liegen statt dessen mehrfache Radikale vor. Machen Sie sich dies klar, indem Sie die Abspaltung der beiden alogenatome aus 1,3-Dibrombenzol auf dem Papier nachvollziehen! Machen Sie sich bei jeder Fragmentierung klar, ob die vererbte Ladung bzw. das einsame Elektron bei der von Ihnen formulierten Struktur an einem Atom lokalisiert oder aber delokalisiert ist! Siehe dazu auch die nachfolgenden Übungsaufgaben. Fragmentierungen im Massenspektrometer sind umso wahrscheinlicher, je stabiler die erhaltenen Fragmente sind. Auch dies können Sie nur beurteilen, wenn Sie für die Fragmente Strukturformeln anschreiben. Richten Sie Ihr Augenmerk darauf, auf welche Positionen Ladungen oder einsame Elektronen (Radikale) günstig platziert werden oder ob stabile Neutralteilchen (z.b. CO CO 2 2 O) abgespalten werden können. Beurteilen Sie stets beide Produkte einer Fragmentierung! Die nach der Spaltung vorliegenden Fragmente können sich durch weitreichende Gerüstumlagerungen stabilisieren. Auch diese Umlagerungen lassen sich z.t. durch Regeln systematisieren. Wenn Sie solche Umlagerungen in Erwägung ziehen, so halten Sie sich an das, was gemäß diesen Regeln als wahrscheinlich anzunehmen ist! Für den Begriff der Stabilität dürfen Sie nicht die Maßstäbe anlegen, die Sie von den Substanzen in Ihren Kolben im Labor gewohnt sind. Bedenken Sie, dass die in einem Massenspektrometer nachgewiesenen Teilchen nur eine Lebenszeit von wenigen Mikrosekunden hatten und während dieser Zeit vollkommen mit sich selbst fertig werden mussten, also keinerlei Reaktionspartner hatten! Diese Bemerkung soll Sie nicht dazu anspornen, wilde Phantasien bei der Interpretation zu entwickeln. Vielmehr müssen Sie lernen, dass es in der evakuierten Welt des Massenspektrometers eigene Gesetzmäßigkeiten gibt! Je stabiler die Zerfallsprodukte, umso intensiver wird der zugehörige Peak. Bei Peaks mit hoher Intensität müssen Sie sich also energetisch besonders günstige Strukturen einfallen lassen. Erwerben Sie frühestmöglich ein so ausreichendes Wissen, dass Sie beim Anblick einer chemischen Strukturformel gewisse Erwartungen hegen, in welcher Weise die Substanz im Massenspektrometer wohl fragmentieren muss. Folgende Standardreaktionen sollten Sie kennen: (Formulieren Sie die Reaktionsgleichungen!) Aus halogenhaltigen Verbindungen wird das alogen fast immer leicht abgespalten. Dies erfolgt entweder homolytisch (Abgespalten wird also das ungeladene alogenradikal) oder zusammen mit einem Wasserstoffatom. (abgespalten wird also die alogenwasserstoffsäure.) Phenole spalten Kohlenmonoxid ab, Aniline auf analoge Weise Blausäure (CN). Auch aromatische N-eterocyclen spalten Blausäure ab. Nitrogruppen spalten ab: O, NO. und NO2. Für den NO-Verlust ist eine vorhergehende Umlagerung zum Salpetrigsäureester notwendig
4 Aromatische Kerne spalten Acetylen ab. Wenn m/z = 77 als Phenylkation gedeutet wird, so muss immer auch nach der Masse m/z = = 51 (Cyclobutadienylkation) gesucht werden. Aromaten mit Seitenketten spalten in der benzylischen Stellung unter Bildung des Tropyliumkations. Dieses zerfällt weiter unter sukzessiver Abspaltung von Acetylen. Wenn Sie die Masse m/z = 91 detektieren und dem Tropyliumkation zuordnen wollen, so sollten Sie den Befund also immer durch die Massen m/z = = 65 (Cyclopentadienylkation) und m/z = = 39 (Cyclopropenylkation) absichern. Das Tropyliumkation hat eine außerordentlich hohe Bildungstendenz. Bei Aromaten mit unverzweigter Seitenkette ist die Masse m/z = 91 in der Regel der Basispeak. Aber auch, wenn in der benzylischen Stellung eine Verzweigung vorliegt und das Tropyliumkation auf dem Papier nicht mehr ohne weiteres durch einfache Spaltung erhalten werden kann, ist die Masse m/z = 91 im Spektrometer häufig dennoch zu beobachten. (Z.B. bei tert. Butylbenzol) Meist ist der Peak dann aber wenig intensiv. Denken Sie daran, dass es auch nichtbenzoide Aromaten gibt! Auch diese können in der Benzylstellung fragmentieren. Das entstehende Fragment hat dann natürlich nicht mehr die Masse m/z = 91! Manchmal bleibt in der Interpretation der Zerfallskette eine Deutungslücke. Ein Beispiel ist das eben genannte Tropyliumkation, wenn es aus einem Aromaten mit verzweigter Seitenkette entstanden ist. In diesem Falle können Sie zwar die Folgezerfälle erkennen, wissen aber nicht genau, wie das Tropyliumkation entstanden ist. Verzichten Sie in so einem Fall darauf, sich etwas aus den Fingern zu saugen und lassen also die Deutungslücke offen. Ein anderes Beispiel ist das Phenylkation, welches manchmal auch bei mehrfach substituierten Aromaten nachzuweisen ist. Verzweigte Kohlenwasserstoffketten spalten bevorzugt an der Verzweigungsstelle. (Es verbleibt ein sekundäres oder sogar tertiäres Kation!) Auf der Alkoholseite spalten Carbonsäureester sowohl den Alkyl- wie auch den Alkoxyund den Alkoxycarbonylrest ab! Bei allen drei Zerfällen können jeweils beide entstehenden Töchter Ladungsträger sein. Der Peak für die Abspaltung des Alkylrestes kann auch einmal sehr klein sein oder ganz fehlen. at die Carbonsäureseite mindestens 3 lineare Kohlenstoffatome, so ist eine Fragmentierung nach McLafferty möglich. Es können Isomerisierungen verschiedenster Art auftreten. Die Umlagerung des Benzylkations in das Tropyliumkation wurde schon erwähnt. Ein anderes Beispiel sind Ringgrößenänderungen, z.b. vom Typ Cyclohexan -> Methylcyclopentan und umgekehrt. Wenn durch Protonenwanderung eine Delokalisation oder sogar Rearomatisierung der Struktur erreichen kann, so ist diese Umlagerung stets wahrscheinlich
5 Aufgabe 2: Bei den in dieser Aufgabe zu lösenden Problemen handelt es sich nicht um die Interpretation konkreter Spektren, sondern vielmehr um eine Art Fingerübungen zur korrekten Formulierung von Zerfallsstrukturen. Nehmen Sie an, ein Molekül enthielte ein Bromatom und sei im Massenspektrometer zum Radikalkation ionisiert worden. Der organische Molekülrest hat also irgendwo ein Elektron verloren, ist jetzt also positiv geladen und hat auch ein nicht gepaartes Elektron. Die Verhältnisse zeigt schematisch die folgende Abbildung: +. Br Nehmen Sie an, bei der nachfolgenden Fragmentierung würde das Bromatom so abgespalten, dass der organische Rest die Ladung behielte und als Fragmention nachgewiesen werden würde. Wie müsste die betreffende Bindung gespalten werden? Welches der beiden Fragmente hätte eine ungerade Elektronenzahl? Beantworten Sie die gleichen Fragen für den Fall, dass statt des Bromatoms Bromwasserstoff abgespalten würde! In der folgenden Reihe sehen Sie drei Formeln. Alle Wasserstoffatome sind eingezeichnet. Alle offenen Valenzen bleiben frei. An welcher Position sitzt die Ladung? Gibt es Mesomeriestabilisierungen? Gibt es ein ungepaartes Elektron? 3 C O 3 C O 3 C O Vervollständigen Sie auch bei den letzten Beispielen die Formeln entsprechend! Freie Valenzen werden dazu zunächst so weit als möglich mit Mehrfachbindungen abgesättigt. Die fertigen Strukturen sollen eine positive Ladung erhalten. Es ist Ihre Aufgabe zu entscheiden, ob das Molekül dazu ein ungepaartes Elektron haben muss oder nicht. Untersuchen Sie zusätzlich, ob sich durch Umlagerungen energetisch günstigere Zustände erreichen lassen! - 5 -
6 Aufgabe 3: Interpretieren Sie die gekennzeichneten Massen des sec-butyl-iso-butylamins. inweis: Bei mehreren Zerfällen handelt es sich um Mc-Lafferty- und Oniumreaktionen. C 3 N 3 C C 3 C 3-6 -
7 Aufgabe 4: Es mag Sie überraschen, aber die Substanzen der beiden folgenden Spektren sind zueinander isomer. Sie haben also die gleiche Summenformel. Welche Schlussfolgerungen können Sie daraus ziehen? Beginnen Sie die Interpretation mit dem ersten Spektrum. Wenn Sie sich den Molpeakbereich näher ansehen, ist die Zuordnung - auch der Fragmente - nicht weiter schwer
8 Aufgabe 5: Interpretieren Sie das Massenspektrum der Buttersäure! - 8 -
9 Aufgabe 6: Dieses Spektrum stammt von einem Naphthalinderivat. Bitte werten Sie die angekreuzten Peaks aus! Richten Sie Ihr Augenmerk dabei auch auf die Massentabelle! m/e %
10 Aufgabe 7: Wenn Sie den richtigen Blick haben, lässt sich das folgende Massenspektrum ohne weitere Zusatzinformationen interpretieren. Auf welches Strukturelement lässt die Zerfallskaskade 137 -> 120 -> 92 schließen? Auch die Massendifferenz 92 -> 65 ist charakteristisch für bestimmte Strukturelemente. Die Masse 65 sollte Ihnen schließlich geläufig sein. Bauen Sie, von der Masse 65 ausgehend, die abgespaltenen Fragmente wieder an!
11 Aufgabe 8: Die hier vermessene Verbindung hat Ähnlichkeiten mit derjenigen aus Aufgabe 7. Sie finden auch hier die Peaks m/z = 120; 92 und 65. Neu sind vor allem die folgenden Dinge: Der Molpeak ist zu höheren Massen verschoben. (Um wie viel? Welche Schlüsse sind daraus möglich?) Es tritt auch die Masse 119 auf (Welchen Schluss bezüglich der Struktur lässt diese Aussage zu?) Machen Sie einen Strukturvorschlag!
Fragmentierungs-Reaktionen - 1
 Spektroskopie in der rganischen hemie Fragmentierungs-Reaktionen - 1 Weil nicht alle Bindungen in einem Molekül gleich fest sind, verlaufen Fragmentierungen nicht regellos und zufällig, sondern meist nach
Spektroskopie in der rganischen hemie Fragmentierungs-Reaktionen - 1 Weil nicht alle Bindungen in einem Molekül gleich fest sind, verlaufen Fragmentierungen nicht regellos und zufällig, sondern meist nach
Massenspektrometrie. (Bilder aus Hesse, Meier, Zeeh: Spektroskopische Methoden in der Organischen Chemie)
 Massenspektrometrie (Bilder aus Hesse, Meier, Zeeh: Spektroskopische Methoden in der Organischen Chemie) Die Massenspektrometrie erlaubt die genaue Bestimmung der relativen Molekülmasse einer Verbindung
Massenspektrometrie (Bilder aus Hesse, Meier, Zeeh: Spektroskopische Methoden in der Organischen Chemie) Die Massenspektrometrie erlaubt die genaue Bestimmung der relativen Molekülmasse einer Verbindung
Was bedeutet CH 3 OH?
 Was bedeutet CH 3 OH? 1 C 1 H H 17 O MS Einleitung 1 Worin unterscheiden sich diese Moleküle? MS Einleitung Richtig, sie unterscheiden sich in der Masse! MS Einleitung 3 Aber woher kommt unser Wissen über
Was bedeutet CH 3 OH? 1 C 1 H H 17 O MS Einleitung 1 Worin unterscheiden sich diese Moleküle? MS Einleitung Richtig, sie unterscheiden sich in der Masse! MS Einleitung 3 Aber woher kommt unser Wissen über
Kombinierte Übungen zur Spektroskopie Beispiele für die Bearbeitung
 Im folgenden soll gezeigt werden, daß es großen Spaß macht, spektroskopische Probleme zu lösen. Es gibt kein automatisches Lösungsschema, sondern höchstens Strategien, wie beim "Puzzle Lösen"; häufig hilft
Im folgenden soll gezeigt werden, daß es großen Spaß macht, spektroskopische Probleme zu lösen. Es gibt kein automatisches Lösungsschema, sondern höchstens Strategien, wie beim "Puzzle Lösen"; häufig hilft
Teil 4 Massenspektrometrie. Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2016/17
 Teil 4 Massenspektrometrie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2016/17 www.ruhr-uni-bochum.de/chirality 1 Funktionseinheiten eines Massenspektrometers Grundprinzip der MS: Trennung von Ionen nach
Teil 4 Massenspektrometrie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2016/17 www.ruhr-uni-bochum.de/chirality 1 Funktionseinheiten eines Massenspektrometers Grundprinzip der MS: Trennung von Ionen nach
Seminar WiSe 2015/2016
 Massenspektrometrie Seminar WiSe 2015/2016 PD Dr. Markus Nett Nachwuchsgruppenleiter Libi Leibniz Institut i für Naturstoff Forschung und Infektionsbiologie i E mail: markus.nett@hki jena.de Grundvorgänge
Massenspektrometrie Seminar WiSe 2015/2016 PD Dr. Markus Nett Nachwuchsgruppenleiter Libi Leibniz Institut i für Naturstoff Forschung und Infektionsbiologie i E mail: markus.nett@hki jena.de Grundvorgänge
Spektroskopie-Seminar SS 18 8 Massenspektrometrie Massenspektrometrie
 SS 18 Massenspektrometrie 1 8.1 Prinzip Methode zur Bestimmung der Masse von Molekülen Analyt wird in die Gasphase überführt Moleküle werden ionisiert und durch elektrisches Feld beschleunigt Auftrennung
SS 18 Massenspektrometrie 1 8.1 Prinzip Methode zur Bestimmung der Masse von Molekülen Analyt wird in die Gasphase überführt Moleküle werden ionisiert und durch elektrisches Feld beschleunigt Auftrennung
Bioanalytik Zusatzinformation: Massenspektrometrie 012_001. BioAnalytik
 Bioanalytik 11.01.16 Zusatzinformation: Massenspektrometrie 012_001 Rev. 1.5 091206 - Standort Recklinghausen- Wintersemester 2015-16 2015-2016 : 1 Folienbasis: Prof. Beyer Massenspektrometrie Einführung
Bioanalytik 11.01.16 Zusatzinformation: Massenspektrometrie 012_001 Rev. 1.5 091206 - Standort Recklinghausen- Wintersemester 2015-16 2015-2016 : 1 Folienbasis: Prof. Beyer Massenspektrometrie Einführung
Spektroskopie in der Organischen Chemie. Massenspektren
 Massenspektren In der Frühzeit der MS wurden Spektren auf Fotopapier registriert, wobei das Spektrum mehrfach mit unterschiedlicher Ordinatenauslenkung ausgeschrieben wurde, um sehr schwache neben sehr
Massenspektren In der Frühzeit der MS wurden Spektren auf Fotopapier registriert, wobei das Spektrum mehrfach mit unterschiedlicher Ordinatenauslenkung ausgeschrieben wurde, um sehr schwache neben sehr
ZHAW / N / CH / Analytische Chemie
 Analytische Chemie Kurztest 3 Dauer: Minuten Erlaubte Hilfsmittel: Vorlesungsunterlagen, Lehrbücher, Taschenrechner und eigene Formelsammlungen Alle Berechnungen sind am Schluss zusammen mit diesen Aufgabenblättern
Analytische Chemie Kurztest 3 Dauer: Minuten Erlaubte Hilfsmittel: Vorlesungsunterlagen, Lehrbücher, Taschenrechner und eigene Formelsammlungen Alle Berechnungen sind am Schluss zusammen mit diesen Aufgabenblättern
Chemie für Studierende der Human- und Zahnmedizin WS 2013/14
 Chemie für Studierende der Human- und Zahnmedizin WS 2013/14 Übungsblatt 4: Isomerie, Gibbs-Helmholtz-Gleichung, Katalysator, Addition an Alkene, funktionelle Gruppen, Säure/Base 1) Ordnen Sie die folgenden
Chemie für Studierende der Human- und Zahnmedizin WS 2013/14 Übungsblatt 4: Isomerie, Gibbs-Helmholtz-Gleichung, Katalysator, Addition an Alkene, funktionelle Gruppen, Säure/Base 1) Ordnen Sie die folgenden
2 Massenspektrometrie
 2 Massenspektrometrie 2.1 Grundlagen relative Atommasse Massenzahl Summe relative Molekülmasse M Isotope ein Element gleiche Protonenzahl, aber verschiedene Neutronenzahl Isobare Teilchen gleicher Masse,
2 Massenspektrometrie 2.1 Grundlagen relative Atommasse Massenzahl Summe relative Molekülmasse M Isotope ein Element gleiche Protonenzahl, aber verschiedene Neutronenzahl Isobare Teilchen gleicher Masse,
Schriftliche Prüfung S Analytische Chemie I Winter 2018
 Schriftliche Prüfung 529-0051-00S Analytische Chemie I Winter 2018 Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 60 Min. Teilen Sie sich Ihre Zeit gut
Schriftliche Prüfung 529-0051-00S Analytische Chemie I Winter 2018 Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 60 Min. Teilen Sie sich Ihre Zeit gut
2.3 Photoionisation. 2.3 Photoionisation -25-
 2.3 Photoionisation -25-2.3 Photoionisation Da die resonante Mehrphotonenionisierung ein Spezialfall der Photoionisation ist, soll im Folgenden zunächst ein allgemeiner Überblick über die Photoelektronenspektroskopie,
2.3 Photoionisation -25-2.3 Photoionisation Da die resonante Mehrphotonenionisierung ein Spezialfall der Photoionisation ist, soll im Folgenden zunächst ein allgemeiner Überblick über die Photoelektronenspektroskopie,
Massenspektrometrie. Thomas Lehmann, Freie Universität Berlin 1998/2010
 Massenspektrometrie Thomas Lehmann, Freie Universität Berlin 1998/2010 Inhalt: 1 EINLEITUNG 2 2 PYSIKALISE GRUNDLAGEN 2 3 GEFAR VN ARTEFAKTEN 4 31 Gemische 4 32 Thermische Reaktionen 5 33 Memory-Effekt
Massenspektrometrie Thomas Lehmann, Freie Universität Berlin 1998/2010 Inhalt: 1 EINLEITUNG 2 2 PYSIKALISE GRUNDLAGEN 2 3 GEFAR VN ARTEFAKTEN 4 31 Gemische 4 32 Thermische Reaktionen 5 33 Memory-Effekt
Z 12 1) BESTIMMUNG DER SUMMENFORMEL: a. AUS DEN MASSENPROZENTEN
 ANALYTIK 1) BESTIMMUNG DER SUMMENFORMEL: a. AUS DEN MASSENPROZENTEN Ziel: Ermittlung einer Summenformel einer Substanz aus C, und O wenn die Massenprozent der Elemente und die Molmasse M r der Substanz
ANALYTIK 1) BESTIMMUNG DER SUMMENFORMEL: a. AUS DEN MASSENPROZENTEN Ziel: Ermittlung einer Summenformel einer Substanz aus C, und O wenn die Massenprozent der Elemente und die Molmasse M r der Substanz
1. Bedeutung der Oxidationszahlen
 1. Bedeutung der Oxidationszahlen Unterschiedliche Atome geben eine unterschiedliche Zahl an Elektronen ab: Dann hat das Atom eine positive Oxidationsstufe; das Atom ist mit weniger Elektronen als Protonen
1. Bedeutung der Oxidationszahlen Unterschiedliche Atome geben eine unterschiedliche Zahl an Elektronen ab: Dann hat das Atom eine positive Oxidationsstufe; das Atom ist mit weniger Elektronen als Protonen
1 Terminologie. 1) Die Bezeichnung Massenspektroskop wird praktisch nicht mehr verwendet; für Massenspektrograph siehe Abschnitt
 O:/Wiley/Budzikiewicz/3d/c01.3d from 13.06.2012 13:11:03 Teil I Grundlagen O:/Wiley/Budzikiewicz/3d/c01.3d from 13.06.2012 13:11:03 O:/Wiley/Budzikiewicz/3d/c01.3d from 13.06.2012 13:11:03 3 1 Terminologie
O:/Wiley/Budzikiewicz/3d/c01.3d from 13.06.2012 13:11:03 Teil I Grundlagen O:/Wiley/Budzikiewicz/3d/c01.3d from 13.06.2012 13:11:03 O:/Wiley/Budzikiewicz/3d/c01.3d from 13.06.2012 13:11:03 3 1 Terminologie
Reaktionstypen der Aromate
 Radikalische Reaktionspartner sind Atome bzw. Atomgruppen mit einem ungepaarten Elektron, wie z. B. das Chlorradikal Cl oder das Ethylradikal C 3 C 2. Radikale sind in der Regel sehr unbeständig, kurzlebig
Radikalische Reaktionspartner sind Atome bzw. Atomgruppen mit einem ungepaarten Elektron, wie z. B. das Chlorradikal Cl oder das Ethylradikal C 3 C 2. Radikale sind in der Regel sehr unbeständig, kurzlebig
1. Isotopie und Präzisionsmasse 2. Erkennung/Eigenschaften des Molekülions 3. Fragmentierung (ungeradelektronischer Ionen)
 Interpretation von Massenspektren 1. Isotopie und Präzisionsmasse 2. Erkennung/Eigenschaften des Molekülions 3. Fragmentierung (ungeradelektronischer Ionen) 1 EI-Massenspektrum (Acetophenon, M = 120):
Interpretation von Massenspektren 1. Isotopie und Präzisionsmasse 2. Erkennung/Eigenschaften des Molekülions 3. Fragmentierung (ungeradelektronischer Ionen) 1 EI-Massenspektrum (Acetophenon, M = 120):
2. Radikalische Substitution 2.1
 2. Radikalische Substitution 2.1 Die Radikalische Substitution Alkane sind im Vergleich zu den Alkenen sehr reaktionsträge. Alkane zählen zu den gesättigten, Alkene zu den ungesättigten Kohlenwasserstoffen.
2. Radikalische Substitution 2.1 Die Radikalische Substitution Alkane sind im Vergleich zu den Alkenen sehr reaktionsträge. Alkane zählen zu den gesättigten, Alkene zu den ungesättigten Kohlenwasserstoffen.
III. Strukturbestimmung organischer Moleküle
 III. Strukturbestimmung organischer Moleküle Röntgenstrukturbestimmung g Spektroskopie UV-VIS IR NMR Massenspektrometrie (MS) Röntgenstruktur eines bakteriellen Kohlenhydrats O O O O O O O C3 Röntgenstruktur
III. Strukturbestimmung organischer Moleküle Röntgenstrukturbestimmung g Spektroskopie UV-VIS IR NMR Massenspektrometrie (MS) Röntgenstruktur eines bakteriellen Kohlenhydrats O O O O O O O C3 Röntgenstruktur
1.2 Vergleichen Sie die Reaktionsbedingungen für die Bromierung von A und B und begründen Sie unter Mitverwendung von Grenzformeln den Unterschied!
 Aufgabe II Die aromatischen Ringsysteme folgender Verbindungen sollen zu Monobromderivaten umgesetzt werden: Benzol (A), Anilin (B) und Aniliniumchlorid (C). 1.1 Erläutern Sie unter Mitverwendung von Strukturformeln
Aufgabe II Die aromatischen Ringsysteme folgender Verbindungen sollen zu Monobromderivaten umgesetzt werden: Benzol (A), Anilin (B) und Aniliniumchlorid (C). 1.1 Erläutern Sie unter Mitverwendung von Strukturformeln
Übungen zur IR-Spektroskopie (WS2008/WS2013)
 Übungen zur IR-Spektroskopie (WS2008/WS2013) Vorbemerkung: Diese Übungen können Sie sinnvoll nur unter Zuhilfenahme eines Spektroskopielehrbuchs bearbeiten. Das Lehrbuch brauchen sie, um die IR-spektroskopischen
Übungen zur IR-Spektroskopie (WS2008/WS2013) Vorbemerkung: Diese Übungen können Sie sinnvoll nur unter Zuhilfenahme eines Spektroskopielehrbuchs bearbeiten. Das Lehrbuch brauchen sie, um die IR-spektroskopischen
Aufstellen von Funktionstermen
 Aufstellen von Funktionstermen Bisher haben wir uns mit der Untersuchung von Funktionstermen beschäftigt, um Eigenschaften des Graphen zu ermitteln. Nun wollen wir die Betrachtungsweise ändern. Wir gehen
Aufstellen von Funktionstermen Bisher haben wir uns mit der Untersuchung von Funktionstermen beschäftigt, um Eigenschaften des Graphen zu ermitteln. Nun wollen wir die Betrachtungsweise ändern. Wir gehen
6. Rechenübung Organik (27.01./ )
 1 6. Rechenübung Organik (27.01./03.02.2009) Literatur: 2.) Mortimer : hemie Basiswissen hemie ISBN 3 13 484308 0 Paula Y. Bruice : Organische hemie ISBN 978 3 8273 7190 4 Gesättigtes Atom Atom, nur mit
1 6. Rechenübung Organik (27.01./03.02.2009) Literatur: 2.) Mortimer : hemie Basiswissen hemie ISBN 3 13 484308 0 Paula Y. Bruice : Organische hemie ISBN 978 3 8273 7190 4 Gesättigtes Atom Atom, nur mit
Schriftliche Prüfung BSc Frühling 2006 D CHAB/BIOL. Musterlösung. für den Teil Spektroskopie
 Prüfungen Analytische Chemie Mittwoch, 8. März 2006 Schriftliche Prüfung BSc Frühling 2006 D CAB/BIL Musterlösung für den Teil Spektroskopie Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die
Prüfungen Analytische Chemie Mittwoch, 8. März 2006 Schriftliche Prüfung BSc Frühling 2006 D CAB/BIL Musterlösung für den Teil Spektroskopie Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die
Viel Erfolg! Studiengang BSc Biowissenschaften Modulabschlussprüfung Organische Chemie
 Studiengang BSc Biowissenschaften Modulabschlussprüfung rganische Chemie 12.04.2018 Vor- und Nachname... Matrikelnummer... Geburtsdatum & -ort... Klausur-Wiederholung ja nein Dauer der Klausur: 90 Minuten
Studiengang BSc Biowissenschaften Modulabschlussprüfung rganische Chemie 12.04.2018 Vor- und Nachname... Matrikelnummer... Geburtsdatum & -ort... Klausur-Wiederholung ja nein Dauer der Klausur: 90 Minuten
Welche Arten von Formeln stehen dem Chemiker zur Verfügung?
 Welche Arten von Formeln stehen dem Chemiker zur Verfügung? 1. Summenformeln 2. Valenzstrichformeln (Lewis-Strichformeln) 3. Strukturformeln Summenformel: Die Summenformel dient dazu Art und Anzahl der
Welche Arten von Formeln stehen dem Chemiker zur Verfügung? 1. Summenformeln 2. Valenzstrichformeln (Lewis-Strichformeln) 3. Strukturformeln Summenformel: Die Summenformel dient dazu Art und Anzahl der
Autor: Cornelia Spee Tag der Versuchdurchführung: 31.3.2008. Versuch I2. Massenspektrometrie
 Autor: Tag der Versuchdurchführung: 31.3.2008 Versuch I2 Massenspektrometrie 1. Zusammenfassung Die Massenspektrometrie stellt eine wichtige Methode zur Strukturanalyse, sowie zur Bestimmung von Massen
Autor: Tag der Versuchdurchführung: 31.3.2008 Versuch I2 Massenspektrometrie 1. Zusammenfassung Die Massenspektrometrie stellt eine wichtige Methode zur Strukturanalyse, sowie zur Bestimmung von Massen
Schriftliche Prüfungen Smesterkurs Analytische Chemie I Instrumentalanalyse organischer Vebindungen Sommer 2011
 Schriftliche Prüfungen Smesterkurs Analytische Chemie I Instrumentalanalyse organischer Vebindungen Sommer 2011 Vorname: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120
Schriftliche Prüfungen Smesterkurs Analytische Chemie I Instrumentalanalyse organischer Vebindungen Sommer 2011 Vorname: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120
Terminologie. Die Ausdrücke Massenspektrometer
 I Grundlagen Massenspektrometrie, Fünfte Auflage. H. Budzikiewicz, M. Schäfer Copyright 2005 WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim ISBN: 3-527-30822-9 7 1 Terminologie Ein Massenspektrometer ist
I Grundlagen Massenspektrometrie, Fünfte Auflage. H. Budzikiewicz, M. Schäfer Copyright 2005 WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim ISBN: 3-527-30822-9 7 1 Terminologie Ein Massenspektrometer ist
Schriftliche Prüfung S Analytische Chemie I Sommer 2015
 Schriftliche Prüfung 529-0051- 00S Analytische Chemie I Sommer 2015 Vorname: Name: Legi-Nr.: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 60 Min. Teilen Sie sich Ihre Zeit gut
Schriftliche Prüfung 529-0051- 00S Analytische Chemie I Sommer 2015 Vorname: Name: Legi-Nr.: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 60 Min. Teilen Sie sich Ihre Zeit gut
Übungen zur VL Chemie für Biologen und Humanbiologen Lösung Übung 9
 Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
Protokoll. Kombinierte Anwendung verschiedener Spektroskopischer Methoden
 Protokoll Kombinierte Anwendung verschiedener Spektroskopischer Methoden Zielstellung: Durch die Auswertung von IR-, Raman-, MR-, UV-VIS- und Massenspektren soll die Struktur einer unbekannten Substanz
Protokoll Kombinierte Anwendung verschiedener Spektroskopischer Methoden Zielstellung: Durch die Auswertung von IR-, Raman-, MR-, UV-VIS- und Massenspektren soll die Struktur einer unbekannten Substanz
ORGANISCHE CHEMIE. Struktur organischer Verbindungen: Formeln, Nomenklatur und Reaktionsmechanismen
 ORGANISE EMIE Struktur organischer Verbindungen: Formeln, Nomenklatur und Reaktionsmechanismen hemische Formeln Summenformeln Strukturformeln (Konstitutionsformeln) Ausführliche Strukturformeln Vereinfachte
ORGANISE EMIE Struktur organischer Verbindungen: Formeln, Nomenklatur und Reaktionsmechanismen hemische Formeln Summenformeln Strukturformeln (Konstitutionsformeln) Ausführliche Strukturformeln Vereinfachte
Butanol Butanal Butansäure
 Wiederholungsthema: Gesättigte Kohlenwasserstoffe (Alkane) Zusammenfassung: Gesättigte Kohlenwasserstoffe bestehen aus Ketten aus mit einander vernüpften Kohlenstoff-Atomen, an die die maximal mögliche
Wiederholungsthema: Gesättigte Kohlenwasserstoffe (Alkane) Zusammenfassung: Gesättigte Kohlenwasserstoffe bestehen aus Ketten aus mit einander vernüpften Kohlenstoff-Atomen, an die die maximal mögliche
(Anmerkung: Es sind weitere möglich. Spektren zeigen Diradikal.)
 eispielaufgaben IChO 2. Runde 2017 Aromaten, Lösungen Aromaten eispiel 1: a) b) (Zeichnungen hier und unten teilweise ohne Wasserstoff-Atome) c) Das Anion ist planar und hat ein cyclisch konjugiertes π-elektronensystem
eispielaufgaben IChO 2. Runde 2017 Aromaten, Lösungen Aromaten eispiel 1: a) b) (Zeichnungen hier und unten teilweise ohne Wasserstoff-Atome) c) Das Anion ist planar und hat ein cyclisch konjugiertes π-elektronensystem
Pentan enthält 12 Atome Wasserstoff, ein Wassermolekül 2 Atome. Es entstehen also 6 Moleküle Wasser:
 VERTIEFUNG Aufstellen und Einrichten von Gleichungen Reaktionsgleichungen fassen eine chemische Reaktion knapp zusammen. Es werden die Edukte (Ausgangsstoffe) angegeben, die in der chemischen Reaktion
VERTIEFUNG Aufstellen und Einrichten von Gleichungen Reaktionsgleichungen fassen eine chemische Reaktion knapp zusammen. Es werden die Edukte (Ausgangsstoffe) angegeben, die in der chemischen Reaktion
1. Klausur zur Vorlesung. Einführung in die organische Chemie WS 03/04 11.12.2003
 1. Klausur zur Vorlesung Einführung in die organische Chemie WS 03/04 11.12.2003 Vorname (bitte deutlich schreiben): Nachname (bitte deutlich schreiben): Matrikelnummer: Studiengang: o Chemie (Diplom)
1. Klausur zur Vorlesung Einführung in die organische Chemie WS 03/04 11.12.2003 Vorname (bitte deutlich schreiben): Nachname (bitte deutlich schreiben): Matrikelnummer: Studiengang: o Chemie (Diplom)
 hemie-protokoll 11.11.02, Seite 1 von 5 Lukman Iwan, 12.11.02 Stundenprotokoll vom Montag, 11. ovember 2002 Es fehlen: Janine und Jeannette Zettel 1&2: Aromatische eterocyclen http://www.oci.unizh.ch/edu/lectures/material/a_bii/kap6/kap6.html
hemie-protokoll 11.11.02, Seite 1 von 5 Lukman Iwan, 12.11.02 Stundenprotokoll vom Montag, 11. ovember 2002 Es fehlen: Janine und Jeannette Zettel 1&2: Aromatische eterocyclen http://www.oci.unizh.ch/edu/lectures/material/a_bii/kap6/kap6.html
Literatur zur Massenspektrometrie
 Literatur zur Massenspektrometrie 1. M. Hesse, H. Meier, B. Zeeh: Spektroskopische Methoden in der organischen Chemie. Georg Thieme Verlag, Stuttgart, 8. Auflage 2012, 79.95; ISBN 9783135761084 Behandelt
Literatur zur Massenspektrometrie 1. M. Hesse, H. Meier, B. Zeeh: Spektroskopische Methoden in der organischen Chemie. Georg Thieme Verlag, Stuttgart, 8. Auflage 2012, 79.95; ISBN 9783135761084 Behandelt
Aufbau der Übungsaufgaben zum Lese- und Hörverstehen... 14. Leseverstehen 1... 16 Erste Übungsaufgabe... 16 Zweite Übungsaufgabe...
 Inhaltsverzeichnis Inhaltsverzeichnis Vorwort.............................................................. 5 Selbsteinschätzung................................................. 6 Wie sieht die Prüfung
Inhaltsverzeichnis Inhaltsverzeichnis Vorwort.............................................................. 5 Selbsteinschätzung................................................. 6 Wie sieht die Prüfung
4 Synthesen antiprionen-aktiver Verbindungen
 4 Synthesen antiprionen-aktiver Verbindungen Quinacrinanaloga (Grundstruktur C) 77 4 Synthesen antiprionen-aktiver Verbindungen 4.1 Synthesen der Quinacrinanaloga (Grundstruktur C) Die Synthesen der Quinacrinanaloga
4 Synthesen antiprionen-aktiver Verbindungen Quinacrinanaloga (Grundstruktur C) 77 4 Synthesen antiprionen-aktiver Verbindungen 4.1 Synthesen der Quinacrinanaloga (Grundstruktur C) Die Synthesen der Quinacrinanaloga
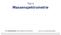
P105. Konstitution. Massenspektrum 100 % m/z
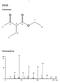 1 P105 Konstitution 7 1 2 6 8 4 5 Massenspektrum 100 % 4 116 50 7 101 29 55 88 15 61 10 14 158 0 0 50 100 150 m/z 2 Direkte Fragmentierungen: 4 115 11 45 129 29 85 7 Damit lassen sich die prominenten Signale
1 P105 Konstitution 7 1 2 6 8 4 5 Massenspektrum 100 % 4 116 50 7 101 29 55 88 15 61 10 14 158 0 0 50 100 150 m/z 2 Direkte Fragmentierungen: 4 115 11 45 129 29 85 7 Damit lassen sich die prominenten Signale
Schriftliche Prüfung BSc Frühling 2014
 Prüfungen Analytische Chemie Samstag, 1. Februar 2014 Schriftliche Prüfung BSc Frühling 2014 D CHAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Samstag, 1. Februar 2014 Schriftliche Prüfung BSc Frühling 2014 D CHAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
3. Wieviel bindig sind folgende Elemente in kovalenten Bindungen? Einige Elemente können auch verschiedene Bindigkeiten zeigen
 Übungen zur VL Chemie für Biologen und umanbiologen 26. 11.2010 1. ennen Sie mindestens 2 Arten der chemischen Bindungen und geben Sie je 2 Beispielverbindungen dafür an (Strukturformel). 1) Ionische Bindung:
Übungen zur VL Chemie für Biologen und umanbiologen 26. 11.2010 1. ennen Sie mindestens 2 Arten der chemischen Bindungen und geben Sie je 2 Beispielverbindungen dafür an (Strukturformel). 1) Ionische Bindung:
38. Lektion Wie alt ist Ötzi wirklich, oder wie wird eine Altersbestimmung durchgeführt?
 38. Lektion Wie alt ist Ötzi wirklich, oder wie wird eine Altersbestimmung durchgeführt? Lernziel: Radioaktive Isotope geben Auskunft über das Alter von organischen Materialien, von Gesteinen und von der
38. Lektion Wie alt ist Ötzi wirklich, oder wie wird eine Altersbestimmung durchgeführt? Lernziel: Radioaktive Isotope geben Auskunft über das Alter von organischen Materialien, von Gesteinen und von der
Kernphysik I. Grundlegende Eigenschaften der Atomkerne: Bindungs-, Separationsenergie Massenmessungen Weizsäcker Massenformel
 Kernphysik I Grundlegende Eigenschaften der Atomkerne: Bindungs-, Separationsenergie Massenmessungen Weizsäcker Massenformel Massendefekt und Bindungsenergie Kerne sind die einzigen gebundenen Systeme,
Kernphysik I Grundlegende Eigenschaften der Atomkerne: Bindungs-, Separationsenergie Massenmessungen Weizsäcker Massenformel Massendefekt und Bindungsenergie Kerne sind die einzigen gebundenen Systeme,
Infrarot Spektroskopie organischer Verbindungen
 Infrarot Spektroskopie organischer Verbindungen Praktikum (B.C. 3.4) Lehrstuhl für Instrumentelle Analytik Michael Deicke Michael.Deicke@uni-jena.de Ziele des Praktikums IR-Spektren organischer Verbindungen
Infrarot Spektroskopie organischer Verbindungen Praktikum (B.C. 3.4) Lehrstuhl für Instrumentelle Analytik Michael Deicke Michael.Deicke@uni-jena.de Ziele des Praktikums IR-Spektren organischer Verbindungen
M U S T E R L Ö S U N G
 Prof. Dr.. Reiser Prof. Dr. A. Geyer 1. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 00 am Dienstag, dem 14. Mai 00 Name:...Vorname:... Matrikelnummer:...
Prof. Dr.. Reiser Prof. Dr. A. Geyer 1. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 00 am Dienstag, dem 14. Mai 00 Name:...Vorname:... Matrikelnummer:...
Teil 1 Aufgaben zum Stoff der Vorlesung OC1a (Grundvorlesung Organische Chemie)
 Übungen 24.01.2012 Teil 1 Aufgaben zum Stoff der Vorlesung C1a (Grundvorlesung rganische Chemie) Aufgabe 1.1 Zeichnen Sie die Strukturformeln der folgenden Verbindungen (jeweils 1 Punkt pro Teilaufgabe).
Übungen 24.01.2012 Teil 1 Aufgaben zum Stoff der Vorlesung C1a (Grundvorlesung rganische Chemie) Aufgabe 1.1 Zeichnen Sie die Strukturformeln der folgenden Verbindungen (jeweils 1 Punkt pro Teilaufgabe).
Kernphysik I. Grundlegende Eigenschaften der Atomkerne: Bindungs-, Separationsenergie Massenmessungen Weizsäcker Massenformel
 Kernphysik I Grundlegende Eigenschaften der Atomkerne: Bindungs-, Separationsenergie Massenmessungen Weizsäcker Massenformel Massendefekt und Bindungsenergie Kerne sind die einzigen gebundenen Systeme,
Kernphysik I Grundlegende Eigenschaften der Atomkerne: Bindungs-, Separationsenergie Massenmessungen Weizsäcker Massenformel Massendefekt und Bindungsenergie Kerne sind die einzigen gebundenen Systeme,
Schriftliche Prüfungen Jahreskurs Analytische Chemie I&II Sommer 2011 BSc D-CHAB/BIOL
 Schriftliche Prüfungen Jahreskurs Analytische Chemie I&II Sommer 2011 BSc D-CHAB/BIOL Vorname: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich Ihre
Schriftliche Prüfungen Jahreskurs Analytische Chemie I&II Sommer 2011 BSc D-CHAB/BIOL Vorname: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich Ihre
Venndiagramm, Grundmenge und leere Menge
 Venndiagramm, Grundmenge und leere Menge In späteren Kapitel wird manchmal auf die Mengenlehre Bezug genommen. Deshalb sollen hier die wichtigsten Grundlagen und Definitionen dieser Disziplin kurz zusammengefasst
Venndiagramm, Grundmenge und leere Menge In späteren Kapitel wird manchmal auf die Mengenlehre Bezug genommen. Deshalb sollen hier die wichtigsten Grundlagen und Definitionen dieser Disziplin kurz zusammengefasst
Massenspektrometrie (MS)
 Massenspektrometrie (MS) Die Massenspektrometrie ist unter den heute routinemäßig verwendeten Methoden die jüngste, denn ihre Anwendung begann erst um 1960. Seit den Arbeiten von BIEMANN über Fragmentierungsmuster
Massenspektrometrie (MS) Die Massenspektrometrie ist unter den heute routinemäßig verwendeten Methoden die jüngste, denn ihre Anwendung begann erst um 1960. Seit den Arbeiten von BIEMANN über Fragmentierungsmuster
Schriftliche Prüfung Analytische Chemie I&II Winter 2012/2013
 Schriftliche Prüfung Analytische Chemie I&II Winter 2012/2013 Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich Ihre Zeit gut ein.
Schriftliche Prüfung Analytische Chemie I&II Winter 2012/2013 Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich Ihre Zeit gut ein.
Günter Baars E-Lern- und Lehrmedium: Quantenchemie und Chemie farbiger Stoffe Modul: Quantenchemie und organische farbige Stoffe Übungen mit Lösungen
 Günter Baars E-Lern- und Lehrmedium: Quantenchemie und Chemie farbiger Stoffe Modul: Quantenchemie und organische farbige Stoffe Übungen mit Lösungen Korrektorat: Dina Baars, Bern Illustrationen: Christoph
Günter Baars E-Lern- und Lehrmedium: Quantenchemie und Chemie farbiger Stoffe Modul: Quantenchemie und organische farbige Stoffe Übungen mit Lösungen Korrektorat: Dina Baars, Bern Illustrationen: Christoph
08.12.2013. Wichtige Stoffgruppen. Stoffgruppe. Atomverband. Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Metall Metall:
 1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter) - Salze Nichtmetall Nichtmetall:
1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter) - Salze Nichtmetall Nichtmetall:
Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag)
 Pharmazeutische Chemie Seite 1 Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag) Fragen zu der sp³ Hybridisierung (S. 124-128): 1.) Notieren Sie die Elektronenverteilung
Pharmazeutische Chemie Seite 1 Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag) Fragen zu der sp³ Hybridisierung (S. 124-128): 1.) Notieren Sie die Elektronenverteilung
Massenspektrometrie (MS)
 Massenspektrometrie (MS) Die Massenspektrometrie ist unter den heute routinemäßig verwendeten Methoden die jüngste, denn ihre Anwendung begann erst um 1960. Seit den Arbeiten von BIEMANN über Fragmentierungsmuster
Massenspektrometrie (MS) Die Massenspektrometrie ist unter den heute routinemäßig verwendeten Methoden die jüngste, denn ihre Anwendung begann erst um 1960. Seit den Arbeiten von BIEMANN über Fragmentierungsmuster
Aromatische Kohlenwasserstoffe.
 Aromatische Kohlenwasserstoffe. Benzol und dessen Homologe. Mechanismus der S E 2-Ar-Reaktion. Orientierung in aromatischem Kern, abhängig vom ersten Substituent. Elektrophiler Mechanismus der Substitutionsreaktionen.
Aromatische Kohlenwasserstoffe. Benzol und dessen Homologe. Mechanismus der S E 2-Ar-Reaktion. Orientierung in aromatischem Kern, abhängig vom ersten Substituent. Elektrophiler Mechanismus der Substitutionsreaktionen.
Strukturanalytik organischer und anorganischer Verbindungen
 Manfred Reichenbächer, Jürgen Popp Strukturanalytik organischer und anorganischer Verbindungen Ein Übungsbuch Teubner Vorwort V VII 1 Massenspektrometrie 1 1.1 Einführung 1 Übung 1.1 7 1.2 Das Molekülion
Manfred Reichenbächer, Jürgen Popp Strukturanalytik organischer und anorganischer Verbindungen Ein Übungsbuch Teubner Vorwort V VII 1 Massenspektrometrie 1 1.1 Einführung 1 Übung 1.1 7 1.2 Das Molekülion
Schriftliche Prüfung BSc Herbst 2010
 Prüfungen Analytische Chemie Dienstag, 24. August 2010 Schriftliche Prüfung BSc Herbst 2010 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Dienstag, 24. August 2010 Schriftliche Prüfung BSc Herbst 2010 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Bundesrealgymnasium Imst. Chemie Klasse 8. Aliphate
 Bundesrealgymnasium Imst Chemie 2010-11 Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter aufgearbeitet
Bundesrealgymnasium Imst Chemie 2010-11 Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter aufgearbeitet
Übungen zum Kapitel I, Grundlagen chemischer Gleichungen
 Übungen zum Kapitel I, Grundlagen chemischer Gleichungen Übersicht der Übungen: Übung Nr. 1 (Bedeutungen und Ausgleichen von Gleichungen) Übung Nr. 2 (Bedeutungen und Ausgleichen von Gleichungen) Übung
Übungen zum Kapitel I, Grundlagen chemischer Gleichungen Übersicht der Übungen: Übung Nr. 1 (Bedeutungen und Ausgleichen von Gleichungen) Übung Nr. 2 (Bedeutungen und Ausgleichen von Gleichungen) Übung
2. Elektroneneffekte in den organischen Molekülen
 2. Elektroneneffekte in den organischen Molekülen Induktive und mesomere Effekte Die Ladungsverteilung in einer Kohlenwasserstoffkette wird durch Substituenten (Halogen, OH, NH 2 usw.) beeinflusst. Man
2. Elektroneneffekte in den organischen Molekülen Induktive und mesomere Effekte Die Ladungsverteilung in einer Kohlenwasserstoffkette wird durch Substituenten (Halogen, OH, NH 2 usw.) beeinflusst. Man
LMPG 3, Spek-ÜB-20 LÖSUNG Seite 1 von 6
 LMPG 3, Spek-ÜB-20 LÖSUG Seite 1 von 6 Aufgabe 1: a) Woran lässt sich aus dem MS-Spektrum auf die Zahl der -Atome schliessen? Molekülionenpeak ist ungerade, also ist auch die Zahl der -Atome ungerade.
LMPG 3, Spek-ÜB-20 LÖSUG Seite 1 von 6 Aufgabe 1: a) Woran lässt sich aus dem MS-Spektrum auf die Zahl der -Atome schliessen? Molekülionenpeak ist ungerade, also ist auch die Zahl der -Atome ungerade.
Methodenworkshop: Fragebogen
 BLKK 21 Mulitplikatorenprogramm Methodenworkshop: Fragebogen 1. Arbeitsvorschlag Versuchen Sie, einen Fragebogen zu einer konkreten Fragestellung zu entwerfen. Bitte folgen Sie folgendem Ablauf: 1. Worüber
BLKK 21 Mulitplikatorenprogramm Methodenworkshop: Fragebogen 1. Arbeitsvorschlag Versuchen Sie, einen Fragebogen zu einer konkreten Fragestellung zu entwerfen. Bitte folgen Sie folgendem Ablauf: 1. Worüber
Kerncurriculum und Schulcurriculum (2 Wochenstunden) Themen und Inhalte. Bezug zu den Standards. Kerncurriculum / Schulcurriculum
 Chemie: Klasse 9 Kerncurriculum und Schulcurriculum (2 Wochenstunden) Zeit Themen und Inhalte Umsetzung Bezug zu den Standards Kerncurriculum / Schulcurriculum 10 Atombau und Periodensystem - Das Kern-Hülle-Modell
Chemie: Klasse 9 Kerncurriculum und Schulcurriculum (2 Wochenstunden) Zeit Themen und Inhalte Umsetzung Bezug zu den Standards Kerncurriculum / Schulcurriculum 10 Atombau und Periodensystem - Das Kern-Hülle-Modell
IR-Spektroskopie Seminar Analytische Chemie I (BC3.4, MCB B1; WS2016/17) Dr. Peter Bellstedt NMR Plattform IAAC & IOMC
 IR-Spektroskopie Seminar Analytische Chemie I (BC3.4, MCB B1; WS2016/17) Dr. Peter Bellstedt NMR Plattform IAAC & IOMC Peter.Bellstedt@uni-jena.de Terminübersicht (14 täg.) Gruppe 1 Gruppe 2 1. Seminar
IR-Spektroskopie Seminar Analytische Chemie I (BC3.4, MCB B1; WS2016/17) Dr. Peter Bellstedt NMR Plattform IAAC & IOMC Peter.Bellstedt@uni-jena.de Terminübersicht (14 täg.) Gruppe 1 Gruppe 2 1. Seminar
Lösungen zum Aufgabenblatt Nr. 1: Konstruktion der reellen Zahlen
 Lösungen zum Aufgabenblatt Nr. 1: Konstruktion der reellen Zahlen Aufgabe 1: Es sei D die Menge aller rationalen Dedekind-Mengen, also D := { M 2 Q M is Dedekind-Menge }. Auf der Menge D definieren wir
Lösungen zum Aufgabenblatt Nr. 1: Konstruktion der reellen Zahlen Aufgabe 1: Es sei D die Menge aller rationalen Dedekind-Mengen, also D := { M 2 Q M is Dedekind-Menge }. Auf der Menge D definieren wir
Bundesrealgymnasium Imst. Chemie Klasse 8. Aromaten und deren Reaktionen
 Bundesrealgymnasium Imst Chemie 2010-11 und deren Reaktionen Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter
Bundesrealgymnasium Imst Chemie 2010-11 und deren Reaktionen Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter
1 Mengen und Aussagen
 Mathematik für Physiker I, WS 010/011 Montag 01.11 $Id: mengen.tex,v 1.4 010/11/01 14:19:48 hk Exp $ $Id: beweise.tex,v 1.3 010/11/05 06:40:11 hk Exp $ 1 Mengen und Aussagen Wir haben jetzt Allaussagen
Mathematik für Physiker I, WS 010/011 Montag 01.11 $Id: mengen.tex,v 1.4 010/11/01 14:19:48 hk Exp $ $Id: beweise.tex,v 1.3 010/11/05 06:40:11 hk Exp $ 1 Mengen und Aussagen Wir haben jetzt Allaussagen
Allgemeine Definition von statistischer Abhängigkeit (1)
 Allgemeine Definition von statistischer Abhängigkeit (1) Bisher haben wir die statistische Abhängigkeit zwischen Ereignissen nicht besonders beachtet, auch wenn wir sie wie im Fall zweier disjunkter Mengen
Allgemeine Definition von statistischer Abhängigkeit (1) Bisher haben wir die statistische Abhängigkeit zwischen Ereignissen nicht besonders beachtet, auch wenn wir sie wie im Fall zweier disjunkter Mengen
Kapitel 4. Reihen 4.1. Definition und Beispiele
 Kapitel 4. Reihen 4.1. Definition und Beispiele Ist (a n ) eine Folge von Zahlen, so heißt der formale Ausdruck a ν = a 0 + a 1 + a 2 +... eine Reihe; die einzelnen a ν sind die Glieder dieser Reihe. Um
Kapitel 4. Reihen 4.1. Definition und Beispiele Ist (a n ) eine Folge von Zahlen, so heißt der formale Ausdruck a ν = a 0 + a 1 + a 2 +... eine Reihe; die einzelnen a ν sind die Glieder dieser Reihe. Um
KW Alkene. Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1
 KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
Ist die Funktion f : R R injektiv, hat den Definitionsbereich D und den Wertebereich W, so ist f : D W bijektiv. Dann heißt
 Ist die Funktion f : R R injektiv, hat den Definitionsbereich D und den Wertebereich W, so ist f : D W bijektiv. Dann heißt f 1 : W D, y wobei D mit f() = y die Umkehrfunktion zu f. Der Graph G f 1 = {(y,
Ist die Funktion f : R R injektiv, hat den Definitionsbereich D und den Wertebereich W, so ist f : D W bijektiv. Dann heißt f 1 : W D, y wobei D mit f() = y die Umkehrfunktion zu f. Der Graph G f 1 = {(y,
Schriftliche Prüfung BSc Frühling 2006
 Prüfungen Analytische Chemie Mittwoch, 8. März 2006 Schriftliche Prüfung BSc Frühling 2006 D CAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt 36.
Prüfungen Analytische Chemie Mittwoch, 8. März 2006 Schriftliche Prüfung BSc Frühling 2006 D CAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt 36.
Die Einheit Mol Stoffmengen können in verschiedenen Einheiten gemessen werden:
 Cusanus-Gymnasium Wittlich W. Zimmer 1/5 Die Einheit Mol Stoffmengen können in verschiedenen Einheiten gemessen werden: a) durch die Angabe ihrer Masse b) durch die Angabe ihres Volumens c) durch die Anzahl
Cusanus-Gymnasium Wittlich W. Zimmer 1/5 Die Einheit Mol Stoffmengen können in verschiedenen Einheiten gemessen werden: a) durch die Angabe ihrer Masse b) durch die Angabe ihres Volumens c) durch die Anzahl
HAW Hamburg Fachbereich HWI Hamburg, Prof. Dr. Badura B. Hamraz, O. Zarenko, M. Behrens. Chemie Testat 2. Name: Vorname: Matrikelnummer:
 Chemie Testat 2 Name: Vorname: Matrikelnummer: Bearbeitungszeit: 1 Stunde Zugelassene Hilfsmittel: Stifte, unbeschriebenes Papier, ein nichtprogrammierbarer Taschenrechner und ein Periodensystem Bitte
Chemie Testat 2 Name: Vorname: Matrikelnummer: Bearbeitungszeit: 1 Stunde Zugelassene Hilfsmittel: Stifte, unbeschriebenes Papier, ein nichtprogrammierbarer Taschenrechner und ein Periodensystem Bitte
Übungen zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe. 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit
 O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
Schriftliche Prüfung BSc Herbst 2013
 Prüfungen Analytische Chemie Dienstag, 13. August 2013 Schriftliche Prüfung BSc Herbst 2013 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Dienstag, 13. August 2013 Schriftliche Prüfung BSc Herbst 2013 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Infrarot-Spektroskopie
 SoSe 19 Infrarot-Spektroskopie E = h v = h c ሚθ E = Energie; h = Planck sches Wirkungsquantum; v = Frequenz; c = Lichtgeschwindigkeit, ሚθ = Wellenzahl 1 3.1 Schwingungsmodi T / % Moleküle werden mit Licht
SoSe 19 Infrarot-Spektroskopie E = h v = h c ሚθ E = Energie; h = Planck sches Wirkungsquantum; v = Frequenz; c = Lichtgeschwindigkeit, ሚθ = Wellenzahl 1 3.1 Schwingungsmodi T / % Moleküle werden mit Licht
Teil 1 Aufgaben zum Stoff der Vorlesung OC1a (Grundvorlesung Organische Chemie) Maximale Punktezahl: 20 Notwendige Mindestpunkte: 8
 3. Klausur OC1 (BSc-Studiengang) PIN: 21.03.2017 11:00 14:00 Uhr N6 Name: Punkte: Matrikel Nr. Note: Notenskala: 80-75=1.0 74-71=1.3 70-67=1.7 66-63=2.0 62-59=2.3 58-53=2.7 52-50=3.0 49-48=3.3 47-42=3.7
3. Klausur OC1 (BSc-Studiengang) PIN: 21.03.2017 11:00 14:00 Uhr N6 Name: Punkte: Matrikel Nr. Note: Notenskala: 80-75=1.0 74-71=1.3 70-67=1.7 66-63=2.0 62-59=2.3 58-53=2.7 52-50=3.0 49-48=3.3 47-42=3.7
3. Aromatische Verbindungen Benzol(en)
 3. Aromatische Verbindungen Benzol(en) Benzol erweist sich merkwürdigerweise als ungewöhnlich stabil gegen viele angreifende Reagenzien. So finden die typischen Additionen an die Doppelbindungen nicht
3. Aromatische Verbindungen Benzol(en) Benzol erweist sich merkwürdigerweise als ungewöhnlich stabil gegen viele angreifende Reagenzien. So finden die typischen Additionen an die Doppelbindungen nicht
Chemie-Grundwissen der 9.Klasse
 Chemie-Grundwissen der 9.Klasse Stoffebene = Makroskopische (sichtbare) Ebene Betrachtung einer Stoffportion mit den erkennbaren und messbaren Eigenschaften Teilchenebene = Submikroskopische Ebene Betrachtung
Chemie-Grundwissen der 9.Klasse Stoffebene = Makroskopische (sichtbare) Ebene Betrachtung einer Stoffportion mit den erkennbaren und messbaren Eigenschaften Teilchenebene = Submikroskopische Ebene Betrachtung
LMPG 3, Spek-ÜB-15 LÖSUNG Seite 1 von 6
 LMPG 3, Spek-ÜB-15 LÖSUG Seite 1 von 6 Aufgabe 1: a) Woran lässt sich aus dem MS-Spektrum auf die Zahl der -Atome schliessen? Molekülionenpeak ist ungerade, also ist auch die Zahl der -Atome ungerade.
LMPG 3, Spek-ÜB-15 LÖSUG Seite 1 von 6 Aufgabe 1: a) Woran lässt sich aus dem MS-Spektrum auf die Zahl der -Atome schliessen? Molekülionenpeak ist ungerade, also ist auch die Zahl der -Atome ungerade.
2 Rationale und reelle Zahlen
 2 reelle Es gibt Mathematik mit Grenzwert (Analysis) und Mathematik ohne Grenzwert (z.b Algebra). Grenzwerte existieren sicher nur dann, wenn der Zahlbereich vollständig ist, also keine Lücken aufweist
2 reelle Es gibt Mathematik mit Grenzwert (Analysis) und Mathematik ohne Grenzwert (z.b Algebra). Grenzwerte existieren sicher nur dann, wenn der Zahlbereich vollständig ist, also keine Lücken aufweist
Erstellen von KV-Diagrammen. Fachschule für Mechatroniktechnik Kempten (Allgäu)
 Erstellen von KV-Diagrammen Zeile A 00 0 0 Eine Eingangsvariable Es wird für jede Zeile der Funktionstabelle ein Kästchen aufgezeichnet. Die Zuordnung muss dabei wie nachfolgend abgebildet erfolgen. Die
Erstellen von KV-Diagrammen Zeile A 00 0 0 Eine Eingangsvariable Es wird für jede Zeile der Funktionstabelle ein Kästchen aufgezeichnet. Die Zuordnung muss dabei wie nachfolgend abgebildet erfolgen. Die
2. [3] Im O2NF ist das N-atom das Zentralatom. a) geben Sie die Resonanzformeln an b) Was kann man über die Gestalt des Moleküls aussagen?
![2. [3] Im O2NF ist das N-atom das Zentralatom. a) geben Sie die Resonanzformeln an b) Was kann man über die Gestalt des Moleküls aussagen? 2. [3] Im O2NF ist das N-atom das Zentralatom. a) geben Sie die Resonanzformeln an b) Was kann man über die Gestalt des Moleküls aussagen?](/thumbs/65/52411034.jpg) Version 15.0 1 6. Lösungen "Lewis-Formeln, Löslichkeitsprodukt" 1. [16] Zeichnen ie die Valenzstrichformeln für folgende Moleküle einschließlich der Formalladungen. a) 4 + b) B4 - c) 4 d) i4 e) f) N g)
Version 15.0 1 6. Lösungen "Lewis-Formeln, Löslichkeitsprodukt" 1. [16] Zeichnen ie die Valenzstrichformeln für folgende Moleküle einschließlich der Formalladungen. a) 4 + b) B4 - c) 4 d) i4 e) f) N g)
1.4. Die Darstellung von Strukturen
 1 Elektronenstruktur und Bindung Säuren und Basen 3D-Moleküle: Li, 2, F zieht positive Ladungen an rot orange gelb grün blau zieht negative Ladungen an stärkstes negatives elektrostatisches Potenzial stärkstes
1 Elektronenstruktur und Bindung Säuren und Basen 3D-Moleküle: Li, 2, F zieht positive Ladungen an rot orange gelb grün blau zieht negative Ladungen an stärkstes negatives elektrostatisches Potenzial stärkstes
n Pentan 2- Methylbutan 2,2, dimethylpropan ( Wasserstoffatome sind nicht berücksichtigt )
 Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Praktikum Chemie für Biologen SS Kurse SS
 1 Praktikum Chemie für Biologen SS 2001 - Kurse SS Klausur in Organischer Chemie (KlOC) Sa 28.07.2001 Name:... Vorname:... Wenn Nachschreiber aus einem der Vorkurse, bitte eintragen: Matrikel-Nr. Semester
1 Praktikum Chemie für Biologen SS 2001 - Kurse SS Klausur in Organischer Chemie (KlOC) Sa 28.07.2001 Name:... Vorname:... Wenn Nachschreiber aus einem der Vorkurse, bitte eintragen: Matrikel-Nr. Semester
Elektrophile Reaktionsmechanismen Erkennungsmerkmale und Reaktionsschritte
 Elektrophile Reaktionsmechanismen Erkennungsmerkmale und Reaktionsschritte H. Wünsch 2012 Signale für elektrophile Reak;onen Signale am organischen Molekül: π- Elektronen (Mehrfachbindungen), π- Elektronensysteme
Elektrophile Reaktionsmechanismen Erkennungsmerkmale und Reaktionsschritte H. Wünsch 2012 Signale für elektrophile Reak;onen Signale am organischen Molekül: π- Elektronen (Mehrfachbindungen), π- Elektronensysteme
3.2 Streuungsmaße. 3 Lage- und Streuungsmaße 133. mittlere Variabilität. geringe Variabilität. große Variabilität 0.0 0.1 0.2 0.3 0.4 0.
 Eine Verteilung ist durch die Angabe von einem oder mehreren Mittelwerten nur unzureichend beschrieben. Beispiel: Häufigkeitsverteilungen mit gleicher zentraler Tendenz: geringe Variabilität mittlere Variabilität
Eine Verteilung ist durch die Angabe von einem oder mehreren Mittelwerten nur unzureichend beschrieben. Beispiel: Häufigkeitsverteilungen mit gleicher zentraler Tendenz: geringe Variabilität mittlere Variabilität
