Versuch 10: Siedediagramm
|
|
|
- Horst Maurer
- vor 7 Jahren
- Abrufe
Transkript
1 Versuch 10: Siedediagramm 1 Messung von Siedekurven binärer Stoffgemische 1. Theorie und Methode 1.1 Theorie Die Siedetemperatur eines Stoffes ist eine stoffspezifische Eigenschaft und hängt von der Größe des Dampfdruckes des Stoffes ab: Hat der Dampfdruck den Atmosphärendruck erreicht, siedet der Stoff und geht von der flüssigen Phase in die Gasphase über. Die Siedetemperatur von flüssigen Mischungen (z.b. Wasser Gemisch) unterscheidet sich von den Siedetemperaturen der einzelnen reinen Komponenten der Mischung. Aus dieser zu beobachtenden Siedepunktsänderung lassen sich Rückschlüsse ziehen auf die Zusammensetzung des Gemisches; der Siedepunkt der Mischung ist dabei von der Zusammensetzung der Mischung abhängig und liegt begründet in der Art und Stärke der Wechselwirkungen der einzelnen Komponenten. Eine Änderung der Zusammensetzung der Mischung z.b. hervorgerufen durch eine Destillation - hat also eine Änderung des Siedepunktes der Mischung zur Folge. In einem sogenannten Siedediagramm verdeutlicht man dieses Verhalten: In einem Siedediagramm wird die Siedetemperatur bei konstantem Druck gegen die Zusammensetzung der Lösung aufgetragen, wobei als Maß für die Zusammensetzung der Mischung der sogenannte Molenbruch (s.u.) verwendet wird. Im Praktikum wurden dabei drei mögliche Fälle bei binären Gemischen untersucht: 1) ideales Verhalten (z.b. Wasser - Gemisch): stetig abfallende Siedekurve; jeder Siedepunkt jedes möglichen Gemisches liegt zwischen den Siedepunkten der reinen Komponenten. 2) Positive Azeotropie (z.b. Chloroform Aceton Gemisch): Am azeotropen Punkt liegt ein Maximum-Siedepunkt vor. ) Negative Azeotropie (z.b. Ethanol Cyclohexan Gemisch): Am azeotropen Punkt liegt ein Minimum-Siedepunkt vor. Die beiden letzten Arten von Siedediagrammen entstehen bei azeotropen Stoffgemischen. Dies sind Stoffgemische, die sich wie reine Stoffe verhalten. Die Zusammensetzung ihrer flüssigen Phase entspricht der Zusammensetzung der gasförmigen Phase, so dass sie sich demnach auch nicht mehr destillativ trennen lassen. Der Siedepunkt von azeotropen Mischungen liegt nicht im Bereich zwischen den Siedepunkten der Einzelkomponenten. Beim Minimum-Siedepunkt handelt es sich um negative Azeotropie ( der azeotrope Punkt ist ein Minimum), d.h. eine Erhöhung des Dampfdruckes führt zu einem Maximum in der Dampfdruckkurve und zu einem Minimum im Siedediagramm. Beim Maximum-Siedepunkt handelt es sich um positive Azeotropie ( der azeotrope Punkt ist ein Maximum). Diese Extrempunkte entstehen durch Wechselwirkungen, die zwischen den Molekülen in dem Gemisch wirken. Ein Minimum im Siedediagramm zeigt eine Destabilisierung, ein Maximum hingegen eine Stabilisierung der flüssigen Phase an.
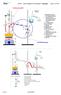
2 2 1.2 Aufgaben im Praktikum In unseren Versuchen sollten die Siedediagramme von Zweikomponentensystemen erstellt werden. Dazu haben wir die Siedepunkte in Abhängigkeit von der Zusammensetzung der folgenden Mischungen bestimmt: 1.) Wasser und (ideales Verhalten), 2.) Chloroform und Aceton (positive Azeotropie),.) Ethanol und Cyclohexan (negative Azeotropie). Aus den Messwerten wird ein Siedediagramm erstellt, in dem die gemessene Siedetemperatur in Abhängigkeit vom Molenbruch aufgetragen wird. Der Molenbruch ergibt sich aus: x A also: x A Molzahl des Stoffes A Gesamtmolzahl aller Stoffe na na+ n B+..., wobei sich die Molzahl n wie folgt ergibt: ma n A MA n A m A M A Molzahl des Stoffes A Masse des Stoffes A Molmasse von A Schließlich muss die Masse der flüssigen Mischungskomponente A bestimmt werden, die sich aus dem Produkt des Volumens V A und der Dichte ρ A berechnen lässt: ma VA ρ A V A ρ A Volumen des Stoffes A [cm ] Dichte des Stoffes A in [g/cm ] 2. Praktische Aufgaben 2.1 Geräteliste / Chemiekalien Dreihalskolben (100 ml) mit Schliffeinsätzen, Thermometer mit Schliff, Rückflusskühler mit Schliff, Heizpilz, Tropftrichter (50 ml), Messzylinder (100 ml), Trichter; Aceton, Ethanol,, Chloroform, Cyclohexan, Wasser, Siedesteinchen 2.2 Aufbau und Durchführung Der Aufbau wird entsprechend der folgenden Skizze vorgenommen und der Versuch wie folgt durchgeführt: Zunächst haben wir 40 ml der Substanz A in einen Dreihalskolben gegeben, um den Siedepunkt des reinen Stoffes A zu bestimmen. Dann haben wir über den Tropftrichter zu diesem Stoff bestimmte Mengen des Stoffes B zugeführt und die jeweiligen Siedetemperaturen gemessen. Genauso sind wir dann mit Stoff B verfahren, so dass wir zunächst den Siedepunkt der reinen Substanz ermittelt haben usw.
3 2. Darstellung und Auswertung der Messergebnisse 2..1 Ideale Mischung: Gemisch aus und Wasser Darstellung der Messergebnisse Nach entsprechender Versuchsausführung wurden die folgenden Siedepunkte bei folgender Zusammensetzung der Mischung bestimmt und anschließend die Molenbrüche errechnet: A: Wasser 40 ml Vorlage B: Zugabe [ml] X * Wasser X 0 100,5 0, ,0 1, ,0 0, ,0 0, ,5 0, ,0 0, ,0 0, ,0 0, ,5 0,1515 7,5 0, ,0 0, ,0 0, ,0 0,261 77,0 0, ,0 0,086 78,0 0,086
4 4 Bei der Berechnung der Molenbrüche wurde dabei mit folgenden Literaturwerten gerechnet: 1 ρ (Wasser) 0,997 g cm M (Wasser) 18,0148 g mol -1 ρ () 0,7914 g cm - M () 2,0416 g mol -1 * Beispielrechnung für die Berechnung des Molenbruchs von bei Zugabe von 8 ml zu 40 ml Wasser: a) Berechung der Masse von 40 ml Wasser: g mh 0,997 40cm ρ H V H cm 9,88 g b) Berechnung der Molzahl von 9,88 g Wasser: mh 9,88 g mol nh 2,217 mol MH O 18,0148g 2 c) Berechnung der Masse von 8 ml : g m ρ V 0,7914 8cm cm 6,12 g d) Berechnung der Molzahl von 6,12 g : n m M 6,12g mol 2,0416g 0,1976 mol e) Berechnung der Summe der Molzahlen: n ges nh O + n 2,217mol + 0,1976mol 2, 411mol 2 f) Berechnung des Molenbruchs X Methnanol : X n n ges 0,1976mol 2,411mol 0,0819 Die anderen Molenbrüche wurden entsprechend berechnet. Anmerkung: Wir haben immer ausschließlich die Molenbrüche der leichter flüchtigen Komponente berechnet, da beim Erstellen der Siedediagramme meist dieser Weg gewählt wird. Der Molenbruch der anderen Komponente B ergäbe sich zu X B 1- X A. Die jeweilige Siedetemperatur des Gemisches wird nun gegen den entsprechenden Molenbruch von aufgetragen; zum Vergleich werden in dasselbe Diagramm zwei Literaturwerte (die Siedepunkte der reinen Stoffe) eingetragen: 1 Literaturwerte aus: CRC: Handbook of Chemistry and Physics. 70. Auflage. London, New York: CRC Press 1989
5 5 Wasser--Gemisch 100,0 95,0 90,0 Sdp. [ C] 85,0 80,0 Messwerte Literaturwerte 75,0 70,0 65,0 60,0 0,0000 0,1000 0,2000 0,000 0,4000 0,5000 0,6000 0,7000 0,8000 0,9000 1,0000 X () Diskussion der Messergebnisse: Vergleich der experimentellen Messwerte mit den Literaturwerten: Substanz K P, exp. [ C] K P, lit. [ C] Fehler Wasser 100, ,5 % 66,0 65,15 1, % An dem Siedediagramm ist deutlich zu erkennen, dass sämtliche Siedepunkte der verschiedenen Mischungszusammensetzungen zwischen den Siedepunkten von reinem Wasser und reinem liegen; der Graph fällt stetig. Es liegt also eine ideale Mischung vor. Dieses ideale Verhalten ist damit zu erklären, dass keine grundlegenden Unterschiede zwischen den Wechselwirkungen, die zwischen Wassermolekülen wirken, und zwischen denjenigen, die zwischen molekülen wirken, bestehen. mit der polaren Hydroxid-Gruppe und dem kleinen unpolaren Rest und Wasser als polares Lösungsmittel sind sich sehr ähnlich. Formal lassen sich beide Substanzen als R-OH formulieren, wobei R im Fall von Wasser ein H-Atom und R im Fall von eine Methyl-Gruppe ist. Beide Substanzen können also untereinander Wasserstoffbrückenbindungen ausbilden; ihre Mischungen verhalten sich aufgrund der Ähnlichkeit der Moleküle ideal.
6 Positive Azeotropie: Gemisch aus Chloroform und Aceton Darstellung der Messergebnisse Nach entsprechender Versuchsausführung wurden die folgenden Siedepunkte bei folgender Zusammensetzung der Mischung bestimmt und anschließend die Molenbrüche errechnet: A: Chloroform 40 ml Vorlage B: Zugabe [ml] Aceton X Aceton Aceton X Aceton Chloroform 0 60,0 0, ,0 1, ,0 0, ,0 0, ,0 0, ,5 0, ,0 0, ,5 0, ,5 0,044 61,5 0, ,0 0,96 62,5 0, ,0 0,4668 6,0 0, ,0 0,5225 6,0 0,5225 Bei der Berechnung der Molenbrüche, die nach dergleichen Vorgehensweise wie unter aufgezeigt vorgenommen wurde, wurde mit folgenden Literaturwerten gerechnet: ρ (Aceton) 0,7899 g cm M (Aceton) 58,0794 g mol -1 ρ (Chloroform) 1,48 g cm - M (Chloroform) 119,779 g mol -1 Die jeweilige Siedetemperatur des Gemisches wird nun gegen den entsprechenden Molenbruch von Aceton aufgetragen; zum Vergleich werden in dasselbe Diagramm drei Literaturwerte (die Siedepunkte der reinen Stoffe und der Siedepunkt am azeotropen Punkt) eingetragen: Aceton-Chloroform-Gemisch 65,0 64,0 6,0 62,0 Sdp. [ C] 61,0 60,0 Messwerte Literaturwerte 59,0 58,0 57,0 56,0 0,0000 0,1000 0,2000 0,000 0,4000 0,5000 0,6000 0,7000 0,8000 0,9000 1,0000 X (Aceton)
7 Diskussion der Messergebnisse Vergleich der experimentellen Messwerte mit den Literaturwerten: Substanz K P, exp. [ C] K P, lit. [ C] Fehler Aceton 57,0 56,5 0,9 % Chloroform 60,0 61,2 2,0 % Gemisch K P, exp. [ C] am azeotropen K P, lit. [ C] am aze- Fehler Punkt otropen Punkt Aceton-Chloroform 6,0 64,4 2,2 % An dem Siedediagramm ist deutlich zu erkennen, dass ein Siedepunkts-Maximum am azeotropen Punkt vorliegt. Dieser Siedepunkt liegt höher als die Siedepunkte der beiden reinen Komponenten des binären Gemisches (positive Azeotropie). An diesem Punkt muss also die flüssige Phase gegenüber der Gasphase stabilisiert sein. Dies lässt sich mit den Wasserstoffbrückenbindungen erklären, wodurch die intermolekularen Wechselwirkungen gegenüber den reinen Stoffen zunehmen und somit der Siedepunkt ansteigt. 2.. Negative Azeotropie: Gemisch aus Cyclohexan und Ethanol Darstellung der Messergebnisse Nach entsprechender Versuchsausführung wurden die folgenden Siedepunkte bei folgender Zusammensetzung der Mischung bestimmt und anschließend die Molenbrüche errechnet: A: Ethanol 40 ml Vorlage B: Zugabe [ml] Cyclohexan X Ethanol Cyclohexan X Ethanol Ethanol 0 78,5 1, ,5 0, ,75 0, ,0 0, ,75 0, ,0 0, ,75 0, ,0 0, ,5 0, ,5 0, ,75 0,755 64,5 0, ,5 0, ,6 0, ,0 0, ,0 0,6494 Bei der Berechnung der Molenbrüche, die nach dergleichen Vorgehensweise wie unter aufgezeigt vorgenommen wurde, wurde mit folgenden Literaturwerten gerechnet: ρ (Ethanol) 0,789 g cm M (Ethanol) 46,0684 g mol -1 ρ (Cyclohexan) 0,7785 g cm - M (Cyclohexan) 84,1608 g mol -1 Die jeweilige Siedetemperatur des Gemisches wird nun gegen den entsprechenden Molenbruch von Ethanol aufgetragen; zum Vergleich werden in dasselbe Diagramm drei Literatur-
8 8 werte (die Siedepunkte der reinen Stoffe und der Siedepunkt am azeotropen Punkt) eingetragen: Cyclohexan-Ethanol-Gemisch 85,0 80,0 75,0 Sdp. [ C] Messwerte Literaturwerte 70,0 65,0 60,0 0,0000 0,1000 0,2000 0,000 0,4000 0,5000 0,6000 0,7000 0,8000 0,9000 1,0000 X (Ethanol) Diskussion der Messergebnisse Vergleich der experimentellen Messwerte mit den Literaturwerten: Substanz K P, exp. [ C] K P, lit. [ C] Fehler Cyclohexan 82,5 80,8 2,1 % Ethanol 78,5 78, 0, % Gemisch K P, exp. [ C] am azeotropen K P, lit. [ C] am aze- Fehler Punkt otropen Punkt Cyclohexan-Ethanol 65,0 64,8 0, % Das Siedediagramm von Cyclohexan und Ethanol weist ein Minimum im Graphen auf (gemessener azeotroper Punkt: 65,0 C), das sich unter den Siedepunkten der reinen Substanzen befindet. Dies liegt daran, dass Cyclohexanmoleküle sehr groß und unpolar sind und somit große van-der-waalskräfte besitzen, während Ethanolmoleküle sehr klein und polar sind. Dies führt dazu, dass sich die beiden Substanzen gegenseitig abschirmen, die Wechselwirkungen zwischen den Teilchen verringert wird, somit die flüssige Phase gegenüber der Gasphase destabilisiert ist und die Siedetemperatur sinkt.
9 9. Fehlerbetrachtung Insgesamt liefert der Versuch, wie die Vergleiche der experimentellen Daten mit den Literaturwerten zeigen, recht gute Ergebnisse. Folgende Fehlerquellen müssen aber in Betracht gezogen werden: Das Thermometer ist nur in 1 C Schritten skaliert, daher ist ein genaues Ablesen des Thermometers besonders bei nicht exakt konstanten Siedepunkten schwierig. Der Druck im Labor entsprach mit 1009 mbar nicht den Normbedingungen, daher kommt es zu Abweichungen bezüglich der Siedepunkte (Siedepunktserniedrigung). Weiterhin ist die Reinheit der eingesetzten Substanzen nicht garantiert; so zieht z.b. Ethanol über die Zeit Wasser an, was sich wiederum auf den Siedepunkt des Ethanols auswirkt. Auch sind gewisse Ungenauigkeiten beim Ablesen der zugegeben Volumina nicht auszuschließen; es wurde nicht mit Präzisionsgeräten (Pipetten) gearbeitet, sondern mit einem Messzylinder, der größere Standardabweichungen bzgl. der Volumina aufweist. Literaturangabe: CRC: Handbook of Chemistry and Physics. 70. Auflage. London, New York: CRC Press 1989
Azeotrope, Nichtideale Mischungen
 Azeotrope, Nichtideale Mischungen http://ac16.uni-paderborn.de/lehrveranstaltungen/_aac/vorles/skript/kap_7/kap7_5/kap7_55.html Nicht alle Lösungen verhalten sich ideal, folgen also dem RAOULTschen Gesetz
Azeotrope, Nichtideale Mischungen http://ac16.uni-paderborn.de/lehrveranstaltungen/_aac/vorles/skript/kap_7/kap7_5/kap7_55.html Nicht alle Lösungen verhalten sich ideal, folgen also dem RAOULTschen Gesetz
Versuch 14: Dampfdruckkurve - Messung der Dampfdruckkurven leicht verdampfbarer Flüssigkeiten -
 1 ersuch 14: Dampfdruckkurve - Messung der Dampfdruckkurven leicht verdampfbarer Flüssigkeiten - 1. Theorie Befindet sich eine Flüssigkeit in einem abgeschlossenen Gefäß, so stellt sich zwischen der Gasphase
1 ersuch 14: Dampfdruckkurve - Messung der Dampfdruckkurven leicht verdampfbarer Flüssigkeiten - 1. Theorie Befindet sich eine Flüssigkeit in einem abgeschlossenen Gefäß, so stellt sich zwischen der Gasphase
Versuch RE Bestimmung von Flüssigkeits-Dampf-Gleichgewichten Ermittlung der Trennleistung verschiedener Rektifikationskolonnen
 Versuch RE Bestimmung von Flüssigkeits-Dampf-Gleichgewichten Ermittlung der Trennleistung verschiedener Rektifikationskolonnen 1.) Bestimmung von Flüssigkeits-Dampf-Gleichgewichten Aufgabenstellung: -
Versuch RE Bestimmung von Flüssigkeits-Dampf-Gleichgewichten Ermittlung der Trennleistung verschiedener Rektifikationskolonnen 1.) Bestimmung von Flüssigkeits-Dampf-Gleichgewichten Aufgabenstellung: -
Siedediagramm binärer Gemische und Rektifikation
 Versuch Nr. 14: Siedediagramm binärer Gemische und Rektifikation 1. Ziel des Versuchs Ziel des Versuches, ist es die Siedekurve eines Methanol-Wasser-Gemisches aufzunehmen. Im zweiten Versuchsteil soll
Versuch Nr. 14: Siedediagramm binärer Gemische und Rektifikation 1. Ziel des Versuchs Ziel des Versuches, ist es die Siedekurve eines Methanol-Wasser-Gemisches aufzunehmen. Im zweiten Versuchsteil soll
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg
 Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg Lösungen zum Übungsblatt 4 zur Vorlesung Physikalische Chemie II WS 2008/09 Prof. E. Bartsch 4.1 Der Siedepunkt einer flüssigen Mischung
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg Lösungen zum Übungsblatt 4 zur Vorlesung Physikalische Chemie II WS 2008/09 Prof. E. Bartsch 4.1 Der Siedepunkt einer flüssigen Mischung
Versuch 5: Siedediagramm eines binären Systems
 Versuchsprotokoll Grundpraktikum Physikalische Chemie WS 09/10 Versuch 5: Siedediagramm eines binären Systems Assistent: Mike Sahl Versuchsdurchführung: 02.12.2009 Protokollabgabe: 09.12.2009 Gruppe B2
Versuchsprotokoll Grundpraktikum Physikalische Chemie WS 09/10 Versuch 5: Siedediagramm eines binären Systems Assistent: Mike Sahl Versuchsdurchführung: 02.12.2009 Protokollabgabe: 09.12.2009 Gruppe B2
Multiple-Choice Test. Alle Fragen können mit Hilfe der Versuchsanleitung richtig gelöst werden.
 PCG-Grundpraktikum Versuch 2- Siedediagramm Multiple-Choice Test Zu jedem Versuch im PCG wird ein Vorgespräch durchgeführt. Für den Versuch Siedediagramm wird dieses Vorgespräch durch einen Multiple-Choice
PCG-Grundpraktikum Versuch 2- Siedediagramm Multiple-Choice Test Zu jedem Versuch im PCG wird ein Vorgespräch durchgeführt. Für den Versuch Siedediagramm wird dieses Vorgespräch durch einen Multiple-Choice
Bundesrealgymnasium Imst. Chemie 2010-11. Klasse 4. Einführung Stoffe
 Bundesrealgymnasium Imst Chemie 2010-11 Einführung Stoffe Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter
Bundesrealgymnasium Imst Chemie 2010-11 Einführung Stoffe Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter
Versuch 6: Rektifikation
 Physikalisch-Chemisches Grundpraktikum Sommersemester 2004 Gruppe B9 Andreas Frintrup / Sven Wolff Versuch 6: Rektifikation Ziel: Die Effizienz zweier verschiedener Trennsäulen, einer fünfbödigen Glockenbodenkolonne
Physikalisch-Chemisches Grundpraktikum Sommersemester 2004 Gruppe B9 Andreas Frintrup / Sven Wolff Versuch 6: Rektifikation Ziel: Die Effizienz zweier verschiedener Trennsäulen, einer fünfbödigen Glockenbodenkolonne
LMPG1 ÜB3-Lösungen Grundlagen der Destillation Seite 1 von 12
 LMPG1 ÜB3-Lösungen Grundlagen der Destillation Seite 1 von 12 LMPG1 ÜB3-Lösungen Grundlagen der Destillation Seite 2 von 12 a. Nennen Sie eine Bedingung, damit eine Gleichstromdestillation zum Einsatz
LMPG1 ÜB3-Lösungen Grundlagen der Destillation Seite 1 von 12 LMPG1 ÜB3-Lösungen Grundlagen der Destillation Seite 2 von 12 a. Nennen Sie eine Bedingung, damit eine Gleichstromdestillation zum Einsatz
LMPG1 ÜB Grundlagen der Destillation Lösungen Seite 1 von 12
 LMPG1 ÜB Grundlagen der Destillation Lösungen Seite 1 von 12 LMPG1 ÜB Grundlagen der Destillation Lösungen Seite 2 von 12 a. Nennen Sie eine Bedingung, damit eine Gleichstromdestillation zum Einsatz kommt.
LMPG1 ÜB Grundlagen der Destillation Lösungen Seite 1 von 12 LMPG1 ÜB Grundlagen der Destillation Lösungen Seite 2 von 12 a. Nennen Sie eine Bedingung, damit eine Gleichstromdestillation zum Einsatz kommt.
Versuch 9: Siedepunktserhöhung und Gefrierpunktserniedrigung
 1 Versuch 9: Siedepunktserhöhung und Gefrierpunktserniedrigung 1. Theorie und Aufgabenstellung Theorie und Methode Lösungen bestehen aus einem Lösungsmittel und dem darin gelösten Stoff. Das Lösemittel
1 Versuch 9: Siedepunktserhöhung und Gefrierpunktserniedrigung 1. Theorie und Aufgabenstellung Theorie und Methode Lösungen bestehen aus einem Lösungsmittel und dem darin gelösten Stoff. Das Lösemittel
Fraktionierte Destillation eines Gemisches
 Fraktionierte Destillation eines Gemisches Die Destillation ist eine physikalische Trennmethode, bei welcher die unterschiedlichen Siedepunkte der Bestandteile (Komponenten) eines Gemisches zur Trennung
Fraktionierte Destillation eines Gemisches Die Destillation ist eine physikalische Trennmethode, bei welcher die unterschiedlichen Siedepunkte der Bestandteile (Komponenten) eines Gemisches zur Trennung
Schmelzdiagramm eines binären Stoffgemisches
 Praktikum Physikalische Chemie I 30. Oktober 2015 Schmelzdiagramm eines binären Stoffgemisches Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 1. Theorie hinter dem Versuch Ein Schmelzdiagramm zeigt
Praktikum Physikalische Chemie I 30. Oktober 2015 Schmelzdiagramm eines binären Stoffgemisches Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 1. Theorie hinter dem Versuch Ein Schmelzdiagramm zeigt
Endersch, Jonas 09./
 Endersch, Jonas 09./10.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Gruppe 3, Platz 53 Versuchsprotokoll Versuch 1.2: Destillation 1 Versuch 1.3: Destillation 2 Einleitung und Theorie: In diesen Versuchen
Endersch, Jonas 09./10.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Gruppe 3, Platz 53 Versuchsprotokoll Versuch 1.2: Destillation 1 Versuch 1.3: Destillation 2 Einleitung und Theorie: In diesen Versuchen
Physikalisches Anfaengerpraktikum. Zustandsgleichung idealer Gase und kritischer Punkt
 Physikalisches Anfaengerpraktikum Zustandsgleichung idealer Gase und kritischer Punkt Ausarbeitung von Marcel Engelhardt & David Weisgerber (Gruppe 37) Freitag, 18. März 005 email: Marcel.Engelhardt@mytum.de
Physikalisches Anfaengerpraktikum Zustandsgleichung idealer Gase und kritischer Punkt Ausarbeitung von Marcel Engelhardt & David Weisgerber (Gruppe 37) Freitag, 18. März 005 email: Marcel.Engelhardt@mytum.de
Protokoll zur Herstellung von Essigsäureethylester
 Protokoll zur Herstellung von Essigsäureethylester 1) Ziel des Versuches: Herstellung von Essigsäureethylester unter säurekatalytischen Bedingungen. 2) Theoretischer Hintergrund: Ester sind eine Klasse
Protokoll zur Herstellung von Essigsäureethylester 1) Ziel des Versuches: Herstellung von Essigsäureethylester unter säurekatalytischen Bedingungen. 2) Theoretischer Hintergrund: Ester sind eine Klasse
Versuch 5: Zersetzungsspannung
 Gruppe : Christina Sauermann und Johannes Martin 1 Versuch 5: Zersetzungsspannung 1 Darstellung der theoretischen Hintergründe Wird an die beiden Elektroden einer galvanischen Zelle eine Gleichspannung
Gruppe : Christina Sauermann und Johannes Martin 1 Versuch 5: Zersetzungsspannung 1 Darstellung der theoretischen Hintergründe Wird an die beiden Elektroden einer galvanischen Zelle eine Gleichspannung
T1 Molare Masse nach Viktor Meyer Protokoll
 Christian Müller Jan Philipp Dietrich Inhalt: a) Versuchserläuterung b) Messwerte c) Berechnung der Molaren Masse d) Berechnung der Dampfdichte e) Fehlerberechnung T1 Molare Masse nach Viktor Meyer Protokoll
Christian Müller Jan Philipp Dietrich Inhalt: a) Versuchserläuterung b) Messwerte c) Berechnung der Molaren Masse d) Berechnung der Dampfdichte e) Fehlerberechnung T1 Molare Masse nach Viktor Meyer Protokoll
Liebigkühler. Rundkolben Vorstoß. Becherglas
 Die Destillation 1 1 Allgemeines Bei der Destillation werden Stoffe mit unterschiedlichen Siedetemperaturen durch Erhitzen voneinander getrennt. Aus Rotwein kann auf diese Weise der Alkohol (Ethanol, Sdp.
Die Destillation 1 1 Allgemeines Bei der Destillation werden Stoffe mit unterschiedlichen Siedetemperaturen durch Erhitzen voneinander getrennt. Aus Rotwein kann auf diese Weise der Alkohol (Ethanol, Sdp.
Phasen, Komponenten, Freiheitsgrade
 Phasendiagramme 1 Lernziele: Ø Phasen, Komponenten, Freiheitsgrade Ø Die Phasenregel Ø Zweikomponentensysteme: Dampfdruckdiagramme, Hebelgesetz Ø Zweikomponentensysteme: Siedediagramme (die Destillation
Phasendiagramme 1 Lernziele: Ø Phasen, Komponenten, Freiheitsgrade Ø Die Phasenregel Ø Zweikomponentensysteme: Dampfdruckdiagramme, Hebelgesetz Ø Zweikomponentensysteme: Siedediagramme (die Destillation
Lernziele: Phasen, Komponenten, Freiheitsgrade Die Phasenregel Zweikomponentensysteme: Dampfdruckdiagramme,
 Phasendiagramme Lernziele: ee Phasen, Komponenten, Freiheitsgrade Die Phasenregel Zweikomponentensysteme: Dampfdruckdiagramme, Hebelgesetz Zweikomponentensysteme: Siedediagramme (die Distillation von Mischungen,
Phasendiagramme Lernziele: ee Phasen, Komponenten, Freiheitsgrade Die Phasenregel Zweikomponentensysteme: Dampfdruckdiagramme, Hebelgesetz Zweikomponentensysteme: Siedediagramme (die Distillation von Mischungen,
Demonstrationsexperimente WS 2005/2005
 Demonstrationsexperimente WS 2005/2005 Thema: Dichtebestimmung von Festkörpern Stefanie Scheler 11.11.2005 1. Versuchsbeschreibung: Materialliste: - Laufgewichtswaage - Aluminiumtauchkörper quaderförmig
Demonstrationsexperimente WS 2005/2005 Thema: Dichtebestimmung von Festkörpern Stefanie Scheler 11.11.2005 1. Versuchsbeschreibung: Materialliste: - Laufgewichtswaage - Aluminiumtauchkörper quaderförmig
Übungen zur Vorlesung Physikalische Chemie I Lösungsvorschlag zu Blatt 7
 1. Aufgabe Die kyroskopische Konstante E k und die ebulloskopische Konstante E e werden wie folgt berechnet. E k Wasser = R T 2 schmelz M H schmelz = 8,31451 J 273,15 K 2 18,02 10 3 kg mol = 1,86 K kg
1. Aufgabe Die kyroskopische Konstante E k und die ebulloskopische Konstante E e werden wie folgt berechnet. E k Wasser = R T 2 schmelz M H schmelz = 8,31451 J 273,15 K 2 18,02 10 3 kg mol = 1,86 K kg
Versuchsprotokoll. Spezifische Wärmekapazität des Wassers. Dennis S. Weiß & Christian Niederhöfer. zu Versuch 7
 Montag, 10.11.1997 Dennis S. Weiß & Christian Niederhöfer Versuchsprotokoll (Physikalisches Anfängerpraktikum Teil II) zu Versuch 7 Spezifische Wärmekapazität des Wassers 1 Inhaltsverzeichnis 1 Problemstellung
Montag, 10.11.1997 Dennis S. Weiß & Christian Niederhöfer Versuchsprotokoll (Physikalisches Anfängerpraktikum Teil II) zu Versuch 7 Spezifische Wärmekapazität des Wassers 1 Inhaltsverzeichnis 1 Problemstellung
 Lösungen flüchtiger Stoffe - Stofftrennung http://ac16.uni-paderborn.de/lehrveranstaltungen/_aac/vorles/skript/kap_7/kap7_5/ Für Lösungen flüchtiger Stoffe ist der Dampfdruck des Gemischs ebenfalls von
Lösungen flüchtiger Stoffe - Stofftrennung http://ac16.uni-paderborn.de/lehrveranstaltungen/_aac/vorles/skript/kap_7/kap7_5/ Für Lösungen flüchtiger Stoffe ist der Dampfdruck des Gemischs ebenfalls von
8. Mehrkomponentensysteme. 8.1 Partielle molare Größen. Experiment 1 unter Umgebungsdruck p:
 8. Mehrkomponentensysteme 8.1 Partielle molare Größen Experiment 1 unter Umgebungsdruck p: Fügen wir einer Menge Wasser n mit Volumen V (molares Volumen v m =V/n) bei einer bestimmten Temperatur T eine
8. Mehrkomponentensysteme 8.1 Partielle molare Größen Experiment 1 unter Umgebungsdruck p: Fügen wir einer Menge Wasser n mit Volumen V (molares Volumen v m =V/n) bei einer bestimmten Temperatur T eine
23. Mai 2000 Physikalisch-Chemisches Praktikum Versuch Nr. 11
 23. Mai 2000 Physikalisch-Chemisches Praktikum Versuch Nr. 11 Thema: Nernst scher Verteilungssatz Aufgabenstellung: 1. Ermittlung des Molekülzustandes der Benzoesäure in der Wasser- und in der Toluolphase
23. Mai 2000 Physikalisch-Chemisches Praktikum Versuch Nr. 11 Thema: Nernst scher Verteilungssatz Aufgabenstellung: 1. Ermittlung des Molekülzustandes der Benzoesäure in der Wasser- und in der Toluolphase
Auswertung. B06: Wasserdampf
 Auswertung zum Versuch B06: Wasserdampf Jule Heier Partner: Alexander FufaeV Gruppe 254 Versuchsteil A: Dampfdruck von Wasser Messung T in C p in mbar 22,2 28 30,5 44 35,9 59 41 77 45,3 98 48,4 113 51,6
Auswertung zum Versuch B06: Wasserdampf Jule Heier Partner: Alexander FufaeV Gruppe 254 Versuchsteil A: Dampfdruck von Wasser Messung T in C p in mbar 22,2 28 30,5 44 35,9 59 41 77 45,3 98 48,4 113 51,6
Dampfdruckmessungen an 1-Butanol und Ethanol
 Dampfdruckmessungen an 1-Butanol und Ethanol Jorge Ferreiro, D-CHAB, 1. Semester, fjorge@student.ethz.ch Lisa Kamber, D-CHAB, 1. Semester, kamberl@student.ethz.ch Assistentin: Maria Grazia Santangelo Abstract:
Dampfdruckmessungen an 1-Butanol und Ethanol Jorge Ferreiro, D-CHAB, 1. Semester, fjorge@student.ethz.ch Lisa Kamber, D-CHAB, 1. Semester, kamberl@student.ethz.ch Assistentin: Maria Grazia Santangelo Abstract:
PC I Thermodynamik und Transportprozesse
 20.06.2006 15:19 1 PC I Thermodynamik und Transportprozesse Kapitel 5 20.06.2006 15:19 2 V. Lösungen und Mischungen Im Winter des Jahres 1729 setzte ich Bier, Wein, Essig und Salzwasser in großen offenen
20.06.2006 15:19 1 PC I Thermodynamik und Transportprozesse Kapitel 5 20.06.2006 15:19 2 V. Lösungen und Mischungen Im Winter des Jahres 1729 setzte ich Bier, Wein, Essig und Salzwasser in großen offenen
Aufbau der Körper. Was ist in der Physik ein Körper?
 Aufbau der Körper Was ist in der Physik ein Körper? Lies im Lehrbuch S. 70/71 Zähle 4 verschiedene Körper auf! Jeder Körper besteht aus einem Stoff oder aus mehreren Stoffen. Es gibt 3 Aggregatzustände:
Aufbau der Körper Was ist in der Physik ein Körper? Lies im Lehrbuch S. 70/71 Zähle 4 verschiedene Körper auf! Jeder Körper besteht aus einem Stoff oder aus mehreren Stoffen. Es gibt 3 Aggregatzustände:
Die freie Energie wird also bei konstantem Volumen und konstanter Temperatur minimal
 Die freie Energie wird also bei konstantem Volumen und konstanter Temperatur minimal 7.2 Die Enthalpie Die Enthalpie H ist definiert als H = U + pv, womit wir für die Änderung erhalten dh = pdv + TdS +
Die freie Energie wird also bei konstantem Volumen und konstanter Temperatur minimal 7.2 Die Enthalpie Die Enthalpie H ist definiert als H = U + pv, womit wir für die Änderung erhalten dh = pdv + TdS +
14 Destillation Grundlagen Destillation
 72 4 Destillation 4 Destillation 4. Grundlagen Mit dem wichtigen rennverfahren der Destillation (die entscheidende Modifikation der Destillation stellt dabei die Rektifikation dar) lässt sich aus einem
72 4 Destillation 4 Destillation 4. Grundlagen Mit dem wichtigen rennverfahren der Destillation (die entscheidende Modifikation der Destillation stellt dabei die Rektifikation dar) lässt sich aus einem
Protokoll zum Versuch 4.2
 Grundpraktikum Physikalische Chemie Studiengang: Chemie-Ingenieurwesen Technische Universität München SS 2003 Protokoll zum Versuch 4.2 Entmischungsgleichgewicht Gruppe 3 Kim Langbein Oliver Gobin 07 April
Grundpraktikum Physikalische Chemie Studiengang: Chemie-Ingenieurwesen Technische Universität München SS 2003 Protokoll zum Versuch 4.2 Entmischungsgleichgewicht Gruppe 3 Kim Langbein Oliver Gobin 07 April
VERDAMPFUNGSGLEICHGEWICHTE: SIEDEDIAGRAMM EINER BINÄREN MISCHUNG
 VERDAMPFUNGSGLEICHGEWICHTE: RAMM EINER BINÄREN MISCHUNG 1. Lernziel Ziel des Versuchs ist es, ein zu bestimmen, um ein besseres Verständnis für Verdampfungsgleichgewichte und Mischeigenschaften flüssiger
VERDAMPFUNGSGLEICHGEWICHTE: RAMM EINER BINÄREN MISCHUNG 1. Lernziel Ziel des Versuchs ist es, ein zu bestimmen, um ein besseres Verständnis für Verdampfungsgleichgewichte und Mischeigenschaften flüssiger
Die Zustandsgleichung realer Gase
 Die Zustandsgleichung realer Gase Grolik Benno, Kopp Joachim 2. Januar 2003 1 Grundlagen des Versuchs Der Zustand eines idealen Gases wird durch die drei elementaren Zustandsgrößen Druck p, Temperatur
Die Zustandsgleichung realer Gase Grolik Benno, Kopp Joachim 2. Januar 2003 1 Grundlagen des Versuchs Der Zustand eines idealen Gases wird durch die drei elementaren Zustandsgrößen Druck p, Temperatur
Aufgaben. 2 Physikalische Grundlagen
 Der Verdampfungs- oder Kondensationspunkt jedes Stoffes ist von der Temperatur und dem Druck abhängig. Für jede Verdampfungstemperatur gibt es nur einen zugehörigen Verdampfungsdruck und für jeden Verdampfungsdruck
Der Verdampfungs- oder Kondensationspunkt jedes Stoffes ist von der Temperatur und dem Druck abhängig. Für jede Verdampfungstemperatur gibt es nur einen zugehörigen Verdampfungsdruck und für jeden Verdampfungsdruck
Versuch 8: Thermospannung
 PC-Grundpraktikum Versuch 8: Thermospannung vom 9.11.1999 Gruppe : Christina Sauermann und Johannes Martin 1 Versuch 8: Thermospannung 1. Theorie Kontaktspannung (Volta-Spannung; Graf Alessandro Volta
PC-Grundpraktikum Versuch 8: Thermospannung vom 9.11.1999 Gruppe : Christina Sauermann und Johannes Martin 1 Versuch 8: Thermospannung 1. Theorie Kontaktspannung (Volta-Spannung; Graf Alessandro Volta
Die Einheit Mol Stoffmengen können in verschiedenen Einheiten gemessen werden:
 Cusanus-Gymnasium Wittlich W. Zimmer 1/5 Die Einheit Mol Stoffmengen können in verschiedenen Einheiten gemessen werden: a) durch die Angabe ihrer Masse b) durch die Angabe ihres Volumens c) durch die Anzahl
Cusanus-Gymnasium Wittlich W. Zimmer 1/5 Die Einheit Mol Stoffmengen können in verschiedenen Einheiten gemessen werden: a) durch die Angabe ihrer Masse b) durch die Angabe ihres Volumens c) durch die Anzahl
Das chemische Potential- eine Übersicht wichtiger Beziehungen
 Das chemische Potential- eine Übersicht wichtiger Beziehungen Definition des chem. Potentials Das chemische Potential beschreibt die bhängigkeit der extensiven thermodynamischen Energiegrößen von der Stoffmenge.
Das chemische Potential- eine Übersicht wichtiger Beziehungen Definition des chem. Potentials Das chemische Potential beschreibt die bhängigkeit der extensiven thermodynamischen Energiegrößen von der Stoffmenge.
Versuch 8 Konzentrations- und Temperaturabhängigkeit der Zersetzungsspannung
 Modultitel Studiengang Versuch 8 Konzentrations- und Temperaturabhängigkeit der Zersetzungsspannung Versuchsdurchführung am Betreuer: Gruppe Namen 1. Ziel des Versuches In diesem Versuch sollen die Temperatur-
Modultitel Studiengang Versuch 8 Konzentrations- und Temperaturabhängigkeit der Zersetzungsspannung Versuchsdurchführung am Betreuer: Gruppe Namen 1. Ziel des Versuches In diesem Versuch sollen die Temperatur-
Universität Leipzig Studiengang Chemie (Bachelor) Wintersemester 2013/2014. Protokoll
 Universität Leipzig Studiengang Chemie (Bachelor) Physikalisch-chemisches Grundpraktikum Wintersemester 203/204 Protokoll Versuch 3 Siede- und Volumenverhalten von binären Flüssigkeitsmischungen Betreuer:
Universität Leipzig Studiengang Chemie (Bachelor) Physikalisch-chemisches Grundpraktikum Wintersemester 203/204 Protokoll Versuch 3 Siede- und Volumenverhalten von binären Flüssigkeitsmischungen Betreuer:
Effizienz von Algorithmen
 Effizienz von Algorithmen Letzte Bearbeitung: Jan 211 Ein wichtiger Aspekt bei Algorithmen sind seine "Kosten". Wir wollen uns hier ausschließlich mit der Laufzeit des gewählten Algorithmus beschäftigen.
Effizienz von Algorithmen Letzte Bearbeitung: Jan 211 Ein wichtiger Aspekt bei Algorithmen sind seine "Kosten". Wir wollen uns hier ausschließlich mit der Laufzeit des gewählten Algorithmus beschäftigen.
M5 Viskosität von Flüssigkeiten
 Christian Müller Jan Philipp Dietrich M5 Viskosität von Flüssigkeiten I. Dynamische Viskosität a) Erläuterung b) Berechnung der dynamischen Viskosität c) Fehlerrechnung II. Kinematische Viskosität a) Gerätekonstanten
Christian Müller Jan Philipp Dietrich M5 Viskosität von Flüssigkeiten I. Dynamische Viskosität a) Erläuterung b) Berechnung der dynamischen Viskosität c) Fehlerrechnung II. Kinematische Viskosität a) Gerätekonstanten
Gefrierpunktserniedrigung
 Knoch, Anastasiya Datum der Durchführung: Petri, Guido 05.01.2016 (Gruppe 11) Datum der Korrektur: 02.02.2016 Praktikum Physikalische Chemie I. Thermodynamik Gefrierpunktserniedrigung 1. Aufgabenstellung
Knoch, Anastasiya Datum der Durchführung: Petri, Guido 05.01.2016 (Gruppe 11) Datum der Korrektur: 02.02.2016 Praktikum Physikalische Chemie I. Thermodynamik Gefrierpunktserniedrigung 1. Aufgabenstellung
Versuch Nr.53. Messung kalorischer Größen (Spezifische Wärmen)
 Versuch Nr.53 Messung kalorischer Größen (Spezifische Wärmen) Stichworte: Wärme, innere Energie und Enthalpie als Zustandsfunktion, Wärmekapazität, spezifische Wärme, Molwärme, Regel von Dulong-Petit,
Versuch Nr.53 Messung kalorischer Größen (Spezifische Wärmen) Stichworte: Wärme, innere Energie und Enthalpie als Zustandsfunktion, Wärmekapazität, spezifische Wärme, Molwärme, Regel von Dulong-Petit,
b) Hydrostatik, Aerostatik (Fortsetzung) Schweredruck:
 b) Hydrostatik, Aerostatik (Fortsetzung) Schweredruck: = Druck einer senkrecht über einer Fläche A Stehenden Substanz (auch Flächen innerhalb der Flüssigkeit, nicht nur am Boden) Schweredruck steigt linear
b) Hydrostatik, Aerostatik (Fortsetzung) Schweredruck: = Druck einer senkrecht über einer Fläche A Stehenden Substanz (auch Flächen innerhalb der Flüssigkeit, nicht nur am Boden) Schweredruck steigt linear
Zu Modul 9: Förderung des eigenverantwortlichen Lernens Integrierte Schülerübungen Thema Dichte. a) integrierte Schülerübung. b) gemeinsame Auswertung
 SET 2 Realschule Bayern integrierte Schülerübung / Dichte Seite 1 Zu Modul 9: Förderung des eigenverantwortlichen Lernens Integrierte Schülerübungen Thema Dichte Aktionen Inhalte / Erwartungen Erfahrungen
SET 2 Realschule Bayern integrierte Schülerübung / Dichte Seite 1 Zu Modul 9: Förderung des eigenverantwortlichen Lernens Integrierte Schülerübungen Thema Dichte Aktionen Inhalte / Erwartungen Erfahrungen
Physikalische Chemie Praktikum. Mischphasenthermodynamik: Gefrierpunktserniedrigung Molmassenbestimmung
 Hochschule Emden / Leer Physikalische Chemie Praktikum Mischphasenthermodynamik: Gefrierpunktserniedrigung Molmassenbestimmung Vers.Nr. 17 Sept. 2015 Allgemeine Grundlagen a) Reine Stoffe Bei reinen Stoffen
Hochschule Emden / Leer Physikalische Chemie Praktikum Mischphasenthermodynamik: Gefrierpunktserniedrigung Molmassenbestimmung Vers.Nr. 17 Sept. 2015 Allgemeine Grundlagen a) Reine Stoffe Bei reinen Stoffen
Modul: Allgemeine Chemie
 Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
A 3 Dampfdruckkurve einer leichtflüchtigen Flüssigkeit
 Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1 A 3 Dampfdruckkurve einer leichtflüchtigen Flüssigkeit Aufgabe: Es ist die Dampfdruckkurve einer leicht flüchtigen Flüssigkeit zu ermitteln
Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1 A 3 Dampfdruckkurve einer leichtflüchtigen Flüssigkeit Aufgabe: Es ist die Dampfdruckkurve einer leicht flüchtigen Flüssigkeit zu ermitteln
Kapitel 2. Fehlerrechnung
 Fehlerrechnung 1 Messungen => quantitative Aussagen Messungen müssen zu jeder Zeit und an jedem Ort zu den gleichen Ergebnissen führen Messungen sind immer mit Fehler behaftet. => Angabe des Fehlers! Bespiel
Fehlerrechnung 1 Messungen => quantitative Aussagen Messungen müssen zu jeder Zeit und an jedem Ort zu den gleichen Ergebnissen führen Messungen sind immer mit Fehler behaftet. => Angabe des Fehlers! Bespiel
E Homogene / inhomogene Mischungen und Entmischungsdiagramme
 E Homogene / inhomogene Mischungen und Entmischungsdiagramme 1 Homogene / inhomogene Mischungen Es gibt Flüssigkeiten, die bilden beim Mischen eine klare und einheitlich aussehende Lösung. Solche Mischungen,
E Homogene / inhomogene Mischungen und Entmischungsdiagramme 1 Homogene / inhomogene Mischungen Es gibt Flüssigkeiten, die bilden beim Mischen eine klare und einheitlich aussehende Lösung. Solche Mischungen,
Messprotokoll 13.9.1907, Partner Albert Einstein
 Messprotokoll 3.9.97, Partner Albert Einstein Aufgabe Eigenfrequenz des Drehpendels messen Dauer von 5 Schwingungen bei anfänglicher Auslenkung von 8 Skalenteilen: Dauer von 5 Schwingungen bei anfänglicher
Messprotokoll 3.9.97, Partner Albert Einstein Aufgabe Eigenfrequenz des Drehpendels messen Dauer von 5 Schwingungen bei anfänglicher Auslenkung von 8 Skalenteilen: Dauer von 5 Schwingungen bei anfänglicher
Taschenbuch der Verfahrenstechnik Herausgegeben von Karl Schwister
 aschenbuch der Verfahrenstechnik Herausgegeben von Karl Schwister ISBN-: 3-446-458-9 ISBN-3: 978-3-446-458-9 Leseprobe Weitere Informationen oder Bestellungen unter http://www.hanser.de/978-3-446-458-9
aschenbuch der Verfahrenstechnik Herausgegeben von Karl Schwister ISBN-: 3-446-458-9 ISBN-3: 978-3-446-458-9 Leseprobe Weitere Informationen oder Bestellungen unter http://www.hanser.de/978-3-446-458-9
2-Methylcyclohexanon
 rganisches Praktikum I - SS 2006 Assistentin: Gabi Marti Synthese von 2-Methylcyclohexanon Zürich, Balzers & Eschen, Juni 2006 Daniel Frick frickd@student.ethz.ch 1. Einleitung 1 Das Ausgangsprodukt dieser
rganisches Praktikum I - SS 2006 Assistentin: Gabi Marti Synthese von 2-Methylcyclohexanon Zürich, Balzers & Eschen, Juni 2006 Daniel Frick frickd@student.ethz.ch 1. Einleitung 1 Das Ausgangsprodukt dieser
Schülerübung Ph-8. b) Ablesen des Volumens an der Skala erfolgt immer auf Augenhöhe.
 Schülerübung Ph-8 Dichte 1)Kurze allgemeine Hinweise a) 1ml entspricht 1cm³ b) Ablesen des Volumens an der Skala erfolgt immer auf Augenhöhe. c) Die Waage schaltet sich nach 60s ohne Aktivität automatisch
Schülerübung Ph-8 Dichte 1)Kurze allgemeine Hinweise a) 1ml entspricht 1cm³ b) Ablesen des Volumens an der Skala erfolgt immer auf Augenhöhe. c) Die Waage schaltet sich nach 60s ohne Aktivität automatisch
mischbar Lösung Feststoffen
 Kristalle züchten Mischen und Lösen - Nicht alle Stoffe sind miteinander mischbar. --> Hexan (Bestandteil von Benzin) und Wasser --> Hast du Beispiele aus dem Alltag? - Kann man die Stoffe nach dem Mischen
Kristalle züchten Mischen und Lösen - Nicht alle Stoffe sind miteinander mischbar. --> Hexan (Bestandteil von Benzin) und Wasser --> Hast du Beispiele aus dem Alltag? - Kann man die Stoffe nach dem Mischen
Chemisches Praktikum für TUM-BWL Praxisseminar II Grundoperationen und Reinigungstechniken
 Chemisches Praktikum für TUM-BWL Praxisseminar II Grundoperationen und Reinigungstechniken Inhalt: Wiederholung Azeotrop-Destillation Extraktion Kontinuierliche Feststoffextraktion Dr. Andreas Bauer, Dr.
Chemisches Praktikum für TUM-BWL Praxisseminar II Grundoperationen und Reinigungstechniken Inhalt: Wiederholung Azeotrop-Destillation Extraktion Kontinuierliche Feststoffextraktion Dr. Andreas Bauer, Dr.
Versuch 1: Destillation Chemieteil, Herbstsemester 2008
 Versuch 1: Destillation Chemieteil, Herbstsemester 2008 Verfasser: Zihlmann Claudio Teammitglied: Knüsel Philippe Datum: 12.11.08 Assistent: André Röthlisberger E-Mail: zclaudio@student.ethz.ch 1. Abstract
Versuch 1: Destillation Chemieteil, Herbstsemester 2008 Verfasser: Zihlmann Claudio Teammitglied: Knüsel Philippe Datum: 12.11.08 Assistent: André Röthlisberger E-Mail: zclaudio@student.ethz.ch 1. Abstract
Mathcad Berechnung hydraulischer Verluste fluidführender Systeme
 WARMWASSER ERNEUERBARE ENERGIEN KLIMA RAUMHEIZUNG Mathcad Berechnung hydraulischer Verluste fluidführender Systeme Dipl.-Ing. Carsten Hüge Agenda > Beschreibung der Problemstellung Definition der Druckverluste
WARMWASSER ERNEUERBARE ENERGIEN KLIMA RAUMHEIZUNG Mathcad Berechnung hydraulischer Verluste fluidführender Systeme Dipl.-Ing. Carsten Hüge Agenda > Beschreibung der Problemstellung Definition der Druckverluste
2. GRUNDLAGEN. 2.1 Kontinuierliche Thermodynamik
 2 GRUNDLAGEN 21 Kontinuierliche Thermodynamik Die Thermodynamik basiert auf Stoffmengen Eine thermodynamische extensive Größe Z wird hierbei als Funktion von der Temperatur T, dem Druck p und den Stoffmengen
2 GRUNDLAGEN 21 Kontinuierliche Thermodynamik Die Thermodynamik basiert auf Stoffmengen Eine thermodynamische extensive Größe Z wird hierbei als Funktion von der Temperatur T, dem Druck p und den Stoffmengen
Die Zusammensetzung am Ausgang der Verdampfereinheit (0) kann aus dem beigefügten T, x-diagramm abgelesen werden zu
 Fragenteil : Aufgabe Phasengleichgewichte P a Eine binäre Mischung wird in einer Verdampfereinheit kontinuierlich teilweise verdampft. Messtechnisch wurden für die Ausgangsströme der Temperatur, der Druck
Fragenteil : Aufgabe Phasengleichgewichte P a Eine binäre Mischung wird in einer Verdampfereinheit kontinuierlich teilweise verdampft. Messtechnisch wurden für die Ausgangsströme der Temperatur, der Druck
2. SIEDEDIAGRAMM FÜR EINE BINÄRE MISCHUNG. Zum Bestehen müssen vier von sechs gestellten Fragen richtig beantwortet werden.
 1 2. SIEDEDIAGRAMM FÜR EINE BINÄRE MISCHUNG Fragen zum Eingangskolloquium: Zum Bestehen müssen vier von sechs gestellten Fragen richtig beantwortet werden. 1. Definieren Sie den Begriff Phase? 2. Wann
1 2. SIEDEDIAGRAMM FÜR EINE BINÄRE MISCHUNG Fragen zum Eingangskolloquium: Zum Bestehen müssen vier von sechs gestellten Fragen richtig beantwortet werden. 1. Definieren Sie den Begriff Phase? 2. Wann
Mathias Arbeiter 02. Mai 2006 Betreuer: Herr Bojarski. Operationsverstärker. OPV-Kenndaten und Grundschaltungen
 Mathias Arbeiter 02. Mai 2006 Betreuer: Herr Bojarski Operationsverstärker OPV-Kenndaten und Grundschaltungen Inhaltsverzeichnis 1 Eigenschaften von Operationsverstärkern 3 1.1 Offsetspannung..........................................
Mathias Arbeiter 02. Mai 2006 Betreuer: Herr Bojarski Operationsverstärker OPV-Kenndaten und Grundschaltungen Inhaltsverzeichnis 1 Eigenschaften von Operationsverstärkern 3 1.1 Offsetspannung..........................................
Protokoll zum Versuch M1 Bestimmung der Fallbeschleunigung g am Fadenpendel
 Protokoll zum Versuch M1 Bestimmung der Fallbeschleunigung g am Fadenpendel Norman Wirsik Matrikelnr: 1829994 8. November 2004 Gruppe 5 Dienstag 13-16 Uhr Praktikumspartner: Jan Hendrik Kobarg 1 1. Ziel
Protokoll zum Versuch M1 Bestimmung der Fallbeschleunigung g am Fadenpendel Norman Wirsik Matrikelnr: 1829994 8. November 2004 Gruppe 5 Dienstag 13-16 Uhr Praktikumspartner: Jan Hendrik Kobarg 1 1. Ziel
Physik 4 Praktikum Auswertung Zustandsdiagramm Ethan
 Physik 4 Praktikum Auswertung Zustandsdiagramm Ethan Von J.W., I.G. 2014 Seite 1. Kurzfassung......... 2 2. Theorie.......... 2 2.1. Zustandsgleichung....... 2 2.2. Koexistenzgebiet........ 3 2.3. Kritischer
Physik 4 Praktikum Auswertung Zustandsdiagramm Ethan Von J.W., I.G. 2014 Seite 1. Kurzfassung......... 2 2. Theorie.......... 2 2.1. Zustandsgleichung....... 2 2.2. Koexistenzgebiet........ 3 2.3. Kritischer
Protokoll. zum Physikpraktikum. Versuch Nr.: 1 Dichtebestimmung. Gruppe Nr.: 1 Andreas Bott (Protokollant)
 Protokoll zum Physikpraktikum Versuch Nr.: 1 Dichtebestimmung Gruppe Nr.: 1 Andreas Bott (Protokollant) Marco Schäfer Theoretische Grundlagen Masse: Die Masse ist eine SI-Basiseinheit. Ihr Formelziechen
Protokoll zum Physikpraktikum Versuch Nr.: 1 Dichtebestimmung Gruppe Nr.: 1 Andreas Bott (Protokollant) Marco Schäfer Theoretische Grundlagen Masse: Die Masse ist eine SI-Basiseinheit. Ihr Formelziechen
LEE2: 2. Messung der Molrefraktion der Flüssigkeiten für die Bestimmung der Qualität des Rohmaterials
 ŠPŠCH Brno Erarbeitung berufspädagogischer Konzepte für die beruflichen Handlungsfelder Arbeiten im Chemielabor und Operator Angewandte Chemie und Lebensmittelanalyse LEE2: 2. Messung der Molrefraktion
ŠPŠCH Brno Erarbeitung berufspädagogischer Konzepte für die beruflichen Handlungsfelder Arbeiten im Chemielabor und Operator Angewandte Chemie und Lebensmittelanalyse LEE2: 2. Messung der Molrefraktion
Protokoll Dampfdruck. Punkte: /10
 Protokoll Dampfdruck Gruppe Biologie Assistent: Olivier Evelyn Jähne, Eva Eickmeier, Claudia Keller Kontakt: claudiakeller@teleport.ch Sommersemester 2006 6. Juni 2006 Punkte: /0 . Einleitung Wenn eine
Protokoll Dampfdruck Gruppe Biologie Assistent: Olivier Evelyn Jähne, Eva Eickmeier, Claudia Keller Kontakt: claudiakeller@teleport.ch Sommersemester 2006 6. Juni 2006 Punkte: /0 . Einleitung Wenn eine
2. Fluide Phasen. 2.1 Die thermischen Zustandsgrößen Masse m [m] = kg
![2. Fluide Phasen. 2.1 Die thermischen Zustandsgrößen Masse m [m] = kg 2. Fluide Phasen. 2.1 Die thermischen Zustandsgrößen Masse m [m] = kg](/thumbs/75/72774995.jpg) 2. Fluide Phasen 2.1 Die thermischen Zustandsgrößen 2.1.1 Masse m [m] = kg bestimmbar aus: Newtonscher Bewegungsgleichung (träge Masse): Kraft = träge Masse x Beschleunigung oder (schwere Masse) Gewichtskraft
2. Fluide Phasen 2.1 Die thermischen Zustandsgrößen 2.1.1 Masse m [m] = kg bestimmbar aus: Newtonscher Bewegungsgleichung (träge Masse): Kraft = träge Masse x Beschleunigung oder (schwere Masse) Gewichtskraft
Versuch 10. Rektifikation und Rektifizierkolonne
 Praktikum Physikalische Chemie Versuch 1 Rektifikation und Rektifizierkolonne Bestimmung der theoretischen Bodenzahl einer Rektifikationskolonne am Beispiel eines binären Gemisches ktualisiertes Versuchsskript,
Praktikum Physikalische Chemie Versuch 1 Rektifikation und Rektifizierkolonne Bestimmung der theoretischen Bodenzahl einer Rektifikationskolonne am Beispiel eines binären Gemisches ktualisiertes Versuchsskript,
Flüssigkeiten. einige wichtige Eigenschaften
 Flüssigkeiten einige wichtige Eigenschaften Die Oberflächenspannung einer Flüssigkeit ist die zur Vergröß ößerung der Oberfläche um den Einheitsbetrag erforderliche Energie (H 2 O bei 20 C: 7.29 10-2 J/m
Flüssigkeiten einige wichtige Eigenschaften Die Oberflächenspannung einer Flüssigkeit ist die zur Vergröß ößerung der Oberfläche um den Einheitsbetrag erforderliche Energie (H 2 O bei 20 C: 7.29 10-2 J/m
Praktikumsprotokoll Physikalisch-Chemisches Anfängerpraktikum
 Praktikumsprotokoll Physikalisch-Chemisches Anfängerpraktikum Tobias Schabel Datum des Praktikumstags: 02.12.2005 Matthias Ernst Protokoll-Datum: 12/20/2005 Gruppe A-11 11. Versuch: Schmelzdiagramm Assistent:
Praktikumsprotokoll Physikalisch-Chemisches Anfängerpraktikum Tobias Schabel Datum des Praktikumstags: 02.12.2005 Matthias Ernst Protokoll-Datum: 12/20/2005 Gruppe A-11 11. Versuch: Schmelzdiagramm Assistent:
LF - Leitfähigkeit / Überführung
 Verfasser: Matthias Ernst, Tobias Schabel Gruppe: A 11 Betreuer: G. Heusel Datum: 18.11.2005 Aufgabenstellung LF - Leitfähigkeit / Überführung 1) Es sind die Leitfähigkeiten von zwei unbekanten Elektrolyten
Verfasser: Matthias Ernst, Tobias Schabel Gruppe: A 11 Betreuer: G. Heusel Datum: 18.11.2005 Aufgabenstellung LF - Leitfähigkeit / Überführung 1) Es sind die Leitfähigkeiten von zwei unbekanten Elektrolyten
0.1 Barometrische Höhenformel
 0. Barometrische Höhenformel Da, wie aus den bisherigen Überlegungen hervorgegeangen ist, Gase komressibel sind, kann deren Dichte nicht als konstant angesehen werden. Dies hat Konsequenzen auf den Schweredruck
0. Barometrische Höhenformel Da, wie aus den bisherigen Überlegungen hervorgegeangen ist, Gase komressibel sind, kann deren Dichte nicht als konstant angesehen werden. Dies hat Konsequenzen auf den Schweredruck
ENGLER-BUNTE-INSTITUT Bereich I: Chemische Energieträger - Brennstofftechnologie. Verfahrenstechnisches Praktikum (22999) am Engler-Bunte-Institut
 ENGLER-BUNTE-INSTITUT Bereich I: Chemische Energieträger - Brennstofftechnologie INHALT Verfahrenstechnisches Praktikum (22999) am Engler-Bunte-Institut - Versuch C3-1 STOFFDATEN VON BENZIN UND DIESEL
ENGLER-BUNTE-INSTITUT Bereich I: Chemische Energieträger - Brennstofftechnologie INHALT Verfahrenstechnisches Praktikum (22999) am Engler-Bunte-Institut - Versuch C3-1 STOFFDATEN VON BENZIN UND DIESEL
Übungen zur Vorlesung Physikalische Chemie 1 (B. Sc.) Lösungsvorschlag zu Blatt 11
 Übungen zur Vorlesung Physikalische Chemie 1 (B. Sc.) Lösungsvorschlag zu Blatt 11 Prof. Dr. Norbert Hampp Jens Träger Sommersemester 2007 02. 07. 2007 Aufgabe 1 a) Die Dampfdrücke nach dem Raoult schen
Übungen zur Vorlesung Physikalische Chemie 1 (B. Sc.) Lösungsvorschlag zu Blatt 11 Prof. Dr. Norbert Hampp Jens Träger Sommersemester 2007 02. 07. 2007 Aufgabe 1 a) Die Dampfdrücke nach dem Raoult schen
Messung der Leitfähigkeit wässriger Elektrolytlösungen
 Versuch Nr. 10: Messung der Leitfähigkeit wässriger Elektrolytlösungen 1. Ziel des Versuchs In diesem Versuch sollen die Leitfähigkeiten von verschiedenen Elektrolyten in verschiedenen Konzentrationen
Versuch Nr. 10: Messung der Leitfähigkeit wässriger Elektrolytlösungen 1. Ziel des Versuchs In diesem Versuch sollen die Leitfähigkeiten von verschiedenen Elektrolyten in verschiedenen Konzentrationen
Mischungslücke in der flüssigen Phase
 Übungen in physikalischer Chemie für B. Sc.-Studierende Versuch Nr.: S05 Version 2015 Kurzbezeichnung: Mischungslücke Mischungslücke in der flüssigen Phase Aufgabenstellung Die Entmischungskurven von Phenol/Wasser
Übungen in physikalischer Chemie für B. Sc.-Studierende Versuch Nr.: S05 Version 2015 Kurzbezeichnung: Mischungslücke Mischungslücke in der flüssigen Phase Aufgabenstellung Die Entmischungskurven von Phenol/Wasser
10. Versuch: Schiefe Ebene
 Physikpraktikum für Pharmazeuten Universität Regensburg Fakultät Physik 10. Versuch: Schiefe Ebene In diesem Versuch untersuchen Sie Mechanik der schiefen Ebene, indem Sie mithilfe dem statischen und dynamischen
Physikpraktikum für Pharmazeuten Universität Regensburg Fakultät Physik 10. Versuch: Schiefe Ebene In diesem Versuch untersuchen Sie Mechanik der schiefen Ebene, indem Sie mithilfe dem statischen und dynamischen
Aufgabe: Es sind die kryoskopischen Konstante von Wasser und die Molmassen von darin löslichen Substanzen zu bestimmen.
 Versuchsanleitungen zum Praktikum Physikalische Chemie für nfänger 1 4 Kryoskopie ufgabe: Es sind die kryoskopischen Konstante von Wasser und die Molmassen von darin löslichen Substanzen zu bestimmen.
Versuchsanleitungen zum Praktikum Physikalische Chemie für nfänger 1 4 Kryoskopie ufgabe: Es sind die kryoskopischen Konstante von Wasser und die Molmassen von darin löslichen Substanzen zu bestimmen.
Während den Arbeiten dieses Abschnitts muss unbedingt die Schutzbrille getragen werden. In einem Erlenmeyer werden
 Synthese von Aspirin Reaktion Während den Arbeiten dieses Abschnitts muss unbedingt die Schutzbrille getragen werden. In einem Erlenmeyer werden 6 g Salicylsäure OH COOH 8 ml (8,6 g) Essigsäureanhydrid
Synthese von Aspirin Reaktion Während den Arbeiten dieses Abschnitts muss unbedingt die Schutzbrille getragen werden. In einem Erlenmeyer werden 6 g Salicylsäure OH COOH 8 ml (8,6 g) Essigsäureanhydrid
1 Die Serienschaltung von Widerständen
 1 Die Serienschaltung von Widerständen Wollen wir mehrere Verbraucher an dieselbe Spannungsquelle anschließen, dann haben wir dazu verschiedene Möglichkeiten. Wir können die Verbraucher in Serie, parallel
1 Die Serienschaltung von Widerständen Wollen wir mehrere Verbraucher an dieselbe Spannungsquelle anschließen, dann haben wir dazu verschiedene Möglichkeiten. Wir können die Verbraucher in Serie, parallel
Phasendiagramm. Praktikum I, Teil Werkstoffe HS 2008/09 Versuch 6; Verfasser: Philippe Knüsel
 Praktikum I, Teil Werkstoffe HS 2008/09 Versuch 6; 19.11.2008 Phasendiagramm Verfasser: Philippe Knüsel (pknuesel@student.ethz.ch) Versuchsdurchführung: Claudio Zihlmann und Philippe Knüsel Assistenz:
Praktikum I, Teil Werkstoffe HS 2008/09 Versuch 6; 19.11.2008 Phasendiagramm Verfasser: Philippe Knüsel (pknuesel@student.ethz.ch) Versuchsdurchführung: Claudio Zihlmann und Philippe Knüsel Assistenz:
Übung 4. SS 2013 Übung - Einführung in die Verbrennung - Methling, Özuylasi 1
 Ziel: Grundlagen der chemischen Reaktionskinetik verstehen Verstehen qualitativer Reaktionsverläufe Aufstellung des Zeitgesetzes Umgang mit nicht reagierenden Stoßpartner (M) Berechnung Geschwindigkeitskoeffizient
Ziel: Grundlagen der chemischen Reaktionskinetik verstehen Verstehen qualitativer Reaktionsverläufe Aufstellung des Zeitgesetzes Umgang mit nicht reagierenden Stoßpartner (M) Berechnung Geschwindigkeitskoeffizient
Anwendung der Kurvenuntersuchung in der Kostenrechnung eines Industriebetriebes
 Dipl.-Kaufm. Wolfgang Schmitt Aus meiner Skriptenreihe: " Keine Angst vor... " Anwendung der Kurvenuntersuchung in der Kostenrechnung eines Industriebetriebes http://www.nf-lernen.de 1 Inhalt Vorkenntnisse.......................
Dipl.-Kaufm. Wolfgang Schmitt Aus meiner Skriptenreihe: " Keine Angst vor... " Anwendung der Kurvenuntersuchung in der Kostenrechnung eines Industriebetriebes http://www.nf-lernen.de 1 Inhalt Vorkenntnisse.......................
Zustandsbeschreibungen
 Aggregatzustände fest Kristall, geordnet Modifikationen Fernordnung flüssig teilgeordnet Fluktuationen Nahordnung gasförmig regellose Bewegung Unabhängigkeit ngigkeit (ideales Gas) Zustandsbeschreibung
Aggregatzustände fest Kristall, geordnet Modifikationen Fernordnung flüssig teilgeordnet Fluktuationen Nahordnung gasförmig regellose Bewegung Unabhängigkeit ngigkeit (ideales Gas) Zustandsbeschreibung
Vakuum (VAK)
 Inhaltsverzeichnis TUM Anfängerpraktikum für Physiker Vakuum (VAK) 25.2.26. Einleitung...2 2. Ideale Gase...2 3. Verwendetes Material...2 4. Versuchsdurchführung...2 4.. Eichung der Pirani-Manometer...2
Inhaltsverzeichnis TUM Anfängerpraktikum für Physiker Vakuum (VAK) 25.2.26. Einleitung...2 2. Ideale Gase...2 3. Verwendetes Material...2 4. Versuchsdurchführung...2 4.. Eichung der Pirani-Manometer...2
Siedediagramm binärer Systeme
 Versuch Nr. 1 Siedediagramm binärer Systeme Praktikum der physikalischen Chemie der Universität Würzburg unter der Leitung von Dr. Roland Colditz im Zeitraum 01.03-21.03.10 Würzburg den 19.03.10 Gruppe:
Versuch Nr. 1 Siedediagramm binärer Systeme Praktikum der physikalischen Chemie der Universität Würzburg unter der Leitung von Dr. Roland Colditz im Zeitraum 01.03-21.03.10 Würzburg den 19.03.10 Gruppe:
Übungsaufgaben Physikalische Chemie
 Übungsaufgaben Physikalische Chemie A1. Welchen Druck übt gasförmiger Stickstoff mit einer Masse von 2,045 g bei 21 C in einem Gefäß mit einem Volumen von 2,00 l aus? A2. In Haushaltgeräten zur Erzeugung
Übungsaufgaben Physikalische Chemie A1. Welchen Druck übt gasförmiger Stickstoff mit einer Masse von 2,045 g bei 21 C in einem Gefäß mit einem Volumen von 2,00 l aus? A2. In Haushaltgeräten zur Erzeugung
Physik 4 Praktikum Auswertung Hall-Effekt
 Physik 4 Praktikum Auswertung Hall-Effekt Von J.W., I.G. 2014 Seite 1. Kurzfassung......... 2 2. Theorie.......... 2 2.1. Elektrischer Strom in Halbleitern..... 2 2.2. Hall-Effekt......... 3 3. Durchführung.........
Physik 4 Praktikum Auswertung Hall-Effekt Von J.W., I.G. 2014 Seite 1. Kurzfassung......... 2 2. Theorie.......... 2 2.1. Elektrischer Strom in Halbleitern..... 2 2.2. Hall-Effekt......... 3 3. Durchführung.........
Versuch: Zustandsdiagramm (Ethan)
 Physikpraktikum Versuch: Zustandsdiagramm (Ethan) Teilnehmer: Arthur Halama 858808 Cristoph Hansen 874837 Kurzfassung Der Versuch Zustandsdiagramm Ethan befasst sich der Untersuchung des Gases Ethan nahe
Physikpraktikum Versuch: Zustandsdiagramm (Ethan) Teilnehmer: Arthur Halama 858808 Cristoph Hansen 874837 Kurzfassung Der Versuch Zustandsdiagramm Ethan befasst sich der Untersuchung des Gases Ethan nahe
T7 Phasenumwandlungsenthalpie
 Christian Müller Jan Philipp Dietrich T7 Phasenumwandlungsenthalpie 1. Bestimmung der Kondensationsenthalpie und -entropie a) Versuchserläuterung b) Werte und Grafiken c) Berechnung der Kondensationsenthalpie
Christian Müller Jan Philipp Dietrich T7 Phasenumwandlungsenthalpie 1. Bestimmung der Kondensationsenthalpie und -entropie a) Versuchserläuterung b) Werte und Grafiken c) Berechnung der Kondensationsenthalpie
Molzahl: n = N/N A [n] = mol N ist die Anzahl der Atome oder Moleküle des Stoffes. Molmasse oder Molekularmasse: M [M ]= kg/kmol
![Molzahl: n = N/N A [n] = mol N ist die Anzahl der Atome oder Moleküle des Stoffes. Molmasse oder Molekularmasse: M [M ]= kg/kmol Molzahl: n = N/N A [n] = mol N ist die Anzahl der Atome oder Moleküle des Stoffes. Molmasse oder Molekularmasse: M [M ]= kg/kmol](/thumbs/50/26795947.jpg) 2. Zustandsgrößen 2.1 Die thermischen Zustandsgrößen 2.1.1. Masse und Molzahl Reine Stoffe: Ein Mol eines reinen Stoffes enthält N A = 6,02214. 10 23 Atome oder Moleküle, N A heißt Avogadro-Zahl. Molzahl:
2. Zustandsgrößen 2.1 Die thermischen Zustandsgrößen 2.1.1. Masse und Molzahl Reine Stoffe: Ein Mol eines reinen Stoffes enthält N A = 6,02214. 10 23 Atome oder Moleküle, N A heißt Avogadro-Zahl. Molzahl:
Protokoll Tag 4, Teil 1
 Protokoll Tag 4, Teil 1 D. Titrationsverfahren D.1. Einführung in die quantitative Analyse; D.2. Acidimetrie (Bestimmung der Konzentration einer Säure) Am heutigen letzten Tag des Praktikums geht es um
Protokoll Tag 4, Teil 1 D. Titrationsverfahren D.1. Einführung in die quantitative Analyse; D.2. Acidimetrie (Bestimmung der Konzentration einer Säure) Am heutigen letzten Tag des Praktikums geht es um
Physikalisches Grundpraktikum Technische Universität Chemnitz
 Physikalisches Grundpraktikum Technische Universität Chemnitz Protokoll «A1 - Messung der Lichtgeschwindigkeit» Martin Wolf Betreuer: Dr. Beddies Mitarbeiter: Martin Helfrich
Physikalisches Grundpraktikum Technische Universität Chemnitz Protokoll «A1 - Messung der Lichtgeschwindigkeit» Martin Wolf Betreuer: Dr. Beddies Mitarbeiter: Martin Helfrich
