Experiment Kristallzüchtung: Kupfer(II)sulfat-Pentahydrat
|
|
|
- Bettina Hausler
- vor 7 Jahren
- Abrufe
Transkript
1 Experiment Kristallzüchtung: Kupfer(II)sulfat-Pentahydrat 1 Einführung In der Natur gibt es für die Entstehung von Kristallen verschiedenste Möglichkeiten. Die meisten natürlichen Kristalle jedoch sind durch Kristallisation aus einer Schmelze (Magma) entstanden. In Abhängigkeit von der Abkühlgeschwindigkeit können dabei mikroskopisch kleine, wie z. B. in vulkanische Gesteinen, oder relativ große Kristalle entstehen, wie wir sie im Granit erkennen. Große Kristalle entstehen, wenn sie für das Wachstum viel Zeit zur Verfügung haben. Im Gegensatz zur Kristallisation aus einer Schmelze, ist die Kristallisation aus einer wässrigen Lösung (z. B. alpine Klüfte und Erzgänge) in der Natur vergleichbar selten. Da dies aber ein äußerst langsamer Vorgang ist, können dabei beeindruckend große und gut ausgebildete Kristalle wachsen. Außerdem eignet sich der Vorgang der Kristallisation aus einer wässrigen Lösung besonders für die Nachahmung, also für die Züchtung im Labor. Die Kristallisation aus der Gasphase ist eher unbedeutend. 2 Aufgabe Durch Kristallisation aus einer wässrigen Lösung sollen im Labor möglichst große, gut ausgebildete Kupfer(II)sulfat-Pentahydrat-Einkristalle gezüchtet werden (Abb. 1). 3 Kupfer(II)sulfat-Pentahydrat (Kupfervitriol) Kupfer(II)sulfat-Pentahydrat (CuSO 4 5H 2 O) bildet tiefblaue, trikline Kristalle, die beim Erhitzen das Kristallwasser abgeben und dann das farblose Kupfersulfat-Anhydrat bilden. Dieser Vorgang ist reversibel. Das Pentahydrat sollte eigentlich als [CuSO 4 (OH 2 ) 4 ] SO 4 H 2 O geschrieben werden, da im Kristall vier Wassermoleküle direkt an das Kupfer(II)-Ion koordiniert sind. Kupfersulfat ist in Wasser gut, in organischen Lösungsmitteln nicht löslich. 3.1 Vorkommen und Gewinnung In der Natur kommt Kupfersulfat als Verwitterungsprodukt sulfidischer Kupfererze als krustenförmige, körnige oder faserige Aggregate vor (Mineral Chalkanthit). Technisch wird Kupfersulfat durch Einwirkung von Schwefelsäure auf Kupferoxide oder Kupfersulfide gewonnen. Es ist das mit Abstand wichtigste Kupfersalz. 1
2 Institut für Geologie Abbildung 1: Ein Kupfer(II)sulfat-Pentahydrat-Einkristall, wie er nach 1 2 Wochen Wachstum gebildet wird. 3.2 Verwendung Kupfersulfat wird zur galvanischen Verkupferung, zur Herstellung von kupferhaltigen Farben und zur Kupferstichatzung verwendet. 3.3 Sicherheitshinweise Gefahrensymbol Xn: Gefahrensymbol N: Gefahrenhinweis R22: Gefahrenhinweis R36/38: Sicherheitsratschlage S22: Schweizer Giftklasse: Gesundheitsschadlich Umweltgefahrlich Gesundheitsschadlich beim Verschlucken Reizt die Atmungsorgane, Augen und Haut Staub nicht einatmen Entsorgung Salze sind in Klaranlagen nicht abbaubar, deshalb Kupfersulfat-Losung nicht in den Ausguss, sondern in eine Sammelstelle geben. 4 Prinzip der Ausfallung durch Ubers attigung Die Loslichkeit eines Stoffes gibt an, ob und in welchem Umfang ein Reinstoff in einem Losungs werden kann. Sie bezeichnet also die Eigenschaft eines Stoffes, sich unter molekularer mittel gelost Verteilung mit dem Losungsmittel homogen zu vermischen. Sulfate sind Salze und somit fast nur in polaren Losungsmitteln wie Wasser oder auch Fluorwasserstoff (HF) loslich. Die quantitative Loslichkeit gibt die Menge eines Stoffes an, welche, unter gegebenen Bedingungen (Temperatur und Druck), maximal in einer bestimmten Menge der Losung loslich ist. Bei Salzen Am Bn kann die Loslichkeit (L) aus dem Loslichkeitsprodukt (K L ) berechnet werden: 2
3 200 Kupfer(II)sulfat-Pentahydrat [g]/100 g dest. H 2 O übersättigt gesättigt untersättigt Temperatur [ C] Übersättigung durch Verdunsten Übersättigung durch Abkühlen Abbildung 2: Oft kann die Konstante K L experimentell ermittelt werden. Dieses Diagramm zeigt die Löslichkeitskurve von Kupfersulfat-5-Hydrat in Abhängigkeit von der Temperatur. In 100 g destilliertem Wasser lösen sich bei 20 C 37 g Kupfersulfat-5-Hydrat, bei 50 C sind es 64 g. K L = [A + ] m [B ] n L = [A+ ] m = [B ] n = n+m KL n n + m m [g/l Lösung] oder [g/100 g Lösung] In warmem Wasser ist also mehr Kupfersulfat löslich (CuSO 4 Cu 2+ + SO 2 4 ) als in kaltem Wasser. Die Löslichkeitskurve (Abb. 2) zeigt nun drei Fälle von Lösungsgleichgewichten: 1. Untersättigte Lösung, Konzentration < Löslichkeit 2. Gesättigte Lösung, Konzentration = Löslichkeit 3. Übersättigte Lösung, Konzentration > Löslichkeit Um eine Ausfällung zu erhalten, bedarf es somit einer übersättigten Lösung. Wie stellt man aber eine übersättigte Lösung her, wenn man nicht mehr Kupfersulfat in Lösung bringen kann? Eine Möglichkeit besteht darin, eine gesättigte Lösung eindunsten zu lassen, wodurch es zur Ausscheidung von Kristallen kommt. Eine weitere Möglichkeit ist es, eine warme, gesättigte Lösung herzustellen. Beim anschließenden Abkühlen der Lösung kommt es wegen plötzlicher Übersättigung ebenfalls zur Ausfällung. Ein in die übersättigte Lösung eingebrachter Kupfersulfat-Kristall 3
4 wächst so lange, bis die Lösung die Löslichkeitskurve erreicht, d. h. bis die Lösung gesättigt ist. Um einen großen Einkristall anstelle von vielen kleinen Kristallen zu züchten, benötigen wir also einen Ausgangskristall, einen so genannten Impfkristall, den wir in die Wachstumslösung hängen. Sind die Bedingungen ideal, lagern sich die Ionen schichtweise an den Keimling an. Diese Phase ist heikel, da bei der geringsten Störung (Eindringen von Staub oder Erschütterungen) spontane Ausfällungen passieren können und so die Bildung eines Einkristalls verhindert würde. Idealerweise soll sich das überschüssige Kupfersulfat langsam und gleichmäßig am Impfkristall abscheiden. Häufig findet man bereits in der Ausgangssubstanz geeignete (> 1 mm) Impfkristalle und kann sich den regelmäßigsten aussuchen. Ist dies nicht der Fall, kann man gesättigte Lösung in einer flachen Schale (Petrischale) eindunsten lassen oder eine warme Lösung abkühlen lassen und die erstgebildeten Kristalle aus der Lösung entfernen. 5 Zutaten 175 g Kupfer(II)sulfat-Pentahydrat CuSO 4 5H 2 O dest. Wasser Filterpapier flache Schale (Petrischale) Feinwaage Kunststoffpinzette Heizplatte Thermometer Becherglas oder Einmachglas (Glas oder Kunststoff) mit Abdeckung Gummihandschuhe Nylonfaden Holzstab Gaze evtl. Nagelfeile 6 Rezept 1. Schritt: Herstellen einer gesättigten Lösung Dazu lösen wir so viel Kupfer(II)sulfat-Pentahydrat in 50 ml destilliertem Wasser wie möglich (bis sich nichts mehr löst). Die Lösung wird mit einem Glas- oder Kunststoffstab gerührt. Für die Entnahme des Kupfer(II)sulfat-Pentahydrats aus dem Behälter sollte ein Kunststofflöffel verwendet werden. 4
5 2. Schritt: Filtrieren Zum Filtrieren wird ein Filter ins Stativ gespannt, Filterpapier eingelegt und mit destilliertem Wasser angefeuchtet. Das untere Ende des Filters sollte die Wand des Auffanggefäßes im obersten Teil berühren. Nun die Lösung nach und nach in den Filter gießen. Falls kein Stativ vorhanden ist, kann der Filter auch in einen Zylinder gegeben und dieser ins Becherglas gestellt werden. Für Versuche zu Hause können anstelle von Becherglas und Filter auch ein normales Einmachglas und ein Kaffeefilter verwendet werden. 3. Schritt: Verdampfen lassen Die Lösung wird in eine Petrischale (flache Schale) gefüllt und an einen Ort ohne Temperaturschwankungen (Keller) gestellt. Nun heißt es warten, bis genügend Wasser verdampft ist und sich möglichst große Kristalle am Boden der Schale abgeschieden haben. Um zu verhindern, dass Staub oder Sonstiges in die Lösung kommt, sollte man die Petrischale mit Gaze abdecken. Nur Geduld, es kann einige Tage dauern! Bei mir war nach vier Tagen alles Wasser verdunstet und es haben sich bis zu 2 cm lange, jedoch sehr dünne Kristalle gebildet. 4. Schritt: Impfkristall aussuchen und an Faden befestigen Mit einer Kunststoffpinzette wird der schönste, regelmäßigste Impfkristall heraus gesucht und vorsichtig vom Boden der Schale gelöst. Nun wird ein Ende des transparenten Nylonfadens mit einer Schlinge am Kristall befestigt, während das andere Ende um einen Holzstab gewickelt wird. Damit der Faden nicht abrutscht, können die Kanten des Kristalls mit einer Nagelfeile eingefurcht werden. Es ist darauf zu achten, dass wir weder Kristall, noch Faden mit unseren (fettigen) Fingern anfassen. Wichtig ist, die Länge des Fadens genau so zu wählen, dass der Impfkristall schließlich 2 3 cm über dem Boden des Becherglases hängt. Anstelle eines Nylonfadens kann ebenso gut ein Haar verwendet werden. 5. Schritt: Herstellen der Wachstumslösung 150 g destilliertes Wasser werden auf ca. 60 C erhitzt (Kontrolle Thermometer) und darin 75 g Kupfer(II)sulfat-Pentahydrat gelöst. Zum Rühren der Lösung ist idealerweise ein Magnetrührer zu verwenden. 6. Schritt: Filtrieren und Abkühlen der Wachstumslösung Die Wachstumslösung wird noch warm(!) filtriert (siehe Schritt 2) in ein geeignetes Becherglas gegeben. Nun sollte man die Lösung möglichst erschütterungsfrei abkühlen (2 3 Std.) lassen. Es ist ganz wichtig, dass das Becherglas reinlich sauber ist, deshalb mit Spülmittel und heißem Wasser auswaschen und trocknen lassen. 7. Schritt: Impfkristall hinein hängen und warten Der am Faden befestigte Impfkristall wird nun so in die Wachstumslösung gehängt, dass er möglichst frei (ohne die Gefäßwand zu berühren), 2 3 cm über dem Gefäßboden hängt. Mit Gaze abgedeckt soll man das Becherglas nun eine Zeit lang (3 4 Tage) stehen lassen. Die Lösung sollte öfters kontrolliert werden. Haben sich an Faden, Boden oder an der Oberfläche der Lösung zusätzliche Kristalle gebildet, muss sie noch einmal filtriert und der Faden mit dem Impfkristall warm abgespült werden. Ansonsten soll das Becherglas nicht berührt werden! 8. Schritt: Stoppen oder neue Wachstumslösung Je nach Bedarf ist der Kristall nun fertig oder kann weiter zum Züchten verwendet werden; 5
6 in diesem Fall nur mit Handschuhen und Pinzette anfassen. Für die neue Wachstumslösung werden 100 g Kupfersulfat in 200 g Wasser unter Erwärmen gelöst. Ansonsten bleibt das Vorgehen dasselbe. Ist der Kristall schön und groß genug, nimmt man ihn aus der Lösung und lässt ihn an der Luft trocknen. Ein guter Tipp ist es, den Kristall mit gewöhnlichem Haarlack zu besprühen, sodass er gegen Fingerabdrücke und Feuchtigkeit geschützt ist. 6
8. Löslichkeit verschiedener Salze bestimmen
 Praktikum Chemie N 8 Classe : Date de la remise : Note sur 10 : Nom(s) : 8. Löslichkeit verschiedener Salze bestimmen Video Löslichkeit Die Löslichkeit eines Stoffes gibt an, in welchem Umfang ein Reinstoff
Praktikum Chemie N 8 Classe : Date de la remise : Note sur 10 : Nom(s) : 8. Löslichkeit verschiedener Salze bestimmen Video Löslichkeit Die Löslichkeit eines Stoffes gibt an, in welchem Umfang ein Reinstoff
Lassen sich gelöste Salze wieder als Kristalle zurückgewinnen?
 Naturwissenschaften - Chemie - Allgemeine Chemie - 6 Teilchenmodell (P752000) 6.4 Kristallisation Experiment von: Phywe Gedruckt:.0.203 3:0:27 intertess (Version 3.06 B200, Export 2000) Aufgabe Aufgabe
Naturwissenschaften - Chemie - Allgemeine Chemie - 6 Teilchenmodell (P752000) 6.4 Kristallisation Experiment von: Phywe Gedruckt:.0.203 3:0:27 intertess (Version 3.06 B200, Export 2000) Aufgabe Aufgabe
Pyrophores Eisen. Experimentieranleitung für Schüler/-innen. September Stephan Knébel, Marianne Dietiker, Christoph Meili.
 Bildungsplattform zur Mikro- und Nanotechnologie für Berufsfach- und Mittelschulen sowie Höhere Fachschulen Pyrophores Eisen Experimentieranleitung für Schüler/-innen September 2014 Stephan Knébel, Marianne
Bildungsplattform zur Mikro- und Nanotechnologie für Berufsfach- und Mittelschulen sowie Höhere Fachschulen Pyrophores Eisen Experimentieranleitung für Schüler/-innen September 2014 Stephan Knébel, Marianne
Tatort Küche. Versuch 1: Rotkohl. Aufgabe: Geräte und Chemikalien: Versuchsdurchführung: Beobachtungen: Auswertung:
 Tatort Küche Aufgabe: Es muss anhand von chemischen Versuchen herausgefunden werden, welcher von drei sehr ähnlich aussehenden Feststoffen Zucker, welcher Kochsalz und welcher Zitronensäure ist. Das Kosten
Tatort Küche Aufgabe: Es muss anhand von chemischen Versuchen herausgefunden werden, welcher von drei sehr ähnlich aussehenden Feststoffen Zucker, welcher Kochsalz und welcher Zitronensäure ist. Das Kosten
Laborführerschein. Dieses Skript gehört:
 Laborführerschein Dieses Skript gehört: Laborführerschein Seite 2 Station 1: Laborgeräte, ein Muss für jeden Chemiker Welche Laborgeräte des Titelbildes findest Du in der Liste wieder? Suche an deinem
Laborführerschein Dieses Skript gehört: Laborführerschein Seite 2 Station 1: Laborgeräte, ein Muss für jeden Chemiker Welche Laborgeräte des Titelbildes findest Du in der Liste wieder? Suche an deinem
Versuch: In der Natur verschwindet nichts - Lösen und Auskristallisieren von Salz
 Name: Datum: Versuch: In der Natur verschwindet nichts - Lösen und Auskristallisieren von Salz Material: Kochsalz (NaCl), Leitungswasser, Mineralwasser, Becherglas, Spatel, destilliertes Wasser, Alu-Teelichtschalen,
Name: Datum: Versuch: In der Natur verschwindet nichts - Lösen und Auskristallisieren von Salz Material: Kochsalz (NaCl), Leitungswasser, Mineralwasser, Becherglas, Spatel, destilliertes Wasser, Alu-Teelichtschalen,
Synthese und Tribolumineszenz von Kupfer(I)-(bis(pyridyl)-triphenylphosphin)-thiocyanat
 Illumina-Chemie.de - Artikel Synthesen Synthese und Tribolumineszenz von Aus Kupfer(I)-thiocyanat, Triphenylphosphin und Pyridin lässt sich ein Komplex herstellen, der eine helle türkisblaue Tribolumineszenz
Illumina-Chemie.de - Artikel Synthesen Synthese und Tribolumineszenz von Aus Kupfer(I)-thiocyanat, Triphenylphosphin und Pyridin lässt sich ein Komplex herstellen, der eine helle türkisblaue Tribolumineszenz
In der Natur verschwindet nichts - Lösen und Auskristallisieren von Kochsalz
 Name: Datum: In der Natur verschwindet nichts - Lösen und Auskristallisieren von Kochsalz Geräte Becherglas, Spatel, Alu-Teelichtschale, Heizplatte, Pipette, Tiegelzange, Glasstab, Lupe Materialien Kochsalz
Name: Datum: In der Natur verschwindet nichts - Lösen und Auskristallisieren von Kochsalz Geräte Becherglas, Spatel, Alu-Teelichtschale, Heizplatte, Pipette, Tiegelzange, Glasstab, Lupe Materialien Kochsalz
3.7 Osmose - Chemischer Garten. Aufgabe. Wie lösen sich Salze in Wasserglas? Naturwissenschaften - Chemie - Säuren, Basen, Salze - 3 Salze
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - 3 Salze (P760000) 3.7 Osmose - Chemischer Garten Experiment von: Phywe Gedruckt: 5.0.203 2:25:55 intertess (Version 3.06 B200, Export 2000) Aufgabe
Naturwissenschaften - Chemie - Säuren, Basen, Salze - 3 Salze (P760000) 3.7 Osmose - Chemischer Garten Experiment von: Phywe Gedruckt: 5.0.203 2:25:55 intertess (Version 3.06 B200, Export 2000) Aufgabe
Laborbericht. Schwarz-Weiss-Photographie. Bianca Theus Anna Senn
 Laborbericht Schwarz-Weiss-Photographie Bianca Theus Anna Senn Dezember 004 Inhaltsverzeichnis 1. Ziel... 1. Einleitung... 1.1 Filmherstellung... 1. Reagenzien... 1.3 Belichtung....4 Entwicklung... 3.5
Laborbericht Schwarz-Weiss-Photographie Bianca Theus Anna Senn Dezember 004 Inhaltsverzeichnis 1. Ziel... 1. Einleitung... 1.1 Filmherstellung... 1. Reagenzien... 1.3 Belichtung....4 Entwicklung... 3.5
Echt ätzend! - Was ist und wie wirkt Abflussreiniger?
 Echt ätzend! - Was ist und wie wirkt Abflussreiniger? Versuch 1: Zusammensetzung von festem Abflussreiniger (Analyse nach Prof. Pick ): fester Abflussreiniger (z.b. Drano Rohrfrei) Petrischale, Holzstab
Echt ätzend! - Was ist und wie wirkt Abflussreiniger? Versuch 1: Zusammensetzung von festem Abflussreiniger (Analyse nach Prof. Pick ): fester Abflussreiniger (z.b. Drano Rohrfrei) Petrischale, Holzstab
Schulversuchspraktikum. Constanze Koch. Sommersemester Klassenstufen 5 & 6. Wasser als Lösungsmittel. Kurzprotokoll
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 5 & 6 Wasser als Lösungsmittel Kurzprotokoll Auf einen Blick: In diesem Protokoll werden ein Lehrerversuch und vier Schülerversuche
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 5 & 6 Wasser als Lösungsmittel Kurzprotokoll Auf einen Blick: In diesem Protokoll werden ein Lehrerversuch und vier Schülerversuche
Nährstoffe und Nahrungsmittel
 1 Weitere Lehrerversuche Schulversuchspraktikum Annika Nüsse Sommersemester 2016 Klassenstufen 5 & 6 Nährstoffe und Nahrungsmittel Kurzprotokoll 1 Weitere Lehrerversuche Auf einen Blick: Der Lehrerversuch
1 Weitere Lehrerversuche Schulversuchspraktikum Annika Nüsse Sommersemester 2016 Klassenstufen 5 & 6 Nährstoffe und Nahrungsmittel Kurzprotokoll 1 Weitere Lehrerversuche Auf einen Blick: Der Lehrerversuch
Bundesrealgymnasium Imst. Chemie 2010-11. Klasse 4. Einführung Stoffe
 Bundesrealgymnasium Imst Chemie 2010-11 Einführung Stoffe Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter
Bundesrealgymnasium Imst Chemie 2010-11 Einführung Stoffe Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter
Abhängigkeit der Reaktionsgeschwindigkeit (RG) von der Konzentration: Kalk (CaCO 3 ) + Salzsäure (HCl)
 Abhängigkeit der Reaktionsgeschwindigkeit Abhängigkeit der Reaktionsgeschwindigkeit (RG) von der Konzentration: Kalk (CaCO 3 ) + Salzsäure (HCl) Beim Lösen von Kalk in Salzsäure bildet sich ein gut wasserlösliches
Abhängigkeit der Reaktionsgeschwindigkeit Abhängigkeit der Reaktionsgeschwindigkeit (RG) von der Konzentration: Kalk (CaCO 3 ) + Salzsäure (HCl) Beim Lösen von Kalk in Salzsäure bildet sich ein gut wasserlösliches
Während den Arbeiten dieses Abschnitts muss unbedingt die Schutzbrille getragen werden. In einem Erlenmeyer werden
 Synthese von Aspirin Reaktion Während den Arbeiten dieses Abschnitts muss unbedingt die Schutzbrille getragen werden. In einem Erlenmeyer werden 6 g Salicylsäure OH COOH 8 ml (8,6 g) Essigsäureanhydrid
Synthese von Aspirin Reaktion Während den Arbeiten dieses Abschnitts muss unbedingt die Schutzbrille getragen werden. In einem Erlenmeyer werden 6 g Salicylsäure OH COOH 8 ml (8,6 g) Essigsäureanhydrid
2. Woche. Anorganische Analysenmethodik
 2. Woche Anorganische Analysenmethodik Die analytische Chemie befasst sich mit den Methoden zur Ermittlung der stofflichen Zusammensetzung. Durch eine qualitative Analyse wird festgestellt, welche Atome
2. Woche Anorganische Analysenmethodik Die analytische Chemie befasst sich mit den Methoden zur Ermittlung der stofflichen Zusammensetzung. Durch eine qualitative Analyse wird festgestellt, welche Atome
Schüler und Schülerinnen im Labor in Rechtenthal. 4 weiße Stoffe
 Schüler und Schülerinnen im Labor in Rechtenthal 4 weiße Stoffe Chemische Laborgeräte (www.seilnacht.com) Chemische Stoffe unterscheiden sich durch ihre Eigenschaften 4 weiße Stoffe: Von außen sind sie
Schüler und Schülerinnen im Labor in Rechtenthal 4 weiße Stoffe Chemische Laborgeräte (www.seilnacht.com) Chemische Stoffe unterscheiden sich durch ihre Eigenschaften 4 weiße Stoffe: Von außen sind sie
Honig: Naturkosmetik selbst gemacht
 Honig: Naturkosmetik selbst gemacht Honig ist nicht nur lecker, sondern wird schon seit langer Zeit für kosmetische und medizinische Zwecke genutzt, da er sowohl entzündungshemmend als auch unterstützend
Honig: Naturkosmetik selbst gemacht Honig ist nicht nur lecker, sondern wird schon seit langer Zeit für kosmetische und medizinische Zwecke genutzt, da er sowohl entzündungshemmend als auch unterstützend
CREME SCHNELLE TAGESCREME MIT ALOE VERA
 CREME SCHNELLE TAGESCREME MIT ALOE VERA 50 g Cremaba 3 Messlöffel Aloe Vera 10fach 5 ml Nachtkerzenöl 5-10 Tropfen Parfümöl nach Wunsch 15 Tropfen Paraben K Aloe Vera 10fach und Nachtkerzenöl vorsichtig
CREME SCHNELLE TAGESCREME MIT ALOE VERA 50 g Cremaba 3 Messlöffel Aloe Vera 10fach 5 ml Nachtkerzenöl 5-10 Tropfen Parfümöl nach Wunsch 15 Tropfen Paraben K Aloe Vera 10fach und Nachtkerzenöl vorsichtig
Trenne ein Gemisch aus Sand und Kochsalz sowie ein Gemisch aus Sand und Eisen.
 Naturwissenschaften - Chemie - Allgemeine Chemie - 3 Trennverfahren (P750900) 3.2 Gemischtrennungen - Filtrieren, Magnetscheidung Experiment von: Phywe Gedruckt:.0.203 2:53:30 intertess (Version 3.06 B200,
Naturwissenschaften - Chemie - Allgemeine Chemie - 3 Trennverfahren (P750900) 3.2 Gemischtrennungen - Filtrieren, Magnetscheidung Experiment von: Phywe Gedruckt:.0.203 2:53:30 intertess (Version 3.06 B200,
Experimente Lehrerinformation
 Lehrerinformation 1/7 Arbeitsauftrag Die SuS experimentieren mit Salz und lernen es von der chemischen Seite her besser kennen. Dabei lernen sie in Modellversuchen wichtige Merkmale von Salz kennen. Ziel
Lehrerinformation 1/7 Arbeitsauftrag Die SuS experimentieren mit Salz und lernen es von der chemischen Seite her besser kennen. Dabei lernen sie in Modellversuchen wichtige Merkmale von Salz kennen. Ziel
Welche Vorsichtsmaßnahmen sind beim Umgang mit Säuren zu beachten?
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - Säuren (P757000). Allgemeine Vorsichtsmaßnahmen beim Umgang mit Säuren Experiment von: Phywe Gedruckt: 5.0.203 0:55: intertess (Version 3.06 B200,
Naturwissenschaften - Chemie - Säuren, Basen, Salze - Säuren (P757000). Allgemeine Vorsichtsmaßnahmen beim Umgang mit Säuren Experiment von: Phywe Gedruckt: 5.0.203 0:55: intertess (Version 3.06 B200,
Auf welche Eigenschaften lassen sich Kunststoffe untersuchen? (2)
 Naturwissenschaften - Chemie - Polymerchemie - 3 Erste Identifizierung von Kunststoffen (P780500) 3.2 Kunststoffeigenschaften (2) - Ermittlung der Dichte von Kunststoffen Experiment von: Seb Gedruckt:
Naturwissenschaften - Chemie - Polymerchemie - 3 Erste Identifizierung von Kunststoffen (P780500) 3.2 Kunststoffeigenschaften (2) - Ermittlung der Dichte von Kunststoffen Experiment von: Seb Gedruckt:
Vorpraktikum Grundoperationen im chemischen Laboratorium
 Vorpraktikum Grundoperationen im chemischen Laboratorium Stand: 09. April 2018 Inhalt: Volumetrische Messgeräte Analysenwaagen Fest-Flüssig-Trennverfahren Flüssig-Flüssig-Trennverfahren Wasserlöslichkeit
Vorpraktikum Grundoperationen im chemischen Laboratorium Stand: 09. April 2018 Inhalt: Volumetrische Messgeräte Analysenwaagen Fest-Flüssig-Trennverfahren Flüssig-Flüssig-Trennverfahren Wasserlöslichkeit
Dauerdrucksystem (CISS) für CANON PIXMA IP6000. Installationsanleitung
 Dauerdrucksystem (CISS) für CANON PIXMA IP6000 Installationsanleitung Bitte nehmen Sie sich Zeit für die Installation des Dauerdrucksystems. Entfernen Sie Ihre alten Patronen nicht bevor das Dauerdrucksystem
Dauerdrucksystem (CISS) für CANON PIXMA IP6000 Installationsanleitung Bitte nehmen Sie sich Zeit für die Installation des Dauerdrucksystems. Entfernen Sie Ihre alten Patronen nicht bevor das Dauerdrucksystem
Nanocoating. NANO-4-SCHOOLS Martin Vonlanthen März 2005 / September 2007 1
 Nanocoating Brillenglas mit Antihaftbeschichtung auf Alkylsilanbasis. Wassertropfen perlen praktisch rückstandsfrei ab. Solche hydrophoben (wasserabweisenden) Beschichtungen werden auch in vielen anderen
Nanocoating Brillenglas mit Antihaftbeschichtung auf Alkylsilanbasis. Wassertropfen perlen praktisch rückstandsfrei ab. Solche hydrophoben (wasserabweisenden) Beschichtungen werden auch in vielen anderen
Merkmale chemischer Reaktionen
 Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 7 & 8 Merkmale chemischer Reaktionen Kurzprotokoll Auf einen Blick: Im Folgenden werden weitere Versuche zum Thema Merkmale einer
Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 7 & 8 Merkmale chemischer Reaktionen Kurzprotokoll Auf einen Blick: Im Folgenden werden weitere Versuche zum Thema Merkmale einer
Wasser-Woche in der Klasse 2a
 Wasser-Woche in der Klasse 2a Zu Beginn der Wasserwoche haben wir uns überlegt, was wir schon über Wasser wissen und was wir gerne noch wissen möchten. All das haben wir auf große blaue Papiertropfen geschrieben.
Wasser-Woche in der Klasse 2a Zu Beginn der Wasserwoche haben wir uns überlegt, was wir schon über Wasser wissen und was wir gerne noch wissen möchten. All das haben wir auf große blaue Papiertropfen geschrieben.
Chemie in der Grundschule
 Chemie in der Grundschule Ausgearbeitet vom Jungchemikerforum Regensburg für den Chemieunterricht in den Jahrgangsstufen eins bis vier. copyright 2004 Jungchemikerforum Regensburg Warum die Brause sprudelt
Chemie in der Grundschule Ausgearbeitet vom Jungchemikerforum Regensburg für den Chemieunterricht in den Jahrgangsstufen eins bis vier. copyright 2004 Jungchemikerforum Regensburg Warum die Brause sprudelt
Protokoll zur Herstellung von Essigsäureethylester
 Protokoll zur Herstellung von Essigsäureethylester 1) Ziel des Versuches: Herstellung von Essigsäureethylester unter säurekatalytischen Bedingungen. 2) Theoretischer Hintergrund: Ester sind eine Klasse
Protokoll zur Herstellung von Essigsäureethylester 1) Ziel des Versuches: Herstellung von Essigsäureethylester unter säurekatalytischen Bedingungen. 2) Theoretischer Hintergrund: Ester sind eine Klasse
Wie verändern sich die Eigenschaften der Alkohole bei Zunahme der Kohlenstoffzahl?
 Naturwissenschaften - Chemie - Organische Chemie - 4 Alkohole (P77200) 4.6 Eigenschaften der homologen Reihe Experiment von: Phywe Gedruckt: 20.07.206 3:58:38 intertess (Version 3.2 B24, Export 2000) Aufgabe
Naturwissenschaften - Chemie - Organische Chemie - 4 Alkohole (P77200) 4.6 Eigenschaften der homologen Reihe Experiment von: Phywe Gedruckt: 20.07.206 3:58:38 intertess (Version 3.2 B24, Export 2000) Aufgabe
Thermoplast oder Duroplast?
 Name: Datum: Thermoplast oder Duroplast? Geräte Heißluftgebläse oder Brenner, Tiegelzange, Keramiknetz Materialien verschiedene Kunststoffproben (Joghurtbecher, Einwegflasche, Wasserschlauch, Partybesteck,
Name: Datum: Thermoplast oder Duroplast? Geräte Heißluftgebläse oder Brenner, Tiegelzange, Keramiknetz Materialien verschiedene Kunststoffproben (Joghurtbecher, Einwegflasche, Wasserschlauch, Partybesteck,
Vorpraktikum Grundoperationen im chemischen Laboratorium
 Vorpraktikum Grundoperationen im chemischen Laboratorium Stand: 23. April 2019 Inhalt: Volumetrische Messgeräte Säure-Base-Titration Analysenwaagen Fest-Flüssig-Trennverfahren Wasserlöslichkeit Verdünnung
Vorpraktikum Grundoperationen im chemischen Laboratorium Stand: 23. April 2019 Inhalt: Volumetrische Messgeräte Säure-Base-Titration Analysenwaagen Fest-Flüssig-Trennverfahren Wasserlöslichkeit Verdünnung
3.6 Wirkungsweise eines Belüftungsbeckens (Kläranlage) Aufgabe. Warum wird Schmutzwasser in den Klärwerken belüftet?
 Naturwissenschaften - Chemie - Anorganische Chemie - 3 Wasser, Wasserbestandteile und Wasserreinigung (P755000) 3.6 Wirkungsweise eines Belüftungsbeckens (Kläranlage) Experiment von: Seb Gedruckt: 24.03.204
Naturwissenschaften - Chemie - Anorganische Chemie - 3 Wasser, Wasserbestandteile und Wasserreinigung (P755000) 3.6 Wirkungsweise eines Belüftungsbeckens (Kläranlage) Experiment von: Seb Gedruckt: 24.03.204
Versuch: Eis und Salz Was passiert dann?
 Name: Datum: Versuch: Was passiert dann? Geräte: 250 ml-becherglas, Teelöffel, Thermometer Materialien: Eis, Kochsalz Rühre mit dem Löffel, nicht mit dem Thermometer um! Lass das Thermometer nicht im Becherglas
Name: Datum: Versuch: Was passiert dann? Geräte: 250 ml-becherglas, Teelöffel, Thermometer Materialien: Eis, Kochsalz Rühre mit dem Löffel, nicht mit dem Thermometer um! Lass das Thermometer nicht im Becherglas
Zucker und seine Eigenschaften
 Anleitung LP Ziel: Die SuS entdecken selbstständig die Eigenschaften vom Zucker durch Handeln und Ausprobieren. Sie können die Experimente mit Hilfe der Anleitung selbstständig durchführen und die Ergebnisse
Anleitung LP Ziel: Die SuS entdecken selbstständig die Eigenschaften vom Zucker durch Handeln und Ausprobieren. Sie können die Experimente mit Hilfe der Anleitung selbstständig durchführen und die Ergebnisse
Umschmelzen und Tiefziehen von Polystyrol
 Umschmelzen und Tiefziehen von Heißluftgebläse, Keramiknetz, Tiegelzange, Saugflasche mit Gummiring, Glasfritte, Wasserstrahlpumpe, Stativ mit Muffe und Klammer Joghurtbecher aus (PS) Schutzbrille! Das
Umschmelzen und Tiefziehen von Heißluftgebläse, Keramiknetz, Tiegelzange, Saugflasche mit Gummiring, Glasfritte, Wasserstrahlpumpe, Stativ mit Muffe und Klammer Joghurtbecher aus (PS) Schutzbrille! Das
Schmelz- und Erstarrungskurve von watriumthiosulfat
 Lehrer-/Dozentenblatt Schmelz- und Erstarrungskurve von watriumthiosulfat (Artikelnr.: P044600) Curriculare Themenzuordnung Fachgebiet: Physik Bildungsstufe: Klasse 7-0 Lehrplanthema: Wärmelehre Unterthema:
Lehrer-/Dozentenblatt Schmelz- und Erstarrungskurve von watriumthiosulfat (Artikelnr.: P044600) Curriculare Themenzuordnung Fachgebiet: Physik Bildungsstufe: Klasse 7-0 Lehrplanthema: Wärmelehre Unterthema:
Brenner Streichhölzer Eis
 Versuch 1: Wir erhitzen Eis! Reagenzglas Reagenzglasklammer Reagenzglasständer Brenner Streichhölzer Eis Fülle soviel Eis in das Reagenzglas, dass es zu einem Drittel gefüllt ist. Damit Du Dir beim Erhitzen
Versuch 1: Wir erhitzen Eis! Reagenzglas Reagenzglasklammer Reagenzglasständer Brenner Streichhölzer Eis Fülle soviel Eis in das Reagenzglas, dass es zu einem Drittel gefüllt ist. Damit Du Dir beim Erhitzen
HTBL-PINKAFELD Arbeitsblatt A4/1 Wasser
 HTBL-PINKAFELD Arbeitsblatt A4/1 Wasser DIE ZERDRÜCKTE ALUDOSE LEERE Alu-Getränkedose (1/2 Liter!) Tiegelzange Schüssel mit kaltem Wasser 1. Fülle die leere Getränkedose mit wenig Wasser 2. Stelle die
HTBL-PINKAFELD Arbeitsblatt A4/1 Wasser DIE ZERDRÜCKTE ALUDOSE LEERE Alu-Getränkedose (1/2 Liter!) Tiegelzange Schüssel mit kaltem Wasser 1. Fülle die leere Getränkedose mit wenig Wasser 2. Stelle die
Wie wirkt sich die Zugabe von Salz auf den Schmelz- und Siedepunkt von Wasser aus?
 Naturwissenschaften - Chemie - Allgemeine Chemie - 7 Chemische Bindung (P752400) 7.4 Schmelzpunktserniedrigung und Siedepunktserhöhung Experiment von: Phywe Gedruckt:.0.203 3:5:43 intertess (Version 3.06
Naturwissenschaften - Chemie - Allgemeine Chemie - 7 Chemische Bindung (P752400) 7.4 Schmelzpunktserniedrigung und Siedepunktserhöhung Experiment von: Phywe Gedruckt:.0.203 3:5:43 intertess (Version 3.06
Alles was uns umgibt!
 Was ist Chemie? Womit befasst sich die Chemie? Die Chemie ist eine Naturwissenschaft, die sich mit der Materie (den Stoffen), ihren Eigenschaften und deren Umwandlung befasst Was ist Chemie? Was ist Materie?
Was ist Chemie? Womit befasst sich die Chemie? Die Chemie ist eine Naturwissenschaft, die sich mit der Materie (den Stoffen), ihren Eigenschaften und deren Umwandlung befasst Was ist Chemie? Was ist Materie?
Institut für Anorganische Chemie (Materialchemie)
 1. Gib auf das Blatt Papier 2 Teelöffel Sand, 2 Teelöffel Kochsalz und einige kleine Nägel. 2. Vermische die drei Stoffe gut miteinander. Du hast jetzt ein so genanntes Gemenge hergestellt. 3. Zur Abtrennung
1. Gib auf das Blatt Papier 2 Teelöffel Sand, 2 Teelöffel Kochsalz und einige kleine Nägel. 2. Vermische die drei Stoffe gut miteinander. Du hast jetzt ein so genanntes Gemenge hergestellt. 3. Zur Abtrennung
Einstieg: Schmelzpunkte
 Aufgabe Nomenklatur 1. Welche Verhältnisformeln ergeben sich für folgende Salze: Lithiumoxid, Natriumsulfid, Bariumsulfid, Magnesiumchlorid, Calciumfluorid? 2. Benenne folgende Salze und ermittle die enthaltenen
Aufgabe Nomenklatur 1. Welche Verhältnisformeln ergeben sich für folgende Salze: Lithiumoxid, Natriumsulfid, Bariumsulfid, Magnesiumchlorid, Calciumfluorid? 2. Benenne folgende Salze und ermittle die enthaltenen
1. Schneide den Rotkohl und die Paprikaschote in kleine Stückchen.
 Name: Datum: Materialien: Speiseöl, frische rote, frischer, weitere Obst- und Gemüsesorten und Säfte, Messer, Schneidebrettchen, Spritzflasche mit destilliertem Wasser, vier kleine Glasgefäße mit Deckel
Name: Datum: Materialien: Speiseöl, frische rote, frischer, weitere Obst- und Gemüsesorten und Säfte, Messer, Schneidebrettchen, Spritzflasche mit destilliertem Wasser, vier kleine Glasgefäße mit Deckel
Kaliumdioxalatocuprat(II)- dihydrat
 Kaliumdioxalatocuprat(II)- dihydrat K[Cu(C4)]H Zürich, 17. November 004 Raphael Aardoom, ACP 300 o C 00 50 150 50 ml 100 A N AUS AN AUS 1000 50 ml 0 U/min 1500 50 750 500 1 Synthese 1.1 Methode [1] Kupfer(II)sulfat-pentahydrat
Kaliumdioxalatocuprat(II)- dihydrat K[Cu(C4)]H Zürich, 17. November 004 Raphael Aardoom, ACP 300 o C 00 50 150 50 ml 100 A N AUS AN AUS 1000 50 ml 0 U/min 1500 50 750 500 1 Synthese 1.1 Methode [1] Kupfer(II)sulfat-pentahydrat
*** Wo haben sich die Farben versteckt? ***
 *** Wo haben sich die Farben versteckt? *** 1. Das Experiment mit den schwarzen Filzstiften Möchtest du mal deine Freunde, Geschwister und Eltern mit einem tollen Experiment überraschen? Dann greif dir
*** Wo haben sich die Farben versteckt? *** 1. Das Experiment mit den schwarzen Filzstiften Möchtest du mal deine Freunde, Geschwister und Eltern mit einem tollen Experiment überraschen? Dann greif dir
Zusammenstellung möglicher Aufgaben einer Lernerfolgskontrolle gegen Ende des Schuljahres der 9. Klassenstufe im Fach Physik
 Friedrich-Engels-Gymnasium Fachbereich PHYSIK Zusammenstellung möglicher Aufgaben einer Lernerfolgskontrolle gegen Ende des Schuljahres der 9. Klassenstufe im Fach Physik P1 Wege des Stroms 1. Stelle in
Friedrich-Engels-Gymnasium Fachbereich PHYSIK Zusammenstellung möglicher Aufgaben einer Lernerfolgskontrolle gegen Ende des Schuljahres der 9. Klassenstufe im Fach Physik P1 Wege des Stroms 1. Stelle in
Mischen und. Trennen. Forschertagebuch von
 Mischen und Trennen Forschertagebuch von Forscherauftrag 1 Ein Stück Zucker geht baden > 2 Gläser > zwei Zuckerwürfel > warmes und kaltes Wasser > ein Thermometer > Traubenzucker 1. Fülle beide Gläser
Mischen und Trennen Forschertagebuch von Forscherauftrag 1 Ein Stück Zucker geht baden > 2 Gläser > zwei Zuckerwürfel > warmes und kaltes Wasser > ein Thermometer > Traubenzucker 1. Fülle beide Gläser
Junior-Laborführerschein für die Orientierungsstufe
 Junior-Laborführerschein für die Orientierungsstufe Dieses Skript gehört: Laborführerschein Seite 2 Station 1: Laborgeräte, ein Muss für jeden Chemiker Welche Laborgeräte des Titelbildes findest Du in
Junior-Laborführerschein für die Orientierungsstufe Dieses Skript gehört: Laborführerschein Seite 2 Station 1: Laborgeräte, ein Muss für jeden Chemiker Welche Laborgeräte des Titelbildes findest Du in
Synthese von 3-Aminophthalsäurehydrazid
 Illumina-Chemie.de - Artikel Synthesen Synthese von 3-Aminophthalsäurehydrazid Hier wird eine zweistufige Synthese von Luminol beschrieben. Luminol findet insbesondere für Chemilumineszenz Verwendung,
Illumina-Chemie.de - Artikel Synthesen Synthese von 3-Aminophthalsäurehydrazid Hier wird eine zweistufige Synthese von Luminol beschrieben. Luminol findet insbesondere für Chemilumineszenz Verwendung,
Nachweis von Nährstoffen
 Chemie - Lernstationen Nachweis von Nährstoffen 1. Lernstationen einrichten G Pult mit Lösungen Parkplatz G - tellt die Tische wie in der Abbildung. - Legt die Anleitung für euren ersten Nachweis auf den
Chemie - Lernstationen Nachweis von Nährstoffen 1. Lernstationen einrichten G Pult mit Lösungen Parkplatz G - tellt die Tische wie in der Abbildung. - Legt die Anleitung für euren ersten Nachweis auf den
Schmelzpunktserniedrigung und Siedepunktserhöhung
 Lehrer-/Dozentenblatt Schmelzpunktserniedrigung und Siedepunktserhöhung Aufgabe und Material Lehrerinformationen Lernziele Lösungen haben einen höheren Siedepunkt und einen niedrigeren Schmelzpunkt als
Lehrer-/Dozentenblatt Schmelzpunktserniedrigung und Siedepunktserhöhung Aufgabe und Material Lehrerinformationen Lernziele Lösungen haben einen höheren Siedepunkt und einen niedrigeren Schmelzpunkt als
HERSTELLUNG WARMGERÜHRTE CREME
 DIE HERSTELLUNG EINER WARMGERÜHRTEN CREME Die Herstellung einer Creme erfolgt bei der warmgerührten Variante so gut wie immer auf dieselbe Weise. Damit wir Ihnen eine größere Auswahl an Rezepten zur Verfügung
DIE HERSTELLUNG EINER WARMGERÜHRTEN CREME Die Herstellung einer Creme erfolgt bei der warmgerührten Variante so gut wie immer auf dieselbe Weise. Damit wir Ihnen eine größere Auswahl an Rezepten zur Verfügung
Laborführerschein. Dieses Skript gehört:
 Laborführerschein Dieses Skript gehört: Laborführerschein Seite 2 Station 1: Laborgeräte, ein Muss für jeden Chemiker Welche Laborgeräte des Titelbildes findest Du in der Liste wieder? Suche an deinem
Laborführerschein Dieses Skript gehört: Laborführerschein Seite 2 Station 1: Laborgeräte, ein Muss für jeden Chemiker Welche Laborgeräte des Titelbildes findest Du in der Liste wieder? Suche an deinem
3. STOFFE MISCHEN UND TRENNEN
 CHEMIE / 4.0S Seite - 3.1-3. STOFFE MISCHEN UND TRENNEN 3.1. Herstellung von Gemischen: Die genaue Mischung von Farben, Kosmetika, Reinigungsmitteln u.s.w. sind wohlgehütete Betriebsgeheimnisse der Herstellerfirmen.
CHEMIE / 4.0S Seite - 3.1-3. STOFFE MISCHEN UND TRENNEN 3.1. Herstellung von Gemischen: Die genaue Mischung von Farben, Kosmetika, Reinigungsmitteln u.s.w. sind wohlgehütete Betriebsgeheimnisse der Herstellerfirmen.
Recherche zum Produkt:
 Am Anfang meiner Versuche musste ich mich für ein mittel (Lebensmittel, Genussmittel oder Arzneimittel) entscheiden. In meinem Fall war es das Arzneimittel Mexalen. Recherche zum Produkt: Name: Herstellerfirma:
Am Anfang meiner Versuche musste ich mich für ein mittel (Lebensmittel, Genussmittel oder Arzneimittel) entscheiden. In meinem Fall war es das Arzneimittel Mexalen. Recherche zum Produkt: Name: Herstellerfirma:
Versuch: Reaktion von Magnesium ( ) und Iod ( )
 Name: Datum: Station 1 Versuch: Reaktion von Magnesium ( ) und Iod ( ) Gib zunächst den Bildern mit Nummern eine sinnvolle Reihenfolge und formuliere anschließend eine Durchführung. 1 Führe den Versuch
Name: Datum: Station 1 Versuch: Reaktion von Magnesium ( ) und Iod ( ) Gib zunächst den Bildern mit Nummern eine sinnvolle Reihenfolge und formuliere anschließend eine Durchführung. 1 Führe den Versuch
Ligandenaustausch am Chrom(III)-ion. Gefährdungsbeurteilung. Lehrerexperiment. Schülerexperiment
 Ligandenaustausch am Chrom(III)-ion keine! Chrom(III)-chlorid-Lösung (0,1 mol/l) R-Sätze: 22 S-Sätze: 24-25 Ammoniak-Lösung (20%ig) Eine Chrom(III)-chloridlösung wird im Reagenzglas tropfenweise bis zur
Ligandenaustausch am Chrom(III)-ion keine! Chrom(III)-chlorid-Lösung (0,1 mol/l) R-Sätze: 22 S-Sätze: 24-25 Ammoniak-Lösung (20%ig) Eine Chrom(III)-chloridlösung wird im Reagenzglas tropfenweise bis zur
Inline-Prozessanalyse mit Schallgeschwindigkeit
 Inline-Prozessanalyse mit Schallgeschwindigkeit Dr.-Ing. Ingo Benecke Dipl.-Ing. Stefan Nitschke SensoTech GmbH Steinfeldstr. 1 39179 Magdeburg-Barleben info@sensotech.com www.sensotech.com Die Verwendung
Inline-Prozessanalyse mit Schallgeschwindigkeit Dr.-Ing. Ingo Benecke Dipl.-Ing. Stefan Nitschke SensoTech GmbH Steinfeldstr. 1 39179 Magdeburg-Barleben info@sensotech.com www.sensotech.com Die Verwendung
Chloro(triphenylphosphin)gold(I)
 raktikum Org. und Anorg. Chemie II D-CHAB Wintersemester 04/05 Zürich, den 1. März 2005 [(h 3 )] 1 1. SYNTHESE 1.1 Methode [1] Elementares Gold wird mit Königswasser aufgeschlossen und durch Zugabe von
raktikum Org. und Anorg. Chemie II D-CHAB Wintersemester 04/05 Zürich, den 1. März 2005 [(h 3 )] 1 1. SYNTHESE 1.1 Methode [1] Elementares Gold wird mit Königswasser aufgeschlossen und durch Zugabe von
Erwärmen von Gemischen
 Bei diesen Versuchen wird das Verhalten von Gemischen beim Erwärmen untersucht. Prüfe, ob sich dieses Verfahren zur Rückgewinnung der Reinstoffe eignet! Versuch 1: Erwärmen von Rotwein Vorüberlegungen
Bei diesen Versuchen wird das Verhalten von Gemischen beim Erwärmen untersucht. Prüfe, ob sich dieses Verfahren zur Rückgewinnung der Reinstoffe eignet! Versuch 1: Erwärmen von Rotwein Vorüberlegungen
Kunststoffe im Alltag Unsere ständigen Begleiter.
 Kunststoffe im Alltag Unsere ständigen Begleiter. Name: Datum: Ablauf des Projekttages I. Herstellung von Kunststoffen. V01. Nylonfaden. V02. Biologisch abbaubare Kunststoff. II. Alltägliche Gegenstände
Kunststoffe im Alltag Unsere ständigen Begleiter. Name: Datum: Ablauf des Projekttages I. Herstellung von Kunststoffen. V01. Nylonfaden. V02. Biologisch abbaubare Kunststoff. II. Alltägliche Gegenstände
mischbar Lösung Feststoffen
 Kristalle züchten Mischen und Lösen - Nicht alle Stoffe sind miteinander mischbar. --> Hexan (Bestandteil von Benzin) und Wasser --> Hast du Beispiele aus dem Alltag? - Kann man die Stoffe nach dem Mischen
Kristalle züchten Mischen und Lösen - Nicht alle Stoffe sind miteinander mischbar. --> Hexan (Bestandteil von Benzin) und Wasser --> Hast du Beispiele aus dem Alltag? - Kann man die Stoffe nach dem Mischen
Was verändert das Wetter? Arbeitsblatt
 Lehrerinformation 1/5 Arbeitsauftrag Die SuS erfahren, was die Wettersituation verändern kann, und lernen den Klimabegriff kennen. Sie lösen einen Lückentext, lesen einen Text zum Thema Klima und lernen
Lehrerinformation 1/5 Arbeitsauftrag Die SuS erfahren, was die Wettersituation verändern kann, und lernen den Klimabegriff kennen. Sie lösen einen Lückentext, lesen einen Text zum Thema Klima und lernen
Die kleine Salzwerkstatt. Arbeitsblätter zum Lesen und Lernen
 Die kleine Salzwerkstatt Arbeitsblätter zum Lesen und Lernen Das schwe bende Ei Salz ist überall in der Natur zu finden. Man lässt sich von den Meereswellen schaukeln und liest dabei Comics, und dass ohne
Die kleine Salzwerkstatt Arbeitsblätter zum Lesen und Lernen Das schwe bende Ei Salz ist überall in der Natur zu finden. Man lässt sich von den Meereswellen schaukeln und liest dabei Comics, und dass ohne
Vorversuche: Wärmestrahlung
 Warum friert ein Eisbär nicht? Wäre schwarzen Eisbären wärmer? Die vielen Tricks der Eisbären! Vorversuche: Wärmestrahlung Versuch 1: Durchlässigkeit, Reflexion und Absorption von Stoffen Lege zwei Bücherstapel
Warum friert ein Eisbär nicht? Wäre schwarzen Eisbären wärmer? Die vielen Tricks der Eisbären! Vorversuche: Wärmestrahlung Versuch 1: Durchlässigkeit, Reflexion und Absorption von Stoffen Lege zwei Bücherstapel
Kohlenhydrate in Lebensmitteln Schokolade ist nicht gleich Schokolade!
 Kohlenhydrate in Lebensmitteln ist nicht gleich! Einführung Sicher hast du schon davon gehört, dass es verschiedene Zuckerarten gibt. So gibt es Traubenzucker (Glucose), Fruchtzucker (Fructose) und natürlich
Kohlenhydrate in Lebensmitteln ist nicht gleich! Einführung Sicher hast du schon davon gehört, dass es verschiedene Zuckerarten gibt. So gibt es Traubenzucker (Glucose), Fruchtzucker (Fructose) und natürlich
Versuch: Kohlenhydrate in Lebensmitteln Nachweis von Zucker
 Name: Datum: Versuch: Kohlenhydrate in Lebensmitteln Nachweis von Zucker Geräte Heizplatte, Bechergläser, Reagenzgläser, Reagenzglasständer, Spatel, Faltenfilter, Trichter Materialien Lebensmittel: Glucose,
Name: Datum: Versuch: Kohlenhydrate in Lebensmitteln Nachweis von Zucker Geräte Heizplatte, Bechergläser, Reagenzgläser, Reagenzglasständer, Spatel, Faltenfilter, Trichter Materialien Lebensmittel: Glucose,
Praxisteil Woche 25. Übungen und Tipps zur visuellen Strategie. Ort des Visualisierens
 Praxisteil Woche 25 Übungen und Tipps zur visuellen Strategie Ort des Visualisierens Am besten ist es, wenn ihr Wörter oder Inhalte, die eure SchülerInnen visualisieren sollen links oben auf die Tafel
Praxisteil Woche 25 Übungen und Tipps zur visuellen Strategie Ort des Visualisierens Am besten ist es, wenn ihr Wörter oder Inhalte, die eure SchülerInnen visualisieren sollen links oben auf die Tafel
Dem Täter auf der Spur
 Dem Täter auf der Spur Seite 1 Dem Täter auf der Spur (Ein Projekt der TU Braunschweig, Prof. Dr. P. Mischnick) Heute sollt Ihr verschiedene chemische Methoden kennenlernen, mit denen z.b. die Polizei
Dem Täter auf der Spur Seite 1 Dem Täter auf der Spur (Ein Projekt der TU Braunschweig, Prof. Dr. P. Mischnick) Heute sollt Ihr verschiedene chemische Methoden kennenlernen, mit denen z.b. die Polizei
1.5 X - Y ungelöst? Welcher Stoff wird hier gesucht?
 1.5 X - Y ungelöst? Welcher Stoff wird hier gesucht? X ist gelb und fest, nicht in Wasser löslich. Beim Verbrennen bildet X ein giftiges stechend riechendes Gas. In der Natur kommt X rein oder als vulkanische
1.5 X - Y ungelöst? Welcher Stoff wird hier gesucht? X ist gelb und fest, nicht in Wasser löslich. Beim Verbrennen bildet X ein giftiges stechend riechendes Gas. In der Natur kommt X rein oder als vulkanische
Was macht die Chemie??? Um die Eigenschaften von Stoffen zu untersuchen, müssen diese als reine Stoffe vorliegen.
 Was macht die Chemie??? Um die Eigenschaften von Stoffen zu untersuchen, müssen diese als reine Stoffe vorliegen. Salatsosse Ein Gemisch Ich stelle eine Salatsosse her und mische dazu: -Wasser -Essig -Öl
Was macht die Chemie??? Um die Eigenschaften von Stoffen zu untersuchen, müssen diese als reine Stoffe vorliegen. Salatsosse Ein Gemisch Ich stelle eine Salatsosse her und mische dazu: -Wasser -Essig -Öl
Elektrochemie und Sauerstoffmessung mit LDO. Der gelöste Sauerstoff
 Elektrochemie und Sauerstoffmessung mit LDO Der gelöste Sauerstoff 2 Was ist gelöster Sauerstoff? Gelöster Sauerstoff beschreibt die Konzentration von freiem (nicht chemisch gebundenem) molekularem Sauerstoff
Elektrochemie und Sauerstoffmessung mit LDO Der gelöste Sauerstoff 2 Was ist gelöster Sauerstoff? Gelöster Sauerstoff beschreibt die Konzentration von freiem (nicht chemisch gebundenem) molekularem Sauerstoff
Endotherm und Exotherm
 Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 7 & 8 Endotherm und Exotherm Kurzprotokoll Auf einen Blick: Das Protokoll enthält für die Klassen 7 und 8 einen Lehrerversuch und einen
Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 7 & 8 Endotherm und Exotherm Kurzprotokoll Auf einen Blick: Das Protokoll enthält für die Klassen 7 und 8 einen Lehrerversuch und einen
2 Eulersche Polyederformel und reguläre Polyeder
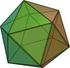 6 2 Eulersche Polyederformel und reguläre Polyeder 2.1 Eulersche Polyederformel Formal besteht ein Graph aus einer Knotenmenge X und einer Kantenmenge U. Jede Kante u U ist eine zweielementige Teilmenge
6 2 Eulersche Polyederformel und reguläre Polyeder 2.1 Eulersche Polyederformel Formal besteht ein Graph aus einer Knotenmenge X und einer Kantenmenge U. Jede Kante u U ist eine zweielementige Teilmenge
Die Wirkung von Wärme und Kälte auf Stoffe oder Alles nur heiße Luft?
 Kurzinformation Lehrkräfte (Sachanalyse) Die Wirkung oder Sachanalyse Naturwissenschaftlich betrachtet ist alles, was eine beobachtbare Masse besitzt, ein Stoff. Alle Körper/Gegenstände bestehen demnach
Kurzinformation Lehrkräfte (Sachanalyse) Die Wirkung oder Sachanalyse Naturwissenschaftlich betrachtet ist alles, was eine beobachtbare Masse besitzt, ein Stoff. Alle Körper/Gegenstände bestehen demnach
Aufgabe: Unterscheidung von Stoffen anhand von Eigenschaften
 Aufgabe: Unterscheidung von Stoffen anhand von Eigenschaften Vorbereitungen: Benötigte Materialien sind entsprechend der Anzahl an Gruppen für die Teams bereitzustellen. -Aufgabenstellung und Hinweise
Aufgabe: Unterscheidung von Stoffen anhand von Eigenschaften Vorbereitungen: Benötigte Materialien sind entsprechend der Anzahl an Gruppen für die Teams bereitzustellen. -Aufgabenstellung und Hinweise
Schulversuchspraktikum. Dennis Roggenkämper. Sommersemester Klassenstufen 9 & 10. Energiespeicherung. Kurzprotokoll
 Schulversuchspraktikum Dennis Roggenkämper Sommersemester 2015 Klassenstufen 9 & 10 Energiespeicherung Kurzprotokoll Auf einen Blick: Das Kurzprotokoll umfasst drei Lehrer- und zwei Schülerexperimente,
Schulversuchspraktikum Dennis Roggenkämper Sommersemester 2015 Klassenstufen 9 & 10 Energiespeicherung Kurzprotokoll Auf einen Blick: Das Kurzprotokoll umfasst drei Lehrer- und zwei Schülerexperimente,
Stoffe & ihre Eigenschaften
 Stoffe & ihre Eigenschaften Seite 1 Stoffe & ihre Eigenschaften Ein Chemiker befasst sich mit den unterschiedlichsten Stoffen und Substanzen. Er versucht herauszufinden, aus was sie bestehen, wie sie sich
Stoffe & ihre Eigenschaften Seite 1 Stoffe & ihre Eigenschaften Ein Chemiker befasst sich mit den unterschiedlichsten Stoffen und Substanzen. Er versucht herauszufinden, aus was sie bestehen, wie sie sich
Alltagschemie im Mittelalter - Farbe
 Alltagschemie im Mittelalter - Farbe E1 Färben mit Indigo E2 Färben mit Krapp E3 Tusche der Römer (Rußtinte) E4 Eisengallus-Tinte E5 Malfarben aus Quark E1 Färben mit Indigo Heiße Flüssigkeiten! Ätzende
Alltagschemie im Mittelalter - Farbe E1 Färben mit Indigo E2 Färben mit Krapp E3 Tusche der Römer (Rußtinte) E4 Eisengallus-Tinte E5 Malfarben aus Quark E1 Färben mit Indigo Heiße Flüssigkeiten! Ätzende
1. Unterrichtsstunde. Thema:
 1. Unterrichtsstunde Thema: Erarbeitung des Begriffs der Extraktion anhand eines Experiments zur Teeextraktion, und in arbeitsteiliger Gruppenarbeit mit Hilfe von unterschiedlichen Texten, Erarbeitung
1. Unterrichtsstunde Thema: Erarbeitung des Begriffs der Extraktion anhand eines Experiments zur Teeextraktion, und in arbeitsteiliger Gruppenarbeit mit Hilfe von unterschiedlichen Texten, Erarbeitung
Von welchen Faktoren hängt die Löslichkeit eines Stoffes in Wasser ab?
 Naturwissenschaften - Chemie - Anorganische Chemie - 3 Wasser, Wasserbestandteile und Wasserreinigung (P754900) 3.5 Löslichkeit von Salzen in Wasser - Vergleich mit der Löslichkeit von Gasen in Wasser
Naturwissenschaften - Chemie - Anorganische Chemie - 3 Wasser, Wasserbestandteile und Wasserreinigung (P754900) 3.5 Löslichkeit von Salzen in Wasser - Vergleich mit der Löslichkeit von Gasen in Wasser
Lösungen zum 6. Übungsblatt
 Lösungen zum 6. Übungsblatt vom 18.05.2016 6.1 Widerstandsschaltung (6 Punkte) Aus vier Widerständen R 1 = 20 Ω, R 2 = 0 Ω und R = R 4 wird die Schaltung aus Abbildung 1 aufgebaut. An die Schaltung wird
Lösungen zum 6. Übungsblatt vom 18.05.2016 6.1 Widerstandsschaltung (6 Punkte) Aus vier Widerständen R 1 = 20 Ω, R 2 = 0 Ω und R = R 4 wird die Schaltung aus Abbildung 1 aufgebaut. An die Schaltung wird
Anionen-Nachweis durch Fällungsreaktionen
 Lehrer-/Dozentenblatt Anionen-Nachweis durch Fällungsreaktionen (Artikelnr.: P7511300) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Allgemeine Chemie- Einführung
Lehrer-/Dozentenblatt Anionen-Nachweis durch Fällungsreaktionen (Artikelnr.: P7511300) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Allgemeine Chemie- Einführung
Darstellung und Charakterisierung zweier Modifikationen von (CuI) 2 (µ 2-2-Ethylpyrazin-N,N )
 Versuch F3 Darstellung und Charakterisierung zweier Modifikationen von (CuI) 2 (µ 2-2-Ethylpyrazin-N,N ) Einführung Der Begriff Polymorphie bezeichnet die Eigenschaft chemischer Verbindung in mehreren
Versuch F3 Darstellung und Charakterisierung zweier Modifikationen von (CuI) 2 (µ 2-2-Ethylpyrazin-N,N ) Einführung Der Begriff Polymorphie bezeichnet die Eigenschaft chemischer Verbindung in mehreren
Schulversuchspraktikum. Carl Föst. Sommersemester Klassenstufen 5 & 6. Einfache Messgeräte
 Schulversuchspraktikum Carl Föst Sommersemester 2015 Klassenstufen 5 & 6 Einfache Messgeräte 1 1 Auf einen Blick: In dieser Versuchsreihe geht es um den Bau von Messinstrumenten für Temperatur, Luftfeuchtigkeit
Schulversuchspraktikum Carl Föst Sommersemester 2015 Klassenstufen 5 & 6 Einfache Messgeräte 1 1 Auf einen Blick: In dieser Versuchsreihe geht es um den Bau von Messinstrumenten für Temperatur, Luftfeuchtigkeit
Schwierigkeitsgrad Vorbereitungszeit Durchführungszeit Empfohlene Gruppengröße. {time:2} 20 Minuten. Versuchsvarianten:
 Lehrer-/Dozentenblatt Gedruckt: 2.8.27 6::24 P753 Siedetemperatur Lehrerinformationen Einführung Schwierigkeitsgrad Vorbereitungszeit Durchführungszeit Empfohlene Gruppengröße {complexity:3} mittel {time:}
Lehrer-/Dozentenblatt Gedruckt: 2.8.27 6::24 P753 Siedetemperatur Lehrerinformationen Einführung Schwierigkeitsgrad Vorbereitungszeit Durchführungszeit Empfohlene Gruppengröße {complexity:3} mittel {time:}
Herstellung und Eigenschaften von Natronlauge
 Lehrer-/Dozentenblatt Herstellung und Eigenschaften von Natronlauge (Artikelnr.: P759000) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-0 Lehrplanthema: Anorganische Chemie Unterthema:
Lehrer-/Dozentenblatt Herstellung und Eigenschaften von Natronlauge (Artikelnr.: P759000) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-0 Lehrplanthema: Anorganische Chemie Unterthema:
Kartuschen einsetzen. Die erste Kartusche einsetzen
 18 Kartuschen einsetzen Feuchtigkeit spendende NIVEA FOR MEN Rasieremulsion ist in Packungen mit 5 Kartuschen und einer kleinen Kunststoffpumpe erhältlich. Werfen Sie die Pumpe nicht weg. Die Pumpe wird
18 Kartuschen einsetzen Feuchtigkeit spendende NIVEA FOR MEN Rasieremulsion ist in Packungen mit 5 Kartuschen und einer kleinen Kunststoffpumpe erhältlich. Werfen Sie die Pumpe nicht weg. Die Pumpe wird
Milchaufschäumer. Gebrauchsanleitung und Rezepte. Tchibo GmbH D-22290 Hamburg 75078AS4X4IVNP 2014-02
 Milchaufschäumer de Gebrauchsanleitung und Rezepte Tchibo GmbH D-22290 Hamburg 75078AS4X4IVNP 2014-02 Liebe Kundin, lieber Kunde! Mit Ihrem neuen Milchaufschäumer schäumen Sie schnell und einfach kalte
Milchaufschäumer de Gebrauchsanleitung und Rezepte Tchibo GmbH D-22290 Hamburg 75078AS4X4IVNP 2014-02 Liebe Kundin, lieber Kunde! Mit Ihrem neuen Milchaufschäumer schäumen Sie schnell und einfach kalte
7.9. Experimente zur Gewinnung und Anwendung von Pflanzenfarbstoffen. AGENS Arbeitsgemeinschaft NaturStoffe Leipzig
 7.9. Experimente zur Gewinnung und Anwendung von Geräte und Materialien: 1 Raspel, 1 Esslöffel, Stoff- und Papierproben Materialien die nicht im Experimentiersatz enthalten sind: Möhren Wasser Arbeitsschritte:
7.9. Experimente zur Gewinnung und Anwendung von Geräte und Materialien: 1 Raspel, 1 Esslöffel, Stoff- und Papierproben Materialien die nicht im Experimentiersatz enthalten sind: Möhren Wasser Arbeitsschritte:
Nachweis von Eisen-Ionen mit Kaliumthiocyanat
 Name: Datum: Nachweis von Eisen- mit Kaliumthiocyanat Geräte 3 Bechergläser (100 ml), 4 Reagenzgläser, Reagenzglasständer, kleiner Trichter, Faltenfilter, Spatel Materialien Eisennagel, Muscheln (braun
Name: Datum: Nachweis von Eisen- mit Kaliumthiocyanat Geräte 3 Bechergläser (100 ml), 4 Reagenzgläser, Reagenzglasständer, kleiner Trichter, Faltenfilter, Spatel Materialien Eisennagel, Muscheln (braun
Schriftliche Abschlussprüfung Chemie
 Sächsisches Staatsministerium für Kultus Schuljahr 2001/2002 Geltungsbereich: für Klassen 10 an - Mittelschulen - Förderschulen - Abendmittelschulen Schriftliche Abschlussprüfung Chemie Realschulabschluss
Sächsisches Staatsministerium für Kultus Schuljahr 2001/2002 Geltungsbereich: für Klassen 10 an - Mittelschulen - Förderschulen - Abendmittelschulen Schriftliche Abschlussprüfung Chemie Realschulabschluss
Schreiben Sie unbedingt auf, was Ihre Unbekannte bedeutet! Seien Sie dabei so präzis wie möglich, geben Sie die Einheiten für die Unbekannte an.
 10 10.1 Einleitung zum Thema Feststellung Viele Lernenden haben Probleme beim Lösen von. Die Erfahrung zeigt, dass oft falsch angepackt werden. Wird das Problem unsystematisch angepackt, so erscheint der
10 10.1 Einleitung zum Thema Feststellung Viele Lernenden haben Probleme beim Lösen von. Die Erfahrung zeigt, dass oft falsch angepackt werden. Wird das Problem unsystematisch angepackt, so erscheint der
Saure, neutrale und alkalische Lösungen
 Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen Kurzprotokoll Auf einen Blick: Das Protokoll enthält für die Klassen 5 und 6 einen Lehrerversuch
Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen Kurzprotokoll Auf einen Blick: Das Protokoll enthält für die Klassen 5 und 6 einen Lehrerversuch
Was macht ein Chemiker
 Was macht ein Chemiker Ein Chemiker befasst sich mit den unterschiedlichsten Stoffen und en. Er versucht herauszufinden, aus was sie bestehen, wie sie sich verhalten, wenn man sie zum Beispiel heiß oder
Was macht ein Chemiker Ein Chemiker befasst sich mit den unterschiedlichsten Stoffen und en. Er versucht herauszufinden, aus was sie bestehen, wie sie sich verhalten, wenn man sie zum Beispiel heiß oder
