Der Joule-Thomson-Effekt
|
|
|
- Peter Biermann
- vor 7 Jahren
- Abrufe
Transkript
1 Joule-homson-Effekt Der Joule-homson-Effekt In diesem ersuh werden die Joule-homson-Koeffizienten von vershiedenen Gasen (e, CO, N ) bestimmt, indem die emeraturänderung der Gase infolge einer Drukänderung untersuht wird. Außerdem wird aus den van-der-waals-parametern ein theoretisher Joule- homson-koeffizient bestimmt. tihworte Ideale Gase, Reale Gase, innere Energie, Arbeit, isoenthalish, adiabatish, Zustandsgleihung, Joule-homson-Koeffizient, van-der-waals-gleihung, irialgleihung, Lennard- Jones-Potential, Linde-erfahren heorie Das ideale Gas Gase werden als ideal bezeihnet, wenn für sie zum Einen das Gesetz von Boyle-Mariotte gilt, f() () wie in Abb. veranshauliht, und zum Anderen ihre innere Energie U unabhängig vom olumen ist. Kombiniert man beide Bedingungen, so folgt, dass die innere Energie auh unabhängig vom Druk ist und nur von der emeratur abhängt: U g() () Betrahtet man nun die Definitionsgleihung der Enthalie, so ergibt sih, dass diese ebenfalls eine Funktion der emeratur ist: U + h() (3) Für eine definierte Menge eines idealen Gases gilt dann für jede emeratur, dass die Ableitungen der inneren Energie und der emeratur nah Druk und olumen vershwinden: U U 0 (4) Aaratives Praktikum Physikalishe Chemie, Dr. Christof Maul 009 U Braunshweig, Institut für Physikalishe und heoretishe Chemie
2 Joule-homson-Effekt Druk 00 K 00 K 300 K 400 K hoh niedrig molares olumen m Abb. : -Diagramm eines idealen Gases Das reale Gas - Joule-homson-Koeffizient Für reale Gase gelten die Aussagen des vorangegangenen Abshnitts niht. Um deren Eigenshaften zu untersuhen, stelle man sih eine Aaratur wie in Abbildung vor. Die Aaratur ist dabei so isoliert, dass sie adiabatish arbeitet, also δq 0 ist. Nun stellt man einen konstanten Gasstrom ein, der von der ohdrukseite durh eine Drossel zur Niederdrukseite führt. Nah einer gewissen Zeit befindet sih das ystem im thermishen Gleihgewiht. Dann hat das Gas auf der ohdrukseite den Druk und die emeratur bzw. auf der Niederdrukseite den Druk und die emeratur. Betrahtet man eine definierte Menge des Gases (z.b. mol), so wird es auf der ohdrukseite das olumen und auf der Niederdrukseite das olumen einnehmen. Dabei beträgt die innere Energie dieser Gasmenge zunähst U und ändert sih nah dem Durhströmen der Drossel auf U. tellt man sih das nahströmende Gas als Kolben vor, so kann man die Arbeit w berehnen, die an dem ystem auf der linken eite geleistet wird. Das olumen ändert sih von auf 0. Es gilt: w - (0- ) (5) Betrahtet man in analoger Weise das Umgebungsgas auf der Niederdrukseite als Kolben, so berehnet sih die geleistete Arbeit wie folgt, da sih das olumen von 0 auf ändert. w - ( -0) - (6) Aaratives Praktikum Physikalishe Chemie, Dr. Christof Maul 009 U Braunshweig, Institut für Physikalishe und heoretishe Chemie
3 Joule-homson-Effekt 3 Drossel,,,, Kolben Abb. : shematishe Darstellung des Joule-homson-ersuhs Die insgesamt an dem ystem verrihtete Arbeit ergibt sih dann zu: w w + w - (7) Die Änderung der inneren Energie ΔU ist die umme aus der am ystem geleisteten Arbeit w ges und der Wärmemenge q, welhe in das ystem hinein geflossen ist. Da das ystem adiabatish arbeitet und somit q 0 ist, ergibt sih: ΔU U U q + w w (8) Formt man Gleihung 8 um, so erhält man die folgende Beziehung: U + U + (9) Dies ist gleihbedeutend mit der Aussage, dass der Prozess isoenthalish abläuft, da U + ist. Die Aussage ist gleihbedeutend damit, das das totale Differential von vershwindet: d 0. Betrahtet man infinitesimale Änderungen von emeratur und Druk, so ergibt sih für d: d d + d (0) Aaratives Praktikum Physikalishe Chemie, Dr. Christof Maul 009 U Braunshweig, Institut für Physikalishe und heoretishe Chemie
4 Joule-homson-Effekt 4 Da der Prozess isoenthalish abläuft, also d 0 ist, lässt sih Gl. 0 wie folgt umshreiben: ( / ) ( / ) μ J () Der Quotient μ J wird als Joule-homson-Koeffizient bezeihnet. Es ist leiht ersihtlih, dass dieser Koeffizient für ideale Gase Null ist, da für diese der Zähler vershwindet (s. Gl. 4). ingegen ist für reale Gase der Joule-homson-Koeffizient von Null vershieden und kann ositive sowie negative Werte annehmen. Dabei bedeutet ein ositives orzeihen, dass bei negativem Δ auh Δ negativ sein muss, sih das Gas also beim Ausdehnen abkühlt. Anshaulih ist der Joule-homson-Koeffizient ein Maß dafür, wie viel otentielle Energie in kinetishe Energie umgewandelt wird (oder umgekehrt), wenn sih die Dihte des Gases ändert und sih somit auh der mittlere, intermolekulare Abstand ändert. ehnish wird der Joule-homson-Effekt im Linde-erfahren genutzt, in welhem Luft verflüssigt wird. Bestimmt man den Joule-homson-Koeffizient über einen ausgedehnten Drukbereih, so erkennt man, dass dieser nahezu konstant ist. Dieser exerimentelle Befund lässt sih auh theoretish bestätigen. Betrahtet man hierzu Gleihung genauer, so stellt man fest, dass der Nenner der Wärmekaazität bei konstantem Druk, also, entsriht. Benutzt man außerdem die allgemein gültige thermodynamishe Beziehung + () und kombiniert diese mit Gleihung, so ergibt sih für den Joule-homson-Koeffizienten: ( / ) μ J (3) Zustandsgleihungen realer Gase Für die weitere Bearbeitung benötigt man einen Ausdruk, der das erhalten realer Gase beshreibt. Die allgemeinste Form zur Beshreibung ist die irialgleihung. In ihr wird das Produkt m als Funktion steigender Potenzen von dargestellt. siehe Anhang Aaratives Praktikum Physikalishe Chemie, Dr. Christof Maul 009 U Braunshweig, Institut für Physikalishe und heoretishe Chemie
5 Joule-homson-Effekt 5 m R + B() + C() +... (4) Die Parameter B, C,... werden als irialkoeffizienten bezeihnet. ie sind abhängig von der emeratur und der hemishen Natur des Gases. m steht in der Gleihung für das molare olumen. Beshränkt man sih auf einen Drukbereih von bis zu 0 bar, so kann die Potenzreihe bereits nah dem zweiten Glied (Näherung. Ordnung) abgebrohen werden. Die sih ergebende Gleihung zeigt eine gute Übereinstimmung mit den exerimentellen Werten und wird häufig in der folgenden Form geshrieben: R m + B( ) (5) Diese verkürzte irialgleihung kann in Gleihung 3 eingesetzt werden. Wird die Ableitung gebildet, so ergibt sih für den Joule-homson-Koeffizienten die Beziehung: ( B ) B μ J (6),m Es stellt sih nun das Problem, einen Ausdruk für den Parameter B zu finden. ierzu betrahtet man eine andere Zustandsgleihung, nämlih die van-der-waals-gleihung (das - Diagramm ist in Abbildung 3 zu sehen). a + ( m b) R (7) m Zunähst wird m ausgeklammert. a b + R m (8) m m Beshränkt man sih nun auf kleine Drüke (also große molare olumina), so erkennt man, dass die Ausdrüke a/( m ) und b/ m klein gegenüber sind. omit kann die für x << geltende Beziehung x ( + x) - angewendet werden und man erhält: m a b R m + (9) m Aaratives Praktikum Physikalishe Chemie, Dr. Christof Maul 009 U Braunshweig, Institut für Physikalishe und heoretishe Chemie
6 Joule-homson-Effekt 6 a und b werden als van-der-waals-parameter bezeihnet und sind stoffabhängige Konstanten. Multiliziert man die beiden Klammerterme aus, so gelangt man zu einer Gleihung, die irialform aufweist und analog Gleihung 4 aufgebaut ist. Gleihung 9 ist jedoh im Gegensatz zu Gleihung 4 in Potenzen von / m entwikelt. b a ab m R 3 + (0) m m m [MPa] , 0, 0,3 0,4 0,5 v [dm 3 mol - ] 73 K 304 K 353 K Abb. 3: -Diagramm nah van der Waals für CO Der erm in dem das Produkt a b auftritt ist sehr klein, da zum Einen a und b klein sind und zum Anderen m groß ist. Außerdem kann näherungsweise m durh R in den Korrekturgliedern ersetzt werden. m a b R m R + () Ausmultilizieren und erneutes ubstituieren von m durh R ergibt: Aaratives Praktikum Physikalishe Chemie, Dr. Christof Maul 009 U Braunshweig, Institut für Physikalishe und heoretishe Chemie
7 Joule-homson-Effekt 7 m a R + b () R Ein ergleih mit der verkürzten irialgleihung (5) zeigt, dass der irialkoeffizient B in dieser Näherung identish ist mit a B b (3) R etzt man Gleihung 3 in Gleihung 6 ein und bestimmt die Ableitung, so lässt sih der Joule-homson-Koeffizient aus den van-der-waals-parametern berehnen. [ ( b a )] b + a ( a ) b + a ( a ) R b μ R R R R J (4),m Die Konstante B lässt sih aber niht nur aus der van-der-waals-gleihung ableiten, sondern auh aus der statistishen hermodynamik. ie steht in direkter Beziehung zu einer intermolekularen Potentialfunktion. B() ist dabei wie folgt definiert: ( ) u( r) k N 0 e πr d r 0 B (5),m,m 4 3 ot. Energie [kjmol - ] Abstand r [m] Abb. 4: Lennard-Jones-Potenzial für Ar-Ar Aaratives Praktikum Physikalishe Chemie, Dr. Christof Maul 009 U Braunshweig, Institut für Physikalishe und heoretishe Chemie
8 Joule-homson-Effekt 8 In dieser Gleihung ist u(r) die otentielle Energie als Funktion des Abstandes zwishen zwei eilhen. Dabei nimmt man an, dass das Potential kugelsymmetrish ist. Ein Beisiel für eine solhe Potentialfunktion ist das Lennard-Jones-Potential (s. Abb. 4). 6 σ σ u () r 4ε (6) r r Dabei ist ε gleihbedeutend mit der Potentialtiefe, und σ entsriht dem Abstand zwishen den beiden Molekülen, bei dem die otentielle Energie den Wert Null annimmt. ersuhsaufbau Manometer Auslassventil hermoelement Fritte Gaseinlass Gasauslass Abb. 5: Der exerimentelle Aufbau Der Aufbau entsriht dem in Abbildung 5 gezeigten. Die ganze Aaratur besteht aus Kunststoff und ist von einer Isolation umgeben, um adiabatishe Bedingungen zu gewährleisten. Die emeraturdifferenz, die zwishen der ohdruk- und der Niederdrukseite des ystems besteht, wird mit ilfe von zwei in Reihe geshalteten hermoelementen bestimmt, die an ein sehr genaues oltmeter (Auflösung µ) angeshlossen sind. Auf der ohdrukseite sind noh ein Manometer zur Drukbestimmung und ein entil zum ülen der Aaratur angebraht. Über einen ierwegehahn wird das zu messende Gas (CO, N oder e) ge- Aaratives Praktikum Physikalishe Chemie, Dr. Christof Maul 009 U Braunshweig, Institut für Physikalishe und heoretishe Chemie
9 Joule-homson-Effekt 9 wählt. Der Eingangsdruk des Gases wird direkt an der Gasflashe geregelt. Die Zuleitung zu der Messaaratur führt durh ein Wasserbad, welhes das Gas auf die gewünshte Eingangstemeratur bringt. Dies ist nötig, da shon im Regelventil der Gasflashe ein merkliher emeraturgradient durh den Joule-homson-Effekt auftritt. ersuhsdurhführung Zu Beginn des ersuhstages wird das Wasserbad in Betrieb genommen und eine emeratur von 5 C eingestellt. Da zu diesem Zeitunkt noh keine emeraturdifferenz in der Aaratur auftreten sollte, wird nun die Offset-annung der hermoelemente bestimmt. Bevor der Gasstrom eingeshaltet wird, ist darauf zu ahten, dass das Auslassventil an der Messaaratur geshlossen ist. Dann wird mittels des ierwegehahns das Messgas gewählt und die entsrehende Gasflashe geöffnet. Mit ilfe des Regelventils an der Gasflashe wird ein Druk von a. bar eingestellt. Nun wird das Auslassventil geöffnet und die Aaratur für a. 30 s mit dem Gas gesült. Danah wird das Auslassventil wieder geshlossen. Jetzt wird die annung zwishen den beiden hermoelementen bestimmt. Ist eine konstante annung erreiht (tyisher Weise dauert dies einige Minuten), so wird dieser Wert notiert und der Gasdruk kann erniedrigt werden. Nun wird erneut solange gewartet, bis ein konstanter annungswert erreiht wird, dieser wird notiert und die Prozedur beginnt vom Neuen. Im Falle von CO steigert man den Druk in Intervallen von 0,5 bar und endet bei 5 bar Überdruk gegenüber der Umgebung. Bei N und e hingegen erhöht man den Druk in Intervallen von a. bar und endet bei 0 bar Überdruk. Ist ein Gas über den gesamten zu untersuhenden Drukbereih vermessen worden, wird zunähst das entil an der Gasflashe geshlossen und dann mit dem ierwegehahn das Gas gewehselt. Bevor nun die nähste Messreihe gestartet werden kann, muss zunähst abgewartet werden, bis sih die Offset-annung zwishen den hermoelementen wieder eingestellt hat. Dies dauert tyisherweise a. eine halbe tunde. Planen ie für die Meßause das ersuhskolloquium und die Mittagsause ein! Dann muß die Aaratur zunähst mit dem neuen Gas wie oben beshrieben gesült werden. Zum Abshluss aller Messungen ist darauf zu ahten, dass sämtlihe entile geshlossen und das Wasserbad sowie das oltmeter ausgeshaltet sind. Aaratives Praktikum Physikalishe Chemie, Dr. Christof Maul 009 U Braunshweig, Institut für Physikalishe und heoretishe Chemie
10 Joule-homson-Effekt 0 Auswertung und Aufgabenstellung Für jedes der drei vermessenen Gase soll ein Grah erstellt werden, in dem Δ (zu berehnen aus den annungswerten) gegen Δ aufgetragen wird. Die Emfindlihkeit der verwendeten hermoelemente beträgt 39 µ/k. Mittels einer linearen Regression ist die teigung und deren tandardabweihung zu bestimmen. Aus den teigungen wiederum sind die Joule- homson-koeffizienten für die drei Gase zu errehnen (Einheit: K Pa - ). Aus den van-der-waals-konstanten a und b, sowie der molaren Wärmekaazität,m ist der theoretishe Joule-homson-Koeffizient bei 98 K zu berehnen. Die hierzu nötigen Literaturwerte finden sih z.b. in den Referenzen oder 6. Aaratives Praktikum Physikalishe Chemie, Dr. Christof Maul 009 U Braunshweig, Institut für Physikalishe und heoretishe Chemie
11 Joule-homson-Effekt Anhang In diesem Abshnitt wird die erleitung der in Gleihung angegebenen Beziehung dargestellt. ierzu betrahtet man die Clausiusshe Definition der Entroie. δq rev d (7) Da die Entroie eine Zustandsfunktion 3 ist, muss sie sih als totales Differential darstellen lassen. Man kann z.b. die Abhängigkeit von und betrahten. d d + d (8) Nah dem ersten autsatz der hermodynamik lässt sih die reversibel mit der Umgebung ausgetaushte Wärmemenge durh die innere Energie und die olumenarbeit ausdrüken. δq rev du + d (9) Nun bildet man das totale Differential der Enthalie, die auh eine Zustandsfunktion ist. d du + d + d (30) Werden die beiden letzten Gleihungen in Gleihung 7 eingesetzt, so ergibt sih: d d d (3) Nun lässt sih das totale Differential der Entroie aus Gleihung 8 wie folgt umshreiben: d d + d d (3) Der erste Differentialquotient aus Gleihung 3 entsriht der Wärmekaazität bei konstantem Druk, deshalb vereinfaht sih die Gleihung zu: d d + d (33) An dieser telle sei erwähnt, dass dies eine thermodynamishe Definition ist. Es gibt auh eine statistishe Definition, die auf Ludwig Boltzmann zurükgeht: k lnw. 3 Ist eine thermodynamishe Größe eine Zustandsfunktion, so bedeutet dies, dass ihr Wert nur vom augenbliklihen Zustand des ystems abhängt und niht vom Weg wie dieser erreiht wurde. Mathematish wird das am Beisiel der Entroie wie folgt ausgedrükt: d 0 Aaratives Praktikum Physikalishe Chemie, Dr. Christof Maul 009 U Braunshweig, Institut für Physikalishe und heoretishe Chemie
12 Joule-homson-Effekt Aaratives Praktikum Physikalishe Chemie, Dr. Christof Maul 009 U Braunshweig, Institut für Physikalishe und heoretishe Chemie Diese Gleihung lässt sih noh wesentlih vereinfahen, wenn man in Betraht zieht, dass die vor d und d stehenden Faktoren artielle Differentialquotienten sind und somit, nah nohmaligem ableiten den atz von hwarz 4 erfüllen müssen. ierzu vergleiht man zunähst Gleihung 33 mit Gleihung 8. Dadurh ergeben sih die folgenden Beziehungen: (34) (35) Werden die entsrehenden Ableitungen gebildet, so ergibt sih: (36) (37) Durh Gleihsetzen erhält man: (38) Das jeweils erste Glied auf der linken sowie auf der rehten eite der Gleihung ist nah dem atz von hwarz identish 5, so dass sih durh einfahes Umformen ein Ausdruk für die artielle Ableitung der Enthalie nah dem Druk bei konstanter emeratur ergibt. + ε (39) Diese artielle Ableitung wird auh als isothermer Drosseleffekt ε bezeihnet und ist die Größe, welhe im heorieteil substituiert wurde. 4 Der atz von hwarz am Beisiel Entroie: 5
Messung der Adiabatenkoeffizienten nach CLEMENT-DESORMES
 VESUCH 1 ADIABATENKOEFFIZIENT Thema Messung der Adiabatenkoeffizienten nah CLEMENT-DESOMES Grundlagen ideale und reale Gase (Gasgesetze, Van-der-Waals Gleihung, Koolu- men, Van-der-Waals Shleifen, Maxwell-Konstruktion,
VESUCH 1 ADIABATENKOEFFIZIENT Thema Messung der Adiabatenkoeffizienten nah CLEMENT-DESOMES Grundlagen ideale und reale Gase (Gasgesetze, Van-der-Waals Gleihung, Koolu- men, Van-der-Waals Shleifen, Maxwell-Konstruktion,
ADIABATENKOEFFIZIENT. Messung der Adiabatenkoeffizienten nach CLEMENT-DESORMES VERSUCH 1. Grundlagen. Literatur. Theorie und Methode
 VESUCH 1 ADIABATENKOEFFIZIENT Thema Messung der Adiabatenkoeffizienten nah CLEMENT-DESOMES Grundlagen ideales und reales Gasgesetz 1. Hauptsatz der Thermodynamik Zustandsgleihungen, Guggenheim-Shema isohore,
VESUCH 1 ADIABATENKOEFFIZIENT Thema Messung der Adiabatenkoeffizienten nah CLEMENT-DESOMES Grundlagen ideales und reales Gasgesetz 1. Hauptsatz der Thermodynamik Zustandsgleihungen, Guggenheim-Shema isohore,
Magdalena Boeddinghaus Gruppe Nr.: 09 Dennis Fischer Datum: Versuch 2: Bestimmung von Verbrennungswärmen
 ersuh : Bestimmung von erbrennungswärmen 1. Ziel des ersuhes: Ziel des ersuhes ist es, mit Hilfe eines Bombenkalorimeters die erbrennungswärme von Saharose zu bestimmen. Dazu wird zuerst die Wärmekaazität
ersuh : Bestimmung von erbrennungswärmen 1. Ziel des ersuhes: Ziel des ersuhes ist es, mit Hilfe eines Bombenkalorimeters die erbrennungswärme von Saharose zu bestimmen. Dazu wird zuerst die Wärmekaazität
SPEZIFISCHE WÄRME 1. Versuchsplatz Komponenten: 2. Allgemeines zum Versuch Wärmekapazität spezifische Wärmekapazität molare Wärmekapazität
 U lausthal Institut für Physikalishe hemie Praktikum eil A und B 03. SPEZIFISHE WÄRME Stand 09//0 SPEZIFISHE WÄRME. ersuhslatz Komonenten: - Aufheizofen - rennstelltrafo - Kalorimeter - hermometer - Probekörer.
U lausthal Institut für Physikalishe hemie Praktikum eil A und B 03. SPEZIFISHE WÄRME Stand 09//0 SPEZIFISHE WÄRME. ersuhslatz Komonenten: - Aufheizofen - rennstelltrafo - Kalorimeter - hermometer - Probekörer.
SPEZIFISCHE WÄRME. lim. lim. 1. Versuchsplatz. 2. Allgemeines zum Versuch
 lausthal Institut für Physikalishe hemie Grundraktikum 3. SPEZIFISHE WÄRME Stand 03//006 SPEZIFISHE WÄRME. ersuhslatz Komonenten: - Aufheizofen - rennstelltrafo - Kalorimeter - hermometer - Probekörer.
lausthal Institut für Physikalishe hemie Grundraktikum 3. SPEZIFISHE WÄRME Stand 03//006 SPEZIFISHE WÄRME. ersuhslatz Komonenten: - Aufheizofen - rennstelltrafo - Kalorimeter - hermometer - Probekörer.
Besprechung der thermodynamischen Grundlagen von Wärmekraftmaschinen und Wärmepumpen
 3.5 Zustandsänderung nderung von Gasen Ziel: Besrehung der thermodynamishen Grundlagen von Wärmekraftmashinen und Wärmeumen Zustand von Gasen wird durh Druk, olumen, und emeratur beshrieben thermodyn.
3.5 Zustandsänderung nderung von Gasen Ziel: Besrehung der thermodynamishen Grundlagen von Wärmekraftmashinen und Wärmeumen Zustand von Gasen wird durh Druk, olumen, und emeratur beshrieben thermodyn.
4. Freie Energie/Enthalpie & Gibbs Gleichungen
 4. Freie Energie/Enthalie & Gibbs Gleichungen 4.3. Gibbs sche Gleichungen Fundamentalgleichungen der D weitere Fundamentalgleichungen basierend auf: einsetzen von (): d d d Ausdifferenzierung der Definition
4. Freie Energie/Enthalie & Gibbs Gleichungen 4.3. Gibbs sche Gleichungen Fundamentalgleichungen der D weitere Fundamentalgleichungen basierend auf: einsetzen von (): d d d Ausdifferenzierung der Definition
Übungen zur Ingenieur-Mathematik III WS 2011/12 Blatt Aufgabe 45: Gesucht ist die Schnittmenge der beiden Zylinder
 Übungen ur Ingenieur-Mathematik III WS 2/2 Blatt..22 Aufgabe 45: Gesuht ist die Shnittmenge der beiden Zlinder 2 + 2 =, 2 + 2 =. (i Zeigen Sie, dass die Shnittmenge aus wei geshlossenen Kurven besteht
Übungen ur Ingenieur-Mathematik III WS 2/2 Blatt..22 Aufgabe 45: Gesuht ist die Shnittmenge der beiden Zlinder 2 + 2 =, 2 + 2 =. (i Zeigen Sie, dass die Shnittmenge aus wei geshlossenen Kurven besteht
Übungen zur Ingenieur-Mathematik III WS 2015/2016 Blatt h(x, y, z) := (x 2) 2 + y 2 + z 2 4 = 0,
 Übungen ur Ingenieur-Mathematik III WS 5/6 Blatt..6 Aufgabe 4: Betrahten Sie die Gleihungen: Lösung: h(,, := ( + + 4 =, g(,, := =, ( h(,, f(,, := = g(,, (. a Geben Sie eine geometrishe Interpretation der
Übungen ur Ingenieur-Mathematik III WS 5/6 Blatt..6 Aufgabe 4: Betrahten Sie die Gleihungen: Lösung: h(,, := ( + + 4 =, g(,, := =, ( h(,, f(,, := = g(,, (. a Geben Sie eine geometrishe Interpretation der
Die Lorentz-Transformation
 Bernhard Szallies Die Lorentz-Transformation Die Lorentz-Transformation stellt die rehnerishe Beziehung zwishen den Ortskoordinaten und der Zeitkoordinate eines Ereignisses bezüglih zweier Inertialsysteme
Bernhard Szallies Die Lorentz-Transformation Die Lorentz-Transformation stellt die rehnerishe Beziehung zwishen den Ortskoordinaten und der Zeitkoordinate eines Ereignisses bezüglih zweier Inertialsysteme
T p = T = RT. V b. ( ) 2 V p. V b. 2a(V b)2 V 3 RT. 2a(V b) V 3 (p+ a V 2 )
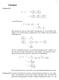 3 Lösung zu 83. Lösungen ( C C = T ( = T ( ( ( 2 van-der-waals Gas: ( ( b + a 2 = T = T b a 2 Man beachte das dies nur eine andere Formulierung der van-der-waals Gleichung ist als auf dem letzten Aufgabenzettel.
3 Lösung zu 83. Lösungen ( C C = T ( = T ( ( ( 2 van-der-waals Gas: ( ( b + a 2 = T = T b a 2 Man beachte das dies nur eine andere Formulierung der van-der-waals Gleichung ist als auf dem letzten Aufgabenzettel.
Versuchsprotokolle + 1=
 Physikalishes Grundraktikum ersuh 05 Adiabatenexonent ersuhsrotokolle Aufgaben 1. Messung des Adiabatenkoeffizientens on nah Clement- Desormes. Messung dessen nah dem erfahren on Rühardt 3. Bestimmen des
Physikalishes Grundraktikum ersuh 05 Adiabatenexonent ersuhsrotokolle Aufgaben 1. Messung des Adiabatenkoeffizientens on nah Clement- Desormes. Messung dessen nah dem erfahren on Rühardt 3. Bestimmen des
12. Lagrange-Formalismus III
 Übungen zur T: Theoretishe Mehanik, SoSe3 Prof. Dr. Dieter Lüst Theresienstr. 37, Zi. 45. Lagrange-Formalismus III Dr. James Gray James.Gray@hysik.uni-muenhen.de Übung.: Eine Gitarrensaite Wir betrahten
Übungen zur T: Theoretishe Mehanik, SoSe3 Prof. Dr. Dieter Lüst Theresienstr. 37, Zi. 45. Lagrange-Formalismus III Dr. James Gray James.Gray@hysik.uni-muenhen.de Übung.: Eine Gitarrensaite Wir betrahten
Kinetische Theorie der Gase
 Kinetishe heorie der Gase 1 Zusammenassung Zusammenhang zwishen Druk, olumen und emeratur nr Nk B Ideales Gasgesetz Anzahl Atome in 1 g 1 C Avogadrozahl N N A 6.0 10 A 1 mol Boltzmannkonstante k k B R
Kinetishe heorie der Gase 1 Zusammenassung Zusammenhang zwishen Druk, olumen und emeratur nr Nk B Ideales Gasgesetz Anzahl Atome in 1 g 1 C Avogadrozahl N N A 6.0 10 A 1 mol Boltzmannkonstante k k B R
1. Thermodynamische Potentiale, Maxwellgleichungen
 69 KAPIEL G hermodynamische Potentiale 1. hermodynamische Potentiale, Maxwellgleichungen hermodynamische Potentiale sind Funktionen von den Zustandsvariablen. Wir haben schon die innere Energie kennengelernt,
69 KAPIEL G hermodynamische Potentiale 1. hermodynamische Potentiale, Maxwellgleichungen hermodynamische Potentiale sind Funktionen von den Zustandsvariablen. Wir haben schon die innere Energie kennengelernt,
... Matrikel-Nummer Name Vorname. ... Semester Geburtstag Geburtsort
 Klausur zu Vorlesung und Übung P WS 2003/04 S. Universität Regensburg Naturwissenshaftlihe Fakultät IV- hemie und Pharmazie Bitte ausfüllen... Matrikel-Nummer Name Vorname... Semester Geburtstag Geburtsort
Klausur zu Vorlesung und Übung P WS 2003/04 S. Universität Regensburg Naturwissenshaftlihe Fakultät IV- hemie und Pharmazie Bitte ausfüllen... Matrikel-Nummer Name Vorname... Semester Geburtstag Geburtsort
Thermische Zustandsgleichung : Thermodynamische Zustandsgrößen als Funktion weiterer Zustandsgrößen berechenbar, z.b.: p = p(v,t) = RT/v
 Die Kalorishe Zstandsgleihng hermishe Zstandsgleihng : hermodynamishe Zstandsgrößen als Fnktion weiterer Zstandsgrößen berehenbar, z.b.: (,) R/ Kalorishe Zstandsgleihng: Kalorishe Zstandsgrößen als Fnktion
Die Kalorishe Zstandsgleihng hermishe Zstandsgleihng : hermodynamishe Zstandsgrößen als Fnktion weiterer Zstandsgrößen berehenbar, z.b.: (,) R/ Kalorishe Zstandsgleihng: Kalorishe Zstandsgrößen als Fnktion
Pool für das Jahr 2017
 Gemeinsame Abituraufgabenpools der Länder Pool für das Jahr 17 Aufgabe für das Fah Mathematik Kurzbeshreibung Anforderungsniveau Prüfungsteil Sahgebiet digitales Hilfsmittel erhöht B Analysis WTR 1 Aufgabe
Gemeinsame Abituraufgabenpools der Länder Pool für das Jahr 17 Aufgabe für das Fah Mathematik Kurzbeshreibung Anforderungsniveau Prüfungsteil Sahgebiet digitales Hilfsmittel erhöht B Analysis WTR 1 Aufgabe
-1- Klassische Punktmechanik: Ein Massenpunkt bewegt sich im dreidimensionalen Raum von r A nach r B längs einer Bahn, die durch die Ortskoordinate r
 -- 3 ERSER HSZ DER HERMODYNMIK 3. rbeit und Wärme 3.. Definition und allgemeine eshreibung der rbeit Klassishe unktmehanik: Ein Massenpunkt bewegt sih im dreidimensionalen Raum von r nah r längs einer
-- 3 ERSER HSZ DER HERMODYNMIK 3. rbeit und Wärme 3.. Definition und allgemeine eshreibung der rbeit Klassishe unktmehanik: Ein Massenpunkt bewegt sih im dreidimensionalen Raum von r nah r längs einer
7.5 Relativistische Bewegungsgleichung
 7.5. RELATIVISTISCHE BEWEGUNGSGLEICHUNG 7 7.5 Relativistishe Bewegungsgleihung Das Ziel ieses Abshnittes ist es, ie Bewegungsgleihung er Klassishen Mehanik an ie relativistishe Kinematik anzupassen. Ausgangspunkt
7.5. RELATIVISTISCHE BEWEGUNGSGLEICHUNG 7 7.5 Relativistishe Bewegungsgleihung Das Ziel ieses Abshnittes ist es, ie Bewegungsgleihung er Klassishen Mehanik an ie relativistishe Kinematik anzupassen. Ausgangspunkt
K4: Alkalische Esterhydrolyse
 K4: Alkalishe Esterhydrolyse Theoretishe Grundlagen: Die Konzentrationsbestimmung eines Stoffes während einer hemishen Reaktion kann auf hemishem Wege, aber auh über physikalishe Methoden vorgenommen werden.
K4: Alkalishe Esterhydrolyse Theoretishe Grundlagen: Die Konzentrationsbestimmung eines Stoffes während einer hemishen Reaktion kann auf hemishem Wege, aber auh über physikalishe Methoden vorgenommen werden.
Doppler-Effekt in Luft. c: Schallgeschwindigkeit (1)
 M24 Physikalishes Praktikum Doppler-ekt in Lut Im Jahre 1842 mahte Christian Johann Doppler (183 1853) ür autretende Wellenbewegungen eine ntdekung von großer Bedeutung. ie besagt: Die hwingungszahl einer
M24 Physikalishes Praktikum Doppler-ekt in Lut Im Jahre 1842 mahte Christian Johann Doppler (183 1853) ür autretende Wellenbewegungen eine ntdekung von großer Bedeutung. ie besagt: Die hwingungszahl einer
Der Zweite Hauptsatz der TD- Lernziele
 Der Zweite Hautsatz der D- Lernziele o Einleitung o Entroie (Definition, Entroie als Zustandsfunktion, die Clausius sche Ungleichung) o Der Zweite Hautzatz der D o Die Entroieänderungen bei seziellen Prozessen
Der Zweite Hautsatz der D- Lernziele o Einleitung o Entroie (Definition, Entroie als Zustandsfunktion, die Clausius sche Ungleichung) o Der Zweite Hautzatz der D o Die Entroieänderungen bei seziellen Prozessen
Das Chemische Gleichgewicht Massenwirkungsgesetz
 Das Chemishe Gleihgewiht Massenwirkungsgesetz Reversible Reaktionen: Beisiel : (Bodenstein 899 Edukt (Reaktanden Produkt H + I HIH Beobahtung: Die Reaktion verläuft unvollständig! ndig! D.h. niht alle
Das Chemishe Gleihgewiht Massenwirkungsgesetz Reversible Reaktionen: Beisiel : (Bodenstein 899 Edukt (Reaktanden Produkt H + I HIH Beobahtung: Die Reaktion verläuft unvollständig! ndig! D.h. niht alle
1 Grundlagen der Strömungsvorgänge
 Grundlagen der svorgänge.0 Einleitung Hydro - (Aero) Mehanik Hydro - (Aero) Statik Hydro - (Aero) Dynamik -dimension. -dimension. 3-dimension. stationäre instationäre Die slehre auh als Fluiddynamik bezeihnet
Grundlagen der svorgänge.0 Einleitung Hydro - (Aero) Mehanik Hydro - (Aero) Statik Hydro - (Aero) Dynamik -dimension. -dimension. 3-dimension. stationäre instationäre Die slehre auh als Fluiddynamik bezeihnet
Allgemeine Chemie Thermodynamik chemischer Reaktionen Das chemische Gleichgewicht
 Allgemeine Chemie hermodynamik hemisher Reaktionen Das hemishe Gleihgewiht AC_Grundlagen_hermodynamik.do Seite von 5 Fk /.5.6 Inhaltsverzeihnis Einleitung... 3 Energie und Enthalpie... 4. Systeme... 4.
Allgemeine Chemie hermodynamik hemisher Reaktionen Das hemishe Gleihgewiht AC_Grundlagen_hermodynamik.do Seite von 5 Fk /.5.6 Inhaltsverzeihnis Einleitung... 3 Energie und Enthalpie... 4. Systeme... 4.
3.1 Innere Energie und erster Hauptsatz
 Kaitel 3: hermodynamik Die historish entwikelte hermodynamik wird heute als hänomenologishe hermodynamik bezeihnet. Hierbei wird on bis 3 Hautsätzen ausgegangen, die sih aus der menshlihen Erfahrung ergeben
Kaitel 3: hermodynamik Die historish entwikelte hermodynamik wird heute als hänomenologishe hermodynamik bezeihnet. Hierbei wird on bis 3 Hautsätzen ausgegangen, die sih aus der menshlihen Erfahrung ergeben
Prof. Dr. H.-H. Kohler, WS 2004/05 PC1 Kapitel A.8 - Enzymkinetik A.8-1
 rof. Dr. H.-H. Kohler, W 2004/05 C Kapitel A.8 - nzymineti A.8- A.8 nzymineti A.8. Katalysatoren und nzyme Katalysatoren sind oleüle, die die Geshwindigeit einer Reation erhöhen, aus der Reation aber unerändert
rof. Dr. H.-H. Kohler, W 2004/05 C Kapitel A.8 - nzymineti A.8- A.8 nzymineti A.8. Katalysatoren und nzyme Katalysatoren sind oleüle, die die Geshwindigeit einer Reation erhöhen, aus der Reation aber unerändert
Innere Energie U. Veränderungen des Systems F A
 inführung in die Thermodnamik Innere nergie U Jeder Stoff besitzt eine Innere nergie U. Sie setzt sih überwiegend zusammen aus der - thermishen nergie: ewegungsenergie der Teilhen, - hemishen nergie: nergie
inführung in die Thermodnamik Innere nergie U Jeder Stoff besitzt eine Innere nergie U. Sie setzt sih überwiegend zusammen aus der - thermishen nergie: ewegungsenergie der Teilhen, - hemishen nergie: nergie
Über schwimmende Balken
 Einleitung Über shwimmende Balken Wolfgang Grentz, Peter Gallin, Kantonssshule Zürher Oberland Der Name Arhimedes wird wohl zuerst wenn auh niht nur mit dem Auftrieb in Verbindung gebraht Wenn wir lesen,
Einleitung Über shwimmende Balken Wolfgang Grentz, Peter Gallin, Kantonssshule Zürher Oberland Der Name Arhimedes wird wohl zuerst wenn auh niht nur mit dem Auftrieb in Verbindung gebraht Wenn wir lesen,
IX.3 Potentiale und Felder einer bewegten Punktladung
 N.BORGHINI Elektrodynamik einer Punktladung Theoretishe Physik IV IX.3 Potentiale und Felder einer bewegten Punktladung Dieser Abshnitt beginnt mit der Berehnung der Potentiale und Felder, die durh eine
N.BORGHINI Elektrodynamik einer Punktladung Theoretishe Physik IV IX.3 Potentiale und Felder einer bewegten Punktladung Dieser Abshnitt beginnt mit der Berehnung der Potentiale und Felder, die durh eine
SPEZIFISCHE WÄRMEKAPAZITÄT VON METALLEN
 INSTITUT FÜR ANGEWANDTE PHYSIK Physikalishes Praktikum für Studierende der Ingenieurswissenshaften Universität Hamburg, ungiusstraße 11 SPEZIFISCHE WÄRMEKAPAZITÄT VON METALLEN 1 Einleitung Wärme ist die
INSTITUT FÜR ANGEWANDTE PHYSIK Physikalishes Praktikum für Studierende der Ingenieurswissenshaften Universität Hamburg, ungiusstraße 11 SPEZIFISCHE WÄRMEKAPAZITÄT VON METALLEN 1 Einleitung Wärme ist die
Thermodynamik der Gase. Joule-Thomson-Prozeß (PHYWE)
 hermodynamik der Gase Joule-homson-Prozeß (PHYWE) Ziel des Versuches ist es, den Joule-homson-Koeffizienten µ J für zwei verschiedene Gase zu bestimmen. Vorbereitung: - hermodynamik idealer/ realer Gase
hermodynamik der Gase Joule-homson-Prozeß (PHYWE) Ziel des Versuches ist es, den Joule-homson-Koeffizienten µ J für zwei verschiedene Gase zu bestimmen. Vorbereitung: - hermodynamik idealer/ realer Gase
11. David Bohm und die Implizite Ordnung
 David Bohm und die Implizite Ordnung Mathematisher Anhang 1 11 David Bohm und die Implizite Ordnung Mathematisher Anhang Streng stetig, streng kausal, streng lokal Relativitätstheorie In der speziellen
David Bohm und die Implizite Ordnung Mathematisher Anhang 1 11 David Bohm und die Implizite Ordnung Mathematisher Anhang Streng stetig, streng kausal, streng lokal Relativitätstheorie In der speziellen
Polarimetrie 1. Polarimetrie
 Polarimetrie 1 Polarimetrie Bei Reaktionen mit optish aktiven Reaktanten kann die Konzentration der an der Reaktion beteiligten toffe gut polarimetrish gemessen werden, indem für das Gemish der Drehwinkel
Polarimetrie 1 Polarimetrie Bei Reaktionen mit optish aktiven Reaktanten kann die Konzentration der an der Reaktion beteiligten toffe gut polarimetrish gemessen werden, indem für das Gemish der Drehwinkel
13. Entropie und Zweiter Hauptsatz
 3. Entropie und Zeiter Hauptsatz 3. Entropie Wir haben festgestellt, dass der reversible isohore und der reversible isotherme Prozess durh die Konstanz einer Zustandsgröße haraterisiert ar ( bz., U). Der
3. Entropie und Zeiter Hauptsatz 3. Entropie Wir haben festgestellt, dass der reversible isohore und der reversible isotherme Prozess durh die Konstanz einer Zustandsgröße haraterisiert ar ( bz., U). Der
1. Ziel des Versuchs. 2. Theorie. Dennis Fischer Gruppe 9 Magdalena Boeddinghaus
 Versuch Nr. 1: Joule - Thomson - Effekt 1. Ziel des Versuchs In diesem Versuch soll der Joule - Thomson - oeffizient für CO und N bestimmt werden.. Theorie Einfache Zustandsgleichungen gegeben das reale
Versuch Nr. 1: Joule - Thomson - Effekt 1. Ziel des Versuchs In diesem Versuch soll der Joule - Thomson - oeffizient für CO und N bestimmt werden.. Theorie Einfache Zustandsgleichungen gegeben das reale
X.5.4 Potentiale und Felder einer bewegten Punktladung
 X.5 Klassishe Theorie der Strahlung 85 X.5.4 Potentiale und Felder einer bewegten Punktladung Dieser Paragraph beginnt mit der Berehnung der Potentiale und Felder, die durh eine bewegte Punktladung mit
X.5 Klassishe Theorie der Strahlung 85 X.5.4 Potentiale und Felder einer bewegten Punktladung Dieser Paragraph beginnt mit der Berehnung der Potentiale und Felder, die durh eine bewegte Punktladung mit
Die Reflexion von Elektronen an einem Potentialsprung nach der relativistischen Dynamik von Dirac.
 Die Reflexion von Elektronen an einem Potentialsprung nah der relativistishen Dynamik von Dira. Von 0. Klein in Kopenhagen. (Eingegangen am 24. Dezember 1928.) Es wird die Reflexion von Elektronen an einem
Die Reflexion von Elektronen an einem Potentialsprung nah der relativistishen Dynamik von Dira. Von 0. Klein in Kopenhagen. (Eingegangen am 24. Dezember 1928.) Es wird die Reflexion von Elektronen an einem
Statistische Physik - Theorie der Wärme (PD Dr. M. Falcke)
 Freie Universität Berlin W 006/007 Fachbereich Physik 8..006 tatistische Physik - heorie der Wärme (PD Dr. M. Falcke) Übungsblatt 9: hermodynamische Identitäten, hermische/kalorische Zustandsgleichung,
Freie Universität Berlin W 006/007 Fachbereich Physik 8..006 tatistische Physik - heorie der Wärme (PD Dr. M. Falcke) Übungsblatt 9: hermodynamische Identitäten, hermische/kalorische Zustandsgleichung,
MWG. 1. Massenwirkungsgesetz
 MWG 1. Massenwirkungsgesetz Betrahten wir den Ablauf einer hemishen Reaktion, so stellen wir fest, dass bestimmte Reaktionsgeshwindigkeiten den Vorgang beeinflussen. Wir wissen, dass formal ähnlihe Umsetzungen
MWG 1. Massenwirkungsgesetz Betrahten wir den Ablauf einer hemishen Reaktion, so stellen wir fest, dass bestimmte Reaktionsgeshwindigkeiten den Vorgang beeinflussen. Wir wissen, dass formal ähnlihe Umsetzungen
32. Lebensdauer von Myonen 5+5 = 10 Punkte
 PD. Dr. R. Klesse, Prof. Dr. A. Shadshneider S. Bittihn, C. von Krühten Wintersemester 2016/2017 Theoretishe Physik in 2 Semestern I Musterlösung zu den Übungen 9 und 10 www.thp.uni-koeln.de/ rk/tpi 16.html
PD. Dr. R. Klesse, Prof. Dr. A. Shadshneider S. Bittihn, C. von Krühten Wintersemester 2016/2017 Theoretishe Physik in 2 Semestern I Musterlösung zu den Übungen 9 und 10 www.thp.uni-koeln.de/ rk/tpi 16.html
Thermodynamik (Wärmelehre) II Wärmeenergie
 Physik A L25 (06.12.2012) Therodynaik (Wärelehre) II Wäreenergie Wäreenge und Wärekaazität Energieerhaltung bei therodynaishen Systeen 1. Hautsatz der Therodynaik Arbeit und innere Energie bei Gasen 1
Physik A L25 (06.12.2012) Therodynaik (Wärelehre) II Wäreenergie Wäreenge und Wärekaazität Energieerhaltung bei therodynaishen Systeen 1. Hautsatz der Therodynaik Arbeit und innere Energie bei Gasen 1
Physik / Mechanik / Kinematik
 1. Setzen Sie bei den folgenden Zahlenpaaren einen Vergleihsoperator (>,,
1. Setzen Sie bei den folgenden Zahlenpaaren einen Vergleihsoperator (>,,
2 Sehnen, Sekanten und Chordalen
 Sehnen, Seanten und Chordalen Übersiht.1 Sehnen- und Seantensatz................................................... 7. Chordalen.................................................................. 3 Weitere
Sehnen, Seanten und Chordalen Übersiht.1 Sehnen- und Seantensatz................................................... 7. Chordalen.................................................................. 3 Weitere
Potenzen mit gleichen Grundzahlen werden multipliziert, indem man die Hochzahlen addiert und die Grundzahlen beibehält. a n a m = a m+n. a...
 Mathematikskript: Steven Passmore Potenzgesetze Einleitung Einen Ausdruk mit einer Hohzahl nennt man Potenz Beispiele: 3 5,9 x, a n ). Zunähst ist eine Potenz eine vereinfahte Shreibweise für die vielfahe
Mathematikskript: Steven Passmore Potenzgesetze Einleitung Einen Ausdruk mit einer Hohzahl nennt man Potenz Beispiele: 3 5,9 x, a n ). Zunähst ist eine Potenz eine vereinfahte Shreibweise für die vielfahe
Versuch LF: Leitfähigkeit
 Versuhsdatum: 8.9.9 Versuh LF: Versuhsdatum: 8.9.9 Seite -- Versuhsdatum: 8.9.9 Einleitung bedeutet, dass ein hemisher Stoff oder ein Stoffgemish in der Lage ist, Energie oder Ionen zu transportieren und
Versuhsdatum: 8.9.9 Versuh LF: Versuhsdatum: 8.9.9 Seite -- Versuhsdatum: 8.9.9 Einleitung bedeutet, dass ein hemisher Stoff oder ein Stoffgemish in der Lage ist, Energie oder Ionen zu transportieren und
Der Zweite Hauptsatz der TD- Lernziele
 Der Zweite Hautsatz der D- Lernziele o Einleitung o Entroie (Definition, Entroie als Zustandsfunktion, die Clausius sche Ungleichung) o Der Zweite Hautzatz der D o Die Entroieänderungen bei seziellen Prozessen
Der Zweite Hautsatz der D- Lernziele o Einleitung o Entroie (Definition, Entroie als Zustandsfunktion, die Clausius sche Ungleichung) o Der Zweite Hautzatz der D o Die Entroieänderungen bei seziellen Prozessen
Fit in Mathe. Musterlösungen. Dezember Klassenstufe 10 Trigonometrie (Taschenrechner erlaubt)
 Thema Trigonometrie (Tashenrehner erlaubt) Drei Bestimmungsstüke sind gegeben. Bestimme die fehlenden Seiten. a) γ = 60, b = 10, = 10 b) γ = 90, b = 3, = 5 ) γ = 10, a, b d) γ = 30 β = 60, = 5 Zu a) Aus
Thema Trigonometrie (Tashenrehner erlaubt) Drei Bestimmungsstüke sind gegeben. Bestimme die fehlenden Seiten. a) γ = 60, b = 10, = 10 b) γ = 90, b = 3, = 5 ) γ = 10, a, b d) γ = 30 β = 60, = 5 Zu a) Aus
x 3x 2x 0 2x x x 3 e 4 t t dt 12
 5 Gewöhnlihe Differentialgleihungen 5. Einführung und Definition einer Differentialgleihung, Beispiele Die Shulmathematik hat sih bisher sehr ausgiebig mit dem Lösen von Gleihungen beshäftigt. In diesen
5 Gewöhnlihe Differentialgleihungen 5. Einführung und Definition einer Differentialgleihung, Beispiele Die Shulmathematik hat sih bisher sehr ausgiebig mit dem Lösen von Gleihungen beshäftigt. In diesen
13 Chemisches Gleichgewicht (Kinetische Ableitung)
 13 Chemishes Gleihgewiht (Kinetishe Ableitung) 13.1 Massenwirkungsgesetz (MWG) Chemishe Reaktionen in geshlossenen Systemen verlaufen selten einsinnig, d.h. in eine Rihtung, sondern sind meist umkehrbar:
13 Chemishes Gleihgewiht (Kinetishe Ableitung) 13.1 Massenwirkungsgesetz (MWG) Chemishe Reaktionen in geshlossenen Systemen verlaufen selten einsinnig, d.h. in eine Rihtung, sondern sind meist umkehrbar:
Wir gehen jetzt zu reversiblen Reaktionen über und betrachten eine reversible Reaktion einfacher Art in der allgemeinen Form (s. Gl.(A.
 Prof. Dr. H.-H. ohler, W 004/05 PC1 apitel.4 - Reversible Reation.4-1.4 Reversible Reationen.4.1 Diretionale und Netto-Reationsgeshwindigeit Wir gehen jetzt zu reversiblen Reationen über und betrahten
Prof. Dr. H.-H. ohler, W 004/05 PC1 apitel.4 - Reversible Reation.4-1.4 Reversible Reationen.4.1 Diretionale und Netto-Reationsgeshwindigeit Wir gehen jetzt zu reversiblen Reationen über und betrahten
Um den Verlauf der Titrationskurven zu verstehen, benötigen wir die Löslichkeitsprodukte der entsprechenden Silberhalogenide.
 1. Potentiometrishe Titration 1 1. POTENTIOMETRISCHE TITRATION 1. Aufgabe Das öslihkeitsprodukt zweier Silberhalogenide soll potentiometrish bestimmt werden. Dazu wird eine wässerige ösung, die zwei Halogenidionen
1. Potentiometrishe Titration 1 1. POTENTIOMETRISCHE TITRATION 1. Aufgabe Das öslihkeitsprodukt zweier Silberhalogenide soll potentiometrish bestimmt werden. Dazu wird eine wässerige ösung, die zwei Halogenidionen
5. Die Thermodynamischen Potentiale
 5. Die hermodynamischen Potentiale 5.1. Einführung der Potentiale Gibbs'sche Fundamentalgleichung. d = du + d, du + d δ Q d = = Ist die Entroie als Funktion von U und bekannt, = ( U, ) dann lassen sich
5. Die hermodynamischen Potentiale 5.1. Einführung der Potentiale Gibbs'sche Fundamentalgleichung. d = du + d, du + d δ Q d = = Ist die Entroie als Funktion von U und bekannt, = ( U, ) dann lassen sich
IX.5 Klassische Theorie der Strahlung
 18 Zeitabhängige elektromagnetishe Felder IX.5 Klassishe Theorie der Strahlung In diesem Abshnitt werden die Maxwell-Gleihungen in Anwesenheit fester äußerer Quellen mithilfe von sogenannten retardierten
18 Zeitabhängige elektromagnetishe Felder IX.5 Klassishe Theorie der Strahlung In diesem Abshnitt werden die Maxwell-Gleihungen in Anwesenheit fester äußerer Quellen mithilfe von sogenannten retardierten
4. Einsteins Gleichungen und das Standardmodell der Kosmologie
 4. Einsteins Gleihungen und das Standardmodell der Kosmologie 4.. Die Einsteinshen Gleihungen (EG) in obertson-walker- Metrik Die Allgemeine elativitätstheorie (AT) geht von der Gleihheit träger und shwerer
4. Einsteins Gleihungen und das Standardmodell der Kosmologie 4.. Die Einsteinshen Gleihungen (EG) in obertson-walker- Metrik Die Allgemeine elativitätstheorie (AT) geht von der Gleihheit träger und shwerer
8.2. KURVEN IM RAUM 37
 8.2. KURVEN IM RAUM 37 Lemma 8.2.3.10 (Differenzierbarkeit der Wegelängenfunktion für glatte Kurven) Ist γ C 1 (I; V ), so ist die Abbildung t L t (γ) differenzierbar, die Ableitung an der Stelle t ergibt
8.2. KURVEN IM RAUM 37 Lemma 8.2.3.10 (Differenzierbarkeit der Wegelängenfunktion für glatte Kurven) Ist γ C 1 (I; V ), so ist die Abbildung t L t (γ) differenzierbar, die Ableitung an der Stelle t ergibt
TU Ilmenau Chemisches Praktikum Versuch Photometrische Bestimmung der Fachgebiet Chemie. Komplexzusammensetzung
 TU Ilmenau Chemishes Praktikum Versuh Photometrishe Bestimmung der Fahgebiet Chemie Komplexzusammensetzung V20 1 Aufgabenstellung Bestimmen Sie von der folgenden Kombination CuSO 4 5 H 2 O und Ethylendiamin
TU Ilmenau Chemishes Praktikum Versuh Photometrishe Bestimmung der Fahgebiet Chemie Komplexzusammensetzung V20 1 Aufgabenstellung Bestimmen Sie von der folgenden Kombination CuSO 4 5 H 2 O und Ethylendiamin
Aufgaben zum Stirlingschen Kreisprozess Ein Stirling-Motor arbeite mit 50 g Luft ( M= 30g mol 1 )zwischen den Temperaturen = 350 C und T3
 Aufgaben zum Stirlingschen Kreisrozess. Ein Stirling-Motor arbeite mit 50 g Luft ( M 0g mol )zwischen den emeraturen 50 C und 50 C sowie den olumina 000cm und 5000 cm. a) Skizzieren Sie das --Diagramm
Aufgaben zum Stirlingschen Kreisrozess. Ein Stirling-Motor arbeite mit 50 g Luft ( M 0g mol )zwischen den emeraturen 50 C und 50 C sowie den olumina 000cm und 5000 cm. a) Skizzieren Sie das --Diagramm
Höhenmessung mittels Seeinterferometer unter Ausnutzung der solaren Radiostrahlung
 Höhenmessung mittels Seeintererometer unter Ausnutzung der solaren Radiostrahlung Christian Monstein Eine ür Amateure neue Anwendung radioastronomisher Messmethoden besteht in der relativen Höhenmessung
Höhenmessung mittels Seeintererometer unter Ausnutzung der solaren Radiostrahlung Christian Monstein Eine ür Amateure neue Anwendung radioastronomisher Messmethoden besteht in der relativen Höhenmessung
LEITFÄHIGKEIT SCHWACHER ELEKTROLYTE
 TU Clausthal Stand //7 LEITFÄHIGKEIT SCHWACHER ELEKTROLYTE. Versuhsplatz Komponenten: - Thermostat - Leitfähigkeitsmessgerät - Elektrode - Thermometer. Allgemeines zum Versuh Der Widerstand R eines Leiters
TU Clausthal Stand //7 LEITFÄHIGKEIT SCHWACHER ELEKTROLYTE. Versuhsplatz Komponenten: - Thermostat - Leitfähigkeitsmessgerät - Elektrode - Thermometer. Allgemeines zum Versuh Der Widerstand R eines Leiters
85 Die allgemeine Cauchysche Integralformel und holomorphe Stammfunktionen
 85 Die allgemeine Cauhyshe Integralformel und holomorphe Stammfunktionen 85. Holomorphe Stammfunktionen 85.2 Äquivalenzen zur Gültigkeit des Cauhyshen Integralsatzes für eine feste Funktion 85.(Ho) Homotopie
85 Die allgemeine Cauhyshe Integralformel und holomorphe Stammfunktionen 85. Holomorphe Stammfunktionen 85.2 Äquivalenzen zur Gültigkeit des Cauhyshen Integralsatzes für eine feste Funktion 85.(Ho) Homotopie
c S sin 2 1 2 c c p sin 4 4.8 Kugelumströmung 4.8.1 Ideale reibungsfreie Umströmung der Kugel (Potentialströmung) Geschwindigkeit auf der Oberfläche
 4.7 Kugelumströmung... 4.7. Ideale reibungsfreie Umströmung der Kugel (Potentialströmung)... 4.7. Reibungsbehaftete Umströmung der Kugel... 4.8 Zylinderumströmung... 4.9 Rohrströmung... 5 4.9. Laminare
4.7 Kugelumströmung... 4.7. Ideale reibungsfreie Umströmung der Kugel (Potentialströmung)... 4.7. Reibungsbehaftete Umströmung der Kugel... 4.8 Zylinderumströmung... 4.9 Rohrströmung... 5 4.9. Laminare
Physikaufgabe 53. ds d. wobei sowohl das Zeitelement als auch das Wegelement
 Home Startseite Imressum Kontakt Gästebuh Aufgabe: Beweisen Sie daß das Weltall eine endlihe Ausdehnung hat jeweils ein endlihes Alter erreiht und daß es keine Ursahe hat Lösung: Beginnend mit dem Urknall
Home Startseite Imressum Kontakt Gästebuh Aufgabe: Beweisen Sie daß das Weltall eine endlihe Ausdehnung hat jeweils ein endlihes Alter erreiht und daß es keine Ursahe hat Lösung: Beginnend mit dem Urknall
1. Beispiel: Untersuchung des Einflusses des Zuleitungswiderstandes
 Beisiele - Hydraulik Vershaltungen. Beisiel: Untersuhung des Einflusses des Zuleitungswiderstandes auf die Volumenstromshwankungen arallel geshalteter Verbrauher Beweis der Behautung: Je höher der Zuleitungswiderstand
Beisiele - Hydraulik Vershaltungen. Beisiel: Untersuhung des Einflusses des Zuleitungswiderstandes auf die Volumenstromshwankungen arallel geshalteter Verbrauher Beweis der Behautung: Je höher der Zuleitungswiderstand
SCHRIFTLICHE ABITURPRÜFUNG PHYSIK (Grundkursniveau)
 PHYSIK (Grundkursniveau) Einlesezeit: Bearbeitungszeit: 30 Minuten 210 Minuten Aus jedem Themenblok ist ein Thema auszuwählen und anzukreuzen. Gewählte Themen: Themenblok Grundlagen Thema G1 Wehselwirkungen
PHYSIK (Grundkursniveau) Einlesezeit: Bearbeitungszeit: 30 Minuten 210 Minuten Aus jedem Themenblok ist ein Thema auszuwählen und anzukreuzen. Gewählte Themen: Themenblok Grundlagen Thema G1 Wehselwirkungen
Temperaturabhängigkeit von Enthalpie H und Entropie S
 Prof. Dr. Norbert Ham 1/5 8. emeraturabhängigkeit von Enthalie und Entroie emeraturabhängigkeit von Enthalie H und Entroie S In abellenwerken sind Enthalien und Entroien in der Regel bezogen auf Standardbedingungen,
Prof. Dr. Norbert Ham 1/5 8. emeraturabhängigkeit von Enthalie und Entroie emeraturabhängigkeit von Enthalie H und Entroie S In abellenwerken sind Enthalien und Entroien in der Regel bezogen auf Standardbedingungen,
Theoretische Physik III (Elektrodynamik)
 Theoretishe Physik III (Elektrodynamik) Prof. Dr. Th. Feldmann 8. Juni 03 Kurzzusammenfassung Vorlesung 6 vom.6.03 Impulserhaltung Analog zur Energieerhaltung leiten wir nun Kontinuitätsgleihung für Impulsdihte
Theoretishe Physik III (Elektrodynamik) Prof. Dr. Th. Feldmann 8. Juni 03 Kurzzusammenfassung Vorlesung 6 vom.6.03 Impulserhaltung Analog zur Energieerhaltung leiten wir nun Kontinuitätsgleihung für Impulsdihte
Die freie Energie wird also bei konstantem Volumen und konstanter Temperatur minimal
 Die freie Energie wird also bei konstantem Volumen und konstanter Temperatur minimal 7.2 Die Enthalpie Die Enthalpie H ist definiert als H = U + pv, womit wir für die Änderung erhalten dh = pdv + TdS +
Die freie Energie wird also bei konstantem Volumen und konstanter Temperatur minimal 7.2 Die Enthalpie Die Enthalpie H ist definiert als H = U + pv, womit wir für die Änderung erhalten dh = pdv + TdS +
D-MAVT/D-MATL Analysis II FS 2018 Dr. Andreas Steiger. Lösung - Serie 14
 D-MAVT/D-MATL Analsis II FS 2018 Dr. Andreas Steiger Lösung - Serie 14 1. Für welhe der folgenden Funktionen f ist f x (x, = e 4x 2x 2, f (x, = os 2x 2? (a (x, 1 4 e4x x 2 2 sin π. (b (x, 1 4 e4x x 2 2
D-MAVT/D-MATL Analsis II FS 2018 Dr. Andreas Steiger Lösung - Serie 14 1. Für welhe der folgenden Funktionen f ist f x (x, = e 4x 2x 2, f (x, = os 2x 2? (a (x, 1 4 e4x x 2 2 sin π. (b (x, 1 4 e4x x 2 2
Zum Zwillingsparadoxon in der Speziellen Relativitätstheorie
 Materialien für Unterriht und Studium Zum Zwillingsparadoxon in der Speziellen Relativitätstheorie von Georg Bernhardt 5. Oktober 017 Beshreibt das Zwillingsparadoxon tatsählih eine logishe Inkonsistenz
Materialien für Unterriht und Studium Zum Zwillingsparadoxon in der Speziellen Relativitätstheorie von Georg Bernhardt 5. Oktober 017 Beshreibt das Zwillingsparadoxon tatsählih eine logishe Inkonsistenz
19.2 Kurvenintegrale. c a. wobei die euklidische Norm bezeichnet. Weiterhin heißt
 Kapitel 19: Integralrehnung mehrerer Variabler 19.2 Kurvenintegrale Für eine stükweise C 1 -Kurve : [a, b] D, D R n, und eine stetige skalare Funktion f : D R hatten wir das Kurvenintegral 1. Art definiert
Kapitel 19: Integralrehnung mehrerer Variabler 19.2 Kurvenintegrale Für eine stükweise C 1 -Kurve : [a, b] D, D R n, und eine stetige skalare Funktion f : D R hatten wir das Kurvenintegral 1. Art definiert
X.5 Klassische Theorie der Strahlung
 X.5 Klassishe Theorie der Strahlung 179 X.5 Klassishe Theorie der Strahlung In diesem Abshnitt werden die Maxwell-Gleihungen in Anwesenheit fester äußerer Quellen mithilfe von retardierten Potentialen
X.5 Klassishe Theorie der Strahlung 179 X.5 Klassishe Theorie der Strahlung In diesem Abshnitt werden die Maxwell-Gleihungen in Anwesenheit fester äußerer Quellen mithilfe von retardierten Potentialen
Lichtgeschwindigkeit
 Vorbereitung Lihtgeshwindigkeit Carsten Röttele 2. Dezember 20 Inhaltsverzeihnis Drehspiegelmethode 2. Vorbereitung auf den Versuh......................... 2.2 Justierung der Apparatur und Messung...................
Vorbereitung Lihtgeshwindigkeit Carsten Röttele 2. Dezember 20 Inhaltsverzeihnis Drehspiegelmethode 2. Vorbereitung auf den Versuh......................... 2.2 Justierung der Apparatur und Messung...................
Schallwellen II. Krystian Gaus. Wintersemester 2012/2013
 Shallwellen II Krystian Gaus Wintersemester 01/013 Erinnerung. ρ = ρ 0 + ρ ist die Gasdihte, p = p 0 + p der Gasdruk und u = ũ die Gasgeshwindigkeit. Dabei sind p, ρ, ũ kleine Amplituden-Störungen. ist
Shallwellen II Krystian Gaus Wintersemester 01/013 Erinnerung. ρ = ρ 0 + ρ ist die Gasdihte, p = p 0 + p der Gasdruk und u = ũ die Gasgeshwindigkeit. Dabei sind p, ρ, ũ kleine Amplituden-Störungen. ist
Betrachtet wird ein endlicher Abschnitt des Stabes, der sich mit dem Stab mitbewegt: t = X 2. u X 2,
 .1 Bewegungsgleihung Homogener Stab: Dihte ρ, Quershnittsflähe A, Elastizitätsmodul E ρ, E, A, u Betrahtet wird ein endliher Abshnitt des Stabes, der sih mit dem Stab mitbewegt: Unverformt: Verformt: N(
.1 Bewegungsgleihung Homogener Stab: Dihte ρ, Quershnittsflähe A, Elastizitätsmodul E ρ, E, A, u Betrahtet wird ein endliher Abshnitt des Stabes, der sih mit dem Stab mitbewegt: Unverformt: Verformt: N(
Einführung. in die. Thermodynamik II
 Einführung in die Theoretishe Physik Therodynaik II Siegfried Petry Fassung vo 3 Januar 013 I n h a l t : 1 Was besagt der 1 Hautsatz der Therodynaik? Die innere Energie eines Systes 3 Die innere Energie
Einführung in die Theoretishe Physik Therodynaik II Siegfried Petry Fassung vo 3 Januar 013 I n h a l t : 1 Was besagt der 1 Hautsatz der Therodynaik? Die innere Energie eines Systes 3 Die innere Energie
Physikalische Chemie Physikalsiche Chemie I SoSe 2009 Prof. Dr. Norbert Hampp 1/10 5. Zustandsfunktionen Idealer und Realer Gase. ZustandsÄnderungen
 Prof. Dr. Norbert Ham 1/10 5. Zustandsfunktionen Idealer und Realer Gase ZustandsÄnderungen Die rennung zwischen unserem System und der ÅUmweltÇ wird durch eine Wand realisiert. WÄnde kånnen unterschiedliche
Prof. Dr. Norbert Ham 1/10 5. Zustandsfunktionen Idealer und Realer Gase ZustandsÄnderungen Die rennung zwischen unserem System und der ÅUmweltÇ wird durch eine Wand realisiert. WÄnde kånnen unterschiedliche
M 8 Schallgeschwindigkeit von Gasen
 M 8 Shallgeshwindigkeit von Gasen 1. Aufgabenstellung 1.1 Bestimmen Sie die Shallgeshwindigkeit in Luft und vorgegebener Gase. 1. Berehnen Sie die zugehörigen Adiabatenexponenten. 1.3 Überprüfen Sie den
M 8 Shallgeshwindigkeit von Gasen 1. Aufgabenstellung 1.1 Bestimmen Sie die Shallgeshwindigkeit in Luft und vorgegebener Gase. 1. Berehnen Sie die zugehörigen Adiabatenexponenten. 1.3 Überprüfen Sie den
Logarithmen und Logarithmengesetze
 R. Brinkmnn http://brinkmnn-du.de Seite 9.. Logrithmen und Logrithmengesetze Wir betrhten die Gleihung 5 = 5 Auf der linken Seite steht eine Potenz mit der Bsis 5 und dem Eponenten. Auf der rehten Seite
R. Brinkmnn http://brinkmnn-du.de Seite 9.. Logrithmen und Logrithmengesetze Wir betrhten die Gleihung 5 = 5 Auf der linken Seite steht eine Potenz mit der Bsis 5 und dem Eponenten. Auf der rehten Seite
3 Messprinzipien der elektronischen Entfernungsmessung
 3 Messprinzipien der elektronishen Entfernungsmessung Der Benutzer der modernen Entfernungsmessgeräte und Tahymeter ist sih der komplexen inneren Abläufe dieser hohwertigen Geräte kaum bewusst. Da die
3 Messprinzipien der elektronishen Entfernungsmessung Der Benutzer der modernen Entfernungsmessgeräte und Tahymeter ist sih der komplexen inneren Abläufe dieser hohwertigen Geräte kaum bewusst. Da die
Einführung in die Meteorologie
 Einführung in die Meteorologie - eil II: Meteorologishe Elemente - Clemens Simmer Meteorologishes Institut Rheinishe Friedrih-Wilhelms Universität Bonn Sommersemester 6 Wintersemester 6/7 II Meteorologishe
Einführung in die Meteorologie - eil II: Meteorologishe Elemente - Clemens Simmer Meteorologishes Institut Rheinishe Friedrih-Wilhelms Universität Bonn Sommersemester 6 Wintersemester 6/7 II Meteorologishe
Musterlösung Klausur Physikalische Chemie I: Thermodynamik (Januar 2009)
 Musterlösung Klausur Physikalische Chemie I: Thermodynamik (Januar 2009) Aufgabe 1: Reaktionsthermodynamik a) möglichst niedrige Temeratur (begünstigt exotherme Reaktionen) möglichst hoher Druck (begünstigt
Musterlösung Klausur Physikalische Chemie I: Thermodynamik (Januar 2009) Aufgabe 1: Reaktionsthermodynamik a) möglichst niedrige Temeratur (begünstigt exotherme Reaktionen) möglichst hoher Druck (begünstigt
Wärmelehre/Thermodynamik. Wintersemester 2007
 Einführung in die Physik I Wärmelehre/hermodynamik Wintersemester 7 ladimir Dyakonov #3 am..7 Folien unter: htt://www.hysik.uni-wuerzburg.de/ep6/teaching.html.3 Ideales Gas Exerimentelle Bestimmung der
Einführung in die Physik I Wärmelehre/hermodynamik Wintersemester 7 ladimir Dyakonov #3 am..7 Folien unter: htt://www.hysik.uni-wuerzburg.de/ep6/teaching.html.3 Ideales Gas Exerimentelle Bestimmung der
Thermische Energie kann nicht mehr beliebig in andere Energieformen umgewandelt werden.
 Wärmemenge: hermische Energie kann nicht mehr beliebig in andere Energieformen umgewandelt werden. Sie kann aber unter gewissen oraussetzungen von einem Körer auf einen nderen übertragen werden. Dabei
Wärmemenge: hermische Energie kann nicht mehr beliebig in andere Energieformen umgewandelt werden. Sie kann aber unter gewissen oraussetzungen von einem Körer auf einen nderen übertragen werden. Dabei
Warten auf einen Run und was kommt dann?
 Warten auf einen Run und was kommt dann? GERD RIEHL, BARSINGHAUSEN Zusammenfassung: Das Problem, die Wahrsheinlihkeit für einen Run der Länge 4 (also 4 gleihe Zahlen hintereinander) beim n-maligen Würfeln
Warten auf einen Run und was kommt dann? GERD RIEHL, BARSINGHAUSEN Zusammenfassung: Das Problem, die Wahrsheinlihkeit für einen Run der Länge 4 (also 4 gleihe Zahlen hintereinander) beim n-maligen Würfeln
Physikalische Chemie Physikalische Chemie I SoSe 2009 Prof. Dr. Norbert Hampp 1/8 15. Chemische Thermodynamik. ZustandsÄnderungen
 Physikalische Chemie Physikalische Chemie I oe 2009 Prof. Dr. Norbert Ham 1/8 15. Chemische hermodynamik Zustandsnderungen Mit Hilfe des chemischen Potentials, knnen wir offene und kommunizierende ysteme
Physikalische Chemie Physikalische Chemie I oe 2009 Prof. Dr. Norbert Ham 1/8 15. Chemische hermodynamik Zustandsnderungen Mit Hilfe des chemischen Potentials, knnen wir offene und kommunizierende ysteme
T4p: Thermodynamik und Statistische Physik Prof. Dr. H. Ruhl Übungsblatt 10 Lösungsvorschlag
 4: hermodynamik und Statistische Physik Prof. Dr. H. Ruhl Übungsblatt 10 Lösungsvorschlag 1. Joule-homson-Effekt Ein Gasstrom wird von Bereich 1 (siehe Abbildung) mit einem Kolben durch eine oröse Wand
4: hermodynamik und Statistische Physik Prof. Dr. H. Ruhl Übungsblatt 10 Lösungsvorschlag 1. Joule-homson-Effekt Ein Gasstrom wird von Bereich 1 (siehe Abbildung) mit einem Kolben durch eine oröse Wand
Kompressionsfaktor. Der Kompressionsfaktor (Realgasfaktor) beschreibt die Abweichung eines realen Gases vom idealen Verhalten:
 Kompressionsfaktor Der Kompressionsfaktor (Realgasfaktor) beshreibt die Abweihung eines realen Gases om idealen Verhalten: pv m ZRT Z pvm RT kleine Drüke: nahezu keine zwishenmolekulare Kräfte pv m ~ RT
Kompressionsfaktor Der Kompressionsfaktor (Realgasfaktor) beshreibt die Abweihung eines realen Gases om idealen Verhalten: pv m ZRT Z pvm RT kleine Drüke: nahezu keine zwishenmolekulare Kräfte pv m ~ RT
5 Relativistische Mechanik
 5 Relativistishe ehanik Nah dem Relativitätsprinzip müssen die Naturgesetze, also insbesondere die Gesetze der ehanik, in jedem IS die gleihe Form annehmen. Zur Formulierung der Impulserhaltung etwa benötigt
5 Relativistishe ehanik Nah dem Relativitätsprinzip müssen die Naturgesetze, also insbesondere die Gesetze der ehanik, in jedem IS die gleihe Form annehmen. Zur Formulierung der Impulserhaltung etwa benötigt
Alexander Halles. Temperaturskalen
 emperatursalen Stand: 15.0.004 - Inhalt - 1. Grundsätzlihes über emperatur 3. Kelvin-Sala 3 3. Fahrenheit-Sala und Ranine-Sala 4 4. Celsius-emperatursala 4 5. Die Réaumur-Sala 4 6. Umrehnung zwishen den
emperatursalen Stand: 15.0.004 - Inhalt - 1. Grundsätzlihes über emperatur 3. Kelvin-Sala 3 3. Fahrenheit-Sala und Ranine-Sala 4 4. Celsius-emperatursala 4 5. Die Réaumur-Sala 4 6. Umrehnung zwishen den
SSYLB2 SS06 Daniel Schrenk, Andreas Unterweger Übung 5. Laborprotokoll SSY. Reglerentwurf nach dem Frequenz- Kennlinien-Verfahren
 Laborprotokoll SSY Reglerentwurf nah dem Frequenz- Kennlinien-Verfahren Daniel Shrenk, Andreas Unterweger, ITS 24 SSYLB2 SS6 Daniel Shrenk, Andreas Unterweger Seite 1 von 13 1. Einleitung Ziel der Übung
Laborprotokoll SSY Reglerentwurf nah dem Frequenz- Kennlinien-Verfahren Daniel Shrenk, Andreas Unterweger, ITS 24 SSYLB2 SS6 Daniel Shrenk, Andreas Unterweger Seite 1 von 13 1. Einleitung Ziel der Übung
LEITFÄHIGKEIT SCHWACHER ELEKTROLYTE
 TU Clausthal Stand 8//3 LEITFÄHIGKEIT SCHWCHER ELEKTROLYTE. Versuhsplatz Komponenten: - Thermostat - Leitfähigkeitsmessgerät - Elektrode - Thermometer. llgemeines zum Versuh Der Widerstand eines Leiters
TU Clausthal Stand 8//3 LEITFÄHIGKEIT SCHWCHER ELEKTROLYTE. Versuhsplatz Komponenten: - Thermostat - Leitfähigkeitsmessgerät - Elektrode - Thermometer. llgemeines zum Versuh Der Widerstand eines Leiters
Höhere Mathematik Vorlesung 9
 Höhere Mathematik Vorlesung 9 Mai 2017 ii Be yourself, everyone else is already taken. Osar Wilde 9 Integralrehnung im Komplexen Das Riemannshe Integral einer komplexwertigen Funktion: Sei f : [a, b] C
Höhere Mathematik Vorlesung 9 Mai 2017 ii Be yourself, everyone else is already taken. Osar Wilde 9 Integralrehnung im Komplexen Das Riemannshe Integral einer komplexwertigen Funktion: Sei f : [a, b] C
Name Charakteristik Beispiele
 hermodynamishe Grundrozesse: Name Charakteristik Beisiele Isohor Isobar Isotherm Isoenergetish ) Isenthal ) Isentro 3) V = onst P = onst = onst U = onst H = onst S = onst Erwärmung oder Abkühlung in festen
hermodynamishe Grundrozesse: Name Charakteristik Beisiele Isohor Isobar Isotherm Isoenergetish ) Isenthal ) Isentro 3) V = onst P = onst = onst U = onst H = onst S = onst Erwärmung oder Abkühlung in festen
Leitfähigkeitsmessungen
 1 Leitfähigkeitsmessungen Ziel des Versuhes Durh Leitfähigkeitsmessungen können Ionenkonzentrationen in Lösungen bis zu sehr geringen Werten (a 1-5 mol l -1 ) bestimmt werden, woraus sih die Anwendbarkeit
1 Leitfähigkeitsmessungen Ziel des Versuhes Durh Leitfähigkeitsmessungen können Ionenkonzentrationen in Lösungen bis zu sehr geringen Werten (a 1-5 mol l -1 ) bestimmt werden, woraus sih die Anwendbarkeit
OBERFLÄCHENAKTIVITÄT. 1. Versuchsplatz. 2. Allgemeines zum Versuch. Komponenten: - Messapparatur - Bechergläser - Pipetten - Messkolben - Laborboy
 Praktikum Teil A und B 10. OBERFLÄCHENAKTIVITÄT Stand 8/05/013 OBERFLÄCHENAKTIVITÄT 1. Versuhsplatz Komponenten: - Messapparatur - Behergläser - Pipetten - Messkolben - Laborboy. Allgemeines zum Versuh
Praktikum Teil A und B 10. OBERFLÄCHENAKTIVITÄT Stand 8/05/013 OBERFLÄCHENAKTIVITÄT 1. Versuhsplatz Komponenten: - Messapparatur - Behergläser - Pipetten - Messkolben - Laborboy. Allgemeines zum Versuh
Das gefaltete Quadrat
 =.? @ / - + Das gefaltete Quadrat Eine Aufgabe aus der Japanishen Tempelgeometrie 21. September 2004 Gegeben sei das Quadrat ABCD mit der Seitenlänge a. Entlang der Linie EF wird das Quadrat gefaltet,
=.? @ / - + Das gefaltete Quadrat Eine Aufgabe aus der Japanishen Tempelgeometrie 21. September 2004 Gegeben sei das Quadrat ABCD mit der Seitenlänge a. Entlang der Linie EF wird das Quadrat gefaltet,
E4: Konduktometrische Messungen
 Grundlagen: Die elektrishe Leitfähigkeit ist ein Maß für die Fähigkeit einer Lösung, elektrishen Strom zu transportieren. Elektrolytlösungen leiten elektrishen Strom durh die Wanderung der Ionen in einem
Grundlagen: Die elektrishe Leitfähigkeit ist ein Maß für die Fähigkeit einer Lösung, elektrishen Strom zu transportieren. Elektrolytlösungen leiten elektrishen Strom durh die Wanderung der Ionen in einem
