Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen V Molkülorbitaltheorie I
|
|
|
- Manuela Seidel
- vor 7 Jahren
- Abrufe
Transkript
1 Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen V Molkülorbitaltheorie I MO-Theorie: Molekülorbitale durch Linearkombinationen von Atomorbitalen (LCAO-Methode: Linear Combination of Atomic Orbitals), bindende-, antibindende-, nichtbindende Molekülorbitale, Molekülorbitaldiagramme Thema heute: Chemische Bindungen VI Molekülorbitaltheorie II, Wasserstoffbrückenbindungen. 179
2 Molekülorbitaldiagramm für das Fluormolekül: 180
3 Molekülorbitaldiagramm für das Sauerstoffmolekül: Im höchst-besetzten MO sind 2 ungepaarte Elektronen Paramagnetismus! Bindungsordnung: BO = ½ [Elektronen (in bindenden MO s) Elektronen (in antibindenden MO s)] Entspricht Anzahl der bindenden Elektronenpaare in Lewis-Formeln 181
4 Molekülorbitaldiagramm für das Distickstoffmolekül: 182
5 Molekülorbitaldiagramm für das Fluorwasserstoffmolekül: bindende antibindende Molekülorbitale nichtbindende 183
6 Molekülorbitaldiagramm für das Wassermolekül: 184
7 Pi-Molekülorbitale des Benzolmoleküls: 185
8 Die Wasserstoff-Brückenbindung Ein Wasserstoffatom in einer polaren Bindung (H-F, H-O, H-N) kann attraktive Wechselwirkungen zu einem Atom eines benachbarten Molekül erfahren, wenn dieses über ein freies Elektronenpaar verfügt (gewöhnlich ein N, O oder F Atom). Die Bindung eines H-Atoms zu einem N-, O- oder F-Atom ist meistens sehr polar! 186
9 Die Eigenschaften von Wasser werden maßgeblich durch Wasserstoffbrückenbindungen bestimmt. 187
10 188
11 Wasserstoffbrückenbindungen führen zu typischen Ketten-, Schicht- und Raumnetzstrukturen Beispiele: Schichtstruktur der Borsäure B(OH) 3 bzw. H 3 BO 3 Raumnetzstruktur von Eis 1 189
12 Im Eis-I liegen über H-Brücken verknüpfte H 2 O-Moleküle vor, die eine weitmaschige, von Hohlräumen durchsetzte Kristallstruktur bilden Dichteanomalie: Eis-I: β-tridymit-struktur, d O-O : 2.76 Å, Winkel (O-O-O): o 190
13 191
14 192
15 Wasserstoff-Brückenbindung Wasserstoffbrücken erhöhen: Schmelztemperatur, Siedetemperatur, Verdampfungsenthalpie, Dipolmoment, elektrische Feldkonstante, Viskosität. Wasserstoffbrücken führen zu typischen Ketten-, Schicht- und Raumnetzstrukturen Beispiele: (außer Wasser bzw. Eis) Fluorwasserstoff, Borsäure, Nucleinsäuren Bindungsenergie einer H-Brücke: ca kj/mol. 193
16 HF kristallin - Zickzackketten linear unsymmetrische Wasserstoffbrücken HF im Gaszustand Vorwiegend (HF) 6 -Ringe 194
17 Die Wasserstoffbrückenbindung zwischen =NH Gruppen und Carbonylgruppen (den Sauerstoffatomen) (C=0) in Amidkristallen ist Å, und deren O H Abstand Å lang. In Proteinen und Nucleinsäuren sind viele Atomgruppen vorhanden, die Wasserstoffbrücken ausbilden können, so z.b. Lysin, Arginin, Histidin oder Glutaminsäure Bei den Nucleinsäuren sind Wasserstoffbrückenbindungen sehr wichtig, da sie die Strukturen der DNA und RNA bestimmen und auch für die molekulare Erkennung und damit die Zellreproduktion regeln. Guanin und Cytosin 195
Themen heute: Komplexchemie-II, Wasserstoffbrückenbindungen, wichtige Begriffe, Reaktionsgleichungen,
 Wiederholung der letzten Vorlesungsstunde: Koordinationsverbindungen / Komplexverbindungen, Liganden, Zentralatom, Koordinationszahl, einzähnige/mehrzähnige Liganden, Nomenklatur, 18- Elektronenregel Themen
Wiederholung der letzten Vorlesungsstunde: Koordinationsverbindungen / Komplexverbindungen, Liganden, Zentralatom, Koordinationszahl, einzähnige/mehrzähnige Liganden, Nomenklatur, 18- Elektronenregel Themen
Modul: Allgemeine Chemie
 Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
Chemie für Biologen WS 2005/6 Arne Lützen Institut für Organische Chemie der Universität Duisburg-Essen (Teil 5: )
 Chemie für Biologen WS 2005/6 Arne Lützen Institut für rganische Chemie der Universität Duisburg-Essen (Teil 5: 23.11.2005) Kovalente Bindung Atome können sich Valenzelektronen unter Ausbildung von Bindungen
Chemie für Biologen WS 2005/6 Arne Lützen Institut für rganische Chemie der Universität Duisburg-Essen (Teil 5: 23.11.2005) Kovalente Bindung Atome können sich Valenzelektronen unter Ausbildung von Bindungen
4.Teil Kovalente Bindung
 4.Teil Kovalente Bindung Lewis-Konzept, Valenstrichformel, Oktettregel Polare Elektronenpaarbindung und Elektronegativität Gebrochene Bindungsordnung und Mesomerie Valenzschalen-Elektronenpaar-Abstoßungsmodell
4.Teil Kovalente Bindung Lewis-Konzept, Valenstrichformel, Oktettregel Polare Elektronenpaarbindung und Elektronegativität Gebrochene Bindungsordnung und Mesomerie Valenzschalen-Elektronenpaar-Abstoßungsmodell
Chemische Bindungen Atombindung
 Atombindung Das Lewis Modell der kovalenten Bindung Bildung von Molekülen (Einfachbindungen) Aus jeweils einem ungepaarten Elektron eines Atoms bildet sich ein gemeinsames Elektronenpaar als Molekülorbital
Atombindung Das Lewis Modell der kovalenten Bindung Bildung von Molekülen (Einfachbindungen) Aus jeweils einem ungepaarten Elektron eines Atoms bildet sich ein gemeinsames Elektronenpaar als Molekülorbital
Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie,
 Wiederholung der letzten Vorlesungsstunde: Thema: Chemische h Bindungen Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie, unterschiedliche Arten chemischer Bindungen, Atombindung, kovalente
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische h Bindungen Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie, unterschiedliche Arten chemischer Bindungen, Atombindung, kovalente
Valenz-Bindungstheorie H 2 : s Ueberlappung von Atomorbitalen s-bindung: 2 Elektronen in einem Orbital zylindrischer Symmetrie
 Valenz-Bindungstheorie Beschreibung von Molekülen mit Hilfe von Orbitalen H H H 2 : H 2 s Ueberlappung von Atomorbitalen s-bindung: 2 Elektronen in einem Orbital zylindrischer Symmetrie um die interatomare
Valenz-Bindungstheorie Beschreibung von Molekülen mit Hilfe von Orbitalen H H H 2 : H 2 s Ueberlappung von Atomorbitalen s-bindung: 2 Elektronen in einem Orbital zylindrischer Symmetrie um die interatomare
Chemische Bindung zweiatomiger Moleküle
 Die Born Oppenheimer Näherung vernachlässigt Elektronenimpulse gegenüber Kernimpulsen und erlaubt die Gesamtwellenfunktion als ein Produkt aus einer Kernwellenfunktion F q ( R) und der einer Elektronenwellenfunktion
Die Born Oppenheimer Näherung vernachlässigt Elektronenimpulse gegenüber Kernimpulsen und erlaubt die Gesamtwellenfunktion als ein Produkt aus einer Kernwellenfunktion F q ( R) und der einer Elektronenwellenfunktion
08.12.2013. Wichtige Stoffgruppen. Stoffgruppe. Atomverband. Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Metall Metall:
 1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter) - Salze Nichtmetall Nichtmetall:
1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter) - Salze Nichtmetall Nichtmetall:
Chemie für Biologen SS Georg Jansen AG Theoretische Organische Chemie Universität Duisburg Essen. (Teil 3: Kovalente Bindungen)
 Chemie für Biologen SS 2007 Georg Jansen AG Theoretische rganische Chemie Universität Duisburg Essen (Teil 3: Kovalente Bindungen) (3) Kovalente Bindung Atome können sich Valenzelektronen unter Ausbildung
Chemie für Biologen SS 2007 Georg Jansen AG Theoretische rganische Chemie Universität Duisburg Essen (Teil 3: Kovalente Bindungen) (3) Kovalente Bindung Atome können sich Valenzelektronen unter Ausbildung
Grundtypen der Bindung. Grundtypen chemischer Bindung. Oktettregel. A.8.1. Atombindung
 Grundtypen der Bindung Grundtypen chemischer Bindung Oktettregel A.8.1. Atombindung 1 A.8.1 Atombindung Valenz (Zahl der Bindungen) Atombindung auch: kovalente Bindung, ElektronenpaarBindung Zwei Atome
Grundtypen der Bindung Grundtypen chemischer Bindung Oktettregel A.8.1. Atombindung 1 A.8.1 Atombindung Valenz (Zahl der Bindungen) Atombindung auch: kovalente Bindung, ElektronenpaarBindung Zwei Atome
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen II
 Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen II Elektronenpaarbindung, Elektronegativität, polare Atombindung, Dipolmoment, Hybridisierung von Atomorbitalen, sp 3 -, sp 2 -, sp-hybridorbitale,
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen II Elektronenpaarbindung, Elektronegativität, polare Atombindung, Dipolmoment, Hybridisierung von Atomorbitalen, sp 3 -, sp 2 -, sp-hybridorbitale,
Oktett-Theorie von Lewis
 Oktett-Theorie von Lewis Oktettregel Atome versuchen durch die Nutzung gemeinsamer Elektronenpaare möglichst ein Elektronenoktett zu erlangen. allgemeiner: Edelgasregel Atome streben durch Vereinigung
Oktett-Theorie von Lewis Oktettregel Atome versuchen durch die Nutzung gemeinsamer Elektronenpaare möglichst ein Elektronenoktett zu erlangen. allgemeiner: Edelgasregel Atome streben durch Vereinigung
Atom-, Molekül- und Festkörperphysik
 Atom-, Molekül- und Festkörperphysik für LAK, SS 2014 Peter Puschnig basierend auf Unterlagen von Prof. Ulrich Hohenester 4. Vorlesung, 27. 3. 2014 Molekülbindung, H2+ - Molekülion, Hybridisierung, Kohlenstoffverbindungen
Atom-, Molekül- und Festkörperphysik für LAK, SS 2014 Peter Puschnig basierend auf Unterlagen von Prof. Ulrich Hohenester 4. Vorlesung, 27. 3. 2014 Molekülbindung, H2+ - Molekülion, Hybridisierung, Kohlenstoffverbindungen
Pentan enthält 12 Atome Wasserstoff, ein Wassermolekül 2 Atome. Es entstehen also 6 Moleküle Wasser:
 VERTIEFUNG Aufstellen und Einrichten von Gleichungen Reaktionsgleichungen fassen eine chemische Reaktion knapp zusammen. Es werden die Edukte (Ausgangsstoffe) angegeben, die in der chemischen Reaktion
VERTIEFUNG Aufstellen und Einrichten von Gleichungen Reaktionsgleichungen fassen eine chemische Reaktion knapp zusammen. Es werden die Edukte (Ausgangsstoffe) angegeben, die in der chemischen Reaktion
Wiederholung der letzten Vorlesungsstunde:
 Wiederholung der letzten Vorlesungsstunde: Chemische Bindungen, starke, schwache Bindungen, Elektronenpaarbindung, bindende und freie Elektronenpaare, Oktettregel, Edelgaskonfiguration, Lewis-Formeln,
Wiederholung der letzten Vorlesungsstunde: Chemische Bindungen, starke, schwache Bindungen, Elektronenpaarbindung, bindende und freie Elektronenpaare, Oktettregel, Edelgaskonfiguration, Lewis-Formeln,
Vorlesung Anorganische Chemie
 Vorlesung Anorganische Chemie Prof. Ingo Krossing WS 2007/08 B.Sc. Chemie Lernziele Block 4 Molekülstruktur Ausnahmen von der Oktettregel Hypervalente Verbindungen VSEPR Hybridisierung Molekülorbitale
Vorlesung Anorganische Chemie Prof. Ingo Krossing WS 2007/08 B.Sc. Chemie Lernziele Block 4 Molekülstruktur Ausnahmen von der Oktettregel Hypervalente Verbindungen VSEPR Hybridisierung Molekülorbitale
2.2 Intermolekulare Wechselwirkungen
 2.2 Intermolekulare Wechselwirkungen -15-2.2 Intermolekulare Wechselwirkungen Die Bildung der hier vorgestellten molekularen Aggregate beruht auf schwachen Wechselwirkungen zwischen Atomen oder Molekülen.
2.2 Intermolekulare Wechselwirkungen -15-2.2 Intermolekulare Wechselwirkungen Die Bildung der hier vorgestellten molekularen Aggregate beruht auf schwachen Wechselwirkungen zwischen Atomen oder Molekülen.
Universität Regensburg
 Universität Regensburg Fakultät für Chemie und Pharmazie Institut für Anorganische Chemie Prof. Dr. R. Winter 93040 Regensburg Musterlösungen Übung 7. 1. Geben Sie an, ob die folgenden Orbitalüberlappungen
Universität Regensburg Fakultät für Chemie und Pharmazie Institut für Anorganische Chemie Prof. Dr. R. Winter 93040 Regensburg Musterlösungen Übung 7. 1. Geben Sie an, ob die folgenden Orbitalüberlappungen
Vom Atom zum Molekül
 Vom Atom zum Molekül Ionenverbindungen Na + Cl NaCl lebensgefährlich giftig lebensgefährlich giftig lebensessentiell Metall + Nichtmetall Salz Beispiel Natriumchlorid Elektronenkonfiguration: 11Na: 1s(2)
Vom Atom zum Molekül Ionenverbindungen Na + Cl NaCl lebensgefährlich giftig lebensgefährlich giftig lebensessentiell Metall + Nichtmetall Salz Beispiel Natriumchlorid Elektronenkonfiguration: 11Na: 1s(2)
Moleküle. Zweiatomige Moleküle: H 2+
 Moleküle Zweiatomige Moleküle: 2+ : zwei Kerne, ein Elektron Der Abstand zwischen den Atomkernen wird so klein gewählt, dass die 1s-Orbitale überlappen und durch Linearkombination Molekülorbitale gebildet
Moleküle Zweiatomige Moleküle: 2+ : zwei Kerne, ein Elektron Der Abstand zwischen den Atomkernen wird so klein gewählt, dass die 1s-Orbitale überlappen und durch Linearkombination Molekülorbitale gebildet
30. Lektion. Moleküle. Molekülbindung
 30. Lektion Moleküle Molekülbindung Lernziel: Moleküle entstehen aus Atomen falls ihre Wellenfunktionen sich derart überlappen, daß die Gesamtenergie abgesenkt wird. Begriffe Begriffe: Kovalente Bindung
30. Lektion Moleküle Molekülbindung Lernziel: Moleküle entstehen aus Atomen falls ihre Wellenfunktionen sich derart überlappen, daß die Gesamtenergie abgesenkt wird. Begriffe Begriffe: Kovalente Bindung
Die chemische Bindung
 Die chemische Bindung Die Valenz-Bond Theorie Molekülorbitale Die Bänder Theorie der Festkörper bei einer ionischen Bindung bildet bildet sich ein Dipol aus ('Übertragung von Elektronen') Eine kovalente
Die chemische Bindung Die Valenz-Bond Theorie Molekülorbitale Die Bänder Theorie der Festkörper bei einer ionischen Bindung bildet bildet sich ein Dipol aus ('Übertragung von Elektronen') Eine kovalente
Lernzielkatalog. Vorlesung: Allgemeine und Anorganische Chemie, Karsten Meyer
 Lernzielkatalog Vorlesung: Allgemeine und Anorganische Chemie, Karsten Meyer Vorlesungen 1-5: 1. Welche vier Elemente findet man am häufigsten im Bereich der Erdkruste, Ozeane und Atmosphäre? 2. Welche
Lernzielkatalog Vorlesung: Allgemeine und Anorganische Chemie, Karsten Meyer Vorlesungen 1-5: 1. Welche vier Elemente findet man am häufigsten im Bereich der Erdkruste, Ozeane und Atmosphäre? 2. Welche
Vorlesung Allgemeine Chemie (CH01)
 Vorlesung Allgemeine Chemie (CH01) Für Studierende im B.Sc.-Studiengang Chemie Prof. Dr. Martin Köckerling Arbeitsgruppe Anorganische Festkörperchemie Mathematisch-Naturwissenschaftliche Fakultät, Institut
Vorlesung Allgemeine Chemie (CH01) Für Studierende im B.Sc.-Studiengang Chemie Prof. Dr. Martin Köckerling Arbeitsgruppe Anorganische Festkörperchemie Mathematisch-Naturwissenschaftliche Fakultät, Institut
Unser Wissen über Atom- und Molekülorbitale wenden wir nun an, um zweiatomige Moleküle der Elemente der 2. Periode zu bilden.
 Additum 6.1 Übersicht und Lernziele Thema Unser Wissen über Atom- und orbitale wenden wir nun an, um zweiatomige e der Elemente der 2. Periode zu bilden. Lernziele 1. Es ist Ihnen möglich, nach dem Studium
Additum 6.1 Übersicht und Lernziele Thema Unser Wissen über Atom- und orbitale wenden wir nun an, um zweiatomige e der Elemente der 2. Periode zu bilden. Lernziele 1. Es ist Ihnen möglich, nach dem Studium
Die Hückel-Theorie (HMO)
 Die ückel-theorie (MO) Voraussetzungen: Rechenregeln für Integrale, Matrizen, Determinanten, LCAO-Methode, Überlappungsintegrale/Erwartungswerte, Dirac-Schreibweise, Ritzquotient, Variationsprinzip, Säkulardeterminante
Die ückel-theorie (MO) Voraussetzungen: Rechenregeln für Integrale, Matrizen, Determinanten, LCAO-Methode, Überlappungsintegrale/Erwartungswerte, Dirac-Schreibweise, Ritzquotient, Variationsprinzip, Säkulardeterminante
Das Lewis-Modell zur Erklärung kovalenter Bindungen
 Das Lewis-Modell zur Erklärung kovalenter Bindungen Erarbeiten Sie sich, innerhalb der Expertengruppe, einen Überblick über das Lewis-Modell zur Erklärung kovalenter Bindungen! Gehen Sie zusätzlich auf
Das Lewis-Modell zur Erklärung kovalenter Bindungen Erarbeiten Sie sich, innerhalb der Expertengruppe, einen Überblick über das Lewis-Modell zur Erklärung kovalenter Bindungen! Gehen Sie zusätzlich auf
Vorlesung Allgemeine Chemie (CH01)
 Vorlesung Allgemeine Chemie (CH01) Für Studierende im B.Sc.-Studiengang Chemie Prof. Dr. Martin Köckerling Arbeitsgruppe Anorganische Festkörperchemie Mathematisch-Naturwissenschaftliche Fakultät, Institut
Vorlesung Allgemeine Chemie (CH01) Für Studierende im B.Sc.-Studiengang Chemie Prof. Dr. Martin Köckerling Arbeitsgruppe Anorganische Festkörperchemie Mathematisch-Naturwissenschaftliche Fakultät, Institut
Übungen zu Physik 2 für Maschinenwesen
 Physikdepartment E13 SS 011 Übungen zu Physik für Maschinenwesen Prof. Dr. Peter Müller-Buschbaum, Dr. Eva M. Herzig, Dr. Volker Körstgens, David Magerl, Markus Schindler, Moritz v. Sivers Vorlesung 1.07.011,
Physikdepartment E13 SS 011 Übungen zu Physik für Maschinenwesen Prof. Dr. Peter Müller-Buschbaum, Dr. Eva M. Herzig, Dr. Volker Körstgens, David Magerl, Markus Schindler, Moritz v. Sivers Vorlesung 1.07.011,
Übungen zur Vorlesung Physikalische Chemie II Lösungsvorschlag zu Blatt 5
 Wintersemester 006 / 007 04.1.006 1. Aufgabe Die Wellenfunktionen unterscheiden sich gar nicht. Während der Lösung der elektronischen Schrödingergleichung werden die Kerne als ruhend betrachtet. Es kommt
Wintersemester 006 / 007 04.1.006 1. Aufgabe Die Wellenfunktionen unterscheiden sich gar nicht. Während der Lösung der elektronischen Schrödingergleichung werden die Kerne als ruhend betrachtet. Es kommt
VL 21 VL Periodensystem VL Röntgenstrahlung VL Homonukleare Moleküle VL Heteronukleare Moleküle
 VL 21 VL 19 20.1. Periodensystem VL 20 21.1. Röntgenstrahlung VL 21 22.1. Homonukleare Moleküle VL 22 23.1. Heteronukleare Moleküle Wim de Boer, Karlsruhe Atome und Moleküle, 02.07.2013 1 Vorlesung 22:
VL 21 VL 19 20.1. Periodensystem VL 20 21.1. Röntgenstrahlung VL 21 22.1. Homonukleare Moleküle VL 22 23.1. Heteronukleare Moleküle Wim de Boer, Karlsruhe Atome und Moleküle, 02.07.2013 1 Vorlesung 22:
Thema heute: Chemische Bindungen, Teil I
 Wiederholung der letzten Vorlesungsstunde: Periodensystem, Anordnung der Elemente nach steigender Ordnungszahl, Hauptgruppen, Nebengruppen, Lanthanoide + Actinoide, Perioden, Döbereiner, Meyer, Medelejew
Wiederholung der letzten Vorlesungsstunde: Periodensystem, Anordnung der Elemente nach steigender Ordnungszahl, Hauptgruppen, Nebengruppen, Lanthanoide + Actinoide, Perioden, Döbereiner, Meyer, Medelejew
Gruppenarbeit : Zwischenmolekulare Kräfte
 Expertengruppe A Zwischenmolekulare Kräfte Allgemeines Zwischenmolekulare Kräfte dürfen nicht mit der Kovalenzbindung verwechselt werden. Bei der Kovalenzbindung geht es um Kräfte innerhalb der Moleküle
Expertengruppe A Zwischenmolekulare Kräfte Allgemeines Zwischenmolekulare Kräfte dürfen nicht mit der Kovalenzbindung verwechselt werden. Bei der Kovalenzbindung geht es um Kräfte innerhalb der Moleküle
Zustände der Elektronen sind Orbitale, die durch 4 Quantenzahlen
 Wiederholung der letzten Vorlesungsstunde: Thema: Das wellenmechanische h Atommodell (Orbitalmodell) ll) Zustände der Elektronen sind Orbitale, die durch 4 Quantenzahlen beschrieben werden, Hauptquantenzahl
Wiederholung der letzten Vorlesungsstunde: Thema: Das wellenmechanische h Atommodell (Orbitalmodell) ll) Zustände der Elektronen sind Orbitale, die durch 4 Quantenzahlen beschrieben werden, Hauptquantenzahl
ORGANISCHE CHEMIE 1. Stoff der 16. Vorlesung: Hybridisierung, Hückel-MO...
 Stoff der 16. Vorlesung: Hybridisierung, Hückel-MO... ORGANISCHE CHEMIE 1 16. Vorlesung, Freitag, 14. Juni 2013 I. Hybridorbitale im Kohlenstoff - Regeln für Wechselwirkung von Orbitalen - σ und π MO s
Stoff der 16. Vorlesung: Hybridisierung, Hückel-MO... ORGANISCHE CHEMIE 1 16. Vorlesung, Freitag, 14. Juni 2013 I. Hybridorbitale im Kohlenstoff - Regeln für Wechselwirkung von Orbitalen - σ und π MO s
Vorgehen bei der qualitativen Analyse. Nachweisreaktion. Nachweisreaktionen. molekular gebauter Stoffe
 Vorgehen bei der qualitativen Analyse 1. Vorprobe liefert Hinweise auf die mögliche Zusammensetzung der Probe ; Bsp. Flammenfärbung 2. Blindprobe zeigt aus Aussehen der Nachweisreagenzien; Vergleichsprobe
Vorgehen bei der qualitativen Analyse 1. Vorprobe liefert Hinweise auf die mögliche Zusammensetzung der Probe ; Bsp. Flammenfärbung 2. Blindprobe zeigt aus Aussehen der Nachweisreagenzien; Vergleichsprobe
2. Linear Combination of Atomic Orbitals
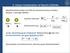 . Linear Combination of Atomi Orbitals Molekülorbitale werden mit ilfe des Variationsansatzes erhalten. Beispiel: -atomiges Molekül Atom, ϕ Atom, ϕ amilton-operator: Orthonormierung: ˆ ϕ El. Atom ϕ = =
. Linear Combination of Atomi Orbitals Molekülorbitale werden mit ilfe des Variationsansatzes erhalten. Beispiel: -atomiges Molekül Atom, ϕ Atom, ϕ amilton-operator: Orthonormierung: ˆ ϕ El. Atom ϕ = =
Grundlagen des Periodensystems der Elemente
 Aus der regelmäßigen Wiederholung ähnlicher Eigenschaften der Elemente leitete Mendelejew das Gesetz der Periodizität ab. Diese Periodizität liegt im Aufbau der Atomhülle begründet. Atomradius Als Atomradius
Aus der regelmäßigen Wiederholung ähnlicher Eigenschaften der Elemente leitete Mendelejew das Gesetz der Periodizität ab. Diese Periodizität liegt im Aufbau der Atomhülle begründet. Atomradius Als Atomradius
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Biologie Arbeitsblätter mit Lösungen - Biochemie
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Biologie Arbeitsblätter mit Lösungen - Biochemie Das komplette Material finden Sie hier: Download bei School-Scout.de B201 LÖSUNG:
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Biologie Arbeitsblätter mit Lösungen - Biochemie Das komplette Material finden Sie hier: Download bei School-Scout.de B201 LÖSUNG:
Übungsaufgaben zur Vorlesung Chemie für Biologen, WS 2005/2006
 Übungsaufgaben zur Vorlesung hemie für Biologen, WS 2005/2006 Themenbereiche Atombau, chemische Bindung, Stöchiometrie, Aggregatzustände 1. Ergänzen Sie folgende Tabelle: Symbol Z M Protonen eutronen Elektronen
Übungsaufgaben zur Vorlesung hemie für Biologen, WS 2005/2006 Themenbereiche Atombau, chemische Bindung, Stöchiometrie, Aggregatzustände 1. Ergänzen Sie folgende Tabelle: Symbol Z M Protonen eutronen Elektronen
1) Welche Aussagen über die Hauptgruppenelemente im Periodensystem sind richtig?
 1) Welche Aussagen über die Hauptgruppenelemente im Periodensystem sind richtig? 1) Es sind alles Metalle. 2) In der äußeren Elektronenschale werden s- bzw. s- und p-orbitale aufgefüllt. 3) Sie stimmen
1) Welche Aussagen über die Hauptgruppenelemente im Periodensystem sind richtig? 1) Es sind alles Metalle. 2) In der äußeren Elektronenschale werden s- bzw. s- und p-orbitale aufgefüllt. 3) Sie stimmen
VL 22 VL Periodensystem VL Röntgenstrahlung VL Homonukleare Moleküle VL Heteronukleare Moleküle
 VL 22 VL 20 20.1. Periodensystem VL 21 21.1. Röntgenstrahlung VL 22 22.1. Homonukleare Moleküle VL 23 23.1. Heteronukleare Moleküle Wim de Boer, Karlsruhe Atome und Moleküle, 10.07.2012 1 Vorlesung 22:
VL 22 VL 20 20.1. Periodensystem VL 21 21.1. Röntgenstrahlung VL 22 22.1. Homonukleare Moleküle VL 23 23.1. Heteronukleare Moleküle Wim de Boer, Karlsruhe Atome und Moleküle, 10.07.2012 1 Vorlesung 22:
Universität Regensburg
 Universität Regensburg Fakultät für Chemie und Pharmazie 93040 Regensburg 14. März 2006 Institut für Anorganische Chemie Prof. Dr. R. Winter 1. Was besagt das Moseleysche Gesetz? Welche Größe kann man
Universität Regensburg Fakultät für Chemie und Pharmazie 93040 Regensburg 14. März 2006 Institut für Anorganische Chemie Prof. Dr. R. Winter 1. Was besagt das Moseleysche Gesetz? Welche Größe kann man
1.1 Darstellung organischer Verbindungen
 1 Lösung 1 AC/OC I, HS 2017 1.1 Darstellung organischer Verbindungen Organische Verbindungen können auf verschiedene Weise dargestellt werden. Ergänzen Sie die untenstehenden Beispiele von Harnstoff, Ethylenglykol
1 Lösung 1 AC/OC I, HS 2017 1.1 Darstellung organischer Verbindungen Organische Verbindungen können auf verschiedene Weise dargestellt werden. Ergänzen Sie die untenstehenden Beispiele von Harnstoff, Ethylenglykol
Die chemische Bindung: Erklärt was die Atome in den Atomverbänden zusammenhält. A. Soi
 Die chemische Bindung: Erklärt was die Atome in den Atomverbänden zusammenhält. A. Soi 2017 18 187 Tip II: Wie gelange ich von der Molekülformel zur Lewis Formel? Das Bauprinzip von Molekülen. i) Ein Zentralatom,
Die chemische Bindung: Erklärt was die Atome in den Atomverbänden zusammenhält. A. Soi 2017 18 187 Tip II: Wie gelange ich von der Molekülformel zur Lewis Formel? Das Bauprinzip von Molekülen. i) Ein Zentralatom,
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Wechselwirkungen zwischen Atomen Was bisher geschah Quantenmechanisches
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Wechselwirkungen zwischen Atomen Was bisher geschah Quantenmechanisches
1. Struktur und Bindung organischer Moleküle (Siehe Kapitel 6. in Allgemeine Chemie B, I. Teil)
 Tuesday, January 30, 2001 Allgemeine Chemie B II. Kapitel 1 Page: 1 Inhalt Index 1. Struktur und Bindung organischer Moleküle (Siehe Kapitel 6. in Allgemeine Chemie B, I. Teil) 1.1 Atomstruktur Die Ordnungszahl
Tuesday, January 30, 2001 Allgemeine Chemie B II. Kapitel 1 Page: 1 Inhalt Index 1. Struktur und Bindung organischer Moleküle (Siehe Kapitel 6. in Allgemeine Chemie B, I. Teil) 1.1 Atomstruktur Die Ordnungszahl
Chemie für Biologen. Vorlesung im. WS 2004/05 V2, Mi 10-12, S04 T01 A02. Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen
 Chemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen (Teil 2: 20.10.2004) MILESS: Chemie für Biologen 24 Aufbau
Chemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen (Teil 2: 20.10.2004) MILESS: Chemie für Biologen 24 Aufbau
Übungsaufgaben Serie 5 Chemie WS09/10
 Übungsaufgaben Serie 5 Chemie WS09/10 Dr. M. Presselt 1) Wie lautet Döbereiners Triadenregel? Welche der folgenden Elemente bilden Triaden: Si, P, S, As, Te, Sb, Na, Li, K, Ca, Sr, Ba? Elemente, die ein
Übungsaufgaben Serie 5 Chemie WS09/10 Dr. M. Presselt 1) Wie lautet Döbereiners Triadenregel? Welche der folgenden Elemente bilden Triaden: Si, P, S, As, Te, Sb, Na, Li, K, Ca, Sr, Ba? Elemente, die ein
Organische Chemie. Kapitel 1. Organic Chemistry 4 th Edition Paula Yurkanis Bruice. Organische Verbindungen enthalten Kohlenstoff
 rganic Chemistry 4 th Edition Paula Yurkanis Bruice Kapitel 1 Elektronische Struktur und Bindung Säuren und Basen rganische Chemie rganische Verbindungen enthalten Kohlenstoff Kohlenstoff ist weder ein
rganic Chemistry 4 th Edition Paula Yurkanis Bruice Kapitel 1 Elektronische Struktur und Bindung Säuren und Basen rganische Chemie rganische Verbindungen enthalten Kohlenstoff Kohlenstoff ist weder ein
Mehratomige Molek ule
 Wir wollen jetzt eine sehr einfache Theorie entwickeln, um die Bindung in Molekülen mit mehr als zwei Atomen zu verstehen Dazu müssen wir den Aufbau von komplexeren n wie π oder δ-n verstehen Wir wissen
Wir wollen jetzt eine sehr einfache Theorie entwickeln, um die Bindung in Molekülen mit mehr als zwei Atomen zu verstehen Dazu müssen wir den Aufbau von komplexeren n wie π oder δ-n verstehen Wir wissen
Posten 1a. Wie sieht das Kugelwolkenmodell aus von einem Sauerstoffatom? Antworten: a) (=> Posten 9o) b) (=> Posten 16l) c) (=> Posten 8k)
 Posten 1a Wie sieht das Kugelwolkenmodell aus von einem Sauerstoffatom? a) (=> Posten 9o) b) (=> Posten 16l) c) (=> Posten 8k) d) (=> Posten 13f) Posten 1d Welcher der beiden Stoffe hat den tieferen Siedepunkt?
Posten 1a Wie sieht das Kugelwolkenmodell aus von einem Sauerstoffatom? a) (=> Posten 9o) b) (=> Posten 16l) c) (=> Posten 8k) d) (=> Posten 13f) Posten 1d Welcher der beiden Stoffe hat den tieferen Siedepunkt?
Grundlagen der Chemie Die Atombindung Kovalente Bindungen
 Die Atombindung Kovalente Bindungen Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu Kovalente Bindungen In einem
Die Atombindung Kovalente Bindungen Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu Kovalente Bindungen In einem
Prof. Christoffers, Vorlesung Organische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler
 Prof. hristoffers, Vorlesung Organische hemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 1. inführung 1.1 Atomorbitale Die Atome im Molekülverband werden durch lektronen
Prof. hristoffers, Vorlesung Organische hemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 1. inführung 1.1 Atomorbitale Die Atome im Molekülverband werden durch lektronen
Da Atome viele ununterscheidbare Elektronen besitzen, sind ihre Zustände durch interelektronische Coulomb- und Austausch-Wechselwirkungen bestimmt.
 12 Moleküle Slide 267 Vorbemerkungen Da Atome viele ununterscheidbare Elektronen besitzen, sind ihre Zustände durch interelektronische Coulomb- und Austausch-Wechselwirkungen bestimmt. Je 2 Elektronen
12 Moleküle Slide 267 Vorbemerkungen Da Atome viele ununterscheidbare Elektronen besitzen, sind ihre Zustände durch interelektronische Coulomb- und Austausch-Wechselwirkungen bestimmt. Je 2 Elektronen
Welche Arten von Formeln stehen dem Chemiker zur Verfügung?
 Welche Arten von Formeln stehen dem Chemiker zur Verfügung? 1. Summenformeln 2. Valenzstrichformeln (Lewis-Strichformeln) 3. Strukturformeln Summenformel: Die Summenformel dient dazu Art und Anzahl der
Welche Arten von Formeln stehen dem Chemiker zur Verfügung? 1. Summenformeln 2. Valenzstrichformeln (Lewis-Strichformeln) 3. Strukturformeln Summenformel: Die Summenformel dient dazu Art und Anzahl der
1. Bedeutung der Oxidationszahlen
 1. Bedeutung der Oxidationszahlen Unterschiedliche Atome geben eine unterschiedliche Zahl an Elektronen ab: Dann hat das Atom eine positive Oxidationsstufe; das Atom ist mit weniger Elektronen als Protonen
1. Bedeutung der Oxidationszahlen Unterschiedliche Atome geben eine unterschiedliche Zahl an Elektronen ab: Dann hat das Atom eine positive Oxidationsstufe; das Atom ist mit weniger Elektronen als Protonen
3. Wieviel bindig sind folgende Elemente in kovalenten Bindungen? Einige Elemente können auch verschiedene Bindigkeiten zeigen
 Übungen zur VL Chemie für Biologen und umanbiologen 26. 11.2010 1. ennen Sie mindestens 2 Arten der chemischen Bindungen und geben Sie je 2 Beispielverbindungen dafür an (Strukturformel). 1) Ionische Bindung:
Übungen zur VL Chemie für Biologen und umanbiologen 26. 11.2010 1. ennen Sie mindestens 2 Arten der chemischen Bindungen und geben Sie je 2 Beispielverbindungen dafür an (Strukturformel). 1) Ionische Bindung:
Chemische Bindung. Ionenbindung (heteropolare Bindung) kovalente Bindung van-der-waals-bindung Metallbindung
 Chemische Bindung Ionenbindung (heteropolare Bindung) kovalente Bindung van-der-waals-bindung Metallbindung 1 Was sind Ionen? Ein Ion besteht aus einem oder mehreren Atomen und hat elektrische Ladung Kationen
Chemische Bindung Ionenbindung (heteropolare Bindung) kovalente Bindung van-der-waals-bindung Metallbindung 1 Was sind Ionen? Ein Ion besteht aus einem oder mehreren Atomen und hat elektrische Ladung Kationen
Chemische Bindungen Atombindung
 Atombindung Das Lewis Modell der kovalenten Bindung Die Entstehung von Molekülen beruht auf der Bildung von gemeinsamen, bindenden Elektronenpaaren in dem Bestreben der Atome, eine energetisch stabile
Atombindung Das Lewis Modell der kovalenten Bindung Die Entstehung von Molekülen beruht auf der Bildung von gemeinsamen, bindenden Elektronenpaaren in dem Bestreben der Atome, eine energetisch stabile
4.2 Kovalente Bindung. Theorie der kovalenten Bindung, Gilbert Newton Lewis (1916)
 4.2 Kovalente Bindung Theorie der kovalenten Bindung, Gilbert Newton Lewis (1916) Treten Atome von Nichtmetallen miteinander in Wechselwirkung, kommt es nicht zu einer Übertragung von Elektronen. Nichtmetallatome
4.2 Kovalente Bindung Theorie der kovalenten Bindung, Gilbert Newton Lewis (1916) Treten Atome von Nichtmetallen miteinander in Wechselwirkung, kommt es nicht zu einer Übertragung von Elektronen. Nichtmetallatome
Übungen Mi 8:15-9:45, Raum 24B, W. Francke Mi 8:15-9:45, Raum 520, S.S. Do 9:30-11:00, Raum 24B, V. Vill Di 9:30-11:00, Raum 325, M.
 0. Vorbemerkungen 0.0 Einteilung der Gruppen, Termine Vorlesung Di 11-12 Hörsaal A, Beginn 03.04.2001 Do 11-13 Hörsaal A, Ende 12.07.2001 Übungen Hauptfach I: Hauptfach II: Nebenfach I: Nebenfach II: Mi
0. Vorbemerkungen 0.0 Einteilung der Gruppen, Termine Vorlesung Di 11-12 Hörsaal A, Beginn 03.04.2001 Do 11-13 Hörsaal A, Ende 12.07.2001 Übungen Hauptfach I: Hauptfach II: Nebenfach I: Nebenfach II: Mi
10. Chemische Bindung
 10. Chemische Bindung 10.1 Hybridisierung 10.2 Massenwirkungsgesetz 10.1 van de Waals Bindung van de Waals-Wechselwirkung wirkt zwischen neutralen inerten Atomen/Molekülen (z.b. Edelgas- Atome) ohne permanentes
10. Chemische Bindung 10.1 Hybridisierung 10.2 Massenwirkungsgesetz 10.1 van de Waals Bindung van de Waals-Wechselwirkung wirkt zwischen neutralen inerten Atomen/Molekülen (z.b. Edelgas- Atome) ohne permanentes
0.6 Einfache Modelle der chemischen Bindung
 0.6 Einfache Modelle der chemischen Bindung Ionenbindung Ionenbindungen entstehen durch Reaktion von ausgeprägt metallischen Elementen (Alkalimetalle und Erdalkalimetalle mit geringer Ionisierungsenergie)
0.6 Einfache Modelle der chemischen Bindung Ionenbindung Ionenbindungen entstehen durch Reaktion von ausgeprägt metallischen Elementen (Alkalimetalle und Erdalkalimetalle mit geringer Ionisierungsenergie)
Vorlesung 20+21: Folien auf dem Web:
 Vorlesung 20+21: Roter Faden: Mehratomige Moleküle Folien auf dem Web: http://www-ekp.physik.uni-karlsruhe.de/~deboer/ Siehe auch: http://www.wmi.badw.de/teaching/lecturenotes/index.html und Alonso-Finn:
Vorlesung 20+21: Roter Faden: Mehratomige Moleküle Folien auf dem Web: http://www-ekp.physik.uni-karlsruhe.de/~deboer/ Siehe auch: http://www.wmi.badw.de/teaching/lecturenotes/index.html und Alonso-Finn:
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Organisatorisches Kurs-Skript http://www.uni-due.de/ adb297b
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Organisatorisches Kurs-Skript http://www.uni-due.de/ adb297b
Vorlesung 20+21: Folien auf dem Web:
 Vorlesung 20+21: Roter Faden: Mehratomige Moleküle Folien auf dem Web: http://www-ekp.physik.uni-karlsruhe.de/~deboer/ Siehe auch: http://www.wmi.badw.de/teaching/lecturenotes/index.html und Alonso-Finn:
Vorlesung 20+21: Roter Faden: Mehratomige Moleküle Folien auf dem Web: http://www-ekp.physik.uni-karlsruhe.de/~deboer/ Siehe auch: http://www.wmi.badw.de/teaching/lecturenotes/index.html und Alonso-Finn:
Chemie für Bauingenieure Uebung 2
 Chemie für Bauingenieure Uebung 2 Aufgabe 1 i. Bestimmen Sie mithilfe des Periodensystems für folgende Elemente die Anzahl Elektronen, Protonen und Neutronen. ii. Bestimmen Sie dann für die jeweiligen
Chemie für Bauingenieure Uebung 2 Aufgabe 1 i. Bestimmen Sie mithilfe des Periodensystems für folgende Elemente die Anzahl Elektronen, Protonen und Neutronen. ii. Bestimmen Sie dann für die jeweiligen
Die 3 Stoffklassen der Elemente
 Die Art der Bindung hängt davon ab, wie stark die Atome ihre Valenzelektronen anziehen. Elektronegativität (Abb. 17, S. 114) Qualitative Angabe, wie stark die Atomrümpfe die Elektronen in der Valenzschale
Die Art der Bindung hängt davon ab, wie stark die Atome ihre Valenzelektronen anziehen. Elektronegativität (Abb. 17, S. 114) Qualitative Angabe, wie stark die Atomrümpfe die Elektronen in der Valenzschale
(2.65 ev), da sich die beiden Elektronen gegenseitig abstossen.
 phys4.026 Page 1 13.8 Das Wasserstoff-Molekül Wie im Fall des H2 + Moleküls führen im H2 Molekül symmetrische Wellenfunktionen zu bindenden Zuständen, wohingegen anti-symmetrische Wellenfunktionen zu anti-bindenden
phys4.026 Page 1 13.8 Das Wasserstoff-Molekül Wie im Fall des H2 + Moleküls führen im H2 Molekül symmetrische Wellenfunktionen zu bindenden Zuständen, wohingegen anti-symmetrische Wellenfunktionen zu anti-bindenden
Übungen zur VL Chemie für Biologen und Humanbiologen Diese Aufgaben werden in der Übung besprochen.
 Übungen zur VL Chemie für Biologen und umanbiologen 03.10.2010 Diese Aufgaben werden in der Übung besprochen. Die Geometrie organischer Verbindungen 1. Welche Form hat ein s-orbital? Welche Form haben
Übungen zur VL Chemie für Biologen und umanbiologen 03.10.2010 Diese Aufgaben werden in der Übung besprochen. Die Geometrie organischer Verbindungen 1. Welche Form hat ein s-orbital? Welche Form haben
3.1. Molekulare Bindungen
 3.1. Molekulare Bindungen Fragestellungen in der Molekülphysik: Warum und wann verbinden sich neutrale Atome zu Molekülen? Wie sehen die Energieniveaus von Molekülen aus (z.b. auch unter Berücksichtigung
3.1. Molekulare Bindungen Fragestellungen in der Molekülphysik: Warum und wann verbinden sich neutrale Atome zu Molekülen? Wie sehen die Energieniveaus von Molekülen aus (z.b. auch unter Berücksichtigung
Grundlagen der Chemie Allgemeine Chemie Teil 2
 Allgemeine Chemie Teil 2 Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu AO-Theorie Wellenmechanik So wie Licht
Allgemeine Chemie Teil 2 Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu AO-Theorie Wellenmechanik So wie Licht
42 02528 Zwischenmolekulare Bindungen Arbeitsvideo/4 Kurzfilme 18 min, Farbe
 42 02528 Zwischenmolekulare Bindungen: Arbeitsvideo / 4 Kurzfilme Seite 1 42 02528 Zwischenmolekulare Bindungen Arbeitsvideo/4 Kurzfilme 18 min, Farbe 1 Wasserstoffbrückenbindung 5,5 min 2 Aggregatzustandwechsel
42 02528 Zwischenmolekulare Bindungen: Arbeitsvideo / 4 Kurzfilme Seite 1 42 02528 Zwischenmolekulare Bindungen Arbeitsvideo/4 Kurzfilme 18 min, Farbe 1 Wasserstoffbrückenbindung 5,5 min 2 Aggregatzustandwechsel
Reaktionstypen der Aliphate
 Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
1 Einleitung. Einleitung 1
 Einleitung 1 1 Einleitung Die Supramolekulare Chemie ist die Chemie der intermolekularen Bindung. Sie beschäftigt sich mit Strukturen und Funktionen von Einheiten, die durch Assoziation zweier oder mehrerer
Einleitung 1 1 Einleitung Die Supramolekulare Chemie ist die Chemie der intermolekularen Bindung. Sie beschäftigt sich mit Strukturen und Funktionen von Einheiten, die durch Assoziation zweier oder mehrerer
VERTIEFUNG. Die Funktionsweise einer Brennstoffzelle
 Die Funktionsweise einer Brennstoffzelle VERTIEFUNG Die folgenden Abbildungen sollen dir helfen, die Vorgänge zu verstehen, die in der Brennstoffzelle ablaufen. Arbeitsauftrag: Beschreibe jeweils die dargestellten
Die Funktionsweise einer Brennstoffzelle VERTIEFUNG Die folgenden Abbildungen sollen dir helfen, die Vorgänge zu verstehen, die in der Brennstoffzelle ablaufen. Arbeitsauftrag: Beschreibe jeweils die dargestellten
2.3 Intermolekulare Anziehungskräfte und Molekülkristalle
 2.3 Intermolekulare Anziehungskräfte und Molekülkristalle Kinetische Energie der Moleküle / Aggregatzustand Bau und Struktur der Moleküle Intermolekulare Anziehungskräfte Kräfte zwischen Molekülen Van-der-Waals-Kräfte
2.3 Intermolekulare Anziehungskräfte und Molekülkristalle Kinetische Energie der Moleküle / Aggregatzustand Bau und Struktur der Moleküle Intermolekulare Anziehungskräfte Kräfte zwischen Molekülen Van-der-Waals-Kräfte
1.4. Die Darstellung von Strukturen
 1 Elektronenstruktur und Bindung Säuren und Basen 3D-Moleküle: Li, 2, F zieht positive Ladungen an rot orange gelb grün blau zieht negative Ladungen an stärkstes negatives elektrostatisches Potenzial stärkstes
1 Elektronenstruktur und Bindung Säuren und Basen 3D-Moleküle: Li, 2, F zieht positive Ladungen an rot orange gelb grün blau zieht negative Ladungen an stärkstes negatives elektrostatisches Potenzial stärkstes
Kinetische Energie der Moleküle / Aggregatzustand
 2.3 Intermolekulare Anziehungskräfte und Molekülkristalle Kräfte zwischen Molekülen - Van-der-Waals-Kräfte Orientierungskräfte bzw. Dipol-Dipol-Kräfte Induktionskräfte bzw. induzierte Dipole Dispersionskräfte
2.3 Intermolekulare Anziehungskräfte und Molekülkristalle Kräfte zwischen Molekülen - Van-der-Waals-Kräfte Orientierungskräfte bzw. Dipol-Dipol-Kräfte Induktionskräfte bzw. induzierte Dipole Dispersionskräfte
5 Elektronenübergänge im Festkörper
 5 Elektronenübergänge im Festkörper 5.1 Übersicht und Lernziele Übersicht Die Bindung in einem Molekül erfolgt durch gemeinsame Elektronenpaare, die jeweils zwei Atomen angehören (Atombindung, Elektronenpaarbindung).
5 Elektronenübergänge im Festkörper 5.1 Übersicht und Lernziele Übersicht Die Bindung in einem Molekül erfolgt durch gemeinsame Elektronenpaare, die jeweils zwei Atomen angehören (Atombindung, Elektronenpaarbindung).
Ausarbeitung zum Theoretischen Seminar
 Ausarbeitung zum Theoretischen Seminar Kovalente Molekübindungen 28.01.2015 Robin.Stegmueller@googlemail.com Inhaltsverzeichnis 1 Einführung 1 1.1 Molekulare Bindungen......................... 1 1.2 Beispiel:
Ausarbeitung zum Theoretischen Seminar Kovalente Molekübindungen 28.01.2015 Robin.Stegmueller@googlemail.com Inhaltsverzeichnis 1 Einführung 1 1.1 Molekulare Bindungen......................... 1 1.2 Beispiel:
Übungen zur VL Chemie für Biologen und Humanbiologen 18.11.2011 Lösung Übung 3
 Übungen zur VL Chemie für Biologen und Humanbiologen 18.11.2011 Lösung Übung 3 Teil 1: Die Geometrie organischer Verbindungen 1. Welche Form hat ein s-orbital? Welche Form haben p-orbitale? Skizzieren
Übungen zur VL Chemie für Biologen und Humanbiologen 18.11.2011 Lösung Übung 3 Teil 1: Die Geometrie organischer Verbindungen 1. Welche Form hat ein s-orbital? Welche Form haben p-orbitale? Skizzieren
TC1 Grundlagen der Theoretischen Chemie
 TC1 Grundlagen der Theoretischen Chemie Irene Burghardt (burghardt@chemie.uni-frankfurt.de) Praktikumsbetreuung: Sarah Römer (roemer@em.uni-frankfurt.de) Simona Scheit (simona.scheit@googlemail.com) Juanma
TC1 Grundlagen der Theoretischen Chemie Irene Burghardt (burghardt@chemie.uni-frankfurt.de) Praktikumsbetreuung: Sarah Römer (roemer@em.uni-frankfurt.de) Simona Scheit (simona.scheit@googlemail.com) Juanma
22. Chemische Bindungen
 .05.03. Chemische Bindungen Molekül: System aus zwei oder mehr Atomen Kleinste Einheit einer Substanz, die deren chemische Eigenschaften ausweist Quantenmechanisches Vielteilchensystem: Exakte explizite
.05.03. Chemische Bindungen Molekül: System aus zwei oder mehr Atomen Kleinste Einheit einer Substanz, die deren chemische Eigenschaften ausweist Quantenmechanisches Vielteilchensystem: Exakte explizite
UNIVERSITÄT GREIFSWALD. Mathematisch-Naturwissenschaftliche Fakultät INSTITUT FÜR BIOCHEMIE. Arbeitskreis Biophysikalische Chemie
 UNIVERSITÄT GREIFSWALD Mathematisch-Naturwissenschaftliche Fakultät INSTITUT FÜR BIOCHEMIE Arbeitskreis Biophysikalische Chemie Prof. Dr. Walter Langel Modelle für elektronische Zustände Einfachstes klassisches
UNIVERSITÄT GREIFSWALD Mathematisch-Naturwissenschaftliche Fakultät INSTITUT FÜR BIOCHEMIE Arbeitskreis Biophysikalische Chemie Prof. Dr. Walter Langel Modelle für elektronische Zustände Einfachstes klassisches
Eigenschaften von Elementarteilchen
 Eigenschaften von Elementarteilchen Elementarteilchen Masse (absolut) [kg] Ladung [C] [e] Radius [m] Dichte [g cm -3 ] Elektron 9.109534 10-31 -1.602189 10-19 -1 < 10-19 sehr hoch Proton 1.672649 10-27
Eigenschaften von Elementarteilchen Elementarteilchen Masse (absolut) [kg] Ladung [C] [e] Radius [m] Dichte [g cm -3 ] Elektron 9.109534 10-31 -1.602189 10-19 -1 < 10-19 sehr hoch Proton 1.672649 10-27
Thema heute: Chemische Bindungen - Ionenbindung
 Wiederholung der letzten Vorlesungsstunde: Chemische Bindungen, Doppelbindungsregel, VSEPR-Theorie Thema heute: Chemische Bindungen - Ionenbindung Vorlesung Allgemeine Chemie, Prof. Dr. Martin Köckerling
Wiederholung der letzten Vorlesungsstunde: Chemische Bindungen, Doppelbindungsregel, VSEPR-Theorie Thema heute: Chemische Bindungen - Ionenbindung Vorlesung Allgemeine Chemie, Prof. Dr. Martin Köckerling
1.3. Periodensystem der Elemente
 1.3. Periodensystem der Elemente Anordnung der Elemente Periodizität von Eigenschaften Folie Nr. 1 Anordnung der Elemente Historie: Johann Wolfgang Döbereiner (dt. Pharmazeut, 1780-1849) Döberreiners Triadenregel
1.3. Periodensystem der Elemente Anordnung der Elemente Periodizität von Eigenschaften Folie Nr. 1 Anordnung der Elemente Historie: Johann Wolfgang Döbereiner (dt. Pharmazeut, 1780-1849) Döberreiners Triadenregel
Schrödinger-Gleichung
 Schrödinger-Gleichung abgeleitet aus Teilchen-Welle-Dualismus (de Broglie) Ψ = Ε Ψ Der amiltonian enthält kinetische und potentielle Energie aller Teilchen wirkt auf die Wellenfunktion Ψ. Ψ 2 beschreibt
Schrödinger-Gleichung abgeleitet aus Teilchen-Welle-Dualismus (de Broglie) Ψ = Ε Ψ Der amiltonian enthält kinetische und potentielle Energie aller Teilchen wirkt auf die Wellenfunktion Ψ. Ψ 2 beschreibt
Anorganische Peroxide und Radikale. von Benjamin Scharbert
 Anorganische Peroxide und Radikale von Benjamin Scharbert Inhalt: 1. Anorganische Peroxide: 2. Radikale: 1.1 Grundsätzliches 1.2 Na 2 O 2 1.3 BaO 2 1.4 H 2 O 2 2.1 Grundsätzliches 2.2 Sauerstoff 2.3 Stickstoffmonoxid
Anorganische Peroxide und Radikale von Benjamin Scharbert Inhalt: 1. Anorganische Peroxide: 2. Radikale: 1.1 Grundsätzliches 1.2 Na 2 O 2 1.3 BaO 2 1.4 H 2 O 2 2.1 Grundsätzliches 2.2 Sauerstoff 2.3 Stickstoffmonoxid
2. VD, BSc. Anorganische Chemie II Herbst 2005 R. Nesper, G. Patzke. Punktgruppenbestimmung (6 Punkte)
 2. VD, BSc. Anorganische Chemie II Herbst 2005 R. Nesper, G. Patzke Aufgabe 1 Punktgruppenbestimmung (6 Punkte) Bestimmen Sie die Punktgruppensymmetrie für die folgenden Moleküle. (a): C 3 (b): C 2v (c):
2. VD, BSc. Anorganische Chemie II Herbst 2005 R. Nesper, G. Patzke Aufgabe 1 Punktgruppenbestimmung (6 Punkte) Bestimmen Sie die Punktgruppensymmetrie für die folgenden Moleküle. (a): C 3 (b): C 2v (c):
Wiederholung der letzten Vorlesungsstunde:
 Wiederholung der letzten Vorlesungsstunde: Hybridisierung, sp3-hybridorbitale, Tetraeder, sp2-hybridorbitale: Dreieck, sp- Hybridorbitale: lineare Anordnung, Oktetterweiterung, Mesomerie/Resonanz Thema
Wiederholung der letzten Vorlesungsstunde: Hybridisierung, sp3-hybridorbitale, Tetraeder, sp2-hybridorbitale: Dreieck, sp- Hybridorbitale: lineare Anordnung, Oktetterweiterung, Mesomerie/Resonanz Thema
Vorlesung Anorganische Chemie
 Vorlesung Anorganische Chemie Prof. Ingo Krossing WS 2007/08 B.Sc. Chemie Nur zur Information: So So würden die f-orbitale räumlich aussehen 1 Lernziele Block 3 Atom-Eigenschaften Eigenschaften Ionisierungsenergie
Vorlesung Anorganische Chemie Prof. Ingo Krossing WS 2007/08 B.Sc. Chemie Nur zur Information: So So würden die f-orbitale räumlich aussehen 1 Lernziele Block 3 Atom-Eigenschaften Eigenschaften Ionisierungsenergie
