Kombinierte Übungen zur Spektroskopie Beispiele für die Bearbeitung
|
|
|
- Rudolf Adler
- vor 7 Jahren
- Abrufe
Transkript
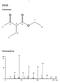
1 Im folgenden soll gezeigt werden, daß es großen Spaß macht, spektroskopische Probleme zu lösen. Es gibt kein automatisches Lösungsschema, sondern höchstens Strategien, wie beim "Puzzle Lösen"; häufig hilft auch die Intuition. Wie beim Anlegen eines Teiles beim Puzzle es könnte passen oder es paßt auf keinen Fall geht man auch bei der Spektroskopie vor: Man sucht sich erst sichere "Ecken " und "Kantenstücke" und arbeitet sich langsam auf das Ziel zu. Wenn z.b. die Form der Teile paßt, ist dies noch kein Beweis dafür, daß es die richtige Lösung ist. Wenn die Teile z.b. in der Form nicht passen, ist es jedoch ein Beweis dafür, daß es so nicht richtig ist. Beispiel : Problem r. 58 A. Qualitative und quantitative Analyse: hierzu werten wir die obere Zeile des Problems aus.. Quantitative Analyse: : % :.8 % : enthält:,,. Berechnung der kompletten Zusamensetzung Berechnung des Sauerstoffanteils. Da die Substanz außer den Elementen und nur enthält, kann man den relativen Anteil an aus der Differenz zu 00 % ermitteln. In unserem Fall : % 00 ( ) 22.9 % % 00 % (% + % ) 2. Berechnung der Verhältnisdformel un kann man als nächsten Schritt auf dem Weg zur Summenformel das Verhältnis der, und Atomen bestimmen: n() n() n() %() M() %() M() %() M() %() %() %() Die Werte ganz rechts erhält man, wenn man alle Anteile durch die kleinste Zahl (in diesem Fall.387) teilt manchmal muß man dann wieder erweitern. Das // Verhältnis lautet damit 4 : 8 :. und damit die mögliche Summenformel: 4 8 oder oder 24 3 etc. 3. Suchen der Molmasse des Stoffes. (aus dem Massenspektrum). 2. MS Spektrum Materialien Spektroskopische Methoden 9/94 bzw. 0/20
2 Man sucht den Peak ganz auf der rechten Seite des Spektrums. In diesem Fall ist das der Peakk mit m/z 72. Aus der Isotopenverteilung / 3 sollte dies Peak für (M + ) sein. Daneben existiert der (M+) + Peak, den man allerdings mit der Lupe suchen muß. Die Molmasse des Stoffes beträgt also (wahrschein lich) 72 g/mol. 4. Berechnung der Summenformel Damit kann die Summenformel nur: 4 8 lauten. 5. Suchen von "Teilen des Moleküls Mit diesem Wissen wenden wir und dem MR Spektrum zu: 3. MR Spektrum: (60 Mz) Wir bestimmen zunächst die Anzahl der Signalgruppen mit der Protonenzahl und evtl. Multiplizität: Evtl. zeichnen wir mit dem Bleistift einige ilfslinien, um die Integrationslinie besser auswerten zu können: Man findet 3 Signalgruppen:. bei 2.4 ein Quartett mit 6 mm 2. bei 2. sehr scharfes Singulett mit mm 3. bei 2.0 ein Triplett mit mm Summe: 28 mm Aus der Summenformel (8 Atome) folgt, daß auf ein Proton 28/8 3.5 mm entfallen. Das linke Signal wird durch (6/3.5.7) für 2 Protonen mit 3 achbarn die mittlere Signalgruppe durch (/ ) für 3 äquivalente Protonen ohne achbarn das rechte Signal durch (/ ) für 3 Protonen mit 2 achbarn hervorgerufen. Aus den Überlegungen zur Kopplung geht hervor, daß es sich einmal um das Kopplungmuster einer Ethyl Gruppe (Gruppen links und rechts) zum anderen um eine isolierte Methyl Gruppe handeln müßte. Wenn wir die Atome dieser beiden Strukturelemente von der Summenformel abziehen, bleibt nur noch und Atom übrig. Was läge näher als anzunehmen, daß es sich um eine Gruppe handelt. Der Blick ins IR Spektrum bestätigt unsere Vermutung durch das Vorhandensein der einzigen "vernünftigen" Bande bei 700 cm. Materialien Spektroskopische Methoden 9/94 bzw. 0/20 2
3 6. Kombinieren der " Molekülteile Damit haben wir auch hier die Strukturformel "ausgetüftelt". Die anderen spektroskopischen Aussagen dienen nun lediglich zur "Probe", ob wir alles richtig gemacht haben. Massenspektrum: Fragment : 43 deutet auf 3 Fragment hin Bruch rechts der Bindung (5) dabei wird 2 5 abgespalten m/z 29 (6) 57 deutet auf Bruch links der Bindung hin dabei wird 3 abgespalten m/z 5 (52) 5. 3 MR Spektrum: ier die einzelnen Signale (mit der Zuordnung zur Tabelle MR T4) a. 207,6 s, Kohlenstoffatom, an das kein Atom gebunden ist (32) b. 36,5 t, Kohlenstoffatom, an das zwei Atome gebunden sind (7) c. 29,0 q, Kohlenstoffatom, an das drei Atome gebunden sind (2) d. 8,0 q, Kohlenstoffatom, an das drei Atome gebunden sind (2) So haben wir auch dieses Problem gemeistert. Zum Abschluß sei noch gezeigt, wie das Ergebnis in der Tabelle der Lösungen aufgeführt ist MS: 72 (M+) 2 Butanon IR: A B MR: A: 2.05 s I3 () B: 2.4 q I2 (). t I2 () A A B 3 MR : 29.0 q (2) 4: 8 q (2) 2: s (33) 3: 36.5 t (7) Materialien Spektroskopische Methoden 9/94 bzw. 0/20 3
4 Beispiel 2: Problem r. 44 A. Qualitative und quantitative Analyse: hierzu werten wir die obere Zeile des Problems aus.. Quantitative Analyse: : 7.09 % : 06.7 % : enthält:,,,. Berechnung der kompletten Zusamensetzung entfällt, das noch der Gehalt von und unbekannt sind. 2. Berechnung der Verhältnisdformel (hier nur: und ) un kann man als ersten Schritt auf dem Weg zur Summenformel das Verhältnis der zu den Atomen bestimmen (M bedeutet Molmasse): n() n() %() M() %() M() %() %() Das / Verhältnis in der Summenformel ist im Rahmen der Genauigkeit der qualitativen Analyse etwa 8:7 der Anteil könnte aber auch z.b. 9 : 8 oder ähnlich sein. An dieser Stelle stockt man schon ein wenig das Verhältnis ist nicht sehr eindeutig. 3. Suchen der Molmasse des Stoffes. (aus dem Massenspektrum). Weiteren Aufschluß gibt das Massenspektrum. 2. MS Spektrum Falls möglich, entnimmt man dem Massenspektrum die Molmasse. Man sucht den Peak mit der größten Masse ganz auf der rechten Seite des Spektrums. Es ist unwahrscheinlich, daß sich unter den Bedingungen im Massenspektrometer Bruchstücke vereinigen und so Peaks mit einer Massenzahl, die größer ist als die Molmasse, auftreten. In diesem Fall ist das die Masse 35. Aus der Isotopenverteilung / 3 wissen wir, daß dies der Peak für ( M+ + ) ist. Achtung : Der (M+ + ) Peak besitzt nur etwa 0 % der Intensität des M + Peaks und kann bei kleinen M + Peaks fehlen. Die Molmasse des Stoffes beträgt also (höchstwahrscheinlich) 35 g/mol. Damit kann man weiter arbeiten. Materialien Spektroskopische Methoden 9/94 bzw. 0/20 4
5 Berechnung der kompletten Zusamensetzung (eigentlich Punkt hier nachgeholt) Der Anteil eines Elementes in der Summenformel berechnet sich: n(element) %(Element). M(Stoff) M(Element). 00 n() %(). M(Stoff),M() also etwa 9 Atome 00 n() %(). M(Stoff) M() also etwa 8 Atome 00 Da die Molmasse nicht zu groß ist, haben wir etwas Glück bei der Bestimmung der Koeffizienten von Sauerstoff und Stickstoff : Auf die beiden Elemente ( und ) entfallen von der Gesamtmasse genau die Summe aus dem 8 fachen der Molmassen von Kohlenstoff ( g/mol) und dem 9 fachen der Molmasse von Wasserstoff (g/mol). 35 ( ) 30 g/mol Die Summe der Vielfachen der Molmassen von Stickstoff (4 g/mol) und Sauerstoff (6 g/mol) muß also genau 30 g/mol ergeben: x. 4 + y Daraus folgt sofort : x und y 4. Berechnung der Summenformel Somit haben wir das erste Etappenziel erreicht: Die Summenformel lautet : Suchen von "Teilen des Moleküls" Mit diesem Wissen wenden wir uns dem MR Spektrum zu. Wir bestimmen zunächst die Anzahl der Signalgruppen mit der Protonenzahl und evtl. Multiplizität. Evtl. zeichnen wir mit dem Bleistift einige ilfslinien, um die Integrationslinie besser auswerten zu können: Man findet 3 Signalgruppen:. bei 8.5 ein breites Singulett (deutet auf Austausch hin) mit 4 mm 2. bei ein unübersichtliches Multiplett mit 7 mm 3. bei 2.0 ein sehr scharfes Singulett mit mm Summe: 32 mm Aus der Summenformel (9 Atome) folgt, daß auf ein Proton 32/9, also ungefähr 3.6 mm entfallen. Das linke Signal wird durch (4/3.6.) ein Proton, die mittlere Signalgruppe durch (7/ ) fünf etwas unterschiedliche Protonen und das rechte Signal durch (/3.6 3.) drei (wahrscheinlich) äquivalente Protonen hervorgerufen. Materialien Spektroskopische Methoden 9/94 bzw. 0/20 5
6 un schauen wir in der Tabelle der chemischen Verschiebungen nach.. Bei 9.5 findet sich ein breites Singulett (also oder mit Brücken) In Frage kämen Strukturelemente mit den ummern 40, 44, 45 oder Strukturelemente mit den ummern 4, 42, 43, Bei liegt ein unübersichtliches Multiplett aber 5 Protonen in dieser Gegend sind fast immer aromatische Protonen. In Frage käme das Strukturelement mit der ummer 39 3.Bei 2.0 ist ein sehr scharfes Singulett (mit drei Protonen) wahrscheinlich eine Methylgruppe. In Frage kämen Strukturelemente mit den ummern 0,, 5, 6 Damit hätten wir alle Atome untergebracht. Es fehlt nur noch ein Atom und die Anordnung der Bruchstücke. Dazu werfen wir einen Blick ins das IR Spektrum. Auffällig sind folgende Banden; hier mit einer Zuordnung zur IR Tabelle 330 cm (4), 2950 cm ( oder ), 2880 cm ( oder ), 680 cm (0 ) 60 cm (2,4 oder 7) Durch die Auflistung scheinen alle Banden so gleichwertig; jedoch ist eine Bande viel wichtiger als alle anderen: Tritt eine Bande um 700 cm auf, so liegt (fast) immer eine Doppelbindung vor! Wir brauchen unser Atom dafür also fallen die Strukturelemente mit weg. un müssen wir nur noch alle Elemente zusammenfügen und haben damit den auptteil der Arbeit geschafft. Wir erhalten nur noch zwei Möglichkeiten: Zwischen diesen beiden zu unterscheiden ist nicht ganz einfach aber das Glück ist uns, wie so oft, hold: Ein zweiter Blick ins Massenspektrum zeigt uns ein sehr stabiles (intensives) Fragmement bei m/z 93. ier ist aus dem Molekül ein Bruchstück mit der Masse 42 abgespalten worden. Das könnte einer Struktur wie 3 2 oder 2 zuzuordnen sein. Letzteres ist für uns günstiger und deutet auf die linke der beiden Verbindungen hin. 6. Kombinieren der " Molekülteile Materialien Spektroskopische Methoden 9/94 bzw. 0/20 6
7 Sozusagen als Bestätigung schauen wir nun das 3 Spektrum an MR Spektrum: Man erkennt 6 Signale für 8 Atome in etwa 3 Gruppen. ier die einzelnen Signale (mit der Zuordnung zur Tabelle MR T4) a s, Kohlenstoffatom, an das kein Atom gebunden ist (30) b s, Kohlenstoffatom, an das kein Atom gebunden ist (23) c. 8.7 d, 2 Kohlenstoffatome (Signalhöhe), an das ein Atom gebunden ist (23) d. 4. d, Kohlenstoffatom, an das ein Atom gebunden ist (23) e. 0.4 d, 2 Kohlenstoffatome (Signalhöhe), an das ein Atom gebunden ist (23) f. 24. q, Kohlenstoffatom, an das drei Atome gebunden sind (2) Alles in allem können wir mit unserer Arbeit zufrieden sein. Zum Abschluß sei noch gezeigt, wie das Ergebnis in der Tabelle der Lösungen aufgeführt ist MS: 35 (M+) Acetanilid Interne ummer: 70 IR: B A MR: A: 7.2 m I5 () B: siehe A E 3 2 D: 8.56 s I () E: 2.03 s I3 () 4 E D E 3 MR : 38.2 S 2: 0.4 d B A 4: 4. d 5: 69.5 s 564 : siehe A 3: 8.7 d 6: 24. q Materialien Spektroskopische Methoden 9/94 bzw. 0/20 7
Z 12 1) BESTIMMUNG DER SUMMENFORMEL: a. AUS DEN MASSENPROZENTEN
 ANALYTIK 1) BESTIMMUNG DER SUMMENFORMEL: a. AUS DEN MASSENPROZENTEN Ziel: Ermittlung einer Summenformel einer Substanz aus C, und O wenn die Massenprozent der Elemente und die Molmasse M r der Substanz
ANALYTIK 1) BESTIMMUNG DER SUMMENFORMEL: a. AUS DEN MASSENPROZENTEN Ziel: Ermittlung einer Summenformel einer Substanz aus C, und O wenn die Massenprozent der Elemente und die Molmasse M r der Substanz
Schriftliche Prüfung BSc Frühling 2006 D CHAB/BIOL. Musterlösung. für den Teil Spektroskopie
 Prüfungen Analytische Chemie Mittwoch, 8. März 2006 Schriftliche Prüfung BSc Frühling 2006 D CAB/BIL Musterlösung für den Teil Spektroskopie Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die
Prüfungen Analytische Chemie Mittwoch, 8. März 2006 Schriftliche Prüfung BSc Frühling 2006 D CAB/BIL Musterlösung für den Teil Spektroskopie Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die
NMR Spektroskopie. Aufgaben
 hemische Verschiebung 1. Zeichnen Sie zu den nachfolgend aufgeführten Stoffen die Strukturformeln! Unterscheiden Sie dann zwischen chemisch äquvalenten und nichtäquivalenten Kernen. Bezeichnen Sie die
hemische Verschiebung 1. Zeichnen Sie zu den nachfolgend aufgeführten Stoffen die Strukturformeln! Unterscheiden Sie dann zwischen chemisch äquvalenten und nichtäquivalenten Kernen. Bezeichnen Sie die
Schriftliche Prüfung BSc Frühling 2006
 Prüfungen Analytische Chemie Mittwoch, 8. März 2006 Schriftliche Prüfung BSc Frühling 2006 D CAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt 36.
Prüfungen Analytische Chemie Mittwoch, 8. März 2006 Schriftliche Prüfung BSc Frühling 2006 D CAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt 36.
Aufgabe 1: (18 Punkte)
 Aufgabe 1: (18 Punkte) In der Arbeitsgruppe Hilt wurde folgende Reaktionssequenz durchgeführt: A H 10 H B O O O 1 1 2 2 + 10 3 3 4 4 Δ DA- Produkt 6-9 5 5 6-9 2 Ph Ph Co(dppe) 2 3 3 4 4 Im ersten Reaktionsschritt
Aufgabe 1: (18 Punkte) In der Arbeitsgruppe Hilt wurde folgende Reaktionssequenz durchgeführt: A H 10 H B O O O 1 1 2 2 + 10 3 3 4 4 Δ DA- Produkt 6-9 5 5 6-9 2 Ph Ph Co(dppe) 2 3 3 4 4 Im ersten Reaktionsschritt
Schriftliche Prüfung 2. Vordiplom / BSc Herbst 2006
 Prüfungen Analytische Chemie Mittwoch, 27. September 2006 Schriftliche Prüfung 2. Vordiplom / BSc Herbst 2006 D CHAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare
Prüfungen Analytische Chemie Mittwoch, 27. September 2006 Schriftliche Prüfung 2. Vordiplom / BSc Herbst 2006 D CHAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare
Übungsaufgaben zur NMR-Spektrometrie
 Übungsaufgaben NMR 33 Übungsaufgaben zur NMR-Spektrometrie Aufgabe 1 a) Wieviele unterschiedliche Orientierungen des Kernmomentes relativ zu einem externen Magnetfeld sind beim 14 N-Kern (I = 1, γ = 1.932
Übungsaufgaben NMR 33 Übungsaufgaben zur NMR-Spektrometrie Aufgabe 1 a) Wieviele unterschiedliche Orientierungen des Kernmomentes relativ zu einem externen Magnetfeld sind beim 14 N-Kern (I = 1, γ = 1.932
Schriftliche Prüfung BSc Frühling 2014
 Prüfungen Analytische Chemie Samstag, 1. Februar 2014 Schriftliche Prüfung BSc Frühling 2014 D CHAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Samstag, 1. Februar 2014 Schriftliche Prüfung BSc Frühling 2014 D CHAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Schriftliche Prüfung BSc Herbst 2010
 Prüfungen Analytische Chemie Dienstag, 24. August 2010 Schriftliche Prüfung BSc Herbst 2010 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Dienstag, 24. August 2010 Schriftliche Prüfung BSc Herbst 2010 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
P105. Konstitution. Massenspektrum 100 % m/z
 1 P105 Konstitution 7 1 2 6 8 4 5 Massenspektrum 100 % 4 116 50 7 101 29 55 88 15 61 10 14 158 0 0 50 100 150 m/z 2 Direkte Fragmentierungen: 4 115 11 45 129 29 85 7 Damit lassen sich die prominenten Signale
1 P105 Konstitution 7 1 2 6 8 4 5 Massenspektrum 100 % 4 116 50 7 101 29 55 88 15 61 10 14 158 0 0 50 100 150 m/z 2 Direkte Fragmentierungen: 4 115 11 45 129 29 85 7 Damit lassen sich die prominenten Signale
Protokoll. Kombinierte Anwendung verschiedener Spektroskopischer Methoden
 Protokoll Kombinierte Anwendung verschiedener Spektroskopischer Methoden Zielstellung: Durch die Auswertung von IR-, Raman-, MR-, UV-VIS- und Massenspektren soll die Struktur einer unbekannten Substanz
Protokoll Kombinierte Anwendung verschiedener Spektroskopischer Methoden Zielstellung: Durch die Auswertung von IR-, Raman-, MR-, UV-VIS- und Massenspektren soll die Struktur einer unbekannten Substanz
Kurs "Spektroskopische Methoden in der Anorganischen und Organischen Chemie" Kernresonanzspektroskopie - Übungen Lösung zu NMR-6 (Blatt 1)
 Kernresonanzspektroskopie - Übungen Lösung zu NMR-6 (Blatt ) Zum Lösungsmittel: Das Kohlenstoffspektrum zeigt bei 77 ppm drei gleich große äquidistante Signale. Diese stammen von CDC 3. Chemische Verschiebungen
Kernresonanzspektroskopie - Übungen Lösung zu NMR-6 (Blatt ) Zum Lösungsmittel: Das Kohlenstoffspektrum zeigt bei 77 ppm drei gleich große äquidistante Signale. Diese stammen von CDC 3. Chemische Verschiebungen
Spektroskopie-Seminar SS NMR-Spektroskopie. H-NMR-Spektroskopie. nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie
 1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 4.1 Allgemeines Spektroskopische Methode zur Untersuchung von Atomen: elektronische Umgebung Wechselwirkung
1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 4.1 Allgemeines Spektroskopische Methode zur Untersuchung von Atomen: elektronische Umgebung Wechselwirkung
Schriftliche Prüfung 2. Vordiplom / BSc Herbst 2004
 Prüfungen Analytische Chemie Dienstag, 1. September 4 Schriftliche Prüfung. Vordiplom / BSc erbst 4 D CAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Dienstag, 1. September 4 Schriftliche Prüfung. Vordiplom / BSc erbst 4 D CAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Übungsaufgaben - Analytik
 Übungsaufgaben - Analytik Übung 1 Von einer Substanz soll der molare Extinktionskoeffizient bestimmt werden. Der Laborant hat mässig exakt verdünnt. Er hat jeweils die auf der x-achse angegbene Zahl an
Übungsaufgaben - Analytik Übung 1 Von einer Substanz soll der molare Extinktionskoeffizient bestimmt werden. Der Laborant hat mässig exakt verdünnt. Er hat jeweils die auf der x-achse angegbene Zahl an
Spektroskopie-Seminar SS NMR-Spektroskopie. H-NMR-Spektroskopie. nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie
 1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 5.1 1 H-NMR-Spektroskopie NMR-Spektrum liefert folgende Informationen: Chemische Verschiebung d (in ppm):
1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 5.1 1 H-NMR-Spektroskopie NMR-Spektrum liefert folgende Informationen: Chemische Verschiebung d (in ppm):
Spektroskopie-Seminar SS NMR-Spektroskopie. H-NMR-Spektroskopie. nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie
 1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 4 NMR-Spektroskopie 5.1 1 H-NMR-Spektroskopie Wasserstoffatome ( 1 H, natürliche Häufigkeit 99,985 %) mit
1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 4 NMR-Spektroskopie 5.1 1 H-NMR-Spektroskopie Wasserstoffatome ( 1 H, natürliche Häufigkeit 99,985 %) mit
7 Kernresonanz-Spektroskopische Untersuchungen
 7 Kernresonanz-Spektroskopische Untersuchungen 79 7 Kernresonanz-Spektroskopische Untersuchungen 7.1 1 H-MR-Signale Die 1 H-MR-Spektroskopie liefert aufgrund der charakteristischen chemischen Verschiebung
7 Kernresonanz-Spektroskopische Untersuchungen 79 7 Kernresonanz-Spektroskopische Untersuchungen 7.1 1 H-MR-Signale Die 1 H-MR-Spektroskopie liefert aufgrund der charakteristischen chemischen Verschiebung
Schriftliche Prüfung Analytische Chemie I&II Winter 2012/2013
 Schriftliche Prüfung Analytische Chemie I&II Winter 2012/2013 Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich Ihre Zeit gut ein.
Schriftliche Prüfung Analytische Chemie I&II Winter 2012/2013 Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich Ihre Zeit gut ein.
Schriftliche Prüfung BSc Herbst 2007
 Prüfungen Analytische Chemie Montag, 3. September 2007 Schriftliche Prüfung BSc Herbst 2007 D CHAB/BIOL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Montag, 3. September 2007 Schriftliche Prüfung BSc Herbst 2007 D CHAB/BIOL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Einführung in die NMR-Spektroskopie. NMR-Spektroskopie. Teil 1: Einführung und Grundlagen der 1 H NMR. Das NMR Spektrometer
 NMR-Spektroskopie Einführung in die NMR-Spektroskopie m I = - /2 (β) Teil : Einführung und Grundlagen der NMR E E. Physikalische und apparative Grundlagen m I = + /2 (α).2 Das D NMR Experiment.3 Die chemische
NMR-Spektroskopie Einführung in die NMR-Spektroskopie m I = - /2 (β) Teil : Einführung und Grundlagen der NMR E E. Physikalische und apparative Grundlagen m I = + /2 (α).2 Das D NMR Experiment.3 Die chemische
M U S T E R L Ö S U N G
 Prof. Dr.. Reiser Prof. Dr. A. Geyer 3. Klausur zum Praktikum rganische hemie I für Studierende der hemie und der Biochemie im SS 2002 am Dienstag, dem 16. Juli 2002 ame:... Vorname:... Matrikelnummer:...
Prof. Dr.. Reiser Prof. Dr. A. Geyer 3. Klausur zum Praktikum rganische hemie I für Studierende der hemie und der Biochemie im SS 2002 am Dienstag, dem 16. Juli 2002 ame:... Vorname:... Matrikelnummer:...
Übungen zur Vorlesung Mathematik I für Studierende der Chemie (WS 2016/2017) Institut für Chemie und Biochemie, FU Berlin Blatt
 Übungen zur Vorlesung Mathematik I für Studierende der Chemie (WS 2016/2017) Institut für Chemie und Biochemie, FU Berlin PD Dr. Dirk Andrae Blatt 1 2016-10-19 1. Geben Sie an, ob die im folgenden genannten
Übungen zur Vorlesung Mathematik I für Studierende der Chemie (WS 2016/2017) Institut für Chemie und Biochemie, FU Berlin PD Dr. Dirk Andrae Blatt 1 2016-10-19 1. Geben Sie an, ob die im folgenden genannten
Übungsaufgaben NMR-Spektroskopie (1)
 Übungsaufgaben NMR-Spektroskopie (1) 1. Kerne haben drei wichtige Eigenschaften: Masse m, Ladung Q und Eigendrehimpuls p. Kernsorte Spin natürliche Häufigkeit Gyromagnet. Verhältnis γ [Tsec] 1 1 H 1/2
Übungsaufgaben NMR-Spektroskopie (1) 1. Kerne haben drei wichtige Eigenschaften: Masse m, Ladung Q und Eigendrehimpuls p. Kernsorte Spin natürliche Häufigkeit Gyromagnet. Verhältnis γ [Tsec] 1 1 H 1/2
Schriftliche Prüfung 2. Vordiplom / BSc Herbst 2004 D CHAB/BIOL. Musterlösung
 Prüfungen Analytische Chemie Dienstag, 21. September 4 Schriftliche Prüfung 2. Vordiplom / BSc erbst 4 D CAB/BIL Musterlösung Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare
Prüfungen Analytische Chemie Dienstag, 21. September 4 Schriftliche Prüfung 2. Vordiplom / BSc erbst 4 D CAB/BIL Musterlösung Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare
Spektroskopiemodul II. H-NMR und 13 C-NMR
 Spektroskopiemodul II 1 H-NMR und 13 C-NMR 1 1. Was gehört zu einer vollständigen Spektreninterpretation zur Strukturaufklärung? 1.1. 1 H-NMR-Spektren Man muss die chemische Verschiebung jedes einzelnen
Spektroskopiemodul II 1 H-NMR und 13 C-NMR 1 1. Was gehört zu einer vollständigen Spektreninterpretation zur Strukturaufklärung? 1.1. 1 H-NMR-Spektren Man muss die chemische Verschiebung jedes einzelnen
Kernmagnetische Resonanzspektroskopie (NMR) Spektroskopische Methoden
 Kernmagnetische Resonanzspektroskopie (NMR) Spektroskopische Methoden Grundlagen Die meisten Atomkerne führen eine Drehbewegung um die eigene Achse aus ("Spin"). Da sie geladene Teilchen (Protonen) enthalten,
Kernmagnetische Resonanzspektroskopie (NMR) Spektroskopische Methoden Grundlagen Die meisten Atomkerne führen eine Drehbewegung um die eigene Achse aus ("Spin"). Da sie geladene Teilchen (Protonen) enthalten,
Schriftliche Prüfung BSc Herbst 2013
 Prüfungen Analytische Chemie Dienstag, 13. August 2013 Schriftliche Prüfung BSc Herbst 2013 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Dienstag, 13. August 2013 Schriftliche Prüfung BSc Herbst 2013 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Schriftliche Prüfung BSc Frühling 2008
 Prüfungen Analytische Chemie Samstag, 9. Februar 2008 Schriftliche Prüfung BSc Frühling 2008 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Samstag, 9. Februar 2008 Schriftliche Prüfung BSc Frühling 2008 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Schriftliche Prüfung BSc Frühling 2010
 Prüfungen Analytische Chemie Donnerstag, 11. Februar 2010 Schriftliche Prüfung BSc Frühling 2010 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Donnerstag, 11. Februar 2010 Schriftliche Prüfung BSc Frühling 2010 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Schriftliche Prüfungen Smesterkurs Analytische Chemie I Instrumentalanalyse organischer Vebindungen Sommer 2011
 Schriftliche Prüfungen Smesterkurs Analytische Chemie I Instrumentalanalyse organischer Vebindungen Sommer 2011 Vorname: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120
Schriftliche Prüfungen Smesterkurs Analytische Chemie I Instrumentalanalyse organischer Vebindungen Sommer 2011 Vorname: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120
Schriftliche Prüfungen Jahreskurs Analytische Chemie I&II Winter 2011/2012 BSc D-CHAB/BIOL
 Schriftliche Prüfungen Jahreskurs Analytische Chemie I&II Winter 2011/2012 BSc D-CHAB/BIOL Vorname: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich
Schriftliche Prüfungen Jahreskurs Analytische Chemie I&II Winter 2011/2012 BSc D-CHAB/BIOL Vorname: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich
LMPG 3, Spek-ÜB-20 LÖSUNG Seite 1 von 6
 LMPG 3, Spek-ÜB-20 LÖSUG Seite 1 von 6 Aufgabe 1: a) Woran lässt sich aus dem MS-Spektrum auf die Zahl der -Atome schliessen? Molekülionenpeak ist ungerade, also ist auch die Zahl der -Atome ungerade.
LMPG 3, Spek-ÜB-20 LÖSUG Seite 1 von 6 Aufgabe 1: a) Woran lässt sich aus dem MS-Spektrum auf die Zahl der -Atome schliessen? Molekülionenpeak ist ungerade, also ist auch die Zahl der -Atome ungerade.
D-(+)-Biotin (Vitamin H)
 D-(+)-Biotin (Vitamin H) Benedikt Jacobi 28. Januar 2005 1 Inhaltsverzeichnis 1 Einleitung 1 1.1 Aufgabenstellung: Prüfung der Stabilität von Biotin (Vitamin H) unter alltäglichen Bedingungen (Kochen,
D-(+)-Biotin (Vitamin H) Benedikt Jacobi 28. Januar 2005 1 Inhaltsverzeichnis 1 Einleitung 1 1.1 Aufgabenstellung: Prüfung der Stabilität von Biotin (Vitamin H) unter alltäglichen Bedingungen (Kochen,
Spektroskopie-Seminar SS NMR-Spektroskopie. C-NMR-Spektroskopie und 2D-Spektroskopie
 13 C-NMR-Spektroskopie und 2D-Spektroskopie 6.1 Allgemeines Kernresonanz: Wechselwirkungen zwischen dem magnetischen Moment von Atomkernen mit einem magnetischen Wechselfeld Nur solche Isotope können untersucht
13 C-NMR-Spektroskopie und 2D-Spektroskopie 6.1 Allgemeines Kernresonanz: Wechselwirkungen zwischen dem magnetischen Moment von Atomkernen mit einem magnetischen Wechselfeld Nur solche Isotope können untersucht
NMR-Spektroskopie. Magnet. Steuerung. Probenrohr Spinner. Shimspulen. B -Spulen. Gradient 2. Vorverstärker
 NMR-Spektroskopie Magnet Steuerung He He CPU Frequenz Pulsform Pulsleistung Zeitkontrolle Temperierung Gradienten Shim/Lock/Gas Vorverstärker N N Probenrohr Spinner Shimspulen B -Spulen Gradient 2 H K
NMR-Spektroskopie Magnet Steuerung He He CPU Frequenz Pulsform Pulsleistung Zeitkontrolle Temperierung Gradienten Shim/Lock/Gas Vorverstärker N N Probenrohr Spinner Shimspulen B -Spulen Gradient 2 H K
NMR-Spektroskopie Teil 2
 BC 3.4 : Analytische Chemie I NMR Teil 2 NMR-Spektroskopie Teil 2 Stefanie Wolfram Stefanie.Wolfram.1@uni-jena.de Raum 228, TO Vom Spektrum zur Struktur 50000 40000 Peaks u. Integrale 30000 Chemische Verschiebung
BC 3.4 : Analytische Chemie I NMR Teil 2 NMR-Spektroskopie Teil 2 Stefanie Wolfram Stefanie.Wolfram.1@uni-jena.de Raum 228, TO Vom Spektrum zur Struktur 50000 40000 Peaks u. Integrale 30000 Chemische Verschiebung
4 Synthesen antiprionen-aktiver Verbindungen
 4 Synthesen antiprionen-aktiver Verbindungen Quinacrinanaloga (Grundstruktur C) 77 4 Synthesen antiprionen-aktiver Verbindungen 4.1 Synthesen der Quinacrinanaloga (Grundstruktur C) Die Synthesen der Quinacrinanaloga
4 Synthesen antiprionen-aktiver Verbindungen Quinacrinanaloga (Grundstruktur C) 77 4 Synthesen antiprionen-aktiver Verbindungen 4.1 Synthesen der Quinacrinanaloga (Grundstruktur C) Die Synthesen der Quinacrinanaloga
Übungen zur Spektroskopie 2
 Übungen zur Spektroskopie 2 C. Dubler und Dr. D. S. Stephenson Department Chemie, Universität München Sie finden diese Übungen und alte Klausuren (mit Lösung) auf unserer Homepage: http://cicum200.cup.unimuenchen.de/intranet/depch/analytik/nmr_f/index.php
Übungen zur Spektroskopie 2 C. Dubler und Dr. D. S. Stephenson Department Chemie, Universität München Sie finden diese Übungen und alte Klausuren (mit Lösung) auf unserer Homepage: http://cicum200.cup.unimuenchen.de/intranet/depch/analytik/nmr_f/index.php
LMPG 3, Spek-ÜB-15 LÖSUNG Seite 1 von 6
 LMPG 3, Spek-ÜB-15 LÖSUG Seite 1 von 6 Aufgabe 1: a) Woran lässt sich aus dem MS-Spektrum auf die Zahl der -Atome schliessen? Molekülionenpeak ist ungerade, also ist auch die Zahl der -Atome ungerade.
LMPG 3, Spek-ÜB-15 LÖSUG Seite 1 von 6 Aufgabe 1: a) Woran lässt sich aus dem MS-Spektrum auf die Zahl der -Atome schliessen? Molekülionenpeak ist ungerade, also ist auch die Zahl der -Atome ungerade.
Schriftliche Prüfung BSc Herbst 2007 D CHAB/BIOL. Musterlösung. für den Teil Spektroskopie
 Prüfungen Analytische Chemie Montag, 3. September 2007 Schriftliche Prüfung BSc Herbst 2007 D CHAB/BIOL Musterlösung für den Teil Spektroskopie Vorname:... Name:... Jede Aufgabe wird separat bewertet.
Prüfungen Analytische Chemie Montag, 3. September 2007 Schriftliche Prüfung BSc Herbst 2007 D CHAB/BIOL Musterlösung für den Teil Spektroskopie Vorname:... Name:... Jede Aufgabe wird separat bewertet.
Schriftliche Prüfung BSc Herbst 2014
 Prüfungen Analytische Chemie Montag, 25. August 2014 Schriftliche Prüfung BSc Herbst 2014 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt 36.
Prüfungen Analytische Chemie Montag, 25. August 2014 Schriftliche Prüfung BSc Herbst 2014 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt 36.
NMR - Seite 1. NMR (Kernresonanzspektroskopie) Allgemeines zur Theorie
 NMR - Seite 1 NMR (Kernresonanzspektroskopie) Allgemeines zur Theorie Protonen besitzen ebenso wie Elektronen einen eigenen Spin (Drehung um die eigene Achse).Allerdings gibt es mehrere Möglichkeiten als
NMR - Seite 1 NMR (Kernresonanzspektroskopie) Allgemeines zur Theorie Protonen besitzen ebenso wie Elektronen einen eigenen Spin (Drehung um die eigene Achse).Allerdings gibt es mehrere Möglichkeiten als
Spektroskopie-Seminar WS 17/18 5 NMR-Spektroskopie. H-NMR-Spektroskopie. nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie
 WS 17/18 1 -NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 1 5.1 1 -NMR-Spektroskopie NMR-Spektrum liefert folgende Informationen: Chemische Verschiebung δ(in
WS 17/18 1 -NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 1 5.1 1 -NMR-Spektroskopie NMR-Spektrum liefert folgende Informationen: Chemische Verschiebung δ(in
Schriftliche Prüfung S Analytische Chemie I Sommer 2017
 Schriftliche Prüfung 529-0051- 00S Analytische Chemie I Sommer 2017 Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 60 Min. Teilen Sie sich Ihre Zeit gut
Schriftliche Prüfung 529-0051- 00S Analytische Chemie I Sommer 2017 Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 60 Min. Teilen Sie sich Ihre Zeit gut
Schriftliche Prüfungen Jahreskurs Analytische Chemie I&II Sommer 2011 BSc D-CHAB/BIOL
 Schriftliche Prüfungen Jahreskurs Analytische Chemie I&II Sommer 2011 BSc D-CHAB/BIOL Vorname: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich Ihre
Schriftliche Prüfungen Jahreskurs Analytische Chemie I&II Sommer 2011 BSc D-CHAB/BIOL Vorname: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich Ihre
Schriftliche Prüfung J Analytische Chemie I&II Sommer 2016
 Schriftliche Prüfung 529-0058- 00J Analytische Chemie I&II Sommer 2016 Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich Ihre Zeit
Schriftliche Prüfung 529-0058- 00J Analytische Chemie I&II Sommer 2016 Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich Ihre Zeit
Chemische und Magnetische Äquivalenz
 Chemische und Magnetische Äquivalenz Das Aussehen von NMR-Signalen in Mehr-Spinsystemen wird ganz wesentlich davon beeinflusst, ob es äquivalente Kerne gibt oder nicht. ierbei sind zwei wichtige Arten
Chemische und Magnetische Äquivalenz Das Aussehen von NMR-Signalen in Mehr-Spinsystemen wird ganz wesentlich davon beeinflusst, ob es äquivalente Kerne gibt oder nicht. ierbei sind zwei wichtige Arten
Schriftliche Prüfung 2. Vordiplom Herbst 2003
 Prüfungen Analytische hemie Mittwoch, 1. ktober 2003 Schriftliche Prüfung 2. Vordiplom erbst 2003 D AB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische hemie Mittwoch, 1. ktober 2003 Schriftliche Prüfung 2. Vordiplom erbst 2003 D AB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Spektroskopie in der Organischen Chemie. Massenspektren
 Massenspektren In der Frühzeit der MS wurden Spektren auf Fotopapier registriert, wobei das Spektrum mehrfach mit unterschiedlicher Ordinatenauslenkung ausgeschrieben wurde, um sehr schwache neben sehr
Massenspektren In der Frühzeit der MS wurden Spektren auf Fotopapier registriert, wobei das Spektrum mehrfach mit unterschiedlicher Ordinatenauslenkung ausgeschrieben wurde, um sehr schwache neben sehr
Teil 1 Aufgaben zum Stoff der Vorlesung OC1a (Grundvorlesung Organische Chemie) Maximale Punktezahl: 20 Notwendige Mindestpunkte: 8
 1. Klausur OC1 (BSc-Studiengang) PIN: 18.02.2016 11:00 14:00 Uhr N6 Name: Punkte: Matrikel Nr. Note: Notenskala: 80-78=1.0 77-75=1.3 74-71=1.5 70-67=1.7 66-63=2.0 62-59=2.3 58-56=2.5 55-53=2.7 52-50=3.0
1. Klausur OC1 (BSc-Studiengang) PIN: 18.02.2016 11:00 14:00 Uhr N6 Name: Punkte: Matrikel Nr. Note: Notenskala: 80-78=1.0 77-75=1.3 74-71=1.5 70-67=1.7 66-63=2.0 62-59=2.3 58-56=2.5 55-53=2.7 52-50=3.0
13 C, 1 H-Kopplungskonstanten. 13 C, 1 H-Kopplungen hier leichter erkannt werden können. Spektroskopie in der Organischen Chemie
 Spektroskopie in der Organischen hemie 13, 1 -Kopplungskonstanten NMR-Signalaufspaltungen aufgrund von skalaren Kopplungen treten grundsätzlich bei beiden Kopplungspartnern auf. Entsprechend kann man 13,
Spektroskopie in der Organischen hemie 13, 1 -Kopplungskonstanten NMR-Signalaufspaltungen aufgrund von skalaren Kopplungen treten grundsätzlich bei beiden Kopplungspartnern auf. Entsprechend kann man 13,
Infrarot Spektroskopie organischer Verbindungen
 Infrarot Spektroskopie organischer Verbindungen Praktikum (B.C. 3.4) Lehrstuhl für Instrumentelle Analytik Michael Deicke Michael.Deicke@uni-jena.de Ziele des Praktikums IR-Spektren organischer Verbindungen
Infrarot Spektroskopie organischer Verbindungen Praktikum (B.C. 3.4) Lehrstuhl für Instrumentelle Analytik Michael Deicke Michael.Deicke@uni-jena.de Ziele des Praktikums IR-Spektren organischer Verbindungen
Der Kern-Overhauser-Effekt (Nuclear Overhauser Effect, NOE)
 Der Kern-verhauser-Effekt (Nuclear verhauser Effect, NE) Die Intensität eines 1 H-Signals kann durch ein Entkopplungsexperiment verändert werden. Wird der Übergang eines ausgewählten 1 H-Kerns S für eine
Der Kern-verhauser-Effekt (Nuclear verhauser Effect, NE) Die Intensität eines 1 H-Signals kann durch ein Entkopplungsexperiment verändert werden. Wird der Übergang eines ausgewählten 1 H-Kerns S für eine
Chemische Formeln und Gleichungen
 Universität des Saarlandes - Fachrichtung Anorganische Chemie C h e m i s c h e s E i n f ü h r u n g s p r a k t i k u m Chemische Formeln und Gleichungen Um die Formel eines Stoffes aufstellen zu können,
Universität des Saarlandes - Fachrichtung Anorganische Chemie C h e m i s c h e s E i n f ü h r u n g s p r a k t i k u m Chemische Formeln und Gleichungen Um die Formel eines Stoffes aufstellen zu können,
Übungsaufgaben Chemie Nr. 3
 Übungsaufgaben Chemie Nr. 3 22) Wie hoch ist die Molarität der jeweiligen Lösungen, wenn die angegebene Substanzmenge in Wasser gelöst und auf 200 ml aufgefüllt wurde? a) 58.44g NaCl (Kochsalz) b) 100
Übungsaufgaben Chemie Nr. 3 22) Wie hoch ist die Molarität der jeweiligen Lösungen, wenn die angegebene Substanzmenge in Wasser gelöst und auf 200 ml aufgefüllt wurde? a) 58.44g NaCl (Kochsalz) b) 100
Teil 2 NMR-Spektroskopie. Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2017/18
 Teil 2 NMR-Spektroskopie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2017/18 www.ruhr-uni-bochum.de/chirality 1 Rückblick Chemische Verschiebung Chemische Umgebung Funktionelle Gruppen Signalintensitäten
Teil 2 NMR-Spektroskopie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2017/18 www.ruhr-uni-bochum.de/chirality 1 Rückblick Chemische Verschiebung Chemische Umgebung Funktionelle Gruppen Signalintensitäten
3. Klausur zum Praktikum Organische Chemie I für Studierende der Chemie und der Biochemie im SS 2000
 Prof. Dr. B. König Prof. Dr. Th. Troll 3. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 2000 am Donnerstag, dem 27. Juli 2000 ame: Mustermann...Vorname: Max...
Prof. Dr. B. König Prof. Dr. Th. Troll 3. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 2000 am Donnerstag, dem 27. Juli 2000 ame: Mustermann...Vorname: Max...
 hemie-protokoll 11.11.02, Seite 1 von 5 Lukman Iwan, 12.11.02 Stundenprotokoll vom Montag, 11. ovember 2002 Es fehlen: Janine und Jeannette Zettel 1&2: Aromatische eterocyclen http://www.oci.unizh.ch/edu/lectures/material/a_bii/kap6/kap6.html
hemie-protokoll 11.11.02, Seite 1 von 5 Lukman Iwan, 12.11.02 Stundenprotokoll vom Montag, 11. ovember 2002 Es fehlen: Janine und Jeannette Zettel 1&2: Aromatische eterocyclen http://www.oci.unizh.ch/edu/lectures/material/a_bii/kap6/kap6.html
Die Strukturabhängigkeit der chemischen Verschiebung
 Die Strukturabhängigkeit der chemischen Verschiebung. Abschirmung in einem Atom (wie bisher geschildert) Die Elektronenverteilung in einem Wasserstoffatom ist sphärisch. B 0 0 0000000 000000000 000000000
Die Strukturabhängigkeit der chemischen Verschiebung. Abschirmung in einem Atom (wie bisher geschildert) Die Elektronenverteilung in einem Wasserstoffatom ist sphärisch. B 0 0 0000000 000000000 000000000
FOS: Radioaktivität und Strahlenschutz. Chemische Elemente und ihre kleinsten Teilchen
 R. Brinkmann http://brinkmann-du.de Seite 5..03 Chemische Elemente FOS: Radioaktivität und Strahlenschutz Chemische Elemente und ihre kleinsten Teilchen Der Planet Erde besteht aus 9 natürlich vorkommenden
R. Brinkmann http://brinkmann-du.de Seite 5..03 Chemische Elemente FOS: Radioaktivität und Strahlenschutz Chemische Elemente und ihre kleinsten Teilchen Der Planet Erde besteht aus 9 natürlich vorkommenden
Die Einheit Mol Stoffmengen können in verschiedenen Einheiten gemessen werden:
 Cusanus-Gymnasium Wittlich W. Zimmer 1/5 Die Einheit Mol Stoffmengen können in verschiedenen Einheiten gemessen werden: a) durch die Angabe ihrer Masse b) durch die Angabe ihres Volumens c) durch die Anzahl
Cusanus-Gymnasium Wittlich W. Zimmer 1/5 Die Einheit Mol Stoffmengen können in verschiedenen Einheiten gemessen werden: a) durch die Angabe ihrer Masse b) durch die Angabe ihres Volumens c) durch die Anzahl
Das Periodensystem der Elemente Lehrerinformation
 Lehrerinformation 1/5 Arbeitsauftrag Ziel Material Die SuS lesen den Informationstext. Als Verständnishilfe verwenden sie gleichzeitig das Arbeitsblatt Leitfragen zum Text. Die SuS verstehen, dass sich
Lehrerinformation 1/5 Arbeitsauftrag Ziel Material Die SuS lesen den Informationstext. Als Verständnishilfe verwenden sie gleichzeitig das Arbeitsblatt Leitfragen zum Text. Die SuS verstehen, dass sich
ZHAW / N / CH / Analytische Chemie
 Analytische Chemie Kurztest 3 Dauer: Minuten Erlaubte Hilfsmittel: Vorlesungsunterlagen, Lehrbücher, Taschenrechner und eigene Formelsammlungen Alle Berechnungen sind am Schluss zusammen mit diesen Aufgabenblättern
Analytische Chemie Kurztest 3 Dauer: Minuten Erlaubte Hilfsmittel: Vorlesungsunterlagen, Lehrbücher, Taschenrechner und eigene Formelsammlungen Alle Berechnungen sind am Schluss zusammen mit diesen Aufgabenblättern
Schriftliche Prüfung Analytische Chemie I Sommer 2014
 Schriftliche Prüfung Analytische Chemie I Sommer 2014 Vorname: Name: Legi-Nr.: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 60 Min. Teilen Sie sich Ihre Zeit gut ein. Es sind
Schriftliche Prüfung Analytische Chemie I Sommer 2014 Vorname: Name: Legi-Nr.: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 60 Min. Teilen Sie sich Ihre Zeit gut ein. Es sind
Spinsysteme. AX 3 -Spinsystem
 Spinsysteme Eine Gruppe aus zwei oder mehreren Kernspins, die miteinander eine magnetische Wechselwirkung eingehen, bezeichnet man als ein Spinsystem. Die Struktur eines hochaufgelösten NMR-Spektrums und
Spinsysteme Eine Gruppe aus zwei oder mehreren Kernspins, die miteinander eine magnetische Wechselwirkung eingehen, bezeichnet man als ein Spinsystem. Die Struktur eines hochaufgelösten NMR-Spektrums und
Studiengang Bsc Biowissenschaften. Modulabschluss Prüfung. Organische Chemie
 Studiengang Bsc Biowissenschaften Modulabschluss Prüfung rganische Chemie 04.10.2016 Name: Vorname: Matrikelnummer: Geboren am: in: Dauer der Klausur: 90 Minuten Wiederholer/in dieser Klausur: Ja Nein
Studiengang Bsc Biowissenschaften Modulabschluss Prüfung rganische Chemie 04.10.2016 Name: Vorname: Matrikelnummer: Geboren am: in: Dauer der Klausur: 90 Minuten Wiederholer/in dieser Klausur: Ja Nein
Spektroskopie in der Organischen Chemie. 1 H, 1 H-Kopplungskonstanten. Geminale Kopplungen
 Spektroskopie in der rganischen hemie Geminale Kopplungen 1, 1 -Kopplungskonstanten Wenn sich die beiden Kopplungspartner (wie Zwillinge; lat.: gemini) am gleichen Kohlenstoffatom befinden, also nur zwei
Spektroskopie in der rganischen hemie Geminale Kopplungen 1, 1 -Kopplungskonstanten Wenn sich die beiden Kopplungspartner (wie Zwillinge; lat.: gemini) am gleichen Kohlenstoffatom befinden, also nur zwei
Atomphysik Klasse 9. Aufgabe: Fülle die freien Felder aus!
 1. Was gibt die Massenzahl A eines Atoms an? Die Zahl der Neutronen im Kern. Die Zahl der Protonen im Kern. Die Summe aus Kernneutronen und Kernprotonen. Die Zahl der Elektronen. Die Summe von Elektronen
1. Was gibt die Massenzahl A eines Atoms an? Die Zahl der Neutronen im Kern. Die Zahl der Protonen im Kern. Die Summe aus Kernneutronen und Kernprotonen. Die Zahl der Elektronen. Die Summe von Elektronen
Schriftliche Prüfung S Analytische Chemie I Sommer 2015
 Schriftliche Prüfung 529-0051- 00S Analytische Chemie I Sommer 2015 Vorname: Name: Legi-Nr.: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 60 Min. Teilen Sie sich Ihre Zeit gut
Schriftliche Prüfung 529-0051- 00S Analytische Chemie I Sommer 2015 Vorname: Name: Legi-Nr.: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 60 Min. Teilen Sie sich Ihre Zeit gut
Schriftliche Prüfung BSc Frühling 2008 D CHAB/BIOL. Musterlösung. für den Teil Spektroskopie
 Prüfungen Analytische Chemie Samstag, 9. Februar 2008 Schriftliche Prüfung BSc Frühling 2008 D CHAB/BIL Musterlösung für den Teil Spektroskopie Vorname:... Name:... Jede Aufgabe wird separat bewertet.
Prüfungen Analytische Chemie Samstag, 9. Februar 2008 Schriftliche Prüfung BSc Frühling 2008 D CHAB/BIL Musterlösung für den Teil Spektroskopie Vorname:... Name:... Jede Aufgabe wird separat bewertet.
5 Die Photolyse von Methyl-Semiquadratsäureamid
 44 5 Die Photolyse von Methyl-Semiquadratsäureamid 5 Die Photolyse von Methyl-Semiquadratsäureamid 5.1 Vorbemerkungen: Methylsemiquadratsäureamid (53) unterscheidet sich von Semiquadratsäureamid (48) nur
44 5 Die Photolyse von Methyl-Semiquadratsäureamid 5 Die Photolyse von Methyl-Semiquadratsäureamid 5.1 Vorbemerkungen: Methylsemiquadratsäureamid (53) unterscheidet sich von Semiquadratsäureamid (48) nur
ESR vs. NMR NMR ESR. ESR - Messung. Kernmagneton. 2cm P. m p 1800 µ e = 1800 m p. m e. (Bohr Magneton)
 M-Spektroskopie M ES vs. M M-Spektren von paramagnetischen Verbindungen? M µ e ist 0 3 mal grösser als das Kernmoment µ hν 0 = γ hb 0 µ = e h cm P Kernmagneton longitudinale elaxation wird zu stark (T
M-Spektroskopie M ES vs. M M-Spektren von paramagnetischen Verbindungen? M µ e ist 0 3 mal grösser als das Kernmoment µ hν 0 = γ hb 0 µ = e h cm P Kernmagneton longitudinale elaxation wird zu stark (T
Auf der rechten Seite sind Beispiele für kovalente Bindungen.
 Bei einem Gemisch aus Natrium und Chlorid wird einen Ionenverbindung entstehen und sich ein Ionengitter ausbilden. Wenn Natrium nicht vorhanden ist, hat Chlorid aber natürlich noch immer das Bedürfnis,
Bei einem Gemisch aus Natrium und Chlorid wird einen Ionenverbindung entstehen und sich ein Ionengitter ausbilden. Wenn Natrium nicht vorhanden ist, hat Chlorid aber natürlich noch immer das Bedürfnis,
1 Terminologie. 1) Die Bezeichnung Massenspektroskop wird praktisch nicht mehr verwendet; für Massenspektrograph siehe Abschnitt
 O:/Wiley/Budzikiewicz/3d/c01.3d from 13.06.2012 13:11:03 Teil I Grundlagen O:/Wiley/Budzikiewicz/3d/c01.3d from 13.06.2012 13:11:03 O:/Wiley/Budzikiewicz/3d/c01.3d from 13.06.2012 13:11:03 3 1 Terminologie
O:/Wiley/Budzikiewicz/3d/c01.3d from 13.06.2012 13:11:03 Teil I Grundlagen O:/Wiley/Budzikiewicz/3d/c01.3d from 13.06.2012 13:11:03 O:/Wiley/Budzikiewicz/3d/c01.3d from 13.06.2012 13:11:03 3 1 Terminologie
Kernmagnetismus und Magnetfelder
 Kernmagnetismus und Magnetfelder. Kernspin Die meisten Kerne besitzen einen Eigendrehimpuls oder P ist gequantelt P = h I(I + ) h = h und h: das Plancksche Wirkungsquantum. π I: Kernspinquantenzahl (kurz:
Kernmagnetismus und Magnetfelder. Kernspin Die meisten Kerne besitzen einen Eigendrehimpuls oder P ist gequantelt P = h I(I + ) h = h und h: das Plancksche Wirkungsquantum. π I: Kernspinquantenzahl (kurz:
Vorlesung Chemie für Biologen: Klausur 1 WS Sa
 1 Vorlesung Chemie für Biologen: Klausur 1 WS 02-03 Sa 07.12.02 Name:... Ihre Unterschrift:... Vorname:... Matrikel-Nr.:... Studienbeginn: SS: WS:...... Tutor der Übungen: (Dort Klausureinsicht.) Punkteschlüssel
1 Vorlesung Chemie für Biologen: Klausur 1 WS 02-03 Sa 07.12.02 Name:... Ihre Unterschrift:... Vorname:... Matrikel-Nr.:... Studienbeginn: SS: WS:...... Tutor der Übungen: (Dort Klausureinsicht.) Punkteschlüssel
Infrarot-Spektroskopie
 SoSe 19 Infrarot-Spektroskopie E = h v = h c ሚθ E = Energie; h = Planck sches Wirkungsquantum; v = Frequenz; c = Lichtgeschwindigkeit, ሚθ = Wellenzahl 1 3.1 Schwingungsmodi T / % Moleküle werden mit Licht
SoSe 19 Infrarot-Spektroskopie E = h v = h c ሚθ E = Energie; h = Planck sches Wirkungsquantum; v = Frequenz; c = Lichtgeschwindigkeit, ሚθ = Wellenzahl 1 3.1 Schwingungsmodi T / % Moleküle werden mit Licht
Organik KOMPAKT Organik Blatt 1/5
 rganik KMPAKT rganik Blatt 1/5 1 Elemente in organischen Verbindungen Kohlenstoff () Sauerstoff () Wasserstoff () Stickstoff (N) Phosphor (P) Schwefel (S) Kohlenstoff kommt immer in organischen Verbindungen
rganik KMPAKT rganik Blatt 1/5 1 Elemente in organischen Verbindungen Kohlenstoff () Sauerstoff () Wasserstoff () Stickstoff (N) Phosphor (P) Schwefel (S) Kohlenstoff kommt immer in organischen Verbindungen
Termumformungen. Binomische Formeln und Faktorisierung Teil 1. Klasse 8. Datei Nr
 Term-Umformungen 5 ALGEBRA Terme Termumformungen Binomische Formeln und Faktorisierung Teil 1 Klasse 8 Datei Nr. 110 Diese Datei enthält nicht alle Lösungen. Auf der Mathematik-CD befinden sich alle Läsungen.
Term-Umformungen 5 ALGEBRA Terme Termumformungen Binomische Formeln und Faktorisierung Teil 1 Klasse 8 Datei Nr. 110 Diese Datei enthält nicht alle Lösungen. Auf der Mathematik-CD befinden sich alle Läsungen.
10. Übung zur Linearen Algebra I -
 . Übung zur Linearen Algebra I - en Kommentare an Hannes.Klarner@FU-Berlin.de FU Berlin. WS 29-. Aufgabe 37 i Für welche α R besitzt das lineare Gleichungssystem 4 αx + αx 2 = 4x + α + 2x 2 = α genau eine,
. Übung zur Linearen Algebra I - en Kommentare an Hannes.Klarner@FU-Berlin.de FU Berlin. WS 29-. Aufgabe 37 i Für welche α R besitzt das lineare Gleichungssystem 4 αx + αx 2 = 4x + α + 2x 2 = α genau eine,
Atome. Chemie. Zusammenfassungen. Prüfung Mittwoch, 14. Dezember Dalton-Modell. Reaktionsgrundgesetze. Chemische Formeln.
 Chemie Atome Zusammenfassungen Prüfung Mittwoch, 14. Dezember 2016 Dalton-Modell Reaktionsgrundgesetze Chemische Formeln Avogadro Relative Massen Quantitative Beziehungen Stöchiometrie Steffi, Tom, Marvin
Chemie Atome Zusammenfassungen Prüfung Mittwoch, 14. Dezember 2016 Dalton-Modell Reaktionsgrundgesetze Chemische Formeln Avogadro Relative Massen Quantitative Beziehungen Stöchiometrie Steffi, Tom, Marvin
Schreiben Sie Ihre ö AUSSCHLIEßLICH!!! auf. die leeren Seiten 5 8!
 1. Ermitteln Sie die Konstitution der Verbindung aus MQ, Protonen und protonenbreitbandentkoppeltem Kohlenstoffspektrum. a. Ermitteln Sie alle chemischen Verschiebungen ( 1 und 13 ) und Kopplungskonstanten
1. Ermitteln Sie die Konstitution der Verbindung aus MQ, Protonen und protonenbreitbandentkoppeltem Kohlenstoffspektrum. a. Ermitteln Sie alle chemischen Verschiebungen ( 1 und 13 ) und Kopplungskonstanten
M U S T E R L Ö S U N G
 Prof. Dr.. eiser Prof. Dr. A. Geyer achholklausur zur 3. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 2002 am Freitag, dem 2. August 2002 ame:...vorname:...
Prof. Dr.. eiser Prof. Dr. A. Geyer achholklausur zur 3. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 2002 am Freitag, dem 2. August 2002 ame:...vorname:...
gleicher Magnetfeldstärke die Resonanzfrequenz entsprechend kleiner; z.b: 400 MHz 1 H, aber MHz 13 C.
 Der 13 C-Kern ist in seinen wichtigsten Kerneigenschaften dem 1 H ähnlich. Er ist ebenso ein Spin-½-Kern, weist also im äußeren Magnetfeld B 0 nur zwei praktisch gleich populierte Energiezustande auf.
Der 13 C-Kern ist in seinen wichtigsten Kerneigenschaften dem 1 H ähnlich. Er ist ebenso ein Spin-½-Kern, weist also im äußeren Magnetfeld B 0 nur zwei praktisch gleich populierte Energiezustande auf.
NMR-Spektroskopie an Peptiden. Peptide. Worum soll es heute gehen? Peptide. 2D-NMR-Spektroskopie. Seminar AG Rademann
 2/52 Seminar AG Rademann 3.11.2005 Worum soll es heute gehen? 2D-NMR-Spektroskopie Sequenzspezifische Zuordnung Bestimmung der 3D-Struktur 3/52 4/52 Die Primärstruktur 5/52 6/52 20 natürliche Aminosäuren
2/52 Seminar AG Rademann 3.11.2005 Worum soll es heute gehen? 2D-NMR-Spektroskopie Sequenzspezifische Zuordnung Bestimmung der 3D-Struktur 3/52 4/52 Die Primärstruktur 5/52 6/52 20 natürliche Aminosäuren
AK Chemie Baukasten Der Schüler als Molekülbaumeister Info X303
 Kategorie Übungen und Tests Übungsmodus ja Testmodus - Schwierigkeitsgrade 2/2 vorwählbare Aufgabenzahl 35 Aktueller Notenstand - Highscore ja Musik zur Belobigung wählbar Spezielle Hilfen: Dr. Atom Steuerung
Kategorie Übungen und Tests Übungsmodus ja Testmodus - Schwierigkeitsgrade 2/2 vorwählbare Aufgabenzahl 35 Aktueller Notenstand - Highscore ja Musik zur Belobigung wählbar Spezielle Hilfen: Dr. Atom Steuerung
6. Viel-Elektronen Atome
 6. Viel-Elektronen 6.1 Periodensystem der Elemente 6.2 Schwerere 6.3 L S und j j Kopplung 6.1 6.1 Periodensystem der Elemente 6.2 Auffüllen der Elektronen-Orbitale Pauliprinzip: je 1 Elektron je Zustand
6. Viel-Elektronen 6.1 Periodensystem der Elemente 6.2 Schwerere 6.3 L S und j j Kopplung 6.1 6.1 Periodensystem der Elemente 6.2 Auffüllen der Elektronen-Orbitale Pauliprinzip: je 1 Elektron je Zustand
Übungsaufgaben zum Atomaufbau und Periodensystem mit Lösungen
 Allgemeine und Anorganische Chemie Übungsaufgaben zum Atomaufbau und Periodensystem mit Lösungen Aufgabe 1: Welche der folgenden Aussagen trifft für alle Atome, einschließlich des Wasserstoffatoms, zu?
Allgemeine und Anorganische Chemie Übungsaufgaben zum Atomaufbau und Periodensystem mit Lösungen Aufgabe 1: Welche der folgenden Aussagen trifft für alle Atome, einschließlich des Wasserstoffatoms, zu?
Allgemeine Chemie I Herbstsemester 2011
 Lösung 2 Allgemeine Chemie I Herbstsemester 2011 1. Aufgabe Für die Berechnung der mittleren Atommasse m von Nickel sind die Massen m i der einzelnen Isotope i in ihrer Häufigkeit p i zu berücksichtigen.
Lösung 2 Allgemeine Chemie I Herbstsemester 2011 1. Aufgabe Für die Berechnung der mittleren Atommasse m von Nickel sind die Massen m i der einzelnen Isotope i in ihrer Häufigkeit p i zu berücksichtigen.
Proteinbestimmung in biogenem Material durch Elementaranalyse von Stickstoff. Elementaranalyse Info 1
 Proteinbestimmung in biogenem Material durch Elementaranalyse von Stickstoff Elementaranalyse Info 1 Einleitung 1 qualitative und quantitative Analyse organischer Verbindungen. Es wird nach der Menge jener
Proteinbestimmung in biogenem Material durch Elementaranalyse von Stickstoff Elementaranalyse Info 1 Einleitung 1 qualitative und quantitative Analyse organischer Verbindungen. Es wird nach der Menge jener
