Umwandlungsenergien. Versuch: Inhaltsverzeichnis. Fachrichtung Physik. Erstellt: U. Escher A. Sadovsky. Physikalisches Grundpraktikum
|
|
|
- Jesko Heintze
- vor 7 Jahren
- Abrufe
Transkript
1 Fachrichtung Physik Physikalisches Grundpraktikum Versuch: UE Erstellt: U. Escher A. Sadovsky Bearbeitet: M. Kreller J. Kelling F. Lemke S. Majewsky i. A. Dr. Escher Aktualisiert: am Umwandlungsenergien Inhaltsverzeichnis 1 Aufgabenstellung 2 2 Allgemeine Grundlagen Phasenumwandlungen Verdampfen Schmelzen Spezifische Wärmekapazität und Umwandlungsenthalpie Aufheizen bzw. Abkühlen im realen Kalorimeter Experimente Bestimmung von C nach der Mischungsmethode Bestimmung der Schmelzenthalpie von Eis Verdampfungs- oder Kondensationsenthalpie Anhang Gleichheit der Flächen Herleitung der Clausius-Clapeyronschen Gleichung Versuchsbedingungen, thermodynamische Potentiale Fragen 8 Literatur 8
2 Versuch: UE Allgemeine Grundlagen Seite 2 1 Aufgabenstellung 1. Die Wärmekapazität eines Kalorimeters ist nach der Mischungsmethode zu bestimmen. 2. Es sind die innere Verdampfungsenthalpie einer Flüssigkeit und 3. die Schmelzenthalpie von Eis zu bestimmen. 2 Allgemeine Grundlagen 2.1 Phasenumwandlungen Verdampfen Der flüssige und dampfförmige Zustand eines Stoffes sind zwei Phasen, die gleichzeitig existieren können und die sich beim Sättigungsdampfdruck im thermodynamischen Gleichgewicht befinden. Bei konstanter Temperatur tritt die gleiche Anzahl von Molekülen aus der Flüssigkeit aus wie auch wieder ein. Bei einer Temperaturerhöhung können mehr Moleküle die zum Verdampfen notwendige (Verdampfungs-) Energie aufbringen. Die Wahrscheinlichkeit, daß ein Molekül verdampft ist, genügt der Boltzmann-Statistik. Dies hat eine exponentiell mit T ansteigende Dampfdruck-Kurve zur Folge (s. Abb. 1): ( p d (T ) n fl kt exp mq ) v (1) N kt Abb. 1: Wasser: Dampfdruck-Kurve (a); Sublimations- und Schmelzdruck sowie Tripelpunkt (b) [1] Zwischen der Steigung der Dampfdruck-Kurve und der Verdampfungswärme (besser: Verdampfungsenthalpie) q v (bzw. entsprechend beim Schmelzen, q s ) vermittelt die Gleichung von Clausius- Clapeyron einen Zusammenhang: q v = T dp d dt (v d v fl ) bzw. q s = T dp s dt (v fl v fest ) (2) Dabei sind v d, v fl und v fest die spezifischen Volumina der drei Aggregatzustände, p d der Dampfdruck und p s der Schmelzdruck Schmelzen Bei der Schmelztemperatur sind Festkörper und Flüssigkeit im thermodynamischen Gleichgewicht. Die spezifische Schmelzenthalpie q s ist immer positiv. Das Vorzeichen des Anstiegs der
3 Versuch: UE Allgemeine Grundlagen Seite 3 Schmelzdruck-Kurve p s (T ) hängt damit vom Vorzeichen von v fl v fest ab. Für Eis und wenige andere Stoffe (Ge, Ga, Bi) ist v fl v fest negativ (die Dichte von Eis ist geringer als die von Wasser). Beim Tripelpunkt (Wasser: p = 6,1 mbar und T = 0,0075 C) besteht ein Gleichgewicht zwischen Festkörper, Flüssigkeit und Dampf. In ihm vereinigen sich Sublimationsdruck-, Dampfdruck- und Schmelzdruck-Kurve. 2.2 Spezifische Wärmekapazität und Umwandlungsenthalpie Die einem Körper der Masse m zugeführte Wärmeenergie ΔQ erzeugt entweder eine Temperaturerhöhung ΔT, die der spezifischen Wärmekapazität c umgekehrt proportional ist ΔQ = m c ΔT (3) oder sie bewirkt bei konstanter Temperatur (im Idealfall adiabatisch; z. B. bei der Schmelz- oder der Siedetemperatur) eine Änderung des Aggregatzustandes (oder allgemeiner eine Strukturoder Phasenumwandlung), z. B. den Übergang vom festen zum flüssigen oder vom flüssigen zum gasförmigen Zustand mit den Energiebilanzen: ΔQ s = m q s (4a) bzw. ΔQ v = m q v (4b) Erwärmt man z. B. eine vorgegebene Masse reinen Wassers bei konstantem Druck in einem idealen Kalorimeter, beginnend bei minus 10 C, durch zeitlich konstante Zufuhr an Wärmeenergie, so ändert sich die Temperatur im Eis (bzw. später im Wasser) entsprechend Abb. 2. Hierbei sind die zwei ansteigenden Kurvenabschnitte der Gleichung (3) und die zwei horizontalen den Gleichungen (4a) und (4b) zuzuordnen. Die Zeitdifferenz t 2 t 1 ist proportional zu q s. Die Schmelzund Siedetemperaturen (T s und T si ) sind druckabhängig (wie?). Abb. 2: Schema des Aufheizens von Eis (bzw. Wasser) im idealen Kalorimeter Die Kalorimetrie beruht auf dem ersten Hauptsatz der Wärmelehre. Es werden Differenzen der inneren Energie (besser: Enthalpie) zwischen zwei Zuständen eines Systems bestimmt. Man unterscheidet zwischen Kalorimetern konstanter Masse und Strömungskalorimetern 1 [3] 2.3 Aufheizen bzw. Abkühlen im realen Kalorimeter Ein reales Kalorimeter konstanter Masse besitzt einerseits eine endliche Wärmekapazität C und gibt andererseits infolge nicht idealer Wärmeisolation durch (Konvektion, Wärmestrahlung und) Wärmeleitung (I w (2) = λa l (T T u ) = k (T T u )) an die Umgebung der Temperatur T u Wärme-Energie ab. Dabei ist der Energie-Verlust I w (1) gleich dem Wärmestrom I w (2). Mit T = T T u gilt: I (1) w = dq dt = (mc + C) d(t Tu) dt I (2) w = k (T T u ) } dt dt = k mc + C T 1 Strömungskalorimeter werden hier nicht betrachtet.
4 Versuch: UE Experimente Seite 4 Aus dieser Differentialgleichung erster Ordnung folgt das Newtonsche Abkühlungsgesetz: 2 ( T T u = (T 0 T u ) exp k ) mc + C t Für geringe Temperaturdifferenzen kann das Newtonsche Abkühlungsgesetz in differentieller Form benutzt oder linearisiert werden: ( ) k T T u = (T 0 T u ) 1 mc + C t wonach die Temperatur im Kalorimeter (ohne zu- oder abgeführte Prozesswärme) näherungsweise linear mit der Zeit ab- bzw. zunimmt. (5) 3 Experimente 3.1 Bestimmung von C nach der Mischungsmethode Zunächst wird die Leermasse des Kalorimetergefäßes einschließlich Deckel, Rührer, Thermometer und bei nachfolgender Bestimmung der Kondensationswärme zusätzlich auch der Kondensationsspirale (s. Abb. 3) ermittelt. Anschließend wird das Kalorimetergefäß mit kaltem Wasser gefüllt. Aus einer Wägung des gefüllten Gefäßes kann die Masse m w,1 des Wassers ermittelt werden. Nach einigen Minuten haben sich die Temperaturen von Gefäß und Wasser ausgeglichen und T 1 kann gemessen werden. Nach Hinzufügen einigen heißen Wassers der Temperatur T 2 und einigem Rühren wird die Mischungstemperatur T M gemessen. Durch nochmaliges Wägen des Gesamtgefäßes lässt sich die Masse des hinzugefügten heißen Wassers m w,2 berechnen. Die gesuchte Wärmekapazität C des Kalorimeters ergibt sich aus der Bilanzgleichung: Abb. 3: Kalorimeter ohne (a) und mit (b) Kondensationsspirale (m w,1 c w + C) (T 1 T M ) = m w,2 c w (T M T 2 ) (6) 2 k Die Geschwindigkeit des Ausgleichsvorgangs wird also durch den Quotienten (Wärmeleitfähigkeit [7]) mc+c bestimmt, den man bei guten Kalorimetern bei geringer Wärmekapazität mc + C (Empfindlichkeit) durch sehr gering gehaltene k-werte möglichst klein halten will. In sogenannten isoperibolen Kalorimetern bildet der Wärmeübergang zur Umgebung hingegen die wesentliche Messgröße. [3]
5 Versuch: UE Experimente Seite Bestimmung der Schmelzenthalpie von Eis Vor Beginn des Experimentes ist zu gewährleisten, dass die zur Messung verwendeten Eiswürfel auf eine Temperatur von T s = 0 C gebracht wurden. Hierzu wird das Eis in ein isoliertes Wassergefäß (T 5 C) gebracht, ein Teil davon in einen speziellen Einsatz (s Abb. 4). In das Kalorimetergefäß, welches zuvor mit Wasser (Masse m w ) bei Raumtemperatur T 1 gefüllt und anschließend gewogen wurde, werden nun ca. 50 g trockene Eiswürfel gegeben und der Temperatur-Zeit- Verlauf der Abkühlung registriert. Die Eismasse m Eis ergibt sich aus einer abschließenden Wägung des gesamten Gefäßes. Die spezifische Schmelzwärme für Eis ergibt sich dann aus der Wärmebilanz: (m w c w + C) (T 1 T M ) = m Eis q s + m Eis c w (T M T s ) (7) 3.3 Verdampfungs- oder Kondensationsenthalpie Abb. 4: Kalorimeter zur Bestimmung der Schmelzwärme Das Kalorimetergefäß, welches die gläserne Kondensationsspirale enthält, wird mit Wasser von Raumtemperatur gefüllt. Die im Verdampferkolben befindliche Flüssigkeit etwa 100 bis 150 ml wird zum Sieden gebracht (Siedetemperatur T si ). Nach Ausbildung stationärer Verhältnisse im Verbindungsrohr zum Kalorimetergefäß wird die Verbindung zur Kondensationsspirale hergestellt (s. Abb. 5) und im Verlauf einiger Minuten Kondensat angesammelt. Nach Abtrennen der Verbindung zum Verdampfer und Abwarten des Temperaturausgleichs wird die Endtemperatur T M im Inneren des Abb. 5: Bestimmung der Verdampfungswärme Kalorimetergefäßes registriert, die Masse des Kondensats m D ergibt sich in Analogie zu den oben beschriebenen Messabläufen aus mehreren Wägungen durch Differenzbildung. Die spezifische Kondensationswärme ergibt sich aus der Beziehung: m D q v,a + m D c w (T si T M ) = (c w m w + C) (T M T 1 ) (8) Die damit bestimmte Größe q v,a setzt sich aus zwei Anteilen zusammen: Zum Trennen der Moleküle muss nur die innere Verdampfenthalpie q v,i aufgebracht werden. Die verbleibende geringe Differenz, die Verdrängungsarbeit des Dampfes gegen den äußeren Luftdruck p L, berechnet sich über p L v d = R T zu: q v,i = q v,a p L (v d v fl ) q v,a p L v d = q v,a R T q v,a R T si (9) Dabei ist R = R/M die spezifische Gaskonstante, die sich aus der universellen Gaskonstante R = 8,315 J/(mol K) sowie der molaren Masse M = 18 g/mol der Flüssigkeit zusammensetzt.
6 Versuch: UE Anhang Seite 6 4 Anhang 4.1 Gleichheit der Flächen Es geht um die Berechnung der vom Kalorimeter aufgenommenen (oder abgegebenen) Wärmeenergie, z.b. der linken Seite von Gleichung (8), worin ohne Korrektur die Temperaturdifferenz verfälscht ist. Diese Korrektur gelingt bei Berücksichtigung der an die Umgebung mit der Temperatur T u während der endlichen Mischungszeit abgeleiteten Wärmenenergie Q u, die sich mit der Konstanten für die Kalorimeterverluste k entsprechend Gleichung (5) berechnet. Es werden zwei Abkühlungskurven (s. Abb. 6) verglichen: 1. Ohne Mischungsvorgang würde die Kurve T 1 (t) von A über B und D nach F verlaufen und die dabei nach außen abgegebene Wärmeenergie wäre nach (5): Q u 1 = k 0 (T 1 T u ) dt (10) 2. Beim Mischungsexperiment läuft die Kurve von A über B und E nach F und die dabei an die Umgebung abgegebene Wärme ist: Q u m = k 0 (T m T u ) dt (11) Abb. 6: Abkühlungskurven Die Differenz beider Beträge der Wärmeenergie Q u 1 Q u m = k 0 (T 1 T m ) dt (12) stellt als Fläche die zu messende Wärmemenge, also die linke Seite von (6), dar. Sie muss unabhängig von der Zeitdauer des Ausgleichs Δt sein, also auch für den Idealfall Δt 0 (Verlauf über die Punkte A, B, C, D und E) gelten. Damit ist zu fordern, dass die Flächen (Integrale), die zu den Kurven A-B-E und A-B-C-D-E gehören, identisch sind. Das bedeutet aber, daß die schraffierten Flächen in Abb. 6 gleich sein müssen. 4.2 Herleitung der Clausius-Clapeyronschen Gleichung Man betrachtet einen Kreisprozess mit einer Flüssigkeit, die bei der Temperatur T + dt verdampft, wobei gegen den Dampfdruck p d + dp die Arbeit W 1 = (p d + dp) (V d V fl ) aufzubringen ist (Punkt 1 zu Punkt 2). Nach adiabatischer Entspannung (zu Punkt 3) wird die Temperatur T erreicht und der Dampf (bzw. dann das Dampf-Flüssigkeits-Gemisch) beim Druck p d komprimiert, bis alles verflüssigt ist (Punkt 4), wobei die Arbeit W 2 = p d (V d V fl ) gewonnen wurde. Danach wird durch geringfügige Temperatur- und Druckerhöhung wieder Punkt 1 erreicht. Abb. 7: Kreisprozess mit verdampfender Flüssigkeit Bezüglich der Energiebeiträge entfallen die Übergänge 2 3 und 4 1 im Grenzfall dt 0, sodass die zugeführte Verdampfungswärme Q v mit dem Wirkungsgrad des Carnot-Prozesses (η C = dt T ) teilweise in die Arbeit ΔW = W 1 W 2 = dp d (V d V fl ) umgewandelt wurde: η C = ΔW = dp d (V d V fl ) = dt Q v Q v T (13)
7 Versuch: UE Literatur Seite 7 T / C q v / kj kg Tabelle 1: Spezifische Verdampfungsenthalpie von Wasser (374 C ist dessen kritische Temperatur) Nach Umstellung der rechten Seite sowie nach Übergang zur spezifischen Verdampfungsenthalpie q v = Q v /m und den spezifischen Volunima v d = V d /m und v fl = V fl /m folgt die Gleichung (2). Die Gleichungen (2) und (12) enthalten auch näherungsweise die Temperaturabhängigkeit von Q v,i (siehe experimentelle Werte für H 2 O in Tabelle 1). Aus der Clausius-Clapeyronschen Gleichung lässt sich auch der wesentliche Verlauf der Dampfdruck-Kurve weit unterhalb der kritischen Temperatur abschätzen. Dazu multiplizieren wir (2) mit m und beachten p V d = R T : Q v T dp d dt (V d V fl ) = T dp d R T dt p d Hieraus folgt eine Differentialgleichung für die Dampfdruck-Kurve p d (T ): dp d Q ( v p d R T 2 dt p d exp Q ) v R T 4.3 Versuchsbedingungen, thermodynamische Potentiale Man muss unterscheiden, ob der betreffende Prozess (z. B. eine Phasenumwandlung) bei konstantem Druck (isobar), konstantem Volumen (isochor), konstanter Temperatur (isotherm) oder konstanter Wärme (adiabatisch) durchgeführt wird. Allgemein ist je nach den Versuchsbedingungen das thermodynamische Gleichgewicht gegeben durch das Minimum der entsprechenden Energiegröße (siehe Tabelle 2), wobei Bezug nehmend auf die innere Energie U differentiell kleine Änderungen in der Nähe des Gleichgewichtes betrachtet werden. Daher muss streng genommen bei konstantem Luftdruck und (auf den Idealfall korrigiert) adiabatischen Bedingungen von Umwandlungsenthalpien gesprochen werden. Im Rahmen des Praktikums genügt auch der Begriff Umwandlungswärme (Enthalpie = Erwärmung). Bedingungen Größe Integrale Form Differientelle Form Q *, V = const. innere Energie U du = T ds p dv Q *, p = const. Enthalpie H = U + pv dh = T ds + V dp V, T = const. freie Energie F = U T S df = S dt p dv p, T = const. freie Enthalpie G = U T S + pv dg = S dt + V dp Tabelle 2: Thermodynamische Potentiale für verschiedene Versuchsbedingungen
8 Versuch: UE Literatur Seite 8 Wasser (H 2 O) Ethanol (C 2 H 5 OH) Temperatur T Dampfdruck p d Temperatur T Dampfdruck p d 98,5 C 960,2 mbar 76 C 926 mbar 99,0 C 977,6 mbar 77 C 963 mbar 99,5 C 995,3 mbar 78 C 1003 mbar 100,0 C 1013,2 mbar 78,4 C 1013,2 mbar 100,5 C 1031,5 mbar 79 C 1043 mbar 101,0 C 1049,9 mbar 80 C 1088 mbar Tabelle 3: Auszüge aus Dampfdruck-Kurven [3][9] Fragen 1. Wovon hängt der Dampfdruck einer Flüssigkeit ab? 2. Was ist die kritische Temperatur in Bezug auf die Dampfdruck-Kurve? 3. Welche Arten der Wärmeübertragung führen zum Temperaturausgleich beim realen Kalorimeter mit konstanter Masse? Wie gelingt gute Wärmeisolation? 4. Was versteht man unter Sublimation? 5. Was besagt die Gleichung von Clausius-Clapeyron? 6. Was versteht man unter dem Tripelpunkt? Bei welchen (p, T )-Koordinaten liegt er etwa bei Wasser? 7. Wie kann man Temperaturen und Wärmemengen messen? 8. Was besagt die van-der-waals sche Gleichung? 9. Wann siedet eine Flüssigkeit? Wie bestimmt man die Siedetemperatur T si von Wasser? 10. Wodurch ist der Anstieg der Dampfdruck-Kurve p d (T ) gegeben? 11. Wie korrigiert man bei kalorimetrischen Messungen die Verluste durch Wärmeaustausch mit der Umgebung? 12. Was versteht man unter Siedeverzug? Wie kann man ihn verhindern? 13. Wie erklären sich das Schlittschuh-Laufen und das Fließen der Gletscher über den Unterschied im spezifischen Volumen zwischen Wasser und Eis? 14. Zeichnen Sie den Temperatur-Zeit-Verlauf für eine gleichmäßige Energieabführung aus einer bestimmten Masse von Wasserdampf bis hin zu Eis! Was könnte man im Idealfall aus den Kurvenabschnitten bestimmen? Literatur [1] C. Gerthsen, H. Vogel, Physik, Springer-Verlag, Berlin, Heidelberg 1995 [2] A. Recknagel, Physik: Schwingungen, Wellen, Wärmelehre, Technik-Verlag, Berlin 1990 [3] F. Kohlrausch, Praktische Physik, Band 1/3, Teubner-Verlag, Stuttgart 1996 [4] H. Niedrig, Physik, Springer-Verlag, Berlin, Heidelberg 1992 [5] W. Walcher, Praktikum der Physik, Teubner-Verlag, Stuttgart 1989 [6] H. J. Paus, Physik in Experimenten und Beispielen, Verlag C.-Hanser, München 1995 [7] G. Joos, B. Fricke, Lehrbuch der theoretischen Physik, Aula-Verlag, Wiesbaden 1989 [8] W. Ilberg (Hrsg.), M. Krötzsch (Hrsg.) et. al., Physikalisches Praktikum für Anfänger, Teubner-Verlag, Leipzig 1994 [9] J. d Ans (Hrsg.), E. Lax (Hrsg.), Taschenbuch für Chemiker und Physiker, Springer- Verlag, Berlin, Heidelberg 1967
Phasenumwandlungsenthalpie
 Universität Potsdam Institut für Physik und Astronomie Grundpraktikum 7 Phasenumwandlungsenthalpie Die Enthalpieänderung beim Übergang eines Systems in einen anderen Aggregatzustand kann unter der Voraussetzung,
Universität Potsdam Institut für Physik und Astronomie Grundpraktikum 7 Phasenumwandlungsenthalpie Die Enthalpieänderung beim Übergang eines Systems in einen anderen Aggregatzustand kann unter der Voraussetzung,
8.4.5 Wasser sieden bei Zimmertemperatur ******
 8.4.5 ****** 1 Motivation Durch Verminderung des Luftdrucks siedet Wasser bei Zimmertemperatur. 2 Experiment Abbildung 1: Ein druckfester Glaskolben ist zur Hälfte mit Wasser gefüllt, so dass die Flüsigkeit
8.4.5 ****** 1 Motivation Durch Verminderung des Luftdrucks siedet Wasser bei Zimmertemperatur. 2 Experiment Abbildung 1: Ein druckfester Glaskolben ist zur Hälfte mit Wasser gefüllt, so dass die Flüsigkeit
Physikalisches Praktikum I
 Fachbereich Physik Physikalisches Praktikum I W21 Name: Verdampfungswärme von Wasser Matrikelnummer: Fachrichtung: Mitarbeiter/in: Assistent/in: Versuchsdatum: Gruppennummer: Endtestat: Folgende Fragen
Fachbereich Physik Physikalisches Praktikum I W21 Name: Verdampfungswärme von Wasser Matrikelnummer: Fachrichtung: Mitarbeiter/in: Assistent/in: Versuchsdatum: Gruppennummer: Endtestat: Folgende Fragen
Experimentalphysik VO, Kapitel 4Wärme: Wärme als Energieform (1. Hauptsatz), Mischungsvorgänge,
 3 Wärme 3.1 Lernziel Die Studierenden vertiefen das Verständnis der Begriffe Innere Energie, Wärme, spezifische Wärmekapazität und molare Wärme von Festkörpern und Flüssigkeiten. Sie können den Wasserwert
3 Wärme 3.1 Lernziel Die Studierenden vertiefen das Verständnis der Begriffe Innere Energie, Wärme, spezifische Wärmekapazität und molare Wärme von Festkörpern und Flüssigkeiten. Sie können den Wasserwert
Versuch Nr.53. Messung kalorischer Größen (Spezifische Wärmen)
 Versuch Nr.53 Messung kalorischer Größen (Spezifische Wärmen) Stichworte: Wärme, innere Energie und Enthalpie als Zustandsfunktion, Wärmekapazität, spezifische Wärme, Molwärme, Regel von Dulong-Petit,
Versuch Nr.53 Messung kalorischer Größen (Spezifische Wärmen) Stichworte: Wärme, innere Energie und Enthalpie als Zustandsfunktion, Wärmekapazität, spezifische Wärme, Molwärme, Regel von Dulong-Petit,
1 Thermodynamik allgemein
 Einführung in die Energietechnik Tutorium II: Thermodynamik Thermodynamik allgemein. offenes System: kann Materie und Energie mit der Umgebung austauschen. geschlossenes System: kann nur Energie mit der
Einführung in die Energietechnik Tutorium II: Thermodynamik Thermodynamik allgemein. offenes System: kann Materie und Energie mit der Umgebung austauschen. geschlossenes System: kann nur Energie mit der
Reale Gase. Versuch: RG. Inhaltsverzeichnis. Fachrichtung Physik. Erstellt: E. Beyer Aktualisiert: am Physikalisches Grundpraktikum
 Versuch: RG Fachrichtung Physik Physikalisches Grundpraktikum Erstellt: E. Beyer Aktualisiert: am 01. 10. 2010 Bearbeitet: J. Kelling F. Lemke S. Majewsky M. Justus Reale Gase Inhaltsverzeichnis 1 Aufgabenstellung
Versuch: RG Fachrichtung Physik Physikalisches Grundpraktikum Erstellt: E. Beyer Aktualisiert: am 01. 10. 2010 Bearbeitet: J. Kelling F. Lemke S. Majewsky M. Justus Reale Gase Inhaltsverzeichnis 1 Aufgabenstellung
Physikalisches Grundpraktikum. Phasenumwandlungen
 Fachrichtungen der Physik UNIVERSITÄT DES SAARLANDES Physikalisches Grundpraktikum WWW-Adresse Grundpraktikum Physik: http://grundpraktikum.physik.uni-saarland.de/ Kontaktadressen der Praktikumsleiter:
Fachrichtungen der Physik UNIVERSITÄT DES SAARLANDES Physikalisches Grundpraktikum WWW-Adresse Grundpraktikum Physik: http://grundpraktikum.physik.uni-saarland.de/ Kontaktadressen der Praktikumsleiter:
Formelsammlung Abfallwirtschaft Seite 1/6 Wärmekapazität Prof. Dr. Werner Bidlingmaier & Dr.-Ing. Christian Springer
 Formelsammlung Abfallwirtschaft Seite 1/6 1 Energiebedarf zur Erwärmung von Stoffen Der Energiebetrag, der benötigt wird, um 1 kg einer bestimmten Substanz um 1 C zu erwärmen, wird als die (auch: Spezifische
Formelsammlung Abfallwirtschaft Seite 1/6 1 Energiebedarf zur Erwärmung von Stoffen Der Energiebetrag, der benötigt wird, um 1 kg einer bestimmten Substanz um 1 C zu erwärmen, wird als die (auch: Spezifische
Wärmelehre/Thermodynamik. Wintersemester 2007
 Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 2007 Vladimir Dyakonov #12 am 26.01.2007 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 2007 Vladimir Dyakonov #12 am 26.01.2007 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
PHYSIKALISCHES PRAKTIKUM FÜR ANFÄNGER LGyGe. W 3 - Kalorimetrie
 10.08.2008 PHYSIKALISCHES PRAKTIKUM FÜR ANFÄNGER LGyGe Versuch: W 3 - Kalorimetrie 1. Grundlagen Definition und Einheit von Wärme und Temperatur; Wärmekapazität (spezifische und molare); Regel von Dulong
10.08.2008 PHYSIKALISCHES PRAKTIKUM FÜR ANFÄNGER LGyGe Versuch: W 3 - Kalorimetrie 1. Grundlagen Definition und Einheit von Wärme und Temperatur; Wärmekapazität (spezifische und molare); Regel von Dulong
Ferienkurs Experimentalphysik 2 - Donnerstag-Übungsblatt
 1 Aufgabe: Entropieänderung Ferienkurs Experimentalphysik 2 - Donnerstag-Übungsblatt 1 Aufgabe: Entropieänderung a) Ein Kilogramm Wasser bei = C wird in thermischen Kontakt mit einem Wärmereservoir bei
1 Aufgabe: Entropieänderung Ferienkurs Experimentalphysik 2 - Donnerstag-Übungsblatt 1 Aufgabe: Entropieänderung a) Ein Kilogramm Wasser bei = C wird in thermischen Kontakt mit einem Wärmereservoir bei
Dampfdruck von Flüssigkeiten (Clausius-Clapeyron' sche Gleichung)
 Versuch Nr. 57 Dampfdruck von Flüssigkeiten (Clausius-Clapeyron' sche Gleichung) Stichworte: Dampf, Dampfdruck von Flüssigkeiten, dynamisches Gleichgewicht, gesättigter Dampf, Verdampfungsenthalpie, Dampfdruckkurve,
Versuch Nr. 57 Dampfdruck von Flüssigkeiten (Clausius-Clapeyron' sche Gleichung) Stichworte: Dampf, Dampfdruck von Flüssigkeiten, dynamisches Gleichgewicht, gesättigter Dampf, Verdampfungsenthalpie, Dampfdruckkurve,
Grundlagen der Physik II
 Grundlagen der Physik II Othmar Marti 12. 07. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Wärmelehre Grundlagen der Physik II 12. 07. 2007 Klausur Die Klausur
Grundlagen der Physik II Othmar Marti 12. 07. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Wärmelehre Grundlagen der Physik II 12. 07. 2007 Klausur Die Klausur
Kapitel IV Wärmelehre und Thermodynamik
 Kapitel IV Wärmelehre und Thermodynamik a) Definitionen b) Temperatur c) Wärme und Wärmekapazität d) Das ideale Gas - makroskopisch e) Das reale Gas / Phasenübergänge f) Das ideale Gas mikroskopisch g)
Kapitel IV Wärmelehre und Thermodynamik a) Definitionen b) Temperatur c) Wärme und Wärmekapazität d) Das ideale Gas - makroskopisch e) Das reale Gas / Phasenübergänge f) Das ideale Gas mikroskopisch g)
Bestimmung der spezifischen Wärmekapazität fester Körper
 - B02.1 - Versuch B2: Bestimmung der spezifischen Wärmekapazität fester Körper 1. Literatur: Demtröder, Experimentalphysik, Bd. I Bergmann-Schaefer, Lehrbuch der Physik, Bd.I Walcher, Praktikum der Physik
- B02.1 - Versuch B2: Bestimmung der spezifischen Wärmekapazität fester Körper 1. Literatur: Demtröder, Experimentalphysik, Bd. I Bergmann-Schaefer, Lehrbuch der Physik, Bd.I Walcher, Praktikum der Physik
1. Klausur ist am 5.12.! Jetzt lernen! Klausuranmeldung: Bitte heute in Listen eintragen!
 1. Klausur ist am 5.12.! Jetzt lernen! Klausuranmeldung: Bitte heute in Listen eintragen! Aggregatzustände Fest, flüssig, gasförmig Schmelz -wärme Kondensations -wärme Die Umwandlung von Aggregatzuständen
1. Klausur ist am 5.12.! Jetzt lernen! Klausuranmeldung: Bitte heute in Listen eintragen! Aggregatzustände Fest, flüssig, gasförmig Schmelz -wärme Kondensations -wärme Die Umwandlung von Aggregatzuständen
Spezifische Wärmekapazität fester Körper
 Version: 14. Oktober 2005 Spezifische Wärmekapazität fester Körper Stichworte Wärmemenge, spezifische Wärme, Schmelzwärme, Wärmekapazität, Wasserwert, Siedepunkt, innere Energie, Energiesatz, Hauptsätze
Version: 14. Oktober 2005 Spezifische Wärmekapazität fester Körper Stichworte Wärmemenge, spezifische Wärme, Schmelzwärme, Wärmekapazität, Wasserwert, Siedepunkt, innere Energie, Energiesatz, Hauptsätze
A 1.1 a Wie groß ist das Molvolumen von Helium, flüssigem Wasser, Kupfer, Stickstoff und Sauerstoff bei 1 bar und 25 C?
 A 1.1 a Wie groß ist das Molvolumen von Helium, flüssigem Wasser, Kupfer, Stickstoff und Sauerstoff bei 1 bar und 25 C? (-> Tabelle p) A 1.1 b Wie groß ist der Auftrieb eines Helium (Wasserstoff) gefüllten
A 1.1 a Wie groß ist das Molvolumen von Helium, flüssigem Wasser, Kupfer, Stickstoff und Sauerstoff bei 1 bar und 25 C? (-> Tabelle p) A 1.1 b Wie groß ist der Auftrieb eines Helium (Wasserstoff) gefüllten
Wärmelehre Zustandsänderungen ideales Gases
 Wärmelehre Zustandsänderungen ideales Gases p Gas-Gleichung 1.Hauptsatz p V = N k B T U Q W p 1 400 1 isobar 300 200 isochor isotherm 100 p 2 0 2 adiabatisch 0 1 2 3 4 5 V V 2 1 V Bemerkung: Mischung verschiedener
Wärmelehre Zustandsänderungen ideales Gases p Gas-Gleichung 1.Hauptsatz p V = N k B T U Q W p 1 400 1 isobar 300 200 isochor isotherm 100 p 2 0 2 adiabatisch 0 1 2 3 4 5 V V 2 1 V Bemerkung: Mischung verschiedener
Carnotscher Kreisprozess
 Carnotscher Kreisprozess (idealisierter Kreisprozess) 2 p 1, V 1, T 1 p(v) dv > 0 p 2, V 2, T 1 Expansionsarbeit wird geleistet dq fließt aus Wärmebad zu dq > 0 p 2, V 2, T 1 p(v) dv > 0 p 3, V 3, T 2
Carnotscher Kreisprozess (idealisierter Kreisprozess) 2 p 1, V 1, T 1 p(v) dv > 0 p 2, V 2, T 1 Expansionsarbeit wird geleistet dq fließt aus Wärmebad zu dq > 0 p 2, V 2, T 1 p(v) dv > 0 p 3, V 3, T 2
Versuch 14: Dampfdruckkurve - Messung der Dampfdruckkurven leicht verdampfbarer Flüssigkeiten -
 1 ersuch 14: Dampfdruckkurve - Messung der Dampfdruckkurven leicht verdampfbarer Flüssigkeiten - 1. Theorie Befindet sich eine Flüssigkeit in einem abgeschlossenen Gefäß, so stellt sich zwischen der Gasphase
1 ersuch 14: Dampfdruckkurve - Messung der Dampfdruckkurven leicht verdampfbarer Flüssigkeiten - 1. Theorie Befindet sich eine Flüssigkeit in einem abgeschlossenen Gefäß, so stellt sich zwischen der Gasphase
2 Allgemeine Grundlagen 2 2.1 Absolute und relative Luftfeuchtigkeit... 2 2.2 Partialdruck des Wasserdampfes... 2
 Versuch: LF Fachrichtung Physik Physikalisches Grundpraktikum Bearbeitet: M. Kreller. Kelling F. Lemke S. Majewsky i.a. Dr. Escher Aktualisiert: am 16. 09. 2009 Luftfeuchtigkeit Inhaltsverzeichnis 1 Aufgabenstellung
Versuch: LF Fachrichtung Physik Physikalisches Grundpraktikum Bearbeitet: M. Kreller. Kelling F. Lemke S. Majewsky i.a. Dr. Escher Aktualisiert: am 16. 09. 2009 Luftfeuchtigkeit Inhaltsverzeichnis 1 Aufgabenstellung
(b) Schritt I: freie adiabatische Expansion, also ist δw = 0, δq = 0 und damit T 2 = T 1. Folglich ist nach 1. Hauptsatz auch U = 0.
 3 Lösungen Lösung zu 65. (a) Siehe Abbildung 1. (b) Schritt I: freie adiabatische Expansion, also ist δw 0, δq 0 und damit. Folglich ist nach 1. Hauptsatz auch U 0. Schritt II: isobare Kompression, also
3 Lösungen Lösung zu 65. (a) Siehe Abbildung 1. (b) Schritt I: freie adiabatische Expansion, also ist δw 0, δq 0 und damit. Folglich ist nach 1. Hauptsatz auch U 0. Schritt II: isobare Kompression, also
Klausur Wärmelehre E2/E2p SoSe 2016 Braun. Formelsammlung Thermodynamik
 Klausur Wärmelehre E2/E2p SoSe 2016 Braun Name: Matrikelnummer: O E2 O E2p (bitte ankreuzen) Die mit Stern (*) gekennzeichneten Aufgaben sind für E2-Kandidaten vorgesehen - E2p-Kandidaten dürfen diese
Klausur Wärmelehre E2/E2p SoSe 2016 Braun Name: Matrikelnummer: O E2 O E2p (bitte ankreuzen) Die mit Stern (*) gekennzeichneten Aufgaben sind für E2-Kandidaten vorgesehen - E2p-Kandidaten dürfen diese
Physik III - Anfängerpraktikum- Versuch 203
 Physik III - Anfängerpraktikum- Versuch 203 Sebastian Rollke (103095) und Daniel Brenner (105292) 1. Februar 2005 Inhaltsverzeichnis 1 Vorbetrachtung 2 2 Theorie 2 2.1 Die mikroskopischen Vorgänge bei
Physik III - Anfängerpraktikum- Versuch 203 Sebastian Rollke (103095) und Daniel Brenner (105292) 1. Februar 2005 Inhaltsverzeichnis 1 Vorbetrachtung 2 2 Theorie 2 2.1 Die mikroskopischen Vorgänge bei
Versuch W1: Kalorimetrie
 Versuch W1: Kalorimetrie Aufgaben: 1. Bestimmen Sie die Wärmekapazität zweier Kalorimeter (Kalorimeterkonstanten). 2. Bestimmen Sie die spezifische Wärmekapazität von 2 verschiedenen festen Stoffen. 3.
Versuch W1: Kalorimetrie Aufgaben: 1. Bestimmen Sie die Wärmekapazität zweier Kalorimeter (Kalorimeterkonstanten). 2. Bestimmen Sie die spezifische Wärmekapazität von 2 verschiedenen festen Stoffen. 3.
Physik 2 (B.Sc. EIT) 2. Übungsblatt
 Institut für Physik Werner-Heisenberg-Weg 9 Fakultät für Elektrotechnik 85577 München / Neubiberg Universität der Bundeswehr München / Neubiberg Prof Dr H Baumgärtner Übungen: Dr-Ing Tanja Stimpel-Lindner,
Institut für Physik Werner-Heisenberg-Weg 9 Fakultät für Elektrotechnik 85577 München / Neubiberg Universität der Bundeswehr München / Neubiberg Prof Dr H Baumgärtner Übungen: Dr-Ing Tanja Stimpel-Lindner,
Spezifische Wärmekapazität
 Versuch: KA Fachrichtung Physik Physikalisches Grundpraktikum Erstellt: L. Jahn B. Wehner J. Pöthig J. Stelzer am 01. 06. 1997 Bearbeitet: M. Kreller J. Kelling F. Lemke S. Majewsky i. A. Dr. Escher am
Versuch: KA Fachrichtung Physik Physikalisches Grundpraktikum Erstellt: L. Jahn B. Wehner J. Pöthig J. Stelzer am 01. 06. 1997 Bearbeitet: M. Kreller J. Kelling F. Lemke S. Majewsky i. A. Dr. Escher am
Phasengleichgewicht und Phasenübergänge. Gasförmig
 Phasengleichgewicht und Phasenübergänge Siedetemperatur Flüssig Gasförmig Sublimationstemperatur Schmelztemperatur Fest Aus unserer Erfahrung mit Wasser wissen wir, dass Substanzen ihre Eigenschaften bei
Phasengleichgewicht und Phasenübergänge Siedetemperatur Flüssig Gasförmig Sublimationstemperatur Schmelztemperatur Fest Aus unserer Erfahrung mit Wasser wissen wir, dass Substanzen ihre Eigenschaften bei
Versuch 2. Physik für (Zahn-)Mediziner. c Claus Pegel 13. November 2007
 Versuch 2 Physik für (Zahn-)Mediziner c Claus Pegel 13. November 2007 1 Wärmemenge 1 Wärme oder Wärmemenge ist eine makroskopische Größe zur Beschreibung der ungeordneten Bewegung von Molekülen ( Schwingungen,
Versuch 2 Physik für (Zahn-)Mediziner c Claus Pegel 13. November 2007 1 Wärmemenge 1 Wärme oder Wärmemenge ist eine makroskopische Größe zur Beschreibung der ungeordneten Bewegung von Molekülen ( Schwingungen,
T p = T = RT. V b. ( ) 2 V p. V b. 2a(V b)2 V 3 RT. 2a(V b) V 3 (p+ a V 2 )
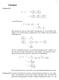 3 Lösung zu 83. Lösungen ( C C = T ( = T ( ( ( 2 van-der-waals Gas: ( ( b + a 2 = T = T b a 2 Man beachte das dies nur eine andere Formulierung der van-der-waals Gleichung ist als auf dem letzten Aufgabenzettel.
3 Lösung zu 83. Lösungen ( C C = T ( = T ( ( ( 2 van-der-waals Gas: ( ( b + a 2 = T = T b a 2 Man beachte das dies nur eine andere Formulierung der van-der-waals Gleichung ist als auf dem letzten Aufgabenzettel.
A 3 Dampfdruckkurve einer leichtflüchtigen Flüssigkeit
 Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1 A 3 Dampfdruckkurve einer leichtflüchtigen Flüssigkeit Aufgabe: Es ist die Dampfdruckkurve einer leicht flüchtigen Flüssigkeit zu ermitteln
Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1 A 3 Dampfdruckkurve einer leichtflüchtigen Flüssigkeit Aufgabe: Es ist die Dampfdruckkurve einer leicht flüchtigen Flüssigkeit zu ermitteln
d) Das ideale Gas makroskopisch
 d) Das ideale Gas makroskopisch Beschreibung mit Zustandsgrößen p, V, T Brauchen trotzdem n, R dazu Immer auch Mikroskopische Argumente dazunehmen Annahmen aus mikroskopischer Betrachtung: Moleküle sind
d) Das ideale Gas makroskopisch Beschreibung mit Zustandsgrößen p, V, T Brauchen trotzdem n, R dazu Immer auch Mikroskopische Argumente dazunehmen Annahmen aus mikroskopischer Betrachtung: Moleküle sind
Die Schmelz- und Verdampfungswärme von Wasser
 1/1 01.10.00,19:27Erstellt von Oliver Stamm Die Schmelz- und Verdampfungswärme von Wasser 1. Einleitung 1.1. Die Ausgangslage zum Experiment 1.2. Die Vorgehensweise 2. Theorie 2.1.
1/1 01.10.00,19:27Erstellt von Oliver Stamm Die Schmelz- und Verdampfungswärme von Wasser 1. Einleitung 1.1. Die Ausgangslage zum Experiment 1.2. Die Vorgehensweise 2. Theorie 2.1.
A 3 Dampfdruckkurve einer leichtflüchtigen Flüssigkeit
 Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1 A 3 Dampfdruckkurve einer leichtflüchtigen Flüssigkeit Aufgabe: Es ist die Dampfdruckkurve einer leicht flüchtigen Flüssigkeit zu ermitteln
Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1 A 3 Dampfdruckkurve einer leichtflüchtigen Flüssigkeit Aufgabe: Es ist die Dampfdruckkurve einer leicht flüchtigen Flüssigkeit zu ermitteln
3.4 Änderung des Aggregatzustandes
 34 Änderung des Aggregatzustandes Man unterscheidet 3 Aggregatzustände: Fest Flüssig Gasförmig Temperatur: niedrig mittel hoch Molekülbindung: Gitter lose Bindung keine Bindung schmelzen sieden erstarren
34 Änderung des Aggregatzustandes Man unterscheidet 3 Aggregatzustände: Fest Flüssig Gasförmig Temperatur: niedrig mittel hoch Molekülbindung: Gitter lose Bindung keine Bindung schmelzen sieden erstarren
Fachrichtung Klima- und Kälteanlagenbauer
 Fachrichtung Klima- und Kälteanlagenbauer 1-7 Schüler Datum: 1. Titel der L.E. : 2. Fach / Klasse : Fachrechnen, 3. Ausbildungsjahr 3. Themen der Unterrichtsabschnitte : 1. Zustandsänderung 2. Schmelzen
Fachrichtung Klima- und Kälteanlagenbauer 1-7 Schüler Datum: 1. Titel der L.E. : 2. Fach / Klasse : Fachrechnen, 3. Ausbildungsjahr 3. Themen der Unterrichtsabschnitte : 1. Zustandsänderung 2. Schmelzen
a) Welche der folgenden Aussagen treffen nicht zu? (Dies bezieht sind nur auf Aufgabenteil a)
 Aufgabe 1: Multiple Choice (10P) Geben Sie an, welche der Aussagen richtig sind. Unabhängig von der Form der Fragestellung (Singular oder Plural) können eine oder mehrere Antworten richtig sein. a) Welche
Aufgabe 1: Multiple Choice (10P) Geben Sie an, welche der Aussagen richtig sind. Unabhängig von der Form der Fragestellung (Singular oder Plural) können eine oder mehrere Antworten richtig sein. a) Welche
Versuch Nr. 7. = q + p dv
 Hochschule Augsburg Versuch Nr. 7 Physikalisches Aufbauten 7 a bzw. 27 a Praktikum Spezifische Verdampfungsenthalpie - Dampfdruckkurve 1. Grundlagen_und_Versuchsidee 1.1 Definition der Verdampfungsenthalpie:E
Hochschule Augsburg Versuch Nr. 7 Physikalisches Aufbauten 7 a bzw. 27 a Praktikum Spezifische Verdampfungsenthalpie - Dampfdruckkurve 1. Grundlagen_und_Versuchsidee 1.1 Definition der Verdampfungsenthalpie:E
(VIII) Wärmlehre. Wärmelehre Karim Kouz WS 2014/ Semester Biophysik
 Quelle: http://www.pro-physik.de/details/news/1666619/neues_bauprinzip_fuer_ultrapraezise_nuklearuhr.html (VIII) Wärmlehre Karim Kouz WS 2014/2015 1. Semester Biophysik Wärmelehre Ein zentraler Begriff
Quelle: http://www.pro-physik.de/details/news/1666619/neues_bauprinzip_fuer_ultrapraezise_nuklearuhr.html (VIII) Wärmlehre Karim Kouz WS 2014/2015 1. Semester Biophysik Wärmelehre Ein zentraler Begriff
1. Klausur ist am 5.12.! (für Vets sowie Bonuspunkte für Zahni-Praktikum) Jetzt lernen!
 1. Klausur ist am 5.12.! (für Vets sowie Bonuspunkte für Zahni-Praktikum) Jetzt lernen! http://www.physik.uni-giessen.de/dueren/ User: duerenvorlesung Password: ****** Druck und Volumen Gesetz von Boyle-Mariotte:
1. Klausur ist am 5.12.! (für Vets sowie Bonuspunkte für Zahni-Praktikum) Jetzt lernen! http://www.physik.uni-giessen.de/dueren/ User: duerenvorlesung Password: ****** Druck und Volumen Gesetz von Boyle-Mariotte:
Festkörper - System steht unter Atmosphärendruck gemessenen Wärmen erhalten Index p : - isoliert
 Kalorimetrie Mit Hilfe der Kalorimetrie können die spezifischen Wärmekapazitäten für Festkörper, Flüssigkeiten und Gase bestimmt werden. Kalorische Grundgleichung: ΔQ = c m ΔT Festkörper - System steht
Kalorimetrie Mit Hilfe der Kalorimetrie können die spezifischen Wärmekapazitäten für Festkörper, Flüssigkeiten und Gase bestimmt werden. Kalorische Grundgleichung: ΔQ = c m ΔT Festkörper - System steht
4.6.5 Dritter Hauptsatz der Thermodynamik
 4.6 Hauptsätze der Thermodynamik Entropie S: ds = dq rev T (4.97) Zustandsgröße, die den Grad der Irreversibilität eines Vorgangs angibt. Sie ist ein Maß für die Unordnung eines Systems. Vorgänge finden
4.6 Hauptsätze der Thermodynamik Entropie S: ds = dq rev T (4.97) Zustandsgröße, die den Grad der Irreversibilität eines Vorgangs angibt. Sie ist ein Maß für die Unordnung eines Systems. Vorgänge finden
Temperatur. Temperaturmessung. Grundgleichung der Kalorik. 2 ² 3 2 T - absolute Temperatur / ºC T / K
 Temperatur Temperatur ist ein Maß für die mittlere kinetische Energie der Teilchen 2 ² 3 2 T - absolute Temperatur [ T ] = 1 K = 1 Kelvin k- Boltzmann-Konst. k = 1,38 10-23 J/K Kelvin- und Celsiusskala
Temperatur Temperatur ist ein Maß für die mittlere kinetische Energie der Teilchen 2 ² 3 2 T - absolute Temperatur [ T ] = 1 K = 1 Kelvin k- Boltzmann-Konst. k = 1,38 10-23 J/K Kelvin- und Celsiusskala
Ferienkurs Experimentalphysik II Elektro- und Thermodynamik. Thermodynamik Teil II. 12. September 2011 Michael Mittermair
 Ferienkurs Experimentalphysik II Elektro- und Thermodynamik Thermodynamik Teil II 12. September 2011 Michael Mittermair Inhaltsverzeichnis 1 Allgemeines 3 1.1 Kategorisierung von Systemen..................
Ferienkurs Experimentalphysik II Elektro- und Thermodynamik Thermodynamik Teil II 12. September 2011 Michael Mittermair Inhaltsverzeichnis 1 Allgemeines 3 1.1 Kategorisierung von Systemen..................
1. Wärmelehre 1.1. Temperatur. Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités)
 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für die Temperatur Prinzip
1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für die Temperatur Prinzip
Grundlagen der Physik II
 Grundlagen der Physik II Othmar Marti Ulf Wiedwald 16. 07. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Wärmelehre Grundlagen der Physik II 16. 07. 2007
Grundlagen der Physik II Othmar Marti Ulf Wiedwald 16. 07. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Wärmelehre Grundlagen der Physik II 16. 07. 2007
1. Wärmelehre 2.4. Die Freiheitsgrade eines Gases. f=5 Translation + Rotation. f=7 Translation + Rotation +Vibration. Wiederholung
 1. Wärmelehre 2.4. Die Freiheitsgrade eines Gases Wiederholung Speziische molare Wärmekapazität c m,v = 2 R R = N A k B = 8.315 J mol K =5 Translation + Rotation =7 Translation + Rotation +ibration 1.
1. Wärmelehre 2.4. Die Freiheitsgrade eines Gases Wiederholung Speziische molare Wärmekapazität c m,v = 2 R R = N A k B = 8.315 J mol K =5 Translation + Rotation =7 Translation + Rotation +ibration 1.
Die 4 Phasen des Carnot-Prozesses
 Die 4 Phasen des Carnot-Prozesses isotherme Expansion: A B V V T k N Q ln 1 1 isotherme Kompression: adiabatische Kompression: adiabatische Expansion: 0 Q Q 0 C D V V T k N Q ln 2 2 S Q 1 1 /T1 T 1 T 2
Die 4 Phasen des Carnot-Prozesses isotherme Expansion: A B V V T k N Q ln 1 1 isotherme Kompression: adiabatische Kompression: adiabatische Expansion: 0 Q Q 0 C D V V T k N Q ln 2 2 S Q 1 1 /T1 T 1 T 2
A 2.6 Wie ist die Zusammensetzung der Flüssigkeit und des Dampfes eines Stickstoff-Sauerstoff-Gemischs
 A 2.1 Bei - 10 o C beträgt der Dampfdruck des Kohlendioxids 26,47 bar, die Dichte der Flüssigkeit 980,8 kg/m 3 und die Dichte des Dampfes 70,5 kg/m 3. Bei - 7,5 o C beträgt der Dampfdruck 28,44 bar. Man
A 2.1 Bei - 10 o C beträgt der Dampfdruck des Kohlendioxids 26,47 bar, die Dichte der Flüssigkeit 980,8 kg/m 3 und die Dichte des Dampfes 70,5 kg/m 3. Bei - 7,5 o C beträgt der Dampfdruck 28,44 bar. Man
Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I Dr. Helge Klemmer
 Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I 12.12.2014 Gase Flüssigkeiten Feststoffe Wiederholung Teil 2 (05.12.2014) Ideales Gasgesetz: pv Reale Gase: Zwischenmolekularen Wechselwirkungen
Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I 12.12.2014 Gase Flüssigkeiten Feststoffe Wiederholung Teil 2 (05.12.2014) Ideales Gasgesetz: pv Reale Gase: Zwischenmolekularen Wechselwirkungen
Thermodynamik. Kapitel 4. Nicolas Thomas
 Thermodynamik Kapitel 4 Arbeit und Wärme Länge, x F Kolben Länge, x F Der Kolben wird sehr langsam um die Distanz -dx verschoben. dx Kolben Wieviel Arbeit mussten wir leisten, um den Kolben zu bewegen?
Thermodynamik Kapitel 4 Arbeit und Wärme Länge, x F Kolben Länge, x F Der Kolben wird sehr langsam um die Distanz -dx verschoben. dx Kolben Wieviel Arbeit mussten wir leisten, um den Kolben zu bewegen?
Grundlagen der Wärmelehre
 Ausgabe 2007-09 Grundlagen der Wärmelehre (Erläuterungen) Die Wärmelehre ist das Teilgebiet der Physik, in dem Zustandsänderungen von Körpern infolge Zufuhr oder Abgabe von Wärmeenergie und in dem Energieumwandlungen,
Ausgabe 2007-09 Grundlagen der Wärmelehre (Erläuterungen) Die Wärmelehre ist das Teilgebiet der Physik, in dem Zustandsänderungen von Körpern infolge Zufuhr oder Abgabe von Wärmeenergie und in dem Energieumwandlungen,
ÜBUNGEN ZUR VORLESUNG Physikalische Chemie I (PC I) (Prof. Meerholz, Hertel, Klemmer) Blatt 14,
 ÜBUNGEN ZUR VORLESUNG Physikalische Chemie I (PC I) (Prof. Meerholz, Hertel, Klemmer) Blatt 14, 12.02.2016 Aufgabe 1 Kreisprozesse Mit einem Mol eines idealen, monoatomaren Gases (cv = 3/2 R) wird, ausgehend
ÜBUNGEN ZUR VORLESUNG Physikalische Chemie I (PC I) (Prof. Meerholz, Hertel, Klemmer) Blatt 14, 12.02.2016 Aufgabe 1 Kreisprozesse Mit einem Mol eines idealen, monoatomaren Gases (cv = 3/2 R) wird, ausgehend
2 Wärmelehre. Reibungswärme Reaktionswärme Stromwärme
 2 Wärmelehre Die Thermodynamik ist ein Musterbeispiel an axiomatisch aufgebauten Wissenschaft. Im Gegensatz zur klassischen Mechanik hat sie die Quantenrevolution überstanden, ohne in ihren Grundlagen
2 Wärmelehre Die Thermodynamik ist ein Musterbeispiel an axiomatisch aufgebauten Wissenschaft. Im Gegensatz zur klassischen Mechanik hat sie die Quantenrevolution überstanden, ohne in ihren Grundlagen
Mischen von Flüssigkeiten mit verschiedener Temperatur
 V13 Thema: Wärme 1. Einleitung Ob bei der Regelung der Körpertemperatur, dem Heizen des Zimmers oder zahlreichen technischen Prozessen: Der Austausch von Wärme spielt eine wichtige Rolle. In diesem Versuch
V13 Thema: Wärme 1. Einleitung Ob bei der Regelung der Körpertemperatur, dem Heizen des Zimmers oder zahlreichen technischen Prozessen: Der Austausch von Wärme spielt eine wichtige Rolle. In diesem Versuch
T1: Wärmekapazität eines Kalorimeters
 Grundpraktikum T1: Wärmekapazität eines Kalorimeters Autor: Partner: Versuchsdatum: Versuchsplatz: Abgabedatum: Inhaltsverzeichnis 1 Physikalische Grundlagen und Aufgabenstellung 2 2 Messwerte und Auswertung
Grundpraktikum T1: Wärmekapazität eines Kalorimeters Autor: Partner: Versuchsdatum: Versuchsplatz: Abgabedatum: Inhaltsverzeichnis 1 Physikalische Grundlagen und Aufgabenstellung 2 2 Messwerte und Auswertung
Physik 2 Hydrologen et al., SoSe 2013 Lösungen 3. Übung (KW 19/20) Carnot-Wärmekraftmaschine )
 3. Übung KW 19/20) Aufgabe 1 T 4.5 Carnot-Wärmekraftmaschine ) Eine Carnot-Wärmekraftmaschine arbeitet zwischen den Temperaturen und. Während der isothermen Expansion vergrößert sich das Volumen von auf
3. Übung KW 19/20) Aufgabe 1 T 4.5 Carnot-Wärmekraftmaschine ) Eine Carnot-Wärmekraftmaschine arbeitet zwischen den Temperaturen und. Während der isothermen Expansion vergrößert sich das Volumen von auf
2.2 Spezifische und latente Wärmen
 1 Einleitung Physikalisches Praktikum für Anfänger - Teil 1 Gruppe 2 Wärmelehre 2.2 Spezifische und latente Wärmen Die spezifische Wärme von Wasser gibt an, wieviel Energie man zu 1 kg Wasser zuführen
1 Einleitung Physikalisches Praktikum für Anfänger - Teil 1 Gruppe 2 Wärmelehre 2.2 Spezifische und latente Wärmen Die spezifische Wärme von Wasser gibt an, wieviel Energie man zu 1 kg Wasser zuführen
Physik III im Studiengang Elektrotechnik
 hysik III im Studiengang Elektrotechnik - reale Gase, hasenübergänge - rof. Dr. Ulrich Hahn WS 2008/09 reale Gase kleine Temperaturen, hohe Drücke: Moleküle weisen Eigenvolumen auf Moleküle ziehen sich
hysik III im Studiengang Elektrotechnik - reale Gase, hasenübergänge - rof. Dr. Ulrich Hahn WS 2008/09 reale Gase kleine Temperaturen, hohe Drücke: Moleküle weisen Eigenvolumen auf Moleküle ziehen sich
Prof. Dr. Peter Vogl, Thomas Eissfeller, Peter Greck. Übung in Thermodynamik und Statistik 4B Blatt 8 (Abgabe Di 3. Juli 2012)
 U München Physik Department, 33 http://www.wsi.tum.de/33 eaching) Prof. Dr. Peter Vogl, homas Eissfeller, Peter Greck Übung in hermodynamik und Statistik 4B Blatt 8 Abgabe Di 3. Juli 202). Extremalprinzip
U München Physik Department, 33 http://www.wsi.tum.de/33 eaching) Prof. Dr. Peter Vogl, homas Eissfeller, Peter Greck Übung in hermodynamik und Statistik 4B Blatt 8 Abgabe Di 3. Juli 202). Extremalprinzip
1. Klausur zur Vorlesung Physikalische Chemie I
 1. Klausur zur Vorlesung Physikalische Chemie I Sommersemester 2006 8. Juni 2006 Angaben zur Person (BITTE LESERLICH UND IN DRUCKBUCHSTABEN) Name, Vorname... Geburtsdatum und -ort... Matrikelnummer...
1. Klausur zur Vorlesung Physikalische Chemie I Sommersemester 2006 8. Juni 2006 Angaben zur Person (BITTE LESERLICH UND IN DRUCKBUCHSTABEN) Name, Vorname... Geburtsdatum und -ort... Matrikelnummer...
Klausur Wärmelehre E2/E2p, SoSe 2012 Braun. Formelsammlung Thermodynamik
 Name: Klausur Wärmelehre E2/E2p, SoSe 2012 Braun Matrikelnummer: Benotung für: O E2 O E2p (bitte ankreuzen, Mehrfachnennungen möglich) Mit Stern (*) gekennzeichnete Aufgaben sind für E2-Kandidaten [E2p-Kandidaten
Name: Klausur Wärmelehre E2/E2p, SoSe 2012 Braun Matrikelnummer: Benotung für: O E2 O E2p (bitte ankreuzen, Mehrfachnennungen möglich) Mit Stern (*) gekennzeichnete Aufgaben sind für E2-Kandidaten [E2p-Kandidaten
Wärmemenge, spezifische Wärmekapazität, molare Wärmekapazität, Kalorimetrie, Dulong-Petitsches Gesetz.
 W1 Spezifische Wärmekapazität von festen Stoffen Stoffgebiet: Wärmemenge, spezifische Wärmekapazität, molare Wärmekapazität, Kalorimetrie, Dulong-Petitsches Gesetz. Versuchsziel: Bestimmung der spezifischen
W1 Spezifische Wärmekapazität von festen Stoffen Stoffgebiet: Wärmemenge, spezifische Wärmekapazität, molare Wärmekapazität, Kalorimetrie, Dulong-Petitsches Gesetz. Versuchsziel: Bestimmung der spezifischen
Lösungen Serie 16: Kalorimetrie
 en Serie 16: Kalorimetrie Aufgabe 16.1 A Sie wollen in einem Kochtopf ( =0.6, =0.4 ( =4.182 k K gegeben: =0.6 =0.4 k K ) einen halben Liter Wasser ) von 10 auf 40 erwärmen. Welche Wärmemenge ist dazu notwendig?
en Serie 16: Kalorimetrie Aufgabe 16.1 A Sie wollen in einem Kochtopf ( =0.6, =0.4 ( =4.182 k K gegeben: =0.6 =0.4 k K ) einen halben Liter Wasser ) von 10 auf 40 erwärmen. Welche Wärmemenge ist dazu notwendig?
200 Spezifische Kondensationswärme von Wasserdampf
 200 Spezifische Kondensationswärme von Wasserdampf 1. Aufgaben 1.1 Ermitteln Sie die Wärmekapazität eines Kalorimeters! 1.2 Bestimmen Sie die spezifische Kondensationswärme von Wasserdampf und berechnen
200 Spezifische Kondensationswärme von Wasserdampf 1. Aufgaben 1.1 Ermitteln Sie die Wärmekapazität eines Kalorimeters! 1.2 Bestimmen Sie die spezifische Kondensationswärme von Wasserdampf und berechnen
Physik 4 Praktikum Auswertung Zustandsdiagramm Ethan
 Physik 4 Praktikum Auswertung Zustandsdiagramm Ethan Von J.W., I.G. 2014 Seite 1. Kurzfassung......... 2 2. Theorie.......... 2 2.1. Zustandsgleichung....... 2 2.2. Koexistenzgebiet........ 3 2.3. Kritischer
Physik 4 Praktikum Auswertung Zustandsdiagramm Ethan Von J.W., I.G. 2014 Seite 1. Kurzfassung......... 2 2. Theorie.......... 2 2.1. Zustandsgleichung....... 2 2.2. Koexistenzgebiet........ 3 2.3. Kritischer
O. Sternal, V. Hankele. 5. Thermodynamik
 5. Thermodynamik 5. Thermodynamik 5.1 Temperatur und Wärme Systeme aus vielen Teilchen Quelle: Wikimedia Commons Datei: Translational_motion.gif Versuch: Beschreibe 1 m 3 Luft mit Newton-Mechanik Beschreibe
5. Thermodynamik 5. Thermodynamik 5.1 Temperatur und Wärme Systeme aus vielen Teilchen Quelle: Wikimedia Commons Datei: Translational_motion.gif Versuch: Beschreibe 1 m 3 Luft mit Newton-Mechanik Beschreibe
Physikalische Chemie 0 Klausur, 22. Oktober 2011
 Physikalische Chemie 0 Klausur, 22. Oktober 2011 Bitte beantworten Sie die Fragen direkt auf dem Blatt. Auf jedem Blatt bitte Name, Matrikelnummer und Platznummer angeben. Zu jeder der 25 Fragen werden
Physikalische Chemie 0 Klausur, 22. Oktober 2011 Bitte beantworten Sie die Fragen direkt auf dem Blatt. Auf jedem Blatt bitte Name, Matrikelnummer und Platznummer angeben. Zu jeder der 25 Fragen werden
3 Der 1. Hauptsatz der Thermodynamik
 3 Der 1. Hauptsatz der Thermodynamik 3.1 Der Begriff der inneren Energie Wir betrachten zunächst ein isoliertes System, d. h. es können weder Teilchen noch Energie mit der Umgebung ausgetauscht werden.
3 Der 1. Hauptsatz der Thermodynamik 3.1 Der Begriff der inneren Energie Wir betrachten zunächst ein isoliertes System, d. h. es können weder Teilchen noch Energie mit der Umgebung ausgetauscht werden.
Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1
 Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1 A 6 Kalorimetrie Aufgabe: Mittels eines Flüssigkeitskalorimeters ist a) die Neutralisationsenthalpie von säure b) die ösungsenthalpie
Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1 A 6 Kalorimetrie Aufgabe: Mittels eines Flüssigkeitskalorimeters ist a) die Neutralisationsenthalpie von säure b) die ösungsenthalpie
Lehrbuch der Thermodynamik
 Ulrich Nickel Lehrbuch der Thermodynamik Eine verständliche Einführung Ж HANSER Carl Hanser Verlag München Wien VII Inhaltsverzeichnis 1 GRUNDBEGRIFFE DER THERMODYNAMIK 1 Einführung 1 Systeme 3 offene
Ulrich Nickel Lehrbuch der Thermodynamik Eine verständliche Einführung Ж HANSER Carl Hanser Verlag München Wien VII Inhaltsverzeichnis 1 GRUNDBEGRIFFE DER THERMODYNAMIK 1 Einführung 1 Systeme 3 offene
Versuch: Sieden durch Abkühlen
 ersuch: Sieden durch Abkühlen Ein Rundkolben wird zur Hälfte mit Wasser gefüllt und auf ein Dreibein mit Netz gestellt. Mit dem Bunsenbrenner bringt man das Wasser zum Sieden, nimmt dann die Flamme weg
ersuch: Sieden durch Abkühlen Ein Rundkolben wird zur Hälfte mit Wasser gefüllt und auf ein Dreibein mit Netz gestellt. Mit dem Bunsenbrenner bringt man das Wasser zum Sieden, nimmt dann die Flamme weg
E2: Wärmelehre und Elektromagnetismus 6. Vorlesung
 E2: Wärmelehre und Elektromagnetismus 6. Vorlesung 26.04.2018 Heute: - Kondensationskerne - Van der Waals-Gas - 2. Hauptsatz https://xkcd.com/1166/ Prof. Dr. Jan Lipfert Jan.Lipfert@lmu.de 26.04.2018 Prof.
E2: Wärmelehre und Elektromagnetismus 6. Vorlesung 26.04.2018 Heute: - Kondensationskerne - Van der Waals-Gas - 2. Hauptsatz https://xkcd.com/1166/ Prof. Dr. Jan Lipfert Jan.Lipfert@lmu.de 26.04.2018 Prof.
Wärme, unsere wichtigste Energieform.
 Kalorik Lehrwerkstätten und Berufsschule Zeughausstrasse 56 für Mechanik und Elektronik Tel. 052 267 55 42 CH-8400 Winterthur Fax 052 267 50 64 Thermo-Gefäss, 1 Liter PA6100 Wärme, unsere wichtigste Energieform.
Kalorik Lehrwerkstätten und Berufsschule Zeughausstrasse 56 für Mechanik und Elektronik Tel. 052 267 55 42 CH-8400 Winterthur Fax 052 267 50 64 Thermo-Gefäss, 1 Liter PA6100 Wärme, unsere wichtigste Energieform.
T3 - Wärmekapazität. Nutzen Sie die Fachliteratur, um die nachfolgenden Fragen und Aufgaben zu beantworten:
 T3 - Wärmekapazität Ziel des Versuches In diesem Versuch sollen Sie sich mit den Konzepten der Wärmekapazität und der Kalorimetrie vertraut machen. Hierzu bestimmen Sie die Wärmekapazität des zur Verfügung
T3 - Wärmekapazität Ziel des Versuches In diesem Versuch sollen Sie sich mit den Konzepten der Wärmekapazität und der Kalorimetrie vertraut machen. Hierzu bestimmen Sie die Wärmekapazität des zur Verfügung
Thermodynamische Hauptsätze, Kreisprozesse Übung
 Thermodynamische Hauptsätze, Kreisprozesse Übung Marcus Jung 4.09.00 Inhaltsverzeichnis Inhaltsverzeichnis Thermodynamische Hauptsätze. Aufgabe :..................................... Aufgabe :.....................................
Thermodynamische Hauptsätze, Kreisprozesse Übung Marcus Jung 4.09.00 Inhaltsverzeichnis Inhaltsverzeichnis Thermodynamische Hauptsätze. Aufgabe :..................................... Aufgabe :.....................................
1. GRUNDLAGEN B04 SPEZIFISCHE WÄRMEN B04
 B04 SPEZIFISCHE WÄRMEN B04 1. GRUNDLAGEN 1.1. Spezifische Wärme Wie viel Energie ist erforderlich, um die Luft im Raum oder einen Topf mit Wasser zu erwärmen? Und wie viel Energie, um das Wasser zu verdampfen?
B04 SPEZIFISCHE WÄRMEN B04 1. GRUNDLAGEN 1.1. Spezifische Wärme Wie viel Energie ist erforderlich, um die Luft im Raum oder einen Topf mit Wasser zu erwärmen? Und wie viel Energie, um das Wasser zu verdampfen?
Thermodynamik 1. Typen der thermodynamischen Systeme. Intensive und extensive Zustandsgröße. Phasenübergänge. Ausdehnung bei Erwärmung.
 Thermodynamik 1. Typen der thermodynamischen Systeme. Intensive und extensive Zustandsgröße. Phasenübergänge. Ausdehnung bei Erwärmung. Nullter und Erster Hauptsatz der Thermodynamik. Thermodynamische
Thermodynamik 1. Typen der thermodynamischen Systeme. Intensive und extensive Zustandsgröße. Phasenübergänge. Ausdehnung bei Erwärmung. Nullter und Erster Hauptsatz der Thermodynamik. Thermodynamische
1. Wärme und der 1. Hauptsatz der Thermodynamik 1.1. Grundlagen
 IV. Wärmelehre 1. Wärme und der 1. Hauptsatz der Thermodynamik 1.1. Grundlagen Historisch: Wärme als Stoff, der übertragen und in beliebiger Menge erzeugt werden kann. Übertragung: Wärmezufuhr Joulesche
IV. Wärmelehre 1. Wärme und der 1. Hauptsatz der Thermodynamik 1.1. Grundlagen Historisch: Wärme als Stoff, der übertragen und in beliebiger Menge erzeugt werden kann. Übertragung: Wärmezufuhr Joulesche
ST Der Stirling-Motor als Wärmekraftmaschine
 ST Der Stirling-Motor als Wärmekraftmaschine Blockpraktikum Herbst 2007 Gruppe 2b 24. Oktober 2007 Inhaltsverzeichnis 1 Grundlagen 2 1.1 Stirling-Kreisprozess............................. 2 1.2 Technische
ST Der Stirling-Motor als Wärmekraftmaschine Blockpraktikum Herbst 2007 Gruppe 2b 24. Oktober 2007 Inhaltsverzeichnis 1 Grundlagen 2 1.1 Stirling-Kreisprozess............................. 2 1.2 Technische
Übungsblatt 2 ( )
 Experimentalphysik für Naturwissenschaftler Universität Erlangen Nürnberg SS 01 Übungsblatt (11.05.01) 1) Geschwindigkeitsverteilung eines idealen Gases (a) Durch welche Verteilung lässt sich die Geschwindigkeitsverteilung
Experimentalphysik für Naturwissenschaftler Universität Erlangen Nürnberg SS 01 Übungsblatt (11.05.01) 1) Geschwindigkeitsverteilung eines idealen Gases (a) Durch welche Verteilung lässt sich die Geschwindigkeitsverteilung
4 Thermodynamik mikroskopisch: kinetische Gastheorie makroskopisch: System:
 Theorie der Wärme kann auf zwei verschiedene Arten behandelt werden. mikroskopisch: Bewegung von Gasatomen oder -molekülen. Vielzahl von Teilchen ( 10 23 ) im Allgemeinen nicht vollständig beschreibbar
Theorie der Wärme kann auf zwei verschiedene Arten behandelt werden. mikroskopisch: Bewegung von Gasatomen oder -molekülen. Vielzahl von Teilchen ( 10 23 ) im Allgemeinen nicht vollständig beschreibbar
Lösungen zu den Zusatzübungen zur Physik für Ingenieure (Maschinenbau) (WS 13/14)
 Lösungen zu den Zusatzübungen zur hysik für Ingenieure (Maschinenbau) (WS 13/14) rof. W. Meyer Übungsgruppenleiter: A. Berlin & J. Herick (NB 2/28) Zusatzübung (Lösung) alle Angaben ohne Gewähr Zusatzaufgabe
Lösungen zu den Zusatzübungen zur hysik für Ingenieure (Maschinenbau) (WS 13/14) rof. W. Meyer Übungsgruppenleiter: A. Berlin & J. Herick (NB 2/28) Zusatzübung (Lösung) alle Angaben ohne Gewähr Zusatzaufgabe
Klausur zur Vorlesung Thermodynamik
 Institut für Thermodynamik 23. August 2013 Technische Universität Braunschweig Prof. Dr. Jürgen Köhler Klausur zur Vorlesung Thermodynamik Für alle Aufgaben gilt: Der Rechen- bzw. Gedankengang muss stets
Institut für Thermodynamik 23. August 2013 Technische Universität Braunschweig Prof. Dr. Jürgen Köhler Klausur zur Vorlesung Thermodynamik Für alle Aufgaben gilt: Der Rechen- bzw. Gedankengang muss stets
Wissenschaft öffentlich machen
 Wissenschaft öffentlich machen Allgemeinverständliche öffentliche Vorträge zur Astronomie und Astrophysik Heinrich-Plett-Str. 40, Kassel, Oberzwehren Gebäude AVZ, Hörsaal 298, Uni Kassel Samstag, 14.11.2015,
Wissenschaft öffentlich machen Allgemeinverständliche öffentliche Vorträge zur Astronomie und Astrophysik Heinrich-Plett-Str. 40, Kassel, Oberzwehren Gebäude AVZ, Hörsaal 298, Uni Kassel Samstag, 14.11.2015,
Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti.
 (c) Ulm University p. 1/1 Grundlagen der Physik 2 Schwingungen und Wärmelehre 14. 05. 2007 Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik Universität Ulm (c) Ulm University p.
(c) Ulm University p. 1/1 Grundlagen der Physik 2 Schwingungen und Wärmelehre 14. 05. 2007 Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik Universität Ulm (c) Ulm University p.
Thermodynamik des Kraftfahrzeugs
 Cornel Stan Thermodynamik des Kraftfahrzeugs Mit 200 Abbildungen und 7 Tabellen Springer Inhaltsverzeichnis Liste der Formelzeichen XV 1 Grundlagen der Technischen Thermodynamik 1 1.1 Gegenstand und Untersuchungsmethodik
Cornel Stan Thermodynamik des Kraftfahrzeugs Mit 200 Abbildungen und 7 Tabellen Springer Inhaltsverzeichnis Liste der Formelzeichen XV 1 Grundlagen der Technischen Thermodynamik 1 1.1 Gegenstand und Untersuchungsmethodik
Musterlösung zur Abschlussklausur PC I Übungen (27. Juni 2018)
 1. Abkühlung (100 Punkte) Ein ideales Gas (genau 3 mol) durchläuft hintereinander zwei (reversible) Zustandsänderungen: Zuerst expandiert es isobar, wobei die Temperatur von 50 K auf 500 K steigt und sich
1. Abkühlung (100 Punkte) Ein ideales Gas (genau 3 mol) durchläuft hintereinander zwei (reversible) Zustandsänderungen: Zuerst expandiert es isobar, wobei die Temperatur von 50 K auf 500 K steigt und sich
Spezifische Schmelzwärme von wis (Artikelnr.: P )
 Lehrer-/Dozentenblatt Spezifische Schmelzwärme von wis (Artikelnr.: P1044700) Curriculare Themenzuordnung Fachgebiet: Physik Bildungsstufe: Klasse 7-10 Lehrplanthema: Wärmelehre Unterthema: Schmelzen,
Lehrer-/Dozentenblatt Spezifische Schmelzwärme von wis (Artikelnr.: P1044700) Curriculare Themenzuordnung Fachgebiet: Physik Bildungsstufe: Klasse 7-10 Lehrplanthema: Wärmelehre Unterthema: Schmelzen,
Physikalisches Grundpraktikum Taupunktmessung. Taupunktmessung
 Aufgabenstellung: 1. Bestimmen Sie den Taupunkt. Berechnen Sie daraus die absolute und relative Luftfeuchtigkeit. 2. Schätzen Sie die Messunsicherheit ab! Stichworte zur Vorbereitung: Temperaturmessung,
Aufgabenstellung: 1. Bestimmen Sie den Taupunkt. Berechnen Sie daraus die absolute und relative Luftfeuchtigkeit. 2. Schätzen Sie die Messunsicherheit ab! Stichworte zur Vorbereitung: Temperaturmessung,
Thermodynamik. Thermodynamics. Markus Arndt. Quantenoptik, Quantennanophysik und Quanteninformation Universität Wien January 2008
 Thermodynamik Thermodynamics Markus Arndt Quantenoptik, Quantennanophysik und Quanteninformation Universität Wien January 2008 Die Hauptsätze der Thermodynamik & Anwendungen in Wärmekraft und Kältemaschinen
Thermodynamik Thermodynamics Markus Arndt Quantenoptik, Quantennanophysik und Quanteninformation Universität Wien January 2008 Die Hauptsätze der Thermodynamik & Anwendungen in Wärmekraft und Kältemaschinen
Wärmelehre/Thermodynamik. Wintersemester 2007
 Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 2007 ladimir Dyakonov #13 am 30.01.2007 Folien im PDF Format unter: htt://www.hysik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 2007 ladimir Dyakonov #13 am 30.01.2007 Folien im PDF Format unter: htt://www.hysik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
Innere Reibung von Flüssigkeiten
 Fachrichtung Physik Physikalisches Grundpraktikum Erstellt: Bearbeitet: Versuch: L. Jahn RF M. Kreller J. Kelling F. Lemke S. Majewsky i. A. Dr. Escher Aktualisiert: am 29. 03. 2010 Innere Reibung von
Fachrichtung Physik Physikalisches Grundpraktikum Erstellt: Bearbeitet: Versuch: L. Jahn RF M. Kreller J. Kelling F. Lemke S. Majewsky i. A. Dr. Escher Aktualisiert: am 29. 03. 2010 Innere Reibung von
Grundlagen der Physik 2 Schwingungen und Wärmelehre
 Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik 21. 05. 2007 Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre 21. 05.
Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik 21. 05. 2007 Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre 21. 05.
E2: Wärmelehre und Elektromagnetismus 6. Vorlesung
 E2: Wärmelehre und Elektromagnetismus 6. Vorlesung 26.04.2018 Heute: - Kondensationskerne - Van der Waals-Gas - 2. Hauptsatz https://xkcd.com/1166/ Prof. Dr. Jan Lipfert Jan.Lipfert@lmu.de 26.04.2018 Prof.
E2: Wärmelehre und Elektromagnetismus 6. Vorlesung 26.04.2018 Heute: - Kondensationskerne - Van der Waals-Gas - 2. Hauptsatz https://xkcd.com/1166/ Prof. Dr. Jan Lipfert Jan.Lipfert@lmu.de 26.04.2018 Prof.
1. Wärmelehre 1.1. Temperatur Wiederholung
 1. Wärmelehre 1.1. Temperatur Wiederholung a) Zur Messung der Temperatur verwendet man physikalische Effekte, die von der Temperatur abhängen. Beispiele: Volumen einer Flüssigkeit (Hg-Thermometer), aber
1. Wärmelehre 1.1. Temperatur Wiederholung a) Zur Messung der Temperatur verwendet man physikalische Effekte, die von der Temperatur abhängen. Beispiele: Volumen einer Flüssigkeit (Hg-Thermometer), aber
Physik für Pharmazeuten und Biologen WÄRME II. Hauptsätze der Wärmelehre Kreisprozesse und Kältemaschinen Aggregatszustände
 Physik für Pharmazeuten und Biologen WÄRME II Hauptsätze der Wärmelehre Kreisprozesse und Kältemaschinen Aggregatszustände 3.4 Hauptsätze der Thermodynamik Hauptsätze folgern aus Beobachtungen, zahlreiche
Physik für Pharmazeuten und Biologen WÄRME II Hauptsätze der Wärmelehre Kreisprozesse und Kältemaschinen Aggregatszustände 3.4 Hauptsätze der Thermodynamik Hauptsätze folgern aus Beobachtungen, zahlreiche
Praktikum Physik. Protokoll zum Versuch 5: Spezifische Wärme. Durchgeführt am Gruppe X
 Praktikum Physik Protokoll zum Versuch 5: Spezifische Wärme Durchgeführt am 10.11.2011 Gruppe X Name 1 und Name 2 (abc.xyz@uni-ulm.de) (abc.xyz@uni-ulm.de) Betreuer: Wir bestätigen hiermit, dass wir das
Praktikum Physik Protokoll zum Versuch 5: Spezifische Wärme Durchgeführt am 10.11.2011 Gruppe X Name 1 und Name 2 (abc.xyz@uni-ulm.de) (abc.xyz@uni-ulm.de) Betreuer: Wir bestätigen hiermit, dass wir das
