Schriftliche Prüfung 2. Vordiplom Herbst 2003 D CHAB/BIOL. Musterlösung
|
|
|
- Sarah Roth
- vor 7 Jahren
- Abrufe
Transkript
1 Prüfungen Analytische hemie Mittwoch, 1. ktober 2003 Schriftliche Prüfung 2. Vordiplom erbst 2003 D AB/BIL Musterlösung Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt 36. Die Maximalnote wird mit mindestens 30 Punkten erreicht. Zeit: 60 Minuten. Teilen Sie sich Ihre Zeit gut ein! Unleserliche Texte, unklare Formulierungen oder unsaubere Skizzen können nicht bewertet werden. Bitte bemühen Sie sich um eine saubere Darstellung. Beginnen Sie jede Aufgabe auf einem neuen Blatt und schreiben Sie jedes abzugebende Blatt einzeln mit Ihrem Namen an. Dieses Deckblatt ist ausgefüllt abzugeben. Wir bitten Sie um Fairness und wünschen Ihnen viel Erfolg!
2
3 1 Aufgabe 1 10 Punkte Auf den folgenden Seiten finden Sie die IR-, Massen-, 1 -NMR- und 13 -NMR-Spektren der Verbindung N26. Sie weist folgende Konstitution auf: I N 2 N + 3 X II N 2 N 2. X N26 Die beiden Schreibweisen I und II können als äquivalent angesehen werden. Das Element X ist ein unbekanntes alogen (F, l, Br, I). Das Amin (Schreibweise II ohne das X) hat die relative Molmasse M r = 104. Einige inweise zu den Spektren: Im Massenspektrum von N26 sind ausschliesslich einfach positiv geladene Ionen sichtbar. In einem EI-Massenspektrum sieht man im Fall eines Ammoniumsalzes, wie im vorliegenden Fall, ein Gemisch des freien Amins und der freien Säure, entsprechend Schreibweise II. Zur Aufnahme der NMR-Spektren wurde sechsfach deuteriertes Dimethylsulfoxid (DMS-d 6 ) als Lösungsmittel verwendet: D 3 S D 3 Protonen, die an eteroatome wie oder N gebunden sind, bezeichnet man als austauschbar. Sie können ihre Position von einem Molekül zu einem anderen wechseln, wodurch Kopplungen zu anderen Protonen oft nicht sichtbar sind. Im Lösungsmittel DMS hingegen bilden diese Protonen Wasserstoffbrücken zu den -Atomen des Lösungsmittels und tauschen ihre Plätze nur noch sehr langsam. Sie werden gleichsam an ihrem rt festgehalten. Dadurch werden Kopplungen zu anderen Protonen sichtbar, wenn der Abstand höchstens 3 Bindungen beträgt. Zusätzlicher inweis durch die Examinatoren zu Anfang der Prüfung bei der Besprechung der Aufgaben: Das breite Signal im 1 -NMR-Spektrum bei 8.4 ppm stammt von den Protonen, die direkt an das N-Atom gebunden sind. a) Um welches alogen handelt es sich beim Atom X? Begründen Sie Ihre Wahl mit mindestens zwei Argumenten! (2 Punkte, einen für jedes Argument) Im Massenspektrum sieht man ein Gemisch des freien Amins und der freien Säure X. Dabei ist aber nicht klar, ob X zu Peaks mit nennenswerter Intensität führt. Es sind also alle Möglichkeiten zu überprüfen: F: m/z = 20 nicht vorhanden l: m/z = 36 vorhanden Br: m/z = 80 nicht vorhanden I; m/z = 128 schwerer als Molekülion Das Signal von l ist also das einzig mögliche für die freie Säure (Argument 1). Wenn m/z = 36 wirklich l darstellt, dann muss auch ein Signal bei m/z = 38 vorhanden sein. Die Isotopenverteilung von hlor (35:37) beträgt ungefähr 3:1. Man findet tatsächlich ein Signal bei
4 2 m/z = 38 mit etwa einer Intensität von einem Drittel der Intensität von m/z = 36 (Argument 2). Auch das Signal m/z = 35 ist klar erkennbar. Wenn es sich dabei um hlor handelt, muss auch das Isotop bei m/z = 37 mit einer Intensität von einem Drittel der Intensität von m/z = 35 auftreten. Dies ist der Fall (Argument 3). b) Liegt die Verbindung N26 im Lösungsmittel DMS als Amin ( N 2 ) oder als Ammonium ( N 3 + ) vor? Begründen Sie Ihre Ansicht mit mindestens zwei Argumenten! (2 Punkte, einen für jedes Argument) Das Lösungsmittel DMS wurde für die Aufnahme der NMR-Spektren verwendet. Daher müssen diese Spektren Auskunft geben. Es geht um die Frage, ob sich am N-Atom zwei oder drei Protonen befinden. Das 13 -NMR-Spektrum gibt keine Auskunft über Protonen, die sich an eteroatomen befinden. Also muss das 1 -NMR-Spektrum bemüht werden. Die Integralverhältnisse der Signale beträgt 3:2:2:2. Die zusätzlichen Signale, die vom Lösungsmittel und vom gelösten Wasser stammen, dürfen nicht berücksichtigt werden. Es handelt sich um Artefakte. Die entsprechenden Peaks sind bezeichnet. Entscheidend ist das Integral der Protonen. die sich am N-Atom befinden. Es sind 3 Protonen, also liegt die Verbindung als Ammoniumsalz vor (Argument 1). In beiden zu unterscheidenden Fällen erwartet man ein Signal, das in 3 Linien aufspaltet (4.8 ppm): die linke 2 -Gruppe hat 2 Nachbarn. Ebenso klar führt die mittlere 2 -Gruppe zu einem 5-Liniensystem ( 2.3 ppm), weil die entsprechende 2 -Gruppe 4 Nachbarn hat Der Unterschied liegt bei der 2 -Gruppe, die dem N-Atom benachbart ist. Nachdem im Lösungsmittel DMS die Kopplungen zwischen Protonen an eteroatomen und anderen Protonen sichtbar sind, müssen die Protonen dieser 2 -Gruppe das entsprechende Aufspaltungsmuster zeigen. Es ist ein zweites 5-Linien-Signal zu erwarten, wenn die Substanz als Amin vorliegt,. Im Fall einer Ammoniumverbindung ist mit einem 6-Liniensystem zu rechnen. Letzteres trifft zu. Man findet das Signal bei 2.9 ppm, (Argument 2). Falls das Amin und die freie Säure vorliegen, muss ein Signal erscheinen, das vom l stammt. Es gibt kein solches Singlett mit Integral 1 (Argument 3). c) Erklären Sie den Basispeak im Massenspektrum! Nehmen Sie dazu die Fragmentierungsregeln zu ilfe! (2 Punkte) Es wurden nur Regeln behandelt, die mit einer direkten Fragmantierung zu tun haben (zumindest in der Zusammenfassung, die für die Prüfung relevant ist). Es gibt nur eine Möglichkeit, durch die Spaltung einer Einfachbindung ein Fragment mit der Masse 30 zu erhalten: Beachten Sie, dass im Massenspektrum das freie Amin und die freie Säure als Gemisch im Verhältnis 1:1 zu sehen sind, nicht das Ammoniumsalz N 2 N 2 Die Fragmentierung wird durch das N-Atom gesteuert. Gemäss Regel IV bricht nicht die Bindung, die unmittelbar zum eteroatom führt, sondern eine daneben liegende. d) Das IR-Spektrum wurde als KBr-Pressling aufgenommen. Sind dabei Sperrgebiete zu berücksichtigen? Warum wurde nicht eine Lösung in l 3 verwendet? (2 Punkte)
5 3 Bei einem KBr-Pressling sind keine Sperrgebiete zu berücksichtigen. KBr ist im ganzen relevanten Frequenzbereich ausreichend durchsichtig. Die bevorzugte Aufnahmetechnik ist die Lösung in hloroform, weil die Moleküle dann weitgehend voneinander getrennt sind und sich nicht übermässig beeinflussen. Ein Salz ist in einem apolaren Lösungsmittel wie l 3 hingegen nicht ohne Weiteres löslich. Dann weicht man auf andere Aufnahmetechniken aus, für Festkörper z. B. den KBr-Pressling. e) Jemand empfiehlt Ihnen, zur Detektion von N26 in einem PL-Experiment einen UV- Detektor bei einer Wellenlänge von 350 nm zu verwenden. Was halten Sie davon? (2 Punkte) Damit eine Substanz UV-Licht von 350 nm absorbiert, muss sie mehrere konjugierte Doppelbindungen enthalten. Dies ist in der vorliegenden Verbindung nicht der Fall. Aliphatische Nitroverbindungen zeigen aufgrund der Nitrogruppe eine sehr schwache Absorptionsbande bei etwa 280 nm. Es ist aber nicht nötig, die Tabellen zu konsultieren, um zu erkennen, dass ein UV-Detektor bei 350 nm für die vorliegende Verbindung blind ist. Jede zusätzliche konjugierte Doppelbindung verschiebt das Absorptionsmaximum um etwa 30 cm 1.
6 4 IR: Perkin-Elmer Modell 125 N26 aufgenommen als KBr-Pressling 100 [%] [cm 1] 500 MS: EI, 70 ev 100 % M m/z
7 5 1 -NMR: N Mz, aufgenommen in DMS-d 6 Lösungsmittel ppm NMR: N Mz, protonen-breitbandentkoppelt, aufgenommen in DMS-d DMS-d 6 0
8 6 Aufgabe 2 8 Punkte Für die Verbindung N26 werden die alternativen Konstitutionen 1-4 vorgeschlagen. Finden Sie für jede Alternative mindestens zwei spektroskopische Argumente, die gegen sie sprechen. (maximal 2 Punkte pro Alternative) N26 N 2 N 2. X inweis zum 1 -NMR-Spektrum: Falls Frage 1b) falsch beantwortet wurde, also im Lösungsmittel DMS das Amin postuliert wurde, wird in dieser Aufgabe ebenfalls davon ausgegangen, dass die Alternativen in der Aminform vorliegen. Dies verhindert eine ungewollte Abhängigkeit zwischen den Fragen. Im Folgenden wird angenommen, dass die Frage richtig beantwortet wurde. Das N-Atom trägt also bei allen Alternativen ein zusätzliches Proton. 1 N 2. X N Im 1 -NMR-Spektrum müsste ein Singlett mit Integral 2 bei grosser chemischer Verschiebung erscheinen, da eine der 2 -Gruppen keine Nachbarn hat. Es kann im 1 -NMR-Spektrum kein Quintett erscheinen. Keine 2 -Gruppe hat 4 Nachbarn. Der Basispeak im MS ist durch eine direkte Fragmentierung machbar (m/z=30 durch N). Die Spaltung ist gemäss Regel IV bevorzugt (gesteuert durch das Ether--Atom). Aufgrund von Regel V ist aber zu erwarten, dass die Ladung auf die -Seite wandert und daher das Fragment mit der Masse 30 nicht so prominent sein sollte. (Regel V muss explizit erwähnt werden). 2 N N. X Im 1 -NMR-Spektrum kann kein breites Signal mit Integral 3 erscheinen, das zu den Protonen am N-Atom gehört (vgl. inweis der Examinatoren, ganz oben). Es müssten zwei Signale sein, eines mit Integral 2 (Protonen am N-Atom) und eines mit Integral 1 (die -Gruppe). Dies gilt als zwei Argumente, wenn klar ausformuliert (Integral falsch und zusätzliches Signal). Im 1 -NMR-Spektrum kann kein Sextett erscheinen. Keine 2 -Gruppe hat 5 Nachbarn. Der Basispeak im MS ist zwar durch eine direkte Fragmentierung machbar (m/z=30 durch N). Gemäss Regel IV ist die Spaltung aber nicht bevorzugt (2 Punkte, wenn die Regel erwähnt wurde). Aufgrund von Regel V ist zu erwarten, dass die Ladung auf die -Seite wandert und daher das Fragment mit der Masse 30 nicht so prominent sein sollte. (2 Punkte, wenn Regel V erwähnt wurde). 3 X S Im 13 -NMR-Spektrum würde man aufgrund der 3 -Gruppe ein zusätzliches Signal erwarten.
9 7 Im 1 -NMR-Spektrum kann kein breites Signal mit dem Integral 3 erscheinen. Die relative Molmasse des Moleküls beträgt 140. Im Massenspektrum ist aber M+1 mit m/z=105 bezeichnet. Der Basispeak im MS kann nicht erklärt werden. Die sehr breite Bande mit Zentrum bei etwa 3000 cm 1 im IR-Spektrum kann nicht erklärt werden. (Sie gehört zur N -Streckschwingung der Ammoniumgruppe). Die Bande bei 1560 cm 1 im IR-Spektrum kann nicht erklärt werden. (Sie gehört zur asymmetrischen N=-Streckschwingung der Nitrogruppe). 4 S N N. X Bemerkung: Es ist nicht klar, welches N-Atom durch die Säure protoniert wird. Im 1 -NMR-Spektrum kann kein breites Signal mit Integral 3 erscheinen, das zu den Protonen am N-Atom gehört (vgl. inweis der Examinatoren, ganz oben). Es müssten zwei Signale sein, eines mit Integral 2 (Protonen am einen N-Atom) und eines mit Integral 1 (Proton am anderen N-Atom). Dies gilt als zwei Argumente, wenn klar ausformuliert (Integral falsch und zusätzliches Signal). Allgemeiner inweis zum 1 -NMR-Spektrum: Da es sich bei diesem Molekül um eine Ringstruktur handelt, ist die Drehung um Einfachbindungen nicht unbeschränkt möglich. Protonen oberhalb der Ringebene können also nicht durch Drehung um Einfachbindungen unter die Ringebene gebracht werden. Daher ergibt sich ein sehr komplexes 1 -NMR-Spektrum, da die Kopplungskonstanten zu Protonen oberhalb und unterhalb der Ringebene nicht gleich sind. Dieser Fall wurde in der Vorlesung nicht behandelt. Daher wird dieser Effekt nicht berücksichtigt. Im 1 -NMR-Spektrum kann kein Sextett erscheinen. Keine 2 -Gruppe hat 5 Nachbarn. Die grosse chemische Verschiebung des Tripletts bei 4.8 ppm kann nicht erklärt werden. Es gibt keine Nachbargruppe, die diesen enormen Effekt bewirken könnte. Die Bande bei 1560 cm 1 im IR-Spektrum kann nicht erklärt werden. (Sie gehört zur asymmetrischen N=-Streckschwingung der Nitrogruppe). (Massenspektrum: Die Regeln für die bevorzugte Spaltung von Bindungen führen im Fall einer Ringstruktur nicht zu einer eigentlichen Fragmentierung, sondern nur zu einer Ringöffnung. Da die Regeln nur ein einziges Mal angewendet werden dürfen, ist der Mechanismus der Fragmentierung nicht nachvollziehbar. Kein Argument aus dem Bereich der Massenspektrometrie wurde akzeptiert.)
10 8 Aufgabe 3 5 Punkte yclosporin ist eines der wirksamsten Medikamente für Transplantationspatienten zur Unterdrückung von Abstossungsreaktionen. Es wurde 1970 im Pilz Tolypocladium inflatum entdeckt. Unten ist die Struktur des cyclischen Peptids mit der relativen Molmasse 1203 dargestellt. N N N N N 2 N N N N N N yclosporin löst sich in organischen Lösungsmitteln besser als in Wasser. Es steht Ihnen eine weitgehend aufgearbeitete wässrige Pilzprobe zur Verfügung, die yclosporin neben Verunreinigungen in Form von anderen Peptiden enthält. a) Schlagen sie ein Trennsystem vor, um yclosporin von anderen Peptiden zu trennen! Welchen Detektor setzen Sie ein? Begründen Sie Ihre Ansicht! (2 Punkte) Peptide und Proteine können durch einen p-puffer gezielt positiv oder negativ geladen werden. Bei kleinen p-werten werden die Aminogruppen protoniert und dadurch positiv geladen. Bei hohen p-werten werden die arboxylgruppen deprotoniert und dadurch negativ geladen. An den Endpunkten eines Peptids befindet sich eine arboxyl- bzw. eine Aminogruppe. Durch die Wahl eines bestimmten p-wertes mit einem Puffer kann das Verhalten eines Peptids bestimmt werden. Peptide können nicht nur an den Endpunkten geladen werden, sondern einige Aminosäuren verfügen auch über zusätzliche Amino- oder arboxylgruppen in den Seitenketten. Jedes Protein oder Peptid trägt also bei einem bestimmten p-wert eine bestimmte (individuelle) totale Ladung. In einem elektrischen Feld können geladene Spezies getrennt werden. Es drängt sich zur Lösung des Problems also eine elektrophoretische Methode auf. Bei einer näheren Betrachtung des yclosporins fällt allerdings auf, dass dieses Molekül über keinerlei basische oder saure Gruppen verfügt. Die Enden der Kette haben sich zu einem Ring geschlossen, was weder Amino- noch arboxylgruppen übriglässt. Keine der beteiligten Aminosäuren verfügt über eine zusätzliche Amino- oder arboxylgruppe. Die Protonen der Amidgruppen sind nicht sauer genug, um durch milde basische Bedingungen deprotoniert zu werden. Das yclosporin kann also in seinem Verhalten durch einen Puffer kaum beeinflusst werden. Es verhält sich wie eine elektrisch neutrale Spezies.
11 9 Die Aufgabestellung lautet aber, dieses Molekül von anderen Peptiden zu trennen, deren Struktur nicht bekannt ist. Eine elektrophoretische Methode kann also dennoch die störenden Peptide zur Anode oder Kathode ziehen. Die nicht geladenen Spezies verharren etwa in der Mitte. Sie werden nur durch den elektroosmotischen Fluss bewegt. Denkbar ist auch der Einsatz der Gelpermeations-hromatographie. Dabei werden die Moleküle nach ihrer Grösse getrennt. b) Was halten sie von einer Trennung mittels G? Welchen Detektor würden Sie allenfalls verwenden? (1 Punkt) Das Peptid ist so gross und polar, dass es nicht in die Gasphase gebracht werden kann. Eine Trennung mit G ist daher nicht möglich. Die Frage nach dem Detektor erübrigt sich. c) Mit welchen spektroskopischen Methoden würden sie versuchen, die Struktur dieses Peptids aufzuklären? Welche Methode liefert am meisten Information? (2 Punkte) MS: Mit modernsten Laser-Desorptionsmethoden scheint eine Strukturaufklärung möglich, wenn man weiss, dass es sich um ein Peptid handelt. Diese Methoden wurden in der Vorlesung nicht explizit behandelt. Mit klassischer MS ist nichts auszurichten, da das Molekül nicht in die Gasphase gebracht werden kann. IR: Es lassen sich die Banden der -, N -, -, und =-Streckschwingungen erkennen, die aber für ein Peptid unspezifisch sind, da sie immer auftreten. 1 -NMR: Mit dem klassischen eindimensionalen 1 -NMR-Spektrum lassen sich mit grosser Mühe die Seitenketten identifizieren. Wie die Aminosäuren verknüpft sind, lässt sich aber nicht feststellen, da nur Protonen innerhalb der Seitenketten miteinander koppeln können. (Mit zweidimensionalen Methoden können möglicherweise die Seitenketten rekonstruiert und allenfalls sogar die Aminosäure-Einheiten zusammengesetzt werden. Diese Methoden wurden aber in der Vorlesung nicht im Detail behandelt.) 13 -NMR: Es lassen sich nur die Anzahl Signale zählen. Durch zusätzliche Multipuls- Experimente kann noch zusätzlich bestimmt werden, ob es sich um -, -, 2 -, oder 3 - Gruppen handelt. Über die Verknüpfung der -Atome ist nichts weiter in Erfahrung zu bringen. Nur das 1 -NMR-Spektrum liefert überhaupt Information über die Verknüpfung von - Atomen.
12 10 Aufgabe 4 6 Punkte Die Bestimmung der Konzentration von Alkohol in Blut muss schnell und zuverlässig durchgeführt werden können. Das Blut wird in einem verschlossenen Röhrchen so lange stehen gelassen, bis die Konzentrationen von Alkohol im Blut und in der überstehenden Gasphase im Gleichgewicht stehen. Dann wird eine bestimmte Menge der Gasphase in den G eingespritzt (ead-space-methode). Sie haben die Aufgabe, ein Trennsystem zu finden, mit dem man pro Stunde so viele Analysen wie möglich durchführen kann. In einem Katalog haben Sie untenstehendes hromatogramm gefunden. Von den getrennten Substanzen interessieren Sie nur die drei Alkohole Methanol, Ethanol und Propanol Methanol 3 Ethanol 6 Propanol min 4 Säule: Rtx-BA2, 30 m Länge, 0.53 mm innerer Durchmesser, 2 µm Schichtdicke Trägergas: e, 1 ml/min Injektortemperatur: 200 fentemperatur: 40, isotherm
13 11 Das Trennsystem wurde so optimiert, dass alle gezeigten Peaks gerade noch basisliniengetrennt sind. Nachdem die Trennung von 3, 4 und 5 im vorliegenden Fall gar nicht bewerkstelligt werden muss, ist die Trennung der verbleibenden Peaks eigentlich zu gut. Man kann sich also eine gezielte Verschlechterung leisten. Die Aufgabe besteht nicht darin, ein einzelnes hromatogramm so schnell wie möglich zu beenden, sondern so viele hromatogramme wie möglich in einer längeren Zeitperiode zu ermöglichen. Es ist also darauf zu achten, dass das Trennsystem nach einer Analyse möglichst schnell für die Bestimmung des nächsten hromatogramms zur Verfügung steht. a) Welche Massnahmen stehen Ihnen zur Verfügung, um die Analysendauer von 3 Minuten pro hromatogramm zu verkleinern? (2 Punkte) Eine Erhöhung der Temperatur kann die Elution der Peaks beschleunigen. Dies ist die Methode der Wahl, da sie keine Änderung des Trennsystems erfordert. Ein Temperaturprogramm würde den Zeitvvorteil wieder zunichte machen, da nach einer Analyse der fen des G wieder auf die ursprüngliche Temperatur abgekühlt und danach einige Zeit konditioniert werden müsste. Dies dauert länger als 3 Minuten. b) Welchen chromatographischen Parameter müssen sie beachten, damit ihre Analyse weiterhin quantitativ auswertbar ist? (2 Punkte) Die Auflösung zwischen den Peaks darf nicht zu klein werden. Anfang und Ende eines Peaks müssen auf der Basislinie liegen. c) Das untenstehende hromatogramm zeigt das Resultat einer Analyse mit einem anderen Säulentyp. at sich die Anzahl theoretischer Böden bezüglich Peak 6 im Vergleich zu obigem hromatogramm vergrössert oder verkleinert? Begründen Sie Ihre Ansicht! (2 Punkte) Die Formel zur Berechnung der Bodenzahl N lautet: t N = 16 ( R w ) 2 wobei t R die Retentionszeit und w die Basisbreite bedeuten. Siehe Skript S. 12. Da die Basisbreite der Peaks etwa gleich ist, die Retentionszeit aber abgenommen hat, hat sich die Anzahl Böden verkleinert.
14 Methanol 3 Ethanol 6 Propanol min 4
15 13 Aufgabe 5 7 Punkte Aus einer Kleeart wurden 25 verschiedene Verbindungen aus derselben Substanzklasse gewonnen und mit PL getrennt (siehe hromatogramm und Strukturen unten). Säule: Phenomenex Prodigy DS3, 5µm Korngrösse, 150 mm Länge, 3.2 mm innerer Durchmesser. Molible Phase: Gemisch von Acetonitril und Wasser: Linearer Konzentrationsgradient von 20 % bis 40 % Acetonitril min 40 R 3 R 4 R 2 R 1 R 5 Peak-Nr. R 1 R 2 R 3 R 4 R unbekannt 22 3 a) Was für eine stationäre Phase wurde wohl für die Trennung dieser Substanzen verwendet? Begründen Sie Ihre Ansicht! (2 Punkte) Nachdem als mobile Phase ein Gemisch von Acetonotril und Wasser verwendet wurde, also ein polares Laufmittel, handelt es sich um eine Umkehrphasen-hromatographie. Die stationäre Phase ist also ein Silicagel, bei dem die -Gruppen durch lange Kohlenwasserstoffketten verethert wurden. Betrachtet man die Strukturen der Substanzen 17, 20 und 22, so fällt auf, dass die Anzahl der -Gruppen, und damit die Polarität, in dieser Reihenfolge abnimmt. Die apolarste Verbindung 22 bleibt also am längsten auf der Säule, die damit ebenfalls apolar sein muss. b) Welche Detektionsmethode erscheint ihnen geeignet für diese Substanzklasse? Warum? (1 Punkt)
16 14 Die Substanzgruppe hat mehrere konjugierte Doppelbindungen, was sie für die Detektion mit einem UV-Spektrometer sehr geeignet macht. c) Um das gezeigte hromatogramm zu erhalten, musste das Pflanzenmaterial aufgearbeitet werden. Wie würden Sie dabei vorgehen? Welche Massnahmen müssen Sie ergeifen, um eine Kleepflanze so aufzuarbeiten, dass Sie einige µl Flüssigkeit in einen PL einspritzen können? (2 Punkte) Mehrere Methoden können in Betracht gezogen werden. Das Pflanzenmaterial muss sicher zerkleinert werden. Dazu eignet sich z. B. ein schnell rotierender Stabmixer. Zusammen mit etwas Wasser oder einem mit Wasser mischbaren Lösungsmittel wird ein dünnflüssiger Brei erzeugt. Dieses Material wird geklärt, indem es zentrifugiert oder filtriert wird. Denkbar ist auch, die Pflanzen zu trocknen und das wasserfreie Material in einer Soxhlet- Apparatur mit einem Lösungsmittel wie Ethanol, Acetonitril, Essigester oder exan zu extrahieren. Bei Verwendung eines apolaren Lösungsmittels könnte der Extrakt zur Trockene eingedampft und mit Acetonitril oder Laufmittel wieder aufgenommen werden. In jedem Fall muss die einzuspritzende Flüssigkeit durch ein Mikrofilter filtriert werden, damit es die Trennsäule nicht verstopft. Zudem muss die Flüssigkeit mit dem Laufmittel in jedem Verhältnis mischbar sein. Auch andere Aufarbeitungsmethoden wie eine Flüssig-flüssig-Extraktion oder dergleichen wurden als richtig akzeptiert. d) Sie interessieren sich im Wesentlichen nur für die Peaks 17, 20, 21 und 22. Zudem haben Sie den Verdacht, dass in den Peaks 21 und 22 jeweils mindestens zwei verschiedene Substanzen co-eluieren. Daher wollen Sie diesen Teil des hromatogramms besonders detailliert untersuchen. Wie ändern Sie die chromatographische Methode, um dieses Ziel zu erreichen? (2 Punkte) Diese Aufgabe ist am Schreibtisch nicht einfach zu lösen. Die vorgeschlagenen Methoden müssten im Labor ausprobiert werden. Daher wurden alle sinnvoll erscheinenden Massnahmen als richtig angesehen: Die vorliegende Methode wurde dahingehend optimiert, möglichst viele der erscheinenden Peaks voneinander zu trennen. Ein Verändern des Konzentrationsgradienten oder ein isokratischer Betrieb drängen sich daher auf. Normalerweise wird der Vorschlag, einen Parameter zu "ändern", in einer solchen Prüfung nicht mit der vollen Punktzahl bewertet. Wir wollen wissen, auf welche Seite man einen Parameter ändern soll. ier wurden alle Vorschläge als richtig anerkannt: das Laufmittel apolarer oder polarer machen oder "ändern", den Gradienten "anpassen". Man könnte generell die Auflösung verbessern, indem die Anzahl Trennstufen durch eine längere Säule vergrössert wird. Diese Massnahme stösst aber schnell an ihre Grenzen. Die eingesetzte Säule hat bereits eine Länge von 15 cm. Um die Auflösung zu verdoppeln, müsste die Säulenlänge vervierfacht werden. Zwei 25 cm lange gestopfte Säulen hintereinander zu schalten, muss bereits als Verzweiflungstat bezeichnet werden. Die möglichen kleinen Flussraten führen zu einem sehr langen hromatogramm.
Schriftliche Prüfung 2. Vordiplom Herbst 2003
 Prüfungen Analytische hemie Mittwoch, 1. ktober 2003 Schriftliche Prüfung 2. Vordiplom erbst 2003 D AB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische hemie Mittwoch, 1. ktober 2003 Schriftliche Prüfung 2. Vordiplom erbst 2003 D AB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Schriftliche Prüfung BSc Frühling 2008
 Prüfungen Analytische Chemie Samstag, 9. Februar 2008 Schriftliche Prüfung BSc Frühling 2008 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Samstag, 9. Februar 2008 Schriftliche Prüfung BSc Frühling 2008 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Schriftliche Prüfung BSc Herbst 2013
 Prüfungen Analytische Chemie Dienstag, 13. August 2013 Schriftliche Prüfung BSc Herbst 2013 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Dienstag, 13. August 2013 Schriftliche Prüfung BSc Herbst 2013 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Schriftliche Prüfung 2. Vordiplom / BSc Herbst 2004
 Prüfungen Analytische Chemie Dienstag, 1. September 4 Schriftliche Prüfung. Vordiplom / BSc erbst 4 D CAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Dienstag, 1. September 4 Schriftliche Prüfung. Vordiplom / BSc erbst 4 D CAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Schriftliche Prüfung BSc Frühling 2006 D CHAB/BIOL. Musterlösung. für den Teil Spektroskopie
 Prüfungen Analytische Chemie Mittwoch, 8. März 2006 Schriftliche Prüfung BSc Frühling 2006 D CAB/BIL Musterlösung für den Teil Spektroskopie Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die
Prüfungen Analytische Chemie Mittwoch, 8. März 2006 Schriftliche Prüfung BSc Frühling 2006 D CAB/BIL Musterlösung für den Teil Spektroskopie Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die
Schriftliche Prüfung 2. Vordiplom / BSc Herbst 2006
 Prüfungen Analytische Chemie Mittwoch, 27. September 2006 Schriftliche Prüfung 2. Vordiplom / BSc Herbst 2006 D CHAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare
Prüfungen Analytische Chemie Mittwoch, 27. September 2006 Schriftliche Prüfung 2. Vordiplom / BSc Herbst 2006 D CHAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare
Schriftliche Prüfung BSc Frühling 2006
 Prüfungen Analytische Chemie Mittwoch, 8. März 2006 Schriftliche Prüfung BSc Frühling 2006 D CAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt 36.
Prüfungen Analytische Chemie Mittwoch, 8. März 2006 Schriftliche Prüfung BSc Frühling 2006 D CAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt 36.
Schriftliche Prüfung BSc Herbst 2007
 Prüfungen Analytische Chemie Montag, 3. September 2007 Schriftliche Prüfung BSc Herbst 2007 D CHAB/BIOL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Montag, 3. September 2007 Schriftliche Prüfung BSc Herbst 2007 D CHAB/BIOL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Schriftliche Prüfung BSc Herbst 2014
 Prüfungen Analytische Chemie Montag, 25. August 2014 Schriftliche Prüfung BSc Herbst 2014 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt 36.
Prüfungen Analytische Chemie Montag, 25. August 2014 Schriftliche Prüfung BSc Herbst 2014 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt 36.
Schriftliche Prüfung 2. Vordiplom Frühling 2004
 Prüfungen Analytische Chemie Montag, 10. März 2004 Schriftliche Prüfung 2. Vordiplom Frühling 2004 D CAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Montag, 10. März 2004 Schriftliche Prüfung 2. Vordiplom Frühling 2004 D CAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Schriftliche Prüfung BSc Frühling 2014
 Prüfungen Analytische Chemie Samstag, 1. Februar 2014 Schriftliche Prüfung BSc Frühling 2014 D CHAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Samstag, 1. Februar 2014 Schriftliche Prüfung BSc Frühling 2014 D CHAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Schriftliche Prüfung BSc Frühling 2010
 Prüfungen Analytische Chemie Donnerstag, 11. Februar 2010 Schriftliche Prüfung BSc Frühling 2010 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Donnerstag, 11. Februar 2010 Schriftliche Prüfung BSc Frühling 2010 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Schriftliche Prüfung BSc Herbst 2007 D CHAB/BIOL. Musterlösung. für den Teil Spektroskopie
 Prüfungen Analytische Chemie Montag, 3. September 2007 Schriftliche Prüfung BSc Herbst 2007 D CHAB/BIOL Musterlösung für den Teil Spektroskopie Vorname:... Name:... Jede Aufgabe wird separat bewertet.
Prüfungen Analytische Chemie Montag, 3. September 2007 Schriftliche Prüfung BSc Herbst 2007 D CHAB/BIOL Musterlösung für den Teil Spektroskopie Vorname:... Name:... Jede Aufgabe wird separat bewertet.
Schriftliche Prüfung BSc Herbst 2010
 Prüfungen Analytische Chemie Dienstag, 24. August 2010 Schriftliche Prüfung BSc Herbst 2010 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Dienstag, 24. August 2010 Schriftliche Prüfung BSc Herbst 2010 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Schriftliche Prüfung BSc Frühling 2008 D CHAB/BIOL. Musterlösung. für den Teil Spektroskopie
 Prüfungen Analytische Chemie Samstag, 9. Februar 2008 Schriftliche Prüfung BSc Frühling 2008 D CHAB/BIL Musterlösung für den Teil Spektroskopie Vorname:... Name:... Jede Aufgabe wird separat bewertet.
Prüfungen Analytische Chemie Samstag, 9. Februar 2008 Schriftliche Prüfung BSc Frühling 2008 D CHAB/BIL Musterlösung für den Teil Spektroskopie Vorname:... Name:... Jede Aufgabe wird separat bewertet.
P105. Konstitution. Massenspektrum 100 % m/z
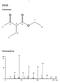 1 P105 Konstitution 7 1 2 6 8 4 5 Massenspektrum 100 % 4 116 50 7 101 29 55 88 15 61 10 14 158 0 0 50 100 150 m/z 2 Direkte Fragmentierungen: 4 115 11 45 129 29 85 7 Damit lassen sich die prominenten Signale
1 P105 Konstitution 7 1 2 6 8 4 5 Massenspektrum 100 % 4 116 50 7 101 29 55 88 15 61 10 14 158 0 0 50 100 150 m/z 2 Direkte Fragmentierungen: 4 115 11 45 129 29 85 7 Damit lassen sich die prominenten Signale
Schriftliche Prüfung BSc Herbst 2013 D CHAB/BIOL. Musterlösung
 Prüfungen Analytische Chemie Dienstag, 13. August 2013 Schriftliche Prüfung BSc Herbst 2013 D CHAB/BIL Musterlösung Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl
Prüfungen Analytische Chemie Dienstag, 13. August 2013 Schriftliche Prüfung BSc Herbst 2013 D CHAB/BIL Musterlösung Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl
Schriftliche Prüfung 2. Vordiplom / BSc Herbst 2004 D CHAB/BIOL. Musterlösung
 Prüfungen Analytische Chemie Dienstag, 21. September 4 Schriftliche Prüfung 2. Vordiplom / BSc erbst 4 D CAB/BIL Musterlösung Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare
Prüfungen Analytische Chemie Dienstag, 21. September 4 Schriftliche Prüfung 2. Vordiplom / BSc erbst 4 D CAB/BIL Musterlösung Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare
Schriftliche Prüfung BSc Herbst 2011
 Prüfungen Analytische Chemie Montag, 29. August 2011 Schriftliche Prüfung BSc Herbst 2011 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt 36.
Prüfungen Analytische Chemie Montag, 29. August 2011 Schriftliche Prüfung BSc Herbst 2011 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt 36.
Schriftliche Prüfung 2. Vordiplom Frühling 2003
 Prüfungen Analytische Chemie Montag, 10. März 2003 Schriftliche Prüfung 2. Vordiplom Frühling 2003 D ABI/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Montag, 10. März 2003 Schriftliche Prüfung 2. Vordiplom Frühling 2003 D ABI/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Schriftliche Prüfung BSc Winter 2016/17
 Prüfungen Analytische hemie Donnerstag, 26. Januar 2017 Schriftliche Prüfung BSc Winter 2016/17 D AB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische hemie Donnerstag, 26. Januar 2017 Schriftliche Prüfung BSc Winter 2016/17 D AB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Schriftliche Prüfung BSc Sommer 2016
 Prüfungen Analytische Chemie Donnerstag, 11. August 2016 Schriftliche Prüfung BSc Sommer 2016 D CHAB/BIOL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Donnerstag, 11. August 2016 Schriftliche Prüfung BSc Sommer 2016 D CHAB/BIOL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Schriftliche Prüfung 2. Vordiplom Frühling 2004 D CHAB/BIOL. Musterlösung
 Prüfungen Analytische Chemie Montag, 10. März 004 Schriftliche Prüfung. Vordiplom Frühling 004 D CAB/BIL Musterlösung Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl
Prüfungen Analytische Chemie Montag, 10. März 004 Schriftliche Prüfung. Vordiplom Frühling 004 D CAB/BIL Musterlösung Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl
Schriftliche Prüfung BSc Herbst 2015 D CHAB/BIOL. Musterlösung
 Prüfungen Analytische Chemie Mittwoch, 4. Februar 2015 Schriftliche Prüfung BSc Herbst 2015 D CHAB/BIL Musterlösung Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl
Prüfungen Analytische Chemie Mittwoch, 4. Februar 2015 Schriftliche Prüfung BSc Herbst 2015 D CHAB/BIL Musterlösung Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl
Schriftliche Prüfungen Jahreskurs Analytische Chemie I&II Sommer 2011 BSc D-CHAB/BIOL
 Schriftliche Prüfungen Jahreskurs Analytische Chemie I&II Sommer 2011 BSc D-CHAB/BIOL Vorname: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich Ihre
Schriftliche Prüfungen Jahreskurs Analytische Chemie I&II Sommer 2011 BSc D-CHAB/BIOL Vorname: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich Ihre
Schriftliche Prüfung 2. Vordiplom / BSc Frühling 2005 D CHAB/BIOL. Musterlösung
 Prüfungen Analytische Chemie Dienstag, 1. März 2005 Schriftliche Prüfung 2. Vordiplom / BSc Frühling 2005 D CHAB/BIL Musterlösung Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare
Prüfungen Analytische Chemie Dienstag, 1. März 2005 Schriftliche Prüfung 2. Vordiplom / BSc Frühling 2005 D CHAB/BIL Musterlösung Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare
Schriftliche Prüfungen Smesterkurs Analytische Chemie I Instrumentalanalyse organischer Vebindungen Sommer 2011
 Schriftliche Prüfungen Smesterkurs Analytische Chemie I Instrumentalanalyse organischer Vebindungen Sommer 2011 Vorname: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120
Schriftliche Prüfungen Smesterkurs Analytische Chemie I Instrumentalanalyse organischer Vebindungen Sommer 2011 Vorname: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120
Schriftliche Prüfungen Jahreskurs Analytische Chemie I&II Winter 2011/2012 BSc D-CHAB/BIOL
 Schriftliche Prüfungen Jahreskurs Analytische Chemie I&II Winter 2011/2012 BSc D-CHAB/BIOL Vorname: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich
Schriftliche Prüfungen Jahreskurs Analytische Chemie I&II Winter 2011/2012 BSc D-CHAB/BIOL Vorname: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich
Schriftliche Prüfung Analytische Chemie I&II Winter 2012/2013
 Schriftliche Prüfung Analytische Chemie I&II Winter 2012/2013 Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich Ihre Zeit gut ein.
Schriftliche Prüfung Analytische Chemie I&II Winter 2012/2013 Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich Ihre Zeit gut ein.
Schriftliche Prüfung BSc Frühling 2012
 Prüfungen Analytische Chemie Samstag, 4. Februar 2012 Schriftliche Prüfung BSc Frühling 2012 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Samstag, 4. Februar 2012 Schriftliche Prüfung BSc Frühling 2012 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Z 12 1) BESTIMMUNG DER SUMMENFORMEL: a. AUS DEN MASSENPROZENTEN
 ANALYTIK 1) BESTIMMUNG DER SUMMENFORMEL: a. AUS DEN MASSENPROZENTEN Ziel: Ermittlung einer Summenformel einer Substanz aus C, und O wenn die Massenprozent der Elemente und die Molmasse M r der Substanz
ANALYTIK 1) BESTIMMUNG DER SUMMENFORMEL: a. AUS DEN MASSENPROZENTEN Ziel: Ermittlung einer Summenformel einer Substanz aus C, und O wenn die Massenprozent der Elemente und die Molmasse M r der Substanz
Schriftliche Prüfung S Analytische Chemie I Sommer 2017
 Schriftliche Prüfung 529-0051- 00S Analytische Chemie I Sommer 2017 Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 60 Min. Teilen Sie sich Ihre Zeit gut
Schriftliche Prüfung 529-0051- 00S Analytische Chemie I Sommer 2017 Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 60 Min. Teilen Sie sich Ihre Zeit gut
Schriftliche Prüfung S Analytische Chemie I Sommer 2015
 Schriftliche Prüfung 529-0051- 00S Analytische Chemie I Sommer 2015 Vorname: Name: Legi-Nr.: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 60 Min. Teilen Sie sich Ihre Zeit gut
Schriftliche Prüfung 529-0051- 00S Analytische Chemie I Sommer 2015 Vorname: Name: Legi-Nr.: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 60 Min. Teilen Sie sich Ihre Zeit gut
Schriftliche Prüfung Analytische Chemie I Sommer 2014
 Schriftliche Prüfung Analytische Chemie I Sommer 2014 Vorname: Name: Legi-Nr.: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 60 Min. Teilen Sie sich Ihre Zeit gut ein. Es sind
Schriftliche Prüfung Analytische Chemie I Sommer 2014 Vorname: Name: Legi-Nr.: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 60 Min. Teilen Sie sich Ihre Zeit gut ein. Es sind
Schriftliche Prüfung Analytische Chemie I / Instrumentalanalyse organischer Verbindungen
 Schriftliche Prüfung Analytische Chemie I / Instrumentalanalyse organischer Verbindungen Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 60 Min. Teilen
Schriftliche Prüfung Analytische Chemie I / Instrumentalanalyse organischer Verbindungen Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 60 Min. Teilen
Grundlagen der Chromatographie
 Grundlagen der Chromatographie Was ist Chromatographie? Trennung ähnlicher Moleküle aus komplexen Gemischen o Die Analyte werden in einer mobilen Phase gelöst und darin durch eine stationäre Phase transportiert.
Grundlagen der Chromatographie Was ist Chromatographie? Trennung ähnlicher Moleküle aus komplexen Gemischen o Die Analyte werden in einer mobilen Phase gelöst und darin durch eine stationäre Phase transportiert.
2.2. Peptide. Peptide entstehen durch Kondensation der a-carboxylgruppe einer Aminosäure mit der a-aminogruppe einer anderen Aminosäure
 2.2. Peptide Peptide entstehen durch Kondensation der a-carboxylgruppe einer Aminosäure mit der a-aminogruppe einer anderen Aminosäure Peptid: bis zu ~30 linear über Peptidbindung verknüpfte Aminosäuren
2.2. Peptide Peptide entstehen durch Kondensation der a-carboxylgruppe einer Aminosäure mit der a-aminogruppe einer anderen Aminosäure Peptid: bis zu ~30 linear über Peptidbindung verknüpfte Aminosäuren
Eingestellter Ginkgotrockenextrakt
 Eingestellter Ginkgotrockenextrakt Ginkgo extractum siccum normatum Definition Eingestellter Ginkgotrockenextrakt wird hergestellt aus den getrockneten Blättern von Ginkgo biloba L. Er enthält mindestens
Eingestellter Ginkgotrockenextrakt Ginkgo extractum siccum normatum Definition Eingestellter Ginkgotrockenextrakt wird hergestellt aus den getrockneten Blättern von Ginkgo biloba L. Er enthält mindestens
Kombinierte Übungen zur Spektroskopie Beispiele für die Bearbeitung
 Im folgenden soll gezeigt werden, daß es großen Spaß macht, spektroskopische Probleme zu lösen. Es gibt kein automatisches Lösungsschema, sondern höchstens Strategien, wie beim "Puzzle Lösen"; häufig hilft
Im folgenden soll gezeigt werden, daß es großen Spaß macht, spektroskopische Probleme zu lösen. Es gibt kein automatisches Lösungsschema, sondern höchstens Strategien, wie beim "Puzzle Lösen"; häufig hilft
Vorlesung. Analytik (für Biologen und Pharmazeuten) Einführung in spektroskopische Methoden der Strukturaufklärung organischer Verbindungen
 Vorlesung Analytik (für Biologen und Pharmazeuten) Einführung in spektroskopische Methoden der Strukturaufklärung organischer Verbindungen Zusammenfassung des Teils "Spektroskopie" für die Prüfung BSc
Vorlesung Analytik (für Biologen und Pharmazeuten) Einführung in spektroskopische Methoden der Strukturaufklärung organischer Verbindungen Zusammenfassung des Teils "Spektroskopie" für die Prüfung BSc
Schriftliche Prüfung 2. Vordiplom Frühling 2003 D ANBI/BIOL. Musterlösung
 Prüfungen Analytische Chemie Montag, 10. März 2003 Schriftliche Prüfung 2. Vordiplom Frühling 2003 D ANBI/BIL Musterlösung Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare
Prüfungen Analytische Chemie Montag, 10. März 2003 Schriftliche Prüfung 2. Vordiplom Frühling 2003 D ANBI/BIL Musterlösung Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare
Chemiepraktikum für Biologen. Versuchsprotokoll. Einzelanalyse Trennung, Reinigung, Nachweis von 3 Reinsubstanzen
 Johannes Gutenberg Universität Fachbereich Biologie hemiepraktikum für Biologen SS 2002 Versuchsprotokoll zum Thema Einzelanalyse Trennung, Reinigung, achweis von 3 Reinsubstanzen von Ausgangslösung: Die
Johannes Gutenberg Universität Fachbereich Biologie hemiepraktikum für Biologen SS 2002 Versuchsprotokoll zum Thema Einzelanalyse Trennung, Reinigung, achweis von 3 Reinsubstanzen von Ausgangslösung: Die
Original oder Fälschung?
 Original oder Fälschung? Eine Analyse von Medikamenten Schlussbericht Studienwoche 15 Schweizer Jugend forscht Autor: Gian Fadri Beeli, Kantonsschule Chur Betreuungspersonen: Dr. Christian Guenat, Novartis
Original oder Fälschung? Eine Analyse von Medikamenten Schlussbericht Studienwoche 15 Schweizer Jugend forscht Autor: Gian Fadri Beeli, Kantonsschule Chur Betreuungspersonen: Dr. Christian Guenat, Novartis
Spektroskopie-Seminar SS NMR-Spektroskopie. H-NMR-Spektroskopie. nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie
 1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 4.1 Allgemeines Spektroskopische Methode zur Untersuchung von Atomen: elektronische Umgebung Wechselwirkung
1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 4.1 Allgemeines Spektroskopische Methode zur Untersuchung von Atomen: elektronische Umgebung Wechselwirkung
Peaky und Chromy in Frankfurt - die richtigen Antworten
 Der HPLC-Tipp im Januar 2013 Peaky und Chromy in Frankfurt - die richtigen Antworten von Dr. Stavros Kromidas, Saarbrücken Liebe Leser, im Dezember-Tipp hatte ich Ihnen vom Gespräch zwischen Peaky und
Der HPLC-Tipp im Januar 2013 Peaky und Chromy in Frankfurt - die richtigen Antworten von Dr. Stavros Kromidas, Saarbrücken Liebe Leser, im Dezember-Tipp hatte ich Ihnen vom Gespräch zwischen Peaky und
4 Synthesen antiprionen-aktiver Verbindungen
 4 Synthesen antiprionen-aktiver Verbindungen Quinacrinanaloga (Grundstruktur C) 77 4 Synthesen antiprionen-aktiver Verbindungen 4.1 Synthesen der Quinacrinanaloga (Grundstruktur C) Die Synthesen der Quinacrinanaloga
4 Synthesen antiprionen-aktiver Verbindungen Quinacrinanaloga (Grundstruktur C) 77 4 Synthesen antiprionen-aktiver Verbindungen 4.1 Synthesen der Quinacrinanaloga (Grundstruktur C) Die Synthesen der Quinacrinanaloga
Teil 1 Aufgaben zum Stoff der Vorlesung OC1a (Grundvorlesung Organische Chemie) Maximale Punktezahl: 20 Notwendige Mindestpunkte: 8
 1. Klausur OC1 (BSc-Studiengang) PIN: 18.02.2016 11:00 14:00 Uhr N6 Name: Punkte: Matrikel Nr. Note: Notenskala: 80-78=1.0 77-75=1.3 74-71=1.5 70-67=1.7 66-63=2.0 62-59=2.3 58-56=2.5 55-53=2.7 52-50=3.0
1. Klausur OC1 (BSc-Studiengang) PIN: 18.02.2016 11:00 14:00 Uhr N6 Name: Punkte: Matrikel Nr. Note: Notenskala: 80-78=1.0 77-75=1.3 74-71=1.5 70-67=1.7 66-63=2.0 62-59=2.3 58-56=2.5 55-53=2.7 52-50=3.0
Schriftliche Prüfung BSc Herbst 2010 D CHAB/BIOL. Musterlösung. Vorname:... Name:...
 Prüfungen Analytische Chemie Dienstag, 24. August 2010 Schriftliche Prüfung BSc Herbst 2010 D CHAB/BIL Musterlösung Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl
Prüfungen Analytische Chemie Dienstag, 24. August 2010 Schriftliche Prüfung BSc Herbst 2010 D CHAB/BIL Musterlösung Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl
Kurs "Spektroskopische Methoden in der Anorganischen und Organischen Chemie" Kernresonanzspektroskopie - Übungen Lösung zu NMR-6 (Blatt 1)
 Kernresonanzspektroskopie - Übungen Lösung zu NMR-6 (Blatt ) Zum Lösungsmittel: Das Kohlenstoffspektrum zeigt bei 77 ppm drei gleich große äquidistante Signale. Diese stammen von CDC 3. Chemische Verschiebungen
Kernresonanzspektroskopie - Übungen Lösung zu NMR-6 (Blatt ) Zum Lösungsmittel: Das Kohlenstoffspektrum zeigt bei 77 ppm drei gleich große äquidistante Signale. Diese stammen von CDC 3. Chemische Verschiebungen
Schriftliche Prüfung BSc Herbst 2015 D CHAB/BIOL. Musterlösung
 Prüfungen Analytische Chemie Dienstag, 18. August 2015 Schriftliche Prüfung BSc Herbst 2015 D CHAB/BIL Musterlösung Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl
Prüfungen Analytische Chemie Dienstag, 18. August 2015 Schriftliche Prüfung BSc Herbst 2015 D CHAB/BIL Musterlösung Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl
Optimierung der Analytik von Peptiden und kleinen Proteinen
 Produkte & Applikationen LC 24 2017 Optimierung der Analytik von Peptiden und kleinen Proteinen Relativ kleine Änderungen der Bedingungen können in der Peptidanalytik mittels RP-Chromatografie größere
Produkte & Applikationen LC 24 2017 Optimierung der Analytik von Peptiden und kleinen Proteinen Relativ kleine Änderungen der Bedingungen können in der Peptidanalytik mittels RP-Chromatografie größere
5 HPLC-Methodenentwicklung zur Isomerentrennung
 HPLC-Untersuchungen 5 HPLC-Untersuchungen 65 5 HPLC-Methodenentwicklung zur Isomerentrennung Die bei der -Substitution des Benzimidazolgrundgerüstes entstehenden Isomere machen eine nachfolgende Trennung
HPLC-Untersuchungen 5 HPLC-Untersuchungen 65 5 HPLC-Methodenentwicklung zur Isomerentrennung Die bei der -Substitution des Benzimidazolgrundgerüstes entstehenden Isomere machen eine nachfolgende Trennung
Elektrophorese. Herbstsemester ETH Zurich Dr. Thomas Schmid Dr. Martin Badertscher,
 Elektrophorese 1 Elektrophorese Allgemein: Wanderung geladener Teilchen im elektrischen Feld Analytische Chemie: Trennung von Ionen im elektrischen Feld (Elektrophoretische Trenntechniken zählen im Allgemeinen
Elektrophorese 1 Elektrophorese Allgemein: Wanderung geladener Teilchen im elektrischen Feld Analytische Chemie: Trennung von Ionen im elektrischen Feld (Elektrophoretische Trenntechniken zählen im Allgemeinen
Spektroskopie-Seminar WS 17/18 5 NMR-Spektroskopie. H-NMR-Spektroskopie. nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie
 WS 17/18 1 -NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 1 5.1 1 -NMR-Spektroskopie NMR-Spektrum liefert folgende Informationen: Chemische Verschiebung δ(in
WS 17/18 1 -NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 1 5.1 1 -NMR-Spektroskopie NMR-Spektrum liefert folgende Informationen: Chemische Verschiebung δ(in
Schriftliche Prüfung J Analytische Chemie I&II Sommer 2015
 Schriftliche Prüfung 529-0058- 00J Analytische Chemie I&II Sommer 2015 Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich Ihre Zeit
Schriftliche Prüfung 529-0058- 00J Analytische Chemie I&II Sommer 2015 Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich Ihre Zeit
Schriftliche Prüfung S Analytische Chemie I Winter 2018
 Schriftliche Prüfung 529-0051-00S Analytische Chemie I Winter 2018 Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 60 Min. Teilen Sie sich Ihre Zeit gut
Schriftliche Prüfung 529-0051-00S Analytische Chemie I Winter 2018 Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 60 Min. Teilen Sie sich Ihre Zeit gut
III. Strukturbestimmung organischer Moleküle
 III. Strukturbestimmung organischer Moleküle Röntgenstrukturbestimmung g Spektroskopie UV-VIS IR NMR Massenspektrometrie (MS) Röntgenstruktur eines bakteriellen Kohlenhydrats O O O O O O O C3 Röntgenstruktur
III. Strukturbestimmung organischer Moleküle Röntgenstrukturbestimmung g Spektroskopie UV-VIS IR NMR Massenspektrometrie (MS) Röntgenstruktur eines bakteriellen Kohlenhydrats O O O O O O O C3 Röntgenstruktur
Schriftliche Prüfung Analytische Chemie I&II Sommer 2014
 Schriftliche Prüfung Analytische Chemie I&II Sommer 2014 Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich Ihre Zeit gut ein. Es
Schriftliche Prüfung Analytische Chemie I&II Sommer 2014 Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich Ihre Zeit gut ein. Es
ATTO 565 und ATTO 590
 ATTO 565 und ATTO 590 Allgemeine Informationen ATTO 565 und ATTO 590 sind Fluoreszenzmarker aus der Familie der Rhodamin-Farbstoffe. Diese Farbstoffe besitzen als gemeinsames Strukturelement einen Carboxyphenyl-
ATTO 565 und ATTO 590 Allgemeine Informationen ATTO 565 und ATTO 590 sind Fluoreszenzmarker aus der Familie der Rhodamin-Farbstoffe. Diese Farbstoffe besitzen als gemeinsames Strukturelement einen Carboxyphenyl-
Analytische Chemie (für Biol. / Pharm. Wiss.)
 Analytische Chemie (für Biol. / Pharm. Wiss.) Teil: Trenntechniken (Chromatographie, Elektrophorese) Dr. Martin Pabst HCI D323 martin.pabst@org.chem.ethz.ch http://www.analytik.ethz.ch/ ETH Zurich Dr.
Analytische Chemie (für Biol. / Pharm. Wiss.) Teil: Trenntechniken (Chromatographie, Elektrophorese) Dr. Martin Pabst HCI D323 martin.pabst@org.chem.ethz.ch http://www.analytik.ethz.ch/ ETH Zurich Dr.
Aufgabe 1: (18 Punkte)
 Aufgabe 1: (18 Punkte) In der Arbeitsgruppe Hilt wurde folgende Reaktionssequenz durchgeführt: A H 10 H B O O O 1 1 2 2 + 10 3 3 4 4 Δ DA- Produkt 6-9 5 5 6-9 2 Ph Ph Co(dppe) 2 3 3 4 4 Im ersten Reaktionsschritt
Aufgabe 1: (18 Punkte) In der Arbeitsgruppe Hilt wurde folgende Reaktionssequenz durchgeführt: A H 10 H B O O O 1 1 2 2 + 10 3 3 4 4 Δ DA- Produkt 6-9 5 5 6-9 2 Ph Ph Co(dppe) 2 3 3 4 4 Im ersten Reaktionsschritt
Spektroskopie-Seminar SS NMR-Spektroskopie. H-NMR-Spektroskopie. nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie
 1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 5.1 1 H-NMR-Spektroskopie NMR-Spektrum liefert folgende Informationen: Chemische Verschiebung d (in ppm):
1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 5.1 1 H-NMR-Spektroskopie NMR-Spektrum liefert folgende Informationen: Chemische Verschiebung d (in ppm):
Spektroskopische Methoden in der Organischen Chemie (OC IV) NMR Spektroskopie 1. Physikalische Grundlagen
 NMR Spektroskopie 1. Physikalische Grundlagen Viele Atomkerne besitzen einen von Null verschiedenen Eigendrehimpuls (Spin) p=ħ I, der ganz oder halbzahlige Werte von ħ betragen kann. I bezeichnet die Kernspin-Quantenzahl.
NMR Spektroskopie 1. Physikalische Grundlagen Viele Atomkerne besitzen einen von Null verschiedenen Eigendrehimpuls (Spin) p=ħ I, der ganz oder halbzahlige Werte von ħ betragen kann. I bezeichnet die Kernspin-Quantenzahl.
Spektroskopie-Seminar SS NMR-Spektroskopie. H-NMR-Spektroskopie. nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie
 1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 4 NMR-Spektroskopie 5.1 1 H-NMR-Spektroskopie Wasserstoffatome ( 1 H, natürliche Häufigkeit 99,985 %) mit
1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 4 NMR-Spektroskopie 5.1 1 H-NMR-Spektroskopie Wasserstoffatome ( 1 H, natürliche Häufigkeit 99,985 %) mit
13 C, 1 H-Kopplungskonstanten. 13 C, 1 H-Kopplungen hier leichter erkannt werden können. Spektroskopie in der Organischen Chemie
 Spektroskopie in der Organischen hemie 13, 1 -Kopplungskonstanten NMR-Signalaufspaltungen aufgrund von skalaren Kopplungen treten grundsätzlich bei beiden Kopplungspartnern auf. Entsprechend kann man 13,
Spektroskopie in der Organischen hemie 13, 1 -Kopplungskonstanten NMR-Signalaufspaltungen aufgrund von skalaren Kopplungen treten grundsätzlich bei beiden Kopplungspartnern auf. Entsprechend kann man 13,
Spektroskopiemodul II. H-NMR und 13 C-NMR
 Spektroskopiemodul II 1 H-NMR und 13 C-NMR 1 1. Was gehört zu einer vollständigen Spektreninterpretation zur Strukturaufklärung? 1.1. 1 H-NMR-Spektren Man muss die chemische Verschiebung jedes einzelnen
Spektroskopiemodul II 1 H-NMR und 13 C-NMR 1 1. Was gehört zu einer vollständigen Spektreninterpretation zur Strukturaufklärung? 1.1. 1 H-NMR-Spektren Man muss die chemische Verschiebung jedes einzelnen
Schriftliche Prüfung J Analytische Chemie I&II Winter 2015
 Schriftliche Prüfung 529-0058- 00J Analytische Chemie I&II Winter 2015 Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich Ihre Zeit
Schriftliche Prüfung 529-0058- 00J Analytische Chemie I&II Winter 2015 Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich Ihre Zeit
Analytische Chemie (für Biol. / Pharm. Wiss.)
 Analytische Chemie (für Biol. / Pharm. Wiss.) Teil: Trenntechniken (Chromatographie, Elektrophorese) Dr. Martin Pabst Laboratory of Organic Chemistry HCI D323 martin.pabst@org.chem.ethz.ch http://www.analytik.ethz.ch/
Analytische Chemie (für Biol. / Pharm. Wiss.) Teil: Trenntechniken (Chromatographie, Elektrophorese) Dr. Martin Pabst Laboratory of Organic Chemistry HCI D323 martin.pabst@org.chem.ethz.ch http://www.analytik.ethz.ch/
Aminosäuren und Proteine
 Aminosäuren und Proteine Von Mohammed Jaber Aminosäuren und Proteine Kleinigkeit: 23 proteinogene AS 250 nicht-proteinogene AS (Anzahl synthetisch erzeugten erheblich größer) Aminosäuren und Proteine Kleinigkeit:
Aminosäuren und Proteine Von Mohammed Jaber Aminosäuren und Proteine Kleinigkeit: 23 proteinogene AS 250 nicht-proteinogene AS (Anzahl synthetisch erzeugten erheblich größer) Aminosäuren und Proteine Kleinigkeit:
Chemisches Praktikum für Biologen
 Chemisches Praktikum für Biologen Klausur am 17.11.2015 Name: Vorname: Matrikelnummer: Aufgabe Maximale Punktzahl Erreichte Punktzahl 1 3 2 3 3 3 4 3 5 3 6 3 7 3 8 3 Gesamt 24 Bestanden: Die Klausur besteht
Chemisches Praktikum für Biologen Klausur am 17.11.2015 Name: Vorname: Matrikelnummer: Aufgabe Maximale Punktzahl Erreichte Punktzahl 1 3 2 3 3 3 4 3 5 3 6 3 7 3 8 3 Gesamt 24 Bestanden: Die Klausur besteht
2017 Umsetzung von Zimtsäurechlorid mit Ammoniak zu Zimtsäureamid
 217 Umsetzung von Zimtsäurechlorid mit Ammoniak zu Zimtsäureamid O O Cl NH 3 NH 2 C 9 H 7 ClO (166.6) (17.) C 9 H 9 NO (147.2) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der Carbonylgruppe
217 Umsetzung von Zimtsäurechlorid mit Ammoniak zu Zimtsäureamid O O Cl NH 3 NH 2 C 9 H 7 ClO (166.6) (17.) C 9 H 9 NO (147.2) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der Carbonylgruppe
Inhalt SEMINAR 1: mit zu bringen ist: 1. DC von Aminosäuren. 2. Pipettierübung (Präzisionskontrolle) 3. Gelfiltration
 SEMINAR 1: mit zu bringen ist: Arbeitsmantel Skriptum Rechner, Bleistift, Lineal... Protokollheft Und darin eingeklebt das Anwesenheitsblatt 1 Inhalt 1. DC von Aminosäuren 2. Pipettierübung (Präzisionskontrolle)
SEMINAR 1: mit zu bringen ist: Arbeitsmantel Skriptum Rechner, Bleistift, Lineal... Protokollheft Und darin eingeklebt das Anwesenheitsblatt 1 Inhalt 1. DC von Aminosäuren 2. Pipettierübung (Präzisionskontrolle)
Endbericht über die Untersuchungen zur. Entwicklung chromatographischer Analysenmethoden zur Charakterisierung von Auszügen aus Wirsingkohl
 KARL-FRANZENS-UNIVERSITÄT GRAZ INSTITUT FÜR PHARMAZEUTISCHE WISSENSCHAFTEN Pharmakognosie Univ.-Prof. Dr. Rudolf Bauer Universitätsplatz 4, A-8010 Graz, Austria Tel. (+43) 316-380 8700; Fax (+43) 316-380
KARL-FRANZENS-UNIVERSITÄT GRAZ INSTITUT FÜR PHARMAZEUTISCHE WISSENSCHAFTEN Pharmakognosie Univ.-Prof. Dr. Rudolf Bauer Universitätsplatz 4, A-8010 Graz, Austria Tel. (+43) 316-380 8700; Fax (+43) 316-380
M U S T E R L Ö S U N G
 Prof. Dr.. Reiser Prof. Dr. A. Geyer 3. Klausur zum Praktikum rganische hemie I für Studierende der hemie und der Biochemie im SS 2002 am Dienstag, dem 16. Juli 2002 ame:... Vorname:... Matrikelnummer:...
Prof. Dr.. Reiser Prof. Dr. A. Geyer 3. Klausur zum Praktikum rganische hemie I für Studierende der hemie und der Biochemie im SS 2002 am Dienstag, dem 16. Juli 2002 ame:... Vorname:... Matrikelnummer:...
Schriftliche Prüfung J Analytische Chemie I&II Sommer 2016
 Schriftliche Prüfung 529-0058- 00J Analytische Chemie I&II Sommer 2016 Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich Ihre Zeit
Schriftliche Prüfung 529-0058- 00J Analytische Chemie I&II Sommer 2016 Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich Ihre Zeit
Übungsaufgaben - Analytik
 Übungsaufgaben - Analytik Übung 1 Von einer Substanz soll der molare Extinktionskoeffizient bestimmt werden. Der Laborant hat mässig exakt verdünnt. Er hat jeweils die auf der x-achse angegbene Zahl an
Übungsaufgaben - Analytik Übung 1 Von einer Substanz soll der molare Extinktionskoeffizient bestimmt werden. Der Laborant hat mässig exakt verdünnt. Er hat jeweils die auf der x-achse angegbene Zahl an
NMR-Spektroskopie. Magnet. Steuerung. Probenrohr Spinner. Shimspulen. B -Spulen. Gradient 2. Vorverstärker
 NMR-Spektroskopie Magnet Steuerung He He CPU Frequenz Pulsform Pulsleistung Zeitkontrolle Temperierung Gradienten Shim/Lock/Gas Vorverstärker N N Probenrohr Spinner Shimspulen B -Spulen Gradient 2 H K
NMR-Spektroskopie Magnet Steuerung He He CPU Frequenz Pulsform Pulsleistung Zeitkontrolle Temperierung Gradienten Shim/Lock/Gas Vorverstärker N N Probenrohr Spinner Shimspulen B -Spulen Gradient 2 H K
Kernmagnetische Resonanzspektroskopie (NMR) Spektroskopische Methoden
 Kernmagnetische Resonanzspektroskopie (NMR) Spektroskopische Methoden Grundlagen Die meisten Atomkerne führen eine Drehbewegung um die eigene Achse aus ("Spin"). Da sie geladene Teilchen (Protonen) enthalten,
Kernmagnetische Resonanzspektroskopie (NMR) Spektroskopische Methoden Grundlagen Die meisten Atomkerne führen eine Drehbewegung um die eigene Achse aus ("Spin"). Da sie geladene Teilchen (Protonen) enthalten,
Fortgeschrittenen-Praktikum Organische Chemie Wintersemester 2012/2013
 Fortgeschrittenen-Praktikum Organische Chemie Wintersemester 2012/2013 Universität Leipzig Fakultät für Chemie und Mineralogie Wasserdampfdestillation von Anisöl aus Anissamen Anton Werwein, Richard Cybik
Fortgeschrittenen-Praktikum Organische Chemie Wintersemester 2012/2013 Universität Leipzig Fakultät für Chemie und Mineralogie Wasserdampfdestillation von Anisöl aus Anissamen Anton Werwein, Richard Cybik
NMR-Spektroskopie Teil 2
 BC 3.4 : Analytische Chemie I NMR Teil 2 NMR-Spektroskopie Teil 2 Stefanie Wolfram Stefanie.Wolfram.1@uni-jena.de Raum 228, TO Vom Spektrum zur Struktur 50000 40000 Peaks u. Integrale 30000 Chemische Verschiebung
BC 3.4 : Analytische Chemie I NMR Teil 2 NMR-Spektroskopie Teil 2 Stefanie Wolfram Stefanie.Wolfram.1@uni-jena.de Raum 228, TO Vom Spektrum zur Struktur 50000 40000 Peaks u. Integrale 30000 Chemische Verschiebung
Spektroskopie-Seminar SS 18 8 Massenspektrometrie Massenspektrometrie
 SS 18 Massenspektrometrie 1 8.1 Prinzip Methode zur Bestimmung der Masse von Molekülen Analyt wird in die Gasphase überführt Moleküle werden ionisiert und durch elektrisches Feld beschleunigt Auftrennung
SS 18 Massenspektrometrie 1 8.1 Prinzip Methode zur Bestimmung der Masse von Molekülen Analyt wird in die Gasphase überführt Moleküle werden ionisiert und durch elektrisches Feld beschleunigt Auftrennung
Übungsaufgaben NMR-Spektroskopie (1)
 Übungsaufgaben NMR-Spektroskopie (1) 1. Kerne haben drei wichtige Eigenschaften: Masse m, Ladung Q und Eigendrehimpuls p. Kernsorte Spin natürliche Häufigkeit Gyromagnet. Verhältnis γ [Tsec] 1 1 H 1/2
Übungsaufgaben NMR-Spektroskopie (1) 1. Kerne haben drei wichtige Eigenschaften: Masse m, Ladung Q und Eigendrehimpuls p. Kernsorte Spin natürliche Häufigkeit Gyromagnet. Verhältnis γ [Tsec] 1 1 H 1/2
NMR - Seite 1. NMR (Kernresonanzspektroskopie) Allgemeines zur Theorie
 NMR - Seite 1 NMR (Kernresonanzspektroskopie) Allgemeines zur Theorie Protonen besitzen ebenso wie Elektronen einen eigenen Spin (Drehung um die eigene Achse).Allerdings gibt es mehrere Möglichkeiten als
NMR - Seite 1 NMR (Kernresonanzspektroskopie) Allgemeines zur Theorie Protonen besitzen ebenso wie Elektronen einen eigenen Spin (Drehung um die eigene Achse).Allerdings gibt es mehrere Möglichkeiten als
ETHANOL 70 Prozent Ethanolum 70 per centum. Aethanolum dilutum. Ethanol 70 Prozent ist eine Mischung von Ethanol 96 Prozent und Wasser.
 ÖAB 2008/004 ETHANOL 70 Prozent Ethanolum 70 per centum Aethanolum dilutum Definition Ethanol 70 Prozent ist eine Mischung von Ethanol 96 Prozent und Wasser. Gehalt: Ethanol 70 Prozent enthält mindestens
ÖAB 2008/004 ETHANOL 70 Prozent Ethanolum 70 per centum Aethanolum dilutum Definition Ethanol 70 Prozent ist eine Mischung von Ethanol 96 Prozent und Wasser. Gehalt: Ethanol 70 Prozent enthält mindestens
Der Kern-Overhauser-Effekt (Nuclear Overhauser Effect, NOE)
 Der Kern-verhauser-Effekt (Nuclear verhauser Effect, NE) Die Intensität eines 1 H-Signals kann durch ein Entkopplungsexperiment verändert werden. Wird der Übergang eines ausgewählten 1 H-Kerns S für eine
Der Kern-verhauser-Effekt (Nuclear verhauser Effect, NE) Die Intensität eines 1 H-Signals kann durch ein Entkopplungsexperiment verändert werden. Wird der Übergang eines ausgewählten 1 H-Kerns S für eine
Spektroskopie in der Organischen Chemie. Massenspektren
 Massenspektren In der Frühzeit der MS wurden Spektren auf Fotopapier registriert, wobei das Spektrum mehrfach mit unterschiedlicher Ordinatenauslenkung ausgeschrieben wurde, um sehr schwache neben sehr
Massenspektren In der Frühzeit der MS wurden Spektren auf Fotopapier registriert, wobei das Spektrum mehrfach mit unterschiedlicher Ordinatenauslenkung ausgeschrieben wurde, um sehr schwache neben sehr
Coffein-Natriumbenzoat Coffeinum-natrii benzoas Synonym: Coffeinum-Natrium benzoicum
 !!! NEUE ÖAB-MONOGRAPHIE!!! Die folgende revidierte Monographie ist für die Aufnahme in das ÖAB (Österreichisches Arzneibuch) vorgesehen. Stellungnahmenf sind bis zum 15.September 2008 an folgende Adresse
!!! NEUE ÖAB-MONOGRAPHIE!!! Die folgende revidierte Monographie ist für die Aufnahme in das ÖAB (Österreichisches Arzneibuch) vorgesehen. Stellungnahmenf sind bis zum 15.September 2008 an folgende Adresse
Die Kleinen im Juni 2014 von Dr. Stavros Kromidas, Saarbrücken
 Die Kleinen im Juni 2014 von Dr. Stavros Kromidas, Saarbrücken Liebe HPLC-Anwenderinnen, liebe HPLC-Anwender, wie in jedem Jahr wollen wir uns in den Monaten Juni-August mit kleinen Tipps beschäftigen,
Die Kleinen im Juni 2014 von Dr. Stavros Kromidas, Saarbrücken Liebe HPLC-Anwenderinnen, liebe HPLC-Anwender, wie in jedem Jahr wollen wir uns in den Monaten Juni-August mit kleinen Tipps beschäftigen,
Application Bulletin
 Nr. 262/1 d Application Bulletin Von Interesse für: Allgemein analytische Laboratorien I L 1, 2, 3, 4, 5, 7, 8, 9, 11, 16 IC-Anionensäule Phenomenex Star Ion A300 (6.1005.100) für die Bestimmung von Anionen
Nr. 262/1 d Application Bulletin Von Interesse für: Allgemein analytische Laboratorien I L 1, 2, 3, 4, 5, 7, 8, 9, 11, 16 IC-Anionensäule Phenomenex Star Ion A300 (6.1005.100) für die Bestimmung von Anionen
Analytische Chemie (für Biol. / Pharm. Wiss.)
 Analytische Chemie (für Biol. / Pharm. Wiss.) Teil: Trenntechniken (Chromatographie, Elektrophorese) Dr. Martin Pabst HCI D323 Martin.pabst@org.chem.ethz.ch http://www.analytik.ethz.ch/ Zusammenfassung
Analytische Chemie (für Biol. / Pharm. Wiss.) Teil: Trenntechniken (Chromatographie, Elektrophorese) Dr. Martin Pabst HCI D323 Martin.pabst@org.chem.ethz.ch http://www.analytik.ethz.ch/ Zusammenfassung
Welcher Indikator ist für die Titration von Essigsäure (pks =4.76) mit Natronlauge am besten geeignet?
 1. Aufgaben zu Versuchstag 1: Säure-Base-Titration Aufgabe 1.1 Welche der folgenden Aussagen ist falsch? A) Säuren erhöhen durch Abgabe eines Protons an Wasser die H3O + -Konzentration einer Lösung. B)
1. Aufgaben zu Versuchstag 1: Säure-Base-Titration Aufgabe 1.1 Welche der folgenden Aussagen ist falsch? A) Säuren erhöhen durch Abgabe eines Protons an Wasser die H3O + -Konzentration einer Lösung. B)
Aufgabe 1.1 Welche der folgenden Aussagen in Bezug auf nachfolgende Reaktionsgleichung ist falsch? HCl + NH3 NH4 + + Cl -
 1. Aufgaben zu Versuchstag 1: Säure-Base-Titration Aufgabe 1.1 Welche der folgenden Aussagen in Bezug auf nachfolgende Reaktionsgleichung ist falsch? HCl + NH3 NH4 + + Cl - A) Salzsäure ist eine stärkere
1. Aufgaben zu Versuchstag 1: Säure-Base-Titration Aufgabe 1.1 Welche der folgenden Aussagen in Bezug auf nachfolgende Reaktionsgleichung ist falsch? HCl + NH3 NH4 + + Cl - A) Salzsäure ist eine stärkere
Analytische Chemie (für Biol. / Pharm. Wiss.)
 Analytische Chemie (für Biol. / Pharm. Wiss.) Teil: Trenntechniken (Chromatographie, Elektrophorese) Dr. Thomas Schmid HCI D323 schmid@org.chem.ethz.ch http://www.analytik.ethz.ch/ Elektrophorese 2 Elektrophorese
Analytische Chemie (für Biol. / Pharm. Wiss.) Teil: Trenntechniken (Chromatographie, Elektrophorese) Dr. Thomas Schmid HCI D323 schmid@org.chem.ethz.ch http://www.analytik.ethz.ch/ Elektrophorese 2 Elektrophorese
LMPG 2, ÜB21, Molekülbau & UV/VIS-Absorption LÖSUNG 1 von 11
 LMPG 2, ÜB21, Molekülbau & UV/VISAbsorption LÖSUG 1 von 11 Übung 1: Charakterisierung von Absorptionsbanden Veränderungen der Molekülstruktur können zu Verschiebungen der einzelnen Absorptionsbanden im
LMPG 2, ÜB21, Molekülbau & UV/VISAbsorption LÖSUG 1 von 11 Übung 1: Charakterisierung von Absorptionsbanden Veränderungen der Molekülstruktur können zu Verschiebungen der einzelnen Absorptionsbanden im
Übungsaufgaben zur NMR-Spektrometrie
 Übungsaufgaben NMR 33 Übungsaufgaben zur NMR-Spektrometrie Aufgabe 1 a) Wieviele unterschiedliche Orientierungen des Kernmomentes relativ zu einem externen Magnetfeld sind beim 14 N-Kern (I = 1, γ = 1.932
Übungsaufgaben NMR 33 Übungsaufgaben zur NMR-Spektrometrie Aufgabe 1 a) Wieviele unterschiedliche Orientierungen des Kernmomentes relativ zu einem externen Magnetfeld sind beim 14 N-Kern (I = 1, γ = 1.932
Massenspektrometrie (MS)
 Massenspektrometrie (MS) Die Massenspektrometrie ist unter den heute routinemäßig verwendeten Methoden die jüngste, denn ihre Anwendung begann erst um 1960. Seit den Arbeiten von BIEMANN über Fragmentierungsmuster
Massenspektrometrie (MS) Die Massenspektrometrie ist unter den heute routinemäßig verwendeten Methoden die jüngste, denn ihre Anwendung begann erst um 1960. Seit den Arbeiten von BIEMANN über Fragmentierungsmuster
Übungsaufgaben zur HPLC für Biolaboranten
 Übungsaufgaben zur HPLC für Biolaboranten 1.1 Trennung von Paracetamol und HPLC Im LTC-Praktikum wurde in einer Kalibrierlösung Paracetamol und Coffein über eine HPLC getrennt. Bedingungen: β(cof) = 12,5
Übungsaufgaben zur HPLC für Biolaboranten 1.1 Trennung von Paracetamol und HPLC Im LTC-Praktikum wurde in einer Kalibrierlösung Paracetamol und Coffein über eine HPLC getrennt. Bedingungen: β(cof) = 12,5
Standortbestimmung / Äquivalenzprüfung. Chemie. Mittwoch, 13. April 2016, Uhr
 Seite 1 von 7 Standortbestimmung / Äquivalenzprüfung Chemie Mittwoch, 13. April 2016, 16.45-18.15 Uhr Dauer der Prüfung: 90 Minuten Erlaubte Hilfsmittel: Eine gedruckte und/oder eine persönlich erstellte
Seite 1 von 7 Standortbestimmung / Äquivalenzprüfung Chemie Mittwoch, 13. April 2016, 16.45-18.15 Uhr Dauer der Prüfung: 90 Minuten Erlaubte Hilfsmittel: Eine gedruckte und/oder eine persönlich erstellte
