Atommodell. Atommodell. Atommodell. Atommodell. Magnetquantenzahl: m l Orientierung von l im Magnetfeld. Spinquantenzahl: s = S
|
|
|
- Damian Frank
- vor 7 Jahren
- Abrufe
Transkript
1 π µ e E = Z n R = n Bor-Sommerfeld:. Postulat: Bandreimpuls des e - at diskrete Werte U = n n = Hauptquantenal: n =,,, π = Planck sces Wirkungsquantum µ = red. Masse des e - U = Umlaufban n a R = Rdberg-Konstante 0 r = = n Z = Ordnungsal Z π µ e Z e = Elektronladung. Postulat: nur diskrete Energieübergänge möglic E = ν. Postulat: stralungsfreier Umlauf auf Kreisban n m e v r = Hauptquantenal n: K, L, M, N π v ~ 0 6 m/s r = Radius n = Hauptquantenal Folie Folie De Broglie: Wellenmecanisces Modell U = n λ U = Umlaufban λ = De Broglie-Wellenlänge p = Impuls Steende Welle (armoniscer Osillator) mit gleicer Pase am Ende/Anfang der Umlaufban λe = p Å = 0-8 cm R ~ Å = 0-0 m ~ 0 nm = 0 nm Nebenquantenal: l l = n (Orbitalquantenal Bandreimpuls) Betrag: l( l + ) π l = 0 bis n- i L = 0 für gesättigte Scalen = = n l i L =,,, für ungesättigte Scalen i= L = Gesamtdreimpuls L Folie Folie
2 Terme: S P D F l = 0 (Anal Knotenebenen) Orbitalbe.: s p d f Betrag: π π π s: Magnetquantenal: m l Orientierung von l im Magnetfeld m l = + m l = 0 m l = - m l = + l, l (l - ), - l l 0 Orbitalbe. s p d m l p: Anal 5 Orientierungen p p p Folie 5 Folie 6 Spinquantenal: s (Eigendreimpuls Eigenrotation e - ) s = ± ½ kleines magn. Moment vektorielle Größe Betrag: µ s = s(s + ) π mit s = ± ½ s i = S Gesamtspinquantenal s = ± ½ bei gesättigten Scalen: S = 0 bei ungesättigten Scalen: gerade e - -Zal: ungerade e - -Zal: S = 0,,, S = ½, 5, Hauptquantenal n: n =,, K, L, M, N Nebenquantenal l: l = n- l = 0,,, (Anal Knotenebenen) Be. s p d f Magnetquantenal m l : m l = +l, l-,. 0. (l-), - l Spinquantenal s: s = ± ½ Wellenmecanisce Bescreibung: Scroedinger - Gleicung Lösung mit Quantenalen, jeweils um mindestens verscieden. Folie 7 Folie 8
3 Spin-Ban-Koppelung WW wiscen Bandreimpuls und Spindreimpuls µ l + µ s = j oder j = l ± s = l ± ½ Einelmomente Betrag: m j = j( j + ) π l l oder: µ s s J = L + S kleine Kerne (Russel Saunders Koppelung) J = Σj i große Kerne j i = l i + s i J = Σj i Energie der Spin Ban WW pro Z. µ l µ s parallele Einstellung s µ l antiparallele Einstellung Folie 9 Folie 0 Multipliität : Gesamtspinquantenal M = S + S : geradee - -Zal: 0,,, : ungerade e - 5 -Zal: ½,, M = Anal der möglicen Energieniveaus M = Singulett n e - geradalig: Singulett Duplett Triplett Triplett Quintett usw. Quadruplett 5 Quintett n e - ungeradalig: Duplett 6 Setett Quartett 7 Septett Setett usw. 8 Oktett... Anal e - 5 WW S / / 0 / / / / 0 5 / / / M 5 6 Beeicnung Duplett Triplett Singulett Quadruplett Duplett Quintett Triplett Singulett Setett Quadruplett Duplett Folie Folie
4 Beispiel Bor: s s p volle Orbitale s und s Gesamtdreimpuls Rumpf = 0 p s = ½ S = (n-) / = ½ M = ½ + = Duplett - Term Singulett: S = ½ M = alle e - sind gepaart <wiscen Vektoren 80 Projektion des Gesamtspins S auf die -Acse : 0 Folie Folie Triplett: S = M = M S S = S = - ½ S S e - Übergänge: E = ν ) S bleibt konstant: Impulseraltungssat S = 0 J (Gesamtdreimpuls) muss sic ändern J = ± S = S = + ½ l, m l ± l ± Dipolstralung l ± Quadrupolstralung Fall a: Fall b: Fall c: α α = 7 +½ α -½ α -½ Projektion in ½ -Acse: 0 M S = + ½ ½ -½ M S = - M S = Spin-Multipliität M S = 0 Folie 5 Folie 6
5 ) Übergangswarsceinlickeiten: E t = (Heisenberg sce Unscärferelation) S = 0 L = 0, ± mit l ± J = 0, ± (J = L + S) keine Änderung der Spinorientierung beim Übergang vom Grund- in den angeregten Zustand S S* erlaubte Übergänge T T* S T* verbotene Übergänge T S* usw. Fluoresen / Posporesen -atomiges Molekül armoniscer Osillator E S 0 S * Anregung E = ν stralungslose Desaktivierung (Pononen) bis e - im niedrigsten Niveau von S* (Termalisierung) ν (oder stralungslos) Ionisationsgrene Lictquant: s = r 0 r r 0 : Grundustand r r > r 0, da Bindung im angeregten Zustand gescwäct Folie 7 Folie 8 ν S 0 S * (τ = 0 5 s) S * S * im tiefsten E-Niveau (τ = s) Termalisierung Fluoresen: S * S 0 (τ ~ 0 8 s) i. d. R. ν abgegeben < ν aufgenommen (Rotversciebung / Stokes -Regel) Fluoresen: geringe WW wiscen Kristallfeld und S * Pononenproesse ur stralungslosen Desaktivierung: oe WW wiscen Kristallfeld und S * Posporesen. Voraussetung: intersstem crossing stralungsloser Übergang in andere Multipliität (Auswalregeln!);. B. S* T*; S * und T * gleice E; Auslöser: untersciedlice Spin-Ban-Koppelungen in S* und T*; magnet. Momente stark in T*; scwac in S*. Voraussetung langsamer Übergang S * S 0 (oe WW Kristallfeld und S *) Konkurrenreaktion u T * S 0 (verboten!) Folie 9 Folie 0
6 E Ionisationsgrene S 0 S * ISC - E=0 T * termisce, stralungslose Desaktivierung (Termalisierung) ν ν ν < ν S 0 r 0 r r Bandenverbreiterungen durc Übergänge aus versciedenen Energieniveaus von S 0 und in S 0 (Anti - Stoke!) r Folie
Eine kurze Wiederholung aus PC-II
 Eine kurze Wiederholung aus PC-II Caroline Röhr Vorlesung Anorganische Pigmente, WS 25/26 Einelektronen-Fall: Quantenzahlen (QZ) Drehimpuls (QZ: d) Quantelung Bahn- Eigen- esamt- Betrag Richtung l = l(l
Eine kurze Wiederholung aus PC-II Caroline Röhr Vorlesung Anorganische Pigmente, WS 25/26 Einelektronen-Fall: Quantenzahlen (QZ) Drehimpuls (QZ: d) Quantelung Bahn- Eigen- esamt- Betrag Richtung l = l(l
Kernmagnetismus und Magnetfelder
 Kernmagnetismus und Magnetfelder. Kernspin Die meisten Kerne besitzen einen Eigendrehimpuls oder P ist gequantelt P = h I(I + ) h = h und h: das Plancksche Wirkungsquantum. π I: Kernspinquantenzahl (kurz:
Kernmagnetismus und Magnetfelder. Kernspin Die meisten Kerne besitzen einen Eigendrehimpuls oder P ist gequantelt P = h I(I + ) h = h und h: das Plancksche Wirkungsquantum. π I: Kernspinquantenzahl (kurz:
Übungsblatt 03. PHYS4100 Grundkurs IV (Physik, Wirtschaftsphysik, Physik Lehramt) Othmar Marti,
 Übungsblatt 03 PHYS4100 Grkurs IV (Pysik, Wirtscaftspysik, Pysik Leramt Otmar Marti, (otmar.marti@pysik.uni-ulm.de 28. 4. 2005 oder 29. 4. 2005 1 Aufgaben 1. Nemen Sie an, dass eine Kugel mit dem Radius
Übungsblatt 03 PHYS4100 Grkurs IV (Pysik, Wirtscaftspysik, Pysik Leramt Otmar Marti, (otmar.marti@pysik.uni-ulm.de 28. 4. 2005 oder 29. 4. 2005 1 Aufgaben 1. Nemen Sie an, dass eine Kugel mit dem Radius
6. Viel-Elektronen Atome
 6. Viel-Elektronen 6.1 Periodensystem der Elemente 6.2 Schwerere 6.3 L S und j j Kopplung 6.1 6.1 Periodensystem der Elemente 6.2 Auffüllen der Elektronen-Orbitale Pauliprinzip: je 1 Elektron je Zustand
6. Viel-Elektronen 6.1 Periodensystem der Elemente 6.2 Schwerere 6.3 L S und j j Kopplung 6.1 6.1 Periodensystem der Elemente 6.2 Auffüllen der Elektronen-Orbitale Pauliprinzip: je 1 Elektron je Zustand
9. Moleküle. 9.1 Wasserstoff-Molekül Ion H Wasserstoff-Molekül H Schwerere Moleküle 9.4 Angeregte Moleküle. Physik IV SS
 9.1 Wasserstoff-Molekül Ion H + 9. Wasserstoff-Molekül H 9.3 Schwerere Moleküle 9.4 Angeregte Moleküle 9.1 9.1 Wasserstoff-Molekül Ion H + Einfachstes Molekül: H + = p + e p + Coulomb-Potenzial: Schrödinger-Gleichung:
9.1 Wasserstoff-Molekül Ion H + 9. Wasserstoff-Molekül H 9.3 Schwerere Moleküle 9.4 Angeregte Moleküle 9.1 9.1 Wasserstoff-Molekül Ion H + Einfachstes Molekül: H + = p + e p + Coulomb-Potenzial: Schrödinger-Gleichung:
Lösung zur Klausur
 ösung zur Klausur 1..01 Aufgabe 1.) a) Hundsche Regeln: maximaler Spin, dann maximales Bahnmoment. Die beiden Elektronen im 4s kann man vernachlässigen, da sie weder Spin- noch Bahmoment beitragen. Damit
ösung zur Klausur 1..01 Aufgabe 1.) a) Hundsche Regeln: maximaler Spin, dann maximales Bahnmoment. Die beiden Elektronen im 4s kann man vernachlässigen, da sie weder Spin- noch Bahmoment beitragen. Damit
22. Wärmestrahlung. rmestrahlung, Quantenmechanik
 22. Wärmestrahlung rmestrahlung, Quantenmechanik Plancksches Strahlungsgesetz: Planck (1904): der Austausch von Energie zwischen dem strahlenden System und dem Strahlungsfeld kann nur in Einheiten von
22. Wärmestrahlung rmestrahlung, Quantenmechanik Plancksches Strahlungsgesetz: Planck (1904): der Austausch von Energie zwischen dem strahlenden System und dem Strahlungsfeld kann nur in Einheiten von
1. Schulaufgabe aus der Physik Lösungshinweise
 . Sculaufgabe 3p Sculjar 2009/200. Sculaufgabe aus der Pysik Lösungsinweise Gruppe A (a) Beim Ruterford-Versuc wird eine ser dünne Goldfolie mit positiv geladenen α-teilcen eines radioaktiven Präparats
. Sculaufgabe 3p Sculjar 2009/200. Sculaufgabe aus der Pysik Lösungsinweise Gruppe A (a) Beim Ruterford-Versuc wird eine ser dünne Goldfolie mit positiv geladenen α-teilcen eines radioaktiven Präparats
Dia- und Paramagnetismus. Brandner Hannes Schlatter Nicola
 Dia- und Paramagnetismus Brandner Hannes Schlatter Nicola Ursachen des magnetischen Moments eines freien Atoms Spin der Elektronen (paramagn.) Deren Bahndrehimpuls bezüglich ihrer Bewegung um den Kern
Dia- und Paramagnetismus Brandner Hannes Schlatter Nicola Ursachen des magnetischen Moments eines freien Atoms Spin der Elektronen (paramagn.) Deren Bahndrehimpuls bezüglich ihrer Bewegung um den Kern
Wiederholung der letzten Vorlesungsstunde:
 Wiederholung der letzten Vorlesungsstunde: Das Bohr sche Atommodell: Strahlenabsorption, -emission, Elektromagentische Strahlung, Wellen, Wellenlänge, Frequenz, Wellenzahl. Postulate: * Elektronen bewegen
Wiederholung der letzten Vorlesungsstunde: Das Bohr sche Atommodell: Strahlenabsorption, -emission, Elektromagentische Strahlung, Wellen, Wellenlänge, Frequenz, Wellenzahl. Postulate: * Elektronen bewegen
( ), und legen deshalb eine Ebene fest. Als Aufpunkt dient ein beliebiger Punkt von g oder h, als Spannvektoren
 Lösungen zur analytiscen Geometrie, Buc S. 9f. a) E in die Parameterform umwandeln: x = x + x + Wäle: x = ; x = x = + E : X = x x x = + + = + In F einsetzen: + + = + = = In E einsetzen: s: X = + + ( )
Lösungen zur analytiscen Geometrie, Buc S. 9f. a) E in die Parameterform umwandeln: x = x + x + Wäle: x = ; x = x = + E : X = x x x = + + = + In F einsetzen: + + = + = = In E einsetzen: s: X = + + ( )
Atommodell. Atommodell nach Bohr und Sommerfeld Für sein neues Atommodell stellte Bohr folgende Postulate auf:
 Für sein neues Atommodell stellte Bohr folgende Postulate auf: Elektronen umkreisen den Kern auf bestimmten Bahnen, wobei keine Energieabgabe erfolgt. Jede Elektronenbahn entspricht einem bestimmten Energieniveau
Für sein neues Atommodell stellte Bohr folgende Postulate auf: Elektronen umkreisen den Kern auf bestimmten Bahnen, wobei keine Energieabgabe erfolgt. Jede Elektronenbahn entspricht einem bestimmten Energieniveau
Atommodell führte Rutherford den nach ihm benannten Streuversuch durch. Dabei bestrahlte er eine dünne Goldfolie mit α Teilchen.
 Atommodell nach Rutherford 1911 führte Rutherford den nach ihm benannten Streuversuch durch. Dabei bestrahlte er eine dünne Goldfolie mit α Teilchen. Beobachtung: Fast alle Teilchen fliegen ungestört durch.
Atommodell nach Rutherford 1911 führte Rutherford den nach ihm benannten Streuversuch durch. Dabei bestrahlte er eine dünne Goldfolie mit α Teilchen. Beobachtung: Fast alle Teilchen fliegen ungestört durch.
Betrag des Drehimpulses
 Voresung Spektroskopie Sommersemester 001 Prof. Dr. W. Knoche 5. Rotations- und Schwingungsspektren 5.1. Rotationsspektren Freie Rotation eines starren Moeküs um drei Achsen: x y J = J + J + J z J J =
Voresung Spektroskopie Sommersemester 001 Prof. Dr. W. Knoche 5. Rotations- und Schwingungsspektren 5.1. Rotationsspektren Freie Rotation eines starren Moeküs um drei Achsen: x y J = J + J + J z J J =
27. Wärmestrahlung, Quantenmechanik (Abschluß: Welle-Teilchen-Dualismus
 26. Vorlesung EP V. STRAHLUNG, ATOME, KERNE 27. Wärmestrahlung, Quantenmechanik (Abschluß: Welle-Teilchen-Dualismus 28. Atomphysik, Röntgenstrahlung, Bohrsches Atommodell Versuche: Elektronenbeugung Linienspektrum
26. Vorlesung EP V. STRAHLUNG, ATOME, KERNE 27. Wärmestrahlung, Quantenmechanik (Abschluß: Welle-Teilchen-Dualismus 28. Atomphysik, Röntgenstrahlung, Bohrsches Atommodell Versuche: Elektronenbeugung Linienspektrum
Mößbauer-Spektroskopie Vortrag zum apparativen Praktikum SS 05. Hella Berlemann Nora Obermann
 Mößbauer-Spektroskopie Vortrag zum apparativen Praktikum SS 05 Hella Berlemann Nora Obermann Übersicht: Mößbauer (1958): rückstoßfreie Kernresonanzabsorption von γ-strahlen γ-strahlung: kurzwellige, hochenergetische,
Mößbauer-Spektroskopie Vortrag zum apparativen Praktikum SS 05 Hella Berlemann Nora Obermann Übersicht: Mößbauer (1958): rückstoßfreie Kernresonanzabsorption von γ-strahlen γ-strahlung: kurzwellige, hochenergetische,
Übungsaufgaben zur NMR-Spektrometrie
 Übungsaufgaben NMR 33 Übungsaufgaben zur NMR-Spektrometrie Aufgabe 1 a) Wieviele unterschiedliche Orientierungen des Kernmomentes relativ zu einem externen Magnetfeld sind beim 14 N-Kern (I = 1, γ = 1.932
Übungsaufgaben NMR 33 Übungsaufgaben zur NMR-Spektrometrie Aufgabe 1 a) Wieviele unterschiedliche Orientierungen des Kernmomentes relativ zu einem externen Magnetfeld sind beim 14 N-Kern (I = 1, γ = 1.932
Vorlesung 9: Roter Faden: Wiederholung Quantisierung der Energien in QM. Franck-Hertz Versuch. Emissions- und Absorptionsspektren der Atome
 Vorlesung 9: Roter Faden: Wiederholung Quantisierung der Energien in QM Franck-Hertz Versuch Emissions- und Absorptionsspektren der Atome Spektren des Wasserstoffatoms Bohrsche Atommodell Folien auf dem
Vorlesung 9: Roter Faden: Wiederholung Quantisierung der Energien in QM Franck-Hertz Versuch Emissions- und Absorptionsspektren der Atome Spektren des Wasserstoffatoms Bohrsche Atommodell Folien auf dem
Vorlesung 20: Roter Faden: Auswahlregeln. Folien auf dem Web:
 Vorlesung 20: Roter Faden: Auswahlregeln Folien auf dem Web: http://www-ekp.physik.uni-karlsruhe.de/~deboer/ Siehe auch: http://www.uni-stuttgart.de/ipf/lehre/online-skript/ Wim de Boer, Karlsruhe Atome
Vorlesung 20: Roter Faden: Auswahlregeln Folien auf dem Web: http://www-ekp.physik.uni-karlsruhe.de/~deboer/ Siehe auch: http://www.uni-stuttgart.de/ipf/lehre/online-skript/ Wim de Boer, Karlsruhe Atome
Ferienkurs Theoretische Mechanik SS 2011
 Ferienkurs Teoretisce Mecanik SS Lösungen Freitag Aufgabe : Rotation eines Quaders um die Raumdiagonale Die Hauptacsen verlaufen durc den Scwerpunkt des Quaders parallel zu den Kanten. Die Kante der Länge
Ferienkurs Teoretisce Mecanik SS Lösungen Freitag Aufgabe : Rotation eines Quaders um die Raumdiagonale Die Hauptacsen verlaufen durc den Scwerpunkt des Quaders parallel zu den Kanten. Die Kante der Länge
Dr. Jan Friedrich Nr
 Übungen zu Experimentalphysik 4 - Lösungsvorschläge Prof. S. Paul Sommersemester 2005 Dr. Jan Friedrich Nr. 7 06.06.2005 Email Jan.Friedrich@ph.tum.de Telefon 089/289-2586 Physik Department E8, Raum 3564
Übungen zu Experimentalphysik 4 - Lösungsvorschläge Prof. S. Paul Sommersemester 2005 Dr. Jan Friedrich Nr. 7 06.06.2005 Email Jan.Friedrich@ph.tum.de Telefon 089/289-2586 Physik Department E8, Raum 3564
Musterlösung 02/09/2014
 Musterlösung 0/09/014 1 Streuexperimente (a) Betrachten Sie die Streuung von punktförmigen Teilchen an einer harten Kugel vom Radius R. Bestimmen Sie die Ablenkfunktion θ(b) unter der Annahme, dass die
Musterlösung 0/09/014 1 Streuexperimente (a) Betrachten Sie die Streuung von punktförmigen Teilchen an einer harten Kugel vom Radius R. Bestimmen Sie die Ablenkfunktion θ(b) unter der Annahme, dass die
Übungen zur Vorlesung Physikalische Chemie 2 (B. Sc.) Lösungsvorschlag zu Blatt 12
 Übungen zur Vorlesung Physikalische Chemie B. Sc. ösungsvorschlag zu Blatt 1 Prof. Dr. Norbert Hampp Jens Träger Wintersemester 7/8. 1. 8 Aufgabe 1 Welche Schwingungsübergänge in einem elektronischen Spektrum
Übungen zur Vorlesung Physikalische Chemie B. Sc. ösungsvorschlag zu Blatt 1 Prof. Dr. Norbert Hampp Jens Träger Wintersemester 7/8. 1. 8 Aufgabe 1 Welche Schwingungsübergänge in einem elektronischen Spektrum
Aufbau von Atomen. Atommodelle Spektrum des Wasserstoffs Quantenzahlen Orbitalbesetzung Periodensystem
 Aufbau von Atomen Atommodelle Spektrum des Wasserstoffs Quantenzahlen Orbitalbesetzung Periodensystem Wiederholung Im Kern: Protonen + Neutronen In der Hülle: Elektronen Rutherfords Streuversuch (90) Goldatome
Aufbau von Atomen Atommodelle Spektrum des Wasserstoffs Quantenzahlen Orbitalbesetzung Periodensystem Wiederholung Im Kern: Protonen + Neutronen In der Hülle: Elektronen Rutherfords Streuversuch (90) Goldatome
Vorlesung Allgemeine Chemie (CH01)
 Vorlesung Allgemeine Chemie (CH01) Für Studierende im B.Sc.-Studiengang Chemie Prof. Dr. Martin Köckerling Arbeitsgruppe Anorganische Festkörperchemie Mathematisch-Naturwissenschaftliche Fakultät, Institut
Vorlesung Allgemeine Chemie (CH01) Für Studierende im B.Sc.-Studiengang Chemie Prof. Dr. Martin Köckerling Arbeitsgruppe Anorganische Festkörperchemie Mathematisch-Naturwissenschaftliche Fakultät, Institut
Thema heute: Aufbau der Materie: Das Bohr sche Atommodell
 Wiederholung der letzten Vorlesungsstunde: Erste Atommodelle, Dalton Thomson, Rutherford, Atombau, Coulomb-Gesetz, Proton, Elektron, Neutron, weitere Elementarteilchen, atomare Masseneinheit u, 118 bekannte
Wiederholung der letzten Vorlesungsstunde: Erste Atommodelle, Dalton Thomson, Rutherford, Atombau, Coulomb-Gesetz, Proton, Elektron, Neutron, weitere Elementarteilchen, atomare Masseneinheit u, 118 bekannte
Kerne und Teilchen. Kernkraft. Moderne Experimentalphysik III Vorlesung 16.
 Kerne und Teilchen Moderne Experimentalphysik III Vorlesung 16 MICHAEL FEINDT & THOMAS KUH INSTITUT FÜ EXPEIMENTELLE KENPHYSIK Kernkraft KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum
Kerne und Teilchen Moderne Experimentalphysik III Vorlesung 16 MICHAEL FEINDT & THOMAS KUH INSTITUT FÜ EXPEIMENTELLE KENPHYSIK Kernkraft KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum
Vorbemerkung. [disclaimer]
![Vorbemerkung. [disclaimer] Vorbemerkung. [disclaimer]](/thumbs/91/105086168.jpg) Vorbemerkung Dies ist ein abgegebener Übungszettel aus dem Modul physik4. Dieser Übungszettel wurde nicht korrigiert. Es handelt sich lediglich um meine Abgabe und keine Musterlösung. Alle Übungszettel
Vorbemerkung Dies ist ein abgegebener Übungszettel aus dem Modul physik4. Dieser Übungszettel wurde nicht korrigiert. Es handelt sich lediglich um meine Abgabe und keine Musterlösung. Alle Übungszettel
Grundkurs Physik: Abiturprüfung 1997 Aufgabe 3 Atomphysik
 Grundkurs Pysik: Abiturprüfung 1997 Aufgabe 3 Atompysik 1. Der gesamte sictbare Bereic (00 nm λ 750 nm) des elektromagnetiscen Spektrums soll auf einem Scirm dargestellt werden. a) Begründen Sie, warum
Grundkurs Pysik: Abiturprüfung 1997 Aufgabe 3 Atompysik 1. Der gesamte sictbare Bereic (00 nm λ 750 nm) des elektromagnetiscen Spektrums soll auf einem Scirm dargestellt werden. a) Begründen Sie, warum
Quantenzahlen. A B z. Einführung in die Struktur der Materie 67
 Quantenzahlen Wir haben uns bis jetzt nur mit dem Grundzustand des H + 2 Moleküls beschäftigt Wie sieht es aus mit angeregten Zuständen wie z.b. 2p Zuständen im H Atom? Bezeichnung der Molekülorbitale
Quantenzahlen Wir haben uns bis jetzt nur mit dem Grundzustand des H + 2 Moleküls beschäftigt Wie sieht es aus mit angeregten Zuständen wie z.b. 2p Zuständen im H Atom? Bezeichnung der Molekülorbitale
Thema heute: Das Bohr sche Atommodell
 Wiederholung der letzten Vorlesungsstunde: Radioaktive Zerfallsgeschwindigkeit, Altersbestimmungen, Ionisationszähler (Geiger-Müller-Zähler), Szintillationszähler, natürliche radioaktive Zerfallsreihen,
Wiederholung der letzten Vorlesungsstunde: Radioaktive Zerfallsgeschwindigkeit, Altersbestimmungen, Ionisationszähler (Geiger-Müller-Zähler), Szintillationszähler, natürliche radioaktive Zerfallsreihen,
Periodensystem, elektromagnetische Spektren, Atombau, Orbitale
 Periodensystem, elektromagnetische Spektren, Atombau, Orbitale Als Mendelejew sein Periodensystem aufstellte waren die Edelgase sowie einige andere Elemente noch nicht entdeck (gelb unterlegt). Trotzdem
Periodensystem, elektromagnetische Spektren, Atombau, Orbitale Als Mendelejew sein Periodensystem aufstellte waren die Edelgase sowie einige andere Elemente noch nicht entdeck (gelb unterlegt). Trotzdem
Wiederholung der letzten Vorlesungsstunde:
 Wiederholung der letzten Vorlesungsstunde: Das (wellen-) quantenchemische Atommodell Orbitalmodell Beschreibung atomarer Teilchen (Elektronen) durch Wellenfunktionen, Wellen, Wellenlänge, Frequenz, Amplitude,
Wiederholung der letzten Vorlesungsstunde: Das (wellen-) quantenchemische Atommodell Orbitalmodell Beschreibung atomarer Teilchen (Elektronen) durch Wellenfunktionen, Wellen, Wellenlänge, Frequenz, Amplitude,
Abschlussprüfung an Fachoberschulen in Bayern NACHTERMIN Mathematik 2015 Geometrie Ausbildungsrichtung Technik
 MK.. B5_T_NB_MK_Loes.xmcd Absclussprüfung an Facobersculen in Bayern NACHTERMIN Matematik 5 Geometrie Ausbildungsrictung Tecnik BE. Ein an den Seiten offener Pavillon aus Holz at die Form eines Quaders,
MK.. B5_T_NB_MK_Loes.xmcd Absclussprüfung an Facobersculen in Bayern NACHTERMIN Matematik 5 Geometrie Ausbildungsrictung Tecnik BE. Ein an den Seiten offener Pavillon aus Holz at die Form eines Quaders,
Ferienkurs Experimentalphysik 4
 Ferienkurs Experimentalphysik 4 Probeklausur Markus Perner, Markus Kotulla, Jonas Funke Aufgabe 1 (Allgemeine Fragen). : (a) Welche Relation muss ein Operator erfüllen damit die dazugehörige Observable
Ferienkurs Experimentalphysik 4 Probeklausur Markus Perner, Markus Kotulla, Jonas Funke Aufgabe 1 (Allgemeine Fragen). : (a) Welche Relation muss ein Operator erfüllen damit die dazugehörige Observable
Streuungen ( ) 1. Raman-Streuung
 Streuungen. Raman-Streuung unelastisce Streuung von Potonen an Molekülen Die Streuung entstet dabei durc Polarisation der Atome im Stralungsfeld und Abstralung als Dipolstralung. Für den Frequenzbereic
Streuungen. Raman-Streuung unelastisce Streuung von Potonen an Molekülen Die Streuung entstet dabei durc Polarisation der Atome im Stralungsfeld und Abstralung als Dipolstralung. Für den Frequenzbereic
ESR vs. NMR NMR ESR. ESR - Messung. Kernmagneton. 2cm P. m p 1800 µ e = 1800 m p. m e. (Bohr Magneton)
 M-Spektroskopie M ES vs. M M-Spektren von paramagnetischen Verbindungen? M µ e ist 0 3 mal grösser als das Kernmoment µ hν 0 = γ hb 0 µ = e h cm P Kernmagneton longitudinale elaxation wird zu stark (T
M-Spektroskopie M ES vs. M M-Spektren von paramagnetischen Verbindungen? M µ e ist 0 3 mal grösser als das Kernmoment µ hν 0 = γ hb 0 µ = e h cm P Kernmagneton longitudinale elaxation wird zu stark (T
Die Erwartungswerte von Operatoren sind gegeben durch. (x, t)a (x, t) =h A i
 Die Wahrscheinlichkeit, das System zu einem bestimmten Zeitpunkt in einem bestimmten Zustand anzutreffen, ist durch das Betragsquadrat der Wellenfunktion (x, t) 2 gegeben Die Erwartungswerte von Operatoren
Die Wahrscheinlichkeit, das System zu einem bestimmten Zeitpunkt in einem bestimmten Zustand anzutreffen, ist durch das Betragsquadrat der Wellenfunktion (x, t) 2 gegeben Die Erwartungswerte von Operatoren
Ferienkurs Experimentalphysik Lösung zur Übung 2
 Ferienkurs Experimentalphysik 4 01 Lösung zur Übung 1. Ermitteln Sie für l = 1 a) den Betrag des Drehimpulses L b) die möglichen Werte von m l c) Zeichnen Sie ein maßstabsgerechtes Vektordiagramm, aus
Ferienkurs Experimentalphysik 4 01 Lösung zur Übung 1. Ermitteln Sie für l = 1 a) den Betrag des Drehimpulses L b) die möglichen Werte von m l c) Zeichnen Sie ein maßstabsgerechtes Vektordiagramm, aus
κ Κα π Κ α α Κ Α
 κ Κα π Κ α α Κ Α Ζ Μ Κ κ Ε Φ π Α Γ Κ Μ Ν Ξ λ Γ Ξ Ν Μ Ν Ξ Ξ Τ κ ζ Ν Ν ψ Υ α α α Κ α π α ψ Κ α α α α α Α Κ Ε α α α α α α α Α α α α α η Ε α α α Ξ α α Γ Α Κ Κ Κ Ε λ Ε Ν Ε θ Ξ κ Ε Ν Κ Μ Ν Τ μ Υ Γ φ Ε Κ Τ θ
κ Κα π Κ α α Κ Α Ζ Μ Κ κ Ε Φ π Α Γ Κ Μ Ν Ξ λ Γ Ξ Ν Μ Ν Ξ Ξ Τ κ ζ Ν Ν ψ Υ α α α Κ α π α ψ Κ α α α α α Α Κ Ε α α α α α α α Α α α α α η Ε α α α Ξ α α Γ Α Κ Κ Κ Ε λ Ε Ν Ε θ Ξ κ Ε Ν Κ Μ Ν Τ μ Υ Γ φ Ε Κ Τ θ
III. Strukturbestimmung organischer Moleküle
 III. Strukturbestimmung organischer Moleküle Röntgenstrukturbestimmung g Spektroskopie UV-VIS IR NMR Massenspektrometrie (MS) Röntgenstruktur eines bakteriellen Kohlenhydrats O O O O O O O C3 Röntgenstruktur
III. Strukturbestimmung organischer Moleküle Röntgenstrukturbestimmung g Spektroskopie UV-VIS IR NMR Massenspektrometrie (MS) Röntgenstruktur eines bakteriellen Kohlenhydrats O O O O O O O C3 Röntgenstruktur
14. Atomphysik. Inhalt. 14. Atomphysik
 Inhalt 14.1 Aufbau der Materie 14.2 Der Atomaufbau 14.2.1 Die Hauptquantenzahl n 14.2.2 Die Nebenquantenzahl l 14.2.3 Die Magnetquantenzahl m l 14.2.4 Der Zeemann Effekt 14.2.5 Das Stern-Gerlach-Experiment
Inhalt 14.1 Aufbau der Materie 14.2 Der Atomaufbau 14.2.1 Die Hauptquantenzahl n 14.2.2 Die Nebenquantenzahl l 14.2.3 Die Magnetquantenzahl m l 14.2.4 Der Zeemann Effekt 14.2.5 Das Stern-Gerlach-Experiment
WALTER SCHOTTKY INSTITUT
 Lerstul für Halbleitertecnologie Lösung zur Zentralübung 3 Aufgabe 1: a Klassisce Betractung (i E 1 ev und V ev (ii E 4 ev und V ev > vollständige Reflexion R 1 > Transmission über die Stufe inweg, R Aber:
Lerstul für Halbleitertecnologie Lösung zur Zentralübung 3 Aufgabe 1: a Klassisce Betractung (i E 1 ev und V ev (ii E 4 ev und V ev > vollständige Reflexion R 1 > Transmission über die Stufe inweg, R Aber:
Strukturaufklärung (BSc-Chemie): Einführung
 Strukturaufklärung (BSc-Chemie): Einführung Prof. S. Grimme OC [TC] 13.10.2009 Prof. S. Grimme (OC [TC]) Strukturaufklärung (BSc-Chemie): Einführung 13.10.2009 1 / 25 Teil I Einführung Prof. S. Grimme
Strukturaufklärung (BSc-Chemie): Einführung Prof. S. Grimme OC [TC] 13.10.2009 Prof. S. Grimme (OC [TC]) Strukturaufklärung (BSc-Chemie): Einführung 13.10.2009 1 / 25 Teil I Einführung Prof. S. Grimme
umlaufendes Dichtband Dichtschlämme Randdämmstreifen 9 cm
 80 30 92 80 Radius 50 cm mit fest verbundenem, umlaufendes / / Viertelkreisform, 80 x 80 cm 104 90 35 90 Radius 55 cm mit fest verbundenem, umlaufendes / / Viertelkreisform, 90 x 90 cm 118 100 45 100 Radius
80 30 92 80 Radius 50 cm mit fest verbundenem, umlaufendes / / Viertelkreisform, 80 x 80 cm 104 90 35 90 Radius 55 cm mit fest verbundenem, umlaufendes / / Viertelkreisform, 90 x 90 cm 118 100 45 100 Radius
14. Atomphysik Physik für E-Techniker. 14. Atomphysik
 14. Atomphysik 14.1 Aufbau der Materie 14.2 Der Atomaufbau 14.2.1 Die Hauptquantenzahl n 14.2.2 Die Nebenquantenzahl l 14.2.3 Die Magnetquantenzahl m l 14.2.4 Der Zeemann Effekt 14.2.5 Das Stern-Gerlach-Experiment
14. Atomphysik 14.1 Aufbau der Materie 14.2 Der Atomaufbau 14.2.1 Die Hauptquantenzahl n 14.2.2 Die Nebenquantenzahl l 14.2.3 Die Magnetquantenzahl m l 14.2.4 Der Zeemann Effekt 14.2.5 Das Stern-Gerlach-Experiment
: Quantenmechanische Lösung H + 2. Molekülion und. Aufstellen der Schrödingergleichung für das H + 2
 H + 2 Die molekulare Bindung : Quantenmechanische Lösung Aufstellen der Schrödingergleichung für das H + 2 Molekülion und Lösung Wichtige Einschränkung: Die Kerne sind festgehalten H Ψ(r) = E Ψ(r) (11)
H + 2 Die molekulare Bindung : Quantenmechanische Lösung Aufstellen der Schrödingergleichung für das H + 2 Molekülion und Lösung Wichtige Einschränkung: Die Kerne sind festgehalten H Ψ(r) = E Ψ(r) (11)
FERIENKURS EXPERIMENTALPHYSIK 4
 FERIENKURS EXPERIMENTALPHYSIK 4 Musterlösung 3 - Mehrelektronensysteme Hannah Schamoni 1 Hundsche Regeln Ein Atom habe die Elektronenkonfiguration Ne3s 3p 6 3d 6 4s. Leite nach den Hundschen Regeln die
FERIENKURS EXPERIMENTALPHYSIK 4 Musterlösung 3 - Mehrelektronensysteme Hannah Schamoni 1 Hundsche Regeln Ein Atom habe die Elektronenkonfiguration Ne3s 3p 6 3d 6 4s. Leite nach den Hundschen Regeln die
Moleküle und Wärmestatistik
 Moleküle und Wärmestatistik Musterlösung.08.008 Molekülbindung Ein Molekül bestehe aus zwei Atomkernen A und B und zwei Elektronen. a) Wie lautet der Ansatz für die symmetrische Wellenfunktion in der Molekülorbitalnäherung?
Moleküle und Wärmestatistik Musterlösung.08.008 Molekülbindung Ein Molekül bestehe aus zwei Atomkernen A und B und zwei Elektronen. a) Wie lautet der Ansatz für die symmetrische Wellenfunktion in der Molekülorbitalnäherung?
Versuch Fluoreszenz-Quenching
 Versuch Fluoreszenz-Quenching Zielstellung: 1.) Aufnahme des UV-Vis-Spektrums eines Fluoreszenzfarbstoffes 2.) Aufnahme der Kennlinie des verwendeten Photon-Counting-Moduls (PCM) im Bereich von 1,9 2,9
Versuch Fluoreszenz-Quenching Zielstellung: 1.) Aufnahme des UV-Vis-Spektrums eines Fluoreszenzfarbstoffes 2.) Aufnahme der Kennlinie des verwendeten Photon-Counting-Moduls (PCM) im Bereich von 1,9 2,9
Merke: Zwei Oszillatoren koppeln am stärksten, wenn sie die gleiche Eigenfrequenz besitzen. RESONANZ
 Merke: Zwei Oszillatoren koppeln am stärksten, wenn sie die gleiche Eigenfrequenz besitzen. RESONANZ Viele Kerne besitzen einen Spindrehimpuls. Ein Kern mit der Spinquantenzahl I hat einen Drehimpuls (L)
Merke: Zwei Oszillatoren koppeln am stärksten, wenn sie die gleiche Eigenfrequenz besitzen. RESONANZ Viele Kerne besitzen einen Spindrehimpuls. Ein Kern mit der Spinquantenzahl I hat einen Drehimpuls (L)
Theoretical Biophysics - Quantum Theory and Molecular Dynamics. 9. Vorlesung. Pawel Romanczuk WS 2017/18
 Theoretical Biophysics - Quantum Theory and Molecular Dynamics 9. Vorlesung Pawel Romanczuk WS 2017/18 http://lab.romanczuk.de/teaching 1 Zusammenfassung letzte VL Wasserstoffatom Quantenmechanisches Zweikörperproblem
Theoretical Biophysics - Quantum Theory and Molecular Dynamics 9. Vorlesung Pawel Romanczuk WS 2017/18 http://lab.romanczuk.de/teaching 1 Zusammenfassung letzte VL Wasserstoffatom Quantenmechanisches Zweikörperproblem
Kerne und Teilchen. Aufbau der Kerne (1) Moderne Experimentalphysik III Vorlesung 17.
 Kerne und Teilchen Moderne Experimentalphysik III Vorlesung 17 MICHAEL FEINDT INSTITUT FÜR EXPERIMENTELLE KERNPHYSIK Aufbau der Kerne (1) KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum
Kerne und Teilchen Moderne Experimentalphysik III Vorlesung 17 MICHAEL FEINDT INSTITUT FÜR EXPERIMENTELLE KERNPHYSIK Aufbau der Kerne (1) KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum
Theoretical Biophysics - Quantum Theory and Molecular Dynamics. 13. Vorlesung. Pawel Romanczuk WS 2016/17
 Theoretical Biophysics - Quantum Theory and Molecular Dynamics 13. Vorlesung Pawel Romanczuk WS 2016/17 http://lab.romanczuk.de/teaching Zusammenfassung letzte VL Variationsrechnung LCAO-Verfahren am Beispiel
Theoretical Biophysics - Quantum Theory and Molecular Dynamics 13. Vorlesung Pawel Romanczuk WS 2016/17 http://lab.romanczuk.de/teaching Zusammenfassung letzte VL Variationsrechnung LCAO-Verfahren am Beispiel
Vorlesung 9: Roter Faden: Franck-Hertz Versuch. Emissions- und Absorptionsspektren der Atome. Spektren des Wasserstoffatoms. Bohrsche Atommodell
 Vorlesung 9: Roter Faden: Franck-Hertz Versuch Emissions- und Absorptionsspektren der Atome Spektren des Wasserstoffatoms Bohrsche Atommodell Folien auf dem Web: http://www-ekp.physik.uni-karlsruhe.de/~deboer/
Vorlesung 9: Roter Faden: Franck-Hertz Versuch Emissions- und Absorptionsspektren der Atome Spektren des Wasserstoffatoms Bohrsche Atommodell Folien auf dem Web: http://www-ekp.physik.uni-karlsruhe.de/~deboer/
Vorbemerkung. [disclaimer]
![Vorbemerkung. [disclaimer] Vorbemerkung. [disclaimer]](/thumbs/75/72955190.jpg) Vorbemerkung Dies ist ein korrigierter Übungszettel aus dem Modul physik4. Dieser Übungszettel wurde von einem Tutor korrigiert. Dies bedeutet jedoch nicht, dass es sich um eine Musterlösung handelt. Weder
Vorbemerkung Dies ist ein korrigierter Übungszettel aus dem Modul physik4. Dieser Übungszettel wurde von einem Tutor korrigiert. Dies bedeutet jedoch nicht, dass es sich um eine Musterlösung handelt. Weder
Für Geowissenschaftler. EP WS 2009/10 Dünnweber/Faessler
 Für Geowissenschaftler Termin Nachholklausur Vorschlag Mittwoch 14.4.10 25. Vorlesung EP V. STRAHLUNG, ATOME, KERNE 27. Wärmestrahlung und Quantenmechanik Photometrie Plancksches Strahlungsgesetze, Welle/Teilchen
Für Geowissenschaftler Termin Nachholklausur Vorschlag Mittwoch 14.4.10 25. Vorlesung EP V. STRAHLUNG, ATOME, KERNE 27. Wärmestrahlung und Quantenmechanik Photometrie Plancksches Strahlungsgesetze, Welle/Teilchen
Das Rutherfordsche Atommodelle
 Dieses Lernskript soll nochmals die einzelnen Atommodelle zusammenstellen und die Bedeutung der einzelnen Atommdelle veranschaulichen. Das Rutherfordsche Atommodelle Entstehung des Modells Rutherford beschoss
Dieses Lernskript soll nochmals die einzelnen Atommodelle zusammenstellen und die Bedeutung der einzelnen Atommdelle veranschaulichen. Das Rutherfordsche Atommodelle Entstehung des Modells Rutherford beschoss
Kernresonanzspektroskopie
 Gleich geht s los! Kernresonanzspektroskopie 1. Geschichtliche Entwicklung 2. Physikalische Grundlagen 3. Das NMR-Spektrometer 4. Anwendung der 1 H-NMR-Spektren zur Analyse der Konstitution von Molekülen
Gleich geht s los! Kernresonanzspektroskopie 1. Geschichtliche Entwicklung 2. Physikalische Grundlagen 3. Das NMR-Spektrometer 4. Anwendung der 1 H-NMR-Spektren zur Analyse der Konstitution von Molekülen
(a) Warum spielen die Welleneigenschaften bei einem fahrenden PKW (m = 1t, v = 100km/h) keine Rolle?
 FK Ex 4-07/09/2015 1 Quickies (a) Warum spielen die Welleneigenschaften bei einem fahrenden PKW (m = 1t, v = 100km/h) keine Rolle? (b) Wie groß ist die Energie von Lichtquanten mit einer Wellenlänge von
FK Ex 4-07/09/2015 1 Quickies (a) Warum spielen die Welleneigenschaften bei einem fahrenden PKW (m = 1t, v = 100km/h) keine Rolle? (b) Wie groß ist die Energie von Lichtquanten mit einer Wellenlänge von
Daltonsche Atomhypothese (1808)
 Daltonsche Atomhypothese (1808) Chemische Elemente bestehen aus kleinsten, chemisch nicht weiter zerlegbaren Teilchen, den Atomen. Alle Atome eines Elementes haben untereinander gleiche Masse, während
Daltonsche Atomhypothese (1808) Chemische Elemente bestehen aus kleinsten, chemisch nicht weiter zerlegbaren Teilchen, den Atomen. Alle Atome eines Elementes haben untereinander gleiche Masse, während
Ferienkurs der TU München- - Experimentalphysik 4 Wasserstoffatom, Feinstruktur und Atome im Magnetfeld. Jonas J. Funke
 Ferienkurs der TU München- - Experimentalphysik 4 Wasserstoffatom, Feinstruktur und Atome im Magnetfeld Lösung Jonas J. Funke 0.08.00-0.09.00 Aufgabe (Drehimpulsaddition). : Gegeben seien zwei Drehimpulse
Ferienkurs der TU München- - Experimentalphysik 4 Wasserstoffatom, Feinstruktur und Atome im Magnetfeld Lösung Jonas J. Funke 0.08.00-0.09.00 Aufgabe (Drehimpulsaddition). : Gegeben seien zwei Drehimpulse
Kapitel 7: Elektronische Spektroskopie
 Kapitel 7: Elektronische Spektroskopie Übersicht: 7.1 Drehimpuls-Kopplungshierarchien in Molekülen: Hundsche Fälle 7.2 Auswahlregeln für rovibronische Übergänge 7.3 Das Franck-Condon-Prinzip 7.4 Zerfall
Kapitel 7: Elektronische Spektroskopie Übersicht: 7.1 Drehimpuls-Kopplungshierarchien in Molekülen: Hundsche Fälle 7.2 Auswahlregeln für rovibronische Übergänge 7.3 Das Franck-Condon-Prinzip 7.4 Zerfall
Von der kosmischen Hintergrundstrahlung zur Heisenbergschen Unbestimmtheitsrelation. eine Einführung in die Quantenmechanik
 Von der kosmischen Hintergrundstrahlung zur Heisenbergschen Unbestimmtheitsrelation eine Einführung in die Quantenmechanik 1) Die Hohlraumstrahlung: Geburt der Quantenmechanik Die kosmische Hintergrundstrahlung
Von der kosmischen Hintergrundstrahlung zur Heisenbergschen Unbestimmtheitsrelation eine Einführung in die Quantenmechanik 1) Die Hohlraumstrahlung: Geburt der Quantenmechanik Die kosmische Hintergrundstrahlung
FERIENKURS EXPERIMENTALPHYSIK 4. Mehrelektronensysteme
 FERIENKURS EXPERIMENTALPHYSIK 4 Vorlesung 3 am 04.09.2013 Mehrelektronensysteme Hannah Schamoni, Susanne Goerke Inhaltsverzeichnis 1 Das Helium-Atom 2 1.1 Grundlagen und Ortswellenfunktion........................
FERIENKURS EXPERIMENTALPHYSIK 4 Vorlesung 3 am 04.09.2013 Mehrelektronensysteme Hannah Schamoni, Susanne Goerke Inhaltsverzeichnis 1 Das Helium-Atom 2 1.1 Grundlagen und Ortswellenfunktion........................
14 B Steigung. 1 Miss bei den drei Keilen die Winkel und Strecken und übertrage sie in die Tabelle. Berechne die Steigung.
 Steigung 4 6 Arbeitseft+ Teste dic selbst Miss bei den drei Keilen die Winkel und Strecken und übertrage sie in die Tabelle. Berecne die Steigung. a a a Keil Keil 2 Keil 3 Keil Keil 2 Keil 3 Horizontale
Steigung 4 6 Arbeitseft+ Teste dic selbst Miss bei den drei Keilen die Winkel und Strecken und übertrage sie in die Tabelle. Berecne die Steigung. a a a Keil Keil 2 Keil 3 Keil Keil 2 Keil 3 Horizontale
1. Allgemeine Grundlagen Quantenmechanik
 1. Allgemeine Grundlagen 1.3. Quantenmechanik Klassische Mechanik vs Quantenmechanik Klassische (Newton sche) Mechanik klassischer harmonischer Oszillator Quantenmechanik quantenmechanischer harmonischer
1. Allgemeine Grundlagen 1.3. Quantenmechanik Klassische Mechanik vs Quantenmechanik Klassische (Newton sche) Mechanik klassischer harmonischer Oszillator Quantenmechanik quantenmechanischer harmonischer
Magnetresonanztomographie (MRT) * =
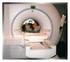 γ * γ π Beispiel: - Protonen ( H) Messung - konstantes B-Feld (T) in -Richtung - Gradientenfeld (3mT/m) in -Richtung - bei 0: f 00 4,6 MH Wie stark ist Frequenveränderung Df der Spins bei 0 mm? f (0mm)
γ * γ π Beispiel: - Protonen ( H) Messung - konstantes B-Feld (T) in -Richtung - Gradientenfeld (3mT/m) in -Richtung - bei 0: f 00 4,6 MH Wie stark ist Frequenveränderung Df der Spins bei 0 mm? f (0mm)
J(J + 1) + S(S + 1) L(L + 1) = g J m J µ B B 0 mit g J = 1 +. (A.2) 2J(J + 1) g J 2
 A. Atomdaten A.. Fein- und Hyperfeinstruktur im Magnetfeld A... Feinstruktur-Aufspaltung Aus der Spin-Bahn-Kopplung eines Zustandes ( J = L + S) ergibt sich die Zusatzenergie E LS = a {J (J + ) L(L + )
A. Atomdaten A.. Fein- und Hyperfeinstruktur im Magnetfeld A... Feinstruktur-Aufspaltung Aus der Spin-Bahn-Kopplung eines Zustandes ( J = L + S) ergibt sich die Zusatzenergie E LS = a {J (J + ) L(L + )
Bohrsches Atommodell / Linienspektren. Experimentalphysik für Biologen und Chemiker, O. Benson & A. Peters, Humboldt-Universität zu Berlin
 Bohrsches Atommodell / Linienspektren Quantenstruktur der Atome: Atomspektren Emissionslinienspektren von Wasserstoffatomen im sichtbaren Bereich Balmer Serie (1885): 1 / λ = K (1/4-1/n 2 ) 656.28 486.13
Bohrsches Atommodell / Linienspektren Quantenstruktur der Atome: Atomspektren Emissionslinienspektren von Wasserstoffatomen im sichtbaren Bereich Balmer Serie (1885): 1 / λ = K (1/4-1/n 2 ) 656.28 486.13
Eigenschaften des Photons
 Eigenschaften des Photons Das Photon ist das Energiequant der elektromagnetischen Wellen, d.h. Licht hat wie von Einstein postuliert nicht nur Wellencharakter, sondern auch Teilchencharakter mit den oben
Eigenschaften des Photons Das Photon ist das Energiequant der elektromagnetischen Wellen, d.h. Licht hat wie von Einstein postuliert nicht nur Wellencharakter, sondern auch Teilchencharakter mit den oben
Lösungen zu delta 6. Kann ich das noch? Lösungen zu den Seiten 6 und 7
 Kann ic das noc? Lösungen zu den Seiten 6 und 7. a) L = { ; } b) L = {0; } c) L = {} d) ( + )( + ) = 0; L = { ; } e) ( 6)( ) = 0; L = {; 6} f) L = {0}; 0,7 G g) ( 8)( + ) = 0; L = { ; 8} ) ( + )( + ) =
Kann ic das noc? Lösungen zu den Seiten 6 und 7. a) L = { ; } b) L = {0; } c) L = {} d) ( + )( + ) = 0; L = { ; } e) ( 6)( ) = 0; L = {; 6} f) L = {0}; 0,7 G g) ( 8)( + ) = 0; L = { ; 8} ) ( + )( + ) =
Analytische Methoden in Org. Chemie und optische Eigenschaften von chiralen Molekülen
 Analytische Methoden in Org. Chemie und optische Eigenschaften von chiralen Molekülen Seminar 5. 0. 200 Teil : NMR Spektroskopie. Einführung und Physikalische Grundlagen.2 H NMR Parameter: a) Chemische
Analytische Methoden in Org. Chemie und optische Eigenschaften von chiralen Molekülen Seminar 5. 0. 200 Teil : NMR Spektroskopie. Einführung und Physikalische Grundlagen.2 H NMR Parameter: a) Chemische
Übungen zur Atomphysik IV
 Ue AP 36 Übungen zur Atompysik IV Die Ursprünge der Quantenteorie Scwarzkörper-Stralung (Stefan-Boltzmann, Wien) 37 Übungen: scwarzer Straler 38 Lösungen: scwarzer Straler 39 Plancksces Stralungsgesetz
Ue AP 36 Übungen zur Atompysik IV Die Ursprünge der Quantenteorie Scwarzkörper-Stralung (Stefan-Boltzmann, Wien) 37 Übungen: scwarzer Straler 38 Lösungen: scwarzer Straler 39 Plancksces Stralungsgesetz
Physik IV Einführung in die Atomistik und die Struktur der Materie
 Physik IV Einführung in die Atomistik und die Struktur der Materie Sommersemester 2011 Vorlesung 20 29.06.2011 Physik IV - Einführung in die Atomistik Vorlesung 20 Prof. Thorsten Kröll 29.06.2011 1 Anmeldung
Physik IV Einführung in die Atomistik und die Struktur der Materie Sommersemester 2011 Vorlesung 20 29.06.2011 Physik IV - Einführung in die Atomistik Vorlesung 20 Prof. Thorsten Kröll 29.06.2011 1 Anmeldung
Elemente der Quantenmechanik III 9.1. Schrödingergleichung mit beliebigem Potential 9.2. Harmonischer Oszillator 9.3. Drehimpulsoperator
 VL 8 VL8. VL9. VL10. Das Wasserstoffatom in der klass. Mechanik 8.1. Emissions- und Absorptionsspektren der Atome 8.2. Quantelung der Energie (Frank-Hertz Versuch) 8.3. Bohrsches Atommodell 8.4. Spektren
VL 8 VL8. VL9. VL10. Das Wasserstoffatom in der klass. Mechanik 8.1. Emissions- und Absorptionsspektren der Atome 8.2. Quantelung der Energie (Frank-Hertz Versuch) 8.3. Bohrsches Atommodell 8.4. Spektren
6.10 Pauli-Verbot & Hundsche Regel Quantenmech. Ursprung
 6.0 Pauli-Verbot & Hundsche Regel Quantenmech. Ursprung 6.0. Nichtunterscheidbarkeit identischer Elementar-Teilchen Klassische Physik: Identische Teilchen lassen sich messtechnisch unterscheiden z.b. durch
6.0 Pauli-Verbot & Hundsche Regel Quantenmech. Ursprung 6.0. Nichtunterscheidbarkeit identischer Elementar-Teilchen Klassische Physik: Identische Teilchen lassen sich messtechnisch unterscheiden z.b. durch
Eigenschaften des Photons
 Eigenschaften des Photons Das Photon ist das Energiequant der elektromagnetischen Wellen, d.h. Licht hat wie von Einstein postuliert nicht nur Wellencharakter, sondern auch Teilchencharakter mit den oben
Eigenschaften des Photons Das Photon ist das Energiequant der elektromagnetischen Wellen, d.h. Licht hat wie von Einstein postuliert nicht nur Wellencharakter, sondern auch Teilchencharakter mit den oben
Grundlagen der Quantentheorie
 Grundlagen der Quantentheorie Ein Schwarzer Körper (Schwarzer Strahler, planckscher Strahler, idealer schwarzer Körper) ist eine idealisierte thermische Strahlungsquelle: Alle auftreffende elektromagnetische
Grundlagen der Quantentheorie Ein Schwarzer Körper (Schwarzer Strahler, planckscher Strahler, idealer schwarzer Körper) ist eine idealisierte thermische Strahlungsquelle: Alle auftreffende elektromagnetische
Notizen zur Kern-Teilchenphysik II (SS 2004): 2. Erhaltungsgrößen. Prof. Dr. R. Santo Dr. K. Reygers
 Notizen zur Kern-Teilchenphysik II (SS 4):. Erhaltungsgrößen Prof. Dr. R. Santo Dr. K. Reygers http://www.uni-muenster.de/physik/kp/lehre/kt-ss4/ Kern- Teilchenphysik II - SS 4 1 Parität (1) Paritätsoperator:
Notizen zur Kern-Teilchenphysik II (SS 4):. Erhaltungsgrößen Prof. Dr. R. Santo Dr. K. Reygers http://www.uni-muenster.de/physik/kp/lehre/kt-ss4/ Kern- Teilchenphysik II - SS 4 1 Parität (1) Paritätsoperator:
NMR Spektroskopie. 1nm Frequenz X-ray UV/VIS Infrared Microwave Radio
 NMR Spektroskopie 1nm 10 10 2 10 3 10 4 10 5 10 6 10 7 Frequenz X-ray UV/VIS Infrared Microwave Radio Anregungsmodus electronic Vibration Rotation Nuclear Spektroskopie X-ray UV/VIS Infrared/Raman NMR
NMR Spektroskopie 1nm 10 10 2 10 3 10 4 10 5 10 6 10 7 Frequenz X-ray UV/VIS Infrared Microwave Radio Anregungsmodus electronic Vibration Rotation Nuclear Spektroskopie X-ray UV/VIS Infrared/Raman NMR
11. Elektrodynamik Magnetische Kraft auf Stromleiter Quellen von Magnetfeldern. 11. Elektrodynamik. Physik für E-Techniker
 11. Elektrodynamik 11.5.2 Magnetische Kraft auf Stromleiter 11.5.3 Quellen von Magnetfeldern 11.5.2 Magnetische Kraft auf Stromleiter Wir hatten: Frage: Kraft auf einzelne Punktladung Kraft auf Stromleiter
11. Elektrodynamik 11.5.2 Magnetische Kraft auf Stromleiter 11.5.3 Quellen von Magnetfeldern 11.5.2 Magnetische Kraft auf Stromleiter Wir hatten: Frage: Kraft auf einzelne Punktladung Kraft auf Stromleiter
Wie wir wissen, besitzt jedes Elektron einen Bahndrehimpuls und einen Spin. bezeichnen die zugehörigen Einteilchenoperatoren mit. L i und S i (5.
 http://oobleck.chem.upenn.edu/ rappe/qm/qmmain.html finden Sie ein Programm, welches Ihnen gestattet, die Mehrelektronenverteilung für alle Elemente zu berechnen und graphisch darzustellen. Einen Hatree-Fock
http://oobleck.chem.upenn.edu/ rappe/qm/qmmain.html finden Sie ein Programm, welches Ihnen gestattet, die Mehrelektronenverteilung für alle Elemente zu berechnen und graphisch darzustellen. Einen Hatree-Fock
NMR Spektroskopie I = 0 : C, 16 O (sogenannte gg-kerne haben immer I=0!) I = 1/2: 1 H, 13 C, 15 N, 19 F, 31 P,... I = 1: 2. H=D, 6 Li, 14 N I = 3/2: 7
 NMR Spektroskopie folie00 Viele Atomkerne besitzen einen von Null verschiedenen Eigendrehimpuls (Spin) p=ħ I, der ganz oder halbzahlige Werte von ħ betragen kann. I bezeichnet die Kernspin-Quantenzahl.
NMR Spektroskopie folie00 Viele Atomkerne besitzen einen von Null verschiedenen Eigendrehimpuls (Spin) p=ħ I, der ganz oder halbzahlige Werte von ħ betragen kann. I bezeichnet die Kernspin-Quantenzahl.
Vorlesung 14: Roter Faden: Wiederholung Lamb-Shift. Hyperfeinstruktur. Folien auf dem Web:
 Vorlesung 14: Roter Faden: Wiederholung Lamb-Shift Anomaler Zeeman-Effekt Hyperfeinstruktur Folien auf dem Web: http://www-ekp.physik.uni-karlsruhe.de/~deboer/ h i k h / d / Siehe auch: http://www.uni-stuttgart.de/ipf/lehre/online-skript/
Vorlesung 14: Roter Faden: Wiederholung Lamb-Shift Anomaler Zeeman-Effekt Hyperfeinstruktur Folien auf dem Web: http://www-ekp.physik.uni-karlsruhe.de/~deboer/ h i k h / d / Siehe auch: http://www.uni-stuttgart.de/ipf/lehre/online-skript/
Tangentensteigung. Gegeben ist die Funktion f(x) = x 2.
 Tangentensteigung Gegeben ist die Funktion () =. Um die Steigung der Tangente im Punkt P( ) zu bestimmen, ermitteln wir zunäcst die Steigung der Sekante durc P( ) und Q( ). Q soll so beweglic sein, dass
Tangentensteigung Gegeben ist die Funktion () =. Um die Steigung der Tangente im Punkt P( ) zu bestimmen, ermitteln wir zunäcst die Steigung der Sekante durc P( ) und Q( ). Q soll so beweglic sein, dass
Schülerbuchseite 8 11
 Scülerbucseite 8 I Sclüsselkonzept: Ableitung Funktionen Seite 8 Die andere Person muss nict notwendig dieselbe Strecke gefaren sein, nur weil sie denselben Farpreis bezalt at. Es gibt versciedene Verbindungen,
Scülerbucseite 8 I Sclüsselkonzept: Ableitung Funktionen Seite 8 Die andere Person muss nict notwendig dieselbe Strecke gefaren sein, nur weil sie denselben Farpreis bezalt at. Es gibt versciedene Verbindungen,
NMR-Lösungsmittel. 1 H-NMR. Bei der Verwendung der normalen, nichtdeuterierten Lösungsmittel. Spektroskopie in der Organischen Chemie
 NMR-Lösungsmittel In der werden i.a. deuterierte Lösungsmittel verwendet. ie Substitution der leichten durch die schweren Wasserstoffatome hat zwei Vorteile: - euterium als Spin-1-Kern hat ebenfalls ein
NMR-Lösungsmittel In der werden i.a. deuterierte Lösungsmittel verwendet. ie Substitution der leichten durch die schweren Wasserstoffatome hat zwei Vorteile: - euterium als Spin-1-Kern hat ebenfalls ein
FK Ex 4 - Musterlösung 08/09/2015
 FK Ex 4 - Musterlösung 08/09/2015 1 Spektrallinien Die Natrium-D-Linien sind emittiertes Licht der Wellenlänge 589.5932 nm (D1) und 588.9965 nm (D2). Diese charakteristischen Spektrallinien entstehen beim
FK Ex 4 - Musterlösung 08/09/2015 1 Spektrallinien Die Natrium-D-Linien sind emittiertes Licht der Wellenlänge 589.5932 nm (D1) und 588.9965 nm (D2). Diese charakteristischen Spektrallinien entstehen beim
Kernphysik. Elemententstehung. 2. Kernphysik. Cora Fechner. Universität Potsdam SS 2014
 Elemententstehung 2. Cora Fechner Universität Potsdam SS 2014 alische Grundlagen Kernladungszahl: Z = Anzahl der Protonen Massenzahl: A = Anzahl der Protonen + Anzahl der Neutronen Bindungsenergie: B
Elemententstehung 2. Cora Fechner Universität Potsdam SS 2014 alische Grundlagen Kernladungszahl: Z = Anzahl der Protonen Massenzahl: A = Anzahl der Protonen + Anzahl der Neutronen Bindungsenergie: B




