3-01. Triphenylmethan
|
|
|
- Käte Brahms
- vor 7 Jahren
- Abrufe
Transkript
1 Triphenylmethan 3-01 Triphenylmethan ist ein farbloser Feststoff. Die Verbindung kann aus Benzol und Trichlormethan durch FRIEDL-CRAFTS-Alkylierung (elektrophile Substitution) hergestellt werden. Die H-Atome der drei Benzolringe behindern sich gegenseitig, daher sind die drei Ringe propellerartig gegeneinander verdreht.
2 Fuchsin 3-02 Fuchsin ist ein grüngelber glänzender Feststoff, der sich in Wasser langsam mit roter Farbe auflöst. Fuchsin wurde 1858 synthetisiert und nach der blauroten Zierpflanze Fuchsie benannt. Fuchsin gehört zu den Triphenylmethanfarbstoffen, ist aber gleichzeitig ein Cyanin. Daher die intensive Farbe der Lösung.
3 Malachitgrün 3-03 Malachitgrün ist ein grüner glänzender Feststoff, der sich in Wasser gut auflöst. Er wurde 1877 synthetisiert und nach dem grünen Mineral Malachit benannt. Malachitgrün hat zwei Absorptionsmaxima bei 420 nm und 620 nm. Die grüne Farbe des Farbstoffs ist also eine Mischfarbe.
4 Kristallviolett 3-04 Kristallviolett ist ein metallisch gold glänzender Feststoff, der sich in Wasser mit intensiv violetter Farbe auflöst. Bei Zugabe einer Säure wird die Lösung zunächst blau, dann grün, schließlich gelb. Ursache für den Farbwechsel sind die N-Atome. Sobald sie mit einem Proton besetzt sind, sind sie nicht mehr mesomeriefähig, daher wird ihr bathochromer Effekt aufgehoben (Lexikon der Chemie, 2008).
5 Fluorescein / Uranin 3-05 Fluorescein ist ein braunroter Feststoff, der sich in alkalischen Lösungen mit intensiv gelbgrüner Farbe auflöst, die im UV-Licht stark fluoresziert. Das wasserlösliche Natriumsalz des F. heißt Uranin. Das Färbevermögen von Uranin ist enorm: Mit 500 g Uranin können Schiffbrüchige 4000 m 2 Meer grün färben. Der Farbstoff wird zum Färben von Schaumbädern und Badezusätzen, Shampoos etc. verwendet. Da es biologisch unbedenklich ist, wird es in der Geologie als Tracer zum Verfolgen von Wasserströmen eingesetzt. Jedes Jahr am St. Patrick's Day wird der Chicago River mit 18 kg Uranin grün eingefärbt (Wikipedia).
6 Phenolphthalein 3-06
7 Phenolphthalein-Synthese a Schritt 1a: Phthalsäureanhydrid wird protoniert (Zugabe von konz. Schwefelsäure). 1b Schritt 1b: Umlagerung der positiven Ladung; Bildung eines Carbenium-Ions, das als Elektrophil auftreten kann.
8 Phenolphthalein-Synthese a 2b Schritt 2a: Elektrophile Substitution an einem Phenol-Molekül mit dem Carbenium-Ion als Elektrophil. Rückgewinnung des Protons aus Schritt 1a. Schritt 2b Protonierung der Carbonyl- Gruppe. 2c Schritt 2c Abspaltung von Wasser, Bildung eines neuen Carbenium- Ions, das wieder als Elektrophil wirken kann.
9 Phenolphthalein-Synthese Schritt 3: Elektrophile Substitution an einem Phenol-Molekül mit dem Carbenium-Ion als Elektrophil. Indikator-Wirkung: Zugabe von Natronlauge, Bildung des Natrium-Salzes.
10 Phenolphthalein als Indikator 3-10 bei ph = 6 Drei kleine Systeme mit konjugierten Doppelbindungen. Absorption von UV-Licht. sp 3 Zentrales C-Atom Durch sp 2 -Hybridisierung entsteht ein zusammenhängendes konjugiertes System. bei ph = 9 Ein großes System mit konjugierten Doppelbindungen. Absorption von sichtbarem Licht. sp 2
11 3-11 Phenolphthalein als Indikator 2 farblos orange violett farblos
Darstellung von Phenolphthalein und Fluorescein
 Philipps-Universität Marburg 04. Juli 2007 Fachbereich 15: Chemie rganisch-chemisches Grundpraktikum für Lehramtskandidaten Praktikumsleiter: Dr. Philipp Reiß SS 2007 Mario Gerwig Versuch: Darstellung
Philipps-Universität Marburg 04. Juli 2007 Fachbereich 15: Chemie rganisch-chemisches Grundpraktikum für Lehramtskandidaten Praktikumsleiter: Dr. Philipp Reiß SS 2007 Mario Gerwig Versuch: Darstellung
Spektroskopie-Seminar SS UV-Vis-Spektroskopie. UV-Vis-Spektroskopie
 UV-Vis-Spektroskopie 7.1 Allgemeines UV-Vis-Spektroskopie verwendet elektromagnetische Strahlung im sichtbaren und UV-Bereich. 190 nm bis 700 nm. Dabei kommt es zur Anregung von Elektronen ( Elektronenspektroskopie
UV-Vis-Spektroskopie 7.1 Allgemeines UV-Vis-Spektroskopie verwendet elektromagnetische Strahlung im sichtbaren und UV-Bereich. 190 nm bis 700 nm. Dabei kommt es zur Anregung von Elektronen ( Elektronenspektroskopie
Triphenylmethanfarbstoffe
 3. Triphenylmethanfarbstoffe 3.1 Triphenylmethanfarbstoffe Diese Farbstoffklasse leitet sich vom Triphenylcarbeniumion als Chromophor ab. Durch Einführung auxochromer Gruppen in Parastellung kann man die
3. Triphenylmethanfarbstoffe 3.1 Triphenylmethanfarbstoffe Diese Farbstoffklasse leitet sich vom Triphenylcarbeniumion als Chromophor ab. Durch Einführung auxochromer Gruppen in Parastellung kann man die
Farbigkeit bei Molekülen Fluoreszenz Phosphoreszenz
 Farbigkeit bei Molekülen Im Unterschied zu einzelnen Atomen zeigen die Absorptionsspektren von Molekülen keine scharfen Linen, sondern breitere Absorptionsbanden. Die Moleküle absorbieren also nicht nur
Farbigkeit bei Molekülen Im Unterschied zu einzelnen Atomen zeigen die Absorptionsspektren von Molekülen keine scharfen Linen, sondern breitere Absorptionsbanden. Die Moleküle absorbieren also nicht nur
1.4 Die elektrophile aromatische Substitution
 1.4 Die elektrophile aromatische Substitution Versuch: Bromierung von Toluol mit Eisen V In einem RG werden 2ml Toluol mit 0,5 g Eisenspänen gemischt. Hierzu werden 5 Tropfen Brom gegeben B Es bildet sich
1.4 Die elektrophile aromatische Substitution Versuch: Bromierung von Toluol mit Eisen V In einem RG werden 2ml Toluol mit 0,5 g Eisenspänen gemischt. Hierzu werden 5 Tropfen Brom gegeben B Es bildet sich
Chemie Stufe 13 / Aromaten / Phenol Folie 01. Das Phenol-Molekül. δ δ+ sp 3. sp 2
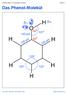 Chemie Stufe 13 / Aromaten / Phenol Folie 01 Das Phenol-Molekül δ δ+ sp 3 sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 02 Das Phenolat-Ion sp 3 H + sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 03 Grenzstrukturen
Chemie Stufe 13 / Aromaten / Phenol Folie 01 Das Phenol-Molekül δ δ+ sp 3 sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 02 Das Phenolat-Ion sp 3 H + sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 03 Grenzstrukturen
Farbstoffe Einleitung
 Einleitung Farben, die aus Mineralien gewonnen wurden, wie die Mineralfarben Mennige, Zinnober oder Malachit dienten bereits in der Altsteinzeit für Höhlenmalereien. Diese Farben bestehen aus anorganischen
Einleitung Farben, die aus Mineralien gewonnen wurden, wie die Mineralfarben Mennige, Zinnober oder Malachit dienten bereits in der Altsteinzeit für Höhlenmalereien. Diese Farben bestehen aus anorganischen
4. Phthaleine 4.1. Mit den Triphenylmethanfarbstoffen eng verwandt sind die Phthaleine, deren Synthese vom Phthalsäureanhydrid
 4. Phthaleine 4.1 Phthaleine Mit den Triphenylmethanfarbstoffen eng verwandt sind die Phthaleine, deren Synthese vom Phthalsäureanhydrid ausgeht. Phenolphthalein erhält man durch Zusammenschmelzen von
4. Phthaleine 4.1 Phthaleine Mit den Triphenylmethanfarbstoffen eng verwandt sind die Phthaleine, deren Synthese vom Phthalsäureanhydrid ausgeht. Phenolphthalein erhält man durch Zusammenschmelzen von
Arbeitsblatt Wie entstehen Farben?
 Arbeitsblatt Wie entstehen Farben? Der für das menschliche Auge sichtbare Wellenlängenbereich liegt bei 380-750 nm. Farbstoffe sind in der Lage bestimmte Wellenlängen des Lichts zu absorbieren und eine
Arbeitsblatt Wie entstehen Farben? Der für das menschliche Auge sichtbare Wellenlängenbereich liegt bei 380-750 nm. Farbstoffe sind in der Lage bestimmte Wellenlängen des Lichts zu absorbieren und eine
Essigsäure färbt ph-papier rot. Natronlauge färbt ph-papier blau
 5. SÄUREN UND BASEN ARBEITSBLATT 5.1 WAS SIND INDIKATOREN? DER PH-WERT SÄUREN und BASEN sind Stoffe die sich gegenseitig in ihrer Wirkung aufheben. INDIKATOREN sind Farbstoffe, die über Farbänderungen
5. SÄUREN UND BASEN ARBEITSBLATT 5.1 WAS SIND INDIKATOREN? DER PH-WERT SÄUREN und BASEN sind Stoffe die sich gegenseitig in ihrer Wirkung aufheben. INDIKATOREN sind Farbstoffe, die über Farbänderungen
Schulversuchspraktikum. Isabel Großhennig. Sommersemester Klassenstufen 11 & 12. Farbstoffe. Kurzprotokoll
 Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 11 & 12 Farbstoffe Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll für die Klassenstufen 11 und 12 zum Thema Farbstoffe enthält
Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 11 & 12 Farbstoffe Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll für die Klassenstufen 11 und 12 zum Thema Farbstoffe enthält
Einfluß von Substituenten am Benzol auf Geschwindigkeit und Richtung der elektrophilen Substitution
 14.01 Einfluß von Substituenten am Benzol auf Geschwindigkeit und Richtung der elektrophilen Substitution Substitutenten Geschwindigkeit (Reaktivität) Richtung (Regioselektivität) Interpretation 1. 2,,
14.01 Einfluß von Substituenten am Benzol auf Geschwindigkeit und Richtung der elektrophilen Substitution Substitutenten Geschwindigkeit (Reaktivität) Richtung (Regioselektivität) Interpretation 1. 2,,
Materialien- Handbuch Kursunterricht Chemie
 Materialien- Handbuch Kursunterricht Chemie Band 6 Farbstoffe - Waschmittel Herausgeber: Dr. Heinz Wambach unter Mitwirkung von Dr. Uwe HHgers Universitäts- und Landisbibliothek Darmstadt Bibliothek Biologie
Materialien- Handbuch Kursunterricht Chemie Band 6 Farbstoffe - Waschmittel Herausgeber: Dr. Heinz Wambach unter Mitwirkung von Dr. Uwe HHgers Universitäts- und Landisbibliothek Darmstadt Bibliothek Biologie
Darstellung von Malachitgrün Präparat 5
 Janine Schneider 22.05.00 Darstellung von Malachitgrün Präparat 5 1. Reaktionstyp: säurekatalysierte Kondensation (elektrophile Substitution) 2. Reaktionsgleichung: O + 2 ( + ) Benzaldehyd N,N- Dimethylanilin
Janine Schneider 22.05.00 Darstellung von Malachitgrün Präparat 5 1. Reaktionstyp: säurekatalysierte Kondensation (elektrophile Substitution) 2. Reaktionsgleichung: O + 2 ( + ) Benzaldehyd N,N- Dimethylanilin
2-01. Das Ethen-Molekül. Perspektivische Darstellung des Ethen-Moleküls.
 Das Ethen-Molekül 2-01 Perspektivische Darstellung des Ethen-Moleküls. Rot: Sigma-Bindungen σ mit je zwei Bindungselektronen Blau: pz-orbitale mit je einem Elektron Die C-Atome sind sp 2 -hybridisiert,
Das Ethen-Molekül 2-01 Perspektivische Darstellung des Ethen-Moleküls. Rot: Sigma-Bindungen σ mit je zwei Bindungselektronen Blau: pz-orbitale mit je einem Elektron Die C-Atome sind sp 2 -hybridisiert,
Farbstoffe Zusammenfassung Klausur K2
 Farbstoffe Zusammenfassung Klausur K2 aphael Michel 10. März 2013 Inhaltsverzeichnis 1 Allgemeines 1 1.1 Mesomeriemodell und Absorption.............................. 1 2 Farbstoffklassen 2 2.1 Indigo.............................................
Farbstoffe Zusammenfassung Klausur K2 aphael Michel 10. März 2013 Inhaltsverzeichnis 1 Allgemeines 1 1.1 Mesomeriemodell und Absorption.............................. 1 2 Farbstoffklassen 2 2.1 Indigo.............................................
Untersuche die Wirkung verschiedener Säuren und Laugen auf natürliche und industriell hergestellte Indikatoren.
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - 1 Säuren (P7157400) 1.5 Wirkung von Säuren und Laugen auf natürliche und technische Indikatoren Experiment von: Phywe Gedruckt: 15.10.2013 11:37:56
Naturwissenschaften - Chemie - Säuren, Basen, Salze - 1 Säuren (P7157400) 1.5 Wirkung von Säuren und Laugen auf natürliche und technische Indikatoren Experiment von: Phywe Gedruckt: 15.10.2013 11:37:56
EinFaCh 4. Studienvorbereitung Chemie. Einstieg in Freibergs anschauliches Chemiewissen Teil 4: Säuren und Basen. tu-freiberg.de
 Studienvorbereitung Chemie EinFaCh Einstieg in Freibergs anschauliches Chemiewissen Teil : Säuren und Basen tu-freiberg.de tu-freiberg.de/fakultaet2/einfach Was ist eine Säure oder Base? Gemäß der heute
Studienvorbereitung Chemie EinFaCh Einstieg in Freibergs anschauliches Chemiewissen Teil : Säuren und Basen tu-freiberg.de tu-freiberg.de/fakultaet2/einfach Was ist eine Säure oder Base? Gemäß der heute
ph-wert ph-wert eine Kenngröße für saure, neutrale oder basische Lösungen
 ph-wert ph-wert eine Kenngröße für saure, neutrale oder basische Lösungen ChemikerInnen verwenden den ph-wert um festzustellen, wie sauer oder basisch eine Lösung ist. Man verwendet eine Skala von 0-14:
ph-wert ph-wert eine Kenngröße für saure, neutrale oder basische Lösungen ChemikerInnen verwenden den ph-wert um festzustellen, wie sauer oder basisch eine Lösung ist. Man verwendet eine Skala von 0-14:
Schulversuchspraktikum. Anna Hille. Sommersemester Klassenstufen 11 & 12. Farbstoffe
 Schulversuchspraktikum Anna Hille Sommersemester 2013 Klassenstufen 11 & 12 Farbstoffe 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Dieses Protokoll beinhaltet zwei Lehrerversuche
Schulversuchspraktikum Anna Hille Sommersemester 2013 Klassenstufen 11 & 12 Farbstoffe 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Dieses Protokoll beinhaltet zwei Lehrerversuche
Tracer Fluid Logging (TFL) Fluoreszierende Tracer in der Praxis
 Tracer Fluid Logging (TFL) Fluoreszierende Tracer in der Praxis Tracer-Fluid-Logging Fließgeschwindigkeit des Wassers wird anhand der Ortsveränderung eines gut nachweisbaren Inhaltsstoffes beobachtet klassischer
Tracer Fluid Logging (TFL) Fluoreszierende Tracer in der Praxis Tracer-Fluid-Logging Fließgeschwindigkeit des Wassers wird anhand der Ortsveränderung eines gut nachweisbaren Inhaltsstoffes beobachtet klassischer
Übungen zur VL Chemie für Biologen und Humanbiologen
 Übungen zur VL Chemie für Biologen und Humanbiologen 28.01.2011 1. Zeichnen Sie die Valenzstrichformeln folgender Verbindungen und benutzen Sie im Falle unbestimmter Alkylreste ein R: a) ein tertiärer
Übungen zur VL Chemie für Biologen und Humanbiologen 28.01.2011 1. Zeichnen Sie die Valenzstrichformeln folgender Verbindungen und benutzen Sie im Falle unbestimmter Alkylreste ein R: a) ein tertiärer
Übungen zur VL Chemie für Biologen und Humanbiologen Lösung Übung 9
 Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
Die elektrophile Addition
 Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Elektrophile Reaktionsmechanismen Erkennungsmerkmale und Reaktionsschritte
 Elektrophile Reaktionsmechanismen Erkennungsmerkmale und Reaktionsschritte H. Wünsch 2012 Signale für elektrophile Reak;onen Signale am organischen Molekül: π- Elektronen (Mehrfachbindungen), π- Elektronensysteme
Elektrophile Reaktionsmechanismen Erkennungsmerkmale und Reaktionsschritte H. Wünsch 2012 Signale für elektrophile Reak;onen Signale am organischen Molekül: π- Elektronen (Mehrfachbindungen), π- Elektronensysteme
Chemie zur Weihnacht. Farbreihe
 Farbreihe Reagenzien: 2 ml Phenolphthalein in 200 ml Wasser verdünnte Natronlauge in Tropfflasche Kaliumpermanganat 2,5 g Eisen(II)-sulfat in 50 ml Wasser 2,5 g Kaliumthiocyanat in 50 ml Wasser 2,5 g Kaliumhexacyanoferrat(II)
Farbreihe Reagenzien: 2 ml Phenolphthalein in 200 ml Wasser verdünnte Natronlauge in Tropfflasche Kaliumpermanganat 2,5 g Eisen(II)-sulfat in 50 ml Wasser 2,5 g Kaliumthiocyanat in 50 ml Wasser 2,5 g Kaliumhexacyanoferrat(II)
Übungsaufgaben zum Kapitel Farbstoffe mit Hilfe des Lernprogramms Farbstoffermittler
 Übungsaufgaben zum Kapitel Farbstoffe mit ilfe des Tipp: Vergleiche auf der KGA-Chemie-Unterrichtsmaterialseite im Lehrplan Kapitel C 11.2 Farbstoffe - mit dem efteintrag Farbstoffe (Passwort: schuelerkga11)
Übungsaufgaben zum Kapitel Farbstoffe mit ilfe des Tipp: Vergleiche auf der KGA-Chemie-Unterrichtsmaterialseite im Lehrplan Kapitel C 11.2 Farbstoffe - mit dem efteintrag Farbstoffe (Passwort: schuelerkga11)
Zusammenfassung vom
 Zusammenfassung vom 20.10. 09 Löslichkeitsprodukt = quantitative Aussage über die Löslichkeit einer schwerlöslichen Verbindung bei gegebener Temperatur A m B n m A n+ + n B m- K L = (c A n+ ) m (c B m-
Zusammenfassung vom 20.10. 09 Löslichkeitsprodukt = quantitative Aussage über die Löslichkeit einer schwerlöslichen Verbindung bei gegebener Temperatur A m B n m A n+ + n B m- K L = (c A n+ ) m (c B m-
Untersuche die Wirkung von verschiedenen Säuren auf Gemüse- und Blütenfarbstoffe.
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - 1 Säuren (P7157300) 1.4 Die Wirkung von Säuren auf Indikatoren Experiment von: Phywe Gedruckt: 15.10.2013 11:36:51 intertess (Version 13.06 B200, Export
Naturwissenschaften - Chemie - Säuren, Basen, Salze - 1 Säuren (P7157300) 1.4 Die Wirkung von Säuren auf Indikatoren Experiment von: Phywe Gedruckt: 15.10.2013 11:36:51 intertess (Version 13.06 B200, Export
11 Organische Farbstoffe
 Lösungen zu den Durchblick-Seiten 11.11 Durchblick Zusammenfassung und Übung Zu den Aufgaben A1 Das Phenolmolekül ist reaktiver als das unsubstituierte Benzolmolekül, da in ihm durch Mesomerie negative
Lösungen zu den Durchblick-Seiten 11.11 Durchblick Zusammenfassung und Übung Zu den Aufgaben A1 Das Phenolmolekül ist reaktiver als das unsubstituierte Benzolmolekül, da in ihm durch Mesomerie negative
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Aromatische Kohlenwasserstoffe.
 Aromatische Kohlenwasserstoffe. Benzol und dessen Homologe. Mechanismus der S E 2-Ar-Reaktion. Orientierung in aromatischem Kern, abhängig vom ersten Substituent. Elektrophiler Mechanismus der Substitutionsreaktionen.
Aromatische Kohlenwasserstoffe. Benzol und dessen Homologe. Mechanismus der S E 2-Ar-Reaktion. Orientierung in aromatischem Kern, abhängig vom ersten Substituent. Elektrophiler Mechanismus der Substitutionsreaktionen.
Präparat 6: Darstellung von Methylorange (4 Dimethylaminoazobenzol-4 -sulfonsäure, Natriumsalz) - Azofarbstoff -
 Christina Sauermann 1 C- A- Praktikum Präparat 6: Darstellung von Methylorange (4 Dimethylaminoazobenzol-4 -sulfonsäure, atriumsalz) - Azofarbstoff - Die Darstellung von Methylorange erfolgt in zwei Teilschritten:
Christina Sauermann 1 C- A- Praktikum Präparat 6: Darstellung von Methylorange (4 Dimethylaminoazobenzol-4 -sulfonsäure, atriumsalz) - Azofarbstoff - Die Darstellung von Methylorange erfolgt in zwei Teilschritten:
Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09
 rganisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah Henkel Datum: 18.11.2008 Gruppe 4: Aromaten Versuch: Herstellung von Fluorescein
rganisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah Henkel Datum: 18.11.2008 Gruppe 4: Aromaten Versuch: Herstellung von Fluorescein
Versuch 6.14 ph-abhängigkeit eines Indikators am Beispiel Thymolblau
 Versuch 6.14 ph-abhängigkeit eines Indikators am Beispiel Thymolblau Einleitung Lösungen mit verschiedenen ph-werten von stark sauer bis stark basisch werden mit gleich viel Thymolblau-Lösung versetzt.
Versuch 6.14 ph-abhängigkeit eines Indikators am Beispiel Thymolblau Einleitung Lösungen mit verschiedenen ph-werten von stark sauer bis stark basisch werden mit gleich viel Thymolblau-Lösung versetzt.
Lösungen 3. Übungsblatt SS 2002
 Lösungen 3. Übungsblatt SS 2002 1. Aufgabe: omenklatur und Stereochemie a) (E)-7-(S)-om-4-nonen-2-on b) H 3- Methoxy-4-methyl-benzaldehyd 2. Aufgabe: Alkene a) A B C D E Stabilitätsbeeinflussende Faktoren
Lösungen 3. Übungsblatt SS 2002 1. Aufgabe: omenklatur und Stereochemie a) (E)-7-(S)-om-4-nonen-2-on b) H 3- Methoxy-4-methyl-benzaldehyd 2. Aufgabe: Alkene a) A B C D E Stabilitätsbeeinflussende Faktoren
Rosa Geheimschrift. Durchführung
 Name: Datum: Materialien verschiedene Papiersorten (auch Filterpapier), Pinsel, Wattestäbchen, Fön, Lösung F (Phenolphthalein-Lösung: 0,1 g/100 ml Ethanol), Lösung G (Natriumcarbonat-Lösung: 1 g/100 ml)
Name: Datum: Materialien verschiedene Papiersorten (auch Filterpapier), Pinsel, Wattestäbchen, Fön, Lösung F (Phenolphthalein-Lösung: 0,1 g/100 ml Ethanol), Lösung G (Natriumcarbonat-Lösung: 1 g/100 ml)
Übungen zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe. 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit
 O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts WS 21/11 Praktikumsleitung: Dr. Reiß Assistent(in): Beate Abé Name: Johannes Hergt Datum: 11.2.211 Gruppe 12: Farb-, Spreng- und Wirkstoffe
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 21/11 Praktikumsleitung: Dr. Reiß Assistent(in): Beate Abé Name: Johannes Hergt Datum: 11.2.211 Gruppe 12: Farb-, Spreng- und Wirkstoffe
SS 2010. Thomas Schrader. der Universität Duisburg-Essen. (Teil 7: Säuren und Basen, Elektrolyte)
 Chemie für Biologen SS 2010 Thomas Schrader Institut t für Organische Chemie der Universität Duisburg-Essen (Teil 7: Säuren und Basen, Elektrolyte) Definition Säure/Base Konjugierte Säure/Base-Paare Konjugierte
Chemie für Biologen SS 2010 Thomas Schrader Institut t für Organische Chemie der Universität Duisburg-Essen (Teil 7: Säuren und Basen, Elektrolyte) Definition Säure/Base Konjugierte Säure/Base-Paare Konjugierte
Indikatoren sind schwache Säuren, deren konjugierte Basen eine andere Farbe aufweist, als die undissoziierte Säure.
 Indikatoren AALYTIK I Dr. Andreas Martens a.mvs@tu-bs.de Institut f. Anorg.u. Analyt. Chemie, Technische Universität aunschweig, aunschweig, Germany Indikatoren Indikatoren sind schwache äuren, deren konjugierte
Indikatoren AALYTIK I Dr. Andreas Martens a.mvs@tu-bs.de Institut f. Anorg.u. Analyt. Chemie, Technische Universität aunschweig, aunschweig, Germany Indikatoren Indikatoren sind schwache äuren, deren konjugierte
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Jan Schäfer Name: Johannes Hergt Datum: 23.11.2010 Gruppe 4: Aromaten Versuch (elektr.
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Jan Schäfer Name: Johannes Hergt Datum: 23.11.2010 Gruppe 4: Aromaten Versuch (elektr.
Säure-Base Titrationen. (Seminar zu den Übungen zur quantitativen Bestimmung von Arznei-, Hilfs- und Schadstoffen)
 Säure-Base Titrationen (Seminar zu den Übungen zur quantitativen Bestimmung von Arznei-, Hilfs- und Schadstoffen) 1. Gehaltsbestimmung von Salzsäure HCl ist eine starke Säure (fast zu 100% dissoziiert)
Säure-Base Titrationen (Seminar zu den Übungen zur quantitativen Bestimmung von Arznei-, Hilfs- und Schadstoffen) 1. Gehaltsbestimmung von Salzsäure HCl ist eine starke Säure (fast zu 100% dissoziiert)
Organik-Beispiel. Inhaltsverzeichnis
 Inhaltsverzeichnis I. Säure-Basen-Gleichungen... 2 a) Nach Arrhenius:... 2 b) Nach Broensted:... 2 c) Nach Lewis:... 2 II. H 2 O + HCl?... 4 a) Was ist in der Reaktion passiert? Welche Produkte entstehen?...
Inhaltsverzeichnis I. Säure-Basen-Gleichungen... 2 a) Nach Arrhenius:... 2 b) Nach Broensted:... 2 c) Nach Lewis:... 2 II. H 2 O + HCl?... 4 a) Was ist in der Reaktion passiert? Welche Produkte entstehen?...
Zweite Klausur zum Organisch-Chemischen Grundpraktikum
 Prof. Dr. Jens Christoffers 12. Juni 2006 Universität ldenburg Zweite Klausur zum rganisch-chemischen Grundpraktikum Vorname: Name: Matrikelnummer: Studiengang: Falls Sie zusätzliche Seiten verwenden,
Prof. Dr. Jens Christoffers 12. Juni 2006 Universität ldenburg Zweite Klausur zum rganisch-chemischen Grundpraktikum Vorname: Name: Matrikelnummer: Studiengang: Falls Sie zusätzliche Seiten verwenden,
Radikalische Substitution von Alkanen
 adikalische Substitution von Alkanen KW mit sp³-hybridisierten C-Atomen (z.b. in Alkanen) und alogene Gemisch aus alogenalkanen und alogenwasserstoff Licht C n n à C n n1 eaktionsmechanismus z.b. Chlorierung
adikalische Substitution von Alkanen KW mit sp³-hybridisierten C-Atomen (z.b. in Alkanen) und alogene Gemisch aus alogenalkanen und alogenwasserstoff Licht C n n à C n n1 eaktionsmechanismus z.b. Chlorierung
Übersicht 3 Aspekte: - Struktur - Farbe (λ, ε) - Wechselwirkung Farbstoff-Faser
 294 XVI Farbstoffe, Photochemie Übersicht 3 Aspekte: - Struktur - Farbe (λ, ε) - Wechselwirkung Farbstoff-Faser 1 Lichtabsorption, Fluoreszens Spektralbereiche und Komplementärfarben high high Frequency
294 XVI Farbstoffe, Photochemie Übersicht 3 Aspekte: - Struktur - Farbe (λ, ε) - Wechselwirkung Farbstoff-Faser 1 Lichtabsorption, Fluoreszens Spektralbereiche und Komplementärfarben high high Frequency
Themengebiet: 1 HA + H 2 O A - + H 3 O + H 3 O + : Oxonium- oder Hydroxoniumion. Themengebiet: 2 B + H 2 O BH + + OH - OH - : Hydroxidion
 1 1 Säuren sind Protonendonatoren, d.h. Stoffe, die an einen Reaktionspartner ein oder mehrere Protonen abgeben können; Säuredefinition nach Brönsted Im Falle von Wasser: HA + H 2 O A - + H 3 O + H 3 O
1 1 Säuren sind Protonendonatoren, d.h. Stoffe, die an einen Reaktionspartner ein oder mehrere Protonen abgeben können; Säuredefinition nach Brönsted Im Falle von Wasser: HA + H 2 O A - + H 3 O + H 3 O
Wirkung von Säuren und Laugen auf natürliche und technische Indikatoren (Artikelnr.: P )
 Lehrer-/Dozentenblatt Wirkung von Säuren und Laugen auf natürliche und technische Indikatoren (Artikelnr.: P7510200) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema:
Lehrer-/Dozentenblatt Wirkung von Säuren und Laugen auf natürliche und technische Indikatoren (Artikelnr.: P7510200) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema:
6. Carbonyl-Verbindungen
 6. Carbonyl-Verbindungen Hierher gehören vor allem die Aldehyde und Ketone. (später: Die Carbonyl-Gruppe weisen auch die Carbonsäuren und ihre Derivate auf). Carbonylgruppe. Innerhalb der Sauerstoff-Kohlenstoff-Doppelbindung
6. Carbonyl-Verbindungen Hierher gehören vor allem die Aldehyde und Ketone. (später: Die Carbonyl-Gruppe weisen auch die Carbonsäuren und ihre Derivate auf). Carbonylgruppe. Innerhalb der Sauerstoff-Kohlenstoff-Doppelbindung
(Anmerkung: Es sind weitere möglich. Spektren zeigen Diradikal.)
 eispielaufgaben IChO 2. Runde 2017 Aromaten, Lösungen Aromaten eispiel 1: a) b) (Zeichnungen hier und unten teilweise ohne Wasserstoff-Atome) c) Das Anion ist planar und hat ein cyclisch konjugiertes π-elektronensystem
eispielaufgaben IChO 2. Runde 2017 Aromaten, Lösungen Aromaten eispiel 1: a) b) (Zeichnungen hier und unten teilweise ohne Wasserstoff-Atome) c) Das Anion ist planar und hat ein cyclisch konjugiertes π-elektronensystem
Grundwissenkarten Hans-Carossa- Gymnasium
 Grundwissenkarten Hans-Carossa- Gymnasium 10. Klasse Chemie SG Es sind insgesamt 20 Karten für die 10. Klasse erarbeitet. Karten ausschneiden : Es ist auf der linken Blattseite die Vorderseite mit Frage/Aufgabe,
Grundwissenkarten Hans-Carossa- Gymnasium 10. Klasse Chemie SG Es sind insgesamt 20 Karten für die 10. Klasse erarbeitet. Karten ausschneiden : Es ist auf der linken Blattseite die Vorderseite mit Frage/Aufgabe,
Lehrerinformation Brillantblau
 Lehrerinformation: Allgemeines zu Triarylmethylfarbstoffen Viele Gegenstände, mit denen wir tagtäglich in Berührung kommen, sind farbig. Letztlich ist aber all diese Farbenpracht auf die chemischen Verbindungen
Lehrerinformation: Allgemeines zu Triarylmethylfarbstoffen Viele Gegenstände, mit denen wir tagtäglich in Berührung kommen, sind farbig. Letztlich ist aber all diese Farbenpracht auf die chemischen Verbindungen
9 Aromaten. 1 Elemente Chemie Oberstufe NRW Ernst Klett Verlag GmbH, Stuttgart Lösungen zu den Durchblick-Seiten
 Lösungen zu den Durchblick-Seiten 9.15 Durchblick Zusammenfassung und Übung Zu den Aufgaben A1 1. Aromaten sind ebene, cyclische Moleküle. 2. Das Ringmolekül weist ein durchgehendes System konjugierter
Lösungen zu den Durchblick-Seiten 9.15 Durchblick Zusammenfassung und Übung Zu den Aufgaben A1 1. Aromaten sind ebene, cyclische Moleküle. 2. Das Ringmolekül weist ein durchgehendes System konjugierter
Schulversuchspraktikum. Isabel Großhennig. Sommersemester Klassenstufen 11 & 12. Farbstoffe
 Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 11 & 12 Farbstoffe 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem ausführlichen Protokoll zum Thema
Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 11 & 12 Farbstoffe 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem ausführlichen Protokoll zum Thema
Lernziele zu Farbigkeit von Stoffen
 Farbstoffe Lernziele zu Farbigkeit von Stoffen du verstehst, wie Farbigkeit mit der Absorption von EM-Strahlung zusammenhängt. du verstehst die Unterschiede zwischen Feuerwerksfarben und Textilfarbstoffen.
Farbstoffe Lernziele zu Farbigkeit von Stoffen du verstehst, wie Farbigkeit mit der Absorption von EM-Strahlung zusammenhängt. du verstehst die Unterschiede zwischen Feuerwerksfarben und Textilfarbstoffen.
Herstellung und Oxidation von 2,4,6-Tri-tert-butylphenol
 2.9B erstellung und xidation von 2,4,6-Tri-tert-butylphenol Chemikalien 4,7 g (50 mmol) Phenol R: 24, 25, 45 S: 28.2, 45 17,6 g (200 mmol) tertylmethylether R: 11, 36, 37, 38 Kp = 55 C S: 9, 16, 26, 29,
2.9B erstellung und xidation von 2,4,6-Tri-tert-butylphenol Chemikalien 4,7 g (50 mmol) Phenol R: 24, 25, 45 S: 28.2, 45 17,6 g (200 mmol) tertylmethylether R: 11, 36, 37, 38 Kp = 55 C S: 9, 16, 26, 29,
H δ+ H H H H. Addition von HBr an Ethen. Zufällig kommt ein HBr-Molekül in die Nähe der elektronenreichen Doppelbindung. Schritt 1
 hemie Q1 / 4. Reaktionswege der Organik / 4.2 Alkene und elektrophile Addition Addition von an Ethen Schritt 1 1/ Zufällig kommt ein -Molekül in die Nähe der elektronenreichen δ- δ+ Ulrich elmich 2015
hemie Q1 / 4. Reaktionswege der Organik / 4.2 Alkene und elektrophile Addition Addition von an Ethen Schritt 1 1/ Zufällig kommt ein -Molekül in die Nähe der elektronenreichen δ- δ+ Ulrich elmich 2015
Kap.7 ph-wert und ph-indikatoren
 Der ph-wert und ph-indikatoren Kapitel 7 Übung 6.1: Berechnung der Konzentration von Wasser in Wasser Wieviel mol H2O sind in 1 L H2O? M(H2O)= 18.01528 g/mol 1 L(H2O)= 00g H2O n= m/m= 00g/ 18.01528 g/mol
Der ph-wert und ph-indikatoren Kapitel 7 Übung 6.1: Berechnung der Konzentration von Wasser in Wasser Wieviel mol H2O sind in 1 L H2O? M(H2O)= 18.01528 g/mol 1 L(H2O)= 00g H2O n= m/m= 00g/ 18.01528 g/mol
Reak%onen an der Carbonylgruppe
 Reak%onen an der Carbonylgruppe H. Wünsch 2013 1.1 Struktur der Carbonylgruppe Die Carbonylgruppe entsteht bei der OxidaBon primärer und sekundärer Alkohole. Kohlenstoff und Sauerstoff sind doppelt gebunden,
Reak%onen an der Carbonylgruppe H. Wünsch 2013 1.1 Struktur der Carbonylgruppe Die Carbonylgruppe entsteht bei der OxidaBon primärer und sekundärer Alkohole. Kohlenstoff und Sauerstoff sind doppelt gebunden,
Herstellung des Benzoldiazoniumchlorids aus Anilin, Natriumnitrit und Salzsäure. Benzoldiazonium-Ion
 Vorlesung 34 Arendiazoniumsalze (Vollhardt, 3. Aufl., S. 1113-1117, 4. Aufl. 1191-1195; art, S. 412-418; Buddrus, S. 621-627) werden in gleicher Weise hergestellt wie die aliphatischen Diazonium-Salze.
Vorlesung 34 Arendiazoniumsalze (Vollhardt, 3. Aufl., S. 1113-1117, 4. Aufl. 1191-1195; art, S. 412-418; Buddrus, S. 621-627) werden in gleicher Weise hergestellt wie die aliphatischen Diazonium-Salze.
Research Collection. Skript zur Vorlesung Allgemeine Chemie I. Educational Material. ETH Library. Author(s): Nesper, Reinhard Friedrich
 Research Collection Educational Material Skript zur Vorlesung Allgemeine Chemie I Author(s): Nesper, Reinhard Friedrich Publication Date: 2001 Permanent Link: https://doi.org/10.3929/ethz-a-004324518 Rights
Research Collection Educational Material Skript zur Vorlesung Allgemeine Chemie I Author(s): Nesper, Reinhard Friedrich Publication Date: 2001 Permanent Link: https://doi.org/10.3929/ethz-a-004324518 Rights
Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag)
 Pharmazeutische Chemie Seite 1 Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag) Fragen zu der sp³ Hybridisierung (S. 124-128): 1.) Notieren Sie die Elektronenverteilung
Pharmazeutische Chemie Seite 1 Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag) Fragen zu der sp³ Hybridisierung (S. 124-128): 1.) Notieren Sie die Elektronenverteilung
Licht und Farbe mit Chemie
 Licht und Farbe mit Chemie Folie 1 Was verstehen wir eigentlich unter Licht? Licht nehmen wir mit unseren Augen wahr Helligkeit: Farben: Schwarz - Grau - Weiß Blau - Grün - Rot UV-Strahlung Blau Türkis
Licht und Farbe mit Chemie Folie 1 Was verstehen wir eigentlich unter Licht? Licht nehmen wir mit unseren Augen wahr Helligkeit: Farben: Schwarz - Grau - Weiß Blau - Grün - Rot UV-Strahlung Blau Türkis
KW Alkene. Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1
 KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
Versuch: Darstellung eines Azofarbstoffes (Methylorange)
 PhilippsUniversität Marburg 02.02.2008 rganisches Grundpraktikum (LA) Katrin ohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß W 2007/08 Gruppe 12, Farbstoffe, Wirkstoffe Versuch: Darstellung eines
PhilippsUniversität Marburg 02.02.2008 rganisches Grundpraktikum (LA) Katrin ohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß W 2007/08 Gruppe 12, Farbstoffe, Wirkstoffe Versuch: Darstellung eines
Schülercode Erste zwei Buchstaben Letzte zwei Buchstaben des Vornamens deiner Geburtstag (TT) deines Vornamens Mutter Kontext Experiment Aufgabe
 Schülercode Letzte zwei Buchstaben deines Vornamens Erste zwei Buchstaben des Vornamens deiner Mutter Geburtstag (TT) Kontext Experiment Aufgabe Erklärung Box 1 Kontext Kohlensäure im Mineralwasser Heute
Schülercode Letzte zwei Buchstaben deines Vornamens Erste zwei Buchstaben des Vornamens deiner Mutter Geburtstag (TT) Kontext Experiment Aufgabe Erklärung Box 1 Kontext Kohlensäure im Mineralwasser Heute
Theorie der Farbigkeit
 1. Theorie der Farbigkeit 1.1 Theorie der Farbigkeit Chromophore Zentraler Bestandteil aller Farbstoffe sind die Chromophore. Als Chromophor (griech. Farbträger) bezeichnet man den Teil eines Farbstoffs,
1. Theorie der Farbigkeit 1.1 Theorie der Farbigkeit Chromophore Zentraler Bestandteil aller Farbstoffe sind die Chromophore. Als Chromophor (griech. Farbträger) bezeichnet man den Teil eines Farbstoffs,
Organische Chemie 10C1. Funktionelle Gruppen 10C2. Homologe Reihe der Alkane 10C3. Nomenklatur der Alkane (gesättigte Kohlenwasserstoffe) 10C4
 Organische Chemie 10C1 Chemie der Kohlenstoffverbindungen (C und v.a. H, N, O, S) C-Atome immer vierbindig Funktionelle Gruppen 10C2 Alkan: nur Einfachbindungen Alken: mindestens eine Doppelbindung Alkin:
Organische Chemie 10C1 Chemie der Kohlenstoffverbindungen (C und v.a. H, N, O, S) C-Atome immer vierbindig Funktionelle Gruppen 10C2 Alkan: nur Einfachbindungen Alken: mindestens eine Doppelbindung Alkin:
ph-indikatoren Sekundenschnelle Analysen
 ph-indikatoren Sekundenschnelle Analysen ph-indikatorpapiere Die Preiswerten In der Praxis genügt es meistens, den ph-wert bis auf ganze ph-einheiten oder Zehntel einer ph-einheit zu bestimmen. Für diese
ph-indikatoren Sekundenschnelle Analysen ph-indikatorpapiere Die Preiswerten In der Praxis genügt es meistens, den ph-wert bis auf ganze ph-einheiten oder Zehntel einer ph-einheit zu bestimmen. Für diese
 hemie-protokoll 11.11.02, Seite 1 von 5 Lukman Iwan, 12.11.02 Stundenprotokoll vom Montag, 11. ovember 2002 Es fehlen: Janine und Jeannette Zettel 1&2: Aromatische eterocyclen http://www.oci.unizh.ch/edu/lectures/material/a_bii/kap6/kap6.html
hemie-protokoll 11.11.02, Seite 1 von 5 Lukman Iwan, 12.11.02 Stundenprotokoll vom Montag, 11. ovember 2002 Es fehlen: Janine und Jeannette Zettel 1&2: Aromatische eterocyclen http://www.oci.unizh.ch/edu/lectures/material/a_bii/kap6/kap6.html
12 Organische Farbstoffe
 12 rganische Farbstoffe 12.1 Licht und Farbe vorläufige Fassung Zur Aufgabe A1 Das absorbierte Licht im Wellenlängenbereich 480 490 nm ist blau. Die Lösung hat folglich die Komplementärfarbe, d.h., sie
12 rganische Farbstoffe 12.1 Licht und Farbe vorläufige Fassung Zur Aufgabe A1 Das absorbierte Licht im Wellenlängenbereich 480 490 nm ist blau. Die Lösung hat folglich die Komplementärfarbe, d.h., sie
Die Indigotinbottle. Zusammenfassung. Einordnung in den Unterricht 1
 V22 Die Indigotinbottle Fach Klasse Überthema Feinthema Zeit Chemie Q4 Farbstoffe Redoxindikator 20 Minuten Zusammenfassung Bei dem Versuch wird ein Redoxsystem erzeugt, dass seine Farbe ändert, je nachdem
V22 Die Indigotinbottle Fach Klasse Überthema Feinthema Zeit Chemie Q4 Farbstoffe Redoxindikator 20 Minuten Zusammenfassung Bei dem Versuch wird ein Redoxsystem erzeugt, dass seine Farbe ändert, je nachdem
» Konzepte, Fakten, Gliederung
 Kapitel 4: Funktionelle π-systeme Farbenchemie rganische Farbstoffe» Konzepte, Fakten, Gliederung Das elektromagnetische Spektrum Wechselwirkung zwischen Materie und elektromagnetischer Strahlung. Das
Kapitel 4: Funktionelle π-systeme Farbenchemie rganische Farbstoffe» Konzepte, Fakten, Gliederung Das elektromagnetische Spektrum Wechselwirkung zwischen Materie und elektromagnetischer Strahlung. Das
Mangan: Ein Chamäleon unter den Metallionen RG 1: RG 2: RG 3: + + +
 Chemie-Übung: Redoxreaktionen (Wiederholung) Datum: Mangan: Ein Chamäleon unter den Metallionen Material: Chemikalien: 3 RG, RG-Ständer, Pipette, Becherglas Kaliumpermanganat-Lsg. (KMnO 4 ), Salzsäure,
Chemie-Übung: Redoxreaktionen (Wiederholung) Datum: Mangan: Ein Chamäleon unter den Metallionen Material: Chemikalien: 3 RG, RG-Ständer, Pipette, Becherglas Kaliumpermanganat-Lsg. (KMnO 4 ), Salzsäure,
UV-Vis Spektroskopie. Praktikum Analytische Chemie I (WS 2013/14)
 UV-Vis Spektroskopie Chromophore Chromophore Welche Chromophore sind bekannt und welche elektronischen Übergänge wären möglich. Welche Systeme lassen sich besonders gut beobachten Erkennen von Chromophoren
UV-Vis Spektroskopie Chromophore Chromophore Welche Chromophore sind bekannt und welche elektronischen Übergänge wären möglich. Welche Systeme lassen sich besonders gut beobachten Erkennen von Chromophoren
Versuchsprotokoll. Gummibärchen-Indikator
 Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 19.12.08 Schulversuche Assistentin: Katrin Hohmann Versuchsprotokoll Gummibärchen-Indikator Gruppe
Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 19.12.08 Schulversuche Assistentin: Katrin Hohmann Versuchsprotokoll Gummibärchen-Indikator Gruppe
Farbigkeit und Theorien
 Farbigkeit und Theorien Farbigkeit von Dinah Shafry Licht ist elektromagnetische Strahlung, bei der jede Farbe eine einzelne Wellenlänge besitzt, die als unterschiedliche Farben vom Menschen wahrgenommen
Farbigkeit und Theorien Farbigkeit von Dinah Shafry Licht ist elektromagnetische Strahlung, bei der jede Farbe eine einzelne Wellenlänge besitzt, die als unterschiedliche Farben vom Menschen wahrgenommen
A B - AB K D. Elektrolytische Dissoziation. AB(aq) Stoffe, die in Lösung Ionen bilden, heißen Elektrolyte. Es gilt das Massenwirkungsgesetz
 Elektrolytische Dissoziation AB(aq) A + (aq) + B - (aq) Stoffe, die in Lösung Ionen bilden, heißen Elektrolyte. Es gilt das Massenwirkungsgesetz K D A B - AB K D : Dissoziationskonstante Dissoziation ist
Elektrolytische Dissoziation AB(aq) A + (aq) + B - (aq) Stoffe, die in Lösung Ionen bilden, heißen Elektrolyte. Es gilt das Massenwirkungsgesetz K D A B - AB K D : Dissoziationskonstante Dissoziation ist
π-bindung: 264 kj/mol (s c hw äc he r als die σ-bindung!)
 . Alkene (lefine) Funktionelle Gruppe: C=C-Doppelbindung π-bindung: 264 kj/mol (s c hw äc he r als die σ-bindung!) => C=C-Doppelbindung: 612 kj/mol sp 2 -hybridisierung σ-bindung: 348 kj/mol Wieder eine
. Alkene (lefine) Funktionelle Gruppe: C=C-Doppelbindung π-bindung: 264 kj/mol (s c hw äc he r als die σ-bindung!) => C=C-Doppelbindung: 612 kj/mol sp 2 -hybridisierung σ-bindung: 348 kj/mol Wieder eine
Skriptum zur Laborübung Wasser und Umwelt
 Skriptum zur Laborübung Wasser und Umwelt 1 1 Wasser und Umwelt 2 1.1 Allgemein Tabelle 2.1: Inhaltsstoffe natürlicher Gewässer (Quelle: L. A. Hütter, Wasser und Wasseruntersuchung, Salle und Sauerländer)
Skriptum zur Laborübung Wasser und Umwelt 1 1 Wasser und Umwelt 2 1.1 Allgemein Tabelle 2.1: Inhaltsstoffe natürlicher Gewässer (Quelle: L. A. Hütter, Wasser und Wasseruntersuchung, Salle und Sauerländer)
2 Grundlagen der Photochemie
 folie191 2 Grundlagen der Photochemie 2.1 UV-Vis-Absorptionsspektren in organischen Verbindungen; Jablonski-Diagramm, Franck-Condon-Prinzip, Emissionsspektren (Fluoreszens, Phosphoreszens, Stokes-Verschiebung)
folie191 2 Grundlagen der Photochemie 2.1 UV-Vis-Absorptionsspektren in organischen Verbindungen; Jablonski-Diagramm, Franck-Condon-Prinzip, Emissionsspektren (Fluoreszens, Phosphoreszens, Stokes-Verschiebung)
Schulversuchspraktikum. Elena von Hoff. Sommersemester Klassenstufen 11 & 12. Farbstoffe
 Schulversuchspraktikum Elena von Hoff Sommersemester 2014 Klassenstufen 11 & 12 Farbstoffe 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Diese Unterrichtseinheit für die Klassen
Schulversuchspraktikum Elena von Hoff Sommersemester 2014 Klassenstufen 11 & 12 Farbstoffe 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Diese Unterrichtseinheit für die Klassen
N N. Chinolin. Pyridin. Imidazol
 6. eterocyclische Verbindungen 51 Als carbocyclisch bezeichnet man ingmoleküle, deren inge nur aus Kohlenstoffatomen aufgebaut sind. In den sogenannten eterocyclen ist mindestens ein Kohlenstoff des ings
6. eterocyclische Verbindungen 51 Als carbocyclisch bezeichnet man ingmoleküle, deren inge nur aus Kohlenstoffatomen aufgebaut sind. In den sogenannten eterocyclen ist mindestens ein Kohlenstoff des ings
LAF-Wiederholungsklausur. Wintersemester 2011/12
 LAF-Wiederholungsklausur Wintersemester 2011/12 Name/Vorname:... Matrikelnummer:... Geburtsdatum:... A1 A2 A3 A4 A5 A6 A7 A8 A9 A10 A11 X X X X Schreiben Sie bitte gut leserlich! Mit Bleistift geschriebene
LAF-Wiederholungsklausur Wintersemester 2011/12 Name/Vorname:... Matrikelnummer:... Geburtsdatum:... A1 A2 A3 A4 A5 A6 A7 A8 A9 A10 A11 X X X X Schreiben Sie bitte gut leserlich! Mit Bleistift geschriebene
CHE 102.1: Grundlagen der Chemie - Organische Chemie
 CE 102.1: Grundlagen der Chemie - rganische Chemie Prof Dr. E. Landau und Prof. Dr. J. A. obinson 6. eterocyclische Verbindungen Als carbocyclisch bezeichnet man ingmoleküle, deren inge nur aus Kohlenstoffatomen
CE 102.1: Grundlagen der Chemie - rganische Chemie Prof Dr. E. Landau und Prof. Dr. J. A. obinson 6. eterocyclische Verbindungen Als carbocyclisch bezeichnet man ingmoleküle, deren inge nur aus Kohlenstoffatomen
Schulversuch (Gruppe 6/Assistentenversuch): Vergleich aliphatischer Alkohole und Phenole
 Philipps-Universität Marburg 26.11.2008 rganisch-chemisches Praktikum für das Lehramt (LA) Torsten Lasse Leitung: Dr. P. Reiß WS 2008/09 Assistentin: Beate Abé Schulversuch (Gruppe 6/Assistentenversuch):
Philipps-Universität Marburg 26.11.2008 rganisch-chemisches Praktikum für das Lehramt (LA) Torsten Lasse Leitung: Dr. P. Reiß WS 2008/09 Assistentin: Beate Abé Schulversuch (Gruppe 6/Assistentenversuch):
Analytische Chemie. B. Sc. Chemieingenieurwesen
 Analytische Chemie B. Sc. Chemieingenieurwesen 6. Februar 2018, 8.30 bis 11.30 Uhr Dr. Stephanie Möller und Prof. Dr. Thomas Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe
Analytische Chemie B. Sc. Chemieingenieurwesen 6. Februar 2018, 8.30 bis 11.30 Uhr Dr. Stephanie Möller und Prof. Dr. Thomas Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe
Licht und Farbe - Dank Chemie!
 Licht und Farbe - Dank Chemie! Folie 1 Was verstehen wir eigentlich unter Licht? Licht nehmen wir mit unseren Augen wahr Helligkeit: Farbe: Schwarz - Grau - Weiß Blau - Grün - Rot UV-Strahlung Blau Türkis
Licht und Farbe - Dank Chemie! Folie 1 Was verstehen wir eigentlich unter Licht? Licht nehmen wir mit unseren Augen wahr Helligkeit: Farbe: Schwarz - Grau - Weiß Blau - Grün - Rot UV-Strahlung Blau Türkis
Versuch 1: Rotkohl oder Blaukraut? Die Farbe des Rotkohlfarbstoffes in Abhängigkeit vom ph-wert
 1 Versuch 1: Rotkohl oder Blaukraut? Die Farbe des Rotkohlfarbstoffes in Abhängigkeit vom ph-wert Durchführung: Rotkohlblätter werden in kleine Streifen geschnitten und einige Minuten ausgekocht. Anschließend
1 Versuch 1: Rotkohl oder Blaukraut? Die Farbe des Rotkohlfarbstoffes in Abhängigkeit vom ph-wert Durchführung: Rotkohlblätter werden in kleine Streifen geschnitten und einige Minuten ausgekocht. Anschließend
SÄUREN, BASEN, ph-wert
 8. Einheit: SÄUREN, BASEN, ph-wert Sebastian Spinnen, Ingrid Reisewitz-Swertz 1 von 23 ZIELE DER HEUTIGEN EINHEIT Am Ende der Einheit Säuren, Basen, ph-wert.. können Sie die Begriffe Säure und Base in
8. Einheit: SÄUREN, BASEN, ph-wert Sebastian Spinnen, Ingrid Reisewitz-Swertz 1 von 23 ZIELE DER HEUTIGEN EINHEIT Am Ende der Einheit Säuren, Basen, ph-wert.. können Sie die Begriffe Säure und Base in
Licht und Farbe mit Chemie
 Licht und Farbe mit Chemie Folie 1 Was verstehen wir eigentlich unter Licht? Licht nehmen wir mit unseren Augen wahr Helligkeit: Farbe: Schwarz - Grau - Weiß Blau - Grün - Rot UV-Strahlung Blau Türkis
Licht und Farbe mit Chemie Folie 1 Was verstehen wir eigentlich unter Licht? Licht nehmen wir mit unseren Augen wahr Helligkeit: Farbe: Schwarz - Grau - Weiß Blau - Grün - Rot UV-Strahlung Blau Türkis
Mehrprotonige Säuren (z.b. H 2 SO 4 )
 Mehrprotonige Säuren (z.b. H SO 4 ) Mehrprotonige Säuren protolysieren stufenweise. Jede Stufe hat eine eigene Säurekonstante, deren Werte von Stufe zu Stufe kleiner werden (die Protolyse wird immer unvollständiger).
Mehrprotonige Säuren (z.b. H SO 4 ) Mehrprotonige Säuren protolysieren stufenweise. Jede Stufe hat eine eigene Säurekonstante, deren Werte von Stufe zu Stufe kleiner werden (die Protolyse wird immer unvollständiger).
4. Die Bedeutung der Endgruppen am Beispiel der Phenylpolyenale und ihrer Farbsalze
 4. Die Bedeutung der Endgruppen am Beispiel der Phenylpolyenale und ihrer Farbsalze 4.1 Lernziele 1. Sie können Absorptionsmessungen von Phenylpolyenalen durchführen. 2. Sie stellen die Farbsalze der Phenylpolyenale
4. Die Bedeutung der Endgruppen am Beispiel der Phenylpolyenale und ihrer Farbsalze 4.1 Lernziele 1. Sie können Absorptionsmessungen von Phenylpolyenalen durchführen. 2. Sie stellen die Farbsalze der Phenylpolyenale
Zweite Klausur zur Vorlesung Grundlagen der Organischen Chemie
 Prof. Dr. Jens Christoffers 28. Februar 2011 Universität ldenburg Zweite Klausur zur Vorlesung Grundlagen der rganischen Chemie für Studierende der Chemie (Fach-Bachelor und Zwei-Fächer-Bachelor, Wert:
Prof. Dr. Jens Christoffers 28. Februar 2011 Universität ldenburg Zweite Klausur zur Vorlesung Grundlagen der rganischen Chemie für Studierende der Chemie (Fach-Bachelor und Zwei-Fächer-Bachelor, Wert:
Chemisches Grundpraktikum für Ingenieure. 2. Praktikumstag. Andreas Rammo
 Chemisches Grundpraktikum für Ingenieure. Praktikumstag Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de Das chemische Gleichgewicht Säure-Base-Reaktionen
Chemisches Grundpraktikum für Ingenieure. Praktikumstag Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de Das chemische Gleichgewicht Säure-Base-Reaktionen
+ MnO MnO 3. Oxidierbarkeit primärer, sekundärer und tertiärer Alkohole. Chemikalien. Materialien
 DaChS xidierbarkeit primärer, sekundärer und tertiärer Alkohole 1 Versuch Nr. 005 xidierbarkeit primärer, sekundärer und tertiärer Alkohole C 3 Mn - 4 (violett) 3 C Mn 2 (braun) 3 C C 3 Mn - 4 (violett)
DaChS xidierbarkeit primärer, sekundärer und tertiärer Alkohole 1 Versuch Nr. 005 xidierbarkeit primärer, sekundärer und tertiärer Alkohole C 3 Mn - 4 (violett) 3 C Mn 2 (braun) 3 C C 3 Mn - 4 (violett)
Farbstoffe Einleitung
 Einleitung Farben, die aus Mineralien gewonnen wurden, wie die Mineralfarben Mennige, Zinnober oder Malachit dienten bereits in der Altsteinzeit für öhlenmalereien. Diese Farben bestehen aus anorganischen
Einleitung Farben, die aus Mineralien gewonnen wurden, wie die Mineralfarben Mennige, Zinnober oder Malachit dienten bereits in der Altsteinzeit für öhlenmalereien. Diese Farben bestehen aus anorganischen
Azofarbstoffe Azofarbstoffe enthalten als Chromophor die beiderseits aromatisch gebundene Azogruppe.
 2. Azofarbstoffe 2.1 Azofarbstoffe Azofarbstoffe enthalten als Chromophor die beiderseits aromatisch gebundene Azogruppe. aromatische Verbindung -= - aromatische Verbindung Sie stellen mengenmäßig die
2. Azofarbstoffe 2.1 Azofarbstoffe Azofarbstoffe enthalten als Chromophor die beiderseits aromatisch gebundene Azogruppe. aromatische Verbindung -= - aromatische Verbindung Sie stellen mengenmäßig die
