eine besondere Herausforderung für die Besonderen Therapierichtungen!?
|
|
|
- Lars Junge
- vor 7 Jahren
- Abrufe
Transkript
1 Elektronischer Datenfluss eine besondere Herausforderung für die Besonderen Therapierichtungen!? Dr. Martin Diller Martin Diller BfArM im Dialog Seite 1
2 Inhaltsverzeichnis 1. Elektronischer Dokumenten- und Datenfluss 2. Elektronisches Antragsformular (electronic Application Form, eaf) 3. Angleichung der Antragsbearbeitung nationaler Anträge auf Zulassungen oder Registrierungen an das DC-Verfahren 4. Beispiel für den elektronischen Datenfluss: Statistik nationaler Änderungen bestehender Zulassungen und Registrierungen Martin Diller BfArM im Dialog Seite 2
3 Elektronischer Daten- und Dokumentenfluss Elektronische Unterlagen Wechsel zum elektronischen Format Einreichungsweg Elektronischer Lifecycle Papierlose Einreichung Technische Validierung Einreichungswege und Datenspeichersysteme Common European Submission Platform CESP HMA esubmission Roadmap Martin Diller BfArM im Dialog Seite 3
4 Elektronischer Datenfluss Elektronische Unterlagen Einreichung nach ectd-standard (ectd = electronic Common Technical Document) PDF-Dateien mit zusammenhängenden Inhaltsverzeichnis (Backbone) Non-eCTD-eSubmission (NeeS) Gleiche Datei- und Verzeichnisstruktur wie ectd Kein Lifecycle Management Vorstufe zum ectd Electronic Application Form (eaf, elektronisches Antragsformular) Einzelne Dateien (z. B. PDF-, MS-Office-Dateien) Gescannte Unterlagen (z. B. Abbildungen) s (bzw. elektronische Korrespondenz) Unterlagen zu Educational Material Martin Diller BfArM im Dialog Seite 4
5 Elektronischer Datenfluss Wechsel zum elektronischen Format Wechsel von Papier zu NeeS jederzeit im Lifecycle eines Arzneimittels immer vor oder nach einer regulatorischen Aktivität Wechsel von Papier oder NeeS zu ectd jederzeit im Lifecycle eines Arzneimittels immer vor oder nach einer regulatorischen Aktivität Start mit einer Sequenz-Verwaltung Einreichung einer sog. Baseline (vorzugsweise Module 3) jederzeit möglich Einmal in ectd gewechselt muss dieses Format beibehalten werden Martin Diller BfArM im Dialog Seite 5
6 Elektronischer Lifecycle Vorteile und Anforderungen Vorteile: Einfachere Nutzung elektronischer Dokumente und Dateien (Suchen, elektronisches Inhaltsverzeichnis, Hyperlinks, Bookmarks, Metadaten, etc.) Verknüpfung von Informationen innerhalb eines Dokument oder zwischen Dokumenten innerhalb eines Dossiers Versionskontrolle (Sequenz) Pflege der Unterlagen wird erleichtert Anforderungen: Standards sind vorgegeben (z. B. Struktur, Dateiformate) Computerprogramme zur Verwaltung der esubmissions notwendig Martin Diller BfArM im Dialog Seite 6
7 Elektronischer Datenfluss Papierlose Einreichung Seit 2010 papierlose Einreichung von Neuanträgen und Änderungsanzeigen Seit 2012 Einreichungen über CESP-Portal möglich Verwaltungspraxis seit August 2013 Verzicht auf (zusätzliche) Einreichung in Papierform für alle Antragsverfahren bei Nutzung des Pharm.Net.Bund- oder CESP-Portals bei Nutzung elektronischer Speichermedien (CD/DVD) Papierform nur erforderlich, wenn zusätzliche Unterlagen ausschließlich auf dem Postweg eingereicht werden können (z. B. unterschriebene Unterlagen) Martin Diller BfArM im Dialog Seite 7
8 Elektronischer Datenfluss Technische Validierung Technische Validierung BfArM überprüft die technischen Spezifikation der elektronisch übermittelten Unterlagen anhand der veröffentlichten Spezifikationsanforderungen. Antrag wird erst nach einer positiv abgeschlossenen, technischen Validierung als gestellt gewertet. Danach Start der formalen und inhaltlichen Validierung des Antrages. Bestätigung an den Antragsteller über Start der formalen und inhaltlichen Validierung. Martin Diller BfArM im Dialog Seite 8
9 Elektronischer Datenfluss Einreichungswege und Datenspeichersysteme e-dokumente CESP BfArM AMIS weitere ectd NeeS eaf Dateien Working Documents Eudralink Zip-Container Pharm.Net. Bund VBS DMS ASMF PSUR Martin Diller BfArM im Dialog Seite 9
10 Elektronischer Datenfluss Common European Submission Platform (CESP) Ziel: Übertragung elektronisch vorliegender Dokumentationen vom Antragsteller zu den Behörden als Ersatz für die Einreichung von Papier- bzw. auf CD/DVD gespeicherten Anträgen per Kurierdienst Anforderung: EU weit nur eine Anlaufstelle zur Einreichung elektronischer Dokumente, unabhängig von Verfahrenstyp (dezentral, national, etc.), unabhängig von Format (ectd, NeeS, unstrukturierte Dateisammlungen), bei einer oder mehreren regulatorischen Behörden. 2013: Produktivbetrieb des CESP-Portals bei irischen Behörde 2015: Fast CESP-Einreichung im BfArM (2014: , 2013: 5600) Martin Diller BfArM im Dialog Seite 10
11 Elektronischer Datenfluss CESP Einreichungsfehler CESP Lieferung ohne Notification . Ohne keine Bearbeitung. Angaben im Delivery File sind nicht vollständig oder nicht korrekt. Anreicherung fehlerhafter Information in der internen Kommunikation In Zukunft Verwendung des elek. Antragsformular als Datenquelle (CESSP). Im ectd oder NeeS ist die Bezeichnung des Antragformulars nicht eindeutig. Dadurch werden unnötige Dateien beigefügt. Zip Container nicht lesbar. Aktuell nur noch wenige Fälle Nachforderung beim Antragsteller Martin Diller BfArM im Dialog Seite 11
12 Elektronische Einreichung HMA esubmission Roadmap bis 2018 esubmission Roadmap Timelines (Auszug) reflecting final adopted version 1.0 dated Nov 2014 Ongoing/optional Mandatory draft esub Roadmap NCA & industry survey esub Roadmap Adoption Use of ectd v.4 Use of NeeS and ectd in DCP and MRP (human) All submissions in CP (human) in ectd ectd New MAA in DCP (human) in ectd All submissions in MRP (human) New MAA in DCP and MRP (human) in ectd All other MRP submissions (human) All submissions in CP, DCP and MRP (human) in ectd egateway (CP) (human and vet) egateway (CP, human) CESP (human and vet) eaf Use of eaf in all procedures (human and vet) CESP in CP in all other procedures Use of PSUR Repository for CAPs and NAPs PSUR (human) Single submission portal - combined CESP/Gateway in CP (human) Single submission portal - combined CESP/Gateway in all other procedures (human and vet) CESSP eaf in all procedures (human and vet) Single Submission Portal with integration of eaf for all submissions (human and vet) Use of PSUR Repository for all CAPs and NAPs (human) Martin Diller BfArM im Dialog Seite 12
13 Elektronisches Antragsformular electronic Application Form (eaf) Geltungsbereich Ausnahmen Bekanntmachung des BfArM Grundlegender Wechsel PDF-Formular (Beispiele) Besonderheiten für hom. Zulassungen Martin Diller BfArM im Dialog Seite 13
14 Elektronisches Antragsformular Geltungsbereich Grundlage für das eaf ist die gemeinsame Roadmap der HMA und EMA 2014 Seit ist das eaf in Europa verpflichtend für Anträge auf Zulassung Registrierung traditioneller pflanzlicher Arzneimittel nach 39a-d AMG Verlängerung der Zulassung oder Registrierung nach 38 AMG Variation gemäß Variation Regulation Dies gilt für DCP und MRP und deren Folgeverfahren Nationale Anträge und deren Folgeverfahren Das eaf wird zentral von der EMA bereit gestellt und gepflegt Martin Diller BfArM im Dialog Seite 14
15 Elektronisches Antragsformular Geltungsbereich: Ausnahmen Ausgenommen von der Verpflichtung sind bislang: Anträge auf Registrierung nach 38 AMG Anträge auf Verlängerung der Registrierung nach 39 (2c) AMG Anträge auf Zulassung oder Verlängerung parallel importierter Arzneimittel Pharm.Net.Bund-Portal Nationale Änderungsanzeigen nach 29 AMG (Änderungstatbestände unterliegen nicht der Variation Regulation) Anzeige einer Nutzung oder der Änderung von genutzten Standardzulassungen gemäß 67 (5) AMG Martin Diller BfArM im Dialog Seite 15
16 Elektronisches Antragsformular Bekanntmachung BfArM Martin Diller BfArM im Dialog Seite 16
17 Elektronisches Antragsformular Grundlegender Wechsel Jetzt PDF-Formular mit Adobe Forms Katalog Auswahlfelder Internet Zugriff auf die EUTCT Kataloge erforderlich. Fehlende Katalogeinträge müssen neu beantragt werden. Abstimmung mit nationalen Katalogen ist zwingend erforderlich. eaf und die Option, Daten von dort zu exportieren, ermöglichen eine automatisierte Prozessunterstützung, die Vernetzung der Informationen, eine bessere Datenqualität, eine Reduzierung des Aufwandes in Erfassung und Prüfung. Martin Diller BfArM im Dialog Seite 17
18 Elektronisches Antragsformular PDF-Formular Vers. 19 Martin Diller BfArM im Dialog Seite 18
19 Elektronisches Antragsformular PDF-Formular: Antragsart Martin Diller BfArM im Dialog Seite 19
20 Elektronisches Antragsformular Formular: Arzneimittelbezeichnung und ATC-Code Martin Diller BfArM im Dialog Seite 20
21 Elektronisches Antragsformular Besonderheiten für homöopathische Zulassungen Nationale Anträge auf homöopathische Zulassungen sind mit dem elektronischen Antragsformular zu stellen. Antragsart (1.4.5): Art. 10a (well-estalished use) ATC-Code (2.1.3): keine Angaben oder V60 sofern vorhanden Angaben zu Darreichungsform, Art der Anwendung, etc. sind ggf. noch nicht im EMA-Katalog hinterlegt (change request). Technische Fehler für diese Eingaben sollten ignoriert werden. Martin Diller BfArM im Dialog Seite 21
22 Angleichung der Antragsbearbeitung nationaler Anträge auf Zulassungen oder Registrierungen an das DC-Verfahren Bekanntmachung Übersicht Neuerungen Bewertungsbericht Bescheidmaske Martin Diller BfArM im Dialog Seite 22
23 Angleichung der Bearbeitung an das DCP Bekanntmachung Martin Diller BfArM im Dialog Seite 23
24 Angleichung der Bearbeitung an das DCP Übersicht der Neuerungen Prozess-Schritt Bisher Neu Antrag & Validierung Formale/inhaltliche Validierung Formale/inhaltliche Validierung Einverständniserklärung elektronische Kommunikation per 1. Phase Bis zu 5 Stellungnahmen der beteiligten Teildisziplinen Mängelschreiben mit Mängelpunkten der Teildisziplinen 6 Monate Mängelbeseitigung Mängelbeseitigung PU Bewertungsbericht aller beteiligten Teildisziplinen mit abgestimmter Mängelliste Ausschließlich -Versand 6 Monate Mängelbeseitigung Beantwortung der Mängelliste Beantwortung der Mängelliste elektronische Einreichung Aktualisierte informative Texte (als Working Documents) Bescheidmaske im Entwurf 2. Phase Prüfung der Mängelbeseitigung Entscheidung über Antrag Überarbeitung Bewertungsbericht Entscheidung über Antrag Verfahrensabschluss Bescheidfertigung Bescheidfertigung auf Grundlage der Bescheidmaske Martin Diller BfArM im Dialog Seite 24
25 Angleichung der Bearbeitung an das DCP Bewertungsbericht Aufbau des Bewertungsberichtes analog EU- Template für Overview and List of Questions in den dezentralen EU- Verfahren Martin Diller BfArM im Dialog Seite 25
26 Angleichung der Bearbeitung an das DCP Bescheidmaske Einheitliche Bescheidmaske für rein nationale und dezentrale EU-Verfahren Entwurf ausgefüllt von PU gemeinsam mit Unterlagen zur Mängelbeseitigung an das BfArM Martin Diller BfArM im Dialog Seite 26
27 Beispiel für den elektronischen Datenfluss: Statistik nationaler Änderungen bestehender Zulassungen und Registrierungen Zuständigkeiten Abteilung 4 Abschlüsse Abteilung 4 ( Quartal) Martin Diller BfArM im Dialog Seite 27
28 Änderungen und Variation national Zuständigkeit Abteilung 4 Alle Änderungen nach 29, 39 und 39d AMG Ausgenommen die Anzeigen, die keiner fachlich-inhaltlichen Bewertung durch die Zulassungsabteilungen bedürfen (z. B. Adressänderungen) Nationale Variations und EU-Variations Typ IB Kategorie B Typ II Alle genannten Änderungen werden in Abt. 4 inhaltlich bewertet, administrativ bearbeitet und abgeschlossen. Fachlich-inhaltliche Bewertung von Änderung der Arzneimittelbezeichnung bei Bedarf Martin Diller BfArM im Dialog Seite 28
29 Änderungen und Variation national Abschlüsse Abteilung 4 ( Quartal) Jahr Gesamt ÄA 29 gesamt ÄA 29 zustimmpfl. Var. nat. gesamt Var. nat. Typ II k. A k. A (22%) (10%) (31%) (5%) (33%) 2016 (Q1) (11%) (45%) Martin Diller BfArM im Dialog Seite 29
30 Vielen Dank für Ihre Aufmerksamkeit! Kontakt Bundesinstitut für Arzneimittel und Medizinprodukte Abteilung 4 Kurt-Georg-Kiesinger-Allee Bonn Ansprechpartner Martin Diller Martin.Diller@bfarm.de Tel. +49 (0) Fax +49 (0) Martin Diller BfArM im Dialog Seite 30
BVL / BfT Info Tag. Elektronische Einreichung von Zulassungsunterlagen
 BVL / BfT Info Tag Elektronische Einreichung von Zulassungsunterlagen BVL / BfT Info Tag Übersicht Grundlage Entwicklung der elektronischen Einreichung im BVL VNeeS Electronic Application Forms (eaf) Was
BVL / BfT Info Tag Elektronische Einreichung von Zulassungsunterlagen BVL / BfT Info Tag Übersicht Grundlage Entwicklung der elektronischen Einreichung im BVL VNeeS Electronic Application Forms (eaf) Was
Elektronische Einreichung von Zulassungsunterlagen - Erfahrungen der Industrie -
 Elektronische Einreichung von Zulassungsunterlagen - Erfahrungen der Industrie - Dr. Christine Dürrwald BVL / BfT Info-Tag Berlin, 16.11.2015 Was umfasst elektronische Einreichung? 1. Erstellung elektronischer
Elektronische Einreichung von Zulassungsunterlagen - Erfahrungen der Industrie - Dr. Christine Dürrwald BVL / BfT Info-Tag Berlin, 16.11.2015 Was umfasst elektronische Einreichung? 1. Erstellung elektronischer
Elektronische Einreichung von Zulassungsunterlagen Erfahrungen der Industrie
 Elektronische Einreichung von Zulassungsunterlagen Erfahrungen der Industrie Dr. Stephan Forderkunz BVL / BfT Info-Tag, Berlin, 29.11.2012 ein immer wiederkehrendes Thema November 2008: BfT /BVL Info-Tag
Elektronische Einreichung von Zulassungsunterlagen Erfahrungen der Industrie Dr. Stephan Forderkunz BVL / BfT Info-Tag, Berlin, 29.11.2012 ein immer wiederkehrendes Thema November 2008: BfT /BVL Info-Tag
BVL / BfT Info Tag Elektronische Einreichung von Zulassungsunterlagen
 BVL / BfT Info Tag Elektronische Einreichung von Zulassungsunterlagen Dr. Gabriele Schweyen 29. November 2012 Seite 1 Grundlagen HMA Beschluss von 2007 ab 1. Januar 2010 E-Einreichung möglich Papier Einreichung
BVL / BfT Info Tag Elektronische Einreichung von Zulassungsunterlagen Dr. Gabriele Schweyen 29. November 2012 Seite 1 Grundlagen HMA Beschluss von 2007 ab 1. Januar 2010 E-Einreichung möglich Papier Einreichung
Aktuelle europäische Entwicklungen HMPWG und Arzneibuch
 Aktuelle europäische Entwicklungen HMPWG und Arzneibuch Dr. Christiane Kirchner Chr. Kirchner BfArM im Dialog 26.04.2016 Seite 1 Übersicht 1. Einleitung 2. Homeopathic Medicinal Products Working Group
Aktuelle europäische Entwicklungen HMPWG und Arzneibuch Dr. Christiane Kirchner Chr. Kirchner BfArM im Dialog 26.04.2016 Seite 1 Übersicht 1. Einleitung 2. Homeopathic Medicinal Products Working Group
Variation Regulation (EG) Nr. 1234/2008. Praktische Erfahrungen aus Firmensicht. PEI im Dialog 11. Mai Heidrun Gardyan Sanofi Pasteur MSD GmbH
 Variation Regulation (EG) Nr. 1234/2008 Praktische Erfahrungen aus Firmensicht PEI im Dialog 11. Mai 2010 Heidrun Gardyan Sanofi Pasteur MSD GmbH 1 Produktportfolio von Sanofi Pasteur MSD Impfstoffe national
Variation Regulation (EG) Nr. 1234/2008 Praktische Erfahrungen aus Firmensicht PEI im Dialog 11. Mai 2010 Heidrun Gardyan Sanofi Pasteur MSD GmbH 1 Produktportfolio von Sanofi Pasteur MSD Impfstoffe national
AGES Gespräch Status und Ausblick nationaler und europäischer IT-Maßnahmen
 AGES Gespräch Status und Ausblick nationaler und europäischer IT-Maßnahmen AGES Medizinmarktaufsicht 27.11.2013 Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH AGENDA Thema Begrüßung
AGES Gespräch Status und Ausblick nationaler und europäischer IT-Maßnahmen AGES Medizinmarktaufsicht 27.11.2013 Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH AGENDA Thema Begrüßung
Verbändegespräch esubmission Bonn, 13.05.2014
 Verbändegespräch esubmission Bonn, 13.05.2014 Übersicht zu den Fragen Zulassung 1. Strategie des BfArM zu esubmission Fragen 1-6 im Kontext der EU-Strategie 2. CESP Fragen 7-22 3. AMG-EV Fragen 23-25 4.
Verbändegespräch esubmission Bonn, 13.05.2014 Übersicht zu den Fragen Zulassung 1. Strategie des BfArM zu esubmission Fragen 1-6 im Kontext der EU-Strategie 2. CESP Fragen 7-22 3. AMG-EV Fragen 23-25 4.
Summe abgeschlossene Vorgänge
 Bearbeitungsstatistik: Übersicht - ZULASSUNGS-/REGISTRIERUNGSANTRÄGE 301 Antragseingänge national Zulassungen/Registrierungen 4 2 2 5 1 1 0 2 0 1 2 4 24 dezentral (MRP+DCP) Zulassungen 7 2 8 2 1 15 4 4
Bearbeitungsstatistik: Übersicht - ZULASSUNGS-/REGISTRIERUNGSANTRÄGE 301 Antragseingänge national Zulassungen/Registrierungen 4 2 2 5 1 1 0 2 0 1 2 4 24 dezentral (MRP+DCP) Zulassungen 7 2 8 2 1 15 4 4
Anforderungen für f r Plasma Master Files
 Anforderungen für f r Plasma Master Files PEI im Dialog Erfahrungen mit der Variation Regulation (EG) Nr. 1234/2008 Johannes Dodt, Gerinnungsprodukte II Susanne Marhold, Gerinnungsprodukte I Langen, 11.
Anforderungen für f r Plasma Master Files PEI im Dialog Erfahrungen mit der Variation Regulation (EG) Nr. 1234/2008 Johannes Dodt, Gerinnungsprodukte II Susanne Marhold, Gerinnungsprodukte I Langen, 11.
Änderungen bei der Meldung einer klinischen Prüfung gemäß MPG
 Änderungen bei der Meldung einer klinischen Prüfung gemäß MPG Dr. Svetlana Seiter Abteilung Klinische Prüfung, Institut Überwachung, AGES MEA AGES Gespräch 25.11.2014 www.ages.at Österreichische Agentur
Änderungen bei der Meldung einer klinischen Prüfung gemäß MPG Dr. Svetlana Seiter Abteilung Klinische Prüfung, Institut Überwachung, AGES MEA AGES Gespräch 25.11.2014 www.ages.at Österreichische Agentur
Klinische Prüfung Umsetzung der EU Regulation 536/2014 aus Sicht der Bundesoberbehörde
 Klinische Prüfung Umsetzung der EU Regulation 536/2014 aus Sicht der Bundesoberbehörde Dr. Aylin Mende Absender Titel 14.10.2015 Seite 1 Was kommt mit der Verordnung auf uns zu - kürzere Fristen - Änderung
Klinische Prüfung Umsetzung der EU Regulation 536/2014 aus Sicht der Bundesoberbehörde Dr. Aylin Mende Absender Titel 14.10.2015 Seite 1 Was kommt mit der Verordnung auf uns zu - kürzere Fristen - Änderung
Klinische Prüfung von Arzneimitteln: Öffentliche Informationen in PharmNet.Bund Clinical Trials (CT)
 Klinische Prüfung von Arzneimitteln: Öffentliche Informationen in PharmNet.Bund Clinical Trials (CT) Nutzertreffen, Köln 8. November 2011 Dr. Barbara Höfgen, Dr. Irina Bosman PharmNet.Bund-CT Gesetzliche
Klinische Prüfung von Arzneimitteln: Öffentliche Informationen in PharmNet.Bund Clinical Trials (CT) Nutzertreffen, Köln 8. November 2011 Dr. Barbara Höfgen, Dr. Irina Bosman PharmNet.Bund-CT Gesetzliche
PEI im Dialog. Erfahrungen von CSL Behring mit der Variation Regulation EG/1234/2008 PMF 2. Schritt
 PEI im Dialog Erfahrungen von CSL Behring mit der Variation Regulation EG/1234/2008 PMF 2. Schritt Dr. Dieter Brazel 11. Mai 2010 Paul-Ehrlich-Institut, Langen 1 EG/1234/2008 - Start im Januar 2010 AIFA
PEI im Dialog Erfahrungen von CSL Behring mit der Variation Regulation EG/1234/2008 PMF 2. Schritt Dr. Dieter Brazel 11. Mai 2010 Paul-Ehrlich-Institut, Langen 1 EG/1234/2008 - Start im Januar 2010 AIFA
Erfahrungen mit der neuen Variation Regulation
 Erfahrungen mit der neuen Variation Regulation Angela Schütz, Alexandra Beranek AGES PharmMed, Institut Zulassung & Lifecycle Management AGES Gespräch Am Pulsschlag des Arzneimittelwesens Das Institut
Erfahrungen mit der neuen Variation Regulation Angela Schütz, Alexandra Beranek AGES PharmMed, Institut Zulassung & Lifecycle Management AGES Gespräch Am Pulsschlag des Arzneimittelwesens Das Institut
Neue Variations-Verordnung was ändert sich?
 Neue Variations-Verordnung was ändert sich? Rechtliche Vorgaben und Erwartungen/Umsetzung Wiebke Godow 4. Dezember 2012 Seite 1 Variations-Verordnung Ziele und Entwicklung Variations-Verordnung gehört
Neue Variations-Verordnung was ändert sich? Rechtliche Vorgaben und Erwartungen/Umsetzung Wiebke Godow 4. Dezember 2012 Seite 1 Variations-Verordnung Ziele und Entwicklung Variations-Verordnung gehört
AGES Gespräch IT Projekt PHAROS
 AGES Gespräch IT Projekt PHAROS AGES Medizinmarktaufsicht 09.09.2014 www.ages.at Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH AGENDA Thema Agenda Presentation External Usergroup
AGES Gespräch IT Projekt PHAROS AGES Medizinmarktaufsicht 09.09.2014 www.ages.at Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH AGENDA Thema Agenda Presentation External Usergroup
Homöopathische und Anthroposophische Arzneimittel - Erfahrungen aus der regulatorischen Praxis -
 Homöopathische und Anthroposophische Arzneimittel - Erfahrungen aus der regulatorischen Praxis - Dr. Christina von der Heidt Christina von der Heidt BfArM im Dialog 26.04.2016 Seite 1 Übersicht Allgemeine
Homöopathische und Anthroposophische Arzneimittel - Erfahrungen aus der regulatorischen Praxis - Dr. Christina von der Heidt Christina von der Heidt BfArM im Dialog 26.04.2016 Seite 1 Übersicht Allgemeine
AGES Gespräch "Elektronische Einreichung"
 AGES Gespräch "Elektronische Einreichung" ectd Handling AGES PharmMed AGES - Gespräch 27 November 2008, Wien Harald Binder AGES OIT, Wien 2 AGES Struktur 3 Elektronische Einreichung Elektronische Einreichungen
AGES Gespräch "Elektronische Einreichung" ectd Handling AGES PharmMed AGES - Gespräch 27 November 2008, Wien Harald Binder AGES OIT, Wien 2 AGES Struktur 3 Elektronische Einreichung Elektronische Einreichungen
Summe abgeschlossene Vorgänge
 Bearbeitungsstatistik: Übersicht - ZULASSUNGS- /REGISTRIERUNGSANTRÄGE 301 Antragseingänge national Zulassungen/Registrierungen 4 0 1 2 0 2 2 2 0 0 3 1 17 dezentral (MRP+DCP) Zulassungen 1 9 13 5 3 7 11
Bearbeitungsstatistik: Übersicht - ZULASSUNGS- /REGISTRIERUNGSANTRÄGE 301 Antragseingänge national Zulassungen/Registrierungen 4 0 1 2 0 2 2 2 0 0 3 1 17 dezentral (MRP+DCP) Zulassungen 1 9 13 5 3 7 11
Summe abgeschlossene Vorgänge
 Bearbeitungsstatistik: Übersicht - ZULASSUNGS- /REGISTRIERUNGSANTRÄGE 301 Antragseingänge national Zulassungen/Registrierungen 0 0 6 0 8 1 1 1 4 0 0 0 21 dezentral (MRP+DCP) Zulassungen 7 14 3 3 10 4 9
Bearbeitungsstatistik: Übersicht - ZULASSUNGS- /REGISTRIERUNGSANTRÄGE 301 Antragseingänge national Zulassungen/Registrierungen 0 0 6 0 8 1 1 1 4 0 0 0 21 dezentral (MRP+DCP) Zulassungen 7 14 3 3 10 4 9
AGES Gespräch IT Projekt PHAROS
 AGES Gespräch IT Projekt PHAROS AGES Medizinmarktaufsicht 06.06.2013 Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH AGENDA Thema Begrüßung und Agenda Zusammenfassung 1. AGES-Gespräch
AGES Gespräch IT Projekt PHAROS AGES Medizinmarktaufsicht 06.06.2013 Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH AGENDA Thema Begrüßung und Agenda Zusammenfassung 1. AGES-Gespräch
- Life-Cycle-Management - Herausforderungen an die pharmazeutische Industrie
 Engagiert Erfahren Erfolgreich - Life-Cycle-Management - Herausforderungen an die pharmazeutische Industrie Dr. Nicole Armbrüster BfArM im Dialog Besondere Therapierichtungen Aktuelle Themen 1 Themenüberblick
Engagiert Erfahren Erfolgreich - Life-Cycle-Management - Herausforderungen an die pharmazeutische Industrie Dr. Nicole Armbrüster BfArM im Dialog Besondere Therapierichtungen Aktuelle Themen 1 Themenüberblick
Pflanzliche Arzneimittel Tradition und Zukunft aus regulatorischer Sicht Prof. Dr. Werner Knöss
 Pflanzliche Arzneimittel Tradition und Zukunft aus regulatorischer Sicht Prof. Dr. Werner Knöss Bundesinstitut für Arzneimittel, Bonn Das BfArM ist ein Bundesinstitut im Geschäftsbereich des Bundesministeriums
Pflanzliche Arzneimittel Tradition und Zukunft aus regulatorischer Sicht Prof. Dr. Werner Knöss Bundesinstitut für Arzneimittel, Bonn Das BfArM ist ein Bundesinstitut im Geschäftsbereich des Bundesministeriums
Checkliste Erstellung Educational Material / Schulungsmaterial (Printmaterialien)
 Checkliste Erstellung Educational Material / Schulungsmaterial (Printmaterialien) Version 1.0, August 2017 I. Formale Vorgaben an das Schulungsmaterial Disclaimer, z.b. Fachkreise:
Checkliste Erstellung Educational Material / Schulungsmaterial (Printmaterialien) Version 1.0, August 2017 I. Formale Vorgaben an das Schulungsmaterial Disclaimer, z.b. Fachkreise:
Einstufung von Änderungen
 Einstufung von Änderungen Mag. Caroline Kleber AGES MEA, Wien AGES-Gespräch, 24. Juni 2014 Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH Aufbau und Zusammenhänge Variation Regulation
Einstufung von Änderungen Mag. Caroline Kleber AGES MEA, Wien AGES-Gespräch, 24. Juni 2014 Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH Aufbau und Zusammenhänge Variation Regulation
DAS PERFEKTE SCHULUNGSMATERIAL AUS SICHT DER PHARMAZEUTISCHEN INDUSTRIE
 DAS PERFEKTE SCHULUNGSMATERIAL AUS SICHT DER PHARMAZEUTISCHEN INDUSTRIE 1 Mara Ernst Referentin Arzneimittelsicherheit Bundesverband der Arzneimittel-Hersteller 2. März 2016 BEHÖRDLICHE VORGABEN Bekanntmachung
DAS PERFEKTE SCHULUNGSMATERIAL AUS SICHT DER PHARMAZEUTISCHEN INDUSTRIE 1 Mara Ernst Referentin Arzneimittelsicherheit Bundesverband der Arzneimittel-Hersteller 2. März 2016 BEHÖRDLICHE VORGABEN Bekanntmachung
Zusammenarbeit zwischen BOB und Ethik-Kommission, Vorstellung des Pilot-Projektes
 Zusammenarbeit zwischen BOB und Ethik-Kommission, Vorstellung des Pilot-Projektes Thomas Sudhop Sudhop Zusammenarbeit zwischen BOB und Ethik-Kommission, Vorstellung des Pilot-Projektes 17.02.2016 Seite
Zusammenarbeit zwischen BOB und Ethik-Kommission, Vorstellung des Pilot-Projektes Thomas Sudhop Sudhop Zusammenarbeit zwischen BOB und Ethik-Kommission, Vorstellung des Pilot-Projektes 17.02.2016 Seite
Mag. Alexander Ertl LCM/REGA
 Mag. Alexander Ertl LCM/REGA AGES Gespräch Wien, 24.06.2014 www.ages.at Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH Überblick Vorstellung CESP Ablauf in der AGES CESP Empfehlungen
Mag. Alexander Ertl LCM/REGA AGES Gespräch Wien, 24.06.2014 www.ages.at Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH Überblick Vorstellung CESP Ablauf in der AGES CESP Empfehlungen
Herausforderungen aus Sicht des BfArM und offene Fragen
 Herausforderungen aus Sicht des BfArM und offene Fragen Dr. Eva Alešík, BfArM Absender Titel 02.03.2016 Seite 1 EudraVigilance (EV): Zeitplan der EMA 2. Quartal 2016: Externe Testung und Pilotphase 3.
Herausforderungen aus Sicht des BfArM und offene Fragen Dr. Eva Alešík, BfArM Absender Titel 02.03.2016 Seite 1 EudraVigilance (EV): Zeitplan der EMA 2. Quartal 2016: Externe Testung und Pilotphase 3.
Übersicht Formerfordernisse für Dokumente / Anträge Overview formal requirements for documents / applications
 Übersicht erfordernisse für Dokumente / Anträge Overview formal requirements for documents / applications Inhalt Diese Übersicht zeigt, welche erfordernisse für Anträge und Dokumente bestehen, die ab 01.03.2014
Übersicht erfordernisse für Dokumente / Anträge Overview formal requirements for documents / applications Inhalt Diese Übersicht zeigt, welche erfordernisse für Anträge und Dokumente bestehen, die ab 01.03.2014
Erweiterung der Variation-Regulation auf rein nationale Zulassungen
 Erweiterung der Variation-Regulation auf rein nationale Zulassungen 15. DGRA Jahreskongress Dr. Michael Horn 21.06.2013 Agenda Rückblick Entwicklung und Angleichung der Änderungssysteme Zweites Gesetz
Erweiterung der Variation-Regulation auf rein nationale Zulassungen 15. DGRA Jahreskongress Dr. Michael Horn 21.06.2013 Agenda Rückblick Entwicklung und Angleichung der Änderungssysteme Zweites Gesetz
Ausbau Swissmedic egovernment Portal
 Swissmedic Regulatory News aus dem Bereich Zulassung 2016 1. Dezember 2016, Stade de Suisse, Bern Ausbau Swissmedic egovernment Portal Heinz Knöpfli, Abteilungsleiter Innovationsmanagement Swissmedic Schweizerisches
Swissmedic Regulatory News aus dem Bereich Zulassung 2016 1. Dezember 2016, Stade de Suisse, Bern Ausbau Swissmedic egovernment Portal Heinz Knöpfli, Abteilungsleiter Innovationsmanagement Swissmedic Schweizerisches
Hinweise zum Verfahren der gegenseitigen Anerkennung (Mutual Recognition Procedure - MRP)
 Hinweise zum Verfahren der gegenseitigen Anerkennung (Mutual Recognition Procedure - MRP) Das BVL in der Funktion als Referenzstaat (RMS) I. Nationale Zulassung Die folgenden Hinweise gelten nur für Präparate,
Hinweise zum Verfahren der gegenseitigen Anerkennung (Mutual Recognition Procedure - MRP) Das BVL in der Funktion als Referenzstaat (RMS) I. Nationale Zulassung Die folgenden Hinweise gelten nur für Präparate,
Leitfaden zum Befüllen des eaf Renewal Form für Human- und Veterinärarzneimittel
 Human- und Veterinärarzneimittel Zweck und generelle Regeln Dieser Leitfaden soll Antragstellern von Verlängerungen gemäß 20 AMG das Ausfüllen des elektronischen Antragsformblatts (eaf Renewal Form) erleichtern.
Human- und Veterinärarzneimittel Zweck und generelle Regeln Dieser Leitfaden soll Antragstellern von Verlängerungen gemäß 20 AMG das Ausfüllen des elektronischen Antragsformblatts (eaf Renewal Form) erleichtern.
Educational Material Von der Einreichung zur Genehmigung
 Educational Material Von der Einreichung zur Genehmigung Dr. Harriet Palissa, BfArM Dr. Harriet Palissa BfArM im Dialog 26.02.2016 Seite 1 Inhaltsverzeichnis 1. Grundlagen Educational Material 2. Das Genehmigungsverfahren
Educational Material Von der Einreichung zur Genehmigung Dr. Harriet Palissa, BfArM Dr. Harriet Palissa BfArM im Dialog 26.02.2016 Seite 1 Inhaltsverzeichnis 1. Grundlagen Educational Material 2. Das Genehmigungsverfahren
MEGRA StartUp 2019-AT
 MEGRA StartUp 2019-AT Ein Lehrgang für Neueinsteiger und Update für Professionals in Drug Regulatory Affairs Wien, Januar Dezember 2019 11 Module von jeweils 13:30-18:00 Uhr Hotel Regina Rooseveltplatz
MEGRA StartUp 2019-AT Ein Lehrgang für Neueinsteiger und Update für Professionals in Drug Regulatory Affairs Wien, Januar Dezember 2019 11 Module von jeweils 13:30-18:00 Uhr Hotel Regina Rooseveltplatz
Schritt 1: Beteiligungsportal Sachsen öffnen
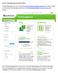 Schritt 1: Beteiligungsportal Sachsen öffnen Das Beteiligungsportal ist unter der Adresse https://bürgerbeteiligung.sachsen.de erreichbar. Fragen zur Nutzung des Beteiligungsportals können an beteiligungsportal@smi.sachsen.de
Schritt 1: Beteiligungsportal Sachsen öffnen Das Beteiligungsportal ist unter der Adresse https://bürgerbeteiligung.sachsen.de erreichbar. Fragen zur Nutzung des Beteiligungsportals können an beteiligungsportal@smi.sachsen.de
BAUEN-ONLINE. Anleitung für Antragsteller und Entwurfsverfasser. Stand: August 2008
 BAUEN-ONLINE Anleitung für Antragsteller und Entwurfsverfasser Stand: August 2008 Inhaltsverzeichnis Einleitung... 3 Systemvorrausetzung... 3 Online - Auskunft... 4 Bearbeitungsstand... 4 Antragsstatus...
BAUEN-ONLINE Anleitung für Antragsteller und Entwurfsverfasser Stand: August 2008 Inhaltsverzeichnis Einleitung... 3 Systemvorrausetzung... 3 Online - Auskunft... 4 Bearbeitungsstand... 4 Antragsstatus...
Archivierung mit PDF und XPS. Formate, Standards und Prozessabläufe
 Archivierung mit PDF und XPS Formate, Standards und Prozessabläufe Dr. Hans Bärfuss PDF Tools AG Winterthur, 8. Mai 2007 Copyright 2007 PDF Tools AG 1 Inhalt Formate Anforderungen an ein Archivformat Ordnung
Archivierung mit PDF und XPS Formate, Standards und Prozessabläufe Dr. Hans Bärfuss PDF Tools AG Winterthur, 8. Mai 2007 Copyright 2007 PDF Tools AG 1 Inhalt Formate Anforderungen an ein Archivformat Ordnung
Weiterentwicklung IT-Systeme: Ausbau Swissmedic egovernment Portal
 Swissmedic Regulatory News aus dem Bereich Zulassung 2015 8. Dezember 2015, Stade de Suisse, Bern Weiterentwicklung IT-Systeme: Ausbau Swissmedic egovernment Portal Heinz Knöpfli, Leiter Abteilung Innovationsmanagement
Swissmedic Regulatory News aus dem Bereich Zulassung 2015 8. Dezember 2015, Stade de Suisse, Bern Weiterentwicklung IT-Systeme: Ausbau Swissmedic egovernment Portal Heinz Knöpfli, Leiter Abteilung Innovationsmanagement
HD-Wegleitung Guidance edok
 Inhaltsverzeichnis 1 Grundsatz... 2 1.1 Bestätigung der Identität... 2 2 Scope... 3 3 Beschreibung der Anforderungen... 3 3.1 Bedeutung der Symbole... 3 4 Technische Vorgaben... 4 5 Ordnerstruktur... 5
Inhaltsverzeichnis 1 Grundsatz... 2 1.1 Bestätigung der Identität... 2 2 Scope... 3 3 Beschreibung der Anforderungen... 3 3.1 Bedeutung der Symbole... 3 4 Technische Vorgaben... 4 5 Ordnerstruktur... 5
Umsetzung der Variation Regulation für rein nationale Zulassungen
 Umsetzung der Variation Regulation für rein nationale Zulassungen Einführung in die Variations-Typen Mariela Becker, M.D.R.A. BfArM im Dialog 12.07.2013 Agenda Rechtlicher Rahmen Verordnung (EG) Nr. 1234/2008
Umsetzung der Variation Regulation für rein nationale Zulassungen Einführung in die Variations-Typen Mariela Becker, M.D.R.A. BfArM im Dialog 12.07.2013 Agenda Rechtlicher Rahmen Verordnung (EG) Nr. 1234/2008
1 Allgemeines Login Laufende Anbringen Neue Kommunikation zum Verfahren... 5
 Leitfaden für das eservice Zulassung und Lifecycle ASP Inhalt: Leitfaden für das eservice Zulassung und Lifecycle ASP... 1 1 Allgemeines... 2 1.1 Login... 2 1.2 Startseite... 3 2 Laufende Anbringen...
Leitfaden für das eservice Zulassung und Lifecycle ASP Inhalt: Leitfaden für das eservice Zulassung und Lifecycle ASP... 1 1 Allgemeines... 2 1.1 Login... 2 1.2 Startseite... 3 2 Laufende Anbringen...
HD-Wegleitung Guidance edok
 Inhaltsverzeichnis 1 Grundsatz... 1 1.1 Bestätigung der Identität... 2 2 Geltungsbereich... 2 3 Beschreibung der Anforderungen... 3 4 Technische Vorgaben... 3 5 Ordnerstruktur... 4 6 Dateinamen... 5 7
Inhaltsverzeichnis 1 Grundsatz... 1 1.1 Bestätigung der Identität... 2 2 Geltungsbereich... 2 3 Beschreibung der Anforderungen... 3 4 Technische Vorgaben... 3 5 Ordnerstruktur... 4 6 Dateinamen... 5 7
Pharmapackage. PASS und PAES Änderung von Zulassungen Kennzeichnung Verlängerung. Rechtsanwalt Professor Burkhard Sträter
 Pharmapackage PASS und PAES Änderung von Zulassungen Kennzeichnung Verlängerung Rechtsanwalt Professor Burkhard Sträter Sträter Rechtsanwälte Kronprinzenstraße 20 Fon: +49 (0) 228-934 54-0 mail@straeterlawyers.de
Pharmapackage PASS und PAES Änderung von Zulassungen Kennzeichnung Verlängerung Rechtsanwalt Professor Burkhard Sträter Sträter Rechtsanwälte Kronprinzenstraße 20 Fon: +49 (0) 228-934 54-0 mail@straeterlawyers.de
Vollzug der Tierarzneimittelzulassung und überwachung (etam) Projektbeschreibung
 Vollzug der Tierarzneimittelzulassung und überwachung (etam) Projektbeschreibung Miriam Alexander-Katz 23. April 2008 Seite 1 Aufgaben des BVL, Abteilung 3 - Tierarzneimittel Änderung der Zulassung Aufgaben
Vollzug der Tierarzneimittelzulassung und überwachung (etam) Projektbeschreibung Miriam Alexander-Katz 23. April 2008 Seite 1 Aufgaben des BVL, Abteilung 3 - Tierarzneimittel Änderung der Zulassung Aufgaben
HD-Wegleitung Guidance edok
 Inhaltsverzeichnis 1 Grundsatz... 1 1.1 Bestätigung der Identität... 2 2 Geltungsbereich... 2 3 Beschreibung der Anforderungen... 3 4 Technische Vorgaben... 3 5 Ordnerstruktur... 4 6 Dateinamen... 5 7
Inhaltsverzeichnis 1 Grundsatz... 1 1.1 Bestätigung der Identität... 2 2 Geltungsbereich... 2 3 Beschreibung der Anforderungen... 3 4 Technische Vorgaben... 3 5 Ordnerstruktur... 4 6 Dateinamen... 5 7
Handbuch oasebw Seite 1 von 11
 Seite 1 von 11 Seite 2 von 11 Inhaltsverzeichnis BESCHREIBUNG 4 STARTSEITE 5 ANTRAG ZUR JUGENDERHOLUNG FÜR FINANZIELL SCHWÄCHER GESTELLTE (A1) 5 REGISTRIEREN 5 ANMELDEN 5 PASSWORT VERGESSEN 5 VORLAGEN
Seite 1 von 11 Seite 2 von 11 Inhaltsverzeichnis BESCHREIBUNG 4 STARTSEITE 5 ANTRAG ZUR JUGENDERHOLUNG FÜR FINANZIELL SCHWÄCHER GESTELLTE (A1) 5 REGISTRIEREN 5 ANMELDEN 5 PASSWORT VERGESSEN 5 VORLAGEN
Entwurf der Bekanntmachung zur Anzeige von AWBs und nichtinterventionellen PASS 75. Routinesitzung Bonn, 11. November 2014
 Entwurf der Bekanntmachung zur Anzeige von AWBs und nichtinterventionellen PASS 75. Routinesitzung Bonn, 11. November 2014 Bundesinstitut für Arzneimittel und Medizinprodukte Das BfArM ist ein Bundesinstitut
Entwurf der Bekanntmachung zur Anzeige von AWBs und nichtinterventionellen PASS 75. Routinesitzung Bonn, 11. November 2014 Bundesinstitut für Arzneimittel und Medizinprodukte Das BfArM ist ein Bundesinstitut
Antrag auf erneute Zulassung. Artikel 43
 Antrag auf erneute Zulassung Artikel 43 Themen Notifizierung Antragstellung GAP-Änderungen Cat. 4 Studien Gegenseitige Anerkennung Zulassungen nach 91/414 Antragstellerkonferenz Claudia Bock Artikel 43
Antrag auf erneute Zulassung Artikel 43 Themen Notifizierung Antragstellung GAP-Änderungen Cat. 4 Studien Gegenseitige Anerkennung Zulassungen nach 91/414 Antragstellerkonferenz Claudia Bock Artikel 43
COI-PharmaSuite ectd-lifecycle Importer. Business White Paper
 COI-PharmaSuite ectd-lifecycle Importer Business White Paper 1 Zusammenfassung 3 2 Die Vorteile im Überblick 4 2.1 Kompletter Import von einzelnen ectd Sequenzen 4 2.2 Übernahme der ectd-lifecycle Daten
COI-PharmaSuite ectd-lifecycle Importer Business White Paper 1 Zusammenfassung 3 2 Die Vorteile im Überblick 4 2.1 Kompletter Import von einzelnen ectd Sequenzen 4 2.2 Übernahme der ectd-lifecycle Daten
Übersicht über die Einreichung von Dossiers (IUCLID 5) Übersicht über die Einreichung von Dossiers (REACH-IT)
 Inhalt Einführung Übersicht über die Einreichung von Dossiers (IUCLID 5) Übersicht über die Einreichung von Dossiers (REACH-IT) Fragen und Antworten Schlussfolgerungen und zukünftige Webinare http://echa.europa.eu
Inhalt Einführung Übersicht über die Einreichung von Dossiers (IUCLID 5) Übersicht über die Einreichung von Dossiers (REACH-IT) Fragen und Antworten Schlussfolgerungen und zukünftige Webinare http://echa.europa.eu
Go-live EudraVigilance und nationale Umstellung auf das zentrale Meldewesen
 Go-live EudraVigilance und nationale Umstellung auf das zentrale Meldewesen 81. Routinesitzung am 16.11.2017 16.11.2017 Seite 1 Scharfschaltung EudraVigilance 16.11.2017 Seite 2 Go-live -Plan der EMA 3.7.
Go-live EudraVigilance und nationale Umstellung auf das zentrale Meldewesen 81. Routinesitzung am 16.11.2017 16.11.2017 Seite 1 Scharfschaltung EudraVigilance 16.11.2017 Seite 2 Go-live -Plan der EMA 3.7.
E i n L e h r g a n g f ü r N e u e i n s t e i g e r u n d U p d a t e f ü r P r o f e s s i o n a l s i n D r u g R e g u l a t o r y A f f a i r s
 M EGRA StartUp 2017-AT E i n L e h r g a n g f ü r N e u e i n s t e i g e r u n d U p d a t e f ü r P r o f e s s i o n a l s i n D r u g R e g u l a t o r y A f f a i r s Wien, Januar Dezember 2017 11
M EGRA StartUp 2017-AT E i n L e h r g a n g f ü r N e u e i n s t e i g e r u n d U p d a t e f ü r P r o f e s s i o n a l s i n D r u g R e g u l a t o r y A f f a i r s Wien, Januar Dezember 2017 11
Erfahrungen mit dem DIMDI-Portal, Einführung und Open Forum- Diskussion
 Erfahrungen mit dem DIMDI-Portal, Einführung und Open Forum- Diskussion Dr. Gabriele Feldmann, Bremen AGAH Workshop, 4. Juli 2012, Bonn 1 Grenzen des DIMDI-Systems bei Antragsstellung Erfahrungsschatz:
Erfahrungen mit dem DIMDI-Portal, Einführung und Open Forum- Diskussion Dr. Gabriele Feldmann, Bremen AGAH Workshop, 4. Juli 2012, Bonn 1 Grenzen des DIMDI-Systems bei Antragsstellung Erfahrungsschatz:
BERATEN. FÖRDERN. UMWELT SCHÜTZEN. Kommunalkredit Public Consulting. Online Einreichung - Siedlungswasserwirtschaft
 Online Einreichung - Siedlungswasserwirtschaft Agenda 1. Wünsche, Vorgaben und Herausforderungen 2. Layout und Workflow - allgemein 3. Weitere Prozesse im Förderungsverlauf 4. Ausblick 2 Wünsche und Vorgaben
Online Einreichung - Siedlungswasserwirtschaft Agenda 1. Wünsche, Vorgaben und Herausforderungen 2. Layout und Workflow - allgemein 3. Weitere Prozesse im Förderungsverlauf 4. Ausblick 2 Wünsche und Vorgaben
BfT / BVL Info-Tag 5. November 2008
 BfT / BVL Info-Tag 5. November 2008 Elektronischer Vollzug der Tierarzneimittelzulassung und überwachung (etam) Dr. Anton Dotter, BVL Anton Dotter 05. November 2008 Seite 1 Aufgaben des BVL, Abteilung
BfT / BVL Info-Tag 5. November 2008 Elektronischer Vollzug der Tierarzneimittelzulassung und überwachung (etam) Dr. Anton Dotter, BVL Anton Dotter 05. November 2008 Seite 1 Aufgaben des BVL, Abteilung
Informationsveranstaltung zum Registrierungsverfahren für öffentlich-rechtliche Ethik- Kommissionen
 Informationsveranstaltung zum Registrierungsverfahren für öffentlich-rechtliche Ethik- Kommissionen Bundesinstitut für Arzneimittel und Medizinprodukte, Bonn 14. Juli 2017 MR Dr. Lars-Christoph Nickel
Informationsveranstaltung zum Registrierungsverfahren für öffentlich-rechtliche Ethik- Kommissionen Bundesinstitut für Arzneimittel und Medizinprodukte, Bonn 14. Juli 2017 MR Dr. Lars-Christoph Nickel
Paul-Ehrlich-Institut. Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel Paul-Ehrlich-Straße Langen
 Anzeige von Änderungen gemäß 29 Abs. 1 S. 1, Abs. 1b und Abs. 1c AMG bzw. Antrag auf Zustimmung zu einer Änderung gemäß 29 Abs. 2a AMG für Parallelimportzulassungen Paul-Ehrlich-Institut Bundesinstitut
Anzeige von Änderungen gemäß 29 Abs. 1 S. 1, Abs. 1b und Abs. 1c AMG bzw. Antrag auf Zustimmung zu einer Änderung gemäß 29 Abs. 2a AMG für Parallelimportzulassungen Paul-Ehrlich-Institut Bundesinstitut
Die korrekte Ethikeinreichung. Michael Fuchs Leiter der Studienzentrale der German Hodgkin Study Group
 Die korrekte Ethikeinreichung Michael Fuchs Leiter der Studienzentrale der German Hodgkin Study Group Einreichung bei EKs als Prüfzentrum als Sponsor 2 Prüfzentrum Unterlagen für Prüfer und Stellvertreter
Die korrekte Ethikeinreichung Michael Fuchs Leiter der Studienzentrale der German Hodgkin Study Group Einreichung bei EKs als Prüfzentrum als Sponsor 2 Prüfzentrum Unterlagen für Prüfer und Stellvertreter
Bearbeitung Online-Antrag
 Bearbeitung Online-Antrag 1. Systemvoraussetzungen Es ist eine Bildschirmauflösung von mindestens 1024*768 erforderlich. Es wird empfohlen, JavaScript nicht zu deaktivieren, da sonst mehrere Eingabehilfen
Bearbeitung Online-Antrag 1. Systemvoraussetzungen Es ist eine Bildschirmauflösung von mindestens 1024*768 erforderlich. Es wird empfohlen, JavaScript nicht zu deaktivieren, da sonst mehrere Eingabehilfen
Puzzle. Versionierung und Verwaltung mehrerer Instanzen Thomas Höhne, IDU IT+Umwelt GmbH
 Puzzle Versionierung und Verwaltung mehrerer Instanzen Thomas Höhne, IDU IT+Umwelt GmbH entstanden im Rahmen vom BergPass Auftraggeber: Landesamt für Bergbau, Energie und Geologie Niedersachsen System
Puzzle Versionierung und Verwaltung mehrerer Instanzen Thomas Höhne, IDU IT+Umwelt GmbH entstanden im Rahmen vom BergPass Auftraggeber: Landesamt für Bergbau, Energie und Geologie Niedersachsen System
How To Get A New
 Erneuerung der Zulassung nach Art. 43 Antragstellerkonferenz 16. Juni 2015 Art. 43 Aktuelle Situation Noch kein abgestimmtes EU Guidance Dokument Letzte Beratungen in Dublin (2. 4. Juni 2015) Neufassung
Erneuerung der Zulassung nach Art. 43 Antragstellerkonferenz 16. Juni 2015 Art. 43 Aktuelle Situation Noch kein abgestimmtes EU Guidance Dokument Letzte Beratungen in Dublin (2. 4. Juni 2015) Neufassung
Diplomarbeits-DB. Kompakthandreichung für Hauptverantwortliche Schüler/in
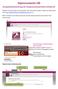 Diplomarbeits-DB Kompakthandreichung für Hauptverantwortliche Schüler/in Nachdem die Login-Daten an die Schüler/innen übermittelt wurden, melden sich diese damit unter https://diplomarbeiten.berufsbildendeschulen.at
Diplomarbeits-DB Kompakthandreichung für Hauptverantwortliche Schüler/in Nachdem die Login-Daten an die Schüler/innen übermittelt wurden, melden sich diese damit unter https://diplomarbeiten.berufsbildendeschulen.at
ExtraNet Fachverfahren FMSA
 ExtraNet Fachverfahren FMSA Funktionen für die Bankenabgabe Bundesanstalt für Finanzmarktstabilisierung (FMSA) für Kunden Version 1.1 (BA) Inhalt 1 EINLEITUNG... 3 2 KUNDENREGISTRIERUNG... 4 2.1 ERSTREGISTRIERUNG...
ExtraNet Fachverfahren FMSA Funktionen für die Bankenabgabe Bundesanstalt für Finanzmarktstabilisierung (FMSA) für Kunden Version 1.1 (BA) Inhalt 1 EINLEITUNG... 3 2 KUNDENREGISTRIERUNG... 4 2.1 ERSTREGISTRIERUNG...
Liechtensteinisches Landesgesetzblatt Jahrgang 2016 Nr... ausgegeben am
 Referendumsvorlage Liechtensteinisches Landesgesetzblatt Jahrgang 2016 Nr.... ausgegeben am... 2016 Abkommen zwischen der Regierung des Fürstentums Liechtenstein und der Österreichischen Bundesregierung
Referendumsvorlage Liechtensteinisches Landesgesetzblatt Jahrgang 2016 Nr.... ausgegeben am... 2016 Abkommen zwischen der Regierung des Fürstentums Liechtenstein und der Österreichischen Bundesregierung
Optimierung der Verfahren aus Sicht der gesundheitlichen Bewertung. Was können die Antragsteller und Bewertungsbehörden tun?
 BUNDESINSTITUT FÜR RISIKOBEWERTUNG Optimierung der Verfahren aus Sicht der gesundheitlichen Bewertung Was können die Antragsteller und Bewertungsbehörden tun? Bernd Stein & Claudia Norr Überblick Harmonisierung
BUNDESINSTITUT FÜR RISIKOBEWERTUNG Optimierung der Verfahren aus Sicht der gesundheitlichen Bewertung Was können die Antragsteller und Bewertungsbehörden tun? Bernd Stein & Claudia Norr Überblick Harmonisierung
Anleitung Kooperationsanträge Schule-Verein 2017/2018
 Anleitung Kooperationsanträge Schule-Verein 2017/2018 1. Anmeldung Internetadresse: https://www.bsb-net.org Für die Erfassung des Kooperationsantrages melden Sie sich zunächst auf dem Internetportal www.bsb-net.org
Anleitung Kooperationsanträge Schule-Verein 2017/2018 1. Anmeldung Internetadresse: https://www.bsb-net.org Für die Erfassung des Kooperationsantrages melden Sie sich zunächst auf dem Internetportal www.bsb-net.org
Musterprozess Förderung
 Kompetenzzentrum Vorgangsbearbeitung, Prozesse und Organisation Musterprozess Förderung Bonn, 04.05.2004 Folie: 1 Übersicht 1 Definition Musterprozesse 2 Musterprozess Förderung im Überblick 3 Teilprozesse
Kompetenzzentrum Vorgangsbearbeitung, Prozesse und Organisation Musterprozess Förderung Bonn, 04.05.2004 Folie: 1 Übersicht 1 Definition Musterprozesse 2 Musterprozess Förderung im Überblick 3 Teilprozesse
Änderungen im IFG-Antrag durch die Novellierung des BremIFG vom 5. Mai 2015
 Vortrag Die Senatorin für Finanzen Änderungen im IFG-Antrag durch die Novellierung des BremIFG vom 5. Mai 2015 Technische Anforderungen an die Umsetzung 27.01.2016 Ausgangssituation: BremIFG 22. April
Vortrag Die Senatorin für Finanzen Änderungen im IFG-Antrag durch die Novellierung des BremIFG vom 5. Mai 2015 Technische Anforderungen an die Umsetzung 27.01.2016 Ausgangssituation: BremIFG 22. April
Europäische Verfahren
 Europäische Verfahren Zur Zeit existieren 3 verschieden Zulassungsverfahren in der EU: Verfahren der gegenseitigen Anerkennung (MRP) dezentrales Verfahren (DCP) zentrales Verfahren Alle Biotech Produkte
Europäische Verfahren Zur Zeit existieren 3 verschieden Zulassungsverfahren in der EU: Verfahren der gegenseitigen Anerkennung (MRP) dezentrales Verfahren (DCP) zentrales Verfahren Alle Biotech Produkte
Handreichung für die Online-Datenlieferung zur Grundbefragung der Kernhaushalte (Befragung zur Abgrenzung des Berichtskreises)
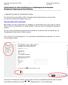 Statistisches Landesamt Sachsen-Anhalt - 1 - Handreichung Grundbefragung Handreichung für die Online-Datenlieferung zur Grundbefragung der e (Befragung zur Abgrenzung des Berichtskreises) 1.) Allgemeine
Statistisches Landesamt Sachsen-Anhalt - 1 - Handreichung Grundbefragung Handreichung für die Online-Datenlieferung zur Grundbefragung der e (Befragung zur Abgrenzung des Berichtskreises) 1.) Allgemeine
Verordnung über den elektronischen Rechtsverkehr in Mecklenburg-Vorpommern (ERVVO M-V) * Vom 5. Januar 2007
 Verordnung über den elektronischen Rechtsverkehr in Mecklenburg-Vorpommern (ERVVO M-V) * Vom 5. Januar 2007 Aufgrund 1. des 130a Abs. 2 Satz 1 der Zivilprozessordnung in der Fassung der Bekanntmachung
Verordnung über den elektronischen Rechtsverkehr in Mecklenburg-Vorpommern (ERVVO M-V) * Vom 5. Januar 2007 Aufgrund 1. des 130a Abs. 2 Satz 1 der Zivilprozessordnung in der Fassung der Bekanntmachung
Kombinationsprodukte im Kontext der Revision der RL 93/42/EWG. Tamara Bauer
 Kombinationsprodukte im Kontext der Revision der RL 93/42/EWG Tamara Bauer Inhalt Definitionen Richtlinien Kombinationsprodukte 2 Fallbeispiele: Medizinprodukt/Arzneimittel Medizinprodukt/Arzneimittel
Kombinationsprodukte im Kontext der Revision der RL 93/42/EWG Tamara Bauer Inhalt Definitionen Richtlinien Kombinationsprodukte 2 Fallbeispiele: Medizinprodukt/Arzneimittel Medizinprodukt/Arzneimittel
Pharmakovigilanz: Risiken erfassen und kontrollieren
 Pharmakovigilanz: Risiken erfassen und kontrollieren Dr. Norbert Paeschke Dr. Norbert Paeschke Risiken erfassen und kontrollieren 15./16.9.2015 Seite 1 Prozess von der Risikoerfassung zur Risikokontrolle
Pharmakovigilanz: Risiken erfassen und kontrollieren Dr. Norbert Paeschke Dr. Norbert Paeschke Risiken erfassen und kontrollieren 15./16.9.2015 Seite 1 Prozess von der Risikoerfassung zur Risikokontrolle
Visa portal - Online application Online appointment
 Visa portal - Online application Online appointment 1. Selection of the competent representation Die Website www.swiss-visa.ch dient als Einstiegsportal um ein Visum zur Einreise in die Schweiz zu beantragen.
Visa portal - Online application Online appointment 1. Selection of the competent representation Die Website www.swiss-visa.ch dient als Einstiegsportal um ein Visum zur Einreise in die Schweiz zu beantragen.
Handreichung zum Ausfüllen des Antragsformulars im Aufruf 2017 zur Mobilität mit Programmländern (KA103)
 Seite 1 von 16 Handreichung zum Ausfüllen des Antragsformulars im Aufruf 2017 zur Mobilität mit Programmländern (KA103) Stand: November 2016 Seite 2 von 16 Inhaltsverzeichnis Einführung 3 Teil A. Allgemeine
Seite 1 von 16 Handreichung zum Ausfüllen des Antragsformulars im Aufruf 2017 zur Mobilität mit Programmländern (KA103) Stand: November 2016 Seite 2 von 16 Inhaltsverzeichnis Einführung 3 Teil A. Allgemeine
Einreichung bei Swissmedic Teil 2
 ectd Implementierung neuer Validierungskriterien it i und Anpassungen der ectd Vorgabe-Dokumente Dienstag, 25. Juni 2013, Hotel Allegro/Kursaal Bern Anforderungen an eine ectd- Einreichung bei Swissmedic
ectd Implementierung neuer Validierungskriterien it i und Anpassungen der ectd Vorgabe-Dokumente Dienstag, 25. Juni 2013, Hotel Allegro/Kursaal Bern Anforderungen an eine ectd- Einreichung bei Swissmedic
Anleitung e-wahlvorschläge
 Anleitung e-wahlvorschläge Stand Januar 2019 Für die diesjährigen National- und Ständeratswahlen stellt die Staatskanzlei (STK) das Formular für die Wahlvorschläge erstmals in elektronischer Form zur Verfügung.
Anleitung e-wahlvorschläge Stand Januar 2019 Für die diesjährigen National- und Ständeratswahlen stellt die Staatskanzlei (STK) das Formular für die Wahlvorschläge erstmals in elektronischer Form zur Verfügung.
Regionale Auftaktveranstaltung zur EU-Förderung - Neuerungen im Antragsverfahren. Janin Wieja Hildesheim,
 Regionale Auftaktveranstaltung zur EU-Förderung - Neuerungen im Antragsverfahren Janin Wieja Hildesheim, 20.07.2015 Agenda Kundenportal: elektronische Antragstellung Einbindung der Ämter für regionale
Regionale Auftaktveranstaltung zur EU-Förderung - Neuerungen im Antragsverfahren Janin Wieja Hildesheim, 20.07.2015 Agenda Kundenportal: elektronische Antragstellung Einbindung der Ämter für regionale
KUNDENINFORMATION. Onlineportal Sonderbewilligungen Release Wichtigste Neuerungen und Verbesserungen
 Eidgenössisches Departement für Umwelt, Verkehr, Energie und Kommunikation UVEK Bundesamt für Strassen ASTRA Shutterstock KUNDENINFORMATION Onlineportal Sonderbewilligungen Release 1.9.0.4 Wichtigste Neuerungen
Eidgenössisches Departement für Umwelt, Verkehr, Energie und Kommunikation UVEK Bundesamt für Strassen ASTRA Shutterstock KUNDENINFORMATION Onlineportal Sonderbewilligungen Release 1.9.0.4 Wichtigste Neuerungen
Handbuch für Antragsteller Antragsplattform KfW Beratungsförderung
 Handbuch für Antragsteller Antragsplattform KfW Beratungsförderung Stand: 1. Oktober 2009 Inhaltsverzeichnis 1 Allgemeines...2 2 Antragsplattform...3 2.1 Gründercoaching...3 2.1.1 Maske "Produktauswahl"...3
Handbuch für Antragsteller Antragsplattform KfW Beratungsförderung Stand: 1. Oktober 2009 Inhaltsverzeichnis 1 Allgemeines...2 2 Antragsplattform...3 2.1 Gründercoaching...3 2.1.1 Maske "Produktauswahl"...3
Zulassungsverfahren für Arzneimittel in der EU
 SEMINAR Regulatory Affairs kompakt AKTUELLE THEMEN Zulassungsverfahren für Arzneimittel in den USA 13./14. März 2014, Mannheim Zulassungsverfahren für Arzneimittel in der EU 8./9. April 2014, Mannheim
SEMINAR Regulatory Affairs kompakt AKTUELLE THEMEN Zulassungsverfahren für Arzneimittel in den USA 13./14. März 2014, Mannheim Zulassungsverfahren für Arzneimittel in der EU 8./9. April 2014, Mannheim
Anleitung zum Online-Antragsverfahren Kooperation Schule-Verein
 Anleitung zum Online-Antragsverfahren Kooperation Schule-Verein Anmeldung im Internet-Portal www.meinwlsb.de Sie melden sich auf dem Internet-Portal unter www.meinwlsb.de wie folgt an: Bitte geben Sie
Anleitung zum Online-Antragsverfahren Kooperation Schule-Verein Anmeldung im Internet-Portal www.meinwlsb.de Sie melden sich auf dem Internet-Portal unter www.meinwlsb.de wie folgt an: Bitte geben Sie
Die Datenbank Spendertestung
 Die Datenbank Spendertestung www.pei.de Olaf Henseler Paul-Ehrlich-Institut Fachgebiet 7/4 Transfusionsmedizin Paul-Ehrlich-Str. 51-59 63225 Langen +49 6103 77-1862 +49 6103 77-1276 olaf.henseler@pei.de
Die Datenbank Spendertestung www.pei.de Olaf Henseler Paul-Ehrlich-Institut Fachgebiet 7/4 Transfusionsmedizin Paul-Ehrlich-Str. 51-59 63225 Langen +49 6103 77-1862 +49 6103 77-1276 olaf.henseler@pei.de
 1. Anmeldung Internetadresse: http://www.bsbvernetzt.de ACHTUNG! Bevor Sie sich im BSBverNETzt anmelden, fragen Sie innerhalb Ihres Vereins, ob bereits Zugangsdaten generiert wurden. Durch eine Neuanmeldung
1. Anmeldung Internetadresse: http://www.bsbvernetzt.de ACHTUNG! Bevor Sie sich im BSBverNETzt anmelden, fragen Sie innerhalb Ihres Vereins, ob bereits Zugangsdaten generiert wurden. Durch eine Neuanmeldung
24/7 & ÜBERALL ERREICHBAR! CMS ikiss & ANTRAGSMANAGEMENT VEREINT ZUM BÜRGERPORTAL
 + DIE MODERNE VERWALTUNG 24/7 & ÜBERALL ERREICHBAR! CMS ikiss & ANTRAGSMANAGEMENT VEREINT ZUM BÜRGERPORTAL Content Management System Leicht zu bedienen, jederzeit erweiterbar & selbstverständlich barrierefrei.
+ DIE MODERNE VERWALTUNG 24/7 & ÜBERALL ERREICHBAR! CMS ikiss & ANTRAGSMANAGEMENT VEREINT ZUM BÜRGERPORTAL Content Management System Leicht zu bedienen, jederzeit erweiterbar & selbstverständlich barrierefrei.
Informationsblatt zum Fachverfahren EMIR
 Allgemeines Informationsblatt zum Fachverfahren EMIR (Stand: 01.04.2017) Über das Portal der Melde- und Veröffentlichungsplattform (MVP Portal) haben Sie die Möglichkeit, Meldungen zu verschiedenen Teilverfahren
Allgemeines Informationsblatt zum Fachverfahren EMIR (Stand: 01.04.2017) Über das Portal der Melde- und Veröffentlichungsplattform (MVP Portal) haben Sie die Möglichkeit, Meldungen zu verschiedenen Teilverfahren
Leitfaden zum Befüllen des eaf Variation Form für Human- und Veterinärarzneimittel
 Human- und Veterinärarzneimittel Zweck und generelle Regeln Dieser Leitfaden soll Antragstellern von Variations gemäß Verordnung (EG) Nr. 1234/2008 das Ausfüllen des elektronischen Antragsformblattes (eaf
Human- und Veterinärarzneimittel Zweck und generelle Regeln Dieser Leitfaden soll Antragstellern von Variations gemäß Verordnung (EG) Nr. 1234/2008 das Ausfüllen des elektronischen Antragsformblattes (eaf
Online-Beteiligungsverfahren zu den Entwürfen von Bewirtschaftungsplan und Maßnahmenprogramm NRW vom 22. Dezember 2008 bis 21.
 Online-Beteiligungsverfahren zu den Entwürfen von Bewirtschaftungsplan und Maßnahmenprogramm NRW vom 22. Dezember 2008 bis 21. Juni 2009 Anwendungshilfe 1. Schritt: Start Zum Starten klicken Sie auf die
Online-Beteiligungsverfahren zu den Entwürfen von Bewirtschaftungsplan und Maßnahmenprogramm NRW vom 22. Dezember 2008 bis 21. Juni 2009 Anwendungshilfe 1. Schritt: Start Zum Starten klicken Sie auf die
Leitfaden für teilnehmende Sponsoren
 Gemeinsames Pilotprojekt von Bundesoberbehörden und Ethik- Kommissionen zur Bearbeitung von Anträgen klinischer Prüfungen mit Humanarzneimitteln entsprechend der Verordnung (EU) 536/2014 unter gleichzeitiger
Gemeinsames Pilotprojekt von Bundesoberbehörden und Ethik- Kommissionen zur Bearbeitung von Anträgen klinischer Prüfungen mit Humanarzneimitteln entsprechend der Verordnung (EU) 536/2014 unter gleichzeitiger
Technische Informationen zum Meldeverfahren für schwerwiegende Betriebs- und Sicherheitsvorfälle bei Zahlungsdienstleistern
 Technische Informationen zum Meldeverfahren für schwerwiegende Betriebs- und Sicherheitsvorfälle bei Zahlungsdienstleistern Meldepflicht bei Sicherheitsvorfällen Durch das Gesetz zur Umsetzung der Zweiten
Technische Informationen zum Meldeverfahren für schwerwiegende Betriebs- und Sicherheitsvorfälle bei Zahlungsdienstleistern Meldepflicht bei Sicherheitsvorfällen Durch das Gesetz zur Umsetzung der Zweiten
edm und Wegleitung Formale Anforderungen Elektronisches Dokumentenmanagement Swissmedic
 edm und Wegleitung Formale Anforderungen Elektronisches Dokumentenmanagement Swissmedic Dr. Vincent Lavanchy, Projektleiter Freitag, 16. Mai 2014, Stade de Suisse Bern Swissmedic Schweizerisches Heilmittelinstitut
edm und Wegleitung Formale Anforderungen Elektronisches Dokumentenmanagement Swissmedic Dr. Vincent Lavanchy, Projektleiter Freitag, 16. Mai 2014, Stade de Suisse Bern Swissmedic Schweizerisches Heilmittelinstitut
 1. Anmeldung Internetadresse: http://www.bsbvernetzt.de ACHTUNG! Bevor Sie sich im BSBverNETzt anmelden, fragen Sie innerhalb Ihres Vereins, ob bereits Zugangsdaten generiert wurden. Durch eine Neuanmeldung
1. Anmeldung Internetadresse: http://www.bsbvernetzt.de ACHTUNG! Bevor Sie sich im BSBverNETzt anmelden, fragen Sie innerhalb Ihres Vereins, ob bereits Zugangsdaten generiert wurden. Durch eine Neuanmeldung
Bewerbung zum Deutschen Buchhandlungspreis 2019
 Ausfüll-Anleitung Bewerbung zum Deutschen Buchhandlungspreis 2019 Registrierung und Anmeldung Für Bewerber 2018 Wenn Sie sich 2018 bereits für den Deutschen Buchhandlungspreis beworben haben, können Sie
Ausfüll-Anleitung Bewerbung zum Deutschen Buchhandlungspreis 2019 Registrierung und Anmeldung Für Bewerber 2018 Wenn Sie sich 2018 bereits für den Deutschen Buchhandlungspreis beworben haben, können Sie
Nutzungshinweise (Langversion)
 (Langversion) Onlineantrag zur Beantragung der Aufwandsentschädigung im Rahmen der ehrenamtlichen Tätigkeit gemäß Berufsbildungsgesetz (BBiG) Stand: 19. Juli 2017 Inhaltsverzeichnis 1 Technische Voraussetzungen...
(Langversion) Onlineantrag zur Beantragung der Aufwandsentschädigung im Rahmen der ehrenamtlichen Tätigkeit gemäß Berufsbildungsgesetz (BBiG) Stand: 19. Juli 2017 Inhaltsverzeichnis 1 Technische Voraussetzungen...
