Vorlesung Wasserinhaltsstoffe. Dr. Thomas Dittmar. Gase
|
|
|
- Christin Linda Schräder
- vor 7 Jahren
- Abrufe
Transkript
1 Vorlesung Wasserinhaltsstoffe Dr. Thomas Dittmar Gase 07/011
2 Gelöste Gase in der Hydrosphäre O, CO, H S, CH 4, N. Vorkommen, Quellen (natürlich, anthropogen), Wirkung (Humangesundheit, Ökologie), Entfernung (Wasseraufbereitung)
3 Gase - Gewässer im Kontakt mit Atmosphäre - Hauptbestandteile der Luft: N, O, (CO ) - biologische Aktivität in Hydrosphäre: Verbrauch/Produktion von Gasen (Photosynthese, Respiration) - weitere wichtige Gase biochemischer Kreisläufe in der Hydrosphäre sind: N : als Produkt der Nitratatmung (Denitrifikation) H S: als anaerobes Abbauprodukt schwefelorg. Verbindungen bzw. anoxischer Desulfurikation (Sulfatatmung) CH 4 : als anaerobes Abbauprodukt org. Verbindungen (Gärung)
4 Löslichkeit von Gasen Thermodynamische Betrachtung Desorption c(a gas ) = x c(a gas ) = x-y Absorption c(a fl ) = 0 c(a fl ) = y t=0 Gleichgewicht A K gas A A f l ca ( ) fl = ca ( ) gas ideale Gasgleichung pv = nrt mitc= p = c R T ca ( ) = gas pa ( ) gas RT n V
5 Löslichkeit von Gasen c(a gas ) Konz. des Gases A in wässriger Phase [mol/l] K A ca ( ) ca ( ) RT fl fl = = pa ( ) gas pa ( ) gas R T R- allgemeine Gaskonstante [J mol -1 K -1 ] K A Ostwald scher Verteilungskoeffizient [J bar -1 L -1 ] p(a gas ) Partialdruck des Gases A [bar] K H Henry-Konstante [mol L -1 bar -1 ] ca ( ) fl ( ) K p A A gas K A = = RT RT ( gas) p A HENRYsche Gesetz: ca ( ) = K pa ( ) fl H gas
6 Löslichkeit von Gasen Gas Henry-Konstante K H [10-3 mol L -1 bar -1 ] für T = 5 C N 0,64 O 1,7 CH 4 1,34 CO 33,8 H S 10, NH , CO + H O HCO + H + 3 HS+ HO HS + H + NH + H O NH + OH pk s1 = 6,3 pk s1 = 7,1 pk B = 4,8
7 Sättigungskonzentration (Temperaturabhängigkeit) Gas p i [bar] T [ C] Sättigungskonz. ci [mg/l] N 0,781 0,5 N 0, ,63 N 0, ,51 N 0, ,4 O 0, ,58 O 0, ,7 O 0,09 0 9,08 O 0, ,53 CO 0, ,7 CO 0, ,51
8 Sauerstoff, O Quellen: - Aufnahme aus der Atmosphäre (0,9 Vol-%) Löslichkeit 8,4 mg/l (5 C), 11, mg/l (10 C) ) - Photosynthese (vereinfacht) Bedeutung: 6CO + 6H O C H O + 6O bildet Lebensgrundlage für Wasserorganismen - aquatische Ökosyteme mit hoher Biodiversität (ganzjährig O -Konz. 4 mg/l!!) - als starkes Oxidationsmittel bestimmt er maßgeblich das Redoxmilieu - wichtig für aeroben Abbau org. Stoffe im Wasser Selbstreinigung der Gewässer h υ Verbrauch: durch biochemische Oxidationen: - Abbau gelöster organischer Verbindungen (Respiration, aerobe Atmung), - Nitrifikation, Sulfurikation - Sauerstoffzehrung durch das Bodensediment.
9 Sauerstoff, O
10 Sauerstoff, O Ökologische Probleme: durch Rückgang der O -Konzentration beeinflusst durch: - hohe Temperaturen (z. B. Kühlwassereinleitungen), 5%iger Rückgang (10 auf 5 C) - hoher Salzgehalt verringert Sättigungskonzentration - Verschmutzung der Gewässeroberfläche mit Mineralölen oder Tensiden (behindern Phasenübergang) - ständige Einleitung an oxidierbaren Wasserinhaltsstoffen (Organik, NH 4+ ) führt zu starker O -Zehrung Probleme v. a. in stehenden Gewässern: - Stagnationsphasen Verhinderung des vertikalen Stofftransports, - hohe Konzentrationen an Oberfläche (Epilimnion) - am Gewässergrund (Hypolimnion) Sauerstoffzehrung [anaerobe Zustände, H S, Mobilisierung Schwermetalle z.b.: Fe(III) Fe(II) und HPO - 4 ]
11 Thermische Schichtung in Standgewässern Ursache: Dichteanomalie des Wassers (ρ max bei 4 C) Für tiefe Seen (> 10 m) der gemäßigten Breiten ist folgender Jahresgang typisch: Frühjahr Sommer Herbst Winter Vollzirkulation (Wind ) Epilimnion Metalimnion 0 C 6 C Hypolimnion 4 C Sediment Sommerstagnation Homothermie (4 C), keine Epilimnion: Licht, P, Thermokline, WI in allen Tiefen O -(Über)sättigung, annähernd konstant Metalimnion: ΔT (ΔT 1 C/m) u. Δρ (Blaualgen) 18 C Hypolimnion: Homothermie; R, P 0, Licht CO /HCO 3-, ph, O, NH 4+ Fe(II), Mn(II), H S, CH 4 Vollzirkulation (Abkühlung) Wind u. abnehmende Lufttemp., Abbau d. Sprungschicht (Homothermie), WI in allen Tiefen konstant Eis C 4 C Winterstagnation Stärkere Abkühlung der oben Schichten (T< 4 C), unten 4 C, Eisbildung, kein Austausch mit Atmosphäre, O, z.b. Fe(II), Mn(II), NH 4 +
12 Kinetische Betrachtungen zum Gaseintrag STREETER-PHELPS-Methode zur Bestimmung des Gaseintrags in Fließgewässern wesentliche Triebkraft: Vorliegen eines Defizits Eintrag von O proportional zum Defizit O -Sättigung D = c c t S t c(o ) c(o ) 0 c(o ) t D max Fließstrecke D D 0 c(o ) min D t BSB dd = D k dt D= D e k = 0 k t ( ln D ln D ) t 0 BSB t
13 Anwendung Physikalischer Gaseintrag Berechnen Sie den k -Wert sowie den physikalischen O -Eintrag um 17:30 Uhr [g/m 3 d] in der fließenden Welle, wenn die O -Konzentration um 14:30 Uhr von 1,5 mg/l auf 4,3 mg/l um 17:30 Uhr ansteigt. Gehen Sie dabei von einer Sättigungskonzentration von 8,0 mg/l aus. dd dt (1) k -Wert Berechnung = k D dd k dt Variablentrennung D = Dt D0 1 D dd = k dt t 0 D = c c 0 s 0 D = 8 mg 1,5 mg = 6,5 mg 0 L L L D = 8 mg 4,3 mg = 3,7 mg t L L L ln D ln D = k t t 0 k t = ln D ln D 0 t 6,5 mg 1 1 k = (ln D ln D) = ln L = 0,1878 h 0 t t 3h 3, 7 mg L 1
14 Anwendung Physikalischer Gaseintrag () Physikalischer Sauerstoffeintrag dd dt = k D dd = k D t dt D t = 8 mg 4,3 mg = 3,7 mg L L L dd = h dt 1 0,1878 3,7 mg L dd mg mg g = 0,6946 = 16,68 = 16,68 3 dt L h L d m d
15 Kinetische Betrachtungen zum Gaseintrag Empirische Gleichungen zur Beschreibung des Gaseintrags in Fließgewässer k = a v m H n v: mittl. Fließgeschwindigkeit [m/s] H: mittl. Wassertiefe [m] a, m, n: Regressionskoeffizienten Spezialvarianten: (1) OWENS Glg.: kleine schnelle Gebirgsflüsse (Oberläufe großer Flüsse) k (0 C ) =,31 v H 0,67 1,85 () CHURCHILL Glg.: größere Flüsse (Mittel- bzw. Unterläufe großer Ströme) k (0 C ) =,18 v H 0,969 1,673
16 Kinetische Betrachtungen zum Gaseintrag - empirische Glg. (Fließgewässer) versagt bei Stand- und Staugewässern c(o ) - Gaseintragsmodell: dd dt = k D P+ R [mg/l] Übersättigung (Austrag) 100 % O -Sättigung Defizit (Eintrag) Tageszeit
17 Kinetische Betrachtungen zum Gaseintrag Größenordnung des Sauerstoffeintrags bei T = 0 C Gewässertyp Einfluss des Salzgehalts auf Kinetik des phys. Gaseintrags k (Salzwasser) > k (Süßwasser) Einfluss der Temperatur k T k T C α phys. O -Eintrag bezogen auf 100 % Defizit [g/m 3 d] Tiefenwasser geschichteter See < 0,1 Teich (ungeschichtet) 1 5 Epilimnion geschichteter See 5 10 Unterlauf großer Flüsse 5 50 Gebirgsbach ( T 0) ( ) = ( = 0 ) α - Regressionskoeffizient ( α= 1,04)
18 Kohlendioxid, CO Quellen: - Aufnahme aus der Atmosphäre (0,035 0,038 Vol-%) Löslichkeit 0,5 mg/l (5 C), 0,81 mg/l (10 C) ) - biochemische Abbauprozesse aerobe Atmung: C H O + 6O 6 H O+ 6CO Gärung: C H O 3 CH + 3CO Bedeutung: - an der Oberfläche geringe Konzentrationen - in Grundwässern Konz. bis zu mehreren hundert mg/l wegen hoher Bioaktivität (Destruenten) in Bodenschichten Verbrauch: Photosynthese, Carbonatbildung
19 Kohlendioxid, CO Chemie der wäßrigen Lösung: - im Wasser steht gelöstes CO ( Kohlensäure ) mit den Dissoziationsprodukten im Gleichgewicht: CO + H O H + HCO + 3 HCO H + CO pk S1 = 6,3 pk S = 10,3 -CO (aq) dominiert nur bei ph-werten < 6,3 (pk S1 ) -CO ist auch Bestandteil des Kalk-Kohlensäure-Gleichgewichts, das die Auflösung/ Ausfällung von Calcit (Calciumcarbonat) beschreibt: CaCO + CO + H O Ca + HCO zugehöriges CO : Konzentration, um die HCO 3 - -Ionen in Lsg. zu halten (im KKG) überschüssiges CO : CO, welches zu Korrosion an Beton und Metallen führt
20 Kohlendioxid, CO Grenzwert nach Trinkwasserverordnung 001 (TrinkwV 001) Anlage : Indikatorparameter lfd. Nr. 3 kein Grenzwert Aufbereitungsziel für Stabilisierung des Wassers: definiert über den ph-wert u. CaCO 3 -Konz. - mechanische Entsäuerung: Belüftung des Rohwasser (ph ) - chemische Entsäuerung: Marmorfiltration (ph, Ca +, Mg + ) - nach Trinkwasserverordnung 001: 6,5 ph 9,5 sowie im KKG
21 ph-wert des natürlichen Regenwassers Der ph-wert des Regenwassers wird bestimmt durch die Auflösung von CO. Geg.: p( CO ) = 0,00035 bar pk = 6,3 (5 C) Lsg.: S1 H(CO ) = 3 33,4mol/(m bar) c(co ) = p(co) H(CO) 3 5 c(co ) = 0,01 mol/m = 1,17 10 mol/l K S1 = + c(h )c(hco c(co ) 3 ) + - c(h ) = c(hco 3) K S1 = c (H c(co + ) ) c( H ) = K c( CO ) = 5,01 10 mol / L 1,17 10 mol / L =, S ph = lg c( H + ) = 5,6
22 Kohlendioxid, CO
23 Schwefelwasserstoff, H S Quellen: - anaerober Abbau schwefelorganischer Verbindungen org. S verbindung HS/ HS + CH + CO + H O - (anoxische) Sulfatatmung (Desulfurikation) { } 4 CH O SO H HS CO H O Auflösung schwefelhaltiger Minerale (z. B. Pyrit) im reduzierten Milieu: FeS + CO + H O Fe + HCO + H S + S + 3 Bedeutung: - Bestandteil des biochemischen Schwefelkreislaufs (Indikator für reduzierende Bedingungen)
24 Schwefelwasserstoff, H S Chemie der wässrigen Lösung: - gut in Wasser löslich (Henry-Konstante etwa dreimal größer als die von CO und ca. 100 mal größer als die von O ) - entsprechend den Dissoziationsgleichgewichten HS H + + HS pk S = 7,1 HS H + S + pk S 13 - dominiert im sauren Bereich H S und im alkalischen Bereich HS -. Sulfid S - tritt nur in geringen Anteilen auf. Bedeutung -H S Atemgift, unangenehmer Geruch - leichte Entfernbarkeit durch offene Belüftung, nasschemische Oxidation, Aktivkohleadsorption
25 Schwefelwasserstoff 1,0 0,8 Anteil f 0,6 0,4 H S HS - S - 0, pk s1 = 7,1 pk s = 13 0, ph
26 Zum Schluss: 3 W (Was war wesentlich?) Henry-Gesetz zur Quantifizierung des Gleichgewichts von gelösten Gasen O [Bedeutung für Hydrosphäre (Eintrag, Verbrauch), Prozesse die den physikalischen Eintrag (negativ) beeinflussen, Kinetik des Eintrags (Streeter-Phelps-Berechnung)] CO [Eintrag und Verbrauch in Hydrosphäre, Säure-Base-Ggw., Kalk-Kohlensäure-Ggw. ph-wert-berechnung, Entfernung in Trinkwasseraufbereitung] H S [Quellen, Indikator für reduzierendes Milieu, Säure-Base-Ggw., Entfernung in der Trinkwasseraufbereitung]
Chemie aquatischer Systeme. Herbstsemester 2013
 Chemie aquatischer Systeme Herbstsemester 2013 Ziele der Vorlesung Verständnis der chemischen Zusammensetzung der Gewässer aufgrund chemischer Prozesse Verknüpfung chemischer Prozesse mit biologischen
Chemie aquatischer Systeme Herbstsemester 2013 Ziele der Vorlesung Verständnis der chemischen Zusammensetzung der Gewässer aufgrund chemischer Prozesse Verknüpfung chemischer Prozesse mit biologischen
VL Limnochemie. Grundlegendes zu Gasen in Lösungen wie Sauerstoff in einer Wasserprobe bestimmt werden kann Sauerstoff in Gewässern
 Sauerstoff VL Limnochemie Und heute Grundlegendes zu Gasen in Lösungen wie Sauerstoff in einer Wasserprobe bestimmt werden kann Sauerstoff in Gewässern 1 Inhalt Wiederholung Henry-Gesetz Sauerstoffmessung
Sauerstoff VL Limnochemie Und heute Grundlegendes zu Gasen in Lösungen wie Sauerstoff in einer Wasserprobe bestimmt werden kann Sauerstoff in Gewässern 1 Inhalt Wiederholung Henry-Gesetz Sauerstoffmessung
PAS I. Inhalt 13. Sitzung. Physik Aquatischer Systeme I. 13. Gasaustausch Energie, Stabilität und Turbulenz. Energieeintrag durch Wind
 PAS I Physik Aquatischer Systeme I 13. Gasaustausch Inhalt 13. Sitzung Kap. 4. Transport in Oberflächengewässern 4.4 Energie, Stabilität und Turbulenz Turbulente kinetische Energie (TKE) Richardson-Zahl,
PAS I Physik Aquatischer Systeme I 13. Gasaustausch Inhalt 13. Sitzung Kap. 4. Transport in Oberflächengewässern 4.4 Energie, Stabilität und Turbulenz Turbulente kinetische Energie (TKE) Richardson-Zahl,
Gas im wässrigen Medium
 Gas im wässrigen Medium Einfache schwerlösliche Gase Henrysches Gesetz und Abweichungen Beispiel Sauerstoff Rückkopplungen im Meer Kohlenstoffkreislauf CO 2 Kohlenstoffpumpen im Meer Gasfreisetzungen im
Gas im wässrigen Medium Einfache schwerlösliche Gase Henrysches Gesetz und Abweichungen Beispiel Sauerstoff Rückkopplungen im Meer Kohlenstoffkreislauf CO 2 Kohlenstoffpumpen im Meer Gasfreisetzungen im
Die chemische Zusammensetzung natiirlicher Gewasser
 Inhaltsverzeichnis Vorwort XI KAPITEL 1 KAPITEL 2 Die chemische Zusammensetzung natiirlicher Gewasser 1.1 Einleitung 1.2 Verwitterungsprozesse 1.3 Wechselwirkungen zwischen Organismen und Wasser 1.4 Das
Inhaltsverzeichnis Vorwort XI KAPITEL 1 KAPITEL 2 Die chemische Zusammensetzung natiirlicher Gewasser 1.1 Einleitung 1.2 Verwitterungsprozesse 1.3 Wechselwirkungen zwischen Organismen und Wasser 1.4 Das
VL Limnochemie
 VL Limnochemie Redoxreaktionen und -gleichgewichte WIEDERHOLUNG: SAUERSTOFF 1 Henry-Gesetz Massenwirkungsgesetz für den Fall: gasförmiger Stoff löst sich in Wasser A gas A fl K H = c(a fl ) c(a gas ) Henry-
VL Limnochemie Redoxreaktionen und -gleichgewichte WIEDERHOLUNG: SAUERSTOFF 1 Henry-Gesetz Massenwirkungsgesetz für den Fall: gasförmiger Stoff löst sich in Wasser A gas A fl K H = c(a fl ) c(a gas ) Henry-
1) Redoxverhältnisse an einer Sediment-Wasser-Grenzfläche in einem Fluss
 1 Uebungen zur Prüfungsvorbereitung 4.12.14 1) Redoxverhältnisse an einer Sediment-Wasser-Grenzfläche in einem Fluss Die folgenden Tiefenprofile von gelöstem Mangan, Eisen und Sulfid (S 2- ) sowie die
1 Uebungen zur Prüfungsvorbereitung 4.12.14 1) Redoxverhältnisse an einer Sediment-Wasser-Grenzfläche in einem Fluss Die folgenden Tiefenprofile von gelöstem Mangan, Eisen und Sulfid (S 2- ) sowie die
Limnische Mikrobiologie
 Limnische Mikrobiologie Geschichtete Seen und phototrophe Bakterien Algen Cyanobakterien Anoxygene Phototrophe Heterotrophe Sulfatreduzierer Methanogene Limnische Mikrobiologie Süßwasser etwa nur 2 % des
Limnische Mikrobiologie Geschichtete Seen und phototrophe Bakterien Algen Cyanobakterien Anoxygene Phototrophe Heterotrophe Sulfatreduzierer Methanogene Limnische Mikrobiologie Süßwasser etwa nur 2 % des
VL 03 Biogeochemische Kreisläufe von C, N, S, Abbau organischer Substanz
 02.11.04 VL 03 Biogeochemische Kreisläufe von C, N, S, Abbau organischer Substanz Bakterien haben keine Zähne Abbau organischer Substanz? Aber: Organisches Material im Ökosystem liegt meist in polymerer
02.11.04 VL 03 Biogeochemische Kreisläufe von C, N, S, Abbau organischer Substanz Bakterien haben keine Zähne Abbau organischer Substanz? Aber: Organisches Material im Ökosystem liegt meist in polymerer
2.Klausur Chemisches Rechnen 21. Januar 2013
 2.Klausur Chemisches Rechnen 21. Januar 2013 Name: Matrikelnr.: Dauer: 90 min. Maximal erreichbare Punkte: 40 Punkte 1 Sehr gut: 40 35.5 Punkte 2 Gut: 35 30.5 Punkte 3 Befriedigend: 30 25.5 Punkte 4 Genügend:
2.Klausur Chemisches Rechnen 21. Januar 2013 Name: Matrikelnr.: Dauer: 90 min. Maximal erreichbare Punkte: 40 Punkte 1 Sehr gut: 40 35.5 Punkte 2 Gut: 35 30.5 Punkte 3 Befriedigend: 30 25.5 Punkte 4 Genügend:
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2009/10 vom
 Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2009/10 vom 18.09.2009 A1 A2 A3 A4 A5 Σ Note 10 10 10 10 10 NAME:... VORNAME:...MUSTERLÖSUNG... Pseudonym für Ergebnisveröffentlichung:... Schreiben
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2009/10 vom 18.09.2009 A1 A2 A3 A4 A5 Σ Note 10 10 10 10 10 NAME:... VORNAME:...MUSTERLÖSUNG... Pseudonym für Ergebnisveröffentlichung:... Schreiben
1 Einsatzgrenzen von ZM-Auskleidungen für den Trinkwassertransport
 1 Einsatzgrenzen von ZM-Auskleidungen für den Trinkwassertransport Der Einsatzbereich von ZM-Auskleidungen als Korrosionsschutz ist sehr weitreichend. Derartig ausgekleidete Rohre sind geeignet zum Transport
1 Einsatzgrenzen von ZM-Auskleidungen für den Trinkwassertransport Der Einsatzbereich von ZM-Auskleidungen als Korrosionsschutz ist sehr weitreichend. Derartig ausgekleidete Rohre sind geeignet zum Transport
4 LÖSLICHKEITSPRODUKT
 Arbeitsunterlagen zur Vorlesung CHEMISCHES RECHNEN 701.118 (Auflage November 005) Einheit 4 LÖSLICHKEITSPRODUKT und KOMPLEXBILDUNG Institut für Chemie Universität für Bodenkultur T. Prohaska 4 LÖSLICHKEITSPRODUKT
Arbeitsunterlagen zur Vorlesung CHEMISCHES RECHNEN 701.118 (Auflage November 005) Einheit 4 LÖSLICHKEITSPRODUKT und KOMPLEXBILDUNG Institut für Chemie Universität für Bodenkultur T. Prohaska 4 LÖSLICHKEITSPRODUKT
A 2.6 Wie ist die Zusammensetzung der Flüssigkeit und des Dampfes eines Stickstoff-Sauerstoff-Gemischs
 A 2.1 Bei - 10 o C beträgt der Dampfdruck des Kohlendioxids 26,47 bar, die Dichte der Flüssigkeit 980,8 kg/m 3 und die Dichte des Dampfes 70,5 kg/m 3. Bei - 7,5 o C beträgt der Dampfdruck 28,44 bar. Man
A 2.1 Bei - 10 o C beträgt der Dampfdruck des Kohlendioxids 26,47 bar, die Dichte der Flüssigkeit 980,8 kg/m 3 und die Dichte des Dampfes 70,5 kg/m 3. Bei - 7,5 o C beträgt der Dampfdruck 28,44 bar. Man
1.2 Herkunft von Wasserinhaltsstoffen. Kationen H + - in natürlichen Wässern 6,5 < ph < 7,5, c(h + ) verursacht durch CO 2 (aq) und HCO 3
 1.2 Herkunft von Wasserinhaltsstoffen Kationen H + in natürlichen Wässern 6,5 < ph < 7,5, c(h + ) verursacht durch CO 2 (aq) und HCO 3 CO 2 (aq) + H 2 O H + + HCO 3 saure Spurengase SO 2, NO x, HCl und
1.2 Herkunft von Wasserinhaltsstoffen Kationen H + in natürlichen Wässern 6,5 < ph < 7,5, c(h + ) verursacht durch CO 2 (aq) und HCO 3 CO 2 (aq) + H 2 O H + + HCO 3 saure Spurengase SO 2, NO x, HCl und
Themen heute: Säuren und Basen, Redoxreaktionen
 Wiederholung der letzten Vorlesungsstunde: Massenwirkungsgesetz, Prinzip des kleinsten Zwangs, Löslichkeitsprodukt, Themen heute: Säuren und Basen, Redoxreaktionen Vorlesung Allgemeine Chemie, Prof. Dr.
Wiederholung der letzten Vorlesungsstunde: Massenwirkungsgesetz, Prinzip des kleinsten Zwangs, Löslichkeitsprodukt, Themen heute: Säuren und Basen, Redoxreaktionen Vorlesung Allgemeine Chemie, Prof. Dr.
Säuren und Basen. Der ph-wert Zur Feststellung, ob eine Lösung sauer oder basisch ist genügt es, die Konzentration der H 3 O H 3 O + + OH -
 Der ph-wert Zur Feststellung, ob eine Lösung sauer oder basisch ist genügt es, die Konzentration der H 3 O + (aq)-ionen anzugeben. Aus der Gleichung: H 2 O + H 2 O H 3 O + + OH - c(h 3 O + ) c(oh - ) K
Der ph-wert Zur Feststellung, ob eine Lösung sauer oder basisch ist genügt es, die Konzentration der H 3 O + (aq)-ionen anzugeben. Aus der Gleichung: H 2 O + H 2 O H 3 O + + OH - c(h 3 O + ) c(oh - ) K
Entwicklung der Bioatmosphäre
 https://www.woxikon.de/referate/biologie/entwicklung-der-bioatmosphaere Entwicklung der Bioatmosphäre Fach Biologie Klasse 10 Autor kbktv Veröffentlicht am 27.08.2018 Zusammenfassung In diesem Referat
https://www.woxikon.de/referate/biologie/entwicklung-der-bioatmosphaere Entwicklung der Bioatmosphäre Fach Biologie Klasse 10 Autor kbktv Veröffentlicht am 27.08.2018 Zusammenfassung In diesem Referat
Grundwasser: chemische Vorgänge bei der Infiltration. Redoxprozesse im Grundwasser Transport reaktiver Spezies
 Grundwasser: chemische Vorgänge bei der Infiltration Redoxprozesse im Grundwasser Transport reaktiver Spezies Belastungsquellen für Grundwasser Problematische Stoffe im Grundwasser für Trinkwassernutzung
Grundwasser: chemische Vorgänge bei der Infiltration Redoxprozesse im Grundwasser Transport reaktiver Spezies Belastungsquellen für Grundwasser Problematische Stoffe im Grundwasser für Trinkwassernutzung
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Biologie Arbeitsblätter mit Lösungen - Ökologie
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Biologie Arbeitsblätter mit Lösungen - Ökologie Das komplette Material finden Sie hier: Download bei School-Scout.de ÖKOLOGIE: Ökosystem
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Biologie Arbeitsblätter mit Lösungen - Ökologie Das komplette Material finden Sie hier: Download bei School-Scout.de ÖKOLOGIE: Ökosystem
Jana Platz, Hanna Vogler & Sarah Bach OHG Bi L1, Herr Kohlhepp Protokoll. Meerfelder Maar und Windsborn Kratersee Chemische Untersuchungen
 Jana Platz, Hanna Vogler & Sarah Bach OHG Bi L1, Herr Kohlhepp 11.11.212 Protokoll und Chemische Untersuchungen Windbsorn Datum: 16.8.212 Datum: 16.8.212 Uhrzeit: 1 Uhr Uhrzeit: 1:3 Uhr Analyse am 16.8.212
Jana Platz, Hanna Vogler & Sarah Bach OHG Bi L1, Herr Kohlhepp 11.11.212 Protokoll und Chemische Untersuchungen Windbsorn Datum: 16.8.212 Datum: 16.8.212 Uhrzeit: 1 Uhr Uhrzeit: 1:3 Uhr Analyse am 16.8.212
Zusammenfassung vom
 Zusammenfassung vom 20.10. 09 Löslichkeitsprodukt = quantitative Aussage über die Löslichkeit einer schwerlöslichen Verbindung bei gegebener Temperatur A m B n m A n+ + n B m- K L = (c A n+ ) m (c B m-
Zusammenfassung vom 20.10. 09 Löslichkeitsprodukt = quantitative Aussage über die Löslichkeit einer schwerlöslichen Verbindung bei gegebener Temperatur A m B n m A n+ + n B m- K L = (c A n+ ) m (c B m-
CHEMIE KAPITEL 4 SÄURE- BASE. Timm Wilke. Georg- August- Universität Göttingen. Wintersemester 2013 / 2014
 CHEMIE KAPITEL 4 SÄURE- BASE Timm Wilke Georg- August- Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Historisches Im 17. Jahrhundert wurden von Robert Boyle Gemeinsamkeiten verschiedener Verbindungen
CHEMIE KAPITEL 4 SÄURE- BASE Timm Wilke Georg- August- Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Historisches Im 17. Jahrhundert wurden von Robert Boyle Gemeinsamkeiten verschiedener Verbindungen
Praktikumsrelevante Themen
 Praktikumsrelevante Themen Lösungen Der Auflösungsprozess Beeinflussung der Löslichkeit durch Temperatur und Druck Konzentration von Lösungen Dampfdruck, Siede- und Gefrierpunkt von Lösungen Lösungen von
Praktikumsrelevante Themen Lösungen Der Auflösungsprozess Beeinflussung der Löslichkeit durch Temperatur und Druck Konzentration von Lösungen Dampfdruck, Siede- und Gefrierpunkt von Lösungen Lösungen von
DEFINITIONEN REINES WASSER
 SÄUREN UND BASEN 1) DEFINITIONEN REINES WASSER enthält gleich viel H + Ionen und OH Ionen aus der Reaktion H 2 O H + OH Die GGWKonstante dieser Reaktion ist K W = [H ]*[OH ] = 10 14 In die GGWKonstante
SÄUREN UND BASEN 1) DEFINITIONEN REINES WASSER enthält gleich viel H + Ionen und OH Ionen aus der Reaktion H 2 O H + OH Die GGWKonstante dieser Reaktion ist K W = [H ]*[OH ] = 10 14 In die GGWKonstante
Wasserchemie Modul 3. Titration Kalkkohlensäuregleichgewicht. Sauerstoff nach Winkler Titration von Metallen Kohlensäurespecies
 Wasserchemie Modul Titration Kalkkohlensäuregleichgewicht TIC-DOC DOC-TOC 1 1. Titrimetrische Bestimmungen Überblick Sauerstoff nach Winkler Titration von Metallen Kohlensäurespecies (KKG) Chloridbestimmung
Wasserchemie Modul Titration Kalkkohlensäuregleichgewicht TIC-DOC DOC-TOC 1 1. Titrimetrische Bestimmungen Überblick Sauerstoff nach Winkler Titration von Metallen Kohlensäurespecies (KKG) Chloridbestimmung
Elektrochemie und Sauerstoffmessung mit LDO. Der gelöste Sauerstoff
 Elektrochemie und Sauerstoffmessung mit LDO Der gelöste Sauerstoff 2 Was ist gelöster Sauerstoff? Gelöster Sauerstoff beschreibt die Konzentration von freiem (nicht chemisch gebundenem) molekularem Sauerstoff
Elektrochemie und Sauerstoffmessung mit LDO Der gelöste Sauerstoff 2 Was ist gelöster Sauerstoff? Gelöster Sauerstoff beschreibt die Konzentration von freiem (nicht chemisch gebundenem) molekularem Sauerstoff
Lösungen V 9. Gesättigte Lösung: ein gelöstes Salz steht mit seiner festen Phase, dem Bodenkörper, im Gleichgewicht
 Gesättigte Lösung: ein gelöstes Salz steht mit seiner festen Phase, dem Bodenkörper, im Gleichgewicht Löslichkeit: maximale Masse an in Lösung gehenden Salzen bezogen auf eine Lösungsmittelmenge; (T-abhängig)
Gesättigte Lösung: ein gelöstes Salz steht mit seiner festen Phase, dem Bodenkörper, im Gleichgewicht Löslichkeit: maximale Masse an in Lösung gehenden Salzen bezogen auf eine Lösungsmittelmenge; (T-abhängig)
Prüfung Allgemeine Chemie für Verfahrenstechniker (SS 2002)
 ChVT 2002/1 Prüfung Allgemeine Chemie für Verfahrenstechniker (SS 2002) Aufgabe 4: Benzin soll vereinfacht nur aus Oktan (C 8 H 18 ) bestehen. a) Wie viel Gramm Wasser (H 2 O) und b) b) wie viel Liter
ChVT 2002/1 Prüfung Allgemeine Chemie für Verfahrenstechniker (SS 2002) Aufgabe 4: Benzin soll vereinfacht nur aus Oktan (C 8 H 18 ) bestehen. a) Wie viel Gramm Wasser (H 2 O) und b) b) wie viel Liter
C Säure-Base-Reaktionen
 -V.C1- C Säure-Base-Reaktionen 1 Autoprotolyse des Wassers und ph-wert 1.1 Stoffmengenkonzentration Die Stoffmengenkonzentration eines gelösten Stoffes ist der Quotient aus der Stoffmenge und dem Volumen
-V.C1- C Säure-Base-Reaktionen 1 Autoprotolyse des Wassers und ph-wert 1.1 Stoffmengenkonzentration Die Stoffmengenkonzentration eines gelösten Stoffes ist der Quotient aus der Stoffmenge und dem Volumen
BITTE AUSFÜLLEN BITTE HALTEN SIE IHREN STUDENTAUSWEIS BEREIT. Matr.-Nr. Name: Vorname: Unterschrift:
 PUNKTZAHL NOTE 1 12.06.2001 Klausur zur Vorlesung "Grundzüge der Chemie" für Studierende des Maschinenbaus und des Studiengangs Umwelttechnik und Ressourcenmanagement Termin: 12. Juni 2001 Ort: HMA 10
PUNKTZAHL NOTE 1 12.06.2001 Klausur zur Vorlesung "Grundzüge der Chemie" für Studierende des Maschinenbaus und des Studiengangs Umwelttechnik und Ressourcenmanagement Termin: 12. Juni 2001 Ort: HMA 10
Bodenbildungspozesse: Redoximorphose
 Bodenbildungspozesse: Redoximorphose Pseudogley aus tertiärem Verwitterungslehm Ah 0-20 cm Sw 20-35 cm Swd 35-50 cm Sd 50-100 cm Profil 15, Rötz - Oberpfalz R. Brandhuber, Bayerische LfL Pseudovergleyung:
Bodenbildungspozesse: Redoximorphose Pseudogley aus tertiärem Verwitterungslehm Ah 0-20 cm Sw 20-35 cm Swd 35-50 cm Sd 50-100 cm Profil 15, Rötz - Oberpfalz R. Brandhuber, Bayerische LfL Pseudovergleyung:
Name: Matrikelnummer: Geburtsdatum: Hilfsmittel: Formelsammlung (beigefügt), Periodensystem (beigefügt), Taschenrechner
 Chemie für Physiker B. Sc. Physikalische Technik XXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXX Prof. Dr. Thomas Jüstel / Stephanie Möller M. Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe
Chemie für Physiker B. Sc. Physikalische Technik XXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXX Prof. Dr. Thomas Jüstel / Stephanie Möller M. Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe
Inhaltsverzeichnis 1 Theorie...1
 Inhaltsverzeichnis 1 Theorie...1 1.1 Gleichgewichtsreaktionen...1 1.1.1 Einführung...1 1.1.2 Thermodynamische Grundlagen...5 1.1.2.1 Massenwirkungsgesetz...5 1.1.2.2 Gibbs sche freie Energie...7 1.1.2.3
Inhaltsverzeichnis 1 Theorie...1 1.1 Gleichgewichtsreaktionen...1 1.1.1 Einführung...1 1.1.2 Thermodynamische Grundlagen...5 1.1.2.1 Massenwirkungsgesetz...5 1.1.2.2 Gibbs sche freie Energie...7 1.1.2.3
Zentralprüfung SwissChO 2016
 PROBLEM 1 - VERSCHIEDENE FRAGEN 9.5 PUNKTE a 6 N A = 3.61 10 4 mol 1 Punkt b Aufgrund der Verdünnung hat man 0.05M Br Ionen, 0.05M I Ionen und 0.1M Br + Ionen. 1/ Punkt wenn Br und I richtig, 1/ Punkt
PROBLEM 1 - VERSCHIEDENE FRAGEN 9.5 PUNKTE a 6 N A = 3.61 10 4 mol 1 Punkt b Aufgrund der Verdünnung hat man 0.05M Br Ionen, 0.05M I Ionen und 0.1M Br + Ionen. 1/ Punkt wenn Br und I richtig, 1/ Punkt
Der globale Kohlenstoffkreislauf
 Der globale Kohlenstoffkreislauf Eine wesentliche Motivation für die Untersuchung des globalen Kohlenstoffkreislaufs ist der anthropogen bedingte Anstieg der atmosphärischen Konzentration von klimarelevanten
Der globale Kohlenstoffkreislauf Eine wesentliche Motivation für die Untersuchung des globalen Kohlenstoffkreislaufs ist der anthropogen bedingte Anstieg der atmosphärischen Konzentration von klimarelevanten
LeWis» ph-wert Berechnungen «Kapitel 5
 Additum 5. Wässrige Lösungen mehrprotoniger Säuren und Basen Ziel dieses Kapitels ist es, eine weitere Anwendungsmöglichkeit des bisher erlernten Vorgehenskonzepts vorzustellen. Die Berechnung von ph-werten
Additum 5. Wässrige Lösungen mehrprotoniger Säuren und Basen Ziel dieses Kapitels ist es, eine weitere Anwendungsmöglichkeit des bisher erlernten Vorgehenskonzepts vorzustellen. Die Berechnung von ph-werten
Lösung 7. Allgemeine Chemie I Herbstsemester Je nach Stärke einer Säure tritt eine vollständige oder nur eine teilweise Dissoziation auf.
 Lösung 7 Allgemeine Chemie I Herbstsemester 2012 1. Aufgabe Je nach Stärke einer Säure tritt eine vollständige oder nur eine teilweise Dissoziation auf. Chlorwasserstoff ist eine starke Säure (pk a = 7),
Lösung 7 Allgemeine Chemie I Herbstsemester 2012 1. Aufgabe Je nach Stärke einer Säure tritt eine vollständige oder nur eine teilweise Dissoziation auf. Chlorwasserstoff ist eine starke Säure (pk a = 7),
Das chemische Gleichgewicht, Massenwirkungsgesetz, Löslichkeit von Salzen in Flüssigkeiten, Löslichkeitsprodukt, Chemische Gleichgewichte, Säuren und
 Wiederholung der letzten Vorlesungsstunde: Das chemische Gleichgewicht, Massenwirkungsgesetz, Löslichkeit von Salzen in Flüssigkeiten, Löslichkeitsprodukt, Thema heute: Chemische Gleichgewichte, Säuren
Wiederholung der letzten Vorlesungsstunde: Das chemische Gleichgewicht, Massenwirkungsgesetz, Löslichkeit von Salzen in Flüssigkeiten, Löslichkeitsprodukt, Thema heute: Chemische Gleichgewichte, Säuren
Säurekapazität in der Belebung einer Kläranlage
 LV Bayern, Besprechung der Lehrer Kläranlagen-Nachbarschaft 2014 Säurekapazität in der Belebung einer Kläranlage Dipl.-Ing. Annette Schlicher, Struktur- und Genehmigungsdirektion Süd, Regionalstelle Wasserwirtschaft,
LV Bayern, Besprechung der Lehrer Kläranlagen-Nachbarschaft 2014 Säurekapazität in der Belebung einer Kläranlage Dipl.-Ing. Annette Schlicher, Struktur- und Genehmigungsdirektion Süd, Regionalstelle Wasserwirtschaft,
Energetik und Kinetik chemischer Reaktionen
 Energetik und Kinetik chemischer Reaktionen Reaktionsenergetik als Teil der Thermodynamik - wann läuft eine chemische Reaktion freiwillig ab? - in welchem Umfang läuft eine Reaktion ab? - wie viel Energie
Energetik und Kinetik chemischer Reaktionen Reaktionsenergetik als Teil der Thermodynamik - wann läuft eine chemische Reaktion freiwillig ab? - in welchem Umfang läuft eine Reaktion ab? - wie viel Energie
Chemiebuch Elemente Lösungen zu Aufgaben aus Kapitel 13
 Kantonsschule Kreuzlingen, Klaus Hensler Chemiebuch Elemente Lösungen zu Aufgaben aus Kapitel 13 Grundregeln für stöchiometrische Berechnungen Wenn es um Reaktionen geht zuerst die chem. Gleichung aufstellen
Kantonsschule Kreuzlingen, Klaus Hensler Chemiebuch Elemente Lösungen zu Aufgaben aus Kapitel 13 Grundregeln für stöchiometrische Berechnungen Wenn es um Reaktionen geht zuerst die chem. Gleichung aufstellen
Regenwassereinleitungen in Stadtgewässer Effekte von Sanierungsmaßnahmen am Beispiel des Halensees
 Regenwassereinleitungen in Stadtgewässer Effekte von Sanierungsmaßnahmen am Beispiel des Halensees Andreas Matzinger & Seán Oppermann unterstützt durch: Günter Gunkel, TU Berlin, FG Wasserreinhaltung Benedikt
Regenwassereinleitungen in Stadtgewässer Effekte von Sanierungsmaßnahmen am Beispiel des Halensees Andreas Matzinger & Seán Oppermann unterstützt durch: Günter Gunkel, TU Berlin, FG Wasserreinhaltung Benedikt
Bundesrealgymnasium Imst. Chemie Klasse 7. Säuren und Basen
 Bundesrealgymnasium Imst Chemie 2010-11 Klasse 7 Säuren und Basen Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter
Bundesrealgymnasium Imst Chemie 2010-11 Klasse 7 Säuren und Basen Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter
Allgemeine Chemie für Studierende mit Nebenfach Chemie Andreas Rammo
 Allgemeine Chemie für Studierende mit Nebenfach Chemie Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de innere Energie U Energieumsatz bei
Allgemeine Chemie für Studierende mit Nebenfach Chemie Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de innere Energie U Energieumsatz bei
PAS I. Inhalt 3. Sitzung. Physik Aquatischer Systeme I. 3. Dichteschichtung ( ) ( ) Salzgehalt und Dichte
 PAS I Physik Aquatischer Systeme I 3. Dichteschichtung Inhalt 3. Sitzung Kap. 1. Physikalische Eigenschaften des Wassers 1.6 Gelöste Stoffe, Dichte, und elektrische Leitfähigkeit Dichte als Funktion des
PAS I Physik Aquatischer Systeme I 3. Dichteschichtung Inhalt 3. Sitzung Kap. 1. Physikalische Eigenschaften des Wassers 1.6 Gelöste Stoffe, Dichte, und elektrische Leitfähigkeit Dichte als Funktion des
Stöchiometrie-Seminar April 2019 Moritz Helmstädter 1
 Stöchiometrie-Seminar 4 1 Themen des heutigen Seminars 1) Zusammenfassung des letzten Seminars 2) Besprechung der Hausaufgaben 3) Theorie 4) Übungsaufgaben 2 Themen des heutigen Seminars 1) Zusammenfassung
Stöchiometrie-Seminar 4 1 Themen des heutigen Seminars 1) Zusammenfassung des letzten Seminars 2) Besprechung der Hausaufgaben 3) Theorie 4) Übungsaufgaben 2 Themen des heutigen Seminars 1) Zusammenfassung
PC-Übung Nr.1 vom
 PC-Übung Nr.1 vom 17.10.08 Sebastian Meiss 25. November 2008 1. Allgemeine Vorbereitung a) Geben Sie die Standardbedingungen in verschiedenen Einheiten an: Druck p in Pa, bar, Torr, atm Temperatur T in
PC-Übung Nr.1 vom 17.10.08 Sebastian Meiss 25. November 2008 1. Allgemeine Vorbereitung a) Geben Sie die Standardbedingungen in verschiedenen Einheiten an: Druck p in Pa, bar, Torr, atm Temperatur T in
Allgemeine Chemie / Lösungsvorschläge Aufgaben
 Allgemeine Chemie / Lösungsvorschläge Aufgaben 1) offene Systeme >>> Erlenmeyerkolben ohne Stopfen geschlossene Systeme >>>> Luftballon abgeschlossen>>>> Thermoskanne 2) M(Ausgangsstoff) = 404 g/mol n(fe
Allgemeine Chemie / Lösungsvorschläge Aufgaben 1) offene Systeme >>> Erlenmeyerkolben ohne Stopfen geschlossene Systeme >>>> Luftballon abgeschlossen>>>> Thermoskanne 2) M(Ausgangsstoff) = 404 g/mol n(fe
Vorlesung Wasserinhaltsstoffe. Dr. Thomas Dittmar. Anionen
 Vorlesung Wasserinhaltsstoffe Dr. Thomas Dittmar Anionen 07/2011 Anorganische Anionen als natürliche Wasserinhaltsstoffe 1. natürliche Wasserinhaltsstoffe Hauptinhaltsstoffe (meist > 10 mg/l) Cl -, HCO
Vorlesung Wasserinhaltsstoffe Dr. Thomas Dittmar Anionen 07/2011 Anorganische Anionen als natürliche Wasserinhaltsstoffe 1. natürliche Wasserinhaltsstoffe Hauptinhaltsstoffe (meist > 10 mg/l) Cl -, HCO
Kolligative Eigenschaften
 Kolligative Eigenschaften Kolligative (lat. colligare, sammeln) Eigenschaften (in verdünnter Lösung): f(nzahl der eilchen des gelösten Stoffs) f(rt der eilchen des gelösten Stoffs) eispiel: Gefrierpunkt,
Kolligative Eigenschaften Kolligative (lat. colligare, sammeln) Eigenschaften (in verdünnter Lösung): f(nzahl der eilchen des gelösten Stoffs) f(rt der eilchen des gelösten Stoffs) eispiel: Gefrierpunkt,
Aufgabe 1: Geben Sie die korrespondierenden Basen zu folgenden Verbindungen an: a) H 3 PO 4 b) H 2 PO 4
 Übungsaufgaben zum Thema Säuren, Basen und Puffer Säure/Base Definition nach Brǿnsted: Säuren sind Stoffe, die Protonen abgeben können (Protonendonatoren). Basen sind Stoffe, die Protonen aufnehmen können
Übungsaufgaben zum Thema Säuren, Basen und Puffer Säure/Base Definition nach Brǿnsted: Säuren sind Stoffe, die Protonen abgeben können (Protonendonatoren). Basen sind Stoffe, die Protonen aufnehmen können
CHEMIE KAPITEL 4 SÄURE-BASE. Timm Wilke. Georg-August-Universität Göttingen. Wintersemester 2013 / 2014
 CHEMIE KAPITEL 4 SÄURE-BASE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Aufgaben In einen Liter Wasser werden 2 g NH - 2 (starke Base) eingeleitet welchen ph-wert hat
CHEMIE KAPITEL 4 SÄURE-BASE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Aufgaben In einen Liter Wasser werden 2 g NH - 2 (starke Base) eingeleitet welchen ph-wert hat
0 Einleitung 0.1 Vorbemerkungen
 0 Einleitung 0.1 Vorbemerkungen Professur Radiochemie Sommersemester 2010 Vorlesung: Umweltchemie Gliederung: 0 Einleitung 0.1 Vorbemerkungen 0.2 Definition Umweltchemie 1 Entstehung der Umwelt 1.1 Bildung
0 Einleitung 0.1 Vorbemerkungen Professur Radiochemie Sommersemester 2010 Vorlesung: Umweltchemie Gliederung: 0 Einleitung 0.1 Vorbemerkungen 0.2 Definition Umweltchemie 1 Entstehung der Umwelt 1.1 Bildung
Analyse der Chemischen Wasseruntersuchungen der Aisch 2009
 Analyse der Chemischen Wasseruntersuchungen der Aisch 2009 Gemessen wurde an 3 verschiedenen Stellen der Aisch (Meßstellen lagen an der Brücke Birkenfeld/Schauerheim, oberhalb Wehr Pahres, Trafo Dachsbach)
Analyse der Chemischen Wasseruntersuchungen der Aisch 2009 Gemessen wurde an 3 verschiedenen Stellen der Aisch (Meßstellen lagen an der Brücke Birkenfeld/Schauerheim, oberhalb Wehr Pahres, Trafo Dachsbach)
Wiederholungen. Puffergleichung (Henderson-Hasselbalch) Ionenprodukt des Wassers. ph-wert-berechnungen. Titrationskurvenberechnung
 Vorlesung 22: Wiederholungen Puffergleichung (Henderson-Hasselbalch) Ionenprodukt des Wassers ph-wert-berechnungen Titrationskurvenberechnung Säuren und Basen Hydroxonium + Chlorid Ammonium + Hydroxid
Vorlesung 22: Wiederholungen Puffergleichung (Henderson-Hasselbalch) Ionenprodukt des Wassers ph-wert-berechnungen Titrationskurvenberechnung Säuren und Basen Hydroxonium + Chlorid Ammonium + Hydroxid
Analytische Chemie. B. Sc. Chemieingenieurwesen. 14. März Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 14. März 2007 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 14. März 2007 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Biologische Abwasserreinigung und Belüftung Auswirkungen auf den Betrieb von KKA
 Biologische Abwasserreinigung und Belüftung Auswirkungen auf den Betrieb von KKA Prof. Dr.-Ing. Jens Nowak FH Potsdam AKUT Umweltschutz Ingenieure Burkard und Partner Berlin Prof. Dr.-Ing. Jens Nowak Obmann
Biologische Abwasserreinigung und Belüftung Auswirkungen auf den Betrieb von KKA Prof. Dr.-Ing. Jens Nowak FH Potsdam AKUT Umweltschutz Ingenieure Burkard und Partner Berlin Prof. Dr.-Ing. Jens Nowak Obmann
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Teilnahmebescheinigungen Mail an christoph.woelper@uni-due.de
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Teilnahmebescheinigungen Mail an christoph.woelper@uni-due.de
Holzsee. Sauerstoff-Profile Die Sauerstoff-Bedingungen in der oberflächennahen
 Seen-Monographien Gewässersystem Schwentine Einzugsgebiet (km ), Uferlänge (km), Wasserfläche (km ), Mittlere Tiefe, Maximale Tiefe,9 Theoret. Erneuerungszeit, Jahre Auswertung 99-9: Edith Reck-Mieth Temperatur-Profile
Seen-Monographien Gewässersystem Schwentine Einzugsgebiet (km ), Uferlänge (km), Wasserfläche (km ), Mittlere Tiefe, Maximale Tiefe,9 Theoret. Erneuerungszeit, Jahre Auswertung 99-9: Edith Reck-Mieth Temperatur-Profile
Was bedeutet das für den See:
 Es wird viel über Düngung Phosphat, Nitrat, NOx und was sonst noch unsere Umwelt bedroht geredet. Hier wird ein Versuch gemacht die Wirkung von Phosphat und den Stickstoffweg über die Gülle ins Wasser
Es wird viel über Düngung Phosphat, Nitrat, NOx und was sonst noch unsere Umwelt bedroht geredet. Hier wird ein Versuch gemacht die Wirkung von Phosphat und den Stickstoffweg über die Gülle ins Wasser
Atmosphärische Gase als natürliche Tracer für die Dynamik von Fluss- und Grundwassersystemen
 1 / 30 Atmosphärische Gase als natürliche Tracer für die Dynamik von Fluss- und Grundwassersystemen Matthias Brennwald matthias.brennwald@eawag.ch Eawag PEAK Kurs, 27.11.2014 http://homepages.eawag.ch/~brennmat/lehre
1 / 30 Atmosphärische Gase als natürliche Tracer für die Dynamik von Fluss- und Grundwassersystemen Matthias Brennwald matthias.brennwald@eawag.ch Eawag PEAK Kurs, 27.11.2014 http://homepages.eawag.ch/~brennmat/lehre
1. Wärmelehre 1.1. Temperatur. Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités)
 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für die Temperatur Prinzip
1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für die Temperatur Prinzip
A 1.1 a Wie groß ist das Molvolumen von Helium, flüssigem Wasser, Kupfer, Stickstoff und Sauerstoff bei 1 bar und 25 C?
 A 1.1 a Wie groß ist das Molvolumen von Helium, flüssigem Wasser, Kupfer, Stickstoff und Sauerstoff bei 1 bar und 25 C? (-> Tabelle p) A 1.1 b Wie groß ist der Auftrieb eines Helium (Wasserstoff) gefüllten
A 1.1 a Wie groß ist das Molvolumen von Helium, flüssigem Wasser, Kupfer, Stickstoff und Sauerstoff bei 1 bar und 25 C? (-> Tabelle p) A 1.1 b Wie groß ist der Auftrieb eines Helium (Wasserstoff) gefüllten
Abwasseraufbereitung Biologische Aufbereitung
 Leonardo da Vinci Projekt Nachhaltigkeit in der gewerblichen Wäscherei Modul 1 Wasseranwendung Kapitel 5 b Abwasseraufbereitung Biologische Aufbereitung 1 Inhalt Einleitung Wäschereiabwasser Mikroorganismen
Leonardo da Vinci Projekt Nachhaltigkeit in der gewerblichen Wäscherei Modul 1 Wasseranwendung Kapitel 5 b Abwasseraufbereitung Biologische Aufbereitung 1 Inhalt Einleitung Wäschereiabwasser Mikroorganismen
Natürliche ökologische Energie- und Stoffkreisläufe
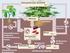 Informationsmaterialien über den ökologischen Landbau für den Unterricht an allgemein bildenden Schulen. Initiiert durch das Bundesministerium für Verbraucherschutz, Ernährung und Landwirtschaft im Rahmen
Informationsmaterialien über den ökologischen Landbau für den Unterricht an allgemein bildenden Schulen. Initiiert durch das Bundesministerium für Verbraucherschutz, Ernährung und Landwirtschaft im Rahmen
Lernziele: Phasen, Komponenten, Freiheitsgrade Die Phasenregel Zweikomponentensysteme: Dampfdruckdiagramme,
 Phasendiagramme Lernziele: ee Phasen, Komponenten, Freiheitsgrade Die Phasenregel Zweikomponentensysteme: Dampfdruckdiagramme, Hebelgesetz Zweikomponentensysteme: Siedediagramme (die Distillation von Mischungen,
Phasendiagramme Lernziele: ee Phasen, Komponenten, Freiheitsgrade Die Phasenregel Zweikomponentensysteme: Dampfdruckdiagramme, Hebelgesetz Zweikomponentensysteme: Siedediagramme (die Distillation von Mischungen,
Professur Radiochemie Sommersemester 2009
 Professur Radiochemie Sommersemester 2009 Vorlesung: Umweltchemie Gliederung: 0 Einleitung 0.1 Vorbemerkungen 0.2 Definition Umweltchemie 1 Entstehung der Umwelt 1.1 Bildung der Elemente 1.2 Aufbau der
Professur Radiochemie Sommersemester 2009 Vorlesung: Umweltchemie Gliederung: 0 Einleitung 0.1 Vorbemerkungen 0.2 Definition Umweltchemie 1 Entstehung der Umwelt 1.1 Bildung der Elemente 1.2 Aufbau der
Seminar zum Quantitativen Anorganischen Praktikum WS 2011/12
 Seminar zum Quantitativen Anorganischen Praktikum WS 211/12 Teil des Moduls MN-C-AlC Dr. Matthias Brühmann Dr. Christian Rustige Inhalt Montag, 9.1.212, 8-1 Uhr, HS III Allgemeine Einführung in die Quantitative
Seminar zum Quantitativen Anorganischen Praktikum WS 211/12 Teil des Moduls MN-C-AlC Dr. Matthias Brühmann Dr. Christian Rustige Inhalt Montag, 9.1.212, 8-1 Uhr, HS III Allgemeine Einführung in die Quantitative
Säuren und Basen. Dr. Torsten Beweries AC I - Allgemeine Chemie LAC-CH01 WS 2016/17.
 Säuren und Basen Dr. Torsten Beweries AC I - Allgemeine Chemie LAC-CH01 WS 2016/17 torsten.beweries@catalysis.de http://www.catalysis.de/forschung/koordinationschemische-katalyse/koordinationschemische-wasserspaltung/
Säuren und Basen Dr. Torsten Beweries AC I - Allgemeine Chemie LAC-CH01 WS 2016/17 torsten.beweries@catalysis.de http://www.catalysis.de/forschung/koordinationschemische-katalyse/koordinationschemische-wasserspaltung/
Fällung und Flockung. Platzhalter für Bild, Bild auf Titelfolie hinter das Logo einsetzen. Übung zur Vorlesung Verfahrenstechnik der Abwasserreinigung
 Platzhalter für Bild, Bild auf Titelfolie hinter das Logo einsetzen Fällung und Flockung Übung zur Vorlesung Verfahrenstechnik der Abwasserreinigung Betül Morcali 29.01.2016 Agenda Auffrischung Definition
Platzhalter für Bild, Bild auf Titelfolie hinter das Logo einsetzen Fällung und Flockung Übung zur Vorlesung Verfahrenstechnik der Abwasserreinigung Betül Morcali 29.01.2016 Agenda Auffrischung Definition
Fällung und Flockung. Platzhalter für Bild, Bild auf Titelfolie hinter das Logo einsetzen. Übung zur Vorlesung Verfahrenstechnik der Abwasserreinigung
 Platzhalter für Bild, Bild auf Titelfolie hinter das Logo einsetzen Fällung und Flockung Übung zur Vorlesung Verfahrenstechnik der Abwasserreinigung Betül Morcali 27.01.2017 Agenda Auffrischung Definition
Platzhalter für Bild, Bild auf Titelfolie hinter das Logo einsetzen Fällung und Flockung Übung zur Vorlesung Verfahrenstechnik der Abwasserreinigung Betül Morcali 27.01.2017 Agenda Auffrischung Definition
ÜBUNGEN ZUR VORLESUNG Physikalische Chemie I (PC I) (Prof. Meerholz, Hertel, Klemmer) Blatt 14,
 ÜBUNGEN ZUR VORLESUNG Physikalische Chemie I (PC I) (Prof. Meerholz, Hertel, Klemmer) Blatt 14, 12.02.2016 Aufgabe 1 Kreisprozesse Mit einem Mol eines idealen, monoatomaren Gases (cv = 3/2 R) wird, ausgehend
ÜBUNGEN ZUR VORLESUNG Physikalische Chemie I (PC I) (Prof. Meerholz, Hertel, Klemmer) Blatt 14, 12.02.2016 Aufgabe 1 Kreisprozesse Mit einem Mol eines idealen, monoatomaren Gases (cv = 3/2 R) wird, ausgehend
Wechselwirkung Umwelt, Packmittel und Füllgut: Stofftransporte
 Wechselwirkung Umwelt, Packmittel und Füllgut: Stofftransporte Diffusion, Strömung (Strahlung) Desorption Permeation: Adsorption, Lösung Diffusion Füllgut Migration Packstoff, Packmittel Stofftransport
Wechselwirkung Umwelt, Packmittel und Füllgut: Stofftransporte Diffusion, Strömung (Strahlung) Desorption Permeation: Adsorption, Lösung Diffusion Füllgut Migration Packstoff, Packmittel Stofftransport
Tracer in der aquatischen Umwelt
 Tracer in der aquatischen Umwelt Geohydromodellierung Institut für Geowissenschaften Christian-Albrechts-Universität zu Kiel 3-1 Datierung von jungen Wässern Datierungsmethoden für junge Wässer (< 40 a)
Tracer in der aquatischen Umwelt Geohydromodellierung Institut für Geowissenschaften Christian-Albrechts-Universität zu Kiel 3-1 Datierung von jungen Wässern Datierungsmethoden für junge Wässer (< 40 a)
1/37. Das Protolysegleichgewicht. Wie könnte man die Stärke einer Säure quantitativ definieren?
 Das Protolysegleichgewicht 1/37 Wie könnte man die Stärke einer Säure quantitativ definieren? Das Protolysegleichgewicht 2/37 Wie könnte man die Stärke einer Säure quantitativ definieren? Ein erster Ansatz
Das Protolysegleichgewicht 1/37 Wie könnte man die Stärke einer Säure quantitativ definieren? Das Protolysegleichgewicht 2/37 Wie könnte man die Stärke einer Säure quantitativ definieren? Ein erster Ansatz
Forschung ist teuer! Zeit, das zu ändern! Dr. Roman Gunold, machbar Potsdam/FabLab Leipzig
 Forschung ist teuer! Zeit, das zu ändern! Dr. Roman Gunold, machbar Potsdam/FabLab Leipzig Die machbar Potsdam / der Wissenschaftsladen Potsdam e.v. Offene Werkstatt, die von jedermann genutzt werden kann
Forschung ist teuer! Zeit, das zu ändern! Dr. Roman Gunold, machbar Potsdam/FabLab Leipzig Die machbar Potsdam / der Wissenschaftsladen Potsdam e.v. Offene Werkstatt, die von jedermann genutzt werden kann
Limnochemisches Praktikum
 TU Dresden Institut für Wasserchemie Bestimmung des m-wertes sowie des CSB verschiedener Wässer Theoretische Grundlagen Limnochemisches Praktikum 1. Theoretische Grundlagen zur Bestimmung des m-wertes
TU Dresden Institut für Wasserchemie Bestimmung des m-wertes sowie des CSB verschiedener Wässer Theoretische Grundlagen Limnochemisches Praktikum 1. Theoretische Grundlagen zur Bestimmung des m-wertes
Einführung. Galvanische Zelle. Korrosion + - Univ.-Prof. Dr. Max J. Setzer Vorlesung - Korrosion Seite 1
 Univ.-Prof. Dr. Max J. Setzer Vorlesung - Korrosion Seite 1 Einführung MWG 8 / Die Korrosion ist ein Redox-Prozess Bei der Änderung der Oxidationsstufe entstehen Ionen geladene Teilchen. Der Oxidationsprozess
Univ.-Prof. Dr. Max J. Setzer Vorlesung - Korrosion Seite 1 Einführung MWG 8 / Die Korrosion ist ein Redox-Prozess Bei der Änderung der Oxidationsstufe entstehen Ionen geladene Teilchen. Der Oxidationsprozess
Begasung des Seewassers durch Luftsauerstoff durch Anwendung mikroporöser Schlauchsysteme in Segelhäfen am Dümmer Möglichkeiten und Grenzen
 Begasung des Seewassers durch Luftsauerstoff durch Anwendung mikroporöser Schlauchsysteme in Segelhäfen am Dümmer Möglichkeiten und Grenzen Prof. Dr.-Ing. Norbert Nowack Sauerstoffgehalt über 3 mg-o 2
Begasung des Seewassers durch Luftsauerstoff durch Anwendung mikroporöser Schlauchsysteme in Segelhäfen am Dümmer Möglichkeiten und Grenzen Prof. Dr.-Ing. Norbert Nowack Sauerstoffgehalt über 3 mg-o 2
4.3 Reaktionsgeschwindigkeit und Katalysator
 4.3 Reaktionsgeschwindigkeit und Katalysator - Neben der thermodynamischen Lage des chemischen Gleichgewichts ist der zeitliche Ablauf der Reaktion, also die Geschwindigkeit der Ein- Einstellung des Gleichgewichts,
4.3 Reaktionsgeschwindigkeit und Katalysator - Neben der thermodynamischen Lage des chemischen Gleichgewichts ist der zeitliche Ablauf der Reaktion, also die Geschwindigkeit der Ein- Einstellung des Gleichgewichts,
Säure - Base - Theorien
 Säure Base Theorien S. Arrhenius (1887) Säuren sind Stoffe, die in wässriger Lösung H + (aq) Ionen bilden, während Basen OH (aq) Ionen bilden. H 2 SO 4, HNO 3, HCl, NaOH, Ba(OH) 2, aber: NH 3, CH 3, OCH
Säure Base Theorien S. Arrhenius (1887) Säuren sind Stoffe, die in wässriger Lösung H + (aq) Ionen bilden, während Basen OH (aq) Ionen bilden. H 2 SO 4, HNO 3, HCl, NaOH, Ba(OH) 2, aber: NH 3, CH 3, OCH
Versuch BS Stofftransport in der Blasensäule Absorption von Luftsauerstoff in Wasser. 1.) Absorption von Luftsauerstoff in Wasser.
 Versuch BS Stofftransport in der Blasensäule Absorption von Luftsauerstoff in Wasser 1.) Absorption von Luftsauerstoff in Wasser Aufgabenstellung: - Untersuchung der Absorption von Luftsauerstoff in H
Versuch BS Stofftransport in der Blasensäule Absorption von Luftsauerstoff in Wasser 1.) Absorption von Luftsauerstoff in Wasser Aufgabenstellung: - Untersuchung der Absorption von Luftsauerstoff in H
CHEMISCHE UND BIOLOGISCHE FUNKTION VON CALCIUM IN DER ABWASSERREINIGUNG. Norbert Weber Bundesverband der Deutschen Kalkindustrie e.v.
 CHEMISCHE UND BIOLOGISCHE FUNKTION VON CALCIUM IN DER ABWASSERREINIGUNG Norbert Weber Bundesverband der Deutschen Kalkindustrie e.v. Köln 1 Gliederung - Kalk - Kohlenstoff - Kreislauf - Wasserplanet Erde
CHEMISCHE UND BIOLOGISCHE FUNKTION VON CALCIUM IN DER ABWASSERREINIGUNG Norbert Weber Bundesverband der Deutschen Kalkindustrie e.v. Köln 1 Gliederung - Kalk - Kohlenstoff - Kreislauf - Wasserplanet Erde
Allgemeine Chemie für Biologen und Pharmazeuten (Robelek):
 Allgemeine Chemie für Biologen und Pharmazeuten (Robelek): 1.02.2014 1) Sie haben zwei SalpetersäureLösungen vorliegen. Eine phmessung beider Lösungen liefert für die erste Lösung einen phwert von 0,3
Allgemeine Chemie für Biologen und Pharmazeuten (Robelek): 1.02.2014 1) Sie haben zwei SalpetersäureLösungen vorliegen. Eine phmessung beider Lösungen liefert für die erste Lösung einen phwert von 0,3
Lösungsvorschlag Übung 2
 Lösungsvorschlag Übung Aufgabe : Dichte von Gasen a) Die Dichte ρ eines Gases ist definiert als der Quotient aus Masse m und Volumen V ρ = m V..) Die Masse eines Gases erhält man aus dem Produkt seiner
Lösungsvorschlag Übung Aufgabe : Dichte von Gasen a) Die Dichte ρ eines Gases ist definiert als der Quotient aus Masse m und Volumen V ρ = m V..) Die Masse eines Gases erhält man aus dem Produkt seiner
ph-wert Berechnung für starke Säuren / Basen
 ph-wert Berechnung für starke Säuren / Basen 0.1 mol/l HCl: HCl + H 2 O H 3 O + + Cl starke Säure, vollständige Dissoziation [H 3 O + ] = 10 1 mol/l; ph = 1 0.1 mol/l NaOH: NaOH + H 2 O Na + aq + OH starke
ph-wert Berechnung für starke Säuren / Basen 0.1 mol/l HCl: HCl + H 2 O H 3 O + + Cl starke Säure, vollständige Dissoziation [H 3 O + ] = 10 1 mol/l; ph = 1 0.1 mol/l NaOH: NaOH + H 2 O Na + aq + OH starke
4 Thermodynamik mikroskopisch: kinetische Gastheorie makroskopisch: System:
 Theorie der Wärme kann auf zwei verschiedene Arten behandelt werden. mikroskopisch: Bewegung von Gasatomen oder -molekülen. Vielzahl von Teilchen ( 10 23 ) im Allgemeinen nicht vollständig beschreibbar
Theorie der Wärme kann auf zwei verschiedene Arten behandelt werden. mikroskopisch: Bewegung von Gasatomen oder -molekülen. Vielzahl von Teilchen ( 10 23 ) im Allgemeinen nicht vollständig beschreibbar
Skript zur Vorlesung
 Skript zur Vorlesung 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für
Skript zur Vorlesung 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für
Lanker See. Auswertung : Edith Reck-Mieth
 Seen-Monographien Gewässersystem Schwentine Einzugsgebiet (km 2 ) 46 Uferlänge (km),2 Wasserfläche (km2) 3,8 Mittlere Tiefe (m) 3,6 Maximale Tiefe (m), Theoret. Erneuerungszeit, Messstellen M: Wahlstorf,
Seen-Monographien Gewässersystem Schwentine Einzugsgebiet (km 2 ) 46 Uferlänge (km),2 Wasserfläche (km2) 3,8 Mittlere Tiefe (m) 3,6 Maximale Tiefe (m), Theoret. Erneuerungszeit, Messstellen M: Wahlstorf,
Phasen, Komponenten, Freiheitsgrade
 Phasendiagramme Lernziele: Phasen, Komonenten, Freiheitsgrade Die Phasenregel Zweikomonentensysteme: Damfdruckdiagramme, Hebelgesetz Zweikomonentensysteme: Siedediagramme (die Destillation von Mischungen,
Phasendiagramme Lernziele: Phasen, Komonenten, Freiheitsgrade Die Phasenregel Zweikomonentensysteme: Damfdruckdiagramme, Hebelgesetz Zweikomonentensysteme: Siedediagramme (die Destillation von Mischungen,
Spezialfälle. BOYLE-MARIOTT`sches Gesetz p V = n R T bei T, n = konstant: p V = const. GAY-LUSSAC`sches Gesetz. bei V, n = konstant: p = const.
 Spezialfälle BOYLE-MARIOTT`sches Gesetz p V = n R T bei T, n = konstant: p V = const. GAY-LUSSAC`sches Gesetz p V = n R T bei V, n = konstant: p = const. T Druck Druck V = const. Volumen T 2 T 1 Temperatur
Spezialfälle BOYLE-MARIOTT`sches Gesetz p V = n R T bei T, n = konstant: p V = const. GAY-LUSSAC`sches Gesetz p V = n R T bei V, n = konstant: p = const. T Druck Druck V = const. Volumen T 2 T 1 Temperatur
Verfahrenstechnisches Praktikum
 Engler-Bunte-Institut Lehrstuhl für Wasserchemie und Wassertechnologie Leiter: Prof. Dr. Harald Horn Verfahrenstechnisches Praktikum 22999 Kinetik der Eisen(II)-Oxidation Engler-Bunte-Institut, Bereich
Engler-Bunte-Institut Lehrstuhl für Wasserchemie und Wassertechnologie Leiter: Prof. Dr. Harald Horn Verfahrenstechnisches Praktikum 22999 Kinetik der Eisen(II)-Oxidation Engler-Bunte-Institut, Bereich
Verbrennung und Dampferzeugung
 Institut für Energietechnik, Verbrennung und Dampferzeugung - universitäres Fernstudium Wasseraufbereitung, Kühlsysteme, Verschmutzungen im Dampferzeuger - Wasser und Wasseraufbereitung - Folie 2 von 30
Institut für Energietechnik, Verbrennung und Dampferzeugung - universitäres Fernstudium Wasseraufbereitung, Kühlsysteme, Verschmutzungen im Dampferzeuger - Wasser und Wasseraufbereitung - Folie 2 von 30
Physikalische Aspekte der Respiration
 Physikalische Aspekte der Respiration Christoph Hitzenberger Zentrum für Biomedizinische Technik und Physik Themenübersicht Physik der Gase o Ideale Gasgleichung o Atmosphärische Luft o Partialdruck Strömungsmechanik
Physikalische Aspekte der Respiration Christoph Hitzenberger Zentrum für Biomedizinische Technik und Physik Themenübersicht Physik der Gase o Ideale Gasgleichung o Atmosphärische Luft o Partialdruck Strömungsmechanik
Organische Chemie 1 Teil 2 1. Vorlesung, Dienstag
 Inhalte der 1. Vorlesung: 1. Die Reaktivität organischer Moleküle 1.1 Warum geschehen Chemische Reaktionen 1.2 Gleichgewichtsreaktionen, Ungleichgewichtsreaktionen 1.2.1 Triebkraft chemischer Reaktionen
Inhalte der 1. Vorlesung: 1. Die Reaktivität organischer Moleküle 1.1 Warum geschehen Chemische Reaktionen 1.2 Gleichgewichtsreaktionen, Ungleichgewichtsreaktionen 1.2.1 Triebkraft chemischer Reaktionen
Kapitel 17: Weitere Aspekt. wässriger Gleichgew. Einfluss gleicher Ionen: Gleichioniger Zusatz, Verschiebung des Gleichgewichtes nach Le-Châtelier.
 Ache2 Kapitel 17: Weitere Aspekt. wässriger Gleichgew. Einfluss gleicher Ionen: Gleichioniger Zusatz, Verschiebung des Gleichgewichtes nach Le-Châtelier. Bsp. ph berechnen einer 0.085 mol/l salpetriger
Ache2 Kapitel 17: Weitere Aspekt. wässriger Gleichgew. Einfluss gleicher Ionen: Gleichioniger Zusatz, Verschiebung des Gleichgewichtes nach Le-Châtelier. Bsp. ph berechnen einer 0.085 mol/l salpetriger
Mikrobiologie des Abwassers
 Mikrobiologie des Abwassers Kläranlage (Belebtschlamm und Faulturm) www.klaeranlage-online.de Aufbau einer Kläranlage Kläranlage Schwerte Abbildung aus Mudrack, 1988 Daten zur Kläranlage Oldenburg (Wehdestraße
Mikrobiologie des Abwassers Kläranlage (Belebtschlamm und Faulturm) www.klaeranlage-online.de Aufbau einer Kläranlage Kläranlage Schwerte Abbildung aus Mudrack, 1988 Daten zur Kläranlage Oldenburg (Wehdestraße
