Wirkstoffe: Betamethasondihydrogenphosphat-Dinatrium (Ph. Eur.), Betamethasondipropionat (Ph. Eur.).
|
|
|
- Kirsten Kerstin Schäfer
- vor 8 Jahren
- Abrufe
Transkript
1 DIPROSONE DEPOT 2 ml Fertigspritze Gebrauchsinformation und Fachinformation 1. Bezeichnung des Arzneimittels DIPROSONE Depot 2 ml Fertigspritze 2. Qualitative und quantitative Zusammensetzung Wirkstoffe: Betamethasondihydrogenphosphat-Dinatrium (Ph. Eur.), Betamethasondipropionat (Ph. Eur.). 1 Fertigspritze mit 2 ml Injektionssuspension enthält 5,26 mg Betamethasondihydrogenphosphat- Dinatrium (Ph. Eur.) (entsprechend 4,0 mg Betamethason) und 12,86 mg Betamethasondipropionat (Ph. Eur.) (entsprechend 10,0 mg Betamethason). Sonstige Bestandteile: Enthält 9 mg Benzylalkohol pro 1 ml. Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt Darreichungsform Injektionssuspension (Kristallsuspension) 4. Klinische Angaben 4.1 Anwendungsgebiete Intraartikuläre Injektionen: nach Allgemeinbehandlung von chronisch-entzündlichen Gelenkerkrankungen persistierende Entzündung in einem oder wenigen Gelenken, Arthritis bei Pseudogicht/Chondrokalzinose, aktivierte Arthrose, verschiedene akute Formen der Periarthropathia humeroscapularis. Infiltrationstherapie: Tendovaginitis (strenge Indikationsstellung), nicht bakterielle Bursitis, Periarthropathien, Insertionstendopathien, Engpass-Syndrome bei entzündlich-rheumatischen Erkrankungen, Enthesitiden bei Spondyloarthropathien. Indiziert ist eine Infiltrationstherapie nur, wenn eine umschriebene, nicht bakterielle, entzündliche Reaktion vorliegt. DIPROSONE Depot ist eine Kristallsuspension, die neben dem leicht wasserlöslichen Betamethasondihydrogenphosphat das schwer wasserlösliche Betamethasondipropionat, letzteres mit einer mittleren Partikelgröße von 6 µm, enthält (s. 5.2). Kristallsuspensionen sollten vorrangig zur intraartikulären Therapie großer Gelenke eingesetzt werden. Hierbei können Suspensionen mit geringer Kristallgröße eine bessere lokale Verträglichkeit besitzen. Suspensionen mit langer Verweildauer im Gelenk sollten bevorzugt verwendet werden, da sie eine längere lokale Wirksamkeit und eine geringere systemische Wirkung aufweisen. Zur Verweildauer von DIPROSONE Depot im
2 Gelenk siehe 5.2. Die Therapie kleiner Gelenke sollte wegen der geringeren Gewebsreizung vorrangig mit wässrigen Lösungen oder mikrokristallinen Suspensionen erfolgen. Es empfiehlt sich, zur Infiltrationstherapie bevorzugt wässrige Glukokortikoid-Lösungen oder mikrokristalline Suspensionen zu verwenden, um Kristallreaktionen und insbesondere Sehnenschäden und Sehnenruptur zu vermeiden. 4.2 Dosierung und Art der Anwendung Intraartikuläre Anwendung: Dosierung: Bei der intraartikulären Anwendung ist die Dosierung abhängig von der Größe des Gelenks und von der Schwere der Symptome. Im Allgemeinen genügen bei Erwachsenen zur Besserung der Beschwerden für: Kleine Gelenke: (z. B. Finger, Zehen) Mittelgroße Gelenke: (z. B. Schulter, Ellenbogen) Große Gelenke: (z. B. Hüfte, Knie) 0,25 0,5 ml 0,5 1 ml 1 2 ml Art: Intraartikuläre Injektionen sind wie offene Gelenkeingriffe zu betrachten und nur unter streng aseptischen Bedingungen durchzuführen. Eine Untersuchung der Gelenkflüssigkeit sollte erfolgen, um einen septischen Prozess auszuschließen. Eine lokale Injektion in ein infiziertes Gelenk sollte vermieden werden. Der Patient sollte eine übermäßige Strapazierung des behandelten Gelenks vermeiden. Dauer: In der Regel reicht eine einmalige intraartikuläre Injektion für eine erfolgreiche Symptomlinderung aus. Wird eine erneute Injektion als notwendig erachtet, sollte diese frühestens nach 3 4 Wochen erfolgen, die Zahl der Injektionen pro Gelenk ist auf 3 4 pro Jahr zu beschränken. Insbesondere nach wiederholter Injektion ist eine ärztliche Kontrolle des behandelten Gelenks angezeigt. Infiltrationstherapie: Dosierung: 0,25 1,0 ml, in seltenen Fällen bis 2,0 ml. Bei Bursitis sind mind. 0,5 ml erforderlich. Bei Synovialzysten werden nach Absaugen des Exsudates 0,25 0,5 ml durch die Absaugkanüle injiziert und ein Druckverband angelegt. Art: DIPROSONE Depot wird in den Bereich des stärksten Schmerzes bzw. der Sehnenansätze infiltriert. Bei Epikondylitis humeri (Tennisellenbogen), Tendopathien, Weichteilrheumatismus etc. wird in das Gebiet der größten Schmerzhaftigkeit fächerförmig infiltriert. Eine intratendinöse Injektion muss unter allen Umständen vermieden werden! Es ist auf strenge aseptische Kautelen zu achten! Dauer: Eine Wiederholung der Applikation ist möglich, wobei ein Abstand von 3 4 Wochen zwischen den Injektionen eingehalten werden soll. Anwendung von Lokalanästhetika: Wird die Kombination mit einem Lokalanästhetikum gewünscht, kann DIPROSONE Depot z. B. mit 1%igem oder 2%igem Lidocain oder anderen Lokalanästhetika gemischt werden. Lokalanästhetika, die Parabene oder Phenol enthalten, sind zu vermeiden.
3 Anwendung bei Kindern und Jugendlichen: Zur intraartikulären Anwendung und Infiltrationstherapie von DIPROSONE Depot bei Kindern und Jugendlichen liegen keine ausreichenden Daten zum Beleg der Wirksamkeit und Unbedenklichkeit vor. Daher wird die Anwendung von DIPROSONE Depot bei Kindern nicht empfohlen. Anwendung bei älteren Patienten: Bei älteren Patienten sollte die Anwendung nur unter besonderer Nutzen-Risiko-Abwägung erfolgen (Osteoporose-Risiko erhöht). Zur Beachtung: DIPROSONE Depot darf nicht intravenös gegeben werden! Kristallsuspension vor Gebrauch gut aufschütteln! Ampullen: Die Dosis nach dem Aufschütteln sofort mit einer Spritze entnehmen! Allgemein sollte die niedrigst mögliche Dosierung von Kortikosteroiden bei der Langzeittherapie angewendet werden. Eine eventuelle Dosisminderung sollte schrittweise erfolgen. Dosisanpassungen können erforderlich sein aufgrund Remission oder Verschlechterung des Krankheitsprozesses, individuell unterschiedlichem Ansprechen des Patienten auf die Therapie oder wenn der Patient emotionalem oder physischem Stress ausgesetzt ist, wie z. B. bei schweren Infektionen, Operationen oder Verletzungen. Eine Überwachung kann bis zu einem Jahr nach Beendigung einer Langzeit- oder Hochdosis-Kortikosteroid-Therapie erforderlich sein. 4.3 Gegenanzeigen Überempfindlichkeit gegen die Wirkstoffe oder andere Kortikosteroide, Methyl- 4-hydroxybenzoat, Propyl-4-hydroxybenzoat oder einen der sonstigen Bestandteile. Intraartikuläre Injektion und Infiltrationstherapie: Infektionen innerhalb oder in unmittelbarer Nähe des zu behandelnden Gelenks oder des Applikationsbereichs, Psoriasisherd im Applikationsbereich, Blutungsneigung (spontan oder durch Antikoagulanzien), periartikuläre Kalzifikation, Instabilität des zu behandelnden Gelenks, nicht vaskularisierte Knochennekrose, Sehnenruptur, Charcot-Gelenk. Bei länger dauernder Therapie: Magen-Darm-Ulzera, schwere Osteoporose, psychiatrische Anamnese, akute Infektionen (Herpes zoster, Herpes simplex, Varizellen), HBsAG-positive chronisch-aktive Hepatitis, ca. 8 Wochen vor bis 2 Wochen nach Schutzimpfungen, systemische Mykosen und Parasitosen, Poliomyelitis, Lymphadenitis nach BCG-Impfung, Eng- und Weitwinkelglaukom, Amöbeninfektion, Herpes ophthalmicus. DIPROSONE Depot darf wegen des Gehaltes an Benzylalkohol nicht bei Frühgeborenen oder Neugeborenen angewendet werden. 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Intraartikuläre Anwendung: Jede Gelenkpunktion kann zu Verletzungen von Gefäßen, Nerven sowie periartikulären und artikulären Strukturen führen. Die intraartikuläre Gabe von Glukokortikoiden erhöht substanzimmanent die Gefahr einer Gelenkinfektion. Diese ist zu unterscheiden von einer Kristallsynovitis, die bereits nach wenigen Stunden auftritt, keine Allgemeinsymptome hervorruft und in wenigen Tagen wieder abklingt. Das Auftreten einer Kristallsynovitis hängt u. a. von der Kristallgröße des Präparates ab (s. 5.2). Eine merkliche Verstärkung der Schmerzen und eine lokale Schwellung, ferner eine Einschränkung der Beweglichkeit des Gelenks, Fieber und Unwohlsein deuten auf eine septische Arthritis hin. Wenn die Diagnose einer Sepsis bestätigt wird, ist eine adäquate antimikrobielle Therapie einzuleiten. Glukokortikoide dürfen nicht in instabile Gelenke und sollten nicht in Zwischenwirbelräume injiziert werden. Wiederholte Injektionen in Gelenke, die von Osteoarthritis betroffen sind, können die
4 Gelenkzerstörung beschleunigen. Die längerfristige und wiederholte Anwendung von Glukokortikoiden in gewichttragenden Gelenken kann zu einer Verschlimmerung der verschleißbedingten Veränderungen im Gelenk führen. Ursache dafür ist möglicherweise eine Überbeanspruchung des betroffenen Gelenks nach Rückgang der Schmerzen oder anderer Symptome. Infiltrationstherapie: Jede Punktion kann zu Verletzungen von Gefäßen, Nerven sowie periartikulären Strukturen führen. Die infiltrative Anwendung von Glukokortikoiden erhöht substanzimmanent die Gefahr einer Infektion im Bereich der behandelten Gewebsstrukturen. Direkte Injektionen von Glukokortikoiden in Sehnen sind unbedingt zu vermeiden, da dies im späteren Verlauf zu Sehnenrupturen führen kann. Allgemein: Während der Anwendung von Kortikosteroiden können neue Infektionen auftreten oder Symptome einer Infektion überdeckt werden. Eine verminderte Widerstandsfähigkeit kann auftreten und die Lokalisation von Infektionen erschwert sein. Des Weiteren können Sekundärinfekte durch Pilze oder Viren am Auge vermehrt auftreten. Während einer Behandlung mit Kortikosteroiden sollten Patienten nicht gegen Pocken geimpft werden sowie allgemein keine Impfungen mit Lebendimpfstoffen durchgeführt werden. Insbesondere bei hohen Kortikosteroiddosen sollten auch andere Impfungen nicht vorgenommen werden, da die Gefahr von neurologischen Komplikationen und ausbleibender Antikörperbildung besteht. Im Falle einer Substitutionstherapie mit Kortikosteroiden, z. B. bei Morbus Addison, kann jedoch eine Immunisierung durchgeführt werden. Aufgrund der bisher in Einzelfällen aufgetretenen anaphylaktischen Reaktion sind vor allem bei Patienten mit bekannter allergischer Disposition entsprechende Vorsichtsmaßnahmen zu ergreifen. Bei bestehenden Infektionen darf DIPROSONE Depot nur unter gleichzeitiger spezifischer antiinfektiöser Therapie angewendet werden, bei Tuberkulose in der Anamnese (Cave: Reaktivierung) Anwendung nur unter Tuberkulostatika-Schutz. Wenn Kortikosteroide bei Patienten mit latenter Tuberkulose oder positivem Tuberkulintest angewendet werden, ist eine sorgfältige Überwachung nötig, da es zum erneuten Ausbruch der Krankheit kommen kann. Bei einer länger dauernden Kortikosteroidtherapie sollte eine Chemoprophylaxe durchgeführt werden. Falls Rifampicin zur Chemoprophylaxe verwendet wird, muss dessen beschleunigender Effekt auf die Metabolisierung von Kortikosteroiden beachtet werden; möglicherweise ist eine Anpassung der Kortikosteroiddosis nötig. Während der Anwendung von DIPROSONE Depot ist bei Diabetikern ein eventuell erhöhter Bedarf an Insulin oder oralen Antidiabetika zu berücksichtigen. Während der Behandlung mit DIPROSONE Depot ist bei Patienten mit schwer einstellbarem Bluthochdruck eine regelmäßige Blutdruckkontrolle erforderlich. Patienten mit schwerer Herzinsuffizienz sind sorgfältig zu überwachen, da die Gefahr einer Verschlechterung besteht. Bei Patienten mit Hypothyreose oder Leberzirrhose zeigen Kortikosteroide eine verstärkte Wirkung. Wegen der Gefahr einer Darmperforation darf DIPROSONE Depot nur bei zwingender Indikation und unter entsprechender Überwachung angewendet werden bei: schwerer Colitis ulcerosa mit drohender Perforation Divertikulitis Enteroanastomosen (unmittelbar postoperativ)
5 Auch Vorsicht bei Patienten mit Myasthenia gravis, Niereninsuffizienz, Cushing-Syndrom, Thrombophlebitis, Ulcus pepticum in der Anamnese, Osteoporose. Vorsicht bei Patienten mit okulärem Herpes simplex aufgrund der möglichen cornealen Perforation. Acetylsalicylsäure sollte in Kombination mit Kortikosteroiden mit Vorsicht bei Hypoprothrombinämie verwendet werden. Bei einer lang dauernden Therapie mit DIPROSONE Depot sind regelmäßige ärztliche Kontrollen (einschließlich augenärztlicher Kontrollen in dreimonatigen Abständen) angezeigt, bei vergleichsweise hohen Dosen ist auf eine ausreichende Kaliumzufuhr und Natrium-Restriktion zu achten und der Serum-Kalium-Spiegel zu überwachen. Bei Beendigung oder gegebenenfalls Abbruch der Langzeitgabe ist an folgende Risiken zu denken: Exazerbation bzw. Rezidiv der Grundkrankheit, akute NNR-Insuffizienz (insbesondere in Stresssituationen, z. B. während Infektionen, nach Unfällen, bei verstärkter körperlicher Belastung), Cortison-Entzugssyndrom. Spezielle Viruserkrankungen (Windpocken, Masern) können bei Patienten, die mit Glukokortikoiden behandelt werden, besonders schwer verlaufen. Insbesondere gefährdet sind abwehrgeschwächte (immunsupprimierte) Kinder und Personen ohne bisherige Windpocken- oder Maserninfektion. Wenn diese Personen während einer Behandlung mit DIPROSONE Depot Kontakt zu masern- oder windpockenerkrankten Personen haben, sollte gegebenenfalls eine vorbeugende Behandlung eingeleitet werden. Bei einer Langzeit-Kortikoidtherapie sollte ein Wechsel von der parenteralen zur oralen Gabe in Betracht gezogen werden, wobei möglicher Nutzen und Risiken gegeneinander abgewogen werden müssen. Einfluss auf Untersuchungsmethoden: Hautreaktionen auf Allergietests können unterdrückt werden. Der Nitroblau-Tetrazolium-Test zum Nachweis einer bakteriellen Infektion kann zu falsch negativen Ergebnissen führen. Benzylalkohol kann bei Säuglingen und Kindern bis zu 3 Jahren toxische und anaphylaktoide Reaktionen hervorrufen. Methyl-4-hydroxybenzoat und Propyl-4-hydroxybenzoat können Überempfindlichkeitsreaktionen, auch Spätreaktionen, und selten Bronchospasmen (Bronchialkrampf) hervorrufen. Die Anwendung von DIPROSONE Depot kann bei Dopingkontrollen zu positiven Ergebnissen führen. DIPROSONE Depot enthält Natrium, aber weniger als 1 mmol (23 mg) Natrium pro 2 ml (max. Einzeldosis), d. h. es ist nahezu natriumfrei. 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Auch bei lokaler Applikation (intraartikuläre und infiltrative Anwendung) von Betamethason- Derivaten können die folgenden systemischen Interaktionen nicht ausgeschlossen werden: Östrogene (z. B. Ovulationshemmer): Die Kortikoidwirkung kann verstärkt werden. Arzneimittel, die CYP3A4 inhibieren, wie Ketoconazol und Itraconazol: Die systemischen Glukokortikoidnebenwirkungen können verstärkt werden. ACE-Hemmstoffe: Erhöhtes Risiko des Auftretens von Blutbildveränderungen. Herzglykoside: Die Glykosidwirkung kann durch Kaliummangel verstärkt werden. Saluretika/Laxantien, Amphotericin B: Die Kaliumausscheidung kann verstärkt werden. Antidiabetika: Die blutzuckersenkende Wirkung kann vermindert werden. Cumarin-Derivate: Die Antikoagulanzienwirkung kann abgeschwächt oder auch verstärkt
6 werden. Nichtsteroidale Antiphlogistika/Antirheumatika und Salicylate, Alkohol: Die Gefahr von Magen-Darm-Blutungen wird erhöht. Nicht depolarisierende Muskelrelaxantien: Die Muskelrelaxation kann länger anhalten (s. a. Abschnitt 4.8). Atropin, andere Anticholinergika: Zusätzliche Augeninnendrucksteigerungen bei gleichzeitiger Anwendung mit DIPROSONE Depot sind möglich. Praziquantel: Durch Kortikosteroide ist ein Abfall der Praziquantel-Konzentration im Blut möglich. Chloroquin, Hydroxychloroquin, Mefloquin: Es besteht ein erhöhtes Risiko des Auftretens von Myopathien, Kardiomyopathien. Somatropin: Die Wirkung von Somatropin kann vermindert werden. Protirelin: Der TSH-Anstieg bei Gabe von Protirelin kann reduziert sein. Ciclosporin: Die Blutspiegel von Ciclosporin werden erhöht: Es besteht eine erhöhte Gefahr zerebraler Krampfanfälle. Rifampicin, Phenytoin, Barbiturate, Primidon, Ephedrin: Kortikoidwirkung vermindert. Einfluss auf Untersuchungsmethoden: Hautreaktionen auf Allergietests können unterdrückt werden. Der Nitroblau-Tetrazolium-Test zum Nachweis einer bakteriellen Infektion kann zu falsch negativen Ergebnissen führen. 4.6 Fertilität, Schwangerschaft und Stillzeit Während der Schwangerschaft, besonders in den ersten drei Monaten, soll die Anwendung nur nach sorgfältiger Nutzen/Risiko-Abwägung erfolgen. Bei einer Langzeitbehandlung mit Glukokortikoiden während der Schwangerschaft sind Wachstumsstörungen des Fetus nicht auszuschließen. Betamethason führte im Tierexperiment zur Ausbildung von Gaumenspalten (siehe 5.3). Ein erhöhtes Risiko für orale Spaltbildungen bei menschlichen Feten durch die Gabe von Glukokortikoiden während des ersten Trimenons wird diskutiert. Werden Glukokortikoide am Ende der Schwangerschaft gegeben, besteht für den Fetus die Gefahr einer Atrophie der Nebennierenrinde, die eine ausschleichende Substitutionsbehandlung des Neugeborenen erforderlich machen kann. Glukokortikoide gehen in die Muttermilch über. Eine Schädigung des Säuglings ist bisher nicht bekannt geworden. Trotzdem sollte die Indikation in der Stillzeit streng gestellt werden. Sind aus Krankheitsgründen höhere Dosen erforderlich, sollte abgestillt werden. 4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen Bisher liegen keine Hinweise vor, dass DIPROSONE Depot die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zur Bedienung von Maschinen beeinträchtigt. Gleiches gilt auch für Arbeiten ohne sicheren Halt. 4.8 Nebenwirkungen Intraartikuläre Anwendung: Lokale Reizungen und Unverträglichkeitserscheinungen sind möglich (Hitzegefühl, länger anhaltende Schmerzen). Die Entwicklung einer Hautatrophie und einer Atrophie des Unterhautgewebes an der Injektionsstelle kann nicht ausgeschlossen werden, wenn Glukokortikoide nicht sorgfältig in die Gelenkhöhle injiziert werden. Nach wiederholten intraartikulären Injektionen kann es zu Gelenkinstabilität kommen. Verbunden mit der Applikationstechnik kann es zu Verletzungen von Gefäßen oder Nerven sowie periartikulären und artikulären Strukturen kommen. Charcot-artige Arthropathie ist möglich. Bei jeder Gelenkpunktion ist die Einschleppung von Keimen (Infektion)
7 möglich. Die Gelenkinfektion ist differentialdiagnostisch von einer Kristallsynovitis zu unterscheiden, die bereits nach wenigen Stunden auftritt, im Gegensatz zur Gelenkinfektion aber keine Allgemeinsymptome hervorruft und in wenigen Tagen wieder abklingt. Das Auftreten einer Kristallsynovitis hängt u. a. von der Kristallgröße des Präparates ab (siehe 5.2). Infiltrative Anwendung: Lokale Reizungen und systemische Unverträglichkeitserscheinungen sind möglich (Hitzegefühl, länger anhaltende Schmerzen). Die Entwicklung einer Hautatrophie und/oder einer Atrophie des Unterhautgewebes mit Depigmentierung und Lanugoverlust an der Injektionsstelle kann nicht ausgeschlossen werden. In sehr seltenen Fällen kann es zu Sehnenschäden und/oder einer späteren Sehnenruptur kommen. Verbunden mit der Applikationstechnik kann auch eine Keimverschleppung (Infektion) sowie die Verletzung von Gefäßen oder Nerven nicht ausgeschlossen werden. Intraartikuläre und infiltrative Anwendung: Auch bei lokaler Applikation (intraartikuläre und infiltrative Anwendung) von Betamethason- Derivaten können die folgenden systemischen Nebenwirkungen nicht ausgeschlossen werden: Endokrine Störungen: Adrenale Suppression und Induktion eines Cushing-Syndroms (typische Symptome Vollmondgesicht, Stammfettsucht und Plethora), verminderte Glukosetoleranz, Diabetes mellitus, Wachstumshemmung bei Kindern, Störungen der Sexualhormonsekretion (unregelmäßige Menstruation, Impotenz, veränderte Beweglichkeit und Anzahl der Spermien), sekundäre, adrenokortikale und hypophysäre Nichtansprechbarkeit, besonders unter Stress sowie bei Trauma, chirurgischen Eingriffen oder Krankheit. Stoffwechsel- und Ernährungsstörungen: Gewichtszunahme, Hypercholesterinämie und Hypertriglyceridämie, Natriumretention mit Ödembildung, vermehrte Kaliumausscheidung (Cave: Rhythmusstörungen), hypokalämische Alkalose, Flüssigkeitsretention, bei prädisponierten Patienten Stauungsherzinsuffizienz, gesteigerte Calciumausscheidung, negative Stickstoffbilanz aufgrund eines Protein-Katabolismus. Erkrankungen der Haut und des Unterhautzellgewebes: Striae rubrae, Atrophie, Teleangiektasien, erhöhte Kapillarfragilität, Petechien, Ekchymosen, Hypertrichose, Steroidakne, verzögerte Wundheilung, Rosazea-artige (periorale) Dermatitis, Änderungen der Hautpigmentierung, Überempfindlichkeitsreaktionen, z. B. Arzneimittelexanthem, Hautverdünnung, Gesichtserythem, verstärktes Schwitzen, allergische Dermatitis, Urtikaria, angioneurotisches Ödem. Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen: Muskelatrophie und -schwäche, Osteoporose (dosisabhängig, auch bei nur kurzer Anwendung möglich), aseptische Knochennekrosen (Kopf des Oberarm- und Oberschenkelknochens), Sehnenruptur, Wirbelfrakturen, Frakturen der langen Röhrenknochen, kortikosteroide Myopathie, Verschlimmerung der Symptome bei Myasthenia gravis, steriler Abszess. Psychiatrische Erkrankungen: Depressionen, Gereiztheit, Euphorie, Antriebs- und Appetitsteigerung, Psychosen, Schlafstörungen, Stimmungsschwankungen, Persönlichkeitsveränderungen. Erkrankungen des Nervensystems: Pseudotumor cerebri (insb. bei Kindern), Krämpfe, Manifestation einer latenten Epilepsie, Erhöhung der Anfallsbereitschaft bei manifester Epilepsie, Drehschwindel, Kopfschmerz. Erkrankungen des Gastrointestinaltraktes: Magen-Darm-Ulcera, gastrointestinale Blutungen, Pankreatitis, Schluckauf, Bauchblähung, ulzerative Ösophagitis. Gefäßerkrankungen:
8 Blutdruckerhöhung, Erhöhung des Arteriosklerose- und Thromboserisikos, Vaskulitis (auch als Entzugssyndrom nach Langzeittherapie). Erkrankungen des Blutes und Lymphsystems: Mäßige Leukozytose, Lymphopenie, Eosinopenie, Polyglobulie. Erkrankungen des Immunsystems: Schwächung der Immunabwehr, Maskierung von Infektionen, Exazerbation latenter Infektionen, allergische Reaktionen, anaphylaktoide oder Überempfindlichkeitsreaktionen sowie Blutdruckabfall und Schockreaktionen. Augenerkrankungen: Katarakt, insbesondere mit hinterer subcapsulärer Trübung, Glaukom, Verschlechterung der Symptome bei Hornhautulcus, Begünstigung viraler, fungaler und bakterieller Entzündungen am Auge, Exophthalmus. Selten können Überempfindlichkeitsreaktionen durch Benzylalkohol auftreten. Methyl-4-hydroxybenzoat und Propyl-4-hydroxybenzoat können Überempfindlichkeitsreaktionen, auch Spätreaktionen, und selten Bronchospasmen (Bronchialkrampf) hervorrufen. Meldung des Verdachts auf Nebenwirkungen Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger- Allee 3, D Bonn, Website: anzuzeigen. 4.9 Überdosierung Akute Intoxikationen mit DIPROSONE Depot sind nicht bekannt. Bei chronischer Überdosierung ist mit verstärkten Nebenwirkungen (s. Abschnitt 4.8) insbesondere auf Endokrinium, Stoffwechsel und Elektrolythaushalt zu rechnen. Bei auftretenden Komplikationen sollte die jeweils angemessene Behandlung durchgeführt werden. Auf eine entsprechende Flüssigkeitsaufnahme sollte geachtet und Elektrolytkonzentrationen im Serum und Urin insbesondere von Natrium und Kalium überwacht werden. Gegebenenfalls muss eine Elektrolytstörung behandelt werden. Ein Antidot für DIPROSONE Depot ist nicht bekannt. 5. Pharmakologische Eigenschaften 5.1 Pharmakodynamische Eigenschaften Pharmakotherapeutische Gruppe: Glukokortikoid ATC-Code: H02AB DIPROSONE Depot ist die Kombination des Natriumsalzes eines leicht wasserlöslichen Phosphorsäure-Esters des Betamethasons mit einem schwer wasserlöslichen Propionsäure-Ester desselben Kortikosteroids. Wirksam ist in beiden Fällen nach enzymatischer Esterspaltung der freie Alkohol Betamethason. Betamethason ist ein fluoriertes Glukokortikoid, das eine etwa 25fach stärkere antientzündliche Wirkung als das natürliche Nebennierenrindenhormon Cortisol besitzt. Die mineralokortikoide Wirkungskomponente fehlt dagegen fast vollkommen. Glukokortikoide wie Betamethason entfalten ihre biologische Wirkung durch Aktivierung der Transkription von Kortikoid-sensitiven Genen. Die entzündungshemmenden, immunsuppressiven und
9 antiproliferativen Effekte werden u. a. durch verringerte Bildung, Freisetzung und Aktivität von Entzündungsmediatoren und durch Inhibierung der spezifischen Funktionen und der Migration von Entzündungszellen hervorgerufen. Zusätzlich wird die Wirkung sensibilisierter T-Lymphozyten und Makrophagen auf Targetzellen durch Kortikosteroide möglicherweise verhindert. Bei einer notwendigen Kortikoid-Langzeitmedikation muss die mögliche Induktion einer transienten NNR-Insuffizienz berücksichtigt werden. Die Supprimierbarkeit der Hypothalamus-Hypophysen- NNR-Achse hängt u. a. auch von individuellen Faktoren ab. Die Cushing-Schwellendosis wird bei systemischer Gabe mit 1 1,5 mg/tag angegeben. 5.2 Pharmakokinetische Eigenschaften Kortikosteroide werden in unterschiedlichen Maßen an Plasmaproteine gebunden, durch die Leber metabolisiert und über die Niere ausgeschieden. Betamethason hat eine Proteinbindung von 62,5 % (zum Vergleich Hydrokortison 89 %). Es besteht kein direkter Zusammenhang zwischen Blutspiegel (total oder ungebunden) und Dauer der therapeutischen Wirksamkeit. Während die Plasmahalbwertszeit von Betamethason 300 Minuten beträgt, wurde die biologische Halbwertszeit bei systemischer Gabe mit Stunden ermittelt. DIPROSONE Depot ist eine Kristallsuspension. Die mittlere Partikelgröße von Betamethasondipropionat in DIPROSONE Depot liegt bei etwa 6 µm; mehr als 95 % der Partikel sind kleiner als 10 µm. Betamethasondihydrogenphosphat, die leicht wasserlösliche Kortikosteroid- Komponente von DIPROSONE Depot, führt bei lokaler Applikation zu einem schnellen Wirkungseintritt, während die Langzeitwirkung durch den in Kristallform suspendierten schwerlöslichen Propionsäure-Ester hervorgerufen wird. Eine Besserung der Symptomatik tritt bei intraartikulärer Gabe gewöhnlich innerhalb weniger Stunden (in einigen Fällen innerhalb einer Stunde) ein. Bei intraartikulärer Applikation beträgt die Wirkdauer von Betamethasondihydrogenphosphat 2 4 Tage und die von Betamethasondipropionat 4 6 oder mehr Wochen. 5.3 Präklinische Daten zur Sicherheit Akute Toxizität Tierart Applikationsart LD 50 (mg*/kg) Maus peroral i.m. > ,7 94,1 Ratte peroral > i.m. > 100 Meerschweinchen peroral > Hund peroral > 780 i.m. > 29,7 Kaninchen i.m. 2,5 5,0 *Angegeben als Betamethason Chronische Toxizität Spezielle Untersuchungen zur chronischen Toxizität von Betamethasondihydrogenphosphat und Betamethasondipropionat am Tier liegen nicht vor. Ratten, die über 9 Monate täglich 0,05 1 mg/kg Betamethason oral erhielten, zeigten erst in der höchsten Dosisgruppe Veränderungen, wie sie für Kortikosteroide typisch sind, wie Lymphopenie, Eosinopenie und Ansteigen der neutrophilen Blutkörperchen. Unerwartete toxische Effekte wurden nicht gefunden. Mutagenes und tumorerzeugendes Potenzial Betamethason zeigte negative Ergebnisse in Mutagenitätstests an Bakterien (Salmonella und
10 Escherichia) und an Säugerzellen (CHO/HGPRT). Ein positives Ergebnis wurde im Chromosomenaberrationstest in vitro an Humanlymphozyten und ein uneindeutiges Ergebnis im Mikronukleustest in vivo am Knochenmark der Maus festgestellt. Dieses Wirkungsmuster gleicht dem von Dexamethason und Hydrokortison und wird als Wirkungsmerkmal der Kortikoid-Stoffklasse angesehen. Langzeitstudien am Tier zum kanzerogenen Potenzial von Betamethason wurden nicht durchgeführt. Reproduktionstoxizität Betamethasondinatriumphosphat zeigte bei parenteraler Applikation teratogene Effekte bei Ratten und Kaninchen. Die am häufigsten auftretenden Missbildungen waren Gaumenspalten. Höhere Dosierungen erwiesen sich als embryoletal. 6. Pharmazeutische Angaben 6.1 Liste der sonstigen Bestandteile Fertigspritze: Benzylalkohol, Methyl-4-hydroxybenzoat (Ph. Eur.), Propyl-4-hydroxybenzoat (Ph. Eur.), Dinatriumhydrogenphosphat, Natriumchlorid, Polysorbat 80, Carmellose-Natrium, Macrogol 4000, Natriumedetat (Ph. Eur.), Salzsäure 36 %, Wasser für Injektionszwecke. Enthält 9 mg Benzylalkohol pro 1 ml. 6.2 Inkompatibilitäten Licht, Oxidationsmittel und stark alkalisch reagierende Verbindungen führen zu einer Zersetzung des Kortikoids. DIPROSONE Depot sollte nicht mit anderen Arzneimitteln gemischt werden. Ausnahme: Lokalanästhetika (s. Abschnitt 4.2). 6.3 Dauer der Haltbarkeit Nach Anbruch sofort verwenden. Die Dauer der Haltbarkeit beträgt 18 Monate im unversehrten Behältnis. Dieses Arzneimittel soll nach Ablauf des Verfallsdatums nicht mehr angewendet werden. 6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Nicht über 25 C lagern. Vor Licht geschützt aufbewahren. Nicht einfrieren. 6.5 Art und Inhalt des Behältnisses 1 Fertigspritze zu 2 ml Injektionssuspension 6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung Keine besonderen Anforderungen. 7. Inhaber der Zulassung MSD SHARP & DOHME GMBH
11 Lindenplatz Haar Postanschrift: Postfach Haar Tel.: 0800/ Fax: 0800/ @msd.de Hersteller: SP S.A. 2, rue Louis Pasteur Hérouville St Clair Frankreich Tel.: 0033/ Fax: 0033/ Zulassungsnummer DIPROSONE Depot 2 ml Fertigspritze: Datum der Erteilung der Zulassung/Verlängerung der Zulassung 16. Dezember Stand der Information Juli Verkaufsabgrenzung Verschreibungspflichtig ÄA
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Viscosan - Augentropfen Wirkstoff: Hypromellose
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Viscosan - Augentropfen Wirkstoff: Hypromellose Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Viscosan - Augentropfen Wirkstoff: Hypromellose Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
Nasa Rhinathiol 0,1 %ige Nasenspray, Lösung Xylometazolinhydrochlorid
 Seite 1/5 Packungsbeilage Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mir der Anwendung dieses Arzneimittels beginnen. Sie enthält wichtige Informationen für Ihre Behandlung. Wenn
Seite 1/5 Packungsbeilage Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mir der Anwendung dieses Arzneimittels beginnen. Sie enthält wichtige Informationen für Ihre Behandlung. Wenn
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Protagent-Einmalaugentropfen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 ml Lösung (= ca. 30 Tropfen) enthält 20 mg
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Protagent-Einmalaugentropfen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 ml Lösung (= ca. 30 Tropfen) enthält 20 mg
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Heumann s Blasen- und Nierentee Solubitrat Wirkstoffe: Dickextrakt aus Birkenblättern, Dickextrakt aus Riesengoldrutenkraut Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Heumann s Blasen- und Nierentee Solubitrat Wirkstoffe: Dickextrakt aus Birkenblättern, Dickextrakt aus Riesengoldrutenkraut Lesen Sie die gesamte Packungsbeilage
PREDNISOLON 250 MG-ROTEXMEDICA
 Gebrauchsinformation: Information für den Anwender Injektionssuspension Wirkstoff: Prednisolon-21-acetat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für den Anwender Injektionssuspension Wirkstoff: Prednisolon-21-acetat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. PROGESTOGEL 1 % Gel. Progesteron
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER PROGESTOGEL 1 % Gel Progesteron Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. Heben
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER PROGESTOGEL 1 % Gel Progesteron Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. Heben
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Legalon SIL - Trockensubstanz zur Infusionsbereitung
 PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Legalon SIL - Trockensubstanz zur Infusionsbereitung Wirkstoff: Silibinin-C-2,3-bis(hydrogensuccinat), Dinatriumsalz Lesen Sie die gesamte
PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Legalon SIL - Trockensubstanz zur Infusionsbereitung Wirkstoff: Silibinin-C-2,3-bis(hydrogensuccinat), Dinatriumsalz Lesen Sie die gesamte
Gebrauchsinformation: Information für den Anwender. Supertendin /60 mg/2 ml Injektionssuspension. Zur Anwendung bei Erwachsenen
 Gebrauchsinformation: Information für den Anwender Supertendin 10 10/60 mg/2 ml Injektionssuspension Zur Anwendung bei Erwachsenen Dexamethasonacetat (Ph.Eur.)/Lidocainhydrochlorid Lesen Sie die gesamte
Gebrauchsinformation: Information für den Anwender Supertendin 10 10/60 mg/2 ml Injektionssuspension Zur Anwendung bei Erwachsenen Dexamethasonacetat (Ph.Eur.)/Lidocainhydrochlorid Lesen Sie die gesamte
Gebrauchsinformation: Information für den Anwender. Supertendin 5. 5/30 mg/ml Injektionssuspension. Zur Anwendung bei Erwachsenen
 Gebrauchsinformation: Information für den Anwender Supertendin 5 5/30 mg/ml Injektionssuspension Zur Anwendung bei Erwachsenen Dexamethasonacetat (Ph.Eur.)/Lidocainhydrochlorid Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für den Anwender Supertendin 5 5/30 mg/ml Injektionssuspension Zur Anwendung bei Erwachsenen Dexamethasonacetat (Ph.Eur.)/Lidocainhydrochlorid Lesen Sie die gesamte Packungsbeilage
Sidroga Blasentee akut Wirkstoffe: Bärentraubenblätter, Birkenblätter, Goldrutenkraut, Orthosiphonblätter
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Sidroga Blasentee akut Wirkstoffe: Bärentraubenblätter, Birkenblätter, Goldrutenkraut, Orthosiphonblätter Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Sidroga Blasentee akut Wirkstoffe: Bärentraubenblätter, Birkenblätter, Goldrutenkraut, Orthosiphonblätter Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Vitagutt Vitamin E 670 mg, Weichkapsel Zur Anwendung bei Erwachsenen Wirkstoff: 1000 mg all-rac-alpha-tocopherolacetat (entsprechend 670 mg RRR-alpha- Tocopherol-Äquivalente).
Gebrauchsinformation: Information für Anwender Vitagutt Vitamin E 670 mg, Weichkapsel Zur Anwendung bei Erwachsenen Wirkstoff: 1000 mg all-rac-alpha-tocopherolacetat (entsprechend 670 mg RRR-alpha- Tocopherol-Äquivalente).
Sumatriptan Antrag auf Freistellung von der Verschreibungspflicht mit Beschränkungen
 Sumatriptan Antrag auf Freistellung von der Verschreibungspflicht mit Beschränkungen Sachverständigen-Ausschuss für Verschreibungspflicht 62. Sitzung am 13.01.2009 im Bundesinstitut für Arzneimittel- und
Sumatriptan Antrag auf Freistellung von der Verschreibungspflicht mit Beschränkungen Sachverständigen-Ausschuss für Verschreibungspflicht 62. Sitzung am 13.01.2009 im Bundesinstitut für Arzneimittel- und
Ambulante Eingriffe zur Behandlung chronischer Rückenschmerzen an der Univ.Klinik für Orthopädie, AKH Wien
 Ambulante Eingriffe zur Behandlung chronischer Rückenschmerzen an der Univ.Klinik für Orthopädie, AKH Wien FACETTENGELENKSINFILTRATIONEN Definition: Eine Injektion von Lokalanästhetikum und Kortisonpräparat
Ambulante Eingriffe zur Behandlung chronischer Rückenschmerzen an der Univ.Klinik für Orthopädie, AKH Wien FACETTENGELENKSINFILTRATIONEN Definition: Eine Injektion von Lokalanästhetikum und Kortisonpräparat
Bijsluiter DE versie Imaverol 100 mg (glas) B. PACKUNGSBEILAGE 1
 B. PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION Imaverol 100 mg, Konzentrat zur örtlichen Anwendung 1.NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE
B. PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION Imaverol 100 mg, Konzentrat zur örtlichen Anwendung 1.NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE
Gebrauchsinformation: Information für Anwender. LOMUSOL Augentropfen. Wirkstoff: Dinatriumcromoglicat
 Gebrauchsinformation: Information für Anwender LOMUSOL Augentropfen Wirkstoff: Dinatriumcromoglicat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für Anwender LOMUSOL Augentropfen Wirkstoff: Dinatriumcromoglicat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Wirkstoffe: Trockenextrakt aus Birkenblättern, Trockenextrakt aus Goldrutenkraut
 Gebrauchsinformation: Information für Anwender HEUMANN Blasen- und Nierentee SOLUBITRAT uro Teeaufgusspulver Wirkstoffe: Trockenextrakt aus Birkenblättern, Trockenextrakt aus Goldrutenkraut Lesen Sie die
Gebrauchsinformation: Information für Anwender HEUMANN Blasen- und Nierentee SOLUBITRAT uro Teeaufgusspulver Wirkstoffe: Trockenextrakt aus Birkenblättern, Trockenextrakt aus Goldrutenkraut Lesen Sie die
zur Verfügung gestellt von Gebrauchs.info GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 2,5 mg/g Wirkstoff: Prednicarbat GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. Heben
2,5 mg/g Wirkstoff: Prednicarbat GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. Heben
MS und Impfungen. DAS KLEINE IMPF-1x1. DAS KLEINE IMPF-1x1. Christian Lampl. Abteilung für Allgemeine Neurologie und Schmerzmedizin
 MS und Impfungen Christian Lampl Abteilung für Allgemeine Neurologie und Schmerzmedizin DAS KLEINE IMPF-1x1 Impfungen stellen sehr wirksame und wichtige präventivmedizinische Maßnahmen dar. Das unmittelbare
MS und Impfungen Christian Lampl Abteilung für Allgemeine Neurologie und Schmerzmedizin DAS KLEINE IMPF-1x1 Impfungen stellen sehr wirksame und wichtige präventivmedizinische Maßnahmen dar. Das unmittelbare
Packungsbeilage CORSODYL Mundspüllösung / Spray 03-2012 Seite 1/5 BE106802 / BE191764 Belgien GEBRAUCHINFORMATION: INFORMATION FÜR DEN ANWENDER
 Seite 1/5 BE106802 / BE191764 Belgien GEBRAUCHINFORMATION: INFORMATION FÜR DEN ANWENDER CORSODYL 200mg/100ml mundwasser CORSODYL 200mg/100ml spray zur Anwendung in der Mundhöhle Chlorhexidindigluconat
Seite 1/5 BE106802 / BE191764 Belgien GEBRAUCHINFORMATION: INFORMATION FÜR DEN ANWENDER CORSODYL 200mg/100ml mundwasser CORSODYL 200mg/100ml spray zur Anwendung in der Mundhöhle Chlorhexidindigluconat
Pflichttexte zur Verwendung in der Werbung für Arzneimittel in Deutschland gemäß Heilmittelwerbegesetz (HWG) Endverbraucher
 Cutasept F Pflichttexte Cutasept F: Wirkstoff: Propan-2-ol. Zusammensetzung: 100 g Lösung enthalten: Wirkstoff: Propan-2-ol 63,0 g, entspricht 72 Vol.%. Sonstige Bestandteile: Benzalkoniumchlorid, Gereinigtes
Cutasept F Pflichttexte Cutasept F: Wirkstoff: Propan-2-ol. Zusammensetzung: 100 g Lösung enthalten: Wirkstoff: Propan-2-ol 63,0 g, entspricht 72 Vol.%. Sonstige Bestandteile: Benzalkoniumchlorid, Gereinigtes
WAS finde ich WO im Beipackzettel
 WAS finde ich WO im Beipackzettel Sie haben eine Frage zu Ihrem? Meist finden Sie die Antwort im Beipackzettel (offiziell "Gebrauchsinformation" genannt). Der Aufbau der Beipackzettel ist von den Behörden
WAS finde ich WO im Beipackzettel Sie haben eine Frage zu Ihrem? Meist finden Sie die Antwort im Beipackzettel (offiziell "Gebrauchsinformation" genannt). Der Aufbau der Beipackzettel ist von den Behörden
Patientenleitfaden für das Gespräch mit dem Arzt. Liebe Patientin, lieber Patient!
 Patientenleitfaden für das Gespräch mit dem Arzt Liebe Patientin, lieber Patient! Je besser Sie sich auf das Gespräch mit Ihrem Arzt vorbereiten, desto leichter wird es für sie/ihn sein, eine Diagnose
Patientenleitfaden für das Gespräch mit dem Arzt Liebe Patientin, lieber Patient! Je besser Sie sich auf das Gespräch mit Ihrem Arzt vorbereiten, desto leichter wird es für sie/ihn sein, eine Diagnose
Wirkstoffe: Betamethasondihydrogenphosphat-Dinatrium (Ph.Eur.), Betamethasondipropionat (Ph.Eur.).
 DIPROSONE DEPOT 1 ml Ampulle Gebrauchsinformation und Fachinformation 1. Bezeichnung des Arzneimittels DIPROSONE Depot 1 ml Ampulle 2. Qualitative und quantitative Zusammensetzung Wirkstoffe: Betamethasondihydrogenphosphat-Dinatrium
DIPROSONE DEPOT 1 ml Ampulle Gebrauchsinformation und Fachinformation 1. Bezeichnung des Arzneimittels DIPROSONE Depot 1 ml Ampulle 2. Qualitative und quantitative Zusammensetzung Wirkstoffe: Betamethasondihydrogenphosphat-Dinatrium
Hepatyrix Injektionssuspension Hepatitis-A-(inaktiviert) und Typhus-Polysaccharid-Impfstoff (adsorbiert) ab dem vollendeten 15.
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER 22.07.2009 Hepatyrix Injektionssuspension Hepatitis-A-(inaktiviert) und Typhus-Polysaccharid-Impfstoff (adsorbiert) ab dem vollendeten 15. Lebensjahr
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER 22.07.2009 Hepatyrix Injektionssuspension Hepatitis-A-(inaktiviert) und Typhus-Polysaccharid-Impfstoff (adsorbiert) ab dem vollendeten 15. Lebensjahr
Gebrauchsinformation: Information für Anwender. Delphi 0,1 % Creme Triamcinolonacetonid
 Gebrauchsinformation: Information für Anwender Delphi 0,1 % Creme Triamcinolonacetonid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen,
Gebrauchsinformation: Information für Anwender Delphi 0,1 % Creme Triamcinolonacetonid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen,
Gebrauchsinformation: Information für den Anwender
 Wortlaut der für die Gebrauchsinformation vorgesehenen Angaben Stand: Mai 2008 1 Gebrauchsinformation: Information für den Anwender Harntee-Steiner, Teeaufgusspulver Zur Anwendung bei Heranwachsenden ab
Wortlaut der für die Gebrauchsinformation vorgesehenen Angaben Stand: Mai 2008 1 Gebrauchsinformation: Information für den Anwender Harntee-Steiner, Teeaufgusspulver Zur Anwendung bei Heranwachsenden ab
1. WAS IST DAFALGAN Zäpfchen UND WOFÜR WIRD ES ANGEWENDET?
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER DAFALGAN Säuglinge 80 mg Zäpfchen DAFALGAN Kleinkinder 150 mg Zäpfchen DAFALGAN große Kinder 300 mg Zäpfchen Paracetamol Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER DAFALGAN Säuglinge 80 mg Zäpfchen DAFALGAN Kleinkinder 150 mg Zäpfchen DAFALGAN große Kinder 300 mg Zäpfchen Paracetamol Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für Anwender. Prednifluid 10 mg/ml Augentropfensuspension Prednisolonacetat
 Gebrauchsinformation: Information für Anwender Prednifluid 10 mg/ml Augentropfensuspension Prednisolonacetat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für Anwender Prednifluid 10 mg/ml Augentropfensuspension Prednisolonacetat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Zusammenfassung der Merkmale des Arzneimittels. Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
 Zusammenfassung der Merkmale des Arzneimittels 1. Bezeichnung des Arzneimittels Virupos 30 mg/g Augensalbe 2. Qualitative und quantitative Zusammensetzung Wirkstoff: 1 g Salbe enthält Aciclovir 30 mg Die
Zusammenfassung der Merkmale des Arzneimittels 1. Bezeichnung des Arzneimittels Virupos 30 mg/g Augensalbe 2. Qualitative und quantitative Zusammensetzung Wirkstoff: 1 g Salbe enthält Aciclovir 30 mg Die
Erratum Benkert, Pocket Guide, Psychopharmaka von A bis Z. 3.Aufl. ISBN (print): 978-3-642-54766-9/ DOI 10.1007/978-3-642-54767-6
 Erratum Benkert, Pocket Guide, Psychopharmaka von A bis Z. 3.Aufl. ISBN (print): 978-3-642-54766-9/ DOI 10.1007/978-3-642-54767-6 Trotz sorgfältiger Erstellung des Buchs Benkert, Pocket Guide, Psychopharmaka
Erratum Benkert, Pocket Guide, Psychopharmaka von A bis Z. 3.Aufl. ISBN (print): 978-3-642-54766-9/ DOI 10.1007/978-3-642-54767-6 Trotz sorgfältiger Erstellung des Buchs Benkert, Pocket Guide, Psychopharmaka
Atronase 0,3 mg/ml Nasenspray, Lösung (Ipratropiumbromid)
 GEBRAUCHSINFORMATION ATRONASE 0,3 MG/ML NASENSPRAY, LÖSUNG Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses Arzneimittel ist auch ohne Verschreibung
GEBRAUCHSINFORMATION ATRONASE 0,3 MG/ML NASENSPRAY, LÖSUNG Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses Arzneimittel ist auch ohne Verschreibung
Sandoz Pharmaceuticals AG
 Die Pille danach. Was ist eine Notfallverhütung oder die sogenannte «Pille danach»? 1 Wann wird NorLevo Uno eingenommen? 2 Bei der «Pille danach» handelt es sich um eine Notfallverhütung, die eine unerwünschte
Die Pille danach. Was ist eine Notfallverhütung oder die sogenannte «Pille danach»? 1 Wann wird NorLevo Uno eingenommen? 2 Bei der «Pille danach» handelt es sich um eine Notfallverhütung, die eine unerwünschte
Isotonische Kochsalzlösung 0,9% Infusionslösung
 Gebrauchsinformation und Fachinformation SERAG-WIESSNER GmbH & Co. KG Zum Kugelfang 8-12 95119 Naila Isotonische Kochsalzlösung 0,9% Infusionslösung Diese Packungsbeilage beinhaltet: 1. Was ist Isotonische
Gebrauchsinformation und Fachinformation SERAG-WIESSNER GmbH & Co. KG Zum Kugelfang 8-12 95119 Naila Isotonische Kochsalzlösung 0,9% Infusionslösung Diese Packungsbeilage beinhaltet: 1. Was ist Isotonische
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Kamillosan -Mundspray. Kamillenblütenauszug Pfefferminzöl Anisöl
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Kamillosan -Mundspray Kamillenblütenauszug Pfefferminzöl Anisöl Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Kamillosan -Mundspray Kamillenblütenauszug Pfefferminzöl Anisöl Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
FACHINFORMATION (ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS) systemische Wirkung aufweisen. Zur Verweildauer
 1. BEZEICHNUNG DER ARZNEIMITTEL 1 ml Ampulle 2,0 mg/ml + 5,0 mg/ml Injektions suspension 1 ml Fertigspritze 2,0 mg/ml + 5,0 mg/ml Injektions suspension 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Wirkstoffe:
1. BEZEICHNUNG DER ARZNEIMITTEL 1 ml Ampulle 2,0 mg/ml + 5,0 mg/ml Injektions suspension 1 ml Fertigspritze 2,0 mg/ml + 5,0 mg/ml Injektions suspension 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Wirkstoffe:
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Tantum Verde 3 mg Pastillen mit Minzgeschmack Wirkstoff: Benzydaminhydrochlorid
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tantum Verde 3 mg Pastillen mit Minzgeschmack Wirkstoff: Benzydaminhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tantum Verde 3 mg Pastillen mit Minzgeschmack Wirkstoff: Benzydaminhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Cytomegalie & Co. Häufige Virusinfektionen in der Schwangerschaft. Deutsches Grünes Kreuz e.v.
 Cytomegalie & Co Häufige Virusinfektionen in der Schwangerschaft Schwangerschaft Eine ganz besondere Zeit der Vorfreude Verantwortung Sorge Die werdenden Eltern möchten alles richtig machen für das Wohl
Cytomegalie & Co Häufige Virusinfektionen in der Schwangerschaft Schwangerschaft Eine ganz besondere Zeit der Vorfreude Verantwortung Sorge Die werdenden Eltern möchten alles richtig machen für das Wohl
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Magnevist 2 mmol/l Injektionslösung. Gadopentetsäure, Dimeglumin
 1 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Magnevist 2 mmol/l Injektionslösung Gadopentetsäure, Dimeglumin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor dieses Arzneimittel bei
1 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Magnevist 2 mmol/l Injektionslösung Gadopentetsäure, Dimeglumin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor dieses Arzneimittel bei
Wie unsere Augen Erfahren Sie, wie wir sehen, und wie Sie Ihre Vision zu schützen.
 Wie unsere Augen Erfahren Sie, wie wir sehen, und wie Sie Ihre Vision zu schützen. Levobunolol ist ein Beta-Blocker, der den Druck im Inneren des Auges reduziert. Levobunolol Augen (Auge) ist für die Behandlung
Wie unsere Augen Erfahren Sie, wie wir sehen, und wie Sie Ihre Vision zu schützen. Levobunolol ist ein Beta-Blocker, der den Druck im Inneren des Auges reduziert. Levobunolol Augen (Auge) ist für die Behandlung
Patienteninformationsbroschüre Valproat
 Patienteninformationsbroschüre Valproat Informationen für Patientinnen Die Informationen in dieser Broschüre sind für Frauen bestimmt, denen Valproat verschrieben wird und die schwanger werden können (Frauen
Patienteninformationsbroschüre Valproat Informationen für Patientinnen Die Informationen in dieser Broschüre sind für Frauen bestimmt, denen Valproat verschrieben wird und die schwanger werden können (Frauen
Gebrauchsinformation: Information für Patienten. Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench)
 Gebrauchsinformation: Information für Patienten Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench) Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Gebrauchsinformation: Information für Patienten Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench) Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
1. NAME UND ANSCHRIFT DES PHARMAZEUTISCHEN UNTERNEHMERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS
 Gebrauchsinformation Eurican SHPPi2 Staupe-Adenovirusinfektion-Parvovirose-Parainfluenza Typ 2-Lebendimpfstoff, Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension, für Hunde 1. NAME
Gebrauchsinformation Eurican SHPPi2 Staupe-Adenovirusinfektion-Parvovirose-Parainfluenza Typ 2-Lebendimpfstoff, Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension, für Hunde 1. NAME
AUFKLÄRUNGSBLATT* ZUR IMPFUNG GEGEN DIE FSME (Frühsommer-Meningoenzephalitis) *(Auszug aus den jeweiligen Packungsinformationen)
 AUFKLÄRUNGSBLATT* ZUR IMPFUNG GEGEN DIE FSME (Frühsommer-Meningoenzephalitis) *(Auszug aus den jeweiligen Packungsinformationen) Lesen Sie die gesamte Information sorgfältig durch, bevor Sie sich bzw.
AUFKLÄRUNGSBLATT* ZUR IMPFUNG GEGEN DIE FSME (Frühsommer-Meningoenzephalitis) *(Auszug aus den jeweiligen Packungsinformationen) Lesen Sie die gesamte Information sorgfältig durch, bevor Sie sich bzw.
1. Was sind Dorithricin Halstabletten und wofür werden sie angewendet?
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Dorithricin - Halstabletten Wirkstoffe: Tyrothricin, Benzalkoniumchlorid, Benzocain Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Dorithricin - Halstabletten Wirkstoffe: Tyrothricin, Benzalkoniumchlorid, Benzocain Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
Moderne Behandlung des Grauen Stars
 Katarakt Moderne Behandlung des Grauen Stars Sehr geehrte Patientin, sehr geehrter Patient, Bei Ihnen wurde eine Trübung der Augenlinse festgestellt, die umgangssprachlich auch Grauer Star genannt wird.
Katarakt Moderne Behandlung des Grauen Stars Sehr geehrte Patientin, sehr geehrter Patient, Bei Ihnen wurde eine Trübung der Augenlinse festgestellt, die umgangssprachlich auch Grauer Star genannt wird.
Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen:
 BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 06.11.2014 Veronika Iro REGA +43 (0) 505 55 36247 pv-implementation@ages.at
BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 06.11.2014 Veronika Iro REGA +43 (0) 505 55 36247 pv-implementation@ages.at
Diabetes mellitus : Folgeschäden
 Diabetes mellitus : Folgeschäden Warum ist der Diabetes mellitus eine wichtige Erkrankung? a. Akute Probleme: Hypoglykämie Hyperglykämie Ketoazidose b. Chronische Probleme: Folgeschäden: Typische Schäden:
Diabetes mellitus : Folgeschäden Warum ist der Diabetes mellitus eine wichtige Erkrankung? a. Akute Probleme: Hypoglykämie Hyperglykämie Ketoazidose b. Chronische Probleme: Folgeschäden: Typische Schäden:
INFORMATIONEN ZUR NACHSORGE VON ZAHNIMPLANTATEN
 INFORMATIONEN ZUR NACHSORGE VON ZAHNIMPLANTATEN WORIN BESTEHT DIE NACHSORGE? Straumann-Implantate sind eine moderne Möglichkeit für Zahnersatz, wenn ein oder mehrere Zähne fehlen. Diese bekannte und hochwertige
INFORMATIONEN ZUR NACHSORGE VON ZAHNIMPLANTATEN WORIN BESTEHT DIE NACHSORGE? Straumann-Implantate sind eine moderne Möglichkeit für Zahnersatz, wenn ein oder mehrere Zähne fehlen. Diese bekannte und hochwertige
Dontisolon D Mundheilpaste
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER 5 mg/g Paste Wirkstoff: Prednisolonacetat (Ph.Eur.) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER 5 mg/g Paste Wirkstoff: Prednisolonacetat (Ph.Eur.) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Trockenes Auge. Haben Sie Trockene Augen?
 Trockenes Auge Jeder 3 bis 5 Patient, der den Augenarzt besucht, an der Krankheit Trockenes Auge leidet. Ein Trockenes Auge entsteht, wenn der Körper zu wenig Tränenflüssigkeit produziert oder die Zusammensetzung
Trockenes Auge Jeder 3 bis 5 Patient, der den Augenarzt besucht, an der Krankheit Trockenes Auge leidet. Ein Trockenes Auge entsteht, wenn der Körper zu wenig Tränenflüssigkeit produziert oder die Zusammensetzung
Anhang III. Ergänzungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Ergänzungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage 20 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS [Der unten genannte Wortlaut
Anhang III Ergänzungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage 20 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS [Der unten genannte Wortlaut
IMPLANON NXT Erläuternde Broschüre für Patientinnen
 Die Markteinführung von IMPLANON NXT wurde von den belgischen Gesundheitsbehörden an bestimmte Bedingungen geknüpft. Der vorgeschriebene Plan zur Risikominimierung in Belgien, der auch das vorliegende
Die Markteinführung von IMPLANON NXT wurde von den belgischen Gesundheitsbehörden an bestimmte Bedingungen geknüpft. Der vorgeschriebene Plan zur Risikominimierung in Belgien, der auch das vorliegende
Anleitung zur Handhabung von Durchstechflasche und Einmalspritze (für Patienten, Ärzte, Diabetesberater und Apotheker)
 Anleitung zur Handhabung von Durchstechflasche und Einmalspritze (für Patienten, Ärzte, Diabetesberater und Apotheker) EIN LEITFADEN ZUR ERSTEN VERWENDUNG VON APIDRA in 10ml- DURCHSTECHFLASCHEN Apidra
Anleitung zur Handhabung von Durchstechflasche und Einmalspritze (für Patienten, Ärzte, Diabetesberater und Apotheker) EIN LEITFADEN ZUR ERSTEN VERWENDUNG VON APIDRA in 10ml- DURCHSTECHFLASCHEN Apidra
ENR: Predni 10 mg Lichtenstein N Zul.-Nr.: ENR: Predni 25 mg Lichtenstein N Zul.-Nr.:
 Fachinformation 1. BEZEICHNUNG DER ARZNEIMITTEL Predni 10 mg Lichtenstein N Injektionssuspension (Kristallsuspension) Predni 25 mg Lichtenstein N Injektionssuspension (Kristallsuspension) Wirkstoff: Prednisolonacetat
Fachinformation 1. BEZEICHNUNG DER ARZNEIMITTEL Predni 10 mg Lichtenstein N Injektionssuspension (Kristallsuspension) Predni 25 mg Lichtenstein N Injektionssuspension (Kristallsuspension) Wirkstoff: Prednisolonacetat
DAS GRÜNE REZEPT. Für eine sichere Medikation mit rezeptfreien Arzneimitteln
 DAS GRÜNE REZEPT Für eine sichere Medikation mit rezeptfreien Arzneimitteln Was ist das Grüne Rezept? Obwohl das Grüne Rezept schon seit Jahren in Arztpraxen verwendet wird, ist es vielen Patienten und
DAS GRÜNE REZEPT Für eine sichere Medikation mit rezeptfreien Arzneimitteln Was ist das Grüne Rezept? Obwohl das Grüne Rezept schon seit Jahren in Arztpraxen verwendet wird, ist es vielen Patienten und
Gebrauchsinformation: Information für Patienten
 Gebrauchsinformation: Information für Patienten Esberitox -Tabletten Trockenextrakt aus einer Mischung von Lebensbaumspitzen und -blättern, Purpursonnenhutwurzel, Blassfarbener Sonnenhutwurzel und Färberhülsenwurzel
Gebrauchsinformation: Information für Patienten Esberitox -Tabletten Trockenextrakt aus einer Mischung von Lebensbaumspitzen und -blättern, Purpursonnenhutwurzel, Blassfarbener Sonnenhutwurzel und Färberhülsenwurzel
aktive / passive Immunisierung
 FS 2010 aktive / passive Immunisierung DTP-Impfstoff Michelle, Andrea 3Ma Überblick Wo befinden wir uns eigentlich? 10 000 Mia. Zellen Nerven-, Muskel-, Bindegewebsoder Blutzellen weißes BK (Leukozyt)
FS 2010 aktive / passive Immunisierung DTP-Impfstoff Michelle, Andrea 3Ma Überblick Wo befinden wir uns eigentlich? 10 000 Mia. Zellen Nerven-, Muskel-, Bindegewebsoder Blutzellen weißes BK (Leukozyt)
Hirnödeme bei HAE was Patienten wissen sollten
 Hirnödeme bei HAE was Patienten wissen sollten Dieser immer stärker werdende Druck... Starke Kopfschmerzen? Bei HAE kann auch ein Hirnödem die Ursache sein. 2 Ein kaum beachteter Zusammenhang Verspannungen,
Hirnödeme bei HAE was Patienten wissen sollten Dieser immer stärker werdende Druck... Starke Kopfschmerzen? Bei HAE kann auch ein Hirnödem die Ursache sein. 2 Ein kaum beachteter Zusammenhang Verspannungen,
Risiken und Revisionsoperationen nach einem künstlichen Kniegelenksersatz
 Risiken und Revisionsoperationen nach einem künstlichen Kniegelenksersatz Dies bedeutet eine ausgedehntere Operation mit mehr Blutverlust. Der Ersatz einer Teilprothese mit einer Totalprothese ist relativ
Risiken und Revisionsoperationen nach einem künstlichen Kniegelenksersatz Dies bedeutet eine ausgedehntere Operation mit mehr Blutverlust. Der Ersatz einer Teilprothese mit einer Totalprothese ist relativ
Faltschachtel. Unverkäufliches Muster (Eindruck auf Linie) Teil einer Klinikpackung, Einzelverkauf unzulässig (Eindruck auf Linie)
 Packmittelmanuskript Nr. 64000/009/94/6 Seite 2 Faltschachtel HEUMANN PHARMA GmbH & Co. Generica KG Südwestpark 50 90449 Nürnberg Urso 400 Heumann Filmtabletten mit 400 mg Ursodeoxycholsäure Zur Auflösung
Packmittelmanuskript Nr. 64000/009/94/6 Seite 2 Faltschachtel HEUMANN PHARMA GmbH & Co. Generica KG Südwestpark 50 90449 Nürnberg Urso 400 Heumann Filmtabletten mit 400 mg Ursodeoxycholsäure Zur Auflösung
Labortests für Ihre Gesundheit. Vorsorge-Impfungen bei Kindern 29
 Labortests für Ihre Gesundheit Vorsorge-Impfungen bei Kindern 29 01IPF Labortests für Ihre Gesundheit Vorsorge-Impfungen bei Kindern Schutz von Anfang an Kinder: Wenn sie das Licht der Welt erblicken,
Labortests für Ihre Gesundheit Vorsorge-Impfungen bei Kindern 29 01IPF Labortests für Ihre Gesundheit Vorsorge-Impfungen bei Kindern Schutz von Anfang an Kinder: Wenn sie das Licht der Welt erblicken,
GEBRAUCHSINFORMATION Eurican SHPPi2L Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension, für Hunde
 GEBRAUCHSINFORMATION Eurican SHPPi2L Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension, für Hunde 1. NAME UND ANSCHRIFT DES PHARMAZEUTISCHEN UNTERNEHMERS UND, WENN UNTERSCHIEDLICH,
GEBRAUCHSINFORMATION Eurican SHPPi2L Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension, für Hunde 1. NAME UND ANSCHRIFT DES PHARMAZEUTISCHEN UNTERNEHMERS UND, WENN UNTERSCHIEDLICH,
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. DELPHI 0,1% creme Triamcinolonacetonid
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER DELPHI 0,1% creme Triamcinolonacetonid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER DELPHI 0,1% creme Triamcinolonacetonid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses
? Kann ich mit Karotten zu viel Vitamin A
 Schwangere aus sozial schwachen Schichten Schwangere, die alkohol-, drogen- oder nikotinabhängig sind Schwangere, die aufgrund einer chronischen Erkrankung Medikamente einnehmen müssen, welche die Nährstoffverwertung
Schwangere aus sozial schwachen Schichten Schwangere, die alkohol-, drogen- oder nikotinabhängig sind Schwangere, die aufgrund einer chronischen Erkrankung Medikamente einnehmen müssen, welche die Nährstoffverwertung
Intraoperative Strahlentherapie bei Brustkrebs
 Intraoperative Strahlentherapie bei Brustkrebs Uniklinik Köln 1 Kein Grund für Verzweiflung Wenn die Diagnose Brustkrebs festgestellt wird, ist erst einmal die Sorge groß. Beruhigend zu wissen, dass es
Intraoperative Strahlentherapie bei Brustkrebs Uniklinik Köln 1 Kein Grund für Verzweiflung Wenn die Diagnose Brustkrebs festgestellt wird, ist erst einmal die Sorge groß. Beruhigend zu wissen, dass es
1) Warum sollten Sie die Bindehautentzündung grundsätzlich vom Arzt behandeln lassen? 4. 2) Was ist eine Bindehautentzündung? 5
 1) Warum sollten Sie die Bindehautentzündung grundsätzlich vom Arzt behandeln lassen? 4 2) Was ist eine Bindehautentzündung? 5 3) Durch welche Symptome kann sich eine Bindehautentzündung bemerkbar machen?
1) Warum sollten Sie die Bindehautentzündung grundsätzlich vom Arzt behandeln lassen? 4 2) Was ist eine Bindehautentzündung? 5 3) Durch welche Symptome kann sich eine Bindehautentzündung bemerkbar machen?
FACHINFORMATION. Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1
 FACHINFORMATION 1. BEZEICHNUNG DER ARZNEIMITTEL Predni 10 mg Lichtenstein N Injektionssuspension (Kristallsuspension) Predni 25 mg Lichtenstein N Injektionssuspension (Kristallsuspension) 2. QUALITATIVE
FACHINFORMATION 1. BEZEICHNUNG DER ARZNEIMITTEL Predni 10 mg Lichtenstein N Injektionssuspension (Kristallsuspension) Predni 25 mg Lichtenstein N Injektionssuspension (Kristallsuspension) 2. QUALITATIVE
Frühe Behandlung der unterschiedlichen Ausprägungen am Beispiel PsA
 Psoriasis als komplexe Systemerkrankung Frühe Behandlung der unterschiedlichen Ausprägungen am Beispiel PsA Univ.-Prof. Dr. Jörg Christian Prinz Berlin (9. Oktober 2009) - Das Krankheitsverständnis der
Psoriasis als komplexe Systemerkrankung Frühe Behandlung der unterschiedlichen Ausprägungen am Beispiel PsA Univ.-Prof. Dr. Jörg Christian Prinz Berlin (9. Oktober 2009) - Das Krankheitsverständnis der
Gebrauchsinformation: Information für Anwender. LIVOSTIN - Augentropfen Wirkstoff: Levocabastin-Hydrochlorid
 Gebrauchsinformation: Information für Anwender LIVOSTIN - Augentropfen Wirkstoff: Levocabastin-Hydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für Anwender LIVOSTIN - Augentropfen Wirkstoff: Levocabastin-Hydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Tebofortan 40 mg - Filmtabletten. Wirkstoff: Trockenextrakt aus Ginkgo-biloba-Blättern
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tebofortan 40 mg - Filmtabletten Wirkstoff: Trockenextrakt aus Ginkgo-biloba-Blättern Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tebofortan 40 mg - Filmtabletten Wirkstoff: Trockenextrakt aus Ginkgo-biloba-Blättern Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
Gefahren bei unsterilem Arbeiten. Dr. Gerhard Eich Abteilung Infektiologie und Spitalhygiene Stadtspital Triemli
 Gefahren bei unsterilem Arbeiten Dr. Gerhard Eich Abteilung Infektiologie und Spitalhygiene Stadtspital Triemli Injektion von Bakterien Pyrogene Reaktion Beispiel: Infusion von bakteriell kontaminierten
Gefahren bei unsterilem Arbeiten Dr. Gerhard Eich Abteilung Infektiologie und Spitalhygiene Stadtspital Triemli Injektion von Bakterien Pyrogene Reaktion Beispiel: Infusion von bakteriell kontaminierten
Durchfall in der Pflege. Der kleine Ratgeber von Aplona
 Durchfallerkrankungen Durchfall in der Pflege Der kleine von Aplona Der kleine von Aplona 3 Fotos: Titel, Seite 2, 3 und 4: Fotolia.com Durchfall in der Pflege Akute Durchfallerkrankungen stellen eine
Durchfallerkrankungen Durchfall in der Pflege Der kleine von Aplona Der kleine von Aplona 3 Fotos: Titel, Seite 2, 3 und 4: Fotolia.com Durchfall in der Pflege Akute Durchfallerkrankungen stellen eine
Welche der aufgeführten zahnmedizinischen relevanten Erscheinungen treffen auf Sie zu?
 Ihre Wünsche sind uns wichtig. Grund Ihres Besuches?... Worauf legen Sie besonderen Wert?... Was haben Sie bisher beim Zahnarztbesuch besonders vermisst?.. Welche der aufgeführten zahnmedizinischen relevanten
Ihre Wünsche sind uns wichtig. Grund Ihres Besuches?... Worauf legen Sie besonderen Wert?... Was haben Sie bisher beim Zahnarztbesuch besonders vermisst?.. Welche der aufgeführten zahnmedizinischen relevanten
24-STUNDEN-SAMMELURIN
 Blutfarbstoffs (Hämoglobin), wird normalerweise nicht mit dem Urin ausgeschieden. Erst bei einer erhöhten Konzentration im Blutserum enthält auch der Urin Bilirubin dies ist der Fall, wenn eine Funktionsstörung
Blutfarbstoffs (Hämoglobin), wird normalerweise nicht mit dem Urin ausgeschieden. Erst bei einer erhöhten Konzentration im Blutserum enthält auch der Urin Bilirubin dies ist der Fall, wenn eine Funktionsstörung
PACKUNGSBEILAGE. CORSODYL Zahngel, 10 mg Chlorhexidin digluconat pro g Zahngel
 Seite 1/5 981 IS 153 F7 Belgien PACKUNGSBEILAGE Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Wenn Sie weitere Fragen haben, wenden Sie sich an
Seite 1/5 981 IS 153 F7 Belgien PACKUNGSBEILAGE Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Wenn Sie weitere Fragen haben, wenden Sie sich an
Verschreibungsfreie Arzneimittel wieder in der Erstattung
 Satzungsleistungen Verschreibungsfreie Arzneimittel wieder in der Erstattung Was sind Satzungsleistungen? Der Rahmen für die Leistungen der gesetzlichen Krankenversicherung wird im Fünften Sozialgesetzbuch
Satzungsleistungen Verschreibungsfreie Arzneimittel wieder in der Erstattung Was sind Satzungsleistungen? Der Rahmen für die Leistungen der gesetzlichen Krankenversicherung wird im Fünften Sozialgesetzbuch
Der Gesundheitskompass für die junge Frau
 Haarausfall? Blutentnahme zu Hormonlabor, Eisenwerte, Schilddrüsenwerte, Biotin und Zink 86,87 EURO Wiederholte Scheideninfektionen? Mit dem Vaginalstatus können Infektionen durch spezielle Kulturen auf
Haarausfall? Blutentnahme zu Hormonlabor, Eisenwerte, Schilddrüsenwerte, Biotin und Zink 86,87 EURO Wiederholte Scheideninfektionen? Mit dem Vaginalstatus können Infektionen durch spezielle Kulturen auf
!!! Folgeerkrankungen
 Ein zu hoher Blutzuckerspiegel kann Folgen auf Ihr Herzkreislaufsystem haben und zu Erkrankungen wie der Schaufensterkrankheit, einer Angina pectoris, einem Herzinfarkt oder einem Schlaganfall führen.
Ein zu hoher Blutzuckerspiegel kann Folgen auf Ihr Herzkreislaufsystem haben und zu Erkrankungen wie der Schaufensterkrankheit, einer Angina pectoris, einem Herzinfarkt oder einem Schlaganfall führen.
Sonstige Bestandteile: Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
 1. BEZEICHNUNG DES ARZNEIMITTELS MUTAGRIP Kinder 2014/2015 Injektionssuspension in einer Fertigspritze Influenza-Spaltimpfstoff (inaktiviert) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Impfdosis
1. BEZEICHNUNG DES ARZNEIMITTELS MUTAGRIP Kinder 2014/2015 Injektionssuspension in einer Fertigspritze Influenza-Spaltimpfstoff (inaktiviert) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Impfdosis
Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva
 Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva Darmstadt (19. Februar 2009) Die Merck KGaA hat heute bekannt gegeben, dass die europäische Arzneimittelbehörde EMEA
Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva Darmstadt (19. Februar 2009) Die Merck KGaA hat heute bekannt gegeben, dass die europäische Arzneimittelbehörde EMEA
RSV. RSV kennen. Das Virus, das Eltern kennen sollten. Informationen. Kinder schützen
 RSV kennen Kinder schützen RSV Das Virus, das Eltern kennen sollten. Informationen zu einem wenig bekannten Virus sowie praktische Ratschläge, wie Sie das Risiko einer RSV-Infektion verringern können.
RSV kennen Kinder schützen RSV Das Virus, das Eltern kennen sollten. Informationen zu einem wenig bekannten Virus sowie praktische Ratschläge, wie Sie das Risiko einer RSV-Infektion verringern können.
Bericht über die Untersuchung zur Erblichkeit von Herzerkrankungen beim PON
 1 Bericht über die Untersuchung zur Erblichkeit von Herzerkrankungen beim PON Einleitung Bei der Rasse PON wurden im APH in der letzten Zeit auffällig viele Herzkrankheiten und Herzveränderungen unterschiedlicher
1 Bericht über die Untersuchung zur Erblichkeit von Herzerkrankungen beim PON Einleitung Bei der Rasse PON wurden im APH in der letzten Zeit auffällig viele Herzkrankheiten und Herzveränderungen unterschiedlicher
Lederlon 5 Wirkstoff: Triamcinolonhexacetonid
 Liebe Patientin, lieber Patient! Bitte lesen Sie folgende Gebrauchsinformation aufmerksam, weil sie wichtige Informationen darüber enthält, was Sie bei der Anwendung dieses Arzneimittels beachten sollen.
Liebe Patientin, lieber Patient! Bitte lesen Sie folgende Gebrauchsinformation aufmerksam, weil sie wichtige Informationen darüber enthält, was Sie bei der Anwendung dieses Arzneimittels beachten sollen.
Künstlicher Hüftgelenksersatz
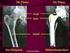 Künstlicher Hüftgelenksersatz Künstlicher Hüftgelenksersatz Was ist eine Hüftgelenk-Arthrose? Das Hüftgelenk ist eine bewegliche Verbindung zwischen dem Becken- und dem Oberschenkelknochen. Die am Gelenk
Künstlicher Hüftgelenksersatz Künstlicher Hüftgelenksersatz Was ist eine Hüftgelenk-Arthrose? Das Hüftgelenk ist eine bewegliche Verbindung zwischen dem Becken- und dem Oberschenkelknochen. Die am Gelenk
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Normhydral - lösliches Pulver
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Normhydral - lösliches Pulver p 1/5 Wirkstoffe: Wasserfreie Glucose, Natriumchlorid, Natriumcitrat, Kaliumchlorid Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Normhydral - lösliches Pulver p 1/5 Wirkstoffe: Wasserfreie Glucose, Natriumchlorid, Natriumcitrat, Kaliumchlorid Lesen Sie die gesamte Packungsbeilage
Wichtige Impfungen für Senioren. Vortrag für Mitarbeiter und Bewohner von Pflegeeinrichtungen
 Wichtige Impfungen für Senioren Vortrag für Mitarbeiter und Bewohner von Pflegeeinrichtungen Bedeutung von Impfungen Impfen ist eine der wichtigsten Vorsorgemaßnahme Impfen schützt jeden Einzelnen vor
Wichtige Impfungen für Senioren Vortrag für Mitarbeiter und Bewohner von Pflegeeinrichtungen Bedeutung von Impfungen Impfen ist eine der wichtigsten Vorsorgemaßnahme Impfen schützt jeden Einzelnen vor
Kopf dicht? Nase zu? Husten?
 Kopf dicht? Nase zu? Husten? Inhalt 2 Inhalt 2-3 Wunderwerk Atemwege 4-7 Kopf dicht, Nase zu, Husten was im Körper passiert 8-11 Wie hilft GeloMyrtol forte? 12-15 Wirksamkeit klinisch bestätigt 16-17 Wie
Kopf dicht? Nase zu? Husten? Inhalt 2 Inhalt 2-3 Wunderwerk Atemwege 4-7 Kopf dicht, Nase zu, Husten was im Körper passiert 8-11 Wie hilft GeloMyrtol forte? 12-15 Wirksamkeit klinisch bestätigt 16-17 Wie
zu Euer Wahl.. dass Ihr Eure eigene Praxis haben wollt an forderster Front mit den Menschen und ich hoffe, dass Ihr Eure Chance nutzt, denn..
 Als erstes meinen Glückwunsch zu Euer Wahl.. dass Ihr Eure eigene Praxis haben wollt an forderster Front mit den Menschen persönlich arbeiten wollt und ich hoffe, dass Ihr Eure Chance nutzt, denn.. die
Als erstes meinen Glückwunsch zu Euer Wahl.. dass Ihr Eure eigene Praxis haben wollt an forderster Front mit den Menschen persönlich arbeiten wollt und ich hoffe, dass Ihr Eure Chance nutzt, denn.. die
Td-IMMUN, Injektionssuspension, Einzeldosis-Fertigspritze. Diphtherie- und Tetanus-Impfstoff (adsorbiert, mit reduziertem Antigenhalt)
 Zusammenfassung der Merkmale des Arzneimittels 1 Bezeichnung des Arzneimittels Td-IMMUN, Injektionssuspension, Einzeldosis-Fertigspritze. Diphtherie- und Tetanus-Impfstoff (adsorbiert, mit reduziertem
Zusammenfassung der Merkmale des Arzneimittels 1 Bezeichnung des Arzneimittels Td-IMMUN, Injektionssuspension, Einzeldosis-Fertigspritze. Diphtherie- und Tetanus-Impfstoff (adsorbiert, mit reduziertem
10.000 10.000. an Masern erkrankt. an Mumps erkrankt. mit Röteln infiziert
 Nutzen: Bei Viruskontakt ist mein geimpftes Kind auch künftig besser gegen Masern, Mumps und Röteln geschützt. Je mehr Menschen geimpft sind, desto unwahrscheinlicher werden Kontakte mit dem Virus. ohne
Nutzen: Bei Viruskontakt ist mein geimpftes Kind auch künftig besser gegen Masern, Mumps und Röteln geschützt. Je mehr Menschen geimpft sind, desto unwahrscheinlicher werden Kontakte mit dem Virus. ohne
Anleitung zum DKM-Computercheck Windows Defender aktivieren
 Anleitung zum DKM-Computercheck Windows Defender aktivieren Ziel der Anleitung Sie möchten das Antivirenprogramm Windows Defender auf Ihrem Computer aktivieren, um gegen zukünftige Angriffe besser gewappnet
Anleitung zum DKM-Computercheck Windows Defender aktivieren Ziel der Anleitung Sie möchten das Antivirenprogramm Windows Defender auf Ihrem Computer aktivieren, um gegen zukünftige Angriffe besser gewappnet
Gebrauchsinformation: Information für Anwender. APOZEMA Bluthochdruck Crataegus complex Nr.10-Tropfen
 Gebrauchsinformation: Information für Anwender APOZEMA Bluthochdruck Crataegus complex Nr.10-Tropfen Wirkstoffe: Crataegus Dil. D4, Arnica Dil. D4, Aurum chloratum natronatum Dil. D5, Barium jodatum Dil.
Gebrauchsinformation: Information für Anwender APOZEMA Bluthochdruck Crataegus complex Nr.10-Tropfen Wirkstoffe: Crataegus Dil. D4, Arnica Dil. D4, Aurum chloratum natronatum Dil. D5, Barium jodatum Dil.
Packungsbeilage GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. NUSO-SAN Menthol 1mg/ml Nasenspray, Lösung. Xylometazolinhydrochlorid
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER NUSO-SAN Menthol 1mg/ml Nasenspray, Lösung Xylometazolinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER NUSO-SAN Menthol 1mg/ml Nasenspray, Lösung Xylometazolinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige
PHV-issue: Codein for the treatment of cough or cold in paediatric patients
 BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 27.05.2015 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 27.05.2015 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
Labortests für Ihre Gesundheit. Therapie nach Maß 26
 Labortests für Ihre Gesundheit Therapie nach Maß 26 01IPF Labortests für Ihre Gesundheit Therapie nach Maß Die individuelle Dosis finden Jeder Mensch ist einzigartig. Keiner gleicht dem anderen nicht nur
Labortests für Ihre Gesundheit Therapie nach Maß 26 01IPF Labortests für Ihre Gesundheit Therapie nach Maß Die individuelle Dosis finden Jeder Mensch ist einzigartig. Keiner gleicht dem anderen nicht nur
Erkältung. Ein complexes Thema einfach erklärt. Trotz Erkältung voll im Leben.
 Erkältung Ein complexes Thema einfach erklärt Trotz Erkältung voll im Leben. Erkältung kaum einer entkommt ihr! Eine Erkältung ist weltweit die häufigste Erkrankung, von der Sahara bis nach Grönland. Würde
Erkältung Ein complexes Thema einfach erklärt Trotz Erkältung voll im Leben. Erkältung kaum einer entkommt ihr! Eine Erkältung ist weltweit die häufigste Erkrankung, von der Sahara bis nach Grönland. Würde
LANSOYL Paraffine Gel zum Einnehmenv3.0_B2.0 1/5
 PIL September 2015 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER LANSOYL PARAFFINE 78,230 g/100 g Gel zum Einnehmen Paraffinöl Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
PIL September 2015 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER LANSOYL PARAFFINE 78,230 g/100 g Gel zum Einnehmen Paraffinöl Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Pulver zur Herstellung einer Lösung zum Einnehmen, verpackt in Beuteln.
 Fachinformation 1. BEZEICHNUNG DES ARZNEIMITTELS Dulcolax M Balance 10 g Pulver zur Herstellung einer Lösung zum Einnehmen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Jeder Beutel enthält 10 g Macrogol
Fachinformation 1. BEZEICHNUNG DES ARZNEIMITTELS Dulcolax M Balance 10 g Pulver zur Herstellung einer Lösung zum Einnehmen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Jeder Beutel enthält 10 g Macrogol
