Simvastatin Actavis ACTAVIS
|
|
|
- Leander Richter
- vor 8 Jahren
- Abrufe
Transkript
1 Simvastatin Actavis ACTAVIS AMZV Zusammensetzung Wirkstoff: Simvastatinum. Hilfsstoffe: Antioxidans: E 320, excipiens pro compresso obducto. Galenische Form und Wirkstoffmenge pro Einheit Filmtabletten zu 20 mg (mit Bruchrille, teilbar), 40 mg (mit Bruchrille, teilbar) und 80 mg (mit Bruchrille, teilbar). Indikationen/Anwendungsmöglichkeiten Reduktion von erhöhtem Gesamt- und LDL-Cholesterin, Apolipoprotein B und Triglyzeriden bei Patienten mit primärer Hypercholesterinämie, Mischformen der Hyperlipidämie und bei Patienten mit heterozygoter familiärer Hypercholesterinämie zusätzlich zur Diät, wenn diese und andere nicht-pharmakologische Massnahmen (wie Fitnesstraining und Gewichtsreduktion) keine ausreichende Wirkung erbringen. Simvastatin Actavis ist auch indiziert als Adjuvans zur Diät und zu anderen nicht-diätetischen Massnahmen für die Reduktion von erhöhtem Gesamtcholesterin, LDL-Cholesterin und Apolipoprotein B bei Patienten mit homozygoter familiärer Hypercholesterinämie, wenn der Erfolg dieser Massnahmen ungenügend ist. Bei Patienten mit hohem Risiko für eine koronare Herzkrankheit (mit oder ohne Hyperlipidämie), wie z.b. Patienten mit Diabetes mellitus, Status nach zerebrovaskulärem Insult, anderen zerebrovaskulären Erkrankungen oder periphervaskulären Erkrankungen oder bei Patienten mit bestehender koronarer Herzkrankheit ist Simvastatin Actavis indiziert. Simvastatin Actavis führt zu einer Reduktion der Gesamtmortalität infolge Reduktion des Risikos der kardiovaskulären Mortalität, der kardiovaskulären Ereignisse, zur Reduktion von notwendigen koronaren, nicht-koronaren und peripheren Revaskularisationen und zur Reduktion des Risikos von Hospitalisationen wegen Angina pectoris. Bekannte Ursachen der kardiovaskulären Mortalität oder Morbidität wie Hypertonie und Diabetes mellitus sollten behandelt und das Rauchen eingestellt werden. Simvastatin Actavis ist indiziert zur Erhöhung des HDL-Cholesterins bei Patienten mit mässig erhöhtem Gesamtcholesterin (5,5 8,0 mmol/l). Dosierung/Anwendung Vor Beginn der Behandlung mit Simvastatin Actavis soll der Patient einer cholesterinsenkenden Diät unterzogen werden, die während der Behandlung weiterzuführen ist. Notwendige Dosierungsanpassungen sollen im Abstand von mindestens 4 Wochen erfolgen und 80 mg pro Tag nicht übersteigen. Die Tabletten werden unzerkaut in der Regel mit der Abendmahlzeit eingenommen. Übliche Dosierung Patienten mit erhöhtem Risiko für eine koronare Herzkrankheit (KHK) oder mit bestehender Herzkrankheit Bei Patienten mit erhöhtem Risiko für eine koronare Herzkrankheit (mit oder ohne Hyperlipidämie), einschliesslich Patienten mit Diabetes mellitus, cerebrovaskulärer oder peripherer Gefässerkrankung oder mit bestehender Herzkrankheit, beträgt die Dosis von Simvastatin Actavis 40 mg pro Tag, verabreicht als Einzeldosis am Abend. Patienten mit Hyperlipidämie, die nicht zur obigen Risikogruppe gehören Die Anfangsdosis beträgt 20 mg täglich und soll als Einzeldosis mit der Abendmahlzeit unzerkaut eingenommen werden. Patienten die eine grössere LDL-Reduktion (über 45%) benötigen, können mit einer Dosis von 40 mg/tag als Einzeldosis abends beginnen. Dosierungsanpassungen sollten wie oben beschrieben vorgenommen werden. Da die höhere Dosierung (80 mg) mit dem häufigeren Auftreten von Nebenwirkungen verbunden ist, sollte diese Patienten mit einem ungenügenden Ansprechen vorbehalten sein, bei denen eine Reduktion des Gesamt- oder LDL Cholesterins mit der 40 mg Dosis nicht erreicht werden kann (siehe «Warnhinweise und Vorsichtsmassnahmen»). Beim Absinken des Gesamtcholesterins unter 160 mg/dl (4,1 mmol/l) oder des LDL-Cholesterins unter 100 mg/dl (2,6 mmol/l) ist eine Dosisreduktion vorzunehmen. Die Behandlung mit Simvastatin Actavis sollte abgebrochen werden, wenn nach einer Therapiedauer von 3 Monaten keine befriedigende Wirkung feststellbar ist. Homozygote familiäre Hypercholesterinämie Die empfohlene Dosierung für Patienten mit homozygoter familiärer Hypercholesterinämie beträgt 40 mg Simvastatin Actavis täglich abends oder 80 mg pro Tag in drei Einzeldosen, je 20 mg morgens und mittags und einmal 40 mg abends. Simvastatin Actavis sollte bei diesen Patienten eingesetzt werden als Adjuvans zu anderen lipidsenkenden Behandlungen (z.b. LDL-Apherese) oder wenn solche andere Behandlungen nicht zur Verfügung stehen. Begleitende Behandlung Simvastatin Actavis ist allein wirksam oder in Kombination mit Anionentauschern. Bei gleichzeitiger Verabreichung von Simvastatin Actavis mit Ciclosporin, Danazol, Gemfibrozil oder anderen Fibraten (ausser Fenofibrat) sollte die Dosis von Simvastatin Actavis 10 mg pro Tag nicht überschreiten. Bei gleichzeitiger Verabreichung von Simvastatin Actavis mit Amiodaron oder Verapamil sollte die Dosis von Simvastatin Actavis 20 mg pro Tag nicht überschreiten (siehe «Warnhinweise und Vorsichtsmassnahmen, Myopathie/Rhabdomyolyse» und «Interaktionen»). Spezielle Dosierungsanweisungen Niereninsuffizienz Da Simvastatin nicht in nennenswertem Ausmass durch die Niere ausgeschieden wird, ist bei mässiger Niereninsuffizienz keine Dosisreduktion erforderlich. Bei Patienten mit schwerer Niereninsuffizienz (Kreatinin Clearance <30 ml/min) sollten Dosierungen über 10 mg pro Tag nur mit Vorsicht verwendet werden (siehe «Pharmakokinetik»). Seite 1
2 Verabreichung im Alter Bei Patienten über 65 Jahren, die im Rahmen von kontrollierten klinischen Studien Simvastatin erhielten, unterschied sich die Wirkung, gemessen an der Senkung der LDL- und Gesamtcholesterinwerte, nicht von derjenigen bei der Gesamtpopulation. Klinische oder im Labor erfasste störende Befunde wurden nicht vermehrt beobachtet. Pädiatrie Kinder und Jugendliche im Alter von Jahren bei heterozygoter familiärer Hypercholesterinämie Die empfohlene Anfangsdosis beträgt 10 mg einmal täglich am Abend eingenommen. Der empfohlene Dosisbereich beträgt mg/tag. Die maximal empfohlene Dosierung beträgt 40 mg täglich. Die Dosis sollte den individuellen Zielwerten der Therapie angepasst werden (siehe «Eigenschaften/Wirkungen»). Mädchen sollten mindestens 1 Jahr nach der Menarche sein (siehe «Warnhinweise und Vorsichtsmassnahmen»). Kinder unter 10 Jahren Die Anwendung von Simvastatin Actavis wird bei Kindern unter 10 Jahren nicht empfohlen, da keine Erfahrungen vorliegen. Kontraindikationen Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe. Aktive Lebererkrankung oder unerklärte persistierende Erhöhung der Serum-Transaminasen. Schwangerschaft und Stillperiode (siehe auch «Schwangerschaft/Stillzeit»). Warnhinweise und Vorsichtsmassnahmen Myopathie/Rhabdomyolyse Wie andere HMG-CoA-Reduktase-Hemmer verursacht Simvastatin gelegentlich eine Myopathie, welche sich in Form von Muskelschmerz, -schwäche oder -empfindlichkeit zusammen mit stark erhöhter Kreatinkinase (CK, auf das Zehnfache der oberen Normgrenze) äussert. Myopathie kann manchmal in Form einer Rhabdomyolyse mit oder ohne akutem Nierenversagen aufgrund einer Myoglobinurie auftreten und selten sind Todesfälle vorgekommen. Das Risiko einer Myopathie ist bei hoher HMG-CoA- Reduktase-Inhibitoraktivität im Plasma erhöht. Die Ärzte sollten Statine mit Vorsicht bei Patienten mit prädisponierenden Faktoren für eine Rhabdomyolyse verschreiben. Ein Kreatinkinase-Wert sollte vor Beginn einer Statinbehandlung in den folgenden Situationen bestimmt werden: Einschränkung der Nierenfunktion. Hypothyreose. Persönliche oder familiäre Vorgeschichte von erblichen Muskelerkrankungen. Vorgeschichte von Muskeltoxizität mit einem Statin oder Fibrat. Alkoholabhängigkeit. Ältere Personen (>70 Jahre): die Notwendigkeit einer solchen Messung sollte bei Vorhandensein von anderen prädisponierenden Faktoren für eine Rhabdomyolyse in Betracht gezogen werden. In solchen Situationen sollte das Risiko einer Behandlung in Relation zum möglichen Nutzen betrachtet werden und eine klinische Überwachung wird empfohlen. Wenn die CK-Ausgangswerte signifikant erhöht sind (>5mal die obere Normgrenze), darf die Behandlung nicht eingeleitet werden. Alle Patienten, welche eine Behandlung mit Simvastatin beginnen oder bei denen die Dosis von Simvastatin erhöht werden soll, sollten über das Myopathierisiko aufgeklärt und angehalten werden, allfällige auftretende unklare Zeichen wie Muskelschmerz, Empfindlichkeit der Muskulatur oder Muskelschwäche unverzüglich zu melden. Die Therapie mit Simvastatin sollte unverzüglich abgebrochen werden, wenn eine Myopathie diagnostiziert oder vermutet wird. Diese Symptome und/oder ein Wert >10 ULN ist ein Hinweis auf eine Myopathie. Bei sofortigem Absetzen der Therapie sind Muskelsymptome und CK Werte in den meisten Fällen rückläufig. Periodische CK-Bestimmungen sind bei Patienten, welche eine Behandlung mit Simvastatin beginnen oder bei denen die Dosis von Simvastatin erhöht werden soll, in Betracht zu ziehen, es gibt jedoch keine Sicherheit, dass dadurch das Auftreten einer Myopathie verhindert werden kann. Kreatinkinase (CK) sollte nicht nach körperlicher Anstrengung oder in Gegenwart irgendeiner anderen plausiblen Ursache für eine CK-Erhöhung gemessen werden, da dies die Interpretation der Messresultate erschwert. Wenn die CK-Ausgangswerte signifikant erhöht sind (>5mal die obere Normgrenze), sollte die Messung innerhalb 5 bis 7 Tage später zur Bestätigung der Resultate wiederholt werden. Wenn bei Patienten während der Behandlung mit einem Statin Muskelschmerzen, -schwäche oder -krämpfe vorkommen, sollten ihre CK-Werte bestimmt werden. Wenn diese Werte signifikant erhöht sind (>5mal die obere Normgrenze), sollte die Behandlung abgebrochen werden. Wenn die Muskelsymptome schwerwiegend sind und täglich Unannehmlichkeiten verursachen, selbst wenn die CK-Werte im Bereich 5mal die obere Normgrenze erhöht sind, sollte ein Abbruch der Behandlung in Betracht gezogen werden. Wenn die Symptome zurückgehen und die CK-Werte sich normalisieren, dann kann eine Wiederaufnahme der Behandlung mit dem Statin oder eine Behandlung mit einem alternativen Statin bei der tiefsten Dosis mit enger Überwachung des Patienten in Betracht gezogen werden. Viele der Patienten, die unter Simvastatin-Therapie eine Rhabdomyolyse entwickelt haben, hatten erschwerende Befunde in der Anamnese einschliesslich Niereninsuffizienz, meist als Folge eines langdauernden Diabetes mellitus. Diese Patienten erfordern eine engmaschigere Überwachung. Die Behandlung mit Simvastatin sollte vorübergehend einige Tage vor einem grösseren chirurgischen Wahleingriff abgesetzt werden, ebenso wenn ein akutes medizinisches oder chirurgisches Leiden auftritt. Wie bei anderen HMG-CoA Hemmern ist das Risiko einer Myopathie/Rhabdomyolyse dosisabhängig. In klinischen Studien, in welchen die Patienten sorgfältig überwacht und einige interagierende Arzneimittel ausgeschlossen wurden, betrug die Häufigkeit ungefähr 0,02% bei 20 mg, 0,08% bei 40 mg und 0,53% bei 80 mg. Das Risiko einer Myopathie/Rhabdomyolyse wird bei gleichzeitiger Anwendung von Simvastatin mit folgenden Arzneimitteln erhöht: Seite 2
3 Potente Hemmer von CYP3A4: Itraconazol, Ketoconazol, Erythromycin, Clarithromycin, Telithromycin, HIV-Proteasehemmer oder Nefazodon siehe «Interaktionen», «CYP3A4-Interaktionen»). Die gleichzeitige Anwendung von Simvastatin mit potenten CYP3A4 Hemmern sollte daher vermieden werden oder, falls notwendig, die Therapie mit Simvastatin unterbrochen werden. Andere Arzneimittel Gemfibrozil oder andere Fibrate (ausser Fenofibrat) (siehe «Interaktionen»): Bei Patienten, die Gemfibrozil oder andere Fibrate (ausser Fenofibrat) erhalten, sollte die tägliche Dosis von Simvastatin 10 mg nicht überschreiten. Die gleichzeitige Anwendung von Simvastatin und Gemfibrozil sollte vermieden werden, es sei denn die Vorteile überwiegen die Risiken dieser Kombination. Die Vorteile einer gleichzeitigen Medikation mit Fibraten (ausser Fenofibrat) sollte gegen die Risiken abgewogen werden. Vorsicht ist geboten bei der gleichzeitigen Medikation von Simvastatin mit Fenofibrat, da Fenofibrat alleine Myopathie verursachen kann. Der Zusatz von Fibraten zu Simvastatin bewirkt in der Regel eine geringfügige zusätzliche Herabsetzung des LDL-Cholesterins; es können jedoch weitere Reduktionen der Triglyzeride und weitere Erhöhungen des HDL-Cholesterins erreicht werden. Kombinationen von Fibraten oder Niacin mit Simvastatin wurden in kleinen, kurzdauernden klinischen Studien mit sorgfältiger Überwachung eingesetzt, ohne dass Myopathien beobachtet wurden. Ciclosporin oder Danazol (siehe «Interaktionen»): Die Dosis von Simvastatin sollte bei Patienten, die gleichzeitig mit Ciclosporin oder Danazol behandelt werden, 10 mg täglich nicht überschreiten. Amiodaron oder Verapamil (siehe «Interaktionen»): Bei Patienten mit gleichzeitiger Verabreichung von Amiodaron oder Verapamil sollte die Dosis von Simvastatin 20 mg pro Tag nicht überschreiten. Diltiazem (siehe «Interaktionen»): Patienten unter Behandlung mit Diltiazem und Simvastatin 80 mg haben ein leicht erhöhtes Risiko einer Myopathie. Bei gleichzeitiger Anwendung mit Diltiazem sollte eine Dosis von 40 mg Simvastatin pro Tag nicht überschritten werden, es sei denn, die Vorteile überwiegen das erhöhte Risiko dieser Kombination für Myopathie. Fusidinsäure (siehe «Interaktionen»): Patienten unter Behandlung mit Fusidinsäure und Simvastatin könnten ein erhöhtes Risiko für Myopathie haben und sollten deshalb eng überwacht werden. Eine vorübergehende Unterbrechung der Therapie mit Simvastatin sollte in Betracht gezogen werden Niacin ( 1 g/tag) (siehe «Interaktionen»): Vorsicht ist geboten, wenn Simvastatin und Niacin ( 1 g/tag) zusammen verschrieben werden, da Niacin bei Monotherapie Myopathien verursachen kann (siehe «Interaktionen»). Wirkungen auf die Leber In klinischen Studien hat Simvastatin bei einigen erwachsenen Patienten zu einer wesentlichen Erhöhung der Serumtransaminasen (mehr als das Dreifache der oberen Normwerte, ULN) geführt. Nach Unterbruch oder Absetzen des Arzneimittels kam es normalerweise zu einem langsamen Absinken der Transaminasen auf Werte vor Behandlungsbeginn. Der Anstieg war nicht von Gelbsucht oder anderen klinischen Symptomen begleitet. Anzeichen für Überempfindlichkeit bestanden nicht. Einige dieser Patienten hatten vor Behandlungsbeginn erhöhte Leberfunktionswerte und/oder einen erheblichen Alkoholkonsum. In der «Scandinavian Simvastatin Survival Study» [4S] (siehe «Eigenschaften/Wirkungen») waren persitierende Transaminasenerhöhung (ALT 3 ULN) bei Simvastatin und Placebo (14 [0,7%] gegenüber 12 [0,6%]) vergleichbar. Allerdings waren einzelne Erhöhungen der ALT auf das Dreifache der oberen Normgrenze im ersten Studienjahr in der Simvastatin-Gruppe signifikant häufiger (20 gegenüber 8, p= 0,023). Erhöhte Transaminasen (ALT, AST) hatten bei 8 Patienten der Simvastatin-Gruppe (n= 2 221) und bei 5 Patienten der Placebo-Gruppe (n= 2 223) ein Absetzen der Therapie zur Folge. In zwei weiteren kontrollierten klinischen Studien bei Patienten betrug die Häufigkeit persistierender Lebertransaminasenerhöhungen, welche auf das Arzneimittel zurückzuführen waren, in 6 Monaten 0,7% bei einer Dosis von 40 mg und 1,8% bei einer Dosis von 80 mg. In der «Heart Protection Studie (HPS)», in der Patienten randomisiert der Behandlung mit Simvastatin 40 mg pro Tag oder mit Placebo zugeteilt wurden, betrug die Häufigkeit erhöhter Transaminasen (3 ULN) bei Patienten unter Behandlung mit Simvastatin 0,21% (n= 21) und bei Patienten unter Placebo 0,09% (n= 9). Erhöhte Serumtransaminasen erfordern besondere Beachtung: Es wird empfohlen, Leberfunktionsprüfungen vor Therapiebeginn und später, wenn klinisch angezeigt, durchzuführen. Bei Patienten mit Dosiserhöhung auf 80 mg sollte ein zusätzlicher Test vor Dosiserhöhung, 3 Monate nach Erhöhung auf 80 mg und später in periodischen Abständen (z.b. halbjährlich) während des ersten Behandlungsjahres durchgeführt werden. Bei Patienten, die erhöhte Transaminasenwerte entwickeln, sollte die Analyse sofort und anschliessend in kurzen Abständen wiederholt werden. Bei weiterem Ansteigen der Transaminasen, besonders auf Werte über dem dreifachen Normbereich, und dort persistierend, soll das Arzneimittel abgesetzt werden. Bei Patienten mit Alkoholabusus und/oder einer Vorgeschichte betreffend Lebererkrankungen soll das Arzneimittel mit Vorsicht angewendet werden. Aktive Leberleiden oder eine unerklärte Erhöhung der Transaminasen stellen Kontraindikationen dar (siehe «Kontraindikationen»). Wie unter anderen Lipidsenkern sind auch mit Simvastatin mässig erhöhte Transaminasenwerte unter dem dreifachen Normbereich (ULN) beobachtet worden. Diese Veränderungen traten kurz nach Therapiebeginn auf, waren oft vorübergehend, nicht von Symptomen begleitet und erforderten keinen Behandlungsunterbruch. Augen Ohne jegliche Arzneimitteltherapie muss mit der Zeit, als Folge des Alterungsprozesses, eine erhöhte Prävalenz von Linsentrübungen erwartet werden. Gegenwärtige Daten aus kontrollierten klinischen Langzeituntersuchungen geben keinen Hinweis auf eine nachteilige Wirkung von Simvastatin auf die menschliche Linse. Hypertriglyzeridämie Simvastatin Actavis senkt die Triglyzeride nur mässig und ist nicht indiziert, wenn die Hypertriglyzeridämie im Vordergrund steht. Dies betrifft Hyperlipidämien vom Typ I, IV und V. Anwendung bei Kindern und Jugendlichen Die Sicherheit und Wirksamkeit von Simvastatin bei 10 17jährigen Patienten mit heterozygoter familiärer Hypercholesterinämie wurden in einer kontrollierten klinischen Studie bei jugendlichen Knaben und Mädchen, die ihre Menarche mindestens ein Jahr vorher hatten, untersucht. Patienten, die mit Simvastatin behandelt wurden, hatten im Allgemeinen unerwünschte Wirkungen ähnlich wie unter Placebo. Dosierungen über 40 mg wurden in dieser Population nicht untersucht. In dieser limitierten, kontrollierten Studie wurde kein bestimmbarer Effekt auf das Wachstum und die sexuelle Reifung der jugendlichen Knaben und Mädchen oder Seite 3
4 ein Effekt auf die Länge der Menstruationszyklen bei Mädchen festgestellt (siehe «Dosierung/Anwendung», «Unerwünschte Wirkungen», «Eigenschaften/Wirkungen»). Jugendliche Mädchen sollten über entsprechende Verhütungsmethoden beraten werden, während sie mit Simvastatin behandelt werden (siehe «Kontraindikationen», «Warnhinweise und Vorsichtsmassnahmen», «Schwangerschaft/Stillzeit»). Simvastatin wurde bei Kindern unter 10 Jahren oder bei Mädchen vor der Menarche nicht untersucht. Interaktionen CYP3A4-Interaktionen Simvastatin wird über CYP3A4 metabolisiert, hat aber keine inhibitorische CYP3A4-Aktivität. Deshalb ist nicht zu erwarten, dass Plasmaspiegel anderer Arzneimittel, die durch CYP3A4 metabolisiert werden, beeinflusst werden. Potente Inhibitoren von CYP3A4 können das Myopathie- und Rhabdomyolyserisiko durch Verminderung der Elimination von Simvastatin erhöhen. Siehe «Warnhinweise und Vorsichtsmassnahmen», zum erhöhten Risiko einer Myopathie/Rhabdomyolyse bei Kombination mit folgenden Substanzen: Itraconazol. Ketoconazol. Erythromycin. Clarithromycin. Telithromycin. HIV-Proteasehemmer. Nefazodon. Grapefruitsaft enthält eine oder mehrere Komponenten, die CYP3A4 hemmen, und kann die Plasmaspiegel von Arzneimitteln, die über CYP3A4 metabolisiert werden, erhöhen. Die Wirkung einer normalen Menge Grapefruitsaft (1 Glas zu 250 ml täglich) ist minimal (Erhöhung der AUC der HMG-CoA-Reduktase-Inhibitoraktivität im Plasma um 13%) und klinisch nicht relevant. Grössere Mengen (mehr als 1 Liter) können jedoch die HMG-CoA-Reduktase-Inhibitoraktivität im Plasma unter Simvastatin-Therapie signifikant erhöhen und sollten vermieden werden. Interaktionen mit lipidsenkenden Arzneimitteln, die allein verabreicht eine Myopathie oder Rhabdomyolyse verursachen können Das Myopathie- und Rhabdomyolyserisiko wird ebenfalls erhöht durch folgende lipidsenkende Arzneimittel, die nicht potente Hemmer von CYP3A4 sind, aber allein verabreicht eine Myopathie verursachen können; siehe «Warnhinweise und Vorsichtsmassnahmen, Myopathie/Rhabdomyolyse»: Gemfibrozil. Andere Fibrate (ausser Fenofibrat). Niacin (Nikotinsäure, 1 g/tag). Interaktionen mit anderen Arzneimitteln Ciclosporin oder Danazol Das Risiko einer Myopathie/Rhabdomyolyse wird durch gleichzeitige Verabreichung von Ciclosporin oder Danazol besonders mit höheren Dosen von Simvastatin erhöht (siehe «Warnhinweise und Vorsichtsmassnahmen, Myopathie/Rhabdomyolyse»). Amiodaron oder Verapamil Das Risiko einer Myopathie/Rhabdomyolyse wird durch gleichzeitige Verabreichung von Amiodaron oder Verapamil mit höheren Dosen von Simvastatin erhöht (siehe «Warnhinweise und Vorsichtsmassnahmen, Myopathie/Rhabdomyolyse»). Diltiazem Patienten unter Behandlung mit Diltiazem, welche gleichzeitig Simvastatin 80 mg erhalten, zeigen ein leicht erhöhtes Risiko für eine Myopathie (siehe «Warnhinweise und Vorsichtsmassnahmen, Myopathie/Rhabdomyolyse»). Fusidinsäure Patienten unter Behandlung mit Fusidinsäure, welche gleichzeitig Simvastatin erhalten, könnten ein erhöhtes Risiko für eine Myopathie haben (siehe «Warnhinweise und Vorsichtsmassnahmen, Myopathie/Rhabdomyolyse»). Cumarin Derivate In zwei klinischen Studien eine bei gesunden Freiwilligen und die andere bei Patienten mit Hypercholesterinämie erhöhte Simvastatin mg/tag in mässigem Ausmass den Antikoagulationseffekt von Cumarin-Derivaten: bei den gesunden Freiwilligen erhöhte sich die Prothrombinzeit (angegeben als «International Normalized Ratio») von einem Ausgangswert von 1,7 auf 1,8 und bei den Patienten von 2,6 auf 3,4. Bei Patienten unter Antikoagulation sollte die Prothrombinzeit vor Einleitung der Simvastatin- Therapie und genügend häufig während Beginn der Behandlung bestimmt werden, um signifikante Veränderungen der Prothrombinzeit zu erfassen. Sobald sich eine stabile Prothrombinzeit eingestellt hat, können die Prothrombinzeiten mit den üblichen für Patienten unter Cumarinantikoagulantien empfohlenen Intervallen weiterverfolgt werden. Wenn die Simvastatin-Dosis geändert wird oder Simvastatin abgesetzt wird, sollte dasselbe Vorgehen wiederholt werden. Bei nicht-antikoagulierten Patienten ist die Behandlung mit Simvastatin nicht mit Blutungen oder Veränderungen der Prothrombinzeit in Verbindung gebracht worden. Digoxin Die gleichzeitige Gabe von Simvastatin und Digoxin bei gesunden Freiwilligen resultierte in einer geringen Erhöhung des Digoxin- Spiegels (weniger als 0,3 ng/ml, gemessen im Radio-Immuno-Assay), während dies mit Placebo nicht beobachtet wurde. Andere gleichzeitige Behandlungen In klinischen Studien wurde Simvastatin gleichzeitig mit ACE-Hemmern, Betablockern, Diuretika und nicht-steroidalen Entzündungshemmern verabreicht ohne Hinweise auf klinisch signifikante nachteilige Interaktionen. Propranolol Bei gesunden Freiwilligen wurde keine klinisch relevante pharmakokinetische oder pharmakodynamische Interaktion nach gleichzeitiger Gabe von Einzeldosen von Simvastaitin und Propranolol beobachtet. Seite 4
5 Schwangerschaft/Stillzeit Simvastatin Actavis ist in der Schwangerschaft kontraindiziert. Die Sicherheit bei schwangeren Frauen wurde nicht untersucht. Seltene Berichte über kongenitale Missbildungen bei Säuglingen, deren Mütter während der Schwangerschaft HMG-CoA-Reduktasehemmer erhalten hatten, liegen vor. In einer Überprüfung von ca. 200 Schwangerschaften, in denen die Frauen während des ersten Trimenons Simvastatin oder einen anderen HMG-CoA- Reduktasehemmer erhielten, war die Inzidenz von kongenitalen Missbildungen jedoch vergleichbar mit derjenigen bei unbehandelten Frauen. Simvastatin Actavis sollte bei Frauen, die schwanger sind, schwanger werden wollen oder den Verdacht haben schwanger zu sein, nicht angewendet werden. Die Behandlung mit Simvastatin Actavis sollte für die Dauer der Schwangerschaft oder bis zum klaren Ausschluss einer Schwangerschaft ausgesetzt werden (siehe «Kontraindikationen»). Stillende Mütter Es ist nicht bekannt, ob Simvastatin oder dessen Metaboliten in die Muttermilch ausgeschieden werden. Wegen der möglichen Gefahr für den Säugling sollen Mütter unter Behandlung mit Simvastatin Actavis nicht stillen (siehe «Kontraindikationen»). Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen Aufgrund der möglichen unerwünschten Wirkungen kann die Reaktionsfähigkeit, die Fahrtüchtigkeit und die Fähigkeit, Werkzeuge und Maschinen zu bedienen, beeinträchtigt sein. Unerwünschte Wirkungen Die Häufigkeitsangaben der folgenden unerwünschten Wirkungen, die während klinischen Studien und/oder nach Markteinführung beobachtet wurden, sind anhand der Bewertung ihrer Inzidenzraten in grossen, placebokontrollierten, klinischen Langzeitstudien einschliesslich HPS (Heart Protection Studie) und 4S (Scandinavian Simvastatin Survival Study) mit resp Patienten kategorisiert. Für HPS wurden nur schwerwiegende unerwünschte Wirkungen aufgenommen wie auch Myalgie, Erhöhungen der Serumtransaminasen und der Kreatinkinase. Für 4S wurden alle unten aufgeführten unerwünschten Wirkungen aufgenommen. Wenn die Inzidenzraten für Simvastatin in diesen Studien geringer oder ähnlich im Vergleich zu Placebo waren und die Spontanmeldungen in einem ähnlichen Kausalzusammenhang standen, wurden diese unerwünschten Wirkungen als «selten» klassiert. In der Studie HPS, in der Patienten mit Simvastatin 40 mg pro Tag (n= ) oder mit Placebo (n= ) behandelt wurden, waren die Sicherheitsprofile über die mittlere Studiendauer von 5 Jahren vergleichbar zwischen den Patienten unter Behandlung mit Simvastatin und den Patienten unter Placebo. Die Abbruchraten infolge unerwünschter Wirkungen waren in beiden Behandlungsgruppen vergleichbar (4,8% bei Patienten unter Behandlung mit Simvastatin 40 mg verglichen mit 5,1% bei Patienten unter Placebo). Die Häufigkeit von Myopathie war <0,1% bei Patienten unter Behandlung mit Simvastatin 40 mg. Erhöhte Transaminasen (mehr als das Dreifache der oberen Normgrenze, bestätigt durch Wiederholungstest) kamen bei 0,21% (n= 21) der Patienten unter Behandlung mit Simvastatin im Vergleich zu 0,09% (n= 9) der Patienten unter Placebo vor. Die Häufigkeitsangaben der unerwünschten Wirkungen sind nach folgender Einteilung aufgeführt: sehr häufig ( 1/10), häufig ( 1/100, <1/10), gelegentlich ( 1/1 000, <1/100), selten ( 1/10 000, <1/1 000) und sehr selten (<1/10 000). Untersuchungen Selten: Erhöhungen der Serumtransaminasen (Alanin-Aminotransferase, Aspartat-Aminotransferase, γ-glutamyl-transpeptidase [siehe «Warnhinweise und Vorsichtsmassnahmen, Wirkungen auf die Leber»]), erhöhte alkalische Phosphatase, Erhöhung von Serumkreatinkinasespiegel (siehe «Warnhinweise und Vorsichtsmassnahmen, Myopathie/Rhabdomyolyse»). Störungen des Blut- und Lymphsystems Selten: Anämie. Störungen des Immunsystems Ein offensichtlich auf Überempfindlichkeit zurückzuführendes Syndrom mit den folgenden Symptomen wurde selten beobachtet: Angioödem, Lupus-ähnliches Syndrom, Polymyalgia rheumatica, Dermatomyositis, Vaskulitis, Thrombozytopenie, Eosinophilie, erhöhte BSR, Arthritis, Gelenkschmerzen, Urtikaria, Lichtempfindlichkeit, Fieber, Hitzewallungen, Dyspnoe und Unwohlsein. Störungen des Nervensystems Selten: Kopfschmerzen, Parästhesien, Benommenheit, periphere Neuropathie. Sehr selten: Gedächtnisstörung. Gastrointestinale Beschwerden Selten: Konstipation, Abdominalschmerzen, Flatulenz, Dyspepsie, Diarrhö, Nausea, Erbrechen, Pankreatitis. Funktionsstörungen der Haut und des Unterhautzellgewebes Selten: Hautausschläge, Juckreiz, Alopezie. Funktionsstörungen des Bewegungsapparates und des Bindegewebes Selten: Myopathie, Rhabdomyolyse (siehe «Warnhinweise und Vorsichtsmassnahmen, Myopathie/Rhabdomyolyse»), Myalgie, Muskelkrämpfe. Rhabdomyolyse ist eine potentiell lebensbedrohliche unerwünschte Wirkung. Isolierte Fälle von Beschwerden der Achillessehne, selten verbunden mit Achillessehnenruptur. Allgemeine Störungen Selten: Asthenie. Funktionsstörungen der Leber und der Galle Selten: Hepatitis/Gelbsucht. Sehr selten: Leberversagen. Psychiatrische Erkrankungen Sehr selten: Insomnie. Seite 5
6 Kinder und Jugendliche im Alter von Jahren In einer Studie mit Jugendlichen im Alter von Jahren und mit heterozygoter familiärer Hypercholesterinämie (n= 175) war die Sicherheit und Verträglichkeit der Gruppe, die mit Simvastatin behandelt wurde, im Allgemeinen ähnlich derjenigen, die mit Placebo behandelt wurden (siehe «Warnhinweise und Vorsichtsmassnahmen», «Eigenschaften/Wirkungen»). Überdosierung Es sind einige wenige Fälle einer Überdosierung bekannt geworden. Die maximal eingenommene Dosis war 3,6 g. Alle Patienten erholten sich ohne Folgen. Eine symptomatische Behandlung und die Überwachung der Leberfunktionen wird empfohlen. Eigenschaften/Wirkungen ATC-Code: C10AA01 Wirkmechanismus/Pharmakodynamik Simvastatin Actavis Tabletten enthalten den lipidsenkenden Wirkstoff Simvastatin, der synthetisch aus einem Gärungsprodukt von Aspergillus terreus gewonnen wird. Nach peroraler Aufnahme wird Simvastatin, ein inaktives Lakton, zur entsprechenden Beta- Hydroxysäure hydrolysiert. Diese ist der wesentliche Metabolit und ein Hemmer der 3-Hydroxy-3-Methylglutaryl-Coenzym A (HMG- CoA)-Reduktase. Dieses Enzym katalysiert einen frühen Schritt der Cholesterin-Biosynthese. In klinischen Studien wurde gezeigt, dass die orale Verabreichung von Simvastatin in allen geprüften Dosierungen die Plasmakonzentration des Gesamtcholesterins, des LDL (low density lipoprotein)-cholesterins, der Triglyceride und des VLDL (very low density lipoprotein)-cholesterins verminderte und das HDL (high density lipoprotein)-cholesterin sowohl in heterozygoten familiären als auch nicht familiären Formen der Hypercholesterinämie erhöhte. Das war auch der Fall für Mischformen der Hyperlipidämie, bei welchen erhöhte Cholesterinwerte im Vordergrund standen und Diät allein ungenügend wirksam war. Nach 2 Wochen wurde eine deutliche Wirkung beobachtet; das Wirkungsmaximum wurde nach 4 6 Wochen erreicht. Die Wirkung wurde während der Fortdauer der Behandlung beibehalten. Wird die Behandlung mit Simvastatin gestoppt, kehren das Cholesterin und die Lipide auf Werte wie vor der Behandlung zurück. Die aktive Form von Simvastatin ist ein spezifischer Hemmer der HMG-CoA-Reduktase. Er hemmt somit jenes Enzym, das die Konversion des HMG-CoA in Mevalonat katalysiert. Diese Konversion ist ein früher Schritt in der Biosynthese des Cholesterins und die Behandlung mit Simvastatin Actavis dürfte deshalb keine Anreicherung potentiell schädlicher Steroide verursachen. Zudem wird HMG-CoA rasch wieder zu Acetyl-CoA zurückmetabolisiert, welches an vielen biosynthetischen Abläufen im Organismus beteiligt ist. Obwohl Cholesterin die Vorstufe aller Steroidhormone ist, zeigte Simvastatin keine klinische Wirkung auf den Haushalt der Steroidhormone. Simvastatin verursachte keine Erhöhung der Lithogenizität der Galle und es ist daher nicht mit einer erhöhten Inzidenz von Gallensteinen zu rechnen. Resultate aus Tierversuchen, in denen Simvastatin oral verabreicht wurde, zeigten eine hohe Selektivität der Substanz für die Leber an, wo es bedeutend höhere Konzentrationen aufwies als in anderen Organen. Simvastatin wird in der Leber, dem hauptsächlichen Wirkungsort, einer deutlichen first-pass-extraktion unterzogen und dann mit der Galle ausgeschieden. Es wurde festgestellt, dass die systemisch wirksame Menge der aktiven Form von Simvastatin weniger als 5% der oralen Dosis beträgt. Davon sind 95% an die Plasmaproteine gebunden. Klinische Wirksamkeit In einer randomisierten, doppelblinden und placebokontrollierten Multizenterstudie (Scandinavian Simvastatin Survival Study [4S]) wurden Patienten (82% Männer) mit vorangegangenem Myokardinfarkt (79%) oder Angina pectoris und Hypercholesterinämie (5,5 8,0 mmol/l) während einer mittleren Dauer von 5,4 Jahren mit Diät und Simvastatin mg/tag (n= 2 221) oder Placebo (n= 2 223) behandelt. Im Verlauf der Studie führte die Therapie mit Simvastatin zu einer mittleren Senkung des Gesamtcholesterins, des LDL-Cholesterins und der Triglyzeride von 25%, 35% und 10%, und zu einem mittleren Anstieg des HDL-Cholesterins von 8%. Simvastatin verminderte das Todesrisiko von 11,5% (Placebo) auf 8,2% (p= 0,0003). Das Risiko eines koronaren Herztodes nahm von 8,5% (Placebo) auf 5% ab (p= 0,00001). Simvastatin verminderte auch das Risiko für schwerere koronare Ereignisse (koronarer Herztod plus im Spital verifizierter und stummer, nicht-letaler Myokardinfarkt) von 28% (Placebo) auf 19% (p <0,00001). Zudem verminderte Simvastatin das Risiko für koronare Revaskularisationsinterventionen (koronare Bypassoperation oder perkutane transluminale koronare Angioplastie) von 17,2% (Placebo) auf 11,3% (p <0,00001). Überdies senkte Simvastatin signifikant das Risiko letaler und nicht-letaler zerebrovaskulärer Ereignisse (Schlaganfall, transiente ischämische Attacken) um 28% (p= 0,033; Simvastatin 75 Patienten, Placebo 102 Patienten). Hinsichtlich nicht-kardiovaskulärer Mortalität gab es keinen statistisch signifikanten Unterschied zwischen den Behandlungsgruppen. Simvastatin verminderte das Risiko für schwerere koronare Ereignisse in ähnlichem Ausmass über den gesamten Bereich der Ausgangswerte von Gesamtcholesterin und LDL-Cholesterin. Das Todesrisiko bei den über sechzigjährigen Patienten sank um 27% und bei den Patienten unter 60 Jahren um 37% (p <0,01 in beiden Altersgruppen). Da sich unter den Verstorbenen nur 53 Frauen befanden, konnte die Wirkung von Simvastatin auf die Mortalität bei den Frauen nicht ausreichend beurteilt werden. Jedoch verminderte Simvastatin das Risiko, schwerere koronare Ereignisse zu erleiden, um 34% (p= 0,012, 60 Frauen vs. 91 Frauen mit einem oder mehreren Ereignissen). Bei Patienten mit Diabetes mellitus wurde das Risiko von schwerwiegenden koronaren Ereignissen um 55% reduziert (p= 0,002). In der «Heart Protection Studie (HPS)» wurden die Wirkungen der Therapie mit Simvastatin bei Patienten mit oder ohne Hyperlipidämie beurteilt, die einem hohen Risiko für eine Herzkrankheit wegen Diabetes, Hirnschlag oder anderer Hirngefässkrankheit in der Vorgeschichte, peripherer Gefässerkrankung oder bestehender Herzkrankheit ausgesetzt waren. In dieser multizentrischen, randomisierten, doppelblinden, placebokontrollierten Studie wurden Patienten mit Simvastatin 40 mg pro Tag und Patienten mit Placebo über eine mittlere Studiendauer von 5 Jahren behandelt Patienten (33%) hatten Ausgangswerte von LDL-Cholesterin unter 116 mg/dl, Patienten (25%) hatten Ausgangswerte zwischen 116 mg/dl und 135 mg/ dl und Patienten (42%) hatten Ausgangswerte über 135 mg/dl. Die Behandlung mit Simvastatin 40 mg pro Tag verminderte im Vergleich zu Placebo das Risiko der Gesamtmortalität um 13% (p= 0,0003), zurückzuführen auf eine 18%-ige Reduktion der Todesfälle wegen Herzkrankheit (p= 0,0005); die Reduktion nichtkoronar bedingter Todesfälle war statistisch nicht signifikant. Simvastatin senkte auch das Risiko von bedeutenden koronaren Ereignissen (zusammengesetzter Endpunkt aus nicht letalem Myokardinfarkt oder Tod aufgrund einer koronaren Herzkrankheit) um 27% (p <0,0001). Simvastatin verminderte den Bedarf für eine koronare Revaskularisation (einschliesslich Bypass-Operation Seite 6
7 am Herzen oder perkutane transluminale koronare Angioplastie [PTCA]) um 30% (p <0,0001). Simvastatin verringerte das Risiko eines ischämischen Hirnschlages um 30% (p <0,0001). Simvastatin verminderte ferner das Risiko einer Hospitalisation wegen Angina pectoris um 17% (p <0,00001). Die Risiken von bedeutenden koronaren Ereignissen und von bedeutenden vaskulären Ereignissen (zusammengesetzter Endpunkt aus bedeutenden koronaren Ereignissen, Hirnschlag oder Revaskularisationsverfahren) wurden bei Patienten mit oder ohne Herzkrankheit einschliesslich Diabetikern und Patienten mit peripherer Krankheit um etwa 25% vermindert. Zusätzlich verringerte Simvastatin bei Patienten mit Diabetes das Risiko nicht-koronar bedingter arterieller Eingriffe. Die durch Simvastatin erzielte Risikoreduktion auf das erste bedeutende vaskuläre Ereignis waren nicht korreliert mit folgenden Studienvariablen: Alter und Geschlecht des Patienten, Ausgangswerte LDL-C, HDL-C, Triglyceride, Apolipoproteine A-1 oder B, Hypertonie, Kreatininwerten, Basistherapie mit Herzkreislaufmedikamenten (d.h. Aspirin, Betablocker, ACE-Hemmer oder Kalziumantagonisten), Raucherstatus, Alkoholkonsum oder Fettleibigkeit. 32% der Patienten in der Placebogruppe nahmen im Verlauf von 5 Jahren ein Statin (ausserhalb des Protokolls) ein, so dass die beobachteten Risikoreduktionen die tatsächliche Wirkung von Simvastatin unterbewerten. In der randomisierten, doppelblinden und placebokontrollierten Multizenterstudie (Multicenter Anti-Atheroma Study [MAAS]) wurden 404 Patienten mit angiographisch nachgewiesener koronarer Herzkrankheit und Hypercholesterinämie (5,5 8,0 mmol/l) während 4 Jahren mit Diät und Simvastatin 20 mg/tag (n= 204; 89% Männer) bzw. Placebo behandelt. Koronare Angiogramme wurden zu Beginn und nach 2 und 4 Jahren angefertigt. Simvastatin verlangsamte das Fortschreiten der Läsionen gemäss der mittels Angiogramm erhobenen durchschnittlichen Veränderung des minimalen (p= 0,005) und mittleren (p= 0,026) Durchmessers der Gefässlumina pro Patient signifikant (beides co-primäre Endpunkte als Hinweis auf herdförmige bzw. diffuse Veränderungen); gleiches gilt auch für die prozentuale Einengung des Gefässdurchmessers (p= 0,003). Unter Simvastatin war auch der Anteil der Patienten mit neuen Läsionen (Simvastatin 13%, Placebo 24%, p= 0,009) und neuen vollständigen Verschlüssen (5% vs. 11%, p= 0,04) signifikant geringer. Die Resultate von Studien, welche die Dosis-Wirkung von Simvastatin bei Patienten mit primärer Hypercholesterinämie aufzeigen, sind nachfolgend dargestellt. Bei einem Drittel der Patienten wurde eine Reduktion des LDL-Cholesterins von 53% und mehr mit der Dosis von 80 mg erreicht verglichen mit 46% mit der 40 mg Dosis. Die Reduktion des LDL-Cholesterins war im wesentlichen unabhängig vom Ausgangswert. Im Gegensatz dazu war die Reduktion der Triglyzeride abhängig vom Ausgangswert der Triglyzeride. Von den 664 unter 80 mg eingeschlossenen Patienten hatten 475 Patienten mit Plasmatriglyzeridwerten von 2,25 mmol/l eine mittlere Reduktion der Triglyzeride von 21%, während bei 189 Patienten mit Hypertriglyzeridämie (>2,25 mmol/l) eine mittlere Senkung der Triglyzeride von 36% resultierte. In diesen Studien wurden Patienten mit Triglyzeridwerten von >4,0 mmol/l ausgeschlossen. In einer kontrollierten klinischen Studie erhielten 12 Patienten im Alter von Jahren mit homozygoter familiärer Hypercholesterinämie 40 mg Simvastatin pro Tag als Einzeldosis oder aufgeteilt in 3 Gaben oder 80 mg pro Tag in 3 Gaben. Die durchschnittliche LDL-Cholesterinsenkung betrug 14% für die 40 mg Dosierung respektive 25% für die 80 mg Dosierung. Ein Patient mit fehlender LDL-Rezeptor-Funktion hatte eine LDL-Cholesterinsenkung von 41% mit der 80 mg Dosis. Klinische Studien bei Jugendlichen im Alter von Jahren In einer doppelblinden, placebokontrollierten Studie wurden 175 Patienten (99 Knaben und 76 Mädchen nach der Menarche) im Alter von Jahren (Durchschnittsalter von 14,1 Jahren) und mit heterozygoter familiärer Hypercholesterinämie für 24 Wochen (Basisstudie) zu Simvastatin oder Placebo randomisiert. Für den Einschluss in die Studie war ein LDL-Cholesterin-Wert zwischen 160 und 400 mg/dl (zwischen 4,1 mmol/liter und 10,4 mmol/liter) und mindestens ein Elternteil mit einem LDL-Cholesterin-Wert >189 mg/dl (>4,9 mmol/liter) notwendig. Die Dosis von Simvastatin war 10 mg einmal täglich am Abend für die ersten 8 Wochen, 20 mg für die zweiten 8 Wochen, und danach 40 mg. In einer 24 Wochen dauernden Extension nahmen 144 Patienten teil und erhielten 40 mg Simvastatin oder Placebo. Simvastatin senkte die Plasmawerte von Gesamtcholesterin, LDL-Cholesterin, Triglyzeride, und Apolipoprotein B signifikant. Die Resultate der Extensionstudie nach 48 Wochen waren mit denjenigen der Basisstudie vergleichbar. Nach 24 Wochen Behandlung, war der durchschnittlich erreichte LDL-Cholesterinwert 124,9 mg/dl (3,2 mmol/liter) (Bereich 64,0 289,0 mg/dl; 1,7 mmol/liter 7,5 mmol/liter) in der mit Simvastatin 40 mg behandelten Gruppe im Vergleich zu 207,8 mg/dl (5,4 mmol/liter) (Bereich 128,0 334,0 mg/dl; 3,3 mmol/liter 8,7 mmol/liter) in der Gruppe die Placebo erhielt. Simvastatin senkte die durchschnittlichen Anfangswerte von Gesamtcholesterin um 26,5% (Placebo: 1,6% Zunahme), von LDL- Cholesterin um 36,8% (Placebo: 1,1% Zunahme), von Triglyzeriden um 7,9% (Placebo: 3,2% Zunahme), von Apolipoprotein B um 32,4% (Placebo: 0,5%), und erhöhte die durchschnittlichen Werte von HDL-Cholesterin um 8,3% (Placebo: 3,6%). Die Sicherheit und Wirksamkeit von Dosierungen über 40 mg pro Tag bei Kindern und Jugendlichen mit heterozygoter familiärer Hypercholesterinämie wurden nicht untersucht. Die Langzeitwirkung einer Behandlung mit Simvastatin in der Kindheit bezüglich einer Reduktion der Morbidität und Mortalität im Erwachsenenalter wurde nicht untersucht. Pharmakokinetik Absorption In Analogie zum Modell beim Hund wird Simvastatin gut resorbiert. Anhand einer i.v. Referenzdosis des Metaboliten L (siehe «Metabolismus») wurde die Verfügbarkeit des L nach oraler Verabreichung von Simvastatin im Kreislauf geschätzt. Auf Grund des ausgeprägten First-Pass-Effektes fand sich ein Wert von weniger als 5% der verabreichten Dosis. In Untersuchungen der Dosis-Proportionalität fanden sich für Dosen von 5, 10, 20, 60, 90 und 120 mg keine erheblichen Abweichungen vom linearen AUC-Nachweis der Inhibitoren im Kreislauf. In Bezug auf den Nüchternzustand wurde das Plasmaprofil der Inhibitoren nicht beeinflusst, wenn Simvastatin unmittelbar vor einer Mahlzeit verabreicht wurde. Die Pharmakokinetik einzelner und mehrerer Dosen von Simvastatin liess keine Anhäufung des Wirkstoffs durch die Wiederholung der Dosis erkennen. In allen pharmakokinetischen Studien wurde die maximale Plasmakonzentration der Inhibitoren nach 1,3 bis 2,4 Stunden erreicht. Distribution Simvastatin wird als erstes von der Leber, dem hauptsächlichen Organ seiner Aktivität, aufgenommen. Äquivalente des Wirkstoffs werden dann durch die Galle ausgeschieden (siehe «Elimination»). Simvastatin und sein Metabolit L sind weitgehend an menschliche Plasmaproteine gebunden (95%). Deshalb ist die systemische Verfügbarkeit des Wirkstoffs niedrig. Seite 7
8 Metabolismus Simvastatin wird über CYP3A4 metabolisiert, hat aber keine inhibitorische CYP3A4-Aktivität. Deshalb ist nicht zu erwarten, dass Plasmaspiegel anderer Arzneimittel, die durch CYP3A4 metabolisiert werden, beeinflusst werden. Potente Inhibitoren von CYP3A4 können das Myopathierisiko durch Verminderung der Elimination von Simvastatin erhöhen. Simvastatin ist ein inaktives Lakton, das in vivo leicht zur entsprechenden Beta-Hydroxysäure, L , einem wirksamen Inhibitor der HMG-CoA-Reduktase, hydrolysiert wird. Die Hemmung der HMG-CoA-Reduktase ist der Ausgangspunkt für pharmakokinetische Studien der Beta-Hydroxysäure-Metaboliten (aktive Inhibitoren) und, nach erfolgter basischer Hydrolyse, der aktiven und der latenten Inhibitoren (Gesamt-Inhibitoren). Beide werden nach der Zufuhr von Simvastatin im Plasma bestimmt. Im Plasma finden sich, als hauptsächliche Metaboliten des Simvastatins, das L und vier weitere aktive Metaboliten. Elimination In einer Verteilungsstudie mit 14 C-markiertem Simvastatin wurden 100 mg (20 µci) als Kapseln verabreicht (5 20 mg) und anschliessend Blut, Urin und Faeces gesammelt. 13% der Radioaktivität fanden sich im Urin, 60% in den Faeces. Der letztere Wert entspricht sowohl dem gallengängigen Anteil der Substanz als auch dem nicht resorbierten Wirkstoff. Weniger als 0,5% der verabreichten Dosis wurden im Urin in Form der HMG-CoA-Reduktasehemmer gefunden. Im Plasma entsprachen die Inhibitoren 14% (aktive Inhibitoren), beziehungsweise 28% (Gesamt-Inhibitoren) der totalen Radioaktivität. Dies deutet darauf hin, dass die meisten vorhandenen Anteile inaktive oder schwache Inhibitoren waren. Die Halbwertszeit des Beta-Hydroxysäure-Metaboliten beträgt nach intravenöser Injektion 1,9 Stunden. Kinetik spezieller Patientengruppen Niereninsuffizienz In einer Studie bei Patienten mit schwerer Niereninsuffizienz (Kreatinin-Clearance <30 ml/min) waren die Plasmakonzentrationen der Gesamtinhibitoren nach einer Einzeldosis eines verwandten HMG-CoA-Reduktasehemmers ungefähr zweimal höher als jene bei gesunden Freiwilligen. Ältere Patienten Eine pharmakokinetische Studie ergab bei Patienten im Alter von Jahren um ca. 45% höhere mittlere Plasmawerte von Simvastatin als bei Patienten im Alter von Pädiatrie Für die Anwendung bei Kindern unter 10 Jahren gibt es keine Erfahrungen. Präklinische Daten Basierend auf konventionellen Tierstudien bezüglich Pharmakodynamik, Toxikologie bei Mehrfachdosierungen, Genotoxizität und Karzinogenität wurden für die Patienten keine weiteren Risiken beobachtet, ausser denjenigen, die aufgrund der pharmakologischen Mechanismen erwartet wurden. Bei den verträglichen Maximaldosen in Ratten und Kaninchen führte Simvastatin zu keinen fetalen Missbildungen und hatte keinen Effekt auf die Fruchtbarkeit, Fortpflanzung oder neonatale Entwicklung. Die Empfehlungen unter dem Abschnitt Schwangerschaft/Stillzeit sollten aber berücksichtigt werden. Sonstige Hinweise Haltbarkeit Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP.» bezeichneten Datum verwendet werden. Besondere Lagerungshinweise Bei Raumtemperatur (15 25 C), in der Originalverpackung vor Licht geschützt und für Kinder unerreichbar aufbewahren. Zulassungsnummer (Swissmedic). Zulassungsinhaberin Actavis Switzerland AG, 8105 Regensdorf. Stand der Information November Der Text wurde behördlich genehmigt und vom verantwortlichen Unternehmen zur Publikation durch die Documed AG freigegeben. Copyright 2011 by Documed AG, Basel. Die unberechtigte Nutzung und Weitergabe ist untersagt. [ ] Seite 8
WAS finde ich WO im Beipackzettel
 WAS finde ich WO im Beipackzettel Sie haben eine Frage zu Ihrem? Meist finden Sie die Antwort im Beipackzettel (offiziell "Gebrauchsinformation" genannt). Der Aufbau der Beipackzettel ist von den Behörden
WAS finde ich WO im Beipackzettel Sie haben eine Frage zu Ihrem? Meist finden Sie die Antwort im Beipackzettel (offiziell "Gebrauchsinformation" genannt). Der Aufbau der Beipackzettel ist von den Behörden
Patienteninformationsbroschüre Valproat
 Patienteninformationsbroschüre Valproat Informationen für Patientinnen Die Informationen in dieser Broschüre sind für Frauen bestimmt, denen Valproat verschrieben wird und die schwanger werden können (Frauen
Patienteninformationsbroschüre Valproat Informationen für Patientinnen Die Informationen in dieser Broschüre sind für Frauen bestimmt, denen Valproat verschrieben wird und die schwanger werden können (Frauen
Anhang III Änderungen an den Zusammenfassungen der Merkmale des Arzneimittels und den Packungsbeilagen
 Anhang III Änderungen an den Zusammenfassungen der Merkmale des Arzneimittels und den Packungsbeilagen Hinweis: Diese Änderungen der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
Anhang III Änderungen an den Zusammenfassungen der Merkmale des Arzneimittels und den Packungsbeilagen Hinweis: Diese Änderungen der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Legalon SIL - Trockensubstanz zur Infusionsbereitung
 PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Legalon SIL - Trockensubstanz zur Infusionsbereitung Wirkstoff: Silibinin-C-2,3-bis(hydrogensuccinat), Dinatriumsalz Lesen Sie die gesamte
PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Legalon SIL - Trockensubstanz zur Infusionsbereitung Wirkstoff: Silibinin-C-2,3-bis(hydrogensuccinat), Dinatriumsalz Lesen Sie die gesamte
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Viscosan - Augentropfen Wirkstoff: Hypromellose
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Viscosan - Augentropfen Wirkstoff: Hypromellose Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Viscosan - Augentropfen Wirkstoff: Hypromellose Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
Ausfüllanleitung. zum indikationsspezifischen Datensatz. für das strukturierte Behandlungsprogramm KHK
 Ausfüllanleitung zum indikationsspezifischen Datensatz für das strukturierte Behandlungsprogramm KHK Stand der letzten Bearbeitung: 10-11-2014 Version 4.1 Anamnese- und Befunddaten Angina pectoris Bitte
Ausfüllanleitung zum indikationsspezifischen Datensatz für das strukturierte Behandlungsprogramm KHK Stand der letzten Bearbeitung: 10-11-2014 Version 4.1 Anamnese- und Befunddaten Angina pectoris Bitte
Sandoz Pharmaceuticals AG
 Die Pille danach. Was ist eine Notfallverhütung oder die sogenannte «Pille danach»? 1 Wann wird NorLevo Uno eingenommen? 2 Bei der «Pille danach» handelt es sich um eine Notfallverhütung, die eine unerwünschte
Die Pille danach. Was ist eine Notfallverhütung oder die sogenannte «Pille danach»? 1 Wann wird NorLevo Uno eingenommen? 2 Bei der «Pille danach» handelt es sich um eine Notfallverhütung, die eine unerwünschte
Erratum Benkert, Pocket Guide, Psychopharmaka von A bis Z. 3.Aufl. ISBN (print): 978-3-642-54766-9/ DOI 10.1007/978-3-642-54767-6
 Erratum Benkert, Pocket Guide, Psychopharmaka von A bis Z. 3.Aufl. ISBN (print): 978-3-642-54766-9/ DOI 10.1007/978-3-642-54767-6 Trotz sorgfältiger Erstellung des Buchs Benkert, Pocket Guide, Psychopharmaka
Erratum Benkert, Pocket Guide, Psychopharmaka von A bis Z. 3.Aufl. ISBN (print): 978-3-642-54766-9/ DOI 10.1007/978-3-642-54767-6 Trotz sorgfältiger Erstellung des Buchs Benkert, Pocket Guide, Psychopharmaka
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Heumann s Blasen- und Nierentee Solubitrat Wirkstoffe: Dickextrakt aus Birkenblättern, Dickextrakt aus Riesengoldrutenkraut Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Heumann s Blasen- und Nierentee Solubitrat Wirkstoffe: Dickextrakt aus Birkenblättern, Dickextrakt aus Riesengoldrutenkraut Lesen Sie die gesamte Packungsbeilage
Simvastatin Teva 5 mg-filmtabletten 2. Qualitative und quantitative Zusammensetzung 1 Filmtablette enthält 5 mg Simvastatin. Sonstiger Bestandteil: 1
 Simvastatin Teva 5 mg-filmtabletten 2. Qualitative und quantitative Zusammensetzung 1 Filmtablette enthält 5 mg Simvastatin. Sonstiger Bestandteil: 1 Filmtablette enthält 76,63 mg Lactose-Monohydrat. Die
Simvastatin Teva 5 mg-filmtabletten 2. Qualitative und quantitative Zusammensetzung 1 Filmtablette enthält 5 mg Simvastatin. Sonstiger Bestandteil: 1 Filmtablette enthält 76,63 mg Lactose-Monohydrat. Die
Vom 19. Februar 2009. I. Die Anlage 4 wird um den folgenden Therapiehinweis ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über die Einleitung eines Stellungnahmeverfahrens zur Änderung der Arzneimittel-Richtlinie in Anlage 4: Therapiehinweis zu Ezetimib Vom 19. Februar 2009 Der
Beschluss des Gemeinsamen Bundesausschusses über die Einleitung eines Stellungnahmeverfahrens zur Änderung der Arzneimittel-Richtlinie in Anlage 4: Therapiehinweis zu Ezetimib Vom 19. Februar 2009 Der
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. PROGESTOGEL 1 % Gel. Progesteron
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER PROGESTOGEL 1 % Gel Progesteron Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. Heben
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER PROGESTOGEL 1 % Gel Progesteron Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. Heben
Sumatriptan Antrag auf Freistellung von der Verschreibungspflicht mit Beschränkungen
 Sumatriptan Antrag auf Freistellung von der Verschreibungspflicht mit Beschränkungen Sachverständigen-Ausschuss für Verschreibungspflicht 62. Sitzung am 13.01.2009 im Bundesinstitut für Arzneimittel- und
Sumatriptan Antrag auf Freistellung von der Verschreibungspflicht mit Beschränkungen Sachverständigen-Ausschuss für Verschreibungspflicht 62. Sitzung am 13.01.2009 im Bundesinstitut für Arzneimittel- und
Orale Antikoagulation
 A. Plehn? Orale Antikoagulation NOAC Rivaroxaban (Xarelto) // Faktor-Xa-Hemmung Dabigatran (Pradaxa) // Faktor-IIa-Hemmung (Thrombin) Apixaban (Eliquis) // Faktor-Xa-Hemmung (Edoxaban // Faktor-Xa-Hemmung)
A. Plehn? Orale Antikoagulation NOAC Rivaroxaban (Xarelto) // Faktor-Xa-Hemmung Dabigatran (Pradaxa) // Faktor-IIa-Hemmung (Thrombin) Apixaban (Eliquis) // Faktor-Xa-Hemmung (Edoxaban // Faktor-Xa-Hemmung)
Gebrauchsinformation: Information für Patienten. Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench)
 Gebrauchsinformation: Information für Patienten Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench) Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Gebrauchsinformation: Information für Patienten Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench) Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Sidroga Blasentee akut Wirkstoffe: Bärentraubenblätter, Birkenblätter, Goldrutenkraut, Orthosiphonblätter
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Sidroga Blasentee akut Wirkstoffe: Bärentraubenblätter, Birkenblätter, Goldrutenkraut, Orthosiphonblätter Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Sidroga Blasentee akut Wirkstoffe: Bärentraubenblätter, Birkenblätter, Goldrutenkraut, Orthosiphonblätter Lesen Sie die gesamte Packungsbeilage sorgfältig
Wie unsere Augen Erfahren Sie, wie wir sehen, und wie Sie Ihre Vision zu schützen.
 Wie unsere Augen Erfahren Sie, wie wir sehen, und wie Sie Ihre Vision zu schützen. Levobunolol ist ein Beta-Blocker, der den Druck im Inneren des Auges reduziert. Levobunolol Augen (Auge) ist für die Behandlung
Wie unsere Augen Erfahren Sie, wie wir sehen, und wie Sie Ihre Vision zu schützen. Levobunolol ist ein Beta-Blocker, der den Druck im Inneren des Auges reduziert. Levobunolol Augen (Auge) ist für die Behandlung
Simvastatin Sandoz 40 mg Filmtabletten mit Bruchrille
 GID Seite 1 von 8 Für verschreibungspflichtige Arzneimittel. Gebrauchsinformation Lesen Sie die gesamte Gebrauchsinformation sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen.
GID Seite 1 von 8 Für verschreibungspflichtige Arzneimittel. Gebrauchsinformation Lesen Sie die gesamte Gebrauchsinformation sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen.
INFORMATIONEN FÜR TYP-2-DIABETIKER. Warum der HbA 1c -Wert für Sie als Typ-2-Diabetiker so wichtig ist!
 INFORMATIONEN FÜR TYP-2-DIABETIKER Warum der HbA 1c -Wert für Sie als Typ-2-Diabetiker so wichtig ist! Liebe Leserin, lieber Leser, Wer kennt das nicht: Kurz vor dem nächsten Arztbesuch hält man sich besonders
INFORMATIONEN FÜR TYP-2-DIABETIKER Warum der HbA 1c -Wert für Sie als Typ-2-Diabetiker so wichtig ist! Liebe Leserin, lieber Leser, Wer kennt das nicht: Kurz vor dem nächsten Arztbesuch hält man sich besonders
Gefährlich hohe Blutzuckerwerte
 Gefährlich hohe Blutzuckerwerte In besonderen Situationen kann der Blutzuckerspiegel gefährlich ansteigen Wenn in Ausnahmefällen der Blutzuckerspiegel sehr hoch ansteigt, dann kann das für Sie gefährlich
Gefährlich hohe Blutzuckerwerte In besonderen Situationen kann der Blutzuckerspiegel gefährlich ansteigen Wenn in Ausnahmefällen der Blutzuckerspiegel sehr hoch ansteigt, dann kann das für Sie gefährlich
Indikationserweiterungen für JANUVIA (Sitagliptin, MSD) in der EU - Kombination mit Sulfonylharnstoff n
 Indikationserweiterungen für JANUVIA (Sitagliptin, MSD) in der EU Kombination mit Sulfonylharnstoff nun ebenfalls zugelassen Haar (März 2008) - Die europäische Arzneimittelbehörde EMEA hat JANUVIA für
Indikationserweiterungen für JANUVIA (Sitagliptin, MSD) in der EU Kombination mit Sulfonylharnstoff nun ebenfalls zugelassen Haar (März 2008) - Die europäische Arzneimittelbehörde EMEA hat JANUVIA für
Gebrauchsinformation: Information für Anwender. LOMUSOL Augentropfen. Wirkstoff: Dinatriumcromoglicat
 Gebrauchsinformation: Information für Anwender LOMUSOL Augentropfen Wirkstoff: Dinatriumcromoglicat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für Anwender LOMUSOL Augentropfen Wirkstoff: Dinatriumcromoglicat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen:
 BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 06.11.2014 Veronika Iro REGA +43 (0) 505 55 36247 pv-implementation@ages.at
BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 06.11.2014 Veronika Iro REGA +43 (0) 505 55 36247 pv-implementation@ages.at
Simvastatin AL 5 mg/- 10 mg/- 20 mg/- 40 mg Filmtabletten
 1. Bezeichnung des Arzneimittels Simvastatin AL 5 mg Simvastatin AL 10 mg Simvastatin AL 20 mg Simvastatin AL 40 mg 2. Qualitative und quantitative Zusammensetzung Simvastatin AL 5 mg 1 Filmtablette enthält
1. Bezeichnung des Arzneimittels Simvastatin AL 5 mg Simvastatin AL 10 mg Simvastatin AL 20 mg Simvastatin AL 40 mg 2. Qualitative und quantitative Zusammensetzung Simvastatin AL 5 mg 1 Filmtablette enthält
Labortests für Ihre Gesundheit. Therapie nach Maß 26
 Labortests für Ihre Gesundheit Therapie nach Maß 26 01IPF Labortests für Ihre Gesundheit Therapie nach Maß Die individuelle Dosis finden Jeder Mensch ist einzigartig. Keiner gleicht dem anderen nicht nur
Labortests für Ihre Gesundheit Therapie nach Maß 26 01IPF Labortests für Ihre Gesundheit Therapie nach Maß Die individuelle Dosis finden Jeder Mensch ist einzigartig. Keiner gleicht dem anderen nicht nur
? Kann ich mit Karotten zu viel Vitamin A
 Schwangere aus sozial schwachen Schichten Schwangere, die alkohol-, drogen- oder nikotinabhängig sind Schwangere, die aufgrund einer chronischen Erkrankung Medikamente einnehmen müssen, welche die Nährstoffverwertung
Schwangere aus sozial schwachen Schichten Schwangere, die alkohol-, drogen- oder nikotinabhängig sind Schwangere, die aufgrund einer chronischen Erkrankung Medikamente einnehmen müssen, welche die Nährstoffverwertung
Nasa Rhinathiol 0,1 %ige Nasenspray, Lösung Xylometazolinhydrochlorid
 Seite 1/5 Packungsbeilage Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mir der Anwendung dieses Arzneimittels beginnen. Sie enthält wichtige Informationen für Ihre Behandlung. Wenn
Seite 1/5 Packungsbeilage Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mir der Anwendung dieses Arzneimittels beginnen. Sie enthält wichtige Informationen für Ihre Behandlung. Wenn
Wirkstoffe: Trockenextrakt aus Birkenblättern, Trockenextrakt aus Goldrutenkraut
 Gebrauchsinformation: Information für Anwender HEUMANN Blasen- und Nierentee SOLUBITRAT uro Teeaufgusspulver Wirkstoffe: Trockenextrakt aus Birkenblättern, Trockenextrakt aus Goldrutenkraut Lesen Sie die
Gebrauchsinformation: Information für Anwender HEUMANN Blasen- und Nierentee SOLUBITRAT uro Teeaufgusspulver Wirkstoffe: Trockenextrakt aus Birkenblättern, Trockenextrakt aus Goldrutenkraut Lesen Sie die
!!! Folgeerkrankungen
 Ein zu hoher Blutzuckerspiegel kann Folgen auf Ihr Herzkreislaufsystem haben und zu Erkrankungen wie der Schaufensterkrankheit, einer Angina pectoris, einem Herzinfarkt oder einem Schlaganfall führen.
Ein zu hoher Blutzuckerspiegel kann Folgen auf Ihr Herzkreislaufsystem haben und zu Erkrankungen wie der Schaufensterkrankheit, einer Angina pectoris, einem Herzinfarkt oder einem Schlaganfall führen.
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Vitagutt Vitamin E 670 mg, Weichkapsel Zur Anwendung bei Erwachsenen Wirkstoff: 1000 mg all-rac-alpha-tocopherolacetat (entsprechend 670 mg RRR-alpha- Tocopherol-Äquivalente).
Gebrauchsinformation: Information für Anwender Vitagutt Vitamin E 670 mg, Weichkapsel Zur Anwendung bei Erwachsenen Wirkstoff: 1000 mg all-rac-alpha-tocopherolacetat (entsprechend 670 mg RRR-alpha- Tocopherol-Äquivalente).
Anleitung zum Computercheck Windows Firewall aktivieren oder eine kostenlose Firewall installieren
 Anleitung zum Computercheck Windows Firewall aktivieren oder eine kostenlose Firewall installieren Ziel der Anleitung Sie möchten ein modernes Firewallprogramm für Ihren Computer installieren, um gegen
Anleitung zum Computercheck Windows Firewall aktivieren oder eine kostenlose Firewall installieren Ziel der Anleitung Sie möchten ein modernes Firewallprogramm für Ihren Computer installieren, um gegen
Diabetes mellitus : Folgeschäden
 Diabetes mellitus : Folgeschäden Warum ist der Diabetes mellitus eine wichtige Erkrankung? a. Akute Probleme: Hypoglykämie Hyperglykämie Ketoazidose b. Chronische Probleme: Folgeschäden: Typische Schäden:
Diabetes mellitus : Folgeschäden Warum ist der Diabetes mellitus eine wichtige Erkrankung? a. Akute Probleme: Hypoglykämie Hyperglykämie Ketoazidose b. Chronische Probleme: Folgeschäden: Typische Schäden:
Patienteninformation Ich bin schwanger. Warum wird allen schwangeren Frauen ein Test auf
 Patienteninformation Ich bin schwanger. Warum wird allen schwangeren Frauen ein Test auf Schwangerschaftsdiabetes angeboten? Liebe Leserin, dieses Merkblatt erläutert, warum allen Schwangeren ein Test
Patienteninformation Ich bin schwanger. Warum wird allen schwangeren Frauen ein Test auf Schwangerschaftsdiabetes angeboten? Liebe Leserin, dieses Merkblatt erläutert, warum allen Schwangeren ein Test
Die HIT ist keine Allergie! Da die von ihr ausgelösten. Krankheitsbild. Was ist eine Histamin- Intoleranz?
 Was ist eine Histamin- Intoleranz? Die Histamin-Intoleranz ist eine Pseudoallergie. Die HIT ist keine Allergie! Da die von ihr ausgelösten Gesundheitsstörungen jedoch von allergiebedingten Beschwerden
Was ist eine Histamin- Intoleranz? Die Histamin-Intoleranz ist eine Pseudoallergie. Die HIT ist keine Allergie! Da die von ihr ausgelösten Gesundheitsstörungen jedoch von allergiebedingten Beschwerden
Dieser Ablauf soll eine Hilfe für die tägliche Arbeit mit der SMS Bestätigung im Millennium darstellen.
 Millennium SMS Service Schnellübersicht Seite 1 von 6 1. Tägliche Arbeiten mit der SMS Bestätigung Dieser Ablauf soll eine Hilfe für die tägliche Arbeit mit der SMS Bestätigung im Millennium darstellen.
Millennium SMS Service Schnellübersicht Seite 1 von 6 1. Tägliche Arbeiten mit der SMS Bestätigung Dieser Ablauf soll eine Hilfe für die tägliche Arbeit mit der SMS Bestätigung im Millennium darstellen.
Anleitung zum DKM-Computercheck Windows Defender aktivieren
 Anleitung zum DKM-Computercheck Windows Defender aktivieren Ziel der Anleitung Sie möchten das Antivirenprogramm Windows Defender auf Ihrem Computer aktivieren, um gegen zukünftige Angriffe besser gewappnet
Anleitung zum DKM-Computercheck Windows Defender aktivieren Ziel der Anleitung Sie möchten das Antivirenprogramm Windows Defender auf Ihrem Computer aktivieren, um gegen zukünftige Angriffe besser gewappnet
Bijsluiter DE versie Imaverol 100 mg (glas) B. PACKUNGSBEILAGE 1
 B. PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION Imaverol 100 mg, Konzentrat zur örtlichen Anwendung 1.NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE
B. PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION Imaverol 100 mg, Konzentrat zur örtlichen Anwendung 1.NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE
Bericht über die Untersuchung zur Erblichkeit von Herzerkrankungen beim PON
 1 Bericht über die Untersuchung zur Erblichkeit von Herzerkrankungen beim PON Einleitung Bei der Rasse PON wurden im APH in der letzten Zeit auffällig viele Herzkrankheiten und Herzveränderungen unterschiedlicher
1 Bericht über die Untersuchung zur Erblichkeit von Herzerkrankungen beim PON Einleitung Bei der Rasse PON wurden im APH in der letzten Zeit auffällig viele Herzkrankheiten und Herzveränderungen unterschiedlicher
BLUTHOCHDRUCK UND NIERE
 BLUTHOCHDRUCK UND NIERE Hilfreiche Informationen zu Ihrer Nierengesundheit Bluthochdruck und Niere Die Nieren sind die Organe unseres Körpers, die den Blutdruck regeln. Der Blutdruck ist der Druck, der
BLUTHOCHDRUCK UND NIERE Hilfreiche Informationen zu Ihrer Nierengesundheit Bluthochdruck und Niere Die Nieren sind die Organe unseres Körpers, die den Blutdruck regeln. Der Blutdruck ist der Druck, der
Knochendichtemessung
 Knochendichtemessung im Krankenhaus Meran Dienst für Radiologie Primar Dr. Anton Wieser Tel. 0473 26 3070, E-Mail: rx-me@asbmeran-o.it Knochendichtemessung DEXA: Ab 21. Oktober 2013 auch in Meran durchführbar
Knochendichtemessung im Krankenhaus Meran Dienst für Radiologie Primar Dr. Anton Wieser Tel. 0473 26 3070, E-Mail: rx-me@asbmeran-o.it Knochendichtemessung DEXA: Ab 21. Oktober 2013 auch in Meran durchführbar
FETTSTOFFWECHSEL - STÖRUNGEN
 Patientenratgeber FETTSTOFFWECHSEL - STÖRUNGEN Information Kompakt Was ist eine Fettstoffwechselstörung? Welches sind die gesundheitlichen Risiken? Warum ist der Einsatz von Medikamenten wichtig? Liebe
Patientenratgeber FETTSTOFFWECHSEL - STÖRUNGEN Information Kompakt Was ist eine Fettstoffwechselstörung? Welches sind die gesundheitlichen Risiken? Warum ist der Einsatz von Medikamenten wichtig? Liebe
Anhang III. Ergänzungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Ergänzungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage 20 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS [Der unten genannte Wortlaut
Anhang III Ergänzungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage 20 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS [Der unten genannte Wortlaut
Patientenleitfaden für das Gespräch mit dem Arzt. Liebe Patientin, lieber Patient!
 Patientenleitfaden für das Gespräch mit dem Arzt Liebe Patientin, lieber Patient! Je besser Sie sich auf das Gespräch mit Ihrem Arzt vorbereiten, desto leichter wird es für sie/ihn sein, eine Diagnose
Patientenleitfaden für das Gespräch mit dem Arzt Liebe Patientin, lieber Patient! Je besser Sie sich auf das Gespräch mit Ihrem Arzt vorbereiten, desto leichter wird es für sie/ihn sein, eine Diagnose
Labortests für Ihre Gesundheit. Blutzucker- und Cholesterintests 11
 Labortests für Ihre Gesundheit Blutzucker- und Cholesterintests 11 01IPF Labortests für Ihre Gesundheit Blutzucker- und Cholesterintests Fragen und Antworten Diabetes nimmt explosionsartig zu. Die Weltgesundheitsorganisation
Labortests für Ihre Gesundheit Blutzucker- und Cholesterintests 11 01IPF Labortests für Ihre Gesundheit Blutzucker- und Cholesterintests Fragen und Antworten Diabetes nimmt explosionsartig zu. Die Weltgesundheitsorganisation
INFORMATIONEN ZUR NACHSORGE VON ZAHNIMPLANTATEN
 INFORMATIONEN ZUR NACHSORGE VON ZAHNIMPLANTATEN WORIN BESTEHT DIE NACHSORGE? Straumann-Implantate sind eine moderne Möglichkeit für Zahnersatz, wenn ein oder mehrere Zähne fehlen. Diese bekannte und hochwertige
INFORMATIONEN ZUR NACHSORGE VON ZAHNIMPLANTATEN WORIN BESTEHT DIE NACHSORGE? Straumann-Implantate sind eine moderne Möglichkeit für Zahnersatz, wenn ein oder mehrere Zähne fehlen. Diese bekannte und hochwertige
Vorsorgestiftung für Gesundheit und Soziales. Reglement über die Bildung und Auflösung von technischen Rückstellungen
 Vorsorgestiftung für Gesundheit und Soziales Reglement über die Bildung und Auflösung von technischen Rückstellungen Sarnen, 1. Januar 2006 Inhaltsverzeichnis 1. Grundsätze und Ziele 1 1.1 Einleitung 1
Vorsorgestiftung für Gesundheit und Soziales Reglement über die Bildung und Auflösung von technischen Rückstellungen Sarnen, 1. Januar 2006 Inhaltsverzeichnis 1. Grundsätze und Ziele 1 1.1 Einleitung 1
Cytomegalie & Co. Häufige Virusinfektionen in der Schwangerschaft. Deutsches Grünes Kreuz e.v.
 Cytomegalie & Co Häufige Virusinfektionen in der Schwangerschaft Schwangerschaft Eine ganz besondere Zeit der Vorfreude Verantwortung Sorge Die werdenden Eltern möchten alles richtig machen für das Wohl
Cytomegalie & Co Häufige Virusinfektionen in der Schwangerschaft Schwangerschaft Eine ganz besondere Zeit der Vorfreude Verantwortung Sorge Die werdenden Eltern möchten alles richtig machen für das Wohl
Medizinische Klinik D Allg. Innere sowie Nieren- und Hochdruckkrankheiten und Rheumatologie
 Medizinische Klinik D Allg. Innere sowie Nieren- und Hochdruckkrankheiten und Rheumatologie Fettstoffwechselstörungen Eine Information für Patienten Direktor: Univ.-Prof. Dr. H. Pavenstädt, Oberärztin
Medizinische Klinik D Allg. Innere sowie Nieren- und Hochdruckkrankheiten und Rheumatologie Fettstoffwechselstörungen Eine Information für Patienten Direktor: Univ.-Prof. Dr. H. Pavenstädt, Oberärztin
Informationen zum Thema Arzneimitteldokumentation und Arzneimitteltherapiesicherheit
 Gesundheitskarte AKTUELL Informationen zum Thema Arzneimitteldokumentation und Arzneimitteltherapiesicherheit Arzneimittel sind ein elementarer Bestandteil in der modernen medizinischen Behandlung. Bei
Gesundheitskarte AKTUELL Informationen zum Thema Arzneimitteldokumentation und Arzneimitteltherapiesicherheit Arzneimittel sind ein elementarer Bestandteil in der modernen medizinischen Behandlung. Bei
Moderne Behandlung des Grauen Stars
 Katarakt Moderne Behandlung des Grauen Stars Sehr geehrte Patientin, sehr geehrter Patient, Bei Ihnen wurde eine Trübung der Augenlinse festgestellt, die umgangssprachlich auch Grauer Star genannt wird.
Katarakt Moderne Behandlung des Grauen Stars Sehr geehrte Patientin, sehr geehrter Patient, Bei Ihnen wurde eine Trübung der Augenlinse festgestellt, die umgangssprachlich auch Grauer Star genannt wird.
PKV-Info. Lohnt der Wechsel innerhalb der PKV?
 PKV-Info Lohnt der Wechsel innerhalb der PKV? 2 Die Unternehmen der privaten Krankenversicherung (PKV) stehen miteinander im Wettbewerb. Das ist so gewollt, zum Nutzen der Versicherten. Denn jeder Wettbewerb
PKV-Info Lohnt der Wechsel innerhalb der PKV? 2 Die Unternehmen der privaten Krankenversicherung (PKV) stehen miteinander im Wettbewerb. Das ist so gewollt, zum Nutzen der Versicherten. Denn jeder Wettbewerb
Diese Broschüre fasst die wichtigsten Informationen zusammen, damit Sie einen Entscheid treffen können.
 Aufklärung über die Weiterverwendung/Nutzung von biologischem Material und/oder gesundheitsbezogen Daten für die biomedizinische Forschung. (Version V-2.0 vom 16.07.2014, Biobanken) Sehr geehrte Patientin,
Aufklärung über die Weiterverwendung/Nutzung von biologischem Material und/oder gesundheitsbezogen Daten für die biomedizinische Forschung. (Version V-2.0 vom 16.07.2014, Biobanken) Sehr geehrte Patientin,
Ausfüllanleitung. zum indikationsspezifischen Datensatz. für das strukturierte Behandlungsprogramm. Asthma bronchiale
 Ausfüllanleitung zum indikationsspezifischen Datensatz für das strukturierte Behandlungsprogramm Asthma bronchiale Stand der letzten Bearbeitung: 20.11.2012 Version 4.2 Anamnese- und Befunddaten Häufigkeit
Ausfüllanleitung zum indikationsspezifischen Datensatz für das strukturierte Behandlungsprogramm Asthma bronchiale Stand der letzten Bearbeitung: 20.11.2012 Version 4.2 Anamnese- und Befunddaten Häufigkeit
Diabetische Retinopathie
 Netzhautkomplikationen Diabetische Netzhautkomplikationen sind krankhafte Veränderungen in den Augen, die durch einen Diabetes mellitus verursacht werden können. Es handelt sich um die diabetische Retinopathie
Netzhautkomplikationen Diabetische Netzhautkomplikationen sind krankhafte Veränderungen in den Augen, die durch einen Diabetes mellitus verursacht werden können. Es handelt sich um die diabetische Retinopathie
DAS GRÜNE REZEPT. Für eine sichere Medikation mit rezeptfreien Arzneimitteln
 DAS GRÜNE REZEPT Für eine sichere Medikation mit rezeptfreien Arzneimitteln Was ist das Grüne Rezept? Obwohl das Grüne Rezept schon seit Jahren in Arztpraxen verwendet wird, ist es vielen Patienten und
DAS GRÜNE REZEPT Für eine sichere Medikation mit rezeptfreien Arzneimitteln Was ist das Grüne Rezept? Obwohl das Grüne Rezept schon seit Jahren in Arztpraxen verwendet wird, ist es vielen Patienten und
IhreInsulinfunktionen
 Insulinfunktionen: Insulinfunktionen: Wichtige Wichtige Informationen BlutzuckerBlutzucker-und undketon-messsystem Keton-Messsystem Ihre IhreInsulinfunktionen Insulinfunktionen Die DieInsulineinstellungen
Insulinfunktionen: Insulinfunktionen: Wichtige Wichtige Informationen BlutzuckerBlutzucker-und undketon-messsystem Keton-Messsystem Ihre IhreInsulinfunktionen Insulinfunktionen Die DieInsulineinstellungen
Wie oft soll ich essen?
 Wie oft soll ich essen? Wie sollen Sie sich als Diabetiker am besten ernähren? Gesunde Ernährung für Menschen mit Diabetes unterscheidet sich nicht von gesunder Ernährung für andere Menschen. Es gibt nichts,
Wie oft soll ich essen? Wie sollen Sie sich als Diabetiker am besten ernähren? Gesunde Ernährung für Menschen mit Diabetes unterscheidet sich nicht von gesunder Ernährung für andere Menschen. Es gibt nichts,
Diabetische Netzhauterkrankung
 Diabetes und Auge Diabetische Netzhauterkrankung Die diabetische Retinopathie ist die häufigste Erblindungsursache in der Bevölkerung zwischen dem 30. und 65. Lebensjahren in der westlichen Welt. Das Auftreten
Diabetes und Auge Diabetische Netzhauterkrankung Die diabetische Retinopathie ist die häufigste Erblindungsursache in der Bevölkerung zwischen dem 30. und 65. Lebensjahren in der westlichen Welt. Das Auftreten
LÄNGER LEBEN BEI GUTER GESUNDHEIT
 LÄNGER LEBEN BEI GUTER GESUNDHEIT Ein Informationsblatt für alle, die über das Angebot einer Vorsorgeuntersuchung nachdenken. Seit 2005 wird in Österreich die neue Vorsorgeuntersuchung angeboten. Bewährtes
LÄNGER LEBEN BEI GUTER GESUNDHEIT Ein Informationsblatt für alle, die über das Angebot einer Vorsorgeuntersuchung nachdenken. Seit 2005 wird in Österreich die neue Vorsorgeuntersuchung angeboten. Bewährtes
LEGIONELLEN in Trinkwasser-Installationen
 Wärmetechnik... weil Energie wertvoll ist! LEGIONELLEN in Trinkwasser-Installationen Verbraucherinformation Was sind Legionellen? Legionellen sind eine Gattung stäbchenförmiger Bakterien aus der Familie
Wärmetechnik... weil Energie wertvoll ist! LEGIONELLEN in Trinkwasser-Installationen Verbraucherinformation Was sind Legionellen? Legionellen sind eine Gattung stäbchenförmiger Bakterien aus der Familie
Screening Das Programm. zur Früherkennung von Brustkrebs
 Mammographie Screening Das Programm zur Früherkennung von Brustkrebs das Mammographie Screening Programm Wenn Sie zwischen 50 und 69 Jahre alt sind, haben Sie alle zwei Jahre Anspruch auf eine Mammographie-Untersuchung
Mammographie Screening Das Programm zur Früherkennung von Brustkrebs das Mammographie Screening Programm Wenn Sie zwischen 50 und 69 Jahre alt sind, haben Sie alle zwei Jahre Anspruch auf eine Mammographie-Untersuchung
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Tantum Verde 3 mg Pastillen mit Minzgeschmack Wirkstoff: Benzydaminhydrochlorid
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tantum Verde 3 mg Pastillen mit Minzgeschmack Wirkstoff: Benzydaminhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tantum Verde 3 mg Pastillen mit Minzgeschmack Wirkstoff: Benzydaminhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Diabetes. Zulassungserweiterung: Levemir (Insulin detemir) als Add-on Therapie zu Victoza (Liraglutid) bei Mens
 Zulassungserweiterung Levemir (Insulin detemir) als Add-on Therapie zu Victoza (Liraglutid) bei Menschen mit Typ 2 Diabetes Mainz (16. November 2011) Die Europäische Kommission hat die Zulassung des modernen
Zulassungserweiterung Levemir (Insulin detemir) als Add-on Therapie zu Victoza (Liraglutid) bei Menschen mit Typ 2 Diabetes Mainz (16. November 2011) Die Europäische Kommission hat die Zulassung des modernen
Antikoagulation 2012: alles anders?
 Antikoagulation 2012: alles anders? Ärztekongress Arosa 24. März 2012 (Etzel Gysling) Neue Antikoagulantien Wo und wofür sind sie aktuell zugelassen? Seit 2011 sind neue Studienresultate und eine neue
Antikoagulation 2012: alles anders? Ärztekongress Arosa 24. März 2012 (Etzel Gysling) Neue Antikoagulantien Wo und wofür sind sie aktuell zugelassen? Seit 2011 sind neue Studienresultate und eine neue
3.9 Brustdrüse der Frau
 ICD-10 C50 Ergebnisse zur 77 3.9 Brustdrüse der Frau Kernaussagen Inzidenz und Mortalität: Die altersstandardisierte Inzidenz von Krebserkrankungen der weiblichen Brustdrüse (Mammakarzinom) ist seit den
ICD-10 C50 Ergebnisse zur 77 3.9 Brustdrüse der Frau Kernaussagen Inzidenz und Mortalität: Die altersstandardisierte Inzidenz von Krebserkrankungen der weiblichen Brustdrüse (Mammakarzinom) ist seit den
Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva
 Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva Darmstadt (19. Februar 2009) Die Merck KGaA hat heute bekannt gegeben, dass die europäische Arzneimittelbehörde EMEA
Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva Darmstadt (19. Februar 2009) Die Merck KGaA hat heute bekannt gegeben, dass die europäische Arzneimittelbehörde EMEA
Wenn Ihnen etwas auf den Magen schlägt, dann schlagen Sie zurück! Aber fragen Sie vorher besser Ihren Apotheker!
 Wenn Ihnen etwas auf den Magen schlägt, dann schlagen Sie zurück! Aber fragen Sie vorher besser Ihren Apotheker! Selbstmedikation Selbstmedikation ist ein weltweiter Trend Selbstmedikation ist praktisch
Wenn Ihnen etwas auf den Magen schlägt, dann schlagen Sie zurück! Aber fragen Sie vorher besser Ihren Apotheker! Selbstmedikation Selbstmedikation ist ein weltweiter Trend Selbstmedikation ist praktisch
Künstlicher Hüftgelenksersatz
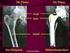 Künstlicher Hüftgelenksersatz Künstlicher Hüftgelenksersatz Was ist eine Hüftgelenk-Arthrose? Das Hüftgelenk ist eine bewegliche Verbindung zwischen dem Becken- und dem Oberschenkelknochen. Die am Gelenk
Künstlicher Hüftgelenksersatz Künstlicher Hüftgelenksersatz Was ist eine Hüftgelenk-Arthrose? Das Hüftgelenk ist eine bewegliche Verbindung zwischen dem Becken- und dem Oberschenkelknochen. Die am Gelenk
Medikament zur Behandlung der Muskeldystrophie Duchenne jetzt in Deutschland VERFÜGBAR:
 München, den 08.01.2015 Medikament zur Behandlung der Muskeldystrophie Duchenne jetzt in Deutschland VERFÜGBAR: TRANSLARNA TM mit dem Wirkstoff Ataluren Liebe Patienten, liebe Eltern, In einem Schreiben
München, den 08.01.2015 Medikament zur Behandlung der Muskeldystrophie Duchenne jetzt in Deutschland VERFÜGBAR: TRANSLARNA TM mit dem Wirkstoff Ataluren Liebe Patienten, liebe Eltern, In einem Schreiben
Das Persönliche Budget in verständlicher Sprache
 Das Persönliche Budget in verständlicher Sprache Das Persönliche Budget mehr Selbstbestimmung, mehr Selbstständigkeit, mehr Selbstbewusstsein! Dieser Text soll den behinderten Menschen in Westfalen-Lippe,
Das Persönliche Budget in verständlicher Sprache Das Persönliche Budget mehr Selbstbestimmung, mehr Selbstständigkeit, mehr Selbstbewusstsein! Dieser Text soll den behinderten Menschen in Westfalen-Lippe,
Video Unlimited -Nutzungsbeschränkungen
 Video Unlimited -Nutzungsbeschränkungen In diesem Dokument werden Beschränkungen erklärt, die für die Verwendung von Videos gelten, die Sie über Video Unlimited -Dienste gekauft oder ausgeliehen haben
Video Unlimited -Nutzungsbeschränkungen In diesem Dokument werden Beschränkungen erklärt, die für die Verwendung von Videos gelten, die Sie über Video Unlimited -Dienste gekauft oder ausgeliehen haben
Anleitung zum BW-Bank Computer-Check Windows-Firewall aktivieren
 Anleitung zum BW-Bank Computer-Check Windows-Firewall aktivieren Ziel der Anleitung Sie möchten die Windows-Firewall auf Ihrem Computer aktivieren, um gegen zukünftige Angriffe besser gewappnet zu sein.
Anleitung zum BW-Bank Computer-Check Windows-Firewall aktivieren Ziel der Anleitung Sie möchten die Windows-Firewall auf Ihrem Computer aktivieren, um gegen zukünftige Angriffe besser gewappnet zu sein.
Die östrogenfreie Pille
 Alle wichtigen Infos über Sexualität und Verhütung unter: www.frau-und-pille.de Mit bester Empfehlung Die östrogenfreie Pille Verhütung für Frauen mit besonderem Anspruch. Einscannen und mehr erfahren...
Alle wichtigen Infos über Sexualität und Verhütung unter: www.frau-und-pille.de Mit bester Empfehlung Die östrogenfreie Pille Verhütung für Frauen mit besonderem Anspruch. Einscannen und mehr erfahren...
Gebrauchsinformation: Information für den Anwender
 Wortlaut der für die Gebrauchsinformation vorgesehenen Angaben Stand: Mai 2008 1 Gebrauchsinformation: Information für den Anwender Harntee-Steiner, Teeaufgusspulver Zur Anwendung bei Heranwachsenden ab
Wortlaut der für die Gebrauchsinformation vorgesehenen Angaben Stand: Mai 2008 1 Gebrauchsinformation: Information für den Anwender Harntee-Steiner, Teeaufgusspulver Zur Anwendung bei Heranwachsenden ab
Atronase 0,3 mg/ml Nasenspray, Lösung (Ipratropiumbromid)
 GEBRAUCHSINFORMATION ATRONASE 0,3 MG/ML NASENSPRAY, LÖSUNG Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses Arzneimittel ist auch ohne Verschreibung
GEBRAUCHSINFORMATION ATRONASE 0,3 MG/ML NASENSPRAY, LÖSUNG Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses Arzneimittel ist auch ohne Verschreibung
Der Medizinkamm fürs Haar Ein Ratgeber bei Haarausfall für Sie und Ihn
 Der Medizinkamm fürs Haar Ein Ratgeber bei Haarausfall für Sie und Ihn Ein Wort zuvor: Etwas Haarverlust ist ganz natürlich Das große Problem: Erblich bedingter Haarausfall as Leben eines Haares dauert
Der Medizinkamm fürs Haar Ein Ratgeber bei Haarausfall für Sie und Ihn Ein Wort zuvor: Etwas Haarverlust ist ganz natürlich Das große Problem: Erblich bedingter Haarausfall as Leben eines Haares dauert
mehrmals mehrmals mehrmals alle seltener nie mindestens **) in der im Monat im Jahr 1 bis 2 alle 1 bis 2 Woche Jahre Jahre % % % % % % %
 Nicht überraschend, aber auch nicht gravierend, sind die altersspezifischen Unterschiede hinsichtlich der Häufigkeit des Apothekenbesuchs: 24 Prozent suchen mindestens mehrmals im Monat eine Apotheke auf,
Nicht überraschend, aber auch nicht gravierend, sind die altersspezifischen Unterschiede hinsichtlich der Häufigkeit des Apothekenbesuchs: 24 Prozent suchen mindestens mehrmals im Monat eine Apotheke auf,
Hirnödeme bei HAE was Patienten wissen sollten
 Hirnödeme bei HAE was Patienten wissen sollten Dieser immer stärker werdende Druck... Starke Kopfschmerzen? Bei HAE kann auch ein Hirnödem die Ursache sein. 2 Ein kaum beachteter Zusammenhang Verspannungen,
Hirnödeme bei HAE was Patienten wissen sollten Dieser immer stärker werdende Druck... Starke Kopfschmerzen? Bei HAE kann auch ein Hirnödem die Ursache sein. 2 Ein kaum beachteter Zusammenhang Verspannungen,
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Magnevist 2 mmol/l Injektionslösung. Gadopentetsäure, Dimeglumin
 1 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Magnevist 2 mmol/l Injektionslösung Gadopentetsäure, Dimeglumin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor dieses Arzneimittel bei
1 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Magnevist 2 mmol/l Injektionslösung Gadopentetsäure, Dimeglumin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor dieses Arzneimittel bei
Packungsbeilage CORSODYL Mundspüllösung / Spray 03-2012 Seite 1/5 BE106802 / BE191764 Belgien GEBRAUCHINFORMATION: INFORMATION FÜR DEN ANWENDER
 Seite 1/5 BE106802 / BE191764 Belgien GEBRAUCHINFORMATION: INFORMATION FÜR DEN ANWENDER CORSODYL 200mg/100ml mundwasser CORSODYL 200mg/100ml spray zur Anwendung in der Mundhöhle Chlorhexidindigluconat
Seite 1/5 BE106802 / BE191764 Belgien GEBRAUCHINFORMATION: INFORMATION FÜR DEN ANWENDER CORSODYL 200mg/100ml mundwasser CORSODYL 200mg/100ml spray zur Anwendung in der Mundhöhle Chlorhexidindigluconat
Anleitung zur Handhabung von Durchstechflasche und Einmalspritze (für Patienten, Ärzte, Diabetesberater und Apotheker)
 Anleitung zur Handhabung von Durchstechflasche und Einmalspritze (für Patienten, Ärzte, Diabetesberater und Apotheker) EIN LEITFADEN ZUR ERSTEN VERWENDUNG VON APIDRA in 10ml- DURCHSTECHFLASCHEN Apidra
Anleitung zur Handhabung von Durchstechflasche und Einmalspritze (für Patienten, Ärzte, Diabetesberater und Apotheker) EIN LEITFADEN ZUR ERSTEN VERWENDUNG VON APIDRA in 10ml- DURCHSTECHFLASCHEN Apidra
Implantate Anwendung in unserer Praxis
 PRAXIS DR. MED. DENT. SIEGFRIED MASLO, AUF DEM KLÜTERORT 20, 27798 HUDE Anwendung in unserer Praxis 20, 27798 Hude Seite 1 Lust auf schöne und natürliche Zähne? kommen der natürlichen Optik am nächsten.
PRAXIS DR. MED. DENT. SIEGFRIED MASLO, AUF DEM KLÜTERORT 20, 27798 HUDE Anwendung in unserer Praxis 20, 27798 Hude Seite 1 Lust auf schöne und natürliche Zähne? kommen der natürlichen Optik am nächsten.
Interventionelle Behandlung der Aortenklappenstenose
 Innovationsgipfel 07.05.2009 Interventionelle Behandlung der Aortenklappenstenose Prof. Dr. H. Drexler Aortenstenose Aortenstenose: Verengung des Auslassventils der linken Herzkammer Aortenstenose Aortenstenose
Innovationsgipfel 07.05.2009 Interventionelle Behandlung der Aortenklappenstenose Prof. Dr. H. Drexler Aortenstenose Aortenstenose: Verengung des Auslassventils der linken Herzkammer Aortenstenose Aortenstenose
Hautkrebsscreening. 49 Prozent meinen, Hautkrebs sei kein Thema, das sie besorgt. Thema Hautkrebs. Ist Hautkrebs für Sie ein Thema, das Sie besorgt?
 Hautkrebsscreening Datenbasis: 1.004 gesetzlich Krankenversicherte ab 1 Jahren Erhebungszeitraum:. bis 4. April 01 statistische Fehlertoleranz: +/- Prozentpunkte Auftraggeber: DDG Hautkrebs ist ein Thema,
Hautkrebsscreening Datenbasis: 1.004 gesetzlich Krankenversicherte ab 1 Jahren Erhebungszeitraum:. bis 4. April 01 statistische Fehlertoleranz: +/- Prozentpunkte Auftraggeber: DDG Hautkrebs ist ein Thema,
Gebrauchsinformation: Information für Anwender. Cyprostol - Tabletten Wirkstoff: Misoprostol
 1 Gebrauchsinformation: Information für Anwender Cyprostol - Tabletten Wirkstoff: Misoprostol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
1 Gebrauchsinformation: Information für Anwender Cyprostol - Tabletten Wirkstoff: Misoprostol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
Kritische Lebensereignisse und Gesundheit im Alter
 Christian Deindl, Universität zu Köln Kritische Lebensereignisse und Gesundheit im Alter DGS Trier, Oktober 2014 Hintergrund Die Geburt eines Kindes Arbeitslosigkeit Auszug aus dem Elternhaus Haben Auswirkungen
Christian Deindl, Universität zu Köln Kritische Lebensereignisse und Gesundheit im Alter DGS Trier, Oktober 2014 Hintergrund Die Geburt eines Kindes Arbeitslosigkeit Auszug aus dem Elternhaus Haben Auswirkungen
Lineargleichungssysteme: Additions-/ Subtraktionsverfahren
 Lineargleichungssysteme: Additions-/ Subtraktionsverfahren W. Kippels 22. Februar 2014 Inhaltsverzeichnis 1 Einleitung 2 2 Lineargleichungssysteme zweiten Grades 2 3 Lineargleichungssysteme höheren als
Lineargleichungssysteme: Additions-/ Subtraktionsverfahren W. Kippels 22. Februar 2014 Inhaltsverzeichnis 1 Einleitung 2 2 Lineargleichungssysteme zweiten Grades 2 3 Lineargleichungssysteme höheren als
IMPLANON NXT Erläuternde Broschüre für Patientinnen
 Die Markteinführung von IMPLANON NXT wurde von den belgischen Gesundheitsbehörden an bestimmte Bedingungen geknüpft. Der vorgeschriebene Plan zur Risikominimierung in Belgien, der auch das vorliegende
Die Markteinführung von IMPLANON NXT wurde von den belgischen Gesundheitsbehörden an bestimmte Bedingungen geknüpft. Der vorgeschriebene Plan zur Risikominimierung in Belgien, der auch das vorliegende
Fragebogen Kopfschmerzen
 Fragebogen Kopfschmerzen Fragen an Dich Fragen an Dich Fragen an die Eltern Bei diesen Fragen geht es um Deine Kopfschmerzen. Es wäre schön, wenn Du darüber etwas sagst. Deine Antworten helfen, für Deine
Fragebogen Kopfschmerzen Fragen an Dich Fragen an Dich Fragen an die Eltern Bei diesen Fragen geht es um Deine Kopfschmerzen. Es wäre schön, wenn Du darüber etwas sagst. Deine Antworten helfen, für Deine
1. Was sind Dorithricin Halstabletten und wofür werden sie angewendet?
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Dorithricin - Halstabletten Wirkstoffe: Tyrothricin, Benzalkoniumchlorid, Benzocain Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Dorithricin - Halstabletten Wirkstoffe: Tyrothricin, Benzalkoniumchlorid, Benzocain Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
Gründe für fehlende Vorsorgemaßnahmen gegen Krankheit
 Gründe für fehlende Vorsorgemaßnahmen gegen Krankheit politische Lage verlassen sich auf Familie persönliche, finanzielle Lage meinen, sich Vorsorge leisten zu können meinen, sie seien zu alt nicht mit
Gründe für fehlende Vorsorgemaßnahmen gegen Krankheit politische Lage verlassen sich auf Familie persönliche, finanzielle Lage meinen, sich Vorsorge leisten zu können meinen, sie seien zu alt nicht mit
Intraoperative Strahlentherapie bei Brustkrebs
 Intraoperative Strahlentherapie bei Brustkrebs Uniklinik Köln 1 Kein Grund für Verzweiflung Wenn die Diagnose Brustkrebs festgestellt wird, ist erst einmal die Sorge groß. Beruhigend zu wissen, dass es
Intraoperative Strahlentherapie bei Brustkrebs Uniklinik Köln 1 Kein Grund für Verzweiflung Wenn die Diagnose Brustkrebs festgestellt wird, ist erst einmal die Sorge groß. Beruhigend zu wissen, dass es
1. WAS IST DAFALGAN Zäpfchen UND WOFÜR WIRD ES ANGEWENDET?
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER DAFALGAN Säuglinge 80 mg Zäpfchen DAFALGAN Kleinkinder 150 mg Zäpfchen DAFALGAN große Kinder 300 mg Zäpfchen Paracetamol Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER DAFALGAN Säuglinge 80 mg Zäpfchen DAFALGAN Kleinkinder 150 mg Zäpfchen DAFALGAN große Kinder 300 mg Zäpfchen Paracetamol Lesen Sie die gesamte Packungsbeilage
Knappschaft Gesundheitsmanagement 44781 Bochum www.knappschaft.de
 Risikopotential Selbstmedikation:.. und der Beitrag der Krankenkasse zur Verbesserung der AMTS ihrer Versicherten bei Selbstbehandlung mit OTC Medikation Knappschaft Gesundheitsmanagement 44781 Bochum
Risikopotential Selbstmedikation:.. und der Beitrag der Krankenkasse zur Verbesserung der AMTS ihrer Versicherten bei Selbstbehandlung mit OTC Medikation Knappschaft Gesundheitsmanagement 44781 Bochum
APOTHEKIA SPECIAL DIE PILLE DANACH
 APOTHEKIA SPECIAL DIE PILLE DANACH Die zwei Pillen danach In Deutschland sind aktuell zwei Wirkstoffe für die Pille danach zugelassen, Ulipristalacetat (Handelsname ellaone) und Levonorgestrel (Handelsname
APOTHEKIA SPECIAL DIE PILLE DANACH Die zwei Pillen danach In Deutschland sind aktuell zwei Wirkstoffe für die Pille danach zugelassen, Ulipristalacetat (Handelsname ellaone) und Levonorgestrel (Handelsname
Ihre Protein Analyse
 Ihre Protein Analyse Patient Max Dusan Mustermann Sladek... geboren am 17.10.1986... Gewicht 83 kg... Probennummer P07245... Probenmaterial Plasma... Eingang 18.6.2014... Ausgang 7.7.2014 Sehr geehrter
Ihre Protein Analyse Patient Max Dusan Mustermann Sladek... geboren am 17.10.1986... Gewicht 83 kg... Probennummer P07245... Probenmaterial Plasma... Eingang 18.6.2014... Ausgang 7.7.2014 Sehr geehrter
