Im Vordergrund steht die Bewertung der Herstellungsverfahren. Erfüllt das Produkt seine Funktion und ist es nicht schädlich für den Patienten?
|
|
|
- Cornelia Raske
- vor 7 Jahren
- Abrufe
Transkript
1 Institut für Klinische Transfusionsmedizin und Hämotherapie Direktor: Prof. Dr. M. Böck Vereinfachtes Genehmigungsverfahren nach 21a AMG für Stammzellzubereitungen Endproduktspezifikation Informationsveranstaltung des PEI am Dr. A. Opitz
2 21 a AMG Satz 1 gilt entsprechend für Blutstammzellzubereitungen, die zur autologen oder gerichteten für eine bestimmte Person vorgesehene Anwendung bestimmt sind. Die Genehmigung umfasst die Verfahren für die Gewinnung, Verarbeitung und Prüfung, die und die Dokumentation für jeden Verfahrensschritt sowie die quantitativen und qualitativen Kriterien für Gewebezubereitungen. Insbesondere sind die kritischen Verarbeitungsverfahren daraufhin zu bewerten, dass die Verfahren die Gewebe klinisch nicht unwirksam oder schädlich für die Patienten machen.
3 21 a Genehmigungsverfahren Im Vordergrund steht die Bewertung der Herstellungsverfahren. Erfüllt das Produkt seine Funktion und ist es nicht schädlich für den Patienten? Ist die Endproduktspezifikation im Zusammenhang mit 21a notwendig bzw. sinnvoll?
4 Problematische Aspekte der Endproduktspezifikation : Einheitliche Mindeststandards bei der Herstellung und Prüfung sind notwendig (Prozessqualität). Jedes allogene und autologe Blutstammzellpräparat ist ein Unikat (individuelle Rezeptur). Die Ergebnisqualität ist abhängig vom Ausgangswert des Spenders. Der Zielwert für die Menge wird durch den Empfänger bestimmt. Stammzellpräparate sind ein Bestandteil eines komplexen therapeutischen Verfahrens. Gibt es therapeutische Alternativen?
5 Konsequenzen bei Nichteinhaltung der Endproduktspezifikation? 1. Medizinische Konsequenzen: 2. Forensische Konsequenzen: 16 AMWHV: Die Freigabe darf nur erfolgen, wenn... Die Überprüfung der Herstellungs- und Prüfunterlagen die Übereinstimmung der Produkte mit ihrer Spezifikation, einschließlich der Endverpackung bestätigt hat. 32 AMWHV Ordnungswidrigkeiten 96 (Strafvorschriften) und 97 (Bußgeld) des AMG.
6 Endproduktspezifikation von autologen Stammzellzubereitungen (I) Prüfparameter Spezifikation Prüfhäufigk eit Prüfzeitpunkt AB0 1,2 bestimmt / deklariert 100 % am Patientenblut bei (NSB-SC: aus NSB- VB) Rh-(D) 1,2 bestimmt / deklariert 100 % am Patientenblut bei (NSB-SC: aus NSB- VB) HBs-Antigen 1,4 bestimmt / deklariert 100 % am Patientenblut bei (NSB-SC: aus mütterl. Blut) Anti-HBc- Antikörper 1,4 bestimmt / deklariert 100 % am Patientenblut bei (NSB-SC: aus mütterl. Blut) HBV-Genom 3 bestimmt / deklariert 100 % am Patientenblut bei (NSB-SC: aus NSB- Plasma) Anti-HCV- Antikörper 1,4 bestimmt / deklariert 100 % am Patientenblut bei (NSB-SC: aus mütterl. Blut) HCV-Genom 3 bestimmt / deklariert 100 % am Patientenblut bei (NSB-SC: aus NSB- Plasma) Anti-HIV-1/2- Antikörper 1,4 bestimmt / deklariert 100 % am Patientenblut bei (NSB-SC: aus mütterl. Blut) Verfahren
7 Endproduktspezifikation von autologen Stammzellzubereitungen (II) Prüfparameter Spezifikation Prüfhäufigk eit Prüfzeitpunkt HIV-Genom 3 bestimmt / deklariert 100 % am Patientenblut bei (NSB-SC: aus NSB- Plasma) Anti-Treponema pallidum-antikörper 1,4 (nach 1 nur PBSC) Ggf. Anti-CMV- Antikörper 4 für NSB-SC? ggf. Anti-HTLV-I/II- Antikörper 4 für NSB-SC? CMV-Genom für NSB-SC? ggf. Parvovirus-B19- Genom für NSB-SC? bestimmt / deklariert 100 % am Patientenblut bei (NSB-SC: aus mütterl. Blut) bestimmt / deklariert 100 % am Patientenblut bei (NSB-SC: aus mütterl. Blut) bestimmt / deklariert 100 % am Patientenblut bei (NSB-SC: aus mütterl. Blut) bestimmt / deklariert 100 % am Patientenblut bei (NSB-SC: aus NSB- VB) bestimmt / deklariert 100 % am Patientenblut bei (NSB-SC: aus NSB- Plasma) Verfahren
8 Endproduktspezifikation von autologen Stammzellzubereitungen (III) Prüfparameter Spezifikation Prüfhäufigkeit Prüfzeitpunkt Verfahren/ Kriterium Volumen 2 Kernhaltige Zellen (NC) 5,7 pro Endproduktbeutel für NSB-SC zusätzlich gemäß Spezifikation gemäß Anforderung (nicht für NSB-SC) Quantitativ Kernhaltige Zellen (NC) 5,7 pro Transplantat Nur für NSB-SC: Erythroblasten pro Transplantat 7 CD34 + Zellen pro Endproduktbeutel CD34 + Zellen pro Transplantat gemäß Anforderung (nicht für NSB-SC) gemäß Anforderung (nicht für NSB-SC) gemäß Anforderung (nicht für NSB-SC) Vitalität der NC mindestens % Quantitativ Qualität 100 % vor Konditionierung des Patienten** Proliferationsfähigkeit (Koloniebildung) 2,5,7 bestimmt Stichprobenartig (Korrelation der Dosis CD34+ Zellen und CFC; bei Änderungen in Gewinnung und Präparation, die die Qualität der CD34+ Zellen beeinflussen könnten) nach Herstellung vor Konditionierung des Patienten**.
9 Endproduktspezifikation von autologen Stammzellzubereitungen (IV) Prüfparameter Spezifikation Prüfhäufigk eit Prüfzeitpunkt Resterythrozyten 2 Restthrombozyten 2 Restgranulozyten 2 Verfahren/ Kriterium Sterilität 2,5,6 steril bzw. Antibiogramm 100% nach Herstellung: Prüfung am Endprodukt aus jedem Endproduktbeutel bzw. vor Konditionierung des Patienten**: Prüfung von Referenzproben des Endproduktes inkl. DMSO aus jedem Endproduktbeutel Visuelle Kontrolle 3 ggf. weitere Spezifikationen Keine Aggregate 100 % vor Kryokonservierung Unversehrtheit 100 % Nach Herstellung, vor Abgabe Qualität Qualität
10 Endproduktspezifikation von allogenen Stammzellzubereitungen (I) Prüfparameter Spezifikation Prüfhäufigk eit Prüfzeitpunkt AB0 4,2 bestimmt / deklariert 100 % am Spenderblut bis Spende Rh-(D) 4,2 bestimmt / deklariert 100 % am Spenderblut bis Spende HLA-Klasse-I+II- Merk-male 4,2* irreguläre Antikörper 4 bestimmt / deklariert keine klinisch relevanten Antikörper nachweisbar 100 % am Spenderblut vor Spende 100 % am Spenderblut bis Spende HBs-Antigen 1,5 negativ 100 % am Spenderblut bis Anti-HBc- Antikörper 1,5 negativ** 100 % am Spenderblut bis HBV-Genom (NAT) 3 negativ 100 % am Spenderblut bis Anti-HCV- negativ 100 % am Spenderblut bis Antikörper 1,5 HCV-Genom negativ 100 % am Spenderblut bis (NAT) 1,3 Anti-HIV-1/2- negativ 100 % am Spenderblut bis Antikörper 1,5 Verfahren
11 Endproduktspezifikation von allogenen Stammzellzubereitungen (II) Prüfparameter Spezifikation Prüfhäufigk eit Prüfzeitpunkt HIV-1-Genom negativ 100 % am Spenderblut bis (NAT) 1,3 Anti-Treponema pallidum- Antikörper 1,4,5 ALT (37 C, IFCC) 4 (kann nach 3 entfallen) negativ 100 % am Spenderblut bis U / L U / L Anti-CMV-IgG 4,5 bestimmt / deklariert Anti-CMV-IgM 4,5 bestimmt / deklariert 100 % am Spenderblut bis 100 % am Spenderblut bis 100 % am Spenderblut bis ggf. weitere Prüfungen nach 5 Verfahren Nicht gefordert
12 Endproduktspezifikation von allogenen Stammzellzubereitungen (III) Prüfparameter Spezifikation Prüfhäufigkeit Prüfzeitpunkt Volumen 2,4 Kernhaltige Zellen (NC) pro Endproduktbeutel 6 Kernhaltige Zellen (NC) pro Transplantat 6 CD34+ Zellen 2,6*** pro Endproduktbeutel CD34+ Zellen 2,6*** pro Transplantat gemäß Anforderung gemäß Anforderung gemäß Anforderung gemäß Anforderung Vitalität der NC mindestens % Proliferationsfähigkeit (Koloniebildung) 2,6. bestimmt 100 % (nur, wenn Präparat nicht innerhalb von 24 h transfundiert wird) 2,6 Quantitativ Quantitativ Quantitativ nach Herstellung (>24 und <72h) Qualität 100 % bei kryokonservierten Präparaten: vor Konditionierung des Patienten **** Stichprobenartig (Korrelation der Dosis CD34+ Zellen und CFC; bei Änderungen in Gewinnung und Präparation, die die Qualität der CD34+ Zellen beeinflussen könnten) nach Herstellung ## vor Konditionierung des Patienten **** Resterythrozyten 2 bestimmt / deklariert Restthrombozyten 2 bestimmt / deklariert
13 Endproduktspezifikation von allogenen Stammzellzubereitungen (IV) Prüfparameter Spezifikation Prüfhäufig keit Prüfzeitpunkt Restgranulozyten 2 bestimmt / deklariert Sterilität 2,6,7 steril bzw. Antibiogramm : Prüfung am Endprodukt aus jedem Endproduktbeutel ## Visuelle Kontrolle 3 ggf. weitere Spezifikationen bzw. ggf. bei kryokonservierten Präparaten vor Konditionierung des Patienten *** : Prüfung an Referenzproben des Endproduktes inkl. DMSO aus jedem Endproduktbeutel keine Aggregate 100% nach Herstellung, vor Abgabe bzw. vor Kryokonservierung Unversehrtheit 100% nach Herstellung, vor Abgabe Qualität (Lymphozyten?) Qualität Qualität
14 Diskussionspunkte: 1. Unterschiedliche Kriterien bei autologen und allogenen Stammzellzubereitungen? 2. Verfahren für die Gewinnung, Verarbeitung und Prüfung, die und die Dokumentation für jeden Verfahrensschritt? 3. Welche qualitativen und quantitativen Kriterien sind sinnvoll? 4. Endproduktspezifikation gemäß Anforderung des transplantierenden Arztes möglich?
Programm der Informationsveranstaltung zur Genehmigung von Stammzellzubereitungen nach 21a AMG
 Programm der Informationsveranstaltung zur Genehmigung von Stammzellzubereitungen nach 21a AMG 12:00 Uhr Begrüßung, M. Heiden, PEI 12:10 Uhr Einführung gesetzliche Neuregelung, H.M. Huber, PEI 12:50 Uhr
Programm der Informationsveranstaltung zur Genehmigung von Stammzellzubereitungen nach 21a AMG 12:00 Uhr Begrüßung, M. Heiden, PEI 12:10 Uhr Einführung gesetzliche Neuregelung, H.M. Huber, PEI 12:50 Uhr
START Wareneingangskontrolle bei Stammzellprodukten? Dr. Ute Buwitt-Beckmann. Leitung der Qualitätskontrolle, Sachkundige Person
 START 2014 Wareneingangskontrolle bei Dr. Ute Buwitt-Beckmann Leitung der Qualitätskontrolle, Sachkundige Person Sektion Stammzell- u. Immuntherapie Campus Kiel Zur Gewinnung und Herstellung von peripheren
START 2014 Wareneingangskontrolle bei Dr. Ute Buwitt-Beckmann Leitung der Qualitätskontrolle, Sachkundige Person Sektion Stammzell- u. Immuntherapie Campus Kiel Zur Gewinnung und Herstellung von peripheren
Beurteilungsbericht zur Veröffentlichung
 Anlage 3 zur Zulassung PEI.H.03545.01.1 1 / 10 Beurteilungsbericht zur Veröffentlichung (gemäß 34 Abs. 1a und 1 b Arzneimittelgesetz) Leukozytendepletiertes Gefrorenes Frischplasma GFP-Q (MS) Universitätsklinikum
Anlage 3 zur Zulassung PEI.H.03545.01.1 1 / 10 Beurteilungsbericht zur Veröffentlichung (gemäß 34 Abs. 1a und 1 b Arzneimittelgesetz) Leukozytendepletiertes Gefrorenes Frischplasma GFP-Q (MS) Universitätsklinikum
Genehmigung von autologen und gerichteten allogenen Stammzellzubereitungen aus Knochenmark, peripherem Blut bzw. Nabelschnurblut nach 21a AMG
 Genehmigung von autologen und gerichteten allogenen Stammzellzubereitungen aus Knochenmark, peripherem Blut bzw. Nabelschnurblut nach 21a AMG Margarethe Heiden Helga Marie Huber Paul-Ehrlich-Institut Paul-Ehrlich-Straße
Genehmigung von autologen und gerichteten allogenen Stammzellzubereitungen aus Knochenmark, peripherem Blut bzw. Nabelschnurblut nach 21a AMG Margarethe Heiden Helga Marie Huber Paul-Ehrlich-Institut Paul-Ehrlich-Straße
Genehmigung von autologen und gerichteten allogenen Stammzellzubereitungen aus Knochenmark, peripherem Blut bzw. Nabelschnurblut nach 21a AMG
 Genehmigung von autologen und gerichteten allogenen Stammzellzubereitungen aus Knochenmark, peripherem Blut bzw. Nabelschnurblut nach 21a AMG Margarethe Heiden Helga Marie Huber Paul-Ehrlich-Institut Paul-Ehrlich-Straße
Genehmigung von autologen und gerichteten allogenen Stammzellzubereitungen aus Knochenmark, peripherem Blut bzw. Nabelschnurblut nach 21a AMG Margarethe Heiden Helga Marie Huber Paul-Ehrlich-Institut Paul-Ehrlich-Straße
Genehmigung von Gewebezubereitungen nach 21a Arzneimittelgesetz (AMG) Gesetz über den Verkehr mit Arzneimitteln
 Genehmigung von Gewebezubereitungen nach 21a Arzneimittelgesetz (AMG) Gesetz über den Verkehr mit Arzneimitteln Antragsteile Unterlagen zur Qualität (Modul 3) mit Endproduktspezifikation, Liste der Infektionstestparameter,
Genehmigung von Gewebezubereitungen nach 21a Arzneimittelgesetz (AMG) Gesetz über den Verkehr mit Arzneimitteln Antragsteile Unterlagen zur Qualität (Modul 3) mit Endproduktspezifikation, Liste der Infektionstestparameter,
Beurteilungsbericht zur Veröffentlichung
 Anlage 3 zur Zulassung PEI.H.03073.01.1 1 / 9 Beurteilungsbericht zur Veröffentlichung (gemäß 34 Abs. 1a und 1 b Arzneimittelgesetz) Leukozytendepletiertes Gefrorenes Frischplasma GFP-ACD (MS) Universitätsklinikum
Anlage 3 zur Zulassung PEI.H.03073.01.1 1 / 9 Beurteilungsbericht zur Veröffentlichung (gemäß 34 Abs. 1a und 1 b Arzneimittelgesetz) Leukozytendepletiertes Gefrorenes Frischplasma GFP-ACD (MS) Universitätsklinikum
Verbringen hämatopoetischer Stammzellen nach Deutschland
 Verbringen hämatopoetischer Stammzellen nach Deutschland START - PEI 2016 Markus Wiesneth IKT Ulm IKT Ulm Universitätsklinikum Ulm Verbringen hämatopoetischer Stammzellen Regulatorische Anforderungen sind
Verbringen hämatopoetischer Stammzellen nach Deutschland START - PEI 2016 Markus Wiesneth IKT Ulm IKT Ulm Universitätsklinikum Ulm Verbringen hämatopoetischer Stammzellen Regulatorische Anforderungen sind
Beurteilungsbericht zur Veröffentlichung
 Anlage 3 zur Zulassung PEI.H.03074.01.1 1 / 6 Beurteilungsbericht zur Veröffentlichung (gemäß 34 Abs. 1a und 1 b Arzneimittelgesetz) Leukozytendepletiertes Erythrozytenkonzentrat (DUMS) bestrahlt Universitätsklinikum
Anlage 3 zur Zulassung PEI.H.03074.01.1 1 / 6 Beurteilungsbericht zur Veröffentlichung (gemäß 34 Abs. 1a und 1 b Arzneimittelgesetz) Leukozytendepletiertes Erythrozytenkonzentrat (DUMS) bestrahlt Universitätsklinikum
Auftrag für GMP- Dienstleistung
 An: Von: Bayerische Stammzellbank Klinik Robert-Koch-Allee 23 82131 Gauting Telefon Telefon 089 89 32 66-250 Ansprechpartner: 089 89 32 66-29 Request-ID (ZKRD) Auftragsart (Bitte ankreuzen, mehrere Kreuze
An: Von: Bayerische Stammzellbank Klinik Robert-Koch-Allee 23 82131 Gauting Telefon Telefon 089 89 32 66-250 Ansprechpartner: 089 89 32 66-29 Request-ID (ZKRD) Auftragsart (Bitte ankreuzen, mehrere Kreuze
Auftrag für GMP- Dienstleistung
 An: Von: Bayerische Stammzellbank Klinik Robert-Koch-Allee 23 82131 Gauting Telefon Telefon 089 89 32 66-250 Ansprechpartner: 089 89 32 66-29 Request-ID (ZKRD) Auftragsart (Bitte ankreuzen, mehrere Kreuze
An: Von: Bayerische Stammzellbank Klinik Robert-Koch-Allee 23 82131 Gauting Telefon Telefon 089 89 32 66-250 Ansprechpartner: 089 89 32 66-29 Request-ID (ZKRD) Auftragsart (Bitte ankreuzen, mehrere Kreuze
32. Gebiet Transfusionsmedizin
 Auszug aus der Weiterbildungsordnung der Ärztekammer Niedersachsen und Richtlinien vom 01.05.2005, geändert zum 01.02.2012 (siehe jeweilige Fußnoten) 32. Gebiet Transfusionsmedizin Definition: Das Gebiet
Auszug aus der Weiterbildungsordnung der Ärztekammer Niedersachsen und Richtlinien vom 01.05.2005, geändert zum 01.02.2012 (siehe jeweilige Fußnoten) 32. Gebiet Transfusionsmedizin Definition: Das Gebiet
Antrag auf Genehmigung von Gewebezubereitungen gemäß 21a AMG
 Langen 18. Dezember 2007 Antrag auf Genehmigung von Gewebezubereitungen gemäß 21a AMG Paul-Ehrlich-Institut; Division of Medical Biotechnology; www.pei.de Regelungsbereich des GWG im AMG: Entnommene Gewebe
Langen 18. Dezember 2007 Antrag auf Genehmigung von Gewebezubereitungen gemäß 21a AMG Paul-Ehrlich-Institut; Division of Medical Biotechnology; www.pei.de Regelungsbereich des GWG im AMG: Entnommene Gewebe
Richtlinie zur Herstellung und Anwendung von hämatopoetischen Stammzellzubereitungen Erste Fortschreibung
 BUNDESÄRZTEKAMMER Bekanntmachungen Richtlinie zur Herstellung und Anwendung von hämatopoetischen Stammzellzubereitungen Erste Fortschreibung Der Vorstand der Bundesärztekammer hat in seiner Sitzung vom
BUNDESÄRZTEKAMMER Bekanntmachungen Richtlinie zur Herstellung und Anwendung von hämatopoetischen Stammzellzubereitungen Erste Fortschreibung Der Vorstand der Bundesärztekammer hat in seiner Sitzung vom
Einfuhr von Arzneimitteln menschlicher Herkunft zur unmittelbaren Anwendung gem. 72 Abs. 2 AMG
 Regierung von Oberbayern Zentrale Arzneimittelüberwachung Bayern (GMP/GCP) Einfuhr von Arzneimitteln menschlicher Herkunft zur unmittelbaren Anwendung gem. 72 Abs. 2 AMG Sabine Schmitt 10.07.2008 sabine.schmitt@reg-ob.bayern.de
Regierung von Oberbayern Zentrale Arzneimittelüberwachung Bayern (GMP/GCP) Einfuhr von Arzneimitteln menschlicher Herkunft zur unmittelbaren Anwendung gem. 72 Abs. 2 AMG Sabine Schmitt 10.07.2008 sabine.schmitt@reg-ob.bayern.de
Gewebegesetz. Antrag auf Genehmigung von Gewebezubereitungen gemäß 21a AMG
 Gewebegesetz Transfusionsmedizinische Gespräche Hannover 16. Februar 2008 Paul-Ehrlich-Institut - Federal Agency for Sera and Vaccines - Section 6/4 Non-vital Tissue Preparations, Xenogeneic Cell Therapeutics
Gewebegesetz Transfusionsmedizinische Gespräche Hannover 16. Februar 2008 Paul-Ehrlich-Institut - Federal Agency for Sera and Vaccines - Section 6/4 Non-vital Tissue Preparations, Xenogeneic Cell Therapeutics
Bewertung des kausalen Zusammenhangs eines Verdachts einer HIV-Übertragung beim Empfänger durch Blut und Blutkomponenten
 Votum 34 des Arbeitskreises Blut Anhang D 1: Bewertung des Verdachts einer HIV-, HBV- und/oder HCV- Übertragung durch Blut und Blutkomponenten gemäß 63b AMG* HIV Infektionsmerkmale beim Empfänger Serologisch
Votum 34 des Arbeitskreises Blut Anhang D 1: Bewertung des Verdachts einer HIV-, HBV- und/oder HCV- Übertragung durch Blut und Blutkomponenten gemäß 63b AMG* HIV Infektionsmerkmale beim Empfänger Serologisch
Antrag zu Änderung der Richtlinien hinsichtlich der Quarantänelagerung für kryokonservierte Erythrozytenkonzentrate und der Spenderrekrutierung
 Antrag zu Änderung der Richtlinien hinsichtlich der Quarantänelagerung für kryokonservierte Erythrozytenkonzentrate und der Spenderrekrutierung Inge von Zabern AG Seltene Blutgruppen DGTI 2009 Institut
Antrag zu Änderung der Richtlinien hinsichtlich der Quarantänelagerung für kryokonservierte Erythrozytenkonzentrate und der Spenderrekrutierung Inge von Zabern AG Seltene Blutgruppen DGTI 2009 Institut
5. Fortbildungsveranstaltung für Klinische Hämotherapie
 CC Düsseldorf, 16. September 2008 5. Fortbildungsveranstaltung für Klinische Hämotherapie Kommission für Klinische Hämotherapie von DGTI & BDT Gemeinschaftsveranstaltung BDT DGTI GTH DGHO DGAI Berufverband
CC Düsseldorf, 16. September 2008 5. Fortbildungsveranstaltung für Klinische Hämotherapie Kommission für Klinische Hämotherapie von DGTI & BDT Gemeinschaftsveranstaltung BDT DGTI GTH DGHO DGAI Berufverband
mvzlm RUHR REFERENZWERTTABELLE
 Blutgruppe / AK-Suchtest vor erwarteter bzw. wahrscheinlicher Transfusion; vor Therapie mit monoklonalen Antikörpern Material: EDTA, 7,5 ml Häufigkeit: 24 h täglich Meßverfahren: Agglutinationsverfahren
Blutgruppe / AK-Suchtest vor erwarteter bzw. wahrscheinlicher Transfusion; vor Therapie mit monoklonalen Antikörpern Material: EDTA, 7,5 ml Häufigkeit: 24 h täglich Meßverfahren: Agglutinationsverfahren
Vergleich Richtlinie Hämotherapie 2010 und 2017
 2010 (alt) 2017 (neu) Abschnitt Inhalt Abschnitt Inhalt 1.4 Qualitätsmanagement (QM)/Qualitätssicherung 6 Qualitätsmanagement und Qualitätssicherung 1.4.1 Sowohl Einrichtungen, in denen Blut und Blutbestandteile
2010 (alt) 2017 (neu) Abschnitt Inhalt Abschnitt Inhalt 1.4 Qualitätsmanagement (QM)/Qualitätssicherung 6 Qualitätsmanagement und Qualitätssicherung 1.4.1 Sowohl Einrichtungen, in denen Blut und Blutbestandteile
Modul 1.3 PRODUKTINFORMATION
 Modul 1.3 PRODUKTINFORMATION Des Antrages auf Genehmigung von Stammzellzubereitungen aus Knochenmark, peripherem Blut bzw. Nabelschnurblut nach 21a Abs. 1-3 des Arzneimittelgesetzes (AMG) MODUL 1 ARZNEIMITTELERFASSUNG
Modul 1.3 PRODUKTINFORMATION Des Antrages auf Genehmigung von Stammzellzubereitungen aus Knochenmark, peripherem Blut bzw. Nabelschnurblut nach 21a Abs. 1-3 des Arzneimittelgesetzes (AMG) MODUL 1 ARZNEIMITTELERFASSUNG
Erlaubniserteilung für Entnahme- und Gewebeeinrichtungen nach dem Gewebegesetz ( 20b und 20c AMG)
 Erlaubniserteilung für Entnahme- und Gewebeeinrichtungen nach dem Gewebegesetz ( 20b und 20c AMG) Dr. Regine Leo 18. Dezember 2008 Langen Zu meiner Person Biologin, Schwerpunkt Immunologie und Zelltherapie
Erlaubniserteilung für Entnahme- und Gewebeeinrichtungen nach dem Gewebegesetz ( 20b und 20c AMG) Dr. Regine Leo 18. Dezember 2008 Langen Zu meiner Person Biologin, Schwerpunkt Immunologie und Zelltherapie
EMPFEHLUNG DES PAUL-EHRLICH-INSITUTES ZUR VORLAGE VON PERIODISCHEN SICHERHEITSBERICHTEN (Periodic Safety Update Report - PSUR)
 EMPFEHLUNG DES PAUL-EHRLICH-INSITUTES ZUR VORLAGE VON PERIODISCHEN SICHERHEITSBERICHTEN (Periodic Safety Update Report - PSUR) IM ZUSAMMENHANG MIT BLUTKOMPONENTEN nach 63i Abs. 4 AMG Allgemeines: Durch
EMPFEHLUNG DES PAUL-EHRLICH-INSITUTES ZUR VORLAGE VON PERIODISCHEN SICHERHEITSBERICHTEN (Periodic Safety Update Report - PSUR) IM ZUSAMMENHANG MIT BLUTKOMPONENTEN nach 63i Abs. 4 AMG Allgemeines: Durch
Die Gewebespende im Gesundheit Nord - Klinikverbund Bremen
 Die Gewebespende im Gesundheit Nord - Klinikverbund Bremen Deutsche Gesellschaft für Gewebetransplantation/ 2 Informationen zur Gewebespende Kooperationsvertrag/Gesetzliche Grundlagen 3 Ihre Ansprechpartner
Die Gewebespende im Gesundheit Nord - Klinikverbund Bremen Deutsche Gesellschaft für Gewebetransplantation/ 2 Informationen zur Gewebespende Kooperationsvertrag/Gesetzliche Grundlagen 3 Ihre Ansprechpartner
Institut für Zelltherapeutika Cellular Therapy Centre L. Arseniev. (L. Arseniev, U. Köhl)
 Institut für Zelltherapeutika (L. Arseniev, U. Köhl) Präsentierte Daten CD34-Selektionen und CD3/CD19-Depletionen aus Hannover 2000 2014 (verantwortlich L. Arseniev) bis Aug. 2011 unter der Herstellungserlaubnis
Institut für Zelltherapeutika (L. Arseniev, U. Köhl) Präsentierte Daten CD34-Selektionen und CD3/CD19-Depletionen aus Hannover 2000 2014 (verantwortlich L. Arseniev) bis Aug. 2011 unter der Herstellungserlaubnis
Look back Kommunikation zwischen Anwender & Pharmazeutischem Hersteller
 Look back Kommunikation zwischen Anwender & Pharmazeutischem Hersteller Blutspendedienst des BRK Dr. Petra Michel Stufenplanbeauftragte Hannover, 27. September 2011 Rückverfolgung Regulatorische Vorgaben
Look back Kommunikation zwischen Anwender & Pharmazeutischem Hersteller Blutspendedienst des BRK Dr. Petra Michel Stufenplanbeauftragte Hannover, 27. September 2011 Rückverfolgung Regulatorische Vorgaben
Stufenplan zur Anti-HBc-Testung und Votum 42 AK Blut
 www.pei.de Stufenplan zur Anti-HBc-Testung und Votum 42 AK Blut M. Heiden DGTI Sektion Sicherheit von Blutprodukten Bad Oeynhausen, 21.03.2013 Antikörper gegen Hepatitis-B-Core-Antigen Epidemiologischer
www.pei.de Stufenplan zur Anti-HBc-Testung und Votum 42 AK Blut M. Heiden DGTI Sektion Sicherheit von Blutprodukten Bad Oeynhausen, 21.03.2013 Antikörper gegen Hepatitis-B-Core-Antigen Epidemiologischer
Die Gewebespende in der Universitätsmedizin Greifswald
 Die Gewebespende in der Universitätsmedizin Greifswald Deutsche Gesellschaft für Gewebetransplantation/ 2 Informationen zur Gewebespende Kooperationsvertrag/Gesetzliche Grundlagen 3 Ihre Ansprechpartner
Die Gewebespende in der Universitätsmedizin Greifswald Deutsche Gesellschaft für Gewebetransplantation/ 2 Informationen zur Gewebespende Kooperationsvertrag/Gesetzliche Grundlagen 3 Ihre Ansprechpartner
Standard Operating Procedures am Klinikum rechts der Isar
 Standard Operating Procedures am Klinikum rechts der Isar H. Menzel, R. Peter, C. von Schilling, C. Peschel III. Med. Klinik Klinikum rechts der Isar Technische Universität t MünchenM Einführung I Standardisierung
Standard Operating Procedures am Klinikum rechts der Isar H. Menzel, R. Peter, C. von Schilling, C. Peschel III. Med. Klinik Klinikum rechts der Isar Technische Universität t MünchenM Einführung I Standardisierung
Erfahrungen mit dem Anti-HBc-Stufenplan 2006
 Erfahrungen mit dem Anti-HBc-Stufenplan 2006 Notwendigkeit der Anti-HBc-Testung lt. Votum 31 des AK Blut Anti-HBc auch vorhanden, wenn HBsAg-Bildung gering oder/und Escape-Mutanten vorliegen USA: 0,24
Erfahrungen mit dem Anti-HBc-Stufenplan 2006 Notwendigkeit der Anti-HBc-Testung lt. Votum 31 des AK Blut Anti-HBc auch vorhanden, wenn HBsAg-Bildung gering oder/und Escape-Mutanten vorliegen USA: 0,24
Bezirksregierung Düsseldorf. Eine arzneimittelrechtliche Erlaubnis (nach 13 AMG resp. 20b/c AMG) ist immer erforderlich bei
 Bezirksregierung Düsseldorf.. Anzeige gemäß 67 Abs. 1 u. 2 AMG für die erlaubnisfreie Herstellung von Arzneimitteln durch Ärzte und zur Ausübung der Heilkunde bei Menschen befugten Personen gemäß 13 Abs.
Bezirksregierung Düsseldorf.. Anzeige gemäß 67 Abs. 1 u. 2 AMG für die erlaubnisfreie Herstellung von Arzneimitteln durch Ärzte und zur Ausübung der Heilkunde bei Menschen befugten Personen gemäß 13 Abs.
Bezirksregierung Münster Dezernat 24 Domplatz Münster Fax: +49 (251)
 Bezirksregierungen Münster Anzeige gemäß 67 Abs. 1 u. 2 AMG für die erlaubnisfreie Herstellung von Arzneimitteln durch Ärzte und zur Ausübung der Heilkunde bei Menschen befugten Personen gemäß 13 Abs.
Bezirksregierungen Münster Anzeige gemäß 67 Abs. 1 u. 2 AMG für die erlaubnisfreie Herstellung von Arzneimitteln durch Ärzte und zur Ausübung der Heilkunde bei Menschen befugten Personen gemäß 13 Abs.
Blutgruppenserologische Untersuchungen und. Transfusion
 Teil I Ernst-Moritz-Arndt-Universität, Praktikum Transfusionsmedizin Blutgruppenserologische Untersuchungen und Transfusion Blutgruppenbestimmung, Antikörperscreening serologische Verträglichkeitsprobe
Teil I Ernst-Moritz-Arndt-Universität, Praktikum Transfusionsmedizin Blutgruppenserologische Untersuchungen und Transfusion Blutgruppenbestimmung, Antikörperscreening serologische Verträglichkeitsprobe
ANTRAG AUF GENEHMIGUNG für Arzneimittel für neuartige Therapien
 ANTRAG AUF GENEHMIGUNG für Arzneimittel für neuartige Therapien nach 4 b Abs. 3 i.v.m. 21a Abs. 2-8 des Arzneimittelgesetzes (AMG) Modul 0 Einstufung des Arzneimittels als Arzneimittel für neuartige Therapien
ANTRAG AUF GENEHMIGUNG für Arzneimittel für neuartige Therapien nach 4 b Abs. 3 i.v.m. 21a Abs. 2-8 des Arzneimittelgesetzes (AMG) Modul 0 Einstufung des Arzneimittels als Arzneimittel für neuartige Therapien
Kriterien der Spenderauswahl bei der allogenen Stammzellspende
 Kriterien der Spenderauswahl bei der allogenen Stammzellspende Umsetzungsgrad der Anforderungen der Stammzellrichtlinien an die Spenderzulassung in der Routine Carla Kreissig, Ärztliche Leitung Cellex
Kriterien der Spenderauswahl bei der allogenen Stammzellspende Umsetzungsgrad der Anforderungen der Stammzellrichtlinien an die Spenderzulassung in der Routine Carla Kreissig, Ärztliche Leitung Cellex
FRISCH GEFRORENES PLASMA LEUKOZYTENDEPLETIERT, AUS VOLLBLUT, ZUR EIGENBLUT- TRANSFUSION
 Vorschriften Blutspende SRK Schweiz Kapitel 18 C: Spezifikationen: Plasma REFERENZEN 1 - Guide to the preparation, use and quality assurance of blood components - Council of Europe - aktuelle Version 2
Vorschriften Blutspende SRK Schweiz Kapitel 18 C: Spezifikationen: Plasma REFERENZEN 1 - Guide to the preparation, use and quality assurance of blood components - Council of Europe - aktuelle Version 2
DRK-Blutspendedienst Baden-Württemberg - Hessen ggmbh PF D Mannheim Friedrich-Ebert-Str. 107; D Mannheim
 DRK-Blutspendedienst Baden-Württemberg - Hessen ggmbh PF 10 08 53 D 68008 Mannheim Friedrich-Ebert-Str. 107; D - 68167 Mannheim Institut für Transfusionsmedizin und Immunologie Mannheim PF 10 08 53; D
DRK-Blutspendedienst Baden-Württemberg - Hessen ggmbh PF 10 08 53 D 68008 Mannheim Friedrich-Ebert-Str. 107; D - 68167 Mannheim Institut für Transfusionsmedizin und Immunologie Mannheim PF 10 08 53; D
Bitte zurücksenden per an:
 Schriftliche Anhörung 2011 zu dem Entwurf der Richtlinie zur Herstellung und Anwendung von hämatopoietischen Stammzellen Beratungsgrundlage: Entwurf, Stand 30.09.2011 Bitte zurücksenden per E-Mail an:
Schriftliche Anhörung 2011 zu dem Entwurf der Richtlinie zur Herstellung und Anwendung von hämatopoietischen Stammzellen Beratungsgrundlage: Entwurf, Stand 30.09.2011 Bitte zurücksenden per E-Mail an:
QM in der Physiotherapie. Forderungen Grundsätze Konzeption Maßnahmen
 QM in der Physiotherapie Forderungen Grundsätze Konzeption Maßnahmen Integrierte Managementsysteme Rathausstr. 22 82194 Gröbenzell Tel.: 08142-504248, Fax: - 504286 ims@prozess-effizienz.de 10.03.2005
QM in der Physiotherapie Forderungen Grundsätze Konzeption Maßnahmen Integrierte Managementsysteme Rathausstr. 22 82194 Gröbenzell Tel.: 08142-504248, Fax: - 504286 ims@prozess-effizienz.de 10.03.2005
NUB Antrag 2018/2019 virusspezfische Spenderzellen
 Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? Dieser Antrag wurde gemeinsam durch die Gesellschaft für Pädiatrische
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? Dieser Antrag wurde gemeinsam durch die Gesellschaft für Pädiatrische
Stellungnahme des BPI. zum Referentenentwurf. eines Gesetzes zur Umsetzung. der RL (EU) 2015/566 und 2015/565. Stand: 24.
 des BPI zum Referentenentwurf eines Gesetzes zur Umsetzung der RL (EU) 2015/566 und 2015/565 Stand: 24. März 2016 per E-Mail: 113@bmg.bund.de Seite 1 Das Bundesministerium für Gesundheit hat dem BPI den
des BPI zum Referentenentwurf eines Gesetzes zur Umsetzung der RL (EU) 2015/566 und 2015/565 Stand: 24. März 2016 per E-Mail: 113@bmg.bund.de Seite 1 Das Bundesministerium für Gesundheit hat dem BPI den
Beantragung einer Erlaubnis für die im Rahmen der Gewinnung von Gewebe erforderlichen Laboruntersuchungen nach 20b Abs. 1 Arzneimittelgesetz
 DIE REGIERUNGSPRÄSIDIEN FREIBURG - KARLSRUHE - STUTTGART -TÜBINGEN Beantragung einer Erlaubnis für die im Rahmen der Gewinnung von Gewebe erforderlichen Laboruntersuchungen nach 20b Abs. 1 Arzneimittelgesetz
DIE REGIERUNGSPRÄSIDIEN FREIBURG - KARLSRUHE - STUTTGART -TÜBINGEN Beantragung einer Erlaubnis für die im Rahmen der Gewinnung von Gewebe erforderlichen Laboruntersuchungen nach 20b Abs. 1 Arzneimittelgesetz
Votum 42 AK Blut und Überarbeitung Stufenplan zur Anti-HBc-Testung
 www.pei.de Votum 42 AK Blut und Überarbeitung Stufenplan zur Anti-HBc-Testung M. Heiden Abklärung eines initial reaktiven Anti-HBc bei negativem HBsAg Freigabe von Blutkomponenten möglich, sofern eindeutig
www.pei.de Votum 42 AK Blut und Überarbeitung Stufenplan zur Anti-HBc-Testung M. Heiden Abklärung eines initial reaktiven Anti-HBc bei negativem HBsAg Freigabe von Blutkomponenten möglich, sofern eindeutig
Meldungen unerwünschter Wirkungen an das PEI
 Meldungen unerwünschter Wirkungen an das PEI Brigitte Keller-Stanislawski Markus Funk Annette Lohmann Paul-Ehrlich-Str. 5-59 635 Langen arzneimittelsicherheit@pei.de http://www.pei.de Hämovigilanz in Deutschland
Meldungen unerwünschter Wirkungen an das PEI Brigitte Keller-Stanislawski Markus Funk Annette Lohmann Paul-Ehrlich-Str. 5-59 635 Langen arzneimittelsicherheit@pei.de http://www.pei.de Hämovigilanz in Deutschland
IKT Ulm: Versorgungslage, Dateistrukturen, Testprogramme
 IKT Ulm: Versorgungslage, Dateistrukturen, Testprogramme Inge von Zabern AG Seltene Blutgruppen DGTI 9 Institut für Transfusionsmedizin, Universitätsklinikum Ulm Institut für Klinische Transfusionsmedizin
IKT Ulm: Versorgungslage, Dateistrukturen, Testprogramme Inge von Zabern AG Seltene Blutgruppen DGTI 9 Institut für Transfusionsmedizin, Universitätsklinikum Ulm Institut für Klinische Transfusionsmedizin
Grobplanung Monitoring-System TxG
 =Beobachtungsfeld Schlüsselfragen zu Indikatoren Info-Quellen Zielgruppen für Verbreitung Situation der Bevölkerung und des medizinischen Personals Auswirkung des TxGs auf die Struktur der Anbieter (z.b.
=Beobachtungsfeld Schlüsselfragen zu Indikatoren Info-Quellen Zielgruppen für Verbreitung Situation der Bevölkerung und des medizinischen Personals Auswirkung des TxGs auf die Struktur der Anbieter (z.b.
hier: Abwehr von Arzneimittelrisiken Testung auf Antikörper gegen Hepatitis-B-Core-Antigen (anti-hbc) im Blutspendewesen
 Paul-Ehrlich-Institut Postfach 63207 Langen An die Inhaber der Zulassung von zellulären Blutkomponenten und gefrorenem Frischplasma sowie Inhaber von Genehmigungen von allogenen Stammzellzubereitungen
Paul-Ehrlich-Institut Postfach 63207 Langen An die Inhaber der Zulassung von zellulären Blutkomponenten und gefrorenem Frischplasma sowie Inhaber von Genehmigungen von allogenen Stammzellzubereitungen
CAMPUS GROSSHADERN CAMPUS INNENSTADT
 CAMPUS GROSSHADERN CAMPUS INNENSTADT KLINIK FÜR ANAESTHESIOLOGIE ABTEILUNG FÜR TRANSFUSIONSMEDIZIN ZELLTHERAPEUTIKA U. HÄMOSTASEOLOGIE Dokumentenart Information Version: 01 Freigabe zur Schulung: 02.12.2016
CAMPUS GROSSHADERN CAMPUS INNENSTADT KLINIK FÜR ANAESTHESIOLOGIE ABTEILUNG FÜR TRANSFUSIONSMEDIZIN ZELLTHERAPEUTIKA U. HÄMOSTASEOLOGIE Dokumentenart Information Version: 01 Freigabe zur Schulung: 02.12.2016
Organisation der klinischen und ambulanten Hämotherapie in Deutschland
 Organisation der klinischen und ambulanten Hämotherapie in Deutschland Beate Zimmermann DRK-Blutspendedienst NSTOB Institut Bremen-Oldenburg Gesetz zur Regelung des Transfusionswesens (Transfusionsgesetz
Organisation der klinischen und ambulanten Hämotherapie in Deutschland Beate Zimmermann DRK-Blutspendedienst NSTOB Institut Bremen-Oldenburg Gesetz zur Regelung des Transfusionswesens (Transfusionsgesetz
Interne Qualitätskontrollen Im Urinlabor
 Interne Qualitätskontrollen Im Urinlabor Interne Qualitätskontrollen - Auszüge Interne Qualitätskontrollen Auszüge aus Teil B3 2 Interne Qualitätskontrollen - Auszüge 1 (2) Qualitätskontrolle an einzelnen
Interne Qualitätskontrollen Im Urinlabor Interne Qualitätskontrollen - Auszüge Interne Qualitätskontrollen Auszüge aus Teil B3 2 Interne Qualitätskontrollen - Auszüge 1 (2) Qualitätskontrolle an einzelnen
Qualitätsbericht Hämotherapie. Dokumentationsbogen (Berichtsjahr 2018)
 Qualitätssicherung Hämotherapie Qualitätsbericht Hämotherapie Dokumentationsbogen (Berichtshr 2018) (einzureichen bis zum 1. März 2019 an die Landesärztekammer und zeitgleich an die Leitung der Einrichtung)
Qualitätssicherung Hämotherapie Qualitätsbericht Hämotherapie Dokumentationsbogen (Berichtshr 2018) (einzureichen bis zum 1. März 2019 an die Landesärztekammer und zeitgleich an die Leitung der Einrichtung)
CAMPUS GROSSHADERN CAMPUS INNENSTADT
 CAMPUS GROSSHADERN CAMPUS INNENSTADT KLINIK FÜR ANAESTHESIOLOGIE ABTEILUNG FÜR TRANSFUSIONSMEDIZIN ZELLTHERAPEUTIKA U. HÄMOSTASEOLOGIE Dokumentenart Information Version: 01 Freigabe zur Schulung: 02.12.2016
CAMPUS GROSSHADERN CAMPUS INNENSTADT KLINIK FÜR ANAESTHESIOLOGIE ABTEILUNG FÜR TRANSFUSIONSMEDIZIN ZELLTHERAPEUTIKA U. HÄMOSTASEOLOGIE Dokumentenart Information Version: 01 Freigabe zur Schulung: 02.12.2016
Vom Spender zum Patienten
 Vom Spender zum Patienten Was mit dem Blutplasma nach der Plasmaspende passiert Plasmaspender sind Lebensretter denn aus dem kostbaren Blutplasma werden wertvolle Stoffe für unterschiedliche Arzneimittel
Vom Spender zum Patienten Was mit dem Blutplasma nach der Plasmaspende passiert Plasmaspender sind Lebensretter denn aus dem kostbaren Blutplasma werden wertvolle Stoffe für unterschiedliche Arzneimittel
Anforderungen an die Genehmigung von muskuloskelettalen Allografts gemäß
 Anforderungen an die Genehmigung von muskuloskelettalen Allografts gemäß 21a AMG Symposium Allograft 26. AGA-Kongress Deutsche Arbeitsgemeinschaft für Arthroskopie Leipzig, 19.09.2009 Paul-Ehrlich-Institut
Anforderungen an die Genehmigung von muskuloskelettalen Allografts gemäß 21a AMG Symposium Allograft 26. AGA-Kongress Deutsche Arbeitsgemeinschaft für Arthroskopie Leipzig, 19.09.2009 Paul-Ehrlich-Institut
Kapitel 18 C: Spezifikationen: Plasma
 REFERENZEN 1 - Guide to the preparation, use and quality assurance of blood components - Council of Europe - aktuelle Version 2 - European Pharmacopoeia - aktuelle Version FRISCH GEFRORENES PLASMA LEUKOZYTENDEPLETIERT,
REFERENZEN 1 - Guide to the preparation, use and quality assurance of blood components - Council of Europe - aktuelle Version 2 - European Pharmacopoeia - aktuelle Version FRISCH GEFRORENES PLASMA LEUKOZYTENDEPLETIERT,
Qualitätssicherung in der Hämotherapie Ärztekammer Hamburg
 Qualitätsbericht 2017 Vorlage für den Qualitätsbericht gem. Anhang 1 der BÄK-Richtlinien zur Gewinnung von Blut und Blutbestandteilen und zur Anwendung von Blutprodukten (Hämotherapie). Für alle medizinischen
Qualitätsbericht 2017 Vorlage für den Qualitätsbericht gem. Anhang 1 der BÄK-Richtlinien zur Gewinnung von Blut und Blutbestandteilen und zur Anwendung von Blutprodukten (Hämotherapie). Für alle medizinischen
Termine in Sporthallen und öffentlichen Gebäuden
 Termine in Sporthallen und öffentlichen Gebäuden Welche Vorschriften gibt es bei der Raumauswahl? (1. März 2014, AGTF Kassel) Dr. med. Andreas Opitz Ärztlicher Geschäftsführer Bedeutung von mobilen Standorte
Termine in Sporthallen und öffentlichen Gebäuden Welche Vorschriften gibt es bei der Raumauswahl? (1. März 2014, AGTF Kassel) Dr. med. Andreas Opitz Ärztlicher Geschäftsführer Bedeutung von mobilen Standorte
Rundschreiben D 04/2009
 Rundschreiben D 04/2009 An die 30.03.2009 Damen und Herren Durchgangsärzte 411/094 - LV 2 - Kanülenstichverletzungen/Infektionsgefahr bei Blutkontakt DOK-Nr.: 412.42-HIV Sehr geehrte Damen und Herren,
Rundschreiben D 04/2009 An die 30.03.2009 Damen und Herren Durchgangsärzte 411/094 - LV 2 - Kanülenstichverletzungen/Infektionsgefahr bei Blutkontakt DOK-Nr.: 412.42-HIV Sehr geehrte Damen und Herren,
Infektionsserologie/PCR
 CMV-IgG oder IgM-Antikörper (Anti-CMV-IgG / -IgM) Screening von Blutspender- und Patientenproben mit unbekanntem Antikörperstatus Hepatitis-A-Virus-IgM-Antikörper (Anti-HAV-IgM) Nachweis einer akuten HAV-Infektion
CMV-IgG oder IgM-Antikörper (Anti-CMV-IgG / -IgM) Screening von Blutspender- und Patientenproben mit unbekanntem Antikörperstatus Hepatitis-A-Virus-IgM-Antikörper (Anti-HAV-IgM) Nachweis einer akuten HAV-Infektion
Das Gewebegesetz in der Überwachungspraxis
 Das Gewebegesetz in der Überwachungspraxis Anforderungen an Entnahmeeinrichtungen und Gewebespenderlabore Dr. Dr. Gabriele Wanninger, Regierung von von Oberbayern gabriele.wanninger@reg-ob.bayern.de Gewebe
Das Gewebegesetz in der Überwachungspraxis Anforderungen an Entnahmeeinrichtungen und Gewebespenderlabore Dr. Dr. Gabriele Wanninger, Regierung von von Oberbayern gabriele.wanninger@reg-ob.bayern.de Gewebe
Erfahrungen zu Rückverfolgungsverfahren bei Anti-HBc Serokonversion
 Erfahrungen zu Rückverfolgungsverfahren bei Anti-HBc Serokonversion KOLT 2011 Paul - Ehrlich - Institut W. Sireis, I. Helman, A. Vornwald, T. Dengler, U. Mayr - Wohlfart, M. Schmidt DRK Blutspendedienst
Erfahrungen zu Rückverfolgungsverfahren bei Anti-HBc Serokonversion KOLT 2011 Paul - Ehrlich - Institut W. Sireis, I. Helman, A. Vornwald, T. Dengler, U. Mayr - Wohlfart, M. Schmidt DRK Blutspendedienst
Bekanntmachungen des Paul-Ehrlich-Instituts im Bundesanzeiger
 Veröffentlichung 21.03.2012; Bundesanzeiger Nr. 46; S. 1154 Seite 1 / 13 Bekanntmachung Nr. 368 über die Zulassung von Impfstoffen und biomedizinischen Arzneimitteln sowie andere Amtshandlungen Vom 8.
Veröffentlichung 21.03.2012; Bundesanzeiger Nr. 46; S. 1154 Seite 1 / 13 Bekanntmachung Nr. 368 über die Zulassung von Impfstoffen und biomedizinischen Arzneimitteln sowie andere Amtshandlungen Vom 8.
Zeit für einen Wechsel? Widersprüche zwischen Klinikdaten und Meldungen an die Ärztekammer
 Zeit für einen Wechsel? Widersprüche zwischen Klinikdaten und Meldungen an die Ärztekammer Überwachung der Qualitätssicherungssysteme nach den Hämotherapierichtlinien 6. Erfahrungsaustausch für Qualitätsbeauftragte
Zeit für einen Wechsel? Widersprüche zwischen Klinikdaten und Meldungen an die Ärztekammer Überwachung der Qualitätssicherungssysteme nach den Hämotherapierichtlinien 6. Erfahrungsaustausch für Qualitätsbeauftragte
Statistische Prozesskontrolle
 Statistische Prozesskontrolle Paul-Ehrlich-Institut P. Volkers Paul-Ehrlich-Straße 51-59 63225 Langen GERMANY +49 (0) 6103 77-3720 +49 (0) 6103 77-1251 Email: pei@pei.de Homepage: http://www.pei.de 1 -
Statistische Prozesskontrolle Paul-Ehrlich-Institut P. Volkers Paul-Ehrlich-Straße 51-59 63225 Langen GERMANY +49 (0) 6103 77-3720 +49 (0) 6103 77-1251 Email: pei@pei.de Homepage: http://www.pei.de 1 -
Aufbau der Stammzellbank am Universitätsklinikum Erlangen
 Aufbau der Stammzellbank am Universitätsklinikum Erlangen Prof. Dr. Volker Weisbach Transfusionsmedizinische und Hämostaseologische Abteilung, Universitätsklinikum Erlangen 06.02.2010 Plazentarestblutbank
Aufbau der Stammzellbank am Universitätsklinikum Erlangen Prof. Dr. Volker Weisbach Transfusionsmedizinische und Hämostaseologische Abteilung, Universitätsklinikum Erlangen 06.02.2010 Plazentarestblutbank
Die Datenbank Spendertestung
 Die Datenbank Spendertestung www.pei.de Olaf Henseler Paul-Ehrlich-Institut Fachgebiet 7/4 Transfusionsmedizin Paul-Ehrlich-Str. 51-59 63225 Langen +49 6103 77-1862 +49 6103 77-1276 olaf.henseler@pei.de
Die Datenbank Spendertestung www.pei.de Olaf Henseler Paul-Ehrlich-Institut Fachgebiet 7/4 Transfusionsmedizin Paul-Ehrlich-Str. 51-59 63225 Langen +49 6103 77-1862 +49 6103 77-1276 olaf.henseler@pei.de
PeliCase 2 Best.-Nr
 PeliCase 2 Best.-Nr. 546009 Charge: 8000243354 Verfallsdatum: 2017-12-11 Name: Krankenhaus: Unterschrift: Station: Fall: Frau Jonkhuis (63 Jahre alt) wurde am Darm operiert und ist erneut für eine Operation
PeliCase 2 Best.-Nr. 546009 Charge: 8000243354 Verfallsdatum: 2017-12-11 Name: Krankenhaus: Unterschrift: Station: Fall: Frau Jonkhuis (63 Jahre alt) wurde am Darm operiert und ist erneut für eine Operation
Anzeige einer vertraglichen Bindung mit einer Gewebeentnahmeeinrichtung nach 20b Abs. 2 Arzneimittelgesetz
 DIE REGIERUNGSPRÄSIDIEN FREIBURG - KARLSRUHE - STUTTGART -TÜBINGEN Anzeige einer vertraglichen Bindung mit einer Gewebeentnahmeeinrichtung nach 20b Abs. 2 Arzneimittelgesetz (Stand: Januar 2016) Die Anzeige
DIE REGIERUNGSPRÄSIDIEN FREIBURG - KARLSRUHE - STUTTGART -TÜBINGEN Anzeige einer vertraglichen Bindung mit einer Gewebeentnahmeeinrichtung nach 20b Abs. 2 Arzneimittelgesetz (Stand: Januar 2016) Die Anzeige
S E L B S T I N S P E K T I O N
 1 Durchführungsbestätigung Selbstinspektion Verteiler: S E L B S T I N S P E K T I O N gemäß QM-Handbuch Hämotherapie Auditierte Abteilung: Datum / Uhrzeit: Audit-Leiter: Weitere Teilnehmer: Auditbericht
1 Durchführungsbestätigung Selbstinspektion Verteiler: S E L B S T I N S P E K T I O N gemäß QM-Handbuch Hämotherapie Auditierte Abteilung: Datum / Uhrzeit: Audit-Leiter: Weitere Teilnehmer: Auditbericht
Regierungsentwurf 4. AMG-ÄndG Neue nationale Durchführungsregelungen zu der Verordnung (EU) Nr. 536/2014
 Regierungsentwurf 4. AMG-ÄndG Neue nationale Durchführungsregelungen zu der Verordnung (EU) Nr. 536/2014 DGRA JahreskongressBonn 15./16. Juni 2016 1 Verordnung (EU) Nr. 536/2014: Genehmigungsverfahren
Regierungsentwurf 4. AMG-ÄndG Neue nationale Durchführungsregelungen zu der Verordnung (EU) Nr. 536/2014 DGRA JahreskongressBonn 15./16. Juni 2016 1 Verordnung (EU) Nr. 536/2014: Genehmigungsverfahren
Paul-Ehrlich-Institut
 Anlage zum DKG-Rundschreiben Nr. 02/2010 vom 04.01.2010 Angaben zu Art und Menge der en, untersuchten, en, be- und en, konservierten, en, abgegebenen oder anderweitig verwendeten, en und en Gewebe sowie
Anlage zum DKG-Rundschreiben Nr. 02/2010 vom 04.01.2010 Angaben zu Art und Menge der en, untersuchten, en, be- und en, konservierten, en, abgegebenen oder anderweitig verwendeten, en und en Gewebe sowie
Ergänzende Empfehlungen zur Testung von Blut- und Plasmaspenden und zum Rückverfolgungsverfahren
 Bundesgesundheitsbl - Gesundheitsforsch - Gesundheitsschutz 1999 42: 888 892 Springer-Verlag 1999 Bekanntmachung des Arbeitskreises Blut des Bundesministeriums für Gesundheit Bei der 34. Sitzung des Arbeitskreis
Bundesgesundheitsbl - Gesundheitsforsch - Gesundheitsschutz 1999 42: 888 892 Springer-Verlag 1999 Bekanntmachung des Arbeitskreises Blut des Bundesministeriums für Gesundheit Bei der 34. Sitzung des Arbeitskreis
4.1. Dauer der Aplasie nach Hochdosis-Chemotherapie und Retransfusion
 4. Ergebnisse 4.1. Aplasie nach Hochdosis-Chemotherapie und Die Auswertung über 71 en zwischen 1996 und 2000 wird wie folgt zusammengefasst: Tabelle 2: Darstellung der durchschnittlichen Aplasiedauer und
4. Ergebnisse 4.1. Aplasie nach Hochdosis-Chemotherapie und Die Auswertung über 71 en zwischen 1996 und 2000 wird wie folgt zusammengefasst: Tabelle 2: Darstellung der durchschnittlichen Aplasiedauer und
Qualitätssicherung Hämotherapie quo vadis? Erfahrungsaustausch für Qualitätsbeauftragte Ärzte Hämotherapie am
 Qualitätssicherung Hämotherapie quo vadis? Erfahrungsaustausch für Qualitätsbeauftragte Ärzte Hämotherapie am 04.03.2016 Novelle(n) der Richtlinien Hämotherapie 2 Novelle RiLi Hämo Entwicklung der Richtlinien
Qualitätssicherung Hämotherapie quo vadis? Erfahrungsaustausch für Qualitätsbeauftragte Ärzte Hämotherapie am 04.03.2016 Novelle(n) der Richtlinien Hämotherapie 2 Novelle RiLi Hämo Entwicklung der Richtlinien
Einfluss der Lymphombehandlung auf das Blut. Michael Gregor Abteilung für Hämatologie Kantonsspital Luzern
 Einfluss der Lymphombehandlung auf das Blut Michael Gregor Abteilung für Hämatologie Kantonsspital Luzern Zusammensetzung des Blutes Blutgefäss Erythrozyten Blutkörperchen (Zellen) Blutflüssigkeit (Plasma)
Einfluss der Lymphombehandlung auf das Blut Michael Gregor Abteilung für Hämatologie Kantonsspital Luzern Zusammensetzung des Blutes Blutgefäss Erythrozyten Blutkörperchen (Zellen) Blutflüssigkeit (Plasma)
GCP-Routineinspektionen im Rahmen von klinischen Prüfungen - Ein Erfahrungsbericht -
 GCP-Routineinspektionen im Rahmen von klinischen Prüfungen - Ein Erfahrungsbericht - Katharina Thorn 11. DVMD-Fachtagung, Hannover Inspektionen / Audits GCP-Inspektionen im Rahmen von Zulassungsverfahren
GCP-Routineinspektionen im Rahmen von klinischen Prüfungen - Ein Erfahrungsbericht - Katharina Thorn 11. DVMD-Fachtagung, Hannover Inspektionen / Audits GCP-Inspektionen im Rahmen von Zulassungsverfahren
Aus dem Fachbereich Medizin der Johann Wolfgang Goethe-Universität Frankfurt am Main
 Aus dem Fachbereich Medizin der Johann Wolfgang Goethe-Universität Frankfurt am Main Blutspendedienst des Deutschen Roten Kreuzes Institut für Transfusionsmedizin und Immunhämatologie Direktor: Professor
Aus dem Fachbereich Medizin der Johann Wolfgang Goethe-Universität Frankfurt am Main Blutspendedienst des Deutschen Roten Kreuzes Institut für Transfusionsmedizin und Immunhämatologie Direktor: Professor
Herstellung von Lebensmitteln ohne Gentechnik Betriebsbeschreibung Verarbeitung / Aufbereitung
 TEIL 1: BETRIEBSPARAMETER Name des Unternehmens, Ansprechpartner Anschrift Bundesland Landkreis Telefon-Nummer E-Mail Handelsregisterauszug/ Gewerbeanmeldung anliegend Veterinärkontrollnummer Beschreibung
TEIL 1: BETRIEBSPARAMETER Name des Unternehmens, Ansprechpartner Anschrift Bundesland Landkreis Telefon-Nummer E-Mail Handelsregisterauszug/ Gewerbeanmeldung anliegend Veterinärkontrollnummer Beschreibung
SOPS Tranfusionskette SOP-6 Version Nr.: 1 vom Dok. Nr.: 6-SEROLOG DOC Seite 1 von 5
 Version Nr.: 1 vom 07.02.1997 Dok. Nr.: 6-SEROLOG-12.11.2006.DOC Seite 1 von 5 1 Titel Auswahl von Blutprodukten unter Berücksichtigung blutgruppenserologischer Befunde 2 Ziel und Zweck Standardisierung
Version Nr.: 1 vom 07.02.1997 Dok. Nr.: 6-SEROLOG-12.11.2006.DOC Seite 1 von 5 1 Titel Auswahl von Blutprodukten unter Berücksichtigung blutgruppenserologischer Befunde 2 Ziel und Zweck Standardisierung
Erhebungsbogen. für die. Zulassung als Weiterbildungsstätte zur Weiterbildung in der Gebietsbezeichnung TRANSFUSIONSMEDIZIN
 Erhebungsbogen für die Zulassung als Weiterbildungsstätte zur Weiterbildung in der Gebietsbezeichnung TRANSFUSIONSMEDIZIN A. Weiterbildungsstätte (Bezeichnung, Adresse) Bitte Zutreffendes ankreuzen, Mehrfachnennungen
Erhebungsbogen für die Zulassung als Weiterbildungsstätte zur Weiterbildung in der Gebietsbezeichnung TRANSFUSIONSMEDIZIN A. Weiterbildungsstätte (Bezeichnung, Adresse) Bitte Zutreffendes ankreuzen, Mehrfachnennungen
Geplante nationale Durchführungsregelungen zu der Verordnung (EU) Nr. 536/2014
 Geplante nationale Durchführungsregelungen zu der Verordnung (EU) Nr. 536/2014 33. Jahrestagung des Arbeitskreises Medizinischer Ethik-Kommissionen Berlin, 12. November 2015 Ministerialrat Dr. Lars Christoph
Geplante nationale Durchführungsregelungen zu der Verordnung (EU) Nr. 536/2014 33. Jahrestagung des Arbeitskreises Medizinischer Ethik-Kommissionen Berlin, 12. November 2015 Ministerialrat Dr. Lars Christoph
DRK-Blutspendedienst West Wo stehen wir beim Eigenblut und bei automaschinellen Verfahren?
 Wo stehen wir beim Eigenblut und bei automaschinellen Verfahren? PD Dr. med. Thomas Zeiler Präoperative Eigenblutspenden seit 2000 250.000 220904 200.000 150.000 100.000 90063 50.000 0 17012 Quelle: PEI
Wo stehen wir beim Eigenblut und bei automaschinellen Verfahren? PD Dr. med. Thomas Zeiler Präoperative Eigenblutspenden seit 2000 250.000 220904 200.000 150.000 100.000 90063 50.000 0 17012 Quelle: PEI
Novelle der Richtlinie Hämotherapie 2017 Qualitätssicherung. Erfahrungsaustausch der Qualitätsbeauftragten Ärzte in der Hämotherapie
 Novelle der Richtlinie Hämotherapie 2017 Qualitätssicherung Erfahrungsaustausch der Qualitätsbeauftragten Ärzte in der Hämotherapie Ludwigshafen, den 02.03.2018 Historie der Hämotherapie Richtlinie 2 1958
Novelle der Richtlinie Hämotherapie 2017 Qualitätssicherung Erfahrungsaustausch der Qualitätsbeauftragten Ärzte in der Hämotherapie Ludwigshafen, den 02.03.2018 Historie der Hämotherapie Richtlinie 2 1958
Konformitätsbewertung 3.9 A 3
 Antworten und Beschlüsse des EK-Med Konformitätsbewertung 3.9 A 3 Reihenfolge bei der Durchführung von Konformitätsbewertungsverfahren Artikel 11 der Richtlinie 93/42/EWG legt fest, welche Konformitätsbewertungsverfahren
Antworten und Beschlüsse des EK-Med Konformitätsbewertung 3.9 A 3 Reihenfolge bei der Durchführung von Konformitätsbewertungsverfahren Artikel 11 der Richtlinie 93/42/EWG legt fest, welche Konformitätsbewertungsverfahren
Klinische Prüfung von Arzneimitteln: Öffentliche Informationen in PharmNet.Bund Clinical Trials (CT)
 Klinische Prüfung von Arzneimitteln: Öffentliche Informationen in PharmNet.Bund Clinical Trials (CT) Nutzertreffen, Köln 8. November 2011 Dr. Barbara Höfgen, Dr. Irina Bosman PharmNet.Bund-CT Gesetzliche
Klinische Prüfung von Arzneimitteln: Öffentliche Informationen in PharmNet.Bund Clinical Trials (CT) Nutzertreffen, Köln 8. November 2011 Dr. Barbara Höfgen, Dr. Irina Bosman PharmNet.Bund-CT Gesetzliche
Chronische lymphatische Leukämie (CLL)
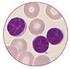 Chronische lymphatische Leukämie (CLL) Peter Dreger Medizinische Klinik V Universitätsklinikum Heidelberg 9/2005 CLL: Entstehung Neu auftretender "Programmfehler" im genetischen Programm einer B-Abwehrzelle
Chronische lymphatische Leukämie (CLL) Peter Dreger Medizinische Klinik V Universitätsklinikum Heidelberg 9/2005 CLL: Entstehung Neu auftretender "Programmfehler" im genetischen Programm einer B-Abwehrzelle
Stand 08/09. Institut für Transfusionsmedizin Erlanger Allee 101 Laborzentrum Jena. Mit den Laboratorien:
 Einrichtung: Mit den Laboratorien: Institut für Transfusionsmedizin Erlanger Allee 101 Laborzentrum 07740 Jena Arbeitsbereich (AB) Labor Transplantationsimmunologie AB Labor Prätransfusionelle Diagnostik
Einrichtung: Mit den Laboratorien: Institut für Transfusionsmedizin Erlanger Allee 101 Laborzentrum 07740 Jena Arbeitsbereich (AB) Labor Transplantationsimmunologie AB Labor Prätransfusionelle Diagnostik
Biosimilars ähnlich, aber nicht identisch!
 Biosimilars ähnlich, aber nicht identisch! München, 23. April 2007 Dr. Frank Mathias Geschäftsführer, AMGEN GmbH Deutschland Die Frage...... identisch - oder nur ähnlich? 2 Biotechnologisch hergestellte
Biosimilars ähnlich, aber nicht identisch! München, 23. April 2007 Dr. Frank Mathias Geschäftsführer, AMGEN GmbH Deutschland Die Frage...... identisch - oder nur ähnlich? 2 Biotechnologisch hergestellte
EDV-gestützte Erstellung einer Blutbereitstellungsrichtlinie
 Klinikum St.Georg ggmbh Delitzscher Str.141,04129 Leipzig EDV-gestützte Erstellung einer Blutbereitstellungsrichtlinie Dr.med.Karin Liebscher Institut für Transfusionsmedizin und klinische Hämostaseologie
Klinikum St.Georg ggmbh Delitzscher Str.141,04129 Leipzig EDV-gestützte Erstellung einer Blutbereitstellungsrichtlinie Dr.med.Karin Liebscher Institut für Transfusionsmedizin und klinische Hämostaseologie
Grundlagen für die Vorbereitung auf die Klausur. Immunreaktionen gegen Erythrozyten, Granzulozyten
 Immunreaktionen gegen Erythrozyten, Granzulozyten Grundlagen für die Vorbereitung auf die Klausur Medizinische Biotechnologie, 4. Semester Prof. Dr. med. Volker Kiefel Institut für Transfusionsmedizin
Immunreaktionen gegen Erythrozyten, Granzulozyten Grundlagen für die Vorbereitung auf die Klausur Medizinische Biotechnologie, 4. Semester Prof. Dr. med. Volker Kiefel Institut für Transfusionsmedizin
Qualitätsbericht Hämotherapie Berichtsjahr
 Qualitätsbericht gemäß der aktuellen Richtlinien zur Gewinnung von Blut und Blutbestandteilen und zur Anwendung von Blutprodukten (Hämotherapie-Richtlinie) Kapitel 7 Anhang. Für alle medizinischen Einrichtungen,
Qualitätsbericht gemäß der aktuellen Richtlinien zur Gewinnung von Blut und Blutbestandteilen und zur Anwendung von Blutprodukten (Hämotherapie-Richtlinie) Kapitel 7 Anhang. Für alle medizinischen Einrichtungen,
PEI-Festsymposium im Rahmen der DGTI-Jahrestagung 2004
 PEI-Festsymposium im Rahmen der DGTI-Jahrestagung 2004 Arzneimittel aus Blut - Konsequenzen aus der HIV-Problematik DGTI/Festsymp/PEI 24.09.2004 von Auer Ausgangslage Tragische HIV-Übertragungen durch
PEI-Festsymposium im Rahmen der DGTI-Jahrestagung 2004 Arzneimittel aus Blut - Konsequenzen aus der HIV-Problematik DGTI/Festsymp/PEI 24.09.2004 von Auer Ausgangslage Tragische HIV-Übertragungen durch
Beantragung einer Erlaubnis für die Gewinnung von Gewebe nach 20b Abs. 1 Arzneimittelgesetz
 DIE REGIERUNGSPRÄSIDIEN FREIBURG - KARLSRUHE - STUTTGART -TÜBINGEN Beantragung einer Erlaubnis für die Gewinnung von Gewebe nach 20b Abs. 1 Arzneimittelgesetz (Stand: Dezember 2018) Der Antrag mit den
DIE REGIERUNGSPRÄSIDIEN FREIBURG - KARLSRUHE - STUTTGART -TÜBINGEN Beantragung einer Erlaubnis für die Gewinnung von Gewebe nach 20b Abs. 1 Arzneimittelgesetz (Stand: Dezember 2018) Der Antrag mit den
AMK-AMG-Herstell-Anz Seite 1 von 6
 AMK-AMG-Herstell-Anz-2010-01-25 Seite 1 von 6 Information der Arzneimittelkommission der deutschen Heilpraktiker bezüglich der arzneimittelrechtlichen Änderungen zur Anzeigepflicht der Herstellung von
AMK-AMG-Herstell-Anz-2010-01-25 Seite 1 von 6 Information der Arzneimittelkommission der deutschen Heilpraktiker bezüglich der arzneimittelrechtlichen Änderungen zur Anzeigepflicht der Herstellung von
Deutsches Rotes Kreuz
 Ausgabe 11 medizin Beiträge zur Transfusionsmedizin 2008 Baden-Württemberg Hessen Überwachung der Qualitätssicherung der Anwendung von Blutprodukten durch die Ärzteschaft 1. Erfahrungsbericht aus Mecklenburg-Vorpommern
Ausgabe 11 medizin Beiträge zur Transfusionsmedizin 2008 Baden-Württemberg Hessen Überwachung der Qualitätssicherung der Anwendung von Blutprodukten durch die Ärzteschaft 1. Erfahrungsbericht aus Mecklenburg-Vorpommern
Antrag auf Erteilung einer Ermächtigung zur Weiterbildung zum Facharzt für Transfusionsmedizin
 Landesärztekammer Thüringen Körperschaft des öffentlichen Rechts Postfach 10 07 40 Telefon: 03641 614-124 07707 Jena Fax: 03641 614-129 Internet: www.laek-thueringen.de Email: weiterbildung@laek-thueringen.de
Landesärztekammer Thüringen Körperschaft des öffentlichen Rechts Postfach 10 07 40 Telefon: 03641 614-124 07707 Jena Fax: 03641 614-129 Internet: www.laek-thueringen.de Email: weiterbildung@laek-thueringen.de
Auszug aus dem Strukturierten Qualitätsbericht
 Auszug aus dem Strukturierten Qualitätsbericht gemäß 137 Abs. 3 Satz 1 Nr. 4 SGB V für das Berichtsjahr 2010 Institut für Transplantationsdiagnostik und Zelltherapeutika B-31 Institut für Transplantationsdiagnostik
Auszug aus dem Strukturierten Qualitätsbericht gemäß 137 Abs. 3 Satz 1 Nr. 4 SGB V für das Berichtsjahr 2010 Institut für Transplantationsdiagnostik und Zelltherapeutika B-31 Institut für Transplantationsdiagnostik
