Gravimetrie und Redoxtitration
|
|
|
- Jens Biermann
- vor 7 Jahren
- Abrufe
Transkript
1 Praktikum 1 Chemie Gravimetrie und Redoxtitration WS 006 /07 Verfasser: David Weibel, Carlo Weingart weibeld@student.ethz.ch carlow@student.ethz.ch Datum: Assistentin: Maha Maglinao
2 Zusammenfassung: In diesem Versuch wurden zwei Experimente durchgeführt. In einem ersten Experiment wurde mittels Gravimetrie der Nickelgehalt einer 10 Rappen Münze bestimmt. Dafür wurde die Münze in Salpetersäure und Salzsäure aufgelöst. Die entstehenden Kupferionen werden an das Thiosulfat gebunden und die Nickelionen bilden einen Komplex mit dem Dimethylglyoxim. Der Ni-DMG Komplex wurde in einer Keramiknutsche gefiltert und anschliessend getrocknet. Aus dem Gewicht des Substrates errechnete man den Nickelgehalt der Münze. Das gemittelte Resultat von 1.7 wt% wich nur gering von dem theoretischen Ni-Gehalt von 5 wt% ab bei einer Standardabweichung von.69. Im zweiten Experiment wurde der Kupfergehalt einer 10 Cent Euro Münze mittels Iodometrie bestimmt. Wiederum wurde die Münze in Salpetersäure und Schwefelsäure aufgelöst. Danach wurden die Kupferionen mit dem Iodid aus dem beigefügten Kaliumiodid gebunden. Diese Lösung wurde mit Natriumthiosulfat titriert. Die erhaltenen Werte für den Kupfergehalt von über 140 wt% waren unrealistisch und enorm über dem theoretischen Wert von 89 wt%. Wir haben den Endpunkt der Titration verpasst, weil wir die Versuchsvorschrift an diesem Punkt missverstanden haben. Wir konnten den Cu-Gehalt also nicht genügend genau bestimmen. David Weibel / Carlo Weingart - 1 -
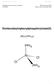
3 1 Einleitung 1.1 Ziel Dieser Versuch bestand aus zwei Teilversuchen. Das Ziel des ersten Experiments war, der Massenprozentgehalt an Nickel in einer 10 Rappen Münze zu messen. Dabei kam die Methode der Gravimetrie zum Einsatz. Das Ziel des zweiten Experiments war, der Massenprozentgehalt an Kupfer in einer 10 Cent Euro Münze iodometrisch zu bestimmen. 1. Methode der Gravimetrie Die Gravimetrie ist ein analytisches Verfahren um die Konzentration einer chemischen Verbindung in einer Lösung durch eine Fällungsreaktion zu bestimmen. In unserem Fall war dies Nickel. Dazu musste die Münze aufgelöst werden um das Nickel zu separieren. Das Nickel wurde anschliessend in einen schwer löslichen Komplex mit bekannter Stöchiometrie überführt. Mit dem Wägen der Münze und dem Produkt konnte der Nickelgehalt bestimmt werden Auflösung der Cu/Ni-Legierung (Oxidation) Die Münze, bestehend aus einer Cu/Ni-Legierung wird mittels konzentrierter Salpetersäure aufgelöst, wobei die Metalle oxidiert werden. Es entstehen dabei giftige Stickstoffverbindungen (NO x ), welche als braun-rotes Gas aus der Lösung steigen. [1] Cu( s) Cu Ni( s) Ni NO ( aq) + H NO ( aq) + 4H ( aq) + e ( aq) + e + + ( aq) + e ( aq) + 3e NO ( g) + H NO( g) + H O( l) O( l) 1.. Komplexbildung Die Metalle liegen nun in Form von Ni + und Cu + Ionen aquatisiert vor. Das Kupferion wird mit dem Thiosulfat-Anion komplexiert. Der entstehende Komplex ist gut wasserlöslich und reagiert nicht mit dem Dimethylglyoxim. Somit entstehen in der Lösung mit DMG nur die schwer-löslichen [Ni(HDMG) ]-Komplexe, welche als rötlichen Feststoff ausfallen. [1] Abb.1: Bildung des Ni-Komplexes David Weibel / Carlo Weingart - -
4 1..3 Berechnung Mit Hilfe der gemessenen Masse vom erhaltenen Ni-Komplex kann man die Masse vom vorhandenen reinen Ni wie folgt berechnen: ( Ni( HDMG) ) 5) M ( = M ( Ni( HDMG) ) M( = g/mol, M(Ni(HDMG) ) = g/mol Die Masse des Komplexes wird mit 5 multipliziert, weil nur 0% der Lösung verwendet wurde. Aus der Masse an Ni kann der Gehalt an Ni in der Münze berechnet werden: 100% = wt%( coin) Der molare Prozentgehalt wird wie folgt berechnet: M ( *100% = mol% Ni coin) + M ( Cu) M ( 1.3 Methode der Iodometrie Die Iodometrie ist eine Redoxtitration zur analytischen Bestimmung von chemischen Substanzen (in unserem Fall Cu) mit Hilfe von Iod. Das freie Iod hat eine oxidierende, das Iodid-Ion eine reduzierende Wirkung. Die Stöchiometrie des schwer löslichen Komplexes (CuI) muss dabei bekannt sein Bildung des Kupferiodid Wenn man zu den Kupferionen einen Überschuss an Iodid-Anionen beifügt bildet sich das schwerlösliche Kupferiodid. Dieser Feststoff fällt als gelblichweisser Niederschlag aus. [1] (1) Cu I - CuI + I 1.3. Titration mit Thiosulfat Das gebildete Iod wird mit einer Thiosulfatlösung spezifisch titriert. Dabei verschiebt sich das Gleichgewicht der obigen Reaktion gemäss Le Chatelier nach rechts. Die Titration ist beendet wenn alle Kupferionen zu Kupferiodid umgewandelt wurden und kein Iod mehr entsteht. [1] () I + S O 3 - I - + S 4 O 6 - Parallel dazu bildet sich folgendes Gleichgewicht: David Weibel / Carlo Weingart - 3 -
5 (3) I + I - (aq) I 3 - Die Triiodid-Anionen sind an ihrer sehr kräftigen braun-roten Farbe erkennbar. Wenn kein Iod mehr vorhanden ist, gibt es auch kein Triiodid mehr und die Lösung erscheint farblos Berechnung Die Gleichungen (1) und () zeigen dass pro mol Kupfer gleich viel mol Thiosulfat reagiert. Deshalb kann man den Gehalt an Kupfer der Münze direkt berechnen: n( Na ) * S O3 M ( Cu) *10 *100% = wt%( Cu) Münze) M(Cu) = g/mol Die Stoffmenge an Thiosulfat muss mit dem Faktor 10 multipliziert werden, weil pro Messung nur 10% der Lösung verwendet wurde. 1.4 Fehlerrechnung Der Mittelwert wurde wie folgt berechnet: 1 m = * n n= Anzahl Werte, x= Werte n x i i= 1 Die Standardabweichung wurde aus dem Mittelwert gemäss folgender Formel berechnet: s = n i= 1 ( x i a) n Leitstoffe Die Leitstoffe dieses Versuches waren Kupfer und Nickel aus den jeweiligen Münzen. Auch Salpetersäure, konzentrierte Salzsäure, Dimethylglyoxim, und Natriumthiosulfat wurden verwendet. 1.6 Hypothese 1. Mit der Methode der Gravimetrie sollte es möglich sein den Nickelgehalt einer Münze zu bestimmen. Wenn man das genaue Gewicht der Münze kennt sollte man dann den prozentualen Gehalt berechnen können. David Weibel / Carlo Weingart - 4 -
6 . Wenn man mit Hilfe der Iodometrie die Menge an Kupfer in einer Lösung exakt bestimmen kann sollte es möglich sein den prozentualen Gehalt an Kupfer in einer 10 Cent Euro Münze zu berechnen. Material und Methode.1 Gravimetrie.1.1 Material Für dieses Experiment wurde eine 10 Rappen Münze analysiert. Sie wurde mit 15M (65%) Salpetersäure (HNO 3 ) und 1M Salzsäure (HCL) aufgelöst. Weiter benötigte man 00g/l Weinsäure (C 4 H 6 O 6 ) und 00g/l Natriumthiosulfat (Na S O 3 ) für die Maskierung und Komplexbildung des Kupfers. Danach wurde M HCL, 5wt% Ammoniumhydroxid (NH 4 OH) und 00g/l Ammoniumacetat (NH 3 CH 3 COO) benötigt um den ph der Lösung einzustellen. Schliesslich verwendete man Dimethylglyoxime (10g in 1l Ethanol) um den Nickel-Komplex zu bilden..1. Methode Auflösung der Münze / Herstellung der Stammlösung: Zuerst wurde die Münze mit Aceton gewaschen und mit einem Papiertuch getrocknet. Anschliessend hat man auf der digitalen Waage die Masse bestimmt. Die Münze wird in ein 400ml Becherglas gegeben und 0ml Salpetersäure zugefügt. Dabei wurde langsam erhitzt bis sie nach 0min. anfängt zu sieden. Danach wird so lange Salzsäure zugegeben bis keine nitrosen Gase mehr entweichen. Die Metallionen sind nun in einer blau-grünen Lösung gelöst. Die erhaltne Lösung wird nun in einen 1000ml Messkolben gegeben. Das Becherglas wird dabei mehrmals mit entionisiertem Wasser ausgewaschen und ebenfalls in den Messkolben gegeben. Anschliessend hat man den Messkolben mit entionisiertem Wasser aufgefüllt. Bestimmung des Nickelgehalts: 00ml der Stammlösung wurde in ein 600ml Becherglas gegeben. Dann hat man 5ml der Weinsäure dazugegeben. Ab jetzt wird mit dem ph-meter gearbeitet. Es wird Ammoniumhydroxid dazugegeben bis die Lösung leicht alkalisch reagiert. Jetzt gibt man Salzsäure dazu, bis die Lösung einen ph von 3-5 aufweist. Das Becherglas wird mit entionisiertem Wasser aufgefüllt bis 400ml. Die Lösung wird dann auf exakt 45 C aufgeheizt und danach gibt man 15ml Natriumthiosulfat dazu. Das Kupfer wurde während einer 15min. Wartezeit maskiert. Danach gibt man 40ml 1% DMG sowie 40ml Ammoniumacetat dazu (ph 6.5-7). Die dunkelrote Lösung wurde unter rühren während 30min abgekühlt. Dieser Vorgang wurde mit zwei weiteren 600ml Bechergläsern wiederholt. David Weibel / Carlo Weingart - 5 -
7 Drei Keramiknutschen wurden gewogen und beschriftet. Dann wurden die erstellten Lösungen mit jeweils einer Nutsche gefiltert. Dabei bleibt der Ni- Komplex im Filter zurück und dieser wurde über Nacht in den Trockenofen gestellt (110 C). Die Keramiknutschen wurden dann erneut gewogen.. Iodometrie..1 Material Die Leitsubstanz in diesem Experiment war eine 10 Cent Euro Münze von Irland. Die Münze wurde in 15M Salpetersäure (HNO 3 ) und konzentrierter Schwefelsäure (H SO 4 95% - 97%) aufgelöst. Für die iodometrische Bestimmung des Kupfers wurde eine Stärkelösung (0.g/l), festes Kaliumiodid, Harnstoff-Lösung (CH 4 N O 100g/l) und Natriumthiosulfat Lösung (Na S O 3 0.M) verwendet... Methode Herstellung der Stammlösung: Die Münze wurde in ein 50ml Becherglas gegeben und 0ml Salpetersäure dazugegeben. Stickoxide steigen als rot-brauner Rauch auf. Der blaue Niederschlag am Becherrand wurde mit entionisiertem Wasser heruntergewaschen. Sobald keine Stickoxide mehr aufstiegen wurden 0ml Schwefelsäure dazugegeben. Die Lösung hat man nun bis zum Sieden langsam erhitzt um die letzten NO x aus der Lösung zu entfernen. Danach wurde die Lösung auf Raumtemperatur abgekühlt. Die erhaltene Lösung wird in einen 50ml Messkolben gegeben. Das Becherglas wurde mit entionisiertem Wasser mehrmals ausgespült und ebenfalls in den Messkolben gegeben. Danach wurde der Messkolben aufgefüllt. Titration: Mit der Vollpipette wurden5ml der Stammlösung in einen 100ml Erlenmeyerkolben gegeben. Man hat 10ml der Harnstofflösung dazugegeben und auf den Magnetrührer gestellt. Nach 5 Minuten wurde g Kaliumiodid dazugegeben, worauf sich braun-grüner Niederschlag bildete. Dieser liess man sedimentieren. Man hat danach mit der langsamen Titration mit Natriumthiosulfat begonnen. Sobald die Lösung nur noch leicht gelb war, hat man ml Stärkelösung dazugegeben. Die Lösung verfärbte sich blau bis violett. Jetzt wurde die Titration nur noch Tropfenweise weitergeführt. Die Titration war beendet, sobald die Oberfläche farblos war oder sich leicht weiss verfärbte. David Weibel / Carlo Weingart - 6 -
8 3 Resultate 3.1 Gravimetrie Tabelle 1: Das Gewicht und theoretischer Ni-Gehalt der Münze Theoretischer wt% Theoretischer Gehalt an Alter Ni in der Münze [] Gewicht nach Reinigung Nickel Münze %.974 ± g ± g Tabelle 1 zeigt das gemessene Gewicht nach der Reinigung mit Aceton (.974g), sowie den theoretischen Gehalt an Nickel von 0.744g, respektive 5%. Tabelle : Berechnete Massen, wt% und Mol% Ni der drei Proben inkl. Fehlerrechnung 1. Probe. Probe 3. Probe Durchschnitt Standardabweichung Ni(HDMG) ) ± [g] [g] Wt% Ni [%] Mol% Ni [%] Der Gehalt an Nickel in Massenprozenten beträgt bei der ersten Probe 4.11, bei der zweiten.19 und bei der dritten einen massiv tieferen Wert von Iodometrie Tabelle 3: Gewicht, Alter, Herkunft und theoretischer Kupfergehalt der Münze Alter, Theoretischer wt% Cu in der Gewicht der Theoretischer Herkunftsland Münze [3] Münze Gehalt an Kupfer Münze Ireland % ± 0.001g ± 0.001g Die irische Münze hat einen theoretischen Kupfergehalt von 3.641g, respektive 89%. (Tab 3) Tabelle 4: Berechneter Kupfergehalt der drei Proben inkl. Fehlerrechnung 1. Probe. Probe 3. Probe Durchschnitt Standardabweichung V(Na S O 3 ) ± 0.1 [ml] C(Na S O 3 ) [mol/l] Cu) ± [g] Wt% Cu [%] Die Massen des erhaltenen Kupfer betragen zwischen 5.85 und 6.1g. Die Standardabweichung beträgt dabei nur Der durchschnittliche Wert für den massenprozentualen Anteil an Kupfer beträgt 140%. David Weibel / Carlo Weingart - 7 -
9 4 Diskussion 4.1 Gravimetrie Vergleich der Resultate mit der Hypothese Im Verlaufe des Versuchs konnten wir die Hypothese bestätigen. Mit Hilfe der Gravimetrie bestimmten wir in den drei Proben einen Durchschnittswert von 1.70 wt% Ni in der Münze. Dieser Wert war recht nahe am theoretisch exakten Wert von 5 wt%. Die erste Probe wich sogar nur 0.89% vom theoretischen Wert ab Kritische Beurteilung & Verbesserung Die im Vergleich zu den anderen beiden Proben grosse Abweichung der dritten Probe vom exakten Wert (6. wt%) lässt sich folgendermassen erklären. Die dritte Probe hatte viel weniger Zeit um die Ni-Komplexe zu bilden. Vielleicht wurde nicht alles Ni in der Lösung komplexiert. Da die Resultate doch recht exakt zu sein scheinen, sollte man nichts an dem Versuch verändern. 4. Iodometrie 4..1 Vergleich der Resultate mit der Hypothese Die Hypothese konnte nicht bestätigt werden. Die Resultate bezüglich des Kupferanteils in der Münze waren nicht zuverlässig. Somit kann man sagen, dass mit der Iodometrie der Kupfergehalt unserer Münze nicht ermittelt werden konnte. 4.. Kritische Beurteilung & Verbesserung In diesem Experiment hat man im Durchschnitt einen Kupferanteil von wt% erhalten. Dieser Wert ist natürlich vollkommen unmöglich und weicht sehr stark vom theoretischen Kupfergehalt in der Münze von 89 wt% ab. Obwohl die erhaltenen Werte für die drei Proben alle viel zu hoch waren, sind sie doch sehr nahe beieinander. Dies zeigt auch die kleine Standardabweichung von 3.1. Dies lässt sich folgendermassen erklären: Während der Titration wurde so viel Natriumthiosulfat hinzugegeben, bis die gesamte Lösung eine klare bis weissliche Farbe erhielt. Das war nicht korrekt, da anstelle der gesamten Lösung nur die oberste Schicht eine klare Farbe erhalten sollte. Wir haben diesen Punkt in der Versuchsanleitung missverstanden. Um sagen zu können, was man an dem Versuch verbessern könnte müsste man zuerst den Versuch nochmals durchführen. So könnte man sehen was für Resultate die Methode liefert, wenn die Titration am richtigen Zeitpunkt gestoppt wird. Da die Iodometrie eine sehr genaue Methode ist, sollten eigentlich die Resultate dann viel exakter herauskommen. David Weibel / Carlo Weingart - 8 -
10 5 Quellen [1] Versuchsvorschrift zum Versuch Gravimetrie und Iodometrie, Praktikum I, Peter Walde 005 [] besucht am [3] besucht am David Weibel / Carlo Weingart - 9 -
Quantitative Bestimmung des Nickel- und Kupfergehalts in Münzen durch Gravimetrie und Redoxtitration
 Praktikum I, WS 05/06 Versuch 4-02.02.2006 Quantitative Bestimmung des Nickel- und Kupfergehalts in Münzen durch Gravimetrie und Redoxtitration Zahner Michele (zahnerm@student.ethz.ch) Büchi Luca (lbuechi@student.ethz.ch)
Praktikum I, WS 05/06 Versuch 4-02.02.2006 Quantitative Bestimmung des Nickel- und Kupfergehalts in Münzen durch Gravimetrie und Redoxtitration Zahner Michele (zahnerm@student.ethz.ch) Büchi Luca (lbuechi@student.ethz.ch)
Gravimetrie und Redoxtitration
 Praktikum I, Teil Chemie HS 2008/09 Versuch 4; 5.11.2008 Quantitative Bestimmung des Nickel- und Kupfergehaltes in Münzen durch Gravimetrie und Redoxtitration Verfasser: Philippe Knüsel (pknuesel@student.ethz.ch)
Praktikum I, Teil Chemie HS 2008/09 Versuch 4; 5.11.2008 Quantitative Bestimmung des Nickel- und Kupfergehaltes in Münzen durch Gravimetrie und Redoxtitration Verfasser: Philippe Knüsel (pknuesel@student.ethz.ch)
Chemiepraktikum I, HS 2011, ETH Zürich. Bericht von: Nicole Schai Thomas Rölli Assistiert von:
 Chemiepraktikum I, HS 2011, ETH Zürich Versuch 4 Gravimetrie und Redoxtitration Bericht von: Nicole Schai (schain@student.ethz.ch) Thomas Rölli (roellit@student.ethz.ch) Assistiert von: Niklaus Kränzlin
Chemiepraktikum I, HS 2011, ETH Zürich Versuch 4 Gravimetrie und Redoxtitration Bericht von: Nicole Schai (schain@student.ethz.ch) Thomas Rölli (roellit@student.ethz.ch) Assistiert von: Niklaus Kränzlin
Quantitative Bestimmungen des Nickelund Kupfergehalte in Münzen durch Gravimetrie und Redoxtitration
 Chemie Praktikum Quantitative Bestimmungen des Nickelund Kupfergehalte in Münzen durch Gravimetrie und Redoxtitration WS 2006/2007 Verfasser: Lorenz Germann, Lukas Bischoff Versuchsteilnehmer: Lorenz Germann,
Chemie Praktikum Quantitative Bestimmungen des Nickelund Kupfergehalte in Münzen durch Gravimetrie und Redoxtitration WS 2006/2007 Verfasser: Lorenz Germann, Lukas Bischoff Versuchsteilnehmer: Lorenz Germann,
Säure-Base Titrationen
 Chemie Praktikum Säure-Base Titrationen WS 2006/2007 Verfasser: Lorenz Germann, Lukas Bischoff Versuchsteilnehmer: Lorenz Germann, Lukas Bischoff Datum: 29.11.2006 Assistent: Lera Tomasic E-mail: lukas-bischoff@student.ethz.ch
Chemie Praktikum Säure-Base Titrationen WS 2006/2007 Verfasser: Lorenz Germann, Lukas Bischoff Versuchsteilnehmer: Lorenz Germann, Lukas Bischoff Datum: 29.11.2006 Assistent: Lera Tomasic E-mail: lukas-bischoff@student.ethz.ch
Versuchsprotokoll Grundpraktikum Analytische Chemie WS 09/10. V1/3: Iodometrie Iodometrische Bestimmung von Iodat und Kupfer
 Versuchsprotokoll Grundpraktikum Analytische Chemie WS 09/10 V1/: Iodometrie Iodometrische Bestimmung von Iodat und Kupfer Versuchsdurchführung: 26.02.2010 Protokollabgabe: 01.0.2010 durchgeführt von:
Versuchsprotokoll Grundpraktikum Analytische Chemie WS 09/10 V1/: Iodometrie Iodometrische Bestimmung von Iodat und Kupfer Versuchsdurchführung: 26.02.2010 Protokollabgabe: 01.0.2010 durchgeführt von:
Chemisches Grundpraktikum Nickelbestimmung im Stahl
 im Stahl Analytischer Versuch von: Alexander Treter und Romina Dörig Abstract: Es wurde Stahl aufgeschlossen und der Nickelanteil bestimmt. Wir erhielten einen Anteil von 11.3 % ±0.9 (n=4; 95%). Inhaltsverzeichnis
im Stahl Analytischer Versuch von: Alexander Treter und Romina Dörig Abstract: Es wurde Stahl aufgeschlossen und der Nickelanteil bestimmt. Wir erhielten einen Anteil von 11.3 % ±0.9 (n=4; 95%). Inhaltsverzeichnis
How To Determine The
 ZÜRCHER HCHSCHULE FÜR ANGEWANDTE WISSENSCHAFTEN DEPARTEMENT LIFE SCIENCES UND FACILITY MANAGEMENT INSTITUT FÜR CHEMIE UND BILGISCHE CHEMIE (ICBC) WÄDENSWIL Aufschluss von Legierungen Messing von Remo Badertscher
ZÜRCHER HCHSCHULE FÜR ANGEWANDTE WISSENSCHAFTEN DEPARTEMENT LIFE SCIENCES UND FACILITY MANAGEMENT INSTITUT FÜR CHEMIE UND BILGISCHE CHEMIE (ICBC) WÄDENSWIL Aufschluss von Legierungen Messing von Remo Badertscher
Analytische Chemie. B. Sc. Chemieingenieurwesen. 22. September 2017, 13 bis 16 Uhr. Dr. Stephanie Möller & Prof. Dr. Thomas Jüstel.
 Analytische Chemie B. Sc. Chemieingenieurwesen 22. September 2017, 13 bis 16 Uhr Dr. Stephanie Möller & Prof. Dr. Thomas Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des
Analytische Chemie B. Sc. Chemieingenieurwesen 22. September 2017, 13 bis 16 Uhr Dr. Stephanie Möller & Prof. Dr. Thomas Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des
3. Praktikumstag. Elektro- und Redoxchemie. Versuch 1.1: Qualitative Versuche zur Redoxchemie. Geräte: 2 Reagenzgläser
 Elektro- und Redoxchemie Versuch 1.1: Qualitative Versuche zur Redoxchemie Geräte: 2 Reagenzgläser Chemikalien: Fe-Nagel, Zn-Granalie, CuSO 4 -Lösung, SnCl 2 -Lösung Versuchsdurchführung: 3. Praktikumstag
Elektro- und Redoxchemie Versuch 1.1: Qualitative Versuche zur Redoxchemie Geräte: 2 Reagenzgläser Chemikalien: Fe-Nagel, Zn-Granalie, CuSO 4 -Lösung, SnCl 2 -Lösung Versuchsdurchführung: 3. Praktikumstag
Versuchsprotokoll Grundpraktikum Analytische Chemie WS 09/10. V1/4: Komplexometrische Bestimmung von Cobalt durch Rücktitration
 Versuchsprotokoll Grundpraktikum Analytische Chemie WS 09/10 V1/4: Komplexometrische Bestimmung von Cobalt durch Rücktitration Versuchsdurchführung: 18.01.2010 Protokollabgabe: 22.02.2010 durchgeführt
Versuchsprotokoll Grundpraktikum Analytische Chemie WS 09/10 V1/4: Komplexometrische Bestimmung von Cobalt durch Rücktitration Versuchsdurchführung: 18.01.2010 Protokollabgabe: 22.02.2010 durchgeführt
AnC I Protokoll: 3.4 Iodometrische Bestimmung von Ascorbinsäure (Vitamin C)" SS Analytische Chemie I. Versuchsprotokoll
 Analytische Chemie I Versuchsprotokoll 3.4 Iodometrische Bestimmung von Ascorbinsäure (Vitamin C) 1.! Theoretischer Hintergrund Bei dieser Redoxtitration wird Ascorbinsäure mit Hilfe von Triiodid oxidiert.
Analytische Chemie I Versuchsprotokoll 3.4 Iodometrische Bestimmung von Ascorbinsäure (Vitamin C) 1.! Theoretischer Hintergrund Bei dieser Redoxtitration wird Ascorbinsäure mit Hilfe von Triiodid oxidiert.
Protokoll Tag 4, Teil 1
 Protokoll Tag 4, Teil 1 D. Titrationsverfahren D.1. Einführung in die quantitative Analyse; D.2. Acidimetrie (Bestimmung der Konzentration einer Säure) Am heutigen letzten Tag des Praktikums geht es um
Protokoll Tag 4, Teil 1 D. Titrationsverfahren D.1. Einführung in die quantitative Analyse; D.2. Acidimetrie (Bestimmung der Konzentration einer Säure) Am heutigen letzten Tag des Praktikums geht es um
Analytische Chemie. B. Sc. Chemieingenieurwesen. 6. Juli 2016, Uhr. Prof. Dr. T. Jüstel & Stephanie Möller M.Sc.
 Analytische Chemie B. Sc. Chemieingenieurwesen 6. Juli 2016, 10.30 13.30 Uhr Prof. Dr. T. Jüstel & Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
Analytische Chemie B. Sc. Chemieingenieurwesen 6. Juli 2016, 10.30 13.30 Uhr Prof. Dr. T. Jüstel & Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
3. Praktikumstag. Elektro- und Redoxchemie. Versuch 1.1: Qualitative Versuche zur Redoxchemie. Geräte: 2 Reagenzgläser
 Elektro- und Redoxchemie Versuch 1.1: Qualitative Versuche zur Redoxchemie Geräte: 2 Reagenzgläser Chemikalien: Fe-Nagel, Zn-Granalie, CuSO 4 -Lösung, SnCl 2 -Lösung Versuchsdurchführung: 3. Praktikumstag
Elektro- und Redoxchemie Versuch 1.1: Qualitative Versuche zur Redoxchemie Geräte: 2 Reagenzgläser Chemikalien: Fe-Nagel, Zn-Granalie, CuSO 4 -Lösung, SnCl 2 -Lösung Versuchsdurchführung: 3. Praktikumstag
Seminar zum Quantitativen Anorganischen Praktikum WS 2011/12
 Seminar zum Quantitativen Anorganischen Praktikum WS 2011/12 Teil des Moduls MN-C-AlC Dr. Matthias Brühmann Dr. Christian Rustige Inhalt Montag, 09.01.2012, 8-10 Uhr, HS III Allgemeine Einführung in die
Seminar zum Quantitativen Anorganischen Praktikum WS 2011/12 Teil des Moduls MN-C-AlC Dr. Matthias Brühmann Dr. Christian Rustige Inhalt Montag, 09.01.2012, 8-10 Uhr, HS III Allgemeine Einführung in die
Quantitativer, selektiver, eindeutiger, stöchiometrisch einheitlicher und rascher Reaktionsverlauf.
 Grundlage der Maßanalyse Quantitativer, selektiver, eindeutiger, stöchiometrisch einheitlicher und rascher Reaktionsverlauf. Was ist eine Maßlösung? Eine Lösung mit genau bekannter Konzentration mithilfe
Grundlage der Maßanalyse Quantitativer, selektiver, eindeutiger, stöchiometrisch einheitlicher und rascher Reaktionsverlauf. Was ist eine Maßlösung? Eine Lösung mit genau bekannter Konzentration mithilfe
Anorganisches Praktikum 1. Semester. FB Chemieingenieurwesen. Labor für Anorg. Chemie Angew. Materialwiss. Versuchsvorschriften
 Anorganisches Praktikum 1. Semester FB Chemieingenieurwesen Labor für Anorg. Chemie Angew. Materialwiss. Versuchsvorschriften 1 Gravimetrie Bestimmung von Nickel Sie erhalten eine Lösung, die 0.1-0.2g
Anorganisches Praktikum 1. Semester FB Chemieingenieurwesen Labor für Anorg. Chemie Angew. Materialwiss. Versuchsvorschriften 1 Gravimetrie Bestimmung von Nickel Sie erhalten eine Lösung, die 0.1-0.2g
Messung des Vitamin C Gehaltes in Orangen mit und ohne Schalen written by Cyril Hertz, 3dMN, 25.11.2004
 1. Fragestellung: Das Ziel des Versuches war, herauszufinden, ob sich die Ascorbinsäure 1 eher im Fruchtfleisch oder in der Schale von Orangen befindet. Zu diesem Zweck wurden Orangen mit und ohne Schale
1. Fragestellung: Das Ziel des Versuches war, herauszufinden, ob sich die Ascorbinsäure 1 eher im Fruchtfleisch oder in der Schale von Orangen befindet. Zu diesem Zweck wurden Orangen mit und ohne Schale
Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2004/
 Klausur zum Anorganisch-Chemischen Grundpraktikum vom 08.04.05 Seite 1 von 10 Punkte: von 84 Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2004/2005 08.04.2005 Matrikelnummer: Name:
Klausur zum Anorganisch-Chemischen Grundpraktikum vom 08.04.05 Seite 1 von 10 Punkte: von 84 Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2004/2005 08.04.2005 Matrikelnummer: Name:
Versuch Synthese von Kupfer(I)-oxid. Einleitung. Material und Methoden. Versuchsdurchführung
 Synthese von Kupfer(I)-oxid Versuch 3.16 Ausgehend von Kupfersulfat soll Kupfer(I)oxid gebildet werden. Kupfer(I) neigt in wässriger Lösung zur Disproportionierung und ist daher instabil. Die Gleichung
Synthese von Kupfer(I)-oxid Versuch 3.16 Ausgehend von Kupfersulfat soll Kupfer(I)oxid gebildet werden. Kupfer(I) neigt in wässriger Lösung zur Disproportionierung und ist daher instabil. Die Gleichung
Übungsaufgaben zu Ionenreaktionen in wässriger Lösung
 Übungsaufgaben zu Ionenreaktionen in wässriger Lösung 1) Berechnen Sie den phwert von folgenden Lösungen: a) 0.01 M HCl b) 3 10 4 M KOH c) 0.1 M NaOH d) 0.1 M CH 3 COOH (*) e) 0.3 M NH 3 f) 10 8 M HCl
Übungsaufgaben zu Ionenreaktionen in wässriger Lösung 1) Berechnen Sie den phwert von folgenden Lösungen: a) 0.01 M HCl b) 3 10 4 M KOH c) 0.1 M NaOH d) 0.1 M CH 3 COOH (*) e) 0.3 M NH 3 f) 10 8 M HCl
Dichlorobis(triphenylphosphin)nickel(II)
 Praktikum Org. und Anorg. Chemie II D-CHAB Wintersemester 04/05 Zürich, den 8. November 2004 Dichlorobis(triphenylphosphin)nickel(II) [Ni 2 ( ) 2 ] Ni 1 1. SYNTHESE 1.1 Methode [1] Nickel(II)chlorid reagiert
Praktikum Org. und Anorg. Chemie II D-CHAB Wintersemester 04/05 Zürich, den 8. November 2004 Dichlorobis(triphenylphosphin)nickel(II) [Ni 2 ( ) 2 ] Ni 1 1. SYNTHESE 1.1 Methode [1] Nickel(II)chlorid reagiert
H1 Bestimmung des Löslichkeitsprodukts von Magnesiumhydroxid
 H Löslichkeitsprodukt und Komplexgleichgewichte Auch bei den Komplex-Reaktionen beschäftigen wir uns im Wesentlichen mit Gleichgewichtsreaktionen, in denen Liganden ausgetauscht werden. Dabei sollen Kriterien
H Löslichkeitsprodukt und Komplexgleichgewichte Auch bei den Komplex-Reaktionen beschäftigen wir uns im Wesentlichen mit Gleichgewichtsreaktionen, in denen Liganden ausgetauscht werden. Dabei sollen Kriterien
Trisacetylacetonatoferrat(III) Fe(acac) 3
 Trisacetylacetonatoferrat(III) Fe(acac) 3 Mols, 21. 11. 2004 Marco Lendi, AC II 1. Synthese 1.1 Methode Wasserfreies Eisen(III)chlorid wird in wässriger, basischer Lösung durch Erhitzen in Eisen(III)hydroxid
Trisacetylacetonatoferrat(III) Fe(acac) 3 Mols, 21. 11. 2004 Marco Lendi, AC II 1. Synthese 1.1 Methode Wasserfreies Eisen(III)chlorid wird in wässriger, basischer Lösung durch Erhitzen in Eisen(III)hydroxid
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2009/10 vom
 Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2009/10 vom 18.09.2009 A1 A2 A3 A4 A5 Σ Note 10 10 10 10 10 NAME:... VORNAME:...MUSTERLÖSUNG... Pseudonym für Ergebnisveröffentlichung:... Schreiben
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2009/10 vom 18.09.2009 A1 A2 A3 A4 A5 Σ Note 10 10 10 10 10 NAME:... VORNAME:...MUSTERLÖSUNG... Pseudonym für Ergebnisveröffentlichung:... Schreiben
Das Iod-Verteilungsgleichgewicht. Online-Ergänzung
 Das Iod-Verteilungsgleichgewicht Ein problemorientierter Zugang zum chemischen Gleichgewicht zur Schulung der naturwissenschaftlichen Arbeitsweise im Chemieunterricht S. I S. I + II S. II HOLGER FLEISCHER
Das Iod-Verteilungsgleichgewicht Ein problemorientierter Zugang zum chemischen Gleichgewicht zur Schulung der naturwissenschaftlichen Arbeitsweise im Chemieunterricht S. I S. I + II S. II HOLGER FLEISCHER
Tris(acetylacetonato)eisen(III)
 Praktikum rg. und Anorg. Chemie II DCHAB Wintersemester 04/05 Zürich, den 15. November 2004 Tris(acetylacetonato)eisen(III) [Fe(acac) 3 ] Fe 1 1. SYNTHESE 1.1 Methode [1] Eisen(III)chlorid wird mit Ammoniak
Praktikum rg. und Anorg. Chemie II DCHAB Wintersemester 04/05 Zürich, den 15. November 2004 Tris(acetylacetonato)eisen(III) [Fe(acac) 3 ] Fe 1 1. SYNTHESE 1.1 Methode [1] Eisen(III)chlorid wird mit Ammoniak
Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2007/
 Klausur zum Anorganisch-Chemischen Grundpraktikum vom 28.03.08 Seite 1 von 12 Punkte: von 94 Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2007/2008 28.03.2008 Matrikelnummer: Name:
Klausur zum Anorganisch-Chemischen Grundpraktikum vom 28.03.08 Seite 1 von 12 Punkte: von 94 Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2007/2008 28.03.2008 Matrikelnummer: Name:
Tris(acetylacetonato)cobalt(III)
 Tris(acetylacetonato)cobalt(III) [Co(C5H7)3] Cobalt(III)acetylacetonat Zürich, 7. November 004 Raphael Aardoom, ACP 1 Synthese 1.1 Methode [1] Cobalt(II)carbonat reagiert mit Acetylaceton in Gegenwart
Tris(acetylacetonato)cobalt(III) [Co(C5H7)3] Cobalt(III)acetylacetonat Zürich, 7. November 004 Raphael Aardoom, ACP 1 Synthese 1.1 Methode [1] Cobalt(II)carbonat reagiert mit Acetylaceton in Gegenwart
Stoffe oder Teilchen, die Protonen abgeben kånnen, werden als SÄuren bezeichnet (Protonendonatoren).
 5 10 15 20 25 30 35 40 45 O C 50 Chemie Technische BerufsmaturitÄt BMS AGS Basel Kapitel 6 SÄuren und Basen Baars, Kap. 12.1; 12.2; 13 Versuch 1 Ein Becherglas mit Thermometer enthält violette FarbstofflÅsung
5 10 15 20 25 30 35 40 45 O C 50 Chemie Technische BerufsmaturitÄt BMS AGS Basel Kapitel 6 SÄuren und Basen Baars, Kap. 12.1; 12.2; 13 Versuch 1 Ein Becherglas mit Thermometer enthält violette FarbstofflÅsung
Studienbegleitende Prüfung Modul 12 Anorganisch-Chemisches Grundpraktikum WS 2002/
 Studienbegleitende Prüfung Modul 12 Anorganisch-Chemisches Grundpraktikum WS 2002/2003 22.04.2003 Name: Vorname: Matrikelnummer: Fachsemester: Punkte: Note: Frage 1 Welche Flammenfärbung zeigen folgende
Studienbegleitende Prüfung Modul 12 Anorganisch-Chemisches Grundpraktikum WS 2002/2003 22.04.2003 Name: Vorname: Matrikelnummer: Fachsemester: Punkte: Note: Frage 1 Welche Flammenfärbung zeigen folgende
Analytische Chemie. B. Sc. Chemieingenieurwesen. 10. Juli Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 10. Juli 2009 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 10. Juli 2009 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie. B. Sc. Chemieingenieurwesen. 7. März 2016, Uhr. Prof. Dr. Thomas Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer:
 Analytische Chemie B. Sc. Chemieingenieurwesen 7. März 2016, 8.00 11.00 Uhr Prof. Dr. Thomas Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
Analytische Chemie B. Sc. Chemieingenieurwesen 7. März 2016, 8.00 11.00 Uhr Prof. Dr. Thomas Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
Analytische Chemie. B. Sc. Chemieingenieurwesen. 19. März Prof. Dr. T. Jüstel, Stephanie Möller M.Sc. Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 19. März 2014 Prof. Dr. T. Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der
Analytische Chemie B. Sc. Chemieingenieurwesen 19. März 2014 Prof. Dr. T. Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der
Konzentrationsbestimmung mit Lösungen
 Kapitel 5 Konzentrationsbestimmung mit Lösungen Abb. 5.1: Die Farben von Universalindikatoren sind nützlich für Konzentrationsbestimmungen. Sie lernen auf den folgenden Seiten eine sehr nützliche Methode
Kapitel 5 Konzentrationsbestimmung mit Lösungen Abb. 5.1: Die Farben von Universalindikatoren sind nützlich für Konzentrationsbestimmungen. Sie lernen auf den folgenden Seiten eine sehr nützliche Methode
Analytische Chemie. B. Sc. Chemieingenieurwesen. 5. Februar Dr. Stephanie Möller, Prof. Dr. Thomas Jüstel. Matrikelnummer:
 Analytische Chemie B. Sc. Chemieingenieurwesen 5. Februar 2019 Dr. Stephanie Möller, Prof. Dr. Thomas Jüstel Name: Matrikelnummer: Geburtsdatum: Sowohl der Lösungsweg als auch die Endergebnisse sind korrekt
Analytische Chemie B. Sc. Chemieingenieurwesen 5. Februar 2019 Dr. Stephanie Möller, Prof. Dr. Thomas Jüstel Name: Matrikelnummer: Geburtsdatum: Sowohl der Lösungsweg als auch die Endergebnisse sind korrekt
3. Seminar zum Quantitativen Anorganischen Praktikum WS 2013/14
 3. Seminar zum Quantitativen Anorganischen Praktikum WS 2013/14 Teil des Moduls MN-C-AlC S. Sahler, M. Wolberg 20.01.14 Titrimetrie (Volumetrie) Prinzip: Messung des Volumenverbrauchs einer Reagenslösung
3. Seminar zum Quantitativen Anorganischen Praktikum WS 2013/14 Teil des Moduls MN-C-AlC S. Sahler, M. Wolberg 20.01.14 Titrimetrie (Volumetrie) Prinzip: Messung des Volumenverbrauchs einer Reagenslösung
AnC I Protokoll: 7.1 Synthese und Charakterisierung von Tetraamminkupfer(II)-sulfat! SS Analytische Chemie I.
 Analytische Chemie I Versuchsprotokoll 7.1 Synthese und Charakterisierung der Komplexverbindung Tetraamminkupfer(II)-sulfat 1.! Theoretischer Hintergrund Aus Kupfer(II)-sulfat und Ammoniak wird zunächst
Analytische Chemie I Versuchsprotokoll 7.1 Synthese und Charakterisierung der Komplexverbindung Tetraamminkupfer(II)-sulfat 1.! Theoretischer Hintergrund Aus Kupfer(II)-sulfat und Ammoniak wird zunächst
Vorpraktikum Grundoperationen im chemischen Laboratorium
 Vorpraktikum Grundoperationen im chemischen Laboratorium Stand: 23. April 2019 Inhalt: Volumetrische Messgeräte Säure-Base-Titration Analysenwaagen Fest-Flüssig-Trennverfahren Wasserlöslichkeit Verdünnung
Vorpraktikum Grundoperationen im chemischen Laboratorium Stand: 23. April 2019 Inhalt: Volumetrische Messgeräte Säure-Base-Titration Analysenwaagen Fest-Flüssig-Trennverfahren Wasserlöslichkeit Verdünnung
Säure-Base-Titrationen
 Martin Raiber Chemie Protokoll Nr.3 19.2.2006 Säure-Base-Titrationen 1. Titration von Salzsäure mit Natronlauge Chemikalien: Salzsäure (100ml; c(hcl)=0,1 mol/l) Natronlauge (c(naoh)=1 mol/l) Bromthymolblau
Martin Raiber Chemie Protokoll Nr.3 19.2.2006 Säure-Base-Titrationen 1. Titration von Salzsäure mit Natronlauge Chemikalien: Salzsäure (100ml; c(hcl)=0,1 mol/l) Natronlauge (c(naoh)=1 mol/l) Bromthymolblau
Technische Universität Chemnitz Chemisches Grundpraktikum
 Technische Universität Chemnitz Chemisches Grundpraktikum Protokoll «CfP4 - Gesamtanalyse» Martin Wolf Betreuerin: Frau Sachse Datum: 05.05.2006 8:00 Uhr bis 12:00 Uhr
Technische Universität Chemnitz Chemisches Grundpraktikum Protokoll «CfP4 - Gesamtanalyse» Martin Wolf Betreuerin: Frau Sachse Datum: 05.05.2006 8:00 Uhr bis 12:00 Uhr
Anorganisches Praktikum 1. Semester. FB Chemieingenieurwesen. Labor für Anorg. Chemie Angew. Materialwiss. Versuchsvorschriften
 Anorganisches Praktikum 1. Semester FB Chemieingenieurwesen Labor für Anorg. Chemie Angew. Materialwiss. Versuchsvorschriften 1 Gravimetrie Bestimmung von Nickel Sie erhalten eine Lösung, die 0.1-0.2g
Anorganisches Praktikum 1. Semester FB Chemieingenieurwesen Labor für Anorg. Chemie Angew. Materialwiss. Versuchsvorschriften 1 Gravimetrie Bestimmung von Nickel Sie erhalten eine Lösung, die 0.1-0.2g
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 2,
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr., 6.04.11 1. Sie legen 100 ml einer 0, mol/l Natronlauge vor. Als Titrant verwenden Sie eine 0,8 mol/l Salzsäure. Berechnen
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr., 6.04.11 1. Sie legen 100 ml einer 0, mol/l Natronlauge vor. Als Titrant verwenden Sie eine 0,8 mol/l Salzsäure. Berechnen
CHEMIE-PRAKTIKUM FÜR MEDIZINER WS 2010/2011
 Universität Duisburg-Essen - Institut für Organische Chemie 1 CHEMIE-PRAKTIKUM FÜR MEDIZINER WS 2010/2011 1. Tag: Maßanalyse I Datum: Name: Kurs: Saal: Platz Nr. Theoret. Grundlagen: 1. Aufgabe: Titerstellung
Universität Duisburg-Essen - Institut für Organische Chemie 1 CHEMIE-PRAKTIKUM FÜR MEDIZINER WS 2010/2011 1. Tag: Maßanalyse I Datum: Name: Kurs: Saal: Platz Nr. Theoret. Grundlagen: 1. Aufgabe: Titerstellung
Chemiebuch Elemente Lösungen zu Aufgaben aus Kapitel 13
 Kantonsschule Kreuzlingen, Klaus Hensler Chemiebuch Elemente Lösungen zu Aufgaben aus Kapitel 13 Grundregeln für stöchiometrische Berechnungen Wenn es um Reaktionen geht zuerst die chem. Gleichung aufstellen
Kantonsschule Kreuzlingen, Klaus Hensler Chemiebuch Elemente Lösungen zu Aufgaben aus Kapitel 13 Grundregeln für stöchiometrische Berechnungen Wenn es um Reaktionen geht zuerst die chem. Gleichung aufstellen
Aufgabe Punkte (je 10) Anorganisches Grund-Praktikum (Poly-BSc/Lehramt) Abschlußklausur (Nachklausur) Name: Vorname: Matrikel-Nr.
 Aufgabe 1 2 3 4 5 6 7 8 9 10 Punkte (je 10) Ich bin damit einverstanden, dass mein Klausurergebnis unter Angabe der Matrikelnummer im Web bekanntgegeben wird: Anorganisches Grund-Praktikum (Poly-BSc/Lehramt)
Aufgabe 1 2 3 4 5 6 7 8 9 10 Punkte (je 10) Ich bin damit einverstanden, dass mein Klausurergebnis unter Angabe der Matrikelnummer im Web bekanntgegeben wird: Anorganisches Grund-Praktikum (Poly-BSc/Lehramt)
Protokoll 2. Labor für Physikalische Chemie. Modul IV. Versuch 6
 Protokoll 2 Labor für Physikalische Chemie Modul IV Versuch 6 Herstellung einer Titerbestimmung von 500mL einer Salzsäure Maßlösung mit der Äquivalentkonzentration c(hcl) = 0,1 mol/l Fachbereich MT 1 Wintersemester
Protokoll 2 Labor für Physikalische Chemie Modul IV Versuch 6 Herstellung einer Titerbestimmung von 500mL einer Salzsäure Maßlösung mit der Äquivalentkonzentration c(hcl) = 0,1 mol/l Fachbereich MT 1 Wintersemester
Chemisches Praktikum für Biologen
 Chemisches Praktikum für Biologen Klausur am 13.02.2015 Name: Vorname: Matrikelnummer: Aufgabe Maximale Punktzahl Erreichte Punktzahl 1 3 2 3 3 3 4 3 5 3 6 3 7 3 8 3 Gesamt 24 Bestanden: Die Klausur besteht
Chemisches Praktikum für Biologen Klausur am 13.02.2015 Name: Vorname: Matrikelnummer: Aufgabe Maximale Punktzahl Erreichte Punktzahl 1 3 2 3 3 3 4 3 5 3 6 3 7 3 8 3 Gesamt 24 Bestanden: Die Klausur besteht
Chloro(triphenylphosphin)gold(I)
 raktikum Org. und Anorg. Chemie II D-CHAB Wintersemester 04/05 Zürich, den 1. März 2005 [(h 3 )] 1 1. SYNTHESE 1.1 Methode [1] Elementares Gold wird mit Königswasser aufgeschlossen und durch Zugabe von
raktikum Org. und Anorg. Chemie II D-CHAB Wintersemester 04/05 Zürich, den 1. März 2005 [(h 3 )] 1 1. SYNTHESE 1.1 Methode [1] Elementares Gold wird mit Königswasser aufgeschlossen und durch Zugabe von
Analytische Chemie. B. Sc. Chemieingenieurwesen. 15. März 2017, Uhr. Prof. Dr. Thomas Jüstel, Dr. Stephanie Möller.
 Analytische Chemie B. Sc. Chemieingenieurwesen 15. März 2017, 12.30 15.30 Uhr Prof. Dr. Thomas Jüstel, Dr. Stephanie Möller Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
Analytische Chemie B. Sc. Chemieingenieurwesen 15. März 2017, 12.30 15.30 Uhr Prof. Dr. Thomas Jüstel, Dr. Stephanie Möller Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
Versuchsprotokoll Grundpraktikum Analytische Chemie WS 09/10. V2/3: Coulometrie. Coulometrische Titration von Ascorbinsäure
 Versuchsprotokoll Grundpraktikum Analytische Chemie WS 09/10 V2/3: Coulometrie Coulometrische Titration von Ascorbinsäure Versuchsdurchführung: 01.03.2010 Protokollabgabe: 03.03.2010 durchgeführt von:
Versuchsprotokoll Grundpraktikum Analytische Chemie WS 09/10 V2/3: Coulometrie Coulometrische Titration von Ascorbinsäure Versuchsdurchführung: 01.03.2010 Protokollabgabe: 03.03.2010 durchgeführt von:
Klausur in Anorganischer Chemie
 1 Klausur in Anorganischer Chemie zum Praktikum Chemie für Biologen, SS2000 Kurse SS Sa 20.05.2000 Name:... Vorname:... Wenn Nachschreiber aus einem der Vorkurse, bitte eintragen: Geb. am in Semester des
1 Klausur in Anorganischer Chemie zum Praktikum Chemie für Biologen, SS2000 Kurse SS Sa 20.05.2000 Name:... Vorname:... Wenn Nachschreiber aus einem der Vorkurse, bitte eintragen: Geb. am in Semester des
Bis(acetylacetonato)kupfer(II) [Cu(acac) 2 ] Simon Weidmann D-CHAB; ETH Zürich H 196/175
![Bis(acetylacetonato)kupfer(II) [Cu(acac) 2 ] Simon Weidmann D-CHAB; ETH Zürich H 196/175 Bis(acetylacetonato)kupfer(II) [Cu(acac) 2 ] Simon Weidmann D-CHAB; ETH Zürich H 196/175](/thumbs/93/114329878.jpg) Bis(acetylacetonato)kupfer(II) [Cu(acac) 2 ] Cu Simon Weidmann D-CHAB; ETH Zürich H 196/175 ACP II Simon Weidmann H 196/175 1. Synthese [1] 1.1. Methode upfer(ii)chlorid und Acetylaceton reagieren in wässriger
Bis(acetylacetonato)kupfer(II) [Cu(acac) 2 ] Cu Simon Weidmann D-CHAB; ETH Zürich H 196/175 ACP II Simon Weidmann H 196/175 1. Synthese [1] 1.1. Methode upfer(ii)chlorid und Acetylaceton reagieren in wässriger
AnC I Protokoll: 5.5 Simultanbestimmung von Bi/Pb! SS Analytische Chemie I. Versuchsprotokoll. 5.5 Simultanbestimmung von Bi/Pb
 Analytische Chemie I Versuchsprotokoll 5.5 Simultanbestimmung von Bi/Pb.! Theoretischer Hintergrund Bi 3+ und Pb 2+ werden nebeneinander bestimmt. Bismut(III) bildet bereits im Sauren einen EDTA-Komplex,
Analytische Chemie I Versuchsprotokoll 5.5 Simultanbestimmung von Bi/Pb.! Theoretischer Hintergrund Bi 3+ und Pb 2+ werden nebeneinander bestimmt. Bismut(III) bildet bereits im Sauren einen EDTA-Komplex,
Kaliumdioxalatocuprat(II)- dihydrat
 Kaliumdioxalatocuprat(II)- dihydrat K[Cu(C4)]H Zürich, 17. November 004 Raphael Aardoom, ACP 300 o C 00 50 150 50 ml 100 A N AUS AN AUS 1000 50 ml 0 U/min 1500 50 750 500 1 Synthese 1.1 Methode [1] Kupfer(II)sulfat-pentahydrat
Kaliumdioxalatocuprat(II)- dihydrat K[Cu(C4)]H Zürich, 17. November 004 Raphael Aardoom, ACP 300 o C 00 50 150 50 ml 100 A N AUS AN AUS 1000 50 ml 0 U/min 1500 50 750 500 1 Synthese 1.1 Methode [1] Kupfer(II)sulfat-pentahydrat
Versuch 3: Säure-Base Titrationen Chemieteil, Herbstsemester 2008
 Versuch 3: Säure-Base Titrationen Chemieteil, Herbstsemester 2008 Verfasser: Zihlmann Claudio Teammitglied: Knüsel Philippe Datum: 29.10.08 Assistent: David Weibel E-Mail: zclaudio@student.ethz.ch 1. Abstract
Versuch 3: Säure-Base Titrationen Chemieteil, Herbstsemester 2008 Verfasser: Zihlmann Claudio Teammitglied: Knüsel Philippe Datum: 29.10.08 Assistent: David Weibel E-Mail: zclaudio@student.ethz.ch 1. Abstract
Handbuch zum Chemischen Praktikum für Studierende der Human- und Zahnmedizin. Steffen Blaurock Thomas Zimmermann
 Handbuch zum Chemischen Praktikum für Studierende der Human- und Zahnmedizin Steffen Blaurock Thomas Zimmermann 1.1 Einleitung Titrationen werden in der chemischen Analytik durchgeführt, um die Stoffmenge
Handbuch zum Chemischen Praktikum für Studierende der Human- und Zahnmedizin Steffen Blaurock Thomas Zimmermann 1.1 Einleitung Titrationen werden in der chemischen Analytik durchgeführt, um die Stoffmenge
Abschlußklausur (Nachklausur)
 Aufgabe 1 2 3 4 5 6 7 8 9 10 Punkte (je 10) Ich bin damit einverstanden, dass mein Klausurergebnis unter Angabe der Matrikelnummer im Web bekanntgegeben wird: Anorganisches Grund-Praktikum (Lehramt) Abschlußklausur
Aufgabe 1 2 3 4 5 6 7 8 9 10 Punkte (je 10) Ich bin damit einverstanden, dass mein Klausurergebnis unter Angabe der Matrikelnummer im Web bekanntgegeben wird: Anorganisches Grund-Praktikum (Lehramt) Abschlußklausur
Versuchsprotokoll:Stärkespaltung
 Versuchsprotokoll:Stärkespaltung Zeitaufwand: Aufbau: 5 Minuten Durchführung: 20 Minuten Abbau/Entsorgung:: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol Schuleinsatz Pentahydrat
Versuchsprotokoll:Stärkespaltung Zeitaufwand: Aufbau: 5 Minuten Durchführung: 20 Minuten Abbau/Entsorgung:: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol Schuleinsatz Pentahydrat
Kalium 13-vanadonickelat(IV) K 7 [NiV 13 O 38 ]*16 H 2 0
![Kalium 13-vanadonickelat(IV) K 7 [NiV 13 O 38 ]*16 H 2 0 Kalium 13-vanadonickelat(IV) K 7 [NiV 13 O 38 ]*16 H 2 0](/thumbs/79/80348146.jpg) K 7 [NiV 13 O 38 ]*16 H 0 Zürich, 03.0.004 1 SYNTHESE 1.1 Methode Kaliumcarbonat und Vanadiumpentoxid reagieren in Wasser zu Kaliummetavanadat. Kaliummetavanadat und Nickelsulfat in Wasser reagieren in
K 7 [NiV 13 O 38 ]*16 H 0 Zürich, 03.0.004 1 SYNTHESE 1.1 Methode Kaliumcarbonat und Vanadiumpentoxid reagieren in Wasser zu Kaliummetavanadat. Kaliummetavanadat und Nickelsulfat in Wasser reagieren in
Analytische Chemie. B. Sc. Chemieingenieurwesen. 13. Juli 2017, Uhr. Prof. Dr. T. Jüstel, Dr. Stephanie Möller.
 Analytische Chemie B. Sc. Chemieingenieurwesen 13. Juli 2017, 8.30 11.30 Uhr Prof. Dr. T. Jüstel, Dr. Stephanie Möller Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
Analytische Chemie B. Sc. Chemieingenieurwesen 13. Juli 2017, 8.30 11.30 Uhr Prof. Dr. T. Jüstel, Dr. Stephanie Möller Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
Praktikum Chemie für Mediziner und Zahnmediziner 125
 Praktikum Chemie für Mediziner und Zahnmediziner 125 10. Studieneinheit Lernziele Endotherme und exotherme Prozesse Temperaturabhängige Verschiebung von Gleichgewichten Zeitlicher Verlauf chemischer Reaktionen
Praktikum Chemie für Mediziner und Zahnmediziner 125 10. Studieneinheit Lernziele Endotherme und exotherme Prozesse Temperaturabhängige Verschiebung von Gleichgewichten Zeitlicher Verlauf chemischer Reaktionen
Was ist eine Titration?
 Was ist eine Titration? Von Kathrin Brcic Kostic Die Titration ist eines der vielen quantitativen Bestimmungsverfahren für gelöste Substanzen. Hierbei wird die Menge einer in einem Lösungsmittel gelösten
Was ist eine Titration? Von Kathrin Brcic Kostic Die Titration ist eines der vielen quantitativen Bestimmungsverfahren für gelöste Substanzen. Hierbei wird die Menge einer in einem Lösungsmittel gelösten
Ansatzwerte: SurTec 691 I Ansatzlösung 8 Vol% (7-9 Vol%) SurTec 691 II Ansatzadditiv 2 Vol% (1,5-3 Vol%)
 SurTec 691 Schwarzpassivierung für alkalische Zinküberzüge Eigenschaften Chrom(VI)-freie Schwarzpassivierung auf Basis von dreiwertigem Chrom speziell entwickelt für die Beschichtung von Massenware erzeugt
SurTec 691 Schwarzpassivierung für alkalische Zinküberzüge Eigenschaften Chrom(VI)-freie Schwarzpassivierung auf Basis von dreiwertigem Chrom speziell entwickelt für die Beschichtung von Massenware erzeugt
Technische Universität Chemnitz Chemisches Grundpraktikum
 Technische Universität Chemnitz Chemisches Grundpraktikum Protokoll «CfP5 - Massanalytische Bestimmungsverfahren (Volumetrie)» Martin Wolf Betreuerin: Frau Sachse Datum:
Technische Universität Chemnitz Chemisches Grundpraktikum Protokoll «CfP5 - Massanalytische Bestimmungsverfahren (Volumetrie)» Martin Wolf Betreuerin: Frau Sachse Datum:
1. Manganometrie 1.1. E 0 (MnO 4 - /MnO 2 ) = +1,68V. Das violette Permanganat wird hierbei zu braunem Mangandioxid (Braunstein) umgewandelt.
 1. Manganometrie 1.1 Manganometrie 1 Die Manganometrie ist ein wichtiges Analyseverfahren zur Bestimmung der Konzentration von reduzierenden Substanzen. Bei der Manganometrischen Konzentrationsbestimmung
1. Manganometrie 1.1 Manganometrie 1 Die Manganometrie ist ein wichtiges Analyseverfahren zur Bestimmung der Konzentration von reduzierenden Substanzen. Bei der Manganometrischen Konzentrationsbestimmung
Analytische Chemie. B. Sc. Chemieingenieurwesen. 11. Februar Prof. Dr. T. Jüstel, Stephanie Möller M.Sc. Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 11. Februar 2014 Prof. Dr. T. Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der
Analytische Chemie B. Sc. Chemieingenieurwesen 11. Februar 2014 Prof. Dr. T. Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der
!!! NEUE ÖAB-MONOGRAPHIE!!!
 !!! NEUE ÖAB-MONOGRAPHIE!!! Die folgende neue Monographie ist für die Aufnahme in das ÖAB (österreichisches Arzneibuch) vorgesehen. Stellungnahmen zu diesem Gesetzesentwurf sind bis zum 31.01.2015 an folgende
!!! NEUE ÖAB-MONOGRAPHIE!!! Die folgende neue Monographie ist für die Aufnahme in das ÖAB (österreichisches Arzneibuch) vorgesehen. Stellungnahmen zu diesem Gesetzesentwurf sind bis zum 31.01.2015 an folgende
Analytische Chemie. B. Sc. Chemieingenieurwesen. 11. September Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 11. September 2013 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 11. September 2013 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Stöchiometrie-Seminar April 2019 Moritz Helmstädter 1
 Stöchiometrie-Seminar 4 1 Themen des heutigen Seminars 1) Zusammenfassung des letzten Seminars 2) Besprechung der Hausaufgaben 3) Theorie 4) Übungsaufgaben 2 Themen des heutigen Seminars 1) Zusammenfassung
Stöchiometrie-Seminar 4 1 Themen des heutigen Seminars 1) Zusammenfassung des letzten Seminars 2) Besprechung der Hausaufgaben 3) Theorie 4) Übungsaufgaben 2 Themen des heutigen Seminars 1) Zusammenfassung
Analytische Chemie. B. Sc. Chemieingenieurwesen. 13. September 2016, Uhr. Prof. Dr. Thomas Jüstel, Stephanie Möller M.Sc.
 Analytische Chemie B. Sc. Chemieingenieurwesen 13. September 2016, 8.00 11.00 Uhr Prof. Dr. Thomas Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe
Analytische Chemie B. Sc. Chemieingenieurwesen 13. September 2016, 8.00 11.00 Uhr Prof. Dr. Thomas Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe
WEGE ZUR BESTIMMUNG EINER SÄURE:
 WEGE ZUR BESTIMMUNG EINER SÄURE: "BESTIMMUNG DES SÄUREGEHALTS IN EINEM HAUSHALTSESSIG" Bestimmung des Säuregehalts in Haushaltsessig In den letzten Chemiestunden versuchten wir, anhand von mehreren Möglichkeiten
WEGE ZUR BESTIMMUNG EINER SÄURE: "BESTIMMUNG DES SÄUREGEHALTS IN EINEM HAUSHALTSESSIG" Bestimmung des Säuregehalts in Haushaltsessig In den letzten Chemiestunden versuchten wir, anhand von mehreren Möglichkeiten
V 1 Ableiten des Zeitgesetzes für die Reduktion von Iodat-Ionen durch Iodid-Ionen (Landolt-Reaktion)
 V 1 Ableiten des Zeitgesetzes für die Reduktion von IodatIonen durch IodidIonen (LandoltReaktion) Bei diesem Versuch soll es darum gehen, das Geschwindigkeitsgesetz für die Landoltreaktion herzuleiten.
V 1 Ableiten des Zeitgesetzes für die Reduktion von IodatIonen durch IodidIonen (LandoltReaktion) Bei diesem Versuch soll es darum gehen, das Geschwindigkeitsgesetz für die Landoltreaktion herzuleiten.
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2016/17 vom
 Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2016/17 vom 23.09.2016 A1 A2 A3 A4 A5 Note 12 12 8 10 8 NAME:... VORNAME:... Stichpunkte zu den Lösungen Pseudonym für Ergebnisveröffentlichung:...
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2016/17 vom 23.09.2016 A1 A2 A3 A4 A5 Note 12 12 8 10 8 NAME:... VORNAME:... Stichpunkte zu den Lösungen Pseudonym für Ergebnisveröffentlichung:...
S YNTHESE 2: [Pd(OAc) 2 ] Diacetatopalladium(II) H 3 C. Zürich, WS 04/05 OACP
![S YNTHESE 2: [Pd(OAc) 2 ] Diacetatopalladium(II) H 3 C. Zürich, WS 04/05 OACP S YNTHESE 2: [Pd(OAc) 2 ] Diacetatopalladium(II) H 3 C. Zürich, WS 04/05 OACP](/thumbs/81/83411029.jpg) S YNTHESE 2: [Pd(OAc) 2 ] Diacetatopalladium(II) O O H 3 C Pd CH 3 O O Zürich, 14.11.2004 WS 04/05 OACP 2 D-CHA, ETHZ Raphael Sigrist - 1 - 1.1 Methode, Prinzip Palladium reagiert in Anwesenheit von Salpetersäure
S YNTHESE 2: [Pd(OAc) 2 ] Diacetatopalladium(II) O O H 3 C Pd CH 3 O O Zürich, 14.11.2004 WS 04/05 OACP 2 D-CHA, ETHZ Raphael Sigrist - 1 - 1.1 Methode, Prinzip Palladium reagiert in Anwesenheit von Salpetersäure
Seminar zum anorganisch-chemischen Praktikum I. Quantitative Analyse. Prof. Dr. M. Scheer Patrick Schwarz
 Seminar zum anorganisch-chemischen Praktikum I Quantitative Analyse Prof. Dr. M. Scheer Patrick Schwarz Termine und Organisatorisches Immer Donnerstag, 11:00 12:00 in HS 44 Am Semesteranfang zusätzlich
Seminar zum anorganisch-chemischen Praktikum I Quantitative Analyse Prof. Dr. M. Scheer Patrick Schwarz Termine und Organisatorisches Immer Donnerstag, 11:00 12:00 in HS 44 Am Semesteranfang zusätzlich
Maßanalyse. Bestimmung einer Schwefelsäure mit einer NaOH Maßlösung: bzw. n(naoh * 1 = n(h 2 SO 4 ) * 2 V [ml] * * t * 1 = n(h 2 SO 4 ) * 2
![Maßanalyse. Bestimmung einer Schwefelsäure mit einer NaOH Maßlösung: bzw. n(naoh * 1 = n(h 2 SO 4 ) * 2 V [ml] * * t * 1 = n(h 2 SO 4 ) * 2 Maßanalyse. Bestimmung einer Schwefelsäure mit einer NaOH Maßlösung: bzw. n(naoh * 1 = n(h 2 SO 4 ) * 2 V [ml] * * t * 1 = n(h 2 SO 4 ) * 2](/thumbs/79/78929570.jpg) Maßanalyse Bei der Maßanalyse (Volumetrie) wird zu der zu analysierenden Lösung unbekannten Gehaltes soviel einer Lösung bekannter Konzentration der Maßlösung zugegeben, bis ein Indikationssystem den Endpunkt
Maßanalyse Bei der Maßanalyse (Volumetrie) wird zu der zu analysierenden Lösung unbekannten Gehaltes soviel einer Lösung bekannter Konzentration der Maßlösung zugegeben, bis ein Indikationssystem den Endpunkt
Fette, Öle und Tenside
 Schulversuchspraktikum Thomas Polle Sommersemester 2015 Klassenstufen 11 & 12 Fette, Öle und Tenside Kurzprotokoll Inhalt Inhaltsverzeichnis 1Weitere Lehrerversuche... 3 V1 Verseifungszahl... 3 2Weitere
Schulversuchspraktikum Thomas Polle Sommersemester 2015 Klassenstufen 11 & 12 Fette, Öle und Tenside Kurzprotokoll Inhalt Inhaltsverzeichnis 1Weitere Lehrerversuche... 3 V1 Verseifungszahl... 3 2Weitere
Qualitative Kationen und Anionenanalyse
 Qualitative Kationen und Anionenanalyse Die Aufgabe: Die Proben: Ihr müsst mindestens zwei unbekannte Salze mit Hilfe von verschiedenen Tests identifizieren. Die Salze die ihr identifizieren müsst, können
Qualitative Kationen und Anionenanalyse Die Aufgabe: Die Proben: Ihr müsst mindestens zwei unbekannte Salze mit Hilfe von verschiedenen Tests identifizieren. Die Salze die ihr identifizieren müsst, können
Analytische Chemie. B. Sc. Chemieingenieurwesen
 Analytische Chemie B. Sc. Chemieingenieurwesen 6. Februar 2018, 8.30 bis 11.30 Uhr Dr. Stephanie Möller und Prof. Dr. Thomas Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe
Analytische Chemie B. Sc. Chemieingenieurwesen 6. Februar 2018, 8.30 bis 11.30 Uhr Dr. Stephanie Möller und Prof. Dr. Thomas Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe
Gefahrenstoffe. 2 Bechergläser (230 ml), Bürette, Magnetrührer, Trichter, Rührschwein, Pipette, Stativ, Muffe, ph-meter
 1.1 V1 Titration von Cola In diesem Versuch wird die in Cola enthaltene Phosphorsäure mittels Säure-Base-Titration titriert und bestimmt. Ebenfalls wird mit den erhaltenen Werten gerechnet um das chemische
1.1 V1 Titration von Cola In diesem Versuch wird die in Cola enthaltene Phosphorsäure mittels Säure-Base-Titration titriert und bestimmt. Ebenfalls wird mit den erhaltenen Werten gerechnet um das chemische
2. Teilklausur zum Chemischen Grundpraktikum im WS 2014/15 vom
 2. Teilklausur zum Chemischen Grundpraktikum im WS 2014/15 vom 21.01.2015 A1 A2 A3 F4 R5 E6 Note 8 12 5 9 8 8 50 NAME/VORNAME:... Matrikelnummer:... Pseudonym für Ergebnisveröffentlichung Schreiben Sie
2. Teilklausur zum Chemischen Grundpraktikum im WS 2014/15 vom 21.01.2015 A1 A2 A3 F4 R5 E6 Note 8 12 5 9 8 8 50 NAME/VORNAME:... Matrikelnummer:... Pseudonym für Ergebnisveröffentlichung Schreiben Sie
Analytische Chemie. B. Sc. Chemieingenieurwesen. 8. Juli 2015, Uhr. Prof. Dr. T. Jüstel, Stephanie Möller M. Sc.
 Analytische Chemie B. Sc. Chemieingenieurwesen 8. Juli 2015, 12.30 15.30 Uhr Prof. Dr. T. Jüstel, Stephanie Möller M. Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
Analytische Chemie B. Sc. Chemieingenieurwesen 8. Juli 2015, 12.30 15.30 Uhr Prof. Dr. T. Jüstel, Stephanie Möller M. Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
Protokolle zu den Analysen
 Qualitative Analysen Protokolle zu den Analysen Namen, Datum und Analysennummer angeben Möglicherweise enthaltene Ionen angeben Merkmale wie Farbe, Homogenität, (Geruch) feststellen Vorproben wie, Flammenfärbung,
Qualitative Analysen Protokolle zu den Analysen Namen, Datum und Analysennummer angeben Möglicherweise enthaltene Ionen angeben Merkmale wie Farbe, Homogenität, (Geruch) feststellen Vorproben wie, Flammenfärbung,
Stöchiometrie-Seminar November 2017 Pascal Heitel 1
 Stöchiometrie-Seminar 4 Pascal Heitel 1 Themen des heutigen Seminars 1) Zusammenfassung des letzten Seminars 2) Besprechung der Hausaufgaben 3) Theorie 4) Übungsaufgaben Pascal Heitel 2 1) Zusammenfassung
Stöchiometrie-Seminar 4 Pascal Heitel 1 Themen des heutigen Seminars 1) Zusammenfassung des letzten Seminars 2) Besprechung der Hausaufgaben 3) Theorie 4) Übungsaufgaben Pascal Heitel 2 1) Zusammenfassung
!!! NEUE ÖAB-MONOGRAPHIE!!!
 !!! NEUE ÖAB-MONOGRAPHIE!!! Die folgende neue Monographie ist für die Aufnahme in das ÖAB (österreichisches Arzneibuch) vorgesehen. Stellungnahmen zu diesem Gesetzesentwurf sind bis zum 31.05.2014 an folgende
!!! NEUE ÖAB-MONOGRAPHIE!!! Die folgende neue Monographie ist für die Aufnahme in das ÖAB (österreichisches Arzneibuch) vorgesehen. Stellungnahmen zu diesem Gesetzesentwurf sind bis zum 31.05.2014 an folgende
SurTec 691 Schwarzpassivierung für alkalische Zinküberzüge
 Protection upgraded SurTec 691 Schwarzpassivierung für alkalische Zinküberzüge Eigenschaften Chrom(VI)-freie Schwarzpassivierung auf Basis von dreiwertigem Chrom speziell entwickelt für die Beschichtung
Protection upgraded SurTec 691 Schwarzpassivierung für alkalische Zinküberzüge Eigenschaften Chrom(VI)-freie Schwarzpassivierung auf Basis von dreiwertigem Chrom speziell entwickelt für die Beschichtung
Anorganisch-Chemisches Praktikum für Physiker:
 Anorganisch-Chemisches Praktikum für Physiker: Quantitative Analyse (Teil 1) Dr. Christopher Anson INSTITUT FÜR ANORGANISCHE CHEMIE KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum
Anorganisch-Chemisches Praktikum für Physiker: Quantitative Analyse (Teil 1) Dr. Christopher Anson INSTITUT FÜR ANORGANISCHE CHEMIE KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum
Vorpraktikum Grundoperationen im chemischen Laboratorium
 Vorpraktikum Grundoperationen im chemischen Laboratorium Stand: 09. April 2018 Inhalt: Volumetrische Messgeräte Analysenwaagen Fest-Flüssig-Trennverfahren Flüssig-Flüssig-Trennverfahren Wasserlöslichkeit
Vorpraktikum Grundoperationen im chemischen Laboratorium Stand: 09. April 2018 Inhalt: Volumetrische Messgeräte Analysenwaagen Fest-Flüssig-Trennverfahren Flüssig-Flüssig-Trennverfahren Wasserlöslichkeit
Titration kleiner Chloridmengen mit Quecksilber(II)-nitrat
 Illumina-Chemie.de - Artikel Analytik Mit der hier dargestellten maßanalytischen Bestimmung von Chlorid über eine eingestellte Quecksilber(II)-nitrat-Lösung können noch sehr geringe Mengen, bis etwa 0,5
Illumina-Chemie.de - Artikel Analytik Mit der hier dargestellten maßanalytischen Bestimmung von Chlorid über eine eingestellte Quecksilber(II)-nitrat-Lösung können noch sehr geringe Mengen, bis etwa 0,5
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2011/12 vom
 Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2011/12 vom 23.09.2011 A1 A2 A3 A4 A5 Σ Note 8 8 10 10 14 50 NAME/VORNAME:... Matrikelnummer: STICHPUNKTE ZU DEN LÖSUNGEN Pseudonym für Ergebnisveröffentlichung:...
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2011/12 vom 23.09.2011 A1 A2 A3 A4 A5 Σ Note 8 8 10 10 14 50 NAME/VORNAME:... Matrikelnummer: STICHPUNKTE ZU DEN LÖSUNGEN Pseudonym für Ergebnisveröffentlichung:...
Das abgetrennte Eisen als Fe 2 O 3 gravimetrisch bestimmen;nickel mit Dimethylglyoxim gravimetrisch bestimmen oder komplexometrisch titrieren.
 Trennungen, Mehrkomponenten-Bestimmungen 81 Versuch 313: Hydrolysentrennung von Eisen und Nickel Arbeitsanleitung Geräte: Bunsenbrenner, Dreifuß, Ceranplatte, 0-mL-Vollpipette, Messzylinder, 600-mL-Bechergläser,
Trennungen, Mehrkomponenten-Bestimmungen 81 Versuch 313: Hydrolysentrennung von Eisen und Nickel Arbeitsanleitung Geräte: Bunsenbrenner, Dreifuß, Ceranplatte, 0-mL-Vollpipette, Messzylinder, 600-mL-Bechergläser,
Qualitative Analyse. - Identifikation von Ionen (häufig in einem Gemisch) - Charakterisierung der Analyse nach Farbe, Morphologie, Geruch,
 - Identifikation von Ionen (häufig in einem Gemisch) - Charakterisierung der Analyse nach Farbe, Morphologie, Geruch, Löslichkeit - charakteristische Nachweisreaktionen für Einzelionen: - Fällungsreaktionen
- Identifikation von Ionen (häufig in einem Gemisch) - Charakterisierung der Analyse nach Farbe, Morphologie, Geruch, Löslichkeit - charakteristische Nachweisreaktionen für Einzelionen: - Fällungsreaktionen
Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2004/
 Nachklausur zum Anorganisch-Chemischen Grundpraktikum, 28.04.05 Seite 1 von 10 Punkte: von 90 Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2004/2005 28.04.2005 Matrikelnummer: Name:
Nachklausur zum Anorganisch-Chemischen Grundpraktikum, 28.04.05 Seite 1 von 10 Punkte: von 90 Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2004/2005 28.04.2005 Matrikelnummer: Name:
