Positive Studien-Ergebnisse mit VEGF Trap-Eye bei Zentralvenen- Verschluss des Auges und bei diabetischem Makulaödem
|
|
|
- Karola Seidel
- vor 7 Jahren
- Abrufe
Transkript
1 Investor News Nur zur Verwendung außerhalb der USA Bayer AG Investor Relations Leverkusen Deutschland Positive Studien-Ergebnisse mit VEGF Trap-Eye bei Zentralvenen- Verschluss des Auges und bei diabetischem Makulaödem Phase-III-Studie bei Zentralvenen-Verschluss des Auges: 56 Prozent der mit VEGF Trap-Eye behandelten Patienten verbesserten Sehkraft um mindestens 15 Buchstaben im Vergleich zu 12 Prozent in der Kontrollgruppe Phase-II-Studie zu diabetischem Makulaödem: Mit VEGF Trap-Eye behandelte Gruppen inklusive der Dosierung von 2 mg alle zwei Monate konnten die Verbesserung ihres Sehvermögens über 52 Wochen halten oder weiter verbessern Leverkusen, 20. Dezember 2010 Das Medikament VEGF Trap-Eye (Aflibercept- Lösung zur Anwendung am Auge) hat in weiteren klinischen Studien positive Ergebnisse gezeigt. VEGF Trap-Eye ist ein gemeinsames Entwicklungsprodukt von Bayer HealthCare und Regeneron Pharmaceuticals, Tarrytown/USA, u. a. zur Behandlung von Zentralvenen-Verschluss des Auges. In der ersten Phase-III-Studie (COPERNICUS) an Patienten mit Zentralvenen-Verschluss des Auges erreichte das Präparat den primären Endpunkt. Die von Regeneron durchgeführte Studie ist eine von zwei Phase-III-Studien an Patienten mit Makula-Ödem aufgrund eines Verschlusses der zentralen Netzhautvene (Central Retinal Vein Occlusion, CRVO). In beiden Studien ist der primäre Endpunkt die Verbesserung des Sehvermögens gegenüber dem Ausgangswert. In der COPERNICUS- Studie verbesserten 56,1 Prozent der mit 2 mg VEGF Trap-Eye einmal monatlich behandelten Patienten mit Zentralvenen-Verschluss ihr Sehvermögen um mindestens 15 Buchstaben im Vergleich zu 12,3 Prozent der Patienten in der Kontrollgruppe, die Scheininjektionen erhielten (p<0,0001). Die mittlere Verbesserung des Sehvermögens (sekundärer Endpunkt) lag bei Therapie mit 2 mg VEGF Trap-Eye einmal monatlich bei 17,3 Buchstaben, in der Kontrollgruppe nahm das Sehvermögen dagegen um 4,0 Buchstaben ab (p<0,001). Die zweite Phase-III-Studie (GALILEO) ist noch nicht beendet und wird von Bayer HealthCare durchgeführt. - 1/7 -
2 Die mit VEGF Trap-Eye behandelten Patienten in der COPERNICUS-Studie zeigten eine erhebliche Verbesserung ihrer Sehkraft, sagte George D. Yancopoulos, M.D., Ph.D., Präsident von Regeneron Research Laboratories. Sollten die jetzigen Ergebnisse durch die Daten der GALILEO-Studie, die wir für das zweite Quartal 2011 erwarten, bestätigt werden, könnte VEGF Trap-Eye für Patienten und Ärzte eine neue Behandlungsoption bei Zentralvenen-Verschluss des Auges werden. Nach den positiven Ergebnissen unseres globalen Phase-III-Studienprogramms (VIEW 1 und VIEW 2) mit VEGF Trap-Eye bei der neovaskulären Form der altersbedingten Makula-Degeneration freuen wir uns sehr über diese weiteren positiven Phase-III-Daten bei der Behandlung des Zentralvenen-Verschlusses des Auges eine mögliche zweite Indikation für VEGF Trap-Eye, sagte Dr. Kemal Malik, Leiter der Globalen Entwicklung und Mitglied des Executive Committee bei Bayer HealthCare. Gemeinsam mit Regeneron bereiten wir jetzt sehr sorgfältig die Zulassungsanträge für VEGF Trap-Eye zur Behandlung der feuchten AMD für die Einreichung in der ersten Jahreshälfte von 2011 vor. VEGF Trap-Eye erwies sich als allgemein gut verträglich. Die unerwünschten Ereignisse, die am häufigsten beobachtet wurden, waren typisch für Folgen der Injektionen in den Glaskörper des Auges bzw. der zugrundeliegenden Erkrankung. Von den randomisierten CRVO-Patienten erhielten 114 als Studienmedikation VEGF Trap-Eye und 73 die Scheininjektion. Schwerwiegende unerwünschte Ereignisse am Auge waren bei den mit VEGF Trap-Eye Behandelten selten (3,5 Prozent) und traten in der Kontrollgruppe häufiger auf (13,5 Prozent). In der Häufigkeit von schwerwiegenden unerwünschten Ereignissen außerhalb des Auges gab es keine nennenswerten Unterschiede zwischen den Gruppen, die mit VEGF Trap-Eye behandelt wurden und denen, die Scheininjektionen erhielten. Unter den 114 Patienten, die VEGF Trap-Eye erhielten, gab es keinen Todesfall. In der Kontrollgruppe, die Scheininjektionen erhielt, verstarben zwei der 73 Patienten (2,7 Prozent). Weitere Daten der COPERNICUS-Studie werden im Februar 2011 auf der Konferenz Angiogenesis in Miami, USA, vorgestellt. Phase-II-Ergebnisse zum diabetischem Makulaödem Die Ergebnisse nach 52 Wochen Behandlung mit VEGF Trap-Eye in der Phase-II-Studie DA VINCI bei diabetischem Makulaödem (DME) waren ebenfalls positiv. Der primäre - 2/7 -
3 Endpunkt das erzielte Sehvermögen nach einer 24-wöchigen Gabe von VEGF Trap- Eye wurde bis zum Studienende (Woche 52) in allen mit VEGF Trap-Eye behandelten Studiengruppen beibehalten oder numerisch verbessert. Dies beinhaltete auch die Gruppe, die alle zwei Monate 2 mg VEGF Trap-Eye erhielt. Auf Basis dieser positiven Ergebnisse bei DME diskutieren Bayer HealthCare und Regeneron den Start von Phase- III-Studien. In dieser doppelblinden, randomisierten und prospektiven Multicenterstudie der Phase II mit dem Namen DA VINCI (DME And VEGF Trap-Eye: INvestigation of Clinical Impact) wurden 221 Patienten mit klinisch signifikantem DME mit Beteiligung des zentralen Teils der Makula nach dem Zufallsprinzip in eine von fünf Behandlungsgruppen eingeteilt, wovon 219 gleichmäßig über die verschiedenen Studienarme verteilt Behandlung erhielten. Die Kontrollgruppe erhielt eine Lasertherapie der Makula zum Behandlungsstart sowie weitere Laserbehandlungen nach Bedarf, jedoch nicht öfter als alle 16 Wochen. Zwei weitere Gruppen erhielten über den gesamten 12-monatigen Behandlungszeitraum monatlich eine Dosis von 0,5 oder 2 mg VEGF Trap-Eye. Die beiden übrigen Gruppen erhielten drei initiale Dosen von 2 mg VEGF Trap-Eye (zu Beginn der Studie sowie nach 4 und 8 Wochen) und danach bis Woche 52 entweder weitere Dosen alle zwei Monate oder nach Bedarf. Für die Behandlung nach Bedarf galten strenge Kriterien. Die folgende Tabelle gibt die mittlere Verbesserung des Sehvermögens wider: Laser 0.5 mg monatlich 2 mg monatlich 2 mg alle zwei Monate* 2 mg bei Bedarf* n Mittlere Verbesserung des Sehvermögens in Woche 24 gegenüber dem Ausgangswert 1 (Buchstaben) 2,5 8,6** 11,4** 8,5** 10,3** Mittlere Verbesserung des Sehvermögens in Woche 52 gegenüber dem Ausgangswert (Buchstaben) *Nach 3 initialen monatlichen Dosen **p<0.01 gegenüber Laser 1 Primärer Endpunkt -1,3 11,0** 13,1** 9,7** 12,0** Es wurden keine statistisch signifikanten Unterschiede zwischen den VEGF Trap-Eye Gruppen beobachtet. Etwa 80 Prozent der VEGF Trap-Eye-Patienten und 75 Prozent der Laser-Patienten blieben über die gesamten 52 Wochen in der Studie. - 3/7 -
4 VEGF Trap-Eye war allgemein gut verträglich, und es wurden während der Studie keine schwerwiegenden unerwünschten Ereignisse am Auge oder außerhalb des Auges berichtet, die mit der Medikation im Zusammenhang standen. Die unerwünschten Ereignisse, die am häufigsten beobachtet wurden, waren typisch für Folgen der Injektionen in den Glaskörper des Auges bzw. der zugrundeliegenden Erkrankung. Zu den häufigsten unerwünschten Ereignissen am Auge bei den Patienten, die mit VEGF Trap-Eye behandelt wurden, gehörten Bindehautblutung, Augenschmerzen, Augenrötungen (Hyperämie) und erhöhter Augeninnendruck. Das Auftreten schwerwiegender unerwünschter Ereignisse außerhalb des Auges war in allen Behandlungsgruppen vergleichbar. Sechs der 175 VEGF Trap-Eye-Patienten (3,4 Prozent) und einer der 44 mit Laser behandelten Patienten (2,3 Prozent) starben. Weitere Daten der DA VINCI-Studie werden im Februar 2011 auf der Konferenz Angiogenesis in Miami, USA, vorgestellt. Über das Phase-III-Studienprogramm bei Zentralvenen-Verschluss (CRVO) In den beiden Studien COPERNICUS (Controlled Phase 3 Evaluation of Repeated intravitreal administration of VEGF Trap-Eye In Central retinal vein occlusion: Utility and Safety) und GALILEO (General Assessment Limiting Infiltration of Exudates in central retinal vein Occlusion with VEGF Trap-Eye) erhalten Patienten entweder sechs monatliche Injektionen VEGF Trap-Eye (Dosis: 2 mg) oder Scheininjektionen. Patienten in der COPERNICUS-Studie wurden im Verhältnis 3:2 randomisiert, so dass 114 Patienten mit VEGF Trap-Eye behandelt wurden und 73 Patienten im Kontrollarm Scheininjektionen erhielten. Nach Beendigung der ersten sechs Monate erhielten alle mit VEGF Trap-Eye behandelten Patienten für weitere sechs Monate VEGF Trap-Eye Behandlungen nach Bedarf. In der COPERNICUS Studie können Patienten im Kontrollarm nach Beendigung der ersten sechs Monate zu VEGF Trap-Eye Behandlungen nach Bedarf wechseln. Während der zweiten sechs Monate haben alle Patienten Anspruch auf eine Laserbehandlung als Notfalltherapie. Das Sehvermögen wurde gemessen an der Gesamtzahl der korrekt erkannten Buchstaben auf der ETDRS-Tafel (ETDRS = Early Treatment Diabetic Retinopathy Study), die in der Forschung als Standard für die Sehschärfenmessung verwendet wird. Zentralvenen-Verschluss (CRVO) - 4/7 -
5 Schätzungen zufolge leiden über Menschen in den USA und mehr als Menschen in den Kernländern Europas unter CRVO. Die Krankheit entsteht durch einen Verschluss der zentralen Netzhautvene, die zu Blutstauungen und Ödemen in der Netzhaut führt. Dies wiederum führt zu einer Schädigung der Netzhaut und Sehkraftverlust. Die Netzhaut kann darüber hinaus ischämisch werden, das heißt, unter Sauerstoffmangel leiden. Dadurch können sich neue, krankhafte Blutgefäße bilden, die wiederum einen weiteren Sehkraftverlust und schwere Komplikationen zur Folge haben können. Verantwortlich für die krankhafte Neubildung von Gefäßen ist ein natürlicher Wachstumsfaktor (VEGF = vascular endothial growth factor). Er erhöht die Gefäßdurchlässigkeit und regt die Bildung neuer Blutgefäße (Angiogenese) an. Möglicherweise kann eine Anti- VEGF-Behandlung dabei unterstützen, die Gefäßdurchlässigkeit sowie Ödeme zu verringern und das Wachstum neuer, abnormaler Blutgefäße in der Netzhaut bei CRVO- Patienten zu verhindern. Das diabetische Makulaödem (DME) Das diabetische Makulaödem (DME) ist die häufigste Ursache eines mittelschweren Sehkraftverlustes bei Diabetikern. DME ist eine bekannte Komplikation der diabetischen Retinopathie, einer Erkrankung der Netzhautgefäße. Das klinisch signifikante DME ist eine der häufigsten Ursachen der Erblindung bei jüngeren Erwachsenen (unter 50 Jahre). Es entsteht, wenn im Zentrum der Makula Flüssigkeit aus den geschädigten Gefäßen austritt. Da dieser Bereich (der sogenannte gelbe Fleck) die Stelle des schärfsten Sehens ist, führt eine Flüssigkeitsansammlung zum Verlust der Sehkraft oder zur Erblindung. Etwa Amerikaner leiden derzeit unter klinisch signifikantem DME; jedes Jahr kommen neue Fälle hinzu. Laut der American Diabetes Association leben mehr als 18 Millionen Amerikaner mit Diabetes, und viele weitere tragen ein hohes Risiko, Diabetes zu entwickeln. Die Inzidenz des Diabetes nimmt ständig zu laut Schätzungen werden 10 Prozent aller Diabetiker im Laufe ihres Lebens ein diabetisches Makulaödem entwickeln. VEGF Trap-Eye VEGF Trap-Eye ist ein komplett humanes, lösliches Rezeptorbindungsprotein des Wachstumsfaktors VEGF (vascular endothelial growth factor). Es bindet an sämtliche Formen des VEGF-A sowie zusätzlich auch an den verwandten Placental Growth Factor (PlGF). VEGF Trap-Eye ist ein spezifischer, hochwirksamer Hemmstoff für diese Wachstumsfaktoren. VEGF Trap-Eye ist speziell aufgereinigt und enthält iso-osmotische Puffer-Konzentrationen, die für die Injektion in das Auge geeignet sind. - 5/7 -
6 Regeneron und Bayer HealthCare kooperieren in der globalen Entwicklung von VEGF Trap-Eye zur Behandlung der feuchten altersbedingten Makuladegeneration (AMD), des diabetischen Makulaödems (DME), des Verschlusses der zentralen Netzhautvene (CRVO) sowie anderer Augenkrankheiten. Im November 2010 berichteten die beiden Unternehmen positive Ergebnisse aus zwei parallelen Phase-III-Studien (VIEW 1 und VIEW 2) an Patienten mit feuchter AMD. In diesen Studien erreichte VEGF Trap-Eye (Aflibercept-Lösung zur Anwendung am Auge) den primären Endpunkt in allen Dosierungen im Vergleich mit dem derzeitigen Therapiestandard (monatliche Gabe von Ranibizumab) einschließlich der Dosierung von VEGF Trap-Eye alle zwei Monate. Der primäre Endpunkt war der Anteil der Patienten, die nach 52 Wochen Behandlung ihre Sehkraft erhalten (oder verbessert) hatten. Statistisch wurde auf Nicht-Unterlegenheit ('Non-Inferiority') getestet. Sowohl für VEGF Trap-Eye als auch für Ranibizumab fiel das Sicherheitsprofil positiv aus. Für alle der vier Behandlungsgruppen in beiden Studien ergab sich eine vergleichbare Häufigkeit von Berichten zu unerwünschten Ereignissen am Auge. Bei den unerwünschten Ereignissen außerhalb des Auges gab es ebenfalls keine wesentlichen Unterschiede zwischen den Behandlungsgruppen. Bayer HealthCare und Regeneron planen auf Basis der positiven Ergebnisse aus den Studien VIEW 1 und VIEW 2 die Beantragung der Zulassung für die Indikation feuchte AMD in Europa und den USA für die erste Hälfte des Jahres Bayer HealthCare wird VEGF Trap-Eye außerhalb der Vereinigten Staaten vermarkten, beide Partner teilen sich dabei alle erzielten Gewinne. Regeneron hält die exklusiven Vermarktungsrechte in den Vereinigten Staaten. Über Regeneron Pharmaceuticals, Inc. Regeneron ist ein vollständig integriertes biopharmazeutisches Unternehmen, in dem Medikamente zur Behandlung schwerer Erkrankungen entdeckt, entwickelt und vermarktet werden. Das erste auf dem Markt eingeführte Präparat des Unternehmens ist ARCALYST (Rilonacept) zur subkutanen Injektion. Außerdem hat Regeneron mehrere therapeutische Kandidaten in der Phase III der klinischen Entwicklung, und zwar zur Behandlung von Gicht, Augenerkrankungen (feuchte altersbedingte Makula-Degeneration und Zentralvenenverschluss des Auges) sowie bestimmter Krebsarten. Weitere therapeutische Kandidaten, entwickelt mit der firmeneigenen Technologie zur Herstellung vollständig menschlicher monoklonaler Antikörper, befinden sich in früheren Stadien der klinischen Entwicklung für die Behandlung von rheumatoider Arthritis und anderen entzündlichen Prozessen, Schmerzen, Cholesterinsenkung, allergische und immunologische - 6/7 -
7 Erkrankungen und Krebs. Weitere Informationen über Regeneron sowie aktuelle Pressemeldungen sind auf der Webseite des Unternehmens unter zu finden. Über Bayer HealthCare Die Bayer AG ist ein weltweit tätiges, forschungsbasiertes und wachstumsorientiertes Unternehmen mit Kernkompetenzen auf den Gebieten Gesundheit, Ernährung und hochwertige Materialien. Mit einem Umsatz von Millionen Euro (2009) gehört Bayer HealthCare, ein Teilkonzern der Bayer AG, zu den weltweit führenden innovativen Unternehmen in der Gesundheitsversorgung mit Arzneimitteln und medizinischen Produkten. Das Unternehmen mit Sitz in Leverkusen bündelt die Aktivitäten der Divisionen Animal Health, Consumer Care, Medical Care sowie Pharma. Ziel von Bayer HealthCare ist es, Produkte zu erforschen, zu entwickeln, zu produzieren und zu vertreiben, um die Gesundheit von Mensch und Tier weltweit zu verbessern. Bei Bayer Healthcare arbeiten weltweit über Mitarbeiterinnen und Mitarbeiter in mehr als 100 Ländern. Mehr Informationen finden Sie unter Mehr zum Thema altersbedingte Makula-Degeneration (AMD) erfahren Sie unter: Ansprechpartner Bayer AG, Investor Relations: Dr. Alexander Rosar ( ) Dr. Juergen Beunink ( ) Peter Dahlhoff ( ) Judith Nestmann ( ) Dr. Olaf Weber ( ) Zukunftsgerichtete Aussagen Diese Presseinformation kann bestimmte in die Zukunft gerichtete Aussagen enthalten, die auf den gegenwärtigen Annahmen und Prognosen der Unternehmensleitung des Bayer-Konzerns bzw. seiner Teilkonzerne beruhen. Verschiedene bekannte wie auch unbekannte Risiken, Ungewissheiten und andere Faktoren können dazu führen, dass die tatsächlichen Ergebnisse, die Finanzlage, die Entwicklung oder die Performance der Gesellschaft wesentlich von den hier gegebenen Einschätzungen abweichen. Diese Faktoren schließen diejenigen ein, die Bayer in veröffentlichten Berichten beschrieben hat. Diese Berichte stehen auf der Bayer-Webseite zur Verfügung. Die Gesellschaft übernimmt keinerlei Verpflichtung, solche zukunftsgerichteten Aussagen fortzuschreiben und an zukünftige Ereignisse oder Entwicklungen anzupassen. - 7/7 -
Erneut positive Studien-Ergebnisse in Phase III für VEGF Trap-Eye bei Zentralvenenverschluss der Netzhaut
 Investor News Nicht für US-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Erneut positive Studien-Ergebnisse in Phase III für VEGF Trap-Eye bei Zentralvenenverschluss
Investor News Nicht für US-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Erneut positive Studien-Ergebnisse in Phase III für VEGF Trap-Eye bei Zentralvenenverschluss
Positive Ergebnisse von zwei Phase-III-Studien mit VEGF Trap-Eye bei feuchter altersbedingter Makula-Degeneration
 Positive Ergebnisse von zwei Phase-III-Studien mit VEGF Trap-Eye bei feuchter altersbedingter Makula-Degeneration - Präparat erreicht in allen Studienarmen inklusive der Dosierung von 2 mg alle zwei Monate
Positive Ergebnisse von zwei Phase-III-Studien mit VEGF Trap-Eye bei feuchter altersbedingter Makula-Degeneration - Präparat erreicht in allen Studienarmen inklusive der Dosierung von 2 mg alle zwei Monate
Bayer erhält Empfehlung für neue Behandlungsoption mit Aflibercept-Injektionslösung in der EU
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer erhält Empfehlung für neue Behandlungsoption mit Aflibercept-Injektionslösung in der EU CHMP empfiehlt
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer erhält Empfehlung für neue Behandlungsoption mit Aflibercept-Injektionslösung in der EU CHMP empfiehlt
Bayer und Regeneron erweitern augenheilkundliches Forschungsund Entwicklungsprogramm für VEGF Trap-Eye in Asien
 Investor News Nicht für US-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer und Regeneron erweitern augenheilkundliches Forschungsund Entwicklungsprogramm
Investor News Nicht für US-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer und Regeneron erweitern augenheilkundliches Forschungsund Entwicklungsprogramm
VEGF Trap-Eye verbessert Sehkraft bei altersbedingter Makula-Degeneration. Nachhaltige Sehkraftverbesserung über 52 Wochen in Phase-II-Studie
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de VEGF Trap-Eye verbessert Sehkraft bei altersbedingter Makula-Degeneration Nachhaltige Sehkraftverbesserung über
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de VEGF Trap-Eye verbessert Sehkraft bei altersbedingter Makula-Degeneration Nachhaltige Sehkraftverbesserung über
Bayer erhält Empfehlung zur Zulassung für die Behandlung des Sehschärfenverlustes infolge eines diabetischen Makulaödems in der EU
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Aflibercept zur Injektion ins Auge: Bayer erhält Empfehlung zur Zulassung für die Behandlung des Sehschärfenverlustes
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Aflibercept zur Injektion ins Auge: Bayer erhält Empfehlung zur Zulassung für die Behandlung des Sehschärfenverlustes
Behandlung des Sehschärfenverlustes infolge eines diabetischen Makulaödems in der EU
 Aflibercept zur Injektion ins Auge: Bayer erhält Empfehlung zur Zulassung für die Behandlung des Sehsc Aflibercept zur Injektion ins Auge: Bayer erhält Empfehlung zur Zulassung für die Behandlung des Sehschärfenverlustes
Aflibercept zur Injektion ins Auge: Bayer erhält Empfehlung zur Zulassung für die Behandlung des Sehsc Aflibercept zur Injektion ins Auge: Bayer erhält Empfehlung zur Zulassung für die Behandlung des Sehschärfenverlustes
Investor News. Bayer erhält Zulassung für Eylea in China
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer erhält Zulassung für Eylea in China Eylea erhält in China die Zulassung zur Behandlung des Sehschärfenverlusts
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer erhält Zulassung für Eylea in China Eylea erhält in China die Zulassung zur Behandlung des Sehschärfenverlusts
Phase-II-Studie. VEGF Trap-Eye verbessert Sehkraft bei altersbedingter Makula-Degeneration: Nachhaltige Sehkraftverbes
 VEGF Trap-Eye verbessert Sehkraft bei altersbedingter Makula-Degeneration Nachhaltige Sehkraftverbesserung über 52 Wochen in Phase-II-Studie Leverkusen und Tarrytown, NY, USA, (19. August 2008) Patienten
VEGF Trap-Eye verbessert Sehkraft bei altersbedingter Makula-Degeneration Nachhaltige Sehkraftverbesserung über 52 Wochen in Phase-II-Studie Leverkusen und Tarrytown, NY, USA, (19. August 2008) Patienten
Nachweis von Beta-Amyloid-Plaques bei Alzheimer-Patienten möglich Florbetaben könnte derzeitige Diagnosemöglichkeiten verbessern
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer startet Phase-III-Studie mit Florbetaben Nachweis von Beta-Amyloid-Plaques bei Alzheimer-Patienten möglich
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer startet Phase-III-Studie mit Florbetaben Nachweis von Beta-Amyloid-Plaques bei Alzheimer-Patienten möglich
Prävention von Venenthrombosen nach Hüft- oder Kniegelenkersatzoperation:
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Prävention von Venenthrombosen nach Hüft- oder Kniegelenkersatzoperation: Xarelto senkt Thrombose-Risiko gegenüber
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Prävention von Venenthrombosen nach Hüft- oder Kniegelenkersatzoperation: Xarelto senkt Thrombose-Risiko gegenüber
Beratergremium der FDA votiert gegen die Zulassung von Xarelto (Rivaroxaban) von Bayer bei Patienten mit ACS
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Akutes Koronarsyndrom (ACS): Beratergremium der FDA votiert gegen die Zulassung von Xarelto (Rivaroxaban) von
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Akutes Koronarsyndrom (ACS): Beratergremium der FDA votiert gegen die Zulassung von Xarelto (Rivaroxaban) von
Bayer AG Investor Relations Leverkusen Deutschland Investor News. Nicht für US- und UK-Medien bestimmt
 Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Neue Studie mit Xarelto (Rivaroxaban) von Bayer bei Patienten mit nicht-valvulärem
Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Neue Studie mit Xarelto (Rivaroxaban) von Bayer bei Patienten mit nicht-valvulärem
Phase-III-Studie mit Nexavar bei Lungenkrebs verfehlt primären Endpunkt einer Verbesserung der Gesamtüberlebenszeit
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Fortgeschrittenes nicht-kleinzelliges Lungenkarzinom: Phase-III-Studie mit Nexavar bei Lungenkrebs verfehlt
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Fortgeschrittenes nicht-kleinzelliges Lungenkarzinom: Phase-III-Studie mit Nexavar bei Lungenkrebs verfehlt
Lokal fortgeschrittener oder metastasierter differenzierter Schilddrüsenkrebs:
 Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Lokal fortgeschrittener oder metastasierter differenzierter Schilddrüsenkrebs:
Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Lokal fortgeschrittener oder metastasierter differenzierter Schilddrüsenkrebs:
Bayer bringt klinische Studien zu Riociguat voran
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Neuer Ansatz in der Therapie des Lungenhochdrucks Bayer bringt klinische Studien zu Riociguat voran Vorstellung
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Neuer Ansatz in der Therapie des Lungenhochdrucks Bayer bringt klinische Studien zu Riociguat voran Vorstellung
Investor News. Nicht für US- und UK-Medien bestimmt
 Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de FDA erteilt Complete Response Letter für Xarelto (Rivaroxaban) von Bayer
Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de FDA erteilt Complete Response Letter für Xarelto (Rivaroxaban) von Bayer
Bayer schließt Patientenrekrutierung für große Phase-III-Studie mit Rivaroxaban (ROCKET AF) ab
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer-Engagement zur Prävention arterieller Thrombosen: Bayer schließt Patientenrekrutierung für große Phase-III-Studie
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer-Engagement zur Prävention arterieller Thrombosen: Bayer schließt Patientenrekrutierung für große Phase-III-Studie
Chronisch-thromboembolische pulmonale Hypertonie und pulmonal-arterielle Hypertonie:
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Chronisch-thromboembolische pulmonale Hypertonie und pulmonal-arterielle Hypertonie: Beratergremium der US-Gesundheitsbehörde
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Chronisch-thromboembolische pulmonale Hypertonie und pulmonal-arterielle Hypertonie: Beratergremium der US-Gesundheitsbehörde
Übersicht über Eylea und Begründung für die Zulassung in der EU
 EMA/481361/2018 EMEA/H/C/002392 Übersicht über Eylea und Begründung für die Zulassung in der EU Was ist Eylea und wofür wird es angewendet? Eylea ist ein Arzneimittel für Erwachsene zur Behandlung: der
EMA/481361/2018 EMEA/H/C/002392 Übersicht über Eylea und Begründung für die Zulassung in der EU Was ist Eylea und wofür wird es angewendet? Eylea ist ein Arzneimittel für Erwachsene zur Behandlung: der
Bayer erhält US-Zulassung für Krebsmedikament Xofigo (Radium 223 Dichlorid)
 Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer erhält US-Zulassung für Krebsmedikament Xofigo (Radium 223 Dichlorid)
Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer erhält US-Zulassung für Krebsmedikament Xofigo (Radium 223 Dichlorid)
Bayer präsentiert neue Forschungsdaten zur Hämophilie auf dem WFH-Kongress. Bayer präsentiert neue Forschungsdaten zur Hämophilie auf dem WFH-Kongress
 Bayer präsentiert neue Forschungsdaten zur Hämophilie auf dem WFH-Kongress Berlin (2. Juli 2012) - Bayer HealthCare wird auf einem wissenschaftlichen Forum anlässlich des 50. Jahreskongresses der World
Bayer präsentiert neue Forschungsdaten zur Hämophilie auf dem WFH-Kongress Berlin (2. Juli 2012) - Bayer HealthCare wird auf einem wissenschaftlichen Forum anlässlich des 50. Jahreskongresses der World
Phase-III-Studie mit Regorafenib bei Patienten mit metastasiertem GIST erreicht primären Endpunkt
 Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Gastrointestinale Stroma-Tumoren (GIST): Phase-III-Studie mit Regorafenib
Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Gastrointestinale Stroma-Tumoren (GIST): Phase-III-Studie mit Regorafenib
Außerdem: Vorläufige Rücknahme des Zulassungsantrags zur Prävention von Stentthrombosen
 Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de FDA gewährt Xarelto (Rivaroxaban) von Bayer vorrangige Prüfung zur Behandlung
Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de FDA gewährt Xarelto (Rivaroxaban) von Bayer vorrangige Prüfung zur Behandlung
Xarelto (Rivaroxaban) von Bayer in EU zur Zulassung in der Sekundärprävention nach akutem Koronarsyndrom eingereicht
 Investor News Nicht für Medien in den USA oder Großbritannien Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Akutes Koronarsyndrom (ACS): Xarelto (Rivaroxaban) von Bayer
Investor News Nicht für Medien in den USA oder Großbritannien Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Akutes Koronarsyndrom (ACS): Xarelto (Rivaroxaban) von Bayer
Einziges orales Mono-Therapeutikum mit Wirksamkeitsnachweis in der Behandlung von tiefen Venenthrombosen und Lungenembolien
 Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Weitere US-Zulassung für Xarelto (Rivaroxaban) zur Behandlung tiefer Venenthrombosen
Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Weitere US-Zulassung für Xarelto (Rivaroxaban) zur Behandlung tiefer Venenthrombosen
Erste Ergebnisse aus Phase-II-Kombinationsstudie mit Nexavar und Paclitaxel bei Brustkrebs zeigen positiven Trend
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Metastasiertes Brustkarzinom: Erste Ergebnisse aus Phase-II-Kombinationsstudie mit Nexavar und Paclitaxel bei
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Metastasiertes Brustkarzinom: Erste Ergebnisse aus Phase-II-Kombinationsstudie mit Nexavar und Paclitaxel bei
Bayer AG Investor Relations Leverkusen Deutschland Investor News. Nicht für US- und UK-Medien bestimmt
 Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Rivaroxaban: Complete Response zur Sekundärprävention sowie Zulassungsantrag
Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Rivaroxaban: Complete Response zur Sekundärprävention sowie Zulassungsantrag
Bayer Schering Pharma startet Phase-III-Programm mit Medikament gegen Lungenhochdruck
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Entwicklung von Riociguat kommt gut voran: Bayer Schering Pharma startet Phase-III-Programm mit Medikament gegen
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Entwicklung von Riociguat kommt gut voran: Bayer Schering Pharma startet Phase-III-Programm mit Medikament gegen
ACS-Studie mit Xarelto (Rivaroxaban) von Bayer erreicht primären Wirksamkeitsendpunkt und zeigt signifikante Minderung der Mortalität
 Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Sekundärprävention bei akutem Koronarsyndrom (ACS): ACS-Studie mit Xarelto
Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Sekundärprävention bei akutem Koronarsyndrom (ACS): ACS-Studie mit Xarelto
Ergebnisse zulassungsrelevanter Studie bei Patienten mit metastasiertem Darmkrebs:
 Investor News Nicht zur Verteilung in den USA und UK bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Ergebnisse zulassungsrelevanter Studie bei Patienten mit metastasiertem
Investor News Nicht zur Verteilung in den USA und UK bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Ergebnisse zulassungsrelevanter Studie bei Patienten mit metastasiertem
Investor News Nicht für US- und UK-Medien bestimmt
 Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de CHMP empfiehlt EU-Zulassung von Xarelto für die Schlaganfallprophylaxe
Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de CHMP empfiehlt EU-Zulassung von Xarelto für die Schlaganfallprophylaxe
TVT-Therapie. Bayer HealthCare: Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Präventio
 Bayer HealthCare: Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Präventio Bayer HealthCare Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Prävention
Bayer HealthCare: Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Präventio Bayer HealthCare Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Prävention
Investor News. Nicht für US- und UK-Medien bestimmt
 Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Beratergremium der US-amerikanischen FDA votiert gegen die Zulassung von
Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Beratergremium der US-amerikanischen FDA votiert gegen die Zulassung von
Bayer erhält Zulassungsempfehlung für Regorafenib zur Behandlung von metastasiertem Darmkrebs in der EU
 Stivarga Bayer erhält Zulassungsempfehlung für Regorafenib zur Behandlung von metastasiertem Darmkrebs in der EU - Ergebnisse zulassungsrelevanter Phase-III-Studie belegen längere Überlebenszeit von Patienten,
Stivarga Bayer erhält Zulassungsempfehlung für Regorafenib zur Behandlung von metastasiertem Darmkrebs in der EU - Ergebnisse zulassungsrelevanter Phase-III-Studie belegen längere Überlebenszeit von Patienten,
Hot Line Session auf Kongress der European Society of Cardiology (ESC) 2014:
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Hot Line Session auf Kongress der European Society of Cardiology (ESC) 2014: Xarelto einmal täglich von Bayer
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Hot Line Session auf Kongress der European Society of Cardiology (ESC) 2014: Xarelto einmal täglich von Bayer
PATIENT. Patienten-Ratgeber für die Behandlung mit EYLEA. (Aflibercept Injektionslösung)
 PATIENT Patienten-Ratgeber für die Behandlung mit EYLEA (Aflibercept Injektionslösung) Lesen Sie sich bitte vor Beginn Ihrer Behandlung mit EYLEA das gesamte Informationsmaterial, einschließlich der beiliegenden
PATIENT Patienten-Ratgeber für die Behandlung mit EYLEA (Aflibercept Injektionslösung) Lesen Sie sich bitte vor Beginn Ihrer Behandlung mit EYLEA das gesamte Informationsmaterial, einschließlich der beiliegenden
Investor News. Schlaganfallprophylaxe bei Patienten mit Vorhofflimmern:
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Schlaganfallprophylaxe bei Patienten mit Vorhofflimmern: US-Zulassung für Bayer-Medikament Xarelto (Rivaroxaban)
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Schlaganfallprophylaxe bei Patienten mit Vorhofflimmern: US-Zulassung für Bayer-Medikament Xarelto (Rivaroxaban)
Kongress der American Thoracic Society 2010 in New Orleans, USA: Bayer präsentiert neue Daten aus Phase-II-Studien mit Riociguat
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Kongress der American Thoracic Society 2010 in New Orleans, USA: Bayer präsentiert neue Daten aus Phase-II-Studien
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Kongress der American Thoracic Society 2010 in New Orleans, USA: Bayer präsentiert neue Daten aus Phase-II-Studien
Rivaroxaban beugt lebensbedrohlichen Blutgerinnseln wirksamer vor als die Standardtherapie mit Enoxaparin
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de VTE-Prophylaxe nach großen orthopädischen Eingriffen: Rivaroxaban beugt lebensbedrohlichen Blutgerinnseln wirksamer
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de VTE-Prophylaxe nach großen orthopädischen Eingriffen: Rivaroxaban beugt lebensbedrohlichen Blutgerinnseln wirksamer
Ergebnisse weiterer Studiengruppen werden auf dem 55. Jahreskongress der American Society of Hematology präsentiert
 Presse-Information Bayer Pharma AG 13342 Berlin Deutschland Tel. +49 30 468-1111 www.bayerpharma.de Portola Pharmaceuticals veröffentlicht erste Ergebnisse einer Phase-II-Studie zur dosisabhängigen Aufhebung
Presse-Information Bayer Pharma AG 13342 Berlin Deutschland Tel. +49 30 468-1111 www.bayerpharma.de Portola Pharmaceuticals veröffentlicht erste Ergebnisse einer Phase-II-Studie zur dosisabhängigen Aufhebung
Bayer erhält in Japan Zulassung für Riociguat zur Behandlung der chronisch-thromboembolischen pulmonalen Hypertonie
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer erhält in Japan Zulassung für Riociguat zur Behandlung der chronisch-thromboembolischen pulmonalen Hypertonie
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer erhält in Japan Zulassung für Riociguat zur Behandlung der chronisch-thromboembolischen pulmonalen Hypertonie
Nexavar in Kombination mit Chemotherapie verlängert progressionsfreies Überleben von Patientinnen mit fortgeschrittenem Brustkrebs
 Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Nexavar in Kombination mit Chemotherapie verlängert progressionsfreies
Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Nexavar in Kombination mit Chemotherapie verlängert progressionsfreies
FDA prüft Riociguat von Bayer im beschleunigten Zulassungsverfahren zur Behandlung von zwei lebensbedrohlichen Formen des Lungenhochdrucks
 Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de FDA prüft Riociguat von Bayer im beschleunigten Zulassungsverfahren zur
Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de FDA prüft Riociguat von Bayer im beschleunigten Zulassungsverfahren zur
Factsheet: Bepanthen-Kinderförderung
 Factsheet: Bepanthen-Kinderförderung Bayer Vital GmbH Unternehmenskommunikation 51368 Leverkusen Deutschland Tel. +49 214 30-1 www.presse.bayer.de Achtsamkeitsstudie 2017: Achtsamkeit in Deutschland: Kommen
Factsheet: Bepanthen-Kinderförderung Bayer Vital GmbH Unternehmenskommunikation 51368 Leverkusen Deutschland Tel. +49 214 30-1 www.presse.bayer.de Achtsamkeitsstudie 2017: Achtsamkeit in Deutschland: Kommen
DSW Aktienforum. 31. Mai 2012 I Dr. Alexander Rosar, Investor Relations
 DSW Aktienforum Berlin 31. Mai 2012 I Dr. Alexander Rosar, Investor Relations Rechtliche Hinweise Diese Präsentation kann bestimmte in die Zukunft gerichtete Aussagen enthalten, die auf den gegenwärtigen
DSW Aktienforum Berlin 31. Mai 2012 I Dr. Alexander Rosar, Investor Relations Rechtliche Hinweise Diese Präsentation kann bestimmte in die Zukunft gerichtete Aussagen enthalten, die auf den gegenwärtigen
weitere Störungen des Sehvermögens, die auf eine choroidale Neovaskularisation zurückzuführen sind;
 EMA/704742/2016 EMEA/H/C/000715 Zusammenfassung des EPAR für die Öffentlichkeit Ranibizumab Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
EMA/704742/2016 EMEA/H/C/000715 Zusammenfassung des EPAR für die Öffentlichkeit Ranibizumab Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
Xarelto (Rivaroxaban) von Bayer zur EU-Zulassung für die Prävention atherothrombotischer Ereignisse nach akutem Koronarsyndrom (ACS) empfohlen
 Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Xarelto (Rivaroxaban) von Bayer zur EU-Zulassung für die Prävention atherothrombotischer
Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Xarelto (Rivaroxaban) von Bayer zur EU-Zulassung für die Prävention atherothrombotischer
Medienmitteilung. FDA erteilt Zulassung für Lucentis (Ranibizumab Injektionslösung) zur Behandlung des diabetischen Makulaödems
 Medienmitteilung Basel, den 13. August 2012 FDA erteilt Zulassung für Lucentis (Ranibizumab Injektionslösung) zur Behandlung des diabetischen Makulaödems Erster grosser Therapiefortschritt seit über 25
Medienmitteilung Basel, den 13. August 2012 FDA erteilt Zulassung für Lucentis (Ranibizumab Injektionslösung) zur Behandlung des diabetischen Makulaödems Erster grosser Therapiefortschritt seit über 25
Ad-hoc-Mitteilung nach 15 WpHG
 Ad-hoc-Mitteilung nach 15 WpHG Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de DARF IN DEN USA, AUSTRALIEN, KANADA UND JAPAN SOWIE IN DIESE LÄNDER WEDER DIREKT NOCH INDIREKT
Ad-hoc-Mitteilung nach 15 WpHG Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de DARF IN DEN USA, AUSTRALIEN, KANADA UND JAPAN SOWIE IN DIESE LÄNDER WEDER DIREKT NOCH INDIREKT
Ergebnisse aus Phase-II-Studie beim fortgeschrittenen Brustkarzinom:
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Ergebnisse aus Phase-II-Studie beim fortgeschrittenen Brustkarzinom: Nexavar in Kombination mit Chemotherapie
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Ergebnisse aus Phase-II-Studie beim fortgeschrittenen Brustkarzinom: Nexavar in Kombination mit Chemotherapie
zugelassen Erfahrungen und neue Perspektiven mit Aflibercept: EYLEA jetzt auch bei Makulaödem infolge von ZVV
 Erfahrungen und neue Perspektiven mit Aflibercept: EYLEA jetzt auch bei Makulaödem infolge von ZVV Erfahrungen und neue Perspektiven mit Aflibercept EYLEA jetzt auch bei Makulaödem infolge von ZVV zugelassen
Erfahrungen und neue Perspektiven mit Aflibercept: EYLEA jetzt auch bei Makulaödem infolge von ZVV Erfahrungen und neue Perspektiven mit Aflibercept EYLEA jetzt auch bei Makulaödem infolge von ZVV zugelassen
Bayer AG Investor Relations Leverkusen Deutschland Investor News
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Phase-III-COMPASS-Studie mit Rivaroxaban von Bayer zeigt überragende Wirksamkeit bei Patienten mit koronarer
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Phase-III-COMPASS-Studie mit Rivaroxaban von Bayer zeigt überragende Wirksamkeit bei Patienten mit koronarer
Bayer AG Investor Relations Leverkusen Deutschland Investor News
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer und Orion starten Phase-III-Studie mit neuartigem Krebspräparat ODM-201 bei Männern mit kastrationsresistentem,
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer und Orion starten Phase-III-Studie mit neuartigem Krebspräparat ODM-201 bei Männern mit kastrationsresistentem,
Phase IIb-Studie bei Lungenhochdruck als Begleiterkrankung der idiopathischen interstitiellen Pneumonie gestartet
 Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer testet Riociguat in neuer Indikation Phase IIb-Studie bei Lungenhochdruck
Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer testet Riociguat in neuer Indikation Phase IIb-Studie bei Lungenhochdruck
Bayer wird mit Orion Corporation neue Behandlung von Prostatakrebs entwickeln und vermarkten
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer wird mit Orion Corporation neue Behandlung von Prostatakrebs entwickeln und vermarkten Berlin, 2. Juni
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer wird mit Orion Corporation neue Behandlung von Prostatakrebs entwickeln und vermarkten Berlin, 2. Juni
Phase III-Studie zur Behandlung von Nierentumoren gestartet. Erste vorläufige positive Ergebnisse in Phase II-Studie
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer HealthCare und Onyx Pharmaceuticals Phase III-Studie zur Behandlung von Nierentumoren gestartet Erste
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer HealthCare und Onyx Pharmaceuticals Phase III-Studie zur Behandlung von Nierentumoren gestartet Erste
SdK Unternehmenspräsentation Kaiserslautern
 SdK Unternehmenspräsentation Kaiserslautern 29. August 2012 I Peter Dahlhoff, Investor Relations Rechtliche Hinweise Diese Präsentation kann bestimmte in die Zukunft gerichtete Aussagen enthalten, die
SdK Unternehmenspräsentation Kaiserslautern 29. August 2012 I Peter Dahlhoff, Investor Relations Rechtliche Hinweise Diese Präsentation kann bestimmte in die Zukunft gerichtete Aussagen enthalten, die
BEYOND Studie: Ergebnisse stützen keinen Zulassungsantrag für 500 mcg Betaferon
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Therapie der Multiplen Sklerose BEYOND Studie: Ergebnisse stützen keinen Zulassungsantrag für 500 mcg Betaferon
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Therapie der Multiplen Sklerose BEYOND Studie: Ergebnisse stützen keinen Zulassungsantrag für 500 mcg Betaferon
Xarelto von Bayer erhält EU-Zulassung für die Sekundärprävention nach akutem Koronarsyndrom
 Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Xarelto von Bayer erhält EU-Zulassung für die Sekundärprävention nach akutem
Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Xarelto von Bayer erhält EU-Zulassung für die Sekundärprävention nach akutem
Aflibercept (Eylea) bei altersbedingter Makuladegeneration
 verstehen abwägen entscheiden Aflibercept (Eylea) bei altersbedingter Makuladegeneration Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) Inhaltsverzeichnis Überblick Einleitung
verstehen abwägen entscheiden Aflibercept (Eylea) bei altersbedingter Makuladegeneration Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) Inhaltsverzeichnis Überblick Einleitung
EMA bestätigt positives Nutzen-Risiko-Profil von Xarelto von Bayer zur Schlaganfallprävention bei Patienten mit nicht valvulärem Vorhofflimmern
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de EMA bestätigt positives Nutzen-Risiko-Profil von Xarelto von Bayer zur Schlaganfallprävention bei Patienten
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de EMA bestätigt positives Nutzen-Risiko-Profil von Xarelto von Bayer zur Schlaganfallprävention bei Patienten
Jahreskongress der American Society of Hematology (ASH) 2015:
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Jahreskongress der American Society of Hematology (ASH) 2015: Neue Daten aus der Praxisanwendung bei der Behandlung
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Jahreskongress der American Society of Hematology (ASH) 2015: Neue Daten aus der Praxisanwendung bei der Behandlung
Phase-III-Studie zur Kombinationstherapie von Nexavar und Tarceva bei Leberkrebs gestartet
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Phase-III-Studie zur Kombinationstherapie von Nexavar und Tarceva bei Leberkrebs gestartet Leverkusen, 28. Mai
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Phase-III-Studie zur Kombinationstherapie von Nexavar und Tarceva bei Leberkrebs gestartet Leverkusen, 28. Mai
Stivarga (Regorafenib) von Bayer in der EU zur Behandlung von gastrointestinalen Stromatumoren (GIST) zugelassen
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Stivarga (Regorafenib) von Bayer in der EU zur Behandlung von gastrointestinalen Stromatumoren (GIST) zugelassen
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Stivarga (Regorafenib) von Bayer in der EU zur Behandlung von gastrointestinalen Stromatumoren (GIST) zugelassen
Investor News. Nicht für US- und UK-Medien bestimmt
 Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Xarelto von Bayer in der EU zur Prävention von Schlaganfällen bei Patienten
Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Xarelto von Bayer in der EU zur Prävention von Schlaganfällen bei Patienten
Bayer startet neue Studien mit Rivaroxaban zur Verbesserung der medizinischen Versorgung von Patienten mit arteriellen Thromboembolien
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer startet neue Studien mit Rivaroxaban zur Verbesserung der medizinischen Versorgung von Patienten mit arteriellen
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer startet neue Studien mit Rivaroxaban zur Verbesserung der medizinischen Versorgung von Patienten mit arteriellen
Late-Breaking-Science-Präsentation auf dem ESC-Kongress 2015:
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Late-Breaking-Science-Präsentation auf dem ESC-Kongress 2015: Neue Daten aus klinischem Alltag bestätigen niedrige
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Late-Breaking-Science-Präsentation auf dem ESC-Kongress 2015: Neue Daten aus klinischem Alltag bestätigen niedrige
Neue Daten aus Phase-II-Studie zu Alemtuzumab bei Multipler Sklerose: Dreijährige Studie bestätigt Wirksamkeit von Alemtuzumab im Vergleich zu Rebif
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Neue Daten aus Phase-II-Studie zu Alemtuzumab bei Multipler Sklerose: Dreijährige Studie bestätigt Wirksamkeit
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Neue Daten aus Phase-II-Studie zu Alemtuzumab bei Multipler Sklerose: Dreijährige Studie bestätigt Wirksamkeit
Investor News. Bayer erhält in Japan Zulassung für Stivarga (Regorafenib) als Zweitlinienbehandlung von Leberkrebs
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer erhält in Japan Zulassung für Stivarga (Regorafenib) als Zweitlinienbehandlung von Leberkrebs Stivarga
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer erhält in Japan Zulassung für Stivarga (Regorafenib) als Zweitlinienbehandlung von Leberkrebs Stivarga
Gefährdungsbeurteilung beim Umgang mit Gefahrgütern
 Gefährdungsbeurteilung beim Umgang mit 02.07.2015 Bernd Kontenak Fachkraft für Arbeitssicherheit und Gefahrgutbeauftragter Bernd.Kontenak@Bayer.com Bernd Kontenak Bayer Pharma AG Berlin Fachkraft für Arbeitssicherheit
Gefährdungsbeurteilung beim Umgang mit 02.07.2015 Bernd Kontenak Fachkraft für Arbeitssicherheit und Gefahrgutbeauftragter Bernd.Kontenak@Bayer.com Bernd Kontenak Bayer Pharma AG Berlin Fachkraft für Arbeitssicherheit
Bayer reicht Zulassungsantrag für Riociguat zur Behandlung der pulmonal-arteriellen Hypertonie in Japan ein
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer reicht Zulassungsantrag für Riociguat zur Behandlung der pulmonal-arteriellen Hypertonie in Japan ein
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer reicht Zulassungsantrag für Riociguat zur Behandlung der pulmonal-arteriellen Hypertonie in Japan ein
DSW Aktienforum Bonn
 DSW Aktienforum Bonn 26. Juni 2012 I Peter Dahlhoff, Investor Relations Rechtliche Hinweise Diese Präsentation kann bestimmte in die Zukunft gerichtete Aussagen enthalten, die auf den gegenwärtigen Annahmen
DSW Aktienforum Bonn 26. Juni 2012 I Peter Dahlhoff, Investor Relations Rechtliche Hinweise Diese Präsentation kann bestimmte in die Zukunft gerichtete Aussagen enthalten, die auf den gegenwärtigen Annahmen
AMD kann das scharfe Sehen zerstören, das notwendig ist für Aktivitäten wie Lesen, Autofahren und für das Erkennen von Gesichtern.
 Was ist AMD? AMD (Altersbedingte Makuladegeneration) ist eine Erkrankung des Auges, bei der im Alter zu einer Schädigung der Stelle des schärfsten Sehens (Makula) kommt. AMD kann zum Verlust der Sehkraft
Was ist AMD? AMD (Altersbedingte Makuladegeneration) ist eine Erkrankung des Auges, bei der im Alter zu einer Schädigung der Stelle des schärfsten Sehens (Makula) kommt. AMD kann zum Verlust der Sehkraft
Ad-hoc Meldung nach 15 WpHG
 Ad-hoc Meldung nach 15 WpHG Investor Relations 51368 Leverkusen www.investor.bayer.de Bayer trifft bilanzielle Vorsorge in Höhe von 275 Mio für zivilrechtliche Kartellverfahren Leverkusen, 6. Dezember
Ad-hoc Meldung nach 15 WpHG Investor Relations 51368 Leverkusen www.investor.bayer.de Bayer trifft bilanzielle Vorsorge in Höhe von 275 Mio für zivilrechtliche Kartellverfahren Leverkusen, 6. Dezember
Bayer und Orion erweitern klinisches Studienprogramm für BAY (ODM-201) bei Prostatakrebs
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Onkologie bei Bayer: Bayer und Orion erweitern klinisches Studienprogramm für BAY- 1841788 (ODM-201) bei Prostatakrebs
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Onkologie bei Bayer: Bayer und Orion erweitern klinisches Studienprogramm für BAY- 1841788 (ODM-201) bei Prostatakrebs
Früherkennung mit dem OCT schützen Sie Ihr Augenlicht Netzhauterkrankungen & Grüner Star. Patienteninformation
 Früherkennung mit dem OCT schützen Sie Ihr Augenlicht Netzhauterkrankungen & Grüner Star Patienteninformation Die Augen sind die wichtigsten Sinnesorgane. Mit ihrer Hilfe orientieren wir uns und nehmen
Früherkennung mit dem OCT schützen Sie Ihr Augenlicht Netzhauterkrankungen & Grüner Star Patienteninformation Die Augen sind die wichtigsten Sinnesorgane. Mit ihrer Hilfe orientieren wir uns und nehmen
Antiangiogenetische Therapie bei neovaskulärer altersabhängiger Makuladegeneration
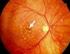 Antiangiogenetische Therapie bei neovaskulärer altersabhängiger Makuladegeneration VEGF Vascular Endothelial growth factor ist ein Protein, welches selektiv an Rezeptoren auf der Oberfläche von Gefäßendothelzellen
Antiangiogenetische Therapie bei neovaskulärer altersabhängiger Makuladegeneration VEGF Vascular Endothelial growth factor ist ein Protein, welches selektiv an Rezeptoren auf der Oberfläche von Gefäßendothelzellen
12. Jahreskongress der European Cardiac Arrhythmia Society (ECAS) 2016:
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de 12. Jahreskongress der European Cardiac Arrhythmia Society (ECAS) 2016: Neue Daten aus klinischem Alltag bestätigen
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de 12. Jahreskongress der European Cardiac Arrhythmia Society (ECAS) 2016: Neue Daten aus klinischem Alltag bestätigen
Phase-III-Zulassungsstudie mit Vericiguat bei Patienten mit chronischer Herzinsuffizienz begonnen
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Phase-III-Zulassungsstudie mit Vericiguat bei Patienten mit chronischer Herzinsuffizienz begonnen Leverkusen,
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Phase-III-Zulassungsstudie mit Vericiguat bei Patienten mit chronischer Herzinsuffizienz begonnen Leverkusen,
Bayer Pharma AG Berlin Deutschland Tel Presse-Information
 Presse-Information Bayer Pharma AG 13342 Berlin Deutschland Tel. +49 30 468-1111 www.bayerpharma.de Bayer erhält US-Zulassung für Adempas (Riociguat), den ersten Stimulator der löslichen Guanylatcyclase,
Presse-Information Bayer Pharma AG 13342 Berlin Deutschland Tel. +49 30 468-1111 www.bayerpharma.de Bayer erhält US-Zulassung für Adempas (Riociguat), den ersten Stimulator der löslichen Guanylatcyclase,
Behandlung der feuchten altersabhängigen Makuladegeneration (feuchte AMD) mit VEGF-Hemmern durch operative Medikamenteneingabe in das Auge
 Augenarztpraxis AltenKirchen Dr. med. Thomas Wehler Facharzt für Augenheilkunde Wilhelmstr. 32 Schlossweg 2 57610 Altenkirchen Tel 02681-1651 Fax 02681-6094 Mail info@ak-augenarzt.de Net www.ak-augenarzt.de
Augenarztpraxis AltenKirchen Dr. med. Thomas Wehler Facharzt für Augenheilkunde Wilhelmstr. 32 Schlossweg 2 57610 Altenkirchen Tel 02681-1651 Fax 02681-6094 Mail info@ak-augenarzt.de Net www.ak-augenarzt.de
Riociguat von Bayer erstes wirksames Medikament bei Patienten mit chronisch-thromboembolischer pulmonaler Hypertonie (CTEPH)
 Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Riociguat von Bayer erstes wirksames Medikament bei Patienten mit chronisch-thromboembolischer
Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Riociguat von Bayer erstes wirksames Medikament bei Patienten mit chronisch-thromboembolischer
Priv.-Doz. Dr. med. Monika Fleckenstein Universitäts-Augenklinik Bonn. Ophthalmologische Fortbildung für medizinische Fachangestellte 25.
 Neuigkeiten aus der IVOM-Sprechstunde Priv.-Doz. Dr. med. Monika Fleckenstein Universitäts-Augenklinik Bonn Ophthalmologische Fortbildung für medizinische Fachangestellte 25. März 2015 Altersabhängige
Neuigkeiten aus der IVOM-Sprechstunde Priv.-Doz. Dr. med. Monika Fleckenstein Universitäts-Augenklinik Bonn Ophthalmologische Fortbildung für medizinische Fachangestellte 25. März 2015 Altersabhängige
mit symptomatischen Knochenmetastasen beim CRPC
 Innovation aus der Bayer Onkologie-Entwicklung: Xofigo Eine neue Therapieoption für Patienten mit s Innovation aus der Bayer Onkologie-Entwicklung Xofigo Eine neue Therapieoption für Patienten mit symptomatischen
Innovation aus der Bayer Onkologie-Entwicklung: Xofigo Eine neue Therapieoption für Patienten mit s Innovation aus der Bayer Onkologie-Entwicklung Xofigo Eine neue Therapieoption für Patienten mit symptomatischen
Internationaler Kongress der American Thoracic Society 2013:
 Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Internationaler Kongress der American Thoracic Society 2013: Bayer stellt
Investor News Nicht für US- und UK-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Internationaler Kongress der American Thoracic Society 2013: Bayer stellt
Humira jetzt bei polyartikulärer juveniler idiopathischer Arthritis für Kinder ab vier Jahren zugelassen
 EU-Zulassungserweiterung für Adalimumab (Humira ) Humira jetzt bei polyartikulärer juveniler idiopathischer Arthritis für Kinder ab vier Jahren zugelassen Wiesbaden/Ludwigshafen (1. Juli 2011) Die Europäische
EU-Zulassungserweiterung für Adalimumab (Humira ) Humira jetzt bei polyartikulärer juveniler idiopathischer Arthritis für Kinder ab vier Jahren zugelassen Wiesbaden/Ludwigshafen (1. Juli 2011) Die Europäische
PATIENTENRATGEBER DAS DIABETISCHE MAKULAÖDEM (DMÖ)
 PATIENTENRATGEBER DAS DIABETISCHE MAKULAÖDEM (DMÖ) URSACHEN THERAPIE PRÄVENTION INHALTSVERZEICHNIS DAS DIABETISCHE MAKULAÖDEM 3 8 16 Das diabetische Makulaödem Behandlungsmöglichkeiten für das diabetische
PATIENTENRATGEBER DAS DIABETISCHE MAKULAÖDEM (DMÖ) URSACHEN THERAPIE PRÄVENTION INHALTSVERZEICHNIS DAS DIABETISCHE MAKULAÖDEM 3 8 16 Das diabetische Makulaödem Behandlungsmöglichkeiten für das diabetische
IVOM welches Medikament bei welcher Erkrankung
 IVOM welches Medikament bei welcher Erkrankung GIO IVOM - KURS 2016 Neumünster Arnd Bunse F.E.B.O. Augenärzte BEP Schwerpunktpraxis für Netzhaut- und Makulaerkrankungen 21029 Hamburg www.augenaerzte-bep-bergedorf.de
IVOM welches Medikament bei welcher Erkrankung GIO IVOM - KURS 2016 Neumünster Arnd Bunse F.E.B.O. Augenärzte BEP Schwerpunktpraxis für Netzhaut- und Makulaerkrankungen 21029 Hamburg www.augenaerzte-bep-bergedorf.de
kolorektalen Karzinoms
 Signifikante Lebensverlängerung durch Angiogenese-Hemmung Avastin in der First-Line-Therapie des metastasierten kolorektalen Karzinoms Berlin (24. März 2006) - Erhalten Patienten mit metastasiertem kolorektalen
Signifikante Lebensverlängerung durch Angiogenese-Hemmung Avastin in der First-Line-Therapie des metastasierten kolorektalen Karzinoms Berlin (24. März 2006) - Erhalten Patienten mit metastasiertem kolorektalen
LUCENTIS bei Visusbeeinträchtigung infolge eines Makulaödems aufgrund eines retinalen Venenverschlusses (RVV)
 DIE WELT IST WUNDERSCHÖN ANZUSEHEN LUCENTIS bei Visusbeeinträchtigung infolge eines Makulaödems aufgrund eines retinalen Venenverschlusses (RVV) Ihr Leitfaden für die Behandlung mit LUCENTIS Teil 1 Über
DIE WELT IST WUNDERSCHÖN ANZUSEHEN LUCENTIS bei Visusbeeinträchtigung infolge eines Makulaödems aufgrund eines retinalen Venenverschlusses (RVV) Ihr Leitfaden für die Behandlung mit LUCENTIS Teil 1 Über
Merck beantragt Zulassung in den USA für Cladribin-Tabletten als mögliche orale Kurzzeitbehandlung der Multiplen Sklerose
 Merck beantragt Zulassung in den USA für Cladribin-Tabletten als mögliche orale Kurzzeitbehandlung der Multiplen Sklerose Darmstadt (30. September 2009) - Die Merck KGaA hat heute bekannt gegeben, dass
Merck beantragt Zulassung in den USA für Cladribin-Tabletten als mögliche orale Kurzzeitbehandlung der Multiplen Sklerose Darmstadt (30. September 2009) - Die Merck KGaA hat heute bekannt gegeben, dass
Rivaroxaban von Bayer zeigte besseren Schutz vor wiederkehrenden venösen Thromboembolien im Vergleich zu Aspirin in EINSTEIN CHOICE-Studie
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Neue Late-Breaking-Studiendaten beim ACC.17 vorgestellt: Rivaroxaban von Bayer zeigte besseren Schutz vor wiederkehrenden
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Neue Late-Breaking-Studiendaten beim ACC.17 vorgestellt: Rivaroxaban von Bayer zeigte besseren Schutz vor wiederkehrenden
FDA gewährt Entwicklungskandidat Copanlisib von Bayer vorrangige Prüfung für Follikuläres Lymphom
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de FDA gewährt Entwicklungskandidat Copanlisib von Bayer vorrangige Prüfung für Follikuläres Lymphom Zulassungseinreichung
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de FDA gewährt Entwicklungskandidat Copanlisib von Bayer vorrangige Prüfung für Follikuläres Lymphom Zulassungseinreichung
