N & T (R) 4 Chemische Verfahren 01 Name: Vorname: Datum:
|
|
|
- Hinrich Maier
- vor 7 Jahren
- Abrufe
Transkript
1 N & T (R) 4 Chemische Verfahren 01 Name: Vorname: Datum: Schon zur Zeit der Griechen (vor 2500 Jahren) wurde geglaubt, dass alle Dinge auf der Erde aus kleinsten Teilchen bestehen. Auch wenn er sie zu dieser Zeit nur vermutete, so gab Demokrit ihnen dennoch einen Namen: Atome (von griechisch atomos = unteilbar) Dieses Modell griff John Dalton ( ) um 1803 wieder auf, als er sie auf Grund verschiedener Beobachtungen neu definierte: Atome haben kugelförmige Gestalt. Atome ändern sich nicht (nicht teilbar, können weder vernichtet noch erzeugt werden). Elemente besitzen gleichartige Atome. Atome verschiedener Elemente unterscheiden sich in Grösse und Masse. Jedes Atom kann sich nur mit einer bestimmten Anzahl von andern Atomen verbinden (hat eine bestimmte Anzahl Bindungsstellen). Durchmesser eines Atoms: Gewicht eines Atoms: ca. 0, mm ca. 0, g Als Vergleich: Ein Atom ist im Vergleich zu einem Apfel etwa so gross wie ein Apfel im Vergleich zur Erde. In einem Liter Wasser hat es: Atome = Atome Aufgabe 1: Element (Atom) wie Helium Element (Molekül) wie Sauerstoff Element (met. Gitter) wie Eisen Aufgabe 2: Verbindung (Molekül) wie reines Wasser Verbindung (Ion. Gitter) wie Kochsalz Gemisch wie Luft Molekülgemisch wie Apfelsaft
2 N & T (R) 4 Chemische Verfahren 01 Aufgabe 3: Fülle die Tabelle gemäss Theorie: fest / fest: Beispiele: fest / flüssig: fest / gasförmig: flüssig / flüssig: flüssig / gasförmig: fest / fest: beliebig / flüssig: gasförmig / gasförmig: Aufgabe 4: Füge als Beispiele folgende Stoffe ein: Bimsstein (Gestein aus Vulkanen), Eisen (typisches Metall), Granit (häufige Steinart), Helium (Gas für Ballone), Kochsalz, Luft, Messing (goldenes Metall), Methan (in Verdauungsgasen), Milch, Mineralwasser (aus der Flasche), Nitinol (spezielles Metall), Rasierschaum, Sauerstoff (lebensnotwendiges Gas), Schlamm
3 N & T (R) 4 Chemische Verfahren 02 Name: Vorname: Datum: Gemische gibt es nahezu unendlich viele, sowohl homo- als auch heterogene. Die Anzahl der Verbindungen ist ebenfalls nahezu unendlich. Ganz im Gegensatz dazu ist die Anzahl der Elemente stark begrenzt. Es gibt bis jetzt (August 2011) genau 118. Davon kommen 94 Elemente natürlich vor. Diese werden uns interessieren. Hauptgruppe: Untergruppe: Für uns wichtig: 7 Alkali- und 7 Erdalkalimetalle Kalzium, Natrium 68 Metalle 35 Übergangsmetalle Gold, Silber, Kupfer, Zinn, Quecksilber, Blei, Eisen, Aluminium 14 Lanthaniden und 5 Actiniden Uran 7 Halbmetalle - Silizium 19 Nichtmetalle Die wichtigsten Metalle: 6 Edelgase Helium, Neon 5 Halogene und 8 andere Sauerstoff, Wasserstoff, Stickstoff, Chlor, Kohlenstoff, Schwefel Ca Kalzium weich, silberweiss im Kalk, in Knochen, Zement Na Natrium weich, schneidbar, glänzend im Kochsalz, Seifen Ag Silber härter als Gold Münzen, Besteck, Fotografie Al Aluminium leicht verformbar, Leiter wichtigstes Leichtmetall Au Gold schwer, weich, beständig Münzen, Schmuck, Zahnarzt Cu Kupfer guter elektrischer Leiter Elektrotechnik, Pfannen Fe Eisen rostet rasch, magnetisch wichtigstes Gebrauchsmetall Hg Quecksilber flüssig bei Zimmertemperatur Thermometer, Lampen Pb Blei schwer, leicht schmelzbar Rohre, Kabel, Akkus Sn Zinn silberweiss, glänzend, dehnbar Überzug von Blechen, Gefässe U Uran schwer, schwach radioaktiv Kernbrennstoff Die wichtigsten Nichtmetalle: O Sauerstoff farb-, geruchs-, geschmacklos 21% der Luft, Atmungsgeräte H Wasserstoff farb-, geruchs-, geschmacklos Brennstoff, Ballonfüllungen N Stickstoff farb-, geruchs-, geschmacklos 78% der Luft, Düngemittel He Helium farb-, geruchs-, geschmacklos Ballonfüllung Cl Chlor giftig, gelbgrün, riechend Bleichmittel, Schwimmbad
4 N & T (R) 4 Chemische Verfahren 02 C Kohlenstoff Graphit: schwarz, weich Diamant: hart, farblos Bestandteil pflanzlicher und tierischer Stoffe, Kohle S Schwefel gelb, brennbar im Gummi, Spritzmittel, Haare Si Silizium grau-schwarz, metallisch Halbleitergrundstoff Ne Neon farb-, geruchs-, geschmacklos Leuchtreklame, Sparlampen Die Abkürzungen sind wichtig, da Chemiker meist nur diese verwenden. Die Abkürzungen kommen alle vom lateinischen (selten griechischen) Wort dieses Elements her: Ag = Argentum Al = Aluminium Au = Aurum C = Carboneum Ca = Calcium Cl = Chlor Cu = Cuprum Fe = Ferrum H = Hydrogenium He = Helium Hg = Hydrargyrum N = Nitrogenium Na = Natrium Ne = Neon O = Oxygenium Pb = Plumbum S = Sulfur Si = Silicium Sn = Stannum U = Uranium Aufgabe 1: Welche der obigen Abkürzungen kann man sich besonders gut merken, da sie sofort auf das Element schliessen lassen, wofür sie stehen: Aufgabe 2: Nenne diejenigen Abkürzungen, die mit dem deutschen Namen nichts zu tun haben und deshalb speziell gelernt werden sollten:
5 N & T (R) 4 Chemische Verfahren 03 Name: Vorname: Datum: Gemische auftrennen: Gemische herstellen: Verbindungen auftrennen: Verbindungen herstellen: Verbindungen überführen: Elemente überführen: Physikalisches Verfahren (fraktionieren) sedimentieren, zentrifugieren, dekantieren, sieben, filtrieren, eindampfen, destillieren, magnetscheiden, adsorbieren, chromatografieren Physikalisches Verfahren (mischen) Chemisches Verfahren (Analyse, Reduktion) Chemisches Verfahren (Synthese, Oxidation) Chemisches Verfahren (Redoxreaktion) Physikalisches Verfahren (Kernreaktionen) Aufgabe 1: Wir führen eine Thermolyse (Analyse mit Hilfe von Wärme) durch. Dazu wird Silberoxid in einem Reagenzglas über der Flamme erhitzt. Beschreibe das Silberoxid: Silberoxid (Lehrperson gibt) Erwärme das Silberoxid über dem Bunsenbrenner. Beschreibe, was geschieht: Beschreibe das Endprodukt im Reagenzglas: Aufgabe 2: Schreibe auf, welcher Stoffe hier analysiert wird und welche gefunden werden:
6 N & T (R) 4 Chemische Verfahren 03 Aufgabe 3: Wir führen eine Elektrolyse (Analyse mit Hilfe von elektrischem Strom durch). Dazu wird angesäuertes Wasser in einem Hoffmann schen Apparat unter Spannung gesetzt: Beschreibe den Aufbau des Hoff-mann schen Apparates: Was geschieht, wenn er unter Spannung steht? Beschreibe / Zeichne ein. Freiwillig! Entnimm der kleinen Gasmenge eine Probe und führe einen Glimmspan ein. Beschreibe: Glimmspanprobe Freiwillig! Entnimm der grösseren Gasmenge eine Probe und halte eine Flamme oben ans Reagenzglas. Beschreibe: Knallgasprobe Aufgabe 4: a) Schreibe auf, welcher Stoffe hier analysiert wird und welche gefunden werden: b) In welchem Verhältnis stehen die beiden Stoffe? Von welchem hat es mehr, von welchem weniger? Wir stellen fest: Beim chemischen Verfahren ist das Mischverhältnis wichtig, zudem ändern sich die Stoffeigenschaften.
7 N & T (R) 4 Chemische Verfahren 04 Name: Vorname: Datum: Aufgabe 1: a) Die Lehrperson wiegt für rund 5 Gruppen 12 g Eisen und 21 g Schwefel ab. b) Die beiden Stoffe werden von der Lehrperson zerstossen und gut gemischt. c) Betrachte das Gemisch mit Auge oder einer Lupe und male die Struktur in den Kreis des ersten Feldes oben links. d) Gib das Gemisch in ein Reagenzglas. (Trichter verwenden!) e) Beschreibe (ins zweite Feld links), was geschieht, wenn man einen Magneten an dieses Gemisch hält. f) Erhitze das Gemisch über der Flamme. Beschreibe. Achte auf Dämpfe! Beschreibe, was geschieht: (ins breite Feld in der Mitte) g) Wenn es genug kühl ist: Zerstossen und den Versuch mit dem Magneten bzw. der Lupe mit der Verbindung durchführen: (in die rechten Felder) h) Tut euch mit einer anderen Gruppe zusammen. Die Lehrperson schlämmt eine Verbindung auf und versetzt eine andere mit Salzsäure. Notiert die Beobachtungen. Lupe Gemisch Eisen / Schwefel Verbindung Eisensulfid Magnet: Reaktionsbeschreibung: Salzsäure Aufgabe 2: Schreibe auf, welche Stoffe hier synthetisiert werden und welcher dabei entsteht:
8 N & T (R) 4 Chemische Verfahren 04 Aufgabe 3: Bei diesem Versuch ist es ganz wichtig, dass du den Ablauf befolgst! a) Wäge ein Stück Eisenwatte. Trage das Gewicht bei 1. Versuch ein. b) Glühe die erste Eisenwatte in der normalen Umgebungsluft (evtl. in Sauerstoff) durch. Beschreibe unter Reaktionsbeschreibung. c) Wäge die Eisenwatte ein zweites Mal und trage das Gewicht unten ein. d) Wäge ein zweites Stück Eisenwatte. Trage das Gewicht bei 2. Versuch ein. e) Glühe die erste Eisenwatte in der normalen Umgebungsluft (evtl. in Sauerstoff) durch. Beschreibe unter Reaktionsbeschreibung. f) Wäge die Eisenwatte ein zweites Mal und trage das Gewicht unten ein. 1. Versuch 2. Versuch Gewicht zu Beginn: Reaktionsbeschreibung Gewicht am Ende: Aufgabe 4: Begründe, warum es diese Gewichtsveränderung bei Aufgabe 3 gegeben hat: Aufgabe 5: a) Lasse eine Kerze in einem Wasserbecken schwimmen. b) Zünde sie an und warte, bis sie gut brennt. c) Setze dann schnell ein hohes Becherglas über die Kerze, so dass keine Luft mehr dazu kommt. d) Beschreibe, was geschieht: e) Begründung?
9 N & T (R) 4 Chemische Verfahren 05 Name: Vorname: Datum: Aufgabe 1: Lasse eine Kerze in Luft brennen. Beschreibe und zeichne: Lasse eine Kerze in Sauerstoff brennen. Beschreibe und zeichne: Die Luft ist ein Gemisch aus verschiedenen Gasen: 78 % Stickstoff 21 % Sauerstoff 1 % verschiedene Gase, darunter Kohlendioxid, Kohlenmonoxid, Edelgase, Ozon, Wasserstoff, Methan usw. Dazu kommen Staub, Verunreinigungen usw. In der Luft ist immer auch ein gewisser Anteil an Wasserdampf (relative Luftfeuchtigkeit) vorhanden. Sauerstoff ist ein reiner Stoff (Molekül): Dichte: Siedetemp.: Schmelztemp.: 1,33 g/l -183 C -219 C reagiert mit fast allen Elementen zu Oxiden Gewinnung durch Luftverflüssigung: Sauerstoff wird bei -183 C, Stickstoff bei -196 C flüssig. Kühlt man in einer Kältemaschine auf diese tiefen Temperaturen ab, so lassen sich die Gase trennen. In blauen (roten) Druckflaschen. Eine chemische Synthese mit Sauerstoff heisst Oxidation i. e. S. (Verbrennung). Die dabei entstehenden Verbindungen enden meist auf -oxid: Kohlendioxid, Silberoxid Stille Oxidation: Verbrennung: Explosion: langsame Oxidation Typisch: Eisen rostet, Silber läuft an, Kupfer wird zu Grünspan mittelschnelle Oxidation Typisch: Aluminium verbrennt, Magnesium verbrennt sehr schnelle Oxidation Typisch: Kalium explodiert, Natrium explodiert, Knallgas
10 N & T (R) 4 Chemische Verfahren 05 Aufgabe 2: a) Beispiel einer langsamen Oxidation: Die Lehrperson befeuchtet ein hohes Becherglas innen und bestreut es danach mit Eisenpulver. Anschliessend stellt sie es wie abgebildet in eine Wanne. Betrachte die Versuchsanordnung eine Woche später und beschreibe, was geschehen ist: b) Schreibe auf, welche Stoffe an der Reaktion beteiligt sind: Aufgabe 3: Beispiel einer mittelschnellen Oxidation: a) Halte ein Plättchen Magnesium in die Flamme eines Bunsenbrenners. Beschreibe: b) Schreibe auf, welche Stoffe an der Reaktion beteiligt sind: Aufgabe 4: Dieser Versuch wird auf Grund der Verletzungsgefahr nur durchgeführt, wenn die Abteilung entsprechend konzentriert und genau arbeitet. Ansonsten fällt er ersatzlos weg. Beispiel einer sehr schnellen Oxidation: Ein kleiner Ballon wird mit Wasserstoff gefüllt (dies macht die Lehrperson). Damit gehen wir nach draussen: a) Draussen wird eine Kerze an der Stange an den Ballon gehalten. Beschreibe, was geschieht: b) Schreibe auf, welche Stoffe an der Reaktion beteiligt sind: Diese Oxidation ist ein Ersatz für die früher häufig durchgeführte Oxidation von Kalium. Diese ist seit dem tödlichen Unfall vom März 2003 in Goldach (SG) verboten.
11 N & T (R) 4 Chemische Verfahren 06 Name: Vorname: Datum: Bei der Oxidation wird bei der Reaktion jeweils Sauerstoff aufgenommen: Eisen + Sauerstoff ==Oxidation==> Eisenoxid (Rost) Magnesium + Sauerstoff ==Oxidation==> Magnesiumoxid (Magnesium im Sport) Wasserstoff + Sauerstoff ==Oxidation==> Wasser Die gegenteilige Reaktion, wenn Sauerstoff abgegeben wird, nennt man Reduktion: Silberoxid ==Reduktion==> Silber + Sauerstoff Wasser ==Reduktion==> Wasserstoff + Sauerstoff Aufgabe 1: Analyse, Synthese, Oxidation und Reduktion sind unabhängig voneinander definiert. Dennoch kann man zwei einander zuordnen, da die Gleichheit häufig zutrifft: ist meist eine. ist meist eine. Aufgabe 2: Mische 2,03 g Zinkpulver und 2,5 g Kupferoxid in einer Schale und gib es anschliessend in ein Reagenzglas. Erhitze das Reagenzglas über dem Bunsenbrenner. Beschreibe: Bei vielen Reaktionen treten Oxidation und Reduktion gleichzeitig auf (wie in Aufgabe 4): Kupferoxid ==Reduktion==> Kupfer + Sauerstoff Zink + Sauerstoff ==Oxidation==> Zinkoxid In einem solchen Fall spricht man von einer Redoxreaktion (REDuktion / OXidation): Kupferoxid + Zink ==Redoxreaktion==> Kupfer + Zinkoxid Aufgabe 3: a) Zünde eine Kerze an und lasse diese in ein Becherglas hinunter b) Beschreibe:
12 N & T (R) 4 Chemische Verfahren 06 Aufgabe 4: a) Fülle Kohlendioxid in ein Becherglas. b) Lasse die Kerze ins Becherglas mit dem Kohlendioxid hinunter. c) Beschreibe: Aufgabe 5: a) Lasse eine Kerze in einem luftgefüllten Becherglas brennen. b) Giesse (oder tu zumindest so) das Kohlendioxid ins Becherglas mit der brennenden Kerze. c) Beschreibe: d) Was lässt sich über die Dichte von Kohlendioxid sagen? Kohlenmonoxid (CO) ist eine instabile Verbindung (Molekül) Dichte: 1,25 g/l Siedetemp.: -191,6 C Schmelztemp.: -205,1 C Entsteht bei Verbrennungen ohne genügend Sauerstoff (Auto, Zigarettenrauch) Grillen in der Wohnung häufigste Ursache für eine Kohlenmonoxidvergiftung. Ist sehr giftig (ab 0,02 % der Luft tödlich), geschmacks-, geruchs- und farblos. Verbrennt mit blauer Flamme zu Kohlendioxid. Kohlendioxid (CO 2 ) ist eine Verbindung (Molekül): Dichte: 1,98 g/l Siedetemp.: nicht vorhanden Schmelztemp.: -56,6 C ist ein Reaktionsprodukt fast aller organischer Verbrennungen. Ist ungiftig, geschmack-, geruchs- und farblos. Führt erst in höheren Konzentrationen (> 15 % der Luft) zum Ersticken. Hauptverwendung für Kohlensäure, Trockeneis, Feuerlöschmittel. In grauen Druckflaschen. Aufgabe 6: Was sollte man tun, wenn man in einen Raum kommt, indem besonders viel CO 2 gebildet wird (offenes Feuer in einem kleinen Raum, Brunnenschacht, Bunker, Keller mit Gärungsprozessen von Most oder Wein).
N & T 4 Chemische Verfahren 01 Name: Vorname: Datum:
 N & T 4 Chemische Verfahren 01 Name: Vorname: Datum: Schon zur Zeit der Griechen (vor 2500 Jahren) wurde geglaubt, dass alle Dinge auf der Erde aus kleinsten Teilchen bestehen. Auch wenn er sie zu dieser
N & T 4 Chemische Verfahren 01 Name: Vorname: Datum: Schon zur Zeit der Griechen (vor 2500 Jahren) wurde geglaubt, dass alle Dinge auf der Erde aus kleinsten Teilchen bestehen. Auch wenn er sie zu dieser
Chemische Reaktionen. Wir erzeugen Wasser
 hemische Reaktionen + Natrium + -> hlor -> Natriumchlorid = Kochsalz Wir erzeugen Wasser Die kleinsten Teilchen des Sauerstoffes und des Wasserstoffes waren im roten Ballon bereits gut durchmischt. Daher
hemische Reaktionen + Natrium + -> hlor -> Natriumchlorid = Kochsalz Wir erzeugen Wasser Die kleinsten Teilchen des Sauerstoffes und des Wasserstoffes waren im roten Ballon bereits gut durchmischt. Daher
Wasserstoff. Helium. Bor. Kohlenstoff. Standort: Name: Ordnungszahl: Standort: Name: Ordnungszahl: 18. Gruppe. Standort: Ordnungszahl: Name:
 H Wasserstoff 1 1. Gruppe 1. Periode He Helium 2 18. Gruppe 1. Periode B Bor 5 13. Gruppe C Kohlenstoff 6 14. Gruppe N Stickstoff 7 15. Gruppe O Sauerstoff 8 16. Gruppe Ne Neon 10 18. Gruppe Na Natrium
H Wasserstoff 1 1. Gruppe 1. Periode He Helium 2 18. Gruppe 1. Periode B Bor 5 13. Gruppe C Kohlenstoff 6 14. Gruppe N Stickstoff 7 15. Gruppe O Sauerstoff 8 16. Gruppe Ne Neon 10 18. Gruppe Na Natrium
Chemie Fragenkatalog Jahrgang 8
 Chemie Fragenkatalog Jahrgang 8 - Stoffe und ihre Eigenschaften - Stoffgemische und Trennverfahren - Vom Aufbau der Stoffe - Die chemische Reaktion - Luft und Verbrennung - Gewinnung von Metallen Redoxreaktionen
Chemie Fragenkatalog Jahrgang 8 - Stoffe und ihre Eigenschaften - Stoffgemische und Trennverfahren - Vom Aufbau der Stoffe - Die chemische Reaktion - Luft und Verbrennung - Gewinnung von Metallen Redoxreaktionen
Die chemische Reaktion
 Die chemische Reaktion 1. Versuch In eine mit Sauerstoff gefüllte Flasche halten wir ein Stück brennenden Schwefel. Aus den beiden Ausgangsstoffen (Edukten) entsteht ein neuer Stoff (Produkt) mit eigenen,
Die chemische Reaktion 1. Versuch In eine mit Sauerstoff gefüllte Flasche halten wir ein Stück brennenden Schwefel. Aus den beiden Ausgangsstoffen (Edukten) entsteht ein neuer Stoff (Produkt) mit eigenen,
1.11 Welcher Stoff ist es?
 L *** 1.11 Welcher Stoff ist es? Didaktisch-methodische Hinweise Im Arbeitsblatt wird der Versuch des Lösens von vier verschiedenen Salzen in Wasser in einem Labor beschrieben. Aus Zahlenangaben müssen
L *** 1.11 Welcher Stoff ist es? Didaktisch-methodische Hinweise Im Arbeitsblatt wird der Versuch des Lösens von vier verschiedenen Salzen in Wasser in einem Labor beschrieben. Aus Zahlenangaben müssen
Lösungen Thema: Stoffe und ihre Eigenschaften
 Lösungen Thema: Stoffe und ihre Eigenschaften zu 1: Siedetemperatur, Schmelztemperatur, Dichte (Löslichkeit) zu 2: Brennbarkeit, Härte, Löslichkeit, Farbe, Geruch zu 3: zu 4: Bei der Flüssigkeit handelt
Lösungen Thema: Stoffe und ihre Eigenschaften zu 1: Siedetemperatur, Schmelztemperatur, Dichte (Löslichkeit) zu 2: Brennbarkeit, Härte, Löslichkeit, Farbe, Geruch zu 3: zu 4: Bei der Flüssigkeit handelt
KSO METALLE (SEKP) Skript Metalle (SekP) V1.0 04/15 Bor
 1 KSO METALLE (SEKP) Skript Metalle (SekP) V1.0 04/15 Bor 2 INHALTSVERZEICHNIS "METALLE" 1. Einleitung...03 2. Reaktionen von Metallen... 05 3. Gewinnung von Metallen... 07 4. Domino: Eigenschaften der
1 KSO METALLE (SEKP) Skript Metalle (SekP) V1.0 04/15 Bor 2 INHALTSVERZEICHNIS "METALLE" 1. Einleitung...03 2. Reaktionen von Metallen... 05 3. Gewinnung von Metallen... 07 4. Domino: Eigenschaften der
LB1 Stoffe. LB1 Stoffe. LB1 Stoffe. Womit beschäftigt sich die Chemie?
 Lernkartei Klasse 7 LB1: Stoffe Womit beschäftigt sich die Chemie? LB1 Stoffe mit den Stoffen, ihren Eigenschaften und ihren Veränderungen (Stoffumwandlungen) Was sind Stoffe? LB1 Stoffe Stoffe sind die
Lernkartei Klasse 7 LB1: Stoffe Womit beschäftigt sich die Chemie? LB1 Stoffe mit den Stoffen, ihren Eigenschaften und ihren Veränderungen (Stoffumwandlungen) Was sind Stoffe? LB1 Stoffe Stoffe sind die
Grundkenntnisse der Chemie und der Physik. Was ihr hier findet
 Grundkenntnisse der hemie und der Physik P Was ihr hier findet Wissensgebiete der hemie und der Physik Formeln Elemente Metalle Kohlenstoff Analyse Synthese Basen Laugen Salze Atome Moleküle Akustik Optik
Grundkenntnisse der hemie und der Physik P Was ihr hier findet Wissensgebiete der hemie und der Physik Formeln Elemente Metalle Kohlenstoff Analyse Synthese Basen Laugen Salze Atome Moleküle Akustik Optik
Integration von Schülerinnen und Schülern mit einer Sehschädigung an Regelschulen. Didaktikpool
 Integration von Schülerinnen und Schülern mit einer Sehschädigung an Regelschulen Didaktikpool Periodensystem der Elemente für blinde und hochgradig sehgeschädigte Laptop-Benutzer Reinhard Apelt 2008 Technische
Integration von Schülerinnen und Schülern mit einer Sehschädigung an Regelschulen Didaktikpool Periodensystem der Elemente für blinde und hochgradig sehgeschädigte Laptop-Benutzer Reinhard Apelt 2008 Technische
Chemie ist eine naturwissenschaftliche Disziplin, welche sich mit den Stoffen, den Stoffeigenschaften und den Stoffumwandlungen beschäftigt.
 1 Definition: Chemie ist eine naturwissenschaftliche Disziplin, welche sich mit den Stoffen, den Stoffeigenschaften und den Stoffumwandlungen beschäftigt. 2 Erscheinungsformen der Materie Homogen oder
1 Definition: Chemie ist eine naturwissenschaftliche Disziplin, welche sich mit den Stoffen, den Stoffeigenschaften und den Stoffumwandlungen beschäftigt. 2 Erscheinungsformen der Materie Homogen oder
Was passiert, wenn Schwefeldampf über einen heissen Kupferblechstreifen streicht?
 Posten 1a Was passiert, wenn Schwefeldampf über einen heissen Kupferblechstreifen streicht? a) es entsteht Wasserdampf (Wassertropfen kondensieren am Streifen) (=> Posten 5l) b) der Schwefeldampf wird
Posten 1a Was passiert, wenn Schwefeldampf über einen heissen Kupferblechstreifen streicht? a) es entsteht Wasserdampf (Wassertropfen kondensieren am Streifen) (=> Posten 5l) b) der Schwefeldampf wird
Die chemische Reaktion
 Die chemische Reaktion 1. Versuch In eine mit Sauerstoff gefüllte Flasche halten wir ein Stück brennenden Schwefel. Beobachtung : Der gelbe Schwefel verbrennt mit blauer Flamme. Dabei wird Wärme frei und
Die chemische Reaktion 1. Versuch In eine mit Sauerstoff gefüllte Flasche halten wir ein Stück brennenden Schwefel. Beobachtung : Der gelbe Schwefel verbrennt mit blauer Flamme. Dabei wird Wärme frei und
Physik/Chemie 4.Klasse: Alle Fragen für den letzten PC Test
 Physik/Chemie 4.Klasse: Alle Fragen für den letzten PC Test 1 Nenne fünf Bereiche, mit denen sich die Physik beschäftigt. 2 Wie nennt man einen Stoff, der den Strom leiten kann? 3 Wie nennt man einen Stoff,
Physik/Chemie 4.Klasse: Alle Fragen für den letzten PC Test 1 Nenne fünf Bereiche, mit denen sich die Physik beschäftigt. 2 Wie nennt man einen Stoff, der den Strom leiten kann? 3 Wie nennt man einen Stoff,
1 Chemische Elemente und chemische Grundgesetze
 1 Chemische Elemente und chemische Grundgesetze Die Chemie ist eine naturwissenschaftliche Disziplin. Sie befasst sich mit der Zusammensetzung, Charakterisierung und Umwandlung von Materie. Unter Materie
1 Chemische Elemente und chemische Grundgesetze Die Chemie ist eine naturwissenschaftliche Disziplin. Sie befasst sich mit der Zusammensetzung, Charakterisierung und Umwandlung von Materie. Unter Materie
Anorganische Chemie! der unbelebten Natur keine Kohlenstoffverbindung (Kohlenstoffatome C) Metall Nichtmetallverbindungen Ionenbindung
 3 Chemie / Physik 3.1 Eigenheiten der Chemie und Physik Chemie ist die Lehre von den Stoffen, ihrer Zusammensetzung, dem Aufbau, der Struktur und ihrer Umwandlung Die Chemie untersucht und beschreibt die
3 Chemie / Physik 3.1 Eigenheiten der Chemie und Physik Chemie ist die Lehre von den Stoffen, ihrer Zusammensetzung, dem Aufbau, der Struktur und ihrer Umwandlung Die Chemie untersucht und beschreibt die
Steckbrief von Sauerstoff, O 2
 Steckbrief von Sauerstoff, O 2 farblos, d.h. unsichtbar, nur in sehr dicken Schichten himmelblau geruch- und geschmacklos - Etwas schwerer als Luft - notwendig für die Verbrennung, brennt aber nicht selbst
Steckbrief von Sauerstoff, O 2 farblos, d.h. unsichtbar, nur in sehr dicken Schichten himmelblau geruch- und geschmacklos - Etwas schwerer als Luft - notwendig für die Verbrennung, brennt aber nicht selbst
Welche beiden Metalle prägten eine Epoche?
 Posten 1a Welche beiden Metalle prägten eine Epoche? a) Silber / Gold (=> Posten 2a) b) Bronze / Eisen (=> Posten 3d) c) Eisen / Gold (=> Posten 4j) d) Silber / Bronze (=> Posten 5s) Posten 2d Welcher
Posten 1a Welche beiden Metalle prägten eine Epoche? a) Silber / Gold (=> Posten 2a) b) Bronze / Eisen (=> Posten 3d) c) Eisen / Gold (=> Posten 4j) d) Silber / Bronze (=> Posten 5s) Posten 2d Welcher
Was haben wir gelernt?
 Was haben wir gelernt? - Gesetze chemischer Reaktionen - Atommodell von Dalton - Elementsymbole - Die atomare Masseneinheit u - Die Avogadro-Zahl und deren Umkehrung - Von Massenverhältnissen zu Teilchenverhältnissen
Was haben wir gelernt? - Gesetze chemischer Reaktionen - Atommodell von Dalton - Elementsymbole - Die atomare Masseneinheit u - Die Avogadro-Zahl und deren Umkehrung - Von Massenverhältnissen zu Teilchenverhältnissen
1. Chemie ist da wo es stinkt und kracht Die chemische Reaktion zwischen Zucker und Kaliumnitrat
 1. Chemie ist da wo es stinkt und kracht Die chemische Reaktion zwischen Zucker und Kaliumnitrat Geräte/Chemikalien: Mörser mit Pistill, feuerfeste Unterlage, Zucker, Kaliumnitrat, Zünder: Kaliumpermanganat
1. Chemie ist da wo es stinkt und kracht Die chemische Reaktion zwischen Zucker und Kaliumnitrat Geräte/Chemikalien: Mörser mit Pistill, feuerfeste Unterlage, Zucker, Kaliumnitrat, Zünder: Kaliumpermanganat
Eigenschaften Reinstoffe Elemente Kugelteilchen Elementes Atom
 Einstieg: Atom Der Chemiker will alles genau untersuchen, um die Eigenschaften von Stoffen heraus zu finden. Er trennt Gemische in Reinstoffe. Er analysiert Reinstoffe, so dass sie in ihre Elemente zerfallen.
Einstieg: Atom Der Chemiker will alles genau untersuchen, um die Eigenschaften von Stoffen heraus zu finden. Er trennt Gemische in Reinstoffe. Er analysiert Reinstoffe, so dass sie in ihre Elemente zerfallen.
Posten 1a. Was gilt immer. bei einer Oxidation?
 Posten 1a Was gilt immer bei einer Oxidation? a) Es werden Elektronen aufgenommen. (=> Posten 3c) b) Es wird mit Sauerstoff reagiert. (=> Posten 6b) c) Sie kann alleine in einer Reaktions- 9k) gleichungg
Posten 1a Was gilt immer bei einer Oxidation? a) Es werden Elektronen aufgenommen. (=> Posten 3c) b) Es wird mit Sauerstoff reagiert. (=> Posten 6b) c) Sie kann alleine in einer Reaktions- 9k) gleichungg
Grundlagen Chemie. Dipl.-Lab. Chem. Stephan Klotz. Freiwill ige Feuerwehr Rosenheim
 Grundlagen Dipl.-Lab. Chem. Stephan Klotz Freiwill ige Feuerwehr Rosenheim Einführung Lernziele Einfache chemische Vorgänge, die Bedeutung für die Feuerwehrpraxis haben, erklären. Chemische Grundlagen
Grundlagen Dipl.-Lab. Chem. Stephan Klotz Freiwill ige Feuerwehr Rosenheim Einführung Lernziele Einfache chemische Vorgänge, die Bedeutung für die Feuerwehrpraxis haben, erklären. Chemische Grundlagen
Modelle helfen Erscheinungen und Vorgänge zu beschreiben und Wesentliches zu erkennen, geben jedoch die Wirklichkeit nie vollständig wieder.
 I. Stoffen auf der Spur 1. Eigenschaften von Stoffen erkennen Farbe Geruch Geschmack Kristallform Klang Zustandsform 2. Eigenschaften von Stoffen ermitteln/ messen Wärmeleitfähigkeit Elektrische Leitfähigkeit
I. Stoffen auf der Spur 1. Eigenschaften von Stoffen erkennen Farbe Geruch Geschmack Kristallform Klang Zustandsform 2. Eigenschaften von Stoffen ermitteln/ messen Wärmeleitfähigkeit Elektrische Leitfähigkeit
10TG. Training II2. 1. Schreibe die Reaktionsgleichungen folgender Reaktionen. Benenne die Produkte. Erkläre die Teilchenebene.
 Training II2 1. Schreibe die Reaktionsgleichungen folgender Reaktionen. Benenne die Produkte. Erkläre die Teilchenebene. (4X4=1 X4=16P) a. Verbrennung von Kohlenstoff C + O2 CO2 Kohlenstoffdioxid b. Thermolyse
Training II2 1. Schreibe die Reaktionsgleichungen folgender Reaktionen. Benenne die Produkte. Erkläre die Teilchenebene. (4X4=1 X4=16P) a. Verbrennung von Kohlenstoff C + O2 CO2 Kohlenstoffdioxid b. Thermolyse
Curriculum Chemie Klasse 8 Albert-Einstein-Gymnasium Ulm
 Curriculum Chemie Klasse 8 Albert-Einstein-Gymnasium Ulm Klasse 8 Themen Experimentieren im Chemieunterricht Grundregeln des Experimentierens 5. - mit Laborgeräten sachgerecht umgehen und die Sicherheitsmaßnahmen
Curriculum Chemie Klasse 8 Albert-Einstein-Gymnasium Ulm Klasse 8 Themen Experimentieren im Chemieunterricht Grundregeln des Experimentierens 5. - mit Laborgeräten sachgerecht umgehen und die Sicherheitsmaßnahmen
Verbindungen mit Sauerstoff heißen
 Welche der flgenden Aussagen trifft für Sauerstff Sauerstff ist durchsichtig. etwa 10% Sauerstff ist brennbar. etwa 15% Sauerstff ist ein Gas. etwa 20% Sauerstff fördert die Verbrennung. etwa 25% Verbindungen
Welche der flgenden Aussagen trifft für Sauerstff Sauerstff ist durchsichtig. etwa 10% Sauerstff ist brennbar. etwa 15% Sauerstff ist ein Gas. etwa 20% Sauerstff fördert die Verbrennung. etwa 25% Verbindungen
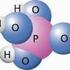
Wasser à. Nachweis: Wasser ist
 Arbeitsblatt zu Kap. 5. Atome Bausteine der Stoffe 5.1 Elemente und Verbindungen Elektrolyse des Reinstoffes Wasser Wasser à Nachweis: Wasser ist Stoffeinteilung 5.2 Von den Elementen zu den Atomen Synthese
Arbeitsblatt zu Kap. 5. Atome Bausteine der Stoffe 5.1 Elemente und Verbindungen Elektrolyse des Reinstoffes Wasser Wasser à Nachweis: Wasser ist Stoffeinteilung 5.2 Von den Elementen zu den Atomen Synthese
Warum ist Feuer nützlich und warum sind Flammen heiß?
 Warum ist Feuer nützlich und warum sind Flammen heiß? Professor Dr.-Ing. Dieter Brüggemann KinderUniversität Bayreuth 1. Juli 2009 Wozu nutzen wir Feuer? Wir nutzen Feuer, um zu beleuchten Quelle: Wikipedia
Warum ist Feuer nützlich und warum sind Flammen heiß? Professor Dr.-Ing. Dieter Brüggemann KinderUniversität Bayreuth 1. Juli 2009 Wozu nutzen wir Feuer? Wir nutzen Feuer, um zu beleuchten Quelle: Wikipedia
Elektronenpaarbindung (oder Atombindung) Nichtmetallatom + Nichtmetallatom Metallatom + Nichtmetallatom 7. Welche Bindungsart besteht jeweils?
 LÖSUNGEN Probetest 1 Kap. 03 Theorie Name: 1. C = Kohlenstoff Ag = Silber Br = Brom Schwefel = S Lithium = Li Uran = U 2. Aluminium - Finde die richtigen Zahlen mit Hilfe deines PSE: Massenzahl: 27 Ordnungszahl:
LÖSUNGEN Probetest 1 Kap. 03 Theorie Name: 1. C = Kohlenstoff Ag = Silber Br = Brom Schwefel = S Lithium = Li Uran = U 2. Aluminium - Finde die richtigen Zahlen mit Hilfe deines PSE: Massenzahl: 27 Ordnungszahl:
Testfragen für Jahrgang 7
 Testfragen für Jahrgang 7 Nenne 5 Stoffe, die sich beim Erhitzen verändern! Nenne 3 Stoffe, die sich beim Erhitzen nicht verändern! An welchen 3 Kennzeichen erkennt man eine chemische Reaktion? Nenne 5
Testfragen für Jahrgang 7 Nenne 5 Stoffe, die sich beim Erhitzen verändern! Nenne 3 Stoffe, die sich beim Erhitzen nicht verändern! An welchen 3 Kennzeichen erkennt man eine chemische Reaktion? Nenne 5
CHEMIE WIEDERHOLUNG: KAPITEL 5 REAKTIONEN DER ANORGANISCHEN CHEMIE. Timm Wilke. Georg-August-Universität Göttingen. Wintersemester 2013 / 2014
 CHEMIE WIEDERHOLUNG: KAPITEL 5 REAKTIONEN DER ANORGANISCHEN CHEMIE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Einführung Brennendes Magnesiumband reagiert mit Sauerstoff
CHEMIE WIEDERHOLUNG: KAPITEL 5 REAKTIONEN DER ANORGANISCHEN CHEMIE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Einführung Brennendes Magnesiumband reagiert mit Sauerstoff
Überlege dir welche drei Voraussetzungen gegeben sein müssen, damit Verbrennung stattfinden kann.
 Verbrennungsvorgang Überlege dir welche drei Voraussetzungen gegeben sein müssen, damit Verbrennung stattfinden kann. Trage die Begriffe in die leeren Felder des Verbrennungsdreiecks ein. Die drei Voraussetzungen
Verbrennungsvorgang Überlege dir welche drei Voraussetzungen gegeben sein müssen, damit Verbrennung stattfinden kann. Trage die Begriffe in die leeren Felder des Verbrennungsdreiecks ein. Die drei Voraussetzungen
Chemie Stoffe: Gemenge Reinstoffe Grundstoffe Verbindungen physikalische Trennverfahren chemische Trennverfahren
 Chemie Stoffe: Gemenge Reinstoffe Grundstoffe Verbindungen physikalische Trennverfahren chemische Trennverfahren heterogenes Gemenge Granit: heterogenes Gemenge Salzlösung: homogenes Gemenge Elektrolyse
Chemie Stoffe: Gemenge Reinstoffe Grundstoffe Verbindungen physikalische Trennverfahren chemische Trennverfahren heterogenes Gemenge Granit: heterogenes Gemenge Salzlösung: homogenes Gemenge Elektrolyse
Übungen zum Kapitel I, Grundlagen chemischer Gleichungen
 Übungen zum Kapitel I, Grundlagen chemischer Gleichungen Übersicht der Übungen: Übung Nr. 1 (Bedeutungen und Ausgleichen von Gleichungen) Übung Nr. 2 (Bedeutungen und Ausgleichen von Gleichungen) Übung
Übungen zum Kapitel I, Grundlagen chemischer Gleichungen Übersicht der Übungen: Übung Nr. 1 (Bedeutungen und Ausgleichen von Gleichungen) Übung Nr. 2 (Bedeutungen und Ausgleichen von Gleichungen) Übung
DÜNGE- LEHRE Abendschule für Gartenbau 2003/2004
 DÜNGE- LERE Abendschule für Gartenbau 2003/2004 ELEMENTE die für Pflanzen wichtig sind Na Wasserstoff in Form von Wasser Natrium K Kalium für die Wiederstandsfähigkeit, Wasserhaushalt Mg Magnesium Zentralatom
DÜNGE- LERE Abendschule für Gartenbau 2003/2004 ELEMENTE die für Pflanzen wichtig sind Na Wasserstoff in Form von Wasser Natrium K Kalium für die Wiederstandsfähigkeit, Wasserhaushalt Mg Magnesium Zentralatom
Repetitionen Chemie und Werkstoffkunde
 BEARBEITUNGSTECHNIK REPETITONEN Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 2 Begriffe der Chemie und Werkstoffkunde Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1,
BEARBEITUNGSTECHNIK REPETITONEN Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 2 Begriffe der Chemie und Werkstoffkunde Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1,
Repetitionen Chemie und Werkstoffkunde
 BEARBEITUNGSTECHNIK REPETITONEN Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 2 Begriffe der Chemie und Werkstoffkunde Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1,
BEARBEITUNGSTECHNIK REPETITONEN Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 2 Begriffe der Chemie und Werkstoffkunde Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1,
Gegenstand genau zu beschreiben? Antworten: a) Geschmack & Form (=> Posten 2a) b) Dichte & Form (=> Posten 3d) c) Stoff & Form
 Posten 1a Was muss man alles angeben, um einen Gegenstand genau zu beschreiben? a) Geschmack & Form (=> Posten 2a) b) Dichte & Form (=> Posten 3d) c) Stoff & Form (=> Posten 4j) d) Dichte & Stoff (=> Posten
Posten 1a Was muss man alles angeben, um einen Gegenstand genau zu beschreiben? a) Geschmack & Form (=> Posten 2a) b) Dichte & Form (=> Posten 3d) c) Stoff & Form (=> Posten 4j) d) Dichte & Stoff (=> Posten
Hewlett-Packard Company. [Dokumenttitel] [Untertitel des Dokuments] Walter Whites explosives Chemie Quiz Fragen & Antworten.
![Hewlett-Packard Company. [Dokumenttitel] [Untertitel des Dokuments] Walter Whites explosives Chemie Quiz Fragen & Antworten. Hewlett-Packard Company. [Dokumenttitel] [Untertitel des Dokuments] Walter Whites explosives Chemie Quiz Fragen & Antworten.](/thumbs/95/126174167.jpg) Hewlett-Packard Company [Dokumenttitel] [Untertitel des Dokuments] Walter Whites explosives Chemie Quiz Fragen & Antworten Johanika [Datum] Walter Whites Chemie Quiz Fragen 1. Aus wie vielen Atomen besteht
Hewlett-Packard Company [Dokumenttitel] [Untertitel des Dokuments] Walter Whites explosives Chemie Quiz Fragen & Antworten Johanika [Datum] Walter Whites Chemie Quiz Fragen 1. Aus wie vielen Atomen besteht
EDUKTE PRODUKTE. Bei einer chemischen Reaktion wandeln sich Stoffe in neue Stoffe mit anderen Eigenschaften um. Symbolische Schreibweise: Reagiert zu
 L2 1 Chemische Reaktion, Energetik Bei einer chemischen Reaktion wandeln sich Stoffe in neue Stoffe mit anderen Eigenschaften um. Symbolische Schreibweise: Ausgangsstoff e EDUKTE Reagiert zu Endstoffe
L2 1 Chemische Reaktion, Energetik Bei einer chemischen Reaktion wandeln sich Stoffe in neue Stoffe mit anderen Eigenschaften um. Symbolische Schreibweise: Ausgangsstoff e EDUKTE Reagiert zu Endstoffe
Was passiert, wenn Schwefeldampf über einen heissen Kupferblechstreifen streicht? Antworten: a) es entsteht Wasserdampf (Wasser-
 Posten 1a Was passiert, wenn Schwefeldampf über einen heissen Kupferblechstreifen streicht? a) es entsteht Wasserdampf (Wasser- (=> Posten 5l) tropfen kondensieren am Streifen) b) der Schwefeldampf wird
Posten 1a Was passiert, wenn Schwefeldampf über einen heissen Kupferblechstreifen streicht? a) es entsteht Wasserdampf (Wasser- (=> Posten 5l) tropfen kondensieren am Streifen) b) der Schwefeldampf wird
Vom Atombau zum Königreich der Elemente
 Vom Atombau zum Königreich der Elemente Wiederholung: Elektronenwellenfunktionen (Orbitale) Jedes Orbital kann durch einen Satz von Quantenzahlen n, l, m charakterisiert werden Jedes Orbital kann maximal
Vom Atombau zum Königreich der Elemente Wiederholung: Elektronenwellenfunktionen (Orbitale) Jedes Orbital kann durch einen Satz von Quantenzahlen n, l, m charakterisiert werden Jedes Orbital kann maximal
Calcium. Calcium fest. Ordnungszahl. Siedepunkt. Siedepunkt Atommasse Dichte. Kohlenstoff. Carbon fest. Ordnungszahl 3642!
 Al Aluminium Aluminium fest 13 660.32 2519 2.375 5000 74.92160 B Bor Cl Boron fest 5 10.811 2.08 3.515 2076 3927 16,200 Co 58.933195 18,350 Chlorine gasförmig 17 35.453 1.5625-101.5-34.04 206 7.75 Cu 1907
Al Aluminium Aluminium fest 13 660.32 2519 2.375 5000 74.92160 B Bor Cl Boron fest 5 10.811 2.08 3.515 2076 3927 16,200 Co 58.933195 18,350 Chlorine gasförmig 17 35.453 1.5625-101.5-34.04 206 7.75 Cu 1907
Chemie, Kapitel 4 : Chemische Reaktionen und Luft
 Lesen Sie aufmerksam das Kapitel 4.4 und lösen Sie die folgenden Aufgaben: a) Definieren Sie die drei Begriffe in jeweils einem Satz b) Geben Sie ein Beispiel aus dem Alltag Exotherme Reaktion: Endotherme
Lesen Sie aufmerksam das Kapitel 4.4 und lösen Sie die folgenden Aufgaben: a) Definieren Sie die drei Begriffe in jeweils einem Satz b) Geben Sie ein Beispiel aus dem Alltag Exotherme Reaktion: Endotherme
Stoffe und ihre Eigenschaften
 Stoffe und ihre Eigenschaften 1.) Welche Stoffeigenschaften kennen Sie? Zählen Sie auf. Aussehen, Geruch, Geschmack, Verformbarkeit, elektr. LF, Magnetismus, Härte, Verhalten beim Erhitzen, Brennbarkeit;
Stoffe und ihre Eigenschaften 1.) Welche Stoffeigenschaften kennen Sie? Zählen Sie auf. Aussehen, Geruch, Geschmack, Verformbarkeit, elektr. LF, Magnetismus, Härte, Verhalten beim Erhitzen, Brennbarkeit;
Die Stoffteilchen (II): Ionengruppen und ihre Ionen
 Die Stoffteilchen (II): Ionengruppen und ihre Ionen Ionen sind die Bausteine der Ionengruppen, den gedachten Stoffteilchen der Salze. Was haben Ionengruppen mit der Formel von Salzen zu tun? DARUM GEHT
Die Stoffteilchen (II): Ionengruppen und ihre Ionen Ionen sind die Bausteine der Ionengruppen, den gedachten Stoffteilchen der Salze. Was haben Ionengruppen mit der Formel von Salzen zu tun? DARUM GEHT
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Übungstests Chemie im praktischen Paket
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Übungstests Chemie im praktischen Paket Das komplette Material finden Sie hier: School-Scout.de Titel: Übungstest: Atombindungen Bestellnummer:
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Übungstests Chemie im praktischen Paket Das komplette Material finden Sie hier: School-Scout.de Titel: Übungstest: Atombindungen Bestellnummer:
Grundlagen Chemischer Gleichungen
 Grundlagen Chemischer Gleichungen Lehrprogramm zum Erlernen der Grundlagen zum Aufstellen und verstehen Chemischer Gleichungen und Formeln. Björn Schulz, Berlin 2004 www.lernmaus.de www.polarographie.de
Grundlagen Chemischer Gleichungen Lehrprogramm zum Erlernen der Grundlagen zum Aufstellen und verstehen Chemischer Gleichungen und Formeln. Björn Schulz, Berlin 2004 www.lernmaus.de www.polarographie.de
Echt ätzend! - Was ist und wie wirkt Abflussreiniger?
 Echt ätzend! - Was ist und wie wirkt Abflussreiniger? Versuch 1: Zusammensetzung von festem Abflussreiniger (Analyse nach Prof. Pick ): fester Abflussreiniger (z.b. Drano Rohrfrei) Petrischale, Holzstab
Echt ätzend! - Was ist und wie wirkt Abflussreiniger? Versuch 1: Zusammensetzung von festem Abflussreiniger (Analyse nach Prof. Pick ): fester Abflussreiniger (z.b. Drano Rohrfrei) Petrischale, Holzstab
Lösungen Kap. 4 Die chemische Reaktion
 Elemente Grundlagen der Chemie für Schweizer Maturitätsschulen Klett und Balmer Verlag Zug 2007 Verwendung für den Gebrauch in der eigenen Klasse gestattet Lösungen Kap. 4 Die chemische Reaktion Lösungen
Elemente Grundlagen der Chemie für Schweizer Maturitätsschulen Klett und Balmer Verlag Zug 2007 Verwendung für den Gebrauch in der eigenen Klasse gestattet Lösungen Kap. 4 Die chemische Reaktion Lösungen
Grundlagen der Chemie
 Grundlagen - 1-1.1 Einteilung der Stoffe, Gemische und reine Stoffe Grundlagen der Chemie Das Lernziel dieser Unterrichtseinheit beinhaltet folgende Punkte: Was sind Stoffe und Reinstoffe, Aggregatszustände,
Grundlagen - 1-1.1 Einteilung der Stoffe, Gemische und reine Stoffe Grundlagen der Chemie Das Lernziel dieser Unterrichtseinheit beinhaltet folgende Punkte: Was sind Stoffe und Reinstoffe, Aggregatszustände,
Stoffe im Alltag 8 Experimentieren in der Chemie 10
 2 Stoffe im Alltag 8 Experimentieren in der Chemie 10 Feuer und Brandbekämpfung 12 Feuer und Flamme 12 Voraussetzungen für die Verbrennung 14 Brände löschen 15 Stoffe und ihre Eigenschaften 16 Den Stoffen
2 Stoffe im Alltag 8 Experimentieren in der Chemie 10 Feuer und Brandbekämpfung 12 Feuer und Flamme 12 Voraussetzungen für die Verbrennung 14 Brände löschen 15 Stoffe und ihre Eigenschaften 16 Den Stoffen
Empfohlene Hilfsmittel zum Lösen der Arbeitsaufträge: Arbeitsblätter, Theorieblätter, Fachbuch, Tabellenbuch und Ihr Wissen aus dem Praxisalltag
 2.1.1 Aufbau der Materie (Arbeitsaufträge) Empfohlene Hilfsmittel zum Lösen der Arbeitsaufträge: Arbeitsblätter, Theorieblätter, Fachbuch, Tabellenbuch und Ihr Wissen aus dem Praxisalltag 1. Beim Bearbeiten
2.1.1 Aufbau der Materie (Arbeitsaufträge) Empfohlene Hilfsmittel zum Lösen der Arbeitsaufträge: Arbeitsblätter, Theorieblätter, Fachbuch, Tabellenbuch und Ihr Wissen aus dem Praxisalltag 1. Beim Bearbeiten
Kapitel 03. Aufbau der Materie (Buch ab Seite 17)
 Kapitel 03 Aufbau der Materie (Buch ab Seite 17) ATOME SIND DIE BAUSTEINE DER CHEMIE Film1 Geschichtliches Kern-Hülle-Modell 8min ATOME SIND DIE BAUSTEINE DER CHEMIE Alle Stoffe im Universum (Sonne, Mond,
Kapitel 03 Aufbau der Materie (Buch ab Seite 17) ATOME SIND DIE BAUSTEINE DER CHEMIE Film1 Geschichtliches Kern-Hülle-Modell 8min ATOME SIND DIE BAUSTEINE DER CHEMIE Alle Stoffe im Universum (Sonne, Mond,
ATOMSYMBOLE. DARUM GEHT S IN DIESER LernBOX. Mit dieser LernBOX kannst du Folgendes lernen: welches die Grundbausteine der Atome sind.
 Atome und Atombau Was sind Atome und wie kann man sich deren Aufbau vorstellen? Gibt es verschiedene Atome? BAUSTEINE DER ATOME ATOME UND Notiere dir nach der Bearbeitung der Aufgaben jeweils das Wichtigste
Atome und Atombau Was sind Atome und wie kann man sich deren Aufbau vorstellen? Gibt es verschiedene Atome? BAUSTEINE DER ATOME ATOME UND Notiere dir nach der Bearbeitung der Aufgaben jeweils das Wichtigste
Kapitel 2 Repetitionen Chemie und Werkstoffkunde. Thema 6 Oxidation und Reduktion
 BEARBEITUNGSTECHNIK REPETITONEN LÖSUNGSSATZ Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 6 Oxidation und Reduktion Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1, 8772
BEARBEITUNGSTECHNIK REPETITONEN LÖSUNGSSATZ Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 6 Oxidation und Reduktion Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1, 8772
N & T 5 Periodensystem der Elemente 01 Name: Vorname: Datum:
 N & T 5 Periodensystem der Elemente 01 Name: Vorname: Datum: Dalton definierte sein Atommodell um 1803. Schon bald stellten die Chemiker fest, dass das Modell zwar gut war, doch nicht alle Fragen klären
N & T 5 Periodensystem der Elemente 01 Name: Vorname: Datum: Dalton definierte sein Atommodell um 1803. Schon bald stellten die Chemiker fest, dass das Modell zwar gut war, doch nicht alle Fragen klären
man sagt : Phosphor + Sauerstoff reagieren Tetraphosphorzu dekaoxid
 Die Luft 1.Versuch Wir entzünden eine Kerze und stülpen ein Becherglas darüber. Beobachtung : Nach kurzer Zeit erlischt die Flamme. Feststellung : Für die Verbrennung in unserer Umwelt ist Luft notwendig.
Die Luft 1.Versuch Wir entzünden eine Kerze und stülpen ein Becherglas darüber. Beobachtung : Nach kurzer Zeit erlischt die Flamme. Feststellung : Für die Verbrennung in unserer Umwelt ist Luft notwendig.
Grundwissenkarten Hans-Carossa-Gymnasium. 9. Klasse. Chemie SG
 Grundwissenkarten Hans-Carossa-Gymnasium 9. Klasse Chemie SG Es sind insgesamt 18 Karten für die 9. Klasse erarbeitet. Karten ausschneiden : Es ist auf der linken Blattseite die Vorderseite mit Frage/Aufgabe,
Grundwissenkarten Hans-Carossa-Gymnasium 9. Klasse Chemie SG Es sind insgesamt 18 Karten für die 9. Klasse erarbeitet. Karten ausschneiden : Es ist auf der linken Blattseite die Vorderseite mit Frage/Aufgabe,
ATOMSYMBOLE. DARUM GEHT S IN DIESER LernBOX. Mit dieser LernBOX kannst du Folgendes lernen: welches die Grundbausteine der Atome sind.
 Atome und Atombau Was sind Atome und wie kann man sich deren Aufbau vorstellen? Gibt es verschiedene Atome? GRUNDBAUSTEINE DER ATOME ATOME UND Notiere dir nach der Bearbeitung der Aufgaben jeweils das
Atome und Atombau Was sind Atome und wie kann man sich deren Aufbau vorstellen? Gibt es verschiedene Atome? GRUNDBAUSTEINE DER ATOME ATOME UND Notiere dir nach der Bearbeitung der Aufgaben jeweils das
4. Klasse. Letzte Aktualisierung am 6. März Lehrer: Christian Graf, PHS Krems
 4. Klasse Letzte Aktualisierung am 6. März 2016 Lehrer: Christian Graf, PHS Krems Frage 1 Antwort 1 Woran erkennt man einen chemischen Vorgang? Bei einem chemischen Vorgang ändern sich die Stoffe und ihre
4. Klasse Letzte Aktualisierung am 6. März 2016 Lehrer: Christian Graf, PHS Krems Frage 1 Antwort 1 Woran erkennt man einen chemischen Vorgang? Bei einem chemischen Vorgang ändern sich die Stoffe und ihre
Wiederholung der letzten Vorlesungsstunde: Thema: Metallbindung
 Wiederholung der letzten Vorlesungsstunde: Thema: Metallbindung Chemische Bindungen in Metallen, Elektronengasmodell, elektronische Bänder, Bandstrukturmodell, Metalle, Halbleiter, Isolatoren, Bandlücke,
Wiederholung der letzten Vorlesungsstunde: Thema: Metallbindung Chemische Bindungen in Metallen, Elektronengasmodell, elektronische Bänder, Bandstrukturmodell, Metalle, Halbleiter, Isolatoren, Bandlücke,
Kapitel 4: Chemische. Woher stammen die chemischen Symbole?
 Kapitel 4: Chemische Symbole Woher stammen die chemischen Symbole? Das sind die Anfangsbuchstaben (manchmal auch die ersten beiden Anfangsbuchstaben) der lateinischen oder griechischen Namen der Elemente.
Kapitel 4: Chemische Symbole Woher stammen die chemischen Symbole? Das sind die Anfangsbuchstaben (manchmal auch die ersten beiden Anfangsbuchstaben) der lateinischen oder griechischen Namen der Elemente.
Themenbereiche für die Prüfung von Nichtschülerinnen und Nichtschülern zum Erwerb des Hauptschulabschlusses im Fach Chemie
 Themenbereiche für die Prüfung von Nichtschülerinnen und Nichtschülern zum Erwerb des Hauptschulabschlusses im Fach Chemie Die Prüflinge wählen im Rahmen der mündlichen Prüfung in Absprache mit den Prüfern
Themenbereiche für die Prüfung von Nichtschülerinnen und Nichtschülern zum Erwerb des Hauptschulabschlusses im Fach Chemie Die Prüflinge wählen im Rahmen der mündlichen Prüfung in Absprache mit den Prüfern
Periodensystem der Elemente - PSE
 Periodensystem der Elemente - PSE Historische Entwicklung Möglichkeiten der Reindarstellung seit 18. Jhdt. wissenschaftliche Beschreibung der Elemente 1817 Johann Wolfgang Döbereiner: ähnliche Elemente
Periodensystem der Elemente - PSE Historische Entwicklung Möglichkeiten der Reindarstellung seit 18. Jhdt. wissenschaftliche Beschreibung der Elemente 1817 Johann Wolfgang Döbereiner: ähnliche Elemente
[ ] 1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe + - Moleküle aus gleichen Atomen. Ionen. Moleküle aus verschiedenen Atomen
![[ ] 1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe + - Moleküle aus gleichen Atomen. Ionen. Moleküle aus verschiedenen Atomen [ ] 1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe + - Moleküle aus gleichen Atomen. Ionen. Moleküle aus verschiedenen Atomen](/thumbs/68/58264490.jpg) 1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe Gemische Reinstoffe Elemente Verbindungen gleiche Atome Moleküle aus gleichen Atomen Moleküle aus verschiedenen Atomen Ionen + Kation Anion z.b.
1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe Gemische Reinstoffe Elemente Verbindungen gleiche Atome Moleküle aus gleichen Atomen Moleküle aus verschiedenen Atomen Ionen + Kation Anion z.b.
Kochsalz-Kristalle (Halit) Wichtige Stoffgruppen Atomverband Stoffgruppe Metall Metall: Metallische Stoffe Salzartige Stoffe Metall Nichtmetall:
 Kochsalz-Kristalle (Halit) 1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter)
Kochsalz-Kristalle (Halit) 1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter)
(a) [4] Um welches Element handelt es sich? (Lösungsweg angeben)
![(a) [4] Um welches Element handelt es sich? (Lösungsweg angeben) (a) [4] Um welches Element handelt es sich? (Lösungsweg angeben)](/thumbs/88/117474080.jpg) Klausur zur Vorlesung LV 18000, AC1 (Anorganische Experimentalchemie) am 03.09.2007 1 1 2 3 4 5 6 7 8 9 10 Σ Note: Vorname: Matr.-Nr.: Nachname: Chemie und Biochemie Lehramt Chemie vertieft Lehramt Chemie
Klausur zur Vorlesung LV 18000, AC1 (Anorganische Experimentalchemie) am 03.09.2007 1 1 2 3 4 5 6 7 8 9 10 Σ Note: Vorname: Matr.-Nr.: Nachname: Chemie und Biochemie Lehramt Chemie vertieft Lehramt Chemie
Verbrennung einer Kerze
 Verbrennung einer Kerze Schauen wir uns zunächst die Kerze genauer an. Aus welchen Bestandteilen besteht sie? Und wozu dienen diese? Bestandteil Stoff Funktion Der Stoff ist das Material, woraus ein Körper
Verbrennung einer Kerze Schauen wir uns zunächst die Kerze genauer an. Aus welchen Bestandteilen besteht sie? Und wozu dienen diese? Bestandteil Stoff Funktion Der Stoff ist das Material, woraus ein Körper
Grundwissen 8. Klasse 1 Grundwissen 8. Klasse 1. Grundwissen 8. Klasse 2 Grundwissen 8. Klasse 2. Stoffebene
 Grundwissen 8. Klasse 1 Grundwissen 8. Klasse 1 Stoff Einteilung der Stoffe Reinstoff mischen Gemisch Stelle in einem Fließdiagramm folgende Begriffe zueinander in Beziehung: Stoff, Reinstoff, Gemisch,
Grundwissen 8. Klasse 1 Grundwissen 8. Klasse 1 Stoff Einteilung der Stoffe Reinstoff mischen Gemisch Stelle in einem Fließdiagramm folgende Begriffe zueinander in Beziehung: Stoff, Reinstoff, Gemisch,
Wer spannt wem den Sauerstoff aus? Metalloxide
 1 von 24 Wer spannt wem den Sauerstoff aus? Metalloxide Ein Beitrag von Petra Frank, Tobias Frank und Dr. Hans-Peter Haseloff, Esslingen Mit Illustrationen von Julia Lenzmann, Stuttgart Foto: Colourbox
1 von 24 Wer spannt wem den Sauerstoff aus? Metalloxide Ein Beitrag von Petra Frank, Tobias Frank und Dr. Hans-Peter Haseloff, Esslingen Mit Illustrationen von Julia Lenzmann, Stuttgart Foto: Colourbox
Löschversuche mit Wasser sowie Feuchtigkeit führen zur Spaltung von Wasser und erzeugen Knallgas
 Thermit / Blatt 1 Einleitung Gegen Ende des 19. Jahrhunderts entdeckte Hans Goldschmidt in Essen die technische Gewinnung von Schwermetallen aus ihren Oxiden durch die Oxidation von Aluminium. Thermit
Thermit / Blatt 1 Einleitung Gegen Ende des 19. Jahrhunderts entdeckte Hans Goldschmidt in Essen die technische Gewinnung von Schwermetallen aus ihren Oxiden durch die Oxidation von Aluminium. Thermit
Was kannst Du (schon)? Stoffe und Eigenschaften D
 Falte zunächst das Blatt entlang des Pfeils nach hinten. Mache Dir zunächst alleine Gedanken über Deine Fähigkeiten und kreuze an. Tausche Dich im Folgenden mit Deinem Nachbar aus bzw. falte das Blatt
Falte zunächst das Blatt entlang des Pfeils nach hinten. Mache Dir zunächst alleine Gedanken über Deine Fähigkeiten und kreuze an. Tausche Dich im Folgenden mit Deinem Nachbar aus bzw. falte das Blatt
1. Standortbestimmung, Januar Chemie. Eine gedruckte und/oder eine persönlich erstellte und vom Dozenten visierte Formelsammlung,
 1. Standortbestimmung, Januar 2015 Chemie Dauer der Prüfung: 90 Minuten Erlaubte Hilfsmittel: Eine gedruckte und/oder eine persönlich erstellte und vom Dozenten visierte Formelsammlung, Ein netzunabhängiger,
1. Standortbestimmung, Januar 2015 Chemie Dauer der Prüfung: 90 Minuten Erlaubte Hilfsmittel: Eine gedruckte und/oder eine persönlich erstellte und vom Dozenten visierte Formelsammlung, Ein netzunabhängiger,
Identifizierung der Produkte der Reaktion "Alkalimetalle + Wasser"
 Identifizierung der Produkte der Reaktion "Alkalimetalle + Wasser" a) Identifizierung des entstehenden Gases: Chemikalien: Geräte: Lithium [C] [F], Natrium [C] [F] (jeweils in Benzin mit Siedebereich 90-110
Identifizierung der Produkte der Reaktion "Alkalimetalle + Wasser" a) Identifizierung des entstehenden Gases: Chemikalien: Geräte: Lithium [C] [F], Natrium [C] [F] (jeweils in Benzin mit Siedebereich 90-110
B E I S P I E L A R B E I T / Aufgaben. Kultusministerium
 B E I S P I E L A R B E I T / Aufgaben Kultusministerium Name, Vorname: Klasse: Schule: Seite 1 von 6 B E I S P I E L A R B E I T / Aufgaben Aufgabe 1: Stoffe und ihre Eigenschaften a) Die Naturwissenschaft
B E I S P I E L A R B E I T / Aufgaben Kultusministerium Name, Vorname: Klasse: Schule: Seite 1 von 6 B E I S P I E L A R B E I T / Aufgaben Aufgabe 1: Stoffe und ihre Eigenschaften a) Die Naturwissenschaft
N & T (R) 3 Physikalische Verfahren 01 Name: Vorname: Datum:
 N & T (R) 3 Physikalische Verfahren 01 Name: Vorname: Datum: Du hast nun zahlreiche Stoffeigenschaften kennengelernt, auf Grund derer sich verschiedene Stoffe unterscheiden lassen. Doch die verschiedenen
N & T (R) 3 Physikalische Verfahren 01 Name: Vorname: Datum: Du hast nun zahlreiche Stoffeigenschaften kennengelernt, auf Grund derer sich verschiedene Stoffe unterscheiden lassen. Doch die verschiedenen
A 1.1 a Wie groß ist das Molvolumen von Helium, flüssigem Wasser, Kupfer, Stickstoff und Sauerstoff bei 1 bar und 25 C?
 A 1.1 a Wie groß ist das Molvolumen von Helium, flüssigem Wasser, Kupfer, Stickstoff und Sauerstoff bei 1 bar und 25 C? (-> Tabelle p) A 1.1 b Wie groß ist der Auftrieb eines Helium (Wasserstoff) gefüllten
A 1.1 a Wie groß ist das Molvolumen von Helium, flüssigem Wasser, Kupfer, Stickstoff und Sauerstoff bei 1 bar und 25 C? (-> Tabelle p) A 1.1 b Wie groß ist der Auftrieb eines Helium (Wasserstoff) gefüllten
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Atombau und PSE. Das komplette Material finden Sie hier: School-Scout.
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Atombau und PSE Das komplette Material finden Sie hier: School-Scout.de Chemiekonzept Pro Unterrichtsreihen Sekundarstufe I Band 11
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Atombau und PSE Das komplette Material finden Sie hier: School-Scout.de Chemiekonzept Pro Unterrichtsreihen Sekundarstufe I Band 11
Nachweisreaktionen Versuche. Flüssigkeiten beim Erhitzen, Siedeverzug 12-17 20-21 28-29 32-33 128 24-25 35-42
 Klasse 5 Sicherheitsbelehrung 6-9 Hinweise auf Fluchtwege, Feuerlösch- Einrichtungen, Verhalten im Chemieraum und beim Experiment, persönliche Sicherheitsvorkehrungen, Gefahrensymbole Umgang mit dem Gasbrenner
Klasse 5 Sicherheitsbelehrung 6-9 Hinweise auf Fluchtwege, Feuerlösch- Einrichtungen, Verhalten im Chemieraum und beim Experiment, persönliche Sicherheitsvorkehrungen, Gefahrensymbole Umgang mit dem Gasbrenner
Grundwissen 9.Klasse SG 1 Grundwissen 9.Klasse SG 1. Grundwissen 9.Klasse SG 2 Grundwissen 9.Klasse SG 2. Stoffebene.
 Grundwissen 9.Klasse SG 1 Grundwissen 9.Klasse SG 1 Stoff Reinstoff mischen Gemisch Einteilung der Stoffe Bei gleichen Bedingungen (Temp., Druck) immer gleiche Eigenschaften (z.b. Schmelz- /Siedetemp.,
Grundwissen 9.Klasse SG 1 Grundwissen 9.Klasse SG 1 Stoff Reinstoff mischen Gemisch Einteilung der Stoffe Bei gleichen Bedingungen (Temp., Druck) immer gleiche Eigenschaften (z.b. Schmelz- /Siedetemp.,
N & T (R) 5 Periodensystem der Elemente 01 Name: Vorname: Datum:
 N & T (R) 5 Periodensystem der Elemente 01 Name: Vorname: Datum: Dalton definierte sein Atommodell um 1803. Schon bald stellten die Chemiker fest, dass das Modell zwar gut war, doch nicht alle Fragen klären
N & T (R) 5 Periodensystem der Elemente 01 Name: Vorname: Datum: Dalton definierte sein Atommodell um 1803. Schon bald stellten die Chemiker fest, dass das Modell zwar gut war, doch nicht alle Fragen klären
Repetitionen Chemie und Werkstoffkunde
 BEARBEITUNGSTECHNIK REPETITONEN Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 6 Oxidation und Reduktion Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1, 8772 Nidfurn 055-654
BEARBEITUNGSTECHNIK REPETITONEN Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 6 Oxidation und Reduktion Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1, 8772 Nidfurn 055-654
Lösung. Gasgemisch. Legierung. Suspension. Ein löslicher Stoff (z.b. Salz) ist in einem Lösungsmittel (z.b. Wasser) gelöst.
 Ein löslicher Stoff (z.b. Salz) ist in einem Lösungsmittel (z.b. Wasser) gelöst. Lösung 8C1 Jede Lösung ist ein homogenes Stoffgemisch: Feststofflösung: Feststoff ist in Flüssigkeit gelöst (Zuckerwasser)
Ein löslicher Stoff (z.b. Salz) ist in einem Lösungsmittel (z.b. Wasser) gelöst. Lösung 8C1 Jede Lösung ist ein homogenes Stoffgemisch: Feststofflösung: Feststoff ist in Flüssigkeit gelöst (Zuckerwasser)
Arbeitsblatt zum Stationenlernen "Eigenschaften von Metallen"
 Arbeitsblatt zum Stationenlernen "Eigenschaften von Metallen" Station 1: Glänzend gemacht!! - Das Aussehen von Metallen Stoff Farbe und Glanz Farbe und Glanz der nichtpolierten Fläche der polierten Fläche
Arbeitsblatt zum Stationenlernen "Eigenschaften von Metallen" Station 1: Glänzend gemacht!! - Das Aussehen von Metallen Stoff Farbe und Glanz Farbe und Glanz der nichtpolierten Fläche der polierten Fläche
Themenheft. Chemie. chemische Gesetze, Atombau und Formeln. Arbeitsblätter für den deutschsprachigen Fachunterricht an Auslandsschulen
 Themenheft Chemie chemische Gesetze, Atombau und Formeln Arbeitsblätter für den deutschsprachigen Fachunterricht an Auslandsschulen Inhaltsverzeichnis: Blatt 1: Die Masse bei chemischen Reaktionen Blatt
Themenheft Chemie chemische Gesetze, Atombau und Formeln Arbeitsblätter für den deutschsprachigen Fachunterricht an Auslandsschulen Inhaltsverzeichnis: Blatt 1: Die Masse bei chemischen Reaktionen Blatt
Grundwissen 8.Klasse 1 Grundwissen 8.Klasse 1. Grundwissen 8.Klasse 2 Grundwissen 8.Klasse 2. Stoffebene. Teilchen -ebene
 Grundwissen 8.Klasse 1 Grundwissen 8.Klasse 1 Stoff Reinstoff mischen Gemisch Einteilung der Stoffe Bei gleichen Bedingungen (Temp., Druck) immer gleiche Eigenschaften (z.b. Schmelz- /Siedetemp., Löslichkeit,
Grundwissen 8.Klasse 1 Grundwissen 8.Klasse 1 Stoff Reinstoff mischen Gemisch Einteilung der Stoffe Bei gleichen Bedingungen (Temp., Druck) immer gleiche Eigenschaften (z.b. Schmelz- /Siedetemp., Löslichkeit,
Standortbestimmung / Äquivalenzprüfung. Chemie. Mittwoch, 13. April 2016, Uhr
 Seite 1 von 7 Standortbestimmung / Äquivalenzprüfung Chemie Mittwoch, 13. April 2016, 16.45-18.15 Uhr Dauer der Prüfung: 90 Minuten Erlaubte Hilfsmittel: Eine gedruckte und/oder eine persönlich erstellte
Seite 1 von 7 Standortbestimmung / Äquivalenzprüfung Chemie Mittwoch, 13. April 2016, 16.45-18.15 Uhr Dauer der Prüfung: 90 Minuten Erlaubte Hilfsmittel: Eine gedruckte und/oder eine persönlich erstellte
Grundwissen Chemie 8I
 1) Stoffe, Experimente Chemie ist die Lehre von den Stoffen, ihren Eigenschaften, ihrem Aufbau, ihren Veränderungen und ihrer Herstellung. Einfache Möglichkeiten der Stofferkennung (Farbe, Glanz, Kristallform,
1) Stoffe, Experimente Chemie ist die Lehre von den Stoffen, ihren Eigenschaften, ihrem Aufbau, ihren Veränderungen und ihrer Herstellung. Einfache Möglichkeiten der Stofferkennung (Farbe, Glanz, Kristallform,
Lernmaterial Lernfeld 1 Grundlagen Physik und Chemie. Chemische Grundlagen, Bindungsarten. Zu Erinnerung : Schematischer Aufbau eines Wasserstoffatoms
 Chemische Grundlagen, Bindungsarten Zu Erinnerung : Schematischer Aufbau eines Wasserstoffatoms Hier ist ein Lithiumatom schematisch dargestellt. Elektronen umkreisen den Kern in diskreten Bahnen IQ Technikum
Chemische Grundlagen, Bindungsarten Zu Erinnerung : Schematischer Aufbau eines Wasserstoffatoms Hier ist ein Lithiumatom schematisch dargestellt. Elektronen umkreisen den Kern in diskreten Bahnen IQ Technikum
Inhaltsverzeichnis. Vorwort Zur Gestaltung des Buches
 Hans Rudolf Christen Struktur Stoff Reaktion Allgemeine und anorganische Chemie Sekundarstufe I 5401 Diesterweg Salle Frankfurt am Main Berlin München Verlag Sauerländer Aarau Vorwort Zur Gestaltung des
Hans Rudolf Christen Struktur Stoff Reaktion Allgemeine und anorganische Chemie Sekundarstufe I 5401 Diesterweg Salle Frankfurt am Main Berlin München Verlag Sauerländer Aarau Vorwort Zur Gestaltung des
