7 Thermodynamik. 7.1 Kinetische Energie des idealen Gases
|
|
|
- Emilia Straub
- vor 7 Jahren
- Abrufe
Transkript
1 7 hermodynamik Wärme: ungeordnete Molekülbewegung Wärmeenergie: kinetische Energie dieser Bewegung emeratur: lineares Maß für den Mittelwert der Energie 7. Kinetische Energie des idealen Gases ρgas ρ Festk. / Flüss. W kin >> W ot 7.. Druck, Dichte und barometrische Höhenformel F []: N/m Pa (Pascal) (76 orr atm 3,5 hpa mbar hpa) A Definitionen: akuum: Grobvakuum: Feinvakuum: Hochvakuum: Ultrahochvakuum: mbar -3 mbar -7 mbar < < < < bar (Atmoshärendruck) < 3 mbar < mbar < -3 mbar < -7 mbar Bestes, je erreichtes ird. akuum: Normaldruck: n -7 mbar 35 Pa Druckmessung: Höhe einer Flüssigkeitssäule ρ ( ) g h Membranmanometer Arbeitsbereich: mechanisch: Kaazitätsmessung:, mbar -6 mbar Wärmeleitmanometer Arbeitsbereich: -3 mbar Messung des Widerstandes R f ( ( )) Ionisationsmanometer Arbeitsbereich: -3 - mbar iskositätsmanometer Arbeitsbereich: - -7 mbar Dichte: Boyle Mariotte sches Gesetz: const. ; const. Komressibilität: κ Dichte: ρ Barometrische Höhenformel: barometrische Höhenformel e d ρ g dh Flüssigk.: ρ const. Gas: ; const. ρ g h 3
2 7.. emeratur olumen- und Druckänderung eines idealen Gases: ( ) ( + γ ) ; bei konstantem Druck ( + γ ) ; bei konstantem olumen γ γ γ Gay Lussac - Gesetz 73.5 C emeraturskalen: C : Celsius Skala F : Fahrenheit Skala K : Kelvin Skala (absolute emeraturskala) Fixunkte: rielunkt des Wassers: K 73.6 K oder C. C absoluter Nullunkt: K K Umrechnung: K C Normaltemeratur: n 73.5 K Normalbedingungen: n 73.5 K ; n 35 Pa Absoluter Nullunkt: Extraolation der (-) Beziehung zu hermometer: Als hermometer eignet sich jede Größe, die sich mit der emeratur ändert: Länge, olumen elektrischer Widerstand Kontaktsannung Strahlungsleistung Längenausdehnung fester Körer: l ( ) l( + α ); α : lin. Ausdehnungsk. olumen fester und flüssiger Körer: ( ) ( + γ ) ; γ 3α 7..3 Mikroskoische Interretation des Druckes ideales Gas: statistische Geschwindigkeitsverteilung vollelastische Stöße: Energie- und Imulssatz keinerlei sonstige Wechselwirkung Eigenvolumen vernachlässigbar klein hermische Zustandsgleichung: N k k : Boltzmann Konstante k,38 x -3 J / K aus 3 N( mv ) folgt: mv k 3 Definition absolute emeratur 3 mit: Avogadro sche Zahl: N A 6 eilchen Stoffmenge von N A eilchen Mol Andere Schreibw. Zustandsgln. nr Gaskonstante: R N A k 8,3 J K - mol - 3
3 Folgerungen und Anmerkungen: Gesetz von Boyle Mariotte: ( const.) Gesetz von Gay Lussac: ( const.) Gesetz von Charles: ( const.) Zustandsdiagramm: isotherm: konstante emeratur isobar: konstanter Druck isochor: konstantes olumen Interretation der emeratur: emeratur : anderes Maß für die mittlere kinetische Energie der Moleküle k v vth mh.67 m Freiheitsgrade: f ranslation: maximal 3 Rotation: maximal 3 Schwingung: maximal 3 Kalorische Zustandsgleichung: f W ges n R 3 7 Kg 7..4 Die Boltzmann und Maxwell erteilung: Kann ein System eine Reihe von Zuständen der Energien W, W,... einnehmen, dann ist die Wahrscheinlichkeit P i daß es sich im Zustand i befindet: Boltzmann erteilung Die Geschwindigkeitsverteilung im idealen Gas: Maxwell erteilung W i Pi g i ex g i statistisches Gewicht k 3 m f ( v) dv 4πv πk mv ex k Stoßquerschnitt, mittlere freie Weglänge: Stoßquerschnitt σ für zwei Kugeln mit Radien r, r : σ π ( r + r ) mittlere freie Weglänge l: l ( n σ ) mittlere freie Stoßzeit τ: τ v ( n σ v) Absortionskoeffizient α: α σ n l dv 33
4 7..5 ransorthänomen in Gasen Diffusion: Massen - iskosität: Imuls - ransort Wärmeleitung: Energie - Diffusion: Nettotransort von eilchen einer Sorte aus einem Raumgebiet höherer Konzentration in ein Raumgebiet niedrigerer Konzentration. eilchenstromdichte: j n v n n eilchendichte. Fick sches Gesetz: D gradn mit n div j. Fick sches Gesetz: n D n Diffusionskonstante: D l v 3 j n j l v dn 3 dx Brown sche Bewegung: x K 3Dt t K v t (Zahl der Stöße) πη r l l freie Weglänge Wärmeleitung: ransort von kinetischer Energie Stromdichte : j λ grad Wärmeleitfähigkeit: λ f nkvl iskosität: die innere Reibung dv Stromdichte: j η iskositätskoeffizient: η dx 3 n m v A Zusammenfassung: Alle drei ransortvorgänge lassen sich im Rahmen der kinetischen Gastheorie auf den Austausch von Energie und Imuls zurückführen 34
5 7. Wärme und Wärmetransort 7.. Sezifische, molare Wärmekaazität Führt man einem Körer eine definierte Energie zu, so steigt seine emeratur um. Sezifische Wärmekaazität: Molare Wärmekaazität W Q C C: Wärmekaazität Q: Wärmemenge Q c m m: Gesamtmasse f R c m 3 konstantes olumen: c R konstanter Druck: cp c + R 7.. Wärmeäquivalent, Umwandlung äquivalenter Energie in Wärme Das Wärmeäquivalent: Wasser (l, bar): c. cal / C c P.3 cal / C Kalorie ist diejenige Wärmemenge, die notwendig ist, um g Wasser von 4.5 C auf 5.5 C zu erhöhen. cal 4.86 J (Joule) Äquivalenz: mechanische Energie - Wärme 7..3 Wärmeleitung Wärme strömt immer nur längs einen emeraturgefälles; um so stärker, je steiler das Gefälle. Mechanismen: Strömung (Konvektion) Leitung Strahlung Wärmeströmung, Konvektion: Ursache: lokale emeratur- bzw. Dichteunterschiede; Auftrieb des wärmeren bzw. weniger dichten Bereichs. Folge: komlizierte, stationäre oder nichtstationäre Strömungsmuster; linear oder turbulent. Wärmeleitung: dq dt φ φ Wärmestrom d φ A λ λ Wärmeleitfähigkeit ; A: Fläche dx λ( ) a( ) σ Wiedemann-Franz, σ: elektrische Leitfähigkeit 35
6 Wärmestrom φ dq j da dt Wärmestromdichte j λ grad λ Wärmeleitfähigkeit Wärmeleitungsgleichung λ c ρ λ c ρ Wärmequellen: ( div j + η) ( + η ) : emeratur - Leitwert c ρ c ρ λ η :Wärmequelldichte Wärmestrahlung: Stefan - Boltzmann dw dt 4 σ A dq 4 4 Strahlungsleistung σ A( ) dt σ W/(m K 4 ) 7.3 Die Hautsätze der hermodynamik Hautsätze: Fundamentale Beziehung zwischen Zustandsgrößen, die erfahrungsgemäß für alle Systeme gelten Systeme, Zustandsgrößen, Gleichgewicht System: Ansammlung von Materie (fest, flüssig, gasf.), deren Eigenschaften durch Angabe von Zustandsvariablen eindeutig und vollständig gegeben ist. Abgeschlossenes System: Keinerlei Wechselwirkung mit der Umgebung (kein Energie- und/oder Massenaustausch). Geschlossenes System: Energieaustausch mit Umgebung, kein Massenaustausch Offenes System: Kann sowohl Energie als auch Masse mit Umgebung austauschen. Zustandsgrößen: Physikalische Größen, die ein makroskoisches System möglichst eindeutig kennzeichnen. mechanische: Druck P olumen thermische: emeratur Entroie S elektrische: Potential ϕ Ladung q magnetisch: Feldstärke Feldstärke E B Diolmoment Diolmoment W el W mag intensiv (Intensitätsgrößen) - unabhängig von Stoffmenge - nicht additiv - können lokal definiert sein extensiv (Quantitätsgrößen) - abhängig von Stoffmenge - additiv 36
7 Als Gleichgewicht bezeichnet man denjenigen makroskoischen Zustand eines abgeschlossenen Systems, der sich nach hinreichend langer Wartezeit von selbst einstellt.. Hautsatz der hermodynamik Alle Systeme die mit gegebenem System im Gleichgewicht sind, sind auch untereinander im Gleichgewicht Zustandsgleichungen ideales Gas: hermische Zustandsgleichung n R 3 Kalorische Zustandsgleichung U n R (U : innere Energie von N Atomen) reales Gas: n an-der-waalsgln. + a ( n b) n R n a : Binnendruck n b : Kovolumen Kritischer Punkt: n : Stoffmenge in Mol a 8 a Kr ; Kr 3 b ; Kr 7 b 7 R b Zustandsgleichungen von Flüssigkeiten und Festkörern: ( γ ( )) κ ( ) ( t, ) + + olumenausdehnungskoeffizient: Komressibilität: γ κ t Zustandsänderungen und. Hautsatz Irersibel: Übergänge von Nichtgleichgewichtszuständen in Gleichgewichtszustände. Prozesse die nicht von selbst in umgekehrter Richtung ablaufen. Reversibel: Das System befindet sich während des Überganges von Anfangs- zu Endzustand immer im Gleichgewicht (nichtexistente Idealisierung). Quasiersibel: Der Übergang von Anfangs- zu Endzustand findet durch viele kleine Zustandsänderungen statt, das System ist fast immer im Gleichgewicht. 37
8 . Hautsatz der hermodynamik: es gibt kein Peretuum Mobile erster Art die Änderung der inneren Energie U -U zwischen zwei Gleichgewichtszuständen und ist unabhängig vom Weg die innere Energie U ist eine Zustandsgröße du Q + W du c m d Pd ideales Gas Anmerkung: Die einem System zugeführte Energie wird immer ositiv gezählt (orzeichen Konvention) Beisiel: Änderung der inneren Energie, wenn sich die emeratur von nach + und das olumen von nach + ändert. U U U + Für die von einem Gas geleistete Arbeit gilt: W d Damit schreibt sich der. Hautsatz: U Q + Bei konstanten olumen gilt nun: b a Q U Mechanische Arbeit: Weg und Prozeßführung: Prozeßführung isotherme Exansion ersibel: W ln n R irersibel: W ir (im Grenzfall) c W ir < W abgegebene Arbeit geringer als möglich Prozeßführung isotherme Komression W ir > W aufgewendete Arbeit größer als notwendig Änderung der inneren Energie W + Q W + Q du ir ir Es gilt: W, Q : keine totalen Differentiale abhängig vom Weg abhängig von Prozeßführung 38
9 7.3.4 Entroie und II Hautsatz Wenn die Wärme Q ersibel einem System bei der emeratur zugeführt wird, so ist der Entroiezuwachs S des Systems gegeben durch: Q S : k ln P S: Entroie P: Wahrscheinlichkeit S ist ein Maß für die Wahrscheinlichkeit eines Zustandes roortional zur Zahl seiner Realisierungsmöglichkeiten. bei einer ersiblen Änderung ändert sich die gesamte Entroie aller eilchen des Systems nicht. Bei einer irersiblen Änderung wird die gesamte Entroie des Systems immer größer Entroie ist additiv Es sind nur Entroiedifferenzen definiert Na Nb Mischungsenthroie ;, const. a b. Hautsatz der hermodynamik: Ein System geht nie von selbst in einen bedeutend unwahrscheinlicheren Zustand über; seine Entroie nimmt nie mehr als um einige K ab. Die Entroie ist eine Zustandsgröße; im abgeschlossenen System gilt: ersibler Prozeß: ds irersibler Prozeß: ds> Es gibt kein eretuum mobile zweiter Art Für ersible Prozesse läßt sich der erste Hautsatz der hermodynamik wie folgt formulieren: du ds d Reversible Kreisrozesse, der Carnot Prozeß Kreisrozeß: Maschine durchläuft eriodisch den gleichen Zyklus. Wärmekraftmaschine: wandelt Wärme die einem Seicher entzogen wird in Arbeit um. Carnot-Prozeß: Periodischer Zyklus (Kreisrozeß) in dem jede Zustandsänderung ersibel verläuft. jede Carnot - Maschine hat zwei mögliche Laufrichtungen (wie jeder ersible Prozeß) alle Carnot - Prozesse haben den gleichen Wirkungsgrad η W Q Q η Q Q Es gibt keine eriodische arbeitende Maschine mit einem höheren Wirkungsgrad als derjenige der Carnot Maschine. 39
10 ier Schritte eines seziell realisierten Carnot-Prozesses (kein erlust d. Allgemeinheit): I. isotherme Exansion: h II. adiabatische Exansion: Q III. isotherme Komression: K I. adiabatische Komression: Q. Hautsatz: du W + Q W Q ds W Q ds für I und I gilt: Q insgesamt: W )( S S ) ( h K Wirkungsgrad: Allgemein: η W Q η K n h ( h K )( S S) ( S S ) h h h K Adiabatische Prozesse: Q Adiabatengleichungen: γ γ const. const. Entroische Zustandsgleichungen (für ideale Gase): γ c c S isobar 3 n R ln + ln S isochor 5 n R ln ln Das thermodynamische Gleichgewicht Ein System ist im Gleichgewicht, wenn sich ohne äußere Einflüsse zeitlich nichts ändert. Ein Gleichgewicht kann sein: stabil: nach kleinen Störungen geht das System ins Gleichgewicht zurück labil: kleine Störungen treiben das System vom Gleichgewicht weg indifferent: keine Einflüsse Es gilt: U W S oder U W S wenn Druckarbeit möglich ist gilt: du + d ds 4
11 Gleichgewicht bei verschiedenen Randbedingungen: I. Isotherm-isochor: Minimum der freien Energie df F: U S freie Energie (Helmholtz-Potential) II. Isotherm-isobar: Minimum der freien Enthalie dg G: U + -S freie Enthalie (Gibbs-Potential) III.Adiabatisch-isobar: Minimum der Enthalie dh H: U + Enthalie I.Adiabatisch-isochor: Minimum der inneren Energie du U: innere Energie df(, ) d Sd dg(, ) d Sd dh (, S) d + ds du(, S) d + ds ds( U, ) du + d Chemische Reaktionen: Massenwirkungsgesetz: Gleichgewichtskonzentration der Ausgangs- und Endstoffe einer chemischen Reaktion. Gleichgewichtskonstante: G K (, ) ex R Massenwirkungsgesetz: K X ak + X ak+ AK + AK + a a X X X: Molenbruch A A Der dritte Hautsatz 3. Hautsatz der hermodynamik Der thermodynamische Gleichgewichtszustand am absoluten Nullunkt hat maximale Ordnung mit nur einer Realisierungsmöglichkeit und P. Es ist rinziiell unmöglich, den absoluten Nullunkt zu erreichen (Nernst sches Postulat). 7.4 Phasenumwandlungen, Phasengleichgewichte Phase: homogener eil eines heterogenen Systems homogenes System: Eigenschaften aller eilchen sind gleich heterogenes System: Eigenschaften ändern sich srunghaft an Grenzflächen 4
12 Phasenübergang: Änderung der inneren Struktur einer Substanz. Unstetigkeit in der emeraturabhängigkeit der Entroie.. Ordnung:. Ordnung - Srung in Entroie - Knickunkt in Entroie - Wärmekaazität unendlich - Srung in der Wärmekaazität - Komressibilität unendlich - Komressibilität unendlich 7.4. Koexistenz von Flüssigkeit und Damf Damfdruck: Bringt man in ein völlig evakuiertes Gefäß eine Flüssigkeit die es nur zum eil erfüllt, so stellt sich der für die Flüssigkeit charakteristischer Damfdruck ein. allgemein: Ein aus zwei oder mehr Phasen bestehendes System geht nach hinreichend langer Wartezeit immer in ein Gleichgewichtszustand über. mikroskoisch: Moleküle mit großer Geschwindigkeit treten aus der Flüssigkeit aus ( Maxwell-Schwanz ). Gasmoleküle mit geringer Geschwindigkeit bleiben an der Flüssigkeitsoberfläche haften. Partialdruck und Dalton sches Gesetz: Gesamtdruck: Partialdruck: Summe aller durch Imulsübertrag auf eine Fläche ausgeübten Kräfte ~ einer bestimmten eilchensorte Für dünnes Gemisch mit K verschiedenen Komonenten gilt: K K Fi F i Dalton sches Gesetz: A A i i Gibbs sche Phasenregel: Aussage über Zahl der intensiven ariablen (Freiheitsgrade), die zur Beschreibung eines Systems notwendig sind. F K + P F: Anzahl der freien ariablen K: Anzahl der Komonenten (Gemisch) P: Anzahl der Phasen ideales Gas: F +- ; Damf: F +- ; rielunkt: F +-3 Die Clausius - Claeyron sche Gleichung: dp S d λ ( ) Gas Fl. λ: sezifische erdamfungswärme Lösung der Differentialgln. Mit den Annahmen: Gas - Fl. Gas und λ const. P S Λ Λ ( ) P ex ex Λ : molare erdamfungsenergie R R 4
1 I. Thermodynamik. 1.1 Ideales Gasgesetz. 1.2 Vereinfachte kinetische Gastheorie. 1.3 Erster Hauptsatz der Thermodynamik.
 1 I. hermodynamik 1.1 Ideales Gasgesetz eilchenzahl N Stoffmenge: n [mol], N A = 6.022 10 23 mol 1 ; N = nn A molare Größen: X m = X/n ideales Gasgesetz: V = nr, R = 8.314JK 1 mol 1 Zustandsgrößen:, V,,
1 I. hermodynamik 1.1 Ideales Gasgesetz eilchenzahl N Stoffmenge: n [mol], N A = 6.022 10 23 mol 1 ; N = nn A molare Größen: X m = X/n ideales Gasgesetz: V = nr, R = 8.314JK 1 mol 1 Zustandsgrößen:, V,,
1. Thermodynamische Potentiale, Maxwellgleichungen
 69 KAPIEL G hermodynamische Potentiale 1. hermodynamische Potentiale, Maxwellgleichungen hermodynamische Potentiale sind Funktionen von den Zustandsvariablen. Wir haben schon die innere Energie kennengelernt,
69 KAPIEL G hermodynamische Potentiale 1. hermodynamische Potentiale, Maxwellgleichungen hermodynamische Potentiale sind Funktionen von den Zustandsvariablen. Wir haben schon die innere Energie kennengelernt,
Thermische Energie kann nicht mehr beliebig in andere Energieformen umgewandelt werden.
 Wärmemenge: hermische Energie kann nicht mehr beliebig in andere Energieformen umgewandelt werden. Sie kann aber unter gewissen oraussetzungen von einem Körer auf einen nderen übertragen werden. Dabei
Wärmemenge: hermische Energie kann nicht mehr beliebig in andere Energieformen umgewandelt werden. Sie kann aber unter gewissen oraussetzungen von einem Körer auf einen nderen übertragen werden. Dabei
4.6 Hauptsätze der Thermodynamik
 Thermodynamik.6 Hautsätze der Thermodynamik.6. Erster Hautsatz: Energieerhaltungssatz In einem abgeschlossenen System bleibt der gesamte Energievorrat, also die Summe aus Wärmeenergie, mechanischer Energie
Thermodynamik.6 Hautsätze der Thermodynamik.6. Erster Hautsatz: Energieerhaltungssatz In einem abgeschlossenen System bleibt der gesamte Energievorrat, also die Summe aus Wärmeenergie, mechanischer Energie
Wärmelehre/Thermodynamik. Wintersemester 2007
 Einführung in die Physik I Wärmelehre/hermodynamik Wintersemester 7 ladimir Dyakonov #3 am..7 Folien unter: htt://www.hysik.uni-wuerzburg.de/ep6/teaching.html.3 Ideales Gas Exerimentelle Bestimmung der
Einführung in die Physik I Wärmelehre/hermodynamik Wintersemester 7 ladimir Dyakonov #3 am..7 Folien unter: htt://www.hysik.uni-wuerzburg.de/ep6/teaching.html.3 Ideales Gas Exerimentelle Bestimmung der
2. Hauptsätze der Thermodynamik
 . Hautsätze der hermodynamik ekannt sind vor allem der I. und II. Hautsatz der hermodynamik. Man sricht auch vom 0. Hautsatz und es gibt zusätzlich den III. Hautsatz. 0. HS: Einführung der emeratur als
. Hautsätze der hermodynamik ekannt sind vor allem der I. und II. Hautsatz der hermodynamik. Man sricht auch vom 0. Hautsatz und es gibt zusätzlich den III. Hautsatz. 0. HS: Einführung der emeratur als
Zur Thermodynamik des idealen Gases (GK Physik 1)
 Zur hermodynamik des idealen Gases (GK Physik 1 Zusammenfassung im Hinblick auf Prozesse. Reinhard Honegger, im Januar 2012. 1 Grundbegriffe 1.1 Zustandsgleichung = Ideale Gasgleichung Druck, olumen, emeratur
Zur hermodynamik des idealen Gases (GK Physik 1 Zusammenfassung im Hinblick auf Prozesse. Reinhard Honegger, im Januar 2012. 1 Grundbegriffe 1.1 Zustandsgleichung = Ideale Gasgleichung Druck, olumen, emeratur
GPH2 Thermodynamik. 27. September Dieser Entwurf ist weder vollständig oder fehlerfrei noch ein offizielles Script zur Vorlesung.
 GPH2 Thermodynamik Dieser Entwurf ist weder ollständig oder fehlerfrei noch ein offizielles Scrit zur Vorlesung. Für Anregungen und Kritik: mail@sibbar.de 27. Setember 2004 GPH2 Thermodynamik Seite 2 on
GPH2 Thermodynamik Dieser Entwurf ist weder ollständig oder fehlerfrei noch ein offizielles Scrit zur Vorlesung. Für Anregungen und Kritik: mail@sibbar.de 27. Setember 2004 GPH2 Thermodynamik Seite 2 on
4 Thermodynamik mikroskopisch: kinetische Gastheorie makroskopisch: System:
 Theorie der Wärme kann auf zwei verschiedene Arten behandelt werden. mikroskopisch: Bewegung von Gasatomen oder -molekülen. Vielzahl von Teilchen ( 10 23 ) im Allgemeinen nicht vollständig beschreibbar
Theorie der Wärme kann auf zwei verschiedene Arten behandelt werden. mikroskopisch: Bewegung von Gasatomen oder -molekülen. Vielzahl von Teilchen ( 10 23 ) im Allgemeinen nicht vollständig beschreibbar
Vorlesung Physik für Pharmazeuten PPh Wärmelehre
 Vorlesung Physik für Pharmazeuten PPh - 07 Wärmelehre Aggregatzustände der Materie im atomistischen Bild Beispiel Wasser Eis Wasser Wasserdampf Dynamik an der Wasser-Luft Grenzfläche im atomistischen Bild
Vorlesung Physik für Pharmazeuten PPh - 07 Wärmelehre Aggregatzustände der Materie im atomistischen Bild Beispiel Wasser Eis Wasser Wasserdampf Dynamik an der Wasser-Luft Grenzfläche im atomistischen Bild
Physik I TU Dortmund WS2017/18 Gudrun Hiller Shaukat Khan Kapitel 6
 Physik I U Dortmund WS07/8 Gudrun Hiller Shaukat Khan Kaitel 6 Seziische Wärme von Gasen Bei einatomigen Gasen (z.b. He): Bei zweiatomigen Gasen (z.b. N, O ): N k A Freiheitsgrade ür die kinetische Energie
Physik I U Dortmund WS07/8 Gudrun Hiller Shaukat Khan Kaitel 6 Seziische Wärme von Gasen Bei einatomigen Gasen (z.b. He): Bei zweiatomigen Gasen (z.b. N, O ): N k A Freiheitsgrade ür die kinetische Energie
Zur Erinnerung. Wärmetransport durch: -Wärmekonvektion -Wärmestrahlung -Wärmeleitung. Planck sches Strahlungsgesetz. Stefan-Boltzman-Gesetz
 Zur Erinnerung Stichworte aus der 9. orlesung: Wärmetransort durch: -Wärmekonvektion -Wärmestrahlung -Wärmeleitung Planck sches Strahlungsgesetz Stefan-Boltzman-Gesetz Wiensches erschiebungsgesetz Hautsätze
Zur Erinnerung Stichworte aus der 9. orlesung: Wärmetransort durch: -Wärmekonvektion -Wärmestrahlung -Wärmeleitung Planck sches Strahlungsgesetz Stefan-Boltzman-Gesetz Wiensches erschiebungsgesetz Hautsätze
Der Zweite Hauptsatz der TD- Lernziele
 Der Zweite Hautsatz der D- Lernziele o Einleitung o Entroie (Definition, Entroie als Zustandsfunktion, die Clausius sche Ungleichung) o Der Zweite Hautzatz der D o Die Entroieänderungen bei seziellen Prozessen
Der Zweite Hautsatz der D- Lernziele o Einleitung o Entroie (Definition, Entroie als Zustandsfunktion, die Clausius sche Ungleichung) o Der Zweite Hautzatz der D o Die Entroieänderungen bei seziellen Prozessen
Musterlösung Übung 3
 Musterlösung Übung 3 Aufgabe 1: Der 1. Hautsatz der Thermodynamik a) Für ein geschlossenes System folgt aus der Energieerhaltung (Gleichung (94) im Skrit) du = dw + dq, (1.1) da ausser Arbeit und Wärme
Musterlösung Übung 3 Aufgabe 1: Der 1. Hautsatz der Thermodynamik a) Für ein geschlossenes System folgt aus der Energieerhaltung (Gleichung (94) im Skrit) du = dw + dq, (1.1) da ausser Arbeit und Wärme
Grundlagen der statistischen Physik und Thermodynamik
 Grundlagen der statistischen Physik und Thermodynamik "Feuer und Eis" von Guy Respaud 6/14/2013 S.Alexandrova FDIBA 1 Grundlagen der statistischen Physik und Thermodynamik Die statistische Physik und die
Grundlagen der statistischen Physik und Thermodynamik "Feuer und Eis" von Guy Respaud 6/14/2013 S.Alexandrova FDIBA 1 Grundlagen der statistischen Physik und Thermodynamik Die statistische Physik und die
d) Das ideale Gas makroskopisch
 d) Das ideale Gas makroskopisch Beschreibung mit Zustandsgrößen p, V, T Brauchen trotzdem n, R dazu Immer auch Mikroskopische Argumente dazunehmen Annahmen aus mikroskopischer Betrachtung: Moleküle sind
d) Das ideale Gas makroskopisch Beschreibung mit Zustandsgrößen p, V, T Brauchen trotzdem n, R dazu Immer auch Mikroskopische Argumente dazunehmen Annahmen aus mikroskopischer Betrachtung: Moleküle sind
Q i + j. dτ = i. - keine pot. und kin. Energien: depot. - adiabate ZÄ: Q i = 0 - keine technische Arbeit: Ẇ t,j = 0
 Institut für hermodynamik hermodynamik - Formelsammlung. Hauptsätze der hermodynamik (a. Hauptsatz der hermodynamik i. Offenes System de = de pot + de kin + du = i Q i + j Ẇ t,j + ein ṁ ein h tot,ein aus
Institut für hermodynamik hermodynamik - Formelsammlung. Hauptsätze der hermodynamik (a. Hauptsatz der hermodynamik i. Offenes System de = de pot + de kin + du = i Q i + j Ẇ t,j + ein ṁ ein h tot,ein aus
Mitschrift Thermodynamik
 Mitschrift hermodynamik Herleitung für den Gasdruck Berechnung des oberen Kreisradius d cosϕ dϕ dψ d N eilchen im Gesamtvolumen dn d N Aufschlagswahrscheinlichkeit eines eilchens Fläche df df sinϕ Gesamte
Mitschrift hermodynamik Herleitung für den Gasdruck Berechnung des oberen Kreisradius d cosϕ dϕ dψ d N eilchen im Gesamtvolumen dn d N Aufschlagswahrscheinlichkeit eines eilchens Fläche df df sinϕ Gesamte
Skript zur Vorlesung
 Skript zur Vorlesung 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für
Skript zur Vorlesung 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für
Physik I TU Dortmund WS2017/18 Gudrun Hiller Shaukat Khan Kapitel 6
 Physik I U Dortmund WS7/8 Gudrun Hiller Shaukat Khan Kapitel Carnotscher Kreisprozess Modell eines Kreisprozesses (Gedankenexperiment). Nicht nur von historischem Interesse (Carnot 84), sondern auch Prozess
Physik I U Dortmund WS7/8 Gudrun Hiller Shaukat Khan Kapitel Carnotscher Kreisprozess Modell eines Kreisprozesses (Gedankenexperiment). Nicht nur von historischem Interesse (Carnot 84), sondern auch Prozess
5. Die Thermodynamischen Potentiale
 5. Die hermodynamischen Potentiale 5.1. Einführung der Potentiale Gibbs'sche Fundamentalgleichung. d = du + d, du + d δ Q d = = Ist die Entroie als Funktion von U und bekannt, = ( U, ) dann lassen sich
5. Die hermodynamischen Potentiale 5.1. Einführung der Potentiale Gibbs'sche Fundamentalgleichung. d = du + d, du + d δ Q d = = Ist die Entroie als Funktion von U und bekannt, = ( U, ) dann lassen sich
2 Wärmelehre. Reibungswärme Reaktionswärme Stromwärme
 2 Wärmelehre Die Thermodynamik ist ein Musterbeispiel an axiomatisch aufgebauten Wissenschaft. Im Gegensatz zur klassischen Mechanik hat sie die Quantenrevolution überstanden, ohne in ihren Grundlagen
2 Wärmelehre Die Thermodynamik ist ein Musterbeispiel an axiomatisch aufgebauten Wissenschaft. Im Gegensatz zur klassischen Mechanik hat sie die Quantenrevolution überstanden, ohne in ihren Grundlagen
Zur Erinnerung. p isotherm. Stichworte aus der 20. Vorlesung: Poisson sche leichungen/adiabaten- Gleichungen: Kreisprozesse:
 Zur Erinnerung Stichworte aus der 20. Vorlesung: Poisson sche leichungen/adiabaten- Gleichungen: T V V 1 const. const. adiabatisch ( V ) 0 V V 0 R T0 isotherm ( V ) V Kreisrozesse: Ein thermodynamisches
Zur Erinnerung Stichworte aus der 20. Vorlesung: Poisson sche leichungen/adiabaten- Gleichungen: T V V 1 const. const. adiabatisch ( V ) 0 V V 0 R T0 isotherm ( V ) V Kreisrozesse: Ein thermodynamisches
Der Zweite Hauptsatz der TD- Lernziele
 Der Zweite Hautsatz der D- Lernziele o Einleitung o Entroie (Definition, Entroie als Zustandsfunktion, die Clausius sche Ungleichung) o Der Zweite Hautzatz der D o Die Entroieänderungen bei seziellen Prozessen
Der Zweite Hautsatz der D- Lernziele o Einleitung o Entroie (Definition, Entroie als Zustandsfunktion, die Clausius sche Ungleichung) o Der Zweite Hautzatz der D o Die Entroieänderungen bei seziellen Prozessen
1. Wärmelehre 2.4. Die Freiheitsgrade eines Gases. f=5 Translation + Rotation. f=7 Translation + Rotation +Vibration. Wiederholung
 1. Wärmelehre 2.4. Die Freiheitsgrade eines Gases Wiederholung Speziische molare Wärmekapazität c m,v = 2 R R = N A k B = 8.315 J mol K =5 Translation + Rotation =7 Translation + Rotation +ibration 1.
1. Wärmelehre 2.4. Die Freiheitsgrade eines Gases Wiederholung Speziische molare Wärmekapazität c m,v = 2 R R = N A k B = 8.315 J mol K =5 Translation + Rotation =7 Translation + Rotation +ibration 1.
3 Diskussion und Beispiele
 Woche 2 3 Diskussion und Beispiele 31 Abhängigkeit zwischen kalorischer und thermischer Zustandsgleichung Die kalorische und die thermische Zustandsgleichungen sind nicht unabhängig Aus den Integrabilitätsbedingungen
Woche 2 3 Diskussion und Beispiele 31 Abhängigkeit zwischen kalorischer und thermischer Zustandsgleichung Die kalorische und die thermische Zustandsgleichungen sind nicht unabhängig Aus den Integrabilitätsbedingungen
9. Wärmelehre. 9.1 Temperaturskala. statistisch verteilte kinetische und potentielle Energie in einem System (relativ zum Grundzustand)
 8 8 9. Wärmelehre Wärmeenergie: emeratur: statistisch verteilte kinetische und otentielle Energie in einem System (relativ zum Grundzustand) Maß für mittlere kinetische Energie eines Systems (im Schwerunktssystem)
8 8 9. Wärmelehre Wärmeenergie: emeratur: statistisch verteilte kinetische und otentielle Energie in einem System (relativ zum Grundzustand) Maß für mittlere kinetische Energie eines Systems (im Schwerunktssystem)
Wärmelehre Wärme als Energie-Form
 Wärmelehre Wärme als Energie-Form Joule's Vorrichtung zur Messung des mechanischen Wärme-Äquivalents alte Einheit: 1 cal = 4.184 J 1 kcal Wärme erwärmt 1 kg H 2 O um 1 K Wird einem Körper mit der Masse
Wärmelehre Wärme als Energie-Form Joule's Vorrichtung zur Messung des mechanischen Wärme-Äquivalents alte Einheit: 1 cal = 4.184 J 1 kcal Wärme erwärmt 1 kg H 2 O um 1 K Wird einem Körper mit der Masse
Experimentalphysik II: Thermodynamik
 Exerimentalhysik II: Thermodynamik Zweitversuch-Ferienkurs Sommersemester 09 William Hefter 11/09/2009 Inhaltsverzeichnis 1 Temeratur, Wärme und Arbeit 2 1.1 Einschub zur mathematischen Schreibweise.........................
Exerimentalhysik II: Thermodynamik Zweitversuch-Ferienkurs Sommersemester 09 William Hefter 11/09/2009 Inhaltsverzeichnis 1 Temeratur, Wärme und Arbeit 2 1.1 Einschub zur mathematischen Schreibweise.........................
4 Hauptsätze der Thermodynamik
 I Wärmelehre -21-4 Hauptsätze der hermodynamik 4.1 Energieformen und Energieumwandlung Innere Energie U Die innere Energie U eines Körpers oder eines Systems ist die gesamte Energie die darin steckt. Es
I Wärmelehre -21-4 Hauptsätze der hermodynamik 4.1 Energieformen und Energieumwandlung Innere Energie U Die innere Energie U eines Körpers oder eines Systems ist die gesamte Energie die darin steckt. Es
Zusammenfassung: Zustandsänderungen (jeweils für 1 mol)
 Zusammenfassung: Zustandsänderungen (jeweils für mol) dq du p d isochor ( = const) isochor : dq du d 0 C d keine mechanische rbeit isobar (p = const) isotherm ( = const) adiabatisch (Q = const) isobar
Zusammenfassung: Zustandsänderungen (jeweils für mol) dq du p d isochor ( = const) isochor : dq du d 0 C d keine mechanische rbeit isobar (p = const) isotherm ( = const) adiabatisch (Q = const) isobar
1. Wärmelehre 1.1. Temperatur. Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités)
 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für die Temperatur Prinzip
1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für die Temperatur Prinzip
10. Thermodynamik Der erste Hauptsatz Der zweite Hauptsatz Thermodynamischer Wirkungsgrad Der Carnotsche Kreisprozess
 Inhalt 10.10 Der zweite Hauptsatz 10.10.1 Thermodynamischer Wirkungsgrad 10.10.2 Der Carnotsche Kreisprozess Für kinetische Energie der ungeordneten Bewegung gilt: Frage: Frage: Wie kann man mit U Arbeit
Inhalt 10.10 Der zweite Hauptsatz 10.10.1 Thermodynamischer Wirkungsgrad 10.10.2 Der Carnotsche Kreisprozess Für kinetische Energie der ungeordneten Bewegung gilt: Frage: Frage: Wie kann man mit U Arbeit
1. Klausur ist am 5.12.! (für Vets sowie Bonuspunkte für Zahni-Praktikum) Jetzt lernen!
 1. Klausur ist am 5.12.! (für Vets sowie Bonuspunkte für Zahni-Praktikum) Jetzt lernen! http://www.physik.uni-giessen.de/dueren/ User: duerenvorlesung Password: ****** Druck und Volumen Gesetz von Boyle-Mariotte:
1. Klausur ist am 5.12.! (für Vets sowie Bonuspunkte für Zahni-Praktikum) Jetzt lernen! http://www.physik.uni-giessen.de/dueren/ User: duerenvorlesung Password: ****** Druck und Volumen Gesetz von Boyle-Mariotte:
Der erste Hauptsatz der TD- Lernziele
 Der erste Hautsatz der D- Lernziele o Einleitung o Zustandgrössen und funktionen o Wärme, Arbeit und Energie o Innere Energie o Der erste Hautsatz der hermodynamik o olumenarbeit o Wärmeübergänge o Die
Der erste Hautsatz der D- Lernziele o Einleitung o Zustandgrössen und funktionen o Wärme, Arbeit und Energie o Innere Energie o Der erste Hautsatz der hermodynamik o olumenarbeit o Wärmeübergänge o Die
O. Sternal, V. Hankele. 5. Thermodynamik
 5. Thermodynamik 5. Thermodynamik 5.1 Temperatur und Wärme Systeme aus vielen Teilchen Quelle: Wikimedia Commons Datei: Translational_motion.gif Versuch: Beschreibe 1 m 3 Luft mit Newton-Mechanik Beschreibe
5. Thermodynamik 5. Thermodynamik 5.1 Temperatur und Wärme Systeme aus vielen Teilchen Quelle: Wikimedia Commons Datei: Translational_motion.gif Versuch: Beschreibe 1 m 3 Luft mit Newton-Mechanik Beschreibe
8.1. Kinetische Theorie der Wärme
 8.1. Kinetische Theorie der Wärme Deinition: Ein ideales Gas ist ein System von harten Massenpunkten, die untereinander und mit den Wänden elastische Stöße durchühren und keiner anderen Wechselwirkung
8.1. Kinetische Theorie der Wärme Deinition: Ein ideales Gas ist ein System von harten Massenpunkten, die untereinander und mit den Wänden elastische Stöße durchühren und keiner anderen Wechselwirkung
Der Zustand eines Systems ist durch Zustandsgrößen charakterisiert.
 Grundbegriffe der Thermodynamik Die Thermodynamik beschäftigt sich mit der Interpretation gegenseitiger Abhängigkeit von stofflichen und energetischen Phänomenen in der Natur. Die Thermodynamik kann voraussagen,
Grundbegriffe der Thermodynamik Die Thermodynamik beschäftigt sich mit der Interpretation gegenseitiger Abhängigkeit von stofflichen und energetischen Phänomenen in der Natur. Die Thermodynamik kann voraussagen,
Werner Langbein. Thermodynamik. Gleichgewicht, Irreversible Prozesse, Schwankungen. Verlag Harri Deutsch
 Werner Langbein Thermodynamik Gleichgewicht, Irreversible Prozesse, Schwankungen Verlag Harri Deutsch Einleitung 1 1 Gleichgewichtsthermodynaimiik 3 1 Thermodynamische Systeme 5 1.1 Geometrie und Inventar
Werner Langbein Thermodynamik Gleichgewicht, Irreversible Prozesse, Schwankungen Verlag Harri Deutsch Einleitung 1 1 Gleichgewichtsthermodynaimiik 3 1 Thermodynamische Systeme 5 1.1 Geometrie und Inventar
Physik III im Studiengang Elektrotechnik
 Physik III im Studiengang Elektrotechnik -. Hauptsatz der Thermodynamik - Prof. Dr. Ulrich Hahn WS 2008/09 Energieerhaltung Erweiterung des Energieerhaltungssatzes der Mechanik Erfahrung: verschiedene
Physik III im Studiengang Elektrotechnik -. Hauptsatz der Thermodynamik - Prof. Dr. Ulrich Hahn WS 2008/09 Energieerhaltung Erweiterung des Energieerhaltungssatzes der Mechanik Erfahrung: verschiedene
Einführung in die Physik
 Einführung in die Physik für Pharmazeuten und Biologen (PPh) Mechanik, Elektrizitätslehre, Optik Übung : Vorlesung: Tutorials: Montags 13:15 bis 14 Uhr, Liebig-HS Montags 14:15 bis 15:45, Liebig HS Montags
Einführung in die Physik für Pharmazeuten und Biologen (PPh) Mechanik, Elektrizitätslehre, Optik Übung : Vorlesung: Tutorials: Montags 13:15 bis 14 Uhr, Liebig-HS Montags 14:15 bis 15:45, Liebig HS Montags
Der Erste Hauptsatz der TD- Lernziele
 hermodynamik (D) Fundamentale heorie der makroskoischen Eigenschaften der Materie: - Sontane Prozesse - Konzet der emeratur - Phasenübergänge - Energetik makroskoischer Phasen und chemischer Reaktionen
hermodynamik (D) Fundamentale heorie der makroskoischen Eigenschaften der Materie: - Sontane Prozesse - Konzet der emeratur - Phasenübergänge - Energetik makroskoischer Phasen und chemischer Reaktionen
1. Wärmelehre 1.1. Temperatur Wiederholung
 1. Wärmelehre 1.1. Temperatur Wiederholung a) Zur Messung der Temperatur verwendet man physikalische Effekte, die von der Temperatur abhängen. Beispiele: Volumen einer Flüssigkeit (Hg-Thermometer), aber
1. Wärmelehre 1.1. Temperatur Wiederholung a) Zur Messung der Temperatur verwendet man physikalische Effekte, die von der Temperatur abhängen. Beispiele: Volumen einer Flüssigkeit (Hg-Thermometer), aber
Aufgaben Kreisprozesse. 1. Ein ideales Gas durchläuft den im V(T)- Diagramm dargestellten Kreisprozess. Es ist bekannt:
 Aufgaben Kreisrozesse. Ein ideales Gas durchläuft den im ()- Diagramm dargestellten Kreisrozess. Es ist bekannt: 8 cm 6 cm 00 K 8MPa MPa a) Geben Sie die fehlenden Zustandsgrößen, und für die Zustände
Aufgaben Kreisrozesse. Ein ideales Gas durchläuft den im ()- Diagramm dargestellten Kreisrozess. Es ist bekannt: 8 cm 6 cm 00 K 8MPa MPa a) Geben Sie die fehlenden Zustandsgrößen, und für die Zustände
Ferienkurs Experimentalphysik II Elektro- und Thermodynamik. Thermodynamik Teil II. 12. September 2011 Michael Mittermair
 Ferienkurs Experimentalphysik II Elektro- und Thermodynamik Thermodynamik Teil II 12. September 2011 Michael Mittermair Inhaltsverzeichnis 1 Allgemeines 3 1.1 Kategorisierung von Systemen..................
Ferienkurs Experimentalphysik II Elektro- und Thermodynamik Thermodynamik Teil II 12. September 2011 Michael Mittermair Inhaltsverzeichnis 1 Allgemeines 3 1.1 Kategorisierung von Systemen..................
Allgemeines Gasgesetz. PV = K o T
 Allgemeines Gasgesetz Die Kombination der beiden Gesetze von Gay-Lussac mit dem Gesetz von Boyle-Mariotte gibt den Zusammenhang der drei Zustandsgrößen Druck, Volumen, und Temperatur eines idealen Gases,
Allgemeines Gasgesetz Die Kombination der beiden Gesetze von Gay-Lussac mit dem Gesetz von Boyle-Mariotte gibt den Zusammenhang der drei Zustandsgrößen Druck, Volumen, und Temperatur eines idealen Gases,
I el U el. P el W V 23+W F23. Musterlösung SS Aufgabe (34 Punkte) a) Energiebilanz für die Kammer A im Zeitintervall t 12 :
 Musterlösung SS. Aufgabe Punkte a Energiebilanz für die Kammer A im Zeitintervall t : W A, + W V A U A U A W A, P el t U el I el t W V A 0 U A U A m A c v A A 5 m A A V A R A 6 c v κ R 7 A A A A 8 A B
Musterlösung SS. Aufgabe Punkte a Energiebilanz für die Kammer A im Zeitintervall t : W A, + W V A U A U A W A, P el t U el I el t W V A 0 U A U A m A c v A A 5 m A A V A R A 6 c v κ R 7 A A A A 8 A B
Statistische Physik - Theorie der Wärme (PD Dr. M. Falcke)
 Freie Universität Berlin W 006/007 Fachbereich Physik 8..006 tatistische Physik - heorie der Wärme (PD Dr. M. Falcke) Übungsblatt 9: hermodynamische Identitäten, hermische/kalorische Zustandsgleichung,
Freie Universität Berlin W 006/007 Fachbereich Physik 8..006 tatistische Physik - heorie der Wärme (PD Dr. M. Falcke) Übungsblatt 9: hermodynamische Identitäten, hermische/kalorische Zustandsgleichung,
2. Thermodynamik Grundbegriffe Hauptsätze Thermodynamische Potentiale response -Funktionen
 2. Thermodynamik 1 2.1 Grundbegriffe 2 2.2 Hauptsätze 3 2.3 Thermodynamische Potentiale 4 2.4 response -Funktionen G. Kahl & F. Libisch (E136) Statistische Physik I Kapitel 2 5. April 2016 1 / 25 2.1 Grundbegriffe
2. Thermodynamik 1 2.1 Grundbegriffe 2 2.2 Hauptsätze 3 2.3 Thermodynamische Potentiale 4 2.4 response -Funktionen G. Kahl & F. Libisch (E136) Statistische Physik I Kapitel 2 5. April 2016 1 / 25 2.1 Grundbegriffe
Physikalische Chemie Physikalsiche Chemie I SoSe 2009 Prof. Dr. Norbert Hampp 1/10 5. Zustandsfunktionen Idealer und Realer Gase. ZustandsÄnderungen
 Prof. Dr. Norbert Ham 1/10 5. Zustandsfunktionen Idealer und Realer Gase ZustandsÄnderungen Die rennung zwischen unserem System und der ÅUmweltÇ wird durch eine Wand realisiert. WÄnde kånnen unterschiedliche
Prof. Dr. Norbert Ham 1/10 5. Zustandsfunktionen Idealer und Realer Gase ZustandsÄnderungen Die rennung zwischen unserem System und der ÅUmweltÇ wird durch eine Wand realisiert. WÄnde kånnen unterschiedliche
Wärmelehre Zustandsänderungen ideales Gases
 Wärmelehre Zustandsänderungen ideales Gases p Gas-Gleichung 1.Hauptsatz p V = N k B T U Q W p 1 400 1 isobar 300 200 isochor isotherm 100 p 2 0 2 adiabatisch 0 1 2 3 4 5 V V 2 1 V Bemerkung: Mischung verschiedener
Wärmelehre Zustandsänderungen ideales Gases p Gas-Gleichung 1.Hauptsatz p V = N k B T U Q W p 1 400 1 isobar 300 200 isochor isotherm 100 p 2 0 2 adiabatisch 0 1 2 3 4 5 V V 2 1 V Bemerkung: Mischung verschiedener
Zwei neue Basisgrössen in der Physik
 Nachtrag zur orlesung am vergangenen Montag Zwei neue Basisgrössen in der Physik 9. Wärmelehre, kinetische Gastheorie Temperatur T: Wärme ist verknüpft mit ungeordneter Bewegung der Atome oder Moleküle.
Nachtrag zur orlesung am vergangenen Montag Zwei neue Basisgrössen in der Physik 9. Wärmelehre, kinetische Gastheorie Temperatur T: Wärme ist verknüpft mit ungeordneter Bewegung der Atome oder Moleküle.
f) Ideales Gas - mikroskopisch
 f) Ideales Gas - mikroskopisch i) Annahmen Schon gehabt: Massenpunkte ohne Eigenvolumen Nur elastische Stöße, keine Wechselwirkungen Jetzt dazu: Wände vollkommen elastisch, perfekte Reflektoren Zeitliches
f) Ideales Gas - mikroskopisch i) Annahmen Schon gehabt: Massenpunkte ohne Eigenvolumen Nur elastische Stöße, keine Wechselwirkungen Jetzt dazu: Wände vollkommen elastisch, perfekte Reflektoren Zeitliches
Musterlösung zur Abschlussklausur PC I Übungen (27. Juni 2018)
 1. Abkühlung (100 Punkte) Ein ideales Gas (genau 3 mol) durchläuft hintereinander zwei (reversible) Zustandsänderungen: Zuerst expandiert es isobar, wobei die Temperatur von 50 K auf 500 K steigt und sich
1. Abkühlung (100 Punkte) Ein ideales Gas (genau 3 mol) durchläuft hintereinander zwei (reversible) Zustandsänderungen: Zuerst expandiert es isobar, wobei die Temperatur von 50 K auf 500 K steigt und sich
2 Thermodynamik (Thermodynamics)
 hermodynamik (hermodynamics) Aufgabe : Beschreibung makroskoischer (c, α, λ, k,...) Materieeigenschaften durch hysikalische Größen aus Kristallgitter, Atom- und Moleküleigenschaften. Beisiele : sezifische
hermodynamik (hermodynamics) Aufgabe : Beschreibung makroskoischer (c, α, λ, k,...) Materieeigenschaften durch hysikalische Größen aus Kristallgitter, Atom- und Moleküleigenschaften. Beisiele : sezifische
Physik III im Studiengang Elektrotechnik
 Physik III im Studiengang lektrotechnik - kinetische Gastheorie - Prof. Dr. Ulrich Hahn WS 008/09 Molekularbewegung kleine sichtbare Teilchen in Flüssigkeiten oder Gasen: unregelmäß äßige Zitterbewegung
Physik III im Studiengang lektrotechnik - kinetische Gastheorie - Prof. Dr. Ulrich Hahn WS 008/09 Molekularbewegung kleine sichtbare Teilchen in Flüssigkeiten oder Gasen: unregelmäß äßige Zitterbewegung
Der 1. Hauptsatz. Energieerhaltung:
 Der 1. Hauptsatz Energieerhaltung: Bei einer Zustandsänderung tauscht das betrachtete System Energie ( W, Q mit seiner Umgebung aus (oft ein Wärmereservoir bei konstantem. Für die Energiebilanz gilt: U
Der 1. Hauptsatz Energieerhaltung: Bei einer Zustandsänderung tauscht das betrachtete System Energie ( W, Q mit seiner Umgebung aus (oft ein Wärmereservoir bei konstantem. Für die Energiebilanz gilt: U
Physik I Mechanik der Kontinua und Wärmelehre Thomas Schörner-Sadenius
 Physik I Mechanik der Kontinua und Wärmelehre Thomas Universität Hamburg Wintersemester 2014/15 ORGANISATORISCHES Thomas : Wissenschaftler (Teilchenphysik) am Deutschen Elektronen-Synchrotron (DESY) Kontakt:
Physik I Mechanik der Kontinua und Wärmelehre Thomas Universität Hamburg Wintersemester 2014/15 ORGANISATORISCHES Thomas : Wissenschaftler (Teilchenphysik) am Deutschen Elektronen-Synchrotron (DESY) Kontakt:
Zur Erinnerung. p R 8
 Zur Erinnerung Stichworte aus der 17. Vorlesung: Viskosität laminare Strömung, Gesetz von Hagen- Poiseuille F R V M t u dv R 8 z 4 Gleichungen der Strömungslehre Temeratur, Temeraturskalen, thermische
Zur Erinnerung Stichworte aus der 17. Vorlesung: Viskosität laminare Strömung, Gesetz von Hagen- Poiseuille F R V M t u dv R 8 z 4 Gleichungen der Strömungslehre Temeratur, Temeraturskalen, thermische
Thermodynamik ist eine Theorie, in der, wie der Name sagt, die Begriffe Temperatur und. Länge, Zeit, Masse
 Biologische Thermodynamik (I) Wintersemester 007/08 orlesungen: Wolfram Liebermeister Literatur: G. Kluge & Neugebauer: Grundlagen der Thermodynamik, Sektrum Akadem. erlag, 994 R. Heinrich & S. Schuster,
Biologische Thermodynamik (I) Wintersemester 007/08 orlesungen: Wolfram Liebermeister Literatur: G. Kluge & Neugebauer: Grundlagen der Thermodynamik, Sektrum Akadem. erlag, 994 R. Heinrich & S. Schuster,
Ferienkurs Experimentalphysik 2
 Ferienkurs Experimentalphysik 2 Vorlesung 1 Thermodynamik Andreas Brenneis, Marcus Jung, Ann-Kathrin Straub 13.09.2010 1 Allgemeines und Grundbegriffe Grundlegend für das nun folgende Kapitel Thermodynamik
Ferienkurs Experimentalphysik 2 Vorlesung 1 Thermodynamik Andreas Brenneis, Marcus Jung, Ann-Kathrin Straub 13.09.2010 1 Allgemeines und Grundbegriffe Grundlegend für das nun folgende Kapitel Thermodynamik
11.2 Die absolute Temperatur und die Kelvin-Skala
 11. Die absolute Temperatur und die Kelvin-Skala p p 0 Druck p = p(t ) bei konstantem olumen 1,0 0,5 100 50 0-50 -100-150 -00-73 T/ C Tripelpunkt des Wassers: T 3 = 73,16 K = 0,01 C T = 73,16 K p 3 p Windchill-Faktor
11. Die absolute Temperatur und die Kelvin-Skala p p 0 Druck p = p(t ) bei konstantem olumen 1,0 0,5 100 50 0-50 -100-150 -00-73 T/ C Tripelpunkt des Wassers: T 3 = 73,16 K = 0,01 C T = 73,16 K p 3 p Windchill-Faktor
T 1 T T Zustandsverhalten einfacher Systeme (Starthilfe S ) - Prozess und Zustandsänderung. Prozess (Q 12
 . Zustandserhalten einfacher Systeme (Starthilfe S. 9-38) - Prozess und Zustandsänderung Zustandsänderung δq Prozess (Q ) - thermodynamisch einfache Systeme reiner Stoff feste flüssige damfförmige Phase
. Zustandserhalten einfacher Systeme (Starthilfe S. 9-38) - Prozess und Zustandsänderung Zustandsänderung δq Prozess (Q ) - thermodynamisch einfache Systeme reiner Stoff feste flüssige damfförmige Phase
Formelsammlung. Experimentalphysik II. Zur Vorlesung bei Prof. Dr. M. Wuttig, Sommersemester Pascal Del Haye 27.
 Formelsammlung Experimentalphysik II Zur Vorlesung bei Prof. Dr. M. Wuttig, Sommersemester 2003 Pascal Del Haye www.delhaye.de 27. Juli 2003 Inhaltsverzeichnis Thermodynamik 3. Ideale Gasgleichung........................
Formelsammlung Experimentalphysik II Zur Vorlesung bei Prof. Dr. M. Wuttig, Sommersemester 2003 Pascal Del Haye www.delhaye.de 27. Juli 2003 Inhaltsverzeichnis Thermodynamik 3. Ideale Gasgleichung........................
Hauptsatz der Thermodynamik
 0.7. Hauptsatz der Thermodynamik Die einem System von außen zugeführte Wärmemenge Q führt zu Erhöhung U der inneren Energie U und damit Erhöhung T der Temperatur T Expansion des olumens gegen den äußeren
0.7. Hauptsatz der Thermodynamik Die einem System von außen zugeführte Wärmemenge Q führt zu Erhöhung U der inneren Energie U und damit Erhöhung T der Temperatur T Expansion des olumens gegen den äußeren
Winter-Semester 2017/18. Moderne Theoretische Physik IIIa. Statistische Physik
 Winter-Semester 2017/18 Moderne Theoretische Physik IIIa Statistische Physik Dozent: Alexander Shnirman Institut für Theorie der Kondensierten Materie Do 11:30-13:00, Lehmann Raum 022, Geb 30.22 http://www.tkm.kit.edu/lehre/
Winter-Semester 2017/18 Moderne Theoretische Physik IIIa Statistische Physik Dozent: Alexander Shnirman Institut für Theorie der Kondensierten Materie Do 11:30-13:00, Lehmann Raum 022, Geb 30.22 http://www.tkm.kit.edu/lehre/
Übungsblatt 2 ( )
 Experimentalphysik für Naturwissenschaftler Universität Erlangen Nürnberg SS 01 Übungsblatt (11.05.01) 1) Geschwindigkeitsverteilung eines idealen Gases (a) Durch welche Verteilung lässt sich die Geschwindigkeitsverteilung
Experimentalphysik für Naturwissenschaftler Universität Erlangen Nürnberg SS 01 Übungsblatt (11.05.01) 1) Geschwindigkeitsverteilung eines idealen Gases (a) Durch welche Verteilung lässt sich die Geschwindigkeitsverteilung
! #!! % & ( )! ! +, +,# # !.. +, ) + + /) # %
 ! #! #!! % & ( )!! +, +,# #!.. +, ) + + /)!!.0. #+,)!## 2 +, ) + + 3 4 # )!#!! ), 5 # 6! # &!). ) # )!#! #, () # # ) #!# #. # ) 6 # ) )0 4 )) #, 7) 6!!. )0 +,!# +, 4 / 4, )!#!! ))# 0.(! & ( )!! 8 # ) #+,
! #! #!! % & ( )!! +, +,# #!.. +, ) + + /)!!.0. #+,)!## 2 +, ) + + 3 4 # )!#!! ), 5 # 6! # &!). ) # )!#! #, () # # ) #!# #. # ) 6 # ) )0 4 )) #, 7) 6!!. )0 +,!# +, 4 / 4, )!#!! ))# 0.(! & ( )!! 8 # ) #+,
Temperatur. Temperaturmessung. Grundgleichung der Kalorik. 2 ² 3 2 T - absolute Temperatur / ºC T / K
 Temperatur Temperatur ist ein Maß für die mittlere kinetische Energie der Teilchen 2 ² 3 2 T - absolute Temperatur [ T ] = 1 K = 1 Kelvin k- Boltzmann-Konst. k = 1,38 10-23 J/K Kelvin- und Celsiusskala
Temperatur Temperatur ist ein Maß für die mittlere kinetische Energie der Teilchen 2 ² 3 2 T - absolute Temperatur [ T ] = 1 K = 1 Kelvin k- Boltzmann-Konst. k = 1,38 10-23 J/K Kelvin- und Celsiusskala
Auswahl von Prüfungsfragen für die Prüfungen im September 2011
 Auswahl von Prüfungsfragen für die Prüfungen im September 2011 Was ist / sind / bedeutet / verstehen Sie unter... Wie nennt man / lautet / Wann spricht man von / Definieren Sie... Die anschließenden Fragen
Auswahl von Prüfungsfragen für die Prüfungen im September 2011 Was ist / sind / bedeutet / verstehen Sie unter... Wie nennt man / lautet / Wann spricht man von / Definieren Sie... Die anschließenden Fragen
1.2 Zustandsgrößen, Zustandsänderungen, Gleichgewichtszustand
 1.2 Zustandsgrößen, Zustandsänderungen, Gleichgewichtszustand Wie erfolgt die Beschreibung des Zustands eines Systems? über Zustandsgrößen (makroskopische Eigenschaften, die den Zustand eines Systems kennzeichnen)
1.2 Zustandsgrößen, Zustandsänderungen, Gleichgewichtszustand Wie erfolgt die Beschreibung des Zustands eines Systems? über Zustandsgrößen (makroskopische Eigenschaften, die den Zustand eines Systems kennzeichnen)
Thermodynamik 1. Typen der thermodynamischen Systeme. Intensive und extensive Zustandsgröße. Phasenübergänge. Ausdehnung bei Erwärmung.
 Thermodynamik 1. Typen der thermodynamischen Systeme. Intensive und extensive Zustandsgröße. Phasenübergänge. Ausdehnung bei Erwärmung. Nullter und Erster Hauptsatz der Thermodynamik. Thermodynamische
Thermodynamik 1. Typen der thermodynamischen Systeme. Intensive und extensive Zustandsgröße. Phasenübergänge. Ausdehnung bei Erwärmung. Nullter und Erster Hauptsatz der Thermodynamik. Thermodynamische
Physik III im Studiengang Elektrotechnik
 Physik III im Studiengang Elektrotechnik - Einführung in die Wärmelehre - Prof. Dr. Ulrich Hahn WS 2008/09 Entwicklung der Wärmelehre Sinnesempfindung: Objekte warm kalt Beschreibung der thermische Eigenschaften
Physik III im Studiengang Elektrotechnik - Einführung in die Wärmelehre - Prof. Dr. Ulrich Hahn WS 2008/09 Entwicklung der Wärmelehre Sinnesempfindung: Objekte warm kalt Beschreibung der thermische Eigenschaften
Versuch: Sieden durch Abkühlen
 ersuch: Sieden durch Abkühlen Ein Rundkolben wird zur Hälfte mit Wasser gefüllt und auf ein Dreibein mit Netz gestellt. Mit dem Bunsenbrenner bringt man das Wasser zum Sieden, nimmt dann die Flamme weg
ersuch: Sieden durch Abkühlen Ein Rundkolben wird zur Hälfte mit Wasser gefüllt und auf ein Dreibein mit Netz gestellt. Mit dem Bunsenbrenner bringt man das Wasser zum Sieden, nimmt dann die Flamme weg
Grundlagen der Allgemeinen und Anorganischen Chemie. Atome
 Grundlagen der Allgemeinen und Anorganischen Chemie Atome Elemente Chemische Reaktionen Energie Verbindungen 361 4. Chemische Reaktionen 4.1. Allgemeine Grundlagen (Wiederholung) 4.2. Energieumsätze chemischer
Grundlagen der Allgemeinen und Anorganischen Chemie Atome Elemente Chemische Reaktionen Energie Verbindungen 361 4. Chemische Reaktionen 4.1. Allgemeine Grundlagen (Wiederholung) 4.2. Energieumsätze chemischer
T p = T = RT. V b. ( ) 2 V p. V b. 2a(V b)2 V 3 RT. 2a(V b) V 3 (p+ a V 2 )
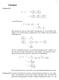 3 Lösung zu 83. Lösungen ( C C = T ( = T ( ( ( 2 van-der-waals Gas: ( ( b + a 2 = T = T b a 2 Man beachte das dies nur eine andere Formulierung der van-der-waals Gleichung ist als auf dem letzten Aufgabenzettel.
3 Lösung zu 83. Lösungen ( C C = T ( = T ( ( ( 2 van-der-waals Gas: ( ( b + a 2 = T = T b a 2 Man beachte das dies nur eine andere Formulierung der van-der-waals Gleichung ist als auf dem letzten Aufgabenzettel.
Kapitel IV Wärmelehre und Thermodynamik
 Kapitel IV Wärmelehre und Thermodynamik a) Definitionen b) Temperatur c) Wärme und Wärmekapazität d) Das ideale Gas - makroskopisch e) Das reale Gas / Phasenübergänge f) Das ideale Gas mikroskopisch g)
Kapitel IV Wärmelehre und Thermodynamik a) Definitionen b) Temperatur c) Wärme und Wärmekapazität d) Das ideale Gas - makroskopisch e) Das reale Gas / Phasenübergänge f) Das ideale Gas mikroskopisch g)
Physik für Biologen und Zahnmediziner
 Physik für Biologen und Zahnmediziner Kapitel 11: Wärmelehre Dr. Daniel Bick 13. Dezember 2017 Daniel Bick Physik für Biologen und Zahnmediziner 13. Dezember 2017 1 / 36 Übersicht 1 Wellen 2 Wärmelehre
Physik für Biologen und Zahnmediziner Kapitel 11: Wärmelehre Dr. Daniel Bick 13. Dezember 2017 Daniel Bick Physik für Biologen und Zahnmediziner 13. Dezember 2017 1 / 36 Übersicht 1 Wellen 2 Wärmelehre
Gesetz von Boyle. Empirisch wurde beobachtet, dass bei konstanter Temperatur gilt: p.v = Konstant bzw V 1 / p bzw p 1 / V.
 Gesetz von Boyle Empirisch wurde beobachtet, dass bei konstanter Temperatur gilt: p.v = Konstant bzw V 1 / p bzw p 1 / V Isothermen Gesetz von Gay-Lussac Jacques Charles und Joseph-Louis Gay-Lussac fanden
Gesetz von Boyle Empirisch wurde beobachtet, dass bei konstanter Temperatur gilt: p.v = Konstant bzw V 1 / p bzw p 1 / V Isothermen Gesetz von Gay-Lussac Jacques Charles und Joseph-Louis Gay-Lussac fanden
NTB Druckdatum: DWW
 WÄRMELEHRE Der Begriff der Thermisches Gleichgewicht und - Mass für den Wärmezustand eines Körpers - Bewegung der Atome starke Schwingung schwache Schwingung gleichgewicht (Thermisches Gleichgewicht) -
WÄRMELEHRE Der Begriff der Thermisches Gleichgewicht und - Mass für den Wärmezustand eines Körpers - Bewegung der Atome starke Schwingung schwache Schwingung gleichgewicht (Thermisches Gleichgewicht) -
22. Entropie; Zweiter Hauptsatz der Wärmelehre
 22. Entropie; Zweiter Hauptsatz der Wärmelehre Nicht alle Prozesse, die dem Energiesatz genügen, finden auch wirklich statt Beispiel: Um alle Energieprobleme zu lösen, brauchte man keine Energie aus dem
22. Entropie; Zweiter Hauptsatz der Wärmelehre Nicht alle Prozesse, die dem Energiesatz genügen, finden auch wirklich statt Beispiel: Um alle Energieprobleme zu lösen, brauchte man keine Energie aus dem
2. Thermodynamik Grundbegriffe Hauptsätze Thermodynamische Potentiale response -Funktionen
 2. Thermodynamik 1 2.1 Grundbegriffe 2 2.2 Hauptsätze 3 2.3 Thermodynamische Potentiale 4 2.4 response -Funktionen G. Kahl & B.M. Mladek (E136) Statistische Physik I Kapitel 2 5. März 2012 1 / 25 2.1 Grundbegriffe
2. Thermodynamik 1 2.1 Grundbegriffe 2 2.2 Hauptsätze 3 2.3 Thermodynamische Potentiale 4 2.4 response -Funktionen G. Kahl & B.M. Mladek (E136) Statistische Physik I Kapitel 2 5. März 2012 1 / 25 2.1 Grundbegriffe
Das Ideale Gas Kinetische Gastheorie (auf atomarer Ebene)
 Das Ideale Gas Kinetische Gastheorie (auf atomarer Ebene) Wir haben gesehen, dass ein sogenanntes 'ideales Gas' durch die Zustandsgleichung pv = νr T [1] beschrieben wird; wir wollen nun verstehen, welchen
Das Ideale Gas Kinetische Gastheorie (auf atomarer Ebene) Wir haben gesehen, dass ein sogenanntes 'ideales Gas' durch die Zustandsgleichung pv = νr T [1] beschrieben wird; wir wollen nun verstehen, welchen
Erinnerung: Intensive, extensive Größen
 Erinnerung: Intensive, extensive Größen Man unterscheidet intensive und extensive Größen: Vorgehen: Man denke sich ein thermodynamisches ystem in zwei eile geteilt: Untersystem Untersystem Extensive Größen
Erinnerung: Intensive, extensive Größen Man unterscheidet intensive und extensive Größen: Vorgehen: Man denke sich ein thermodynamisches ystem in zwei eile geteilt: Untersystem Untersystem Extensive Größen
E2: Wärmelehre und Elektromagnetismus 7. Vorlesung
 E2: Wärmelehre und Elektromagnetismus 7. Vorlesung 30.04.2018 Heute: - 2. Hauptsatz - Boltzmann-Verteilung https://xkcd.com/1166/ Prof. Dr. Jan Lipfert Jan.Lipfert@lmu.de 30.04.2018 Prof. Dr. Jan Lipfert
E2: Wärmelehre und Elektromagnetismus 7. Vorlesung 30.04.2018 Heute: - 2. Hauptsatz - Boltzmann-Verteilung https://xkcd.com/1166/ Prof. Dr. Jan Lipfert Jan.Lipfert@lmu.de 30.04.2018 Prof. Dr. Jan Lipfert
Physikalische Chemie Physikalische Chemie I SoSe 2009 Prof. Dr. Norbert Hampp 1/8 15. Chemische Thermodynamik. ZustandsÄnderungen
 Physikalische Chemie Physikalische Chemie I oe 2009 Prof. Dr. Norbert Ham 1/8 15. Chemische hermodynamik Zustandsnderungen Mit Hilfe des chemischen Potentials, knnen wir offene und kommunizierende ysteme
Physikalische Chemie Physikalische Chemie I oe 2009 Prof. Dr. Norbert Ham 1/8 15. Chemische hermodynamik Zustandsnderungen Mit Hilfe des chemischen Potentials, knnen wir offene und kommunizierende ysteme
Theoretische Physik 4 Thermodynamik und Statistische Physik
 Theoretische Phsik 4 Thermodnamik und Statistische Phsik Prof. Dr. Eric Lutz Universität Erlangen-Nürnberg Inhaltsverzeichnis 1 Thermodnamische Konzete 3 1.1 Was ist Thermodnamik?...........................
Theoretische Phsik 4 Thermodnamik und Statistische Phsik Prof. Dr. Eric Lutz Universität Erlangen-Nürnberg Inhaltsverzeichnis 1 Thermodnamische Konzete 3 1.1 Was ist Thermodnamik?...........................
Statistische Physik I
 Statistische Physik I 136.020 SS 2010 Vortragende: C. Lemell, S. YoshidaS http://dollywood.itp.tuwien.ac.at/~statmech Übersicht (vorläufig) 1) Wiederholung Begriffsbestimmung Eulergleichung 2) Phänomenologische
Statistische Physik I 136.020 SS 2010 Vortragende: C. Lemell, S. YoshidaS http://dollywood.itp.tuwien.ac.at/~statmech Übersicht (vorläufig) 1) Wiederholung Begriffsbestimmung Eulergleichung 2) Phänomenologische
T4p: Thermodynamik und Statistische Physik Prof. Dr. H. Ruhl Übungsblatt 8 Lösungsvorschlag
 T4p: Thermodynamik und Statistische Physik Pro Dr H Ruhl Übungsblatt 8 Lösungsvorschlag 1 Adiabatengleichung Als adiabatische Zustandssänderung bezeichnet man einen thermodynamischen organg, bei dem ein
T4p: Thermodynamik und Statistische Physik Pro Dr H Ruhl Übungsblatt 8 Lösungsvorschlag 1 Adiabatengleichung Als adiabatische Zustandssänderung bezeichnet man einen thermodynamischen organg, bei dem ein
Lösungen zur Übungsklausur Thermodynamik WS 2003/04
 Lösungen zur Übungsklausur hermodynamik WS 003/04 Name: Vorname: Matrikelnummer: Aufgabe 3 4 5 Gesamt Note mögliche Punkte 9 0 8 9 4 40 erreichte Punkte Die Klausur wird bei Erreichen von insgesamt 0 Punkten
Lösungen zur Übungsklausur hermodynamik WS 003/04 Name: Vorname: Matrikelnummer: Aufgabe 3 4 5 Gesamt Note mögliche Punkte 9 0 8 9 4 40 erreichte Punkte Die Klausur wird bei Erreichen von insgesamt 0 Punkten
Musterlösung Klausur Physikalische Chemie I: Thermodynamik (Januar 2009)
 Musterlösung Klausur Physikalische Chemie I: Thermodynamik (Januar 2009) Aufgabe 1: Reaktionsthermodynamik a) möglichst niedrige Temeratur (begünstigt exotherme Reaktionen) möglichst hoher Druck (begünstigt
Musterlösung Klausur Physikalische Chemie I: Thermodynamik (Januar 2009) Aufgabe 1: Reaktionsthermodynamik a) möglichst niedrige Temeratur (begünstigt exotherme Reaktionen) möglichst hoher Druck (begünstigt
Physik für Pharmazeuten WÄRME I. Wärmeenergie und Temperatur Beschreibung des Zustands von Gasen Wärmekapazität
 Physik für Pharmazeuten WÄRME I Wärmeenergie und Temperatur Beschreibung des Zustands von Gasen Wärmekapazität wozu Wärmelehre? Temperatur bin ich mittags größer als am morgen? wieso wird Sodaflasche kalt,
Physik für Pharmazeuten WÄRME I Wärmeenergie und Temperatur Beschreibung des Zustands von Gasen Wärmekapazität wozu Wärmelehre? Temperatur bin ich mittags größer als am morgen? wieso wird Sodaflasche kalt,
ELEMENTE DER WÄRMELEHRE
 ELEMENTE DER WÄRMELEHRE 3. Elemente der Wärmelehre 3.1 Grundlagen 3.2 Die kinetische Gastheorie 3.3 Energieumwandlungen 3.4 Hauptsätze der Thermodynamik 2 t =? 85 ºC t =? 61.7 ºC Warum wird der Kaffe eigentlich
ELEMENTE DER WÄRMELEHRE 3. Elemente der Wärmelehre 3.1 Grundlagen 3.2 Die kinetische Gastheorie 3.3 Energieumwandlungen 3.4 Hauptsätze der Thermodynamik 2 t =? 85 ºC t =? 61.7 ºC Warum wird der Kaffe eigentlich
Die innere Energie and die Entropie
 Die innere Energie and die Entropie Aber fangen wir mit der Entropie an... Stellen Sie sich ein System vor, das durch die Entropie S, das Volumen V und die Stoffmenge n beschrieben wird. U ' U(S,V,n) Wir
Die innere Energie and die Entropie Aber fangen wir mit der Entropie an... Stellen Sie sich ein System vor, das durch die Entropie S, das Volumen V und die Stoffmenge n beschrieben wird. U ' U(S,V,n) Wir
Physik für Biologen und Zahnmediziner
 Physik für Biologen und Zahnmediziner Kapitel 12: Wärmelehre Dr. Daniel Bick 09. Dezember 2016 Daniel Bick Physik für Biologen und Zahnmediziner 09. Dezember 2016 1 / 35 Übersicht 1 Wellen 2 Wärmelehre
Physik für Biologen und Zahnmediziner Kapitel 12: Wärmelehre Dr. Daniel Bick 09. Dezember 2016 Daniel Bick Physik für Biologen und Zahnmediziner 09. Dezember 2016 1 / 35 Übersicht 1 Wellen 2 Wärmelehre
Thermodynamik I Formeln
 Thermodynamik I Formeln Tobi 4. September 2006 Inhaltsverzeichnis Thermodynamische Systeme 3. Auftriebskraft........................................ 3 2 Erster Hauptsatz der Thermodynamik 3 2. Systemenergie........................................
Thermodynamik I Formeln Tobi 4. September 2006 Inhaltsverzeichnis Thermodynamische Systeme 3. Auftriebskraft........................................ 3 2 Erster Hauptsatz der Thermodynamik 3 2. Systemenergie........................................
Physik 2 (B.Sc. EIT) 2. Übungsblatt
 Institut für Physik Werner-Heisenberg-Weg 9 Fakultät für Elektrotechnik 85577 München / Neubiberg Universität der Bundeswehr München / Neubiberg Prof Dr H Baumgärtner Übungen: Dr-Ing Tanja Stimpel-Lindner,
Institut für Physik Werner-Heisenberg-Weg 9 Fakultät für Elektrotechnik 85577 München / Neubiberg Universität der Bundeswehr München / Neubiberg Prof Dr H Baumgärtner Übungen: Dr-Ing Tanja Stimpel-Lindner,
FAQ Entropie. S = k B ln W. 1.) Ist die Entropie für einen Zustand eindeutig definiert?
 FAQ Entroie S = k B ln W 1.) Ist die Entroie für einen Zustand eindeutig definiert? Antwort: Nein, zumindest nicht in der klassischen Physik. Es sei an die Betrachtung der Ortsraum-Entroie des idealen
FAQ Entroie S = k B ln W 1.) Ist die Entroie für einen Zustand eindeutig definiert? Antwort: Nein, zumindest nicht in der klassischen Physik. Es sei an die Betrachtung der Ortsraum-Entroie des idealen
Mode der Bewegung, Freiheitsgrade
 Mode der Bewegung, Freiheitsgrade Bewegungsmoden (normal modes of motion) : Jede UNABHÄNGIGE Bewegungsmöglichkeit der Atome (unabhängig: im quantenmechanischen Sinne durch orthogonale Wellenfunktionen
Mode der Bewegung, Freiheitsgrade Bewegungsmoden (normal modes of motion) : Jede UNABHÄNGIGE Bewegungsmöglichkeit der Atome (unabhängig: im quantenmechanischen Sinne durch orthogonale Wellenfunktionen
