Kriterien zur Bestimmung der zweckmäßigen Vergleichstherapie
|
|
|
- Claudia Baumgartner
- vor 7 Jahren
- Abrufe
Transkript
1 Kriterien zur Bestimmung der zweckmäßigen Vergleichstherapie und Recherche und Synopse der Evidenz zur Bestimmung der zweckmäßigen Vergleichstherapie nach 35a SGB V Vorgang: D-052 Aflibercept Stand:
2 I. Zweckmäßige Vergleichstherapie: Kriterien gemäß 5. Kapitel 6 VerfO G-BA Kriterien gemäß 5. Kapitel 6 VerfO Aflibercept zur Behandlung der feuchten altersbedingten Makuladegeneration. Sofern als Vergleichstherapie eine Arzneimittelanwendung in Betracht kommt, muss das Arzneimittel grundsätzlich eine Zulassung für das Anwendungsgebiet haben. Sofern als Vergleichstherapie eine nicht-medikamentöse Behandlung in Betracht kommt, muss diese im Rahmen der GKV erbringbar sein. Beschlüsse/Bewertungen/Empfehlungen des Gemeinsamen Bundesausschusses zu im Anwendungsgebiet zugelassenen Arzneimitteln/nicht-medikamentösen Behandlungen Die Vergleichstherapie soll nach dem allgemein anerkannten Stand der medizinischen Erkenntnisse zur zweckmäßigen Therapie im Anwendungsgebiet gehören. Bei mehreren Alternativen ist die wirtschaftlichere Therapie zu wählen, vorzugsweise eine Therapie, für die ein Festbetrag gilt. [ ] vorzugsweise eine Therapie, [ ] die sich in der praktischen Anwendung bewährt hat. Pegaptanib, Verteporfin, Ranibizumab Photodynamische Therapie (PDT), Photokoagulation mittels Laser Photodynamische Therapie (PDT) mit Verteporfin bei altersabhängiger feuchter Makuladegeneration mit subfoveolärer klassischer choriodaler Neovaskularisation, (Beschluss vom 16. Oktober 2000) Siehe systematische Literaturrecherche nicht angezeigt nicht angezeigt 2
3 II. Zugelassene Arzneimittel im Anwendungsgebiet Wirkstoff ATC-Code Handelsname Anwendungsgebiet (Text aus Fachinformation) Zu bewertendes Arzneimittel: Aflibercept (Eylea ) Pegaptanib Macugen S01LA03 Verteporfin Visudyne S01LA01 Ranibizumab Lucentis S01LA04 ist indiziert zur Behandlung der neovaskulären (feuchten) altersabhängigen Makuladegeneration (AMD) bei Erwachsenen. ist indiziert zur Behandlung der neovaskulären (feuchten) altersabhängigen Makuladegeneration (AMD) bei Erwachsenen. ist anzuwenden für die Behandlung von Erwachsenen mit exsudativer (feuchter) altersbezogener Makuladegeneration (AMD) mit vorwiegend klassischen subfovealen chorioidalen Neovaskularisationen (CNV) ist bei Erwachsenen indiziert zur Behandlung der neovaskulären (feuchten) altersabhängigen Makuladegeneration (AMD) Quellen: AMIS-Datenbank, Fachinformationen 3
4 Datum: Indikation für die Recherche: neovaskuläre (exsudative, feuchte ) altersbedingte Makuladegeneration Berücksichtigte Wirkstoffe/Therapien: Pegaptanib, Ranibizumab, photodynamische Therapie (PDT) mit Verteporfin, Laser-Photokoagulation. Systematische Recherche: Es wurde eine systematische Literaturrecherche nach systematischen Reviews, Meta-Analysen, HTA-Berichten und Evidenz-basierten systematischen Leitlinien zur Indikation neovaskuläre altersbedingte Makuladegeneration durchgeführt (Recherche am abgeschlossen). Die Suche erfolgte in folgenden Datenbanken: The Cochrane Library (einschl. NHS CRD-Datenbanken), Medline (PubMed), AWMF, GIN, NGC, TRIP. Die Recherche ergab 154 Quellen, die anschließend nach Themenrelevanz und methodischer Qualität gesichtet wurden. Es wurden 16 Quellen in die synoptische Evidenz-Übersicht eingeschlossen. Durch eine ergänzende Handsuche wurde ein Dokument des NICE mit Hinweisen auf potentielle Komparatoren von Aflibercept identifiziert und eingeschlossen (NICE Health Technology Appraisal. Aflibercept solution for injection for the treatment of wet age-related macular degeneration. Draft scope (Pre-referral)). Vedula Antiangiogenic therapy with anti-vascular endothelial growth factor modalities for neovascular age-related macular degeneration. Cochrane Database of Systematic Reviews 2008, Issue 2. Art. No.: CD Cochrane Reviews Systematischer Review mit 5 eingeschlossenen RCTs (2 zu Pegaptanib vs. Sham (EOP1003 und EOP 1004), 1 zu Ranubizumab vs. Sham (MARINA), 1 zu Ranibizumab/Verteprofin PDT Sham vs. Verteporfin PDT/Ranibizumab Sham (ANCHOR), 1 zu Ranibizumab plus Verteporfin PDT vs. Verteprofin PDT (FOCUS)). Pegaptanib Statistisch sign. Vorteil für Pegaptanib vs. Sham beim Verlust von mehr als 15 Buchstaben nach 1 Jahr mit (gepoolt) RR 0,71 (KI 95%: 0,61-0,84). Nur sehr wenige Fälle bei Pegaptanib vs. Sham mit Visusverbesserung um mehr als 15 Buchstaben (keine aussagefähige Auswertung möglich). Statistisch sign. Vorteil für Pegaptanib vs. Sham beim Risiko der Erblindung nach 1 Jahr mit (gepoolt) RR 0,69 (KI 95%: 0,59-0,82) Ranibizumab Statistisch sign. Vorteil für Ranibizumab vs. Sham beim Verlust von mehr als 15 Buchstaben nach 1 Jahr mit RR 0,14 (KI 95%: 0,10-0,22) Statistisch sign. Vorteil für Ranibizumab vs. Verteporfin PDT beim Verlust von mehr als 15 Buchstaben nach 1 Jahr mit RR 0,13 (KI 95%: 0,07-0,23) Statistisch sign. Vorteil für Ranibizumab+Verteporfin PDT vs. Verteporfin PDT beim Verlust von mehr als 15 Buchstaben nach 1 Jahr mit RR 0,30 (KI 95%: 0,15-0,60) Statistisch sign. Vorteil für Ranibizumab vs. Sham bei der Visusverbesserung von mehr als 15 Buchstaben nach 1 Jahr mit (gepoolt) RR 5,81 (KI 95%: 3,29-10,26) bzw. RR 6,79 (KI 95% 3,41-13,54) für Ranibizumab 4
5 vs. Verteporfin PDT, sowie RR 4,44 (KI 95%: 1,40-14,08) für Ranibizumab+Verteporfin PDT vs. Verteporfin PDT. Statistisch sign. Vorteil für Ranibizumab vs. Sham beim Risiko der Erblindung nach 1 Jahr mit RR 0,28 (KI 95%: 0,21-0,37) bzw. RR 0,32 (KI 95%: 0,24-0,42) für Ranibizumab vs. Verteporfin PDT sowie RR 0,64 (KI 95%: 0,42-0,96) für Ranibizumab+Verteporfin PDT vs. Verteporfin PDT. Wormald Photodynamic therapy for neovascular age-related macular degeneration. Cochrane Database of Systematic Reviews 2007, Issue 3. Art. No.: CD Virgili Laser photocoagulation for neovascular age-related macular degeneration. Cochrane Database of Systematic Reviews 2007, Issue 3. Art. No.: CD Arnold Age related macular degeneration. Clin Evid (Online) 2007 Schlussfolgerung der Autoren: Pegaptanib und Ranibizumab verringern das Risiko des Visusverlusts bei Patienten mti einer neovaskulären AMD. Ranibizumab bewirkt in vielen Fällen eine Zunahme des Visusverlusts. Lebensqualität und Kosten sind wichtig hinsichtlich der Therapieentscheidung. Systematischer Review mit 4 eingeschlossenen RCTs zu Verteporfin PDT vs. PDT mit 5% Dextroselösung. Statistisch sign. Vorteil für Verum-Arm beim Verlust von mehr als 3 Visus-Zeilen nach 24 Monaten mit RR 0,80 (KI 95%: 0,73-0,88) bzw. beim Verlust von mehr als 6 Visus-Zeilen nach 24 Monaten mit RR 0,66 (KI 95%: 0,56-0,83). Schlussfolgerung der Autoren: Photodynamische Therapie ist effektiv bei Menschen mit choroidaler Neovaskularisation zur Prävention des klinisch signifikanten Visusverlusts. Es besteht keine Evidenz bzgl. der Lebensqualität. Systematischer Review mit 15 eingeschlossenen RCTs. Schlussfolgerung der Autoren: In der mittel- bis langfristigen Betrachtung verlangsamt die Laser- Photokoagulation die Progression des Visusverlusts. Die Laser-Photokoagulation ist jedoch mit einer Risikozunahme für Visusverlust unmittelbar nach der Behandlung. Diese Periode kann für Patienten mit subfovealer AMD länger sein. Durch die Vorteile moderner pharmakologischer Therapien, ist die Laser- Photokoagulation der subfovealen choroidalen Neovaskularisation nicht empfehlenswert. Systematische Reviews, Meta-Analysen, HTA-Berichte Systematischer Review zur Behandlung der AMD. (Anmerkung FBMed: Recherchezeitraum bis März 2006). Zusammenfassung der wesentlichen Aussagen: Photodynamische Therapie mit Verteporfin reduziert das Risiko eines moderaten bis schweren Visusverlusts und der Erblindung bei Patienten mit einem initialen Visus von über 20/100 oder 20/200 im Vergleich zum Placebo. Die PDT mit Verteporfin scheint weniger wirksam zu sein im Vergleich zur Behandlung mit Ranibizumab. PDT ist assoziiert mit einem anfänglichen Visusverlust und photosensitiven Reaktionen bei einem kleinen Populationsanteil. (niedrige Evidenzqualität) Die thermale Laser-Photokoagulation kann schweren Visusverlust bei Patienten mit exsudativer AMD nach 2-5 Jahren im Vergleich zu keiner Behandlung reduzieren (hohe Evidenzqualität). Die Therapie ist häufig assoziiert mit einer sofortigen und permanenten Reduktion des Visus, wenn die Läsionen die zentrale Stelle 5
6 Brown Management of neovascular age-related macular degeneration: systematic drug class review and economic evaluation. Canadian Agency for Drugs and Technologies in Health (CADTH) 2008; -63. Colquitt Ranibizumab and pegaptanib for the treatment of age-related macular degeneration: a systematic review and economic evaluation Health Technology Assessment 2008; Vol. 12: No. 16 Cruess Photodynamic therapy with verteporfin in age-related der Makula betreffen, dennoch bleibt sie eine erprobte wirksame Behandlung der extrafovealen CNV. Etwa die Hälfte der Menschen rezidiviert innerhalb von 3 Jahren nach Behandlung. Es ist unklar, ob die Laser-Behandlung der Drusen eine Progression der Erkrankung verhindert. Die Behandlung könnte auch einen Anstieg der kurzfristen Raten der CNV bewirken. (niedrige Evidenzqualität) Antiangiogenese-bezogene Behandlung mit VEGF-Inhibitoren: - Pegaptanib könnte das Risiko eines moderaten Visusverlusts im Vergleich zur Sham-Behandlung nach 54 Wochen bei Patienten mit einer subfovealen CNV und AMD reduzieren (niedrige Evidenzqualität) - Ranibizumab reduziert das Risiko eines moderaten Visusverlusts im Vergleich zur Sham-Behandlung mit einer subfovealen klassischen oder okkulten CNV und AMD. - Ranibizumab reduziert das Risiko eines moderaten Visusverlusts im Vergleich zur PDT mit Verteporfin. (moderate Evidenzqualität) - Ranibizumab verbessert den Visus im Vergleich zur Sham-Behandlung nach Monaten. - Ranibizumab verbessert den Visus im Vergleich zur PDT mit Verteporfin nach 12 Monaten. (moderate Evidenzqualität) HTA-Bericht zum Management der neovaskulären AMD. Zusammenfassung der wesentlichen Ergebnisse: Ranibizumab zeigt statistisch signifikante Verbesserungen des Visus (Verlust von mind. 15 Buchstaben oder Verbesserung um mind. 15 Buchstaben) im Vergleich zur PDT mit Verteporfin. Ranibizumab zeigt statistisch signifikante durchschnittliche Verbesserungen des Visus (etwa 4,9 bis 11,3 Buchstaben) im Vergleich zur PDT mit Verteporfin (Verlust von etwa 8,2 bis 9,5 Buchstaben) nach 12 Monaten. Andere Visus-bezogenen Zielgrößen favorisieren ebenso Ranibizumab vs. PDT. Aus der Zusammenfassung: Zwischen PDT mit Verteporfin, Pegaptanib und Ranibizumab, zeigt nur Ranibizumab einen Umkehr des degenerativen Prozesses der CNV. HTA-Bericht zu Ranibizumab und Pegaptanib (Anmerkung FBMed: Recherchezeitraum bis September 2006). Zu Pegaptanib berücksichtigt: VISION-Studie. Zu Ranibizumab berücksichtigt: MARINA, ANCHOR, FOCUS und PIER. Zusammenfassung der wesentlichen Ergebnisse: Pegaptanib und Ranibizumab zeigen jeweils stat. sign. Vorteil vs. Sham bei Risiko eines Verlusts von mehr als 15 Buchstaben nach 12 Monaten. Ranibizumab zeigt zudem einen stat. sign. Vorteil vs. PDT mit Verteporfin. Der Anteil an Patienten mit einer Visusverbesserung war stat. sign. höher bei Pegaptanib (0,3 mg, 1 mg jedoch nicht 3 mg) vs. Sham sowie bei allen Ranibizumab-Gruppen vs. Sham oder PDT mit Verteporfin. Eine stat. sign. Vorteil bzgl. Der Wahrscheinlichkeit für eine Visusverbesserung wurde auch für Ranibizumab+PDT vs. PDT festgestellt. Systematischer Review ohne Meta-Analyse zur PDT mit Verteporfin. Pivotale RCTs unterstützen den Einsatz von PDT in der AMD-Behandlung bei Läsionen, die angiographisch 6
7 macular degeneration: a systematic review of efficacy, safety, treatment modifications and pharmacoeconomic properties. Acta Ophthalmol 2009; 87 (2): Escassi Efficacy and safety of new therapies for age-related macular degeneration. Andalusian Agency for Health Technology Assessment (AETSA) 2007; -52. Fadda Treatments for macular degeneration: summarising evidence using network metaanalysis. Br J Ophthalmol 2011; 95 (10): Ip Anti-vascular endothelial growth factor pharmacotherapy for agerelated macular degeneration: a report by the American Academy of Ophthalmology. Ophthalmology 2008; 115 (10): Mitchell A systematic review of the efficacy and safety outcomes of anti-vegf agents used for treating neovascular agerelated macular degeneration: gut definiert werden können (was eine klassische Komponente voraussetzt). Die VIO-Studie legt nahe, dass okkulte Läsionen ohne klassische Komponente eher unwahrscheinlich von der PDT profitieren. Die Relevanz der PDT für die minimal klassischen Patienten bleibt bestehen. Systematischer Review mit 4 eingeschlossenen RCTs (je 2 zu Ranibizumab und Pegaptanib). Schlussfolgerung der Autoren: Die Behandlung mit Ranibizumab zeigte die besten Ergebnisse hinsichtlich der Wirksamkeit und Sicherheit basierend auf der Evidenz mittlerer Qualität. Die Evidenz zu Bevacizumab ist limitiert (keine publizierten Studien, vergleichbare Ergebnisse aus Beobachtungsstudien, ( ). Die Behandlung mit Pegaptanib zeigte bessere Ergebnisse als Placebo. Hinsichtlich des schweren Visusverlusts war die Wirksamkeit weniger ausgeprägt im Vergleich zu Ranibizumab (indirekter Vergleich). Netzwerk-Meta-Analyse zum indirekten Vergleich zwischen Pegaptanib, Ranibizumab, Bevacizumab, Verteporfin und Placebo (methodische Beschreibung ist unzureichend) zu dem gemeinsamen Endpunkt Verlust von mehr als 15 Buchstaben nach 1 Jahr. Wesentliche Vergleiche: Vorteil für Ranibizumab vs. Pegaptanib (RR 0,83, KI 95%: 0,70-0,98) Vorteil für Ranibizumab vs. Verteporfin (RR 0,70, KI 95%: 0,62-0,77) Systematischer Review zur Anti-VEGF-Behandlung der AMD. Folgende pivotale Studien berücksichtigt: MARINA, ANCHOR, PIER, VISION. Schlussfolgerung der Autoren: der Review der verfügbaren Daten zeigt, dass eine intravitreale Anti-VEGF-Therapie eine sichere und wirksame Behandlung für bis zu 2 Jahren darstellt. Die Level I Evidenz unterstützt diese Schlussfolgerung für Pegaptanib und Ranibizumab. Die Daten deuten darauf hin, dass die Visus-bezogene Wirksamkeit bei Ranibizumab höher als bei Pagaptanib ist. Zu den Unterschieden in der Sicherheit liegt keine ausreichende Evidenz vor. Im Ergebnis stellt Pegaptanib keine breit verbreitete Therapie der AMD dar. Es liegt keine Level I Evidenz für Bevacizumab vor. Systematischer Review zur Behandlung der AMD mit Ranibizumab und Bevacizumab. 8 Studien der Evidenzklasse I zu Ranibizumab und 1 Studie der Evidenzklasse I zu Bevacizumab eingeschlossen. Level II Evidenz Studien: 5 zu Ranibizumab und 6 zu Bevacizumab). Schlussfolgerung der Autoren: Umfangreiche Level I und II Evidenz zeigt die Wirksamkeit und Sicherheit von Ranibizumab und unterstützt die Therapie als den aktuellen Goldstand in der Behandlung der feuchten AMD. 7
8 comparison of ranibizumab and bevacizumab. Curr Med Res Opin 2011; 27 (7): NICE Ranibizumab and pegaptanib for the treatment of age-related macular degeneration. NICE technology appraisal guidance Takeda Pegaptanib and ranibizumab for neovascular age-related macular degeneration: a systematic review. Br J Ophthalmol 2007; 91 (9): van der Reis A systematic review of the adverse events of intravitreal anti-vascular endothelial growth factor injections. Retina 2011; 31 (8): Die Daten deuten auch auf die Wirksamkeit von Bevacizumab hin. Im Vergleich zu Ranibizumab sind die sicherheitsbezogenen Daten zu Bevacizumab unvollständig und nicht robust. Ranibizumab wird zur Anwendung empfohlen (Beschreibung der Voraussetzungen + Kostenübernahme des Herstellers nach der 14 Injektion). Pegaptanib wird nicht zur Anwendung empfohlen. Das Committee schlussfolgert auf Basis der verfügbaren RCT-Evidenz, ranibizumab is more clinically effective than pegaptanib in improving visual acuity. Systematischer Review zu Ranibizumab und Pegaptanib mit pivotalen Studien: MARINA, ANCHOR, FOCUS und VISION. (Anmerkung FBMed: Recherchezeitraum bis September 2006). Ranibizumab und Pegaptanib können die Progression der AMD verlangsamen oder aufhalten. Die Ergebnisse der RCTs zu Ranibizumab zeigen tendenziell einen größeren Effekt beim Visus als die Studie zu Pegaptanib. Systematischer Review zu unerwünschten Ereignissen der Anti-VEGF Therapien der AMD. Die Inzidenz von schwerwiegenden okulären und nicht-okulären unerwünschten Ereignissen lag bei etwa 1 pro 100 Injektionen für Bevacizumab, Ranibizumab und Pegaptanib. Die meisten milden unerwünschten Ereignisse lagen unter 5 pro 100 Injektionen. Schlussfolgerung der Autoren: Die berichteten Raten zu schwerwiegenden unerwünschten Nebenwirkungen waren niedrig. Die Evidenz ist nicht ausreichend, um Differenzen zwischen den jeweiligen Therapien festzustellen. keine eingeschlossen RCTs American Academy of Ophthalmology (AAO). Age-related macular degeneration. San Francisco Leitlinien Unter den aufgelisteten Therapieoptionen sind: - Ranibizumab (GoR A, LoE I) bei subfovealer CNV - Bavacizumab (GoR A, LoE I) bei subfovealer CNV - Pegaptanib (GoR A, LoE I) bei subfovealer CNV (neu oder Rezidiv, bei vorwiegend klassichen 8
9 (CA): AAO, 2008 Läsionen; minimal klassisch oder okkult ohne klassische Läsionen ( ) beim Verlust von 15 Buchstaben in den letzten 12 Monaten) - PDT mit Verteprofin (GoR A, LoE I) bei subfovealer CNV mit klassischer Komponente von über 50% ( ) - Laser-Photokoagulation (GoR A, LoE I) bei extrafovealer klassicher CNV Oliva / Catalan Agency for Health Information, Assessment and Quality (CAHIAQ Degeneración macular asociada a la edad: estrategias actuales en el tratamiento Ranibizumab ist wirksam uns sicher im Vergleich zum Placebo zur Prävention des Visusverlusts bei einer Behandlung von bis zu 2 Jahren (GoR A) und im Vergleich zur photodynamischen Therapie bei einer Behandlung bis zu einem Jahr (GoR B). Auch Pegaptanib könnte im Vergleich zu Placebo wirksam uns sicher bei einer Behandlung bis zu einem Jahr sein (GoR B). Photodynamische Therapie ist wirksam und sicher im Vergleich zum Placebo bei Patienten mit einer vorwiegend klassischen neovaskulären AMD bei einer Behandlung von bis zu 2 Jahren. CNV: choroidale Neovaskularisation Institutionelle Hinweise zu Komparatoren von Aflibercept NICE Genannte Komparatoren von Aflibercept: Health Technology Appraisal Aflibercept solution for injection Ranibizumab for the treatment of wet agerelated macular degeneration, Best supportive care Bevacizumab Draft scope (Pre-referral)
Antiangiogenetische Therapie bei neovaskulärer altersabhängiger Makuladegeneration
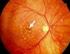 Antiangiogenetische Therapie bei neovaskulärer altersabhängiger Makuladegeneration VEGF Vascular Endothelial growth factor ist ein Protein, welches selektiv an Rezeptoren auf der Oberfläche von Gefäßendothelzellen
Antiangiogenetische Therapie bei neovaskulärer altersabhängiger Makuladegeneration VEGF Vascular Endothelial growth factor ist ein Protein, welches selektiv an Rezeptoren auf der Oberfläche von Gefäßendothelzellen
Ergebnisse der Strahlentherapie bei Makuladegeneration
 Ergebnisse der Strahlentherapie bei Makuladegeneration Frank Zimmermann Klinik für Strahlentherapie und Radioonkologie, Universitätsspital Basel radioonkologiebasel.ch Einteilung der Makuladegeneration
Ergebnisse der Strahlentherapie bei Makuladegeneration Frank Zimmermann Klinik für Strahlentherapie und Radioonkologie, Universitätsspital Basel radioonkologiebasel.ch Einteilung der Makuladegeneration
Priv.-Doz. Dr. med. Monika Fleckenstein Universitäts-Augenklinik Bonn. Ophthalmologische Fortbildung für medizinische Fachangestellte 25.
 Neuigkeiten aus der IVOM-Sprechstunde Priv.-Doz. Dr. med. Monika Fleckenstein Universitäts-Augenklinik Bonn Ophthalmologische Fortbildung für medizinische Fachangestellte 25. März 2015 Altersabhängige
Neuigkeiten aus der IVOM-Sprechstunde Priv.-Doz. Dr. med. Monika Fleckenstein Universitäts-Augenklinik Bonn Ophthalmologische Fortbildung für medizinische Fachangestellte 25. März 2015 Altersabhängige
Rheologische Infusionstherapie beim Hörsturz
 EVIDENZ KOMPAKT Rheologische Infusionstherapie beim Hörsturz Stand: 05.01.2017 Autoren Dr. Silke Thomas, MPH Medizinischer Dienst des Spitzenverbandes Bund der Krankenkassen e.v. (MDS), Essen Review Dr.
EVIDENZ KOMPAKT Rheologische Infusionstherapie beim Hörsturz Stand: 05.01.2017 Autoren Dr. Silke Thomas, MPH Medizinischer Dienst des Spitzenverbandes Bund der Krankenkassen e.v. (MDS), Essen Review Dr.
Kriterien zur Bestimmung der zweckmäßigen Vergleichstherapie
 Kriterien zur Bestimmung der zweckmäßigen Vergleichstherapie und Recherche und Synopse der Evidenz zur Bestimmung der zweckmäßigen Vergleichstherapie nach 35a SGB V Vorgang: 2015-04-15-D-161 Ruxolitinib
Kriterien zur Bestimmung der zweckmäßigen Vergleichstherapie und Recherche und Synopse der Evidenz zur Bestimmung der zweckmäßigen Vergleichstherapie nach 35a SGB V Vorgang: 2015-04-15-D-161 Ruxolitinib
Botulinumtoxin bei Hyperhidrose
 Botulinumtoxin bei Hyperhidrose EVIDENZ KOMPAKT Stand: 17.10.2017 EVIDENZ KOMPAKT Botulinumtoxin bei Hyperhidrose Stand: 17.10.2017 Autoren Dr. Dawid Pieper, MPH Institut für Forschung in der Operativen
Botulinumtoxin bei Hyperhidrose EVIDENZ KOMPAKT Stand: 17.10.2017 EVIDENZ KOMPAKT Botulinumtoxin bei Hyperhidrose Stand: 17.10.2017 Autoren Dr. Dawid Pieper, MPH Institut für Forschung in der Operativen
Bach-Blütentherapie. Ergebnisbericht aktualisierte Fassung
 Bach-Blütentherapie Ergebnisbericht aktualisierte Fassung Recherche Datum der Erstrecherche: 13.08.2011 Datum der Aktualisierungsrecherche: 11.03.2015 PICO-Fragestellung: Population: Personen mit diversen
Bach-Blütentherapie Ergebnisbericht aktualisierte Fassung Recherche Datum der Erstrecherche: 13.08.2011 Datum der Aktualisierungsrecherche: 11.03.2015 PICO-Fragestellung: Population: Personen mit diversen
1. Zusatznutzen des Arzneimittels im Verhältnis zur zweckmäßigen Vergleichstherapie
 Fidaxomicin Beschluss vom: 4. Juli 2013 gültig bis: unbefristet In Kraft getreten am: 4. Juli 2013 BAnz AT 02.08.2013 B7 Zugelassenes Anwendungsgebiet1 (Stand Januar 2013): DIFICLIR ist indiziert bei Erwachsenen
Fidaxomicin Beschluss vom: 4. Juli 2013 gültig bis: unbefristet In Kraft getreten am: 4. Juli 2013 BAnz AT 02.08.2013 B7 Zugelassenes Anwendungsgebiet1 (Stand Januar 2013): DIFICLIR ist indiziert bei Erwachsenen
Tragende Gründe. Vom 17. September Inhaltsverzeichnis. 1. Rechtsgrundlagen. 2. Eckpunkte der Entscheidung. 3. Verfahrensablauf. 4.
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Richtlinie Methoden Krankenhausbehandlung: Protonentherapie bei altersabhängiger Makuladegeneration Vom 17. September
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Richtlinie Methoden Krankenhausbehandlung: Protonentherapie bei altersabhängiger Makuladegeneration Vom 17. September
Welche Evidenz gibt es für die Wirksamkeit / Sicherheit für Ciclesonid bei Patienten mit Asthma bronchiale im Vergleich zu herkömmlichen ICS?
 Titel Nachrecherche zu Kapitel 4 (Wirkstoffe) - Ciclesonid Fragestellung Welche Evidenz gibt es für die Wirksamkeit / Sicherheit für Ciclesonid bei Patienten mit Asthma bronchiale im Vergleich zu herkömmlichen
Titel Nachrecherche zu Kapitel 4 (Wirkstoffe) - Ciclesonid Fragestellung Welche Evidenz gibt es für die Wirksamkeit / Sicherheit für Ciclesonid bei Patienten mit Asthma bronchiale im Vergleich zu herkömmlichen
EVIDENZ KOMPAKT. Lungenfunktionstestung mittels Spirometrie bei asymptomatischen Erwachsenen
 EVIDENZ KOMPAKT Lungenfunktionstestung mittels Spirometrie bei asymptomatischen Erwachsenen Stand: 14.02.2017 Autoren Stefanie Butz (M. Sc. Public Health) Dr. med. Dagmar Lühmann (Oberärztliche Koordinatorin
EVIDENZ KOMPAKT Lungenfunktionstestung mittels Spirometrie bei asymptomatischen Erwachsenen Stand: 14.02.2017 Autoren Stefanie Butz (M. Sc. Public Health) Dr. med. Dagmar Lühmann (Oberärztliche Koordinatorin
Untersuchungen zur Behandlung Choroidaler Neovaskularisationen. (CNV) am Augenhintergrund mittels Photodynamischer Therapie (PDT)
 1 Aus der Augenklinik und Hochschulambulanz für Augenheilkunde Campus Benjamin Franklin, Charité-Universitätsmedizin Berlin (Direktor: Univ. Prof. Dr. med. Michael H. Foerster) Untersuchungen zur Behandlung
1 Aus der Augenklinik und Hochschulambulanz für Augenheilkunde Campus Benjamin Franklin, Charité-Universitätsmedizin Berlin (Direktor: Univ. Prof. Dr. med. Michael H. Foerster) Untersuchungen zur Behandlung
LASERKOAGULATION 7/29/10 DIABETISCHES MAKULAÖDEM DIABETISCHES MAKULAÖDEM VENENASTVERSCHLUSS. HEINRICH HEIMANN Royal Liverpool University Hospital
 LASERKOAGULATION HEINRICH HEIMANN Royal Liverpool University Hospital 48-jähriger Patient Diabetisches Makulaödem Visus 0,1 Over a 2-year period, focal/grid photocoagulation is more effective and has fewer
LASERKOAGULATION HEINRICH HEIMANN Royal Liverpool University Hospital 48-jähriger Patient Diabetisches Makulaödem Visus 0,1 Over a 2-year period, focal/grid photocoagulation is more effective and has fewer
BAnz AT B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Dossierbewertung A14-26 Version 1.0 Empagliflozin Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Empagliflozin gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Empagliflozin gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG)
 Kurzfassung Der Gemeinsame Bundesausschuss (G-BA) hat mit Schreiben vom 22.02.2005 das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen mit der Nutzenbewertung verschiedener in Deutschland
Kurzfassung Der Gemeinsame Bundesausschuss (G-BA) hat mit Schreiben vom 22.02.2005 das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen mit der Nutzenbewertung verschiedener in Deutschland
Behandlung der feuchten altersabhängigen Makuladegeneration (feuchte AMD) mit VEGF-Hemmern durch operative Medikamenteneingabe in das Auge
 Augenarztpraxis AltenKirchen Dr. med. Thomas Wehler Facharzt für Augenheilkunde Wilhelmstr. 32 Schlossweg 2 57610 Altenkirchen Tel 02681-1651 Fax 02681-6094 Mail info@ak-augenarzt.de Net www.ak-augenarzt.de
Augenarztpraxis AltenKirchen Dr. med. Thomas Wehler Facharzt für Augenheilkunde Wilhelmstr. 32 Schlossweg 2 57610 Altenkirchen Tel 02681-1651 Fax 02681-6094 Mail info@ak-augenarzt.de Net www.ak-augenarzt.de
BAnz AT B7. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
EVIDENZ KOMPAKT. PSA-Test zur Früherkennung von Prostata-Krebs
 EVIDENZ KOMPAKT PSA-Test zur Früherkennung von Prostata-Krebs Stand: 04.04.2017 Autoren Dr. Silke Thomas, MPH Medizinischer Dienst des Spitzenverbandes Bund der Krankenkassen e.v. (MDS), Essen Review Dr.
EVIDENZ KOMPAKT PSA-Test zur Früherkennung von Prostata-Krebs Stand: 04.04.2017 Autoren Dr. Silke Thomas, MPH Medizinischer Dienst des Spitzenverbandes Bund der Krankenkassen e.v. (MDS), Essen Review Dr.
Altersbedingte Makuladegeneration: Etablierte und neue Behandlungsverfahren
 Altersbedingte Makuladegeneration: Etablierte und neue Behandlungsverfahren Bei der Behandlung der altersbedingten Makuladegeneration (AMD) werden immer neue Fortschritte erzielt. In den entwickelten Industrieländern
Altersbedingte Makuladegeneration: Etablierte und neue Behandlungsverfahren Bei der Behandlung der altersbedingten Makuladegeneration (AMD) werden immer neue Fortschritte erzielt. In den entwickelten Industrieländern
Kriterien zur Bestimmung der zweckmäßigen Vergleichstherapie
 Kriterien zur Bestimmung der zweckmäßigen Vergleichstherapie und Recherche und Synopse der Evidenz zur Bestimmung der zweckmäßigen Vergleichstherapie nach 35a SGB V Vorgang: 2017-B-295 Hydrocortison Stand:
Kriterien zur Bestimmung der zweckmäßigen Vergleichstherapie und Recherche und Synopse der Evidenz zur Bestimmung der zweckmäßigen Vergleichstherapie nach 35a SGB V Vorgang: 2017-B-295 Hydrocortison Stand:
EVIDENZ KOMPAKT. Screening auf das Vorliegen einer Carotisstenose bei asymptomatischen Erwachsenen
 EVIDENZ KOMPAKT Screening auf das Vorliegen einer Carotisstenose bei asymptomatischen Erwachsenen Stand: 15.11.2016 Autoren Stefanie Butz (M. Sc. Public Health) Dr. med. Dagmar Lühmann (Oberärztliche Koordinatorin
EVIDENZ KOMPAKT Screening auf das Vorliegen einer Carotisstenose bei asymptomatischen Erwachsenen Stand: 15.11.2016 Autoren Stefanie Butz (M. Sc. Public Health) Dr. med. Dagmar Lühmann (Oberärztliche Koordinatorin
Beschluss. im Alter von 5 Jahren und älter)
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Aflibercept (Eylea) bei altersbedingter Makuladegeneration
 verstehen abwägen entscheiden Aflibercept (Eylea) bei altersbedingter Makuladegeneration Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) Inhaltsverzeichnis Überblick Einleitung
verstehen abwägen entscheiden Aflibercept (Eylea) bei altersbedingter Makuladegeneration Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) Inhaltsverzeichnis Überblick Einleitung
Frühe Nutzenbewertung aus Sicht des IQWiG. Jürgen Windeler
 Frühe Nutzenbewertung aus Sicht des IQWiG Jürgen Windeler AMNOG, aus der Begründung Die Datenlage für neue Wirkstoffe (insbesondere in der Onkologie) wird von Experten als unbefriedigend bezeichnet. Die
Frühe Nutzenbewertung aus Sicht des IQWiG Jürgen Windeler AMNOG, aus der Begründung Die Datenlage für neue Wirkstoffe (insbesondere in der Onkologie) wird von Experten als unbefriedigend bezeichnet. Die
Therapieempfehlungen Therapieversagen
 Therapieempfehlungen Therapieversagen J. Nasemann Patient M.A, 2006 Patient M.A. Erstvorstellung im Januar 2002 83-jähriger Akademiker, geistig sehr rege Rechtes Auge: Visus 1/35 bei Pseudotumor, keine
Therapieempfehlungen Therapieversagen J. Nasemann Patient M.A, 2006 Patient M.A. Erstvorstellung im Januar 2002 83-jähriger Akademiker, geistig sehr rege Rechtes Auge: Visus 1/35 bei Pseudotumor, keine
EVIDENZ KOMPAKT. Lichttherapie bei Akne
 EVIDENZ KOMPAKT Lichttherapie bei Akne Stand: 06.02.2018 Autor Dr. Dawid Pieper, MPH Institut für Forschung in der Operativen Medizin (IFOM), Universität Witten/Herdecke Review Prof. Dr. med. Torsten Schäfer,
EVIDENZ KOMPAKT Lichttherapie bei Akne Stand: 06.02.2018 Autor Dr. Dawid Pieper, MPH Institut für Forschung in der Operativen Medizin (IFOM), Universität Witten/Herdecke Review Prof. Dr. med. Torsten Schäfer,
Bach-Blütentherapie. Evidenzsynthese
 Bach-Blütentherapie Evidenzsynthese Datenlage: Die Bach-Blütentherapie soll vor allem bei psychischen Problemen wie verschiedenen Angst- und Stresszuständen einen nützlichen Effekt haben. Insgesamt wurden
Bach-Blütentherapie Evidenzsynthese Datenlage: Die Bach-Blütentherapie soll vor allem bei psychischen Problemen wie verschiedenen Angst- und Stresszuständen einen nützlichen Effekt haben. Insgesamt wurden
Kunsttherapie für Krebspatienten und deren Angehörigen
 Kunsttherapie für Krebspatienten und deren Angehörigen Evidenzsynthese Datenlage: Zur Nutzen-Schaden-Abwägung der Kunsttherapie (malerisch oder zeichnerisch) bei Krebspatienten bzw. deren Angehörigen wurden
Kunsttherapie für Krebspatienten und deren Angehörigen Evidenzsynthese Datenlage: Zur Nutzen-Schaden-Abwägung der Kunsttherapie (malerisch oder zeichnerisch) bei Krebspatienten bzw. deren Angehörigen wurden
Elocon mometasone mometasone furoate monohydrate Nasonex Sch Sch rinelom
 Titel Nachrecherche zu Kapitel 4 (Wirkstoffe) - Mometason Fragestellung Welche Evidenz gibt es für die Wirksamkeit / Sicherheit für Mometason bei Patienten mit Asthma bronchiale im Vergleich zu herkömmlichen
Titel Nachrecherche zu Kapitel 4 (Wirkstoffe) - Mometason Fragestellung Welche Evidenz gibt es für die Wirksamkeit / Sicherheit für Mometason bei Patienten mit Asthma bronchiale im Vergleich zu herkömmlichen
Abschlussbericht D06-01H Version 1.0 PET und PET/CT bei Ösophaguskarzinom
 Kurzfassung Der Gemeinsame Bundesausschuss (G-BA) hat mit Schreiben vom 21.12.2006 das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) mit der Recherche, Darstellung und Bewertung
Kurzfassung Der Gemeinsame Bundesausschuss (G-BA) hat mit Schreiben vom 21.12.2006 das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) mit der Recherche, Darstellung und Bewertung
Kunsttherapie bei psychischen Erkrankungen
 Kunsttherapie bei psychischen Erkrankungen Evidenzsynthese Datenlage: Die vorliegende Bewertung bezieht sich auf die Nutzen-Schaden-Abwägung der Kunsttherapie (malerisch oder zeichnerisch) bei psychischen
Kunsttherapie bei psychischen Erkrankungen Evidenzsynthese Datenlage: Die vorliegende Bewertung bezieht sich auf die Nutzen-Schaden-Abwägung der Kunsttherapie (malerisch oder zeichnerisch) bei psychischen
zur Therapie der chorioidalen Neovaskularisation bei Myopie
 Stellungnahme der Deutschen Ophthalmologischen Gesellschaft, der Retinologischen Gesellschaft und des Berufsverbandes der Augenärzte Deutschlands zur Therapie der chorioidalen Neovaskularisation bei Myopie
Stellungnahme der Deutschen Ophthalmologischen Gesellschaft, der Retinologischen Gesellschaft und des Berufsverbandes der Augenärzte Deutschlands zur Therapie der chorioidalen Neovaskularisation bei Myopie
BAnz AT B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Pasireotid Beschluss vom: 6. Dezember 2012 gültig bis: unbefristet In Kraft getreten am: 6. Dezember 2012 BAnz AT B3
 Beschluss vom: 6. Dezember 01 gültig bis: unbefristet In Kraft getreten am: 6. Dezember 01 BAnz AT 1.01.013 B3 Zugelassenenes Anwendungsgebiet Signifor ist indiziert für die Behandlung von erwachsenen
Beschluss vom: 6. Dezember 01 gültig bis: unbefristet In Kraft getreten am: 6. Dezember 01 BAnz AT 1.01.013 B3 Zugelassenenes Anwendungsgebiet Signifor ist indiziert für die Behandlung von erwachsenen
Decitabin Beschluss vom: 2. Mai 2013 gültig bis: unbefristet In Kraft getreten am: 2. Mai 2013 BAnz AT B6
 Beschluss vom: 2. Mai 2013 gültig bis: unbefristet In Kraft getreten am: 2. Mai 2013 BAnz AT 29.05.2013 B6 Zugelassenes Anwendungsgebiet Dacogen ist indiziert zur Behandlung erwachsener Patienten ab einem
Beschluss vom: 2. Mai 2013 gültig bis: unbefristet In Kraft getreten am: 2. Mai 2013 BAnz AT 29.05.2013 B6 Zugelassenes Anwendungsgebiet Dacogen ist indiziert zur Behandlung erwachsener Patienten ab einem
IVOM welches Medikament bei welcher Erkrankung
 IVOM welches Medikament bei welcher Erkrankung GIO IVOM - KURS 2016 Neumünster Arnd Bunse F.E.B.O. Augenärzte BEP Schwerpunktpraxis für Netzhaut- und Makulaerkrankungen 21029 Hamburg www.augenaerzte-bep-bergedorf.de
IVOM welches Medikament bei welcher Erkrankung GIO IVOM - KURS 2016 Neumünster Arnd Bunse F.E.B.O. Augenärzte BEP Schwerpunktpraxis für Netzhaut- und Makulaerkrankungen 21029 Hamburg www.augenaerzte-bep-bergedorf.de
Tragende Gründe. Vom 3. September 2015
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen
Dossierbewertung A16-12 Version 1.0 Empagliflozin Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Empagliflozin gemäß 35a SGB V beauftragt. Der pu hat für den zu bewertenden
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Empagliflozin gemäß 35a SGB V beauftragt. Der pu hat für den zu bewertenden
Dossierbewertung A15-20 Version 1.0 Secukinumab Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Secukinumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Secukinumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
Bewertung von Arzneimitteln. Überblick über den AMNOG Prozess
 Bewertung von Arzneimitteln Überblick über den AMNOG Prozess Was erwartet Sie? Ablauf und Prinzip der frühen Nutzenbewertung nach 35a SGB V (Bewertung des Nutzens von Arzneimitteln mit neuen Wirkstoffen)
Bewertung von Arzneimitteln Überblick über den AMNOG Prozess Was erwartet Sie? Ablauf und Prinzip der frühen Nutzenbewertung nach 35a SGB V (Bewertung des Nutzens von Arzneimitteln mit neuen Wirkstoffen)
Besondere Anforderungen an Studien für Kinderarzneimittel (PUMA) aus Sicht der Nutzenbewertung des G-BA
 Besondere Anforderungen an Studien für Kinderarzneimittel (PUMA) aus Sicht der Nutzenbewertung des G-BA More Medicines for Minors - Bonn, 8. Juni 2015 Dr. Wiebke Löbker Abteilung Arzneimittel des Gemeinsamen
Besondere Anforderungen an Studien für Kinderarzneimittel (PUMA) aus Sicht der Nutzenbewertung des G-BA More Medicines for Minors - Bonn, 8. Juni 2015 Dr. Wiebke Löbker Abteilung Arzneimittel des Gemeinsamen
Konsequenzen aus der CATT-Studie. J. Nasemann
 Konsequenzen aus der CATT-Studie J. Nasemann Mai 2011 Studiendesign Ranibizumab gegen Bevacizumab monatliche Injektionen gegen bei Bedarf 1185 Patienten in 43 Zentren in den USA Single blind Prinzip der
Konsequenzen aus der CATT-Studie J. Nasemann Mai 2011 Studiendesign Ranibizumab gegen Bevacizumab monatliche Injektionen gegen bei Bedarf 1185 Patienten in 43 Zentren in den USA Single blind Prinzip der
ebm info.at ärzteinformationszentrum Goldimplantate (Berlockimplantate) zur Behandlung von Gelenksschmerzen
 ebm info.at ärzteinformationszentrum EbM Ärzteinformationszentrum www.ebm info.at Department für Evidenzbasierte Medizin und Klinische Epidemiologie Donau-Universität Krems Antwortdokument zur Anfrage
ebm info.at ärzteinformationszentrum EbM Ärzteinformationszentrum www.ebm info.at Department für Evidenzbasierte Medizin und Klinische Epidemiologie Donau-Universität Krems Antwortdokument zur Anfrage
Mit 66 Jahren, da hört das Sehen auf? Kombinationsbehandlung bei feuchter Makuladegeneration
 Mit 66 Jahren, da hört das Sehen auf? Kombinationsbehandlung bei feuchter Makuladegeneration So sollten Sie Ihr Enkelkind nicht sehen! Altersbezogene Makuladegeneration (Häufigkeit) Die AMD ist mit ca.
Mit 66 Jahren, da hört das Sehen auf? Kombinationsbehandlung bei feuchter Makuladegeneration So sollten Sie Ihr Enkelkind nicht sehen! Altersbezogene Makuladegeneration (Häufigkeit) Die AMD ist mit ca.
Eigenbluttherapie bei Tendinopathie
 Eigenbluttherapie bei Tendinopathie Evidenzsynthese 1.0 - Erstbewertung Datenlage: Insgesamt wurden zur Nutzen-Schadenabwägung der Eigenbluttherapie bei einer Tendinopathie drei Übersichtsarbeiten sowie
Eigenbluttherapie bei Tendinopathie Evidenzsynthese 1.0 - Erstbewertung Datenlage: Insgesamt wurden zur Nutzen-Schadenabwägung der Eigenbluttherapie bei einer Tendinopathie drei Übersichtsarbeiten sowie
Dossierbewertung A14-23 Nutzenbewertung gemäß 35a SGB V Version 1.0 Vedolizumab Colitis ulcerosa
 I 2 Nutzenbewertung I 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Vedolizumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
I 2 Nutzenbewertung I 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Vedolizumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss vom: 7. Februar 2013 gültig bis: unbefristet In Kraft getreten am: 7. Februar 2013 BAnz AT B1
 Beschluss vom: 7. Februar 2013 gültig bis: unbefristet In Kraft getreten am: 7. Februar 2013 BAnz AT 05.03.2013 B1 Zugelassenes Anwendungsgebiet (Kalydeco ) von Vertex Pharmaceuticals wird angewendet zur
Beschluss vom: 7. Februar 2013 gültig bis: unbefristet In Kraft getreten am: 7. Februar 2013 BAnz AT 05.03.2013 B1 Zugelassenes Anwendungsgebiet (Kalydeco ) von Vertex Pharmaceuticals wird angewendet zur
Isolated patellofemoral osteoarthritis A systematic review of treatment options using the GRADE approach
 Isolated patellofemoral osteoarthritis A systematic review of treatment options using the GRADE approach Interpretiert von: Sophie Narath, Birgit Reihs Inhalt Hintergrund & Thema Material & Methods Results
Isolated patellofemoral osteoarthritis A systematic review of treatment options using the GRADE approach Interpretiert von: Sophie Narath, Birgit Reihs Inhalt Hintergrund & Thema Material & Methods Results
Beschluss vom: 2. August 2012 gültig bis: unbefristet In Kraft getreten am: 2. August 2012 BAnz AT B3
 Beschluss vom: 2. August 202 gültig bis: unbefristet In Kraft getreten am: 2. August 202 BAnz AT 9.09.202 B3 Zugelassenes Anwendungsgebiet: Benlysta ist indiziert als Zusatztherapie bei erwachsenen Patienten
Beschluss vom: 2. August 202 gültig bis: unbefristet In Kraft getreten am: 2. August 202 BAnz AT 9.09.202 B3 Zugelassenes Anwendungsgebiet: Benlysta ist indiziert als Zusatztherapie bei erwachsenen Patienten
zur Therapie der chorioidalen Neovaskularisation bei pathologischer Myopie
 Stellungnahme der Deutschen Ophthalmologischen Gesellschaft, der Retinologischen Gesellschaft und des Berufsverbandes der Augenärzte Deutschlands zur Therapie der chorioidalen Neovaskularisation bei pathologischer
Stellungnahme der Deutschen Ophthalmologischen Gesellschaft, der Retinologischen Gesellschaft und des Berufsverbandes der Augenärzte Deutschlands zur Therapie der chorioidalen Neovaskularisation bei pathologischer
BAnz AT B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss vom: 18. Juni 2015 gültig bis: unbefristet In Kraft getreten am: 18. Juni 2015 BAnz AT B1
 Pasireotid (neues Anwendungsgebiet: Akromegalie) Beschluss vom: 18. Juni 2015 gültig bis: unbefristet In Kraft getreten am: 18. Juni 2015 BAnz AT 16.07.2015 B1 Neu zugelassenes Anwendungsgebiet vom 19.
Pasireotid (neues Anwendungsgebiet: Akromegalie) Beschluss vom: 18. Juni 2015 gültig bis: unbefristet In Kraft getreten am: 18. Juni 2015 BAnz AT 16.07.2015 B1 Neu zugelassenes Anwendungsgebiet vom 19.
1. Die Angaben zu Tenofoviralafenamid in der Fassung des Beschlusses vom 21. September 2017 (BAnz AT B2) werden aufgehoben.
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V
Screening auf Hirnleistungsstörungen zur Demenzprävention (Hirnleistungs-Check)
 EVIDENZ KOMPAKT Screening auf Hirnleistungsstörungen zur Demenzprävention (Hirnleistungs-Check) Stand: 14.11.2017 Autoren Dr. Tim Mathes, Köln Review Dr. med. Karin Kaiser-Rüb, Fachärztin für Neurologie
EVIDENZ KOMPAKT Screening auf Hirnleistungsstörungen zur Demenzprävention (Hirnleistungs-Check) Stand: 14.11.2017 Autoren Dr. Tim Mathes, Köln Review Dr. med. Karin Kaiser-Rüb, Fachärztin für Neurologie
Aufklärungsbogen für Patienten zum Vertrag zur besonderen ambulanten augenchirurgischen
 Aufklärungsbogen für Patienten zum Vertrag zur besonderen ambulanten augenchirurgischen Versorgung Sehr geehrte Patientin, sehr geehrter Patient, bei Ihnen ist ein/e altersbedingte feuchte Makuladegeneration
Aufklärungsbogen für Patienten zum Vertrag zur besonderen ambulanten augenchirurgischen Versorgung Sehr geehrte Patientin, sehr geehrter Patient, bei Ihnen ist ein/e altersbedingte feuchte Makuladegeneration
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Daratumumab wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Phase-II-Studie. VEGF Trap-Eye verbessert Sehkraft bei altersbedingter Makula-Degeneration: Nachhaltige Sehkraftverbes
 VEGF Trap-Eye verbessert Sehkraft bei altersbedingter Makula-Degeneration Nachhaltige Sehkraftverbesserung über 52 Wochen in Phase-II-Studie Leverkusen und Tarrytown, NY, USA, (19. August 2008) Patienten
VEGF Trap-Eye verbessert Sehkraft bei altersbedingter Makula-Degeneration Nachhaltige Sehkraftverbesserung über 52 Wochen in Phase-II-Studie Leverkusen und Tarrytown, NY, USA, (19. August 2008) Patienten
Goldimplantate (Berlockimplantate) zur Behandlung von Gelenksschmerzen
 Goldimplantate (Berlockimplantate) zur Behandlung von Gelenksschmerzen erstellt von Dr.in Glechner, Dr.in Angela Kaminski-Hartenthaler http://www.ebminfo.at/goldimplantate-bei-gelenksschmerzen Bitte den
Goldimplantate (Berlockimplantate) zur Behandlung von Gelenksschmerzen erstellt von Dr.in Glechner, Dr.in Angela Kaminski-Hartenthaler http://www.ebminfo.at/goldimplantate-bei-gelenksschmerzen Bitte den
Patientenaufklärung und Einverständniserklärung zur intravitrealen Injektion bei der feuchten altersbedingen Makuladegeneration (AMD)
 Patientendaten Arzt-/Klinikstempel Patientenaufklärung und Einverständniserklärung zur intravitrealen Injektion bei der feuchten altersbedingen Makuladegeneration (AMD) Die feuchte altersbedingte Makuladegeneration
Patientendaten Arzt-/Klinikstempel Patientenaufklärung und Einverständniserklärung zur intravitrealen Injektion bei der feuchten altersbedingen Makuladegeneration (AMD) Die feuchte altersbedingte Makuladegeneration
Dossierbewertung A16-13 Version 1.0 Empagliflozin/Metformin Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung der Wirkstoffkombination Empagliflozin/Metformin gemäß 35a SGB V beauftragt. Die Bewertung
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung der Wirkstoffkombination Empagliflozin/Metformin gemäß 35a SGB V beauftragt. Die Bewertung
Rapid Report N14-03 Version 1.0 Stammzelltransplantation bei Multiplem Myelom Update
 Kurzfassung Der Gemeinsame Bundesausschuss (G-BA) hat mit Schreiben vom 16.10.2014 das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) mit der Aktualisierung der Nutzenbewertung
Kurzfassung Der Gemeinsame Bundesausschuss (G-BA) hat mit Schreiben vom 16.10.2014 das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) mit der Aktualisierung der Nutzenbewertung
Rapid Report N14-01 Version 1.0 Intrakranielle Stents
 Kurzfassung Der Gemeinsame Bundesausschuss (G-BA) hat mit Schreiben vom 28.02.2014 das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) mit der Bewertung von Stents zur Behandlung
Kurzfassung Der Gemeinsame Bundesausschuss (G-BA) hat mit Schreiben vom 28.02.2014 das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) mit der Bewertung von Stents zur Behandlung
Übersicht über Eylea und Begründung für die Zulassung in der EU
 EMA/481361/2018 EMEA/H/C/002392 Übersicht über Eylea und Begründung für die Zulassung in der EU Was ist Eylea und wofür wird es angewendet? Eylea ist ein Arzneimittel für Erwachsene zur Behandlung: der
EMA/481361/2018 EMEA/H/C/002392 Übersicht über Eylea und Begründung für die Zulassung in der EU Was ist Eylea und wofür wird es angewendet? Eylea ist ein Arzneimittel für Erwachsene zur Behandlung: der
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V () 1 Anhang Checkliste zur Prüfung der formalen Vollständigkeit
Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V () 1 Anhang Checkliste zur Prüfung der formalen Vollständigkeit
BAnz AT B1. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
(neues Anwendungsgebiet: Prostatakarzinom, nach Versagen einer Androgenentzugstherapie, vor Chemotherapie)
 Abirateronacetat (neues Anwendungsgebiet: Prostatakarzinom, nach Versagen einer Androgenentzugstherapie, vor Chemotherapie) Beschluss vom: 4. Juli 2013 gültig bis: unbefristet In Kraft getreten am: 4.
Abirateronacetat (neues Anwendungsgebiet: Prostatakarzinom, nach Versagen einer Androgenentzugstherapie, vor Chemotherapie) Beschluss vom: 4. Juli 2013 gültig bis: unbefristet In Kraft getreten am: 4.
Dossierbewertung A14-01 Version 1.0 Trastuzumab Emtansin Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Trastuzumab Emtansin gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Trastuzumab Emtansin gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf
1. Die Angaben zu Ingenolmebutat in der Fassung des Beschlusses vom 4. Juli 2013 (BAnz AT B5) werden aufgehoben.
 Beschluss des Gemeinsamen Bundesausschusses über eine Änung Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V (eubewertung
Beschluss des Gemeinsamen Bundesausschusses über eine Änung Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V (eubewertung
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um die Wirkstoffkombination Tiotropium/Olodaterol wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Monitoring, Wiederbehandlungsund Prognoseparameter bei der Anti-VEGF-Therapie der AMD
 Monitoring, Wiederbehandlungsund Prognoseparameter bei der Anti-VEGF-Therapie der AMD Stefan Koinzer 23.04.2016 www.scienceofamd.org www.magna-charta.org So fing alles an MARINA (2006) Ranibizumab (Lucentis)
Monitoring, Wiederbehandlungsund Prognoseparameter bei der Anti-VEGF-Therapie der AMD Stefan Koinzer 23.04.2016 www.scienceofamd.org www.magna-charta.org So fing alles an MARINA (2006) Ranibizumab (Lucentis)
Ausmaß und Wahrscheinlichkeit des Zusatznutzens gegenüber Ciclosporin in Kombination mit Corticosteroiden und Mycophenolatmofetil:
 Belatacept Beschluss vom: 7. Januar 2016 / 21. April 2016 gültig bis: unbefristet In Kraft getreten am: 7. Januar 2016 / 21. April 2016 BAnz AT 16.02.2016 B3 / BAnz AT 17.05.2016 B2 Zugelassenes Anwendungsgebiet:
Belatacept Beschluss vom: 7. Januar 2016 / 21. April 2016 gültig bis: unbefristet In Kraft getreten am: 7. Januar 2016 / 21. April 2016 BAnz AT 16.02.2016 B3 / BAnz AT 17.05.2016 B2 Zugelassenes Anwendungsgebiet:
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
1. Zusatznutzen des Arzneimittels im Verhältnis zur zweckmäßigen Vergleichstherapie
 Ipilimumab Beschluss vom: 2. August 2012 / 7. April 2016 gültig bis: unbefristet In Kraft getreten am: 2. August 2012 / 7. April 2016 BAnz AT 29.08.2012 B6 / BAnz AT 03.06.2016 B3 Zugelassenes Anwendungsgebiet:
Ipilimumab Beschluss vom: 2. August 2012 / 7. April 2016 gültig bis: unbefristet In Kraft getreten am: 2. August 2012 / 7. April 2016 BAnz AT 29.08.2012 B6 / BAnz AT 03.06.2016 B3 Zugelassenes Anwendungsgebiet:
BAnz AT B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V
Dossierbewertung A16-60 Version 1.0 Ibrutinib (chronische lymphatische Leukämie)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ibrutinib in Kombination mit Bendamustin und Rituximab (Ibrutinib + BR) gemäß
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ibrutinib in Kombination mit Bendamustin und Rituximab (Ibrutinib + BR) gemäß
ANTI-VEGF BEHANDLUNG DER CNV BEI AMD: NON RESPONDER UND DEREN BEHANDLUNG. Gisbert Richard, Hamburg
 ANTI-VEGF BEHANDLUNG DER CNV BEI AMD: NON RESPONDER UND DEREN BEHANDLUNG Gisbert Richard, Hamburg FINANCIAL DISCLOSURE SPONSOR IMI 2003-2010 BAYER PFIZER NOVARTIS 2009-2013 (ongoing) 2010 (ongoing) 2011-2013
ANTI-VEGF BEHANDLUNG DER CNV BEI AMD: NON RESPONDER UND DEREN BEHANDLUNG Gisbert Richard, Hamburg FINANCIAL DISCLOSURE SPONSOR IMI 2003-2010 BAYER PFIZER NOVARTIS 2009-2013 (ongoing) 2010 (ongoing) 2011-2013
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Aflibercept (Eylea) Nutzenbewertung gemäß 35a SGB V Dossierbewertung
 IQWiG-Berichte Nr. 156 Aflibercept (Eylea) Nutzenbewertung gemäß 35a SGB V Dossierbewertung Auftrag: A12-19 Version: 1.0 Stand: 13.03.2013 Impressum Herausgeber: Institut für Qualität und Wirtschaftlichkeit
IQWiG-Berichte Nr. 156 Aflibercept (Eylea) Nutzenbewertung gemäß 35a SGB V Dossierbewertung Auftrag: A12-19 Version: 1.0 Stand: 13.03.2013 Impressum Herausgeber: Institut für Qualität und Wirtschaftlichkeit
Monitoring und Reinjektionskriterien unter anti-vegf-therapie
 1 Monitoring und Reinjektionskriterien unter anti-vegf-therapie Frank G. Holz AAD - 2011 Bevölkerung in Europa 65 Jahre (Mio) 2 200 180 160 140 120 100 80 60 40 20 0 14.7% 16.2% 18.9% 22.6% 25.5% 27.6%
1 Monitoring und Reinjektionskriterien unter anti-vegf-therapie Frank G. Holz AAD - 2011 Bevölkerung in Europa 65 Jahre (Mio) 2 200 180 160 140 120 100 80 60 40 20 0 14.7% 16.2% 18.9% 22.6% 25.5% 27.6%
Altersabhängige Makuladegeneration
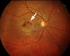 Altersabhängige Makuladegeneration Pathophysiologie - Symptome - Diagnostik - Prophylaxe - Therapie Altersabhängige Makuladegeneration Erkrankung der Netzhautmitte (Makula) Heterogenes Krankheitsbild >
Altersabhängige Makuladegeneration Pathophysiologie - Symptome - Diagnostik - Prophylaxe - Therapie Altersabhängige Makuladegeneration Erkrankung der Netzhautmitte (Makula) Heterogenes Krankheitsbild >
1. Zusatznutzen des Arzneimittels im Verhältnis zur zweckmäßigen Vergleichstherapie
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Anlage 1 Beschlüsse des G-BA über eine Änderung der Arzneimittel-Richtlinie
 Anlage Beschlüsse des G-BA über eine Änderung der Arzneimittel-Richtlinie BAnz. Nr. 6 (S. ) vom. 0. 0 Bekanntmachung [47 A] eines Beschlusses des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie
Anlage Beschlüsse des G-BA über eine Änderung der Arzneimittel-Richtlinie BAnz. Nr. 6 (S. ) vom. 0. 0 Bekanntmachung [47 A] eines Beschlusses des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie
BAnz AT B1. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss vom: 15. Dezember 2016 gültig bis: unbefristet In Kraft getreten am: 15. Dezember 2016 BAnz AT B2
 (neues Anwendungsgebiet: follikuläres Lymphom) Beschluss vom: 15. Dezember 2016 gültig bis: unbefristet In Kraft getreten am: 15. Dezember 2016 BAnz AT 13.01.2017 B2 Zugelassenes Anwendungsgebiet (laut
(neues Anwendungsgebiet: follikuläres Lymphom) Beschluss vom: 15. Dezember 2016 gültig bis: unbefristet In Kraft getreten am: 15. Dezember 2016 BAnz AT 13.01.2017 B2 Zugelassenes Anwendungsgebiet (laut
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 3a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 3a SGB
BAnz AT B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V Binimetinib
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V Binimetinib
BAnz AT B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneitel-Richtlinie (AM- RL): Anlage XII Beschlüsse über die utzenbewertung von Arzneiteln neuen Wirkstoffen nach 35a SGB V Brodalumab
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneitel-Richtlinie (AM- RL): Anlage XII Beschlüsse über die utzenbewertung von Arzneiteln neuen Wirkstoffen nach 35a SGB V Brodalumab
Dossierbewertung A19-09 Version 1.0 Apalutamid (Prostatakarzinom)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Apalutamid gemäß 35a SGB V beauftragt. Die Bewertung erfolgt auf Basis eines
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Apalutamid gemäß 35a SGB V beauftragt. Die Bewertung erfolgt auf Basis eines
Neoadjuvante Pertuzumab-Gabe bei HER2-positivem Brustkrebs
 Anhaltspunkt für geringeren Nutzen Neoadjuvante Pertuzumab-Gabe bei HER2-positivem Brustkrebs - Keine positiven Effekte belegt / Mehr Therapieabbrüche wegen Nebenwirkungen Köln (1. Dezember 2015) - Pertuzumab
Anhaltspunkt für geringeren Nutzen Neoadjuvante Pertuzumab-Gabe bei HER2-positivem Brustkrebs - Keine positiven Effekte belegt / Mehr Therapieabbrüche wegen Nebenwirkungen Köln (1. Dezember 2015) - Pertuzumab
Ruxolitinib bei Myelofibrose: Hinweis auf beträchtlichen Zusatznutzen
 Vorteile bei Symptomen und Überlebenszeit im Vergleich zu best supportive care Ruxolitinib bei Myelofibrose: Hinweis auf beträchtlichen Zusatznutzen Köln (15. August 2014) - Ruxolitinib (Handelsname: Jakavi)
Vorteile bei Symptomen und Überlebenszeit im Vergleich zu best supportive care Ruxolitinib bei Myelofibrose: Hinweis auf beträchtlichen Zusatznutzen Köln (15. August 2014) - Ruxolitinib (Handelsname: Jakavi)
1. Zusatznutzen des Arzneimittels im Verhältnis zur zweckmäßigen Vergleichstherapie
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Dossierbewertung A18-71 Version 1.0 Erenumab (Migräne)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Erenumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgt auf Basis eines
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Erenumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgt auf Basis eines
BAnz AT B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
