Die 1 H-chemische Verschiebung Bereich & Einflüsse
|
|
|
- Helga Kaufer
- vor 8 Jahren
- Abrufe
Transkript
1 Spektroskopie in der Organischen hemie Die 1 -chemische Verschiebung Bereich & Einflüsse Der Resonanzbereich der Protonen in organischen Molekülen ist ca. 10 ppm breit. Nur saure Protonen (z.b. OO oder SO 3 ) liegen darüber; Protonensignale von Formylgruppen (z.b. Aldehyde) liegen um δ = 9 bis 11. Auch die Amidprotonen des Indolrings (z.b. in Tryptophan) sind bei ppm. Es gibt eine deutliche Abhängigkeit vom s-harakter der wasserstofftragenden Kohlenstoffe, aber keine Korrelation! sp 3 (Alkane): δ = 0.5 bis 4 sp 2 (Alkene/Aromaten): δ = 4.5 bis 9 sp (Alkine): δ = ca. 2 bis 3 Innerhalb des sp 3 -Bereiches werden Protonen durch benachbarte (geminale) elektronegative oder ungesättigte Substituenten entschirmt: δ(--f) > δ(--o) > δ(--n) > δ(--=) > δ(---) 1 -NMR-Spektroskopie 1
2 Spektroskopie in der Organischen hemie Aber auch der Substitutionsgrad spielt eine Rolle: δ(x) > δ( 2 X) > δ( 3 X) yclopropyl- 1 -Signale haben ungewöhnlich kleine δ-werte: -0.5 bis Wie für die - Bindungen bewirkt auch bei anderen X- Bindungen die Zunahme der Elektronegativität von X die Abnahme der Abschirmung und entsprechend die Zunahme der chemischen Verschiebung, z.b O δ( O ) = 2.56 ppm > 3-2 -S δ( S ) = 1.46 ppm 1 -NMR-Spektroskopie 2
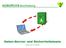
3 Spektroskopie in der Organischen hemie Bereich der 1 -chemischen Verschiebung (Abb. nach: Friebolin) 1 -NMR-Spektroskopie 3
4 Spektroskopie in der Organischen hemie Anisotropieeffekte δ(aromat.-) > δ(olefin.-) Dies ist eine Konsequenz der anisotropen Elektronenverteilung im Molekül und wird bei Aromaten nach Pople durch den Ringstrom-Effekt erklärt: Durch das äußere Magnetfeld B 0 wird im Aromaten ein Ringstrom induziert, der seinerseits ein B 0 entgegen gerichtetes Magnetfeld erzeugt. Dieses schwächt B 0 oberhalb der Ringebene ab (Abschirmung; kleineres δ), während es B 0 in der Ringebene verstärkt (Entschirmung = geringere Abschirmung; größeres δ). 1 -NMR-Spektroskopie 4
5 Spektroskopie in der Organischen hemie Beispiel: 1 -NMR-Spektrum von Ethylether 3 2 O 2 3 O- 2 3 Man beachte die 1 -chemischen Verschiebungen in Abhängigkeit von der Position des elektronegativen Sauerstoffatoms. Über den Signalen sind sog. Integrationsstufen aufgezeichnet. Diese stellen ein relatives Maß für die Zahl der zu den jeweiligen Signalen gehörenden Wasserstoffatome dar. 1 -NMR-Spektroskopie 5
6 Spektroskopie in der Organischen hemie 1, 1 -Kopplungskonstanten bei skalarer (J-) Kopplung 3 2 O- 2 O Das 1 -NMR-Spektrum von Diethylether (links) demonstriert, dass das Spektrum außer der 1 - chemischen Verschiebung und der Integration noch einen weiteren Messparameter enthält, nämlich die Multiplizität der Signale. Diese Signalaufspaltungen sind auf skalare Kopplungen benachbarter Kerne zurückzuführen. Es handelt sich um einen Informationsaustausch zwischen Kopplungspartnern über die dazwischen liegenden Bindungselektronen. 1 -NMR-Spektroskopie 1
7 Spektroskopie in der Organischen hemie Ein Kern A kann über diesen Mechanismus den Spinzustand seines Nachbarn X erkennen und reagiert darauf mit seiner Linienposition. J magnetische Polarisation der Elektronenhülle Kernmoment A bzw. X Für jeden der beiden, praktisch gleich populierten Spin- (Energie-)zustände zeigt A ein einzelnes Signal; es resultiert ein Dublett, dessen Abstand Kopplungskonstante J (in z), eine stoffspezifische Konstante, genannt wird. Eine gleich große Kopplungsaufspaltung tritt auch am Signal des Kerns X auf. 1 -NMR-Spektroskopie 2
8 Spektroskopie in der Organischen hemie Energieniveauschema (B 0 > 0 -> Aufspaltung der magnetischen E-Niveaus α, β): 1-Spinsystem A 2-Spinsystem AX E E 1 β A 1 E 2 α E = -mhν A bzw. E in z: E = -mν A E 1 = 1/2 ν A E 2 = -1/2 ν A A1: ΔE 1-2 = ν A -> 1 Linie bei ν A E 1 = 1/2 ν A +1/2 ν X E 2 = 1/2 ν A -1/2 ν X E 3 = -1/2 ν A +1/2 ν X E 4 = -1/2 ν A -1/2 ν X A1: ΔE 1-3 = ν A usw. E 1 = 1/2 ν A +1/2 ν X +1/4J AX E 2 = 1/2 ν A -1/2 ν X -1/4J AX E 3 = -1/2 ν A +1/2 ν X -1/4J AX E 4 = -1/2 ν A -1/2 ν X +1/4J AX A1: ΔE 1-3 = ν A +1/2 J usw. J J 1 -NMR-Spektroskopie ν A ν A ν X ν A ν X 3
9 Spektroskopie in der Organischen hemie Allgemein gilt: Die Multiplizität M eines Signals (Dublett, Triplett, usw.) ergibt sich aus der Zahl der Kopplungspartner: Bei n gleichartigen Kopplungspartnern gilt: M = 2 n I + 1 I = Spinquantenzahl; hier I = 1/2, also M = n + 1 Die Multiplizität sowie die relative Intensitätsverteilung innerhalb der Multipletts lassen sich durch das PASALsche Dreieck darstellen: n = 0 1 Singulett n = Dublett n = Triplett n = Quartett n = Quintett n = Sextett n = eptett Jede Zahl ist immer die Summe der beiden links und rechts darüber stehenden Zahlen; keine Zahl (außerhalb des Dreiecks) bedeutet NMR-Spektroskopie 4
10 Spektroskopie in der Organischen hemie Man kann also aus der Multiplizität eines 1 -Signals der Zahl der jeweiligen Nachbarkerne errechnen und auf diese Weise ein Netzwerk von 1, 1 -Konnektivitäten im Molekül ermitteln. Im Falle des Diethylethers findet man für das linke Signal (O 2 ) Multiplizität: Quartett (q), 3 Kopplungspartner, und für das rechte Signal ( 3 ) Multiplizität: Triplett (t) 2 Kopplungspartner Bei nicht gleichartigen Kopplungspartnern: ier kann es passieren, dass ein Kern A zwei oder mehr Kopplungspartner M, X usw. mit unterschiedlichen Kopplungskonstanten J(A,M), J(A,X) usw. hat. Man interpretiert die Signalaufspaltungen dann nacheinander für jeden Partner, z.b.: A J(AX) J(AM) 1 -NMR-Spektroskopie 5
11 Spektroskopie in der Organischen hemie Ein weiteres Beispiel: 1,1-Dichlorethan, l 2-3 J 1 -NMR-Spektroskopie 6
12 Spektroskopie in der Organischen hemie Geminale Kopplungen Wenn sich die beiden Kopplungspartner (wie Zwillinge; lat.: gemini) am gleichen Kohlenstoffatom befinden, also nur zwei Bindungen voneinander entfernt sind, nennt man dies eine geminale Kopplung, 2 J( 1, 1 ). In sehr vielen Fällen sind die beiden Kerne chemisch äquivalent oder enantiotop ( ) und haben deshalb die gleiche chemische Verschiebung; sie sind isochron. Dann ist das Signal bei Fehlen weiterer Kopplungspartner ein Singulett (A 2 -System). Merke, allgemein tritt die skalare Kopplung zwischen magnetisch äquivalenten Kernen im Spektrum nicht in Erscheinung. (QM-erleitung s. Günther) Isochrone Kerne Ai, die nur eine Spin-Spin-Kopplung zu Nachbarkernen zeigen, sind magnetisch äquivalent. Sind die beiden Wasserstoffkerne dagegen diastereotop, sind sie anisochron, bilden ein AX- bzw. AB-Spinsystem bzw. -Teilsysteme, und die Kopplung ist ermittelbar. 1 -NMR-Spektroskopie 1
13 Spektroskopie in der Organischen hemie Beispiele für geminale Kopplungskonstanten: Einfluss des s-harakters (s. Günther): z -4.5 z +2.5 z Einfluss der Substitution (s. Günther): O O l z +5.5 z -1.3 z z.b. 4 J nicht aus Spektrum -> Abschätzung z.b. basierend auf D NMR-Spektroskopie 2
14 Spektroskopie in der Organischen hemie Vicinale Kopplungen Wenn sich die beiden Kopplungspartner an benachbarten Kohlenstoffatomen (lat.: vicinus, der Nachbar) befinden, also drei Bindungen voneinander entfernt sind, nennt man dies eine vicinale Kopplung, 3 J( 1, 1 )-Werte sind immer positiv. ϕ Die Besonderheit der vicinalen Kopplung ist, dass sie eine starke Abhängigkeit vom Torsionswinkel ϕ zwischen den beiden --Bindungen besitzt. Diese wird durch die sog. KARPLUS-Beziehung beschrieben (nächste Seite). In den Abbildungen links und unten ist der Torsionswinkel ca ; die beiden Wasserstoffatome stehen gauche zueinander. 1 -NMR-Spektroskopie 3
15 Spektroskopie in der Organischen hemie ϕ KARPLUS-Beziehung 3 J( 1, 1 ) in z Karplus-onroy-Kurve allgemein: 3 J = A + Bcos ϕ + cos2ϕ A = 4.5, B = -0.5, = 4.5 ϕ 3 J( 1, 1 ) = 8.5 cos 2 ϕ bei 0 0 ϕ J( 1, 1 ) = 9.5 cos 2 ϕ bei 90 0 ϕ Merke: Die KARPLUS-Beziehung liefert für eine experimentell ermittelte Kopplung keinen exakten Torsionswinkel, sondern immer nur Winkelbereiche! Wenn nicht eindeutig -> Zusatzinformationen notwendig. 1 -NMR-Spektroskopie 4
16 Spektroskopie in der Organischen hemie Die KARPLUS-Abhängigkeit gilt auch für olefinische Wasserstoffatome: Z E z.b.: Ph Ph OO OO 7-12 z z 12.3 z 15.8 z Merke: Die 3 J( 1, 1 )-Kopplungskonstante ist ein hervorragender Parameter zur Unterscheidung von cis- (ϕ = 0 ) & trans- (ϕ = 180 ) Olefinen (bzw. Z & E). Es gibt aber auch hier Abhängigkeiten vom s-harakter und von Substitution: 11.6 z 2.8 z 5.1 z 8.8 z 7.5 z 1 -NMR-Spektroskopie 5
17 Spektroskopie in der Organischen hemie 6 1 -NMR-Spektroskopie O O z 1-3 z 5-8 z 2-5 z 2-5 z 9-12 z Bei frei drehbaren Teilstrukturen (Kohlenwasserstoff-Ketten) beobachtet man 3 J( 1, 1 ) = 7 bis 8 z als Durchschnittswert.
18 Spektroskopie in der Organischen hemie Es gibt aber auch eine Abhängigkeit von benachbarten elektronegativen Substituenten: O 2 O O 2-5 z O O O aber: 9-12 z O 2 O O O O α: 3.5 z β: 7.7 z D-Glucose O Bei den Zuckern sind die 3 J( 1, 1 )- Kopplungskonstanten wegen der Existenz der Sauerstoffatome eher am unteren Ende des Erwartungsbereiches. 1 -NMR-Spektroskopie 7
19 Spektroskopie in der Organischen hemie Fernkopplungen (Long-Range-Kopplungen) Sind die beiden Kopplungspartner mehr als drei Bindungen voneinander entfernt, spricht man von Fernkopplungen (long-range-kopplungen). n J( 1, 1 ) mit n > 3 Meist sind diese Kopplungen sehr klein (< 0.5 z), unter bestimmten Umständen können sie jedoch Werte annehmen, die im Spektrum erkennbare Signalaufspaltungen verursachen. Unter folgenden strukturellen Voraussetzungen können long-range-kopplungen beobachtet werden: 1-4 z (a) W-Kopplung ( 4 J): Die Wasserstoff- und die dazwischen liegenden Kohlenstoffatome bilden eine Anordnung wie der Buchstabe W. Achtung: Das ganze Strukturelement muss weitgehend koplanar sein. Geringe Abweichungen werden aber toleriert. 1 -NMR-Spektroskopie 8
20 Spektroskopie in der Organischen hemie (b) Allyl-Kopplung ( 4 J): (c) omoallyl-kopplung ( 5 J): -3,5 bis +2.5 z -3 bis +2 z 0 bis 2.5 z 1 bis 2 z 0 bis 1 z 1 bis 3 z 1 -NMR-Spektroskopie 9
21 Spektroskopie in der Organischen hemie 13 -NMR-Spektroskopie Der 13 -Kern ist in seinen wichtigsten Kerneigenschaften dem 1 ähnlich. Er ist ebenso ein Spin-1/2-Kern, weist also im äußeren Magnetfeld B 0 nur zwei Energiezustände mit geringem Populationsunterschied auf. Er hat kein Quadrupolmoment, liefert also hochaufgelöste Signale. Im Vergleich zur 1 -NMR-Spektroskopie gibt es aber zwei wesentliche Unterschiede: Das magnetogyrische Verhältnis ist viel kleiner: 4. Dadurch ist bei gleicher Magnetfeldstärke die Resonanzfrequenz entsprechend kleiner; z.b: 400 Mz 1, aber Mz 13. γ ( γ ( 1 ) ) 13, resultiert eine deutlich gerin- Wegen einer ungefähren Abhängigkeit von gere Messempfindlichkeit. 2 3 B NMR-Spektroskopie 1
22 Spektroskopie in der Organischen hemie Gravierender jedoch ist die Tatsache, dass die natürliche äufigkeit des Isotops 13 nur ca. 1.1% ist. (Das auptisotop 12 mit 98.9% äufigkeit hat eine Spinquantenzahl I = 0; es ist also NMR-inaktiv.) Zusammen mit der geringeren Empfindlichkeit ergibt sich unter sonst gleichen Messbedingungen (gleiche Substanzkonzentration, gleiches Spektrometer) für den Vergleich der Sensitivitäten S: S( 1 )/S( 13 ) 5700 Es kommt noch eine weitere Erschwernis hinzu: 13 -Signale sind wegen der zahlreichen und zum Teil großen 13, 1 -Kopplungen (siehe später) oft stark aufgespalten; das heißt, die ohnehin relativ geringe Signalintensität verteilt sich auf mehrere, womöglich durch Fernkopplung sogar noch verbreiterte Teilsignale. Dies sind die Gründe, warum die 13 -NMR-Spektroskopie erst in den 1970er Jahren, also mehr als ein Jahrzehnt später als die 1 -NMR-Spektroskopie eine Routinemethode wurde. Anfangs standen deshalb auch messtechnische Verbesserungen des Signal- Rausch-(S/N)-Verhältnisses im Vordergrund. 13 -NMR-Spektroskopie 2
23 Spektroskopie in der Organischen hemie Viele 13 NMR Spektren werden mit { 1 }-Breitband (BB)-Entkopplung aufgenommen. ierbei wird während der 13 -NMR-Messung (Acquisition) ein Entkopplerfeld auf den gesamten Protonenbereich gelegt, das so intensiv ist, dass es alle Protonen gleichzeitig sättigen und damit entkoppeln kann. Dadurch kollabieren die durch die 13, 1 -Kopplungen aufgespaltenen 13 - Multipletts zu schmalen Singuletts. Gleichzeitig wird auch noch ein zweiter begrüßenswerter Effekt erzielt, die Erhöhung der Signalintensität durch den Kern-Overhauser-Effekt (siehe IM3). Er kann wegen η max = 1/2 γ(s)/γ(i) und γ(s)[ 1 ]/γ(i)[ 13 ] 4 η max 2 das 13 -NMR-Signal auf das Dreifache (1+η max ) erhöhen; allerdings nur bei wasserstofftragenden Kohlenstoffatomen. Dann ist die räumliche Entfernung zwischen dem 13 -Kern und den NOE-erzeugenden Protonen sehr kurz, was die zentrale Voraussetzung für eine effektive NOE-Wechselwirkung ist. Quartäre Kohlenstoffatome erfahren nur geringe NOE-Effekte und haben meist viel kleinere Signale. Merke: Integrale von 13 -NMR-Signalen sollten deshalb nicht zur Bestimmung der Zahl der jeweils zugehörigen -Atome verwendet werden. 13 -NMR-Spektroskopie 3
24 Spektroskopie in der Organischen hemie 13 -NMR-Spektren von 2-Butanol { 1 }-BB-entkoppelt (unten) und 1 -gekoppelt (oben) O NMR-Spektroskopie 4
25 Spektroskopie in der Organischen hemie Off-Resonance -entkoppelt (unten) und DEPT135 (oben) 13 -NMR-Spektroskopie 5
26 Spektroskopie in der Organischen hemie { 1 }-BB-entkoppelte 13 -NMR-Spektren weisen also im Vergleich zur Messung 1 -gekoppelter Spektren ein deutlich verbessertes S/N-Verhältnis und eine größere Übersichtlichkeit auf. Allerdings geht bei dieser Technik die gesamte Information über die Zahl der am jeweiligen Kohlenstoffatom befindlichen Wasserstoffe, die sich im 1 -gekoppelten Spektrum in den Signalmultiplizitäten ausdrückt, verloren. Aus diesem Grund hat sich schon früh die routinemäßige Messung von Begleitexperimenten, den sog. Off-Resonance -Spektren, durchgesetzt. ierbei wird die 1 - Entkoppler-Frequenz nicht wie bei BB-Messungen auf den 1 -Resonanzbereich gesetzt, sondern daneben ( off resonance ). Dadurch werden die Protonen nur teilweise entkoppelt; sie werden im Vergleich zu den 1 -gekoppelten Signalen schmaler (geringere Gefahr der Überlappung), behalten aber eine Restkopplung, sodass die Multiplizität noch erkennbar ist. Seit den 1980er Jahren hat sich jedoch eine fortschrittlichere Technik, DEPT, durchgesetzt, bei der die Information über die Zahl der anhängenden Wasserstoffe nicht durch (manchmal nur schwer erkennbare) Restaufspaltungen, sondern durch Signalphasen von Singuletts erhältlich ist. 13 -NMR-Spektroskopie 6
27 Spektroskopie in der Organischen hemie Wichtig: in DEPT-Spektren gibt es keine Signale von quartären Kohlenstoffatomen (siehe Dl 3 -Signal)! Es gibt eine zwei gängige DEPT-Varianten: DEPT90, das nur Signale von - Atomen abbildet, und DEPT135, bei dem und 3 positive und 2 negative Signale gibt. Zusammen mit dem BB-entkoppelten 13 -NMR- Spektrum lassen sich die 13 -Signale auch komplexer Verbindungen eindeutig zuordnen: DEPT90 z.b.: 13 1D NMR Spektren Oleanolsäurederivat (nur Aliphatenteil) DEPT135 OO 3 BB 13 -NMR-Spektroskopie AcO nur in BB 7
28 Spektroskopie in der Organischen hemie Die 13 -chemische Verschiebung Im Vergleich zur 1 -chemischen Verschiebung ist der δ( 13 )-Bereich sehr viel größer. Er erstreckt sich über ca. 250 ppm und zeigt eine ausgeprägte Differenzierung für Alkan- (δ = 0-80) und Alken-/Aromaten-Kohlenstoffatome (δ = ). Es sei erwähnt, dass es hier keine wesentlichen Unterschiede zwischen Alkenen und Aromaten gibt, weil der aus der 1 -NMR bekannte Anisotropieeffekt bei Aromaten (Ringstrom) hier aufgrund des viel größeren Resonanzbereichs nicht mehr identifizierbar ist. Die chemische Verschiebung der Alkan- und Alken-/Aromatenkohlenstoffe ist zudem von der Existenz benachbarter eteroatome abhängig. Auch für die arbonylgruppen gibt es einen separaten Bereich, der je nach Oxidationsstufe des arbonyl- s sogar noch weiter unterteilt ist. Dadurch wird es sehr einfach, Kohlensäure- und arbonsäurederivate (δ = ) von Aldehyden (δ = ) und Ketonen (δ = ) zu unterscheiden. Noch größere δ-werte haben nur Thioketone (δ = ) und arbeniumionen (δ = ). 13 -NMR-Spektroskopie 1
29 Spektroskopie in der Organischen hemie Man beachte, dass alle genannten Bereiche nur als typische Bereiche anzusehen sind. Es gibt für alle Substanzklassen Molelülstrukturen, deren Resonanzen Ausreißer nach oben und unten sein können! 13 -NMR-Spektroskopie 2
30 Spektroskopie in der Organischen hemie Ein ungewöhnliches Verhalten zeigen die α-effekte der schweren alogene ( Schweratom-Effekt ), wie hier am Beispiel δ( 13 ) der alogenmethane ( 4-n X n ) gezeigt. Während bei den hloriden mit zunehmender Substitution die jeweiligen Inkremente additiv bleiben (ca. +25 ppm), gilt dies für X = Br nur bis 2 Br 2 (ca ppm); danach werden die Inkremente negativ. Bei den Iodiden sind sie von Anfang an negativ und nehmen in ihren Absolutwerten sogar stark zu. Das Maximum ist Br 4 mit δ = -292, ein solitärer Wert weit ab vom üblichen Resonanzbereich. n ierfür werden relativistische Effekte verantwortlich gemacht. 13 -NMR-Spektroskopie 3
31 Spektroskopie in der Organischen hemie Wegen des großen Resonanzbereichs ist die Signalzuordnung ein wesentliches Problem, ohne dessen Lösung Strukturbestimmungen oft fragwürdig bleiben. Es ist daher sehr wichtig, empirisch ermittelte Strukturabhängigkeiten und Inkrementenregeln zu kennen, die oft spezifisch für bestimmte Substanzklassen sind. Im folgenden werden einige dieser Regeln vorgestellt ( NMR-1 in IM-2). Man beachte, dass in den letzten zwei Jahrzehnten ein- und zweidimensionale Multipuls-NMR-Experimente entwickelt wurden, die empirische Zuordnungen teilweise oder sogar ganz entbehrlich machen. Sie beruhen auf Spin-Spin-Korrelationen durch die zwischen den Kernen liegenden Bindungen (skalare Kopplung) oder durch den Raum (dipolare Kopplung, NOE) und erlauben dadurch, ein dreidimensionales Netzwerk der 1 - und 13 -Kerne aufzustellen. Zu den wichtigsten dieser Methoden gehören OSY, ETOR, MQ, MB, NOESY und einige andere ( NMR in IM-3). 13 -NMR-Spektroskopie 4
32 Spektroskopie in der Organischen hemie Beispiele: 13 -NMR-Spektrum von yanessigsäureethylester. Ordne die Signale zu. s-singulett, t-terzett, q-quartett 13 -NMR-Spektroskopie 5
33 Spektroskopie in der Organischen hemie 13 -NMR-Spektren von ortho-bromphenol. -> Substitutionsmuster 13 -NMR-Spektroskopie 6
34 Spektroskopie in der Organischen hemie Aufgabe: Entscheide anhand der beiden 13 -NMR-Spektren, um welche der alternativen Strukturen es sich jeweils handelt. -> chem. äquiv. Lösung: Abzählen der Peaks gibt (a) ycloheptatrienderivat, rechts (b) yclohexandienderivat, links 13 -NMR-Spektroskopie 7
35 Spektroskopie in der Organischen hemie NMR-Lösungsmittel Für die NMR-Spektroskopie in der O werden i.a. deuterierte Lösungsmittel verwendet. Die Substitution der leichten durch die schweren Wasserstoffatome hat zwei Vorteile: - Deuterium als Spin-1-Kern hat ebenfalls ein magnetisches Moment, aber seine Resonanzfrequenz ist sehr weit von der der Protonen entfernt. Es kann deshalb dazu benutzt werden, das Verhältnis von Magnetfeld und Radiofrequenz konstant zu halten (Lock), ein Routineverfahren zur elektronischen Stabilisierung der Messmethode. - Das Lösungsmittel hat bei 100%iger Substitution kein eigenes Signal in der 1 -NMR. Bei der Verwendung der normalen, nichtdeuterierten Lösungsmittel wäre bei den üblichen Substratkonzentrationen das Lösungsmittelsignal das bei weitem größte, was zu unerwünschten Signalüberlagerungen, aber auch zu Problemen bei der Darstellung kleinerer Signale nach der Fourier- Transformierung des FIDs führen kann. Schreibweisen am Beispiel des Aceton: (D 3 ) 2 O, Aceton-d 6 oder [D 6 ]-Aceton. NMR-Spektroskopie 1
36 Spektroskopie in der Organischen hemie Dennoch haben die üblicherweise verwendeten deuterierten Lösungsmittel ein wenn auch kleines 1 -Signal, weil der Deuterierungsgrad der üblichen kommerziellen Lösungsmittel nicht 100%, sondern nur 99% bis 99,9% ist. Einige 1 -chemische Verschiebungen häufig benutzter Lösungsmittel (bei RT): l 3 δ = 7.24 Methanol-d 3 (D 2 OD) δ = 3.35 Aceton-d 5 δ = 2.04 Benzol-d 5 δ = 7.27 Dl 2 δ = 5.32 D 2 N δ = 1.93 DO δ = 4.65 Merke: Die Lösungsmittelmoleküle, deren 1 -Signale man beobachtet, besitzen einen 1 -Kern und eine um 1 verminderte Zahl von Deuteriumatomen, also z.b. Aceton-d 5. NMR-Spektroskopie 2
37 Spektroskopie in der Organischen hemie Die 1 -Signale der deuterierten Lösungsmittel sind jedoch keine Singuletts, wenn die Gesamtzahl der Wasserstoffatome im Molekül meist größer als 1 ist, also auch noch Deuteriumatome ( 2 ) vorhanden sind. Beispiel Dl 2 : Deuterium hat die Spinquantenzahl 1. Das bedeutet, dass es für einen Deuteriumkern drei ähnlich stark populierte Energieniveaus gibt: m = -1, 0 und +1. Das Signal eines 1 -Kern, der mit einem 2 koppelt, besteht also aus drei äquidistanten, praktisch gleich intensiven Linien (1:1:1-Triplett): 2 J ( 2, 1 ) ν( 1 ) 2, 1 -Kopplungskonstanten sind ungefähr um den Faktor 1/6.5 kleiner als die entsprechenden 1, 1 -Kopplungskonstanten, weil γ( 1 )/ γ( 2 ) 6.5. NMR-Spektroskopie 3
38 Spektroskopie in der Organischen hemie Bei mehr als einem Deuterium-Kopplungspartner wird das 1 -Signal mit jedem neuen Deuterium-Kopplungspartner in ein 1:1:1-Triplett aufgespalten. Beispiel: Methanol-d, D 2 -OD ν( 1 ) Es entsteht ein 1:2:3:2:1-Quintett. NMR-Spektroskopie 4
39 Spektroskopie in der Organischen hemie Die Multiplizitäten und die relativen Peakintensitäten können bei Kopplung mit Spin-1-Kernen aus einer dem PASALschen Dreieck ähnlichen Darstellung abgeleitet werden: n = 0 1 n = n = n = n = n = n = Jede Zahl ist immer die Summe der unmittelbar über ihr sowie der beiden links und rechts davon stehenden Zahlen; keine Zahl (außerhalb des Dreiecks) bedeutet 0. NMR-Spektroskopie 5
40 Spektroskopie in der Organischen hemie Schwieriger ist es bei Lösungsmitteln, die chemisch unterschiedliche Deuteriumpositionen enthalten. Beispiel: Deuterobenzol, 6 D 5 D D D D D Das Proton (oben) koppelt mit zwei ortho-, zwei meta- und einem para-ständigen Deuteriumkern. Da die ortho- und die meta- 2 -Kerne paarweise auch noch magnetisch nichtäquivalent ( ) sind, resultiert ein außerordentlich komplexes 1 -Signal das aus vielen Einzellinien besteht (siehe links simuliertes Signal). Die D,-Kopplungskonstanten sind aber recht klein, nämlich nur ca. 15% (1/6.5) der entsprechenden J( 1, 1 )-Werte. Deshalb beobachtet man i. a. ein deutlich verbreitertes Singulett (die Einhüllende). NMR-Spektroskopie 6
41 Spektroskopie in der Organischen hemie Lösungsmittelsignale in der 13 -NMR Für die Aufspaltungen der 13 -NMR-Signale von deuterierten Lösungsmitteln gilt Analoges wie bei Protonen, weil beide Kerne einen Kernspin von 1/2 haben. Allerdings bekommt man für nicht oder nur teilweise deuterierte Spezies separate Signale (Isotopenverschiebung) mit der jeweiligen Deuterium-Aufspaltung. Angesichts der üblicherweise sehr hohen Deuterierungsgrade kommerzieller Lösungsmittel spielt dies aber kaum eine Rolle. Das 13 -Signal des gebräuchlichsten Lösungsmittels Dl 3 (Deuterochloroform) ist ein Triplett bei δ = 77.0: 1 J ( 13, 2 ) ν( 13 ) Auch hier gilt: 1 J( 13, 2 ) 1 J( 13, 1 )/6.5 ( z/ 6.5 ) NMR-Spektroskopie 7
42 Spektroskopie in der Organischen hemie 13 -chemische Verschiebungen, Multiplizitäten und 1 J( 13, 2 )-Werte (in z) einiger deuterierter Lösungsmittel: Dl t 32 D 2 l quint 27 D 3 OD 49.3 sept 21 D 3 -O-D sept m 6 D t 24 D 3 -O-D sept 21 D 3 N 1.3 sept m Pyridin-d t t t 27 ppm z NMR-Spektroskopie 8
43 Spektroskopie in der Organischen hemie Beispiele für Lösungsmittelsignale (Aceton) mit unterschiedlichem Deuterierungsgrad: *: 1 D 2 -O-D 3 *: D 3 -O-D 3 o: 1 2 D-O-D 3 o: 1 D 2 -O-D 3 NMR-Spektroskopie 9
44 Zusammenfassung1: Magnetisierungstransfer bzw. Korrelation von einem Kern mit benachbarten Kernen in einem Protein Skalare bzw. J-Kopplung - via Bindungselektronen -> Bestimmung der chemischen Verschiebungen einzelener Kernen und welche Kerne über chemische Bindungen verknüpft sind Dipolare Kopplung - durch den Raum zwischen Kernen, die sich räumlich nahe sind. Z.B. NOE-Effekt zur Gewinnung struktureller Informationen in Form von interatomaren Distanzen (-> NOESY) R N! N! O Distanzen (NOEs) Zusammenfassung 2: Strukturinformationen aus NMR-Daten Wasserstoffbrücken ( 3 J, EX) Orientierung von Bindungsvektoren (RDs) Dihedrale Winkel ( 3 J) Dissoziationskonstanten Diffusionskonstanten Ionisierungskonstante -OO -OO Dynamik RDs
45 Anhang: Auf den folgenden Seiten sind einige ergänzende Informationen Atomkerne können eine magnetisches Moment haben Resonanz- bzw. Larmorfrequenz Für Kerne mit Spin 1/2, z.b. 1, 15 N, 13, 31 P Magnetfeld B 0 Aus. Kessler!Skriptum zur Vorlesung OIV", TU München
46 Aufbau eines Kernspinresonanzspektrometers Temperierbarer Probenkopf Für Kerne mit Spin 1/2, z.b. 1, 15 N, 13, 31 P omputer zur Steuerung und Datensicherung Supraleitender Magnet Elektronik (Temperaturkontrolle, Freqzenzsynthesizer, A- D Konverter, Verstärker) Aus. Kessler!Skriptum zur Vorlesung OIV", TU München Isotopenmarkierung Zu gering -> Ausweg: Isotopenmarkierung Zum Beispiel durch Produktion des gewünschten Proteins in gentechnisch veränderten Bakterienzellen (Escherichia coli) -> einzige Stickstoffquelle 15 N-Ammoniumchlorid -> einzige Kohlenstoffquelle 13 -Glucose
47 Erzeugung detektierbarer Magnetisierung 1D 1 Spektrum eines Proteins
Bereich der 1 H-chemischen Verschiebung (Abb. nach: Friebolin)
 Bereich der 1 -chemischen Verschiebung (Abb. nach: Friebolin) 1 -NM-Spektroskopie 1 Der esonanzbereich der Protonen in organischen Molekülen ist ca. 10 ppm breit. Nur saure Protonen (z.b. COO oder SO 3
Bereich der 1 -chemischen Verschiebung (Abb. nach: Friebolin) 1 -NM-Spektroskopie 1 Der esonanzbereich der Protonen in organischen Molekülen ist ca. 10 ppm breit. Nur saure Protonen (z.b. COO oder SO 3
Spektroskopie in der Organischen Chemie. 1 H, 1 H-Kopplungskonstanten. Geminale Kopplungen
 Spektroskopie in der rganischen hemie Geminale Kopplungen 1, 1 -Kopplungskonstanten Wenn sich die beiden Kopplungspartner (wie Zwillinge; lat.: gemini) am gleichen Kohlenstoffatom befinden, also nur zwei
Spektroskopie in der rganischen hemie Geminale Kopplungen 1, 1 -Kopplungskonstanten Wenn sich die beiden Kopplungspartner (wie Zwillinge; lat.: gemini) am gleichen Kohlenstoffatom befinden, also nur zwei
gleicher Magnetfeldstärke die Resonanzfrequenz entsprechend kleiner; z.b: 400 MHz 1 H, aber MHz 13 C.
 Der 13 C-Kern ist in seinen wichtigsten Kerneigenschaften dem 1 H ähnlich. Er ist ebenso ein Spin-½-Kern, weist also im äußeren Magnetfeld B 0 nur zwei praktisch gleich populierte Energiezustande auf.
Der 13 C-Kern ist in seinen wichtigsten Kerneigenschaften dem 1 H ähnlich. Er ist ebenso ein Spin-½-Kern, weist also im äußeren Magnetfeld B 0 nur zwei praktisch gleich populierte Energiezustande auf.
NMR-Lösungsmittel. 1 H-NMR. Bei der Verwendung der normalen, nichtdeuterierten Lösungsmittel. Spektroskopie in der Organischen Chemie
 NMR-Lösungsmittel In der werden i.a. deuterierte Lösungsmittel verwendet. ie Substitution der leichten durch die schweren Wasserstoffatome hat zwei Vorteile: - euterium als Spin-1-Kern hat ebenfalls ein
NMR-Lösungsmittel In der werden i.a. deuterierte Lösungsmittel verwendet. ie Substitution der leichten durch die schweren Wasserstoffatome hat zwei Vorteile: - euterium als Spin-1-Kern hat ebenfalls ein
Die 13 C-chemische Verschiebung
 Spektroskopie in der rganischen hemie Die 13 -chemische Verschiebung Im Vergleich zur 1 H-chemischen Verschiebung ist der δ( 13 )-Bereich sehr viel größer, weil er durch den paramagnetischen Beitrag zur
Spektroskopie in der rganischen hemie Die 13 -chemische Verschiebung Im Vergleich zur 1 H-chemischen Verschiebung ist der δ( 13 )-Bereich sehr viel größer, weil er durch den paramagnetischen Beitrag zur
2) In welcher Einheit wird die Energie (x-achse) im NMR-Spektrum angegeben und wie ist sie definiert?
 Aufgabe 1: Verständnisfragen 1) Welche Eigenschaften eines Atomkerns führen zu einem starken NMR-Signal? (man sagt der Kern hat eine große Empfindlichkeit) Ein Isotop eines Elements wird empfindlich genannt,
Aufgabe 1: Verständnisfragen 1) Welche Eigenschaften eines Atomkerns führen zu einem starken NMR-Signal? (man sagt der Kern hat eine große Empfindlichkeit) Ein Isotop eines Elements wird empfindlich genannt,
Schreiben Sie Ihre ö AUSSCHLIEßLICH!!! auf. die leeren Seiten 5 8!
 1. Ermitteln Sie die Konstitution der Verbindung aus MQ, Protonen und protonenbreitbandentkoppeltem Kohlenstoffspektrum. a. Ermitteln Sie alle chemischen Verschiebungen ( 1 und 13 ) und Kopplungskonstanten
1. Ermitteln Sie die Konstitution der Verbindung aus MQ, Protonen und protonenbreitbandentkoppeltem Kohlenstoffspektrum. a. Ermitteln Sie alle chemischen Verschiebungen ( 1 und 13 ) und Kopplungskonstanten
Bestimmung der Primärstruktur kleiner Moleküle mittels 1D-NMR-Spektroskopie
 Bestimmung der Primärstruktur kleiner Moleküle mittels 1D-NMR-Spektroskopie Zusammenfassung Mit Hilfe von 1D 1 H- und 13 C-NMR-Spektren und gegebener Summenformel wird die Primärstruktur eines unbekannten
Bestimmung der Primärstruktur kleiner Moleküle mittels 1D-NMR-Spektroskopie Zusammenfassung Mit Hilfe von 1D 1 H- und 13 C-NMR-Spektren und gegebener Summenformel wird die Primärstruktur eines unbekannten
Zeichen bei Zahlen entschlüsseln
 Zeichen bei Zahlen entschlüsseln In diesem Kapitel... Verwendung des Zahlenstrahls Absolut richtige Bestimmung von absoluten Werten Operationen bei Zahlen mit Vorzeichen: Addieren, Subtrahieren, Multiplizieren
Zeichen bei Zahlen entschlüsseln In diesem Kapitel... Verwendung des Zahlenstrahls Absolut richtige Bestimmung von absoluten Werten Operationen bei Zahlen mit Vorzeichen: Addieren, Subtrahieren, Multiplizieren
Professionelle Seminare im Bereich MS-Office
 Der Name BEREICH.VERSCHIEBEN() ist etwas unglücklich gewählt. Man kann mit der Funktion Bereiche zwar verschieben, man kann Bereiche aber auch verkleinern oder vergrößern. Besser wäre es, die Funktion
Der Name BEREICH.VERSCHIEBEN() ist etwas unglücklich gewählt. Man kann mit der Funktion Bereiche zwar verschieben, man kann Bereiche aber auch verkleinern oder vergrößern. Besser wäre es, die Funktion
13 C, 1 H-Kopplungskonstanten. 13 C, 1 H-Kopplungen hier leichter erkannt werden können. Spektroskopie in der Organischen Chemie
 Spektroskopie in der Organischen hemie 13, 1 -Kopplungskonstanten NMR-Signalaufspaltungen aufgrund von skalaren Kopplungen treten grundsätzlich bei beiden Kopplungspartnern auf. Entsprechend kann man 13,
Spektroskopie in der Organischen hemie 13, 1 -Kopplungskonstanten NMR-Signalaufspaltungen aufgrund von skalaren Kopplungen treten grundsätzlich bei beiden Kopplungspartnern auf. Entsprechend kann man 13,
Was ist Sozial-Raum-Orientierung?
 Was ist Sozial-Raum-Orientierung? Dr. Wolfgang Hinte Universität Duisburg-Essen Institut für Stadt-Entwicklung und Sozial-Raum-Orientierte Arbeit Das ist eine Zusammen-Fassung des Vortrages: Sozialräume
Was ist Sozial-Raum-Orientierung? Dr. Wolfgang Hinte Universität Duisburg-Essen Institut für Stadt-Entwicklung und Sozial-Raum-Orientierte Arbeit Das ist eine Zusammen-Fassung des Vortrages: Sozialräume
Lineargleichungssysteme: Additions-/ Subtraktionsverfahren
 Lineargleichungssysteme: Additions-/ Subtraktionsverfahren W. Kippels 22. Februar 2014 Inhaltsverzeichnis 1 Einleitung 2 2 Lineargleichungssysteme zweiten Grades 2 3 Lineargleichungssysteme höheren als
Lineargleichungssysteme: Additions-/ Subtraktionsverfahren W. Kippels 22. Februar 2014 Inhaltsverzeichnis 1 Einleitung 2 2 Lineargleichungssysteme zweiten Grades 2 3 Lineargleichungssysteme höheren als
Das INEPT-Experiment
 Das INEPT-Experiment Das Prinzip des Polarisations-Transfers (PT) ist im Zusammenhang mit dem heteronuklearen ( 13 C, 1 H) Experiment Selective Population Inversion (SPI) beschrieben worden. Hierbei wird
Das INEPT-Experiment Das Prinzip des Polarisations-Transfers (PT) ist im Zusammenhang mit dem heteronuklearen ( 13 C, 1 H) Experiment Selective Population Inversion (SPI) beschrieben worden. Hierbei wird
Physik & Musik. Stimmgabeln. 1 Auftrag
 Physik & Musik 5 Stimmgabeln 1 Auftrag Physik & Musik Stimmgabeln Seite 1 Stimmgabeln Bearbeitungszeit: 30 Minuten Sozialform: Einzel- oder Partnerarbeit Voraussetzung: Posten 1: "Wie funktioniert ein
Physik & Musik 5 Stimmgabeln 1 Auftrag Physik & Musik Stimmgabeln Seite 1 Stimmgabeln Bearbeitungszeit: 30 Minuten Sozialform: Einzel- oder Partnerarbeit Voraussetzung: Posten 1: "Wie funktioniert ein
50. Mathematik-Olympiade 2. Stufe (Regionalrunde) Klasse 11 13. 501322 Lösung 10 Punkte
 50. Mathematik-Olympiade. Stufe (Regionalrunde) Klasse 3 Lösungen c 00 Aufgabenausschuss des Mathematik-Olympiaden e.v. www.mathematik-olympiaden.de. Alle Rechte vorbehalten. 503 Lösung 0 Punkte Es seien
50. Mathematik-Olympiade. Stufe (Regionalrunde) Klasse 3 Lösungen c 00 Aufgabenausschuss des Mathematik-Olympiaden e.v. www.mathematik-olympiaden.de. Alle Rechte vorbehalten. 503 Lösung 0 Punkte Es seien
Die Invaliden-Versicherung ändert sich
 Die Invaliden-Versicherung ändert sich 1 Erklärung Die Invaliden-Versicherung ist für invalide Personen. Invalid bedeutet: Eine Person kann einige Sachen nicht machen. Wegen einer Krankheit. Wegen einem
Die Invaliden-Versicherung ändert sich 1 Erklärung Die Invaliden-Versicherung ist für invalide Personen. Invalid bedeutet: Eine Person kann einige Sachen nicht machen. Wegen einer Krankheit. Wegen einem
Was meinen die Leute eigentlich mit: Grexit?
 Was meinen die Leute eigentlich mit: Grexit? Grexit sind eigentlich 2 Wörter. 1. Griechenland 2. Exit Exit ist ein englisches Wort. Es bedeutet: Ausgang. Aber was haben diese 2 Sachen mit-einander zu tun?
Was meinen die Leute eigentlich mit: Grexit? Grexit sind eigentlich 2 Wörter. 1. Griechenland 2. Exit Exit ist ein englisches Wort. Es bedeutet: Ausgang. Aber was haben diese 2 Sachen mit-einander zu tun?
Stellen Sie bitte den Cursor in die Spalte B2 und rufen die Funktion Sverweis auf. Es öffnet sich folgendes Dialogfenster
 Es gibt in Excel unter anderem die so genannten Suchfunktionen / Matrixfunktionen Damit können Sie Werte innerhalb eines bestimmten Bereichs suchen. Als Beispiel möchte ich die Funktion Sverweis zeigen.
Es gibt in Excel unter anderem die so genannten Suchfunktionen / Matrixfunktionen Damit können Sie Werte innerhalb eines bestimmten Bereichs suchen. Als Beispiel möchte ich die Funktion Sverweis zeigen.
Leichte-Sprache-Bilder
 Leichte-Sprache-Bilder Reinhild Kassing Information - So geht es 1. Bilder gucken 2. anmelden für Probe-Bilder 3. Bilder bestellen 4. Rechnung bezahlen 5. Bilder runterladen 6. neue Bilder vorschlagen
Leichte-Sprache-Bilder Reinhild Kassing Information - So geht es 1. Bilder gucken 2. anmelden für Probe-Bilder 3. Bilder bestellen 4. Rechnung bezahlen 5. Bilder runterladen 6. neue Bilder vorschlagen
geben. Die Wahrscheinlichkeit von 100% ist hier demnach nur der Gehen wir einmal davon aus, dass die von uns angenommenen
 geben. Die Wahrscheinlichkeit von 100% ist hier demnach nur der Vollständigkeit halber aufgeführt. Gehen wir einmal davon aus, dass die von uns angenommenen 70% im Beispiel exakt berechnet sind. Was würde
geben. Die Wahrscheinlichkeit von 100% ist hier demnach nur der Vollständigkeit halber aufgeführt. Gehen wir einmal davon aus, dass die von uns angenommenen 70% im Beispiel exakt berechnet sind. Was würde
AB-Spinsystem (1) - Ein Spektrenbeispiel
 AB-Spinsystem () - Ein Spektrenbeispiel (A) (B) l N N 60 Mz- -NMR-Spektrum von -hlor-6-ethoxy-pyridazin in l mit Integration; die aromatischen Protonen bilden ein AB-System (aus: orst Friebolin, Ein- und
AB-Spinsystem () - Ein Spektrenbeispiel (A) (B) l N N 60 Mz- -NMR-Spektrum von -hlor-6-ethoxy-pyridazin in l mit Integration; die aromatischen Protonen bilden ein AB-System (aus: orst Friebolin, Ein- und
Was ist das Budget für Arbeit?
 1 Was ist das Budget für Arbeit? Das Budget für Arbeit ist ein Persönliches Geld für Arbeit wenn Sie arbeiten möchten aber nicht mehr in einer Werkstatt. Das gibt es bisher nur in Nieder-Sachsen. Und in
1 Was ist das Budget für Arbeit? Das Budget für Arbeit ist ein Persönliches Geld für Arbeit wenn Sie arbeiten möchten aber nicht mehr in einer Werkstatt. Das gibt es bisher nur in Nieder-Sachsen. Und in
Das große ElterngeldPlus 1x1. Alles über das ElterngeldPlus. Wer kann ElterngeldPlus beantragen? ElterngeldPlus verstehen ein paar einleitende Fakten
 Das große x -4 Alles über das Wer kann beantragen? Generell kann jeder beantragen! Eltern (Mütter UND Väter), die schon während ihrer Elternzeit wieder in Teilzeit arbeiten möchten. Eltern, die während
Das große x -4 Alles über das Wer kann beantragen? Generell kann jeder beantragen! Eltern (Mütter UND Väter), die schon während ihrer Elternzeit wieder in Teilzeit arbeiten möchten. Eltern, die während
Alle gehören dazu. Vorwort
 Alle gehören dazu Alle sollen zusammen Sport machen können. In diesem Text steht: Wie wir dafür sorgen wollen. Wir sind: Der Deutsche Olympische Sport-Bund und die Deutsche Sport-Jugend. Zu uns gehören
Alle gehören dazu Alle sollen zusammen Sport machen können. In diesem Text steht: Wie wir dafür sorgen wollen. Wir sind: Der Deutsche Olympische Sport-Bund und die Deutsche Sport-Jugend. Zu uns gehören
Kapitel 4: Chemische. Woher stammen die chemischen Symbole?
 Kapitel 4: Chemische Symbole Woher stammen die chemischen Symbole? Das sind die Anfangsbuchstaben (manchmal auch die ersten beiden Anfangsbuchstaben) der lateinischen oder griechischen Namen der Elemente.
Kapitel 4: Chemische Symbole Woher stammen die chemischen Symbole? Das sind die Anfangsbuchstaben (manchmal auch die ersten beiden Anfangsbuchstaben) der lateinischen oder griechischen Namen der Elemente.
Eva Douma: Die Vorteile und Nachteile der Ökonomisierung in der Sozialen Arbeit
 Eva Douma: Die Vorteile und Nachteile der Ökonomisierung in der Sozialen Arbeit Frau Dr. Eva Douma ist Organisations-Beraterin in Frankfurt am Main Das ist eine Zusammen-Fassung des Vortrages: Busines
Eva Douma: Die Vorteile und Nachteile der Ökonomisierung in der Sozialen Arbeit Frau Dr. Eva Douma ist Organisations-Beraterin in Frankfurt am Main Das ist eine Zusammen-Fassung des Vortrages: Busines
Oxidation und Reduktion Redoxreaktionen Blatt 1/5
 Oxidation und Reduktion Redoxreaktionen Blatt 1/5 1 Elektronenübertragung, Oxidation und Reduktion Gibt Natrium sein einziges Außenelektron an ein Chloratom (7 Außenelektronen) ab, so entsteht durch diese
Oxidation und Reduktion Redoxreaktionen Blatt 1/5 1 Elektronenübertragung, Oxidation und Reduktion Gibt Natrium sein einziges Außenelektron an ein Chloratom (7 Außenelektronen) ab, so entsteht durch diese
Wichtige Forderungen für ein Bundes-Teilhabe-Gesetz
 Wichtige Forderungen für ein Bundes-Teilhabe-Gesetz Die Parteien CDU, die SPD und die CSU haben versprochen: Es wird ein Bundes-Teilhabe-Gesetz geben. Bis jetzt gibt es das Gesetz noch nicht. Das dauert
Wichtige Forderungen für ein Bundes-Teilhabe-Gesetz Die Parteien CDU, die SPD und die CSU haben versprochen: Es wird ein Bundes-Teilhabe-Gesetz geben. Bis jetzt gibt es das Gesetz noch nicht. Das dauert
Spektroskopie-Seminar SS NMR-Spektroskopie. H-NMR-Spektroskopie. nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie
 1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 4.1 Allgemeines Spektroskopische Methode zur Untersuchung von Atomen: elektronische Umgebung Wechselwirkung
1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 4.1 Allgemeines Spektroskopische Methode zur Untersuchung von Atomen: elektronische Umgebung Wechselwirkung
Primzahlen und RSA-Verschlüsselung
 Primzahlen und RSA-Verschlüsselung Michael Fütterer und Jonathan Zachhuber 1 Einiges zu Primzahlen Ein paar Definitionen: Wir bezeichnen mit Z die Menge der positiven und negativen ganzen Zahlen, also
Primzahlen und RSA-Verschlüsselung Michael Fütterer und Jonathan Zachhuber 1 Einiges zu Primzahlen Ein paar Definitionen: Wir bezeichnen mit Z die Menge der positiven und negativen ganzen Zahlen, also
Warum benutzt man verdrillte Leitungspaare in LANs und nicht Paare mit parallel geführten Leitungen?
 Warum benutzt man verdrillte Leitungspaare in LANs und nicht Paare mit parallel geführten Leitungen? Das kann man nur verstehen, wenn man weiß, was ein magnetisches Feld ist und was das Induktionsgesetz
Warum benutzt man verdrillte Leitungspaare in LANs und nicht Paare mit parallel geführten Leitungen? Das kann man nur verstehen, wenn man weiß, was ein magnetisches Feld ist und was das Induktionsgesetz
2.8 Grenzflächeneffekte
 - 86-2.8 Grenzflächeneffekte 2.8.1 Oberflächenspannung An Grenzflächen treten besondere Effekte auf, welche im Volumen nicht beobachtbar sind. Die molekulare Grundlage dafür sind Kohäsionskräfte, d.h.
- 86-2.8 Grenzflächeneffekte 2.8.1 Oberflächenspannung An Grenzflächen treten besondere Effekte auf, welche im Volumen nicht beobachtbar sind. Die molekulare Grundlage dafür sind Kohäsionskräfte, d.h.
Lichtbrechung an Linsen
 Sammellinsen Lichtbrechung an Linsen Fällt ein paralleles Lichtbündel auf eine Sammellinse, so werden die Lichtstrahlen so gebrochen, dass sie durch einen Brennpunkt der Linse verlaufen. Der Abstand zwischen
Sammellinsen Lichtbrechung an Linsen Fällt ein paralleles Lichtbündel auf eine Sammellinse, so werden die Lichtstrahlen so gebrochen, dass sie durch einen Brennpunkt der Linse verlaufen. Der Abstand zwischen
Spektroskopiemodul II. H-NMR und 13 C-NMR
 Spektroskopiemodul II 1 H-NMR und 13 C-NMR 1 1. Was gehört zu einer vollständigen Spektreninterpretation zur Strukturaufklärung? 1.1. 1 H-NMR-Spektren Man muss die chemische Verschiebung jedes einzelnen
Spektroskopiemodul II 1 H-NMR und 13 C-NMR 1 1. Was gehört zu einer vollständigen Spektreninterpretation zur Strukturaufklärung? 1.1. 1 H-NMR-Spektren Man muss die chemische Verschiebung jedes einzelnen
Übungen zur VL Chemie für Biologen und Humanbiologen 18.11.2011 Lösung Übung 3
 Übungen zur VL Chemie für Biologen und Humanbiologen 18.11.2011 Lösung Übung 3 Teil 1: Die Geometrie organischer Verbindungen 1. Welche Form hat ein s-orbital? Welche Form haben p-orbitale? Skizzieren
Übungen zur VL Chemie für Biologen und Humanbiologen 18.11.2011 Lösung Übung 3 Teil 1: Die Geometrie organischer Verbindungen 1. Welche Form hat ein s-orbital? Welche Form haben p-orbitale? Skizzieren
Einführung in die Algebra
 Prof. Dr. H. Brenner Osnabrück SS 2009 Einführung in die Algebra Vorlesung 13 Einheiten Definition 13.1. Ein Element u in einem Ring R heißt Einheit, wenn es ein Element v R gibt mit uv = vu = 1. DasElementv
Prof. Dr. H. Brenner Osnabrück SS 2009 Einführung in die Algebra Vorlesung 13 Einheiten Definition 13.1. Ein Element u in einem Ring R heißt Einheit, wenn es ein Element v R gibt mit uv = vu = 1. DasElementv
NMR Spektroskopie (Nuclear Magnetic Resonance Kern-Magnetische Resonanz)
 NMR Spektroskopie (Nuclear Magnetic Resonance Kern-Magnetische Resonanz) Viele Atomkerne besitzen einen von Null verschiedenen Eigendrehimpuls (Spin) p = ħ I, der ganz - oder halbzahlige Werte von ħ betragen
NMR Spektroskopie (Nuclear Magnetic Resonance Kern-Magnetische Resonanz) Viele Atomkerne besitzen einen von Null verschiedenen Eigendrehimpuls (Spin) p = ħ I, der ganz - oder halbzahlige Werte von ħ betragen
Guide DynDNS und Portforwarding
 Guide DynDNS und Portforwarding Allgemein Um Geräte im lokalen Netzwerk von überall aus über das Internet erreichen zu können, kommt man um die Themen Dynamik DNS (kurz DynDNS) und Portweiterleitung(auch
Guide DynDNS und Portforwarding Allgemein Um Geräte im lokalen Netzwerk von überall aus über das Internet erreichen zu können, kommt man um die Themen Dynamik DNS (kurz DynDNS) und Portweiterleitung(auch
Abituraufgabe zur Analysis, Hessen 2009, Grundkurs (TR)
 Abituraufgabe zur Analysis, Hessen 2009, Grundkurs (TR) Gegeben ist die trigonometrische Funktion f mit f(x) = 2 sin(2x) 1 (vgl. Material 1). 1.) Geben Sie für die Funktion f den Schnittpunkt mit der y
Abituraufgabe zur Analysis, Hessen 2009, Grundkurs (TR) Gegeben ist die trigonometrische Funktion f mit f(x) = 2 sin(2x) 1 (vgl. Material 1). 1.) Geben Sie für die Funktion f den Schnittpunkt mit der y
1 Mathematische Grundlagen
 Mathematische Grundlagen - 1-1 Mathematische Grundlagen Der Begriff der Menge ist einer der grundlegenden Begriffe in der Mathematik. Mengen dienen dazu, Dinge oder Objekte zu einer Einheit zusammenzufassen.
Mathematische Grundlagen - 1-1 Mathematische Grundlagen Der Begriff der Menge ist einer der grundlegenden Begriffe in der Mathematik. Mengen dienen dazu, Dinge oder Objekte zu einer Einheit zusammenzufassen.
PTV VISWALK TIPPS UND TRICKS PTV VISWALK TIPPS UND TRICKS: VERWENDUNG DICHTEBASIERTER TEILROUTEN
 PTV VISWALK TIPPS UND TRICKS PTV VISWALK TIPPS UND TRICKS: VERWENDUNG DICHTEBASIERTER TEILROUTEN Karlsruhe, April 2015 Verwendung dichte-basierter Teilrouten Stellen Sie sich vor, in einem belebten Gebäude,
PTV VISWALK TIPPS UND TRICKS PTV VISWALK TIPPS UND TRICKS: VERWENDUNG DICHTEBASIERTER TEILROUTEN Karlsruhe, April 2015 Verwendung dichte-basierter Teilrouten Stellen Sie sich vor, in einem belebten Gebäude,
Spektroskopie-Seminar SS NMR-Spektroskopie. H-NMR-Spektroskopie. nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie
 1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 4 NMR-Spektroskopie 5.1 1 H-NMR-Spektroskopie Wasserstoffatome ( 1 H, natürliche Häufigkeit 99,985 %) mit
1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 4 NMR-Spektroskopie 5.1 1 H-NMR-Spektroskopie Wasserstoffatome ( 1 H, natürliche Häufigkeit 99,985 %) mit
Das Leitbild vom Verein WIR
 Das Leitbild vom Verein WIR Dieses Zeichen ist ein Gütesiegel. Texte mit diesem Gütesiegel sind leicht verständlich. Leicht Lesen gibt es in drei Stufen. B1: leicht verständlich A2: noch leichter verständlich
Das Leitbild vom Verein WIR Dieses Zeichen ist ein Gütesiegel. Texte mit diesem Gütesiegel sind leicht verständlich. Leicht Lesen gibt es in drei Stufen. B1: leicht verständlich A2: noch leichter verständlich
13. Lineare DGL höherer Ordnung. Eine DGL heißt von n-ter Ordnung, wenn Ableitungen y, y, y,... bis zur n-ten Ableitung y (n) darin vorkommen.
 13. Lineare DGL höherer Ordnung. Eine DGL heißt von n-ter Ordnung, wenn Ableitungen y, y, y,... bis zur n-ten Ableitung y (n) darin vorkommen. Sie heißt linear, wenn sie die Form y (n) + a n 1 y (n 1)
13. Lineare DGL höherer Ordnung. Eine DGL heißt von n-ter Ordnung, wenn Ableitungen y, y, y,... bis zur n-ten Ableitung y (n) darin vorkommen. Sie heißt linear, wenn sie die Form y (n) + a n 1 y (n 1)
Nicht über uns ohne uns
 Nicht über uns ohne uns Das bedeutet: Es soll nichts über Menschen mit Behinderung entschieden werden, wenn sie nicht mit dabei sind. Dieser Text ist in leicht verständlicher Sprache geschrieben. Die Parteien
Nicht über uns ohne uns Das bedeutet: Es soll nichts über Menschen mit Behinderung entschieden werden, wenn sie nicht mit dabei sind. Dieser Text ist in leicht verständlicher Sprache geschrieben. Die Parteien
6. Reaktionsgleichungen 6.1 Chemisches Reaktionsschema Wortschema Reaktionsschema Beispiel 1: Kupfer und Schwefel Vorzahlen
 6. Reaktionsgleichungen 6.1 Chemisches Reaktionsschema Das Wortschema benennt die Ausgangsstoffe und die Reaktionsprodukte einer chemischen Reaktion. Das Reaktionsschema sagt zusätzlich etwas über das
6. Reaktionsgleichungen 6.1 Chemisches Reaktionsschema Das Wortschema benennt die Ausgangsstoffe und die Reaktionsprodukte einer chemischen Reaktion. Das Reaktionsschema sagt zusätzlich etwas über das
Catherina Lange, Heimbeiräte und Werkstatträte-Tagung, November 2013 1
 Catherina Lange, Heimbeiräte und Werkstatträte-Tagung, November 2013 1 Darum geht es heute: Was ist das Persönliche Geld? Was kann man damit alles machen? Wie hoch ist es? Wo kann man das Persönliche Geld
Catherina Lange, Heimbeiräte und Werkstatträte-Tagung, November 2013 1 Darum geht es heute: Was ist das Persönliche Geld? Was kann man damit alles machen? Wie hoch ist es? Wo kann man das Persönliche Geld
Welche wichtigen Begriffe gibt es?
 Welche wichtigen Begriffe gibt es? Moleküle Beispiel: Kohlendioxid CO 2 bestehen aus Protonen (+) bestehen aus Atomkerne Chemische Elemente bestehen aus Atome bestehen aus Neutronen Beispiele: Kohlenstoff
Welche wichtigen Begriffe gibt es? Moleküle Beispiel: Kohlendioxid CO 2 bestehen aus Protonen (+) bestehen aus Atomkerne Chemische Elemente bestehen aus Atome bestehen aus Neutronen Beispiele: Kohlenstoff
AGROPLUS Buchhaltung. Daten-Server und Sicherheitskopie. Version vom 21.10.2013b
 AGROPLUS Buchhaltung Daten-Server und Sicherheitskopie Version vom 21.10.2013b 3a) Der Daten-Server Modus und der Tresor Der Daten-Server ist eine Betriebsart welche dem Nutzer eine grosse Flexibilität
AGROPLUS Buchhaltung Daten-Server und Sicherheitskopie Version vom 21.10.2013b 3a) Der Daten-Server Modus und der Tresor Der Daten-Server ist eine Betriebsart welche dem Nutzer eine grosse Flexibilität
Bundesverband Flachglas Großhandel Isolierglasherstellung Veredlung e.v. U g -Werte-Tabellen nach DIN EN 673. Flachglasbranche.
 Bundesverband Flachglas Großhandel Isolierglasherstellung Veredlung e.v. U g -Werte-Tabellen nach DIN EN 673 Ug-Werte für die Flachglasbranche Einleitung Die vorliegende Broschüre enthält die Werte für
Bundesverband Flachglas Großhandel Isolierglasherstellung Veredlung e.v. U g -Werte-Tabellen nach DIN EN 673 Ug-Werte für die Flachglasbranche Einleitung Die vorliegende Broschüre enthält die Werte für
Lineare Gleichungssysteme
 Lineare Gleichungssysteme 1 Zwei Gleichungen mit zwei Unbekannten Es kommt häufig vor, dass man nicht mit einer Variablen alleine auskommt, um ein Problem zu lösen. Das folgende Beispiel soll dies verdeutlichen
Lineare Gleichungssysteme 1 Zwei Gleichungen mit zwei Unbekannten Es kommt häufig vor, dass man nicht mit einer Variablen alleine auskommt, um ein Problem zu lösen. Das folgende Beispiel soll dies verdeutlichen
Festigkeit von FDM-3D-Druckteilen
 Festigkeit von FDM-3D-Druckteilen Häufig werden bei 3D-Druck-Filamenten die Kunststoff-Festigkeit und physikalischen Eigenschaften diskutiert ohne die Einflüsse der Geometrie und der Verschweißung der
Festigkeit von FDM-3D-Druckteilen Häufig werden bei 3D-Druck-Filamenten die Kunststoff-Festigkeit und physikalischen Eigenschaften diskutiert ohne die Einflüsse der Geometrie und der Verschweißung der
Allotrope Kohlenstoffmodifikationen. Ein Vortrag von Patrick Knicknie. Datum: 04.05.06 Raum:112
 Allotrope Kohlenstoffmodifikationen Ein Vortrag von Patrick Knicknie Datum: 04.05.06 Raum:112 Themen: 1. Was ist Allotrop? 2. Unterschiedliche Kohlenstoffmodifikationen 3. Der Graphit 4. Der Diamant 5.
Allotrope Kohlenstoffmodifikationen Ein Vortrag von Patrick Knicknie Datum: 04.05.06 Raum:112 Themen: 1. Was ist Allotrop? 2. Unterschiedliche Kohlenstoffmodifikationen 3. Der Graphit 4. Der Diamant 5.
Outlook. sysplus.ch outlook - mail-grundlagen Seite 1/8. Mail-Grundlagen. Posteingang
 sysplus.ch outlook - mail-grundlagen Seite 1/8 Outlook Mail-Grundlagen Posteingang Es gibt verschiedene Möglichkeiten, um zum Posteingang zu gelangen. Man kann links im Outlook-Fenster auf die Schaltfläche
sysplus.ch outlook - mail-grundlagen Seite 1/8 Outlook Mail-Grundlagen Posteingang Es gibt verschiedene Möglichkeiten, um zum Posteingang zu gelangen. Man kann links im Outlook-Fenster auf die Schaltfläche
Elektrische Logigsystem mit Rückführung
 Mathias Arbeiter 23. Juni 2006 Betreuer: Herr Bojarski Elektrische Logigsystem mit Rückführung Von Triggern, Registern und Zählern Inhaltsverzeichnis 1 Trigger 3 1.1 RS-Trigger ohne Takt......................................
Mathias Arbeiter 23. Juni 2006 Betreuer: Herr Bojarski Elektrische Logigsystem mit Rückführung Von Triggern, Registern und Zählern Inhaltsverzeichnis 1 Trigger 3 1.1 RS-Trigger ohne Takt......................................
Fachdidaktik der Informatik 18.12.08 Jörg Depner, Kathrin Gaißer
 Fachdidaktik der Informatik 18.12.08 Jörg Depner, Kathrin Gaißer Klassendiagramme Ein Klassendiagramm dient in der objektorientierten Softwareentwicklung zur Darstellung von Klassen und den Beziehungen,
Fachdidaktik der Informatik 18.12.08 Jörg Depner, Kathrin Gaißer Klassendiagramme Ein Klassendiagramm dient in der objektorientierten Softwareentwicklung zur Darstellung von Klassen und den Beziehungen,
OECD Programme for International Student Assessment PISA 2000. Lösungen der Beispielaufgaben aus dem Mathematiktest. Deutschland
 OECD Programme for International Student Assessment Deutschland PISA 2000 Lösungen der Beispielaufgaben aus dem Mathematiktest Beispielaufgaben PISA-Hauptstudie 2000 Seite 3 UNIT ÄPFEL Beispielaufgaben
OECD Programme for International Student Assessment Deutschland PISA 2000 Lösungen der Beispielaufgaben aus dem Mathematiktest Beispielaufgaben PISA-Hauptstudie 2000 Seite 3 UNIT ÄPFEL Beispielaufgaben
Behindert ist, wer behindert wird
 Behindert ist, wer behindert wird Alle Menschen müssen lernen, dass Menschen mit Behinderungen gleichberechtigt sind Auf der ganzen Welt leben sehr viele Menschen mit Behinderungen: über 1 Milliarde Menschen
Behindert ist, wer behindert wird Alle Menschen müssen lernen, dass Menschen mit Behinderungen gleichberechtigt sind Auf der ganzen Welt leben sehr viele Menschen mit Behinderungen: über 1 Milliarde Menschen
40-Tage-Wunder- Kurs. Umarme, was Du nicht ändern kannst.
 40-Tage-Wunder- Kurs Umarme, was Du nicht ändern kannst. Das sagt Wikipedia: Als Wunder (griechisch thauma) gilt umgangssprachlich ein Ereignis, dessen Zustandekommen man sich nicht erklären kann, so dass
40-Tage-Wunder- Kurs Umarme, was Du nicht ändern kannst. Das sagt Wikipedia: Als Wunder (griechisch thauma) gilt umgangssprachlich ein Ereignis, dessen Zustandekommen man sich nicht erklären kann, so dass
Fotos verkleinern mit Paint
 Fotos verkleinern mit Paint Warum Paint? Sicher, es gibt eine Menge kostenloser guter Programme und Möglichkeiten im Netz zum Verkleinern von Fotos. Letztendlich ist es Geschmackssache, aber meine Erfahrungen
Fotos verkleinern mit Paint Warum Paint? Sicher, es gibt eine Menge kostenloser guter Programme und Möglichkeiten im Netz zum Verkleinern von Fotos. Letztendlich ist es Geschmackssache, aber meine Erfahrungen
Anleitung über den Umgang mit Schildern
 Anleitung über den Umgang mit Schildern -Vorwort -Wo bekommt man Schilder? -Wo und wie speichert man die Schilder? -Wie füge ich die Schilder in meinen Track ein? -Welche Bauteile kann man noch für Schilder
Anleitung über den Umgang mit Schildern -Vorwort -Wo bekommt man Schilder? -Wo und wie speichert man die Schilder? -Wie füge ich die Schilder in meinen Track ein? -Welche Bauteile kann man noch für Schilder
Chemie Zusammenfassung KA 2
 Chemie Zusammenfassung KA 2 Wärmemenge Q bei einer Reaktion Chemische Reaktionen haben eine Gemeinsamkeit: Bei der Reaktion wird entweder Energie/Wärme frei (exotherm). Oder es wird Wärme/Energie aufgenommen
Chemie Zusammenfassung KA 2 Wärmemenge Q bei einer Reaktion Chemische Reaktionen haben eine Gemeinsamkeit: Bei der Reaktion wird entweder Energie/Wärme frei (exotherm). Oder es wird Wärme/Energie aufgenommen
Die Post hat eine Umfrage gemacht
 Die Post hat eine Umfrage gemacht Bei der Umfrage ging es um das Thema: Inklusion Die Post hat Menschen mit Behinderung und Menschen ohne Behinderung gefragt: Wie zufrieden sie in dieser Gesellschaft sind.
Die Post hat eine Umfrage gemacht Bei der Umfrage ging es um das Thema: Inklusion Die Post hat Menschen mit Behinderung und Menschen ohne Behinderung gefragt: Wie zufrieden sie in dieser Gesellschaft sind.
Man nimmt an, dass sich der Kernspin zusammensetzt aus der Vektorsumme der Nukleonenspins und der Bahndrehimpulse der Nukleonen
 2.5.1 Spin und magnetische Momente Proton und Neutron sind Spin-½ Teilchen (Fermionen) Aus Hyperfeinstruktur der Energieniveaus vieler Atomkerne kann man schließen, dass Atomkerne ein magnetisches Moment
2.5.1 Spin und magnetische Momente Proton und Neutron sind Spin-½ Teilchen (Fermionen) Aus Hyperfeinstruktur der Energieniveaus vieler Atomkerne kann man schließen, dass Atomkerne ein magnetisches Moment
Abschlussprüfung Realschule Bayern II / III: 2009 Haupttermin B 1.0 B 1.1
 B 1.0 B 1.1 L: Wir wissen von, dass sie den Scheitel hat und durch den Punkt läuft. Was nichts bringt, ist beide Punkte in die allgemeine Parabelgleichung einzusetzen und das Gleichungssystem zu lösen,
B 1.0 B 1.1 L: Wir wissen von, dass sie den Scheitel hat und durch den Punkt läuft. Was nichts bringt, ist beide Punkte in die allgemeine Parabelgleichung einzusetzen und das Gleichungssystem zu lösen,
Approximation durch Taylorpolynome
 TU Berlin Fakultät II - Mathematik und Naturwissenschaften Sekretariat MA 4-1 Straße des 17. Juni 10623 Berlin Hochschultag Approximation durch Taylorpolynome Im Rahmen der Schülerinnen- und Schüler-Uni
TU Berlin Fakultät II - Mathematik und Naturwissenschaften Sekretariat MA 4-1 Straße des 17. Juni 10623 Berlin Hochschultag Approximation durch Taylorpolynome Im Rahmen der Schülerinnen- und Schüler-Uni
 Name:... Matrikel-Nr.:... 3 Aufgabe Handyklingeln in der Vorlesung (9 Punkte) Angenommen, ein Student führt ein Handy mit sich, das mit einer Wahrscheinlichkeit von p während einer Vorlesung zumindest
Name:... Matrikel-Nr.:... 3 Aufgabe Handyklingeln in der Vorlesung (9 Punkte) Angenommen, ein Student führt ein Handy mit sich, das mit einer Wahrscheinlichkeit von p während einer Vorlesung zumindest
Regeln für das Qualitäts-Siegel
 Regeln für das Qualitäts-Siegel 1 Inhalt: Die Qualitäts-Regeln vom Netzwerk Leichte Sprache 3 Die Übersetzung in Leichte Sprache 5 Die Prüfung auf Leichte Sprache 6 Wir beantworten jede Anfrage 7 Wir schreiben
Regeln für das Qualitäts-Siegel 1 Inhalt: Die Qualitäts-Regeln vom Netzwerk Leichte Sprache 3 Die Übersetzung in Leichte Sprache 5 Die Prüfung auf Leichte Sprache 6 Wir beantworten jede Anfrage 7 Wir schreiben
Berechnung der Erhöhung der Durchschnittsprämien
 Wolfram Fischer Berechnung der Erhöhung der Durchschnittsprämien Oktober 2004 1 Zusammenfassung Zur Berechnung der Durchschnittsprämien wird das gesamte gemeldete Prämienvolumen Zusammenfassung durch die
Wolfram Fischer Berechnung der Erhöhung der Durchschnittsprämien Oktober 2004 1 Zusammenfassung Zur Berechnung der Durchschnittsprämien wird das gesamte gemeldete Prämienvolumen Zusammenfassung durch die
! " # $ " % & Nicki Wruck worldwidewruck 08.02.2006
 !"# $ " %& Nicki Wruck worldwidewruck 08.02.2006 Wer kennt die Problematik nicht? Die.pst Datei von Outlook wird unübersichtlich groß, das Starten und Beenden dauert immer länger. Hat man dann noch die.pst
!"# $ " %& Nicki Wruck worldwidewruck 08.02.2006 Wer kennt die Problematik nicht? Die.pst Datei von Outlook wird unübersichtlich groß, das Starten und Beenden dauert immer länger. Hat man dann noch die.pst
ERGÄNZUNGEN ZUR ANALYSIS II MITTELWERTSATZ UND ANWENDUNGEN
 ERGÄNZUNGEN ZUR ANALYSIS II MITTELWERTSATZ UND ANWENDUNGEN CHRISTIAN HARTFELDT. Zweiter Mittelwertsatz Der Mittelwertsatz Satz VI.3.4) lässt sich verallgemeinern zu Satz.. Seien f, g : [a, b] R auf [a,
ERGÄNZUNGEN ZUR ANALYSIS II MITTELWERTSATZ UND ANWENDUNGEN CHRISTIAN HARTFELDT. Zweiter Mittelwertsatz Der Mittelwertsatz Satz VI.3.4) lässt sich verallgemeinern zu Satz.. Seien f, g : [a, b] R auf [a,
EasyWk DAS Schwimmwettkampfprogramm
 EasyWk DAS Schwimmwettkampfprogramm Arbeiten mit OMEGA ARES 21 EasyWk - DAS Schwimmwettkampfprogramm 1 Einleitung Diese Präsentation dient zur Darstellung der Zusammenarbeit zwischen EasyWk und der Zeitmessanlage
EasyWk DAS Schwimmwettkampfprogramm Arbeiten mit OMEGA ARES 21 EasyWk - DAS Schwimmwettkampfprogramm 1 Einleitung Diese Präsentation dient zur Darstellung der Zusammenarbeit zwischen EasyWk und der Zeitmessanlage
Ist Fernsehen schädlich für die eigene Meinung oder fördert es unabhängig zu denken?
 UErörterung zu dem Thema Ist Fernsehen schädlich für die eigene Meinung oder fördert es unabhängig zu denken? 2000 by christoph hoffmann Seite I Gliederung 1. In zu großen Mengen ist alles schädlich. 2.
UErörterung zu dem Thema Ist Fernsehen schädlich für die eigene Meinung oder fördert es unabhängig zu denken? 2000 by christoph hoffmann Seite I Gliederung 1. In zu großen Mengen ist alles schädlich. 2.
Elternzeit Was ist das?
 Elternzeit Was ist das? Wenn Eltern sich nach der Geburt ihres Kindes ausschließlich um ihr Kind kümmern möchten, können sie bei ihrem Arbeitgeber Elternzeit beantragen. Während der Elternzeit ruht das
Elternzeit Was ist das? Wenn Eltern sich nach der Geburt ihres Kindes ausschließlich um ihr Kind kümmern möchten, können sie bei ihrem Arbeitgeber Elternzeit beantragen. Während der Elternzeit ruht das
Spektroskopie-Seminar WS 17/18 5 NMR-Spektroskopie. H-NMR-Spektroskopie. nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie
 WS 17/18 1 -NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 1 5.1 1 -NMR-Spektroskopie NMR-Spektrum liefert folgende Informationen: Chemische Verschiebung δ(in
WS 17/18 1 -NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 1 5.1 1 -NMR-Spektroskopie NMR-Spektrum liefert folgende Informationen: Chemische Verschiebung δ(in
Simulation LIF5000. Abbildung 1
 Simulation LIF5000 Abbildung 1 Zur Simulation von analogen Schaltungen verwende ich Ltspice/SwitcherCAD III. Dieses Programm ist sehr leistungsfähig und wenn man weis wie, dann kann man damit fast alles
Simulation LIF5000 Abbildung 1 Zur Simulation von analogen Schaltungen verwende ich Ltspice/SwitcherCAD III. Dieses Programm ist sehr leistungsfähig und wenn man weis wie, dann kann man damit fast alles
Versuch 3. Frequenzgang eines Verstärkers
 Versuch 3 Frequenzgang eines Verstärkers 1. Grundlagen Ein Verstärker ist eine aktive Schaltung, mit der die Amplitude eines Signals vergößert werden kann. Man spricht hier von Verstärkung v und definiert
Versuch 3 Frequenzgang eines Verstärkers 1. Grundlagen Ein Verstärker ist eine aktive Schaltung, mit der die Amplitude eines Signals vergößert werden kann. Man spricht hier von Verstärkung v und definiert
Musterprüfung Chemie Klassen: MPL 09 Datum: 14. 16. April 2010
 1 Musterprüfung Chemie Klassen: MPL 09 Datum: 14. 16. April 2010 Themen: Metallische Bindungen (Skript S. 51 53, inkl. Arbeitsblatt) Reaktionsverlauf (Skript S. 54 59, inkl. Arbeitsblatt, Merke, Fig. 7.2.1
1 Musterprüfung Chemie Klassen: MPL 09 Datum: 14. 16. April 2010 Themen: Metallische Bindungen (Skript S. 51 53, inkl. Arbeitsblatt) Reaktionsverlauf (Skript S. 54 59, inkl. Arbeitsblatt, Merke, Fig. 7.2.1
Welche Lagen können zwei Geraden (im Raum) zueinander haben? Welche Lagen kann eine Gerade bezüglich einer Ebene im Raum einnehmen?
 Welche Lagen können zwei Geraden (im Raum) zueinander haben? Welche Lagen können zwei Ebenen (im Raum) zueinander haben? Welche Lagen kann eine Gerade bezüglich einer Ebene im Raum einnehmen? Wie heiÿt
Welche Lagen können zwei Geraden (im Raum) zueinander haben? Welche Lagen können zwei Ebenen (im Raum) zueinander haben? Welche Lagen kann eine Gerade bezüglich einer Ebene im Raum einnehmen? Wie heiÿt
1 Zwei Teilchen in einem Kastenpotenzial
 1 Zwei Teilchen in einem Kastenpotenzial Es geht hier darum herauszu nden, welche prinzipiellen Eigenschaften die Wellenfunktion für mehrere Teilchen im gleichen Potenzial aufweisen muss. Wir unterscheiden
1 Zwei Teilchen in einem Kastenpotenzial Es geht hier darum herauszu nden, welche prinzipiellen Eigenschaften die Wellenfunktion für mehrere Teilchen im gleichen Potenzial aufweisen muss. Wir unterscheiden
Sonderrundschreiben. Arbeitshilfe zu den Pflichtangaben in Immobilienanzeigen bei alten Energieausweisen
 Sonderrundschreiben Arbeitshilfe zu den Pflichtangaben in Immobilienanzeigen bei alten Energieausweisen Sonnenstraße 11-80331 München Telefon 089 / 5404133-0 - Fax 089 / 5404133-55 info@haus-und-grund-bayern.de
Sonderrundschreiben Arbeitshilfe zu den Pflichtangaben in Immobilienanzeigen bei alten Energieausweisen Sonnenstraße 11-80331 München Telefon 089 / 5404133-0 - Fax 089 / 5404133-55 info@haus-und-grund-bayern.de
Die Übereckperspektive mit zwei Fluchtpunkten
 Perspektive Perspektive mit zwei Fluchtpunkten (S. 1 von 8) / www.kunstbrowser.de Die Übereckperspektive mit zwei Fluchtpunkten Bei dieser Perspektivart wird der rechtwinklige Körper so auf die Grundebene
Perspektive Perspektive mit zwei Fluchtpunkten (S. 1 von 8) / www.kunstbrowser.de Die Übereckperspektive mit zwei Fluchtpunkten Bei dieser Perspektivart wird der rechtwinklige Körper so auf die Grundebene
www.mathe-aufgaben.com
 Abiturprüfung Mathematik Baden-Württemberg (ohne CAS) Pflichtteil Aufgaben Aufgabe : ( VP) Bilden Sie die erste Ableitung der Funktion f mit sin() f() =. Aufgabe : ( VP) Berechnen Sie das Integral ( )
Abiturprüfung Mathematik Baden-Württemberg (ohne CAS) Pflichtteil Aufgaben Aufgabe : ( VP) Bilden Sie die erste Ableitung der Funktion f mit sin() f() =. Aufgabe : ( VP) Berechnen Sie das Integral ( )
Kapitalerhöhung - Verbuchung
 Kapitalerhöhung - Verbuchung Beschreibung Eine Kapitalerhöhung ist eine Erhöhung des Aktienkapitals einer Aktiengesellschaft durch Emission von en Aktien. Es gibt unterschiedliche Formen von Kapitalerhöhung.
Kapitalerhöhung - Verbuchung Beschreibung Eine Kapitalerhöhung ist eine Erhöhung des Aktienkapitals einer Aktiengesellschaft durch Emission von en Aktien. Es gibt unterschiedliche Formen von Kapitalerhöhung.
Übungsaufgaben zur NMR-Spektrometrie
 Übungsaufgaben NMR 33 Übungsaufgaben zur NMR-Spektrometrie Aufgabe 1 a) Wieviele unterschiedliche Orientierungen des Kernmomentes relativ zu einem externen Magnetfeld sind beim 14 N-Kern (I = 1, γ = 1.932
Übungsaufgaben NMR 33 Übungsaufgaben zur NMR-Spektrometrie Aufgabe 1 a) Wieviele unterschiedliche Orientierungen des Kernmomentes relativ zu einem externen Magnetfeld sind beim 14 N-Kern (I = 1, γ = 1.932
Würfelt man dabei je genau 10 - mal eine 1, 2, 3, 4, 5 und 6, so beträgt die Anzahl. der verschiedenen Reihenfolgen, in denen man dies tun kann, 60!.
 040304 Übung 9a Analysis, Abschnitt 4, Folie 8 Die Wahrscheinlichkeit, dass bei n - maliger Durchführung eines Zufallexperiments ein Ereignis A ( mit Wahrscheinlichkeit p p ( A ) ) für eine beliebige Anzahl
040304 Übung 9a Analysis, Abschnitt 4, Folie 8 Die Wahrscheinlichkeit, dass bei n - maliger Durchführung eines Zufallexperiments ein Ereignis A ( mit Wahrscheinlichkeit p p ( A ) ) für eine beliebige Anzahl
Die Gleichung A x = a hat für A 0 die eindeutig bestimmte Lösung. Für A=0 und a 0 existiert keine Lösung.
 Lineare Gleichungen mit einer Unbekannten Die Grundform der linearen Gleichung mit einer Unbekannten x lautet A x = a Dabei sind A, a reelle Zahlen. Die Gleichung lösen heißt, alle reellen Zahlen anzugeben,
Lineare Gleichungen mit einer Unbekannten Die Grundform der linearen Gleichung mit einer Unbekannten x lautet A x = a Dabei sind A, a reelle Zahlen. Die Gleichung lösen heißt, alle reellen Zahlen anzugeben,
Was ist Leichte Sprache?
 Was ist Leichte Sprache? Eine Presse-Information vom Verein Netzwerk Leichte Sprache in Leichter Sprache Leichte Sprache heißt: So schreiben oder sprechen, dass es alle gut verstehen. Leichte Sprache ist
Was ist Leichte Sprache? Eine Presse-Information vom Verein Netzwerk Leichte Sprache in Leichter Sprache Leichte Sprache heißt: So schreiben oder sprechen, dass es alle gut verstehen. Leichte Sprache ist
3.2 Spiegelungen an zwei Spiegeln
 3 Die Theorie des Spiegelbuches 45 sehen, wenn die Person uns direkt gegenüber steht. Denn dann hat sie eine Drehung um die senkrechte Achse gemacht und dabei links und rechts vertauscht. 3.2 Spiegelungen
3 Die Theorie des Spiegelbuches 45 sehen, wenn die Person uns direkt gegenüber steht. Denn dann hat sie eine Drehung um die senkrechte Achse gemacht und dabei links und rechts vertauscht. 3.2 Spiegelungen
Selbst-Test zur Vorab-Einschätzung zum Vorkurs Chemie für Mediziner
 Liebe Studierende der Human- und Zahnmedizin, mithilfe dieses Tests können Sie selbst einschätzen, ob Sie den Vorkurs besuchen sollten. Die kleine Auswahl an Aufgaben spiegelt in etwa das Niveau des Vorkurses
Liebe Studierende der Human- und Zahnmedizin, mithilfe dieses Tests können Sie selbst einschätzen, ob Sie den Vorkurs besuchen sollten. Die kleine Auswahl an Aufgaben spiegelt in etwa das Niveau des Vorkurses
Alle Schlüssel-Karten (blaue Rückseite) werden den Schlüssel-Farben nach sortiert und in vier getrennte Stapel mit der Bildseite nach oben gelegt.
 Gentlemen", bitte zur Kasse! Ravensburger Spiele Nr. 01 264 0 Autoren: Wolfgang Kramer und Jürgen P. K. Grunau Grafik: Erhard Dietl Ein Gaunerspiel für 3-6 Gentlemen" ab 10 Jahren Inhalt: 35 Tresor-Karten
Gentlemen", bitte zur Kasse! Ravensburger Spiele Nr. 01 264 0 Autoren: Wolfgang Kramer und Jürgen P. K. Grunau Grafik: Erhard Dietl Ein Gaunerspiel für 3-6 Gentlemen" ab 10 Jahren Inhalt: 35 Tresor-Karten
Positions-Papier vom BVWR. Frauen-Beauftragte in Werkstätten für behinderte Menschen
 Positions-Papier vom BVWR Leichte Sprache Frauen-Beauftragte in Werkstätten für behinderte Menschen BVWR ist eine Abkürzung. Die Abkürzung bedeutet: Bundes-Vereinigung der Landes-Arbeits-Gemeinschaften
Positions-Papier vom BVWR Leichte Sprache Frauen-Beauftragte in Werkstätten für behinderte Menschen BVWR ist eine Abkürzung. Die Abkürzung bedeutet: Bundes-Vereinigung der Landes-Arbeits-Gemeinschaften
Tangentengleichung. Wie lautet die Geradengleichung für die Tangente, y T =? Antwort:
 Tangentengleichung Wie Sie wissen, gibt die erste Ableitung einer Funktion deren Steigung an. Betrachtet man eine fest vorgegebene Stelle, gibt f ( ) also die Steigung der Kurve und somit auch die Steigung
Tangentengleichung Wie Sie wissen, gibt die erste Ableitung einer Funktion deren Steigung an. Betrachtet man eine fest vorgegebene Stelle, gibt f ( ) also die Steigung der Kurve und somit auch die Steigung
Mathematik. UND/ODER Verknüpfung. Ungleichungen. Betrag. Intervall. Umgebung
 Mathematik UND/ODER Verknüpfung Ungleichungen Betrag Intervall Umgebung Stefan Gärtner 004 Gr Mathematik UND/ODER Seite UND Verknüpfung Kommentar Aussage Symbolform Die Aussagen Hans kann schwimmen p und
Mathematik UND/ODER Verknüpfung Ungleichungen Betrag Intervall Umgebung Stefan Gärtner 004 Gr Mathematik UND/ODER Seite UND Verknüpfung Kommentar Aussage Symbolform Die Aussagen Hans kann schwimmen p und
Programm 4: Arbeiten mit thematischen Karten
 : Arbeiten mit thematischen Karten A) Anteil der ausländischen Wohnbevölkerung an der Wohnbevölkerung insgesamt 2001 in Prozent 1. Inhaltliche und kartographische Beschreibung - Originalkarte Bei dieser
: Arbeiten mit thematischen Karten A) Anteil der ausländischen Wohnbevölkerung an der Wohnbevölkerung insgesamt 2001 in Prozent 1. Inhaltliche und kartographische Beschreibung - Originalkarte Bei dieser
