Nomenklatur organischer Verbindungen nach den IUPAC-Regeln Hier findest Du die Zauberformel!
|
|
|
- Carin Schumacher
- vor 7 Jahren
- Abrufe
Transkript
1 Nomenklatur organischer Verbindungen nach den IUPAC-Regeln Hier findest Du die Zauberformel! Prof. Dr. Ivo C. Ivanov
2 Einführung (interaktive Vorlesung) Die genaue Benennung organischer Verbindungen nach verbindlichen Regeln ist eine Grundvoraussetzung für ein erfolgreiches Arbeiten im Chemieunterricht. Dieses Lernprogramm ist dazu gedacht, die Grundlagen der IUPAC-Nomenklatur selbstständig einzuüben oder zu wiederholen. Für die Arbeit mit dem Programm brauchen Sie unbedingt einige unbeschriebene Arbeitsblätter. Notieren Sie sich bei den Übungen zuerst Ihre Überlegungen und überprüfen Sie erst danach die Lösung durch einen linken Mausklick. Erstbenutzer folgen am besten dem Lernprogramm. Sie können aber auch durch Anklicken der Überschriften im Inhaltsverzeichnis direkt zu den einzelnen Kapiteln gelangen. Prof. Dr. Ivo C. Ivanov
3 Inhaltsverzeichnis. Einleitung. Gesättigte Kohlenwasserstoffe (KW): Alkane. Ungesättigte Kohlenwasserstoffe: Alkene und Alkine. Aromatische KW. Funktionelle Gruppen: Grundlagen. Halogenderivate 7. Alkohole 8. Phenole 9. Ether 0. Aldehyde und Ketone. Carbonsäuren. Ester. Amine. Organische Schwefelverbindungen. Mehrfunktionelle Verbindungen Prof. Dr. Ivo C. Ivanov
4 . Einleitung In der Frühzeit der organischen Chemie waren nur relativ wenige Stoffe bekannt, die meist mehr oder weniger willkürlich benannt wurden. Viele dieser Trivialnamen wie Harnstoff, Glycerin oder Milchsäure sind auch heute noch im Gebrauch und können nur gelernt werden. Mit der wachsenden Zahl bekannter organischer Verbindungen wurde eine systematisch aufgebaute Nomenklatur dringend nötig. Bis heute wuchs die Zahl organischer Verbindungen auf über zwölf Millionen. 89 wurden bei einem Kongress in Genf erstmals verbindliche Regeln für die Benennung organischer Verbindungen aufgestellt. Diese Genfer Nomenklatur wurde seither mehrfach ergänzt und insbesondere von der International Union of Pure and Applied Chemistry (IUPAC) weiter entwickelt. Im Fach Chemie wird nur noch die IUPAC-Nomenklatur verwendet. Im Chemieunterricht sollte deshalb von Anfang an die IUPAC-Nomenklatur konsequent eingeübt werden. Prof. Dr. Ivo C. Ivanov
5 Grundzüge der IUPAC-Nomenklatur Substitutiv bringt zum Ausdruck, dass ein H-Atom substituiert wird. Radikofunktionell bedeutet, dass die Stammverbindung als Radikal (Alkylrest) fungiert. Es stehen drei rationelle Benennungsmöglichkeiten zur Verfügung: Zwei durch die substitutive und eine durch die radikofunktionelle Nomenklatur. Die drei Möglichkeiten sollen am Beispiel eines Moleküls miteiner OH-Gruppe erläutert werden. Prof. Dr. Ivo C. Ivanov
6 . Gesättigte KW: Grundlagen. Die längste Kohlenstoffkette wird wie ein Alkan bezeichnet und bestimmt den Stammnamen.. Vor diesen Namen setzt man die Bezeichnung der Seitenketten (Methyl-, Ethyl-, Propyl- usw.). Gleiche Seitenketten werden durch griech. bzw. lat. Zahlwörter (di-, tri-, tetra-, penta- usw.) zusammengefasst. Verschiedene Seitenketten werden alphabetisch angeordnet.. Die C-Atome der Hauptkette werden so durchnummeriert, dass die Verzweigungsstellen möglichst kleine Zahlen erhalten. Diese Zahlen werden den Namen der Seitenketten vorangestellt.. Cyclische Verbindungen (Ringverbindungen) erhalten die Vorsilbe Cyclo-. Prof. Dr. Ivo C. Ivanov
7 Gesättigte KW Homologe Reihe der Alkane C n H n+ Alkylgruppen (Seitenketten) Methan Hexan C H Ethan C H Heptan C 7 H Methyl- - Ethyl- - - (-C H ) Propan C H 8 Octan C 8 H 8 Butan C H 0 Nonan C 9 H 0 Pentan C H Decan C 0 H Die Glieder unterscheiden sich durch eine Methylengruppe - - Propyl (-C H 7 ) Isopropyl H C-- Isobutyl ( ) - - Zahlwörter: = mono; = di; = tri; = tetra; = penta; = hexa; 7 = hepta; 8 =octa; 9 = nona; 0 = deca; = undeca; = dodeca; = hexadeca; 8 = octadeca; 0 = eicosa. Prof. Dr. Ivo C. Ivanov 7
8 Beispiele Benennen wir die folgenden Verbindungen nach den IUPAC-Regeln: H C -Methylhexan H C H C -Ethyl--methylhexan C H H C C,,-Trimethylpentan H C C C H H C C H C -Ethyl-,-dimethylheptan C H C 7 Prof. Dr. Ivo C. Ivanov 8
9 . Gesättigte KW: Übung Erstellen Sie die Strukturformel für folgende Verbindungen:,,-Trimethylbutan H C C,-Diethyl-,-dimethyloctan C H C 7 8 Cyclohexan H C H C Propylcyclohexan H C H C H C Prof. Dr. Ivo C. Ivanov 9
10 Gesättigte KW: Übung Welche(r) der folgenden Namen sind (ist) richtig? Geben Sie gegebenenfalls den richtigen Namen an. -Ethyl-,-dimethylbutan falsch! C H richtig ist:,-dimethylhexan,-dimethyl--propylhexan falsch! richtig ist: -Ethyl-,-dimethylheptan H C C 7 -Ethyl-,-dimethylheptan richtig! H C C 7 Prof. Dr. Ivo C. Ivanov 0
11 . Gesättigte KW: Übung Verzweigte Seitenketten werden in runden Klammern angegeben. Hier bestimmt das griech. Zahlwort die alphabetische Einordnung. Die Nummerierung der verzweigten Seitenkette beginnt mit dem C- Atom, das an die Hauptkette gebunden ist. Welche Strukturformel muss nach dieser Regel die Verbindung 7-(,-Dimethylbutyl)--ethyltridecan haben? H C 7 8 C H C H 9 Benennen Sie die folgende Verbindung: H C 0 H C H C 7-(,-Dimethylbutyl)--ethyldodecan Prof. Dr. Ivo C. Ivanov
12 . Ungesättigte KW: Grundlagen. Verbindungen mit einer Doppelbindung (Alkene) erhalten die Endung en, mit zwei Doppelbindungen die Endung dien usw.. Verbindungen mit einer Dreifachbindung (Alkine) erhalten die Endung in, mit zwei Dreifachbindungen die Endung -diin usw.. Die Hauptkette muss die Mehrfachbindung enthalten, die möglichst am Kettenanfang liegen soll. Eine Zahl vor der Endung -en bzw. in gibt den Ausgangspunkt der Doppelbindung an.. Bei Verbindungen mit Doppel- und Dreifachbindungen erhält die Doppelbindung die niedrigste Nummer. Prof. Dr. Ivo C. Ivanov
13 Ungesättigte KW: Homologe Reihe der Alkene C n H n Ethen C H H C= Propen C H H C=- But--en C H 8 H C=- - usw. Homologe Reihe der Alkine C n H n- Ethin C H HC Propin C H HC C- But--in C H HC C- - usw. Alkenylreste Ethenyl- (Vinyl-) H C=- Methin- =- Alkinylreste Ethinyl- HC C- Prof. Dr. Ivo C. Ivanov
14 Ungesättigte KW: Benennen wir folgende Verbindungen nach den IUPAC-Regeln: H C HC C H C But--en oder -Buten -Methylbut--in -Methyl--butin Buta-,-dien bzw.,-butadien H C C Pent--en--in bzw. -Penten--in H C C C -Methylhex--en--in C H C Hexa-,-dien--in,-Hexadien--in Prof. Dr. Ivo C. Ivanov
15 Ungesättigte KW: Benennen wir folgende Verbindungen nach den IUPAC-Regeln: HC Cyclopenten H C C,-Dimethylcyclopenten H C C HC Cyclohexa-,-dien HC H C H C HC HC -Ethylcyclobuten HC HC Prof. Dr. Ivo C. Ivanov
16 Ungesättigte KW:,-Dimethylocta-,7-dien H C C 7 8 -Ethyl-,9,9-trimethyldeca-,,7-trien H C C 0 9 C 8 7 Prof. Dr. Ivo C. Ivanov
17 . Aromatische KW: Grundlagen Grundkörper der meisten aromatischen Verbindungen ist das Benzol C H : Mesomerie-Modell hypothetische Grenzformeln oder Phenylgruppe: -C H R R R R Es gibt beim Benzol drei Disubstitutionsprodukte mit den Stellungen: ortho- (o-) meta- (m-) para- (p-) R R Wichtige Derivate des Benzols. Am gebräuchlichsten sind hier die Trivialnamen! OH NH O COOH SO H = Phenol Anilin Toluol Benzaldehyd Benzoesäure Benzolsulfon- Styrol Benzol-ol Phenylamin Methylbenzol Phenylmethanal Benzolcarbonsäure säure Ethenylbenzol Aminobenzol Vinylbenzol Prof. Dr. Ivo C. Ivanov 7
18 . Aromatische KW: Grundlagen Ist an einem cyclischen Kohlenwasserstoff wie dem Benzolkern eine Seitenkette gebunden, so ergibt sich die Möglichkeit, den Stammnamen von der Seitenkette oder vom cyclischen Kohlenwasserstoff abzuleiten: H C Abgeleitet vom Ethan: Phenylethan oder abgeleitet vom Benzol: Ethylbenzol? Kriterien für eine Entscheidung zwischen den beiden Alternativen sind: Die größere, entscheidendere Struktureinheit bestimmt den Namen. Die Struktureinheit mit den meisten Substituenten bestimmt den Namen. Im obigen Beispiel müsste man sich für den Namen Ethylbenzol entscheiden! Hier leitet man den Namen vom Methan ab, da dieses drei Substituenten (Phenyl-Gruppen) trägt. Der systematische Name lautet hier also: Triphenylmethan! Prof. Dr. Ivo C. Ivanov 8
19 Aromatische KW: Es gibt drei isomere Dimethylbenzole mit den Trivialnamen ortho-xylol, meta-xylol und para-xylol. Erstellen Sie die Strukturformeln der drei Isomere und geben Sie den IUPAC- Namen an. ortho-dimethylbenzol meta-dimethylbenzol para-dimethylbenzol o- Dimethylbenzol m-dimethylbenzol p-dimethylbenzol,-dimethylbenzol,-dimethylbenzol,-dimethylbenzol Prof. Dr. Ivo C. Ivanov 9
20 . Aromatische KW: Wie viele Tri- und Tetramethylbenzole gibt es? H C Es gibt drei Trisubstitutionsprodukte,,- Trimethylbenzol,,-Trimethylbenzol,,-Trimethylbenzol H C H C Es gibt auch drei Tetrasubstitutionsprodukte,,,-Tetramethylbenzol,,,-Tetramethylbenzol,,,-Tetramethylbenzol Prof. Dr. Ivo C. Ivanov 0
21 Erstellen Sie die Strukturformeln von: -Ethyl--methylbenzol. Aromatische KW: H C Unterschiedliche Substituenten werden in alphabetischer Reihenfolge angegeben! Ethenylbenzol (Vinylbenzol, Styrol) HC -Phenyloctadecan H C ( ) Erstellen Sie die Namen folgender Verbindungen: ( ),-Diphenylhexan Abgeleitet vom Hexan! H C Isopropylbenzol Abgeleitet vom Benzol! Siehe Aromatische KW: Grundlagen! Prof. Dr. Ivo C. Ivanov
22 . Aromatische KW: Kondensierte Aromate enthalten mehrere Benzolringe. Die Moleküle von Naphthalin, Anthracen und Benzpyren setzen sich aus zwei, drei und fünf Benzol-Ringen zusammen. Ihre π-elektronen sind dabei über das gesamte Kohlenstoff-Gerüst delokalisiert. Ergänzen Sie in den dargestellten Grundgerüsten die restlichen π-elektronen Naphthalin Anthracen,-Benzpyren 0 π-elektronen π-elektronen 0 π-elektronen Ausgangsstoff für Farbstoffe Ausgangsstoff für Farbstoffe Kanzerogen wirkender Bestandteil im Zigarettenrauch Prof. Dr. Ivo C. Ivanov
23 Stoffklasse. Funktionelle Gruppen: Grundlagen funktionelle Gruppe Alkene Doppelbindung >C=C< Alkine Dreifachbindung -C C- Halogenkohlenwasserstoffe Halogenatome -F; -Cl; -Br; -I Alkohole Hydroxy-Gruppe -OH Thiole Mercapto-Gruppe -SH (Thiol-Gruppe) Aldehyde Aldehyd-Gruppe -O Ketone Keto-Gruppe >C=O (Carbonyl-Gruppe) Carbonsäuren Carboxy-Gruppe -COOH Ester Esterbindung Ether Oxy-Gruppe -O- Amine Amino-Gruppe -NH -C(=O)O- Nitroverbindungen Nitro-Gruppe -NO Sulfonsäure Sulfonsäure-Gruppe SO H Isocyanate Isocyanat-Gruppe -NCO Prof. Dr. Ivo C. Ivanov
24 . Funktionelle Gruppen: Grundlagen Benennung von Verbindungen mit funktionellen Gruppen:. Man sucht die längste C-Kette im Molekül, welche die funktionelle Gruppe enthält. Die C-Atome werden derart nummeriert, dass die funktionelle Gruppe eine möglichst niedrige Zahl erhält.. Die funktionellen Gruppen werden in der Regel durch die Endung des Namens charakterisiert: -en (Doppelbindung), -in (Dreifachbindung), -ol (Hydroxy- Gruppe), -al (Aldehyd-Gruppe), -on (Keto-Gruppe), -säure (Carboxy-Gruppe), -ester (Ester-Gruppe), ether (Oxy- Gruppe), -amin (Amino-Gruppe).. Gleiche funktionelle Gruppen werden durch griech. bzw. lat. Zahlwörter (di-, tri-, tetra-, usw.) zusammengefasst. Prof. Dr. Ivo C. Ivanov
25 . Funktionelle Gruppen:. Die Stellungen der funktionellen Gruppen werden durch Zahlen vor den Endungen en, -in, -ol usw. angegeben. (Notiz: Der Vokal a am Ende eines Zahlwortes wird weggelassen, wenn die nachfolgende Endung mit einem Vokal beginnt.) Ausnahmen: Die Halogenatome und die Nitro-Gruppe (-NO ) werden wie Seitenglieder behandelt. Prof. Dr. Ivo C. Ivanov
26 . Halogenderivate: Grundlagen Die IUPAC-Regeln empfehlen hier ausschließlich Substitutionsnamen. Beispiel: H C-Br Brommethan; hier kommt zum Ausdruck, dass ein H-Atom des Methans durch ein Br-Atom ersetzt wurde. Der radikofunktionelle Name Methylbromid für obige Verbindung ist nicht empfehlenswert, da die Endung -id bereits für Anionen (z.b. Chlorid-Ion) reserviert ist. Prof. Dr. Ivo C. Ivanov
27 . Halogenderivate: Benennen Sie die folgenden Verbindungen: Cl Trichlormethan H C Cl (Chloroform) Cl Vergleichen Sie:,-Dibrom--ethylbenzol mit (,-Dibromethyl)benzol Br -Brom--methylbenzol od. -Bromtoluol Br-Atome am arom. Ring! H C Br Br Br Br Br-Atome an der Seitenkette! Vom,-Dichlorethen gibt es zwei Stereoisomere (cis- bzw. Z und trans- bzw.e)! Geben Sie die Strukturformeln und die Namen der beiden Isomere an: H Cl C C H Cl (Z)-,-Dichlorethen (E)-,-Dichlorethen H Cl C C Prof. Dr. Ivo C. Ivanov 7 Cl H
28 Halogenderivate: Zum Schluß - für Könner: Das Kontaktinsektizid DDT dringt bei Berührung in den Insektenkörper ein und wirkt bereits in geringsten Mengen tödlich. Es hat den IUPAC-Namen:,-Bis-(-chlorphenyl)-,,-trichlorethan. Versuchen Sie, die Strukturformel zu erstellen. Hinweis: Sind Seitengruppen (hier -chlorphenyl-) vorhanden, deren Namen bereits ein Zahlwort enthalten, so ist deren Anzahl durch die Vorsilbe bis-, tris- usw. anzugeben. H Cl C Cl Cl C Cl Cl Die Bezeichnung DDT leitet sich von einer alten Bezeichnung ab:,-(,-dichlordiphenyl)-,,-trichlor-ethan Prof. Dr. Ivo C. Ivanov 8
29 Ende Prof. Dr. Ivo C. Ivanov 9
IUPAC muss das denn sein?
 IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
IUPAC muss das denn sein?
 IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
IUPAC-Nomenklaturregeln als Grundlage für Q11 Chemie
 Nomenklatur 1 IUPA-Nomenklaturregeln als Grundlage für Q11 hemie 1 Kohlenwasserstoffe und Derivate 1.1 Regeln zur Benennung von unverzweigten Alkanen (n-alkane) Der Name der n-alkane enthält die folgenden
Nomenklatur 1 IUPA-Nomenklaturregeln als Grundlage für Q11 hemie 1 Kohlenwasserstoffe und Derivate 1.1 Regeln zur Benennung von unverzweigten Alkanen (n-alkane) Der Name der n-alkane enthält die folgenden
IUPAC muss das denn sein?
 IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
Organik KOMPAKT Organik Blatt 1/5
 rganik KMPAKT rganik Blatt 1/5 1 Elemente in organischen Verbindungen Kohlenstoff () Sauerstoff () Wasserstoff () Stickstoff (N) Phosphor (P) Schwefel (S) Kohlenstoff kommt immer in organischen Verbindungen
rganik KMPAKT rganik Blatt 1/5 1 Elemente in organischen Verbindungen Kohlenstoff () Sauerstoff () Wasserstoff () Stickstoff (N) Phosphor (P) Schwefel (S) Kohlenstoff kommt immer in organischen Verbindungen
Übungen zur Nomenklatur: Zeichne die Formeln auf ein leeres kariertes Blatt und benenne die einzelnen Formeln.
 Übungen zur Nomenklatur: Zeichne die Formeln auf ein leeres kariertes Blatt und benenne die einzelnen Formeln. Einfache Formeln, Verzweigungen, längste Kette, Nummerierung Nr Formel Name A1 Propan 3 2
Übungen zur Nomenklatur: Zeichne die Formeln auf ein leeres kariertes Blatt und benenne die einzelnen Formeln. Einfache Formeln, Verzweigungen, längste Kette, Nummerierung Nr Formel Name A1 Propan 3 2
IUPAC Nomenklatur. Der Name eines Moleküls wird in 4 Felder aufgeteilt: Feld 1: Name und Position von Substituenten. Feld 2: Stammname der Verbindung
 Der Name eines Moleküls wird in 4 Felder aufgeteilt: Feld 1: Name und Position von Substituenten Feld 2: Stammname der Verbindung Feld 3: Grad der Ungesättigtheit Feld 4: funktionelle Gruppe mit höchster
Der Name eines Moleküls wird in 4 Felder aufgeteilt: Feld 1: Name und Position von Substituenten Feld 2: Stammname der Verbindung Feld 3: Grad der Ungesättigtheit Feld 4: funktionelle Gruppe mit höchster
Systematische Nomenklatur
 Systematische Nomenklatur Je größer eine chemische Verbindung wird, desto komplizierter wird in der Regel deren Struktur, und desto schwieriger wird es, diese Verbindung eindeutig zu benennen. Dieses Problem
Systematische Nomenklatur Je größer eine chemische Verbindung wird, desto komplizierter wird in der Regel deren Struktur, und desto schwieriger wird es, diese Verbindung eindeutig zu benennen. Dieses Problem
IUPAC Nomenklatur. Der Name eines Moleküls wird in 3 Felder aufgeteilt: Feld 1: Name und Position von Substituenten (Präfixe)
 Der Name eines Moleküls wird in 3 Felder aufgeteilt: Feld 1: Name und Position von Substituenten (Präfixe) Feld 2: Stammkern der Verbindung Feld 3: funktionelle Gruppe mit höchster Priorität (Suffix) Substituenten/
Der Name eines Moleküls wird in 3 Felder aufgeteilt: Feld 1: Name und Position von Substituenten (Präfixe) Feld 2: Stammkern der Verbindung Feld 3: funktionelle Gruppe mit höchster Priorität (Suffix) Substituenten/
EINFÜHRUNG IN DIE ORGANISCHE CHEMIE
 rganische Chemie Lehrgang CEMIE FÜR BILGIELERKRÄFTE EINFÜRUNG IN DIE RGANISCE CEMIE 1) DEFINITINEN Die C beschäftigt sich mit Molekülen, die ein Kohlenstoffgerüst haben. Die Fähigkeit des Kohlenstoffs
rganische Chemie Lehrgang CEMIE FÜR BILGIELERKRÄFTE EINFÜRUNG IN DIE RGANISCE CEMIE 1) DEFINITINEN Die C beschäftigt sich mit Molekülen, die ein Kohlenstoffgerüst haben. Die Fähigkeit des Kohlenstoffs
Z 8 EINFÜHRUNG IN DIE ORGANISCHE CHEMIE 1) DEFINITIONEN 2) ELEMENTE UND BINDUNGEN. Organische Chemie. Kunstoffe. Farbstoffe
 EINFÜRUNG IN DIE RGANISCE CEMIE 1) DEFINITINEN Die C beschäftigt sich mit Molekülen, die ein Kohlenstoffgerüst haben. Die Fähigkeit des Kohlenstoffs Einfach-, Zweifach- und Dreifachbindungen (mit seinen
EINFÜRUNG IN DIE RGANISCE CEMIE 1) DEFINITINEN Die C beschäftigt sich mit Molekülen, die ein Kohlenstoffgerüst haben. Die Fähigkeit des Kohlenstoffs Einfach-, Zweifach- und Dreifachbindungen (mit seinen
I. Alkane Homologe Reihe, Nomenklatur
 Organische Chemie Grundkurs (11. Klasse) Theorie und Übungen I. Alkane omologe Reihe, Nomenklatur omologe Reihe der Alkane Aufgabe: Setzen Sie die Tabelle fort Name Summenformel Struktur Rest Methan C
Organische Chemie Grundkurs (11. Klasse) Theorie und Übungen I. Alkane omologe Reihe, Nomenklatur omologe Reihe der Alkane Aufgabe: Setzen Sie die Tabelle fort Name Summenformel Struktur Rest Methan C
Skript zur Vorlesung Organische Chemie (Prof. M. Albrecht) an der RWTH Aachen
 Skript zur Vorlesung rganische hemie (Prof. M. Albrecht) an der WT Aachen Erstellt von: Michael Müller Erstellungsdatum: 23.01.2004 e-mail: michael.mueller@rwth-aachen.de Nomenklatur und Isomerie organischer
Skript zur Vorlesung rganische hemie (Prof. M. Albrecht) an der WT Aachen Erstellt von: Michael Müller Erstellungsdatum: 23.01.2004 e-mail: michael.mueller@rwth-aachen.de Nomenklatur und Isomerie organischer
Systematische Nomenklatur
 Systematische Nomenklatur IUPAC-Nomenklatur Alle Verbindungen sind Derivate der längsten im Molekül vorkommenden Kohlenstoff-Kette. Von der Kette abzweigende Gruppen werden als Vorsilben angefügt. Die
Systematische Nomenklatur IUPAC-Nomenklatur Alle Verbindungen sind Derivate der längsten im Molekül vorkommenden Kohlenstoff-Kette. Von der Kette abzweigende Gruppen werden als Vorsilben angefügt. Die
Organische Chemie. Einstieg. Chemie-Formeldarstellungen. Formeldarstellungen der Chemie: Bei Ionenverbindungen: Verhältnisformeln. , AlF 3. etc.
 Organische Chemie Einstieg Chemie-Formeldarstellungen Formeldarstellungen der Chemie: Textuelle Darstellungen: Bei Ionenverbindungen: Verhältnisformeln Bsp: NaCl; CaBr 2, AlF 3 etc. Bei Molekülverbindungen:
Organische Chemie Einstieg Chemie-Formeldarstellungen Formeldarstellungen der Chemie: Textuelle Darstellungen: Bei Ionenverbindungen: Verhältnisformeln Bsp: NaCl; CaBr 2, AlF 3 etc. Bei Molekülverbindungen:
Chemie für Biologen, a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride?
 Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
Organische Chemie. 3. Semester, SWS: V-3, Ü-1, P-3; insgesamt: V-45, Ü-15, P-45; ECTS 8. Lehrstuhl für Organische Chemie
 Organische Chemie 3. Semester, SWS: V-3, Ü-1, P-3; insgesamt: V-45, Ü-15, P-45; ECTS 8 Lehrstuhl für Organische Chemie (ivanov43@gmail.com) Prof. Dr. Ivo C. Ivanov 1 1. Gegenstand der Organischen Chemie,
Organische Chemie 3. Semester, SWS: V-3, Ü-1, P-3; insgesamt: V-45, Ü-15, P-45; ECTS 8 Lehrstuhl für Organische Chemie (ivanov43@gmail.com) Prof. Dr. Ivo C. Ivanov 1 1. Gegenstand der Organischen Chemie,
Kohlenwasserstoffe. Alkane. Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind.
 2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
Alkane. Name: Summenformel: vereinfachte Formel: Zustand: Methan CH 4 CH 4 g (gaseous) Ethan C 2 H 6 CH 3 CH 3 g. Propan C 3 H 8 CH 3 CH 2 CH 3 g
 Alkane Name: Summenformel: vereinfachte Formel: Zustand: Methan C 4 C 4 g (gaseous) Ethan C 2 6 C 3 C 3 g Propan C 3 8 C 3 C 2 C 3 g Butan C 4 10 C 3 C 2 C 2 C 3 g Pentan C 5 12 C 3 C 2 C 2 C 2 C 3 l (liquid)
Alkane Name: Summenformel: vereinfachte Formel: Zustand: Methan C 4 C 4 g (gaseous) Ethan C 2 6 C 3 C 3 g Propan C 3 8 C 3 C 2 C 3 g Butan C 4 10 C 3 C 2 C 2 C 3 g Pentan C 5 12 C 3 C 2 C 2 C 2 C 3 l (liquid)
Ein Alkan, dem ein H-Atom fehlt, wird Alkyl-Rest genannt. Der Name ergibt sich aus dem Alkan, jedoch mit der Endung yl:
 Organische Chemie Unter organischer Chemie versteht man die Chemie der Kohlenwasserstoffe und ihre Derivate. Die C- Atome verbinden sich durch Kovalentebindung (Einfach-, Doppel- und Dreifachbindungen)
Organische Chemie Unter organischer Chemie versteht man die Chemie der Kohlenwasserstoffe und ihre Derivate. Die C- Atome verbinden sich durch Kovalentebindung (Einfach-, Doppel- und Dreifachbindungen)
Organische Chemie 10C1. Funktionelle Gruppen 10C2. Homologe Reihe der Alkane 10C3. Nomenklatur der Alkane (gesättigte Kohlenwasserstoffe) 10C4
 Organische Chemie 10C1 Chemie der Kohlenstoffverbindungen (C und v.a. H, N, O, S) C-Atome immer vierbindig Funktionelle Gruppen 10C2 Alkan: nur Einfachbindungen Alken: mindestens eine Doppelbindung Alkin:
Organische Chemie 10C1 Chemie der Kohlenstoffverbindungen (C und v.a. H, N, O, S) C-Atome immer vierbindig Funktionelle Gruppen 10C2 Alkan: nur Einfachbindungen Alken: mindestens eine Doppelbindung Alkin:
wir-sind-klasse.jimdo.com
 Alkane Alkane sind kettenförmige Kohlenwasserstoffe, deren Atome im Molekül durch Einfachbindungen miteinander verknüpft sind. Sie bilden eine homologe Reihe. Ihre allgemeine Summenformel lautet: C n H
Alkane Alkane sind kettenförmige Kohlenwasserstoffe, deren Atome im Molekül durch Einfachbindungen miteinander verknüpft sind. Sie bilden eine homologe Reihe. Ihre allgemeine Summenformel lautet: C n H
 INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 Säuren und Basen der organischen Chemie 5 3.2 Chemische Reaktionstypen 15 3.3 Stereochemie 39 3.4 Alkane, Cycloalkane
INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 Säuren und Basen der organischen Chemie 5 3.2 Chemische Reaktionstypen 15 3.3 Stereochemie 39 3.4 Alkane, Cycloalkane
Fragen zum Thema funktionelle Gruppen Alkohol und Phenol
 1. Was sind Derivate? 2. Was sind Substituenten? 3. Wann werden neu angehängte Atome oder Gruppen als Substituent bezeichnet? 4. Warum sind Substituenten so wichtig für organische Verbindungen? Alkohol
1. Was sind Derivate? 2. Was sind Substituenten? 3. Wann werden neu angehängte Atome oder Gruppen als Substituent bezeichnet? 4. Warum sind Substituenten so wichtig für organische Verbindungen? Alkohol
VII INHALTSVERZEICHNIS
 VII INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 3.2 Chemische Reaktionstypen 12 3.3 Stereochemie 30 3.4 Alkane, Cycloalkane 46 3.5 Alkene, Alkine 47 3.6 Aromatische
VII INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 3.2 Chemische Reaktionstypen 12 3.3 Stereochemie 30 3.4 Alkane, Cycloalkane 46 3.5 Alkene, Alkine 47 3.6 Aromatische
Alkane. homologe Reihe. homologe Reihe der Alkane Nomenklatur. Isomerie. Gesättigte, kettenförmige Kohlenwasserstoffe
 Gesättigte, kettenförmige Kohlenwasserstoffe Alkane gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane : n 2n+2 (n N) Alle Alkane erhalten
Gesättigte, kettenförmige Kohlenwasserstoffe Alkane gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane : n 2n+2 (n N) Alle Alkane erhalten
Einführung in die Organische Chemie. Benjamin Grimm
 Einführung in die Organische Chemie Benjamin Grimm Gliederung Einführung: Begriff der organischen Chemie Synthese organischer Stoffe: Cracken von Erdöl Organische Stoffklassen Isomerie Orbitalmodell: Hybridisierung
Einführung in die Organische Chemie Benjamin Grimm Gliederung Einführung: Begriff der organischen Chemie Synthese organischer Stoffe: Cracken von Erdöl Organische Stoffklassen Isomerie Orbitalmodell: Hybridisierung
Einführung in die Nomenklatur der organischen Chemie. Einteilung der Kohlenwasserstoffe
 organischen hemie Klasse 8 Einteilung der Kohlenwasserstoffe Alkane Alkene Alkine Kettenverbindungen Organische hemie socyclen ycloalkane ycloalkene ycloalkine Aromate Ringverbindungen eterocyclen Fünfringe
organischen hemie Klasse 8 Einteilung der Kohlenwasserstoffe Alkane Alkene Alkine Kettenverbindungen Organische hemie socyclen ycloalkane ycloalkene ycloalkine Aromate Ringverbindungen eterocyclen Fünfringe
Organische Chemie. Kohlenstoff. Kohlenstoffkreislauf. Erdölverarbeitung. Kohlenwasserstoffe
 rganische hemie Teilgebiet der hemie, welches sich mit Aufbau, erstellung und Eigenschaften der Verbindungen des Kohlenstoffs beschäftigt. NTG 10.1 Kohlenstoff - 4. auptgruppe 4 Valenzelektronen 4 Bindungen
rganische hemie Teilgebiet der hemie, welches sich mit Aufbau, erstellung und Eigenschaften der Verbindungen des Kohlenstoffs beschäftigt. NTG 10.1 Kohlenstoff - 4. auptgruppe 4 Valenzelektronen 4 Bindungen
Butanol Butanal Butansäure
 Wiederholungsthema: Gesättigte Kohlenwasserstoffe (Alkane) Zusammenfassung: Gesättigte Kohlenwasserstoffe bestehen aus Ketten aus mit einander vernüpften Kohlenstoff-Atomen, an die die maximal mögliche
Wiederholungsthema: Gesättigte Kohlenwasserstoffe (Alkane) Zusammenfassung: Gesättigte Kohlenwasserstoffe bestehen aus Ketten aus mit einander vernüpften Kohlenstoff-Atomen, an die die maximal mögliche
Bundesrealgymnasium Imst. Chemie Klasse 8. Aliphate
 Bundesrealgymnasium Imst Chemie 2010-11 Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter aufgearbeitet
Bundesrealgymnasium Imst Chemie 2010-11 Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter aufgearbeitet
Kohlenstoffverbindungen
 Kohlenstoffverbindungen Zusammenfassung Im 19. Jahrhundert begann man die Zusammensetzung von Naturstoffen zu untersuchen. Dieser Zweig der hemie wird Organische hemie genannt. Ursprünglich glaubte man,
Kohlenstoffverbindungen Zusammenfassung Im 19. Jahrhundert begann man die Zusammensetzung von Naturstoffen zu untersuchen. Dieser Zweig der hemie wird Organische hemie genannt. Ursprünglich glaubte man,
Kennsilbe. -an. -en -in. -yl. -ol. -al (VI) -on. (VII) -säure (VIII)
 Hinweise und Übungen zur Nomenklatur (Benennung) organischer Verbindungen Die Vielfalt organischer Verbindungen ist im Gegensatz zur anorganischen hemie durch wenige Elemente aber zahlreiche Strukturmöglichkeiten
Hinweise und Übungen zur Nomenklatur (Benennung) organischer Verbindungen Die Vielfalt organischer Verbindungen ist im Gegensatz zur anorganischen hemie durch wenige Elemente aber zahlreiche Strukturmöglichkeiten
n Pentan 2- Methylbutan 2,2, dimethylpropan ( Wasserstoffatome sind nicht berücksichtigt )
 Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Nomenklatur. 2. Nummerierung der Kette dergestalt, dass die Substituenten möglichst niedrige Ziffern bekommen. 3,3,4,4-Tetramethylheptan
 Nomenklatur Alkane. Ermittle die längte Kohlenstoffkette Stammname 8 8 8 -Methyloctan -Ethyloctan -Propyloctan. Nummerierung der Kette dergestalt, dass die Substituenten möglichst niedrige Ziffern bekommen
Nomenklatur Alkane. Ermittle die längte Kohlenstoffkette Stammname 8 8 8 -Methyloctan -Ethyloctan -Propyloctan. Nummerierung der Kette dergestalt, dass die Substituenten möglichst niedrige Ziffern bekommen
Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1. Grundwissen 10.Klasse NTG 2 Grundwissen 10.Klasse NTG 2
 Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1 Homologe Reihe: Reihe von Kohlenwasserstoffen, bei der jedes Molekül eine CH 2 -Gruppe mehr enthält als das vorhergehende. Gesättigte Kohlenwasserstoffe
Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1 Homologe Reihe: Reihe von Kohlenwasserstoffen, bei der jedes Molekül eine CH 2 -Gruppe mehr enthält als das vorhergehende. Gesättigte Kohlenwasserstoffe
KW Alkene. Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1
 KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
Aufgabe S. 2/a (6 Punkte) Zeichnen Sie die Strukturformeln der folgenden Verbindungen! 3-Ethylheptan-2-on
 15-2 2 Aufgabe S. 2/a (6 Punkte) Zeichnen Sie die Strukturformeln der folgenden Verbindungen! Pyridin Acetylchlorid p-xylol 3-Ethylheptan-2-on Glycol Ölsäure Aufgabe S. 2/b (6 Punkte) Zeichnen Sie jeweils
15-2 2 Aufgabe S. 2/a (6 Punkte) Zeichnen Sie die Strukturformeln der folgenden Verbindungen! Pyridin Acetylchlorid p-xylol 3-Ethylheptan-2-on Glycol Ölsäure Aufgabe S. 2/b (6 Punkte) Zeichnen Sie jeweils
Aktuelle Beispiele aus der Forschung
 Vorlesung: Allgemeine Chemie Organische Chemie 05.12.; 08.12.; Prof. Dr. C. Meier Eine Einführung in die Organische Chemie Themen: Elektronenstruktur, kovalente Bindung, Säure-Basen-Eigenschaften in Abhängigkeit
Vorlesung: Allgemeine Chemie Organische Chemie 05.12.; 08.12.; Prof. Dr. C. Meier Eine Einführung in die Organische Chemie Themen: Elektronenstruktur, kovalente Bindung, Säure-Basen-Eigenschaften in Abhängigkeit
Übungsbeispiele Kapitel Organische Verbindungen
 Übungsbeispiele 26. 1. 2016 Kapitel rganische Verbindungen 10) (9 Punkte) Schreiben Sie Valenzstrichformeln für folgende Substanzen: 3-Methyl-1-hepten, 2E-Nonen-4,5-diol-6-on, 2,3-Dihydroxybutandisäure,
Übungsbeispiele 26. 1. 2016 Kapitel rganische Verbindungen 10) (9 Punkte) Schreiben Sie Valenzstrichformeln für folgende Substanzen: 3-Methyl-1-hepten, 2E-Nonen-4,5-diol-6-on, 2,3-Dihydroxybutandisäure,
Grundwissen Chemie Jahrgangsstufe 10 (NTG)
 Grundwissen Chemie Jahrgangsstufe 10 (NTG) Die organische Chemie ist die Chemie des Kohlenstoffs und seiner Verbindungen. Kohlenstoffkreislauf ATMSPHÄE (C 2 ) BISPHÄE (Lebewesen) LITHSPHÄE HYDSPHÄE (Gesteine)
Grundwissen Chemie Jahrgangsstufe 10 (NTG) Die organische Chemie ist die Chemie des Kohlenstoffs und seiner Verbindungen. Kohlenstoffkreislauf ATMSPHÄE (C 2 ) BISPHÄE (Lebewesen) LITHSPHÄE HYDSPHÄE (Gesteine)
Summenformel. Strukturformel. Halbstrukturformel. Fossile Energieträger. ( 10. Klasse NTG 1 / 47 ) ( 10. Klasse NTG 2 / 47 ) ( 10. Klasse NTG 3 / 47 )
 Summenformel ( 10. Klasse NTG 1 / 47 ) Angabe der Atomsorten und deren Anzahl innerhalb eines Moleküls z.b. Ethanol C 2 6 O Strukturformel ( 10. Klasse NTG 2 / 47 ) Darstellung der bindenden und freien
Summenformel ( 10. Klasse NTG 1 / 47 ) Angabe der Atomsorten und deren Anzahl innerhalb eines Moleküls z.b. Ethanol C 2 6 O Strukturformel ( 10. Klasse NTG 2 / 47 ) Darstellung der bindenden und freien
Grundlagen der organischen Chfemie
 Dr. sc. nat. Hans Rudolf Christen 'BHiGil.'liÜ ' \ Grundlagen der organischen Chfemie Verlag Sauerländer, Aarau Diesterweg Salle, Frankfurt am Main 9 Inhaltsverzeichnis Vorwort 7 I.Teil: Überblick über
Dr. sc. nat. Hans Rudolf Christen 'BHiGil.'liÜ ' \ Grundlagen der organischen Chfemie Verlag Sauerländer, Aarau Diesterweg Salle, Frankfurt am Main 9 Inhaltsverzeichnis Vorwort 7 I.Teil: Überblick über
Grundwissen der 10.Klasse NTG
 Grundwissen der 10.Klasse NTG 1. Kohlenwasserstoffe 1.1 Alkane 1.1.1 Organische Stoffe = Verbindungen, die Kohlenstoffatome enthalten Ausnahme: Kohlenstoffoxide, Kohlensäure, Carbonate 1.1.2 Kohlenwasserstoffe
Grundwissen der 10.Klasse NTG 1. Kohlenwasserstoffe 1.1 Alkane 1.1.1 Organische Stoffe = Verbindungen, die Kohlenstoffatome enthalten Ausnahme: Kohlenstoffoxide, Kohlensäure, Carbonate 1.1.2 Kohlenwasserstoffe
Grundlagen der organischen Chemie: Gesättigte Kohlenwasserstoffe
 Grundlagen der organischen Chemie: Gesättigte Kohlenwasserstoffe Patrick Bucher 13. August 2011 Inhaltsverzeichnis 1 Einführung in die organische Chemie 1 1.1 Die Einteilung der organischen Verbindungen..................
Grundlagen der organischen Chemie: Gesättigte Kohlenwasserstoffe Patrick Bucher 13. August 2011 Inhaltsverzeichnis 1 Einführung in die organische Chemie 1 1.1 Die Einteilung der organischen Verbindungen..................
2. AUFBAU ORGANISCHER VERBINDUNGEN - ISOMERIEN
 2. AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybridisierungskonzepts verstehen und anschaulich darstellen (siehe
2. AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybridisierungskonzepts verstehen und anschaulich darstellen (siehe
Inhaltsverzeichnis. 3 Organische Chemie. Vorwort Chemische Bindung Chemische Reaktionstypen Bindungen...
 VII Inhaltsverzeichnis Vorwort... V 3 Organische Chemie 3.1 Chemische Bindung... 3 3.1.1 Orbitale, deren Hybridisierung und Überlappung....................... 3 3.1.2 Einfachbindungen... 12 3.1.3 Doppelbindungen...
VII Inhaltsverzeichnis Vorwort... V 3 Organische Chemie 3.1 Chemische Bindung... 3 3.1.1 Orbitale, deren Hybridisierung und Überlappung....................... 3 3.1.2 Einfachbindungen... 12 3.1.3 Doppelbindungen...
Beispielklausur Allgemeine Chemie II (Organische Chemie)
 Beispielklausur Allgemeine Chemie II (rganische Chemie) für Studierende mit Chemie als Nebenfach zum Üben 1. Zeichnen Sie für die folgenden Stoffklassen jeweils die Strukturformel einer dazu passenden
Beispielklausur Allgemeine Chemie II (rganische Chemie) für Studierende mit Chemie als Nebenfach zum Üben 1. Zeichnen Sie für die folgenden Stoffklassen jeweils die Strukturformel einer dazu passenden
Grundwissen Chemie Jahrgangsstufe 10, naturwissenschaftlicher Zweig. Methan Ethan Propan Butan Pentan Hexan Heptan Octan Nonan Decan
 Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
Auswahlverfahren Medizin Prüfungsgebiet Chemie. 5.Termin Organische Chemie
 Auswahlverfahren Medizin Prüfungsgebiet Chemie 5.Termin Organische Chemie Kursleiter Mag. Wolfgang Mittergradnegger IFS Kurs 2009 1 Merkmale organischer Verbindungen Verbindungen des Kohlenstoffs Ausnahmen:
Auswahlverfahren Medizin Prüfungsgebiet Chemie 5.Termin Organische Chemie Kursleiter Mag. Wolfgang Mittergradnegger IFS Kurs 2009 1 Merkmale organischer Verbindungen Verbindungen des Kohlenstoffs Ausnahmen:
Verzeichnis der Wortabkürzungen... Verzeichnis der Zeichen und Symbole...XVII
 VII Verzeichnis der Wortabkürzungen... XIII Verzeichnis der Zeichen und Symbole...XVII Organische Chemie 3.1 Chemische Bindung... 3 3.1.1 Orbitale, deren Hybridisierung und Überlappung... 3 3.1.2 Einfachbindungen...
VII Verzeichnis der Wortabkürzungen... XIII Verzeichnis der Zeichen und Symbole...XVII Organische Chemie 3.1 Chemische Bindung... 3 3.1.1 Orbitale, deren Hybridisierung und Überlappung... 3 3.1.2 Einfachbindungen...
10.1. Was versteht man unter einem Orbital? 10.2
 10.1 Was versteht man unter einem Orbital? Ein Orbital ist ein dreidimensionaler Aufenthaltsraum für maximal 2 Elektronen, in dem diese sich mit 99% Wahrscheinlichkeit aufhalten. Je nach Energiestufe ist
10.1 Was versteht man unter einem Orbital? Ein Orbital ist ein dreidimensionaler Aufenthaltsraum für maximal 2 Elektronen, in dem diese sich mit 99% Wahrscheinlichkeit aufhalten. Je nach Energiestufe ist
Organische Chemie. Kohlenwasserstoffe. Alkane. Alkane
 1 1 Organische Chemie beschäftigt sich mit Verbindungen, die C- Atome enthalten 2 2 Kohlenwasserstoffe bestehen ausschließlich aus C- und H- Atomen 3 3 es existieren nur C-H Einfachbindungen C-C Einfachbindung
1 1 Organische Chemie beschäftigt sich mit Verbindungen, die C- Atome enthalten 2 2 Kohlenwasserstoffe bestehen ausschließlich aus C- und H- Atomen 3 3 es existieren nur C-H Einfachbindungen C-C Einfachbindung
Chemie. Elektrochemie, Alkane und Alkene
 Zinkhalbzelle Mehr Zusammenfassungen von Malte Jakob findest du hier: hemie Elektrochemie, Alkane und Alkene Elektrochemie Galvanische Zelle: Anode Oxidation - e - e- e U - e - + Kathode Reduktion Zinkelektrode
Zinkhalbzelle Mehr Zusammenfassungen von Malte Jakob findest du hier: hemie Elektrochemie, Alkane und Alkene Elektrochemie Galvanische Zelle: Anode Oxidation - e - e- e U - e - + Kathode Reduktion Zinkelektrode
Drill&Practice: Alkene und Alkine
 Drill&Practice: Aufgaben und Lösungen, A. Dinter, KME 1 Drill&Practice: Alkene und Alkine 1. Orbitalzeichnungen sind sehr aufwändig. Zeichnen Sie in die folgenden Strukturen mit rot die π -Bindungen und
Drill&Practice: Aufgaben und Lösungen, A. Dinter, KME 1 Drill&Practice: Alkene und Alkine 1. Orbitalzeichnungen sind sehr aufwändig. Zeichnen Sie in die folgenden Strukturen mit rot die π -Bindungen und
Grundwissen Chemie 10. Klasse NTG
 Grundwissen Chemie 10. Klasse NTG Homologe Reihe der Alkane Methan, Ethan, Propan, Butan, Pentan, Hexan, Heptan, Octan, Nonan, Decan 10.1 C NTG Allg. Summenformel Alkane C n H 2n+2 (gesättigte Kohlenwasserstoffe,
Grundwissen Chemie 10. Klasse NTG Homologe Reihe der Alkane Methan, Ethan, Propan, Butan, Pentan, Hexan, Heptan, Octan, Nonan, Decan 10.1 C NTG Allg. Summenformel Alkane C n H 2n+2 (gesättigte Kohlenwasserstoffe,
Benennung (Nomenklatur) von Alkanen. zusammengestellt von W. Habelitz-Tkotz in Anlehnung an Galvani 3, Oldenbourg-Verlag, S.
 Benennung (Nomenklatur) von Alkanen zusammengestellt von W. abelitz-tkotz in Anlehnung an Galvani 3, Oldenbourg-Verlag, S. 34 + 35 istorische Entwicklung ursprünglich: Trivialnamen für viele Stoffe, z.
Benennung (Nomenklatur) von Alkanen zusammengestellt von W. abelitz-tkotz in Anlehnung an Galvani 3, Oldenbourg-Verlag, S. 34 + 35 istorische Entwicklung ursprünglich: Trivialnamen für viele Stoffe, z.
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Aufgabe S. 2/a (2 Punkte) Wodurch können Sie Cyclopenten von Benzol unterscheiden?
 14-1 2 Zur Punktevergabe bei multiple choice-aufgaben: Meist gibt es 5 Antwortmöglichkeiten, und 2 Punkte können pro Aufgabe erreicht werden. Pro falscher Antwort (Kreuz zu viel, aber auch fehlend) wird
14-1 2 Zur Punktevergabe bei multiple choice-aufgaben: Meist gibt es 5 Antwortmöglichkeiten, und 2 Punkte können pro Aufgabe erreicht werden. Pro falscher Antwort (Kreuz zu viel, aber auch fehlend) wird
Beschreiben Sie den Aufbau und die Eigenschaften der Kohlenwasserstoffe. Beschreiben Sie die Alkane allgemein.
 den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
Übungen zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe. 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit
 O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
Vorlesung 5. Alkane. Experimentalchemie, Prof. H. Mayr 20 Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. Anzahl C-Atome im n-alkan
 Vorlesung 5. Alkane Verbindungen aus Kohlenstoff und Wasserstoff, die nur Einfachbindungen enthalten, nennt man gesättigte Kohlenwasserstoffe. Sie sind ein auptbestandteil von Erdgas und Erdöl. Liegen
Vorlesung 5. Alkane Verbindungen aus Kohlenstoff und Wasserstoff, die nur Einfachbindungen enthalten, nennt man gesättigte Kohlenwasserstoffe. Sie sind ein auptbestandteil von Erdgas und Erdöl. Liegen
REAKTIONEN DER ORGANISCHEN CHEMIE
 REAKTIONEN DER ORGANISCHEN CHEMIE 1) ÜBERSICHT VON DEN REAKTIONEN AUSGEHEND: Die Reaktion der OC lassen sich auf 4 Grundtypen zurückführen: Grundtyp Addition Substitution Eliminierung Umlagerung allg A
REAKTIONEN DER ORGANISCHEN CHEMIE 1) ÜBERSICHT VON DEN REAKTIONEN AUSGEHEND: Die Reaktion der OC lassen sich auf 4 Grundtypen zurückführen: Grundtyp Addition Substitution Eliminierung Umlagerung allg A
Rupprecht-Gymnasium München Fachschaft Chemie
 Rupprecht-Gymnasium München Fachschaft Chemie Grundwissen der 10. Klasse NTG In der Jahrgangsstufe 10 erwerben die Schüler folgendes Grundwissen: Sie kennen die wichtigsten Alkane, Alkene und Alkine, können
Rupprecht-Gymnasium München Fachschaft Chemie Grundwissen der 10. Klasse NTG In der Jahrgangsstufe 10 erwerben die Schüler folgendes Grundwissen: Sie kennen die wichtigsten Alkane, Alkene und Alkine, können
2. Elektroneneffekte in den organischen Molekülen
 2. Elektroneneffekte in den organischen Molekülen Induktive und mesomere Effekte Die Ladungsverteilung in einer Kohlenwasserstoffkette wird durch Substituenten (Halogen, OH, NH 2 usw.) beeinflusst. Man
2. Elektroneneffekte in den organischen Molekülen Induktive und mesomere Effekte Die Ladungsverteilung in einer Kohlenwasserstoffkette wird durch Substituenten (Halogen, OH, NH 2 usw.) beeinflusst. Man
Alkane und Cycloalkane
 Systematik und Nomenklatur Alkane und ycloalkane einfachstes Alkan: Methan 4 Summenformel Strukturformel schrittweise Verlängerung um eine - 2 - Einheit homologe Reihe rganische hemie I 1 Alkane Gesättigte
Systematik und Nomenklatur Alkane und ycloalkane einfachstes Alkan: Methan 4 Summenformel Strukturformel schrittweise Verlängerung um eine - 2 - Einheit homologe Reihe rganische hemie I 1 Alkane Gesättigte
Aufgabe S. 2/a (2 Punkte) Wodurch können Sie Cyclohexan von Cyclohexen unterscheiden?
 16-1 2 Zur Punktevergabe bei multiple choice-aufgaben: Es gibt meist 5 Antwortmöglichkeiten, und 2 Punkte können pro Aufgabe erreicht werden. Pro falscher Antwort (Kreuz zu viel, aber auch fehlend) wird
16-1 2 Zur Punktevergabe bei multiple choice-aufgaben: Es gibt meist 5 Antwortmöglichkeiten, und 2 Punkte können pro Aufgabe erreicht werden. Pro falscher Antwort (Kreuz zu viel, aber auch fehlend) wird
Lösungen zum Übungsblatt zur Schulaufgabe. 0. Aufgaben aus dem Buch, S. 34
 Lösungen zum Übungsblatt zur Schulaufgabe 0. Aufgaben aus dem Buch, S. 34 A1 a) c) Br 5-Brom-2-methyl-hexa-2,3-dien 5-Brom-2-methyl-2,3-hexadien b) 3-Ethyl-3,4-dimethyldecan 3-Methylhexan A2 Butanmoleküle
Lösungen zum Übungsblatt zur Schulaufgabe 0. Aufgaben aus dem Buch, S. 34 A1 a) c) Br 5-Brom-2-methyl-hexa-2,3-dien 5-Brom-2-methyl-2,3-hexadien b) 3-Ethyl-3,4-dimethyldecan 3-Methylhexan A2 Butanmoleküle
Aufgabe S. 2/a (6 Punkte) Zeichnen Sie die Strukturformeln der folgenden Verbindungen! 3-Ethylheptan-2-on
 15-3 2 Aufgabe S. 2/a (6 Punkte) Zeichnen Sie die Strukturformeln der folgenden Verbindungen! Anilin Propionsäure Phenol 3-Ethylheptan-2-on Glycerin Formaldehyd Aufgabe S. 2/b (6 Punkte) Zeichnen Sie jeweils
15-3 2 Aufgabe S. 2/a (6 Punkte) Zeichnen Sie die Strukturformeln der folgenden Verbindungen! Anilin Propionsäure Phenol 3-Ethylheptan-2-on Glycerin Formaldehyd Aufgabe S. 2/b (6 Punkte) Zeichnen Sie jeweils
ORGANISCHE CHEMIE. Alkene und Alkine
 GANISE EMIE Alkene und Alkine Alkene 2 4 6 einfache Verbindungsklasse, n 2n enthalten nur und Doppelbindungen und Einfachbindungen werden als lefine oder ungesättigte Kohlenwasserstoffe bezeichnet 1 3
GANISE EMIE Alkene und Alkine Alkene 2 4 6 einfache Verbindungsklasse, n 2n enthalten nur und Doppelbindungen und Einfachbindungen werden als lefine oder ungesättigte Kohlenwasserstoffe bezeichnet 1 3
L.9 Organische Chemie I
 L.9 rganische hemie I 9.1. Schreiben Sie die Konstitutionsformeln für die 4 Isomere der Summenformel 4 9 auf. Zur Summenformel 4 10 existieren zwei verschiedene Konstitutionsisomere (n-butan und iso-butan):
L.9 rganische hemie I 9.1. Schreiben Sie die Konstitutionsformeln für die 4 Isomere der Summenformel 4 9 auf. Zur Summenformel 4 10 existieren zwei verschiedene Konstitutionsisomere (n-butan und iso-butan):
Seminar Organische Chemie für Biochemiker BBCM 1.7
 Juni 2017 Organische Chemie SS 2017 Trivialnamen Seite 1 Organische Chemie für Biochemiker BBCM 1.7 Trivialnamen Dr. Jürgen Vitz Institut für Organische Chemie und Makromolekulare Chemie (IOMC) Philosophenweg
Juni 2017 Organische Chemie SS 2017 Trivialnamen Seite 1 Organische Chemie für Biochemiker BBCM 1.7 Trivialnamen Dr. Jürgen Vitz Institut für Organische Chemie und Makromolekulare Chemie (IOMC) Philosophenweg
Beispielklausur Allgemeine Chemie II (Organische Chemie)
 Beispielklausur Allgemeine hemie II (rganische hemie) für Studierende mit hemie als Nebenfach zum Üben LÖSUNGEN (Teilweise gibt es viele mögliche richtige Antworten, dann sind lediglich Beispiele angegeben.)
Beispielklausur Allgemeine hemie II (rganische hemie) für Studierende mit hemie als Nebenfach zum Üben LÖSUNGEN (Teilweise gibt es viele mögliche richtige Antworten, dann sind lediglich Beispiele angegeben.)
im Molekül eine Dreifachbindung (eine σ-bindung,
 1 14.03.2006 0.1 Grundwissen Alkane Gesättigte Kohlenwasserstoffe, die keine Mehrfachbindungen, sondern nur Einfachbindungen (σ-bindungen) zwischen den Kohlenstoffatomen im Molekül aufweisen. Die allgemeine
1 14.03.2006 0.1 Grundwissen Alkane Gesättigte Kohlenwasserstoffe, die keine Mehrfachbindungen, sondern nur Einfachbindungen (σ-bindungen) zwischen den Kohlenstoffatomen im Molekül aufweisen. Die allgemeine
4-Butyl-2,5-dimethylheptan 5-Ethyl-4,8-dimethylundecan
 Übungsaufgaben zur Vorlesung Chemie für Biologen, WS 2005/2006 Themenbereich rganische Chemie 1. Warum ist der Kohlenstoff mehr als jedes andere Element dafür prädestiniert, komplexe Molekülverbindungen
Übungsaufgaben zur Vorlesung Chemie für Biologen, WS 2005/2006 Themenbereich rganische Chemie 1. Warum ist der Kohlenstoff mehr als jedes andere Element dafür prädestiniert, komplexe Molekülverbindungen
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Grundwissen: Chemie für Biologen (Sek II)
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Grundwissen: Chemie für Biologen (Sek II) Das komplette Material finden Sie hier: School-Scout.de Titel: Grundwissen: Chemie für Biologen
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Grundwissen: Chemie für Biologen (Sek II) Das komplette Material finden Sie hier: School-Scout.de Titel: Grundwissen: Chemie für Biologen
3. AUFBAU ORGANISCHER VERBINDUNGEN - ISOMERIEN
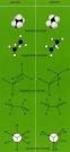 3 AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybrdisierungskonzepts verstehen und anschaulich darstellen (siehe
3 AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybrdisierungskonzepts verstehen und anschaulich darstellen (siehe
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Die Nomenklatur organischer Verbindungen - ein Übungszirkel - als veränderbare WORD-Datei Das komplette Material finden Sie hier:
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Die Nomenklatur organischer Verbindungen - ein Übungszirkel - als veränderbare WORD-Datei Das komplette Material finden Sie hier:
Decan Homologe Reihe der Alkane, unterschiedlich lange C-Ketten mit C- C (sp 3 /sp 3 ) und C-H (sp 3 /s)-bindungen (σ-bindungen) Beispiele: Butan
 1 30.09.005 0.1 Alkane Eine einfache Stoffgruppe der organischen Chemie sind die Alkane. Dabei handelt es sich um eine spezielle Gruppe der Kohlenwasserstoffe (KW). Alle Alkane gehorchen folgendem Prinzip:
1 30.09.005 0.1 Alkane Eine einfache Stoffgruppe der organischen Chemie sind die Alkane. Dabei handelt es sich um eine spezielle Gruppe der Kohlenwasserstoffe (KW). Alle Alkane gehorchen folgendem Prinzip:
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Inhaltsverzeichnis. 3 Gesättigte Kohlenwasserstoffe (Alkane) 3.1 Offenkettige Alkane 3.2 Cyclische Alkane
 Inhaltsverzeichnis 1 Chemische Bindung in organischen Verbindungen 1.1 Einleitung 1.2 Grundlagen der chemischen Bindung 1.3 Die Atombindung (kovalente oder homöopolare Bindung) 1.4 Bindungslängen und Bindungsenergien
Inhaltsverzeichnis 1 Chemische Bindung in organischen Verbindungen 1.1 Einleitung 1.2 Grundlagen der chemischen Bindung 1.3 Die Atombindung (kovalente oder homöopolare Bindung) 1.4 Bindungslängen und Bindungsenergien
ORGANISCHE CHEMIE. Struktur organischer Verbindungen: Formeln, Nomenklatur und Reaktionsmechanismen
 ORGANISE EMIE Struktur organischer Verbindungen: Formeln, Nomenklatur und Reaktionsmechanismen hemische Formeln Summenformeln Strukturformeln (Konstitutionsformeln) Ausführliche Strukturformeln Vereinfachte
ORGANISE EMIE Struktur organischer Verbindungen: Formeln, Nomenklatur und Reaktionsmechanismen hemische Formeln Summenformeln Strukturformeln (Konstitutionsformeln) Ausführliche Strukturformeln Vereinfachte
Inhaltsverzeichnis. Teil I Volle Kraft voraus: Die Chemie des Kohlenstoffs 23. Einführung 17. Kapitel 1 Die wundervolle Welt der organischen Chemie 25
 Inhaltsverzeichnis Inhaltsverzeichnis Über den Autor 7 Einführung 17 Über dieses Buch 18 Konventionen in diesem Buch 19 Törichte Annahmen über den Leser 19 Wie dieses Buch aufgebaut ist 20 Teil I: Es war
Inhaltsverzeichnis Inhaltsverzeichnis Über den Autor 7 Einführung 17 Über dieses Buch 18 Konventionen in diesem Buch 19 Törichte Annahmen über den Leser 19 Wie dieses Buch aufgebaut ist 20 Teil I: Es war
Übungen Kapitel 1 Alkane- Radikalische Substitution
 Übungen Kapitel 1 Alkane- Radikalische Substitution 1. Ein Gemisch aus Halogen und Alkan reagiert bei Bestrahlung mit UV- Licht oder höheren Temperaturen (Bsp. die Gase Methan und Chlor erst bei 250-400
Übungen Kapitel 1 Alkane- Radikalische Substitution 1. Ein Gemisch aus Halogen und Alkan reagiert bei Bestrahlung mit UV- Licht oder höheren Temperaturen (Bsp. die Gase Methan und Chlor erst bei 250-400
Energie. 3 x sp Orbitale 3 x sp-orbital 1 x 2p-Orbital
 sp 2 -ybridisierung sp 2 -ybridisierung sp 2 -ybridisierung 1 x 2p Orbital Energie 3 x sp Orbitale 3 x sp-orbital 1 x 2p-Orbital z y x planare Anordnung in sp 2 -hybridisierten -Atomen: Alle 4 (3 s- und
sp 2 -ybridisierung sp 2 -ybridisierung sp 2 -ybridisierung 1 x 2p Orbital Energie 3 x sp Orbitale 3 x sp-orbital 1 x 2p-Orbital z y x planare Anordnung in sp 2 -hybridisierten -Atomen: Alle 4 (3 s- und
Aufgabe S. 2/b (2 Punkte) Wobei kann es sich um ein Derivat (gleiche Oxidationsstufe des Carboxyl-C-Atoms) einer Carbonsäure handeln?
 14-3 2 Zur Punktevergabe bei multiple choice-aufgaben: Meist gibt es 5 Antwortmöglichkeiten, und 2 Punkte können pro Aufgabe erreicht werden. Pro falscher Antwort (Kreuz zu viel, aber auch fehlend) wird
14-3 2 Zur Punktevergabe bei multiple choice-aufgaben: Meist gibt es 5 Antwortmöglichkeiten, und 2 Punkte können pro Aufgabe erreicht werden. Pro falscher Antwort (Kreuz zu viel, aber auch fehlend) wird
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Die Nomenklatur organischer Verbindungen - ein Übungszirkel
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Die Nomenklatur organischer Verbindungen - ein Übungszirkel Das komplette Material finden Sie hier: School-Scout.de 2 von 28 4. Nomenklatur
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Die Nomenklatur organischer Verbindungen - ein Übungszirkel Das komplette Material finden Sie hier: School-Scout.de 2 von 28 4. Nomenklatur
Aromatische Kohlenwasserstoffe.
 Aromatische Kohlenwasserstoffe. Benzol und dessen Homologe. Mechanismus der S E 2-Ar-Reaktion. Orientierung in aromatischem Kern, abhängig vom ersten Substituent. Elektrophiler Mechanismus der Substitutionsreaktionen.
Aromatische Kohlenwasserstoffe. Benzol und dessen Homologe. Mechanismus der S E 2-Ar-Reaktion. Orientierung in aromatischem Kern, abhängig vom ersten Substituent. Elektrophiler Mechanismus der Substitutionsreaktionen.
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Grundwissen 10. Klasse NTG 1
 Grundwissen 10. Klasse NTG 1 1. rganische hemie = Kohlenstoffchemie rganische Verbindungen sind Kohlenstoffverbindungen. Ausnahmen:, 2, Kohlensäure, arbonate; 2. Eigenschaften organischer Verbindungen
Grundwissen 10. Klasse NTG 1 1. rganische hemie = Kohlenstoffchemie rganische Verbindungen sind Kohlenstoffverbindungen. Ausnahmen:, 2, Kohlensäure, arbonate; 2. Eigenschaften organischer Verbindungen
Aufgabe S. 2/a (2 Punkte) Wodurch können Sie Acetaldehyd von Pentan unterscheiden?
 14-2 2 Zur Punktevergabe bei multiple choice-aufgaben: Meist gibt es 5 Antwortmöglichkeiten, und 2 Punkte können pro Aufgabe erreicht werden. Pro falscher Antwort (Kreuz zu viel, aber auch fehlend) wird
14-2 2 Zur Punktevergabe bei multiple choice-aufgaben: Meist gibt es 5 Antwortmöglichkeiten, und 2 Punkte können pro Aufgabe erreicht werden. Pro falscher Antwort (Kreuz zu viel, aber auch fehlend) wird
Zur Benennung organischer Moleküle
 Zur Benennung organischer Moleküle Beispiele und Übungen Funktionelle Gruppen Es sind Atomgruppen in organischen Verbindungen. Sie verändern die Stoffeigenschaften und das Reaktionsverhalten des Ausgangskohlenwasserstoffs.
Zur Benennung organischer Moleküle Beispiele und Übungen Funktionelle Gruppen Es sind Atomgruppen in organischen Verbindungen. Sie verändern die Stoffeigenschaften und das Reaktionsverhalten des Ausgangskohlenwasserstoffs.
6. Rechenübung Organik (27.01./ )
 1 6. Rechenübung Organik (27.01./03.02.2009) Literatur: 2.) Mortimer : hemie Basiswissen hemie ISBN 3 13 484308 0 Paula Y. Bruice : Organische hemie ISBN 978 3 8273 7190 4 Gesättigtes Atom Atom, nur mit
1 6. Rechenübung Organik (27.01./03.02.2009) Literatur: 2.) Mortimer : hemie Basiswissen hemie ISBN 3 13 484308 0 Paula Y. Bruice : Organische hemie ISBN 978 3 8273 7190 4 Gesättigtes Atom Atom, nur mit
Aufgabe S. 2/a (2 Punkte) Wodurch können Sie 2-Hexen von 2-Methylpentan unterscheiden?
 16-2 2 Zur Punktevergabe bei multiple choice-aufgaben: Es gibt meist 5 Antwortmöglichkeiten, und 2 Punkte können pro Aufgabe erreicht werden. Pro falscher Antwort (Kreuz zu viel, aber auch fehlend) wird
16-2 2 Zur Punktevergabe bei multiple choice-aufgaben: Es gibt meist 5 Antwortmöglichkeiten, und 2 Punkte können pro Aufgabe erreicht werden. Pro falscher Antwort (Kreuz zu viel, aber auch fehlend) wird
Prof. Dr. Thomas Heinze Institut für Organische Chemie und Makromolekulare Chemie Humboldtstraße Jena
 Vorlesung/Seminare Organische Chemie für Materialwissenschaften Prof. Dr. Thomas Heinze Institut für Organische Chemie und Makromolekulare Chemie Humboldtstraße 10 07743 Jena 03641/9 48270 03641/9 48271
Vorlesung/Seminare Organische Chemie für Materialwissenschaften Prof. Dr. Thomas Heinze Institut für Organische Chemie und Makromolekulare Chemie Humboldtstraße 10 07743 Jena 03641/9 48270 03641/9 48271
Übung 9: Aufbau und Struktur organischer Verbindungen Übung für Medizinische Biologen - Jun.-Prof. Dr. Michael Giese.
 Zusammenfassung Aufbau und Struktur organischer Verbindungen Kohlenstoff besitzt eine Sonderstellung unter den Elementen ybridisierungsmodell beschreibt die Bindungsverhältnisse in Kohlenstoffverbindungen
Zusammenfassung Aufbau und Struktur organischer Verbindungen Kohlenstoff besitzt eine Sonderstellung unter den Elementen ybridisierungsmodell beschreibt die Bindungsverhältnisse in Kohlenstoffverbindungen
