2 Partikelsynthese. 2.1 Synthese von SiO 2 -Partikeln Sol-Gel- und Stöber-Prozess
|
|
|
- Arwed Winter
- vor 7 Jahren
- Abrufe
Transkript
1 2 Partikelsynthese In diesem Kapitel wird die Synthese der in Abb skizzierten Mikro-SiO 2, Nano- SiO 2 - und Nano@Mikro-SiO 2 -Partikel beschrieben einschließlich ihrer Oberflächenfunktionalisierung und der Synthese von Silika-Polymer-Kernschalepartikeln. 2.1 Synthese von SiO 2 -Partikeln Neben der Flammpyrolyse von (Alkyl)-Chlorsilanen [51] und der ph-abhängigen Kondensation von Natriumsilikat (Wasserglas) [52] [53] ist der Sol-Gel-Prozess [54] [55], bei dem Kieselsäureester SiOR 4 hydrolysiert und dann zu SiO 2 kondensiert werden, das wichtigste Verfahren zur Herstellung von nano- und mikroskopischen Silikapartikeln. Unter den speziellen Bedingungen des Stöber-Prozesses führt das Sol-Gel-Verfahren zu monodispersen Silikapartikeln Sol-Gel- und Stöber-Prozess Die Kondensation von monomeren Kieselsäurederivaten in Alkoholen führt im Sauren über verzweigtkettige SiO x -Oligomere zu lockeren, fraktalen Silika-Clusterpartikeln, im Basischen dagegen über kompakte Nanokeime zu Nanopartikeln [56]. In den primär entstehenden Solen liegen die Silikapartikel vereinzelt vor. Die Sole gehen aber, vor allem im schwach Sauren oder Basischen bei hohen Konzentrationen, leicht in fraktale Gele (Lyogele) über [57], in denen aggregierte Partikel ausgedehnte Netzwerke aufbauen. Aus den Lyogelen werden nach dem Trocknen Xerogele [58] und nach dem Sintern moderne Industriekeramiken gewonnen, die sich wegen ihrer nanoskopischen Kornstruktur durch eine früher nicht für möglich gehaltene Festigkeit auszeichnen. [59] [194] Die Bruttoreaktionsgleichung für die Hydrolyse und Kondensation des Tetraethylorthosilikats (TEOS) zu Siliciumdioxid und Ethanol lautet: Si(OC 2 H 5 ) H 2 O SiO C 2 H 5 OH 15
2 Die basische Kondensation ist in Abb. 2.1 formuliert. Die nucleophilen Angriffe auf das Silizium erfolgen nach dem S N 2-Mechanismus [60]. Sowohl die Hydrolyse der SiOEt- zu SiOH-Funktionen als auch deren Kondensation zu SiOSi-Brücken ist reversibel. [61] a Si OC 2 H 5 OC 2 H 5 NH 4 OH HO - Si OC 2 H 5 OC 2 H 5 - OC 2 H 5 Si OC 2 H 5 HO OC 2 H 5 b Si O - OC 2 H 5 Si OC 2 H 5 OC 2 H 5 OC 2 H 5 Si O Si OC 2 H 5 OC 2 H 5 OC 2 H 5 Abb Basische Kondensation von TEOS: (a) Hydrolyse, (b) verbrückende Kondensation Die Hydrolyse ist autokatalytisch. Die erste SiOEt-Funktion reagiert am langsamsten, die letzte am schnellsten. Die Kondensation verläuft, ebenfalls autokatalytisch, schneller als die Hydrolyse. Deshalb tritt die vollständig hydrolysierte Kieselsäure SiOH 4 nicht als Zwischenprodukt auf. Von Stöber wurde schon 1968 entdeckt, dass diese Reaktion in ammoniakalischen Solen in einem bestimmten Fenster der Wasser- und Ammoniak-Konzentrationen nicht zu Gelen, sondern zu definierten Silika-Mikropartikeln führt [62]. Die Synthese wird heute noch als Stöber-Prozess bezeichnet. Ammoniak katalysiert offenbar komplexierend die Kondensation und stattet die Silikapartikel zudem mit Anionen aus, die sie vor Aggregation schützen. Wie Abb. 2.2 beweist, sind die Partikel sphärisch und monodispers. Die Zunahme des Durchmessers ist an der Eintrübung der Sole erkennbar (Abb. 2.3). 16
3 Abb Silikapartikel aus dem Stöber-Prozess, Durchmesser 300 nm Abb SiO 2 -Sole in Ethanol (1 Gew. %): Eintrübung während des Partikelwachstums Die kontrollierte Bildung von kugelförmigen Silikapartikeln gleicher Größe kann mit dem LaMer-Modell erklärt werden [63] [64], das ursprünglich für die Entstehung von Schwefel-Nanopartikel aus alkoholischer Lösung formuliert worden war: Durch die Hydrolyse und beginnende Kondensation steigt die Konzentration der SiOHfunktionellen, monomeren Kieselsäurederivate, bis sie die kritische Löslichkeitsgrenze überschreitet, worauf im übersättigten Medium spontan Keimbildung statt- 17
4 findet. Überall in der Lösung werden dann plötzlich mit hoher Nukleationsrate Silikakeime von wenigen Nanometern Durchmesser gebildet. Dadurch sinkt die Konzentration der gelösten Kieselsäurederivate wieder unter die kritische Grenze, so dass die Nukleation aufhört und das Wachstum der Partikel durch Addition von Monomeren beginnt. Wenn die Kieselsäurekonzentration immer unter der Sättigungsgrenze gehalten wird, wächst dann eine konstante Zahl an Silikapartikeln bei konstanter Umsatzrate. Der geschwindigkeitsbestimmende Schritt des Wachstums ist die Hydrolyse des Kieselsäureesters. Dieses Modell wurde von vielen Autoren akzeptiert. [65] [66] Einige Autoren stellten dem ein Modell entgegen, wonach die Keimneubildung fortwährend andauert und größere Silikapartikel durch Aggregation der Keime gebildet werden [67]. Die beiden Mechanismen wurden auch kombiniert. Der Aggregationsmechanismus wurde für das Wachstum und die Monomeraddition für die Glättung der Partikeloberfläche verantwortlich gemacht [68] [69], oder es wurde angenommen, dass kleine Kondensate des Typs Si x O y (OH) z sich erst in Lösung bilden und dann auf die Keimpartikel aufwachsen [70]. Die Monodispersität der Silikapartikel ist eine direkte Folge beider Wachstumsmechanismen. Das Wachstum der Silikapartikel ist selbstschärfend: Während der Partikeldurchmesser D zunimmt, nimmt die Polydispersität D/D stetig ab, und zwar bei Diffusionskontrolle mit 1/D 2 und bei Reaktionskontrolle mit 1/D. [71] Partikelgrößeneinstellung Die Größe von Silikapartikeln kann im Stöber-Prozess über die Konzentrationen an Ethanol, Wasser, Ammoniaklösung und TEOS innerhalb von nm präzise gesteuert werden. Dazu liegen viele Synthesevorschriften vor [72-79]. Die Literaturangaben können allerdings nur als Anhaltspunkte dienen, weil die Synthese empfindlich auf leichte Veränderungen reagiert. So treten Schwankungen um bis zu 100 nm bei Verwendung von TEOS verschiedener Hersteller und Chargen auf, weshalb man in systematischen Vergleichsstudien besser eine einzige Charge verwendet. 18
5 Zwei Grundrezepturen, die in dieser Arbeit für die Synthese von Partikeln um 100 nm und 300 nm Durchmesser entwickelt wurden, sind in Tab. 2.1 und Tab. 2.3 formuliert. Die Reaktion wurde als Batch-Prozess durchgeführt, bei dem alle Komponenten zu Anfang schon vorgelegt werden. Tab Rezeptur für Silikapartikel um 100 nm nach dem Stöber-Prozess bei C der Vorlage Masse [g] Gew.% mol/l mol-% Ethanol ,3 15,7 93,6 Ammoniaklösung (25 %) 200 8,4 1,0 5,7 TEOS 80 3,3 0,1 0,8 Ethanol und Ammoniaklösung wurden in einem verschlossenen Doppelmantelreaktor auf C erwärmt und die angegebenen Mengen an unverdünntem TEOS zugegeben. Durch die exakte Einstellung der Temperatur ließen sich besonders kleine (40-50 nm bei 68 C), mittelgroße ( nm bei 50 C) und größere Silicapartikel ( nm bei 42 C) herstellen. Innerhalb von 10 min entstand jeweils eine leicht blaue, milchig trübe bis opake Dispersion. Die vollständige Hydrolyse des eingesetzten TEOS führte zu einer SiO 2 -Dispersion mit einem Feststoffgehalt von 1 Gew.% (Tab. 2.2). Tab Zusammensetzung der Dispersion von 100 nm-silikapartikeln nach der Hydrolyse von TEOS nach Tab.2.1 Masse [g] Gew. % Ethanol ,3 Wasser 136 5,7 NH 3 50,0 2,1 SiO 2 23,1 1,0 Für Silikapartikel mit einem deutlich größeren Durchmesser von etwa 300 nm wurde mit demselben apparativen Aufbau mit anderen Zusammensetzungen der Vorlage gearbeitet. 19
6 Tab.2.3. Rezeptur für Silicapartikel um 300 nm nach dem Stöber-Prozess bei 47 C der Vorlage Masse [g] Gew.% mol/l mol-% Ethanol ,3 13,5 72,4 Wasser 60 8,0 3,8 20,2 Ammoniaklösung (25 %) 60 8,0 0,9 5,0 TEOS 80 10,7 0,4 2,3 Bei vollständiger Hydrolyse des TEOS resultiert eine Dispersion mit einem Feststoffgehalt von 3,1 Gew.% (Tab. 2.4). Tab Zusammensetzung der Dispersion von 300 nm-silicapartikeln nach der Hydrolyse von TEOS nach Tab. 2.3 Masse [g] Gew. % Ethanol 620,8 82,8 Wasser 91,2 12,2 NH 3 15,0 2,0 SiO 2 23,1 3,1 Variiert man das Wasser-Ammoniak-Verhältnis bei gleichbleibendem Ethanol- und TEOS-Anteil, gelingt eine Feinabstimmung des Partikeldurchmessers (Abb. 2.4) im Größenbereich um 300 nm. Der Kurvenverlauf entspricht ungefähr dem schon von Stöber in seiner Originalarbeit publiziertem Diagramm [62]. Der Kugeldurchmesser nimmt mit steigender Ammoniakkonzentration und sinkendem Wassergehalt bis zu einem Plateau zu. 20
7 Größe /nm n(wasser) / n(sio 2 ) ,5 1,0 1,5 2,0 3,5 3,0 2,5 n(nh3 abs ) / n(sio 2 ) Abb Abhängigkeit der SiO 2 -Partikelgröße vom molaren Wasser- und Ammoniakanteil bei gleich bleibendem TEOS/Ethanol-Verhältnis und konstanter Temperatur Der Prozess ist außerordentlich temperaturabhängig. Bei niedrigen Temperaturen lassen sich deutlich größere Partikel herstellen. Als, ausgehend von der zweiten Grundrezeptur für 300 nm-partikel (Tab. 2.3), die Temperatur bis 20 C abgesenkt wurde, stieg die Partikelgröße bis über 500 nm (Abb. 2.5). Es ist davon auszugehen, dass die Keimbildungsrate bei niedrigen Temperaturen infolge einer verringerten Hydrolysegeschwindigkeit des Kieselsäureesters verlangsamt ist und daher weniger Keime gebildet werden, die dann umso größer heranwachsen. 21
8 Durchmesser [nm] Temperatur [ C] Abb Temperaturabhängigkeit der Partikelgröße bei gleich bleibender Konzentration der Komponenten Ethanol, Wasser (8 Gew.%), Ammoniaklösung (8 Gew.%) und TEOS Verringert man die Temperatur weiter auf 10 C, geht die Monodispersität verloren. Es entstehen nichtsphärische polydisperse Partikel von 0,5-3 µm Durchmesser, wobei die größeren Partikel in der Überzahl sind. Dies lässt folgenden Schluss zu: Die thermodynamisch bedingte Keimbildungsrate ist bei diesen Bedingungen langsamer als die diffusionskontrollierte Aggregationsrate. Neu entstandene Keime werden nicht durch Wachstum immer einheitlicher, sondern aggregieren vorher miteinander. Wegen der breiteren Partikelgrößenverteilung und des erhöhten apparativen Aufwands (Kühlaggregate, Isolation) wurde die Synthese großer Partikel bei niedrigen Temperaturen aufgegeben, zumal sich eine bessere Alternative anbot: Große Partikel können sehr exakt mit einem Stufenverfahren erzeugt werden [80] [81]. Der Prozess geht von Silika-Saatpartikeln aus, die durch stufenweise Zugabe oder durch kontinuierliche Dosierung von TEOS bis zur gewünschten Partikelgröße vergrößert werden. Die TEOS-Zugabe muss immer so langsam erfolgen, dass die Kieselsäurekonzentration im System unterkritisch niedrig bleibt, um Gelbildung und Partikelneubildung zu vermeiden. 22
9 Die Silikapartikel in Abb. 2.6 wurden teils mit dem Batch- und teils mit dem Stufenverfahren hergestellt. Die großen Partikel wurden aus 300 nm-partikeln mit einer (400 nm) oder zwei (500 nm) zusätzlichen Stufen erzeugt. a nm b 300 nm c 400 nm d 500 nm Abb TEM-Niederschlagsbilder von Silikapartikeln aus dem Stöber-Prozess: (a, b) Batchverfahren, (c, d) Stufenverfahren Ab D > 100 nm sind die Partikel monodispers. Diese Partikel bildeten die Grundlage der Kernschale- und der Nano@Mikro-Partikel der kommenden Abschnitte. 23
7 Charakterisierung von Sol-Gel-Materialien
 Charakterisierung von Sol-Gel-Materialien 83 7 Charakterisierung von Sol-Gel-Materialien 7.1 Einleitung Sol-Gel-Materialien (Silikatgele) werden meistens durch die Hydrolyse von monomeren tetrafunktionellen
Charakterisierung von Sol-Gel-Materialien 83 7 Charakterisierung von Sol-Gel-Materialien 7.1 Einleitung Sol-Gel-Materialien (Silikatgele) werden meistens durch die Hydrolyse von monomeren tetrafunktionellen
Zusammenfassung und Ausblick
 Kapitel 7 Zusammenfassung und Ausblick Gegenstand der vorliegenden Arbeit ist die Erzeugung und Charakterisierung von Eisenoxid-Nanopartikeln in Gasphasenreaktoren und die Untersuchung des Einflusses sowohl
Kapitel 7 Zusammenfassung und Ausblick Gegenstand der vorliegenden Arbeit ist die Erzeugung und Charakterisierung von Eisenoxid-Nanopartikeln in Gasphasenreaktoren und die Untersuchung des Einflusses sowohl
d Chemical Vapor Deposition (CVD)
 d Chemical Vapor Deposition (CVD) Verfahrensprinzip chemical vapor deposition : Abscheidung aus der Gasphase Verwandte Verfahren d Chemical Vapor Deposition (CVD) Prozessablauf CVD: Bildung eines Kupfer-Nanofilms
d Chemical Vapor Deposition (CVD) Verfahrensprinzip chemical vapor deposition : Abscheidung aus der Gasphase Verwandte Verfahren d Chemical Vapor Deposition (CVD) Prozessablauf CVD: Bildung eines Kupfer-Nanofilms
Aufgabe 2 Erläutern Sie den Matijevic-Mechanismus zur Bildung einheitlicher Partikel durch Fällung. (10 Punkte)
 Klausur 2013-02-20 Aufgabe 1 Erläutern Sie die Ihnen bekannten Methoden zur Herstellung a) einer feinteiligen Suspension b) eine feinteilige Emulsion Erläutern Sie dabei auch aus welchen Gründen sich die
Klausur 2013-02-20 Aufgabe 1 Erläutern Sie die Ihnen bekannten Methoden zur Herstellung a) einer feinteiligen Suspension b) eine feinteilige Emulsion Erläutern Sie dabei auch aus welchen Gründen sich die
c Aufbaureaktionen Aufbau von Kolloiden aus einer Lösung Entstehung und Zerstörung von Dispersionen
 c Aufbaureaktionen Aufbau von Kolloiden aus einer Lösung Entstehung und Zerstörung von Dispersionen OSTWALD Reifung: größere Partikel wachsen auf Kosten kleinerer c Aufbaureaktionen Aufbaureaktionen von
c Aufbaureaktionen Aufbau von Kolloiden aus einer Lösung Entstehung und Zerstörung von Dispersionen OSTWALD Reifung: größere Partikel wachsen auf Kosten kleinerer c Aufbaureaktionen Aufbaureaktionen von
C Säure-Base-Reaktionen
 -V.C1- C Säure-Base-Reaktionen 1 Autoprotolyse des Wassers und ph-wert 1.1 Stoffmengenkonzentration Die Stoffmengenkonzentration eines gelösten Stoffes ist der Quotient aus der Stoffmenge und dem Volumen
-V.C1- C Säure-Base-Reaktionen 1 Autoprotolyse des Wassers und ph-wert 1.1 Stoffmengenkonzentration Die Stoffmengenkonzentration eines gelösten Stoffes ist der Quotient aus der Stoffmenge und dem Volumen
Experiment: Synthese von Gold-Nanopartikeln (Klasse 9)
 Experiment: Synthese von Gold-Nanopartikeln (Klasse 9) Chemikalien Gold(III)-chlorid-Lösung c = 0,000 44 mol/l Natriumcitrat-Lösung c = 1 % Geräte siedendes Wasserbad, Reagenzgläser, Messpipette 10 ml,
Experiment: Synthese von Gold-Nanopartikeln (Klasse 9) Chemikalien Gold(III)-chlorid-Lösung c = 0,000 44 mol/l Natriumcitrat-Lösung c = 1 % Geräte siedendes Wasserbad, Reagenzgläser, Messpipette 10 ml,
im Rahmen des Schwerpunktprogramms SPP 1486 der DFG Partikel im Kontakt Mikromechanik, Mikroprozessdynamik und Partikelkollektive
 Serviceprojekt zur, Funktionalisierung und im Rahmen des Schwerpunktprogramms SPP 1486 der DFG Partikel im Kontakt Mikromechanik, Mikroprozessdynamik und Partikelkollektive 02.12.10 Curriculum Vitae Geburtsdatum:
Serviceprojekt zur, Funktionalisierung und im Rahmen des Schwerpunktprogramms SPP 1486 der DFG Partikel im Kontakt Mikromechanik, Mikroprozessdynamik und Partikelkollektive 02.12.10 Curriculum Vitae Geburtsdatum:
Richtung von spontanem Prozeßablauf und Veränderung der G in Abhängigkeit vom Vorzeichen der Enthalpie und der Entropie
 Richtung von spontanem Prozeßablauf und Veränderung der G in Abhängigkeit vom Vorzeichen der Enthalpie und der Entropie H S G= H-T S Prozeß 1. (-) (+) (-) immer exergonisch, erfolgt spontan bei allen Temperaturen
Richtung von spontanem Prozeßablauf und Veränderung der G in Abhängigkeit vom Vorzeichen der Enthalpie und der Entropie H S G= H-T S Prozeß 1. (-) (+) (-) immer exergonisch, erfolgt spontan bei allen Temperaturen
Partikelgrößenbestimmung mit dynamischer Lichtstreuung
 Partikelgrößenbestimmung mit dynamischer Lichtstreuung Applikationen mit dem Nanopartikel-Messgerät ANALYSETTE 12 DynaSizer Die neue ANALYSETTE 12 DynaSizer erlaubt durch das Messverfahren der dynamischen
Partikelgrößenbestimmung mit dynamischer Lichtstreuung Applikationen mit dem Nanopartikel-Messgerät ANALYSETTE 12 DynaSizer Die neue ANALYSETTE 12 DynaSizer erlaubt durch das Messverfahren der dynamischen
Robuste Schichten aus Himbeerpartikeln
 Robuste Schichten aus Himbeerpartikeln neue Wege zu selbstreinigenden Oberflächen Vom Fachbereich Chemie der Technischen Universität Darmstadt zur Erlangung des akademischen Grades eines Doktor-Ingenieurs
Robuste Schichten aus Himbeerpartikeln neue Wege zu selbstreinigenden Oberflächen Vom Fachbereich Chemie der Technischen Universität Darmstadt zur Erlangung des akademischen Grades eines Doktor-Ingenieurs
Kapitel 17: Weitere Aspekt. wässriger Gleichgew. Einfluss gleicher Ionen: Gleichioniger Zusatz, Verschiebung des Gleichgewichtes nach Le-Châtelier.
 Ache2 Kapitel 17: Weitere Aspekt. wässriger Gleichgew. Einfluss gleicher Ionen: Gleichioniger Zusatz, Verschiebung des Gleichgewichtes nach Le-Châtelier. Bsp. ph berechnen einer 0.085 mol/l salpetriger
Ache2 Kapitel 17: Weitere Aspekt. wässriger Gleichgew. Einfluss gleicher Ionen: Gleichioniger Zusatz, Verschiebung des Gleichgewichtes nach Le-Châtelier. Bsp. ph berechnen einer 0.085 mol/l salpetriger
Das Chemische Gleichgewicht
 Das Chemische Gleichgewicht a A + b B c C + d D r r r r Für r G = 0 gilt: Q = K r G G E D r G = dg dx
Das Chemische Gleichgewicht a A + b B c C + d D r r r r Für r G = 0 gilt: Q = K r G G E D r G = dg dx
Versuch 6.14 ph-abhängigkeit eines Indikators am Beispiel Thymolblau
 Versuch 6.14 ph-abhängigkeit eines Indikators am Beispiel Thymolblau Einleitung Lösungen mit verschiedenen ph-werten von stark sauer bis stark basisch werden mit gleich viel Thymolblau-Lösung versetzt.
Versuch 6.14 ph-abhängigkeit eines Indikators am Beispiel Thymolblau Einleitung Lösungen mit verschiedenen ph-werten von stark sauer bis stark basisch werden mit gleich viel Thymolblau-Lösung versetzt.
9. Oxidation von Legierungen
 Oxidation von Legierungen 66 9. Oxidation von Legierungen Wichtigste Anforderungen an Hochtemperaturlegierungen: langsame Verzunderung unter Bildung dichter und schützender Oxidschichten (in der Regel
Oxidation von Legierungen 66 9. Oxidation von Legierungen Wichtigste Anforderungen an Hochtemperaturlegierungen: langsame Verzunderung unter Bildung dichter und schützender Oxidschichten (in der Regel
SB 22
 Kd 21 SB 22 SB 23 SB 24 SB 25 SB 26 SB 27 4.4 SB 28 SB 29 5.2 Konzentrationsdiagramme 2 zentrale zu unterscheidende Anwendungen Anwendung 1: Dissoziationsgrad von Säure-Base-Paaren in Abhängigkeit des
Kd 21 SB 22 SB 23 SB 24 SB 25 SB 26 SB 27 4.4 SB 28 SB 29 5.2 Konzentrationsdiagramme 2 zentrale zu unterscheidende Anwendungen Anwendung 1: Dissoziationsgrad von Säure-Base-Paaren in Abhängigkeit des
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2011/12 vom
 Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2011/12 vom 23.09.2011 A1 A2 A3 A4 A5 Σ Note 8 8 10 10 14 50 NAME/VORNAME:... Matrikelnummer:... Pseudonym für Ergebnisveröffentlichung:... Schreiben
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2011/12 vom 23.09.2011 A1 A2 A3 A4 A5 Σ Note 8 8 10 10 14 50 NAME/VORNAME:... Matrikelnummer:... Pseudonym für Ergebnisveröffentlichung:... Schreiben
3.2. Aufgaben zu Säure-Base-Gleichgewichten
 .. Aufgaben zu Säure-Base-Gleichgewichten Aufgabe : Herstellung saurer und basischer Lösungen Gib die Reaktionsgleichungen für die Herstellung der folgenden Lösungen durch Reaktion der entsprechenden Oxide
.. Aufgaben zu Säure-Base-Gleichgewichten Aufgabe : Herstellung saurer und basischer Lösungen Gib die Reaktionsgleichungen für die Herstellung der folgenden Lösungen durch Reaktion der entsprechenden Oxide
Praktikum Materialwissenschaft Sol-Gel-Synthese keramischer Werkstoffe am Beispiel von SiO 2
 Praktikum Materialwissenschaft Sol-Gel-Synthese keramischer Werkstoffe am Beispiel von SiO 2 André Schwöbel 1328037, Max Fries 1407149, Jörg Schließer 1401598, Tobias Brink 1400670 (Gruppe 17) e-mail:
Praktikum Materialwissenschaft Sol-Gel-Synthese keramischer Werkstoffe am Beispiel von SiO 2 André Schwöbel 1328037, Max Fries 1407149, Jörg Schließer 1401598, Tobias Brink 1400670 (Gruppe 17) e-mail:
Chemie aquatischer Systeme. Herbstsemester 2013
 Chemie aquatischer Systeme Herbstsemester 2013 Ziele der Vorlesung Verständnis der chemischen Zusammensetzung der Gewässer aufgrund chemischer Prozesse Verknüpfung chemischer Prozesse mit biologischen
Chemie aquatischer Systeme Herbstsemester 2013 Ziele der Vorlesung Verständnis der chemischen Zusammensetzung der Gewässer aufgrund chemischer Prozesse Verknüpfung chemischer Prozesse mit biologischen
lg k ph Profil Versuchsprotokoll Versuch Flüssig D2 1. Stichworte
 Paul Elsinghorst, Jürgen Gäb, Carina Mönig, Iris Korte Versuchsprotokoll Versuch Flüssig D2 lg k ph Profil 1. Stichworte Reaktionskinetik, Reaktionsordnung, Reaktionsmolekularität Stabilität von wässrigen
Paul Elsinghorst, Jürgen Gäb, Carina Mönig, Iris Korte Versuchsprotokoll Versuch Flüssig D2 lg k ph Profil 1. Stichworte Reaktionskinetik, Reaktionsordnung, Reaktionsmolekularität Stabilität von wässrigen
Planung, Bau und Betrieb von Chemieanlagen - Übung Allgemeine Chemie. Allgemeine Chemie. Rückblick auf vorherige Übung
 Planung, Bau und Betrieb von Chemieanlagen - Übung Allgemeine Chemie 1 Allgemeine Chemie Rückblick auf vorherige Übung 2 Löslichkeit Was ist eine Lösung? - Eine Lösung ist ein einphasiges (homogenes) Gemisch
Planung, Bau und Betrieb von Chemieanlagen - Übung Allgemeine Chemie 1 Allgemeine Chemie Rückblick auf vorherige Übung 2 Löslichkeit Was ist eine Lösung? - Eine Lösung ist ein einphasiges (homogenes) Gemisch
Das Chemische Gleichgewicht
 Das Chemische Gleichgewicht Geschwindigkeit der Hinreaktion: v hin = k hin c(a 2 ) c(x 2 ) Geschwindigkeit der Rückreaktion: v rück = k rück c 2 (AX) Gleichgewicht: v hin = v rück k hin c(a 2 ) c(x 2 )
Das Chemische Gleichgewicht Geschwindigkeit der Hinreaktion: v hin = k hin c(a 2 ) c(x 2 ) Geschwindigkeit der Rückreaktion: v rück = k rück c 2 (AX) Gleichgewicht: v hin = v rück k hin c(a 2 ) c(x 2 )
STEUERUNG DER RHEOLOGISCHEN EIGENSCHAFTEN VON PLASTISOLEN DURCH DEN WASSERGEHALT
 STEUERUNG DER RHEOLOGISCHEN EIGENSCHAFTEN VON PLASTISOLEN DURCH DEN WASSERGEHALT L. Tanzil, B. Hochstein, N. Willenbacher Institut für Mechanische Verfahrenstechnik und Mechanik, Bereich Angewandte Mechanik,
STEUERUNG DER RHEOLOGISCHEN EIGENSCHAFTEN VON PLASTISOLEN DURCH DEN WASSERGEHALT L. Tanzil, B. Hochstein, N. Willenbacher Institut für Mechanische Verfahrenstechnik und Mechanik, Bereich Angewandte Mechanik,
CHEMIE KAPITEL 4 SÄURE-BASE. Timm Wilke. Georg-August-Universität Göttingen. Wintersemester 2013 / 2014
 CHEMIE KAPITEL 4 SÄURE-BASE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Aufgaben In einen Liter Wasser werden 2 g NH - 2 (starke Base) eingeleitet welchen ph-wert hat
CHEMIE KAPITEL 4 SÄURE-BASE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Aufgaben In einen Liter Wasser werden 2 g NH - 2 (starke Base) eingeleitet welchen ph-wert hat
Lösungen zu den Übungsaufgaben zur Thematik Säure/Base (Zwei allgemeine Hinweise: aus Zeitgründen habe ich auf das Kursivsetzen bestimmter Zeichen
 Lösungen zu den Übungsaufgaben zur Thematik Säure/Base (Zwei allgemeine Hinweise: aus Zeitgründen habe ich auf das Kursivsetzen bestimmter Zeichen verzichtet; Reaktionsgleichungen sollten den üblichen
Lösungen zu den Übungsaufgaben zur Thematik Säure/Base (Zwei allgemeine Hinweise: aus Zeitgründen habe ich auf das Kursivsetzen bestimmter Zeichen verzichtet; Reaktionsgleichungen sollten den üblichen
Beispielaufgaben IChO 2. Runde 2019 Säurederivate. H2, Pd/C
 Beispielaufgaben Ih 2. Runde 2019 Säurederivate Beispiel 1 ligocarbonsäuren Gegeben sei folgendes Reaktionsschema: A H2, Pd/ H 2, Lindlar Na/NH 3(l) B D Base E A hat eine molare Masse von 118,09 g mol
Beispielaufgaben Ih 2. Runde 2019 Säurederivate Beispiel 1 ligocarbonsäuren Gegeben sei folgendes Reaktionsschema: A H2, Pd/ H 2, Lindlar Na/NH 3(l) B D Base E A hat eine molare Masse von 118,09 g mol
Im Wasser sind ph-werte von ca bis 15 möglich.
 8 Superbasen 8.1 Basizität im System Wasser 2 H 2 O H 3 O + + OH pk =14 Säurestärken (pk S ): pk S HClO 4 10 saurer als H 3 O + HCl 7 H 2 SO 4 3 H 3 O + 0 H 3 PO 4 2.2 H 3.2 HCN 9.2 H 2 O 2 11.6 H 2 O
8 Superbasen 8.1 Basizität im System Wasser 2 H 2 O H 3 O + + OH pk =14 Säurestärken (pk S ): pk S HClO 4 10 saurer als H 3 O + HCl 7 H 2 SO 4 3 H 3 O + 0 H 3 PO 4 2.2 H 3.2 HCN 9.2 H 2 O 2 11.6 H 2 O
Die stationäre Phase: Das Basismaterial - HPLC-Partikeltechnologien
 Die stationäre Phase: Das Basismaterial - HPLC-Partikeltechnologien Core-Shell Partikel Vollporöse Partikel 1 Vollporöses Kieselgel Hydrolyse Polymerisation Tetraethoxysilan (TEOS) Sol-Gel Prozess 99,9
Die stationäre Phase: Das Basismaterial - HPLC-Partikeltechnologien Core-Shell Partikel Vollporöse Partikel 1 Vollporöses Kieselgel Hydrolyse Polymerisation Tetraethoxysilan (TEOS) Sol-Gel Prozess 99,9
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2011/12 vom
 Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2011/12 vom 23.09.2011 A1 A2 A3 A4 A5 Σ Note 8 8 10 10 14 50 NAME/VORNAME:... Matrikelnummer: STICHPUNKTE ZU DEN LÖSUNGEN Pseudonym für Ergebnisveröffentlichung:...
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2011/12 vom 23.09.2011 A1 A2 A3 A4 A5 Σ Note 8 8 10 10 14 50 NAME/VORNAME:... Matrikelnummer: STICHPUNKTE ZU DEN LÖSUNGEN Pseudonym für Ergebnisveröffentlichung:...
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 2,
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr., 6.04.11 1. Sie legen 100 ml einer 0, mol/l Natronlauge vor. Als Titrant verwenden Sie eine 0,8 mol/l Salzsäure. Berechnen
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr., 6.04.11 1. Sie legen 100 ml einer 0, mol/l Natronlauge vor. Als Titrant verwenden Sie eine 0,8 mol/l Salzsäure. Berechnen
Chemie entdecken. Mikrolabor Hefezelle. Christoph Rüthing. Experimentalwettbewerb der Klassenstufen 5-10 in NRW. Zum Thema. von
 Chemie entdecken Experimentalwettbewerb der Klassenstufen 5-10 in NRW Zum Thema Mikrolabor Hefezelle von Christoph Rüthing Versuch 1: Nach Hinzufügen der Hefe in die Zuckerlösung färbt sich das Gemisch
Chemie entdecken Experimentalwettbewerb der Klassenstufen 5-10 in NRW Zum Thema Mikrolabor Hefezelle von Christoph Rüthing Versuch 1: Nach Hinzufügen der Hefe in die Zuckerlösung färbt sich das Gemisch
wird titriert mit Salzsäure der Konzentration c(hcl) = 1 mol/l.
 1 Problemstellung 1 Liter Natronlauge der Konzentration c(naoh) = 1 mol/l wird titriert mit Salzsäure der Konzentration c(hcl) = 1 mol/l. Der ph-wert Lösung soll für verschiedene zugegebene HCl-Volumina
1 Problemstellung 1 Liter Natronlauge der Konzentration c(naoh) = 1 mol/l wird titriert mit Salzsäure der Konzentration c(hcl) = 1 mol/l. Der ph-wert Lösung soll für verschiedene zugegebene HCl-Volumina
ATTO 565 und ATTO 590
 ATTO 565 und ATTO 590 Allgemeine Informationen ATTO 565 und ATTO 590 sind Fluoreszenzmarker aus der Familie der Rhodamin-Farbstoffe. Diese Farbstoffe besitzen als gemeinsames Strukturelement einen Carboxyphenyl-
ATTO 565 und ATTO 590 Allgemeine Informationen ATTO 565 und ATTO 590 sind Fluoreszenzmarker aus der Familie der Rhodamin-Farbstoffe. Diese Farbstoffe besitzen als gemeinsames Strukturelement einen Carboxyphenyl-
Nachklausur zum Praktikum Allgemeine und Anorganische Chemie für Naturwissenschaftler Sommersemester 2007
 Nachklausur zum Praktikum Allgemeine und Anorganische Chemie für Naturwissenschaftler Sommersemester 2007 Name: Matr. Nr.: Studiengang (Bachelor/Diplom): Ergebnis: Punkte/Note: Aufg 1 2 3 4 5 6 7 8 9 10
Nachklausur zum Praktikum Allgemeine und Anorganische Chemie für Naturwissenschaftler Sommersemester 2007 Name: Matr. Nr.: Studiengang (Bachelor/Diplom): Ergebnis: Punkte/Note: Aufg 1 2 3 4 5 6 7 8 9 10
Die Potenziale der Milchproteine zur Gelbildung
 Die Potenziale der Milchproteine zur Gelbildung Seminarvortrag von Petra Westmeier 18.11.2004 Universität Hohenheim Institut für Lebensmittel tierischer Herkunft Leitung: Prof. Dr. Jörg Hinrichs Betreuer:
Die Potenziale der Milchproteine zur Gelbildung Seminarvortrag von Petra Westmeier 18.11.2004 Universität Hohenheim Institut für Lebensmittel tierischer Herkunft Leitung: Prof. Dr. Jörg Hinrichs Betreuer:
Säuren und Basen. Der ph-wert Zur Feststellung, ob eine Lösung sauer oder basisch ist genügt es, die Konzentration der H 3 O H 3 O + + OH -
 Der ph-wert Zur Feststellung, ob eine Lösung sauer oder basisch ist genügt es, die Konzentration der H 3 O + (aq)-ionen anzugeben. Aus der Gleichung: H 2 O + H 2 O H 3 O + + OH - c(h 3 O + ) c(oh - ) K
Der ph-wert Zur Feststellung, ob eine Lösung sauer oder basisch ist genügt es, die Konzentration der H 3 O + (aq)-ionen anzugeben. Aus der Gleichung: H 2 O + H 2 O H 3 O + + OH - c(h 3 O + ) c(oh - ) K
Sol-Gel-basierte Fluorid-Holz-Nanocomposite Zusammensetzung, Struktur und Eigenschaften
 Sol-Gel-basierte Fluorid-Holz-Nanocomposite Zusammensetzung, Struktur und Eigenschaften Erhard Kemnitz 1), Thoralf Krahl 1), Thomas Hübert 2) 1) Humboldt-Universität zu Berlin, Berlin 2) Bundesanstalt
Sol-Gel-basierte Fluorid-Holz-Nanocomposite Zusammensetzung, Struktur und Eigenschaften Erhard Kemnitz 1), Thoralf Krahl 1), Thomas Hübert 2) 1) Humboldt-Universität zu Berlin, Berlin 2) Bundesanstalt
Mehrprotonige Säuren haben ihren ersten EP ebenfalls bei τ = 1. Links: Gleichgewicht bei Produkten, Rechts: Gleichgewicht zw. Edukten/ Produkten
 AnChe2 Kapitel 8: Titrimetrie Voraussetzungen für eine Titration: Quantitative Umsetzung (k >> 1) Eindeutige Stöchiometrie Hohe Reaktionsgeschwindigkeit Präzise Ermittlung des EP Präzise Einstellung der
AnChe2 Kapitel 8: Titrimetrie Voraussetzungen für eine Titration: Quantitative Umsetzung (k >> 1) Eindeutige Stöchiometrie Hohe Reaktionsgeschwindigkeit Präzise Ermittlung des EP Präzise Einstellung der
5. Versuche zur Synthese von Mn-Fe- und Mn-Cr-LDHs
 5. Versuche zur Synthese von Mn-Fe- und Mn-Cr-LDHs In den Systemen Mn-Fe und Mn-Cr wurde die Synthese von LDHs mit Nitrat, Chlorid, Karbonat und Sulfat als Zwischenschichtanion geprüft. Mn-Cr-LDHs Natürlich
5. Versuche zur Synthese von Mn-Fe- und Mn-Cr-LDHs In den Systemen Mn-Fe und Mn-Cr wurde die Synthese von LDHs mit Nitrat, Chlorid, Karbonat und Sulfat als Zwischenschichtanion geprüft. Mn-Cr-LDHs Natürlich
*EP A1* EP A1 (19) (11) EP A1 (12) EUROPÄISCHE PATENTANMELDUNG. (43) Veröffentlichungstag: Patentblatt 2003/38
 (19) Europäisches Patentamt European Patent Office Office européen des brevets *EP001344749A1* (11) EP 1 344 749 A1 (12) EUROPÄISCHE PATENTANMELDUNG (43) Veröffentlichungstag: 17.09.03 Patentblatt 03/38
(19) Europäisches Patentamt European Patent Office Office européen des brevets *EP001344749A1* (11) EP 1 344 749 A1 (12) EUROPÄISCHE PATENTANMELDUNG (43) Veröffentlichungstag: 17.09.03 Patentblatt 03/38
Arbeitsblatt. Puffer
 Arbeitsblatt Ziele: Vertiefen des konzeptes Anwenden der Henderson-Hasselbalch Gleichung: i) Berechnen der ph-änderung bei Zugabe von Säure (mit konkreten Konzentrationen durchgeführte Repetition des Wandtafelbeispiels)
Arbeitsblatt Ziele: Vertiefen des konzeptes Anwenden der Henderson-Hasselbalch Gleichung: i) Berechnen der ph-änderung bei Zugabe von Säure (mit konkreten Konzentrationen durchgeführte Repetition des Wandtafelbeispiels)
Kennzeichnungspflicht für Nanomaterial in Lebensmitteln
 Kennzeichnungspflicht für Nanomaterial in Lebensmitteln Dr. Axel Preuß Berlin, 15.06.2015 1 Neue Kennzeichnungspflicht für Nanomaterial bei Lebensmitteln Artikel 18, Abs. 3 LMIV: Niedersächsisches Landesamt
Kennzeichnungspflicht für Nanomaterial in Lebensmitteln Dr. Axel Preuß Berlin, 15.06.2015 1 Neue Kennzeichnungspflicht für Nanomaterial bei Lebensmitteln Artikel 18, Abs. 3 LMIV: Niedersächsisches Landesamt
Fragen aus dem ersten Abschnitt der pharmazeutischen Prüfung
 Agenda Sildenafil - Synthese Fragen aus dem ersten Abschnitt der pharmazeutischen Prüfung Umlagerungen Arzneistoffsynthese Sildenafil Sildenafil Vardenafil Tadalafil Arzneistoffsynthese Sildenafil Arzneistoffsynthese
Agenda Sildenafil - Synthese Fragen aus dem ersten Abschnitt der pharmazeutischen Prüfung Umlagerungen Arzneistoffsynthese Sildenafil Sildenafil Vardenafil Tadalafil Arzneistoffsynthese Sildenafil Arzneistoffsynthese
4. Ergebnisse. Tab. 10:
 4. Ergebnisse 4.1 in vitro-ergebnisse Es war aus sicherheitstechnischen und arbeitsrechtlichen Gründen nicht möglich, die für den Tierversuch hergestellten, radioaktiv markierten PMMA-Nanopartikel auf
4. Ergebnisse 4.1 in vitro-ergebnisse Es war aus sicherheitstechnischen und arbeitsrechtlichen Gründen nicht möglich, die für den Tierversuch hergestellten, radioaktiv markierten PMMA-Nanopartikel auf
2.2 Silika-Polymer-Hybridpartikel
 2.2 lika-polymer-hybridpartikel Als Hybride werden allgemein Systeme bezeichnet, die aus anorganischen, oft oxidischen und organischen, oft polymeren Komponenten bestehen [82]. Vinylcopolymere aus Polymer-
2.2 lika-polymer-hybridpartikel Als Hybride werden allgemein Systeme bezeichnet, die aus anorganischen, oft oxidischen und organischen, oft polymeren Komponenten bestehen [82]. Vinylcopolymere aus Polymer-
The cytoskeleton and beam theory
 The cytoskeleton and beam theory Intermediary filament Actin Microtubuli Aktin Intermediäre Filamente Mikrotubuli BPM 2.2 2 Aktin actin.pdb Gaub,Rief/SS 2005 BPM 2.2 3 Aktin BPM 2.2 4 Gaub,Rief/SS 2005
The cytoskeleton and beam theory Intermediary filament Actin Microtubuli Aktin Intermediäre Filamente Mikrotubuli BPM 2.2 2 Aktin actin.pdb Gaub,Rief/SS 2005 BPM 2.2 3 Aktin BPM 2.2 4 Gaub,Rief/SS 2005
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2015/16 vom
 Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2015/16 vom 18.09.2015 A1 A2 A3 A4 A5 Note 15 5 9 11 10 NAME:... VORNAME:...LÖSUNGSSTICHPUNKTE... Pseudonym für Ergebnisveröffentlichung:... Schreiben
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2015/16 vom 18.09.2015 A1 A2 A3 A4 A5 Note 15 5 9 11 10 NAME:... VORNAME:...LÖSUNGSSTICHPUNKTE... Pseudonym für Ergebnisveröffentlichung:... Schreiben
Kettenreaktionen. Kapitel 2. In diesem Kapitel sollen die folgenden Fragen beantwortet werden:
 Kapitel 2 Kettenreaktionen In diesem Kapitel sollen die folgenden Fragen beantwortet werden: Was versteht man unter einer Kettenreaktion? Welches sind die verschiedenen Typen von Reaktionsschritten, die
Kapitel 2 Kettenreaktionen In diesem Kapitel sollen die folgenden Fragen beantwortet werden: Was versteht man unter einer Kettenreaktion? Welches sind die verschiedenen Typen von Reaktionsschritten, die
Ultrafeine Partikel im Innenraum: Entstehung und Vorkommen
 Fortbildung für f r den Öffentlichen Gesundheitsdienst Berlin, 19.-21. März M 27 Ultrafeine Partikel im Innenraum: Entstehung und Vorkommen Dieter Bake Umweltbundesamt Fachgebiet Innenraumhygiene dieter.bake@uba.de
Fortbildung für f r den Öffentlichen Gesundheitsdienst Berlin, 19.-21. März M 27 Ultrafeine Partikel im Innenraum: Entstehung und Vorkommen Dieter Bake Umweltbundesamt Fachgebiet Innenraumhygiene dieter.bake@uba.de
(Atommassen: Ca = 40, O = 16, H = 1;
 1.) Welche Molarität hat eine 14,8%ige Ca(OH) 2 - Lösung? (Atommassen: Ca = 40, O = 16, H = 1; M: mol/l)! 1! 2! 2,5! 3! 4 M 2.) Wieviel (Gewichts)%ig ist eine 2-molare Salpetersäure der Dichte 1,100 g/cm
1.) Welche Molarität hat eine 14,8%ige Ca(OH) 2 - Lösung? (Atommassen: Ca = 40, O = 16, H = 1; M: mol/l)! 1! 2! 2,5! 3! 4 M 2.) Wieviel (Gewichts)%ig ist eine 2-molare Salpetersäure der Dichte 1,100 g/cm
BELLAND alkalisch lösliche Hotmelt
 BELLAND alkalisch lösliche Hotmelt Verarbeitung und Handhabung BELLAND Hotmelt (Hot melt pressure sensitive adhesive) BELLAND Hotmelt (HMPSA) bieten Problemlösungen für Einsatzgebiete, in denen Klebeverbindungen
BELLAND alkalisch lösliche Hotmelt Verarbeitung und Handhabung BELLAND Hotmelt (Hot melt pressure sensitive adhesive) BELLAND Hotmelt (HMPSA) bieten Problemlösungen für Einsatzgebiete, in denen Klebeverbindungen
CHEMIE KAPITEL 4 SÄURE- BASE. Timm Wilke. Georg- August- Universität Göttingen. Wintersemester 2013 / 2014
 CHEMIE KAPITEL 4 SÄURE- BASE Timm Wilke Georg- August- Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Historisches Im 17. Jahrhundert wurden von Robert Boyle Gemeinsamkeiten verschiedener Verbindungen
CHEMIE KAPITEL 4 SÄURE- BASE Timm Wilke Georg- August- Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Historisches Im 17. Jahrhundert wurden von Robert Boyle Gemeinsamkeiten verschiedener Verbindungen
Vorkurs Allgemeine Chemie für Ingenieure und Biologen 22. Oktober 2015 Dr. Helmut Sitzmann, Apl.-Professor für Anorganische Chemie
 Vorkurs Allgemeine Chemie für Ingenieure und Biologen 22. Oktober 2015 Dr. Helmut Sitzmann, Apl.-Professor für Anorganische Chemie DAS CHEMISCHE GLEICHGEWICHT Schwefel schmilzt bei 119 C. Bei dieser Temperatur
Vorkurs Allgemeine Chemie für Ingenieure und Biologen 22. Oktober 2015 Dr. Helmut Sitzmann, Apl.-Professor für Anorganische Chemie DAS CHEMISCHE GLEICHGEWICHT Schwefel schmilzt bei 119 C. Bei dieser Temperatur
Lösungen V 9. Gesättigte Lösung: ein gelöstes Salz steht mit seiner festen Phase, dem Bodenkörper, im Gleichgewicht
 Gesättigte Lösung: ein gelöstes Salz steht mit seiner festen Phase, dem Bodenkörper, im Gleichgewicht Löslichkeit: maximale Masse an in Lösung gehenden Salzen bezogen auf eine Lösungsmittelmenge; (T-abhängig)
Gesättigte Lösung: ein gelöstes Salz steht mit seiner festen Phase, dem Bodenkörper, im Gleichgewicht Löslichkeit: maximale Masse an in Lösung gehenden Salzen bezogen auf eine Lösungsmittelmenge; (T-abhängig)
Sauerstoffzuleitung Widerstandsheizung Quarzrohr Wafer in Carrier. Bubblergefäß mit Wasser (~95 C) Abb. 1.1: Darstellung eines Oxidationsofens
 1 Oxidation 1.1 Erzeugung von Oxidschichten 1.1.1 Thermische Oxidation Bei der thermischen Oxidation werden die Siliciumwafer bei ca. 1000 C in einem Oxidationsofen oxidiert. Dieser Ofen besteht im Wesentlichen
1 Oxidation 1.1 Erzeugung von Oxidschichten 1.1.1 Thermische Oxidation Bei der thermischen Oxidation werden die Siliciumwafer bei ca. 1000 C in einem Oxidationsofen oxidiert. Dieser Ofen besteht im Wesentlichen
AC2 ÜB12 Säuren und Basen LÖSUNGEN Seite 1 von 7
 AC2 ÜB12 Säuren und Basen LÖSUNGEN Seite 1 von 7 1. a) CH3COOH, C0=0.125 mol/l Schwache Säure pks = 4.75 (aus Tabelle) => ph = 0.5*(4.75-Log(0.125))= 2.83 b) H24, C0=0.1 mol/l Erste Protolysestufe starke
AC2 ÜB12 Säuren und Basen LÖSUNGEN Seite 1 von 7 1. a) CH3COOH, C0=0.125 mol/l Schwache Säure pks = 4.75 (aus Tabelle) => ph = 0.5*(4.75-Log(0.125))= 2.83 b) H24, C0=0.1 mol/l Erste Protolysestufe starke
5 Deposition von Nanopartikeln im homogenen elektrischen Feld
 5 Deposition von Nanopartikeln im homogenen elektrischen Feld In diesem Kapitel werden nach der Beschreibung der verwendeten Versuchsanlage die makrokopischen Aspekte der Deposition (Phase 1) von einfach
5 Deposition von Nanopartikeln im homogenen elektrischen Feld In diesem Kapitel werden nach der Beschreibung der verwendeten Versuchsanlage die makrokopischen Aspekte der Deposition (Phase 1) von einfach
Versuch 2: Glasartige Monolithe und Filme durch Sol-Gel-Chemie
 Versuch 2: Glasartige Monolithe und Filme durch Sol-Gel-Chemie Glas und Keramik werden traditionell durch Hochtemperaturprozesse erzeugt, in denen die Ausgangsmaterialien durch Schmelzen oder Sintern in
Versuch 2: Glasartige Monolithe und Filme durch Sol-Gel-Chemie Glas und Keramik werden traditionell durch Hochtemperaturprozesse erzeugt, in denen die Ausgangsmaterialien durch Schmelzen oder Sintern in
Aufgabe: Untersuchung der Kinetik der Zersetzung von Harnstoff durch Urease.
 A 36 Michaelis-Menten-Kinetik: Hydrolyse von Harnstoff Aufgabe: Untersuchung der Kinetik der Zersetzung von Harnstoff durch Urease. Grundlagen: a) Michaelis-Menten-Kinetik Im Bereich der Biochemie spielen
A 36 Michaelis-Menten-Kinetik: Hydrolyse von Harnstoff Aufgabe: Untersuchung der Kinetik der Zersetzung von Harnstoff durch Urease. Grundlagen: a) Michaelis-Menten-Kinetik Im Bereich der Biochemie spielen
Aufgabe 1) Ergänzen Sie Name oder Struktur und beantworten Sie die Fragen. (10 Punkte) Name:Tryptophan Name: Name: Enolat Name: Vollacetal
 OC I- Test-Klausur SS2012 Die Test-Klausur wird Freitag 13.7. während der Vorlesung besprochen. Bereitet Euch vor! Generelles: pka-werte aus dem Skript müssen mit Werten gekonnt werden. Ebenfalls wichtige
OC I- Test-Klausur SS2012 Die Test-Klausur wird Freitag 13.7. während der Vorlesung besprochen. Bereitet Euch vor! Generelles: pka-werte aus dem Skript müssen mit Werten gekonnt werden. Ebenfalls wichtige
LeWis» ph-wert Berechnungen «Kapitel 5
 Additum 5. Wässrige Lösungen mehrprotoniger Säuren und Basen Ziel dieses Kapitels ist es, eine weitere Anwendungsmöglichkeit des bisher erlernten Vorgehenskonzepts vorzustellen. Die Berechnung von ph-werten
Additum 5. Wässrige Lösungen mehrprotoniger Säuren und Basen Ziel dieses Kapitels ist es, eine weitere Anwendungsmöglichkeit des bisher erlernten Vorgehenskonzepts vorzustellen. Die Berechnung von ph-werten
Folgende Anforderungen müssen von den chemischen Lösungen erfüllt werden: die Ätzung muss durch Verdünnung mit Wasser gestoppt werden können
 1 Nasschemie 1.1 Nassätzen 1.1.1 Prinzip Das Prinzip beim Nassätzen ist die Umwandlung des festen Materials der Schicht in flüssige Verbindungen unter zu Hilfenahme einer chemischen Lösung. Die Selektivität
1 Nasschemie 1.1 Nassätzen 1.1.1 Prinzip Das Prinzip beim Nassätzen ist die Umwandlung des festen Materials der Schicht in flüssige Verbindungen unter zu Hilfenahme einer chemischen Lösung. Die Selektivität
Sommersemester 2016 Seminar Stöchiometrie
 Sommersemester 2016 Seminar Stöchiometrie Themenüberblick Kurze Wiederholung der wichtigsten Formeln Neue Themen zur Abschlussklausur: 1. Elektrolytische Dissoziation 2. ph-wert Berechnung 3. Puffer Wiederholung
Sommersemester 2016 Seminar Stöchiometrie Themenüberblick Kurze Wiederholung der wichtigsten Formeln Neue Themen zur Abschlussklausur: 1. Elektrolytische Dissoziation 2. ph-wert Berechnung 3. Puffer Wiederholung
Grundversuch 1 (Praktikum Nichtmetallische Werkstoffe)
 1 Grundversuch 1 (Praktikum Nichtmetallische Werkstoffe) Dieser Versuch soll einerseits die chemischen Hintergründe der Pulverherstellung vermitteln, andererseits soll er an zwei praktischen Beispielen
1 Grundversuch 1 (Praktikum Nichtmetallische Werkstoffe) Dieser Versuch soll einerseits die chemischen Hintergründe der Pulverherstellung vermitteln, andererseits soll er an zwei praktischen Beispielen
Silicium. Darstellung:
 Vorkommen: Universum: nach H, He, C, N, O und Ne an 7. Stelle Erdkruste: nach O (45,5%) das häufigste Element: 27,2% nur an O gebunden: stets tetraedrische [SiO 4 ]-Einheiten Darstellung: Silicium Technik:
Vorkommen: Universum: nach H, He, C, N, O und Ne an 7. Stelle Erdkruste: nach O (45,5%) das häufigste Element: 27,2% nur an O gebunden: stets tetraedrische [SiO 4 ]-Einheiten Darstellung: Silicium Technik:
Wintersemester 2016 Seminar Stöchiometrie
 Wintersemester 2016 Seminar Stöchiometrie Tutorien Raum Termin Hörsaal OSZ H5 Mo. 19.12., 18-20 Uhr Hörsaal OSZ H5 Fr. 13.1.,16-18 Uhr Hörsaal OSZ H5 Mo. 30.01., 18-20 Uhr Hörsaal OSZ H5 Mo. 06.02., 18-20
Wintersemester 2016 Seminar Stöchiometrie Tutorien Raum Termin Hörsaal OSZ H5 Mo. 19.12., 18-20 Uhr Hörsaal OSZ H5 Fr. 13.1.,16-18 Uhr Hörsaal OSZ H5 Mo. 30.01., 18-20 Uhr Hörsaal OSZ H5 Mo. 06.02., 18-20
Nano-SiO 2 in PUR-Klarlacken
 Nano-SiO 2 in PUR-Klarlacken Neuartige Stabilisierung von Sol-Gel-Nanopartikeln in hochkratzfesten Dual-Cure-Systemen. Die Verbesserung der Kratzfestigkeit von Klarlacken mit Nanopartikeln wird gegenwärtig
Nano-SiO 2 in PUR-Klarlacken Neuartige Stabilisierung von Sol-Gel-Nanopartikeln in hochkratzfesten Dual-Cure-Systemen. Die Verbesserung der Kratzfestigkeit von Klarlacken mit Nanopartikeln wird gegenwärtig
Übungsklausur "Nanostrukturen aus chemischer Sicht I" WS 2006/2007. Name Ergebnis: % Note:
 Übungsklausur "Nanostrukturen aus chemischer Sicht I" WS 2006/2007 Name Ergebnis: % Note: Aufg1 Aufg2 Aufg3 Aufg4 Aufg5 Aufg6 Aufg7 Aufg8 Aufg9 Aufg10 /3 /7 /4 /8 /7 /9 /9 /7 /6 /12 /72 Richtlinie zur
Übungsklausur "Nanostrukturen aus chemischer Sicht I" WS 2006/2007 Name Ergebnis: % Note: Aufg1 Aufg2 Aufg3 Aufg4 Aufg5 Aufg6 Aufg7 Aufg8 Aufg9 Aufg10 /3 /7 /4 /8 /7 /9 /9 /7 /6 /12 /72 Richtlinie zur
Elektrolyte. (aus: Goldenberg, SOL)
 Elektrolyte Elektrolyte leiten in wässriger Lösung Strom. Zu den Elektrolyten zählen Säuren, Basen und Salze, denn diese alle liegen in wässriger Lösung zumindest teilweise in Ionenform vor. Das Ostwaldsche
Elektrolyte Elektrolyte leiten in wässriger Lösung Strom. Zu den Elektrolyten zählen Säuren, Basen und Salze, denn diese alle liegen in wässriger Lösung zumindest teilweise in Ionenform vor. Das Ostwaldsche
Chemie Protokoll. Versuch 2 3 (RKV) Reaktionskinetik Esterverseifung. Stuttgart, Sommersemester 2012
 Chemie Protokoll Versuch 2 3 (RKV) Reaktionskinetik Esterverseifung Stuttgart, Sommersemester 202 Gruppe 0 Jan Schnabel Maximilian Möckel Henri Menke Assistent: Durmus 20. Mai 202 Inhaltsverzeichnis Theorie
Chemie Protokoll Versuch 2 3 (RKV) Reaktionskinetik Esterverseifung Stuttgart, Sommersemester 202 Gruppe 0 Jan Schnabel Maximilian Möckel Henri Menke Assistent: Durmus 20. Mai 202 Inhaltsverzeichnis Theorie
Nanomaterialien Synthese, Charakterisierung und Eigenschaften
 Nanomaterialien Synthese, Charakterisierung und Eigenschaften Prof. Dr. Johann Plank Department Chemie Technische Universität München Nanopartikel Sonnencreme Desinfektion von Trinkwasser TiO 2 Nanopartikel
Nanomaterialien Synthese, Charakterisierung und Eigenschaften Prof. Dr. Johann Plank Department Chemie Technische Universität München Nanopartikel Sonnencreme Desinfektion von Trinkwasser TiO 2 Nanopartikel
Schema 1: Reaktion von Etherphosphankomplexen des Rutheniums mit gelösten und immobilisierten 1,2- Diaminen; a: R = Ph, b: R = ipr, c: R = Me
 Bericht zu Projekt 2519 der Max-Buchner-Forschungsstiftung Stipendium für F. Novak (abgelöst durch E. Popa) Modifikation von Elektroden und SiO 2 -Nanopartikeln mit redoxaktiven Übergangsmetallkomplexen
Bericht zu Projekt 2519 der Max-Buchner-Forschungsstiftung Stipendium für F. Novak (abgelöst durch E. Popa) Modifikation von Elektroden und SiO 2 -Nanopartikeln mit redoxaktiven Übergangsmetallkomplexen
Synthese von mesoporösen anorganischen Oxid-Nanopartikeln in Miniemulsion
 Organische Chemie III - Makromolekulare Chemie und Organische Materialien Max-Planck-Institut für Polymerforschung Physikalische Chemie der Polymere Synthese von mesoporösen anorganischen Oxid-Nanopartikeln
Organische Chemie III - Makromolekulare Chemie und Organische Materialien Max-Planck-Institut für Polymerforschung Physikalische Chemie der Polymere Synthese von mesoporösen anorganischen Oxid-Nanopartikeln
Diskussion der Ergebnisse
 5 Diskussion der Ergebnisse Die Auswertung der Basiseigenschaften der Gläser beider Versuchsreihen lieferte folgende Ergebnisse: Die optische Einteilung der hergestellten Gläser konnte in zwei Gruppen
5 Diskussion der Ergebnisse Die Auswertung der Basiseigenschaften der Gläser beider Versuchsreihen lieferte folgende Ergebnisse: Die optische Einteilung der hergestellten Gläser konnte in zwei Gruppen
Anorganische-Chemie. Dr. Stefan Wuttke Butenandstr. 11, Haus E, E
 Dr. Stefan Wuttke Butenandstr. 11, Haus E, E 3.039 stefan.wuttke@cup.uni-muenchen.de www.wuttkegroup.de Anorganische-Chemie Grundpraktikum für Biologen 2016 Wie zählen wir Mengen in der Chemie? Stefan
Dr. Stefan Wuttke Butenandstr. 11, Haus E, E 3.039 stefan.wuttke@cup.uni-muenchen.de www.wuttkegroup.de Anorganische-Chemie Grundpraktikum für Biologen 2016 Wie zählen wir Mengen in der Chemie? Stefan
Zusammenfassung. Summary
 Dynamik eigenschaftsverteilter Partikelsysteme: Partikelfällung in Emulsionen Dynamics of Population Balance Systems: Particle Precipition in Emulsions Niemann, Björn; Rauscher, Frank; Voigt, Andreas;
Dynamik eigenschaftsverteilter Partikelsysteme: Partikelfällung in Emulsionen Dynamics of Population Balance Systems: Particle Precipition in Emulsions Niemann, Björn; Rauscher, Frank; Voigt, Andreas;
Chemie Stufe 13 / Aromaten / Phenol Folie 01. Das Phenol-Molekül. δ δ+ sp 3. sp 2
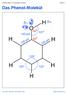 Chemie Stufe 13 / Aromaten / Phenol Folie 01 Das Phenol-Molekül δ δ+ sp 3 sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 02 Das Phenolat-Ion sp 3 H + sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 03 Grenzstrukturen
Chemie Stufe 13 / Aromaten / Phenol Folie 01 Das Phenol-Molekül δ δ+ sp 3 sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 02 Das Phenolat-Ion sp 3 H + sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 03 Grenzstrukturen
8 Carbonsäuren und Derivate
 8 arbonsäuren und Derivate 8.1 Allgemeine Darstellungsverfahren xidation primärer Alkohole und Aldehyde (s. Kap. 6) 2 2 xidation durch r 3 /, KMn 4 /, N 3 aloform-eaktion (s. Kap. 9) 3 Br 2 xidation von
8 arbonsäuren und Derivate 8.1 Allgemeine Darstellungsverfahren xidation primärer Alkohole und Aldehyde (s. Kap. 6) 2 2 xidation durch r 3 /, KMn 4 /, N 3 aloform-eaktion (s. Kap. 9) 3 Br 2 xidation von
3. Mikrostruktur und Phasenübergänge
 3. Mikrostruktur und Phasenübergänge Definition von Mikrostruktur und Gefüge Gefüge bezeichnet die Beschaffenheit der Gesamtheit jener Teilvolumina eines Werkstoffs, von denen jedes hinsichtlich seiner
3. Mikrostruktur und Phasenübergänge Definition von Mikrostruktur und Gefüge Gefüge bezeichnet die Beschaffenheit der Gesamtheit jener Teilvolumina eines Werkstoffs, von denen jedes hinsichtlich seiner
Wintersemester 2017 Seminar Stöchiometrie
 Wintersemester 2017 Seminar Stöchiometrie Themenüberblick Kurze Wiederholung der wichtigsten Formeln Neue Themen zur Abschlussklausur: 1. Elektrolytische Dissoziation 2. ph-wert Berechnung 3. Puffer Wiederholung
Wintersemester 2017 Seminar Stöchiometrie Themenüberblick Kurze Wiederholung der wichtigsten Formeln Neue Themen zur Abschlussklausur: 1. Elektrolytische Dissoziation 2. ph-wert Berechnung 3. Puffer Wiederholung
Schülerlabor. Modul: Funktionale Polymere. Betreuung durch das MPI für Polymerforschung, Mainz (Gunnar Kircher und Wolfgang H.
 1 Schülerlabor Modul: Funktionale Polymere Betreuung durch das MPI für Polymerforschung, Mainz (Gunnar Kircher und Wolfgang H.Meyer) Lerninhalte: Projektschritte: Bedeutung von funktionalen Polymeren Struktur
1 Schülerlabor Modul: Funktionale Polymere Betreuung durch das MPI für Polymerforschung, Mainz (Gunnar Kircher und Wolfgang H.Meyer) Lerninhalte: Projektschritte: Bedeutung von funktionalen Polymeren Struktur
Biochemische UE Alkaline Phosphatase.
 Biochemische UE Alkaline Phosphatase peter.hammerl@sbg.ac.at Alkaline Phosphatase: Katalysiert die Hydrolyse von Phosphorsäure-Estern: O - O - Ser-102 R O P==O O - H 2 O R OH + HO P==O O - ph-optimum im
Biochemische UE Alkaline Phosphatase peter.hammerl@sbg.ac.at Alkaline Phosphatase: Katalysiert die Hydrolyse von Phosphorsäure-Estern: O - O - Ser-102 R O P==O O - H 2 O R OH + HO P==O O - ph-optimum im
Mechanismen nucleophiler Substitutionen am aliphatischen Kohlenstoff
 Vorlesung 16 Mechanismen nucleophiler Substitutionen am aliphatischen Kohlenstoff Bimolekulare nucleophile Substitutionen (S N 2-Reaktionen) In Vorlesung 11 hatten wir bereits die nucleophile Substitution
Vorlesung 16 Mechanismen nucleophiler Substitutionen am aliphatischen Kohlenstoff Bimolekulare nucleophile Substitutionen (S N 2-Reaktionen) In Vorlesung 11 hatten wir bereits die nucleophile Substitution
6. Carbonyl-Verbindungen
 6. Carbonyl-Verbindungen Hierher gehören vor allem die Aldehyde und Ketone. (später: Die Carbonyl-Gruppe weisen auch die Carbonsäuren und ihre Derivate auf). Carbonylgruppe. Innerhalb der Sauerstoff-Kohlenstoff-Doppelbindung
6. Carbonyl-Verbindungen Hierher gehören vor allem die Aldehyde und Ketone. (später: Die Carbonyl-Gruppe weisen auch die Carbonsäuren und ihre Derivate auf). Carbonylgruppe. Innerhalb der Sauerstoff-Kohlenstoff-Doppelbindung
4 LÖSLICHKEITSPRODUKT
 Arbeitsunterlagen zur Vorlesung CHEMISCHES RECHNEN 701.118 (Auflage November 005) Einheit 4 LÖSLICHKEITSPRODUKT und KOMPLEXBILDUNG Institut für Chemie Universität für Bodenkultur T. Prohaska 4 LÖSLICHKEITSPRODUKT
Arbeitsunterlagen zur Vorlesung CHEMISCHES RECHNEN 701.118 (Auflage November 005) Einheit 4 LÖSLICHKEITSPRODUKT und KOMPLEXBILDUNG Institut für Chemie Universität für Bodenkultur T. Prohaska 4 LÖSLICHKEITSPRODUKT
c Herstellung durch Aufbaureaktionen
 c Herstellung durch Aufbaureaktionen Aufbau von Kolloiden aus einer Lösung Entstehung und Zerstörung von Dispersionen OSTWALD Reifung: größere Partikel wachsen auf Kosten kleinerer c Aufbaureaktionen Aufbaureaktionen
c Herstellung durch Aufbaureaktionen Aufbau von Kolloiden aus einer Lösung Entstehung und Zerstörung von Dispersionen OSTWALD Reifung: größere Partikel wachsen auf Kosten kleinerer c Aufbaureaktionen Aufbaureaktionen
Blanc Fixe in Klarlacken
 Blanc Fixe in Klarlacken Oberflächenbehandelte Nano-Bariumsulfate verbessern Härte, Glanz und Transparenz. Bariumsulfat ist schon lange ein bewährter Füllstoff für Lacke. Wegen der hohen Lichtstreuung
Blanc Fixe in Klarlacken Oberflächenbehandelte Nano-Bariumsulfate verbessern Härte, Glanz und Transparenz. Bariumsulfat ist schon lange ein bewährter Füllstoff für Lacke. Wegen der hohen Lichtstreuung
Teil B: Herstellung von Alinitzement aus Mansfelder Kupferschlacke, MVA-Flugasche und Kalksteinmehl
 Teil B: Herstellung von Alinitzement aus Mansfelder Kupferschlacke, MVA-Flugasche und Kalksteinmehl 11.0 Alinit Nachfolgend ist die chemische Zusammensetzung von Alinit nach verschiedenen Autoren angegeben
Teil B: Herstellung von Alinitzement aus Mansfelder Kupferschlacke, MVA-Flugasche und Kalksteinmehl 11.0 Alinit Nachfolgend ist die chemische Zusammensetzung von Alinit nach verschiedenen Autoren angegeben
Wasserchemie und Wasseranalytik SS 2015
 Wasserchemie und Wasseranalytik SS 015 Übung zum Vorlesungsblock II Wasserchemie Dr.-Ing. Katrin Bauerfeld 5,5 6,5 7,5 8,5 9,5 10,5 11,5 1,5 13,5 Anteile [%] Übungsaufgaben zu Block II Wasserchemie 1.
Wasserchemie und Wasseranalytik SS 015 Übung zum Vorlesungsblock II Wasserchemie Dr.-Ing. Katrin Bauerfeld 5,5 6,5 7,5 8,5 9,5 10,5 11,5 1,5 13,5 Anteile [%] Übungsaufgaben zu Block II Wasserchemie 1.
1. Klausur zum Organisch-Chemischen Grundpraktikum des WS 2008/2009. Donnerstag, 4. Dezember 2008, 15:15-18:15 h, Hörsaal Chemie
 INSTITUT FÜR ORGANISCHE CHEMIE UND BIOCHEMIE ALBERT-LUDWIGS-UNIVERSITÄT FREIBURG ALBERTSTR. 21 79104 FREIBURG CHEMISCHES LABORATORIUM Prof. Dr. Dietmar A. Plattner 1. Klausur zum Organisch-Chemischen Grundpraktikum
INSTITUT FÜR ORGANISCHE CHEMIE UND BIOCHEMIE ALBERT-LUDWIGS-UNIVERSITÄT FREIBURG ALBERTSTR. 21 79104 FREIBURG CHEMISCHES LABORATORIUM Prof. Dr. Dietmar A. Plattner 1. Klausur zum Organisch-Chemischen Grundpraktikum
Abschlussbericht. Prof. Regina Palkovits, Tanja Franken (M. Sc.)
 Abschlussbericht Struktur-Aktivitätsbeziehungen von Cu x Co 3-x O 4 Spinellen als Katalysatoren in der katalytischen Zersetzung von N 2 O 1. Einleitung und Motivation Prof. Regina Palkovits, Tanja Franken
Abschlussbericht Struktur-Aktivitätsbeziehungen von Cu x Co 3-x O 4 Spinellen als Katalysatoren in der katalytischen Zersetzung von N 2 O 1. Einleitung und Motivation Prof. Regina Palkovits, Tanja Franken
Klausur zur Vorlesung OC1 Teilklausur 2 SS 2013 am
 Klausur zur Vorlesung OC1 Teilklausur 2 SS 2013 am 13.07.2013 Name...MUSTERLÖSUNG... Vorname... Matrikel-Nr... Viel Erfolg! Maximal zu erreichende Punktzahl 50 Punkte Für die Korrektur Erzielte Punkte
Klausur zur Vorlesung OC1 Teilklausur 2 SS 2013 am 13.07.2013 Name...MUSTERLÖSUNG... Vorname... Matrikel-Nr... Viel Erfolg! Maximal zu erreichende Punktzahl 50 Punkte Für die Korrektur Erzielte Punkte
Technische Universität Dresden Fachrichtung Chemie Modul OC II
 Name: Matrikelnummer: Fachsemester Studienfach: LC Chemie-Bachelor Lehramt-Staatsex. Lehramt-Master Praktikumsteilnehmer und Nachschreiber Praktikumsteilnahme (bitte deutlich lesbar ausfüllen) SoSe 2016
Name: Matrikelnummer: Fachsemester Studienfach: LC Chemie-Bachelor Lehramt-Staatsex. Lehramt-Master Praktikumsteilnehmer und Nachschreiber Praktikumsteilnahme (bitte deutlich lesbar ausfüllen) SoSe 2016
Chem. Grundlagen. ure-base Begriff. Das Protonen-Donator-Akzeptor-Konzept. Wasserstoff, Proton und Säure-Basen. Basen-Definition nach Brønsted
 Der SäureS ure-base Begriff Chem. Grundlagen Das Protonen-Donator-Akzeptor-Konzept Wasserstoff, Proton und Säure-Basen Basen-Definition nach Brønsted Wasserstoff (H 2 ) Proton H + Anion (-) H + = Säure
Der SäureS ure-base Begriff Chem. Grundlagen Das Protonen-Donator-Akzeptor-Konzept Wasserstoff, Proton und Säure-Basen Basen-Definition nach Brønsted Wasserstoff (H 2 ) Proton H + Anion (-) H + = Säure
Welcher Indikator ist für die Titration von Essigsäure (pks =4.76) mit Natronlauge am besten geeignet?
 1. Aufgaben zu Versuchstag 1: Säure-Base-Titration Aufgabe 1.1 Welche der folgenden Aussagen ist falsch? A) Säuren erhöhen durch Abgabe eines Protons an Wasser die H3O + -Konzentration einer Lösung. B)
1. Aufgaben zu Versuchstag 1: Säure-Base-Titration Aufgabe 1.1 Welche der folgenden Aussagen ist falsch? A) Säuren erhöhen durch Abgabe eines Protons an Wasser die H3O + -Konzentration einer Lösung. B)
Klausur in Anorganischer Chemie
 1 Klausur in Anorganischer Chemie zum Praktikum Chemie für Biologen, SS2000 Kurse SS Sa 20.05.2000 Name:... Vorname:... Wenn Nachschreiber aus einem der Vorkurse, bitte eintragen: Geb. am in Semester des
1 Klausur in Anorganischer Chemie zum Praktikum Chemie für Biologen, SS2000 Kurse SS Sa 20.05.2000 Name:... Vorname:... Wenn Nachschreiber aus einem der Vorkurse, bitte eintragen: Geb. am in Semester des
Analytische Chemie. B. Sc. Chemieingenieurwesen. 05. Februar Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 05. Februar 2007 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 05. Februar 2007 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
9. Festkörperreaktionen
 9. Festkörperreaktionen Wir hatten bereits bei der Diskussion von Diffusionsvorgängen gesehen, dass auch im festen Zustand Atome ständig ihre Plätze tauschen und so chemische Reaktionen in fester Materie
9. Festkörperreaktionen Wir hatten bereits bei der Diskussion von Diffusionsvorgängen gesehen, dass auch im festen Zustand Atome ständig ihre Plätze tauschen und so chemische Reaktionen in fester Materie
Olefinierungen. H. Fricke, S. Gocke
 Olefinierungen H. Fricke, S. Gocke 29.11.2004 Inhalt Wittig-Reaktion Klassische Wittig-Reaktion, Schlosser-Variante Wittig-Horner-Reaktion Horner-Wadsworth-Emmons-Reaktion (HWE) Klassische HWE, Still-Gennari-Variante
Olefinierungen H. Fricke, S. Gocke 29.11.2004 Inhalt Wittig-Reaktion Klassische Wittig-Reaktion, Schlosser-Variante Wittig-Horner-Reaktion Horner-Wadsworth-Emmons-Reaktion (HWE) Klassische HWE, Still-Gennari-Variante
