4.2.2.Das Wasserstoff-Molekül H 2 Vergleich der Wellenfunktionen für antiparallele Spinkonfiguration
|
|
|
- Hetty Maier
- vor 7 Jahren
- Abrufe
Transkript
1 g Das Wasserstoff-Molekül H 2 Vergleich der Wellenfunktionen für antiparallele Spinkonfiguration a () ϕ ( 2) ϕ ( 2) ϕ ( 1) ψ = ϕ + 1 b a b Heitler-London ( ) ϕ ( 2) + ϕ ( 2) ϕ ( 1) + [ ϕ ( 1) ϕ ( 2) ϕ ( 1) ( 2) ] ψ + g = ϕ a 1 b a b c a a b ϕ b d = 0 Heitler-London + ionisch g [ ϕ () + ϕ () 1 ][ ϕ ( 2) ϕ ( 2) ] ψ = + Hund-Mulliken-Bloch a 1 b a b d = 1 Allgemeine Wellenfunktion ϕ ϕ + dϕ, ϕ ϕ + a a b b b dϕ a d 1 konstanter Koeffizient ψ g = [ ϕ a () 1 + dϕ b () 1 ][ ϕ b ( 2) + dϕ a ( 2) ] [ ϕ ( 2) + dϕ ( 2) ][ ϕ () 1 + dϕ () 1 ] + a b b a
2 Chemische Bindung: Modelle Valenzbindung-Theorie: die an der Bindung beteiligten Atomorbitale überlappen sich, bleiben aber als Atomorbitale erhalten. Heitler-London Modell Molekülorbital-Theorie: die Atomorbitale wechselwirken und bilden neue Orbitale: die Molekülorbitale. Hund-Mulliken-Bloch Modell Besetzung von Einelektronzuständen: aus Linearkombinationen von Atomorbitalen werden Molekülorbitale gebildet die Molekülorbitale werden ihrer energetischen Reihenfolge nach aufgefüllt, unter Berücksichtigung des Pauli-Prinzips die Besetzung energetisch entarteter Orbitale wird nach Hundschen Regel durchgeführt (Anordnung mit parallelen Spin bevorzugt)
3 4.2.3 Homonukleares zweiatomiges Molekül Atome A und B Molekül AB die zentrale Symmetrie des Coulomb-Feldes wird aufgehoben die Elektronen gehören gleichzeitig zu beiden Atomen die ursprünglich miteinander entarteten Zustände spalten auf Quantenzahlen: (n,l,m l,m s ) (n,λ, m s ) l präzediert um die z-achse mit einer gequantelten z-komponente l: keine gute Quantenzahl in AB A l r B l z =λh λ= m l =0,1,2,,l-1, l
4 m λ 0 ±1 ±2 ±3 λ Symbol σ π δ ϕ e - Zahl In nicht-rotierenden Moleküle sind die Drehimpulszustände (Ausnahme:σ) zweifach entartet. Molekülorbitale: Nomenklatur: getrennte Atome (R ) (n,λ) parität Beispiel: 1σ g,1σ u, 2σ g, 2σ u, 2π g,. (λ,n,l) Beispiel: σ1s A, σ2p B vereinigtes Atom (R 0) (n,l,λ) Beispiel: 1sσ, 2sσ, 2pσ, 2pπ,. σ*- antibindend
5 σ u 1s*=σ1s A -σ1s B 1s A 1s B Atom A σ g 1s =σ1s A +σ1s B Molekül Atom B
6 Molekülorbitale Nomenklatur: n,l,λ, Beispiel: 1sσ, 2sσ, 2pσ, 2pπ,. Konfiguration: (1sσ) 2 (1sσ) 2 (1sσ*) 2 Stabil: (1sσ) 2 (1sσ*)2sσ (excimer)
7
8 Besetzung der MOs H 2 -N 2 Bindungsordnung (BO) = Zahl der Elektronen in bindenden Orbitalen minus Zahl der Elektronen in antibindenden Orbitalen geteilt durch 2. Die Bindungsordnung im N 2 -Molekül ist 3, elementarer Stickstoff ist im Grundzustand diamagnetisch (Singulett-Zustand).
9 Besetzung der MOs O 2, F 2 Die Bindungsordnung im O 2 -Molekül ist 2, elementarer Sauerstoff ist im Grundzustand paramagnetisch (Triplett-Zustand).
10 Beispiele 8 Elektronen in bindenden MOs, 4 in antibindenden MOs Doppelbindung
11 Molekülorbitale Nomenklatur: n,l,λ, Beispiel: 1sσ, 2sσ, 2pσ, 2pπ,. Konfiguration: (1sσ) 2 (1sσ) 2 (1sσ*) 2 Stabil: (1sσ) 2 (1sσ*)2sσ (excimer)
12
13 Besetzung der MOs H 2 -N 2 Bindungsordnung (BO) = Zahl der Elektronen in bindenden Orbitalen minus Zahl der Elektronen in antibindenden Orbitalen geteilt durch 2. Die Bindungsordnung im N 2 -Molekül ist 3, elementarer Stickstoff ist im Grundzustand diamagnetisch (Singulett-Zustand).
14 Besetzung der MOs O 2, F 2 Die Bindungsordnung im O 2 -Molekül ist 2, elementarer Sauerstoff ist im Grundzustand paramagnetisch (Triplett-Zustand).
15 Beispiele 8 Elektronen in bindenden MOs, 4 in antibindenden MOs Doppelbindung
16 Heteronukleares zweiatomiges Molekül σ*=1s A -1s B 1s A 1s B Atom A (H) σ =1s A +1s B Molekül (HHe) + Atom B (He + )
17 Mehrelektronenzustände von zweiatomigen Molekülen A L = L( L +1)h B L r A S = S( S +1)h B S r L z =±Λh, mit Λ= Σλ i Λ= 0,1,2, Symbole: Σ, Π, S r L r J z =Ωh J r L z =Λh S z =Σh S z = Σh, mit Σ = S, S-1,, -S Spektroskopiescher Term: 2S+1 Λ Ω g, u: Parität d. Gesamtwellenfunktion +, - : symmetrisch bzw. antisymmetrisch gegenüber einer Spiegelung an einer Spiegelebene durch die Kernverbindungslinie
18 Spektroskopiescher Term: 2S+1 Λ Ω Beispiel: Ein Zustand sei durch (2pπ)(3sσ)(3dπ) mit 4 3/2 bezeichnet. Es gibt 3 Valenzelektronen mit: n= 2, l=1, λ=1 n= 3, l=0, λ=0 n= 3, l=2, λ=1 Für den Bahndrehimpuls gilt: Λ=1+1=2, daher Für den resultierenden Spin gilt: S=1/2+1/2+1/2=3/2, daher 2S+1=4 Wegen der Multiplizität 4 sind die folgende Konfigurationen möglich: 4 7/2, 4 5/2, 4 3/2, 4 1/2 Aufspaltung: W=A L S W= Spin-Bahn-Wechselwirkungsenergie
19 Spektroskopiescher Term: 2S+1 Λ Ω m l1 m l2
20 Mögliche Konfigurationen der beiden äußersten Elektronen im O 2 -Molekül
21 Spektroskopische Terme Grundzustand und tiefste elektronische Anregungs- Zustände des H 2 -Moleküls
22 Elektronische Terme des H 2 -Moleküls
23 Berechnete Potentialflächen für verschiedene Anregungszustände des H 2 -Moleküls R e (n=4) R e (n=1)
24 Spektroskopische Terme Elektronenkonfiguration homonuklearer zweiatomiger Moleküle Die eingeklammerten Moleküle sind nicht stabil. Diese Reihenfolge der Orbitale ist nicht in allen Fällen die energetische Sequenz. zb.o 2,F 2
25 5. Elektronen- und Rotations- Spektren von Molekülen
26 Absorptionsspektren Optische Dichte Elektronischer Übergang S 0 S 2 von Benzol: In der Gasphase: Rotations-Schwingungsstruktur Im Kristall: Spektrale Verschiebung gegenüber dem Lösungsspektrum Zweite Progression von Schwingungsbändern: Kristallsymmetrie beeinflusst die Symmetrie der Schwingungszustände
27 Energetische Niveaus in Moleküle I und II: Elektronische Zustände v: Quantenzahl der Schwingungsniveaus J: Quantenzahl der Rotationsniveaus E = E el + E vib + E rot
28 Optische Molekülspektren Rotationsspektren: Übergänge zwischen den Rotationsniveaus eines gegebenen Schwingungsniveaus Mikrowellen, Ferninfrarot Rotationsschwingungsspektren: Übergänge zwischen den Rotationsniveaus eines bestimmten Schwingungsniveaus zu den Rotationsniveaus eines anderen Schwingungsniveaus im gleichen Elektronenzustand Infrarot Elektronenspektren: Übergänge zwischen zwei Elektronenzustände Sichtbar, UV, Röntgenstrahlen Beispiel: HCl
29 5.1. Lichtabsorption: Elektronische Banden E = E el + E vib + E rot E ν =0 E ν =0 Intensität: bestimmt durch die Übergangsmatrixelemente und durch die Auswahlregeln: S = 0; Λ = 0; ±1; g u; + +; - -
30 Energie Franck-Condon Prinzip Elektronenübergänge erfolgen senkrecht unter Erhaltung des Kernabstandes R und mit größter Wahrscheinlichkeit zwischen den Bereichen der Wellenfunktion χ(r) in denen die Amplitude am größten ist. R e =R e R e >R e R Übergangswahrscheinlichkeit: χ v' ( R) χ ( ) v' ' R dvkerne Intensität
31 Photodissoziation D Direkte Photodissoziation durch Rotations-Schwingungs-Anregung nur durch Mehrquantenabsorption unter großen Photonenfluss möglich! z.b. mit Hilfe CO 2 Laser AB + nhν vib A*+B* (+E kin ) D Photodissoziation durch eine elektronische Anregung viel wahrscheinlicher!
32 Absorption und Fluoreszenz Absorptionsspektrum: Schwingungsstruktur des elektronischen Anregungszustandes Fluoreszenzspektrum: Schwingungsstruktur des elektronischen Grundszustandes
33 Absorption, Fluoreszenz und Phosphoreszenz
34 Elektronische Spektren größerer Moleküle: Chromophore C O Absorption durch nicht-bindende Elektronen, die zu einer lokalisierten Gruppe im Molekül gehören Beispiel: Carbonyl - Gruppe Ein Elektron von O wird in ein leeres Orbital der C=O Bindung angeregt Absorption bei ~290 nm (4.3 ev) C O
35 Elektronische Spektren größerer Moleküle: d d Übergang Oktaedrischer Komplex (d 1 ) O e g Die energetische Entartung der d-orbitale wird im Metall- Komplexe der d-gruppe aufgehoben t 2g O - Ligandenfeldaufspaltungs- Parameter Charakteristische Absorption: ~500 nm (2.5 ev) [Ti(OH 2 ) 6 ] 3+ in Lösung g g Übergang nur möglich wenn das Inversionszentrum durch eine asymmetrische Schwingung aufgehoben wird! Vibronischer Übergang
36 d d und Ladungs-Transfer- (CT-) Übergang Absorption: ein Elektron wird vom Liganden zu einem d-orbital des zentralen Atoms übertragen (Ligand zu Metall-Ladungs-Transfer = LMCT) oder umgekehrt (Metall zu Ligand-Ladungs-Transfer = MLCT) Großes Übergangsdipolmoment Starke Absorption 2500 d - d CT von Ni O O N N O O Ni O d * x²-y² O 2- ε / M -1 cm ε / M -1 cm -1 d xy d z² λ / nm 0 d xz d yz
37 Elektronische Spektren größerer Moleküle: π π* Übergang Absorption durch ein Elektron einer π-bindung und Anregung des Elektrons in ein anti-bindendes π*- Orbital π* Charakteristische Absorption für C=C: 180 nm (7 ev) π
38 Elektronische Spektren größerer Moleküle: π π* Übergang Absorption durch nicht-bindende aber über das ganze Molekül delokalisierte Elektronen π* : tiefste elektronische Anregungen aromatischer Molekülen (Tetracen)
39 Elektronische Spektren größerer Moleküle: Kristallochromie - Rot-Verschiebung der Absorptionsbanden in Kristallen im Vergleich zu den Banden in Lösung durch intermolekulare Wechselwirkung
40 Elektronische Spektren größerer Moleküle: Fluoreszenz Spektrale Verschiebung mit zunehmender Ausdehnung des π-elektronensystems
41 Elektronische Spektren größerer Moleküle: π π* Übergang Konjugierte Ketten: z. B. lineare Polyene C 6 H 5 -(CH=CH) n -C 6 H 5 Verschiebung der Absorption zu größeren Wellenlängen mit zunehmender Konjugationszahl
5. Elektronen- und Rotations- Spektren von Molekülen
 5. Elektronen- und Rotations- Spektren von Molekülen Absorptionsspektren Optische Dichte Elektronischer Übergang S 0 S von Benzol: In der Gasphase: Rotations-Schwingungsstruktur Im Kristall: Spektrale
5. Elektronen- und Rotations- Spektren von Molekülen Absorptionsspektren Optische Dichte Elektronischer Übergang S 0 S von Benzol: In der Gasphase: Rotations-Schwingungsstruktur Im Kristall: Spektrale
9. Moleküle. 9.1 Wasserstoff-Molekül Ion H Wasserstoff-Molekül H Schwerere Moleküle 9.4 Angeregte Moleküle. Physik IV SS
 9.1 Wasserstoff-Molekül Ion H + 9. Wasserstoff-Molekül H 9.3 Schwerere Moleküle 9.4 Angeregte Moleküle 9.1 9.1 Wasserstoff-Molekül Ion H + Einfachstes Molekül: H + = p + e p + Coulomb-Potenzial: Schrödinger-Gleichung:
9.1 Wasserstoff-Molekül Ion H + 9. Wasserstoff-Molekül H 9.3 Schwerere Moleküle 9.4 Angeregte Moleküle 9.1 9.1 Wasserstoff-Molekül Ion H + Einfachstes Molekül: H + = p + e p + Coulomb-Potenzial: Schrödinger-Gleichung:
Quantenzahlen. A B z. Einführung in die Struktur der Materie 67
 Quantenzahlen Wir haben uns bis jetzt nur mit dem Grundzustand des H + 2 Moleküls beschäftigt Wie sieht es aus mit angeregten Zuständen wie z.b. 2p Zuständen im H Atom? Bezeichnung der Molekülorbitale
Quantenzahlen Wir haben uns bis jetzt nur mit dem Grundzustand des H + 2 Moleküls beschäftigt Wie sieht es aus mit angeregten Zuständen wie z.b. 2p Zuständen im H Atom? Bezeichnung der Molekülorbitale
Induzierte und spontane Übergänge: Einstein-Koeffizienten
 Induzierte und spontane Übergänge: Einstein-Koeffizienten Ein Atom im Zustand E k, das sich in einem elektromagnetischen Strahlungsfeld mit der spektralen Energiedichte w v (ν) n i hv befindet, kann ein
Induzierte und spontane Übergänge: Einstein-Koeffizienten Ein Atom im Zustand E k, das sich in einem elektromagnetischen Strahlungsfeld mit der spektralen Energiedichte w v (ν) n i hv befindet, kann ein
Theoretical Biophysics - Quantum Theory and Molecular Dynamics. 13. Vorlesung. Pawel Romanczuk WS 2016/17
 Theoretical Biophysics - Quantum Theory and Molecular Dynamics 13. Vorlesung Pawel Romanczuk WS 2016/17 http://lab.romanczuk.de/teaching Zusammenfassung letzte VL Variationsrechnung LCAO-Verfahren am Beispiel
Theoretical Biophysics - Quantum Theory and Molecular Dynamics 13. Vorlesung Pawel Romanczuk WS 2016/17 http://lab.romanczuk.de/teaching Zusammenfassung letzte VL Variationsrechnung LCAO-Verfahren am Beispiel
Termschema des neutralen Natriumatoms. Die Zahlen bei den schrägen Strichen sind die Wellenlängen beobachteter Übergänge in nm.
 Termschema des neutralen Natriumatoms. Die Zahlen bei den schrägen Strichen sind die Wellenlängen beobachteter Übergänge in nm. Prof. Dr. D. Winklmair Wechselwirkung 1/11 Symmetrische Valenzschwingung
Termschema des neutralen Natriumatoms. Die Zahlen bei den schrägen Strichen sind die Wellenlängen beobachteter Übergänge in nm. Prof. Dr. D. Winklmair Wechselwirkung 1/11 Symmetrische Valenzschwingung
: Quantenmechanische Lösung H + 2. Molekülion und. Aufstellen der Schrödingergleichung für das H + 2
 H + 2 Die molekulare Bindung : Quantenmechanische Lösung Aufstellen der Schrödingergleichung für das H + 2 Molekülion und Lösung Wichtige Einschränkung: Die Kerne sind festgehalten H Ψ(r) = E Ψ(r) (11)
H + 2 Die molekulare Bindung : Quantenmechanische Lösung Aufstellen der Schrödingergleichung für das H + 2 Molekülion und Lösung Wichtige Einschränkung: Die Kerne sind festgehalten H Ψ(r) = E Ψ(r) (11)
Kapitel 7: Elektronische Spektroskopie
 Kapitel 7: Elektronische Spektroskopie Übersicht: 7.1 Drehimpuls-Kopplungshierarchien in Molekülen: Hundsche Fälle 7.2 Auswahlregeln für rovibronische Übergänge 7.3 Das Franck-Condon-Prinzip 7.4 Zerfall
Kapitel 7: Elektronische Spektroskopie Übersicht: 7.1 Drehimpuls-Kopplungshierarchien in Molekülen: Hundsche Fälle 7.2 Auswahlregeln für rovibronische Übergänge 7.3 Das Franck-Condon-Prinzip 7.4 Zerfall
ORGANISCHE CHEMIE 1. Stoff der 16. Vorlesung: Hybridisierung, Hückel-MO...
 Stoff der 16. Vorlesung: Hybridisierung, Hückel-MO... ORGANISCHE CHEMIE 1 16. Vorlesung, Freitag, 14. Juni 2013 I. Hybridorbitale im Kohlenstoff - Regeln für Wechselwirkung von Orbitalen - σ und π MO s
Stoff der 16. Vorlesung: Hybridisierung, Hückel-MO... ORGANISCHE CHEMIE 1 16. Vorlesung, Freitag, 14. Juni 2013 I. Hybridorbitale im Kohlenstoff - Regeln für Wechselwirkung von Orbitalen - σ und π MO s
(2.65 ev), da sich die beiden Elektronen gegenseitig abstossen.
 phys4.026 Page 1 13.8 Das Wasserstoff-Molekül Wie im Fall des H2 + Moleküls führen im H2 Molekül symmetrische Wellenfunktionen zu bindenden Zuständen, wohingegen anti-symmetrische Wellenfunktionen zu anti-bindenden
phys4.026 Page 1 13.8 Das Wasserstoff-Molekül Wie im Fall des H2 + Moleküls führen im H2 Molekül symmetrische Wellenfunktionen zu bindenden Zuständen, wohingegen anti-symmetrische Wellenfunktionen zu anti-bindenden
Moleküle. Zweiatomige Moleküle: H 2+
 Moleküle Zweiatomige Moleküle: 2+ : zwei Kerne, ein Elektron Der Abstand zwischen den Atomkernen wird so klein gewählt, dass die 1s-Orbitale überlappen und durch Linearkombination Molekülorbitale gebildet
Moleküle Zweiatomige Moleküle: 2+ : zwei Kerne, ein Elektron Der Abstand zwischen den Atomkernen wird so klein gewählt, dass die 1s-Orbitale überlappen und durch Linearkombination Molekülorbitale gebildet
z n z m e 2 WW-Kern-Kern H = H k + H e + H ek
 2 Molekülphysik Moleküle sind Systeme aus mehreren Atomen, die durch Coulomb-Wechselwirkungen Elektronen und Atomkerne ( chemische Bindung ) zusammengehalten werden. 2.1 Born-Oppenheimer Näherung Der nichtrelativistische
2 Molekülphysik Moleküle sind Systeme aus mehreren Atomen, die durch Coulomb-Wechselwirkungen Elektronen und Atomkerne ( chemische Bindung ) zusammengehalten werden. 2.1 Born-Oppenheimer Näherung Der nichtrelativistische
Klausur zur Vorlesung Symmetrie in Chemie und Spektroskopie
 Klausur zur Vorlesung Symmetrie in Chemie und Spektroskopie Zulässige Hilfsmittel: Charakterentafeln, Schema Hierarchie der Punktgruppen SS 6 Prof. Dr. B. Dick Aufgabe 1 (15P): Finden Sie die Punktgruppe
Klausur zur Vorlesung Symmetrie in Chemie und Spektroskopie Zulässige Hilfsmittel: Charakterentafeln, Schema Hierarchie der Punktgruppen SS 6 Prof. Dr. B. Dick Aufgabe 1 (15P): Finden Sie die Punktgruppe
Modul: Allgemeine Chemie
 Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
2. Linear Combination of Atomic Orbitals
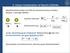 . Linear Combination of Atomi Orbitals Molekülorbitale werden mit ilfe des Variationsansatzes erhalten. Beispiel: -atomiges Molekül Atom, ϕ Atom, ϕ amilton-operator: Orthonormierung: ˆ ϕ El. Atom ϕ = =
. Linear Combination of Atomi Orbitals Molekülorbitale werden mit ilfe des Variationsansatzes erhalten. Beispiel: -atomiges Molekül Atom, ϕ Atom, ϕ amilton-operator: Orthonormierung: ˆ ϕ El. Atom ϕ = =
Das H + 2 -Molekül. Das Wasserstoffmolekülion H + 2 ist das einfachste
 Moleküle Wir haben in den vergangenen Wochen gelernt, wie sich Atome, zusammengesetzt aus elektrisch geladenen Kernen und Elektronen, verhalten. Wie aber verbinden sich elektrisch neutrale Atome zu Molekülen
Moleküle Wir haben in den vergangenen Wochen gelernt, wie sich Atome, zusammengesetzt aus elektrisch geladenen Kernen und Elektronen, verhalten. Wie aber verbinden sich elektrisch neutrale Atome zu Molekülen
Die meisten Elemente liegen in gebundener Form als einzelne Moleküle, in Flüssigkeiten oder in Festkörpern vor.
 phys4.025 Page 1 13. Moleküle Nur eine kleine Anzahl von Elementen kommt natürlich in Form von einzelnen Atomen vor. Die meisten Elemente liegen in gebundener Form als einzelne Moleküle, in Flüssigkeiten
phys4.025 Page 1 13. Moleküle Nur eine kleine Anzahl von Elementen kommt natürlich in Form von einzelnen Atomen vor. Die meisten Elemente liegen in gebundener Form als einzelne Moleküle, in Flüssigkeiten
Chemische Bindung zweiatomiger Moleküle
 Die Born Oppenheimer Näherung vernachlässigt Elektronenimpulse gegenüber Kernimpulsen und erlaubt die Gesamtwellenfunktion als ein Produkt aus einer Kernwellenfunktion F q ( R) und der einer Elektronenwellenfunktion
Die Born Oppenheimer Näherung vernachlässigt Elektronenimpulse gegenüber Kernimpulsen und erlaubt die Gesamtwellenfunktion als ein Produkt aus einer Kernwellenfunktion F q ( R) und der einer Elektronenwellenfunktion
Die chemische Bindung
 Die chemische Bindung Die Valenz-Bond Theorie Molekülorbitale Die Bänder Theorie der Festkörper bei einer ionischen Bindung bildet bildet sich ein Dipol aus ('Übertragung von Elektronen') Eine kovalente
Die chemische Bindung Die Valenz-Bond Theorie Molekülorbitale Die Bänder Theorie der Festkörper bei einer ionischen Bindung bildet bildet sich ein Dipol aus ('Übertragung von Elektronen') Eine kovalente
Einführung in die Spektroskopie für Studenten der Biologie
 Einführung in die Spektroskopie für Studenten der Biologie Jörg H. Kleinschmidt http://www.biologie.uni-konstanz.de/folding/home.html Literatur Banwell, C. N., Elaine M. McCash, Molekülspektroskopie. Ein
Einführung in die Spektroskopie für Studenten der Biologie Jörg H. Kleinschmidt http://www.biologie.uni-konstanz.de/folding/home.html Literatur Banwell, C. N., Elaine M. McCash, Molekülspektroskopie. Ein
Grundlagen der Chemie Allgemeine Chemie Teil 2
 Allgemeine Chemie Teil 2 Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu AO-Theorie Wellenmechanik So wie Licht
Allgemeine Chemie Teil 2 Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu AO-Theorie Wellenmechanik So wie Licht
Übungen zur Vorlesung Physikalische Chemie II Lösungsvorschlag zu Blatt 5
 Wintersemester 006 / 007 04.1.006 1. Aufgabe Die Wellenfunktionen unterscheiden sich gar nicht. Während der Lösung der elektronischen Schrödingergleichung werden die Kerne als ruhend betrachtet. Es kommt
Wintersemester 006 / 007 04.1.006 1. Aufgabe Die Wellenfunktionen unterscheiden sich gar nicht. Während der Lösung der elektronischen Schrödingergleichung werden die Kerne als ruhend betrachtet. Es kommt
FERIENKURS EXPERIMENTALPHYSIK 4. Mehrelektronensysteme
 FERIENKURS EXPERIMENTALPHYSIK 4 Vorlesung 3 am 04.09.2013 Mehrelektronensysteme Hannah Schamoni, Susanne Goerke Inhaltsverzeichnis 1 Das Helium-Atom 2 1.1 Grundlagen und Ortswellenfunktion........................
FERIENKURS EXPERIMENTALPHYSIK 4 Vorlesung 3 am 04.09.2013 Mehrelektronensysteme Hannah Schamoni, Susanne Goerke Inhaltsverzeichnis 1 Das Helium-Atom 2 1.1 Grundlagen und Ortswellenfunktion........................
Valenz-Bindungstheorie H 2 : s Ueberlappung von Atomorbitalen s-bindung: 2 Elektronen in einem Orbital zylindrischer Symmetrie
 Valenz-Bindungstheorie Beschreibung von Molekülen mit Hilfe von Orbitalen H H H 2 : H 2 s Ueberlappung von Atomorbitalen s-bindung: 2 Elektronen in einem Orbital zylindrischer Symmetrie um die interatomare
Valenz-Bindungstheorie Beschreibung von Molekülen mit Hilfe von Orbitalen H H H 2 : H 2 s Ueberlappung von Atomorbitalen s-bindung: 2 Elektronen in einem Orbital zylindrischer Symmetrie um die interatomare
UV/Vis-Spektroskopie oder auch: Elektronenanregungsspektroskopie
 Teil 5 UV/Vis-Spektroskopie oder auch: Elektronenanregungsspektroskopie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2018/19 www.ruhr-uni-bochum.de/chirality 1 Komplementärfarben Absorbiert eine Probe gelbes
Teil 5 UV/Vis-Spektroskopie oder auch: Elektronenanregungsspektroskopie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2018/19 www.ruhr-uni-bochum.de/chirality 1 Komplementärfarben Absorbiert eine Probe gelbes
UV/Vis-Spektroskopie oder auch: Elektronenanregungsspektroskopie
 Teil 5 UV/Vis-Spektroskopie oder auch: Elektronenanregungsspektroskopie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2017/18 www.ruhr-uni-bochum.de/chirality 1 Reminder: MO-Diagramm von O 2 2- MdS-1 UV/Vis-Spektroskopie
Teil 5 UV/Vis-Spektroskopie oder auch: Elektronenanregungsspektroskopie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2017/18 www.ruhr-uni-bochum.de/chirality 1 Reminder: MO-Diagramm von O 2 2- MdS-1 UV/Vis-Spektroskopie
6. Viel-Elektronen Atome
 6. Viel-Elektronen 6.1 Periodensystem der Elemente 6.2 Schwerere 6.3 L S und j j Kopplung 6.1 6.1 Periodensystem der Elemente 6.2 Auffüllen der Elektronen-Orbitale Pauliprinzip: je 1 Elektron je Zustand
6. Viel-Elektronen 6.1 Periodensystem der Elemente 6.2 Schwerere 6.3 L S und j j Kopplung 6.1 6.1 Periodensystem der Elemente 6.2 Auffüllen der Elektronen-Orbitale Pauliprinzip: je 1 Elektron je Zustand
4.Teil Kovalente Bindung
 4.Teil Kovalente Bindung Lewis-Konzept, Valenstrichformel, Oktettregel Polare Elektronenpaarbindung und Elektronegativität Gebrochene Bindungsordnung und Mesomerie Valenzschalen-Elektronenpaar-Abstoßungsmodell
4.Teil Kovalente Bindung Lewis-Konzept, Valenstrichformel, Oktettregel Polare Elektronenpaarbindung und Elektronegativität Gebrochene Bindungsordnung und Mesomerie Valenzschalen-Elektronenpaar-Abstoßungsmodell
Orbitalmodell SPF BCH am
 Orbitalmodell Inhaltsverzeichnis Sie können sich unter einer elektromagnetischen Welle etwas vorstellen. Sie kennen typische Eigenschaften von Wellen im Vergleich zu Teilchen-Strahlen...2 Sie können die
Orbitalmodell Inhaltsverzeichnis Sie können sich unter einer elektromagnetischen Welle etwas vorstellen. Sie kennen typische Eigenschaften von Wellen im Vergleich zu Teilchen-Strahlen...2 Sie können die
6.2 Kovalente Bindung + + r B. r AB. πε0. Ĥ Nicht separierbar. Einfachstes Molekül: Hamiltonoperator: Kinetische Energie. Potentielle Energie
 6. Kovalente indung Einfachstes Molekül: - r H + r + + r e Hamiltonoperator: Ĥ ħ ħ ħ = + m m Kern Kern e me Elektron Kinetische Energie + e 1 1 1 4 πε r r r Kern Kern e nziehung bstoßung Kern Kern e nziehung
6. Kovalente indung Einfachstes Molekül: - r H + r + + r e Hamiltonoperator: Ĥ ħ ħ ħ = + m m Kern Kern e me Elektron Kinetische Energie + e 1 1 1 4 πε r r r Kern Kern e nziehung bstoßung Kern Kern e nziehung
2-01. Das Ethen-Molekül. Perspektivische Darstellung des Ethen-Moleküls.
 Das Ethen-Molekül 2-01 Perspektivische Darstellung des Ethen-Moleküls. Rot: Sigma-Bindungen σ mit je zwei Bindungselektronen Blau: pz-orbitale mit je einem Elektron Die C-Atome sind sp 2 -hybridisiert,
Das Ethen-Molekül 2-01 Perspektivische Darstellung des Ethen-Moleküls. Rot: Sigma-Bindungen σ mit je zwei Bindungselektronen Blau: pz-orbitale mit je einem Elektron Die C-Atome sind sp 2 -hybridisiert,
Physik IV Einführung in die Atomistik und die Struktur der Materie
 Physik IV Einführung in die Atomistik und die Struktur der Materie Sommersemester 2011 Vorlesung 20 29.06.2011 Physik IV - Einführung in die Atomistik Vorlesung 20 Prof. Thorsten Kröll 29.06.2011 1 Anmeldung
Physik IV Einführung in die Atomistik und die Struktur der Materie Sommersemester 2011 Vorlesung 20 29.06.2011 Physik IV - Einführung in die Atomistik Vorlesung 20 Prof. Thorsten Kröll 29.06.2011 1 Anmeldung
Ferienkurs Experimentalphysik 4
 Ferienkurs Experimentalphysik 4 Probeklausur Markus Perner, Markus Kotulla, Jonas Funke Aufgabe 1 (Allgemeine Fragen). : (a) Welche Relation muss ein Operator erfüllen damit die dazugehörige Observable
Ferienkurs Experimentalphysik 4 Probeklausur Markus Perner, Markus Kotulla, Jonas Funke Aufgabe 1 (Allgemeine Fragen). : (a) Welche Relation muss ein Operator erfüllen damit die dazugehörige Observable
Molekülphysik und Quantenchemie
 Hermann Haken Hans Christoph Wolf Molekülphysik und Quantenchemie Einführung in die experimentellen und theoretischen Grundlagen Mit 245 Abbildungen und 43 Tabellen Physikalische Bibliothek Fachbereich
Hermann Haken Hans Christoph Wolf Molekülphysik und Quantenchemie Einführung in die experimentellen und theoretischen Grundlagen Mit 245 Abbildungen und 43 Tabellen Physikalische Bibliothek Fachbereich
Das H + 2 -Molekülion
 Das Näherungen für das elektronische Problem und Kernbewegungen 7. Dezember 2011 Schrödinger-Gleichung des s Abbildung: Arthur Beiser; Atome, Moleküle, Festkörper; Vieweg, Braunschweig 1983 ( K/E 2 2 +
Das Näherungen für das elektronische Problem und Kernbewegungen 7. Dezember 2011 Schrödinger-Gleichung des s Abbildung: Arthur Beiser; Atome, Moleküle, Festkörper; Vieweg, Braunschweig 1983 ( K/E 2 2 +
Moleküle und Wärmestatistik
 Moleküle und Wärmestatistik Musterlösung.08.008 Molekülbindung Ein Molekül bestehe aus zwei Atomkernen A und B und zwei Elektronen. a) Wie lautet der Ansatz für die symmetrische Wellenfunktion in der Molekülorbitalnäherung?
Moleküle und Wärmestatistik Musterlösung.08.008 Molekülbindung Ein Molekül bestehe aus zwei Atomkernen A und B und zwei Elektronen. a) Wie lautet der Ansatz für die symmetrische Wellenfunktion in der Molekülorbitalnäherung?
Molekülphysik und Quantenchemie
 Hermann Haken Hans Christoph Wolf Molekülphysik und Quantenchemie Einführung in die experimentellen und theoretischen Grundlagen Springer-Verlag Berlin Heidelberg New York 3-540-57460-3 Springer-Verlag
Hermann Haken Hans Christoph Wolf Molekülphysik und Quantenchemie Einführung in die experimentellen und theoretischen Grundlagen Springer-Verlag Berlin Heidelberg New York 3-540-57460-3 Springer-Verlag
Mehratomige Molek ule
 Wir wollen jetzt eine sehr einfache Theorie entwickeln, um die Bindung in Molekülen mit mehr als zwei Atomen zu verstehen Dazu müssen wir den Aufbau von komplexeren n wie π oder δ-n verstehen Wir wissen
Wir wollen jetzt eine sehr einfache Theorie entwickeln, um die Bindung in Molekülen mit mehr als zwei Atomen zu verstehen Dazu müssen wir den Aufbau von komplexeren n wie π oder δ-n verstehen Wir wissen
Chemische Bindungen Atombindung
 Atombindung Das Lewis Modell der kovalenten Bindung Die Entstehung von Molekülen beruht auf der Bildung von gemeinsamen, bindenden Elektronenpaaren in dem Bestreben der Atome, eine energetisch stabile
Atombindung Das Lewis Modell der kovalenten Bindung Die Entstehung von Molekülen beruht auf der Bildung von gemeinsamen, bindenden Elektronenpaaren in dem Bestreben der Atome, eine energetisch stabile
Lösung 14. Allgemeine Chemie II Frühjahrsemester 2013
 Lösung 14 Allgemeine Chemie II Frühjahrsemester 2013 1. Aufgabe Bohr hat für das Wasserstoffatom ein Modell erstellt, das der klassischen Mechanik gehorcht und gewisse Ähnlichkeiten mit dem Planetenmodell
Lösung 14 Allgemeine Chemie II Frühjahrsemester 2013 1. Aufgabe Bohr hat für das Wasserstoffatom ein Modell erstellt, das der klassischen Mechanik gehorcht und gewisse Ähnlichkeiten mit dem Planetenmodell
Oktett-Theorie von Lewis
 Oktett-Theorie von Lewis Oktettregel Atome versuchen durch die Nutzung gemeinsamer Elektronenpaare möglichst ein Elektronenoktett zu erlangen. allgemeiner: Edelgasregel Atome streben durch Vereinigung
Oktett-Theorie von Lewis Oktettregel Atome versuchen durch die Nutzung gemeinsamer Elektronenpaare möglichst ein Elektronenoktett zu erlangen. allgemeiner: Edelgasregel Atome streben durch Vereinigung
Übungen zu Physik 2 für Maschinenwesen
 Physikdepartment E13 SS 011 Übungen zu Physik für Maschinenwesen Prof. Dr. Peter Müller-Buschbaum, Dr. Eva M. Herzig, Dr. Volker Körstgens, David Magerl, Markus Schindler, Moritz v. Sivers Vorlesung 1.07.011,
Physikdepartment E13 SS 011 Übungen zu Physik für Maschinenwesen Prof. Dr. Peter Müller-Buschbaum, Dr. Eva M. Herzig, Dr. Volker Körstgens, David Magerl, Markus Schindler, Moritz v. Sivers Vorlesung 1.07.011,
Der nichtrelativistische Hamiltonoperator für ein System aus N k Atomkernen (mit Ladung +Z n ) und N e = N k. n=1 Z n Elektronen lautet: z n z m e 2
 2 Molekülphysik Moleküle sind Systeme aus mehreren Atomen, die durch Coulomb-Wechselwirkungen Elektronen und Atomkerne ( chemische Bindung ) zusammengehalten werden. 2.1 Born-Oppenheimer Näherung Der nichtrelativistische
2 Molekülphysik Moleküle sind Systeme aus mehreren Atomen, die durch Coulomb-Wechselwirkungen Elektronen und Atomkerne ( chemische Bindung ) zusammengehalten werden. 2.1 Born-Oppenheimer Näherung Der nichtrelativistische
2. Elementare Stöchiometrie I Definition und Gesetze, Molbegriff, Konzentrationseinheiten
 Inhalt: 1. Regeln und Normen Modul: Allgemeine Chemie 2. Elementare Stöchiometrie I Definition und Gesetze, Molbegriff, Konzentrationseinheiten 3.Bausteine der Materie Atomkern: Elementarteilchen, Kernkräfte,
Inhalt: 1. Regeln und Normen Modul: Allgemeine Chemie 2. Elementare Stöchiometrie I Definition und Gesetze, Molbegriff, Konzentrationseinheiten 3.Bausteine der Materie Atomkern: Elementarteilchen, Kernkräfte,
Inhaltsverzeichnis Einleitung Mechanische Eigenschaften von Molekülen, Größe, Masse Moleküle in elektrischen und magnetischen Feldern
 Inhaltsverzeichnis 1. Einleitung... 1 1.1 Was ist ein Molekül?... 1 1.2 Ziele und Methoden............................................ 3 1.3 Historische Bemerkungen.......................................
Inhaltsverzeichnis 1. Einleitung... 1 1.1 Was ist ein Molekül?... 1 1.2 Ziele und Methoden............................................ 3 1.3 Historische Bemerkungen.......................................
Chemische Bindungen Atombindung
 Atombindung Das Lewis Modell der kovalenten Bindung Bildung von Molekülen (Einfachbindungen) Aus jeweils einem ungepaarten Elektron eines Atoms bildet sich ein gemeinsames Elektronenpaar als Molekülorbital
Atombindung Das Lewis Modell der kovalenten Bindung Bildung von Molekülen (Einfachbindungen) Aus jeweils einem ungepaarten Elektron eines Atoms bildet sich ein gemeinsames Elektronenpaar als Molekülorbital
Lösung zur Klausur
 ösung zur Klausur 1..01 Aufgabe 1.) a) Hundsche Regeln: maximaler Spin, dann maximales Bahnmoment. Die beiden Elektronen im 4s kann man vernachlässigen, da sie weder Spin- noch Bahmoment beitragen. Damit
ösung zur Klausur 1..01 Aufgabe 1.) a) Hundsche Regeln: maximaler Spin, dann maximales Bahnmoment. Die beiden Elektronen im 4s kann man vernachlässigen, da sie weder Spin- noch Bahmoment beitragen. Damit
Prof. Christoffers, Vorlesung Organische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler
 Prof. hristoffers, Vorlesung Organische hemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 1. inführung 1.1 Atomorbitale Die Atome im Molekülverband werden durch lektronen
Prof. hristoffers, Vorlesung Organische hemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 1. inführung 1.1 Atomorbitale Die Atome im Molekülverband werden durch lektronen
Chemie-Vorkurs für Pharmaziestudenten SoSe Gerd Bendas Fachbereich Pharmazie Rheinische Friedrich Wilhelms Universität Bonn
 Chemie-Vorkurs für Pharmaziestudenten SoSe 2018 Gerd Bendas Fachbereich Pharmazie Rheinische Friedrich Wilhelms Universität Bonn gbendas@uni-bonn.de Einteilung der Veranstaltungen: die Veranstaltungen
Chemie-Vorkurs für Pharmaziestudenten SoSe 2018 Gerd Bendas Fachbereich Pharmazie Rheinische Friedrich Wilhelms Universität Bonn gbendas@uni-bonn.de Einteilung der Veranstaltungen: die Veranstaltungen
WAS FEHLT? STATISCHE KORRELATION UND VOLLE KONFIGURATIONSWECHSELWIRKUNG
 31 besetzen als die β Elektronen. Wenn man dies in der Variation der Wellenfunktion zulässt, also den Satz der Orbitale verdoppelt und α und β Orbitale gleichzeitig optimiert, so ist i. A. die Energie
31 besetzen als die β Elektronen. Wenn man dies in der Variation der Wellenfunktion zulässt, also den Satz der Orbitale verdoppelt und α und β Orbitale gleichzeitig optimiert, so ist i. A. die Energie
5. Atome mit 1 und 2 Leucht-Elektronen 5.1 Alkali-Atome 5.2 He-Atom
 5. Atome mit 1 und 2 Leucht- 5.1 Alkali-Atome 5.2 He-Atom 5.1 5.1 Alkali Atome ein "Leuchtelektron" Alkali Erdalkali 5.2 Tauchbahnen grosser Bahndrehimpuls l: geringes Eintauchen kleiner Bahndrehimpuls
5. Atome mit 1 und 2 Leucht- 5.1 Alkali-Atome 5.2 He-Atom 5.1 5.1 Alkali Atome ein "Leuchtelektron" Alkali Erdalkali 5.2 Tauchbahnen grosser Bahndrehimpuls l: geringes Eintauchen kleiner Bahndrehimpuls
Molekülphysik. Theoretische Grundlagen und experimentelle Methoden Von Wolfgang Demtröder. Oldenbourg Verlag München Wien
 Molekülphysik Theoretische Grundlagen und experimentelle Methoden Von Wolfgang Demtröder Oldenbourg Verlag München Wien Vorwort XI 1 1.1 1.2 1.3 1.4 2 2.1 2.2 2.3 2.4 2.5 2.6 2.7 Einleitung 1 Kurzer historischer
Molekülphysik Theoretische Grundlagen und experimentelle Methoden Von Wolfgang Demtröder Oldenbourg Verlag München Wien Vorwort XI 1 1.1 1.2 1.3 1.4 2 2.1 2.2 2.3 2.4 2.5 2.6 2.7 Einleitung 1 Kurzer historischer
Atommodell. Atommodell nach Bohr und Sommerfeld Für sein neues Atommodell stellte Bohr folgende Postulate auf:
 Für sein neues Atommodell stellte Bohr folgende Postulate auf: Elektronen umkreisen den Kern auf bestimmten Bahnen, wobei keine Energieabgabe erfolgt. Jede Elektronenbahn entspricht einem bestimmten Energieniveau
Für sein neues Atommodell stellte Bohr folgende Postulate auf: Elektronen umkreisen den Kern auf bestimmten Bahnen, wobei keine Energieabgabe erfolgt. Jede Elektronenbahn entspricht einem bestimmten Energieniveau
Die Bindung in Übergangsmetallkomplexenn. Klassische Koordinationschemie (Alfred Wernersche) Valenzstruktur-Theorie (Valenzbindungsth
 Die Bindung in Übergangsmetallkomplexenn Klassische Koordinationschemie (Alfred Wernersche) Valenzstruktur-Theorie (Valenzbindungsth heorie) Ligandenfeld-Theorie H 3 3+ H 3 H 3 Cr H 3 H 3 H 3 Molekülorbital-Theorie
Die Bindung in Übergangsmetallkomplexenn Klassische Koordinationschemie (Alfred Wernersche) Valenzstruktur-Theorie (Valenzbindungsth heorie) Ligandenfeld-Theorie H 3 3+ H 3 H 3 Cr H 3 H 3 H 3 Molekülorbital-Theorie
Lernziele zu Farbigkeit von Stoffen
 Farbstoffe Lernziele zu Farbigkeit von Stoffen du verstehst, wie Farbigkeit mit der Absorption von EM-Strahlung zusammenhängt. du verstehst die Unterschiede zwischen Feuerwerksfarben und Textilfarbstoffen.
Farbstoffe Lernziele zu Farbigkeit von Stoffen du verstehst, wie Farbigkeit mit der Absorption von EM-Strahlung zusammenhängt. du verstehst die Unterschiede zwischen Feuerwerksfarben und Textilfarbstoffen.
Übungen zur Vorlesung Physikalische Chemie 2 (B. Sc.) Lösungsvorschlag zu Blatt 12
 Übungen zur Vorlesung Physikalische Chemie B. Sc. ösungsvorschlag zu Blatt 1 Prof. Dr. Norbert Hampp Jens Träger Wintersemester 7/8. 1. 8 Aufgabe 1 Welche Schwingungsübergänge in einem elektronischen Spektrum
Übungen zur Vorlesung Physikalische Chemie B. Sc. ösungsvorschlag zu Blatt 1 Prof. Dr. Norbert Hampp Jens Träger Wintersemester 7/8. 1. 8 Aufgabe 1 Welche Schwingungsübergänge in einem elektronischen Spektrum
Molekulare Kerndynamik. Grundlagen
 Grundlagen Bei der Bestimmung der elektronischen Struktur von Molekülen haben wir bis jetzt den Fall betrachtet, daß die Kerne fest sind. Lösung der elektronischen Schrödingergleichung in einem festen
Grundlagen Bei der Bestimmung der elektronischen Struktur von Molekülen haben wir bis jetzt den Fall betrachtet, daß die Kerne fest sind. Lösung der elektronischen Schrödingergleichung in einem festen
Physikdepartment. Ferienkurs zur Experimentalphysik 4. Daniel Jost 09/09/15
 Physikdepartment Ferienkurs zur Experimentalphysik 4 Daniel Jost 09/09/15 Inhaltsverzeichnis Technische Universität München 1 Nachtrag: Helium-Atom 1 2 Röntgen-Spektren 2 3 Approximationen 6 3.1 Linear
Physikdepartment Ferienkurs zur Experimentalphysik 4 Daniel Jost 09/09/15 Inhaltsverzeichnis Technische Universität München 1 Nachtrag: Helium-Atom 1 2 Röntgen-Spektren 2 3 Approximationen 6 3.1 Linear
Absorptionsspektrum von PTCDA und DiMe-PTCDI
 3. Gruppentheorie Absorption coefficient *10 5 6 4 2 0 Absorptionsspektrum von PTCDA und DiMe-PTCDI PTCDA Wavelength / nm 800 700 600 500 400 HOMO-LUMO Übergang S 0 -S 1 transition S 0 -S 2 transition
3. Gruppentheorie Absorption coefficient *10 5 6 4 2 0 Absorptionsspektrum von PTCDA und DiMe-PTCDI PTCDA Wavelength / nm 800 700 600 500 400 HOMO-LUMO Übergang S 0 -S 1 transition S 0 -S 2 transition
Schrödinger-Gleichung
 Schrödinger-Gleichung abgeleitet aus Teilchen-Welle-Dualismus (de Broglie) Ψ = Ε Ψ Der amiltonian enthält kinetische und potentielle Energie aller Teilchen wirkt auf die Wellenfunktion Ψ. Ψ 2 beschreibt
Schrödinger-Gleichung abgeleitet aus Teilchen-Welle-Dualismus (de Broglie) Ψ = Ε Ψ Der amiltonian enthält kinetische und potentielle Energie aller Teilchen wirkt auf die Wellenfunktion Ψ. Ψ 2 beschreibt
Ferienkurs Experimentalphysik Übung 2 - Musterlösung
 Ferienkurs Experimentalphysik 4 00 Übung - Musterlösung Kopplung von Drehimpulsen und spektroskopische Notation (*) Vervollständigen Sie untenstehende Tabelle mit den fehlenden Werten der Quantenzahlen.
Ferienkurs Experimentalphysik 4 00 Übung - Musterlösung Kopplung von Drehimpulsen und spektroskopische Notation (*) Vervollständigen Sie untenstehende Tabelle mit den fehlenden Werten der Quantenzahlen.
Chemie für Biologen WS 2005/6 Arne Lützen Institut für Organische Chemie der Universität Duisburg-Essen (Teil 5: )
 Chemie für Biologen WS 2005/6 Arne Lützen Institut für rganische Chemie der Universität Duisburg-Essen (Teil 5: 23.11.2005) Kovalente Bindung Atome können sich Valenzelektronen unter Ausbildung von Bindungen
Chemie für Biologen WS 2005/6 Arne Lützen Institut für rganische Chemie der Universität Duisburg-Essen (Teil 5: 23.11.2005) Kovalente Bindung Atome können sich Valenzelektronen unter Ausbildung von Bindungen
Die Rotationsterme werden im Folgenden wegen der geringen Auflösung des Gerätes nicht weiter betrachtet. Für kleine Schwingungsamplituden gilt näherun
 UV/VIS-Spektroskopie: Optische Bestimmung der Dissoziationsenergie von I 2 Es soll ein UV/VIS-Spektrum von Ioddampf aufgenommen werden. Daraus sollen die Bandensysteme der v 00 -Progressionen (v 00 = 0,
UV/VIS-Spektroskopie: Optische Bestimmung der Dissoziationsenergie von I 2 Es soll ein UV/VIS-Spektrum von Ioddampf aufgenommen werden. Daraus sollen die Bandensysteme der v 00 -Progressionen (v 00 = 0,
Atome im elektrischen Feld
 Kapitel 3 Atome im elektrischen Feld 3.1 Beobachtung und experimenteller Befund Unter dem Einfluss elektrischer Felder kommt es zur Frequenzverschiebung und Aufspaltung in optischen Spektren. Dieser Effekt
Kapitel 3 Atome im elektrischen Feld 3.1 Beobachtung und experimenteller Befund Unter dem Einfluss elektrischer Felder kommt es zur Frequenzverschiebung und Aufspaltung in optischen Spektren. Dieser Effekt
[ H, L 2 ]=[ H, L z. ]=[ L 2, L z. U r = Warum haben wir soviel Zeit mit L 2 verbracht? = x 2 2. r 1 2. y 2 2. z 2 = 2. r 2 2 r
![[ H, L 2 ]=[ H, L z. ]=[ L 2, L z. U r = Warum haben wir soviel Zeit mit L 2 verbracht? = x 2 2. r 1 2. y 2 2. z 2 = 2. r 2 2 r [ H, L 2 ]=[ H, L z. ]=[ L 2, L z. U r = Warum haben wir soviel Zeit mit L 2 verbracht? = x 2 2. r 1 2. y 2 2. z 2 = 2. r 2 2 r](/thumbs/71/65107015.jpg) Warum haben wir soviel Zeit mit L 2 verbracht? = x 2 2 y 2 2 z 2 = 2 r 2 2 r r 1 2 L r 2 ħ 2 11. Das Wasserstoffatom H = p2 2 U r μ = Masse (statt m, da m später als Quantenzahl verwendet wird) U r = e2
Warum haben wir soviel Zeit mit L 2 verbracht? = x 2 2 y 2 2 z 2 = 2 r 2 2 r r 1 2 L r 2 ħ 2 11. Das Wasserstoffatom H = p2 2 U r μ = Masse (statt m, da m später als Quantenzahl verwendet wird) U r = e2
Experimentalphysik Modul PH-EP4 / PH-DP-EP4
 6 Moleküle Universität Leipzig, Fakultät für Physik und Geowissenschaften Experimentalphysik Modul PH-EP4 / PH-DP-EP4 Script für Vorlesung 08. Juni 009 Nach der Beschreibung Ein- und Mehrelektronen-Atomen
6 Moleküle Universität Leipzig, Fakultät für Physik und Geowissenschaften Experimentalphysik Modul PH-EP4 / PH-DP-EP4 Script für Vorlesung 08. Juni 009 Nach der Beschreibung Ein- und Mehrelektronen-Atomen
A. Mezzetti Fragenkatalog X
 Anorganische Chemie I Elektronenespektren A. Mezzetti ragenkatalog X 1. K n [V 6 ] (n muss bestimmt werden) (B) hat µ eff = 2.66 BM. Sein UV-VIS-Spektrum enthält eine sehr schwache Bande (10'000 cm 1 )
Anorganische Chemie I Elektronenespektren A. Mezzetti ragenkatalog X 1. K n [V 6 ] (n muss bestimmt werden) (B) hat µ eff = 2.66 BM. Sein UV-VIS-Spektrum enthält eine sehr schwache Bande (10'000 cm 1 )
Elektronenspektrum von [Ti(H 2 O) 6 ] 3+
![Elektronenspektrum von [Ti(H 2 O) 6 ] 3+ Elektronenspektrum von [Ti(H 2 O) 6 ] 3+](/thumbs/66/55543366.jpg) Elektronenspektrum von [Ti(H 2 O) 6 ] 3+ 3 2 1 15 20 25 30 1000 cm -1 e g hv t 2g Deutung der Elektronenspektren Absorption bestimmter Frequenzen des eingestrahlten Lichts durch: Elektronenübergang zwischen
Elektronenspektrum von [Ti(H 2 O) 6 ] 3+ 3 2 1 15 20 25 30 1000 cm -1 e g hv t 2g Deutung der Elektronenspektren Absorption bestimmter Frequenzen des eingestrahlten Lichts durch: Elektronenübergang zwischen
Dynamik von Molekülen. Rotationen und Schwingungen von Molekülen
 Rotationen und Schwingungen von Molekülen Schwingungen und Rotationen Bis jetzt haben wir immer den Fall betrachtet, daß die Kerne fest sind Was geschieht nun, wenn sich die Kerne bewegen können? Zwei
Rotationen und Schwingungen von Molekülen Schwingungen und Rotationen Bis jetzt haben wir immer den Fall betrachtet, daß die Kerne fest sind Was geschieht nun, wenn sich die Kerne bewegen können? Zwei
Dr. Jan Friedrich Nr
 Übungen zu Experimentalphysik 4 - Lösungsvorschläge Prof. S. Paul Sommersemester 5 Dr. Jan Friedrich Nr. 4.7.5 Email Jan.Friedrich@ph.tum.de Telefon 89/89-586 Physik Department E8, Raum 564 http://www.e8.physik.tu-muenchen.de/teaching/phys4/
Übungen zu Experimentalphysik 4 - Lösungsvorschläge Prof. S. Paul Sommersemester 5 Dr. Jan Friedrich Nr. 4.7.5 Email Jan.Friedrich@ph.tum.de Telefon 89/89-586 Physik Department E8, Raum 564 http://www.e8.physik.tu-muenchen.de/teaching/phys4/
Molekülphysik. April Grundzustand und angeregte Zustände eines Moleküls
 Molekülphysik April 2010 1 Grundzustand und angeregte Zustände eines Moleküls 1.1 Hamiltonoperator für das Gesamtproblem Die Quantenmechanik ist die fundamentale Theorie der Materie. Sowohl die Koordinaten
Molekülphysik April 2010 1 Grundzustand und angeregte Zustände eines Moleküls 1.1 Hamiltonoperator für das Gesamtproblem Die Quantenmechanik ist die fundamentale Theorie der Materie. Sowohl die Koordinaten
Ausarbeitung zum Theoretischen Seminar
 Ausarbeitung zum Theoretischen Seminar Kovalente Molekübindungen 28.01.2015 Robin.Stegmueller@googlemail.com Inhaltsverzeichnis 1 Einführung 1 1.1 Molekulare Bindungen......................... 1 1.2 Beispiel:
Ausarbeitung zum Theoretischen Seminar Kovalente Molekübindungen 28.01.2015 Robin.Stegmueller@googlemail.com Inhaltsverzeichnis 1 Einführung 1 1.1 Molekulare Bindungen......................... 1 1.2 Beispiel:
Zusammenfassung Wasserstoffatom
 Ach ja... ter Teil der Vorlesung Prof. Dr. Tobias Hertel Lehrstuhl II für Physikalische Chemie Institut für Physikalische und Theoretische Chemie Raum 13 Tel.: 0931 318 6300 e-mail: tobias.hertel@uni-wuerzburg.de
Ach ja... ter Teil der Vorlesung Prof. Dr. Tobias Hertel Lehrstuhl II für Physikalische Chemie Institut für Physikalische und Theoretische Chemie Raum 13 Tel.: 0931 318 6300 e-mail: tobias.hertel@uni-wuerzburg.de
c = Ausbreitungsgeschwindigkeit (2, m/s) λ = Wellenlänge (m) ν = Frequenz (Hz, s -1 )
 2.3 Struktur der Elektronenhülle Elektromagnetische Strahlung c = λ ν c = Ausbreitungsgeschwindigkeit (2,9979 10 8 m/s) λ = Wellenlänge (m) ν = Frequenz (Hz, s -1 ) Quantentheorie (Max Planck, 1900) Die
2.3 Struktur der Elektronenhülle Elektromagnetische Strahlung c = λ ν c = Ausbreitungsgeschwindigkeit (2,9979 10 8 m/s) λ = Wellenlänge (m) ν = Frequenz (Hz, s -1 ) Quantentheorie (Max Planck, 1900) Die
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Organisatorisches Kurs-Skript http://www.uni-due.de/ adb297b
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Organisatorisches Kurs-Skript http://www.uni-due.de/ adb297b
Linienform- und Breite
 Linienform- und Breite a) Wodurch ist die Breite eienr Absorptions- (Emissions-) Linie gegeben? welche Anteile gibt es, welcher Anteil dominiert im Normalfall? Dopplerbreite, Stossverbreiterung, natuerliche
Linienform- und Breite a) Wodurch ist die Breite eienr Absorptions- (Emissions-) Linie gegeben? welche Anteile gibt es, welcher Anteil dominiert im Normalfall? Dopplerbreite, Stossverbreiterung, natuerliche
Atome und Bindungen. Was sollen Sie mitnehmen?
 Was sollen Sie mitnehmen? Elementare Grundlagen: Atome und Bindungen Schalenmodell Orbitalmodell Periodensystem der Elemente Typische Eigenschaften der Elemente Die vier Bindungstypen Kovalente Bindung
Was sollen Sie mitnehmen? Elementare Grundlagen: Atome und Bindungen Schalenmodell Orbitalmodell Periodensystem der Elemente Typische Eigenschaften der Elemente Die vier Bindungstypen Kovalente Bindung
Übungsblatt 10. PHYS4100 Grundkurs IV (Physik, Wirtschaftsphysik, Physik Lehramt) Othmar Marti, oder 1. 7.
 Übungsblatt 10 PHYS4100 Grundkurs IV (Physik, Wirtschaftsphysik, Physik Lehramt) Othmar Marti, (othmar.marti@uni-ulm.de) 30. 6. 2005 oder 1. 7. 2005 1 Aufgaben 1. Zeigen Sie, dass eine geschlossene nl-schale
Übungsblatt 10 PHYS4100 Grundkurs IV (Physik, Wirtschaftsphysik, Physik Lehramt) Othmar Marti, (othmar.marti@uni-ulm.de) 30. 6. 2005 oder 1. 7. 2005 1 Aufgaben 1. Zeigen Sie, dass eine geschlossene nl-schale
9 WOODWARD-HOFFMANN-REGELN 92
 9 WOODWARD-HOFFMANN-REGELN 92 Die SMOs des Reaktanden und der Produkte (die nach Idealisierung nicht mehr unterschieden werden) müssen konstruiert und nach ihrer Knotenstruktur energetisch klassifiziert
9 WOODWARD-HOFFMANN-REGELN 92 Die SMOs des Reaktanden und der Produkte (die nach Idealisierung nicht mehr unterschieden werden) müssen konstruiert und nach ihrer Knotenstruktur energetisch klassifiziert
Vorlesung 20: Roter Faden: Auswahlregeln. Folien auf dem Web:
 Vorlesung 20: Roter Faden: Auswahlregeln Folien auf dem Web: http://www-ekp.physik.uni-karlsruhe.de/~deboer/ Siehe auch: http://www.uni-stuttgart.de/ipf/lehre/online-skript/ Wim de Boer, Karlsruhe Atome
Vorlesung 20: Roter Faden: Auswahlregeln Folien auf dem Web: http://www-ekp.physik.uni-karlsruhe.de/~deboer/ Siehe auch: http://www.uni-stuttgart.de/ipf/lehre/online-skript/ Wim de Boer, Karlsruhe Atome
Gruppentheorie ERNST MORITZ ARNDT UNIVERSITÄT GREIFSWALD. Mathematisch-Naturwissenschaftliche Fakultät INSTITUT FÜR BIOCHEMIE
 ERNST MORITZ ARNDT UNIVERSITÄT GREIFSWALD Mathematisch-Naturwissenschaftliche Fakultät INSTITUT FÜR BIOCHEMIE Arbeitskreis Physikalische Chemie Prof. Dr. Walter Langel Gruppentheorie Molekülschwingungen
ERNST MORITZ ARNDT UNIVERSITÄT GREIFSWALD Mathematisch-Naturwissenschaftliche Fakultät INSTITUT FÜR BIOCHEMIE Arbeitskreis Physikalische Chemie Prof. Dr. Walter Langel Gruppentheorie Molekülschwingungen
Versuch 40: UV-Photoelektronenspektroskopie
 Versuch 40: UV-Photoelektronenspektroskopie Ort: MZG (Technische Physik), Zi. 0.175 hω k k ϑ ϕ k Probe worum geht s? Messung der elektronischen Bandstruktur E(k) eines 2D-Festkörpers (Graphit) mittels
Versuch 40: UV-Photoelektronenspektroskopie Ort: MZG (Technische Physik), Zi. 0.175 hω k k ϑ ϕ k Probe worum geht s? Messung der elektronischen Bandstruktur E(k) eines 2D-Festkörpers (Graphit) mittels
Schwingungen (Vibrationen) zweiatomiger Moleküle
 Schwingungen (Vibrationen) zweiatomiger Moleküle Das Molekülpotential ist die Potentialkurve für die Schwingung H 2 Molekül 0.0 2.5 4 5 6 H( 1s) + H( 3l ) Energie in ev 5.0 7.5 H( 1s) + H( 2l ) H( 1s)
Schwingungen (Vibrationen) zweiatomiger Moleküle Das Molekülpotential ist die Potentialkurve für die Schwingung H 2 Molekül 0.0 2.5 4 5 6 H( 1s) + H( 3l ) Energie in ev 5.0 7.5 H( 1s) + H( 2l ) H( 1s)
Ferienkurs der TU München- - Experimentalphysik 4 Wasserstoffatom, Feinstruktur und Atome im Magnetfeld. Jonas J. Funke
 Ferienkurs der TU München- - Experimentalphysik 4 Wasserstoffatom, Feinstruktur und Atome im Magnetfeld Lösung Jonas J. Funke 0.08.00-0.09.00 Aufgabe (Drehimpulsaddition). : Gegeben seien zwei Drehimpulse
Ferienkurs der TU München- - Experimentalphysik 4 Wasserstoffatom, Feinstruktur und Atome im Magnetfeld Lösung Jonas J. Funke 0.08.00-0.09.00 Aufgabe (Drehimpulsaddition). : Gegeben seien zwei Drehimpulse
Gliederung. Potentialenergieflächen für chemische Reaktionen. und konische Durchschneidungen. 1 Born-Oppenheimer-Näherung
 Gliederung Potentialenergieflächen für chemische Reaktionen 1 2 adiabatische und diabatische Potentialflächen 3 Kreuzungsverbot für Potentialflächen, nicht-adiabatische Übergänge und konische Durchschneidungen
Gliederung Potentialenergieflächen für chemische Reaktionen 1 2 adiabatische und diabatische Potentialflächen 3 Kreuzungsverbot für Potentialflächen, nicht-adiabatische Übergänge und konische Durchschneidungen
TC1 Grundlagen der Theoretischen Chemie
 TC1 Grundlagen der Theoretischen Chemie Irene Burghardt (burghardt@chemie.uni-frankfurt.de) Praktikumsbetreuung: Konstantin Falahati (k.falahati@yahoo.com) Jan von Cosel (jvcosel@theochem.uni-frankfurt.de)
TC1 Grundlagen der Theoretischen Chemie Irene Burghardt (burghardt@chemie.uni-frankfurt.de) Praktikumsbetreuung: Konstantin Falahati (k.falahati@yahoo.com) Jan von Cosel (jvcosel@theochem.uni-frankfurt.de)
Spektroskopie-Seminar SS UV-Vis-Spektroskopie. UV-Vis-Spektroskopie
 UV-Vis-Spektroskopie 7.1 Allgemeines UV-Vis-Spektroskopie verwendet elektromagnetische Strahlung im sichtbaren und UV-Bereich. 190 nm bis 700 nm. Dabei kommt es zur Anregung von Elektronen ( Elektronenspektroskopie
UV-Vis-Spektroskopie 7.1 Allgemeines UV-Vis-Spektroskopie verwendet elektromagnetische Strahlung im sichtbaren und UV-Bereich. 190 nm bis 700 nm. Dabei kommt es zur Anregung von Elektronen ( Elektronenspektroskopie
Vorlesung Anorganische Chemie
 Vorlesung Anorganische Chemie Prof. Ingo Krossing WS 2007/08 B.Sc. Chemie Lernziele Block 4 Molekülstruktur Ausnahmen von der Oktettregel Hypervalente Verbindungen VSEPR Hybridisierung Molekülorbitale
Vorlesung Anorganische Chemie Prof. Ingo Krossing WS 2007/08 B.Sc. Chemie Lernziele Block 4 Molekülstruktur Ausnahmen von der Oktettregel Hypervalente Verbindungen VSEPR Hybridisierung Molekülorbitale
ACF-Vorkurs: Symmetrie in der Anorganischen Chemie
 ACF-Vorkurs: Symmetrie in der Anorganischen Chemie Stichworte: - Symmetrielemente - Punktgruppen - Charaktertafeln - Anwendung in der MO-Theorie I.1 Zur qualitativen Beschreibung genügt es oft, die Form
ACF-Vorkurs: Symmetrie in der Anorganischen Chemie Stichworte: - Symmetrielemente - Punktgruppen - Charaktertafeln - Anwendung in der MO-Theorie I.1 Zur qualitativen Beschreibung genügt es oft, die Form
Wechselwirkung zwischen Licht und chemischen Verbindungen
 Photometer Zielbegriffe Photometrie. Gesetz v. Lambert-Beer, Metallkomplexe, Elektronenanregung, Flammenfärbung, Farbe Erläuterungen Die beiden Versuche des 4. Praktikumstages sollen Sie mit der Photometrie
Photometer Zielbegriffe Photometrie. Gesetz v. Lambert-Beer, Metallkomplexe, Elektronenanregung, Flammenfärbung, Farbe Erläuterungen Die beiden Versuche des 4. Praktikumstages sollen Sie mit der Photometrie
Übungen zur Vorlesung Theoretische Chemie II Übungsblatt 1 SoSe 2015 Lösungen Ĥ Ψ = E Ψ (1) c b
 Übungen zur Vorlesung Theoretische Chemie II Übungsblatt SoSe 205 Lösungen. H 2 + Molekülion a) Konstruieren Sie die Schrödingergleichung in Matrixdarstellung. Zunächst geht man von der stationären Schrödinger-Gleichung
Übungen zur Vorlesung Theoretische Chemie II Übungsblatt SoSe 205 Lösungen. H 2 + Molekülion a) Konstruieren Sie die Schrödingergleichung in Matrixdarstellung. Zunächst geht man von der stationären Schrödinger-Gleichung
Chemistry Department Cologne University. Photochemie 1 PC 2 SS Chemistry Department Cologne University. Photochemie
 Photochemie 1 PC 2 2016 Photochemie 2 PC 2 2016 1 Wichtige photophysikalische Prozesse 3 PC 2 2016 Der Grundzustand Boltzmann Verteilung: Alle Moleküle sind im elektronischen Grundzustand (0) chwingungsgrundzustand
Photochemie 1 PC 2 2016 Photochemie 2 PC 2 2016 1 Wichtige photophysikalische Prozesse 3 PC 2 2016 Der Grundzustand Boltzmann Verteilung: Alle Moleküle sind im elektronischen Grundzustand (0) chwingungsgrundzustand
Spin- und Ortsraum-Wellenfunktion
 Spin- und Ortsraum-Wellenfunktion Der Spin,,lebt in einem unabhängigen abstrakten Raum. 02.07.2013 Michael Buballa 1 Spin- und Ortsraum-Wellenfunktion Der Spin,,lebt in einem unabhängigen abstrakten Raum.
Spin- und Ortsraum-Wellenfunktion Der Spin,,lebt in einem unabhängigen abstrakten Raum. 02.07.2013 Michael Buballa 1 Spin- und Ortsraum-Wellenfunktion Der Spin,,lebt in einem unabhängigen abstrakten Raum.
3 Mehrelektronensysteme
 3.1 Lernziele 1. Sie sind in der Lage, den Aufbau des Periodensystems nachzuvollziehen. 2. Sie können die Elektronenverteilung eines Atoms angeben, wenn Sie seine Elektronenanzahl kennen. 3. Sie können
3.1 Lernziele 1. Sie sind in der Lage, den Aufbau des Periodensystems nachzuvollziehen. 2. Sie können die Elektronenverteilung eines Atoms angeben, wenn Sie seine Elektronenanzahl kennen. 3. Sie können
Elektronenspektroskopie
 Elektronenspektroskopie Die Elektronenspektroskopie befasst sich mit der Wechselwirkung elektromagnetischer Strahlung des Wellenlängenbereichs von etwa 100 bis 800 nm mit Materie. Es werden dabei Elektronen
Elektronenspektroskopie Die Elektronenspektroskopie befasst sich mit der Wechselwirkung elektromagnetischer Strahlung des Wellenlängenbereichs von etwa 100 bis 800 nm mit Materie. Es werden dabei Elektronen
ORGANISCHE CHEMIE 1. Stoff der 15. Vorlesung: Atommodell, Bindungsmodell...
 Stoff der 15. Vorlesung: Atommodell, Bindungsmodell... ORGANISCHE CHEMIE 1 15. Vorlesung, Dienstag, 07. Juni 2013 - Einelektronensysteme: H-Atom s,p,d Orbital - Mehrelektronensysteme: He-Atom Pauli-Prinzip,
Stoff der 15. Vorlesung: Atommodell, Bindungsmodell... ORGANISCHE CHEMIE 1 15. Vorlesung, Dienstag, 07. Juni 2013 - Einelektronensysteme: H-Atom s,p,d Orbital - Mehrelektronensysteme: He-Atom Pauli-Prinzip,
Short Summary of the Essentials of the PC V Lecture. To be covered by the first excercise of this class
 Short Summary of the Essentials of the PC V Lecture To be covered by the first excercise of this class Das elektromagnetische Spektrum und Spektralbereiche Lineare Polarisation Elektromagnetische Wellen
Short Summary of the Essentials of the PC V Lecture To be covered by the first excercise of this class Das elektromagnetische Spektrum und Spektralbereiche Lineare Polarisation Elektromagnetische Wellen
