Synthese von Alkylhalogeniden: R X (X = F, Cl, Br, I)
|
|
|
- Clara Meinhardt
- vor 7 Jahren
- Abrufe
Transkript
1 Synthese von Alkylhalogeniden: R X (X = F, l,, I) I_folie107 1) Radikalische Substitution: R + X 2 T oder hν R X + X (X = F, l, ) 2) Elektrophile Addition an Alkene: + X R 2 R 2 (X = l,, I) R 2 R 2 X Alken + X 2 R 2 R 2 (X = l, ) X X 3) Elektrophile Addition an Alkine: X X R R + 2 X 2 R R Alkin X X (X = l, ) 4) Substitution der -Funktion in Alkoholen: R + X (PX 3 ) R X + (P() 3 ) (X = l,, I) Alkohol 5) Fluorhaltige Kohlenwasserstoffe: 2 of 2 + F 2 2 of of 3 eptan 7 F of F Perfluorheptan l 4 SbF 3 l 2 F 2 (Freon 12)
2 Eigenschaften der Alkylhalogenide: I_folie108 Dichte d : 2 : d = 1 g/cm Kohlenwasserstoffe, N-haltige Verbindung (Amine, Nitro-Verbindung, Amide), -haltige Verbindung (Alkohole, Ether, Ester, Säuren, Ketone, Aldehyde, Phenole): d < 1 g/cm Polychlor-Verbindung, om- und Iod-Verbindung: d > 1 g / cm 3 Beispiele: d [g/cm 3 ] X: l I 3 7 -X X X X δ + δ X - Bindung gute Lösungsmittel für polare und ist polar: unpolare Substanzen, wenig wasserlöslich, keine -ückenbindungen
3 Verwendung von Alkylhalogeniden I_folie109a 2 l 2 (Sdp. 40 ) Dichlormethan (Methylenchlorid) Lösungsmittel z.b. für elluloseacetat (entfettend) in Reinigungslösungen enthalten l 3 (Sdp. 61 ) Trichlormethan (hloroform) (enthält % Ethanol als Stabilisator) (krebserzeugend!) Lsm. für Fette, Öle, Wachse in Feuerlöschern, um die Schm.-Temp. von l 4 zu erniedrigen l 4 (Sdp. 121 ) Tetrachlormethan (Tetrachlorkohlen stoff) (leber- und nierenschädigend ruft Sehstörungen hervor) (krebserzeugend!) Tetrafeuerlöscher Lösungsmittel hemische Reinigung l 2 -l 2 (Sdp. 147 ) 1,1,2,2- Tetrachlorethan (toxisch wie l 4 ) (org. Zwischenprodukt; in Insektiziden und in "Unkrautex" enthalten
4 I_folie109b Verwendung von Alkylhalogeniden l 2 =l 2 (Sdp. 124 ) Tetrachlorethylen ("Per"chlorethylen) Lösungsmittel in der chemischen Reinigung zum Entfetten von Metallen 2 =l (Sdp. -13 ) hlorethylen Vinylchlorid (hochtoxisch, krebserzeugend) Monomeres für PV (Polyvinylchlorid) l l 3 (gering flüchtig) (tödliche Dosis für den Menschen: 500 mg/kg (Körpergewicht) l 1,1,1-Trichlor-2,2- bis(p-chlorphenyl)- ethan DDT (wird nur langsam abgebaut; Rückstände werden in der Umwelt und im Körpergewebe akkumuliert) Kontakt- Insektizid besonders wirksam gegen Anopheles Moskito (Überträger der Malaria)
5 Fluorchlorkohlenwasserstoffe (FKW) (hlorfluorcarbon: F) hlorfluoralkane (Freon bzw. Frigene) I_folie110 Fl 3 (Sdp ) Trichlorfluormethan Freon 11 (F-11) Kühlflüssigkeiten in Kühlaggregaten (Eisschränke) F 2 l 2 (Sdp. -29 ) Dichlordifluormethan Freon 12 (F-12) Treibmittel für Aerosole (Spraydosen) Polymethan-Schäume F 3 l (Sdp ) hlortrifluormethan Freon 13 (F-13) (chemisch sehr inert: Schicht) F 4 (Sdp ) Tetrafluormethan Freon 14 (F-14) Treibhausgase analog zu 2 F 3 -l (Sdp ) Schädigung der zon- 1-om-1-chlor-2,2,2- trifluorethan alothan Inhalierungs Anästhetikum
6 Vergleich von FKW und FKW I_folie111 Potential a) zur Zerstörung der zonschicht 1.5 l 4 (11) 1.0 Fl 3 F 2 l 2 (12) 2 l 2 F 4 (114) l 3 F(141b) 3 -l 2 F 2 l 3 F 3 (113) 2 lf 5 (115) F 2 (22) 0 F 3-2 F (134a) 0 l 2 -F F(123) Potential a) für die globale Erwärmung (Treibhauseffekt) a) jeweils bezogen auf (11) (Größe der Kreise ist proportional zur Lebensdauer)
7 I_folie112 zon Abbau in der Stratosphäre (vereinfacht) durch FKW (Fluorchlorkohlenwasserstoffe) F 2 l 2 hν F 2 l + l (Bindungshomolyse) Katalytischer Zyklus 3 + l 2 + l 2 x l 2 l 2 2 l 2 2 hν l 2 + l l l Mesomerie (Resonanz): mesomere Grenzstrukturen oder Resonanzstrukturen
8 folie113 Reaktionen der Alkylhalogenide 1) Nucleophile Substitution: (S N )-Reaktion Nu: R X R Nu : X Nu R X R Nu : X 2) β-eliminierung: (E)-Reaktion B β α B + X + X Beispiel für die Konkurrenz von (S N )- und (E)-Reaktion S N ( 3 ) 2 + Na + ( 3 ) 2 + Na E 3 + Na 3) Metallorganische Verbindungen Beispiel: Grignard-Synthese δ + δ δ δ + R X + Mg R MgX 2 (D 2 ) R (D) + Mg()X
9 I_folie114
10 Nucleophile Substitution I_folie115 a) 3 k 2 3 Reaktionsgeschwindigkeit (R.G.): R.G. = d[ 3 ] dt = k 2 [ 3 ] [ ] bimolekular Reaktion 2. rdnung bei 55 : k l 2 = mol s S 2 N Ethanol : 20 bei [ 3 ] = [ ] = 1mol/l : τ 1/2 = 47 s b) ( 3 ) 3 k 1 ( 3 ) 3 R.G. = d[( 3 ) 3 ] dt = k 1 [( 3 ) 3 ] monomolekular Reaktion 1. rdnung unabhängig von der Ionen Konzentration S N 1 55 : k = s τ 1/2 = 69 sec
11 I_folie116 Reaktionen 1. rdnung: A d[a] Reaktionsgeschwindigkeit: v = [ A]t k1 B = k1 dt [A] ; d[a] [A] = k1 dt t d ln[ A] = k dt 1 [ A] 0 ln[a]t 0 ln[a]o = k1t ; ln albwertszeit t1/2 [A]t = t1/2 = [A]o 2 [A]o = k1t ; [A]t = [A]oe k1t [A]t [Ao] ; ln = k1t1/2 = ln 2 [A]o/2 ln 2 k1 k2 Reaktion 2. rdnung: 2 A B d[a] v= dt [ A]t = k2[a]2 t d [ A] = k 2 dt 2 [ A] [ A0 ] 0 Zeit t 1 1 [A]t [A]o = k2t ; t1/2 = 1 k2[a]o
12 Mögliche Mechanismen der S N 2-Reaktion I_folie117
13 I_folie118 Mechanismus der bimolekularen nucleophilen Substitution: S N 2-Reaktion Konfigurationszuordnung: Die relativen Konfigurationen der beiden Verbindungen sind gleich R-(-)-2-omoctan [α] 25 D = R-(-)-2-ctanol [α] 25 D = -9.9 Experiment: S N 2-Reaktion unter Umkehr (Inversion) der Konfiguration R-(-)-2-omoctan [α] 25 D = o.r. = 100 % + S-(+)-2-ctanol + [α] 25 D = -9.9 o.r. = 100 % stereospezifische Reaktion 3 3 δ δ R S Synchronprozess
14 I_folie119 Relative Reaktionsgeschwindigkeiten: a) In Abhängigkeit vom Alkylrest bei Verzweigung am α--atom Finkelstein-Reaktion: R-X + Na I lösl. in Aceton S N 2 (Aceton) R-I + Na X (X=l, ) unlösl. in Aceton 3 α - > 3-2 α - > ( 3 ) 2 - α - > ( 3 ) 3 α - prim. sec. tert. k rel. 150 : 1 : 0.01 : Sterische Abstoßung in den pentavalenten Übergangszuständen (Gruppenhäufung am α--atom) I α I 3 α I 3 α I 3 α 3 3 3
15 I_folie119a b) in Abhängigkeit vom Alkylrest bei Verzweigung am β--atom S N 2 R- + Li l R-l + Li DMF DMF: Dimethylformamid: ( 3 ) 2 N-= 3 ß 2 α - > > ( 3 ) >> ( 3 ) 3-2 Neopentyl k rel. 1.0 : 0.7 : 0.3 : l β 33 α 3 3 l l 3 β 33 α 3 3 l 3 Übergangszustand: sterisch extrem gehindert
16 Nucleophilie (Lösungsmitteleffekte) bei der S N 2-Reaktion I_folie120 + polares Lösungsmittel Solvatisierung durch Dipol- Ion-Wechselwirkung Protisch µ[d] Dipolmoment ε Dielektrizitäts Konstante δ δ δ 3 δ δ δ Wasser Methanol Aprotisch + - δ δ N Acetonitril 3 N δ + δ - ( ) 2 -= Dimethylformamid DMF + - δ δ ( 3 ) S= Dimethylsulfoxid DMS δ δ ( 3 ) 2 = Aceton
17 I_folie120a X + 3 -I 25 k Lsm X- 3 + I X k DMF k 3 k k 3 DMF N 3.4 x x x 10 5 S- N 7.3 x x x 10 2 X l k DMF k 3 k k 3 DMF x x x x 10 4 I 3.0 x x x 10-3
18 Phasentransferkatalyse: I_folie Phasentransferkatalysator: 2 N l Benzyltriethylammoniumchlorid TEBA (c) Q K + N + Q + l K + l K + l R X N + R X N R + Q + X 2 - Phase Etherphase Phasen grenze Kronenether: Ionendurchmesser: K + :2.66 A; Na + :1.80 A; Li + : 1.20 A A + N + K K + N 18-Krone-6 löslich in organischen Solventien wie Ether, Benzol Na Li 15-Krone-5 komplexiert bevorzugt Na + 12-Krone-4 komplexiert bevorzugt Li +
19 I_folie122a Mechanismus der monomolekularen nucleophilen Substitution: S N 1-Reaktion k 1 ( 3 ) 3 ( 3 ) 3 k -1 A R B langsam ( 3 ) 3 k 2 R P ( 3 ) 3 schnell Kinetik: Bedingung des quasistätionären Zustandes (steady state) der Konzentration der reaktiven Zwischenstufen R R.G. = d[r] dt d[r] dt d[a] dt = k 1 [A] k -1 [R][B] = k 1 [A] k -1 [R][B] = 0 k 2 [R][] steady-state-bedingung [R] = k 1 [A] k -1 [B] + k 2 [] d[a] dt = 1 + k 1 [A] k -1 [B] k 2 [] k -1 [B] << k 2 [] k -1 [B] k 2 [] = 0 -d[a] dt = k 1 [A]
20 folie122b Stereochemie der S N1 -Reaktion Inversion der Konfiguration R-(-)-2-omoctan a.) arbeniumion (sp 2 ), planar b.) a.) b.) "S" "R" Retention der Konfiguration (Erhalt) Das Produkt ist partiell bis vollständig racemisch.
21 eterolytische Bindungsdissoziationsenergien I_folie [kcal/mol] prim sek tert (Gasphase) 1 cal = J Stabilität der arbeniumionen: tert. > sek. > prim. > 3 + S N 1-Substitution: relative Reaktivität: R X langsam F 3 R X schnell R F 3 X Trifluoressigsäure sehr polares Lösungsmittel 3 R: 3 X > X > 3 X > X tert.-butyl Isopropyl Ethyl Methyl tert sek prim. k rel. > < 10-4 < 10-5
22 Lösungsmitteleffekte: I_folie124 δ + δ - R X R X R X Reaktand Übergangszustand eterolyseprodukte E pot Gasphase δ + δ - R X große Stabilisierung des partiell geladenen Übergangszustandes durch das Lösungsmittel geringe Stabilisierung des ungeladenen Reaktanden R-X Lösung R + + X - Abstand (R-X) Im polaren Lösungsmittel: Stabilisierung der Ionen durch Ion-Dipol-Wechselwirkungen Generierung von stabilen arbokationen, die spektroskopisch charakterisiert werden können. R l SbF 5 S 2 (flüssig) 77 K R SbF 5 l komplexes Anion: nicht nucleophil polares aprotisches Lsm.
23 Wagner-Meerwein-Umlagerung I_folie125 a) Alkylwanderung: eterolyse primäres Kation tert. Kation (stabiler) b) ydrid-wanderung prim. Kation (instabil) X X 3 2 Z 3 Z 2 X sek. Kation (stabiler)
24 Wagner-Meerwein-Umlagerungen I_folie125a Wanderung tert. Kation (stabiler) sek. Kation -Wanderung X prim. Kation (instabiler)
25 Austrittsgruppe (leaving group) I_folie126 S N 1 X + Z Nucleophil X Austrittsgruppe S N 2 +Z δ δ Z X Z X Ein Maß für die Stabilität der ausgetretenen Gruppe X ist die Aciditätskonstante K X 2 3 X K a = [ 3 + ] [ X ] [X] X = l,, I starken Säuren alogenid-anionen sehr stabil: gute Austrittsgruppen X = S 2 Ar Sulfonsäuren: starke Säuren Sulfonat-Anionen sehr stabil: gute Austrittsgruppen S 2 3 S 2 3 S 2 F 3 p-toluolsulfonsäure p-toluolsulfonyl-rest Tosyl-: Ts- Methansulfonsäure Methansulfonyl-Rest Mesyl- M S - Trifluormethansulfonsäure Trifluormethansulfonyl-Rest Trifyl-: Tf-
26 I_folie127 Austrittsgruppe (leaving group) Ar S l R Sulfonylchlorid l Ar S R Sulfonsäureester Ts l Tosylchlorid 3 2 Ethanol l 3 2 Ts Ethyltosylat gute Ms l Mesylchlorid ( 3 ) 2 Isopropanol 3 2 Ms Isopropylmesylat Austrittsgruppen Tf l Trifylchlorid ( 3 ) 3 tert.-butanol 3 Tf tert.-butyltriflat X= 3 Acetyl-Rest Acetat-Anion Essigsäure: schwache Säure Ac wenig Ac- K a = 1.8 x 10-5 stabil: schlechtere Austrittsgruppe X = Wasser: sehr schwache Säure Ka = 1.8 x ydroxid-anion sehr instabil: sehr schlechte Austrittsgruppe jedoch: Alkohol protonierter Alkohol Wasser stabil gute Austrittsgruppe
27 I_folie128 Solvolyse: Lösungsmittel (Solvens) fungiert als Nucleophil. Die Reaktion kann sowohl nach dem S N 1 als auch S N 2-Mechanismus verlaufen und folgt entweder einer Kinetik 1.rdnung oder einer Kinetik pseudo 1. rdnung, da auch bei der bimolekularen S N 2-Reaktion die Konzentration des Nucleophils [S-] wegen des großen Solvens-Überschusses als eine Konstante betrachtet werden kann. k R X S R S X R S X Solvens k = pseudo k [S-] Beispiel: Ethanol Neopentylbromid Solvolyse nach S N 1 mit Wagner-Meerwein-Umlagerung
28 inweise auf S N 1 - und S N 2-Reaktionen I_folie129 S N 1-Reaktion S N 2-Reaktion 1. Kinetik 1. rdnung R.G. = k 1 [R-X] 2. Kein Einfluß durch Art und Konzentration des Nucleophils (Nu) 3. Für arbeniumionen typische Umlagerungsreaktionen (Wagner- Meerwein-Umlagerung) 4. großer Lösungsmitteleffekt: stark polare protische Lösungsmittel begünstigen S N 1 5. Stereochemie: partielle bis vollständige Racemisierung auf der Stufe der achiralen arbeniumionen bei Verwendung von chiralen, optisch aktiven Substraten 6. Abhängigkeit von der Substratstruktur: tert. > sec- >> prim. abnehmende Reaktionsgeschwindigkeit 1. Kinetik 2. rdnung R.G. = k 2 [R-X] [Nu] 2. Großer Einfluß durch Art und Konzentration des Nucleophils (Nu) (hohe Konz. [Nu] und starkes Nu begünstigen S N 2) 3. Keine Umlagerungen 4. polare aprotische Lösungsmittel, in denen Nu "nackt" vorliegt, begünstigen S N 2 (Phasen-Transfer-Katalyse) 5. Stereochemie: Rückseitenangriff des Nucleophils. Vollständige Inversion am hiralitätszentrum 6. Abhängigkeit von der Substratstruktur: 3 > prim. > sec. >> tert. abnehmende Reaktionsgeschwindigkeit
Halogenalkane. Radikalische Halogenierung von Alkanen. Addition von Halogenwasserstoffen an Alkene. H 3 C + HBr H C C C H.
 alogenalkane erstellung: adikalische alogenierung von Alkanen + l + l + l l l + l Addition von alogenwasserstoffen an Alkene 3 Br + Br 3 Nucleophile Substitution an Alkylhalogeniden Nucleophil Elektrophil
alogenalkane erstellung: adikalische alogenierung von Alkanen + l + l + l l l + l Addition von alogenwasserstoffen an Alkene 3 Br + Br 3 Nucleophile Substitution an Alkylhalogeniden Nucleophil Elektrophil
Kapitel 3. Nucleophile Substitution
 Kapitel 3. Nucleophile Substitution Reaktionsmechanismen - S N 1-Reaktion: Reaktionskoordinate-Energie-Diagramm; Kinetik, Struktur-Reaktivitätsbeziehungen (stabiles Carbokation, schwaches Nucleophil, gute
Kapitel 3. Nucleophile Substitution Reaktionsmechanismen - S N 1-Reaktion: Reaktionskoordinate-Energie-Diagramm; Kinetik, Struktur-Reaktivitätsbeziehungen (stabiles Carbokation, schwaches Nucleophil, gute
CCl 3. 1,1,1-Trichlor-2,2-di(4-chlorphenyl)ethan Dichlordiphenyltrichlorethan
 V. alogenalkane 2 l 2, l 3, l 4 : wichtige Lösungsmittel l l 1,2-Dichlorethan Insektizid DDT l l 2 1 l 3 1,1,1-Trichlor-2,2-di(4-chlorphenyl)ethan Dichlordiphenyltrichlorethan - Insektizid (P. Müller,
V. alogenalkane 2 l 2, l 3, l 4 : wichtige Lösungsmittel l l 1,2-Dichlorethan Insektizid DDT l l 2 1 l 3 1,1,1-Trichlor-2,2-di(4-chlorphenyl)ethan Dichlordiphenyltrichlorethan - Insektizid (P. Müller,
II. Halogenalkane, radikalische und nukleophile Substitution
 II. alogenalkane, radikalische und nukleophile Substitution Experimentelle Beobachtung: 36 n-c 6 14 RT n-c 6 13 Br + Br Allgemein formuliert: R- Br 2 -Br R-Br Wie geht das? 37 Mechanismus am besten mit
II. alogenalkane, radikalische und nukleophile Substitution Experimentelle Beobachtung: 36 n-c 6 14 RT n-c 6 13 Br + Br Allgemein formuliert: R- Br 2 -Br R-Br Wie geht das? 37 Mechanismus am besten mit
Alkylwanderungen. Mechanismus: HCl. HCl. Cl β-pinen. Bornylchlorid. OC4_folie185
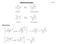 Alkylwanderungen 4_folie185 l l amphen Isobornylchlorid l l β-pinen Bornylchlorid Mechanismus: l l l l Pinakol-Umlagerung 4_folie186 2 + - 2 2-2 + 3 3 3 1,2-3 ~ 3 3 3 3 3 3 3 3 3-3 ( 3 ) 3 Dienon-Phenol-Umlagerung
Alkylwanderungen 4_folie185 l l amphen Isobornylchlorid l l β-pinen Bornylchlorid Mechanismus: l l l l Pinakol-Umlagerung 4_folie186 2 + - 2 2-2 + 3 3 3 1,2-3 ~ 3 3 3 3 3 3 3 3 3-3 ( 3 ) 3 Dienon-Phenol-Umlagerung
Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen.
 1 Übung 13 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen. Ms: Mesyl-Gruppe (CH 3 SO 3 -), Tf: Triflyl-Gruppe (CF 3 SO 3 -), Ts:
1 Übung 13 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen. Ms: Mesyl-Gruppe (CH 3 SO 3 -), Tf: Triflyl-Gruppe (CF 3 SO 3 -), Ts:
Physikalische Eigenschaften der Alkohole
 Physikalische Eigenschaften der Alkohole Die Struktur von Alkoholen ist ähnlich der von Wasser 96pm 110pm 143pm 96pm Methanol 109 104.5 108.9 I_folie228 Wasserstoffbrückenbindungen: BDE = 21KJ/mol 207pm
Physikalische Eigenschaften der Alkohole Die Struktur von Alkoholen ist ähnlich der von Wasser 96pm 110pm 143pm 96pm Methanol 109 104.5 108.9 I_folie228 Wasserstoffbrückenbindungen: BDE = 21KJ/mol 207pm
Chemie für Biologen, 2017
 Chemie für Biologen, 2017 Übung 11 Organisch chemische Reaktionen (Thema 12.1 12.6) Aufgabe 1: a) Erklären Sie folgende Begriffe: i) Übergangszustand Zustand der höchsten Energie in einer Reaktion, kann
Chemie für Biologen, 2017 Übung 11 Organisch chemische Reaktionen (Thema 12.1 12.6) Aufgabe 1: a) Erklären Sie folgende Begriffe: i) Übergangszustand Zustand der höchsten Energie in einer Reaktion, kann
Kapitel 3: Nucleophile Substitution am gesättigten (sp 3 ) C-Atom
 Kapitel 3: ucleophile Substitution am gesättigten (sp 3 ) -Atom 3.1. Allgemeines Reaktionsschema und Grundlagen δ δ Solvens X YI Y Substrat ucleophil Substitutionsprodukt XI nucleofuge Abgangsgruppe (engl.
Kapitel 3: ucleophile Substitution am gesättigten (sp 3 ) -Atom 3.1. Allgemeines Reaktionsschema und Grundlagen δ δ Solvens X YI Y Substrat ucleophil Substitutionsprodukt XI nucleofuge Abgangsgruppe (engl.
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Inhaltsverzeichnis. 3 Gesättigte Kohlenwasserstoffe (Alkane) 3.1 Offenkettige Alkane 3.2 Cyclische Alkane
 Inhaltsverzeichnis 1 Chemische Bindung in organischen Verbindungen 1.1 Einleitung 1.2 Grundlagen der chemischen Bindung 1.3 Die Atombindung (kovalente oder homöopolare Bindung) 1.4 Bindungslängen und Bindungsenergien
Inhaltsverzeichnis 1 Chemische Bindung in organischen Verbindungen 1.1 Einleitung 1.2 Grundlagen der chemischen Bindung 1.3 Die Atombindung (kovalente oder homöopolare Bindung) 1.4 Bindungslängen und Bindungsenergien
Vorlesung "Organische Chemie 1" Übungsblatt 4
 Vorlesung "Organische hemie 1" Übungsblatt 4 Ü1: Beim Steamcracken wird eine komplexe Mischung von Kohlenwasserstoffen durch kurzzeitiges Erhitzen in Gegenwart von Wasserdampf in eine Mischung von leichter
Vorlesung "Organische hemie 1" Übungsblatt 4 Ü1: Beim Steamcracken wird eine komplexe Mischung von Kohlenwasserstoffen durch kurzzeitiges Erhitzen in Gegenwart von Wasserdampf in eine Mischung von leichter
Dipolmomente + - a ohne Feld b mit Feld. δ + δ- δ + δ - δ + δ - δ + δ - δ + δ - δ + Dipolmoment: µ = q * d
 CI_folie29 Dipolmomente δ- + - a ohne Feld b mit Feld + + + + + + - - - - - - Effekt eines elektrostatischen Feldes auf die rientierung polarer Moleküle. Dipolmoment: µ = q * d d: Abstand zwischen den
CI_folie29 Dipolmomente δ- + - a ohne Feld b mit Feld + + + + + + - - - - - - Effekt eines elektrostatischen Feldes auf die rientierung polarer Moleküle. Dipolmoment: µ = q * d d: Abstand zwischen den
Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) OH H + - H 2 O. (aus H 3 PO 4 H 2 SO 4 ) - H + Stichpunkte zum E1-Mechanismus:
 Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) + (aus 3 P 4 2 S 4 ) - 2 - + Stichpunkte zum E1-Mechanismus: 2-Schritt-eaktion über ein Carbenium-Ion (1. Schritt ist Abspaltung der Abgangsgruppe (im
Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) + (aus 3 P 4 2 S 4 ) - 2 - + Stichpunkte zum E1-Mechanismus: 2-Schritt-eaktion über ein Carbenium-Ion (1. Schritt ist Abspaltung der Abgangsgruppe (im
Präparat a n-butyl-phenylether aus Phenol Williamson'sche Ethersynthese
 Präparat 1.2.2.a n-butyl-phenylether aus Phenol Williamson'sche Ethersynthese 1. Reaktionsgleichung Na Na 2 Na Adogen 464 Na Adogen: Methyltrioctylammoniumchlorid (Phasentransferkatalysator) gelbliche,
Präparat 1.2.2.a n-butyl-phenylether aus Phenol Williamson'sche Ethersynthese 1. Reaktionsgleichung Na Na 2 Na Adogen 464 Na Adogen: Methyltrioctylammoniumchlorid (Phasentransferkatalysator) gelbliche,
Versuch: Reaktivität von primären, sekundären und tertiären Alkylbromiden gegenüber ethanolischer Silbernitratlösung. keine Reaktion.
 Philipps-Universität Marburg 15.01.2008 rganisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 5, Halogenalkane Versuch: Reaktivität von primären, sekundären
Philipps-Universität Marburg 15.01.2008 rganisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 5, Halogenalkane Versuch: Reaktivität von primären, sekundären
Halogenderivate der Alkane
 Halogenderivate der Alkane Einteilung - gesättigte und ungesättigte Halogenverb. - nach der Anzahl der -Atome, = 1,2,3, - Dihalogenide: n geminale vicinale disjunkt H 2 H 2 H H 2 primäre, sekundäre, terciäre
Halogenderivate der Alkane Einteilung - gesättigte und ungesättigte Halogenverb. - nach der Anzahl der -Atome, = 1,2,3, - Dihalogenide: n geminale vicinale disjunkt H 2 H 2 H H 2 primäre, sekundäre, terciäre
Reaktionen der Alkene
 Addition an die π-bindung eaktionen der Alkene CI_folie144 C C X Y C C X Y 1) Katalytische ydrierung von Alkenen Beispiele: Katalysator C C Pt C C C C C C C C C C C C, 5 C C -Methyl--hexen (Lösungsmittel)
Addition an die π-bindung eaktionen der Alkene CI_folie144 C C X Y C C X Y 1) Katalytische ydrierung von Alkenen Beispiele: Katalysator C C Pt C C C C C C C C C C C C, 5 C C -Methyl--hexen (Lösungsmittel)
N H H. Carbanionen Lewis-Basen Olefine (Alkane) Die Stärke der Nucleophilie wird von versch. Faktoren beeinflußt z.b.
 Organische hemie Nucleophil = kernliebend Nucleophil = Teilchen oder Gruppe, die Lewis-basische Eigenschaften aufweist (also mind. ein freies Elektronenpaar besitzt), es gibt neutrale Nucleophile sowie
Organische hemie Nucleophil = kernliebend Nucleophil = Teilchen oder Gruppe, die Lewis-basische Eigenschaften aufweist (also mind. ein freies Elektronenpaar besitzt), es gibt neutrale Nucleophile sowie
kj/mol kj/mol 500 I Halogenmethan
 250 200 150 100 50 0 Vorlesung 11. alogenalkane CalogenBindungsstärke nimmt mit zunehmender Größe des alogens ab CalogenBindungslänge nimmt in derselben Richtung zu (Vollhardt,. Aufl., S. 206, Tab. 61,
250 200 150 100 50 0 Vorlesung 11. alogenalkane CalogenBindungsstärke nimmt mit zunehmender Größe des alogens ab CalogenBindungslänge nimmt in derselben Richtung zu (Vollhardt,. Aufl., S. 206, Tab. 61,
1. Klausur zum Praktikum Organische Chemie I für Studierende der Chemie und der Biochemie im SS 2000
 Prof. Dr. B. König Prof. Dr. Th. Troll 1. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 2000 am Dienstag, dem 30. Mai 2000 Name: Mustermann...Vorname: Max...
Prof. Dr. B. König Prof. Dr. Th. Troll 1. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 2000 am Dienstag, dem 30. Mai 2000 Name: Mustermann...Vorname: Max...
Reaktionsmechanismen nach dem gleichnahmigen Buch von R. Brückner
 eaktionsmechanismen nach dem gleichnahmigen Buch von. Brückner Kap. 2 cleophile Substitution Dr. ermann A. Wegner hermann.wegner@unibas.ch 1 Darauf wird aufgebaut... Atom-rbital & Molekül-rbital Theorie
eaktionsmechanismen nach dem gleichnahmigen Buch von. Brückner Kap. 2 cleophile Substitution Dr. ermann A. Wegner hermann.wegner@unibas.ch 1 Darauf wird aufgebaut... Atom-rbital & Molekül-rbital Theorie
Übung: Alkene & Alkohole HS-07
 kt. 007, r.marti / Synthese und eaktionsmechanismen Übung: Alkene & Alkohole S-07 = C 6 7 8 CMe 9 0 Fragen: - Wie können die Intermediate - hergestellt werden, auf was ist zu achten bzgl. eaktivitäten/eagenzien
kt. 007, r.marti / Synthese und eaktionsmechanismen Übung: Alkene & Alkohole S-07 = C 6 7 8 CMe 9 0 Fragen: - Wie können die Intermediate - hergestellt werden, auf was ist zu achten bzgl. eaktivitäten/eagenzien
3 Eliminierungen. 3.1 Begriffe und mechanistische Einteilung. Abspaltung zweier Atome bzw. Atomgruppen aus einem Molekül
 3 Eliminierungen 3.1 Begriffe und mechanistische Einteilung Abspaltung zweier Atome bzw. Atomgruppen aus einem Molekül Einteilung nach den Positionen der abgespaltenen Gruppen 1,1-Eliminierung (α-eliminierung)
3 Eliminierungen 3.1 Begriffe und mechanistische Einteilung Abspaltung zweier Atome bzw. Atomgruppen aus einem Molekül Einteilung nach den Positionen der abgespaltenen Gruppen 1,1-Eliminierung (α-eliminierung)
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Seminarplan zum. Chemischen Praktikum für Biologen ohne Prüfungsfach Chemie. (Lehramt) TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE
 Seminarplan zum Chemischen Praktikum für Biologen ohne Prüfungsfach Chemie (Lehramt) TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE TEIL II: ORGANISCHE CHEMIE 1 TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE Einführung
Seminarplan zum Chemischen Praktikum für Biologen ohne Prüfungsfach Chemie (Lehramt) TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE TEIL II: ORGANISCHE CHEMIE 1 TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE Einführung
Isomerie. Ethanol. Stereoisomere: gleiche Summenformel, gleiche Verknüpfung der Atome, aber in unterschiedlicher Raumrichtung. trans- oder E-2-Buten
 Isomerie Folie271 Konstitutions- zw. Strukturisomere: gleiche Summenformel, unterschiedliche Verknüpfung der Atome: Beispiele: 2 6 : 3 3 3 2 Dimethylether Ethanol 4 10 : 3 2 2 3 3 3 n-butan 3 Isoutan Stereoisomere:
Isomerie Folie271 Konstitutions- zw. Strukturisomere: gleiche Summenformel, unterschiedliche Verknüpfung der Atome: Beispiele: 2 6 : 3 3 3 2 Dimethylether Ethanol 4 10 : 3 2 2 3 3 3 n-butan 3 Isoutan Stereoisomere:
2 Nucleophile Substitutionen am gesättigten Kohlenstoff
 2 ucleophile Substitutionen am gesättigten Kohlenstoff 21 Allgemeiner eaktionsablauf X Y: Y X: allgemeiner: Substrat ucleophil Produkt ucleofug Elektrophil ucleophil Elektrophil ucleophil ucleophile: Anionen
2 ucleophile Substitutionen am gesättigten Kohlenstoff 21 Allgemeiner eaktionsablauf X Y: Y X: allgemeiner: Substrat ucleophil Produkt ucleofug Elektrophil ucleophil Elektrophil ucleophil ucleophile: Anionen
Inhaltsverzeichnis zu Kapitel 5. Halogenalkane
 Inhaltsverzeichnis zu Kapitel 5. alogenalkane 5. alogenalkane 5.1 omenklatur 62 5.2 Stereoisomere 62 5.3 Darstellung von alogenalkanen 65 5.3.1 Radikalische Substitution 65 5.3.2 Elektrophile Addition
Inhaltsverzeichnis zu Kapitel 5. alogenalkane 5. alogenalkane 5.1 omenklatur 62 5.2 Stereoisomere 62 5.3 Darstellung von alogenalkanen 65 5.3.1 Radikalische Substitution 65 5.3.2 Elektrophile Addition
Synthesen von Carbonsäuren: industrielle Verfahren
 Synthesen von arbonsäuren: industrielle Verfahren I_folie267 a. Essigsäure: 2 2 Ethylen Acetylen 2 ( + 2 ) 2 Ethanol 2 (gs 4, + ) 2 2 2, 2 Kat. Vinylalkohol Enol 2 Enol Katalysator: Pdl 2 /ul 2 : Wacker-Prozess
Synthesen von arbonsäuren: industrielle Verfahren I_folie267 a. Essigsäure: 2 2 Ethylen Acetylen 2 ( + 2 ) 2 Ethanol 2 (gs 4, + ) 2 2 2, 2 Kat. Vinylalkohol Enol 2 Enol Katalysator: Pdl 2 /ul 2 : Wacker-Prozess
Kapitel 4: Eliminierung - Übersicht
 » Reaktionstypen - 1,1-, 1,2-, 1,3-, 1,4-Eliminierung (α-, β-, γ-, δ- Eliminierung), thermische Fragmentierung, cis-eliminierung» Regel - Eliminierung wird begünstigt durch hohe Temperatur, starke Basen,
» Reaktionstypen - 1,1-, 1,2-, 1,3-, 1,4-Eliminierung (α-, β-, γ-, δ- Eliminierung), thermische Fragmentierung, cis-eliminierung» Regel - Eliminierung wird begünstigt durch hohe Temperatur, starke Basen,
Verzeichnis der Wortabkürzungen... Verzeichnis der Zeichen und Symbole...XVII
 VII Verzeichnis der Wortabkürzungen... XIII Verzeichnis der Zeichen und Symbole...XVII Organische Chemie 3.1 Chemische Bindung... 3 3.1.1 Orbitale, deren Hybridisierung und Überlappung... 3 3.1.2 Einfachbindungen...
VII Verzeichnis der Wortabkürzungen... XIII Verzeichnis der Zeichen und Symbole...XVII Organische Chemie 3.1 Chemische Bindung... 3 3.1.1 Orbitale, deren Hybridisierung und Überlappung... 3 3.1.2 Einfachbindungen...
8 Carbonsäuren und Derivate
 8 arbonsäuren und Derivate 8.1 Allgemeine Darstellungsverfahren xidation primärer Alkohole und Aldehyde (s. Kap. 6) 2 2 xidation durch r 3 /, KMn 4 /, N 3 aloform-eaktion (s. Kap. 9) 3 Br 2 xidation von
8 arbonsäuren und Derivate 8.1 Allgemeine Darstellungsverfahren xidation primärer Alkohole und Aldehyde (s. Kap. 6) 2 2 xidation durch r 3 /, KMn 4 /, N 3 aloform-eaktion (s. Kap. 9) 3 Br 2 xidation von
6. Rechenübung Organik (27.01./ )
 1 6. Rechenübung Organik (27.01./03.02.2009) Literatur: 2.) Mortimer : hemie Basiswissen hemie ISBN 3 13 484308 0 Paula Y. Bruice : Organische hemie ISBN 978 3 8273 7190 4 Gesättigtes Atom Atom, nur mit
1 6. Rechenübung Organik (27.01./03.02.2009) Literatur: 2.) Mortimer : hemie Basiswissen hemie ISBN 3 13 484308 0 Paula Y. Bruice : Organische hemie ISBN 978 3 8273 7190 4 Gesättigtes Atom Atom, nur mit
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Inhaltsverzeichnis. 3 Organische Chemie. Vorwort Chemische Bindung Chemische Reaktionstypen Bindungen...
 VII Inhaltsverzeichnis Vorwort... V 3 Organische Chemie 3.1 Chemische Bindung... 3 3.1.1 Orbitale, deren Hybridisierung und Überlappung....................... 3 3.1.2 Einfachbindungen... 12 3.1.3 Doppelbindungen...
VII Inhaltsverzeichnis Vorwort... V 3 Organische Chemie 3.1 Chemische Bindung... 3 3.1.1 Orbitale, deren Hybridisierung und Überlappung....................... 3 3.1.2 Einfachbindungen... 12 3.1.3 Doppelbindungen...
a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten!
 Übung Nr. 9 Mi. 02.05.2012 bzw. Fr. 04.05.2012 1. Aromatensynthese a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten! b) Was passiert bei der Umsetzung von
Übung Nr. 9 Mi. 02.05.2012 bzw. Fr. 04.05.2012 1. Aromatensynthese a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten! b) Was passiert bei der Umsetzung von
VII INHALTSVERZEICHNIS
 VII INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 3.2 Chemische Reaktionstypen 12 3.3 Stereochemie 30 3.4 Alkane, Cycloalkane 46 3.5 Alkene, Alkine 47 3.6 Aromatische
VII INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 3.2 Chemische Reaktionstypen 12 3.3 Stereochemie 30 3.4 Alkane, Cycloalkane 46 3.5 Alkene, Alkine 47 3.6 Aromatische
 INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 Säuren und Basen der organischen Chemie 5 3.2 Chemische Reaktionstypen 15 3.3 Stereochemie 39 3.4 Alkane, Cycloalkane
INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 Säuren und Basen der organischen Chemie 5 3.2 Chemische Reaktionstypen 15 3.3 Stereochemie 39 3.4 Alkane, Cycloalkane
Grundlagen der Organischen Chemie
 Grundlagen der Organischen Chemie Vorlesung im WS 2010/2011 1. Einführung 1 1.1 Die wunderbare Welt der Organischen Chemie 1.2 Kohlenstoff ein ganz besonderes Element 4 2. Die kovalente Bindung 5 2.1 Atomorbitale
Grundlagen der Organischen Chemie Vorlesung im WS 2010/2011 1. Einführung 1 1.1 Die wunderbare Welt der Organischen Chemie 1.2 Kohlenstoff ein ganz besonderes Element 4 2. Die kovalente Bindung 5 2.1 Atomorbitale
Übungsblatt 6 - Lösung
 Übungen rganische hemie für Studierende der Lehrämter und der Biologie (Diplom), WS 2003/04 Dr.. abrele Übungsblatt 6 - Lösung 1. n-butylbromid, sec-butylbromid und tert-butylbromid werden jeweils mit
Übungen rganische hemie für Studierende der Lehrämter und der Biologie (Diplom), WS 2003/04 Dr.. abrele Übungsblatt 6 - Lösung 1. n-butylbromid, sec-butylbromid und tert-butylbromid werden jeweils mit
Prof. Dr. Th. K. Lindhorst, SS 2003, Übungsklausur. Übungsklausur. zur Vorlesung Allgemeine Chemie II, SS 2003 Experimentalvorlesung, OC I
 Übungsklausur zur Vorlesung Allgemeine Chemie II, SS 2003 Experimentalvorlesung, C I Diese Auswahl von Aufgaben wurde auf Anfrage zusammengestellt; die Klausur könnte also beispielsweise wie folgt lauten
Übungsklausur zur Vorlesung Allgemeine Chemie II, SS 2003 Experimentalvorlesung, C I Diese Auswahl von Aufgaben wurde auf Anfrage zusammengestellt; die Klausur könnte also beispielsweise wie folgt lauten
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Lösungen 2.Übungsblatt SS NBS, AIBN Br K +
 Lösungen 2.Übungsblatt 2002 1. Aufgabe: ubstitutionsreaktionen NB, AIBN racemisch Erklärung: Die radikalische ubstitution erfolgt wegen der hohen elektivität des omatoms am tertiären (und zugleich auch
Lösungen 2.Übungsblatt 2002 1. Aufgabe: ubstitutionsreaktionen NB, AIBN racemisch Erklärung: Die radikalische ubstitution erfolgt wegen der hohen elektivität des omatoms am tertiären (und zugleich auch
Reaktionen der Ester. Basische Ester-Hydrolyse: Verseifung
 25-27 51-55 30-32 61-65 eaktionen der Ester I_folie286 Basische Ester-ydrolyse: Verseifung 1 a 2 a 1 2 2 1 2 3 3 a 2 2 2 Fett Glycerin Seife 1 2 3 Wachse (z. B. Bienenwachs) Ester von Fettsäuren mit langkettigen
25-27 51-55 30-32 61-65 eaktionen der Ester I_folie286 Basische Ester-ydrolyse: Verseifung 1 a 2 a 1 2 2 1 2 3 3 a 2 2 2 Fett Glycerin Seife 1 2 3 Wachse (z. B. Bienenwachs) Ester von Fettsäuren mit langkettigen
CHE 102.1: Grundlagen der Chemie - Organische Chemie
 E 102.1: Grundlagen der hemie - Organische hemie Prof Dr. E. Landau und Prof. Dr. J. A. Robinson 8. alogenalkane : Nucleophile Substitutions- und Eliminationsreaktionen alogenalkane sind in der organischen
E 102.1: Grundlagen der hemie - Organische hemie Prof Dr. E. Landau und Prof. Dr. J. A. Robinson 8. alogenalkane : Nucleophile Substitutions- und Eliminationsreaktionen alogenalkane sind in der organischen
13.1. Struktur der Carbonyl-Gruppe, Prinzipielle Reaktivität
 13. arbonyl -Verbindungen 13.1. Struktur der arbonyl-gruppe, Prinzipielle Reaktivität 13.2. Aldehyde & Ketone 13.2.1 Nomenklatur 13.2.2 Darstellungen xidationen 13.2.3 Reaktionen Additionen an der = Acetale
13. arbonyl -Verbindungen 13.1. Struktur der arbonyl-gruppe, Prinzipielle Reaktivität 13.2. Aldehyde & Ketone 13.2.1 Nomenklatur 13.2.2 Darstellungen xidationen 13.2.3 Reaktionen Additionen an der = Acetale
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redoxreaktionen Oxidation/Reduktion
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redoxreaktionen Oxidation/Reduktion
D D. D endo-cis exo-cis trans p = 1 bar: 58.4 : 38.6 : 3.0 cis- stereoselectivity: 97% p = 6.8 kbar: 72.0 : 27.0 : <1.0 cis-stereoselectivity: >99%
 4_folie100 [4 + 2] endo-cis exo-cis trans p = 1 bar: 58.4 : 38.6 : 3.0 cis- stereoselectivity: 97% + 120 p = 6.8 kbar: 72.0 : 27.0 : 99% V (endo-exo) -2.5 cm 3 /mol [2 + 2]
4_folie100 [4 + 2] endo-cis exo-cis trans p = 1 bar: 58.4 : 38.6 : 3.0 cis- stereoselectivity: 97% + 120 p = 6.8 kbar: 72.0 : 27.0 : 99% V (endo-exo) -2.5 cm 3 /mol [2 + 2]
Mechanismen nucleophiler Substitutionen am aliphatischen Kohlenstoff
 Vorlesung 16 Mechanismen nucleophiler Substitutionen am aliphatischen Kohlenstoff Bimolekulare nucleophile Substitutionen (S N 2-Reaktionen) In Vorlesung 11 hatten wir bereits die nucleophile Substitution
Vorlesung 16 Mechanismen nucleophiler Substitutionen am aliphatischen Kohlenstoff Bimolekulare nucleophile Substitutionen (S N 2-Reaktionen) In Vorlesung 11 hatten wir bereits die nucleophile Substitution
5. Halogenalkane. Alkylierungsgrad. Halogenalkane Halogenierungsgrad
 5. Halogenalkane Halogenalkane gehören zur Gruppe der Halogenkohlenwasserstoffe (neben Halogenalkenen und Halogenaromaten). In Halogenkohlenwasserstoffen ist mindenstens ein Wasserstoffatom durch ein Halogenatom
5. Halogenalkane Halogenalkane gehören zur Gruppe der Halogenkohlenwasserstoffe (neben Halogenalkenen und Halogenaromaten). In Halogenkohlenwasserstoffen ist mindenstens ein Wasserstoffatom durch ein Halogenatom
n Pentan 2- Methylbutan 2,2, dimethylpropan ( Wasserstoffatome sind nicht berücksichtigt )
 Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Std. Stoffklassen Konzepte & Methoden Reaktionen 2 Struktur und Bindung 2 Alkane Radikale Radikal-Reaktionen 2 Cycloalkane Konfiguration &
 Materialien (Version: 26.06.2001) Diese Materialien dienen zur Überprüfung des Wissens und sind keine detailierten Lernunterlagen. Vorschlag: fragen Sie sich gegenseitig entsprechend dieser Listen ab.
Materialien (Version: 26.06.2001) Diese Materialien dienen zur Überprüfung des Wissens und sind keine detailierten Lernunterlagen. Vorschlag: fragen Sie sich gegenseitig entsprechend dieser Listen ab.
Übungen Kapitel 1 Alkane- Radikalische Substitution
 Übungen Kapitel 1 Alkane- Radikalische Substitution 1. Ein Gemisch aus Halogen und Alkan reagiert bei Bestrahlung mit UV- Licht oder höheren Temperaturen (Bsp. die Gase Methan und Chlor erst bei 250-400
Übungen Kapitel 1 Alkane- Radikalische Substitution 1. Ein Gemisch aus Halogen und Alkan reagiert bei Bestrahlung mit UV- Licht oder höheren Temperaturen (Bsp. die Gase Methan und Chlor erst bei 250-400
Reaktionstypen der Aliphate
 Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Chemisches Praktikum für Studierende der Humanmedizin, der Zahnheilkunde und Biologie/Lehramt
 Chemisches Praktikum für Studierende der umanmedizin, der Zahnheilkunde und Biologie/Lehramt Fachbereich Chemie der Philipps-Universität Marburg 2. Klausur zum 2. Praktikumsteil (C) vom 25.07.17 NAME;
Chemisches Praktikum für Studierende der umanmedizin, der Zahnheilkunde und Biologie/Lehramt Fachbereich Chemie der Philipps-Universität Marburg 2. Klausur zum 2. Praktikumsteil (C) vom 25.07.17 NAME;
Vorlesung OC-V. Carbeniumionen
 Carbeniumionen Woher kennen wir bereits Carbeniumionen? 1. Triphenylmethanfarbstoffe Adolf von Bayer erzeugte 1902 die ersten stabilen intensiv farbigen Triarylmethylkationen Lebensdauer in Wasser > 1h
Carbeniumionen Woher kennen wir bereits Carbeniumionen? 1. Triphenylmethanfarbstoffe Adolf von Bayer erzeugte 1902 die ersten stabilen intensiv farbigen Triarylmethylkationen Lebensdauer in Wasser > 1h
Grundlagen der organischen Chfemie
 Dr. sc. nat. Hans Rudolf Christen 'BHiGil.'liÜ ' \ Grundlagen der organischen Chfemie Verlag Sauerländer, Aarau Diesterweg Salle, Frankfurt am Main 9 Inhaltsverzeichnis Vorwort 7 I.Teil: Überblick über
Dr. sc. nat. Hans Rudolf Christen 'BHiGil.'liÜ ' \ Grundlagen der organischen Chfemie Verlag Sauerländer, Aarau Diesterweg Salle, Frankfurt am Main 9 Inhaltsverzeichnis Vorwort 7 I.Teil: Überblick über
Phenole (Nomenklatur)
 Phenole (omenklatur) I_folie377 Phenol: Schmp. 41 ; Sdp. 182 ; Lösl.: 9.3 g in 100 ml 2 Br 3 2 2 2 2 2 m-bromphenol p-kresol 2,4-Dinitrophenol Pikrinsäure (p-methylphenol) (2,4,6-Trinitrophenol) Salicylsäure
Phenole (omenklatur) I_folie377 Phenol: Schmp. 41 ; Sdp. 182 ; Lösl.: 9.3 g in 100 ml 2 Br 3 2 2 2 2 2 m-bromphenol p-kresol 2,4-Dinitrophenol Pikrinsäure (p-methylphenol) (2,4,6-Trinitrophenol) Salicylsäure
8. Halogenalkane : Nucleophile Substitutions- und Eliminationsreaktionen
 8. alogenalkane : ucleophile Substitutions- und Eliminationsreaktionen 69 alogenalkane sind in der organischen Synthese sehr wichtig, und werden auch in der Industrie als Lösungsmittel, im Krankenhaus
8. alogenalkane : ucleophile Substitutions- und Eliminationsreaktionen 69 alogenalkane sind in der organischen Synthese sehr wichtig, und werden auch in der Industrie als Lösungsmittel, im Krankenhaus
Organische Chemie I Molekül der Woche - Azulen
 I Molekül der Woche - Azulen 1 I Alkine C n H 2n-2 Bindungslängen Der C-H-Abstand verringert sich in dem Maße, wie der s-anteil an der Hybridisierung des C-Atoms wächst Schwermetallacetylide Ag 2 C 2 und
I Molekül der Woche - Azulen 1 I Alkine C n H 2n-2 Bindungslängen Der C-H-Abstand verringert sich in dem Maße, wie der s-anteil an der Hybridisierung des C-Atoms wächst Schwermetallacetylide Ag 2 C 2 und
1. Gruppe: Nucleophile Substitution
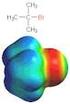 1. Gruppe: ucleophile ubstitution 1 1. ubstitutionstypen: C Y C Y Klassifizierung der ubstitution je nach atur von Y: - Y kann ein ukleophil sein: (ersetzt das ukleophil => Lewis - Base): δ δ a, 3, BuMg
1. Gruppe: ucleophile ubstitution 1 1. ubstitutionstypen: C Y C Y Klassifizierung der ubstitution je nach atur von Y: - Y kann ein ukleophil sein: (ersetzt das ukleophil => Lewis - Base): δ δ a, 3, BuMg
Organische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler
 Prof. Dr. J. Christoffers Institut für Organische Chemie Universität Stuttgart 29.04.2003 Organische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 1. Einführung 2.
Prof. Dr. J. Christoffers Institut für Organische Chemie Universität Stuttgart 29.04.2003 Organische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 1. Einführung 2.
Seminar zum Organisch-Chemischen Praktikum für Biologen Sommersemester 2018
 Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2018 Aliphatische Substitutionen Teil A Sicherheitsbelehrung: egeln für das Arbeiten im Labor Prof. Dr. asmus Linser/Dr. Martin Sumser
Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2018 Aliphatische Substitutionen Teil A Sicherheitsbelehrung: egeln für das Arbeiten im Labor Prof. Dr. asmus Linser/Dr. Martin Sumser
Diene: C n H 2n-2 : 2 Doppelbindungen
 Diene: n 2n-2 : 2 Doppelbindungen I_folie63 ) Isolierte Diene: Die beiden Doppelbindungen sind durch ein oder mehrere sp 3 -hybridisierte - Atome getrennt. 2 2 3 2 4 5 2,4-Pentadien sp 3 2) Kumulierte
Diene: n 2n-2 : 2 Doppelbindungen I_folie63 ) Isolierte Diene: Die beiden Doppelbindungen sind durch ein oder mehrere sp 3 -hybridisierte - Atome getrennt. 2 2 3 2 4 5 2,4-Pentadien sp 3 2) Kumulierte
Kohlenwasserstoffe. Benzol Naphthalin usw. Alkane Alkene Alkine Cycloaliphaten. Ethen (Ethylen) Propen u.s.w. Ethin (Acetylen) Propin u.s.w.
 OI_folie47 Kohlenwasserstoffe Aliphaten Aromaten Benzol Naphthalin usw. Alkane Alkene Alkine ycloaliphaten Methan Ethan u.s.w Ethen (Ethylen) Propen u.s.w. Ethin (Acetylen) Propin u.s.w. ycloalkane ycloalkene
OI_folie47 Kohlenwasserstoffe Aliphaten Aromaten Benzol Naphthalin usw. Alkane Alkene Alkine ycloaliphaten Methan Ethan u.s.w Ethen (Ethylen) Propen u.s.w. Ethin (Acetylen) Propin u.s.w. ycloalkane ycloalkene
Chemie Alkohole, Aldehyde & Ketone, Carbonsäuren
 Alkohole hemie Alkohole, Aldehyde & Ketone, arbonsäuren Alkohole erkennt man aufgrund ihrer funktionellen Gruppe, die ydroxy-gruppe. Diese ist Polar, der Rest ist unpolar. Benannt wird der Alkohol nach
Alkohole hemie Alkohole, Aldehyde & Ketone, arbonsäuren Alkohole erkennt man aufgrund ihrer funktionellen Gruppe, die ydroxy-gruppe. Diese ist Polar, der Rest ist unpolar. Benannt wird der Alkohol nach
4. Alkene und Alkine : Reaktionen und Darstellung
 Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
Aldehyde und Ketone Carbonylverbindungen
 Aldehyde und Ketone Carbonylverbindungen Prof. Dr. Ivo C. Ivanov 1 Prof. Dr. Ivo C. Ivanov 2 Die Siedepunkte liegen höher als bei den jeweils zugrundeliegenden Alkanen, eine Folge des polaren Charakters
Aldehyde und Ketone Carbonylverbindungen Prof. Dr. Ivo C. Ivanov 1 Prof. Dr. Ivo C. Ivanov 2 Die Siedepunkte liegen höher als bei den jeweils zugrundeliegenden Alkanen, eine Folge des polaren Charakters
Seminar zum Organisch-Chemischen Praktikum für Biologen Sommersemester 2017
 Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2017 Aliphatische Substitutionen Teil A Sicherheitsbelehrung: egeln für das Arbeiten im Labor Prof. Dr. asmus Linser September 2017
Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2017 Aliphatische Substitutionen Teil A Sicherheitsbelehrung: egeln für das Arbeiten im Labor Prof. Dr. asmus Linser September 2017
Grundwissen Chemie Jahrgangsstufe 10, naturwissenschaftlicher Zweig. Methan Ethan Propan Butan Pentan Hexan Heptan Octan Nonan Decan
 Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
Vorlesung OC-V. Carbeniumionen
 Carbeniumionen Woher kennen wir bereits Carbeniumionen? 1. Triphenylmethanfarbstoffe Adolf von Bayer erzeugte 1902 die ersten stabilen intensiv farbigen Triarylmethylkationen Lebensdauer in Wasser > 1h
Carbeniumionen Woher kennen wir bereits Carbeniumionen? 1. Triphenylmethanfarbstoffe Adolf von Bayer erzeugte 1902 die ersten stabilen intensiv farbigen Triarylmethylkationen Lebensdauer in Wasser > 1h
Organische Chemie für Biologen und Nebenfächler Übungsaufgaben für die Klausur
 rganische Chemie für Biologen und Nebenfächler Übungsaufgaben für die Klausur Aufgabe 1: Sie wollen Fettflecken von ihrem Kleidungsstück entfernen. Man gibt Ihnen als Fleckenentferner folgende Chemikalien
rganische Chemie für Biologen und Nebenfächler Übungsaufgaben für die Klausur Aufgabe 1: Sie wollen Fettflecken von ihrem Kleidungsstück entfernen. Man gibt Ihnen als Fleckenentferner folgende Chemikalien
CHE 172.1: Organische Chemie für die Life Sciences
 1 E 172.1: Organische hemie für die Life Sciences Prof Dr. J. A. Robinson 4. Alkene und Alkine : Reaktionen und erstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken
1 E 172.1: Organische hemie für die Life Sciences Prof Dr. J. A. Robinson 4. Alkene und Alkine : Reaktionen und erstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken
Richtung von spontanem Prozeßablauf und Veränderung der G in Abhängigkeit vom Vorzeichen der Enthalpie und der Entropie
 Richtung von spontanem Prozeßablauf und Veränderung der G in Abhängigkeit vom Vorzeichen der Enthalpie und der Entropie H S G= H-T S Prozeß 1. (-) (+) (-) immer exergonisch, erfolgt spontan bei allen Temperaturen
Richtung von spontanem Prozeßablauf und Veränderung der G in Abhängigkeit vom Vorzeichen der Enthalpie und der Entropie H S G= H-T S Prozeß 1. (-) (+) (-) immer exergonisch, erfolgt spontan bei allen Temperaturen
Aldehyde und Ketone. Aldehyde C 2 H 5 H 3 C. H Propanal Propionaldehyd. H Ethanal Acetaldehyd. H Methanal Formaldehyd. Benzaldehyd.
 Aldehyde und Ketone Aldehyde Methanal Formaldehyd 3 Ethanal Acetaldehyd 2 5 Propanal Propionaldehyd Benzaldehyd Ketone 3 3 2 5 Propanon Aceton 3 2 5 2-Butanon 2 5 3-Pentanon Acetophenon 3 Natürliche Aldehyde
Aldehyde und Ketone Aldehyde Methanal Formaldehyd 3 Ethanal Acetaldehyd 2 5 Propanal Propionaldehyd Benzaldehyd Ketone 3 3 2 5 Propanon Aceton 3 2 5 2-Butanon 2 5 3-Pentanon Acetophenon 3 Natürliche Aldehyde
Bromierung von Cycloalkenen
 hemie Q1 / 4. Reaktionswege der organischen hemie / 4.2 Alkene und elektrophile Addition 1/ omierung von ycloalkenen Zufällig kommt ein 2-Molekül in die Nähe der elektronenreichen Doppelbindung. Ulrich
hemie Q1 / 4. Reaktionswege der organischen hemie / 4.2 Alkene und elektrophile Addition 1/ omierung von ycloalkenen Zufällig kommt ein 2-Molekül in die Nähe der elektronenreichen Doppelbindung. Ulrich
KW Alkene. Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1
 KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
Gruppe 05: Darstellung von 2-Chlor-2 Methylpropan
 Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 05: Darstellung von 2-Chlor-2 Methylpropan Reaktion: Chemikalien:
Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 05: Darstellung von 2-Chlor-2 Methylpropan Reaktion: Chemikalien:
Elektrophile Additionen von HX an die CC-Doppelbindung (Vollhardt, 3. Aufl., S , 4. Aufl., S ; Hart, S ; Buddrus, S.
 Vorlesung 19 Elektrophile Additionen von X an die -Doppelbindung (Vollhardt, 3. Aufl., S. 504-514, 4. Aufl., S. 566-577; art, S. 96-105; Buddrus, S. 149-155) Die Elektronenwolke der π-bindung verleiht
Vorlesung 19 Elektrophile Additionen von X an die -Doppelbindung (Vollhardt, 3. Aufl., S. 504-514, 4. Aufl., S. 566-577; art, S. 96-105; Buddrus, S. 149-155) Die Elektronenwolke der π-bindung verleiht
Chemie II. Vorlesung: Mo Uhr, HPT C103 Übungen: Mo Uhr, HCI H2.1, HCI J4
 hemie II Vorlesung: Mo 11-13 Uhr, PT 103 Übungen: Mo 14-16 Uhr, I 2.1, I J4 Literatur:.E. Mortimer, U. Müller: hemie, 11. Auflage Thieme-Verlag Stuttgart 2014 Dr. Wolfram Uhlig Laboratorium für Anorganische
hemie II Vorlesung: Mo 11-13 Uhr, PT 103 Übungen: Mo 14-16 Uhr, I 2.1, I J4 Literatur:.E. Mortimer, U. Müller: hemie, 11. Auflage Thieme-Verlag Stuttgart 2014 Dr. Wolfram Uhlig Laboratorium für Anorganische
KATA LOGO Organische Chemie - Zusammenhänge wichtiger funktioneller Gruppen
 KATA LOGO Organische Chemie - Zusammenhänge wichtiger funktioneller Gruppen Ketone werden nicht weiter oxidiert Ether R1 - O - R2 R-O- ersetzt H bei einem Alkan Ether: MTBE (Antiklopfmittel) Tertiäre Alkohole
KATA LOGO Organische Chemie - Zusammenhänge wichtiger funktioneller Gruppen Ketone werden nicht weiter oxidiert Ether R1 - O - R2 R-O- ersetzt H bei einem Alkan Ether: MTBE (Antiklopfmittel) Tertiäre Alkohole
s- und p-orbitale MO-Schema des Wasserstoffmoleküls H 2 y z z x p x p y p z antibindendes MO bindendes MO
 s- und p-rbitale y y z z x x s p x p y p z M-Schema des Wasserstoffmoleküls 2 antibindendes M 1s 1s bindendes M Merkmale wichtiger ybridorbitale sp 3 -ybridisierung: Tetraedrische Ausrichtung der ybridorbitale,
s- und p-rbitale y y z z x x s p x p y p z M-Schema des Wasserstoffmoleküls 2 antibindendes M 1s 1s bindendes M Merkmale wichtiger ybridorbitale sp 3 -ybridisierung: Tetraedrische Ausrichtung der ybridorbitale,
Fragen zum Thema funktionelle Gruppen Alkohol und Phenol
 1. Was sind Derivate? 2. Was sind Substituenten? 3. Wann werden neu angehängte Atome oder Gruppen als Substituent bezeichnet? 4. Warum sind Substituenten so wichtig für organische Verbindungen? Alkohol
1. Was sind Derivate? 2. Was sind Substituenten? 3. Wann werden neu angehängte Atome oder Gruppen als Substituent bezeichnet? 4. Warum sind Substituenten so wichtig für organische Verbindungen? Alkohol
Substituenten-Effekt auf die Orientierung der Zweitsubstituenten Orientierung bei der Toluolsubstitution
 Substituenten-Effekt auf die rientierung der Zweitsubstituenten rientierung bei der Toluolsubstitution I_folie215 3 3 3 3 meta para 58 % Nitrierung 4 % 38 % = N 2 N 3 / 2 S 4 Sulfonierung 32 % 6 % 62 %
Substituenten-Effekt auf die rientierung der Zweitsubstituenten rientierung bei der Toluolsubstitution I_folie215 3 3 3 3 meta para 58 % Nitrierung 4 % 38 % = N 2 N 3 / 2 S 4 Sulfonierung 32 % 6 % 62 %
Die verschiedenen Mechanismen der Nucleophilen Substitution
 Die verschiedenen Mechanismen der Nucleophilen Substitution Dinah Shafry 21. Juni 2010 Inhalt Vom Alkan zum Alkohol...2 Struktur der Alkane...2 Die Lösung des Problems...2 Die nucleophile Substitution...2
Die verschiedenen Mechanismen der Nucleophilen Substitution Dinah Shafry 21. Juni 2010 Inhalt Vom Alkan zum Alkohol...2 Struktur der Alkane...2 Die Lösung des Problems...2 Die nucleophile Substitution...2
b) Zeichnen Sie die beiden möglichen Isomere der Aldol-Kondensation und bezeichnen Sie die Stereochemie der Produkte.
 1. Aufgabe a) Formulieren Sie den Mechanismus der durch ydroxid-ionen katalysierten Aldol- Addition und Aldol-Kondensation zwischen den beiden unten gezeigten Molekülen. + 2 2 b) Zeichnen Sie die beiden
1. Aufgabe a) Formulieren Sie den Mechanismus der durch ydroxid-ionen katalysierten Aldol- Addition und Aldol-Kondensation zwischen den beiden unten gezeigten Molekülen. + 2 2 b) Zeichnen Sie die beiden
Zusammenfassung der Vorlesung OC I, 1. Teil (Stand SS 2010)
 Zusammenfassung der Vorlesung OC I, 1. Teil (Stand SS 2010) Stoffklassen Typische Vertreter/ Wichtige Verbindungen Wichtige eaktionen Begriffe, Prinzipien, Phänomene Alkane Cycloalkane n Methan Propan
Zusammenfassung der Vorlesung OC I, 1. Teil (Stand SS 2010) Stoffklassen Typische Vertreter/ Wichtige Verbindungen Wichtige eaktionen Begriffe, Prinzipien, Phänomene Alkane Cycloalkane n Methan Propan
im Molekül eine Dreifachbindung (eine σ-bindung,
 1 14.03.2006 0.1 Grundwissen Alkane Gesättigte Kohlenwasserstoffe, die keine Mehrfachbindungen, sondern nur Einfachbindungen (σ-bindungen) zwischen den Kohlenstoffatomen im Molekül aufweisen. Die allgemeine
1 14.03.2006 0.1 Grundwissen Alkane Gesättigte Kohlenwasserstoffe, die keine Mehrfachbindungen, sondern nur Einfachbindungen (σ-bindungen) zwischen den Kohlenstoffatomen im Molekül aufweisen. Die allgemeine
O H H 3 C. Methanol. Molekulargewicht Siedepunkt Löslichkeit in Wasser H 3 C-OH. unbegrenzt H 3 C-Cl. 7.4 g/l H 3 C-CH 3 -24/C -88/C
 Struktur und Eigenschaften 3 C 3 C C 3 105 109 112 Wasser Methanol Dimethylether Vektoraddition der einzelnen Dipolmomente eines Moleküls zum Gesamtdipolmoment Anmerkung zu aktuellen Ereignissen: itrofen
Struktur und Eigenschaften 3 C 3 C C 3 105 109 112 Wasser Methanol Dimethylether Vektoraddition der einzelnen Dipolmomente eines Moleküls zum Gesamtdipolmoment Anmerkung zu aktuellen Ereignissen: itrofen
3. Gruppe: Aromatische Substitution
 1 1) Zum chanismus der elektrophilen aromatischen Substitution Aromatischer Charakter Antiaromatischer Charakter (4 n 2)π-lektronen 4 nπ e 3 C C 3 2 C C 2 1.48Å 1.54Å 1.34Å 1.39Å ingstrom-ffekte δ = 5
1 1) Zum chanismus der elektrophilen aromatischen Substitution Aromatischer Charakter Antiaromatischer Charakter (4 n 2)π-lektronen 4 nπ e 3 C C 3 2 C C 2 1.48Å 1.54Å 1.34Å 1.39Å ingstrom-ffekte δ = 5
Komplexe mit einfachen Hydroxo-, Alkoxo- und Amidliganden
 Seminar Anorganische Chemie Komplexe mit einfachen ydroxo-, Alkoxo- und Amidliganden Boris Kosog 07. Dezember 2006 R. G. Bergman, Acc. Chem. Res. 2002, 35, 44-56 Komplexe mit einfachen ydroxo-, Alkoxo-
Seminar Anorganische Chemie Komplexe mit einfachen ydroxo-, Alkoxo- und Amidliganden Boris Kosog 07. Dezember 2006 R. G. Bergman, Acc. Chem. Res. 2002, 35, 44-56 Komplexe mit einfachen ydroxo-, Alkoxo-
Reaktionsmechanismen und Konzepte der Organischen Chemie
 Reaktionsmechanismen und Konzepte der Organischen Chemie 1. Radikalreaktionen Struktur von C-Radikalen Stabilität von C-Radikalen o Mesomeriestabilisierung über π-delokalisation o Hyperkonjugation über
Reaktionsmechanismen und Konzepte der Organischen Chemie 1. Radikalreaktionen Struktur von C-Radikalen Stabilität von C-Radikalen o Mesomeriestabilisierung über π-delokalisation o Hyperkonjugation über
(Anmerkung: Es sind weitere möglich. Spektren zeigen Diradikal.)
 eispielaufgaben IChO 2. Runde 2017 Aromaten, Lösungen Aromaten eispiel 1: a) b) (Zeichnungen hier und unten teilweise ohne Wasserstoff-Atome) c) Das Anion ist planar und hat ein cyclisch konjugiertes π-elektronensystem
eispielaufgaben IChO 2. Runde 2017 Aromaten, Lösungen Aromaten eispiel 1: a) b) (Zeichnungen hier und unten teilweise ohne Wasserstoff-Atome) c) Das Anion ist planar und hat ein cyclisch konjugiertes π-elektronensystem
Cyclisierung von freien Radikalen (Baldwin-Regel) Konkurrenz der Bildung von Fünf- und Sechsringen
 yclisierung von freien adikalen (Baldwin-egel) Konkurrenz der Bildung von Fünf- und Sechsringen 4_folie048 + + = : 98 : 2 = 3 : 99 : 1 33 : 66 Angriff des adikals auf das disubstituierte sp 2 - Atom sterisch
yclisierung von freien adikalen (Baldwin-egel) Konkurrenz der Bildung von Fünf- und Sechsringen 4_folie048 + + = : 98 : 2 = 3 : 99 : 1 33 : 66 Angriff des adikals auf das disubstituierte sp 2 - Atom sterisch
Supramolekulare Chemie: zwischenmolekulare Wechselwirkungen molekulare Erkennung. Pflanzenschutz. Organische Synthese.
 I_folie1 Proteine DNA, NA Enzyme polymere Werkstoffe und Materialien Makromoleküle Peptide Nucleotide Supramolekulare hemie: zwischenmolekulare Wechselwirkungen molekulare Erkennung Synthetische ligo-
I_folie1 Proteine DNA, NA Enzyme polymere Werkstoffe und Materialien Makromoleküle Peptide Nucleotide Supramolekulare hemie: zwischenmolekulare Wechselwirkungen molekulare Erkennung Synthetische ligo-
4. Alkene und Alkine : Reaktionen und Darstellung
 Inhalt Index 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann sich unter Bildung eines Carbeniumions an eine
Inhalt Index 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann sich unter Bildung eines Carbeniumions an eine
M U S T E R L Ö S U N G
 Prof. Dr.. Reiser Prof. Dr. A. Geyer 1. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 00 am Dienstag, dem 14. Mai 00 Name:...Vorname:... Matrikelnummer:...
Prof. Dr.. Reiser Prof. Dr. A. Geyer 1. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 00 am Dienstag, dem 14. Mai 00 Name:...Vorname:... Matrikelnummer:...
