XVI. Patienteninformation und Einverständniserklärungen
|
|
|
- Johannes Baumgartner
- vor 7 Jahren
- Abrufe
Transkript
1 XVI. Patienteninformation und Einverständniserklärungen Therapieoptimierungsstudie für ältere Patienten (> 55 Jahre, ohne obere Altersgrenze) mit akuter lymphatischer Leukämie (GMALL Elderly 1/2003) Sehr geehrte Patientin, sehr geehrter Patient, Sie stehen vor der Entscheidung darüber, ob Sie an einer klinischen Studie zur Behandlung der akuten lymphatischen Leukämie (ALL) teilnehmen möchten. Dieses Merkblatt enthält eine Zusammenfassung aller diese Studie betreffenden wichtigen Informationen. Wir möchten Sie nun bitten, es aufmerksam durchzulesen und nach einem zusätzlichen Gespräch mit Ihrem behandelnden Arzt zu entscheiden, ob Sie die Einverständniserklärung für die Studienteilnahme unterzeichnen möchten. Sie werden eine Kopie dieses Merkblatts erhalten. Seit 1980 wurden von der deutschen Studiengruppe für die akute lymphatische Leukämie des Erwachsenen (GMALL) zahlreiche Therapiestudien zur Behandlung der akuten lymphatischen Leukämie durchgeführt. Bundesweit sind über 100 Kliniken an diesen Studien beteiligt. Seit 1996 wurde eine spezielle Therapiestudie für ältere Patienten mit ALL durchgeführt. Die dabei gewonnenen Erkenntnisse bilden die Grundlage für die Entwicklung dieser neuen Studie. Ihr Arzt hat Ihnen erklärt, daß Sie an einer schweren Krankheit leiden, die unbehandelt innerhalb weniger Wochen oder Monate zum Tod führen kann. Einige Ärzte führen die Behandlung mit einer milden Chemotherapie durch, was den Vorteil geringerer Nebenwirkungen und kürzerer Krankenhausaufenthalte bietet. Allerdings lehrt die Erfahrung, daß mit dieser Art der Behandlung eine Heilung der Leukämie nicht erreicht werden kann. Die bisher durchgeführten Studien haben gezeigt, daß auch bei älteren Patienten eine mäßig intensive Chemotherapie durchgeführt werden kann und daß der Versuch einer Eindämmung der Erkrankung bzw. sogar einer Heilung unternommen werden sollte, wenn Sie dies wünschen. Wir glauben, daß die Heilungschancen durch das vorliegende neue Behandlungskonzept verbessert werden können, da neue Erkenntnisse zu wirksamen Behandlungsformen berücksichtigt wurden. 1. Teilnahme an der Studie An der Studie können Patienten im Alter über 55 Jahren ohne obere Altersgrenze teilnehmen, wenn der behandelnde Arzt die Studientherapie für durchführbar hält. Um die Therapie für ältere Patienten verträglicher zu machen, werden im Vergleich zu der Behandlung bei jüngeren Patienten die Medikamente in reduzierter Dosis und weniger häufig gegeben; einige besonders mit Nebenwirkungen verbundene Medikamente wurden ganz weggelassen. Dies könnte aber auch eine geringere Wirksamkeit im Vergleich zu der bei jüngeren Patienten durchgeführten Therapie zur Folge haben. Die Altersbegrenzung für die Studie wird deshalb flexibel gehandhabt und richtet sich nach dem sog. biologischen Alter. Das bedeutet, daß der Allgemeinzustand und andere Erkrankungen berücksichtigt werden. Bei Patienten im Alter von 55 bis 65 Jahren kann der behandelnde Arzt im Einverständnis mit dem Patienten entscheiden, ob ein guter Allgemeinzustand vorliegt und eine Behandlung nach einer anderen, intensiveren Therapie im Rahmen einer Studie für
2 2 jüngere Patienten durchführbar erscheint, oder ob besser eine Behandlung nach dem hier vorliegenden weniger intensiven Therapieplan für ältere Patienten erfolgen sollte. Die Studie wird in ganz Deutschland durchgeführt. Seit Beginn der Studie im Jahr 2003 sind bereits über 330 Patienten im Rahmen der Studie behandelt worden. Es ist geplant, über einen Zeitraum von 7 Jahren 400 Patienten in die Studie aufzunehmen. 2. Ziele der Studie Ziel der vorliegenden Studie ist die Verbesserung der Heilungschancen für ältere Patienten mit akuter lymphatischer Leukämie durch Optimierung der Chemotherapie. Weiterhin sollen Untersuchungen durchgeführt werden, die es in der Zukunft ermöglichen, das Rückfallrisiko von Patienten besser vorherzusagen. Außerdem soll eine Prognoseverbesserung durch die zusätzliche Behandlung mit einem Antikörper (anti-cd20) erreicht werden, die bei einer Untergruppe der Patienten vorgesehen ist (s.u.). Hierbei soll geprüft werden, ob die Kombination der Antikörperbehandlung mit Chemotherapie verträglich ist und zu einer Verbesserung der Behandlungsergebnisse führt. 3. Bestandteile der Therapie und Therapieablauf Chemotherapie Die Ihnen in dieser Studie vorgeschlagene Behandlung besteht im Wesentlichen aus einer Kombination verschiedener Medikamente, die die Leukämiezellen angreifen. Sie werden Zytostatika genannt. Einzelne Medikamente reichen in der Regel nicht aus, um alle Leukämiezellen zu vernichten. Man kombiniert deshalb mehrere Medikamente, um ihre verschiedenartigen Angriffspunkte auf die Leukämiezelle auszunutzen. Sie werden als Infusion und in Form von Tabletten gegeben. Dazu kommt eine Behandlung des zentralen Nervensystems, weil sich auch dort Leukämiezellen ansiedeln können und von den auf normalem Weg gegebenen Zytostatika nur unzureichend abgetötet werden. Deshalb werden zusätzliche Medikamente direkt in die Rückenmarksflüssigkeit (intrathekal) gegeben. Folgende Zytostatika werden im Rahmen des Therapieprotokolls eingesetzt: Asparaginase, Idarubicin, Cyclophosphamid, Cytosin-Arabinosid (hochdosiert, intrathekal), Dexamethason (als Tablette, intrathekal), 6-Mercaptopurin, Methotrexat (hochdosiert, intrathekal), Prednison, Vincristin. Asparaginase-Therapie Bei jüngeren Patienten und Kindern mit ALL hat sich gezeigt, dass durch die Therapie mit Asparaginase eine Verbesserung der Heilungschancen erreicht weden kann. Daher wird in der Studie eine lang wirkende Form der Asparaginase unmittelbar nach der Induktionstherapie eingesetzt. Eine kürzer wirksame Asparaginase wird in Kombination mit einem anderen Zytostatikum (Methotrexat) eingesetzt. Antikörpertherapie Patienten, deren Leukämiezellen an der Oberfläche ein bestimmtes Merkmal (CD20) aufweisen, erhalten zusätzlich zu den Zytostatika während der Induktionstherapie und vor den Konsolidationszyklen eine Infusion mit einem Antikörper. Der Antikörper (anti-cd20 bzw. Rituximab; Handelsname: MabThera ) bindet sich gezielt an den Oberflächenmarker (CD20) und trägt so zu der Zerstörung der Leukämiezellen bei. Andere Studien bei ähnlichen Erkrankungen haben gezeigt, daß die zusätzliche Behandlung mit anti-cd20 zu einer Verbesserung der Therapieergebnisse geführt hat. Die Behandlung mit dem Antikörper ist für Lymphomerkrankungen durch die Überwachungsbehörden zugelassen, nicht aber in der Kombination und bei der Erkrankung des hier vorliegenden Therapieprotokolls. Die
3 3 Überwachungsbehörden werden daher über den Einsatz des Antikörpers im Rahmen des vorliegenden Protokolls informiert. Imatinibtherapie Imatinib (Glivec oder früher auch STI571 genannt) ist ein kürzlich für die Behandlung einer speziellen Form der ALL zugelassenes Medikament. Bei dieser Form, der sog. Philadelphiapositiven (Ph+) ALL liegt eine ganz spezielle Genveränderung vor. Aufgrund der Genveränderung wird ein Enzym stimuliert, das ursächlich für die Leukämieentstehung ist. Das Medikament Imatinib wiederum hemmt gezielt die Aktivität dieses Enzyms. Imatinib wird einmal täglich in Form von Kapseln eingenommen. Eine bereits durchgeführte Studie (die GMALL Elderly STI571 -Studie) hat bei Ph+-ALL eine Verbesserung der Therapieergebnisse bei Einsatz von Imatinib zusätzlich zur Chemotherapie gezeigt. Imatinib wird bei allen Patienten mit Ph+ ALL eingesetzt und ersetzt bei dieser Patientengruppe die 4-wöchige Induktionschemotherapie (einleitende Chemotherapie zu Beginn der Behandlung). Anschließend wird die Imatinib-Therapie parallel zu den weiteren Chemotherapiezyklen fortgesetzt. Andere Medikamente Zur unterstützenden Behandlung wird der Granulozyten-Kolonien-stimulierende Faktor (G-CSF) eingesetzt. Dieses Medikament wird nach den Chemotherapiezyklen gegeben und soll dazu beitragen, daß sich die weißen Blutkörperchen schneller wieder erholen. Weitere Medikamente (z.b. Antibiotika, Medikamente zur Behandlung von Pilzinfektionen, Medikamente zur Hemmung des Erbrechens) sind nicht Bestandteil der Studie. Über die Notwendigkeit entscheidet der behandelnde Arzt. Therapieablauf Alle Patienten erhalten zunächst eine fünftägige sogenannte Vorphasentherapie. Anschließend erhalten alle Patienten eine Induktionstherapie. Patienten, die Philadelphia-Chromosom-negativ sind (der Philadelphia-Chromosom-Status wird über die Knochenmarkanalyse ermittelt), erhalten eine 6-wöchige Chemotherapie als Induktionstherapie. Patienten, die Philadelphia-Chromosom-positiv sind, erhalten eine vierwöchige Induktionstherapie mit Imatinib als Einzelsubstanz. Etwa in der Mitte der Induktionstherapie und nach Abschluß wird jeweils durch eine Knochenmarkentnahme untersucht, wie die Erkrankung auf die Behandlung angesprochen hat. Ziel ist es eine komplette Remission zu erreichen d.h. einen Status, bei dem keine Erkrankung mehr nachweisbar ist. Im Anschluß wird die Behandlung mit weiteren Chemotherapiezyklen fortgesetzt, die in etwa 6- wöchigen Abständen verabreicht werden. Dazu gehören kürzere Therapiezyklen (Konsolidation) und auch die Reinduktionstherapie, die ähnlich zusammengesetzt ist wie die Induktionschemotherapie. Die einzelnen Zyklen unterscheiden sich in der Zusammensetzung der Medikamente und in der Dauer. Zwischen den Zyklen wird, wenn möglich, eine sog. Erhaltungstherapie (s.u.). gegeben. Die Fortsetzung der Behandlung ist notwendig, da die Erfahrung zeigt, dass sonst sehr bald mit einem Rückfall der Erkrankung zu rechnen ist. Während der Therapie werden in regelmäßigen Abständen Knochenmarkuntersuchungen durchgeführt, um festzustellen, ob noch immer eine komplette Remission vorliegt. Patienten, die Philadelphia-Chromosom-positiv sind, erhalten zusätzlich zu den Chemotherapiezyklen auch kontinuierlich Imatinib. Nach etwa einem Jahr Behandlung wird mit einer sog. Erhaltungstherapie begonnen. Hierbei handelt es sich um eine eher milde Chemotherapie, die ambulant durchgeführt werden kann und aus täglichen Tabletteneinnahmen und wöchentlichen Spritzen besteht. Patienten, die Philadelphia-Chromosom positiv sind, erhalten auch im 2. Therapiejahr zusätzlich Imatinib.
4 4 Auch unter Erhaltungstherapie werden regelmäßig Knochenmarkentnahmen durchgeführt. Die Behandlung endet nach einem Jahr Erhaltungstherapie. Die folgende Abbildung gibt eine Übersicht über den Ablauf der Studientherapie. Ablauf bei Philadelphia-Chromosom negativen Patienten: 1. Therapiejahr Induktion Konsolidation Reinduktion Konsolidation I II III IV V 1 Kn och en markuntersuchungen d 20 d W 10 W 17 W 24 W 32 W 41 W wenn CD20+ (> 20%) Woch en 2 Erhaltungstherapie 2. Therapiejahr Erha ltungsthera pie Knochenmarkuntersuchungen Monate
5 5 Ablauf bei Philadelphia-Chromosom positiven Patienten 1.Therapiejahr Induktion Konsolidation Reinduktion Konsolidation I II III IV V Knochenmarkuntersuchungen Imatinib =Erhaltungstherapie Wochen 2.Therapiejahr Erhaltungstherapie im 2.Jahr Imatinib Erhaltungstherapie Knochenmarkuntersuchungen Monate Dauer der Behandlung Die Behandlungsdauer beträgt etwa 2 Jahre, wobei es im Einzelfall (z.b. bei Komplikationen oder zusätzlichen Behandlungsmaßnahmen) zu einer längeren Therapiedauer kommen kann. Die Therapie wird zum Teil stationär und zum Teil ambulant durchgeführt. Nachsorge An die Therapie schließt sich eine Nachsorgephase an, in der regelmäßig kontrolliert wird, ob die Erkrankung weiterhin in kompletter Remission ist (siehe notwendige Untersuchungen). Diese Nachsorge ist nicht Bestandteil der Studie. Die Entscheidung über Häufigkeit und Gesamtdauer der Nachsorge obliegt dem behandelnden Arzt. Die dafür nötigen Untersuchungen (z. B. Knochenmarkpunktion, Blutabnahme) gehören zu der Standard- Nachsorge bei Krebspatienten und sind nicht studienspezifisch. Im Rahmen der Nachsorge wird von den behandelnden Ärzten der aktuelle Status der Patienten (z.b. Überleben / Erkrankungsstatus) abgefragt. Hierdurch entsteht Ihnen aber kein zusätzliches studienspezifisches Risiko.
6 6 4. Nebenwirkungen der Therapiemaßnahmen Nebenwirkungen der Chemotherapie Leider greifen die Zytostatika nicht nur die Leukämiezellen an, sondern wirken auch auf normale Zellen des Körpers. Sie treffen besonders Zellen, die sich stark vermehren. Das sind neben den Leukämiezellen Zellen des Magen-Darm-Traktes, der Haare und der normalen Blutbildung. Die häufigsten Nebenwirkungen treten daher in diesen Bereichen auf: Übelkeit, Erbrechen, Entzündung der Mund- und Darmschleimhaut, Reizung der Blase, Haarausfall, Verschlechterung der Blutwerte, die ohnehin schon durch die Leukämie beeinträchtigt sind. Einige Zytostatika können in seltenen Fällen schwere oder tödliche Organschäden verursachen (z.b. Herz-, Leber-, Nieren-, Pankreas-, Blasenschäden). Zu den möglichen seltenen Nebenwirkungen im Bereich des zentralen Nervensystems zählen u.a. Depression, Schläfrigkeit, Erschöpfung, Verwirrung, Ohnmacht, Erregungszustände sowie Sinnestäuschungen (Halluzinationen) unterschiedlicher Schweregrade. Außerdem kann es zu Überempfindlichkeitsreaktionen, einer erhöhten Blutungsneigung und zu einem erhöhten Risiko für Thrombosebildung kommen. Weiterhin kann das Risiko einer späteren Entstehung von anderen bösartigen Erkrankungen ansteigen. Die Nebenwirkungen von seiten des Magen- Darm-Traktes treten vor allem in unmittelbarem Zusammenhang mit der Chemotherapie auf. Der Haarausfall bildet sich nach etwa 3-6 Monaten bei fast allen Patienten vollständig zurück. Die gravierendsten Nebenwirkungen der Chemotherapie beruhen auf der Hemmung der Blutbildung und ähneln den Gefahren der Leukämieerkrankung selbst. Wie diese können sie zum Tod führen. Die Reduktion der roten Blutkörperchen kann zu Müdigkeit und Leistungsminderung führen. Durch die Transfusion von roten Blutkörperchen kann dieser Zustand behoben werden. Bedrohlicher ist der Abfall der Blutplättchen, weil es dadurch zu Blutungen kommen kann, die lebensbedrohlich sein können. Bei Abfall der Blutplättchen erhalten Sie gegebenenfalls wiederholt Transfusionen, um dieses Risiko zu vermindern bzw. zu beheben. Die Verminderung der weißen Blutzellen birgt die Gefahr der Entstehung von Infektionen. Sie können ebenso wie zahlreiche andere, seltenere Nebenwirkungen in seltenen Fällen einen tödlichen Ausgang nehmen. Ergänzende Behandlungsmaßnahmen, die sogenannte supportive Therapie, sind nicht fester Bestandteil dieses Therapieprotokolls. Das Protokoll enthält aber Empfehlungen zu diesen Therapiemaßnahmen. Durch die vorbeugende Behandlung mit Antibiotika in Therapiephasen mit hoher Infektionsgefahr, die Gabe von Medikamenten gegen bakterielle oder Pilzinfektionen sowie den Einsatz eines sogenannten Wachstums-Faktors, der die Vermehrung der weißen Blutkörperchen anregt, wird Ihr Arzt versuchen, den bekannten Nebenwirkungen vorzubeugen bzw. deren Ausmaß zu verringern. Ein Risiko bleibt dennoch bestehen. Wichtig für Sie ist jedoch, daß die möglichen Nebenwirkungen weniger bedrohlich sind als der Krankheitsverlauf ohne Behandlung. Nebenwirkung Antikörpertherapie mit anti-cd20 Eine wichtige Nebenwirkung der Antikörpertherapie ist die Entwicklung eines sog. cytokine release syndrome. Es handelt sich dabei um ein Krankheitsbild, das an eine schwere allergische Reaktion erinnert. Es kann mit Atemnot, Sauerstoffmangel, Blutdruckabfall, Fieber, Schüttelfrost, Hautausschlägen und anderen Symptomen einhergehen. Wenn das Krankheitsbild auftritt, muß die Infusion unterbrochen werden, und entsprechende Behandlungsmaßnahmen werden eingeleitet. Weitere mögliche Nebenwirkungen sind: Fieber, Schüttelfrost, Gelenksteifheit, Übelkeit, Hautausschlag, Müdigkeit, Kopfschmerzen, Juckreiz, Atemnot, Gefühl, daß Zunge oder Kehle anschwellen, Entzündung der Nasenschleimhäute, Erbrechen, niedriger Blutdruck, Erröten, Schmerzen an den
7 7 Krankheitsorten, Nierenprobleme, Änderungen der Blutchemie, weitere Schwächung des Immunsystems. Wenn Sie an einer Herzkrankheit leiden, wie unregelmäßigem Herzschlag, Angina (Einschnürung der Brust) oder Brustschmerzen, so können sich diese Symptome verschlechtern bzw. wieder auftreten. In seltenen Fällen sind Herzstörungen mit tödlichem Ausgang aufgetreten. In Studien, in denen Patienten eine Wiederholungsbehandlung mit Rituximab erhalten haben, sind die folgenden Nebenwirkungen vermehrt aufgetreten: Schwächegefühl, Halsreizung, Erröten, erhöhter Herzschlag, verminderter Appetit, Verminderung der Blutzellzahlen, Anschwellen von Händen und Füßen, Schwindel, Schwäche, Atemnot, Nachtschweiß und Juckreiz. Da die Behandlung mit anti-cd20 in dieser Kombination noch nicht durchgeführt wurde, ist es möglich, daß weitere, bisher unbekannte Nebenwirkungen auftreten. Wenn derartige Nebenwirkungen auftreten, sollten Sie diese Ihrem Arzt sofort mitteilen. Nebenwirkungen der Therapie mit Imatinib (Glivec ) Die am häufigsten auftretenden Nebenwirkungen von Imatinib sind milde bis mäßige Übelkeit sowie Erbrechen, Verdauungsbeschwerden, allergischer Hautausschlag und Hautrötung, Muskelkrämpfe, Gelenkschmerzen, Müdigkeit und Kopfschmerzen. Zudem kann es zu Veränderungen in den Laborwerten kommen, die ein vorübergehendes Absetzen oder eine Dosisreduzierung von Imatinib erfordern, Dabei handelt es sich um Erhöhung der Leberfunktionswerte, Verringerung der Anzahl der Blutplättchen (Blutbestandteile, die Wunden verschließen) oder Abnahme der Zahlen an weißen Blutzellen (die beiden letzteren Nebenwirkungen könnten zu Blutungen oder erhöhtem Infektionsrisiko führen). Weitere Nebenwirkungen sind: Ödembildung (Schwellungen durch Einlagerung von Flüssigkeit im Gewebe v.a. der Knöchel oder Augen), Flüssigkeitsretention (Flüssigkeitsansammlung in Körperhöhlen, wie z.b. im Rippenfellspalt, dem Herzbeutel oder der Bauchhöhle), Blutungen, Infektionen. Seltenere Nebenwirkungen sind psychiatrische Erkrankungen (Depression, Verwirrung), Erkrankungen des Nervensystems, Augenerkrankungen, Erkrankungen der Geschlechtsorgane und der Brustdrüse (Brustdrüsenvergrößerung, Schwellung des Hodensacks, Schmerzen der Brustwarzen, Störungen der Sexualfunktion). Nebenwirkungen der intrathekalen Therapie (mit Methotrexat, Cytosin-Arabinosid und Dexamethason) Die intrathekale Therapie kann ganz allgemein zu Kopfschmerzen, Übelkeit, Erbrechen, Fieber, Entzündung der Hirnhäute ( Arachnoiditis ), Taubheitsgefühlen, Nacken- und Rückenschmerzen im Anschluß an die Punktion führen. Weiterhin können in seltenen Fällen Infektionen, Krämpfe, schwerwiegende neurologische Nebenwirkungen oder auch neurologische Spätfolgen auftreten. Schwangerschaftsverhütung Die meisten Medikamente der Leukämietherapie üben schädigende Effekte auf Spermien und Eizellen aus. Männer, die an der Studie teilnehmen, werden daher gebeten während der Studientherapie und mindestens drei Monate danach kein Kind zu zeugen und eine effektive Methode zur Empfängnisverhütung einzusetzen. Sekundäre maligne Erkrankungen Eine Reihe von Medikamenten, die in der Leukämietherapie eingesetzt werden, sind mit einem erhöhten Risiko einer zweiten bösartigen Erkrankung verbunden. Ihr behandelnder Arzt wird versuchen Nebenwirkungen zu verhindern bzw. früh zu erkennen und zu behandeln. Er wird Sie daher regelmäßig untersuchen und Kontrolluntersuchungen (Blutentnahme, Röntgenaufnahmen, CT - Untersuchungen etc.) durchführen, um den Effekt der Behandlung zu prüfen und wenn notwendig die Dosierung anzupassen.
8 8 5. Andere Behandlungsmöglichkeiten Für die Behandlung Ihrer Erkrankung gibt es mehrere Alternativen. Dazu gehört eine rein unterstützende Therapie, die keinen Einfluß auf den Erkrankungsverlauf hat, oder eine Leukämietherapie mit Medikamenten oder Kombinationen, die meist ähnliche Nebenwirkungen wie die der hier vorliegenden Studie haben. Ihr Arzt wird Sie über die verschiedenen Behandlungsalternativen aufklären. 6. Notwendige Untersuchungen im Rahmen des Studienprotokolls Voraussetzung für die Teilnahme an dieser Studie ist die Durchführung ausreichender diagnostischer Untersuchungen vor Therapiebeginn, um die Leukämie zweifelsfrei nachzuweisen. Zu diesem Zweck werden Blutabnahmen, Knochenmarkentnahmen sowie nach Bedarf Röntgenuntersuchungen und Untersuchungen mit Computertomographie durchgeführt. Je nach Einzelfall können weitere Untersuchungen notwendig werden. Diese Untersuchungen sind unabhängig von der Studientherapie bei allen Leukämiepatienten erforderlich. Im Rahmen der Studie wird das entnommene Material an zentrale Labors geschickt, um die Beurteilung durch eine Gruppe sehr erfahrener Laborärzte zu ermöglichen (Referenzuntersuchung). Verbleibendes Material wird aufbewahrt und kann möglicherweise später für weitere Untersuchungen verwendet werden. Die während der Therapie notwendigen Blutuntersuchungen sind unabhängig von der Studientherapie erforderlich. Der Studienplan sieht außerdem mehrere Kontroll-untersuchungen (u.a. Blut- und Knochenmarkuntersuchung) vor, mit denen festgestellt wird, ob die Erkrankung auf die Behandlung anspricht, um ggf. mit einer Umstellung der Therapie reagieren zu können. Die Art der Kontrolluntersuchungen richtet sich danach, wo die Erkrankung bei Diagnosestellung angesiedelt war. Sie umfassen neben einem Gespräch, einer allgemeinen körperlichen Untersuchung, Blutabnahmen zur Kontrolle der Laborwerte weitere Untersuchungen z.b. Knochenmarkentnahme, Untersuchung der Rückenmarkflüssigkeit, Röntgen, Computer- Tomographie, Sonographie usw. Über die Risiken der diagnostischen Verfahren werden Sie ggf. jeweils separat aufgeklärt und um Ihr Einverständnis gebeten. Knochenmark-Punktionen Regelmäßige Knochenmark-Punktionen sind Bestandteil jeder ALL-Therapie. Sie sind notwendig um festzustellen, ob sich die Erkrankung im Knochenmark zurückgebildet hat, d.h. eine komplette Remission eingetreten ist, und ob diese erhalten bleibt. Die im Rahmen des Therapieprotokolls vorgesehenen Knochenmarkpunktionen an den Tagen 20, 36 und in den Wochen 10, 17, 24, 32, 41 und 52 (bzw. Woche 13, 20, 28, 37, 44 und 48 bei Philadelphia- Chromosom-positiven Patienten) sowie 3monatlich im zweiten Therapiejahr sind in diesem Zusammenhang zu sehen. Die genannten Untersuchungen gehören zum Standard bei der ALL. Zusätzlich wird im Rahmen der Studie zu den jeweiligen Untersuchungszeitpunkten eine geringe Menge Knochenmark (5 ml) oder Blut (10 ml) separat eingefroren und für spätere wissenschaftliche Untersuchungen an ein zentrales Labor geschickt. Spiegelbestimmungen Zur Kontrolle der Wirksamkeit und Vorbeugung von Nebenwirkungen sind bei einzelnen Medikamenten (z.b. Methotrexat) Konzentrationsmessungen im Blut erforderlich. Zu diesen Zeitpunkten sind zur Überwachung der Therapie ohnehin regelmäßige Blutuntersuchungen erforderlich, so daß die Spiegelmessungen (jeweils 5 ml Blut) keine wesentliche zusätzliche Belastung darstellen.
9 9 7. Ethik-Kommission, Patientenschutz und Probandenversicherung Ethik-Kommission Das Studienprotokoll wurde der Ethik-Kommission der Universität Frankfurt vorgelegt. Diese Kommission beurteilt, ob berufsethische oder berufsrechtliche Bedenken gegen diese Therapiestudie bestehen. Die Ethik-Kommission der Universität Frankfurt hat das Vorhaben mit Datum vom 2. April 2003 zustimmend bewertet. Die Verantwortung verbleibt jedoch beim Studienleiter. Versicherung Für alle Patienten besteht zum Ausgleich eines Vermögensschadens infolge einer studienbedingten Gesundheitsschädigung von seiten der Studienzentrale der für klinische Prüfungen gesetzlich vorgeschriebene Versicherungsschutz. Die Laufzeit der Probandenversicherung endet am Damit ist gewährleistet, dass alle Patienten während der Therapiedauer von 2 Jahren versichert sind. Die Nachsorge nach Therapieende erfolgt im Rahmen der normalen Krebsnachsorge und ist nicht studienspezifisch. Daher ist sie auch nicht Bestandteil der Probandenversicherung. Während der Dauer der klinischen Prüfung sollte eine andere medizinische Behandlung mit Ausnahme von Notfallsituationen nur im Einvernehmen mit dem Studienarzt erfolgen. Bei Verdacht auf einen studienbedingten Gesundheitsschaden ist der behandelnde Studienarzt sofort zu benachrichtigen, damit dieser in Ihrem Auftrag die Versicherung informieren kann. Sie können erwarten, dass Sie eine Abschrift der Meldung erhalten. Sie können die Versicherung auch selbst informieren. Die Versicherung wurde bei der folgenden Firma abgeschlossen: Allianz Versicherungs-Aktiengesellschaft Zweigniederlassung Frankfurt a.m. Taunusanlage Frankfurt Tel: Fax: Versicherungsschein Nr: 90/0446/ /610 Die Versicherungsbedingungen werden ausgehändigt. Auf die Punkte B (Leistungen) und C (Pflichten des Versicherungsnehmers) wird besonders hingewiesen. 8. Neue Informationen zur Behandlung Ihrer Erkrankung Wichtige neue Informationen, die im Laufe dieser Studie bekannt werden, und die Ihre Bereitschaft zur Teilnahme an dieser Studie beeinflussen könnten, werden Ihnen oder Ihrem rechtlichen Vertreter durch den behandelnden Arzt mitgeteilt. 9. Finanzielle Unterstützung der Studie Die Kosten für die Durchführung der Behandlung und die notwendigen Kontrolluntersuchungen, die als Teil der Standardversorgung für Ihre Erkrankung gelten, werden von der Krankenversicherung übernommen.
10 Hinweise zur Einverständniserklärung Die Mitteilung über die Diagnose Leukämie stellt eine große psychische Belastung für Sie dar. Dazu kommt, daß die Behandlung möglichst schnell begonnen werden muß. Damit Sie selbst einen Überblick über den zeitlichen Ablauf der gesamten Behandlung bekommen, erhalten Sie einen detaillierten Behandlungsplan mit dem zeitlichen Verlauf der einzelnen Behandlungsabschnitte. Ihr behandelnder Arzt hat ein intensives Gespräch mit Ihnen geführt und steht für zusätzliche Fragen zur Verfügung. Die Teilnahme an der Studie ist selbstverständlich freiwillig. Auch wenn Sie sich dagegen entscheiden oder wenn Sie Ihre Teilnahme zu irgendeinem Zeitpunkt beenden wollen, wird Ihr behandelnder Arzt Ihre Weiterbehandlung nach bestem Wissen sicherstellen und Sie ggf. über andere Behandlungsmöglichkeiten unterrichten. Auch der behandelnde Arzt kann die Studienteilnahme beenden, wenn er dies aus medizinischen Gründen für erforderlich hält. Wenn Sie sich für eine Teilnahme an der Studie entscheiden, bitten wir Sie, Ihr schriftliches Einverständnis für die Teilnahme, die Einlagerung von Blut- und Knochenmarkproben und die Weitergabe und Verarbeitung Ihrer Daten auf den beiliegenden Einverständniserklärungen zu geben.
11 11 Therapieoptimierungsstudie für ältere Patienten (> 55 Jahre, ohne obere Altersgrenze) mit akuter lymphatischer Leukämie (GMALL Elderly 1/2003) Einverständniserklärung zur Studienteilnahme Name des Patienten (in Druckbuchstaben): Ich erkläre mich bereit, an der o.g. Studie teilzunehmen. Ich bin von Herrn / Frau (Dr.med.) ausführlich und verständlich über Wesen, Bedeutung und Tragweite der Studie sowie mögliche Belastungen und Risiken aufgeklärt worden. Ich habe darüberhinaus den Text der Patienteninformation und dieser Einverständniserklärung gelesen und verstanden. Aufgetretene Fragen wurden mir verständlich und vollständig beantwortet. Ich hatte ausreichend Zeit, Fragen zu stellen und mich für oder gegen die Studienteilnahme zu entscheiden. Ich werde den ärztlichen Anforderungen, die für die Durchführung der klinischen Prüfung erforderlich sind, Folge leisten. Ich weiß, daß ich jederzeit das Recht habe, meine freiwillige Mitwirkung zu beenden, ohne daß mir daraus Nachteile entstehen. Über den Abschluß einer Versicherung sowie die sich daraus für mich ergebenden Anforderungen bin ich aufgeklärt worden. Eine Kopie der Versicherungsbedingungen habe ich erhalten. Eine Kopie der Patientenaufklärung und dieser Einverständniserklärung sowie der Information und Einverständniserklärung zu Datenweitergabe und Datenschutz habe ich erhalten. Die Originale verbleiben beim Prüfarzt. Aufklärender Arzt Datum Unterschrift Patient/in Datum Unterschrift
12 12 Therapieoptimierungsstudie für ältere Patienten (> 55 Jahre, ohne obere Altersgrenze) mit akuter lymphatischer Leukämie (GMALL Elderly 1/2003) Information und Einverständniserklärung zu Datenweitergabe und Datenschutz Bei wissenschaftlichen Studien werden persönliche Daten und medizinische Befunde über Sie erhoben. Die Weitergabe, Speicherung und Auswertung dieser studienbezogenen Daten erfolgt nach gesetzlichen Bestimmungen und setzt vor Teilnahme an der Studie folgende freiwillige Einwilligung voraus: 1) Ich erkläre mich damit einverstanden, dass im Rahmen dieser Studie erhobene Daten/ Krankheitsdaten auf Fragebögen und elektronischen Datenträgern aufgezeichnet und einschließlich von Namen und Geburtsdatum an die Studienzentrale in Frankfurt weitergeben werden. Die dort beschäftigten Mitarbeiter unterliegen der Schweigepflicht. 2) Ich erkläre mich damit einverstanden, daß diese Daten ohne Namensnennung weitergeben werden an - die zuständige Überwachungsbehörde (Landesamt oder Bezirksregierung) oder - Bundesoberbehörde (Bundesinstitut für Arzneimittel und Medizinprodukte, Bonn) oder - das PEI (Paul Ehrlich Institut) zur Überprüfung der ordnungsgemäßen Durchführung der Studie, sowie ggf. an ein - biometrisches Institut zur Durchführung spezieller Auswertungen - 3) Außerdem erkläre ich mich damit einverstanden, daß ein autorisierter und zur Verschwiegenheit verpflichteter Beauftragter der zuständigen inländischen (und/oder ausländischen) Überwachungsbehörde oder der zuständigen Bundesoberbehörde in meine beim Studienarzt oder in der Studienzentrale vorhandenen personenbezogenen Daten Einsicht nimmt, soweit dies für die Überprüfung der Studie notwendig ist. Für diese Maßnahme entbinde ich den Studienarzt sowie die Studienzentrale von der ärztlichen Schweigepflicht. 4) Ich erkläre mich damit einverstanden, daß überschüssige Blut- und Knochenmarkproben von mir in den an der Studie beteiligten Speziallabors eingelagert und ggf. zu einem späteren Zeitpunkt für wissenschaftliche Untersuchungen genutzt werden. Aufklärender Arzt Datum Unterschrift Patient/in Datum Unterschrift
Einverständniserklärung:
 Zum Verbleib beim Patienten Einverständniserklärung: Name, Vorname...geb. am... wohnhaft in... Ich wurde ausreichend in mündlicher und schriftlicher Form über die klinische Studie Phase II Studie zur Therapie
Zum Verbleib beim Patienten Einverständniserklärung: Name, Vorname...geb. am... wohnhaft in... Ich wurde ausreichend in mündlicher und schriftlicher Form über die klinische Studie Phase II Studie zur Therapie
Sie stehen nun vor der Entscheidung, an einer weiteren Studie teilzunehmen, die begleitend zu den o.g. Studien durchgeführt wird.
 Patienteninformation 1 PATIENTENINFORMATION Multizentrische randomisierte Phase-III-Studie zur Bestimmung von Effektivität und Sicherheit von Rasburicase (Fasturtec ) im Vergleich zu Allopurinol zur Behandlung
Patienteninformation 1 PATIENTENINFORMATION Multizentrische randomisierte Phase-III-Studie zur Bestimmung von Effektivität und Sicherheit von Rasburicase (Fasturtec ) im Vergleich zu Allopurinol zur Behandlung
XXI. Patienteninformation und Einwilligung
 Patienteninformation Seite 1 von 10 XXI. Patienteninformation und Einwilligung Multizentrische Therapieoptimierungsstudie für die Therapie der B-ALL und hochmaligner B-Non-Hodgkin-Lymphome bei Erwachsenen
Patienteninformation Seite 1 von 10 XXI. Patienteninformation und Einwilligung Multizentrische Therapieoptimierungsstudie für die Therapie der B-ALL und hochmaligner B-Non-Hodgkin-Lymphome bei Erwachsenen
Patienteninformation
 1 XII. Patienteninformation Multizentrische Therapieoptimierungsstudie für T-lymphoblastische Lymphome bei Erwachsenen und Adoleszenten ab 18 Jahren (GMALL T-LBL 1/2004) Sehr geehrte Patientin, sehr geehrter
1 XII. Patienteninformation Multizentrische Therapieoptimierungsstudie für T-lymphoblastische Lymphome bei Erwachsenen und Adoleszenten ab 18 Jahren (GMALL T-LBL 1/2004) Sehr geehrte Patientin, sehr geehrter
Schriftliche Einwilligung und datenschutzrechtliche Erklärung zur Teilnahme an der Studie mit dem Namen
 Prüfstelle: Schriftliche Einwilligung und datenschutzrechtliche Erklärung zur Teilnahme an der Studie mit dem Namen Simultaneous Study of Docetaxel Based Anthracycline Free Adjuvant Treatment Evaluation,
Prüfstelle: Schriftliche Einwilligung und datenschutzrechtliche Erklärung zur Teilnahme an der Studie mit dem Namen Simultaneous Study of Docetaxel Based Anthracycline Free Adjuvant Treatment Evaluation,
XXI. Patienteninformation und Einwilligung
 XXI. Patienteninformation und Einwilligung Multizentrische Therapieoptimierungsstudie für die Therapie der B-ALL und hochmaligner B-Non-Hodgkin-Lymphome bei Erwachsenen (ab 18 Jahre) (GMALL-B-ALL/NHL 2002)
XXI. Patienteninformation und Einwilligung Multizentrische Therapieoptimierungsstudie für die Therapie der B-ALL und hochmaligner B-Non-Hodgkin-Lymphome bei Erwachsenen (ab 18 Jahre) (GMALL-B-ALL/NHL 2002)
Patienteninformation und Einverständniserklärung
 Patienteninformation und Einverständniserklärung GMALL 07/2003 Seite 1 von 12 XIX. Patienteninformation und Einverständniserklärung Multizentrische Therapieoptimierungsstudie der akuten lymphatischen Leukämie
Patienteninformation und Einverständniserklärung GMALL 07/2003 Seite 1 von 12 XIX. Patienteninformation und Einverständniserklärung Multizentrische Therapieoptimierungsstudie der akuten lymphatischen Leukämie
PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Therapie mit Cyclophosphamid
 PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Therapie mit Cyclophosphamid Sehr geehrte Patientin! Sehr geehrter Patient! Sie leiden unter einer schwerwiegenden entzündlichen Erkrankung des rheumatischen
PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Therapie mit Cyclophosphamid Sehr geehrte Patientin! Sehr geehrter Patient! Sie leiden unter einer schwerwiegenden entzündlichen Erkrankung des rheumatischen
PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Basistherapie mit Abatacept
 PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Basistherapie mit Abatacept Sehr geehrte Patientin! Sehr geehrter Patient! Sie leiden an einer chronischen Polyarthritis (Rheumatoiden Arthritis). Ihr
PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Basistherapie mit Abatacept Sehr geehrte Patientin! Sehr geehrter Patient! Sie leiden an einer chronischen Polyarthritis (Rheumatoiden Arthritis). Ihr
Patientenaufklärung. Patientenname:... Vorname:... Geburtsdatum:... Diagnose:... Das Aufklärungsgespräch erfolgte am:... durch:...
 Patientenaufklärung Patientenname:... Vorname:... Geburtsdatum:... Diagnose:... Das Aufklärungsgespräch erfolgte am:... durch:... Art der Erkrankung, Ziel der Chemotherapie und Zweck der Studie Sehr geehrte
Patientenaufklärung Patientenname:... Vorname:... Geburtsdatum:... Diagnose:... Das Aufklärungsgespräch erfolgte am:... durch:... Art der Erkrankung, Ziel der Chemotherapie und Zweck der Studie Sehr geehrte
PatientInneninformation 1 und Einwilligungserklärung zur Teilnahme an der klinischen Studie
 PatientInneninformation 1 und Einwilligungserklärung zur Teilnahme an der klinischen Studie... (Vollständiger Titel der klinischen Studie) Sehr geehrte Teilnehmerin, sehr geehrter Teilnehmer! Wir laden
PatientInneninformation 1 und Einwilligungserklärung zur Teilnahme an der klinischen Studie... (Vollständiger Titel der klinischen Studie) Sehr geehrte Teilnehmerin, sehr geehrter Teilnehmer! Wir laden
Patienteninformation. Sehr geehrte Patientin, sehr geehrter Patient,
 und Biomaterialbank Biomaterialsammlung und prospektive Datenerfassung zu Diagnostik, Behandlung und Krankheitsverlauf der ALL des Erwachsenen Patienteninformation Sehr geehrte Patientin, sehr geehrter
und Biomaterialbank Biomaterialsammlung und prospektive Datenerfassung zu Diagnostik, Behandlung und Krankheitsverlauf der ALL des Erwachsenen Patienteninformation Sehr geehrte Patientin, sehr geehrter
Fachbereich Humanmedizin / Klinikum der Johann Wolfgang Goethe-Universität Frankfurt am Main
 PATIENTENINFORMATIONSBLATT: Patientenaufklärung zur Teilnahme an einer wissenschaftlichen Studie Pilot-Studie: Anwendungsbeobachtung zur Evaluierung der therapeutischen Wirksamkeit und Sicherheit bei Durchführung
PATIENTENINFORMATIONSBLATT: Patientenaufklärung zur Teilnahme an einer wissenschaftlichen Studie Pilot-Studie: Anwendungsbeobachtung zur Evaluierung der therapeutischen Wirksamkeit und Sicherheit bei Durchführung
Patienten-/Patientinneninformation und Einwilligungserklärung zur Teilnahme an der Beobachtungsstudie
 Patienten-/Patientinneninformation und Einwilligungserklärung zur Teilnahme an der Beobachtungsstudie APRES: Angemessenheit der Antibiotika -Verschreibungen in der hausärztlichen Praxis in Europa im Hinblick
Patienten-/Patientinneninformation und Einwilligungserklärung zur Teilnahme an der Beobachtungsstudie APRES: Angemessenheit der Antibiotika -Verschreibungen in der hausärztlichen Praxis in Europa im Hinblick
RoACTEMRA (Tocilizumab) Patientenpass
 RoACTEMRA (Tocilizumab) Patientenpass Dieser Patientenpass ist eine Auflage im Rahmen der Zulassung von RoACTEMRA und enthält wichtige Sicherheitsinformationen, über die Patienten bzw. deren Eltern/gesetzliche
RoACTEMRA (Tocilizumab) Patientenpass Dieser Patientenpass ist eine Auflage im Rahmen der Zulassung von RoACTEMRA und enthält wichtige Sicherheitsinformationen, über die Patienten bzw. deren Eltern/gesetzliche
Patienteninformation
 Patienteninformation Version 2.5 vom 18.9.2006 Seite 1 von 9 Patienteninformation Sehr geehrte Patientin, Sehr geehrter Patient, Ihr Arzt hat Ihnen erklärt, dass Sie an einer Akuten Myeloischen Leukämie
Patienteninformation Version 2.5 vom 18.9.2006 Seite 1 von 9 Patienteninformation Sehr geehrte Patientin, Sehr geehrter Patient, Ihr Arzt hat Ihnen erklärt, dass Sie an einer Akuten Myeloischen Leukämie
RoACTEMRA (Tocilizumab) i.v. und s.c. Patientenpass
 RoACTEMRA (Tocilizumab) i.v. und s.c. Patientenpass Dieser Patientenpass enthält wichtige Sicherheitsinformationen, über die Patienten bzw. deren Eltern/ Erziehungsberechtigte Bescheid wissen müssen, bevor,
RoACTEMRA (Tocilizumab) i.v. und s.c. Patientenpass Dieser Patientenpass enthält wichtige Sicherheitsinformationen, über die Patienten bzw. deren Eltern/ Erziehungsberechtigte Bescheid wissen müssen, bevor,
Patienteninformation zur klinischen Studie:
 UniversitätsKlinikum Heidelberg Universitätsklinikum Heidelberg INF 400 69120 Heidelberg Radiologische Klinik Abteilung RadioOnkologie und Strahlentherapie -Czernyklinik- Patienteninformation zur klinischen
UniversitätsKlinikum Heidelberg Universitätsklinikum Heidelberg INF 400 69120 Heidelberg Radiologische Klinik Abteilung RadioOnkologie und Strahlentherapie -Czernyklinik- Patienteninformation zur klinischen
PatientInneninformation 1 und Einwilligungserklärung zur Teilnahme an der klinischen Studie
 PatientInneninformation 1 und Einwilligungserklärung zur Teilnahme an der klinischen Studie Der Einfluss von kontrollierter Bewegung und balneologischer Therapie bei PatientInnen mit chronischen unspezifischen
PatientInneninformation 1 und Einwilligungserklärung zur Teilnahme an der klinischen Studie Der Einfluss von kontrollierter Bewegung und balneologischer Therapie bei PatientInnen mit chronischen unspezifischen
Patienteninformation. zur Teilnahme an
 Prüfstelle: Patienteninformation zur Teilnahme an Randomisierte endokrine Therapieintervention bei postmenopausalen, hormonrezeptorpositiven Patientinnen mit dem Nachweis zirkulierender Tumorzellen im
Prüfstelle: Patienteninformation zur Teilnahme an Randomisierte endokrine Therapieintervention bei postmenopausalen, hormonrezeptorpositiven Patientinnen mit dem Nachweis zirkulierender Tumorzellen im
Biologicaregister für entzündliche rheumatische Erkrankungen e.v. BioReg. ZVR-Zahl Zahl p.a. Schloßhoferstrasse 4/4/12, 1210 Wien
 Biologicaregister für entzündliche rheumatische Erkrankungen e.v. BioReg ZVR-Zahl Zahl 295050213 p.a. Schloßhoferstrasse 4/4/12, 1210 Wien Patientenaufklärung und Patientendatenschutzrechtliche Zustimmungserklärung
Biologicaregister für entzündliche rheumatische Erkrankungen e.v. BioReg ZVR-Zahl Zahl 295050213 p.a. Schloßhoferstrasse 4/4/12, 1210 Wien Patientenaufklärung und Patientendatenschutzrechtliche Zustimmungserklärung
Patienteninformation:
 Patienteninformation: Synthetisches Netz versus kein Netz bei Nabelbrüchen: eine prospektive, doppelblinde, randomisierte, kontrollierte Studie Synthetic mesh versus no mesh for umbilical hernias: a prospective
Patienteninformation: Synthetisches Netz versus kein Netz bei Nabelbrüchen: eine prospektive, doppelblinde, randomisierte, kontrollierte Studie Synthetic mesh versus no mesh for umbilical hernias: a prospective
Patientenaufklärungs- und Informationshinweise
 Patientenaufklärungs- und Informationshinweise ZIELSETZUNG DER STUDIE Ihnen wird hiermit die Teilnahme an einer klinischen Studie angeboten. Ziel dieser Studie ist der klinische Ausgang und der Wirksamkeitsnachweis
Patientenaufklärungs- und Informationshinweise ZIELSETZUNG DER STUDIE Ihnen wird hiermit die Teilnahme an einer klinischen Studie angeboten. Ziel dieser Studie ist der klinische Ausgang und der Wirksamkeitsnachweis
PATIENTENINFORMATION. Caregiver Burden bei betreuenden Angehörigen schwer betroffener Parkinsonpatienten
 Version 1.2 Neurologische Klinik mit Klinischer Neurophysiologie Kommissarischer Direktor: Prof. Dr. med. M. Stangel PD Dr. med. F. Wegner Telefon: (0511) 532-3110 Fax: (0511) 532-3115 Carl-Neuberg-Straße
Version 1.2 Neurologische Klinik mit Klinischer Neurophysiologie Kommissarischer Direktor: Prof. Dr. med. M. Stangel PD Dr. med. F. Wegner Telefon: (0511) 532-3110 Fax: (0511) 532-3115 Carl-Neuberg-Straße
Publikumsvortrag an der AndreasKlinik Cham Zug vom 30. Mai 2006 Leukämien bei älteren Patienten: Neue diagnostische und therapeutische Möglichkeiten
 Publikumsvortrag an der AndreasKlinik Cham Zug vom 30. Mai 2006 Leukämien bei älteren Patienten: Neue diagnostische und therapeutische Möglichkeiten PD Dr.med. Andreas Himmelmann PD Dr.med. Andreas Himmelmann
Publikumsvortrag an der AndreasKlinik Cham Zug vom 30. Mai 2006 Leukämien bei älteren Patienten: Neue diagnostische und therapeutische Möglichkeiten PD Dr.med. Andreas Himmelmann PD Dr.med. Andreas Himmelmann
Sehr geehrte Patientin! Sehr geehrter Patient!
 Univ. Klinik f. Innere Medizin LKH Graz Klinische Abteilung für Rheumatologie und Immunologie Univ. Prof. Dr. W. Graninger Auenbruggerplatz 15, A-8036 Graz Tel 0 316-385-12645 PATIENTENAUFKLÄRUNG ZUR THERAPIE
Univ. Klinik f. Innere Medizin LKH Graz Klinische Abteilung für Rheumatologie und Immunologie Univ. Prof. Dr. W. Graninger Auenbruggerplatz 15, A-8036 Graz Tel 0 316-385-12645 PATIENTENAUFKLÄRUNG ZUR THERAPIE
Was Sie über MabThera wissen sollten
 Die Gesundheitsbehörden der Europäischen Union haben die Markteinführung des Medikaments MabThera an bestimmte Bedingungen gebunden. Der vorgeschriebene Plan zur Risikominimierung in Belgien und im Großherzogtum
Die Gesundheitsbehörden der Europäischen Union haben die Markteinführung des Medikaments MabThera an bestimmte Bedingungen gebunden. Der vorgeschriebene Plan zur Risikominimierung in Belgien und im Großherzogtum
Studie zur Sicherheit von Flugreisen bei Patienten mit Pulmonaler Hypertonie (jeglicher Genese)
 Prüfstelle: Abteilung Pneumologie und Intensivmedizin der Medizinischen Klinik II Uniklinik Gießen und Marburg Standort Gießen Klinikstr. 33, 35392 Gießen Telefon: 0641 985 42352 Prüfärzte: Prof. Dr. A.
Prüfstelle: Abteilung Pneumologie und Intensivmedizin der Medizinischen Klinik II Uniklinik Gießen und Marburg Standort Gießen Klinikstr. 33, 35392 Gießen Telefon: 0641 985 42352 Prüfärzte: Prof. Dr. A.
PED-PTLD-Pilot 2005 Patienten-Einverständnis zur Behandlung Supplement II.5.2
 PED-PTLD-Pilot 2005 Patienten-Einverständnis zur Behandlung Supplement II.5.2 PATIENTENINFORMATION und EINVERSTÄNDNISERKLÄRUNG zur Behandlung einer Transplantations-assoziierten lymphoproliferativen Erkrankung
PED-PTLD-Pilot 2005 Patienten-Einverständnis zur Behandlung Supplement II.5.2 PATIENTENINFORMATION und EINVERSTÄNDNISERKLÄRUNG zur Behandlung einer Transplantations-assoziierten lymphoproliferativen Erkrankung
behördlich genehmigtes Schulungsmaterial (Adalimumab) Patientenpass für Erwachsene
 behördlich genehmigtes Schulungsmaterial HUMIRA (Adalimumab) Patientenpass für Erwachsene Juli 2017 Liebe Patienten, lieber Patient, Ihr behandelnder Arzt hat Ihnen HUMIRA verordnet. Dieser Patientenpass
behördlich genehmigtes Schulungsmaterial HUMIRA (Adalimumab) Patientenpass für Erwachsene Juli 2017 Liebe Patienten, lieber Patient, Ihr behandelnder Arzt hat Ihnen HUMIRA verordnet. Dieser Patientenpass
Information zur Einrichtung einer Gewebebank von chronisch entzündlichen Erkrankungen des Nervensystems im Rahmen des MS-Spenderprogramms
 Telefon : ++49 (0)551 / 39-22700 Fax : ++49 (0)551 / 39-8472 Patienteninformation Information zur Einrichtung einer Gewebebank von chronisch entzündlichen Erkrankungen des Nervensystems im Rahmen des MS-Spenderprogramms
Telefon : ++49 (0)551 / 39-22700 Fax : ++49 (0)551 / 39-8472 Patienteninformation Information zur Einrichtung einer Gewebebank von chronisch entzündlichen Erkrankungen des Nervensystems im Rahmen des MS-Spenderprogramms
Patientenaufklärung. Patientenname:... Vorname:... Geburtsdatum:... Diagnose:... Das Aufklärungsgespräch erfolgte am:... durch:...
 Patientenaufklärung Patientenname:... Vorname:... Geburtsdatum:... Diagnose:... Das Aufklärungsgespräch erfolgte am:... durch:... Art der Erkrankung, Ziel der Therapie und Zweck der Studie Sehr geehrte
Patientenaufklärung Patientenname:... Vorname:... Geburtsdatum:... Diagnose:... Das Aufklärungsgespräch erfolgte am:... durch:... Art der Erkrankung, Ziel der Therapie und Zweck der Studie Sehr geehrte
Information zur Einrichtung einer Gewebebank von chronisch entzündlichen Erkrankungen des Nervensystems im Rahmen des MS-Spenderprogramms
 Telefon : ++49 (0)551 / 39-22700 Fax : ++49 (0)551 / 39-8472 Patienteninformation Information zur Einrichtung einer Gewebebank von chronisch entzündlichen Erkrankungen des Nervensystems im Rahmen des MS-Spenderprogramms
Telefon : ++49 (0)551 / 39-22700 Fax : ++49 (0)551 / 39-8472 Patienteninformation Information zur Einrichtung einer Gewebebank von chronisch entzündlichen Erkrankungen des Nervensystems im Rahmen des MS-Spenderprogramms
für die Patienten-Information und -Einwilligung zur Durchführung einer klinischen Studie mit volljährigen einwilligungsfähigen Patienten
 PROSTATITIS, ENTZÜNDUNG UND FRUCHTBARKEIT für die zur Durchführung einer klinischen Studie mit volljährigen einwilligungsfähigen Patienten Prüfstelle: Klinik für Urologie, Kinderurologie und Andrologie,
PROSTATITIS, ENTZÜNDUNG UND FRUCHTBARKEIT für die zur Durchführung einer klinischen Studie mit volljährigen einwilligungsfähigen Patienten Prüfstelle: Klinik für Urologie, Kinderurologie und Andrologie,
Medikationsleitfaden für Patienten
 Mitoxantron Mitoxantron Medikationsleitfaden für Patienten Wichtige obligatorische Informationen zur Risikominimierung für Patienten, die eine Therapie mit RALENOVA /NOVANTRON (Wirkstoff: Mitoxantron)
Mitoxantron Mitoxantron Medikationsleitfaden für Patienten Wichtige obligatorische Informationen zur Risikominimierung für Patienten, die eine Therapie mit RALENOVA /NOVANTRON (Wirkstoff: Mitoxantron)
Patienten-Information und Einwilligung zur Durchführung einer klinischen Untersuchung mit volljährigen einwilligungsfähigen Patienten 1
 Patienten-Information und Einwilligung zur Durchführung einer klinischen Untersuchung mit volljährigen einwilligungsfähigen Patienten 1 Prüfstelle: Prüfarzt: Petrus-Krankenhaus Wuppertal Prof. Dr. med.
Patienten-Information und Einwilligung zur Durchführung einer klinischen Untersuchung mit volljährigen einwilligungsfähigen Patienten 1 Prüfstelle: Prüfarzt: Petrus-Krankenhaus Wuppertal Prof. Dr. med.
Leitfaden für Patienten zur Anwendung von KYMRIAH (Tisagenlecleucel)
 Leitfaden für Patienten zur Anwendung von KYMRIAH (Tisagenlecleucel) Wichtige Sicherheitsinformationen zur Minimierung des Risikos von KYMRIAH Der Wirkstoff von KYMRIAH heißt Tisagenlecleucel. Diese Bezeichnung
Leitfaden für Patienten zur Anwendung von KYMRIAH (Tisagenlecleucel) Wichtige Sicherheitsinformationen zur Minimierung des Risikos von KYMRIAH Der Wirkstoff von KYMRIAH heißt Tisagenlecleucel. Diese Bezeichnung
Patientenaufklärung. Patientenname:... Vorname:... Geburtsdatum:... Diagnose:... Das Aufklärungsgespräch erfolgte am:... durch:...
 Patientenaufklärung Patientenname:... Vorname:... Geburtsdatum:... Diagnose:... Das Aufklärungsgespräch erfolgte am:... durch:... Art der Erkrankung, Ziel der Chemotherapie und Zweck der Studie Sehr geehrte
Patientenaufklärung Patientenname:... Vorname:... Geburtsdatum:... Diagnose:... Das Aufklärungsgespräch erfolgte am:... durch:... Art der Erkrankung, Ziel der Chemotherapie und Zweck der Studie Sehr geehrte
Patientenaufklärung. Geburtsdatum:... Diagnose:... durch:...
 Patientenaufklärung Titel der Studie: Offene multizentrische Therapieoptimierungsstudie mit Glivec (imatinib mesylate) in Kombination mit einer Chemotherapie aus Mitoxantron, Topotecan und AraC (MTC) bei
Patientenaufklärung Titel der Studie: Offene multizentrische Therapieoptimierungsstudie mit Glivec (imatinib mesylate) in Kombination mit einer Chemotherapie aus Mitoxantron, Topotecan und AraC (MTC) bei
Information zur Einrichtung einer Gewebebank von chronisch entzündlichen Erkrankungen des Nervensystems im Rahmen des MS-Spenderprogramms
 Universitätsmedizin Göttingen, 37099 Göttingen Institut für Neuropathologie, Robert-Koch-Str. 40, D-37075 Göttingen Institut für Neuropathologie Telefon : ++49 (0)551 / 39-22700 Fax : ++49 (0)551 / 39-8472
Universitätsmedizin Göttingen, 37099 Göttingen Institut für Neuropathologie, Robert-Koch-Str. 40, D-37075 Göttingen Institut für Neuropathologie Telefon : ++49 (0)551 / 39-22700 Fax : ++49 (0)551 / 39-8472
Sehr geehrte Patientin! Sehr geehrter Patient!
 Univ. Klinik f. Innere Medizin LKH Graz Klinische Abteilung für Rheumatologie und Immunologie Univ. Prof. Dr. W. Graninger Auenbruggerplatz 15, A-8036 Graz Tel 0 316-385-12645 PATIENTENAUFKLÄRUNG ZUR THERAPIE
Univ. Klinik f. Innere Medizin LKH Graz Klinische Abteilung für Rheumatologie und Immunologie Univ. Prof. Dr. W. Graninger Auenbruggerplatz 15, A-8036 Graz Tel 0 316-385-12645 PATIENTENAUFKLÄRUNG ZUR THERAPIE
Welt Lymphom Tag Seminar für Patienten und Angehörige 15. September 2007 Wien
 Welt Lymphom Tag Seminar für Patienten und Angehörige 15. September 2007 Wien Ein Vortrag von Univ. Prof. Dr. Johannes Drach Medizinische Universität Wien Univ. Klinik für Innere Medizin I Klinische Abteilung
Welt Lymphom Tag Seminar für Patienten und Angehörige 15. September 2007 Wien Ein Vortrag von Univ. Prof. Dr. Johannes Drach Medizinische Universität Wien Univ. Klinik für Innere Medizin I Klinische Abteilung
Information und Einwilligung für Eltern / Erziehungsberechtige zur Durchführung genetischer Analysen bei Kindern und Jugendlichen
 Information und Einwilligung für Eltern / Erziehungsberechtige zur Durchführung genetischer Analysen bei Kindern und Jugendlichen Studienstelle: Klinik für Nephrologie Universitätsklinikum Düsseldorf Moorenstr.
Information und Einwilligung für Eltern / Erziehungsberechtige zur Durchführung genetischer Analysen bei Kindern und Jugendlichen Studienstelle: Klinik für Nephrologie Universitätsklinikum Düsseldorf Moorenstr.
Diskussionsleitfaden für Studienteilnehmer von klinischen Studien
 Diskussionsleitfaden für Studienteilnehmer von klinischen Studien Sehr geehrte Frau [last name], / Sehr geehrter Herr [last name], vielen Dank, dass Sie sich Zeit nehmen, um über eine Teilnahme an einer
Diskussionsleitfaden für Studienteilnehmer von klinischen Studien Sehr geehrte Frau [last name], / Sehr geehrter Herr [last name], vielen Dank, dass Sie sich Zeit nehmen, um über eine Teilnahme an einer
WENN SOGAR UMARMUNGEN WEHTUN DIE NÄCHSTEN SCHRITTE. Informationen für Patienten. besuchen Sie
 DIE NÄCHSTEN SCHRITTE Wir danken Ihnen, dass Sie sich die Zeit genommen haben, sich über diese wichtige Studie zu informieren. Wenn Sie teilnehmen möchten, kontaktieren Sie uns bitte, damit wir einen Besuchstermin
DIE NÄCHSTEN SCHRITTE Wir danken Ihnen, dass Sie sich die Zeit genommen haben, sich über diese wichtige Studie zu informieren. Wenn Sie teilnehmen möchten, kontaktieren Sie uns bitte, damit wir einen Besuchstermin
Patienteninformation und Einwilligungserklärung. zur Teilnahme am Nephronophthise-Register
 Patienteninformation und Einwilligungserklärung zur Teilnahme am Nephronophthise-Register Auftraggeber der Studie: Prof. Dr. med. Heymut Omran Direktor der Klinik und Poliklinik für Kinder- und Jugendmedizin
Patienteninformation und Einwilligungserklärung zur Teilnahme am Nephronophthise-Register Auftraggeber der Studie: Prof. Dr. med. Heymut Omran Direktor der Klinik und Poliklinik für Kinder- und Jugendmedizin
PATIENTENINFORMATION. Nationales Klinisches Amyloidose-Register
 UniversitätsKlinikum Heidelberg Medizinische Klinik Universitätsklinikum Heidelberg Im Neuenheimer Feld 410 69120 Heidelberg Medizinische Klinik (Krehl-Klinik) Abteilung Innere Medizin V Hämatologie, Onkologie
UniversitätsKlinikum Heidelberg Medizinische Klinik Universitätsklinikum Heidelberg Im Neuenheimer Feld 410 69120 Heidelberg Medizinische Klinik (Krehl-Klinik) Abteilung Innere Medizin V Hämatologie, Onkologie
WICHTIGE INFORMATIONEN FÜR PATIENTEN. denen STELARA zur Behandlung des mittelschweren bis schweren aktiven Morbus Crohn verschrieben wurde
 WICHTIGE INFORMATIONEN FÜR PATIENTEN denen STELARA zur Behandlung des mittelschweren bis schweren aktiven Morbus Crohn verschrieben wurde 2 Version 2 (Stand: Februar 2017) Erstellt in Abstimmung mit dem
WICHTIGE INFORMATIONEN FÜR PATIENTEN denen STELARA zur Behandlung des mittelschweren bis schweren aktiven Morbus Crohn verschrieben wurde 2 Version 2 (Stand: Februar 2017) Erstellt in Abstimmung mit dem
Bitte ergänzen Sie diese Seite mit Ihrem zentrumsspezifischen Briefbogen und füllen Sie alle Leerstellen im Dokument mit den entsprechenden Angaben
 Information und Einwilligung für die Einlagerung von Blutproben für die Zentrallabore und deren weitere Verwendung (CLLR3-Studie der DCLLSG, Sponsor ist das Städtische Klinikum München GmbH) Version 2.0
Information und Einwilligung für die Einlagerung von Blutproben für die Zentrallabore und deren weitere Verwendung (CLLR3-Studie der DCLLSG, Sponsor ist das Städtische Klinikum München GmbH) Version 2.0
AMGEVITA (Adalimumab)
 AMGEVITA (Adalimumab) Patientenpass für Ihr Kind behördlich genehmigtes Schulungsmaterial Dieser Pass enthält wichtige Sicherheitsinformationen über AMGEVITA. Alle, die an der medizinischen Versorgung
AMGEVITA (Adalimumab) Patientenpass für Ihr Kind behördlich genehmigtes Schulungsmaterial Dieser Pass enthält wichtige Sicherheitsinformationen über AMGEVITA. Alle, die an der medizinischen Versorgung
Patientinneninformation zur endokrinen Therapierandomisation innerhalb der SUCCESS C Studie (nur Patientinnen mit persistierenden CTC)
 Patientinneninformation zur endokrinen Therapierandomisation innerhalb der SUCCESS C Studie (nur Patientinnen mit persistierenden CTC) Prüfstelle: Prüfarzt: Patienteninformation zur Teilnahme an Randomisierte
Patientinneninformation zur endokrinen Therapierandomisation innerhalb der SUCCESS C Studie (nur Patientinnen mit persistierenden CTC) Prüfstelle: Prüfarzt: Patienteninformation zur Teilnahme an Randomisierte
Information zur Einrichtung einer Gewebebank von chronisch entzündlichen Erkrankungen des Nervensystems im Rahmen des MS-Spenderprogramms
 Information zur Einrichtung einer Gewebebank von chronisch entzündlichen Erkrankungen des ZNS im Rahmen des MS-Spenderprogramms Universitätsmedizin Göttingen, 37099 Göttingen Institut für Neuropathologie,
Information zur Einrichtung einer Gewebebank von chronisch entzündlichen Erkrankungen des ZNS im Rahmen des MS-Spenderprogramms Universitätsmedizin Göttingen, 37099 Göttingen Institut für Neuropathologie,
Als Krebspatient an einer Studie teilnehmen was sollte man wissen?
 Als Krebspatient an einer Studie teilnehmen was sollte man wissen? Krebsinformationsdienst, Heidelberg Dr. Susanne Weg-Remers Seite 2 Grundlage für evidenzbasiertes medizinisches Wissen sind klinische
Als Krebspatient an einer Studie teilnehmen was sollte man wissen? Krebsinformationsdienst, Heidelberg Dr. Susanne Weg-Remers Seite 2 Grundlage für evidenzbasiertes medizinisches Wissen sind klinische
Sehr geehrte Patientin! Sehr geehrter Patient!
 Univ. Klinik f. Innere Medizin LKH Graz Klinische Abteilung für Rheumatologie und Immunologie Univ. Prof. Dr. W. Graninger Auenbruggerplatz 15, A-8036 Graz Tel 0 316-385-12645 PATIENTENAUFKLÄRUNG ZUR THERAPIE
Univ. Klinik f. Innere Medizin LKH Graz Klinische Abteilung für Rheumatologie und Immunologie Univ. Prof. Dr. W. Graninger Auenbruggerplatz 15, A-8036 Graz Tel 0 316-385-12645 PATIENTENAUFKLÄRUNG ZUR THERAPIE
Wichtige Sicherheitsinformationen zur Minimierung des Risikos von immunbedingten Nebenwirkungen
 BAVENCIO (Avelumab) Version 1.6, Juli 2017 Wichtige Sicherheitsinformationen zur Minimierung des Risikos von immunbedingten Nebenwirkungen Patientenpass Dieses Arzneimittel unterliegt einer zusätzlichen
BAVENCIO (Avelumab) Version 1.6, Juli 2017 Wichtige Sicherheitsinformationen zur Minimierung des Risikos von immunbedingten Nebenwirkungen Patientenpass Dieses Arzneimittel unterliegt einer zusätzlichen
Patienteninformation zur Studie
 Patienteninformation zur Studie Rituximab-Gemcitabin/Oxaliplatin-Therapie bei indolenten Lymphomen Sehr geehrte Patientin! Sehr geehrter Patient! Sie wurden darüber aufgeklärt, dass Sie an einem niedrig
Patienteninformation zur Studie Rituximab-Gemcitabin/Oxaliplatin-Therapie bei indolenten Lymphomen Sehr geehrte Patientin! Sehr geehrter Patient! Sie wurden darüber aufgeklärt, dass Sie an einem niedrig
Patienteninformation zur Teilnahme an der Registerstudie NEOCYST Netzwerk zur Erforschung zystischer Nierenerkrankungen im Kindesalter
 Patienteninformation und Einwilligungserklärung zur Teilnahme an der Registerstudie NEOCYST Patienten von 6 17 Jahren Registerleitung: Univ.-Prof. Dr. med. Martin Konrad Klinik und Poliklinik für Kinder-
Patienteninformation und Einwilligungserklärung zur Teilnahme an der Registerstudie NEOCYST Patienten von 6 17 Jahren Registerleitung: Univ.-Prof. Dr. med. Martin Konrad Klinik und Poliklinik für Kinder-
Patienteninformation. Primärbehandlung der akuten Promyelozytenleukämie
 Patienteninformation Primärbehandlung der akuten Promyelozytenleukämie Eine randomisierte Studie bei neu diagnostizierter akuter Promyelozytenleukämie zum Vergleich der Effekte von intensivierter Doppelinduktion
Patienteninformation Primärbehandlung der akuten Promyelozytenleukämie Eine randomisierte Studie bei neu diagnostizierter akuter Promyelozytenleukämie zum Vergleich der Effekte von intensivierter Doppelinduktion
Information und Einverständniserklärung für Patienten und Patientinnen, die an der Schweizerischen HIV-Kohortenstudie teilnehmen
 Information und Einverständniserklärung für Patienten und Patientinnen, die an der Schweizerischen HIV-Kohortenstudie teilnehmen Sehr geehrte Patientin, sehr geehrter Patient Wir laden Sie ein, an der
Information und Einverständniserklärung für Patienten und Patientinnen, die an der Schweizerischen HIV-Kohortenstudie teilnehmen Sehr geehrte Patientin, sehr geehrter Patient Wir laden Sie ein, an der
AMLSG Amendment Nr. 3 vom zur Version der Protokollanhänge vom
 Studie: Randomisierte Phase II-Studie zu All-trans-Retinsäure bei der Induktions- und Konsolidierungstherapie sowie Pegfilgrastim in der Konsolidierungstherapie bei jüngeren Patienten mit neu diagnostizierter
Studie: Randomisierte Phase II-Studie zu All-trans-Retinsäure bei der Induktions- und Konsolidierungstherapie sowie Pegfilgrastim in der Konsolidierungstherapie bei jüngeren Patienten mit neu diagnostizierter
WICHTIGE INFORMATIONEN FÜR PATIENTEN
 WICHTIGE INFORMATIONEN FÜR PATIENTEN denen STELARA zur Behandlung der mittelschweren bis schweren Plaque-Psoriasis bzw. aktiven psoriatischen Arthritis verschrieben wurde 2 Version 5 (Stand: Februar 2017)
WICHTIGE INFORMATIONEN FÜR PATIENTEN denen STELARA zur Behandlung der mittelschweren bis schweren Plaque-Psoriasis bzw. aktiven psoriatischen Arthritis verschrieben wurde 2 Version 5 (Stand: Februar 2017)
AMGEVITA (Adalimumab)
 AMGEVITA (Adalimumab) Patientenpass behördlich genehmigtes Schulungsmaterial Dieser Pass enthält wichtige Sicherheitsinformationen über AMGEVITA. Alle, die an Ihrer medizinischen Versorgung beteiligt sind,
AMGEVITA (Adalimumab) Patientenpass behördlich genehmigtes Schulungsmaterial Dieser Pass enthält wichtige Sicherheitsinformationen über AMGEVITA. Alle, die an Ihrer medizinischen Versorgung beteiligt sind,
Behandlungsprotokoll für Kinder und Jugendliche mit akuter lymphoblastischer Leukämie (ALL) nach der Therapiestudie AIEOP-BFM ALL 2009
 Behandlungsprotokoll für Kinder und Jugendliche mit akuter lymphoblastischer Leukämie (ALL) nach der Therapiestudie AIEOP-BFM ALL 2009 Liebe(r), bei Dir wurde festgestellt, dass Du eine schwere Krankheit
Behandlungsprotokoll für Kinder und Jugendliche mit akuter lymphoblastischer Leukämie (ALL) nach der Therapiestudie AIEOP-BFM ALL 2009 Liebe(r), bei Dir wurde festgestellt, dass Du eine schwere Krankheit
Was Sie über Rixathon wissen sollten
 Die Gesundheitsbehörden der Europäischen Union haben die Markteinführung des Medikaments Rixathon an bestimmte Bedingungen gebunden. Der vorgeschriebene Plan zur Risikominimierung in Belgien, der auch
Die Gesundheitsbehörden der Europäischen Union haben die Markteinführung des Medikaments Rixathon an bestimmte Bedingungen gebunden. Der vorgeschriebene Plan zur Risikominimierung in Belgien, der auch
Patienteninformation und Einwilligungserklärung
 Patienteninformation und Einwilligungserklärung Wirksamkeit und Sicherheit von 90Y-Ibritumomab Tiuxetan bei Patienten mit rezidiviertem oder refraktärem Mantelzell-Lymphom nach autologer Stamzelltransplantation
Patienteninformation und Einwilligungserklärung Wirksamkeit und Sicherheit von 90Y-Ibritumomab Tiuxetan bei Patienten mit rezidiviertem oder refraktärem Mantelzell-Lymphom nach autologer Stamzelltransplantation
Kymriah (tisagenlecleucel)
 Um die Wirkungen des Arzneimittels Kymriah für Ihre Gesundheit optimal nutzen zu können, seine ordnungsgemäße Anwendung sicherzustellen und seine Nebenwirkungen zu begrenzen, sind bestimmte Maßnahmen/Sicherheitsvorkehrungen
Um die Wirkungen des Arzneimittels Kymriah für Ihre Gesundheit optimal nutzen zu können, seine ordnungsgemäße Anwendung sicherzustellen und seine Nebenwirkungen zu begrenzen, sind bestimmte Maßnahmen/Sicherheitsvorkehrungen
VPRIV (Velaglucerase alfa)
 VPRIV (Velaglucerase alfa) Schulungsmaterial für Ärzte Die hier aufgeführten Dokumente wurden von Shire im Rahmen der Verpflichtung zu Risikominimierungsmaβnahmen für VPRIV erstellt und dienen als Leitlinie
VPRIV (Velaglucerase alfa) Schulungsmaterial für Ärzte Die hier aufgeführten Dokumente wurden von Shire im Rahmen der Verpflichtung zu Risikominimierungsmaβnahmen für VPRIV erstellt und dienen als Leitlinie
WAS SIE ÜBER RIXATHON (RITUXIMAB) WISSEN SOLLTEN
 WAS SIE ÜBER RIXATHON (RITUXIMAB) WISSEN SOLLTEN WICHTIGE SICHERHEITSINFORMATIONEN FÜR PATIENTEN, DIE MIT RIXATHON BEHANDELT WERDEN Dieses Informationsmaterial zur Anwendung von Rixathon (Rituximab) wurde
WAS SIE ÜBER RIXATHON (RITUXIMAB) WISSEN SOLLTEN WICHTIGE SICHERHEITSINFORMATIONEN FÜR PATIENTEN, DIE MIT RIXATHON BEHANDELT WERDEN Dieses Informationsmaterial zur Anwendung von Rixathon (Rituximab) wurde
Behandlung mit. was Sie darüber wissen müssen
 Information für Patienten, denen Volibris verschrieben wurde Behandlung mit was Sie darüber wissen müssen Diese Informationsbroschüre ist verpflichtender Teil der Zulassung um sicherzustellen, dass Angehörige
Information für Patienten, denen Volibris verschrieben wurde Behandlung mit was Sie darüber wissen müssen Diese Informationsbroschüre ist verpflichtender Teil der Zulassung um sicherzustellen, dass Angehörige
Leukämie (CML) Was ist Chronische Myeloische Leukämie? Download. Published on Novartis Austria (https://www.novartis.at)
 Published on Novartis Austria (https://www.novartis.at) Home > Printer-friendly PDF > Leukämie (CML) Leukämie (CML) Was ist Chronische Myeloische Leukämie? Die chronische myeloische Leukämie (CML) ist
Published on Novartis Austria (https://www.novartis.at) Home > Printer-friendly PDF > Leukämie (CML) Leukämie (CML) Was ist Chronische Myeloische Leukämie? Die chronische myeloische Leukämie (CML) ist
Behandlung der feuchten altersabhängigen Makuladegeneration (feuchte AMD) mit VEGF-Hemmern durch operative Medikamenteneingabe in das Auge
 Augenarztpraxis AltenKirchen Dr. med. Thomas Wehler Facharzt für Augenheilkunde Wilhelmstr. 32 Schlossweg 2 57610 Altenkirchen Tel 02681-1651 Fax 02681-6094 Mail info@ak-augenarzt.de Net www.ak-augenarzt.de
Augenarztpraxis AltenKirchen Dr. med. Thomas Wehler Facharzt für Augenheilkunde Wilhelmstr. 32 Schlossweg 2 57610 Altenkirchen Tel 02681-1651 Fax 02681-6094 Mail info@ak-augenarzt.de Net www.ak-augenarzt.de
Diagnose MS. Leitfaden zur Therapieauswahl
 Diagnose MS Leitfaden zur Therapieauswahl Vorbereitung ist alles Vor einer Entscheidung für eine Behandlung stehen viele Fragen. Zum einzelnen Wirkstoff. Zum Behandlungsplan. Zur Krankheit generell. Alles
Diagnose MS Leitfaden zur Therapieauswahl Vorbereitung ist alles Vor einer Entscheidung für eine Behandlung stehen viele Fragen. Zum einzelnen Wirkstoff. Zum Behandlungsplan. Zur Krankheit generell. Alles
ANHANG NEBENWIRKUNGEN
 ANHANG NEBENWIRKUNGEN Gegenüberstellung von Imatinib (400mg täglich) und Nilotinib (2x 300mg täglich) bei Patienten mit chronischer myeloischer Leukämie (CML) in erster chronischer Phase, die unter Behandlung
ANHANG NEBENWIRKUNGEN Gegenüberstellung von Imatinib (400mg täglich) und Nilotinib (2x 300mg täglich) bei Patienten mit chronischer myeloischer Leukämie (CML) in erster chronischer Phase, die unter Behandlung
Ihr Wegweiser zur Therapie mit YERVOY (Ipilimumab)
 Behördlich genehmigtes Schulungsmaterial Ihr Wegweiser zur Therapie mit YERVOY (Ipilimumab) Informationsbroschüre für Patienten Diese Patientenbroschüre zur Anwendung von Ipilimumab wurde als Teil der
Behördlich genehmigtes Schulungsmaterial Ihr Wegweiser zur Therapie mit YERVOY (Ipilimumab) Informationsbroschüre für Patienten Diese Patientenbroschüre zur Anwendung von Ipilimumab wurde als Teil der
Wichtige Information zu Dapoxetin (Priligy )
 Wichtige Information zu Dapoxetin (Priligy ) Diese Informationsbroschüre zur Anwendung von Dapoxetin (Priligy ) wurde als Teil der Zulassungsauflagen für das Arzneimittel erstellt und behördlich genehmigt.
Wichtige Information zu Dapoxetin (Priligy ) Diese Informationsbroschüre zur Anwendung von Dapoxetin (Priligy ) wurde als Teil der Zulassungsauflagen für das Arzneimittel erstellt und behördlich genehmigt.
Klinisch wissenschaftliches Begleitprogramm
 Version 3.0; Köln, den 26.07.2010 Sponsor Code: Uni-Koeln-1167 Sponsor: Universität zu Köln Leiter der Klinischen Prüfung: Prof. Dr. A. Engert Patienteninformation Phase I Studie mit AVD plus Lenalidomid
Version 3.0; Köln, den 26.07.2010 Sponsor Code: Uni-Koeln-1167 Sponsor: Universität zu Köln Leiter der Klinischen Prüfung: Prof. Dr. A. Engert Patienteninformation Phase I Studie mit AVD plus Lenalidomid
Patienteninformation Teil 2 Untersuchung der Erbsubstanz (genetische und epigenetische Untersuchung) der Blutproben für das
 Technische Universität München Leiter des Forschungsvorhaben Univ.-Prof. Dr. Wolfgang Dott Direktor des Instituts für Hygiene und Umweltmedizin Pauwelsstr. 30 D 52074 Aachen Telefon (+49) 0241 80 88 385
Technische Universität München Leiter des Forschungsvorhaben Univ.-Prof. Dr. Wolfgang Dott Direktor des Instituts für Hygiene und Umweltmedizin Pauwelsstr. 30 D 52074 Aachen Telefon (+49) 0241 80 88 385
Akute Leukämien und das Myelodysplastische Syndrom
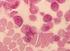 Akute Leukämien und das Myelodysplastische Syndrom Der Begriff Leukämie kommt aus dem Griechischen und bedeutet weißes Blut. Der Name rührt daher, dass bei Patienten mit Leukämie sehr viele weiße Blutzellen
Akute Leukämien und das Myelodysplastische Syndrom Der Begriff Leukämie kommt aus dem Griechischen und bedeutet weißes Blut. Der Name rührt daher, dass bei Patienten mit Leukämie sehr viele weiße Blutzellen
Die Chemotherapie bei den Kleintieren
 Die Chemotherapie bei den Kleintieren Was ist Chemotherapie und wie funktioniert sie? Stellt die Chemotherapie ein Risiko für Menschen dar? Welche Nebenwirkungen hat die Chemotherapie? Was ist eine Chemotherapie?
Die Chemotherapie bei den Kleintieren Was ist Chemotherapie und wie funktioniert sie? Stellt die Chemotherapie ein Risiko für Menschen dar? Welche Nebenwirkungen hat die Chemotherapie? Was ist eine Chemotherapie?
Molekulare Neuropathologie 2.0. zur Erhöhung der diagnostischen Genauigkeit bei Hirntumoren im Kindesalter
 Molekulare Neuropathologie 2.0 zur Erhöhung der diagnostischen Genauigkeit bei Hirntumoren im Kindesalter EINWILLIGUNGSERKLÄRUNG FÜR ERZIEHUNGSBERECHTIGTE Studienleiter: Prof. Dr. Stefan Pfister Deutsches
Molekulare Neuropathologie 2.0 zur Erhöhung der diagnostischen Genauigkeit bei Hirntumoren im Kindesalter EINWILLIGUNGSERKLÄRUNG FÜR ERZIEHUNGSBERECHTIGTE Studienleiter: Prof. Dr. Stefan Pfister Deutsches
Patienteninformation zur Behandlung der Psoriasis mit Methotrexat
 Praxis Dr. Ralph von Kiedrowski Patienteninformation zur Behandlung der Psoriasis mit Methotrexat Liebe Patientin, lieber Patient, dieses Informationsblatt soll Ihnen die vorgesehene Behandlung mit Methotrexat
Praxis Dr. Ralph von Kiedrowski Patienteninformation zur Behandlung der Psoriasis mit Methotrexat Liebe Patientin, lieber Patient, dieses Informationsblatt soll Ihnen die vorgesehene Behandlung mit Methotrexat
*400058* Fragebogen zu Herz- und Kreislauferkrankungen. Postfach Oberursel. Versicherungs-Nr.: Zu versichernde Person: Geburtsdatum:
 ALTE LEIPZIGER Leben Postfach 1660 Absender: 61406 Oberursel Versicherungs-Nr.: Zu versichernde Person: Geburtsdatum: Fragebogen zu Herz- und Kreislauferkrankungen 1. Welche Erkrankungen oder Beeinträchtigungen
ALTE LEIPZIGER Leben Postfach 1660 Absender: 61406 Oberursel Versicherungs-Nr.: Zu versichernde Person: Geburtsdatum: Fragebogen zu Herz- und Kreislauferkrankungen 1. Welche Erkrankungen oder Beeinträchtigungen
PATIENTENINFORMATION UND EINWILLIGUNGSERKLÄRUNG ZUR LAGERUNG VON BLUTPROBEN
 PATIENTENINFORMATION UND EINWILLIGUNGSERKLÄRUNG ZUR LAGERUNG VON BLUTPROBEN Eine placebo-kontrollierte, doppelblinde, randomisierte multizentrische dreiarmige Phase III Studie zu Effektivität und Sicherheit
PATIENTENINFORMATION UND EINWILLIGUNGSERKLÄRUNG ZUR LAGERUNG VON BLUTPROBEN Eine placebo-kontrollierte, doppelblinde, randomisierte multizentrische dreiarmige Phase III Studie zu Effektivität und Sicherheit
Patienteninformation PET-CT 68 Ga-PSMA
 Institut für Nuklearmedizin und Endokrinologie Patienteninformation PET-CT 68 Ga-PSMA Sehr geehrte Patientin! Sehr geehrter Patient! Bei Ihnen ist eine PET/CT Untersuchung vorgesehen. Sie haben dadurch
Institut für Nuklearmedizin und Endokrinologie Patienteninformation PET-CT 68 Ga-PSMA Sehr geehrte Patientin! Sehr geehrter Patient! Bei Ihnen ist eine PET/CT Untersuchung vorgesehen. Sie haben dadurch
PatientInneninformation und Einwilligungserklärung zur Teilnahme an der Pilotstudie
 PatientInneninformation und Einwilligungserklärung zur Teilnahme an der Pilotstudie Effekt einer Reduktion von tierischem Eiweiß auf den Verlauf einer bestehenden Krebserkrankung Sehr geehrte Teilnehmerin,
PatientInneninformation und Einwilligungserklärung zur Teilnahme an der Pilotstudie Effekt einer Reduktion von tierischem Eiweiß auf den Verlauf einer bestehenden Krebserkrankung Sehr geehrte Teilnehmerin,
Patienteninformation. Behandlung der akuten Promyelozytenleukämie mit Arsentrioxid (TRISENOX)
 Anlage 11 Patienteninformation Behandlung der akuten Promyelozytenleukämie mit Arsentrioxid (TRISENOX) Eine Phase-IV Studie mit Arsentrioxid (ATO) zur Erfassung der Wirksamkeit und Toxizität sowie des
Anlage 11 Patienteninformation Behandlung der akuten Promyelozytenleukämie mit Arsentrioxid (TRISENOX) Eine Phase-IV Studie mit Arsentrioxid (ATO) zur Erfassung der Wirksamkeit und Toxizität sowie des
Patienteninformation und Einverständniserklärung zur Teilnahme an der ARPKD Registerstudie ARegPKD
 Patienteninformation und Einverständniserklärung zur Teilnahme an der ARPKD Registerstudie ARegPKD Registerleitung: Stellvertreter: Dr. med. Max C. Liebau Dr. med. Markus Feldkötter Kinderklinik Zentrum
Patienteninformation und Einverständniserklärung zur Teilnahme an der ARPKD Registerstudie ARegPKD Registerleitung: Stellvertreter: Dr. med. Max C. Liebau Dr. med. Markus Feldkötter Kinderklinik Zentrum
Broschüre für Teilnehmer Informationen zur klinischen PASSPORT-Studie
 Broschüre für Teilnehmer Informationen zur klinischen PASSPORT-Studie Gesucht: Patienten mit progressiver supranukleärer Blickparese (PSP) für PASSPORT-Studie PSP betrifft 5 6 von 100.000 Personen. Einige
Broschüre für Teilnehmer Informationen zur klinischen PASSPORT-Studie Gesucht: Patienten mit progressiver supranukleärer Blickparese (PSP) für PASSPORT-Studie PSP betrifft 5 6 von 100.000 Personen. Einige
Erläuterungen zur Einwilligungserklärung
 Erläuterungen zur Einwilligungserklärung Leisten Sie einen Beitrag zur medizinischen Forschung Liebe Patientin, Lieber Patient Dank der medizinischen Forschung leisten die Ärzte und Wissenschaftler der
Erläuterungen zur Einwilligungserklärung Leisten Sie einen Beitrag zur medizinischen Forschung Liebe Patientin, Lieber Patient Dank der medizinischen Forschung leisten die Ärzte und Wissenschaftler der
14.2 Patienteninformation und Protokoll der Patientenaufklärung
 DSHNHL 1999-1 mit Amendments 1-3 Version 10.1.1 vom 28.09.2005 14.2 Patienteninformation und Protokoll der Patientenaufklärung 80 Patienteninformation I 06841-16-23000 (Pforte der Klinik) Sehr geehrte
DSHNHL 1999-1 mit Amendments 1-3 Version 10.1.1 vom 28.09.2005 14.2 Patienteninformation und Protokoll der Patientenaufklärung 80 Patienteninformation I 06841-16-23000 (Pforte der Klinik) Sehr geehrte
Einverständnisserklärung
 Einverständnisserklärung Name: Vorname: Geb.:Datum: Wohnort: Strasse: Tel: Handynummer: Email: Hausarzt: Adresse: Krankenkasse: Größe Gewicht: Mein Termin ist am: Sind Sie von der Rezeptgebühr befrei?
Einverständnisserklärung Name: Vorname: Geb.:Datum: Wohnort: Strasse: Tel: Handynummer: Email: Hausarzt: Adresse: Krankenkasse: Größe Gewicht: Mein Termin ist am: Sind Sie von der Rezeptgebühr befrei?
Therapie mit Acitretin-haltigen Arzneimitteln: Was Sie wissen müssen
 Therapie mit Acitretin-haltigen Arzneimitteln: Was Sie wissen müssen Informationsbroschüre für männliche Patienten und Patientinnen, die nicht im gebärfähigen Alter sind Diese Informationsbroschüre wurde
Therapie mit Acitretin-haltigen Arzneimitteln: Was Sie wissen müssen Informationsbroschüre für männliche Patienten und Patientinnen, die nicht im gebärfähigen Alter sind Diese Informationsbroschüre wurde
Patienteninformation Lamotrigin Desitin 04/2007
 Information für Patientinnen und Patienten Lesen Sie diese Packungsbeilage sorgfältig, bevor Sie das Arzneimittel einnehmen bzw. anwenden. Dieses Arzneimittel ist Ihnen persönlich verschrieben worden und
Information für Patientinnen und Patienten Lesen Sie diese Packungsbeilage sorgfältig, bevor Sie das Arzneimittel einnehmen bzw. anwenden. Dieses Arzneimittel ist Ihnen persönlich verschrieben worden und
MediPreis Produktsteckbrief
 MediPreis Produktsteckbrief CETIRIZIN HEXAL TR B ALLER CETIRIZIN HEXAL Tropfen bei Allergien Hexal AG PZN: 02579607 Menge: 10 ml Art: Tropfen Link: https://www.medipreis.de/02579607 Anwendungsgebiete Das
MediPreis Produktsteckbrief CETIRIZIN HEXAL TR B ALLER CETIRIZIN HEXAL Tropfen bei Allergien Hexal AG PZN: 02579607 Menge: 10 ml Art: Tropfen Link: https://www.medipreis.de/02579607 Anwendungsgebiete Das
Mustertext. (Studienteilnehmer und schwangere Partnerin des Studienteilnehmers)
 Mustertext Klinische Prüfung von Arzneimitteln: Information und Einwilligungserklärung zur Nachverfolgung einer Schwangerschaft der Partnerin eines Studienteilnehmers und zur Gesundheit des Kindes (Studienteilnehmer
Mustertext Klinische Prüfung von Arzneimitteln: Information und Einwilligungserklärung zur Nachverfolgung einer Schwangerschaft der Partnerin eines Studienteilnehmers und zur Gesundheit des Kindes (Studienteilnehmer
Informationsbroschüre für Patienten Was Sie wissen müssen
 Europa hat Bedingungen für die Markteinführung des Arzneimittels VOLIBRIS gestellt (europaweit eingetragen). Dieser in Belgien und Luxemburg obligatorische Risikomanagementplan, zu dem dieses Informationsschreiben
Europa hat Bedingungen für die Markteinführung des Arzneimittels VOLIBRIS gestellt (europaweit eingetragen). Dieser in Belgien und Luxemburg obligatorische Risikomanagementplan, zu dem dieses Informationsschreiben
FORMULAR FÜR DEN START DER BEHANDLUNG MIT TYSABRI
 Die europäischen Gesundheitsbehörden haben für die Markteinführung von TYSABRI Bedingungen auferlegt. Dieser verpflichtende Plan zur Risikoeinschränkung in Belgien - zu dem diese Information gehört - ist
Die europäischen Gesundheitsbehörden haben für die Markteinführung von TYSABRI Bedingungen auferlegt. Dieser verpflichtende Plan zur Risikoeinschränkung in Belgien - zu dem diese Information gehört - ist
