Versuch 1: Rotkohl oder Blaukraut? Die Farbe des Rotkohlfarbstoffes in Abhängigkeit vom ph-wert
|
|
|
- Walther Rosenberg
- vor 7 Jahren
- Abrufe
Transkript
1 1
2 Versuch 1: Rotkohl oder Blaukraut? Die Farbe des Rotkohlfarbstoffes in Abhängigkeit vom ph-wert Durchführung: Rotkohlblätter werden in kleine Streifen geschnitten und einige Minuten ausgekocht. Anschließend wird die stark gefärbte Lösung durch ein Tuch filtriert. Der erhaltene Rotkohlextrakt wird für alle folgenden Versuche eingesetzt. In acht Reagenzgläser werden je 3 Milliliter Rotkohlsaft gegeben. Anschließend wird bis zur Hälfte mit Wasser aufgefüllt. Dann geben wir in die Reagenzgläser: a) farblosen Essig (ph = 3,0) b) frisch gepressten Zitronensaft (ph = 2,4) c) frisch gepressten Apfelsaft (ph = 4,53) d) Geschirrspülmittel (ph = 6,7) e) Weißwein (ph = 3,48) f) Backpulver (ph = 7,3) g) Vollwaschmittel (ph = 10,6) h) Pulver für die Geschirrspülmaschine (ph = 8,9) Danach werden die Reagenzgläser mit Stopfen verschlossen und geschüttelt. Nach einigen Minuten werden sie fotografiert. Die ph-werte werden mit einem ph-meter gemessen (s.o.). Abb. 1: Rotkohlextrakt mit Haushaltschemikalien: von links nach rechts Lösungen a - h (siehe oben) Beobachtung: In Abhängigkeit vom ph-wert treten unterschiedliche Farben auf. Der Rotkohlsaft ist bei niedrigen ph-werten (in Säuren) rot, bei höheren ph-werten (in Laugen) lila, blau, grün und schließlich gelb. Ergebnis: Der Rotkohlfarbstoff ändert seine Farbe in Abhängigkeit vom ph-wert. Rotkohlfarbstoff ist ein ph-indikator. Die Lösungen in den Reagernzgläsern a,b,c, e sind Säuren, die Lösungen d ist schwach sauer, Lösung f leicht alkalisch. Die Lösungen g und h sind Laugen. 2
3 Zusatzversuch: Rotkohlextrakt wird in Pufferlösungen mit unterschiedlichen ph-werten gegeben: Zu den ph-werten der Pufferlösungen siehe Bildunterschrift. Wir wollen dadurch klare Lösungen für eine photometrische Untersuchung erhalten. Abb. 2: Rotkohlextrakt in Lösungen mit den ph-werten 1, 2, 4, 7, 9, 11 (von links nach rechts) Beobachtung: Bei ph = 1 und ph = 2 ist die Lösung rot, bei ph = 4 pink, bei ph = 7 lila, bei ph = 9 blau, bei ph = 11 grün. Nach längerem Stehen verfärbt sich die grüne Lösung bei ph = 11 gelb. Ergebnis: Die Farbveränderungen sind bei den Pufferlösungen und den Haushaltschemikalien ähnlich. Das bestätigt unsere Deutung, dass die Farbe des Rotkohlfarbstoffes vom ph-wert abhängt. Die Grünfärbung entsteht, weil gelbe neben blauen Farbstoffen vorliegen. Nach einiger Zeit wandelt sich der blaue Farbstoff völlig in den gelben um. Fotometrie: Mit einem Fotometer werden Absorptionsspektren der Farbstofflösungen in den Pufferlösungen mit unterschiedlichen ph-werten aufgenommen: Die Lösung bei ph = 11 ist zum Zeitpunkt der Untersuchung bereits gelb. 2,5 E [ ] 2 1,5 1 ph 1 ph 2 ph 4 ph 7 ph 9 ph 11 0, Wellenlänge [nm] Abb. 3: Absorptionsspektren bei unterschiedlichen ph-werten 3
4 Ergebnis: Das Absorptionsverhalten des Rotkohlfarbstoffes ändert sich mit dem ph-wert. Der rote Farbstoff absorbiert vor allem bei etwa 500 nm. Die Absorption des pinken Farbstoffes liegt etwas höher (530 nm). Der lila und der blaue Farbstoff absorbieren um 600 nm. Der gelbe Farbstoff absorbiert v.a. bei 400 nm. Sichtbar wird jeweils die Komplementärfarbe der absorbierten Farbe. Weiter führende Informationen zu den bisher beschriebenen Experimenten: In Rotkohl ist der Farbstoff Cyanin enthalten. Das Molekül besteht aus Cyanidin, das mit zwei Zuckermolekülen verknüpft ist. Dieser Farbstoff besitzt bei unterschiedlichen ph- Werten unterschiedliche Strukturen. Bei hohen ph-werten wandelt sich der blaue Farbstoff langsam in einen gelben um. Bild In vielen Blütenblättern und roten Früchten sind ähnliche Farbstoffe enthalten. Tabelle Abb. 4: Struktur des Cyanidinmoleküls bei unterschiedlichen ph-werten 4
5 Versuch 2: Rotkohl unter Spannung Durchführung: Ein gefaltetes Papiertaschentuch wird in zwei Hälften geschnitten. Danach wird das eine mit rot gefärbtem Rotkohlsaft (angesäuert mit Speiseessig) und das andere in frisch ausgekochtem Rotkohlsaft (lila) getränkt. Es werden je zwei Kupferelektroden parallel auf das Papier gelegt. Dann werden diese an eine Gleichspannungsquelle bei etwa 4,5 Volt für ca. 10 Minuten angeschlossen Abb 5 a: Rotes Taschentuch während des Versuchs Abb 5 b: Blaues Taschentuch während des Versuchs Abb 5 c: Blaues Taschentuch nach dem Versuch (getrocknet) Beobachtung: Bei dem Versuch tritt nach einigen Minuten am Pluspol jeweils eine Blaufärbung auf. Diese ist bei der angesäuerten Lösung ausgeprägter. Am Minuspol verfärbt sich der Farbstoff jeweils grün. Der Bereich des Minuspols verfärbt sich nach einigen Stunden bei dem Ansatz, in dem der nicht angesäuerte Rotkohlextrakt verwendet wurde, gelb. Deutung: Die Blaufärbung deutet darauf hin, dass am Pluspol jeweils das Farbstoff-Anion angereichert wird oder entsteht. Am Minuspol bildet sich die gelbe Form des Farbstoffes. Diese tritt bei hohen ph-werten auf. Bei der Elektrolyse werden am Minuspol Protonen verbraucht. Deshalb steigt dort der ph-wert: 2 H + + 2e - H 2 Zunächst überlagert sich die gelbe Farbe noch mit der des blauen Farbstoffes. Die Umgebung des Minuspols färbt sich zuerst grün. Nach längerer Zeit wandeln sich alle Farbstoffe in der Nähe des Minuspols in die gelbe Form um. 5
6 Versuch 3: Ionenwanderung: Durchführung: Mit Essig angesäuerter Rotkohlsaft wird in den mittleren Schenkel eines dreischenkligen U-Rohres gefüllt. In den äußeren Schenkeln befindet sich Essig. In die äußeren Schenkel werden Grafitelektroden getaucht. eine Gleichspannung von 20 V wird angelegt. + - Abb. 6: Ionenwanderung Beobachtung: Der rote Farbstoff wandert in Richtung Minuspol. Deutung: Bei den Molekülen des roten Farbstoffes handelt es sich um Kationen. Dieses Deutung wird durch Abb. 4 bestätigt. Ergänzung: Die gelbe Lösung bei hohen ph-werten wird ebenfalls untersucht. Es tritt keine Ionenwanderung auf. Die Moleküle des gelben Farbstoffes tragen keine Ladung. Abb 7: Gelbe Form des Farbstoffes (Chalcon) 6
7 Versuch 4: Komplexbildung: Durchführung: Rotkohlextrakt wird in einer Pufferlösung mit dem ph-wert 5,7 gelöst. Die Lösung wird auf vier Reagenzgläser verteilt. Man gibt in Reagenzglas 2 eine Spatelspitze Magnesiumchlorid, in Reagenzglas 3 Eisen-III-chlorid und zu Reagenzglas 4 Kaliumaluminiumsulfat. Abb. 8: Rotkohlextrakt bei ph = 5,7 von links nach rechts: ohne Zusatz, mit Magnesiumchlorid, mit Eisen-III-chlorid, mit Kaliumaluminiumsulfat Beobachtung: In Reagenzglas 2 tritt keine Verfärbung auf, der Inhalt von Reagenzglas 3 färbt sich violett, der von Reagenzglas 4 blau. Deutung: Anthocyane bilden mit einigen Metallionen Komplexverbindungen. Dabei treten Farbänderungen auf. Hier bildet Cyanidin Komplexe mit Fe 3+ - und Al 3+ -Ionen. Zusatzinformation: Gärtner nutzen diese Reaktion aus, wenn sie bei Hortensien dem Gießwasser Eisen- oder Aluminiumsalze zufügen und so Blaufärbung der Blüten erreichen. Abb. 9: Komplexbildung des Cyanidins mit Aluminiumionen 7
8 Versuch 5: Chromatographie: Durchführung: In die Mitte von Rundfiltern wird jeweils mit dem Rotkohlextrakt ein etwa 0,5 cm breiter Farbklecks aufgetragen. Dann wird verschiedene Laufmittel tropfenweise langsam in die Mitte des Farbkleckses gegeben, so dass dieser langsam verläuft. Da im Unterricht in unserer Klasse viele Arbeitsgruppen tätig sind, werden viele verschiedene Lösungsmittelgemische (aus Wasser, Ethanol, Aceton, Natronlauge und Weinsäure) getestet Abb. 10: Ergebnisse der Chromatographieversuche Beobachtung: Mit einigen Lösungsmitteln kann man deutlich zwei Farbzonen unterscheiden. Die besten Trennergebnisse erhalten wir mit Weinsäurelösung der Konzentration 0.01 mol/l. Abb. 11: Ergebnis der Chromatographie mit Weinsäurelösung Deutung: Rotkohlsaft enthält (vermutlich) zwei Anthocyane. Eine Zufallsentdeckung: Beim Bestrahlen der Chromatogramme stellten wir fest, dass der gelbe Farbstoff hell leuchtete. Dieses Phänomen heißt Fluoreszenz. Abb. 12: Fluoreszenz des gelben Farbstoffes (vgl. mit Bild 10 unten rechts) Versuch 6: Mikroskopie 8
9 Durchführung: Von Unterseite eines Rotkohlblattes wird mit einer Rasierklinge eine dünne Schicht abgetrennt und auf einen Objektträger in einen Tropfen Wasser gegeben. Ein Deckgläschen wird aufgelegt. Das mikroskopische Bild wird mit einer Digitalkamera fotografiert. Abb. 13: Rotkohlzellen unter dem Mikroskop (Vergrößerung ca. 800fach) Beobachtung: Die Zellen erscheinen im Mikroskop nahezu vollständig rot gefärbt. In der Abbildung 13 ist außerdem eine Spaltöffnung zu erkennen - eine typische Blattstruktur. Deutung: Rotkohlfarbstoffe befinden sich in den Vakuolen der Zellen. Das ist typisch für wasserlösliche Farbstoffe. Die Vakuolen nehmen nahezu den gesamten Zellinnenraum ein. Versuch 7: Anthocyane bei anderen Pflanzen: 9
10 Durchführung: In unserer Klasse werden Arbeitsgruppen gebildet. Jede dieser Gruppen mörsert rote oder blaue Blütenblätter verschiedener Pflanzen mit Wasser und etwas Seesand. Anschließend wird filtriert. Die Filtrate werden auf jeweils drei Reagenzgläser verteilt. In eines der Reagenzgläser (auf allen Abbildungen das linke) wird verdünnte Salzsäure, in ein anderes (jeweils das rechte) Natronlauge gegeben. In das mittlere Reagenzglas kommt etwas Pufferlösung (ph = 7). Beobachtung: In (fast) allen Fällen erhalten wir gleichartige Farben. Die sauren Lösungen sind - wie beim Rotkohl - jeweils rot, die alkalischen grün oder gelb. Nach einiger Zeit verfärbten sich alle alkalischen Lösungen gelb. Abb 14: Auswahl von Versuchsergebnissen unserer Klasse 10
11 Deutung: In vielen rot oder blau gefärbten Blütenblättern befinden sich ähnliche Farbstoffe. Diese Farbstoffe bezeichnet man als Anthocyane. Sie unterscheiden sich nur durch wenige Seitenketten oder durch die Zucker, mit denen sie verknüpft sind. Wegen ihrer strukturellen Ähnlichkeit verhalten sich die Farbstoffe auch chemisch ähnlich. Abb 15: Strukturformeln und Vorkommen von Anthocyanen (Die meisten uns bekannten Literaturstellen gehen davon aus, dass Cyanidin und nicht Petunidin das Haupt-Anthocyan des Rotkohls ist). Tabelle aus PdN-ChS 7/49 Jg Literaturangaben: Verwendet wurden v.a. [ 1] Haas,Ll: Anthocyane - faszinierende Statiomnen in gekoppelten Biosynthesewegen; in: PdN-ChiS 7/49. Jg [ 2] Korhammer, H., Pfeifer,P.: Experimente mit Anthocyanen - eine Grundlage für Schülerübungen in: NiU-Chemie 10 /1999 Nr. 52 [ 3] verschiedene Internetseiten Die Abb. 4, 7, 9, 15 stammen aus [ 1] 11
Essigsäure färbt ph-papier rot. Natronlauge färbt ph-papier blau
 5. SÄUREN UND BASEN ARBEITSBLATT 5.1 WAS SIND INDIKATOREN? DER PH-WERT SÄUREN und BASEN sind Stoffe die sich gegenseitig in ihrer Wirkung aufheben. INDIKATOREN sind Farbstoffe, die über Farbänderungen
5. SÄUREN UND BASEN ARBEITSBLATT 5.1 WAS SIND INDIKATOREN? DER PH-WERT SÄUREN und BASEN sind Stoffe die sich gegenseitig in ihrer Wirkung aufheben. INDIKATOREN sind Farbstoffe, die über Farbänderungen
Rosa Geheimschrift. Durchführung
 Name: Datum: Materialien verschiedene Papiersorten (auch Filterpapier), Pinsel, Wattestäbchen, Fön, Lösung F (Phenolphthalein-Lösung: 0,1 g/100 ml Ethanol), Lösung G (Natriumcarbonat-Lösung: 1 g/100 ml)
Name: Datum: Materialien verschiedene Papiersorten (auch Filterpapier), Pinsel, Wattestäbchen, Fön, Lösung F (Phenolphthalein-Lösung: 0,1 g/100 ml Ethanol), Lösung G (Natriumcarbonat-Lösung: 1 g/100 ml)
Carbonat, Hydrogencarbonat
 Chlorid a) Die Lösung die einer Menge Substanz, die etwa 2 mg Chlorid entspricht, in 2 ml Wasser R oder 2 ml der vorgeschrieben Lösung werden verwendet. Diese Lösung wird mit verdünnter Salpetersäure R
Chlorid a) Die Lösung die einer Menge Substanz, die etwa 2 mg Chlorid entspricht, in 2 ml Wasser R oder 2 ml der vorgeschrieben Lösung werden verwendet. Diese Lösung wird mit verdünnter Salpetersäure R
Schulversuchspraktikum. Isabel Großhennig. Sommersemester Klassenstufen 11 & 12. Farbstoffe. Kurzprotokoll
 Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 11 & 12 Farbstoffe Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll für die Klassenstufen 11 und 12 zum Thema Farbstoffe enthält
Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 11 & 12 Farbstoffe Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll für die Klassenstufen 11 und 12 zum Thema Farbstoffe enthält
Qualitative Nachweise von Säuren und Basen
 Schulversuchspraktikum Miriam Jarrar Sommersemester 2012 Klassenstufen 9 & 10 Qualitative Nachweise von Säuren und Basen Auf einen Blick: Dieses Protokoll beinhaltet 3 Lehrerversuche und 2 Schülerversuche
Schulversuchspraktikum Miriam Jarrar Sommersemester 2012 Klassenstufen 9 & 10 Qualitative Nachweise von Säuren und Basen Auf einen Blick: Dieses Protokoll beinhaltet 3 Lehrerversuche und 2 Schülerversuche
Säure-Base-Indikatoren und ph-skala
 Säure-Base-Indikatoren und ph-skala Stand: 09.08.2017 Jahrgangsstufen 11/12 Fach/Fächer Übergreifende Bildungsund Erziehungsziele Zeitrahmen Benötigtes Material Chemie Alltagskompetenz und Lebensökonomie
Säure-Base-Indikatoren und ph-skala Stand: 09.08.2017 Jahrgangsstufen 11/12 Fach/Fächer Übergreifende Bildungsund Erziehungsziele Zeitrahmen Benötigtes Material Chemie Alltagskompetenz und Lebensökonomie
Versuche zur Untersuchung von Fruchtfarbstoffen
 Versuche zur Untersuchung von Fruchtfarbstoffen Durchgeführt und protokolliert von: Annika Bauland, Corinna Brockers, Anne Jonas, Isabelle Schmidt 1.Versuch: Dünnschichtchromatographie Für diesen Versuch
Versuche zur Untersuchung von Fruchtfarbstoffen Durchgeführt und protokolliert von: Annika Bauland, Corinna Brockers, Anne Jonas, Isabelle Schmidt 1.Versuch: Dünnschichtchromatographie Für diesen Versuch
Saure, neutrale und alkalische Reaktionen von Salzlösungen (Artikelnr.: P )
 Saure, neutrale und alkalische Reaktionen von Salzlösungen (Artikelnr.: P1145600) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Anorganische Chemie Unterthema:
Saure, neutrale und alkalische Reaktionen von Salzlösungen (Artikelnr.: P1145600) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Anorganische Chemie Unterthema:
Laborprotokoll Qualitative Analyse Ralph Koitz, Einzelsalz
 1. Einzelsalz Aufgabenstellung: Nasschemische qualitative Analyse eines anorganischen Einzelsalzes. o Farblose, grobkörnige Kristalle o Flammenfärbung: leicht orange, nicht charakteristisch da vermutlich
1. Einzelsalz Aufgabenstellung: Nasschemische qualitative Analyse eines anorganischen Einzelsalzes. o Farblose, grobkörnige Kristalle o Flammenfärbung: leicht orange, nicht charakteristisch da vermutlich
Schulversuchspraktikum. Jans Manjali. Sommersemester Klassenstufen 9 & 10. Titration. Kurzprotokoll
 Schulversuchspraktikum Jans Manjali Sommersemester 2015 Klassenstufen 9 & 10 Titration Kurzprotokoll Auf einen Blick: Die hier vorgestellte Argentometrie ist eine Fällungstitration, bei der Silberionen
Schulversuchspraktikum Jans Manjali Sommersemester 2015 Klassenstufen 9 & 10 Titration Kurzprotokoll Auf einen Blick: Die hier vorgestellte Argentometrie ist eine Fällungstitration, bei der Silberionen
Saure, neutrale und alkalische Lösungen
 Schulversuchspraktikum Sina Bachsmann Sommersemester 2014 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Im Folgenden
Schulversuchspraktikum Sina Bachsmann Sommersemester 2014 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Im Folgenden
Schulversuchspraktikum Großtechnische Elektrolyseverfah- ren/galvanisierung Kurzprotokoll
 Schulversuchspraktikum Johanna Osterloh Sommersemester 2015 Klassenstufen 11 & 12 Großtechnische Elektrolyseverfahren/Galvanisierung Kurzprotokoll Auf einen Blick: Das folgende Protokoll enthält einen
Schulversuchspraktikum Johanna Osterloh Sommersemester 2015 Klassenstufen 11 & 12 Großtechnische Elektrolyseverfahren/Galvanisierung Kurzprotokoll Auf einen Blick: Das folgende Protokoll enthält einen
Stoffeigenschaften auf der Spur
 Stoffeigenschaften auf der Spur Station 1 Welche Stoffe sind magnetisch? Sicherheit Entsorgung:/ Prüfe, welche Stoffe vom Magneten angezogen werden! Trage deine Beobachtungen in die Tabelle in deinem Forscherbuch
Stoffeigenschaften auf der Spur Station 1 Welche Stoffe sind magnetisch? Sicherheit Entsorgung:/ Prüfe, welche Stoffe vom Magneten angezogen werden! Trage deine Beobachtungen in die Tabelle in deinem Forscherbuch
Licht und Farben. Kurzprotokoll
 Schulversuchspraktikum Name: Annika Münch Semester: 2. Mastersemester Klassenstufen 5/6 Licht und Farben Kurzprotokoll Auf einen Blick: Für eine Unterrichtseinheit zum Thema Licht und Farben im naturwissenschaftlichen
Schulversuchspraktikum Name: Annika Münch Semester: 2. Mastersemester Klassenstufen 5/6 Licht und Farben Kurzprotokoll Auf einen Blick: Für eine Unterrichtseinheit zum Thema Licht und Farben im naturwissenschaftlichen
Von Arrhenius zu Brönsted
 Schulversuchspraktikum Name Annika Münch Sommersemester 2015 Klassenstufen 9/10 Von Arrhenius zu Brönsted Kurzprotokoll Auf einen Blick: Für die Unterrichtseinheit zum Themas Säure-Base-Konzepte und im
Schulversuchspraktikum Name Annika Münch Sommersemester 2015 Klassenstufen 9/10 Von Arrhenius zu Brönsted Kurzprotokoll Auf einen Blick: Für die Unterrichtseinheit zum Themas Säure-Base-Konzepte und im
KORROSION UND KORROSIONSSCHUTZ VON METALLEN
 11. Einheit: KORROSION UND KORROSIONSSCHUTZ VON METALLEN Sebastian Spinnen, Ingrid Reisewitz-Swertz 1 von 16 ZIELE DER HEUTIGEN EINHEIT Am Ende der Einheit Korrosion und Korrosionsschutz von Metallen..
11. Einheit: KORROSION UND KORROSIONSSCHUTZ VON METALLEN Sebastian Spinnen, Ingrid Reisewitz-Swertz 1 von 16 ZIELE DER HEUTIGEN EINHEIT Am Ende der Einheit Korrosion und Korrosionsschutz von Metallen..
Martin Raiber Chemie Protokoll Nr Gruppe 2 (Schrankseite) Untersuchung von Glycin
 Martin Raiber Chemie Protokoll Nr.4 5.3.2006 Gruppe 2 (Schrankseite) Untersuchung von Glycin Chemikalien: Glycin ( c=0,1 mol/l ) Essigsäure ( c=0,1 mol/l ) 0,75g Glycin Salzsäure ( 100ml, c=0,1 mol/l )
Martin Raiber Chemie Protokoll Nr.4 5.3.2006 Gruppe 2 (Schrankseite) Untersuchung von Glycin Chemikalien: Glycin ( c=0,1 mol/l ) Essigsäure ( c=0,1 mol/l ) 0,75g Glycin Salzsäure ( 100ml, c=0,1 mol/l )
Untersuche die Wirkung verschiedener Säuren und Laugen auf natürliche und industriell hergestellte Indikatoren.
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - 1 Säuren (P7157400) 1.5 Wirkung von Säuren und Laugen auf natürliche und technische Indikatoren Experiment von: Phywe Gedruckt: 15.10.2013 11:37:56
Naturwissenschaften - Chemie - Säuren, Basen, Salze - 1 Säuren (P7157400) 1.5 Wirkung von Säuren und Laugen auf natürliche und technische Indikatoren Experiment von: Phywe Gedruckt: 15.10.2013 11:37:56
Klasse. Schule. Name. Datum. Seite 1
 Schule Name Klasse Datum Seite 1 Inhaltsverzeichnis 1. Reagenzglasständer aus Gips Seite 3 2. Klebstoff aus Milch Seite 4 3. Rotkohl oder Blaukraut? Seite 6 4. Farben mischen und trennen Seite 8 Viel Spaß
Schule Name Klasse Datum Seite 1 Inhaltsverzeichnis 1. Reagenzglasständer aus Gips Seite 3 2. Klebstoff aus Milch Seite 4 3. Rotkohl oder Blaukraut? Seite 6 4. Farben mischen und trennen Seite 8 Viel Spaß
Experiment: Synthese von Gold-Nanopartikeln (Klasse 9)
 Experiment: Synthese von Gold-Nanopartikeln (Klasse 9) Chemikalien Gold(III)-chlorid-Lösung c = 0,000 44 mol/l Natriumcitrat-Lösung c = 1 % Geräte siedendes Wasserbad, Reagenzgläser, Messpipette 10 ml,
Experiment: Synthese von Gold-Nanopartikeln (Klasse 9) Chemikalien Gold(III)-chlorid-Lösung c = 0,000 44 mol/l Natriumcitrat-Lösung c = 1 % Geräte siedendes Wasserbad, Reagenzgläser, Messpipette 10 ml,
ph-wert ph-wert eine Kenngröße für saure, neutrale oder basische Lösungen
 ph-wert ph-wert eine Kenngröße für saure, neutrale oder basische Lösungen ChemikerInnen verwenden den ph-wert um festzustellen, wie sauer oder basisch eine Lösung ist. Man verwendet eine Skala von 0-14:
ph-wert ph-wert eine Kenngröße für saure, neutrale oder basische Lösungen ChemikerInnen verwenden den ph-wert um festzustellen, wie sauer oder basisch eine Lösung ist. Man verwendet eine Skala von 0-14:
Dokumentation Projekt Entwicklung einer Farbskala PLUS-Kurs SU 4+, GGS Vaalserquartier, Aachen
 Die Arbeitsgruppe Die Gemeinschaftsgrundschule Vaalserquartier ist eine zweizügige Grundschule im westlichsten Stadtteil von Aachen, 400 m von der Grenze zu den Niederlanden gelegen. Sie hat 230 SchülerInnen
Die Arbeitsgruppe Die Gemeinschaftsgrundschule Vaalserquartier ist eine zweizügige Grundschule im westlichsten Stadtteil von Aachen, 400 m von der Grenze zu den Niederlanden gelegen. Sie hat 230 SchülerInnen
4. Phthaleine 4.1. Mit den Triphenylmethanfarbstoffen eng verwandt sind die Phthaleine, deren Synthese vom Phthalsäureanhydrid
 4. Phthaleine 4.1 Phthaleine Mit den Triphenylmethanfarbstoffen eng verwandt sind die Phthaleine, deren Synthese vom Phthalsäureanhydrid ausgeht. Phenolphthalein erhält man durch Zusammenschmelzen von
4. Phthaleine 4.1 Phthaleine Mit den Triphenylmethanfarbstoffen eng verwandt sind die Phthaleine, deren Synthese vom Phthalsäureanhydrid ausgeht. Phenolphthalein erhält man durch Zusammenschmelzen von
Chemiebuch Elemente Lösungen zu Aufgaben aus Kapitel 13
 Kantonsschule Kreuzlingen, Klaus Hensler Chemiebuch Elemente Lösungen zu Aufgaben aus Kapitel 13 Grundregeln für stöchiometrische Berechnungen Wenn es um Reaktionen geht zuerst die chem. Gleichung aufstellen
Kantonsschule Kreuzlingen, Klaus Hensler Chemiebuch Elemente Lösungen zu Aufgaben aus Kapitel 13 Grundregeln für stöchiometrische Berechnungen Wenn es um Reaktionen geht zuerst die chem. Gleichung aufstellen
ATTO 565 und ATTO 590
 ATTO 565 und ATTO 590 Allgemeine Informationen ATTO 565 und ATTO 590 sind Fluoreszenzmarker aus der Familie der Rhodamin-Farbstoffe. Diese Farbstoffe besitzen als gemeinsames Strukturelement einen Carboxyphenyl-
ATTO 565 und ATTO 590 Allgemeine Informationen ATTO 565 und ATTO 590 sind Fluoreszenzmarker aus der Familie der Rhodamin-Farbstoffe. Diese Farbstoffe besitzen als gemeinsames Strukturelement einen Carboxyphenyl-
Ligandenaustausch am Chrom(III)-ion. Gefährdungsbeurteilung. Lehrerexperiment. Schülerexperiment
 Ligandenaustausch am Chrom(III)-ion keine! Chrom(III)-chlorid-Lösung (0,1 mol/l) R-Sätze: 22 S-Sätze: 24-25 Ammoniak-Lösung (20%ig) Eine Chrom(III)-chloridlösung wird im Reagenzglas tropfenweise bis zur
Ligandenaustausch am Chrom(III)-ion keine! Chrom(III)-chlorid-Lösung (0,1 mol/l) R-Sätze: 22 S-Sätze: 24-25 Ammoniak-Lösung (20%ig) Eine Chrom(III)-chloridlösung wird im Reagenzglas tropfenweise bis zur
3. Lichtabhängige Reaktionen
 3. Lichtabhängige Reaktionen Problem: Wie wird die elektromagnetische Strahlung des Sonnenlichts in chemisch verwertbare Energie umgewandelt? Um die Lichtenergie chemisch nutzbar zu machen, muss elektromagnetische
3. Lichtabhängige Reaktionen Problem: Wie wird die elektromagnetische Strahlung des Sonnenlichts in chemisch verwertbare Energie umgewandelt? Um die Lichtenergie chemisch nutzbar zu machen, muss elektromagnetische
Protokoll Kurstag 7. Blatt & Blattpigmente. 1) Einleitung
 Datum: 10.12.09 Protokoll Kurstag 7 Blatt & Blattpigmente 1) Einleitung Einige Pflanzenzellen enthalten spezielle Farbstoffe (Pigmente), um Fotosynthese betreiben zu können, zum Schutz vor UV-Strahlung
Datum: 10.12.09 Protokoll Kurstag 7 Blatt & Blattpigmente 1) Einleitung Einige Pflanzenzellen enthalten spezielle Farbstoffe (Pigmente), um Fotosynthese betreiben zu können, zum Schutz vor UV-Strahlung
SÄUR E. BASE oder LAU GE SAUE R BASI SCH
 SÄUR E BASE oder LAU GE SAUE R BASI SCH INDIKATOR (Ital. indicare, heißt zeigen oder anzeigen) Das Forscherlabor Wir treiben es bunt im Forscherlabor Rechtenthal in Tramin! Datum: Name:. Klasse: Lehrpersonen:
SÄUR E BASE oder LAU GE SAUE R BASI SCH INDIKATOR (Ital. indicare, heißt zeigen oder anzeigen) Das Forscherlabor Wir treiben es bunt im Forscherlabor Rechtenthal in Tramin! Datum: Name:. Klasse: Lehrpersonen:
Arbeitsblatt Wie entstehen Farben?
 Arbeitsblatt Wie entstehen Farben? Der für das menschliche Auge sichtbare Wellenlängenbereich liegt bei 380-750 nm. Farbstoffe sind in der Lage bestimmte Wellenlängen des Lichts zu absorbieren und eine
Arbeitsblatt Wie entstehen Farben? Der für das menschliche Auge sichtbare Wellenlängenbereich liegt bei 380-750 nm. Farbstoffe sind in der Lage bestimmte Wellenlängen des Lichts zu absorbieren und eine
Fortbildung am Schülerlabor in Rechtenthal für die Grundschule. Ideen zu weiterführenden Versuchen in der Klasse:
 Fortbildung am 16.11.2012 Schülerlabor in Rechtenthal für die Grundschule Ideen zu weiterführenden Versuchen in der Klasse: Lernziele: -Die Kinder erkennen chemische, physikalische Veränderungen (auch
Fortbildung am 16.11.2012 Schülerlabor in Rechtenthal für die Grundschule Ideen zu weiterführenden Versuchen in der Klasse: Lernziele: -Die Kinder erkennen chemische, physikalische Veränderungen (auch
*** Bunter Farbenzauber mit Rotkohlsaft ***
 *** Bunter Farbenzauber mit Rotkohlsaft *** Experimentier-Anleitung Willst du ganz einfach, aber spannend und farbig experimentieren? Pink, gelb, grün, blau, violett Mit Rotkohl, Zitronensaft, Duschgel,
*** Bunter Farbenzauber mit Rotkohlsaft *** Experimentier-Anleitung Willst du ganz einfach, aber spannend und farbig experimentieren? Pink, gelb, grün, blau, violett Mit Rotkohl, Zitronensaft, Duschgel,
Darstellung von Phenolphthalein und Fluorescein
 Philipps-Universität Marburg 04. Juli 2007 Fachbereich 15: Chemie rganisch-chemisches Grundpraktikum für Lehramtskandidaten Praktikumsleiter: Dr. Philipp Reiß SS 2007 Mario Gerwig Versuch: Darstellung
Philipps-Universität Marburg 04. Juli 2007 Fachbereich 15: Chemie rganisch-chemisches Grundpraktikum für Lehramtskandidaten Praktikumsleiter: Dr. Philipp Reiß SS 2007 Mario Gerwig Versuch: Darstellung
Qualitative Kationen und Anionenanalyse
 Qualitative Kationen und Anionenanalyse Die Aufgabe: Die Proben: Ihr müsst mindestens zwei unbekannte Salze mit Hilfe von verschiedenen Tests identifizieren. Die Salze die ihr identifizieren müsst, können
Qualitative Kationen und Anionenanalyse Die Aufgabe: Die Proben: Ihr müsst mindestens zwei unbekannte Salze mit Hilfe von verschiedenen Tests identifizieren. Die Salze die ihr identifizieren müsst, können
Ist eine Farbe nur EINE Farbe?
 Name: Datum: Ist eine Farbe nur EINE Farbe? Materialien: Fruchtzwerge-Becher Rundfilter mit Loch rechteckiges Filterpapier verschiedene (möglichst auch schwarz) Schere Wasser Versuch 1: 1. Male mit verschiedenen
Name: Datum: Ist eine Farbe nur EINE Farbe? Materialien: Fruchtzwerge-Becher Rundfilter mit Loch rechteckiges Filterpapier verschiedene (möglichst auch schwarz) Schere Wasser Versuch 1: 1. Male mit verschiedenen
Übungsaufgabe 1. Photometrische Bestimmung von Chrom als Chromat Chemikalien: H 2 O 2, Natronlauge, Chrom-(III)-salz
 Übungsaufgabe 1 Photometrische Bestimmung von Chrom als Chromat Chemikalien: H 2 O 2, Natronlauge, Chrom-(III)-salz Versuchsbeschreibung: 20 ml der erhaltenen Probelösung werden in ein 150 ml Becherglas
Übungsaufgabe 1 Photometrische Bestimmung von Chrom als Chromat Chemikalien: H 2 O 2, Natronlauge, Chrom-(III)-salz Versuchsbeschreibung: 20 ml der erhaltenen Probelösung werden in ein 150 ml Becherglas
Entscheide bei jeder Aussage, ob es eine reine Beobachtung ist oder nicht, und kreuze an!
 Kerze Eine brennende Kerze wandelt Energie und Stoffe um. N_9d_44 Über eine brennende Rechaudkerze (Teelicht) wird ein «leeres» Glas gestülpt. Schülerinnen und Schüler notieren Aussagen zum Versuch. Entscheide
Kerze Eine brennende Kerze wandelt Energie und Stoffe um. N_9d_44 Über eine brennende Rechaudkerze (Teelicht) wird ein «leeres» Glas gestülpt. Schülerinnen und Schüler notieren Aussagen zum Versuch. Entscheide
Wirkung von Säuren und Laugen auf natürliche und technische Indikatoren (Artikelnr.: P )
 Lehrer-/Dozentenblatt Wirkung von Säuren und Laugen auf natürliche und technische Indikatoren (Artikelnr.: P7510200) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema:
Lehrer-/Dozentenblatt Wirkung von Säuren und Laugen auf natürliche und technische Indikatoren (Artikelnr.: P7510200) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema:
Säuren und Basen. Dr. Torsten Beweries AC I - Allgemeine Chemie LAC-CH01 WS 2016/17.
 Säuren und Basen Dr. Torsten Beweries AC I - Allgemeine Chemie LAC-CH01 WS 2016/17 torsten.beweries@catalysis.de http://www.catalysis.de/forschung/koordinationschemische-katalyse/koordinationschemische-wasserspaltung/
Säuren und Basen Dr. Torsten Beweries AC I - Allgemeine Chemie LAC-CH01 WS 2016/17 torsten.beweries@catalysis.de http://www.catalysis.de/forschung/koordinationschemische-katalyse/koordinationschemische-wasserspaltung/
STICKOXIDE. Braunes Giftgas
 STICKOXIDE Braunes Giftgas Stativmaterial Standzylinder, Deckglas Brenner Reagenzglas, gebohrter Stopfen Winkelrohr Spatel weißes Papier Aktivkohle, Blei(II)-nitrat, Glycerin Baue das Experiment nach Abbildung
STICKOXIDE Braunes Giftgas Stativmaterial Standzylinder, Deckglas Brenner Reagenzglas, gebohrter Stopfen Winkelrohr Spatel weißes Papier Aktivkohle, Blei(II)-nitrat, Glycerin Baue das Experiment nach Abbildung
Versuch: Fünf Farben in einer Lösung
 Name: Datum: Versuch: Materialien: 5 x 100 ml Bechergläser (nummeriert von 1-5), Tropfpipetten, Messzylinder (50 ml), Spritzflasche mit destilliertem Wasser Chemikalien: Lösung Nr. 1: Lösung Nr. 2: Lösung
Name: Datum: Versuch: Materialien: 5 x 100 ml Bechergläser (nummeriert von 1-5), Tropfpipetten, Messzylinder (50 ml), Spritzflasche mit destilliertem Wasser Chemikalien: Lösung Nr. 1: Lösung Nr. 2: Lösung
Untersuche die Wirkung von verschiedenen Säuren auf Gemüse- und Blütenfarbstoffe.
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - 1 Säuren (P7157300) 1.4 Die Wirkung von Säuren auf Indikatoren Experiment von: Phywe Gedruckt: 15.10.2013 11:36:51 intertess (Version 13.06 B200, Export
Naturwissenschaften - Chemie - Säuren, Basen, Salze - 1 Säuren (P7157300) 1.4 Die Wirkung von Säuren auf Indikatoren Experiment von: Phywe Gedruckt: 15.10.2013 11:36:51 intertess (Version 13.06 B200, Export
Analytische Chemie. B. Sc. Chemieingenieurwesen. 14. März Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 14. März 2007 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 14. März 2007 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
3-01. Triphenylmethan
 Triphenylmethan 3-01 Triphenylmethan ist ein farbloser Feststoff. Die Verbindung kann aus Benzol und Trichlormethan durch FRIEDL-CRAFTS-Alkylierung (elektrophile Substitution) hergestellt werden. Die H-Atome
Triphenylmethan 3-01 Triphenylmethan ist ein farbloser Feststoff. Die Verbindung kann aus Benzol und Trichlormethan durch FRIEDL-CRAFTS-Alkylierung (elektrophile Substitution) hergestellt werden. Die H-Atome
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Säuren, Laugen, Salze. Das komplette Material finden Sie hier:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Säuren, Laugen, Salze Das komplette Material finden Sie hier: School-Scout.de Säuren, Laugen, Salze Themenbereich 1.1 - Säuren: Einführung
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Säuren, Laugen, Salze Das komplette Material finden Sie hier: School-Scout.de Säuren, Laugen, Salze Themenbereich 1.1 - Säuren: Einführung
Gruppe I : Darstellung und Nachweis von Säuren
 Gruppe I : Darstellung und Nachweis von Säuren Behauptung: Säuren lassen sich durch die Reaktion von Nichtmetalloxiden mit Wasser darstellen. 1. Überprüfen Sie experimentell die aufgeführte Behauptung
Gruppe I : Darstellung und Nachweis von Säuren Behauptung: Säuren lassen sich durch die Reaktion von Nichtmetalloxiden mit Wasser darstellen. 1. Überprüfen Sie experimentell die aufgeführte Behauptung
H1 Bestimmung des Löslichkeitsprodukts von Magnesiumhydroxid
 H Löslichkeitsprodukt und Komplexgleichgewichte Auch bei den Komplex-Reaktionen beschäftigen wir uns im Wesentlichen mit Gleichgewichtsreaktionen, in denen Liganden ausgetauscht werden. Dabei sollen Kriterien
H Löslichkeitsprodukt und Komplexgleichgewichte Auch bei den Komplex-Reaktionen beschäftigen wir uns im Wesentlichen mit Gleichgewichtsreaktionen, in denen Liganden ausgetauscht werden. Dabei sollen Kriterien
Nachweis von Eisen-Ionen mit Kaliumthiocyanat
 Name: Datum: Nachweis von Eisen- mit Kaliumthiocyanat Geräte 3 Bechergläser (100 ml), 4 Reagenzgläser, Reagenzglasständer, kleiner Trichter, Faltenfilter, Spatel Materialien Eisennagel, Muscheln (braun
Name: Datum: Nachweis von Eisen- mit Kaliumthiocyanat Geräte 3 Bechergläser (100 ml), 4 Reagenzgläser, Reagenzglasständer, kleiner Trichter, Faltenfilter, Spatel Materialien Eisennagel, Muscheln (braun
Exkursion zur Uni-Graz
 Exkursion zur Uni-Graz der 5.B. Klasse 2012/13 Erstellt von Manuel Ruiß, Raphael Kropf und Sarah Wachtler. Protokolle Experiment: Was Rote Rüben zum Bluten bringt? Material: Rote Rübe, Reagenzgläser, Messer,
Exkursion zur Uni-Graz der 5.B. Klasse 2012/13 Erstellt von Manuel Ruiß, Raphael Kropf und Sarah Wachtler. Protokolle Experiment: Was Rote Rüben zum Bluten bringt? Material: Rote Rübe, Reagenzgläser, Messer,
S 36/37/39 Bei der Arbeit geeignete Schutzhandschuhe, Schutzkleidung und Schutzbrille/Gesichtsschutz
 Blue-Bottle-Experiment keine! Natriumhydroxid (Ätznatron) R-Sätze: 35 S-Sätze: 26-36/37/39-45 Methylenblau R-Sätze: 22 S-Sätze: keine 0,2 Gramm Methylenblau werden in 100 Milliliter Wasser gelöst. In einem
Blue-Bottle-Experiment keine! Natriumhydroxid (Ätznatron) R-Sätze: 35 S-Sätze: 26-36/37/39-45 Methylenblau R-Sätze: 22 S-Sätze: keine 0,2 Gramm Methylenblau werden in 100 Milliliter Wasser gelöst. In einem
Ch 15/02 K_Online-Ergänzung
 Ch 15/02 K_Online-Ergänzung S. I S. I + II S. II CHEMIE MARTIN HOLFELD Online-Ergänzung 1 Gefährdungsbeurteilung Rot-Grün-Gelb-Ampel aufgerufen: 07.11.2015 Vorgang: Oszillierende Redoxreaktion mit Indigocarmin
Ch 15/02 K_Online-Ergänzung S. I S. I + II S. II CHEMIE MARTIN HOLFELD Online-Ergänzung 1 Gefährdungsbeurteilung Rot-Grün-Gelb-Ampel aufgerufen: 07.11.2015 Vorgang: Oszillierende Redoxreaktion mit Indigocarmin
Wasser Kaffeefilter ein Streifen Filterpapier als Docht Schere Tasse
 Trennen von Farben Was Du brauchst: schwarzfarbige Filzstifte Wasser Kaffeefilter ein Streifen Filterpapier als Docht Schere Tasse Wie Du vorgehst: Schneide einen Kreis aus dem Kaffeefilter. Steche mit
Trennen von Farben Was Du brauchst: schwarzfarbige Filzstifte Wasser Kaffeefilter ein Streifen Filterpapier als Docht Schere Tasse Wie Du vorgehst: Schneide einen Kreis aus dem Kaffeefilter. Steche mit
Dieses Buch gehört. PH Vorarlberg Seite 1 Scheier Silke
 Dieses Buch gehört PH Vorarlberg Seite 1 Scheier Silke Versuch 1: Hände tarnen Das brauchst du: Papier Farbkasten Pinsel Wasser Malerkittel Durchführung 1. Nimm ein Blatt Papier und male ein buntes Muster
Dieses Buch gehört PH Vorarlberg Seite 1 Scheier Silke Versuch 1: Hände tarnen Das brauchst du: Papier Farbkasten Pinsel Wasser Malerkittel Durchführung 1. Nimm ein Blatt Papier und male ein buntes Muster
Saure, neutrale und alkalische Lösungen
 Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen Auf einen Blick: Das Protokoll enthält für die Klassen 5 und 6 einen Lehrerversuch und
Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen Auf einen Blick: Das Protokoll enthält für die Klassen 5 und 6 einen Lehrerversuch und
Korrosion und Korrosionsschutz
 Schulversuchspraktikum Christian Köhler Sommersemester 2016 Klassenstufen 7&8 Korrosion und Korrosionsschutz Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll beinhaltet drei weitere Schülerversuche
Schulversuchspraktikum Christian Köhler Sommersemester 2016 Klassenstufen 7&8 Korrosion und Korrosionsschutz Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll beinhaltet drei weitere Schülerversuche
Chemisches Gleichgewicht
 Schulversuchspraktikum Lars Lichtenberg Sommersemester 2015 Klassenstufen 11 & 12 Chemisches Gleichgewicht Kurzprotokoll Auf einen Blick: Die Unterrichtseinheit,,Chemisches Gleichgewicht für die Klassenstufen
Schulversuchspraktikum Lars Lichtenberg Sommersemester 2015 Klassenstufen 11 & 12 Chemisches Gleichgewicht Kurzprotokoll Auf einen Blick: Die Unterrichtseinheit,,Chemisches Gleichgewicht für die Klassenstufen
Gemische. Zeitangabe: 8 min SCHUTZBRILLE NICHT VERGESSEN! VERSUCH 1 VERSUCH 2
 Gemische Zeitangabe: 8 min SCHUTZBRILLE NICHT VERGESSEN! Materialien: Becherglas, Spatel Chemikalien: Wasser, Tinte VERSUCH 1 Gebt in das Becherglas ca. 2 cm hoch Wasser und gebt dann fünf Tropfen Tinte
Gemische Zeitangabe: 8 min SCHUTZBRILLE NICHT VERGESSEN! Materialien: Becherglas, Spatel Chemikalien: Wasser, Tinte VERSUCH 1 Gebt in das Becherglas ca. 2 cm hoch Wasser und gebt dann fünf Tropfen Tinte
Analytische Chemie. B. Sc. Chemieingenieurwesen. 8. Juli 2015, Uhr. Prof. Dr. T. Jüstel, Stephanie Möller M. Sc.
 Analytische Chemie B. Sc. Chemieingenieurwesen 8. Juli 2015, 12.30 15.30 Uhr Prof. Dr. T. Jüstel, Stephanie Möller M. Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
Analytische Chemie B. Sc. Chemieingenieurwesen 8. Juli 2015, 12.30 15.30 Uhr Prof. Dr. T. Jüstel, Stephanie Möller M. Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
Chemie zur Weihnacht. Farbreihe
 Farbreihe Reagenzien: 2 ml Phenolphthalein in 200 ml Wasser verdünnte Natronlauge in Tropfflasche Kaliumpermanganat 2,5 g Eisen(II)-sulfat in 50 ml Wasser 2,5 g Kaliumthiocyanat in 50 ml Wasser 2,5 g Kaliumhexacyanoferrat(II)
Farbreihe Reagenzien: 2 ml Phenolphthalein in 200 ml Wasser verdünnte Natronlauge in Tropfflasche Kaliumpermanganat 2,5 g Eisen(II)-sulfat in 50 ml Wasser 2,5 g Kaliumthiocyanat in 50 ml Wasser 2,5 g Kaliumhexacyanoferrat(II)
Welche Pflanzenfarbe macht die schönste Farbpalette?
 Welche Pflanzenfarbe macht die schönste Farbpalette? Eine Arbeit des Wahlpflichtkurses Auf Spurensuche, Gruppe 6d 15. Juli 2011 Inhaltsverzeichnis Thema Seite Inhaltsverzeichnis 2 1. Kurzfassung 3 2. Einleitung
Welche Pflanzenfarbe macht die schönste Farbpalette? Eine Arbeit des Wahlpflichtkurses Auf Spurensuche, Gruppe 6d 15. Juli 2011 Inhaltsverzeichnis Thema Seite Inhaltsverzeichnis 2 1. Kurzfassung 3 2. Einleitung
Material: Rotkohlblätter, Eiklar, Essigsäurelösung (w=10%), Speiseöl, Spülmittel farblos verdünnt mit Wasser 1:1, Wasser, 9 Reagenzgläser, Messer.
 Bau der Biomembran Experiment mit Rotkohl: Indirekter Nachweis von Membranbestandteilen verändert nach Feldermann, D. (2004). Schwerpunktmaterialien Linder Biologie Band 1. Hannover, Schroedel Fragestellung:
Bau der Biomembran Experiment mit Rotkohl: Indirekter Nachweis von Membranbestandteilen verändert nach Feldermann, D. (2004). Schwerpunktmaterialien Linder Biologie Band 1. Hannover, Schroedel Fragestellung:
1. Qualitativer Nachweis von Anionen und Sodaauszug
 Anionennachweis 1 1. Qualitativer Nachweis von Anionen und Sodaauszug Die moderne Analytische Chemie unterscheidet zwischen den Bereichen der qualitativen und quantitativen Analyse sowie der Strukturanalyse.
Anionennachweis 1 1. Qualitativer Nachweis von Anionen und Sodaauszug Die moderne Analytische Chemie unterscheidet zwischen den Bereichen der qualitativen und quantitativen Analyse sowie der Strukturanalyse.
Dokumentation Projekt Chromatografie PLUS-Kurs SU 4+, GGS Vaalserquartier, Aachen
 Die Arbeitsgruppe Die Gemeinschaftsgrundschule Vaalserquartier ist eine zweizügige Grundschule im westlichsten Stadtteil von Aachen, 400 m von der Grenze zu den Niederlanden gelegen. Sie hat 220 SchülerInnen
Die Arbeitsgruppe Die Gemeinschaftsgrundschule Vaalserquartier ist eine zweizügige Grundschule im westlichsten Stadtteil von Aachen, 400 m von der Grenze zu den Niederlanden gelegen. Sie hat 220 SchülerInnen
Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09
 rganisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah Henkel Datum: 18.11.2008 Gruppe 4: Aromaten Versuch: Herstellung von Fluorescein
rganisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah Henkel Datum: 18.11.2008 Gruppe 4: Aromaten Versuch: Herstellung von Fluorescein
Untersuche das Verhalten von Zitronensäure gegenüber verschiedene Stoffen in Wasser und in Aceton.
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - Säuren (P758500).6 Brönstedt Säuren - Aciditätvergleich einer wässrigen und einer acetonischen Citronensäurel Experiment von: Phywe Gedruckt: 5.0.203
Naturwissenschaften - Chemie - Säuren, Basen, Salze - Säuren (P758500).6 Brönstedt Säuren - Aciditätvergleich einer wässrigen und einer acetonischen Citronensäurel Experiment von: Phywe Gedruckt: 5.0.203
Chemie Stufe 13 / Aromaten / Phenol Folie 01. Das Phenol-Molekül. δ δ+ sp 3. sp 2
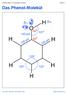 Chemie Stufe 13 / Aromaten / Phenol Folie 01 Das Phenol-Molekül δ δ+ sp 3 sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 02 Das Phenolat-Ion sp 3 H + sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 03 Grenzstrukturen
Chemie Stufe 13 / Aromaten / Phenol Folie 01 Das Phenol-Molekül δ δ+ sp 3 sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 02 Das Phenolat-Ion sp 3 H + sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 03 Grenzstrukturen
V 1 Herstellung von Natriumchlorid
 1 V 1 Herstellung von Natriumchlorid In diesem Versuch wird Natriumchlorid, im Alltag als Kochsalz bekannt, aus den Edukten Natrium und Chlorgas hergestellt. Dieser Versuch ist eine Reaktion zwischen einem
1 V 1 Herstellung von Natriumchlorid In diesem Versuch wird Natriumchlorid, im Alltag als Kochsalz bekannt, aus den Edukten Natrium und Chlorgas hergestellt. Dieser Versuch ist eine Reaktion zwischen einem
Ergänzende Hinweise Nicht zu lange und intensiv spülen! Nur Glasgefäße zum Färben verwenden! Hautkontakt vermeiden!
 Beizenfärbung mit Alizarin * Eisen(III)-chlorid R-Sätze: 22-38-41 S-Sätze: 26-39 Kaliumchrom(III)-sulfat) Natronlauge (verdünnt) R-Sätze: 36/38 S-Sätze: 26-36/37/39-45 Eine Spatelspitze Eisen(III)-chlorid,
Beizenfärbung mit Alizarin * Eisen(III)-chlorid R-Sätze: 22-38-41 S-Sätze: 26-39 Kaliumchrom(III)-sulfat) Natronlauge (verdünnt) R-Sätze: 36/38 S-Sätze: 26-36/37/39-45 Eine Spatelspitze Eisen(III)-chlorid,
Versuche zum Thema Aminosäuren
 Versuche zum Thema Aminosäuren und Proteine 1/5 Versuche zum Thema Aminosäuren ❶ ph-abhängigkeit der Löslichkeit von Tyrosin 1) In zwei Reagenzgläser gibt man je eine Spatelspitze Tyrosin und etwa 2 cm
Versuche zum Thema Aminosäuren und Proteine 1/5 Versuche zum Thema Aminosäuren ❶ ph-abhängigkeit der Löslichkeit von Tyrosin 1) In zwei Reagenzgläser gibt man je eine Spatelspitze Tyrosin und etwa 2 cm
Aufstellung einiger Versuche zur Farbenchemie (Kurzfassung)
 Aufstellung einiger Versuche zur Farbenchemie (Kurzfassung) Zusammenstellung der Versuche, die für Schulversuche als geeignet eingestuft wurden (zusammengestellt von Herrn Buchholz, TU Dresden) 1. Darstellung
Aufstellung einiger Versuche zur Farbenchemie (Kurzfassung) Zusammenstellung der Versuche, die für Schulversuche als geeignet eingestuft wurden (zusammengestellt von Herrn Buchholz, TU Dresden) 1. Darstellung
QUALITATIVE UNTERSUCHUNGEN
 QUALITATIVE UNTERSUCHUNGEN Allgemeiner Alkaloid-Nachweis Cinchonae cortex 0.5 g gepulverte Droge werden mit 10 ml 0.2 M Schwefelsäure geschüttelt und abfiltriert. 2 ml aus den Extrakten werden in Reagenzgläser
QUALITATIVE UNTERSUCHUNGEN Allgemeiner Alkaloid-Nachweis Cinchonae cortex 0.5 g gepulverte Droge werden mit 10 ml 0.2 M Schwefelsäure geschüttelt und abfiltriert. 2 ml aus den Extrakten werden in Reagenzgläser
Praktikum Physikalische Chemie I 30. Januar Aktivierungsenergie. Guido Petri Anastasiya Knoch PC111/112, Gruppe 11
 Praktikum Physikalische Chemie I 30. Januar 2016 Aktivierungsenergie Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 1 Aufgabenstellung Für die Reaktion von Saccharose mit Wasser zu Glucose und Fructose
Praktikum Physikalische Chemie I 30. Januar 2016 Aktivierungsenergie Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 1 Aufgabenstellung Für die Reaktion von Saccharose mit Wasser zu Glucose und Fructose
3.5 Hydrolyse von Salzen. Aufgabe. Reagieren wässrige Salzlösungen neutral? Naturwissenschaften - Chemie - Säuren, Basen, Salze - 3 Salze
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - 3 Salze (P759800) 3.5 Hydrolyse von Salzen Experiment von: Phywe Gedruckt: 5.0.203 2:2:26 intertess (Version 3.06 B200, Export 2000) Aufgabe Aufgabe
Naturwissenschaften - Chemie - Säuren, Basen, Salze - 3 Salze (P759800) 3.5 Hydrolyse von Salzen Experiment von: Phywe Gedruckt: 5.0.203 2:2:26 intertess (Version 3.06 B200, Export 2000) Aufgabe Aufgabe
Nachweis von Fälschungen durch Farbvergleiche Ist eine Farbe nur EINE Farbe?
 Name: Datum: Nachweis von Fälschungen durch Farbvergleiche Ist eine Farbe nur EINE Farbe? Materialien Fruchtzwerge-Becher, Rundfilter mit Loch, rechteckiges Filterpapier zum Docht gerollt, verschiedene
Name: Datum: Nachweis von Fälschungen durch Farbvergleiche Ist eine Farbe nur EINE Farbe? Materialien Fruchtzwerge-Becher, Rundfilter mit Loch, rechteckiges Filterpapier zum Docht gerollt, verschiedene
SV: Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration
 SV: Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration Der Versuch sollte mindestens zu zweit oder in einer Gruppe durchgeführt werden, damit die Messung so genau wie möglich erfolgt. Als
SV: Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration Der Versuch sollte mindestens zu zweit oder in einer Gruppe durchgeführt werden, damit die Messung so genau wie möglich erfolgt. Als
CHEMIE KAPITEL 4 SÄURE-BASE. Timm Wilke. Georg-August-Universität Göttingen. Wintersemester 2013 / 2014
 CHEMIE KAPITEL 4 SÄURE-BASE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Aufgaben In einen Liter Wasser werden 2 g NH - 2 (starke Base) eingeleitet welchen ph-wert hat
CHEMIE KAPITEL 4 SÄURE-BASE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Aufgaben In einen Liter Wasser werden 2 g NH - 2 (starke Base) eingeleitet welchen ph-wert hat
Stoffe oder Teilchen, die Protonen abgeben kånnen, werden als SÄuren bezeichnet (Protonendonatoren).
 5 10 15 20 25 30 35 40 45 O C 50 Chemie Technische BerufsmaturitÄt BMS AGS Basel Kapitel 6 SÄuren und Basen Baars, Kap. 12.1; 12.2; 13 Versuch 1 Ein Becherglas mit Thermometer enthält violette FarbstofflÅsung
5 10 15 20 25 30 35 40 45 O C 50 Chemie Technische BerufsmaturitÄt BMS AGS Basel Kapitel 6 SÄuren und Basen Baars, Kap. 12.1; 12.2; 13 Versuch 1 Ein Becherglas mit Thermometer enthält violette FarbstofflÅsung
Tatort Küche. Versuch 1: Rotkohl. Aufgabe: Geräte und Chemikalien: Versuchsdurchführung: Beobachtungen: Auswertung:
 Tatort Küche Aufgabe: Es muss anhand von chemischen Versuchen herausgefunden werden, welcher von drei sehr ähnlich aussehenden Feststoffen Zucker, welcher Kochsalz und welcher Zitronensäure ist. Das Kosten
Tatort Küche Aufgabe: Es muss anhand von chemischen Versuchen herausgefunden werden, welcher von drei sehr ähnlich aussehenden Feststoffen Zucker, welcher Kochsalz und welcher Zitronensäure ist. Das Kosten
Zellen. 3 N1 Ausgehend von stark angeleitetem, geführtem Arbeiten. Technik beschreiben und benennen. Technik beschreiben und benennen.
 Zellen Zuordnung zum Kompetenzmodell (KM) Aufgabe(n) KM Beschreibung W1 Ich kann Vorgänge und Phänomene in Natur, Umwelt und Technik beschreiben und benennen. 1 N1 Ausgehend von stark angeleitetem, geführtem
Zellen Zuordnung zum Kompetenzmodell (KM) Aufgabe(n) KM Beschreibung W1 Ich kann Vorgänge und Phänomene in Natur, Umwelt und Technik beschreiben und benennen. 1 N1 Ausgehend von stark angeleitetem, geführtem
Seite 1/2. Wir nehmen am Wettbewerb Jugend forscht in der Technik Auf den Spuren des kleinen Albert teil!
 Datenblatt (dient als Titelblatt für die Projektarbeit) Seite 1/2 JUFOTech Jugend forscht in der Technik WKO.at/tirol/jufotech DATENBLATT Wir nehmen am Wettbewerb Jugend forscht in der Technik Auf den
Datenblatt (dient als Titelblatt für die Projektarbeit) Seite 1/2 JUFOTech Jugend forscht in der Technik WKO.at/tirol/jufotech DATENBLATT Wir nehmen am Wettbewerb Jugend forscht in der Technik Auf den
Versuchsprotokoll. Gummibärchen-Indikator
 Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 19.12.08 Schulversuche Assistentin: Katrin Hohmann Versuchsprotokoll Gummibärchen-Indikator Gruppe
Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 19.12.08 Schulversuche Assistentin: Katrin Hohmann Versuchsprotokoll Gummibärchen-Indikator Gruppe
Analytische Chemie. B. Sc. Chemieingenieurwesen. 15. März 2017, Uhr. Prof. Dr. Thomas Jüstel, Dr. Stephanie Möller.
 Analytische Chemie B. Sc. Chemieingenieurwesen 15. März 2017, 12.30 15.30 Uhr Prof. Dr. Thomas Jüstel, Dr. Stephanie Möller Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
Analytische Chemie B. Sc. Chemieingenieurwesen 15. März 2017, 12.30 15.30 Uhr Prof. Dr. Thomas Jüstel, Dr. Stephanie Möller Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
5.2 L Wie färbt sich Wäsche mit Rotkohlextrakt?
 178 Farbstoffe, Aromaten 5.2 L Wie färbt sich Wäsche mit Rotkohlextrakt? Thematik Unterrichtsmethode Grundlagen: Säure-Base-Gleichgewichte, Wechselwirkungen zwischen Farbstoff- und Faser- Molekülen, Chromophor,
178 Farbstoffe, Aromaten 5.2 L Wie färbt sich Wäsche mit Rotkohlextrakt? Thematik Unterrichtsmethode Grundlagen: Säure-Base-Gleichgewichte, Wechselwirkungen zwischen Farbstoff- und Faser- Molekülen, Chromophor,
Auswertung der Versuche mit Aminosäuren und Proteinen (Eiweiß)
 Auswertung der Versuche mit Aminosäuren und Proteinen (Eiweiß) Vorbereitung: Für die folgenden Versuche wird eine Eiweißlösung aus dem Eiklar eines ühnereis hergestellt, indem man dieses in 60 ml dest.
Auswertung der Versuche mit Aminosäuren und Proteinen (Eiweiß) Vorbereitung: Für die folgenden Versuche wird eine Eiweißlösung aus dem Eiklar eines ühnereis hergestellt, indem man dieses in 60 ml dest.
Fette, Öle und Tenside
 Schulversuchspraktikum Thomas Polle Sommersemester 2015 Klassenstufen 11 & 12 Fette, Öle und Tenside Kurzprotokoll Inhalt Inhaltsverzeichnis 1Weitere Lehrerversuche... 3 V1 Verseifungszahl... 3 2Weitere
Schulversuchspraktikum Thomas Polle Sommersemester 2015 Klassenstufen 11 & 12 Fette, Öle und Tenside Kurzprotokoll Inhalt Inhaltsverzeichnis 1Weitere Lehrerversuche... 3 V1 Verseifungszahl... 3 2Weitere
Stelle pflanzliche Farbstoffe her, die zur Säureidentifizierung dienen können.
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - Säuren (P757200).3 Pflanzliche Farbstoffe dienen als Indikatoren Experiment von: Phywe Gedruckt: 5.0.203 :9:42 intertess (Version 3.06 B200, Export
Naturwissenschaften - Chemie - Säuren, Basen, Salze - Säuren (P757200).3 Pflanzliche Farbstoffe dienen als Indikatoren Experiment von: Phywe Gedruckt: 5.0.203 :9:42 intertess (Version 3.06 B200, Export
Coffein-Natriumbenzoat Coffeinum-natrii benzoas Synonym: Coffeinum-Natrium benzoicum
 !!! NEUE ÖAB-MONOGRAPHIE!!! Die folgende revidierte Monographie ist für die Aufnahme in das ÖAB (Österreichisches Arzneibuch) vorgesehen. Stellungnahmenf sind bis zum 15.September 2008 an folgende Adresse
!!! NEUE ÖAB-MONOGRAPHIE!!! Die folgende revidierte Monographie ist für die Aufnahme in das ÖAB (Österreichisches Arzneibuch) vorgesehen. Stellungnahmenf sind bis zum 15.September 2008 an folgende Adresse
!!! NEUE ÖAB-MONOGRAPHIE!!!
 !!! NEUE ÖAB-MONOGRAPHIE!!! Die folgende neue Monographie ist für die Aufnahme in das ÖAB (österreichisches Arzneibuch) vorgesehen. Stellungnahmen zu diesem Gesetzesentwurf sind bis zum 31.01.2015 an folgende
!!! NEUE ÖAB-MONOGRAPHIE!!! Die folgende neue Monographie ist für die Aufnahme in das ÖAB (österreichisches Arzneibuch) vorgesehen. Stellungnahmen zu diesem Gesetzesentwurf sind bis zum 31.01.2015 an folgende
Chemie-Labothek zur Photochemie
 Optischer Datenspeicher auf der Basis molekularer Schalter V1: Herstellung der Spiropyran-Polystyrol-Folie (Angaben für 1 DIN A4 Folie): Arbeitsmaterialien und Chemikalien: hitzebeständige Kopierfolie
Optischer Datenspeicher auf der Basis molekularer Schalter V1: Herstellung der Spiropyran-Polystyrol-Folie (Angaben für 1 DIN A4 Folie): Arbeitsmaterialien und Chemikalien: hitzebeständige Kopierfolie
Station 1: Säuren in Lebensmitteln (1)
 Station 1: Säuren in Lebensmitteln (1) An dieser Station testet ihr, welche Lebensmittel Säuren enthalten. Für den Säurenachweis benutzt man im Labor bestimmte chemische Stoffe, die man Indikatoren (Zeigerstoffe)
Station 1: Säuren in Lebensmitteln (1) An dieser Station testet ihr, welche Lebensmittel Säuren enthalten. Für den Säurenachweis benutzt man im Labor bestimmte chemische Stoffe, die man Indikatoren (Zeigerstoffe)
Versuch 6.14 ph-abhängigkeit eines Indikators am Beispiel Thymolblau
 Versuch 6.14 ph-abhängigkeit eines Indikators am Beispiel Thymolblau Einleitung Lösungen mit verschiedenen ph-werten von stark sauer bis stark basisch werden mit gleich viel Thymolblau-Lösung versetzt.
Versuch 6.14 ph-abhängigkeit eines Indikators am Beispiel Thymolblau Einleitung Lösungen mit verschiedenen ph-werten von stark sauer bis stark basisch werden mit gleich viel Thymolblau-Lösung versetzt.
1.1 Stoffeigenschaften - Härte, Farbe, Magnetisierbarkeit, Wasserlöslichkeit. Aufgabe. Wie lassen sich Stoffe unterscheiden? (1)
 Naturwissenschaften - Chemie - Allgemeine Chemie - 1 Stoffeigenschaften (P7150100) 1.1 Stoffeigenschaften - Härte, Farbe, Magnetisierbarkeit, Wasserlöslichkeit Experiment von: Phywe Gedruckt: 07.12.2015
Naturwissenschaften - Chemie - Allgemeine Chemie - 1 Stoffeigenschaften (P7150100) 1.1 Stoffeigenschaften - Härte, Farbe, Magnetisierbarkeit, Wasserlöslichkeit Experiment von: Phywe Gedruckt: 07.12.2015
Welcher Indikator ist für die Titration von Essigsäure (pks =4.76) mit Natronlauge am besten geeignet?
 1. Aufgaben zu Versuchstag 1: Säure-Base-Titration Aufgabe 1.1 Welche der folgenden Aussagen ist falsch? A) Säuren erhöhen durch Abgabe eines Protons an Wasser die H3O + -Konzentration einer Lösung. B)
1. Aufgaben zu Versuchstag 1: Säure-Base-Titration Aufgabe 1.1 Welche der folgenden Aussagen ist falsch? A) Säuren erhöhen durch Abgabe eines Protons an Wasser die H3O + -Konzentration einer Lösung. B)
Isolierung von Pflanzenfarbstoffen und Untersuchung auf ihre Verwendung als Säure- Base-Indikatoren
 Bodensee-Gymnasium Lindau Januar 2009 Isolierung von Pflanzenfarbstoffen und Untersuchung auf ihre Verwendung als Säure- Base-Indikatoren von Marc Bradenbrink und Florian Gerner Betreuungslehrkraft: StR
Bodensee-Gymnasium Lindau Januar 2009 Isolierung von Pflanzenfarbstoffen und Untersuchung auf ihre Verwendung als Säure- Base-Indikatoren von Marc Bradenbrink und Florian Gerner Betreuungslehrkraft: StR
Abiturprüfung Physik, Grundkurs
 Seite 1 von 5 Abiturprüfung 2012 Physik, Grundkurs Aufgabenstellung: Aufgabe: Farbstoffmoleküle In der Spektroskopie unterscheidet man zwei grundsätzliche Typen von Spektren: Emissionsspektren, wie sie
Seite 1 von 5 Abiturprüfung 2012 Physik, Grundkurs Aufgabenstellung: Aufgabe: Farbstoffmoleküle In der Spektroskopie unterscheidet man zwei grundsätzliche Typen von Spektren: Emissionsspektren, wie sie
+ MnO MnO 3. Oxidierbarkeit primärer, sekundärer und tertiärer Alkohole. Chemikalien. Materialien
 DaChS xidierbarkeit primärer, sekundärer und tertiärer Alkohole 1 Versuch Nr. 005 xidierbarkeit primärer, sekundärer und tertiärer Alkohole C 3 Mn - 4 (violett) 3 C Mn 2 (braun) 3 C C 3 Mn - 4 (violett)
DaChS xidierbarkeit primärer, sekundärer und tertiärer Alkohole 1 Versuch Nr. 005 xidierbarkeit primärer, sekundärer und tertiärer Alkohole C 3 Mn - 4 (violett) 3 C Mn 2 (braun) 3 C C 3 Mn - 4 (violett)
Schülercode Erste zwei Buchstaben Letzte zwei Buchstaben des Vornamens deiner Geburtstag (TT) deines Vornamens Mutter Kontext Experiment Aufgabe
 Schülercode Letzte zwei Buchstaben deines Vornamens Erste zwei Buchstaben des Vornamens deiner Mutter Geburtstag (TT) Kontext Experiment Aufgabe Erklärung Box 1 Kontext Kohlensäure im Mineralwasser Heute
Schülercode Letzte zwei Buchstaben deines Vornamens Erste zwei Buchstaben des Vornamens deiner Mutter Geburtstag (TT) Kontext Experiment Aufgabe Erklärung Box 1 Kontext Kohlensäure im Mineralwasser Heute
2-01. Das Ethen-Molekül. Perspektivische Darstellung des Ethen-Moleküls.
 Das Ethen-Molekül 2-01 Perspektivische Darstellung des Ethen-Moleküls. Rot: Sigma-Bindungen σ mit je zwei Bindungselektronen Blau: pz-orbitale mit je einem Elektron Die C-Atome sind sp 2 -hybridisiert,
Das Ethen-Molekül 2-01 Perspektivische Darstellung des Ethen-Moleküls. Rot: Sigma-Bindungen σ mit je zwei Bindungselektronen Blau: pz-orbitale mit je einem Elektron Die C-Atome sind sp 2 -hybridisiert,
Versuch 2.1: Herstellung von Propoxybenzol (Phenylpropylether)
 Endersch, Jonas 17./19.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.1: Herstellung von Propoxybenzol (Phenylpropylether) Reaktionsgleichung: Einleitung und Theorie
Endersch, Jonas 17./19.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.1: Herstellung von Propoxybenzol (Phenylpropylether) Reaktionsgleichung: Einleitung und Theorie
