Oktett-Theorie von Lewis
|
|
|
- Kai Pfeiffer
- vor 7 Jahren
- Abrufe
Transkript
1 Oktett-Theorie von Lewis Oktettregel Atome versuchen durch die Nutzung gemeinsamer Elektronenpaare möglichst ein Elektronenoktett zu erlangen. allgemeiner: Edelgasregel Atome streben durch Vereinigung mit Bindungspartnern an, eine edelgasanaloge Elektronenkonfiguration zu erlangen. Gilbert Edward Lewis 1
2 Lewis-Symbole von Atomen / Ionen des s- und p- Blocks F abgeschlossene Schale, Elektronen werden nicht dargestellt F 1s 2 2s 2 2p 5 drei Elektronenpaare, ein isoliertes Elektron, Elektronenkonfiguration der äußeren Elektronen 2
3 Die Chemische Bindung - Grenztypen ionische Bindung Vollständiger Übertrag der Valenzelektronen auf den elektronegativeren Partner (Dc groß, oft Metall Nichtmetall). metallische Bindung Abgabe der Valenzelektronen. Elektronen werden gleichmäßig zwischen Atomrümpfen verteilt (Dc klein, nur Metalle beteiligt). kovalente Bindung Zusammenhalt zweier oder mehrerer Atome durch Elektronen, die sich die beteiligten Atome teilen, Besetzung von Molekülorbitalen (Dc klein, mindestens ein Nichtmetall an der Bindung beteiligt). 3
4 Typen der chemischen Bindung Ionischer Charakter [%] _ ionisch kovalent Elektronegativitätsdifferenz 4
5 Typen der chemischen Bindung 5
6 Die ionische Bindung Eine ionische Bindung entsteht dann, wenn ein Atom seine Valenzelektronen (komplett oder partiell) abgibt und ein zweites Atom diese aufnimmt. oft Reaktion von Metall und Nichtmetall, Bildung von Ionen 2 Na Cl 2 2 Na 2 Cl - 2 NaCl 2 Ca O 2 2 Ca 2 2 O 2-2 CaO Ca Br 2 Ca 2 2 Br - CaBr 2 16 Al 3 S 8 16 Al 3 24 S 2-8 Al 2 S 3 6
7 Die ionische Bindung 7
8 Die ionische Bindung 8
9 Die ionische Bindung Elektrostatische Kräfte (Coulomb- Wechselwirkungen) sind nicht gerichtet (ungerichtet). Sie wirken in alle Richtungen gleich stark / sie sind isotrop. Ionenverbindungen bilden nicht einzelne Moleküle, sondern aus Ionen aufgebaute Kristalle. Coulomb sches Gesetz: Kraft zwischen zwei Punktladungen Cl Na F Q1 Q 2 r F Kraft Q 1, Q 2 Ladungen der beiden Teilchen r Teilchenabstand 2 9
10 Änderung der potentiellen Energie bei Annäherung zweier entgegengerichtet geladener Ionen 10
11 Natriumchlorid als Beispiel für einen Ionenverband 11
12 Natriumchlorid als Beispiel für einen Ionenverband 12
13 Ionische Bindung - Elektronendichte 13
14 Mechanische Eigenschaften von Salzen Bruch 14
15 Die Chemische Bindung - Grenztypen ionische Bindung Vollständiger Übertrag der Valenzelektronen auf den elektronegativeren Partner (Dc groß, oft Metall Nichtmetall). metallische Bindung Abgabe der Valenzelektronen. Elektronen werden gleichmäßig zwischen Atomrümpfen verteilt (Dc klein, nur Metalle beteiligt). kovalente Bindung Zusammenhalt zweier oder mehrerer Atome durch Elektronen, die sich die beteiligten Atome teilen, Besetzung von Molekülorbitalen (Dc klein, mindestens ein Nichtmetall an der Bindung beteiligt). 15
16 Die metallische Bindung Elektronengas-Modell: kationische Atomrümpfe in einem Elektronen-See 16
17 Verformbarkeit von Metallen Gold Kupfer 17
18 Legierungen wichtige Werkstoffe Elementare Zusammensetzung eines Flugzeugtriebwerks 18
19 Legierungen Amalgame Amalgame: Legierungen des Quecksilbers. Viele Metalle sind mit Hg in beliebigem Verhältnis kombinierbar. Da Hg flüssig ist, lassen sich Amalgame zudem leicht herstellen. Amalgam hat als Legierung im Vergleich zu den Ausgangsmetallen verbesserte Eigenschaften. Zahnamalgam ist ein Gemisch aus: a) ~50% Quecksilber b) ~22-32% Silber, ~14% Zinn, ~8% Kupfer anderen Metallen 19
20 Die Chemische Bindung - Grenztypen ionische Bindung Vollständiger Übertrag der Valenzelektronen auf den elektronegativeren Partner (Dc groß, oft Metall Nichtmetall). metallische Bindung Abgabe der Valenzelektronen. Elektronen werden gleichmäßig zwischen Atomrümpfen verteilt (Dc klein, nur Metalle beteiligt). kovalente Bindung Zusammenhalt zweier oder mehrerer Atome durch Elektronen, die sich die beteiligten Atome teilen, Besetzung von Molekülorbitalen (Dc klein, mindestens ein Nichtmetall an der Bindung beteiligt). 20
21 Molekülorbitale (MOs) zweiatomiger Moleküle n AO n MO 21
22 Elektronenkonfiguration des Wasserstoffmoleküls die Einfachbindung Bindungsordnung ( e bindend ) ( e antibinden 2 d ) Bindungsordnung
23 Energie-Abstandsprofil des H 2 -Moleküls 23
24 Warum gibt es kein Diheliummolekül, He 2? Energie 1s 1s 1s 2 2 1s Bindungsordnung 0 2 Bindende und antibindende Wechselwirkungen heben sich genau auf! 24
25 Bildung von Molekülorbitalen - Voraussetzungen vergleichbare Energien der Atomorbitale passende räumliche Orientierung der Atomorbitale Vorzeichen der wechselwirkenden Atomorbitale y y s-orbital _ x s-orbital _ x p -Orbital y p -Orbital x 25
26 Bildung von Molekülorbitalen energetisch günstige Überlappung von MOs bindende Molekülorbitale: 26
27 Bildung von Molekülorbitalen energetisch ungünstige Überlappung von MOs: nichtbindend antibindend 27
28 Bildung von Molekülorbitalen Überlappung von p-orbitalen entlang der Bindungsachse: -Molekülorbitale 28
29 Bildung von Molekülorbitalen Überlappung von p-orbitalen ober- und unterhalb der Bindungsachse: -Molekülorbitale 29
30 Molekülorbitale für X 2 -Moleküle der 2. Periode 30
31 Elektronenbesetzung Beispiel O 2 Bindungsordnung
32 Kovalente Bindungstypen In einer Einfachbindung besetzen zwei Elektronen ein bindendes -Molekülorbital 2 Elektronen In einer Doppelbindung besetzt ein bindendes Elektronenpaar ein -Molekülorbital, ein weiteres Elektronenpaar ein -Molekülorbital 4 Elektronen In einer Dreifachbindung besetzt ein bindendes Elektronenpaar ein -Molekülorbital, zwei weitere Elektronenpaare jeweils ein -Molekülorbital 6 Elektronen 32
33 Bindungsordnung - Tendenzen H H H 154 pm C C H H H DH Diss. = 410 kj/mol H 134 pm H C C H H Je größer die Bindungsordnung, desto stärker ist die Bindung. Mit steigender Bindungsordnung verkürzt sich die Länge einer Bindung: Bindungsordnung DH Diss. = 452 kj/mol H 114 pm C C H Anordnung der Atome im Raum mit bisher vorgestellter MO-Theorie noch nicht verstehbar => Hybridisierung / VSEPR DH Diss. = 523 kj/mol 33
34 Bindigkeit und Elektronenkonfiguration Gruppe n Bindigkeit Elektronenkonfiguration (2s 2p) 7. HG F 1 6. HG O 2 5. HG N 3 Bindigkeit entspricht Zahl der ungepaarten Elektronen: 8-n 4. HG C 4 3. HG B 3 2.HG Be 2 Bindigkeit entspricht Zahl der Elektronen: n 1. HG Li 1 34
35 Konstruktion von Lewis-Formeln Regeln I - ein Strich zwischen zwei Elementsymbolen entspricht einem bindenden Elektronenpaar. - ein Strich neben / über / unter einem Elementsymbol entspricht einem nichtbindenden / freien Elektronenpaar. - die Bindigkeit folgt für s- und p- Block Elemente der Anzahl ungepaarter Elektronen, also: Fluor einbindig, Sauerstoff zweibindig, Stickstoff dreibindig - Ziel ist es für jedes beteiligte Atom, an vier Elektronenpaaren teilzuhaben (Ausnahme H: nur ein Elektronenpaar). - unter Berücksichtigung der Molekülladung muss die Summe der Valenzelektronen stimmen! 35
36 Konstruktion von Lewis-Formeln einfache Beispiele 36
37 Elektronenbesetzung vs. Lewis-Formel Beispiel N 2 Lewis-Formel gibt Bindungsordnung und Gesamtelektronenzahl korrekt wieder, aber nicht die MO-Besetzung Bindungsordnung
38 Konstruktion von Lewis-Formeln Regeln II - bei mehreren möglichen Lewis-Formeln ist diejenige mit der größten Anzahl Bindungen und der kleinsten Anzahl Formalladungen zu wählen. - besitzt ein Atom unbesetzte d-orbitale, kann die Zahl von acht Außenelektronen, überschritten werden. Für p- Blockelemente ab der 2. Periode werden so dann oft 10 oder 12 Außenelektronen erreicht - die frühen Elemente der zweiten Periode (Li, Be, B) bilden häufig Verbindungen mit <8 Außenelektronen, man spricht dann von Oktettunterschreitung. - bei einer ungeraden Zahl von Elektronen werden ungepaarte Elektron mit einem Punkt gekennzeichnet. 38
39 Konstruktion von Lewis-Formeln weitere Beispiele Oktettunterschreitung für Bor 39
40 Konstruktion von Lewis-Formeln Mesomerie - manchmal sind mehrere, gleich wahrscheinliche Lewis- Formeln für eine Verbindung möglich. Sie stellen mesomere Grenzstrukturen der Bindungsverhältnisse dar, die Wahrheit ist oft einer Überlagerung der möglichen Strukturen ähnlich. Beispiel: Ozon (O 3 ) 40
41 Konstruktion von Lewis-Formeln Mesomerie 41
42 Wichtige Begriffe Lewis-Symbol Ionische Bindung, Coulomb-Wechselwirkung, Ionengitter, Ionenradius Metallische Bindung, Elektronengas, Legierung Kovalente Bindung, Molekülorbital, Linearkombination von Atomorbitalen (LCAO), σ- / π- Orbitale, Bindungsordnung von X 2 -Molekülen, Dia- / Paramagnetismus Konstruktion von Lewis-Formeln, Oktettunterschreitung / -erweiterung 42
Modul: Allgemeine Chemie
 Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
Chemische Bindungen Atombindung
 Atombindung Das Lewis Modell der kovalenten Bindung Die Entstehung von Molekülen beruht auf der Bildung von gemeinsamen, bindenden Elektronenpaaren in dem Bestreben der Atome, eine energetisch stabile
Atombindung Das Lewis Modell der kovalenten Bindung Die Entstehung von Molekülen beruht auf der Bildung von gemeinsamen, bindenden Elektronenpaaren in dem Bestreben der Atome, eine energetisch stabile
0.6 Einfache Modelle der chemischen Bindung
 0.6 Einfache Modelle der chemischen Bindung Ionenbindung Ionenbindungen entstehen durch Reaktion von ausgeprägt metallischen Elementen (Alkalimetalle und Erdalkalimetalle mit geringer Ionisierungsenergie)
0.6 Einfache Modelle der chemischen Bindung Ionenbindung Ionenbindungen entstehen durch Reaktion von ausgeprägt metallischen Elementen (Alkalimetalle und Erdalkalimetalle mit geringer Ionisierungsenergie)
Vorlesung Anorganische Chemie
 Vorlesung Anorganische Chemie Prof. Ingo Krossing WS 2007/08 B.Sc. Chemie Lernziele Block 4 Molekülstruktur Ausnahmen von der Oktettregel Hypervalente Verbindungen VSEPR Hybridisierung Molekülorbitale
Vorlesung Anorganische Chemie Prof. Ingo Krossing WS 2007/08 B.Sc. Chemie Lernziele Block 4 Molekülstruktur Ausnahmen von der Oktettregel Hypervalente Verbindungen VSEPR Hybridisierung Molekülorbitale
Vom Atom zum Molekül
 Vom Atom zum Molekül Ionenverbindungen Na + Cl NaCl lebensgefährlich giftig lebensgefährlich giftig lebensessentiell Metall + Nichtmetall Salz Beispiel Natriumchlorid Elektronenkonfiguration: 11Na: 1s(2)
Vom Atom zum Molekül Ionenverbindungen Na + Cl NaCl lebensgefährlich giftig lebensgefährlich giftig lebensessentiell Metall + Nichtmetall Salz Beispiel Natriumchlorid Elektronenkonfiguration: 11Na: 1s(2)
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Wechselwirkungen zwischen Atomen Was bisher geschah Quantenmechanisches
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Wechselwirkungen zwischen Atomen Was bisher geschah Quantenmechanisches
Das Lewis-Modell zur Erklärung kovalenter Bindungen
 Das Lewis-Modell zur Erklärung kovalenter Bindungen Erarbeiten Sie sich, innerhalb der Expertengruppe, einen Überblick über das Lewis-Modell zur Erklärung kovalenter Bindungen! Gehen Sie zusätzlich auf
Das Lewis-Modell zur Erklärung kovalenter Bindungen Erarbeiten Sie sich, innerhalb der Expertengruppe, einen Überblick über das Lewis-Modell zur Erklärung kovalenter Bindungen! Gehen Sie zusätzlich auf
4.2 Kovalente Bindung. Theorie der kovalenten Bindung, Gilbert Newton Lewis (1916)
 4.2 Kovalente Bindung Theorie der kovalenten Bindung, Gilbert Newton Lewis (1916) Treten Atome von Nichtmetallen miteinander in Wechselwirkung, kommt es nicht zu einer Übertragung von Elektronen. Nichtmetallatome
4.2 Kovalente Bindung Theorie der kovalenten Bindung, Gilbert Newton Lewis (1916) Treten Atome von Nichtmetallen miteinander in Wechselwirkung, kommt es nicht zu einer Übertragung von Elektronen. Nichtmetallatome
Chemische Bindungen Atombindung
 Atombindung Das Lewis Modell der kovalenten Bindung Bildung von Molekülen (Einfachbindungen) Aus jeweils einem ungepaarten Elektron eines Atoms bildet sich ein gemeinsames Elektronenpaar als Molekülorbital
Atombindung Das Lewis Modell der kovalenten Bindung Bildung von Molekülen (Einfachbindungen) Aus jeweils einem ungepaarten Elektron eines Atoms bildet sich ein gemeinsames Elektronenpaar als Molekülorbital
Welche Arten von Formeln stehen dem Chemiker zur Verfügung?
 Welche Arten von Formeln stehen dem Chemiker zur Verfügung? 1. Summenformeln 2. Valenzstrichformeln (Lewis-Strichformeln) 3. Strukturformeln Summenformel: Die Summenformel dient dazu Art und Anzahl der
Welche Arten von Formeln stehen dem Chemiker zur Verfügung? 1. Summenformeln 2. Valenzstrichformeln (Lewis-Strichformeln) 3. Strukturformeln Summenformel: Die Summenformel dient dazu Art und Anzahl der
Vorlesung Allgemeine Chemie (CH01)
 Vorlesung Allgemeine Chemie (CH01) Für Studierende im B.Sc.-Studiengang Chemie Prof. Dr. Martin Köckerling Arbeitsgruppe Anorganische Festkörperchemie Mathematisch-Naturwissenschaftliche Fakultät, Institut
Vorlesung Allgemeine Chemie (CH01) Für Studierende im B.Sc.-Studiengang Chemie Prof. Dr. Martin Köckerling Arbeitsgruppe Anorganische Festkörperchemie Mathematisch-Naturwissenschaftliche Fakultät, Institut
4.Teil Kovalente Bindung
 4.Teil Kovalente Bindung Lewis-Konzept, Valenstrichformel, Oktettregel Polare Elektronenpaarbindung und Elektronegativität Gebrochene Bindungsordnung und Mesomerie Valenzschalen-Elektronenpaar-Abstoßungsmodell
4.Teil Kovalente Bindung Lewis-Konzept, Valenstrichformel, Oktettregel Polare Elektronenpaarbindung und Elektronegativität Gebrochene Bindungsordnung und Mesomerie Valenzschalen-Elektronenpaar-Abstoßungsmodell
Chemie für Biologen WS 2005/6 Arne Lützen Institut für Organische Chemie der Universität Duisburg-Essen (Teil 5: )
 Chemie für Biologen WS 2005/6 Arne Lützen Institut für rganische Chemie der Universität Duisburg-Essen (Teil 5: 23.11.2005) Kovalente Bindung Atome können sich Valenzelektronen unter Ausbildung von Bindungen
Chemie für Biologen WS 2005/6 Arne Lützen Institut für rganische Chemie der Universität Duisburg-Essen (Teil 5: 23.11.2005) Kovalente Bindung Atome können sich Valenzelektronen unter Ausbildung von Bindungen
Grundwissen Chemie 9. Jahrgangsstufe
 Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar Gasgemisch z.b. Legierung Reinstoff
Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar Gasgemisch z.b. Legierung Reinstoff
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Organisatorisches Kurs-Skript http://www.uni-due.de/ adb297b
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Organisatorisches Kurs-Skript http://www.uni-due.de/ adb297b
Grundlagen der Chemie Die Atombindung Kovalente Bindungen
 Die Atombindung Kovalente Bindungen Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu Kovalente Bindungen In einem
Die Atombindung Kovalente Bindungen Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu Kovalente Bindungen In einem
Welche beiden Metalle prägten eine Epoche?
 Posten 1a Welche beiden Metalle prägten eine Epoche? a) Silber / Gold (=> Posten 2a) b) Bronze / Eisen (=> Posten 3d) c) Eisen / Gold (=> Posten 4j) d) Silber / Bronze (=> Posten 5s) Posten 2d Welcher
Posten 1a Welche beiden Metalle prägten eine Epoche? a) Silber / Gold (=> Posten 2a) b) Bronze / Eisen (=> Posten 3d) c) Eisen / Gold (=> Posten 4j) d) Silber / Bronze (=> Posten 5s) Posten 2d Welcher
Valenz-Bindungstheorie H 2 : s Ueberlappung von Atomorbitalen s-bindung: 2 Elektronen in einem Orbital zylindrischer Symmetrie
 Valenz-Bindungstheorie Beschreibung von Molekülen mit Hilfe von Orbitalen H H H 2 : H 2 s Ueberlappung von Atomorbitalen s-bindung: 2 Elektronen in einem Orbital zylindrischer Symmetrie um die interatomare
Valenz-Bindungstheorie Beschreibung von Molekülen mit Hilfe von Orbitalen H H H 2 : H 2 s Ueberlappung von Atomorbitalen s-bindung: 2 Elektronen in einem Orbital zylindrischer Symmetrie um die interatomare
Wiederholung der letzten Vorlesungsstunde:
 Wiederholung der letzten Vorlesungsstunde: Chemische Bindungen, starke, schwache Bindungen, Elektronenpaarbindung, bindende und freie Elektronenpaare, Oktettregel, Edelgaskonfiguration, Lewis-Formeln,
Wiederholung der letzten Vorlesungsstunde: Chemische Bindungen, starke, schwache Bindungen, Elektronenpaarbindung, bindende und freie Elektronenpaare, Oktettregel, Edelgaskonfiguration, Lewis-Formeln,
Grundwissen 8. Klasse 1 Grundwissen 8. Klasse 1. Grundwissen 8. Klasse 2 Grundwissen 8. Klasse 2. Stoffebene
 Grundwissen 8. Klasse 1 Grundwissen 8. Klasse 1 Stoff Einteilung der Stoffe Reinstoff mischen Gemisch Stelle in einem Fließdiagramm folgende Begriffe zueinander in Beziehung: Stoff, Reinstoff, Gemisch,
Grundwissen 8. Klasse 1 Grundwissen 8. Klasse 1 Stoff Einteilung der Stoffe Reinstoff mischen Gemisch Stelle in einem Fließdiagramm folgende Begriffe zueinander in Beziehung: Stoff, Reinstoff, Gemisch,
Vorlesung Allgemeine Chemie: Chemische Bindung
 Vorlesung Allgemeine Chemie: Chemische Bindung Inhalte Gruppentendenzen: Alkalimetalle, Halogene, Reaktion mit H 2 und H 2 O, basische und saure Oxide, Ionenbindung, Gitterenergie, Tendenzen in Abhängigkeit
Vorlesung Allgemeine Chemie: Chemische Bindung Inhalte Gruppentendenzen: Alkalimetalle, Halogene, Reaktion mit H 2 und H 2 O, basische und saure Oxide, Ionenbindung, Gitterenergie, Tendenzen in Abhängigkeit
1.1 Darstellung organischer Verbindungen
 1 Lösung 1 AC/OC I, HS 2017 1.1 Darstellung organischer Verbindungen Organische Verbindungen können auf verschiedene Weise dargestellt werden. Ergänzen Sie die untenstehenden Beispiele von Harnstoff, Ethylenglykol
1 Lösung 1 AC/OC I, HS 2017 1.1 Darstellung organischer Verbindungen Organische Verbindungen können auf verschiedene Weise dargestellt werden. Ergänzen Sie die untenstehenden Beispiele von Harnstoff, Ethylenglykol
Chemie für Biologen SS Georg Jansen AG Theoretische Organische Chemie Universität Duisburg Essen. (Teil 3: Kovalente Bindungen)
 Chemie für Biologen SS 2007 Georg Jansen AG Theoretische rganische Chemie Universität Duisburg Essen (Teil 3: Kovalente Bindungen) (3) Kovalente Bindung Atome können sich Valenzelektronen unter Ausbildung
Chemie für Biologen SS 2007 Georg Jansen AG Theoretische rganische Chemie Universität Duisburg Essen (Teil 3: Kovalente Bindungen) (3) Kovalente Bindung Atome können sich Valenzelektronen unter Ausbildung
Atome und Bindungen. Was sollen Sie mitnehmen?
 Was sollen Sie mitnehmen? Elementare Grundlagen: Atome und Bindungen Schalenmodell Orbitalmodell Periodensystem der Elemente Typische Eigenschaften der Elemente Die vier Bindungstypen Kovalente Bindung
Was sollen Sie mitnehmen? Elementare Grundlagen: Atome und Bindungen Schalenmodell Orbitalmodell Periodensystem der Elemente Typische Eigenschaften der Elemente Die vier Bindungstypen Kovalente Bindung
Vorlesung Allgemeine Chemie: Chemische Bindung
 Vorlesung Allgemeine Chemie: Chemische Bindung Inhalte Gruppentendenzen: Alkalimetalle, Halogene, Reaktion mit H 2 und H 2 O, basische und saure Oxide, Ionenbindung, Gitterenergie, Tendenzen in Abhängigkeit
Vorlesung Allgemeine Chemie: Chemische Bindung Inhalte Gruppentendenzen: Alkalimetalle, Halogene, Reaktion mit H 2 und H 2 O, basische und saure Oxide, Ionenbindung, Gitterenergie, Tendenzen in Abhängigkeit
Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie,
 Wiederholung der letzten Vorlesungsstunde: Thema: Chemische h Bindungen Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie, unterschiedliche Arten chemischer Bindungen, Atombindung, kovalente
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische h Bindungen Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie, unterschiedliche Arten chemischer Bindungen, Atombindung, kovalente
Thema heute: Chemische Bindungen, Teil I
 Wiederholung der letzten Vorlesungsstunde: Periodensystem, Anordnung der Elemente nach steigender Ordnungszahl, Hauptgruppen, Nebengruppen, Lanthanoide + Actinoide, Perioden, Döbereiner, Meyer, Medelejew
Wiederholung der letzten Vorlesungsstunde: Periodensystem, Anordnung der Elemente nach steigender Ordnungszahl, Hauptgruppen, Nebengruppen, Lanthanoide + Actinoide, Perioden, Döbereiner, Meyer, Medelejew
Bindungstheorie Elektronenoktett durch Übertragung von Elektronen: Ionenbindung
 Bindungstheorie Elektronenoktett durch Übertragung von Elektronen: Ionenbindung al: (Elektronegativität: a 0.9 l 3.1) a (1s 2, 2s 2, 2p 6, 3s 1 ) a + (1s 2, 2s 2, 2p 6 ) + e eon-konfiguration l (1s 2,
Bindungstheorie Elektronenoktett durch Übertragung von Elektronen: Ionenbindung al: (Elektronegativität: a 0.9 l 3.1) a (1s 2, 2s 2, 2p 6, 3s 1 ) a + (1s 2, 2s 2, 2p 6 ) + e eon-konfiguration l (1s 2,
Grundwissen 8.Klasse 1 Grundwissen 8.Klasse 1. Grundwissen 8.Klasse 2 Grundwissen 8.Klasse 2. Stoffebene. Teilchen -ebene
 Grundwissen 8.Klasse 1 Grundwissen 8.Klasse 1 Stoff Reinstoff mischen Gemisch Einteilung der Stoffe Bei gleichen Bedingungen (Temp., Druck) immer gleiche Eigenschaften (z.b. Schmelz- /Siedetemp., Löslichkeit,
Grundwissen 8.Klasse 1 Grundwissen 8.Klasse 1 Stoff Reinstoff mischen Gemisch Einteilung der Stoffe Bei gleichen Bedingungen (Temp., Druck) immer gleiche Eigenschaften (z.b. Schmelz- /Siedetemp., Löslichkeit,
Atome und Bindungen. Was sollen Sie mitnehmen?
 Was sollen Sie mitnehmen? Elementare Grundlagen: Atome und Bindungen Schalenmodell Orbitalmodell Periodensystem der Elemente Typische Eigenschaften der Elemente Die vier Bindungstypen Kovalente Bindung
Was sollen Sie mitnehmen? Elementare Grundlagen: Atome und Bindungen Schalenmodell Orbitalmodell Periodensystem der Elemente Typische Eigenschaften der Elemente Die vier Bindungstypen Kovalente Bindung
Grundtypen der Bindung. Grundtypen chemischer Bindung. Oktettregel. A.8.1. Atombindung
 Grundtypen der Bindung Grundtypen chemischer Bindung Oktettregel A.8.1. Atombindung 1 A.8.1 Atombindung Valenz (Zahl der Bindungen) Atombindung auch: kovalente Bindung, ElektronenpaarBindung Zwei Atome
Grundtypen der Bindung Grundtypen chemischer Bindung Oktettregel A.8.1. Atombindung 1 A.8.1 Atombindung Valenz (Zahl der Bindungen) Atombindung auch: kovalente Bindung, ElektronenpaarBindung Zwei Atome
Besetzung der Orbitale
 Frage Beim Wiederholen des Stoffes bin ich auf die Rechnung zur Energie gestoßen. Warum und zu welchem Zweck haben wir das gemacht? Was kann man daran jetzt erkennen? Was beschreibt die Formel zu E(n),
Frage Beim Wiederholen des Stoffes bin ich auf die Rechnung zur Energie gestoßen. Warum und zu welchem Zweck haben wir das gemacht? Was kann man daran jetzt erkennen? Was beschreibt die Formel zu E(n),
08.12.2013. Wichtige Stoffgruppen. Stoffgruppe. Atomverband. Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Metall Metall:
 1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter) - Salze Nichtmetall Nichtmetall:
1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter) - Salze Nichtmetall Nichtmetall:
Grundwissenkarten Hans-Carossa-Gymnasium. 9. Klasse. Chemie SG
 Grundwissenkarten Hans-Carossa-Gymnasium 9. Klasse Chemie SG Es sind insgesamt 18 Karten für die 9. Klasse erarbeitet. Karten ausschneiden : Es ist auf der linken Blattseite die Vorderseite mit Frage/Aufgabe,
Grundwissenkarten Hans-Carossa-Gymnasium 9. Klasse Chemie SG Es sind insgesamt 18 Karten für die 9. Klasse erarbeitet. Karten ausschneiden : Es ist auf der linken Blattseite die Vorderseite mit Frage/Aufgabe,
Die chemische Bindung
 Die chemische Bindung Die Valenz-Bond Theorie Molekülorbitale Die Bänder Theorie der Festkörper bei einer ionischen Bindung bildet bildet sich ein Dipol aus ('Übertragung von Elektronen') Eine kovalente
Die chemische Bindung Die Valenz-Bond Theorie Molekülorbitale Die Bänder Theorie der Festkörper bei einer ionischen Bindung bildet bildet sich ein Dipol aus ('Übertragung von Elektronen') Eine kovalente
Grundwissen 9.Klasse SG 1 Grundwissen 9.Klasse SG 1. Grundwissen 9.Klasse SG 2 Grundwissen 9.Klasse SG 2. Stoffebene.
 Grundwissen 9.Klasse SG 1 Grundwissen 9.Klasse SG 1 Stoff Reinstoff mischen Gemisch Einteilung der Stoffe Bei gleichen Bedingungen (Temp., Druck) immer gleiche Eigenschaften (z.b. Schmelz- /Siedetemp.,
Grundwissen 9.Klasse SG 1 Grundwissen 9.Klasse SG 1 Stoff Reinstoff mischen Gemisch Einteilung der Stoffe Bei gleichen Bedingungen (Temp., Druck) immer gleiche Eigenschaften (z.b. Schmelz- /Siedetemp.,
Vorlesung Anorganische Chemie
 Vorlesung Anorganische Chemie Prof. Ingo Krossing WS 2007/08 B.Sc. Chemie Nur zur Information: So So würden die f-orbitale räumlich aussehen 1 Lernziele Block 3 Atom-Eigenschaften Eigenschaften Ionisierungsenergie
Vorlesung Anorganische Chemie Prof. Ingo Krossing WS 2007/08 B.Sc. Chemie Nur zur Information: So So würden die f-orbitale räumlich aussehen 1 Lernziele Block 3 Atom-Eigenschaften Eigenschaften Ionisierungsenergie
[ ] 1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe + - Moleküle aus gleichen Atomen. Ionen. Moleküle aus verschiedenen Atomen
![[ ] 1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe + - Moleküle aus gleichen Atomen. Ionen. Moleküle aus verschiedenen Atomen [ ] 1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe + - Moleküle aus gleichen Atomen. Ionen. Moleküle aus verschiedenen Atomen](/thumbs/68/58264490.jpg) 1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe Gemische Reinstoffe Elemente Verbindungen gleiche Atome Moleküle aus gleichen Atomen Moleküle aus verschiedenen Atomen Ionen + Kation Anion z.b.
1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe Gemische Reinstoffe Elemente Verbindungen gleiche Atome Moleküle aus gleichen Atomen Moleküle aus verschiedenen Atomen Ionen + Kation Anion z.b.
Zeichnen von Valenzstrichformeln
 Zeichnen von Valenzstrichformeln ür anorganische Salze werden keine Valenzstrichformeln gezeichnet, da hier eine ionische Bindung vorliegt. Die Elektronen werden vollständig übertragen und die Ionen bilden
Zeichnen von Valenzstrichformeln ür anorganische Salze werden keine Valenzstrichformeln gezeichnet, da hier eine ionische Bindung vorliegt. Die Elektronen werden vollständig übertragen und die Ionen bilden
Übungen zu Physik 2 für Maschinenwesen
 Physikdepartment E13 SS 011 Übungen zu Physik für Maschinenwesen Prof. Dr. Peter Müller-Buschbaum, Dr. Eva M. Herzig, Dr. Volker Körstgens, David Magerl, Markus Schindler, Moritz v. Sivers Vorlesung 1.07.011,
Physikdepartment E13 SS 011 Übungen zu Physik für Maschinenwesen Prof. Dr. Peter Müller-Buschbaum, Dr. Eva M. Herzig, Dr. Volker Körstgens, David Magerl, Markus Schindler, Moritz v. Sivers Vorlesung 1.07.011,
Grundpraktikum für Biologen 2016
 Grundpraktikum für Biologen 2016 31.03.2016 Übersicht # 2 Kovalente Bindung Freies Elektronenpaar Einzelnes Elektron Oktett erfüllt Einzelne Chloratome haben einen Elektronenmangel Reaktion zu Cl 2 erfüllt
Grundpraktikum für Biologen 2016 31.03.2016 Übersicht # 2 Kovalente Bindung Freies Elektronenpaar Einzelnes Elektron Oktett erfüllt Einzelne Chloratome haben einen Elektronenmangel Reaktion zu Cl 2 erfüllt
Stoffgemisch. Reinstoff. Homogenes Gemisch. Heterogenes Gemisch. ( 8. Klasse NTG 1 / 48 ) ( 8. Klasse NTG 2 / 48 ) ( 8. Klasse NTG 3 / 48 )
 Stoffgemisch ( 8. Klasse NTG 1 / 48 ) besteht aus zwei oder mehr verschiedenen Reinstoffen Gemisch unterschiedlicher kleinster Teilchen Trennung durch physikalische Methoden möglich Reinstoff ( 8. Klasse
Stoffgemisch ( 8. Klasse NTG 1 / 48 ) besteht aus zwei oder mehr verschiedenen Reinstoffen Gemisch unterschiedlicher kleinster Teilchen Trennung durch physikalische Methoden möglich Reinstoff ( 8. Klasse
Übungsaufgaben zur Vorlesung Chemie für Biologen, WS 2005/2006
 Übungsaufgaben zur Vorlesung hemie für Biologen, WS 2005/2006 Themenbereiche Atombau, chemische Bindung, Stöchiometrie, Aggregatzustände 1. Ergänzen Sie folgende Tabelle: Symbol Z M Protonen eutronen Elektronen
Übungsaufgaben zur Vorlesung hemie für Biologen, WS 2005/2006 Themenbereiche Atombau, chemische Bindung, Stöchiometrie, Aggregatzustände 1. Ergänzen Sie folgende Tabelle: Symbol Z M Protonen eutronen Elektronen
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen II
 Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen II Elektronenpaarbindung, Elektronegativität, polare Atombindung, Dipolmoment, Hybridisierung von Atomorbitalen, sp 3 -, sp 2 -, sp-hybridorbitale,
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen II Elektronenpaarbindung, Elektronegativität, polare Atombindung, Dipolmoment, Hybridisierung von Atomorbitalen, sp 3 -, sp 2 -, sp-hybridorbitale,
Unser Wissen über Atom- und Molekülorbitale wenden wir nun an, um zweiatomige Moleküle der Elemente der 2. Periode zu bilden.
 Additum 6.1 Übersicht und Lernziele Thema Unser Wissen über Atom- und orbitale wenden wir nun an, um zweiatomige e der Elemente der 2. Periode zu bilden. Lernziele 1. Es ist Ihnen möglich, nach dem Studium
Additum 6.1 Übersicht und Lernziele Thema Unser Wissen über Atom- und orbitale wenden wir nun an, um zweiatomige e der Elemente der 2. Periode zu bilden. Lernziele 1. Es ist Ihnen möglich, nach dem Studium
Definiere den Begriff Chemischer Vorgang! Definiere den Begriff Physikalischer Vorgang!
 Chemischer Vorgang! Stoffänderung, keine Zustandsänderung, mit Energiebeteiligung Physikalischer Vorgang! Zustandsänderung, keine Stoffänderung (z.b. Lösen, Aggregatzustände,...) Erkläre die Begriffe heterogenes
Chemischer Vorgang! Stoffänderung, keine Zustandsänderung, mit Energiebeteiligung Physikalischer Vorgang! Zustandsänderung, keine Stoffänderung (z.b. Lösen, Aggregatzustände,...) Erkläre die Begriffe heterogenes
Chemie-Grundwissen der 9.Klasse
 Chemie-Grundwissen der 9.Klasse Stoffebene = Makroskopische (sichtbare) Ebene Betrachtung einer Stoffportion mit den erkennbaren und messbaren Eigenschaften Teilchenebene = Submikroskopische Ebene Betrachtung
Chemie-Grundwissen der 9.Klasse Stoffebene = Makroskopische (sichtbare) Ebene Betrachtung einer Stoffportion mit den erkennbaren und messbaren Eigenschaften Teilchenebene = Submikroskopische Ebene Betrachtung
Übungen zur Vorlesung Physikalische Chemie II Lösungsvorschlag zu Blatt 5
 Wintersemester 006 / 007 04.1.006 1. Aufgabe Die Wellenfunktionen unterscheiden sich gar nicht. Während der Lösung der elektronischen Schrödingergleichung werden die Kerne als ruhend betrachtet. Es kommt
Wintersemester 006 / 007 04.1.006 1. Aufgabe Die Wellenfunktionen unterscheiden sich gar nicht. Während der Lösung der elektronischen Schrödingergleichung werden die Kerne als ruhend betrachtet. Es kommt
Arbeitsblatt: Bindungsarten & ihre Beschreibung durch AOs 3 (EVA geeignet)
 Ph/Ch UE Quantenchemie Datum: Arbeitsblatt: Bindungsarten & ihre Beschreibung durch AOs 3 (EVA geeignet) 5 Ziel: Darstellung von MOs aus AOs erklärt Bindungsarten Man kann an den elektrischen Ladungsdichten
Ph/Ch UE Quantenchemie Datum: Arbeitsblatt: Bindungsarten & ihre Beschreibung durch AOs 3 (EVA geeignet) 5 Ziel: Darstellung von MOs aus AOs erklärt Bindungsarten Man kann an den elektrischen Ladungsdichten
Wiederholung der letzten Vorlesungsstunde:
 Wiederholung der letzten Vorlesungsstunde: Periodensystem, Anordnung der Elemente nach steigender Ordnungszahl, Hauptgruppen, Nebengruppen, Lanthanoide + Actinoide, Perioden, Döbereiner, Meyer, Medelejew
Wiederholung der letzten Vorlesungsstunde: Periodensystem, Anordnung der Elemente nach steigender Ordnungszahl, Hauptgruppen, Nebengruppen, Lanthanoide + Actinoide, Perioden, Döbereiner, Meyer, Medelejew
CHEMIE KAPITEL 1 AUFBAU DER MATERIE. Timm Wilke. Georg-August-Universität Göttingen. Wintersemester 2014 / 2015
 CHEMIE KAPITEL 1 AUFBAU DER MATERIE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2014 / 2015 Folie 2 Valenzelektronen und Atomeigenschaften Valenzelektronen (Außenelektronen) bestimmen
CHEMIE KAPITEL 1 AUFBAU DER MATERIE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2014 / 2015 Folie 2 Valenzelektronen und Atomeigenschaften Valenzelektronen (Außenelektronen) bestimmen
Grundwissen Chemie 8. Klasse NTG
 Grundwissen Chemie 8. Klasse NTG Reinstoff hat gleich bleibende Eigenschaften (Stoffebene) besteht aus einer Sorte gleichartiger Teilchen z.b.: dest. Wasser, Kupfer, Gold, Salz 8.1 C NTG Element sind nicht
Grundwissen Chemie 8. Klasse NTG Reinstoff hat gleich bleibende Eigenschaften (Stoffebene) besteht aus einer Sorte gleichartiger Teilchen z.b.: dest. Wasser, Kupfer, Gold, Salz 8.1 C NTG Element sind nicht
Grundwissen Chemie 8. Jahrgangsstufe
 Grundwissen Chemie 8. Jahrgangsstufe 1. Stoffeigenschaften und Teilchenmodell Teilchenmodell: Alle Stoffe bestehen aus kleinsten Teilchen, die man sich am einfachsten als Kugeln vorstellen kann (Kugelteilchenmodell).
Grundwissen Chemie 8. Jahrgangsstufe 1. Stoffeigenschaften und Teilchenmodell Teilchenmodell: Alle Stoffe bestehen aus kleinsten Teilchen, die man sich am einfachsten als Kugeln vorstellen kann (Kugelteilchenmodell).
Aufstellen von Valenzstrichformeln
 Anleitung: n - Descartes-Gymnasium Neuburg Autor: M. Helldobler Seite 1 Aufstellen von n 1. Grundlagen zum Aufstellen von n Verwendete Abkürzungen: VE = Valenzelektron(en) VSF = (n) VEP = Valenzelektronenpaar(e)
Anleitung: n - Descartes-Gymnasium Neuburg Autor: M. Helldobler Seite 1 Aufstellen von n 1. Grundlagen zum Aufstellen von n Verwendete Abkürzungen: VE = Valenzelektron(en) VSF = (n) VEP = Valenzelektronenpaar(e)
Einheiten und Einheitenrechnungen
 Chemie für Studierende der Human- und Zahnmedizin WS 2013/14 Übungsblatt 1: allgemeine Chemie, einfache Berechnungen, Periodensystem, Orbitalbesetzung, Metalle und Salze Einheiten und Einheitenrechnungen
Chemie für Studierende der Human- und Zahnmedizin WS 2013/14 Übungsblatt 1: allgemeine Chemie, einfache Berechnungen, Periodensystem, Orbitalbesetzung, Metalle und Salze Einheiten und Einheitenrechnungen
Vorlesung Allgemeine Chemie (CH01)
 Vorlesung Allgemeine Chemie (CH01) Für Studierende im B.Sc.-Studiengang Chemie Prof. Dr. Martin Köckerling Arbeitsgruppe Anorganische Festkörperchemie Mathematisch-Naturwissenschaftliche Fakultät, Institut
Vorlesung Allgemeine Chemie (CH01) Für Studierende im B.Sc.-Studiengang Chemie Prof. Dr. Martin Köckerling Arbeitsgruppe Anorganische Festkörperchemie Mathematisch-Naturwissenschaftliche Fakultät, Institut
Vorkurs Allgemeine Chemie für Ingenieure und Biologen 20. Oktober 2015 Dr. Helmut Sitzmann, Apl.-Professor für Anorganische Chemie
 Vorkurs Allgemeine Chemie für Ingenieure und Biologen 20. Oktober 2015 Dr. Helmut Sitzmann, Apl.-Professor für Anorganische Chemie DIE CHEMISCHE BINDUNG Ionische Bindung, Beispiel Natriumchlorid Trifft
Vorkurs Allgemeine Chemie für Ingenieure und Biologen 20. Oktober 2015 Dr. Helmut Sitzmann, Apl.-Professor für Anorganische Chemie DIE CHEMISCHE BINDUNG Ionische Bindung, Beispiel Natriumchlorid Trifft
Ionenbindungen. Chemie. Library
 Chemie Ionenbindungen Library IONENBINDUNGEN Begriffserklärung 1 Formeltabelle 1 Ladungsermittlung 2 Formale Ladung 3 Hydrogen-Ionen 3 Verhältnisformeln 4 Nomenklatur 4 Gitterenthalpie 4 Eigenschaften
Chemie Ionenbindungen Library IONENBINDUNGEN Begriffserklärung 1 Formeltabelle 1 Ladungsermittlung 2 Formale Ladung 3 Hydrogen-Ionen 3 Verhältnisformeln 4 Nomenklatur 4 Gitterenthalpie 4 Eigenschaften
Moleküle. Zweiatomige Moleküle: H 2+
 Moleküle Zweiatomige Moleküle: 2+ : zwei Kerne, ein Elektron Der Abstand zwischen den Atomkernen wird so klein gewählt, dass die 1s-Orbitale überlappen und durch Linearkombination Molekülorbitale gebildet
Moleküle Zweiatomige Moleküle: 2+ : zwei Kerne, ein Elektron Der Abstand zwischen den Atomkernen wird so klein gewählt, dass die 1s-Orbitale überlappen und durch Linearkombination Molekülorbitale gebildet
Werkstoffkunde Chemische Bindungsarten
 Folie 1/27 Die Elektronen auf der äußersten Schale eines Atoms (Außenelektronen oder Valenzelektronen genannt) bestimmen maßgeblich die chemischen Eigenschaften. Jedes Atom hat dabei das Bestreben die
Folie 1/27 Die Elektronen auf der äußersten Schale eines Atoms (Außenelektronen oder Valenzelektronen genannt) bestimmen maßgeblich die chemischen Eigenschaften. Jedes Atom hat dabei das Bestreben die
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Lernwerkstatt: Atombindung. Das komplette Material finden Sie hier:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Atombindung Das komplette Material finden Sie hier: School-Scout.de Titel: Atombindungen Reihe: Lernwerkstatt Bestellnummer:
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Atombindung Das komplette Material finden Sie hier: School-Scout.de Titel: Atombindungen Reihe: Lernwerkstatt Bestellnummer:
Quantenzahlen. Magnetquantenzahl m => entspricht der Zahl und Orien- (m = -l, -(l-1) 0 +(l-1), +l) tierung der Orbitale in jeder Unterschale.
 Quantenzahlen Magnetquantenzahl m => entspricht der Zahl und Orien- (m = -l, -(l-1) 0 +(l-1), +l) tierung der Orbitale in jeder Unterschale. l = 0, 1, 2, 3, (Orbital-)Symbol s, p, d, f, Zahl der Orbitale
Quantenzahlen Magnetquantenzahl m => entspricht der Zahl und Orien- (m = -l, -(l-1) 0 +(l-1), +l) tierung der Orbitale in jeder Unterschale. l = 0, 1, 2, 3, (Orbital-)Symbol s, p, d, f, Zahl der Orbitale
Stoffgemisch. Reinstoff. Homogenes Gemisch. Heterogenes Gemisch. ( 9. Kl. SG - WSG 1 / 56 ) ( 9. Kl. SG - WSG 2 / 56 ) ( 9. Kl.
 Stoffgemisch ( 9. Kl. SG - WSG 1 / 56 ) besteht aus zwei oder mehr verschiedenen Reinstoffen Gemisch unterschiedlicher kleinster Teilchen Trennung durch physikalische Methoden möglich Reinstoff ( 9. Kl.
Stoffgemisch ( 9. Kl. SG - WSG 1 / 56 ) besteht aus zwei oder mehr verschiedenen Reinstoffen Gemisch unterschiedlicher kleinster Teilchen Trennung durch physikalische Methoden möglich Reinstoff ( 9. Kl.
2. Elektroneneffekte in den organischen Molekülen
 2. Elektroneneffekte in den organischen Molekülen Induktive und mesomere Effekte Die Ladungsverteilung in einer Kohlenwasserstoffkette wird durch Substituenten (Halogen, OH, NH 2 usw.) beeinflusst. Man
2. Elektroneneffekte in den organischen Molekülen Induktive und mesomere Effekte Die Ladungsverteilung in einer Kohlenwasserstoffkette wird durch Substituenten (Halogen, OH, NH 2 usw.) beeinflusst. Man
F Das Periodensystem. Allgemeine Chemie 26
 Allgemeine Chemie 6 F Das Periodensystem Aufgestellt von Mendelejew und Meyer 1869 (rein empirisch!) Perioden in Zeilen: mit jeder Periode erhöht sich die auptquantenzahl der äußeren Schale (s-rbital)
Allgemeine Chemie 6 F Das Periodensystem Aufgestellt von Mendelejew und Meyer 1869 (rein empirisch!) Perioden in Zeilen: mit jeder Periode erhöht sich die auptquantenzahl der äußeren Schale (s-rbital)
Prof. Christoffers, Vorlesung Organische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler
 Prof. hristoffers, Vorlesung Organische hemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 1. inführung 1.1 Atomorbitale Die Atome im Molekülverband werden durch lektronen
Prof. hristoffers, Vorlesung Organische hemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 1. inführung 1.1 Atomorbitale Die Atome im Molekülverband werden durch lektronen
1. Stoffe und Eigenschaften
 1. Stoffe und Eigenschaften Chemischer Vorgang Stoffänderung, keine Zustandsänderung Physikalischer Vorgang Lösung Zustandsänderung, keine Stoffänderung (z.b. Lösen, Aggregatzustände,...) Homogenes Gemisch
1. Stoffe und Eigenschaften Chemischer Vorgang Stoffänderung, keine Zustandsänderung Physikalischer Vorgang Lösung Zustandsänderung, keine Stoffänderung (z.b. Lösen, Aggregatzustände,...) Homogenes Gemisch
Learn4Med. Es gibt in der Chemie drei verschiedene Arten von Bindungen: Metallische Bindung: zwischen zwei Metallen, es entsteht ein Metall
 6. Chemische Bindung Es gibt in der Chemie drei verschiedene Arten von Bindungen: Metallische Bindung: zwischen zwei Metallen, es entsteht ein Metall Atombindung: zwischen zwei Nichtmetallen, es entsteht
6. Chemische Bindung Es gibt in der Chemie drei verschiedene Arten von Bindungen: Metallische Bindung: zwischen zwei Metallen, es entsteht ein Metall Atombindung: zwischen zwei Nichtmetallen, es entsteht
Kochsalz-Kristalle (Halit) Wichtige Stoffgruppen Atomverband Stoffgruppe Metall Metall: Metallische Stoffe Salzartige Stoffe Metall Nichtmetall:
 Kochsalz-Kristalle (Halit) 1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter)
Kochsalz-Kristalle (Halit) 1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter)
Wie sind Atome aufgebaut Welche Informationen enthält das Periodensystem?
 2. DIE KLEINSTEN TEILCHEN ARBEITSBLATT 2.1 DER ATOMAUFBAU FRAGE Wie sind Atome aufgebaut Welche Informationen enthält das Periodensystem? Bausteine der Atome Ladung (+, -, 0) Masse (hoch, sehr gering)
2. DIE KLEINSTEN TEILCHEN ARBEITSBLATT 2.1 DER ATOMAUFBAU FRAGE Wie sind Atome aufgebaut Welche Informationen enthält das Periodensystem? Bausteine der Atome Ladung (+, -, 0) Masse (hoch, sehr gering)
3. Bausteine der Materie: Atomhülle. Form der Atomorbitale. s-orbitale kugelsymmetrische Elektronendichteverteilung
 3. Bausteine der Materie: Atomhülle Form der Atomorbitale s-orbitale kugelsymmetrische Elektronendichteverteilung 1s 2s 3d - Orbitale 3. Bausteine der Materie: Atomhülle 3. Bausteine der Materie: Atomhülle
3. Bausteine der Materie: Atomhülle Form der Atomorbitale s-orbitale kugelsymmetrische Elektronendichteverteilung 1s 2s 3d - Orbitale 3. Bausteine der Materie: Atomhülle 3. Bausteine der Materie: Atomhülle
Musterprüfung Welche der Elemente Lithium, Kohlenstoff, Wasserstoff, Sauerstoff, Magnesium, Aluminium und Calcium sind Nichtmetalle?
 Module: Atombau und Periodensystem Chemische Bindungen Chemische Reaktionen 1 Musterprüfung 1. Teil: Atombau und Periodensystem 1.1. Welche Art von Teilchen befinden sich a) im Atomkern b) in der Elektronenhülle
Module: Atombau und Periodensystem Chemische Bindungen Chemische Reaktionen 1 Musterprüfung 1. Teil: Atombau und Periodensystem 1.1. Welche Art von Teilchen befinden sich a) im Atomkern b) in der Elektronenhülle
Übungsaufgaben zur Atombindung, zum EPA-Modell und zur Polarität
 Übungsaufgaben zur Atombindung, zum EPA-Modell und zur Polarität 1. Strukturformeln aufstellen, Grundlagen zu polaren Bindungen 1.1 a) Weshalb ist Wasserstoff in Molekülverbindungen einbindig (d.h. geht
Übungsaufgaben zur Atombindung, zum EPA-Modell und zur Polarität 1. Strukturformeln aufstellen, Grundlagen zu polaren Bindungen 1.1 a) Weshalb ist Wasserstoff in Molekülverbindungen einbindig (d.h. geht
Grundwissen C8 NTG. 1. Stoffe und Reaktionen. Reinstoff
 Grundwissen C8 NTG 1. Stoffe und Reaktionen Reinstoff Stoffgemisch - besitzt unter bestimmten Bedingungen (z.b. Temperatur, Druck ) kennzeichnende Eigenschaften, z.b. Farbe, Geruch, Geschmack, Dichte,
Grundwissen C8 NTG 1. Stoffe und Reaktionen Reinstoff Stoffgemisch - besitzt unter bestimmten Bedingungen (z.b. Temperatur, Druck ) kennzeichnende Eigenschaften, z.b. Farbe, Geruch, Geschmack, Dichte,
Lösung 14. Allgemeine Chemie II Frühjahrsemester 2013
 Lösung 14 Allgemeine Chemie II Frühjahrsemester 2013 1. Aufgabe Bohr hat für das Wasserstoffatom ein Modell erstellt, das der klassischen Mechanik gehorcht und gewisse Ähnlichkeiten mit dem Planetenmodell
Lösung 14 Allgemeine Chemie II Frühjahrsemester 2013 1. Aufgabe Bohr hat für das Wasserstoffatom ein Modell erstellt, das der klassischen Mechanik gehorcht und gewisse Ähnlichkeiten mit dem Planetenmodell
Organische Chemie. Kapitel 1. Organic Chemistry 4 th Edition Paula Yurkanis Bruice. Organische Verbindungen enthalten Kohlenstoff
 rganic Chemistry 4 th Edition Paula Yurkanis Bruice Kapitel 1 Elektronische Struktur und Bindung Säuren und Basen rganische Chemie rganische Verbindungen enthalten Kohlenstoff Kohlenstoff ist weder ein
rganic Chemistry 4 th Edition Paula Yurkanis Bruice Kapitel 1 Elektronische Struktur und Bindung Säuren und Basen rganische Chemie rganische Verbindungen enthalten Kohlenstoff Kohlenstoff ist weder ein
Atomverbände. In stabilen Verbindungen, die auf der Erde existieren besitzen die Elemente meist die Elektronenkonfiguration
 Atomverbände Möglichkeit 1: Abgabe von Elektronen bei gleichzeitiger Aufnahme durch einen Reaktionspartner --> SALZE In stabilen Verbindungen, die auf der Erde existieren besitzen die Elemente meist die
Atomverbände Möglichkeit 1: Abgabe von Elektronen bei gleichzeitiger Aufnahme durch einen Reaktionspartner --> SALZE In stabilen Verbindungen, die auf der Erde existieren besitzen die Elemente meist die
Atomaufbau. Elektronen e (-) Atomhülle
 Atomaufbau Institut für Elementarteilchen Nukleonen Protonen p (+) Neutronen n (o) Elektronen e (-) Atomkern Atomhülle Atom WIBA-NET 2005 Prof. Setzer 1 Elementarteilchen Institut für Name Symbol Masse
Atomaufbau Institut für Elementarteilchen Nukleonen Protonen p (+) Neutronen n (o) Elektronen e (-) Atomkern Atomhülle Atom WIBA-NET 2005 Prof. Setzer 1 Elementarteilchen Institut für Name Symbol Masse
Übungsaufgaben zur Atombindung, zum EPA-Modell und zur Polarität
 Übungsaufgaben zur Atombindung, zum EPA-Modell und zur Polarität 1. Strukturformeln aufstellen, Grundlagen zu polaren Bindungen 1.1 a) Weshalb ist Wasserstoff in Molekülverbindungen einbindig (d.h. geht
Übungsaufgaben zur Atombindung, zum EPA-Modell und zur Polarität 1. Strukturformeln aufstellen, Grundlagen zu polaren Bindungen 1.1 a) Weshalb ist Wasserstoff in Molekülverbindungen einbindig (d.h. geht
Chemie für Biologen. Vorlesung im. WS 2004/05 V2, Mi 10-12, S04 T01 A02. Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen
 Chemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen (Teil 2: 20.10.2004) MILESS: Chemie für Biologen 24 Aufbau
Chemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen (Teil 2: 20.10.2004) MILESS: Chemie für Biologen 24 Aufbau
4 Die Atombindung im Wasserstoff-Molekül
 4.1 Übersicht und Lernziele Thema Bis jetzt haben wir nur von Atomen gesprochen. In der Chemie beschäftigen wir uns aber normalerweise mit Molekülen oder Ionen. Wir wollen deshalb in diesem Kapitel auf
4.1 Übersicht und Lernziele Thema Bis jetzt haben wir nur von Atomen gesprochen. In der Chemie beschäftigen wir uns aber normalerweise mit Molekülen oder Ionen. Wir wollen deshalb in diesem Kapitel auf
Musterprüfung Welche der Elemente Lithium, Kohlenstoff, Wasserstoff, Sauerstoff, Magnesium, Aluminium und Calcium sind Nichtmetalle?
 1 Module: Atombau und Periodensystem Chemische Bindungen Chemische Reaktionen Musterprüfung 1. Teil: Atombau und Periodensystem 1.1. Welche Art von Teilchen befinden sich a) im Atomkern b) in der Elektronenhülle
1 Module: Atombau und Periodensystem Chemische Bindungen Chemische Reaktionen Musterprüfung 1. Teil: Atombau und Periodensystem 1.1. Welche Art von Teilchen befinden sich a) im Atomkern b) in der Elektronenhülle
Universität Regensburg
 Universität Regensburg Fakultät für Chemie und Pharmazie Institut für Anorganische Chemie Prof. Dr. R. Winter 93040 Regensburg Musterlösungen Übung 7. 1. Geben Sie an, ob die folgenden Orbitalüberlappungen
Universität Regensburg Fakultät für Chemie und Pharmazie Institut für Anorganische Chemie Prof. Dr. R. Winter 93040 Regensburg Musterlösungen Übung 7. 1. Geben Sie an, ob die folgenden Orbitalüberlappungen
VERTIEFUNG. Die Funktionsweise einer Brennstoffzelle
 Die Funktionsweise einer Brennstoffzelle VERTIEFUNG Die folgenden Abbildungen sollen dir helfen, die Vorgänge zu verstehen, die in der Brennstoffzelle ablaufen. Arbeitsauftrag: Beschreibe jeweils die dargestellten
Die Funktionsweise einer Brennstoffzelle VERTIEFUNG Die folgenden Abbildungen sollen dir helfen, die Vorgänge zu verstehen, die in der Brennstoffzelle ablaufen. Arbeitsauftrag: Beschreibe jeweils die dargestellten
CHE 172.1: Organische Chemie für die Life Sciences
 1 CHE 172.1: Organische Chemie für die Life Sciences Prof Dr. J. A. Robinson 1. Struktur und Bindung organischer Moleküle 1.1 Atomstruktur : Die Ordnungszahl (oder Atomzahl /Atomnummer = Atomic number)
1 CHE 172.1: Organische Chemie für die Life Sciences Prof Dr. J. A. Robinson 1. Struktur und Bindung organischer Moleküle 1.1 Atomstruktur : Die Ordnungszahl (oder Atomzahl /Atomnummer = Atomic number)
Chemie für Bauingenieure Uebung 2
 Chemie für Bauingenieure Uebung 2 Aufgabe 1 i. Bestimmen Sie mithilfe des Periodensystems für folgende Elemente die Anzahl Elektronen, Protonen und Neutronen. ii. Bestimmen Sie dann für die jeweiligen
Chemie für Bauingenieure Uebung 2 Aufgabe 1 i. Bestimmen Sie mithilfe des Periodensystems für folgende Elemente die Anzahl Elektronen, Protonen und Neutronen. ii. Bestimmen Sie dann für die jeweiligen
3 Mehrelektronensysteme
 3.1 Lernziele 1. Sie sind in der Lage, den Aufbau des Periodensystems nachzuvollziehen. 2. Sie können die Elektronenverteilung eines Atoms angeben, wenn Sie seine Elektronenanzahl kennen. 3. Sie können
3.1 Lernziele 1. Sie sind in der Lage, den Aufbau des Periodensystems nachzuvollziehen. 2. Sie können die Elektronenverteilung eines Atoms angeben, wenn Sie seine Elektronenanzahl kennen. 3. Sie können
2 Die Atombindung im Wasserstoff-Molekül
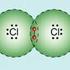 2.1 Lernziele 1. Sie wissen, wie eine chemische Bindung zwischen zwei Wasserstoff-Atomen zustande kommt. 2. Sie können den bindenden vom antibindenden Zustand unterscheiden. 3. Sie wissen, weshalb das
2.1 Lernziele 1. Sie wissen, wie eine chemische Bindung zwischen zwei Wasserstoff-Atomen zustande kommt. 2. Sie können den bindenden vom antibindenden Zustand unterscheiden. 3. Sie wissen, weshalb das
Klausurvorbereitung AC I 11. Juli Die folgenden Aufgaben waren Gegenstand der Klausur vom
 Klausurvorbereitung AC I 11. Juli 2017 Die folgenden Aufgaben waren Gegenstand der Klausur vom 15. 9. 2015. 1) Beschreiben Sie die technische Herstellung von Lithiumoxid in einem vierstufigen Verfahren,
Klausurvorbereitung AC I 11. Juli 2017 Die folgenden Aufgaben waren Gegenstand der Klausur vom 15. 9. 2015. 1) Beschreiben Sie die technische Herstellung von Lithiumoxid in einem vierstufigen Verfahren,
Bohrsches Atommodell
 Atome und ihre Bindungen Atomaufbau Im Atomkern befinden sich die Protonen (positiv geladen) und die Neutronen (neutral). P und N sind ungefähr gleich schwer und machen 99% der Atommasse aus. Um den Kern
Atome und ihre Bindungen Atomaufbau Im Atomkern befinden sich die Protonen (positiv geladen) und die Neutronen (neutral). P und N sind ungefähr gleich schwer und machen 99% der Atommasse aus. Um den Kern
2. Übung Allgemeine Chemie AC01
 Allgemeine und Anorganische Chemie Aufgabe 1: 2. Übung Allgemeine Chemie AC01 Chlor lässt sich gemäß der folgenden Reaktionsgleichung herstellen: MnO 2 + 4 HCl MnCl 2 + Cl 2 + 2 H 2 O 86,9368 g 145,8436
Allgemeine und Anorganische Chemie Aufgabe 1: 2. Übung Allgemeine Chemie AC01 Chlor lässt sich gemäß der folgenden Reaktionsgleichung herstellen: MnO 2 + 4 HCl MnCl 2 + Cl 2 + 2 H 2 O 86,9368 g 145,8436
Grundwissen Chemie 8. Klasse NTG
 Stoffe 1. Stoffe und Reaktionen Reinstoffe: Bestehen nur aus Teilchen gleicher Art, können mit physikalischen Verfahren nicht getrennt werden, besitzen typische Kenneigenschaften: Elemente (z. B. Kupfer)
Stoffe 1. Stoffe und Reaktionen Reinstoffe: Bestehen nur aus Teilchen gleicher Art, können mit physikalischen Verfahren nicht getrennt werden, besitzen typische Kenneigenschaften: Elemente (z. B. Kupfer)
Erläutere den CO 2 -Nachweis. Definiere den Begriff exotherme Reaktion und zeichne ein passendes Energiediagramm. Grundwissenskatalog Chemie 8 NTG
 Erläutere den CO 2 -Nachweis. Wird das Gas in Kalkwasser (Ca(OH) 2 ) eingeleitet bildet sich ein schwerlöslicher Niederschlag von Calciumcarbonat (CaCO 3 ). Abgabe von innerer Energie (Wärme, Knall,...)
Erläutere den CO 2 -Nachweis. Wird das Gas in Kalkwasser (Ca(OH) 2 ) eingeleitet bildet sich ein schwerlöslicher Niederschlag von Calciumcarbonat (CaCO 3 ). Abgabe von innerer Energie (Wärme, Knall,...)
Element. Verbindung. Reinstoff. homogenes Gemisch
 Element Reinstoff, der chemisch nicht mehr zersetzt werden kann dessen Teilchen (Atome oder Moleküle) aus einer einzigen Atomart (gleiche Ordnungszahl) besteht Verbindung = Reinstoff, der sich in Elemente
Element Reinstoff, der chemisch nicht mehr zersetzt werden kann dessen Teilchen (Atome oder Moleküle) aus einer einzigen Atomart (gleiche Ordnungszahl) besteht Verbindung = Reinstoff, der sich in Elemente
Chemie II. Vorlesung: Mo Uhr, HPT C103 Übungen: Mo Uhr, HCI H2.1, HCI J4
 hemie II Vorlesung: Mo 11-13 Uhr, PT 103 Übungen: Mo 14-16 Uhr, I 2.1, I J4 Literatur:.E. Mortimer, U. Müller: hemie, 11. Auflage Thieme-Verlag Stuttgart 2014 Dr. Wolfram Uhlig Laboratorium für Anorganische
hemie II Vorlesung: Mo 11-13 Uhr, PT 103 Übungen: Mo 14-16 Uhr, I 2.1, I J4 Literatur:.E. Mortimer, U. Müller: hemie, 11. Auflage Thieme-Verlag Stuttgart 2014 Dr. Wolfram Uhlig Laboratorium für Anorganische
Grundwissen Chemie 9. Jahrgangsstufe
 Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Homogene und heterogene Stoffgemische Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar
Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Homogene und heterogene Stoffgemische Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar
Grundlagen der Chemie Allgemeine Chemie Teil 2
 Allgemeine Chemie Teil 2 Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu AO-Theorie Wellenmechanik So wie Licht
Allgemeine Chemie Teil 2 Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu AO-Theorie Wellenmechanik So wie Licht
Auf der rechten Seite sind Beispiele für kovalente Bindungen.
 Bei einem Gemisch aus Natrium und Chlorid wird einen Ionenverbindung entstehen und sich ein Ionengitter ausbilden. Wenn Natrium nicht vorhanden ist, hat Chlorid aber natürlich noch immer das Bedürfnis,
Bei einem Gemisch aus Natrium und Chlorid wird einen Ionenverbindung entstehen und sich ein Ionengitter ausbilden. Wenn Natrium nicht vorhanden ist, hat Chlorid aber natürlich noch immer das Bedürfnis,
