Die Bedeutung der Mikrometastasen bei pn0 gestagten Patienten mit Ösophaguskarzinom
|
|
|
- Detlef Schäfer
- vor 7 Jahren
- Abrufe
Transkript
1 Aus der ABT. ALLGEMEIN- UND VISCERALCHIRURGIE DER CHIRURGISCHEN UNIVERSITÄTSKLINIK der Albert-Ludwigs-Universität Freiburg i.br. Die Bedeutung der Mikrometastasen bei pn0 gestagten Patienten mit Ösophaguskarzinom INAUGURAL DISSERTATION zur Erlangung des Medizinischen Doktorgrades der Medizinischen Fakultät der Albert-Ludwigs-Universität Freiburg i.br. Vorgelegt 2006 von Markus Schricker geboren in Altenburg
2 2 Einleitung Dekan: Prof. Dr. med. Christoph Peters 1.Gutachter: Prof. Dr. med. Andreas Imdahl 2. Gutachter: Prof. Dr. med. Martin Werner Jahr der Promotion: 2006
3 3 Einleitung Für Martha
4 4 Einleitung INHALTSVERZEICHNIS 1 EINLEITUNG Einführung Anatomie und Physiologie des Ösophagus Histomorphologischer Aufbau des Magen-Darm-Traktes Ösophagus-Karzinom Ätiologie, Epidemiologie und Pathogenese Tumorklassifizierung Topographische Einteilung Stadieneinteilung und Grading Klinische Einteilung: TNM-Stadium (Klassifikation der UICC) Pathologische Einteilung Histologische Einteilung Ösophaguskarzinom vom plattenepithelialen Typ Adenokarzinom des Ösophagus Lymphabflußwege und Metastasierung Diagnostik Chirurgische Therapie Chirurgische Therapie in kurativer Zielsetzung Multimodale Therapie des Ösophaguskarzinoms Mikrometastasen Zytokeratine Ziel der Arbeit MATERIAL UND METHODEN Patienten Histologische Aufarbeitung... 36
5 5 Einleitung H&E-Färbung Immunhistochemische Färbung LSAB-Immunhistochemie im automatisierten Verfahren (Labelled Streptavidin-Biotin) Statistik ERGEBNISSE Mikrometastasen Patientenevaluation und neoadjuvante Therapie Prognostischer Einfluss und Korrelation Zusammenfassung der Ergebnisse DISKUSSION Diskussion Methodik Diskussion des verwendeten Antikörpers AE1/AE Diskussion der verwendeten Untersuchungsmethode Klinische Bedeutung Klinische Bedeutung von Lymphknotenmikrometastasen und Zytokeratinpositivität Bedeutung der neoadjuvanten Therapie ZUSAMMENFASSUNG LITERATUR ANHANG Reagenzien Geräte und Zubehör Abkürzungsverzeichnis
6 6 Einleitung 1 Einleitung 1.1 Einführung Das Ösophaguskarzinom ist mit einer globalen Überlebensrate zwischen 5 und 11 Prozent ein äußerst aggressiver Tumor. Nach intentional kurativer chirurgischer Intervention werden 5-Jahre ÜLZ (Überlebenszeit, siehe Abkürzungsverzeichnis) von 20 bis 36 Prozent berichtet [34]. Wichtigster prognostischer Faktor ist die lymphogene Metastasierung. Bei 60 Prozent der Patienten liegen zum Zeitpunkt der Operation schon Lymphknotenmetastasen vor, 10 Prozent der Patienten mit einem auf die Mukosa oder Submukosa begrenzten Tumor (Stadium T1) weisen ebenfalls eine nodale Dissemination auf. Die Pathogenität dieser Erkrankung, die sich in Symptomatik und Mortalität widerspiegelt, rechtfertigt eine systematische und kontinuierliche Suche nach optimalen Therapieregimes. Beim Ösophaguskarzinom fanden sich in den letzten Jahren Änderungen hinsichtlich der histogenetischen Differenzierung mit einer Abnahme der Anzahl von Plattenepithelkarzinomen und einer Zunahme von Adenokarzinomen insbesondere des distalen Ösophagus [11]. Auch hinsichtlich des biologischen Verhaltens der Adenkarzinome konnte man während der letzten 20 Jahre eine Tendenz zu weniger gut differenzierten Tumoren mit vermehrter lymphogener Metastasierung beobachten [101]. Als Konsequenz der Einführung immunhistochemischer und molekularer Nachweismethoden in den 80er Jahren hat das Interesse an der Bedeutung der Dissemination von Tumorzellen in Lymphe und Blut deutlich zugenommen [32]. Disseminierte Tumorzellen stellen die eigentliche minimal residual disease dar und sind definitionsgemäß von Mikrometastasen (MM) abzugrenzen. Letztere sind bereits Tumorzellansammlungen bis 2 mm Durchmesser, welche eine Stromareaktion des umgebenden Gewebes aufweisen und Kontakt mit Gefäßen oder dem Sinuswall des Lymphknotens haben können. Vor allem bei Patienten mit Karzinomen des Ösophagus, Magens und Dickdarms konnten MM im Knochenmark in einem Viertel aller Fälle beobachtet werden und Marker für ein metastatisches Potential darstellen [71]. O Sullivan und Kollegen schlussfolgerten in ihrer Arbeit von 1997, dass die präoperative Identifikation von Patienten mit MM wichtig sei, da diese Patienten von einer adjuvanten Therapie profitieren könnten.
7 7 Einleitung Es stellt sich die Frage, ob erweiterte chirurgische Maßnahmen zur Bekämpfung der Systemerkrankung Ösophaguskarzinom sinnvoll sind, und ob sich nicht eine systemische Therapie zur Verbesserung der Prognose etablieren lässt. In Studien konnte die alleinige Chemotherapie nur selten eine komplette pathohistologisch nachgewiesene Remission nach sich ziehen und die Prognose nicht verbessern [104], die alleinige Strahlentherapie bei Patienten mit potentiell kurativ zu behandelnden Tumoren ergab ebenfalls keine Verbesserung der 2-ÜLZ (Zwei-Jahre- Überlebenszeit) [33]. Eine vor der chirurgischen Therapie zu verabreichende kombinierte neoadjuvante Therapie könnte Tumoren verkleinern, somit einer möglichen kurativen Intervention zugänglich machen und damit die maligne Systemerkrankung kontrollierbar halten [101]. Ob die Inzidenz von MM als Marker der frühen lymphogenen Aussaat dadurch ebenfalls verringert werden kann, wurde bisher in nur wenigen Studien aufgegriffen. 1.2 Anatomie und Physiologie des Ösophagus Die Speiseröhre (Ösophagus), ein etwa 22 bis 25 cm langer muskulärer Schlauch, verläuft dorsal der Luftröhre und ventral der Wirbelsäule. Die Speiseröhre ist als Teil des oberen Gastrointestinaltraktes für den Transport der bereits zerkleinerten Bissen aus dem Mund und dem Pharynx zuständig. Dabei steht die Tätigkeit der Muskelschichten des Ösophagus im Vordergrund. Die quergestreifte Muskulatur sorgt proximal für den Verschluss durch eine andauernde Kontraktion (oberer Ösophagussphinkter), während des Schluckakts erschlafft diese und es kommt durch vom Nervus Vagus koordinierte peristaltische Muskelbewegungen zum Transport der Nahrung in den Magen. Erleichtert wird der Ablauf der Kontraktionswellen dadurch, dass die Muskulatur im mittleren Abschnitt des Ösophagus in der Regel nicht tonisiert ist. Den Übergang zum Magen bildet der untere Ösophagussphinkter (Kardiasphinkter), der funktioneller Natur ist. Seine tonische Kontraktion verhindert einen Reflux von Mageninhalt in die Speiseröhre.
8 8 Einleitung Histomorphologischer Aufbau des Magen-Darm-Traktes Alle Abschnitte des Verdauungskanals Ösophagus, Magen, Duodenum, Jejunum, Ileum, Kolon, Analkanal weisen prinzipiell den gleichen Wandaufbau auf (Abbildung 1, S.9): - Tunica mucosae Epithelium mucosae Lamina propria mucosae Lamina muscularis mucosae - Tela submucosa - Tunica muscularis Stratum circulare Stratum longitudinale - Tunica adventitia bzw. Tela subserosa - Tunica serosa
9 9 Einleitung Abbildung 1: Schema zum prinzipiellen histologischen Aufbau des Verdauungskanals (aus [43] ) Als intrathorakaler Muskelschlauch, der von einem unverhornten Plattenepithel ausgekleidet wird, dient der Ösophagus dem Speisetransport in den Magen. 1 unverhorntes Plattenepithel 2 Basalzellschicht der Mukosa 3 Lamina propria mucosae 4 Lamina muscularis mucosae 5 bindegewebige Submukosa glattmuskuläre Muscularis propria mit einer inneren zirkulären und einer äusseren longitudinalen Schicht. 6 Abbildung 2: Querschnitt durch die Ösophaguswand (Quelle: PathoPic) Die Tunica mucosa des Ösophagus wird von einem unverhornten mehrschichtigen Plattenepithel mit hohen Bindegewebspapillen ausgekleidet (Abbildung 2, S.9). In der Lamina propria mucosae, die aus lockerem Bindegewebe, Drüsen und vielen Blutund Lymphgefäßen besteht, kommen in der Nähe des Magens zahlreiche Glandulae
10 10 Einleitung oesophageae cardiacae vor, die den Drüsen der Kardiaregion ähneln. Die Lamina muscularis ist im Gegensatz zum übrigen Gastrointestinaltrakt relativ dick; ihre Muskelfasern verlaufen in Längsrichtung. Die Tela submucosa besteht aus lockerem Bindegewebe, das in proximalen Abschnitten des Ösophagus zahlreiche muköse Drüsen aufweist, die ihren Inhalt an die Oberfläche des Ösophagusepithels abgeben. Hier verlaufen zudem zahlreiche Gefäße, v.a. Venen, die zusammen mit denen der gefäßreichen Lamina propria Teile der portokavalen Anastomose darstellen. Im funktionalen Zusammenhang mit der Tunica mucosa bildet die Tela submucosa bis zu 10 Längsfalten im Ösophagus aus, die beim Transport von Speisen ausgeglichen werden. Die Tunica muscularis besteht im oberen Drittel des Ösophagus aus quergestreifter und glatter, im distalen Drittel nur aus glatter Muskulatur. Die Muskelfasern laufen in ab- und aufsteigenden Schrauben gegenläufig, so dass sie sich überkreuzen. Nur in der Nähe des Magens - im abdominellen Anteil des Ösophagus - findet sich ein Serosaüberzug, sonst ist der Ösophagus über eine Adventitia mit dem umgebenden Gewebe verbunden. Die Lymphe des Ösophagus fließt oberhalb der Bifurkation Richtung oral und zervical, unterhalb der Bifurkation Richtung aboral und epigastrisch. 1.3 Ösophagus-Karzinom Ätiologie, Epidemiologie und Pathogenese Die Überlebensrate von Patienten mit Ösophagus-Karzinomen ist mit einer 5-ÜLR (5- Jahres-Überlebensrate) von nur 10-20% gering selbst nach Resektion mit kurativer Intention [33]. Bei Diagnosestellung liegt meist schon ein fortgeschrittenes Tumorstadium vor. In vielen Zentren mit spezieller Erfahrung sind die Ergebnisse nach chirurgischer Resektion eines Ösophaguskarzinoms besser. Von ausgewählten Patienten, die eine ausgedehnte Lymphknotenresektion erhielten und bei denen eine R0- Resektion vorlag, wurde eine 5-ÜLR von 40% dokumentiert [2, 82]. Tabelle 1, S. 11 zeigt eine Übersicht der gastrointestinalen Tumore und die Überlebensraten in Deutschland und USA.
11 11 Einleitung Karzinom- ÜLR (in%) Deutschland Lokalisation 5-ÜLR (in %) USA 5-ÜLR 10-ÜLR Ösophagus Magen Leber Gallenwege Pankreas Dünndarm Kolon Rektum/Anus / / /52 Tabelle 1: relative 5- und 10-Jahres-Überlebensraten maligner Tumore nach Tumorlokalisation. (Quelle: [23] ) Unter den Begriffen Ösophaguskarzinom und Karzinom des ösophago-gastralen Übergangs werden unabhängig vom histologischen Typ die epithelialen, malignen Neubildungen in allen Bereichen der Speiseröhre und der Kardia zusammengefasst. Das Ösophaguskarzinom geht in etwa 60 bis 70 Prozent der Fälle vom ösophagealen Plattenepithel aus. In etwa 30 bis 40 Prozent hingegen geht es von den mukösen Ösophagealdrüsen, von den Magenschleimhautheterotopien oder vom metaplastischen Zylinderepithel des Barrett-Ösophagus aus. Vereinzelt findet man neuroendokrine Tumoren des APUD-Systems, dessen Zellen der Neuralleiste entstammen. Diese Zellen besitzen die gemeinsame Fähigkeit, Amine bzw. deren Vorstufen aufzunehmen u. zu decarboxylieren ( amine precursor uptake and decarboxylation ), d.h. Polypeptidhormone zu bilden [27]. Diese und andere Karzinom- Entitäten, nichtepitheliale maligne Tumoren und Metastasen sind ausgesprochen selten. Histologie Häufigkeit Plattenepithelkarzinome überwiegend im mittleren und oberen Ösophagusdrittel Adenokarzinome meist im unteren Ösophagusdrittel Andere (anaplastische bzw. kleinzellige Karzinome, Zylindrome, Karzinoide, Leiomyosarkome) % % < 5 % Tabelle 2: Häufigkeiten der histologischen Subtypen des Ösophaguskarzinoms
12 12 Einleitung Die Inzidenz des Ösophaguskarzinom in Europa beträgt etwa 4 Fälle pro Einwohner und Jahr. Es existieren große geographische Unterschiede: besonders häufig tritt das Ösophaguskarzinom in China, Iran und in Südafrika auf. Männer sind häufiger als Frauen betroffen; das Geschlechterverhältnis liegt bei 4:1. Die hohe Prävalenz des männlichen Geschlechtes kann wegen der Rauch- und Trinkgewohnheiten erklärt sein. Der Altersgipfel dieser Tumorentität liegt um das 65. Lebensjahr Tumorklassifizierung Topographische Einteilung Der Ösophagus wird in einen zervikalen und einen thorakalen Anteil unterteilt, der den kurzen abdominellen Anteil mit einschließt (Abbildung 3, S.13). Der thorakale Anteil wird wiederum unterteilt in einen oberen Anteil vom Eintritt in den Thorax bis zur Trachealbifurkation; in einen mittleren Anteil von der Trachealbifurkation bis zum Hiatus und einen unteren abdominellen Anteil. Die Karzinomwahrscheinlichkeit liegt im oberen Drittel bei etwa 15 Prozent, im mittleren Ösophagusdrittel bei 45 bis 50 Prozent und im unteren Abschnitt bei 35 bis 40 Prozent. Prädilektionsstellen für das Ösophaguskarzinom sind die drei physiologischen Engen (Bereich des Ösophagusmundes, Höhe der Trachealbifurkation und Kardiabereich).
13 13 Einleitung Abbildung 3: topographische Einteilung des Ösophagus (nach [13] ) Plattenepithelkarzinome sind im gesamten Ösophagus mit Bevorzugung des mittleren und unteren Drittels zu finden, das Adenokarzinom auf dem Boden einer Barrett-Mukosa ist im unteren Ösophagusdrittel lokalisiert. Die mit zunehmender Häufigkeit auftretenden, meist distal gelegenen Adenokarzinome sind z. T. schwer vom Kardiakarzinom des Magens zu differenzieren und können daher unter dem Oberbegriff Karzinom des ösophago-gastralen Übergangs (AEGI bis AEGIII) zusammengefasst werden [65] Stadieneinteilung und Grading Die Stadiengruppierung (Tabelle 3, S. 14) spielt für die Indikation zur Therapie eine wichtige Rolle und hat für die Methodenwahl entscheidende Bedeutung. Für die Prognose ist unter kurativem Gesichtspunkt relevant, ob Lymphknoten befallen sind oder nicht. In Abhängigkeit vom Stadium sinken die Zahlen für die 5-ÜLR beträchtlich: Im Stadium I beträgt sie 67 Prozent, im Stadium IIa 43 Prozent, im Stadium IIb sinkt sie auf 26 Prozent.
14 14 Einleitung Schlechtere Zahlen sieht man im Stadium III: hier beträgt die 5-ÜLR nur noch 16 Prozent. Die Prognose für Patienten im Stadium IV ist mit 3 Prozent infaust. Stadiengruppierung Stadium 0 Tis N0 M0 Stadium I T1 N0 M0 Stadium IIA T2 N0 M0 T3 N0 M0 Stadium IIB T1 N1 M0 T2 N1 M0 Stadium III T3 N1 M0 T4 jedes N M0 Stadium IV jedes T jedes N M1 Stadium IVA jedes T jedes N M1a Stadium IVB jedes T jedes N M1b Grading G1 hoch differenziert G2 Mäßig differenziert G3 Wenig differenziert Tabelle 3: Stadieneinteilung des Ösophaguskarzinoms (nach UICC 1997 [86] ) und Grading
15 15 Einleitung Klinische Einteilung: TNM-Stadium (Klassifikation der UICC) T Primärtumor Tis Carcinoma in situ T1 Tumor infiltriert Lamina propria oder Submukosa T2 Tumor infiltriert die Muscularis propria T3 Tumor infiltriert die Adventitia T4 Tumor infiltriert Nachbarorgane N - Regionäre Lymphknoten Nx Regionäre Lymphknoten können nicht beurteilt werden N0 Keine regionären Lymphknotenmetastasen N l Regionäre Lymphknotenmetastasen Die Klassifikation regionärer Lymphknoten richtet sich nach der Lokalisation des Primärtumors. Zervikaler Ösophagus: Zervikale Lymphknoten einschließlich supraklavikuläre Lymphknoten. Intrathorakaler Ösophagus: Mediastinale und perigastrische Lymphknoten. Lymphknoten-Metastasen am Truncus coeliacus gelten als Fernmetastasen. M Fernmetastasen Mx Fernmetastasen können nicht beurteilt werden M0 Keine Fernmetastasen M1 Fernmetastasen M1a Lymphknotenmetastasen am Truncus coeliacus M1b Andere Fernmetastasen M1a Metastasen in zervikalen Lymphknoten M1b Andere Fernmetastasen M1a Nicht anwendbar M1b Nichtregionäre Lymphknoten / andere Metastasen Tumor im unteren thorakalen Ösophagus Tumor im oberen thorakalen Ösophagus Tumor im mittleren thorakalen Ösophagus Tabelle 4: klinische Einteilung nach UICC 1997 [86] Pathologische Einteilung Die ptnm Kategorien entsprechen der postoperativen Einteilung. Die Angabe pn0 setzt die Untersuchung von mindestens 6 Lymphknoten voraus. Zur Einstufung in das Stadium N0 müssen mindestens 6 Lymphknoten der mediastinalen Lymphadenektomie untersucht worden sein (UICC 1997 [86] ). yptnm steht für die pathologische Einteilung nach (zusätzlicher) vorangegangener multimodaler Therapie.
16 16 Einleitung Histologische Einteilung Ösophaguskarzinom vom plattenepithelialen Typ Aus epidemiologischen Studien geht hervor, dass in den westlichen Industrienationen für das Zustandekommen eines ösophagealen Karzinoms vom plattenepithelialen Typ exogene und endogene Faktoren verantwortlich sind. Die bekanntesten Risikofaktoren sind hochprozentiger Alkoholgenuß und Nikotinabusus. Darüber hinaus besteht bei Vitamin- und Eisenmangel (Plummer-Vinson-Syndrom), bei der Achalasie, bei häufigem Verzehr nitrosaminhaltiger Speisen und bei bekannter Keratosis palmaris et plantaris ein erhöhtes Risiko. Weiterhin ist für Patienten mit Verätzungsstrikturen des Ösophagus ein erhöhtes Risiko für die Entwicklung eines Plattenepithelkarzinoms beschrieben. Umgekehrt scheint ein protektiver Effekt durch Vitamin C gegeben zu sein [7]. Die Bedeutung von Präkanzerosen für die Entstehung von Plattenepithelkarzinomen des Ösophagus ist umstritten. Von wesentlicher Bedeutung ist weiterhin, dass Plattenepithelkarzinome des Ösophagus bei bis zu 5 Prozent der Patienten mit einem Zweitkarzinom einhergehen. Etwa die Hälfte dieser Zweittumoren befindet sich in den oberen Luftwegen oder der Lunge [13]. Die Lebenserwartung der Patienten mit Plattenepithelkarzinom des Ösophagus hat sich bei einer 5-Jahresüberlebensrate aller Patienten zwischen 5 und 11 Prozent in den letzten Jahren nicht verbessert [73] Adenokarzinom des Ösophagus Die Inzidenz des Adenokarzinoms des Ösophagus hat sich in den westlichen Industrienationen mehr als bei anderen Krebserkrankungen massiv erhöht; so beispielsweise in Dänemark: von 0,3 Neuerkrankungen pro Einwohner und Jahr stieg 1990 die Anzahl der Neuerkrankungen auf 2,3 Neuerkrankungen pro Einwohner und Jahr an [16]. Damit übertrifft Inzidenz und Prävalenz des Adenokarzinoms des Ösophagus in manchen westlichen Nationen bereits die des Plattenepithelkarzinoms. Das durchschnittliche Alter zum Zeitpunkt der Diagnose liegt beim Adenokarzinom des distalen Ösophagus und ösophagogastralen Übergangs bei ca. 63 Jahren und damit etwa 10 Jahre höher als beim Plattenepithelkarzinom. Wie beim
17 17 Einleitung Plattenepithelkarzinom besteht auch beim Adenokarzinom eine deutliche Bevorzugung des männlichen Geschlechts [33]. Es zeigt sich eine stetige Zunahme (ca. 10 Prozent pro Jahr) im Verlauf der letzten 10 Jahre von Adenokarzinomen des Ösophagus; bei Männern unter 50 Jahre mit Ösophaguskarzinom ist das Adenokarzinom inzwischen der häufigste Tumortyp. Der so genannte Barrett-Ösophagus (auch Barrett-Syndrom oder Barrett-Dysplasie genannt) spielt eine entscheidende Rolle als Präkanzerose. In der Regel kommt es hierbei durch eine langjährige Refluxösophagitis zu einem Ersatz des ösophagusspezifischen Plattenepithels durch spezialisiertes Zylinderepithel, was mit einer Epitheldysplasie und damit einer möglichen Entartung zum Adenokarzinom einhergehen kann. Bei einer Ausdehnung von über 3 cm, dem sogenannten Endobrachyösophagus (Barrett-Syndrom) nach Refluxösophagitis, treten gehäuft Adenokarzinome des Ösophagus auf, denn bei hochgradiger Dysplasie ist bei Barrett-Ösophagus mit einer 50 %igen Karzinomwahrscheinlichkeit zu rechnen. [76] Aus prospektiven Langzeitstudien geht hervor, dass bei Patienten mit einem Endobrachyösophagus im Vergleich zur Normalbevölkerung ein ca. 100-mal höheres Risiko für die Entwicklung eines Adenokarzinoms des Ösophagus besteht. Zudem wird das Barrett-Syndrom auch als Vorstufe zur Entwicklung des Adenokarzinoms der Kardia diskutiert [13]. In der Entwicklung des Ösophaguskarzinoms vom prämalignen Stadium bis hin zum Neoplasma zeigen sich häufig heterogene genetische Alterationen. In der überwiegenden Mehrheit der Fälle konnte man eine Inaktivierung des p53-tumorsuppressorgens und des p16-gens in einem frühen Stadium finden, die von Defekten in Genen wie APC, Rb and cyclin D1 in späteren Stadien gefolgt wurden [74]. Aufgrund dieser genetischen Veränderungen kommt es zu einer Hyper- oder Dysgeneration des Plattenepithels, weiterführend über eine Dysplasie und Carcinoma in situ zum invasiven Karzinom, beschrieben als Dysplasie-Karzinom-Sequenz. Unter Miteinbeziehung der postoperativen Letalität und aller Tumorstadien liegt die 5- ÜLR nach kompletter Resektion (R0-Resektion) beim Adenokarzinom des distalen Ösophagus bei etwa 35 Prozent. In der Subgruppe der pt1 Karzinome kann nach chirurgischer Resektion mit einer 5-Jahresüberlebenszeit von über 85 Prozent gerechnet werden, so dass diese Patienten nach dem Eingriff in der Regel als geheilt anzusehen sind [13].
18 18 Einleitung Lymphabflußwege und Metastasierung Für die chirurgische Behandlung des Ösophaguskarzinoms ist es besonders wichtig, Lymphknotenmetastasen der Speiseröhre gut beurteilen zu können. Maligne Neubildungen des Ösophagus verhalten sich besonders aggressiv. Der fehlende Serosaüberzug (zervikaler und intrathorakaler Oesophagus) lässt Tumore früh in das periösophageale Gewebe und benachbarte Strukturen infiltrieren. Durch die enge topographische Nähe zu Wirbelsäule, Trachea, Lungen und großen Gefäßen ist bei Läsionen dieser benachbarten Strukturen oft keine kurative Operation mehr möglich. Durch den gut verzweigten submukösen Lymphgefäßplexus kommt es schnell zu einer linearen Tumorausbreitung und zu frühzeitiger lymphogen-metastatischer Aussaat, sowohl zu lokalen als auch zu entfernten Lymphknoten. Lymphogene Schleimhautmetastasen (skip lesions) befinden sich oft in beträchtlichem Abstand zum Primärtumor. Diese Umstände führen bei über 50 Prozent der Patienten mit Ösophaguskarzinom zu einer fortgeschrittenen Erkrankung zum Zeitpunkt ihrer Diagnose [89]. Tanabe et al. untersuchten 1986 präoperativ den Lymphabfluß durch 99mTc- Lymphszintigraphie bei 42 Ösophaguskarzinom-Patienten [90]. Vom oberen Drittel des thorakalen Ösophagus fließt die Lymphe hauptsächlich in den Hals und das obere Mediastinum, vom mittleren Drittel zusätzlich in das Abdomen, welches als Hauptlymphabflussgebiet des unteren Drittels des thorakalen Ösophagus dient. Eine Arbeitsgruppe um Qubain konnte vom Bereich des oberen Drittels des Ösophagus ausgehend - zeigen, dass sowohl die mediastinalen Lymphknoten des N. recurrens, als auch die zervikalen Lymphknoten mit dem lymphatischen Abfluss verbunden sind. Vor allem die oberflächlichen Lymphgefäße der Ösophaguswand drainieren via Lymphknoten des N. recurrens in die zervikalen Regionen. Wenn man den lymphatischen Abfluss bei Patienten mit Plattenepithelkarzinom betrachtet, ist somit anzunehmen, dass die mediastinalen Lymphknoten des N. recurrens wichtig in der Entstehung zervikaler Metastasen sind [72]. Bei mehr als der Hälfte der Fälle bestehen zum Zeitpunkt der Operation Lymphknotenmetastasen, wobei häufig auch tumorferne Lymphknotenstationen befallen sind. Lymphknotenmetastasen sind bei Adenokarzinomen häufiger. Hämatogene Metastasen werden zum Zeitpunkt der Diagnose in bis zu 10 Prozent der Fälle beobachtet.
19 19 Einleitung Diagnostik Anamnese Labor Tumorlokalisation Tumorinfiltration Lymphknotenmetastasen Fernmetastasen Dysphagie, Gewichtsverlust, Regurgitation, Heiserkeit Lymphknotenschwellung (axillär, nuchal, infra- und supraklavikulär) Basis-Laboruntersuchungen Tumormarker zur Verlaufskontrolle: - SCC (Plattenepithelkarzinom) - CEA (Adenokarzinom) Ösophagoskopie mit Biopsie Doppelkontrast-Ösophagusröntgen Endosonographie (ggf. mit Punktion) Computertomographie Bronchoskopie bei suprabifurkaler und zervikaler Tumorlokalisation HNO-Status (Nn. Recurrentes, Zweit-Tumor) Endosonographie (ggf. mit Punktion) Computertomographie (Hals/Thorax/Abdomen) Positronen-Emissions-Tomographie (PET) Röntgen-Thorax in 2 Ebenen Perkutane Sonographie (Hals/Abdomen) Computertomographie (Hals/Thorax/Abdomen) Positronen-Emissions-Tomographie (PET) Staging-Laparoskopie bei infrabifurkaler Tumorlokalisation Tabelle 5: Diagnostik zur Stadienbestimmung bei Patienten mit Ösophaguskarzinomen (nach [8] ) Der endoskopische Befund muss eine Aussage über die Höhe, Lokalisation und Längenausdehnung des Tumors enthalten. Der makroskopischen Differenzierung zwischen Frühkarzinom und fortgeschrittenem Karzinom sollte die Einteilung der Japanese Society of Diseases of the Esophagus zugrunde liegen. Bei der Bestimmung des Wachstumstyps besteht, je nach Erfahrung des Untersuchers, eine direkte Korrelation zum Tumorstadium. Im Falle eines Frühkarzinoms kann mit dem sogenannten Lugol Staining (Besprühen der gesamten Ösophagusschleimhaut mit 20%ger Lugol scher Lösung) ein multifokales Tumorwachstum ausgeschlossen bzw. nachgewiesen werden. Im Falle einer nicht passierbaren Tumorstenose sollte unter Röntgenkontrolle und ggf. zweizeitig eine Bougierung auf circa 11 mm erfolgen, um die Beurteilung der Stenose und der aboral davon gelegenen Intestinalabschnitte zumindest mit dem Kinder-Endoskop zu ermöglichen. Die generelle Empfehlung zur Dilatation ist derzeit umstritten [84].
20 20 Einleitung Die Endosonographie gibt Aufschluss über die Infiltrationstiefe des Tumors in Korrelation zur TNM-Klassifikation. Bei nicht passierbaren Stenosen können dünne Ultraschallsonden weiterhelfen. Die endoskopische Beurteilung des Lymphknotenstatus ist unsicher, weil eine Differenzierung zwischen entzündlich vergrößerten und metastatisch befallenen Lymphknoten nicht sicher möglich ist. In Studien von Burian et al., Kitagawa et al. und Yasuda et al. wird die Rolle des sogenannten Sentinel-Lymphknotens diskutiert, der mit höherer Wahrscheinlichkeit [14, 48, Lymphknotenmetastasen vorhersagen soll 110]. Jedoch ist dies beim Ösophaguskarzinom durch die komplexe Lymphgefäßsituation als sehr schwierig einzuordnen. Kitagawa berichtet in seinen neuesten Studien von der Wichtigkeit des präoperativen Szintigramms beim Ösophaguskarzinom, um entfernte, nicht im Lymphabflussgebiet liegende Lymphknoten zu erfassen und daraufhin auch das Bestrahlungsfeld im Rahmen einer Radiochemotherapie individuell auszurichten [48]. Für Tumore des oberen Gastrointestinaltrakts gilt, dass mittels des Sentinel-Lymph-Node-Mapping nicht nur die Standardlymphadenektomie durch Erfassung atypisch gelegener Lymphknoten verbessert werden kann, sondern dass auch eine unnötige Lymphadenektomie bei Patienten mit negativem Sentinel-Lymphknoten vermieden werden kann. Damit zeigt sich aus den ersten Untersuchungen ein fließender Übergang vom eigentlichen Prinzip des Sentinel-Lymph-Node-Mapping zur Radioimmuno-guided-Surgery [14]. Die Kontrastdarstellung (Doppelkontrasttechnik) des Ösophagus dient zur Einordnung der pathologischen Veränderungen in den anatomischen Gesamtzusammenhang. Zu fordern sind metrische Angaben, die eine exakte Lokalisation des Tumors in Bezug zum oberen Ösophagussphinkter, zur Trachealbifurkation und zur Kardia ermöglichen. Die perkutane Sonographie dient im Rahmen des Stagings der Fernmetastasensuche (Lymphknoten, Organmetastasen). Der Computertomographie (CT) des Thorax fällt besondere Bedeutung zur Beurteilung einer möglicher Infiltration des Tumors in umgebende Leitstrukturen zu: Aorta, Vorhof, Trachea, Hauptbronchus. Dazu ist vor allem eine gute orale Kontrastierung erforderlich. Die Tumorregion sollte dabei in Dünnschichttechnik (Spiral-CT; 3 mm Schichtdicke; Pitch 1,5; arterielle Kontrastmittelphase; gezoomte
21 21 Einleitung Aufnahmen) untersucht werden, um Infiltrationen in umgebende Leitstrukturen mit höherer Sicherheit beurteilen zu können. Mit der CT des Abdomens werden Organmetastasen und ferne Lymphknotenmetastasen evaluiert. Bei zervikalen Ösophagusmalignomen ist eine ergänzende CT des Halses für den Lymphknotenstatus erforderlich. Bei Adenokarzinomen der distalen Speiseröhre und vorgeplanter neoadjuvanter Therapie kann die diagnostische Laparoskopie zum Ausschluss einer Peritonealkarzinose bzw. einer intraabdominellen Tumormanifestation sinnvoll sein [51]. Etwa 80 Prozent aller Patienten mit einem Plattenepithelkarzinom des Ösophagus weisen einen Nikotin- bzw. Alkoholabusus auf. Eine sorgfältige Abschätzung des Operationsrisikos spielt daher eine entscheidende Rolle. In multivariaten Analysen konnten als wichtigste Faktoren für die postoperative Morbidität und Mortalität nach Ösophagusresektion die Lungen-, Herz- und Leberfunktion nachgewiesen werden. Pulmonales System Kardiovaskuläres System Leberfunktion Nierenfunktion Ernährungsstatus Röntgen-Thorax-Übersichtsaufnahme in zwei Ebenen Einfache Spirometrie (FEV 1 >70%) Blutgasanalyse (pao 2 >55 mmhg ) Physiotherapie (Atemübungen, Inhalation) Basis-EKG Ggf. Belastungs-EKG und Echokardiographie Cholinesterase (>2000 U/l) Protein (>6 g/l) Quick (>70%) Bilirubin (<1,5 mg/dl) Kreatinin im Serum Kreatinin-Clearance (>60 ml/dl) Bei den in aller Regel als Folge ihrer Grunderkrankung mangelernährten Patienten kann präoperativ eine kalorische enterale oder parenterale Ernährung über mindestens 14 Tage angezeigt sein. Tabelle 6: Präoperative Untersuchungsmethoden zur Risikoabschätzung (nach [8, 13] ) Chirurgische Therapie Eine Verbesserung der Prognose von Patienten mit Ösophaguskarzinom kann nur durch das Erreichen einer kompletten makroskopischen und mikroskopischen Tumorentfernung (R0-Resektion) erzielt werden. Somit kommt einer präoperativen exakten Erfassung der Tumorausdehnung und einer präzisen Stadieneinteilung (Staging) eine große Bedeutung zu. Die Klassifikation der Eindringtiefe des Primärtumors (T-Kategorie), des Lymphknotenstatus (N-Kategorie) und der
22 22 Einleitung Fernmetastasierung (M-Kategorie) sowie der Stadiengruppierung erfolgt anhand der Richtlinien der UICC (Union Internationale Contre le Cancer). Entscheidend für die Indikation zur Operation ist die Beurteilung des Risikos des geplanten Eingriffs und die Abschätzung der Wahrscheinlichkeit einer R0-Resektion. Nur die R0-Resektion (radikale Tumorentfernung mit regionalem Lymphabflussgebiet) beinhaltet im Vergleich zu Palliativmassnahmen eine Prognoseverbesserung. Welche Therapieoption nach dem heutigen Wissensstand bei welchen Patienten in Frage kommt, wird somit durch Allgemeinstatus und Tumorstadium bestimmt. Unter therapeutisch-prognostischen Gesichtspunkten und operationstechnischen Aspekten ist folgende Klassifikation der Ösophaguskarzinome bedeutsam: Topographisch-anatomische Einteilung anhand des Bezuges zum Tracheobronchialsystem. Man unterscheidet Tumore unterhalb der Trachealbifurkation (infracarinal), solche in Höhe oder oberhalb der Trachealbifurkation (supracarinal) und Tumore, die auf den zervikalen Ösophagusanteil beschränkt sind (zervikal). Des weiteren hat sich die Abgrenzung von lokal begrenzten Ösophaguskarzinomen (Stadium I-IIB bzw. T1-T2/N0-N1/M0) und lokoregionär fortgeschrittenen Ösophaguskarzinomen (Stadium III bzw. T3-T4/N0-N1/M0) bewährt Chirurgische Therapie in kurativer Zielsetzung Das Risiko der operativen Therapie bei Patienten mit Ösophaguskarzinom ist auch von der Erfahrung des Operateurs und der Institution abhängig. Daher sollte die operative Therapie in Zentren mit spezieller Erfahrung in der Ösophaguschirurgie erfolgen [8]. Entscheidend für die Indikation zur Operation sind die Beurteilung des Risikos des geplanten Eingriffs und die Abschätzung der Wahrscheinlichkeit einer vollständigen Tumorentfernung (R0-Resektion). Die R0-Resektion (radikale Entfernung des Tumors mit regionalem Lymphabflussgebiet) ist die wesentliche Voraussetzung für einen kurativen Behandlungserfolg.
23 23 Einleitung Suprabifurkales Ösophaguskarzinom Bei T1/T2-Tumoren ist die subtotale Ösophagusresektion mit abdominaler und mediastinaler (vermutlich auch zervikaler) Lymphadenektomie (2-Feld-Dissektion) indiziert. Fortgeschrittene Tumoren (T3/T4) sind in Anbetracht ihres frühen Bezugs zum Tracheobronchialsystem lokoregional häufig nicht R0-resektabel. Sie sollten unter Studienbedingungen einer neoadjuvanten Radiochemotherapie mit dem Ziel zugeführt werden, ein Downstaging zu erreichen und sekundär die operative Therapie zu ermöglichen. Bei diesem Konzept ist mit einer Erhöhung des postoperativen Risikos zu rechnen. Infrabifurkales Ösophaguskarzinom Bei T1/T2-Tumoren ist die subtotale Ösophagusresektion mit abdominaler und mediastinaler Lymphadenektomie (2-Feld-Dissektion) indiziert. Auch im fortgeschrittenen Tumorstadium kann dieses Vorgehen erfolgen, allerdings ist bei T4- Tumoren mit einem erhöhten Operationsrisiko und ungünstiger Langzeitprognose zu rechnen. Neoadjuvante Therapiemodalitäten unter Einschluss der Strahlentherapie sind derzeit in der Erprobung. Sie sind nur innerhalb kontrollierter Studien indiziert. Als Alternative kommt bei Patienten im Stadium II/III bei hohem operativem Risiko die Radiochemotherapie zur Anwendung. Prospektive randomisierte Studien zur ausschließlichen Radiochemotherapie fehlen. Zervikales Ösophaguskarzinom Bezüglich des therapeutischen Vorgehens besteht kein Konsens. Studien sind wünschenswert. Operative Technik Thorakale Plattenepithelkarzinome werden durch En-bloc-Resektion des intrathorakalen Ösophagus mit dem umgebenden Fett- und Bindegewebe einschließlich des Ductus thoracicus, ggf. der Vena azygos und adhärenter Strukturen entfernt, am besten nach rechtsseitiger Thorakotomie. Die Speiseröhre wird kranial situationsabhängig entweder in Höhe der Thoraxkuppe oder nach Freilegung am Hals reseziert. Die mediastinale und abdominelle Lymphadenektomie
24 24 Einleitung ist ein fester Bestandteil der Operation. Die abdominelle Lymphadenektomie umfasst die proximale Resektion der kleinen Kurvatur des Magens und die Entfernung der zoeliakalen und suprapankreatischen Lymphknoten (entsprechend Kompartment 2 bei Magenkarzinom). Als Ösophagusersatz dient der zu einem Schlauchmagen umgeformte Magen oder, sofern dieser nicht geeignet ist, ein Kolonabschnitt. Distale Adenokarzinome (Barrett- Karzinome) können sowohl transthorakal als auch durch die radikale transhiatale so genannte 2-Feld-Ösophagektomie mit ausreichender Radikalität behandelt werden. Die Lymphadenektomie im unteren hinteren Mediastinum ist notwendig und kann transhiatal erfolgen. Die abdominelle Lymphadenektomie entspricht dem Vorgehen bei intrathorakalem Plattenepithelkarzinom. Bei Patienten mit hochgradiger intraepithelialer Neoplasie (Dysplasie) in einem Barrett-Oesophagus kann primär eine komplette Entfernung durch endoskopische Mukosaresektion versucht werden. Gelingt eine komplette Entfernung einer hochgradigen intraepithelialen Neoplasie (Dysplasie) durch Mukosaresektion nicht, ist abhängig vom Operationsrisiko eine Resektion zu erwägen. Der therapeutische Wert einer photodynamischen Therapie ist derzeit durch kontrollierte Studien nicht belegt [19]. Höher gelegene Adenokarzinome werden wie Plattenepithelkarzinome operiert. Lokal begrenztes Ösophaguskarzinom (Stadium I-IIB bzw. T1-T2/N0-N1/M0) Bei Patienten mit einem lokal begrenzten, infra- oder supracarinal gelegenen Ösophaguskarzinom ist eine potentiell kurative Resektion möglich. Die abdominorechts-thorakale subtotale En-bloc-Ösophagektomie mit gezielter und standardisierter 2-Feld-Lymphadenektomie (abdominal/mediastinal) stellt bei dieser Patientengruppe bei vertretbarem allgemeinen Risiko weiterhin die Therapie der ersten Wahl dar. Hiermit kann eine 5-ÜLR von ca. 40 % erzielt werden. Als Ösophagusersatz dient wiederum der zu einem Schlauchmagen umgeformte Magen oder ein Koloninterponat. Umstritten ist die transmediastinale (sogenannte stumpfe) Dissektion der Speiseröhre, da sie die Ansprüche an einen adäquat onkologischen Eingriff nicht erfüllt. Diese Methode kann jedoch im Einzelfall unter besonderen Bedingungen indiziert sein (z.b. schwere Dysplasie, Verdacht auf Mukosakarzinom, höheres Risiko bei transthorakalem Vorgehen).
25 25 Einleitung Lokoregionär fortgeschrittenes Ösophaguskarzinom (Stadium III bzw. T3-T4/N0- N1/M0) Bei Patienten mit einem lokoregionär fortgeschrittenen Ösophaguskarzinom sind der alleinigen Chirurgie Grenzen gesetzt. Eine kurative Resektion ist in Anbetracht der Anatomie des hinteren Mediastinums oft nicht möglich. Besonders bei supracarinaler Tumorlokalisation ist die Chance einer R0-Resektion sehr fraglich. Mit einer Ausweitung des Resektionsausmaßes konnte keine Verbesserung der Ergebnisse erzielt werden. Die schlechten Resultate werden unter anderem durch niedrige Resektabilitätsraten, aber auch durch frühzeitiges Auftreten von Lokalrezidiven sowie Fernmetastasen bedingt. So wurden in den letzten Jahren zur Erhöhung der Resektionsrate und zur Senkung der lokalen und systemischen Rezidivrate unterschiedliche multimodale Therapiekonzepte verfolgt Multimodale Therapie des Ösophaguskarzinoms Die alleinige neoadjuvante (präoperative) Radiotherapie des wahrscheinlich R0- resektablen Ösophaguskarzinoms ist nicht zu empfehlen [61]. Die neoadjuvante (präoperative) kombinierte Radiochemotherapie ist prinzipiell wirksam. Sie sollte bei resektablem Tumor derzeit nur innerhalb klinischer Studien eingesetzt werden. Sie wird vor allem bei lokal fortgeschrittenen suprabifurkalen Ösophaguskarzinomen angewandt. Eine intensive Supportivtherapie ist als Begleitmaßnahme wesentlich [37]. Am häufigsten angewandte Therapiemodalitäten sind die präoperative (neoadjuvante) Chemo- und Radiotherapie, allein oder in Kombination. Diese Konzepte zielen auf eine Reduktion des Tumorvolumens (Downstaging) mit konsekutiver Verbesserung der R0-Resektionsrate sowie auf die Kontrolle einer lokalen sowie okkulten systemischen Metastasierung. Nachfolgend eine Übersicht der bisher durchgeführten Studien in Abhängigkeit vom Tumorstadium Präoperative (neoadjuvante) Therapie beim lokal begrenzten Ösophaguskarzinom Die präoperative Bestrahlung wird unter folgender Zielsetzung durchgeführt: Tumorverkleinerung und damit Steigerung der R0-Resektionsrate
26 26 Einleitung Wirkung auf lokoregionäre Lymphknoten und damit Reduzierung der Lokalrezidivrate Reduzierung einer intraoperativen Tumordissemination Bis heute wurden einige randomisierte Studien zur neoadjuvanten Radiotherapie beim Ösophaguskarzinom publiziert [5, 6, 29, 52, 70, 103]. Hierbei kamen Strahlendosen zwischen 20 und 40 Gy zum Einsatz. Keines der Verfahren führte zu einem Anstieg der Resektionsrate und der Überlebensrate im Vergleich zum alleinigen chirurgischen Vorgehen. In einer Studie konnte eine Senkung der Lokalrezidivrate nachgewiesen werden, ohne dass eine Verbesserung der Langzeitprognose erreicht wurde [70]. Eine alleinige neoadjuvante Radiotherapie kann daher nach dem derzeitigen Stand der Erkenntnisse nicht als Erfolg versprechende Behandlungsoption bei potentiell resektablen Ösophaguskarzinomen empfohlen werden [6, 61]. Ziel einer präoperativen Chemotherapie ist neben der lokalen Tumorwirkung auch die Eradikation okkulter Fernmetastasen. Die Kombination aus Cisplatin und 5-Fluorouracil ist heute das am häufigsten eingesetzte Chemotherapieprotokoll. Bisher wurden mehrere Phase-III-Studien durchgeführt [18, 46, 53, 59, 80]. Malthaner und Fenlon konnten in einem Update in Cochrane Reviews 2003 elf randomisierte Studien mit 2051 Patienten zur Frage der präoperativen Chemotherapie bei resektablem thorakalen Ösophaguskarzinom analysieren [60]. Dabei zeigte sich, dass präoperative Chemotherapie mit konsekutiver Chirurgie einen Überlebensvorteil nach 3, 4 und 5 Jahren aufzuweisen scheinen, eine statistische Signifikanz der präoperativen Chemotherapie plus Chirurgie versus alleiniger chirurgischer Intervention zeigte sich nur nach dem 5. Jahr bei jedem histologischen Typ. Beeinflusst werden die Ergebnisse durch die erhöhte Toxizität und Mortalität bei Chemotherapie. Eine optimale Dosisfindung ist zum gegenwärtigen Zeitpunkt noch nicht erreicht worden [60]. Ziele der Kombinationstherapie (kombinierte Radiochemotherapie) sind die Nutzung synergistischer Effekte im Hinblick auf die Effizienz bei gleichzeitiger Reduktion von Nebenwirkungen und die im Kombinationsregime gegenüber der Einzeltherapie reduzierten Dosierungen. Neben einer direkt strahlensensibilisierenden Wirkung einzelner Zytostatika kann ein Synergismus auch in der Überwindung von Resistenzen der Tumorzellen gegen jeweils eine der Modalitäten resultieren. Mit diesen Verfahren lassen sich zwar die lokale Tumorkontrolle verbessern und das
27 27 Einleitung rezidivfreie Überleben verlängern, aber bisher keine signifikante Änderung des Gesamtüberlebens erreichen. Im Vergleich zur präoperativen Chemotherapie führt die neoadjuvante Radiochemotherapie zu einer deutlichen Steigerung der histopathologisch kompletten Remissionsrate. Da aber auch die Morbidität und die postoperativen Mortalität ansteigt, wird das Gesamtergebnis (Überlebenszeit) negativ beeinflusst. [36]. Meta-Analysen von Malthaner et al. [61] und Urschel et al. [97] konnten zeigen, dass im Vergleich zur alleinigen Chirurgie die neoadjuvante Radiochemotherapie eine signifikante Verbesserung der Drei-Jahre-Überlebenszeit und eine Verringerung der lokoregionären Rezidivrate von Patienten mit resektablen Ösophaguskarzinomen erreicht. Das relativ geringe Ausmaß des Benefits könnte durch eine sorgfältige Selektion der Patienten für die neoadjuvante Therapie vergrößert werden [61]. Ein signifikanter Einfluss erhöhter Mortalität durch die neoadjuvante Radiochemotherapie wurde in den untersuchten Studien nicht bewiesen [4, 12, 54, 70, 96, 101]. Die gleichzeitige Anwendung der kombinierten Radiochemotherapie war der sequentiellen Verabreichung überlegen [97]. Präoperative (neoadjuvante) Therapie beim lokoregionär fortgeschrittenen Ösophaguskarziom Durch alleinige Bestrahlung (neoadjuvante Radiotherapie) konnte mit einer 5-ÜLR von unter 5 Prozent bei Patienten mit einem lokoregionär fortgeschrittenen Ösophaguskarzinom keine Verbesserung der Prognose erreicht werden. Nur in frühen Stadien wurden mit Gesamtstrahlendosen 45 Gy bei selektionierten Patienten 5-ÜLR von etwa 20 Prozent erzielt. Dieses Verfahren wurde in verschiedenen Phase-II- und III-Studien extensiv untersucht [18, 53, 59]. Es zeigte sich keine Steigerung der Resektionsrate und kein Einfluß auf die 5-ÜLR (9 bis 16 Prozent), so dass dieses Verfahren als alleinige Methode weitestgehend verlassen wurde. Obwohl zwei Drittel aller Patienten mit einem Ösophaguskarzinom lokal fortgeschrittene Tumorstadien aufweisen, liegt bisher keine Phase-III-Studie über den Einsatz einer alleinigen neoadjuvanten Chemotherapie bei dieser Patientengruppe vor. In verschiedenen Phase-II-Studien wurden mediane Überlebenszeiten von 11 bis 21 Monaten angegeben. Die erzielten histopathologisch dokumentierten Remissionsraten (um 10 Prozent) sind unbefriedigend.
28 28 Einleitung Die niedrige Rate kompletter Remissionen nach präoperativer Chemotherapie waren Anlass für deren Kombination mit einer Strahlentherapie. Auch hier sind die Erfahrungen einer präoperativen Radiochemotherapie beim lokoregionär fortgeschrittenen Ösophaguskarzinom sehr begrenzt und nur durch Ergebnisse von wenigen Studien belegt [4, 12, 36, 37, 96, 101, 102]. Die neoadjuvante Radiochemotherapie führt hiernach offensichtlich bei nicht wenigen Patienten zum Downstaging des Primärtumors und zu einer Zunahme der R0-Resektionsrate [101]. Auch scheint eine Reduktion der Lokalrezidivrate und eine Verlängerung des rezidivfreien Intervalls hierdurch möglich, allerdings bisher ohne Verbesserung der Gesamtüberlebenszeit. Grund hierfür ist vor allem eine durch die Vorbehandlung bedingte deutlich gesteigerte postoperative Morbidität und Letalität [36]. Die neoadjuvante Radiochemotherapie beim lokoregionär fortgeschrittenen Ösophaguskarzinom ist unter den oben genannten Behandlungsmodalitäten das effektivere Verfahren. Aufgrund der weiterhin relativ hohen Toxizität und damit gesteigerten postoperativen Morbidität und Mortalität ist die Suche nach neuen Modalitäten kombinierter Behandlung (z.b. lokale Hyperthermie) und der Einsatz neuer weniger toxischer zytostatischer Substanzen Aufgabe der Zukunft. Postoperative (adjuvante) Therapie Eine postoperative Strahlenbehandlung (Adjuvante Radiotherapie) wird durchgeführt, um eventuell vorhandene mikroskopische Tumorreste im Operationsgebiet oder okkulte Mikrometastasen lokoregionär in den Lymphknoten zu devitalisieren und somit eine verbesserte Lokalkontrolle zu erreichen. Von den bisher vorliegenden vier Studien [25, 92, 107, 111] zeigte nur eine Studie in der Patientensubgruppe mit pn0-status eine signifikante Reduktion der lokoregionären Rezidivrate [92]. Übereinstimmend wird aber vermehrt über Fernmetastasen und eine hohe Toxizitätsrate berichtet. Bei keiner Patientengruppe konnte eine Verbesserung des Gesamtüberlebens erreicht werden. Eine adjuvante Radiotherapie kann anhand dieser Daten bei Patienten nach potentiell kurativer Ösophagusresektion nicht empfohlen werden. Bis heute wurde nur eine Phase-III-Studie publiziert, die eine postoperative, adjuvante Chemotherapie (Cisplatin/Vindesin) versus alleinige Chirurgie vergleicht [3]. Auch hier besteht zwischen beiden Gruppen kein signifikanter Unterschied im Gesamtüberleben, so dass dieses Vorgehen nicht empfohlen werden kann.
29 29 Einleitung Zur adjuvanten Radiochemotherapie liegen derzeit keine Daten vor, die ihren Einsatz außerhalb von Studien rechtfertigen. Bis heute wurde keine Phase-III-Studie publiziert, die eine definitive Radiochemotherapie versus (neoadjuvante) Radiochemotherapie beim lokoregionär fortgeschrittenen Ösophaguskarzinom vergleicht. Stadium I und allg. Operabilität Stadium II+III und allg. Operabilität Stadium I-III und allg. Inoperabilität Stadium IV Neoadjuvante Therapie Operation Definitive Radio-Chemo- Therapie Palliative Therapie Abbildung 4: Stadiengerechte Therapie bei Patienten mit Ösophaguskarzinom nach [8] 1.4 Mikrometastasen Beim Ösophaguskarzinom stellt der Lymphknotenstatus den wesentlichen Prognosefaktor nach kompletter Tumorresektion (R0-Resektion) dar. Nach wie vor wird bei diesen Tumorentitäten die ausgedehnte Lymphadenektomie jedoch kontrovers diskutiert. Ursache hierfür ist, dass nur eine Subgruppe von Patienten von der ausgedehnten Lymphadenektomie zu profitieren scheint [14, 83]. Immunhistochemische und molekulare Untersuchungen haben isolierte Tumorzellen in histologisch unauffälligen Lymphknoten nachgewiesen und dies als Vorstufe einer späteren Metastasierung gedeutet [30]. Diese Zellen oder Zellgruppen sind von so genannten Mikrometastasen (okkulte Metastasen) zu unterscheiden. Mikrometastasen sind histologisch nachgewiesene metastatische Zellgruppen und zeigen eine Invasion des lymphoretikulären Gewebes, meist mit Proliferation und Stromareaktion, auf. Sie werden abhängig von der Subtilität der histomorphologischen Untersuchungstechnik bei den einzelnen Tumoren in unterschiedlicher Häufigkeit beschrieben [32]. Ob Mikrometastasen als Frühform der metastatischen Absiedelung in Lymphknoten prognostische Effekte aufweisen können, ist derzeit noch nicht eindeutig geklärt.
30 30 Einleitung Die Möglichkeiten, Mikrometastasen zu definieren, sind zahlreich. Lymphknoten- Mikrometastasen (LK-MM) entsprechen gemäß der Definition von Jiao und Krasna sowie Cai et al. einer kleinen metastatischen Läsion (Cluster an Zellen oder Einzelzelle), die nicht mit konventionell histologischen Untersuchungsmethoden detektierbar sind [17, 41]. Die Anzahl der erforderlichen Zellen, um zur Definition Mikrometastase zu gelangen, variiert bei vielen Autoren erheblich. Es erscheint sinnvoll, keine bestimmte Mengen- oder Größenangabe zu machen, sondern den direkten Vergleich von H&E-Färbung und Immunhistochemie zu suchen. Immunhistochemische Techniken mit Antikörpern gegen humanes Zytokeratin können (bei Nichtnachweisbarkeit in der konventionellen H&E-Färbung) epitheliale Tumorzellen in Lymphknoten detektieren. Dies gelang zum Beispiel bei Patienten mit kolorektalem Karzinom [77], Mammakarzinom [94], Ösophaguskarzinom Magenkarzinom [38]. Es existieren bisher einige Studien, die sich mit der Bedeutung von Mikrometastasen bei Patienten mit Ösophaguskarzinom auseinandersetzen. Studiengruppen von Hosch et al. [34], Natsugoe et al. [66], Izbicki et al. [39] und Komukai et al. [50] [42] und berichten über einen ungünstigen Effekt von nodalen Mikrometastasen auf des Überleben von Patienten nach Ösophagusresektion, während Tanabe et al. [91], Sato et al. [79] und Glickman et al. [30] keinen Einfluss von Mikrometastasen auf die Prognose nachweisen konnten. Die möglichen Methoden, um isolierte Tumorzellen oder mikrometastatische Cluster zu detektieren, haben in den letzten Jahren deutlich zugenommen. Morphologische und nichtmorphologische Untersuchungsprinzipien wurden etabliert [32]. Jedoch können nur morphologische Methoden, insbesondere die Immunhistochemie mit Zytokeratinen, den Nachweis von Mikrometastasen epithelialer Primärtumore gemäß der aktuellen Definition erbringen. 1.5 Zytokeratine Nach wie vor wird die Hämalaun-Eosin-Färbung (H&E-Färbung) zur histopathologischen Routinefärbung von Operationspräparaten genutzt. Um kleinere epitheliale Tumorzellgruppen mit dem nötigen Gewebekontrast zu differenzieren, bedient man sich schon seit vielen Jahren der immunhistochemischen Färbung mit Zytokeratin-Antikörpern.
31 31 Einleitung Zytokeratine sind eine Familie wasserlöslicher Proteine mit Molekulargewichten zwischen kd, die das Zytoskelett der Epithelzellen bilden. Mindestens 19 unterschiedliche Zytokeratine sind bis heute identifiziert worden und können in zwei Unterfamilien unterteilt werden. Unterfamilie A besteht aus relativ sauren Cytokeratinen (mit einem ph unter 5,5), wogegen die Mitglieder der Unterfamilie B einen relativ basischen ph von 6 oder mehr haben. AE1/AE3 ist ein Cocktail aus zwei monoklonalen Antikörpern, die aus der Immunisierung von Mäusen mit humanen Kalluskeratinen gewonnen wurden [106]. AE1/AE3 weist die Mehrzahl humaner Zytokeratine nach und kann daher als Werkzeug für den positiven IHC-Nachweis von Zellen verwendet werden, deren Herkunft in einfachen und stratifizierten Epithelien liegt [106] [95] ). Antikörper AE1 zeigt eine Immunreaktion mit einer antigenen Determinante, die auf den meisten Cytokeratinen der Subfamilie A vorkommt, einschließlich Cytokeratinen mit der Mollschen Bezeichnung 10, 13, 14, 15, 16 und 19 (MG 56,5, 54', 50, 50', 48 bzw. 40 kd), jedoch nicht auf den Nummern 12, 17 und 18 (MG 55, 47 bzw. 45 kd) [88]. Antikörper AE3 reagiert mit einer antigenen Determinante, die den Cytokeratinen der Subfamilie B gemeinsam ist, einschließlich der Nummern 1 und 2, 3, 4, 5, 6, 7 und 8 (MG 65, 67, 64, 59, 58, 56, 54 bzw. 52 kd) [22]. Monoclonales-Maus-Antihuman-Zytokeratin (Klone AE1/AE3) ist zum Laborgebrauch für den qualitativen Nachweis zweier Epitope mittels Lichtmikroskopie und immunhistochemischer (IHC-) Testmethoden bestimmt, die auf der Mehrzahl von Epithelzytokeratinen in azetonfixierten gefrorenen und formalinfixierten, paraffineingebetteten Geweben vorkommen. Positive Ergebnisse unterstützen bei der Klassifikation gesunder und neoplastischer Gewebe, die ihrer Herkunft nach Epithelien sind [63], und dienen als Ergänzung zur konventionellen Histopathologie. 1.6 Ziel der Arbeit Die einzige therapeutische Möglichkeit, Patienten mit Ösophaguskarzinom potentiell kurativ zu behandeln, ist die komplette chirurgische Resektion mit ausgedehnter Lymphadenektomie. Bei Patienten mit fortgeschrittenem Ösophaguskarzinom (Stadium III) führt die neoadjuvante Radiochemotherapie zum Downstaging des Primärtumors, mit auch histopathologisch nachgewiesener Tumorrückbildung und
32 32 Einleitung Zunahme der R0-Resektionsquote, allerdings ohne bisher gesicherte Steigerung der Überlebenszeit [36]. Die Rezidivrate nach Operation ist sogar bei Patienten, die keinen Lymphknotenbefall aufwiesen, sehr häufig. Dieses Phänomen ist der Beweis dafür, dass die Ausbreitung von Tumorzellen in Lymphknoten weit größer ist, als dies in routine-pathologischen Untersuchungen nachzuweisen ist [66]. Die konventionelle Beurteilung von regionalen Lymphknoten wird gewöhnlicherweise durch einen histologischen Schnitt für jeden LK gemacht. Während routinehistopathologische Untersuchungen metastatische Foci nur über 2mm detektieren können, beschreibt der Term Mikrometastasen Cluster an Zellen, die nicht durch diese konventionellen Methoden entdeckt werden [45]. Neues Interesse wurde in den achtziger Jahren durch die Einführung immunhistochemischer und molekularer Nachweismethoden disseminierter Tumorzellen geweckt. Dies bot Anlass zu verschieden Interpretationen und unterschiedlichen Auslegungen der TNM- und Residualtumor (R) Klassifikation [32]. Die Ausbildung von Metastasen ist ein komplexer Prozess. Nur ein kleiner Prozentsatz von zirkulierenden Tumorzellen (0,05 Prozent) überleben und initiieren einen metastatischen Focus [32]. In dieser Studie werden Muster, Inzidenz und prognostische Bedeutung okkulter Tumorzellen in Lymphknoten (Mikrometastasen) mit immunhistochemischen Methoden untersucht. So soll die Frage geklärt werden, ob ein erweitertes Staging empfehlenswert ist und Einfluss auf die Wahl der Therapie haben könnte. Ein Großteil der Patienten wurde mit einer präoperativen Radiochemotherapie behandelt. Es ist von großem Interesse, zu untersuchen, ob die neoadjuvante Therapie die Inzidenz am mikrometastatischen Tumorfoci und die Überlebensrate beeinflussen kann, um möglicherweise auch in sehr frühen Stadien des Ösophaguskarzinoms sinnvoll zum Einsatz zu gelangen. Dabei sollen histopathologische Merkmale in den Lymphknoten als Residuen der präoperativen Radiochemotherapie aufgezeigt und mit Überlebensraten korreliert werden. Weiterhin soll ersichtlich werden, inwieweit der histologische Subtyp Einfluss auf die Prognose hat.
33 33 Material und Methoden 2 Material und Methoden 2.1 Patienten Insgesamt wurden 162 Patienten, die im Zeitraum zwischen 1991 und 2003 an der Universitätsklinik Freiburg, Abteilung Allgemein- und Viszeralchirurgie wegen eines Ösophaguskarzinomes operiert worden waren, ausgewählt. 104 Patienten erhielten eine kombinierte Radiochemotherapie nach dem Naunheim-Protokoll [67]. Die neoadjuvante Radiochemotherapie wurde 1994 eingeführt. Die Radiotherapie wurde gleichzeitig mit Chemotherapie für vier Wochen an fünf Tagen pro Woche verabreicht. Es wurde mit einer Gesamtdosis von 36 Gy zu täglichen Dosen von 1,8 Gy an Tag 1 bis 5 für vier Wochen bestrahlt. Zusätzlich erhielten die Patienten 500 mg/m 2 5-Fluorouracil an Tag 1 bis 5 für vier Wochen und 20 mg/m 2 Cisplatin an Tag 1 bis 5 in der ersten und vierten Woche. Nach einer Pause von mindestens vier Wochen wurde ein Restaging und die Operation durchgeführt (durchschnittlich acht bis zehn Wochen nach dem Beginn der präoperativen Radiochemotherapie). Die Response auf die präoperative Radiochemotherapie wurde durch den Vergleich des klinischen Tumorstadiums vor Beginn der Behandlung und dem Tumorstadium des resizierten Gewebes bestimmt. Die histologische Aufarbeitung der Resektate durch Pathologen der Universität Freiburg ergab, dass 91 Patienten primär pn0 (keinen durch routinehistopathologische Methoden nachweisbarer Lymphknotenbefall) aufwiesen. Mit diesen Patienten beschäftigte sich die vorliegende Arbeit. Zunächst wurden sämtliche, bereits auf Objektträgern vorhandene H&E-Schnitte von Lymphknoten nochmals komplett auf eventuell übersehene Metastasen untersucht, dabei mussten zwei Patienten nachträglich als pn1 eingestuft werden, da bereits eine Lymphknotenmetastasierung vorlag. Von drei Patienten konnte entweder das komplette Resektat oder die Lymphknotenblöcke nicht im Archiv gefunden werden, sie wurden daher ebenfalls aus der Studie ausgeschlossen. Bei einem Patienten wurde kurz nach der Operation eine zervikale Fernmetastase diagnostiziert, auch dieser Fall wurde nicht berücksichtigt. Von den verbleibenden 85 pn0-patienten waren fünf nicht R0-resiziert, so dass davon auszugehen ist, dass Resttumorgewebe in der Anastomose verblieben ist. Die statistische Auswertung berücksichtigt diese Fälle insbesondere.
34 34 Material und Methoden Von den verbleibenden 80 Patienten erhielten 59 eine neoadjuvante Radiochemotherapie (73,75 Prozent). Operativ wurde in den meisten Fällen ein transthorakaler Zugang mit einer en-bloc- Lymphadenektomie gewählt (Tabelle 7, S.35). Bei einigen Patienten wurde hauptsächlich wegen beeinträchtigter Lungenfunktion ein transhiataler Zugang bevorzugt. Eine thorakoabdominelle Resektionstechnik wurde bei 72 Patienten (90 Prozent der Fälle) durchgeführt, nur 8 Fälle (10 Prozent) wurden transmediastinal operiert. In fast allen Fällen (n=76, 95 Prozent) wurde durch einen Magenhochzug eine zervikale Anastomose erreicht, bei nur sehr wenigen Patienten (n=4, 5 Prozent) musste ein Kolon-Interponat im hinteren Mediastinum plaziert werden. Bei 58 Patienten (72,5 Prozent) der Patienten wurde eine thorakoabdominelle Zwei-Feld- Lymphadenektomie durchgeführt. Eine Ein-Feld-Lymphadenektomie (zervikal, thorakal oder abdominell) erhielten 12,5 Prozent der Patienten (n=10). Postoperativ war eine intensivmedizinische Überwachung für einige Tage obligat, die maschinelle Beatmung wurde meist am Tag der Operation beendet. Acht Patienten (10 Prozent) hatten einen Zweittumor (Stimmbandkarzinom, Prostatakarzinom, Ovarialkarzinom u.a.). Schwere, einschränkende Begleiterkrankungen wurden bei 61 Fällen (76,25 Prozent) festgestellt, hauptsächlich handelte es sich um kardiale und pulmonale Probleme (arterieller Hypertonus, KHK, COPD). Postoperative Komplikationen, hauptsächlich chirurgische (Anastomoseninsuffizienz, Rekurrensparesen), pulmonale (Pneumothorax, ARDS, Pleuraempyem) und kardiale, wurden bei 71 Patienten (88,75 Prozent) gesehen. Nikotinabusus bei 76,25 Prozent und Alkoholabusus bei 67,5 Prozent der Patienten waren die wichtigsten kanzerogenen und mortalitätsbezogenen Risikofaktoren. Die Lokalisation der Primärtumore des Patientengutes verteilt sich analog der empirischen Daten (siehe und Tabelle 7, S.35), das Adenokarzinom trat wie erwartet - vornehmlich im unteren und mittleren Anteil des Ösophagus auf. Dem postoperativen Grading wurde ein weiteres (Gx-)Stadium zugeordnet; hier zeigte sich vor allem bei den neoadjuvant behandelten Patienten kein nachweisbarer Tumor mehr, so dass ein Grading ebenso nicht möglich war. Die sich ergebende histologische Zuordnung der Tumore zeigt ebenfalls die Tabelle 7. Dabei entfielen auf das Plattenepithelkarzinom 72,5 Prozent (n=58), 27,5 Prozent (n=22) der Patienten hatten ein Adeno- bzw. Barettkarzinom.
35 35 Material und Methoden Geschlecht (n/m:w) 63:17 Durchschnittsalter (SD) Lokalisation Primärtumor Histologischer Typ 59,6 (±9,5) Jahre n (% von n=80) oberes Drittel 14 (17,5%) mittleres Drittel 33 (41,3%) unteres Drittel 34 (42,5%) Adenokarzinom 22 (27,5%) Plattenepithelkarzinom 58 (72,5%) Histoloisches Grading neoadjuvante Therapie Operationstechnik Gx 25 (31,25%) G1 3 (3,75%) G2 34 (42,5%) G3 18 (22,5%) ja 59 (73,75%) nein 21 (26,25%) Thorako-abdominal 72 (90%) Lymphadenektomie Transmediastinal 8 (10%) Magenhochzug 76 (95%) Koloninterposition 4 (5%) Ein-Feld 10 (12,5%) Zwei-Feld 58 (72,5%) nicht angegeben 12 (15%) Zweitkarzinom 8 (10%) Schwere Begleiterkrankungen postoperative Komplikationen 61 (76,25%) 71 (88,75%) 1 Fall mit Befall von unterem und oberen Drittel kein TU nach neoadj. Behandlung nachweisbar Tabelle 7: klinisch-pathologische Merkmale der pn0-patientengruppe (n=80) Wie aus der Tabelle 8, S.36 ersichtlich, verteilte sich das Geschlecht der Untersuchten zu 80 Prozent auf Männer und dementsprechend 20 Prozent auf Frauen. Das mediane Alter aller Karzinom-Patienten betrug 59,6 Jahre mit einer Standardabweichung von 9,5 Jahren. Für das plattenepitheliale Karzinom errechnete sich ein männlicher Prozentanteil von 52,9 Prozent gegenüber 15,3 Prozent weiblicher Tumorpatienten. Mit dem errechneten medianen Alter von 58,8
36 36 Material und Methoden (Standardabweichung 9,2 Jahre) stimmt die Auswahl dieser Patienten mit dem in der Literatur angegebenen medianen Alter von 55 Jahren annähernd überein [13]. Für das Adenokarzinom ergab sich die Anzahl von 22 Patienten mit einem weiblichen Anteil von 4,7 Prozent und einem männlichen Anteil von 21,2 Prozent. Das statistische Durchschnittsalter für diese Auswahl zum Zeitpunkt der Operation (57,4 ± 11,1 Jahre) ist aufgrund der geringen Anzahl der Patienten nur annähernd mit den Publikationsangaben (medianes Alter 63 Jahre) vereinbar. Dennoch zeigt die Tumorverteilung (Tabelle 8, S.36) in etwa die statistische Verteilung von Prozent Plattenepithelkarzinome und Prozent Adenokarzinome (vgl. Tabelle 2, S. 11) Tumor Geschlecht Altersverteilung zum Zeitpunkt der männlich weiblich Gesamt OP n=63 n=17 n=80 59,6 Jahre ± 9,5 Gesamt 78,75% 21,25% 100,00% (Mean SD) Plattenepithel-CA Adeno-CA n=45 n=13 n=58 52,94% 15,29% 72,5% n=18 n=4 n=22 21,18% 4,71% 27,5% 58,9 Jahre ± 9,2 (Mean SD) 57,4 Jahre ± 11,1 (Mean SD) Tabelle 8: Geschlechter- und Altersverteilung (Histologie) Aus nachfolgender Tabelle 9 sind die postoperativen T-Stadien zu entnehmen. Anzumerken ist, dass es sich hierbei für einige Fälle um Stadien nach neoadjuvanter Bestrahlung (T0) handelt und einige Primärtumore nicht mehr nachgewiesen werden konnten. T-Stadium T0 T1 T2 T3 T Ges ,25% 16,25% 26,25% 26,25% 100,00% Tabelle 9: postoperative Tumorgröße-Stadien der pn0-patienten (n=80) 2.2 Histologische Aufarbeitung Aus der verbleibenden Patientengruppe wurden alle in Paraffin eingebetteten Gewebeblöcke aus dem Archiv des pathologischen Instituts herausgesucht, hierbei konnte man sich auf die vorhandenen, schriftlich fixierten Befunde berufen. Die
37 37 Material und Methoden Gewebeblöcke wurden gemäß den in der Literatur angegebenen Richtwerten geschnitten (Abbildung 5, S.37). Es wurden insgesamt 6 konsekutive Schnitte entnommen, die Schnittdicke betrug 2 µm. Jeder erste, dritte und fünfte Schnitt wurde mit einer H&E-Färbung aufgearbeitet, jeder zweite, vierte und sechste Schnitt erhielt eine immunhistochemische Färbung. Der erste (H&E) und der zweite Schnitt (IHC) folgten in einem mindestmöglichen Abstand von 2 µm, um die optische Kontrolle zu gewährleisten, nach 150 µm wurde der dritte (H&E) und wiederum in einem Abstand von 2µm der vierte Schnitt (IHC) gewonnen. Nach gleichem Schema wurde mit dem fünften und sechsten Schnitt verfahren Lymphknoten 2µm 150µm 2µm 150µm 2µm Abbildung 5: schematische Darstellung von Schnittanzahl und -abständen durch einen Lymphknoten H&E-Färbung Zur Beurteilung morphologischer Veränderungen wurde eine Standardfärbung mit Hämalaun-Eosin (H&E-Färbung) durchgeführt. Die Hämalaun-Eosin-Färbung (H&E-Färbung) ist eine geeignete Methode zur Übersichtsfärbung von Gewebe. Diese Färbetechnik wurde zur Darstellung der histologischen Routineschnitte des OP-Materials und der neu aufgearbeiteten Kontrollschnitte (Abbildung 5, S.37) eingesetzt. Nach der Entparaffinierung in Xylol und einer absteigenden Alkoholreihe wurden die Schnitte zur Kernfärbung 10 Minuten in einer 1:5 verdünnten Hämalaunlösung nach Mayer (Fa. Merck, Darmstadt) gefärbt. Anschließend wurden sie 10 Minuten unter fließendem Leitungswasser gespült und 30 Sekunden in einprozentiger wässriger
38 38 Material und Methoden Eosinlösung (Fa. Merck, Darmstadt) gegengefärbt. Nach einem kurzen Waschvorgang in aqua dest. wurden die Schnitte in einer aufsteigenden Alkoholreihe entwässert, einige Minuten in Xylol belassen und auf Objektträger (Fa. Langenbrinck, Teningen) eingebettet. Durch das Hämalaun werden alle basophilen Zellbestandteile wie z.b. das Chromatin der Zellkerne blau dargestellt. Diese Bläuung stellt sich beim Überspülen der in Farbe getauchten Objektträger mit elektrolythaltigem Leitungswasser ein, dabei bestimmt die Dauer des Wasserkontaktes die Farbintensität. Danach wurde mit Eosin (Rot) gegengefärbt, welches Zytoplasma und Interzellularsubstanz rosa darstellt. Die Lösung bestand aus 1 Prozent Eosin-Y, 0,5 ml Eisessig auf 0,1 l Aqua dest. Die Präparate wurden eingedeckelt und mit dem Mikroskop Axioskop 50 (Fa. Carl Zeiss) analysiert Immunhistochemische Färbung Zur immunhistochemischen Aufarbeitung der Lymphknotenblöcke wurde der Zytokeratin-Antikörper-Cocktail AE1/AE3 (DAKO, Hamburg) verwendet (siehe auch Abschnitt 1.5., S.30). Wir nutzten AE1/AE3 als gereinigte Immunglobulinfraktion von Aszites in folgender Aufarbeitung: AE1/AE3 1ml TRIS-HCl 0,05 mol/l Natriumazid 0,015 mol/l ph 7,2 Tabelle 10: Zusammensetzung des AE1/AE3-Cocktails LSAB-Immunhistochemie im automatisierten Verfahren (Labelled Streptavidin-Biotin) AE1/AE3 wurde vor den eigentlichen Versuchen über das DAKO -Autostainer-Gerät in Verdünnungsreihen an einem epithelialen Präparat ausgetestet und gefärbt. Verwendet wurde eine Dilution von 1:200, da in dieser Verdünnung der beste Gewebekontrast hergestellt werden konnte.
39 39 Material und Methoden Von den in Paraffin eingebetteten Geweben wurden serielle 2 µm dicke Schnittpräparate hergestellt und auf polysinbeschichtete Objektträger aufgezogen. Nach Inkubation im Brutschrank bei 60 C für mindestens eine Stunde wurden die Schnitte entparaffiniert. Dazu durchliefen sie folgende Alkoholreihe im Entparaffinierungsgerät: in Xylol 16 mal 1,5 min in 100%igem Ethanol 3 mal 1,5 min in 96%igem Ethanol 1 mal 1,5 min in 70 %iger Ethanol 1 mal 1,5 min Die Epitopdemaskierung erfolgte in 1fachem TRS (Target Retrieval Solution, DAKO- Cytomation) für 30 Minuten im Dampfgarer unterhalb des Siedepunktes bei 99 C. Der ph-wert des TRS für den Antikörper AE1/AE3 betrug ph 6. Die proteolytische Vorbehandlung erfolgte mit Proteinase K (Fa. SIGMA, Steelze). Die Färbung mit dem Antikörper erfolgte mit dem Autostainer-Gerät. Die Inkubationszeit mit dem Primärantikörper in einer bestimmten Verdünnung betrug 30 Minuten. Nach kurzem Waschen mit Waschpuffer, wurde der Sekundärantikörper (Flasche A des ChemMate Detection Kit, DAKO-Cytomation) für 15 Minuten zugegeben. In dieser Flasche waren die Sekundärantikörper gegen beide Tierarten (Maus und Kaninchen) enthalten. Nach nochmaligem Waschen wurde die alkalische Phosphatase (Flasche B des ChemMate Detecion Kit, DAKO-Cytomation) für 15 Minuten zugegeben. Die Farbreaktion wurde durch eine 10 minütige Inkubation in Neufuchsin (Flaschen C bis G: Färbekomplex RED Chromogen 1-3, alkalische Phosphatase-Substrat-Puffer, Levamisol) hervorgerufen. Nach Waschen mit Aqua dest. wurden die Zellkerne im Hämalaun nach Mayer 6 Minuten gegengefärbt und 5 Minuten unter fließendem Wasser gebläut. Nach kurzem Eintauchen in die Gefäße einer aufsteigenden Alkoholreihe (70%, 96%, 100% Ethanol, dann 100% Xylol) wurden die Schnitte mit Hilfe eines Folieneindecklers eingedeckelt. Die durch Neufuchsin erzeugte Farbe ist nicht in Alkohol oder anderen organischen Lösungsmitteln löslich, daher können die Präparate vor dem Eindecken entwässert werden.
40 40 Material und Methoden Enzymsubstrat Streptavidin und Sekundärantikörper (biotinyliert) Primärantikörper LSAB-Methode: Ein biotinylierter Sekundärantikörper bindet an den Primärantikörper. Die alkalische Phosphatase (AP) wird im Komplex mit Streptavidin zugegeben. Avidin hat vier Bindungsstellen für Biotin und bindet somit an den Sekundärantiköper. Das Enzymsubstrat Neufuchsin wird von der AP enzymatisch gespalten, was zur Rotfärbung führt. Abbildung 6: Darstellung der Labelled Zusammensetzung der Neufuchsin Antigene StreptAvidin-Biotin-Methode (LSAB-Methode) (nach - Substratlösung [10] ) Zusammensetzung der Neufuchsin-Substratlösung: (empfohlen für Gewebeschnitte) 1. Lösung A: 18 ml 0,2 M 2-Amino-2-methyl-1,3-propandiol mit 50 ml 0,05 M Trispuffer, ph 9,7 und 600 mg Natriumchlorid mischen. 28 mg Levamisol zufügen. 2. Lösung B: 35 mg Naphthol AS-BI-Phosphat in 0,42 ml N,N- Dimethylformamid lösen. 3. Lösung C: Unter einem Laborabzug 0,14 ml 5% Neufuchsin (5 g in 100 ml 2 N HCI) mit 0,35 ml frisch angesetztem 4% Natriumnitrit (NaNO2, 40 mg in 1 ml Aqua dest.) mischen. 60 Sekunden rühren. 4. Lösung A und B mischen, anschließend Lösung C hinzufügen; den ph-wert mit Salzsäure (HCI) auf 8,7 einstellen. Mischen und filtriert auf die Objektträger auftragen min bei Raumtemperatur inkubieren. 6. Mit destilliertem Wasser spülen. 7. Gegenfärben und Eindecken; wässrige (Glycergel, C0563) oder organische Eindeckmedien.
41 41 Material und Methoden 2.3 Statistik Die Daten aller Ösophaguskarzinompatienten wurden fortlaufend über Jahre durch Mitarbeiter der Chirurgischen Universitätsklinik Freiburg erhoben, aktualisiert und ausgewertet. Die letzte Datenaktualisierung fand im April 2004 statt. Folgende Parameter wurden aufgenommen: Geschlecht, Alter, Größe und Gewicht, Zeitpunkt der Operation, ptnm-stadium, Lokalisation des Tumors, Tumorlänge, Tumorstenose, durchgeführte neoadjuvante Therapie, Response auf neoadjuvante Therapie, Operationstechnik und Operationszugang, Länge des postoperativen stationären Aufenthaltes, Risikofaktoren (Alkohol, Nikotin), Histologie (Adenokarzinom, Plattenepithelkarzinom), Vorhandensein eines Zweitkarzinoms, schwere Begleiterkrankungen, postoperative Komplikationen und Überlebensdaten. Die Ergebnisse dieser Arbeit wurden mit der Überlebenszeit, Response (Ausmaß der Tumorremission nach neoadjuvanter Therapie mittels Vergleich von prä- und posttherapeutischen Stadien), Tumorfaktoren (Infiltrationstiefe, Tumorlänge) verglichen und korreliert. Die statistischen Tests wurden mit Hilfe des Programms SPSS (SPSS Inc., Chicago Ill.) durchgeführt. Unterschiede in Häufigkeiten wurden mit dem Chi-Quadrat-Test nach Pearson oder dem Exakten Test nach Fisher detektiert. Unterschiede von Mittelwerten verlangte nach dem Student t-test. Überlebenszeiten wurden mit der Meier-Kaplan-Überlebensanalyse korreliert, die Gleichheit der Überlebenskurven wurde mit dem lok-rank-test analysiert. Ein p-wert (p-value) weniger als 0,05 wurde als signifikant gewertet. Für multivariate Analysen wurde der Cox s propotional hazard test benutzt.
42 42 Ergebnisse 3 Ergebnisse 3.1 Mikrometastasen und Zytokeratinpositivität Die Analyse der bereits vorhandenen H&E-Schnitte aus der routinepathologischen Untersuchung zum Zeitpunkt der Operation und Gewebeentnahme wurden retrospektiv komplett aufgearbeitet. Die eingedeckelten Präparate der frühen Jahrgänge ( ) zeigten starke altersbedingten Materialschäden und konnten nicht vollständig reevaluiert werden. In der immunhistochemischen Aufarbeitung konnten Lymphknotenschnitte von 85 Patienten begutachtet werden. Insgesamt wurden 1435 Lymphnoten aus 429 Gewebe-Blöcken untersucht. Dies entspricht einer Anzahl von 2566 Schnitten. Pro Block wurden durchschnittlich 3,4 Lymphknoten untersucht, pro Fall ergab sich eine durchschnittliche Lymphknotenanzahl von 17,24 (SD ± 11,1). Unklare Befunde und gefundene Mikrometastasen wurden eingehend mit zwei erfahrenen Pathologen nachbesprochen. Tumorverdächtige Zellen wurden nur dann als vitale Mikrometastasen gewertet, wenn folgende Kriterien übereinstimmten: - Fehlende Nachweisbarkeit in der routinehistologischen H&E-Färbung - zytokeratinpositives Zytoplasma - große Zellen (im Vergleich zur Umgebung) - relativ großer, unförmiger Zellkern - große, auffällige Nukleolen - wenig Zytoplasma - tumorassoziierter Bezug zum Nachbargewebe (Ausschluss operationsbedingte Kontamination mit Tumorzellen) - stromale Reaktion des lymphoiden Gewebes - eventuell gleichzeitig auftretende Lymphangiosis carcinomatosa bzw. Tumorzellen auch in anderen LK-Präparaten des gleichen Patienten Insgesamt wurden bei 85 Patienten, deren Lymphknoten untersucht wurden, sechs (8,25 Prozent) Mikrometastasen entsprechend den vordefinierten Kriterien gefunden. Bei einem Fall mit MM handelte es sich um keine vollständige R0-Resektion. Nach Ausschluss der fünf nicht R0-resizierten Patienten entspricht dies einer Detektionsrate von 6,25 Prozent (pn + ) bei nunmehr 80 Patienten. Die Zytokeratin- Positivität (CK +ges ) lag mit 42,5 Prozent erheblich höher. Sie subsumiert sämtliche
43 43 Ergebnisse Fälle, bei denen zytokeratinpositive Zellen in oder an den Lymphknoten nachgewiesen werden konnten. Dies schließt vitale Mikrometastasen, avitale Mikrooder Makrometastasen, nahe Infiltration des benachbarten Fettgewebes, perineurale Infiltration und Lymphangiosis carcinomatosa mit ein. Die Lymphangiosis carcinomatosa (12,5 Prozent) ist als zytokeratinpositives Tumorzellwachstum entlang von Lymphkapillaren und Lymphkollektoren charakterisiert. Eine perineurale Infiltration (Wachstum von Tumorzellen entlang von Nervensträngen) wurde bei 5 Prozent der Fälle beobachtet. Die lymphknotenbezogene Zytokeratinpositivität (CK LK+ ) schließt nur die nach histologischen Kriterien diagnostizierten Mikrometastasen, avitale Mikro- und Makrometastasen, sowie übrige zytokeratinpositive Zellen (inklusive zytokeratinpositiver Restaktivität in fibrotischen oder narbigen Arealen) mit ein. Die CK LK+ war mit 23,75 Prozent ebenfalls noch deutlich erhöht gegenüber dem singulären Nachweis von Mikrometastasen (Tabelle 11). Histologische Merkmale n Patienten (%) auf LK begrenzt (CK LK+ ) (%) Zytokeratinpositivität 34 (42,5) 19 (23,75) Mikrometastasen (pn+) 5 (6,25) 5 (6,25) avitale Mikro-oder Makrometastasen 13 (16,25) 13 (16,25) avitale Mikrometastasen 4 (5) 4 (5) avitale Makrometastasen 11 (13,75) 11 (13,75) Lymphangiosis carcinomatosa 10 (12,5) - perineurale Infiltration 4 (5) - Infiltration Fettgewebe 9 (11,25) - Narben und Fibrosen 17 (21,25) 12 (15) Tabelle 11: Histologische Merkmale und Zytokeratinpositivität bei n=80 Patienten Während vitale Tumorzellnester nur dann als vitale Mikrometastasen eingestuft wurden, wenn sie die oben genannten Kriterien erfüllten, zählte zur CK LK+ nur die Anfärbbarkeit durch AE1/AE3. Auch hier wurden histologische Merkmale (Assoziation zum umgebenden Gewebe, Stromareaktion) kritisch angewendet, um eine Kontaminationswahrscheinlichkeit weitestgehend auszuschließen. Die Kontaminationsrate war mit über 82 Prozent sehr hoch, die zytokeratinpositiven Partikel konnten zuverlässig anhand morphologischer Kriterien erkannt und als
44 44 Ergebnisse falsch-positiv ausgeschlossen werden. Oftmals handelte es sich um operationsbedingte Kontamination von Tumorzellen, des weiteren um Fremdpartikel durch die Aufarbeitung der Präparate. Durch aufgefaltete Lymphknotenschnittflächen war es in wenigen Fällen nicht möglich, eventuell vorhandene zytokeratinpositive Zellen suffizient zu differenzieren. In einem Fall trat neben einer vitalen Mikrometastase auch eine avitale Makrometastase auf, in drei weiteren Fällen war gleichzeitig eine perineurale Infiltration (1 Fall) oder Lymphangiosis carcinomatosa (2 Fälle) zu sehen (Tabelle 12). Mikrometastasen Fall 1 Fall 2 Fall 3 Fall 4 Fall 5 Anzahl untersuchte LK pro Fall Lokalisation Nicht angegeben Cardia Periösophageal Tracheal- Bifurkation Zwerchfellschenkel Primärtumor * AC SCC SCC SCC AC Tumorlokalisation (Drittel) Mittleres unteres unteres Oberes Unteres Begleiterscheinungen Ly.carc. Ly.carc. avitale LK- Metastase Perineurale Infiltration --- pt-stadium neoadjuvante Therapie? nein nein ja Ja nein Tabelle 12: klinisch pathologische Zusammenhänge bei n=5 gefundenen Mikrometastasen * AC= Adenokarzinom, SCC=Platteneptithelkarzinom (Squamous cell carcinoma) Ly.carc.= Lymphangiosis carcinomatosa In keinem Fall wurden mehr als eine Mikrometastase pro Patient festgestellt. Die durchschnittlich untersuchte Lymphknotenanzahl bei den Patienten mit Mikrometastasen (pn + ) war 19 (SD ± 5,7), die der pn0 gebliebenen 17,12 (SD ± 11,4). Tabelle 13 gibt eine aufgeschlüsselte Übersicht. Mikrometastasen Mittlere LK-Anzahl Fälle. Standard-. Abweichung ja 19,00 5 5,568 nein 17, ,354 Total 17, ,070 Tabelle 13: durchschnittliche Lymphknotenanzahl bei Patienten mit oder ohne Mikrometastasen
45 45 Ergebnisse Die Lokalisation der Mikrometastasen entsprach (bis auf einen unklaren Fall) lokoregionären Lymphknoten bei entsprechender Position des Primärtumors. Beispielsweise waren bei einer Tumorlokalisation im unteren Drittel die cardianahen Lymphknoten betroffen, desweiteren Lymphknoten im Zwerchfellschenkel und periösophageal. Bei Position des Primärtumors im oberen Drittel des Ösophagus wurde eine Mikrometastase in den Lymphknoten der Trachealbifurkation gefunden. Mikrometastasen wurden unabhängig vom histologischen Grading (Grad 1 bis 3) detektiert; einschränkend bleibt zu bemerken, dass in 25 von 80 Fällen ein Grading nicht vorlag. Auch das pt-stadium präsentierte sich heterogen: dreimal gelang ein Mikrometastasen-Nachweis bei T3-Tumoren, einmal im T0-Stadium und ein weiteres Mal im Stadium T1. Eine neoadjuvante Therapie erhielten drei von fünf Patienten mit detektierten Mikrometastasen. In einem Fall gelang es nicht, ein CK-positive Zelle genauer zu differenzieren, eine daraufhin durchgeführte CD-68-Färbung (Immunhistochemie) konnte diese Zelle eindeutig als Makrophagen identifizieren. CK-Positivität (LK begrenzt) ØLK-Anzahl Mean Fälle N Std. Deviation ja 20, ,600 nein 16, ,640 Total 17, ,070 Tabelle 14: durchschnittliche Lymphknotenanzahl bei Patienten mit oder ohne nachgewiesener CK- Positivität In der Tabelle 14 erkennt man, dass mit einem Mittelwert von 20,2 (SD 8,6) deutlich mehr Lymphknoten untersucht wurden, wenn Zytokeratinpositivität festgestellt wurde (p=0,182). Abbildung 7; S.46 zeigt die Verteilung der untersuchten Lymphknoten bei CK LK+ und CK LK-.
46 46 Ergebnisse Untersuchte Lymphknoten ja CK-Positivität (LK begrenzt) nein Abbildung 7: 7 Verteilung der Lymphknotenanzahl bei vorhandener detektierter oder nicht detektierte vorhandener CK-Positivität n=43 CK-Positivität (LK begrenzt) ja nein Fälle 30 72,9% 20 n=16 p=0,186 n= ,1% n=3 14,3% 85,7% 0 ja nein prae OP: Neoadjuvante Therapie Abbildung 8: Anteile der Zytokeratinpositivität bei vorhandener (n=59) und nicht vorhandener (n= 21) neoadjuvanter Therapie Abbildung 8, S. 46 zeigt die Anteile der Zytokeratinpositivität bei vorhandener und nicht vorhandener neoadjuvanter Therapie. Erfolgte eine neoadjuvante Therapie, so
47 47 Ergebnisse wurde unter diesen Fällen 27,1 Prozent CK-Positivität detektiert. Wurden Patienten nicht präoperativ behandelt, lag der Anteil der CK-Positivität bei 14,3 Prozent (p=0,186). Diagnostik: N-Staging prae OP CK-Pos. ohne MM Total ja nein cn cn cnx Total Tabelle 15: Auftreten von Zytokeratinpositivität in verschiedenen präoperativen N-Stadien In den abgebildeten Tabellen 15 und 16, S.47 ist der Nachweis von Mikrometastasen oder Zytokeratinpositivität (ohne Mikrometastasen) im Zusammenhang mit der präoperativen cn-situation zu sehen. Mikrometastasen verteilten sich in drei Fällen auf das Stadium cn0 und in zwei Fällen auf das Stadium cn1 (Tabelle 16). Diagnostik: N-Staging prä-op Micrometastasen Total ja nein cn cn cnx Total Tabelle 16: Auftreten von Mikrometastasen in verschiedenen präoperativen N-Stadien Zytokeratinpositivität (siehe Tabelle 15) wurde bei 9 Fällen (64 Prozent) im cn1- Stadium detektiert, 3 Patienten mit nodalem Zytokeratinnachweis hatten ein cn0- Stadium, in 2 Fällen war die präoperative nodale Situation nicht eindeutig (cnx). Alle ehemaligen cn1-fälle waren histopathologisch pn0 gestagt, davon entfielen n=33 (89 Prozent) auf Fälle mit Radiochemotherapie (Tabelle 17). prae OP: Neoadjuvante Therapie ja nein Total Diagnostik: N-Staging prae OP X Total Tabelle 17: Verteilung der Patienten mit oder ohne neoadjuvanter Behandlung in verschiedene präoperativen N-Stadien
48 48 Ergebnisse In der nachfolgenden Bilderserie sind in der Abbildung 9, S im Bild (1) und (2) der Nachweis einer Mikrometastase im Randbereich eines Lymphknotens durch Immunhistochemie mit 10facher (1) und 40facher (2) Vergrößerung zu sehen. Eine weitere Mikrometastase im Randsinus eines Lymphknotens ist im Bild (3) (20fach) und Bild (4) (100fach) in der AE1/AE3-Anfärbung zu sehen. Gut zu erkennen ist der relativ große Zellkern, die ausgeprägten, auffälligen Nukleolen und exzellente zytoplasmatische Anfärbbarkeit durch den Antikörper AE1/AE3. Disseminierte, ungeordnet im Lymphknoten liegende Tumorzellen sind in Bild (5) in 5facher Vergrößerung zu sehen. Die Darstellung einer malignen Einzelzelle (6) wiederholt die eingangs erwähnten Kriterien einer Tumorzelle. In Bild (7) (10fach) ist ein Tumoreinbruch in eine Lymphkapillare zu erkennen (Lymphangiosis carcinomatosa). Ein Cluster von Tumorzellen ist in (8) zu sehen und wurde als Mikrometastase gewertet, da diese Zellen nicht in der H&E-Färbung zu sehen waren. Eine Stromareaktion des umgebenden lymphatischen Gewebes ist dabei sehr gut abzugrenzen. In Abbildung (9) und (10) wurden im Randsinus eines Lymphknotens gefundene Tumorzellen anhand zweier im Abstand von 2 µm gefertigter Schnitte verglichen: (9) zeigt die H&E-Färbung (20fach), in der die metastatischen Zellen nur schwer zu detektieren sind; in (10) sind die selben Zellen durch die gute Kontrastierung durch AE1/AE3 und dem Färbereagenz Neufuchsin sehr leicht vom übrigen Lymphknotengewebe abzugrenzen. In (11) erkennt man eine avitale Makrometastase, die vorher nicht gefunden wurde. Alle Zellen sind nicht mehr vital, eine Anfärbung durch AE/AE3 ist jedoch gegeben. Um das nekrotische Metastasengewebe findet sich fibrotisches Narbengewebe als Resultat der Radiochemotherapie. Der Antikörper färbt auch Mesothelien (12) an. Diese sind jedoch aufgrund typischer histologischer Merkmale leicht von Tumorzellen zu differenzieren. Als ein typisches Artefakt sind im Bild (13) zytokeratinanreichernde Partikel zu identifizieren. Diese haben keine typischen Merkmale von vitalem oder avitalem Tumorgewebe, es besteht kein Bezug zum umgebenden Gewebe. Solche Verschmutzungen kamen häufig vor und wurden nach Diskussion mit zwei Pathologen von der Analyse ausgeschlossen.
49 49 Ergebnisse
50 50 Ergebnisse Bildnachweis: (Abbildung 9) 1. Nachweis einer MM im Randbereich eines LK (10x) 2. Nachweis einer MM im Randbereich eines LK (40x) 3. MM im Randbereich eines LK (20x) 4. MM im Randbereich eines LK (100x) 5. disseminierte Tumorzellen in einem LK (5x) 6. Darstellung einer malignen Einzelzelle (100x) 7. Tumoreinbruch in eine Lymphkapillare (10x) 8. Cluster von Tumorzellen (20x) Bildnachweis: 9. Tumorzellen im Randsinus eines LK (H&E, 20x) 10. Tumorzellen im Randsinus eines LK (IHC, 10x) 11. avitale Makrometastase im LK (2,5x) 12. Anfärbung von Mesothelien durch AE1/AE3 (10x) 13. Artefakt: zytokeratinanreichernde Partikel (40x)
Ösophagustumor (1) Klinisches Krebsregister Kodierhilfe - Stand September Epidemiologie:
 Ösophagustumor (1) Epidemiologie: Der Speiseröhrenkrebs gehört zu den selteneren Krebserkrankungen. Das Robert-Koch-Institut in Berlin gibt für 2002 die Zahl der Neuerkrankungen in Deutschland pro 100
Ösophagustumor (1) Epidemiologie: Der Speiseröhrenkrebs gehört zu den selteneren Krebserkrankungen. Das Robert-Koch-Institut in Berlin gibt für 2002 die Zahl der Neuerkrankungen in Deutschland pro 100
Vorlesungsreihe Onkologie Ösophagus und Magen
 Vorlesungsreihe Onkologie Ösophagus und Magen PD Dr. Michael Heise Klinik für michael.heise@med.uni-jena.de Patientenvorstellung Patientenvorstellung Patientenvorstellung Patientenvorstellung Patientenvorstellung
Vorlesungsreihe Onkologie Ösophagus und Magen PD Dr. Michael Heise Klinik für michael.heise@med.uni-jena.de Patientenvorstellung Patientenvorstellung Patientenvorstellung Patientenvorstellung Patientenvorstellung
Symptome des Ösophaguskarzinoms
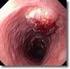 Symptome des Ösophaguskarzinoms Schluckstörungen (Nahrung bleibt stecken) Gewichtsverlust Schmerzen sind eher selten Rekurrensparese, Horner-Syndrom Ösophagus Ösophaguskarzinom - Diagnostik Endoskopie
Symptome des Ösophaguskarzinoms Schluckstörungen (Nahrung bleibt stecken) Gewichtsverlust Schmerzen sind eher selten Rekurrensparese, Horner-Syndrom Ösophagus Ösophaguskarzinom - Diagnostik Endoskopie
GI-ONCOLOGY INTERDISZIPLINÄRES UPDATE. Die neue TNM-Klassifikation von Tumoren. des oberen Gastrointestinaltrakts
 GI-ONCOLOGY 2010 6. INTERDISZIPLINÄRES UPDATE Die neue TNM-Klassifikation von Tumoren des oberen Gastrointestinaltrakts Christian Wittekind, Institut für Pathologie des UKL, Liebigstrasse 26, 04103 Leipzig
GI-ONCOLOGY 2010 6. INTERDISZIPLINÄRES UPDATE Die neue TNM-Klassifikation von Tumoren des oberen Gastrointestinaltrakts Christian Wittekind, Institut für Pathologie des UKL, Liebigstrasse 26, 04103 Leipzig
7. Tag der Organkrebszentren am Klinikum Dortmund Diagnostisches und therapeutisches Vorgehen beim Ösophaguskarzinom
 7. Tag der Organkrebszentren am Klinikum Dortmund Diagnostisches und therapeutisches Vorgehen beim Ösophaguskarzinom Dr. med. Bernd Kroes, Chirurgische Klinik, Klinikum Dortmund ggmbh Epidemiologie 4-5
7. Tag der Organkrebszentren am Klinikum Dortmund Diagnostisches und therapeutisches Vorgehen beim Ösophaguskarzinom Dr. med. Bernd Kroes, Chirurgische Klinik, Klinikum Dortmund ggmbh Epidemiologie 4-5
Ösophagogastraler Übergang
 7 Ösophagogastraler Übergang Jörg-Stephan Müller M. Heise (Hrsg.), Viszeralchirurgie Fragen und Antworten, DOI 10.1007/978--642-54761-4_, Springer-Verlag Berlin Heidelberg 2015 7. Welche der folgenden
7 Ösophagogastraler Übergang Jörg-Stephan Müller M. Heise (Hrsg.), Viszeralchirurgie Fragen und Antworten, DOI 10.1007/978--642-54761-4_, Springer-Verlag Berlin Heidelberg 2015 7. Welche der folgenden
Die Klassifikation gilt nur für Karzinome. Histologische Diagnosesicherung
 Magen 59 Magen (ICD-O C16) Regeln zur Klassifikation Die Klassifikation gilt nur für Karzinome. Histologische Diagnosesicherung ist erforderlich. Verfahren zur Bestimmung der T-, N- und M-Kategorien sind:
Magen 59 Magen (ICD-O C16) Regeln zur Klassifikation Die Klassifikation gilt nur für Karzinome. Histologische Diagnosesicherung ist erforderlich. Verfahren zur Bestimmung der T-, N- und M-Kategorien sind:
Ösophaguskarzinom Ist die Chirurgie beim Adeno- und Plattenepithelkarzinom gleichermaßen noch zeitgemäß?
 Ösophaguskarzinom Ist die Chirurgie beim Adeno- und Plattenepithelkarzinom gleichermaßen noch zeitgemäß? Prof. Dr. Jörg Köninger Klinik für Allgemein- und Viszeralchirurgie Katharinenhospital Klinikum
Ösophaguskarzinom Ist die Chirurgie beim Adeno- und Plattenepithelkarzinom gleichermaßen noch zeitgemäß? Prof. Dr. Jörg Köninger Klinik für Allgemein- und Viszeralchirurgie Katharinenhospital Klinikum
TNM Klassifikation maligner Tumoren
 UICC International Union Against Cancer TNM Klassifikation maligner Tumoren Bearbeitet von Ch Wittekind, H.-J Meyer, F Bootz, G Wagner Neuausgabe 2005. Taschenbuch. xxii, 225 S. Paperback ISBN 978 3 540
UICC International Union Against Cancer TNM Klassifikation maligner Tumoren Bearbeitet von Ch Wittekind, H.-J Meyer, F Bootz, G Wagner Neuausgabe 2005. Taschenbuch. xxii, 225 S. Paperback ISBN 978 3 540
Das Ösophaguskarzinom Diagnostik und interdisziplinäres Therapiekonzept
 Das Ösophaguskarzinom Diagnostik und interdisziplinäres Therapiekonzept von Th. Junginger, I. Gockel, W. Kneist und U. Gönner Ösophaguskarzinome gehören zu den seltenen Tumoren und ihre ungünstige Prognose
Das Ösophaguskarzinom Diagnostik und interdisziplinäres Therapiekonzept von Th. Junginger, I. Gockel, W. Kneist und U. Gönner Ösophaguskarzinome gehören zu den seltenen Tumoren und ihre ungünstige Prognose
Pathologie, Typisierung, Ausbreitungsstadien
 1 24 Anal(kanal)karzinom H. Wiesinger Pathologie, Typisierung, Ausbreitungsstadien Tumoren der Analregion werden in solche des Analkanals und des Analrandes unterteilt. Der Analkanal erstreckt sich vom
1 24 Anal(kanal)karzinom H. Wiesinger Pathologie, Typisierung, Ausbreitungsstadien Tumoren der Analregion werden in solche des Analkanals und des Analrandes unterteilt. Der Analkanal erstreckt sich vom
Interdisziplinäre Behandlung der Karzinome des gastroösophagealen Übergangs und der Magenkarzinome
 Interdisziplinäre Behandlung der Karzinome des gastroösophagealen Übergangs und der Magenkarzinome Priv.-Doz. Dr. René Hennig Klinik für Allgemein und Viszeralchirurgie Bad Cannstatt Magenkarzinom & AEG
Interdisziplinäre Behandlung der Karzinome des gastroösophagealen Übergangs und der Magenkarzinome Priv.-Doz. Dr. René Hennig Klinik für Allgemein und Viszeralchirurgie Bad Cannstatt Magenkarzinom & AEG
Die Pankreasoperation - Indikation zur Operation nach Whipple PD Dr. med. Jan Langrehr
 Die Pankreasoperation - Indikation zur Operation nach Whipple PD Dr. med. Jan Langrehr Klinik für Allgemein-, Visceral- und Transplantationschirurgie Charité, Campus Virchow-Klinikum Universitätsmedizin
Die Pankreasoperation - Indikation zur Operation nach Whipple PD Dr. med. Jan Langrehr Klinik für Allgemein-, Visceral- und Transplantationschirurgie Charité, Campus Virchow-Klinikum Universitätsmedizin
Pathologie des Ösophagus
 Pathologie des Ösophagus Cornelius Kuhnen Institut für Pathologie am Clemenshospital Münster Medical-Center Düesbergweg 128 48153 Münster www.patho-muenster.de Gastroösophageale Refluxkrankheit: Symptome
Pathologie des Ösophagus Cornelius Kuhnen Institut für Pathologie am Clemenshospital Münster Medical-Center Düesbergweg 128 48153 Münster www.patho-muenster.de Gastroösophageale Refluxkrankheit: Symptome
Was ist Strahlentherapie?
 Was ist Strahlentherapie? Ionisierende Strahlen werden gezielt eingesetzt um Tumorgewebe zu beeinflussen / zu zerstören Wirkung erfolgt über zellbiologische Mechanismen lokale / lokoregionäre Therapieform
Was ist Strahlentherapie? Ionisierende Strahlen werden gezielt eingesetzt um Tumorgewebe zu beeinflussen / zu zerstören Wirkung erfolgt über zellbiologische Mechanismen lokale / lokoregionäre Therapieform
3.1 Ergebnisse des endoskopischen Screenings. Im Zeitraum von Mai 2000 bis August 2001 wurde bei insgesamt 148 Kopf-Hals-
 32 3. Ergebnisse 3.1 Ergebnisse des endoskopischen Screenings Im Zeitraum von Mai 2000 bis August 2001 wurde bei insgesamt 148 Kopf-Hals- Tumorpatienten eine einmalige Videoösophagoskopie mit routinemäßigen
32 3. Ergebnisse 3.1 Ergebnisse des endoskopischen Screenings Im Zeitraum von Mai 2000 bis August 2001 wurde bei insgesamt 148 Kopf-Hals- Tumorpatienten eine einmalige Videoösophagoskopie mit routinemäßigen
DIAGNOSTIK UND THERAPIE NICHTSEMINOMATÖSER HODENTUMOREN
 DIAGNOSTIK UND THERAPIE NICHTSEMINOMATÖSER HODENTUMOREN Allgemeines Wesentlich in der Therapie der Hodentumore sind: die exakte histologische Untersuchung die Bestimmung des Stadiums die Festlegung der
DIAGNOSTIK UND THERAPIE NICHTSEMINOMATÖSER HODENTUMOREN Allgemeines Wesentlich in der Therapie der Hodentumore sind: die exakte histologische Untersuchung die Bestimmung des Stadiums die Festlegung der
Chirurgische Therapie des Ösophagus- und Magenkarzinoms Was gibt es Neues? A.H. Hölscher
 Chirurgische Therapie des Ösophagus- und Magenkarzinoms Was gibt es Neues? A.H. Hölscher Wiesbaden, 07. Juli 2012 Was gibt es Neues? Ösophagus Frühkarzinome des Ösophagus Minimal-invasive Ösophagektomie
Chirurgische Therapie des Ösophagus- und Magenkarzinoms Was gibt es Neues? A.H. Hölscher Wiesbaden, 07. Juli 2012 Was gibt es Neues? Ösophagus Frühkarzinome des Ösophagus Minimal-invasive Ösophagektomie
Ösophagus-Plattenepithelkarzinom
 MANUALGastrointestinale Tumoren 1 2010 by Tumorzentrum München und W. Zuckschwerdt Verlag München Ösophagus-Plattenepithelkarzinom C. Meyer zum Büschenfelde, A. Meining, R. Langer, U. Ganswind, M. Hartel,
MANUALGastrointestinale Tumoren 1 2010 by Tumorzentrum München und W. Zuckschwerdt Verlag München Ösophagus-Plattenepithelkarzinom C. Meyer zum Büschenfelde, A. Meining, R. Langer, U. Ganswind, M. Hartel,
Krebs der großen Speicheldrüsen (1)
 Krebs der großen Speicheldrüsen (1) Epidemiologie: Nur etwa 0,3 % aller Tumoren sind epitheliale Speicheldrüsentumoren mit einer geschätzten Inzidenz von 1-3 pro 100 000 Einwohner pro Jahr. Sie kommen
Krebs der großen Speicheldrüsen (1) Epidemiologie: Nur etwa 0,3 % aller Tumoren sind epitheliale Speicheldrüsentumoren mit einer geschätzten Inzidenz von 1-3 pro 100 000 Einwohner pro Jahr. Sie kommen
OESOPHAGUSKARZINOM Multimodale Therapie Therapiestrategien
 OESOPHAGUSKARZINOM Multimodale Therapie Therapiestrategien F. Zimmermann Universitätsspital Basel, Radioonkologie Im Gegensatz zur häufig vertretenen fatalistischen Einstellung handelt es sich beim Ösophaguskarzinom
OESOPHAGUSKARZINOM Multimodale Therapie Therapiestrategien F. Zimmermann Universitätsspital Basel, Radioonkologie Im Gegensatz zur häufig vertretenen fatalistischen Einstellung handelt es sich beim Ösophaguskarzinom
Ösophagus. 3.2 Ösophaguskarzinom
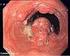 55 3.2 karzinom Das karzinom ist mit einer Inzidenzrate von ca. 8 je 100.000 bzw. 2% aller Krebsneuerkrankungen bei Männern und 2,1 bzw. 0,4% bei Frauen eine seltene Erkrankungsform. 82% der Erkrankten
55 3.2 karzinom Das karzinom ist mit einer Inzidenzrate von ca. 8 je 100.000 bzw. 2% aller Krebsneuerkrankungen bei Männern und 2,1 bzw. 0,4% bei Frauen eine seltene Erkrankungsform. 82% der Erkrankten
Therapie des Bronchialkarzinoms Welcher Patient profitiert von der Operation?
 Therapie des Bronchialkarzinoms Welcher Patient profitiert von der Operation? H.-S. Hofmann Thoraxchirurgisches Zentrum Universitätsklinikum Regensburg Krankenhaus Barmherzige Brüder Regensburg Problem:
Therapie des Bronchialkarzinoms Welcher Patient profitiert von der Operation? H.-S. Hofmann Thoraxchirurgisches Zentrum Universitätsklinikum Regensburg Krankenhaus Barmherzige Brüder Regensburg Problem:
Uterine Leiomyosarkome
 Uterine Leiomyosarkome U. A. Ulrich Martin-Luther-Krankenhaus, Berlin AGO State-of-the-Art München, 6. 8. April 2017 LMS: Epidemiologie 1,3 % der uterinen Malignome, 50 % der uterinen Sarkome medianes
Uterine Leiomyosarkome U. A. Ulrich Martin-Luther-Krankenhaus, Berlin AGO State-of-the-Art München, 6. 8. April 2017 LMS: Epidemiologie 1,3 % der uterinen Malignome, 50 % der uterinen Sarkome medianes
Medizin im Vortrag. Herausgeber: Prof. Dr. med. Christoph Frank Dietrich. Kolorektales Karzinom
 Medizin im Vortrag Herausgeber: Prof. Dr. med. Christoph Frank Dietrich Kolorektales Karzinom Autoren: Dr. med. Stefan Krüger Dr. med. Edgar Hartung Kerstin Siehr Prof. Dr. med. Christoph Frank Dietrich
Medizin im Vortrag Herausgeber: Prof. Dr. med. Christoph Frank Dietrich Kolorektales Karzinom Autoren: Dr. med. Stefan Krüger Dr. med. Edgar Hartung Kerstin Siehr Prof. Dr. med. Christoph Frank Dietrich
1 Einleitung Das Mammakarzinom Epidemiologie Ätiologie Risikofaktoren Protektive Faktoren 3
 Inhaltsverzeichnis 1 Einleitung 1 1.1 Das Mammakarzinom 1 1.1.1 Epidemiologie 1 1.1.2 Ätiologie 2 1.1.2.1 Risikofaktoren 2 1.1.2.2 Protektive Faktoren 3 1.1.3 Prognosefaktoren 4 1.2 Rezeptorstatus 5 1.2.1
Inhaltsverzeichnis 1 Einleitung 1 1.1 Das Mammakarzinom 1 1.1.1 Epidemiologie 1 1.1.2 Ätiologie 2 1.1.2.1 Risikofaktoren 2 1.1.2.2 Protektive Faktoren 3 1.1.3 Prognosefaktoren 4 1.2 Rezeptorstatus 5 1.2.1
14.2 Spezieller Teil. Tumorentitäten Rehabilitation Ösphaguskarzinom. Epidemiologie
 236 frühere überwundene Essstörung aktualisiert werden. Erfahrungsgemäß können Patienten aber in ihrer Selbstreflexion sehr genau zwischen dem somatischen Anteil der jetzigen und dem psychosomatischen
236 frühere überwundene Essstörung aktualisiert werden. Erfahrungsgemäß können Patienten aber in ihrer Selbstreflexion sehr genau zwischen dem somatischen Anteil der jetzigen und dem psychosomatischen
Team Prim. Prof. Dr. Wolfgang Eisterer Malignome von Ösophagus, Magen, Dünndarm, Leber und Galle. Aktuelle Aspekte aus der Chirurgischen Onkologie
 Team Prim. Prof. Dr. Wolfgang Eisterer Malignome von Ösophagus, Magen, Dünndarm, Leber und Galle Aktuelle Aspekte aus der Chirurgischen Onkologie Prim. Assoz. Prof. PD Dr. Matthias Zitt Chirurgie, KH Dornbirn
Team Prim. Prof. Dr. Wolfgang Eisterer Malignome von Ösophagus, Magen, Dünndarm, Leber und Galle Aktuelle Aspekte aus der Chirurgischen Onkologie Prim. Assoz. Prof. PD Dr. Matthias Zitt Chirurgie, KH Dornbirn
NSCLC: Diagnostik. PD Dr. med. F. Griesinger Abtl. Hämatologie und Onkologie Universität Göttingen
 NSCLC: Diagnostik PD Dr. med. F. Griesinger Abtl. Hämatologie und Onkologie Universität Göttingen Bronchialkarzinom Inzidenz: weltweit Jährliche Alters-bezogene Inzidenz des Bronchial-Karzinoms/100.000
NSCLC: Diagnostik PD Dr. med. F. Griesinger Abtl. Hämatologie und Onkologie Universität Göttingen Bronchialkarzinom Inzidenz: weltweit Jährliche Alters-bezogene Inzidenz des Bronchial-Karzinoms/100.000
20. Onkologische Konferenz Eisenach 16. und 17. November 2007
 Stellenwert der Lymphadenektomie bei der chirurgischen Therapie pulmonaler Metastasen V. Wiens Thoraxzentrum Klinik für Thoraxchirurgie und Thorakale Endoskopie 20. Onkologische Konferenz Eisenach 16.
Stellenwert der Lymphadenektomie bei der chirurgischen Therapie pulmonaler Metastasen V. Wiens Thoraxzentrum Klinik für Thoraxchirurgie und Thorakale Endoskopie 20. Onkologische Konferenz Eisenach 16.
Karzinoms. Die Unterscheidung des follikulären Karzinoms vom follikulären Adenom ist in der histologischen Untersuchung oft schwierig.
 1 Einleitung Die Erkrankungen der Schilddrüse erfordern im diagnostischen und therapeutischen Bereich eine interdiziplinäre Vorgehensweise. In Strumaendemiegebieten wie der Bundesrepublik Deutschland stellt
1 Einleitung Die Erkrankungen der Schilddrüse erfordern im diagnostischen und therapeutischen Bereich eine interdiziplinäre Vorgehensweise. In Strumaendemiegebieten wie der Bundesrepublik Deutschland stellt
Leitlinie Bronchialkarzinom 2011 IOZ Passau (adaptiert an S3-Leitlinie Bronchialkarzinom 2010) UICC-Klassifikation 2009
 Nr 27724 Version 1-0-0 Datum 29.08.11 Seite 1 von 5 Leitlinie Bronchialkarzinom 2011 Passau (adaptiert an S3-Leitlinie Bronchialkarzinom 2010) UICC-Klassifikation 2009 Tab.1: Beschreibung der TNM-Parameter
Nr 27724 Version 1-0-0 Datum 29.08.11 Seite 1 von 5 Leitlinie Bronchialkarzinom 2011 Passau (adaptiert an S3-Leitlinie Bronchialkarzinom 2010) UICC-Klassifikation 2009 Tab.1: Beschreibung der TNM-Parameter
Verruköses Karzinom des Ösophagus, nicht metastasierend aber infiltrierend
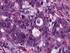 Verruköses Karzinom des Ösophagus, nicht metastasierend aber infiltrierend Ulrich Peitz, Medizinische Klinik 2, Raphaelsklinik Münster Vieth M, Institut für Pathologie, Klinikum Bayreuth Kuhnen C, Institut
Verruköses Karzinom des Ösophagus, nicht metastasierend aber infiltrierend Ulrich Peitz, Medizinische Klinik 2, Raphaelsklinik Münster Vieth M, Institut für Pathologie, Klinikum Bayreuth Kuhnen C, Institut
Maligner Polyp des Kolons/Rektums
 Wolfram Jochum Institut für Pathologie Kantonsspital St.Gallen wolfram.jochum@kssg.ch 1 2 1 Maligner Polyp Begriffsdefinitionen Maligner Polyp (= malignes Adenom): Adenom mit Übergang in ein invasives
Wolfram Jochum Institut für Pathologie Kantonsspital St.Gallen wolfram.jochum@kssg.ch 1 2 1 Maligner Polyp Begriffsdefinitionen Maligner Polyp (= malignes Adenom): Adenom mit Übergang in ein invasives
Indikationsspezifischer Bericht zum Mammakarzinom für die Gemeinsame Einrichtung
 Indikationsspezifischer Bericht zum Mammakarzinom für die Gemeinsame Einrichtung Ausgabe für den Berichtszeitraum 01.07.2005 bis 31.12.2005 Erstellungstag: 15.05.2006 Erstellungssoftware: Rückmeldesystem
Indikationsspezifischer Bericht zum Mammakarzinom für die Gemeinsame Einrichtung Ausgabe für den Berichtszeitraum 01.07.2005 bis 31.12.2005 Erstellungstag: 15.05.2006 Erstellungssoftware: Rückmeldesystem
Struktur der SOP s. Zeichenerklärung. Entscheidungsfrage? Bedeutung : trifft zu. Pfeil senkrecht. Pfeil waagrecht. Bedeutung : trifft nicht zu
 Freigabe: interdisziplinärer Qualitätszirkel Stand 04/16, gültig bis 04/18 Version 2 Struktur der SOP s Zeichenerklärung Entscheidungsfrage? Pfeil senkrecht ja Bedeutung : trifft zu Pfeil waagrecht nein
Freigabe: interdisziplinärer Qualitätszirkel Stand 04/16, gültig bis 04/18 Version 2 Struktur der SOP s Zeichenerklärung Entscheidungsfrage? Pfeil senkrecht ja Bedeutung : trifft zu Pfeil waagrecht nein
3.7 Lunge. Kernaussagen
 ICD-10 C33, C34 Ergebnisse zur 61 3.7 Lunge Kernaussagen Inzidenz und Mortalität: Im 2004 erkrankten ca. 13.200 und 33.000 an Lungenkrebs. Die Zahl der jährlichen Erkrankungsfälle hat sich bei den seit
ICD-10 C33, C34 Ergebnisse zur 61 3.7 Lunge Kernaussagen Inzidenz und Mortalität: Im 2004 erkrankten ca. 13.200 und 33.000 an Lungenkrebs. Die Zahl der jährlichen Erkrankungsfälle hat sich bei den seit
Was steht in meinem Befund?
 Basiskurs Krebswissen 09.11.2016 Was steht in meinem Befund? (Staging, Grading, TNM, ) Rainer Hamacher, MUW-AKH, Univ. Klinik für Innere Medizin I / Onkologie TNM STAGING & GRADING Tumorstaging (=Staging)
Basiskurs Krebswissen 09.11.2016 Was steht in meinem Befund? (Staging, Grading, TNM, ) Rainer Hamacher, MUW-AKH, Univ. Klinik für Innere Medizin I / Onkologie TNM STAGING & GRADING Tumorstaging (=Staging)
Indikationsspezifischer Bericht zum Mammakarzinom für die Gemeinsame Einrichtung
 Indikationsspezifischer Bericht zum Mammakarzinom für die Gemeinsame Einrichtung Ausgabe für den Berichtszeitraum 01.01.2006 bis 30.06.2006 Erstellungstag: 30.06.2006 Erstellungssoftware: Rückmeldesystem
Indikationsspezifischer Bericht zum Mammakarzinom für die Gemeinsame Einrichtung Ausgabe für den Berichtszeitraum 01.01.2006 bis 30.06.2006 Erstellungstag: 30.06.2006 Erstellungssoftware: Rückmeldesystem
Brustkrebs aktuell - OSP am Was ist eigentlich die Aufgabe des Pathologen in Diagnostik und Therapie des Mammakarzinoms?
 Brustkrebs aktuell - OSP am 21.10.2015 Was ist eigentlich die Aufgabe des Pathologen in Diagnostik und Therapie des Mammakarzinoms? Prof. Dr. German Ott, Institut für Pathologie Robert-Bosch-Krankenhaus
Brustkrebs aktuell - OSP am 21.10.2015 Was ist eigentlich die Aufgabe des Pathologen in Diagnostik und Therapie des Mammakarzinoms? Prof. Dr. German Ott, Institut für Pathologie Robert-Bosch-Krankenhaus
Diagnostik und Therapie primärer und metastasierter Mammakarzinome
 Diagnostik und Therapie primärer und metastasierter Mammakarzinome Loko-regionäres Rezidiv Version 2002-2009: Brunnert / Simon/ Audretsch / Bauerfeind / Costa / Dall/ Gerber / Göhring / Lisboa / Rezai
Diagnostik und Therapie primärer und metastasierter Mammakarzinome Loko-regionäres Rezidiv Version 2002-2009: Brunnert / Simon/ Audretsch / Bauerfeind / Costa / Dall/ Gerber / Göhring / Lisboa / Rezai
Nachsorge und adjuvante Chemotherapie des Dickdarmkarzinoms. Sankt Marien-Hospital Buer
 Nachsorge und adjuvante Chemotherapie des Dickdarmkarzinoms Grundlagen und Ziele Nachsorgemethoden Wertigkeit der Nachsorgetests Stadienadaptierte Nachsorgepläne Adjuvante Chemotherapie Leitliniengemässe
Nachsorge und adjuvante Chemotherapie des Dickdarmkarzinoms Grundlagen und Ziele Nachsorgemethoden Wertigkeit der Nachsorgetests Stadienadaptierte Nachsorgepläne Adjuvante Chemotherapie Leitliniengemässe
Tumor des Gebärmutterhalses (Zervixtumor) (1)
 Tumor des Gebärmutterhalses (Zervixtumor) (1) Epidemiologie: Die Inzidenz des Zervixkarzinoms wird vom Robert-Koch-Institut für 2004 mit 14,7 pro 100 000 Frauen pro Jahr angegeben (rohe Rate+). Eine Abnahme
Tumor des Gebärmutterhalses (Zervixtumor) (1) Epidemiologie: Die Inzidenz des Zervixkarzinoms wird vom Robert-Koch-Institut für 2004 mit 14,7 pro 100 000 Frauen pro Jahr angegeben (rohe Rate+). Eine Abnahme
AstraZeneca Focus vom 3.4.2014
 N.B. 23.3.1952 AstraZeneca Focus vom 3.4.2014 Tumoren des oberen Gastrointestinal Traktes 23.05.2012 ÖGD: Hochgradig stenosierendes Ösophaguskarzinom mit 4cm langer Stenose im oberen 1/3 26.06. - 17.07.2012:
N.B. 23.3.1952 AstraZeneca Focus vom 3.4.2014 Tumoren des oberen Gastrointestinal Traktes 23.05.2012 ÖGD: Hochgradig stenosierendes Ösophaguskarzinom mit 4cm langer Stenose im oberen 1/3 26.06. - 17.07.2012:
Langzeit-follow-up Datenbanken bei Mammakarzinom unter besonderer Berücksichtigung der Therapiewahl
 Aus dem Robert-Bosch-Krankenhaus Stuttgart (Akademisches Lehrkrankenhaus der Universität Tübingen) Abteilung für Gynäkologie und Geburtshilfe Chefarzt Professor Dr. W. E. Simon Langzeit-follow-up Datenbanken
Aus dem Robert-Bosch-Krankenhaus Stuttgart (Akademisches Lehrkrankenhaus der Universität Tübingen) Abteilung für Gynäkologie und Geburtshilfe Chefarzt Professor Dr. W. E. Simon Langzeit-follow-up Datenbanken
Chirurgische Therapie primärer und sekundärer Lungentumore
 Chirurgische Therapie primärer und sekundärer Lungentumore Hans-Stefan Hofmann Thoraxchirurgie Regensburg Universitätsklinikum Regensburg KH Barmherzige Brüder Regensburg - und Metastasenverteilung 2009
Chirurgische Therapie primärer und sekundärer Lungentumore Hans-Stefan Hofmann Thoraxchirurgie Regensburg Universitätsklinikum Regensburg KH Barmherzige Brüder Regensburg - und Metastasenverteilung 2009
Schilddrüsenkrebs (1)
 Schilddrüsenkrebs (1) Epidemiologie: Schilddrüsenkrebs gehört zu den seltenen Tumoren. Die Inzidenzzahlen werden vom Robert-Koch- Institut für Deutschland 4,0 bei Männern und 6,1 bei Frauen pro 100 000
Schilddrüsenkrebs (1) Epidemiologie: Schilddrüsenkrebs gehört zu den seltenen Tumoren. Die Inzidenzzahlen werden vom Robert-Koch- Institut für Deutschland 4,0 bei Männern und 6,1 bei Frauen pro 100 000
Krebs des Nasenrachens (Nasopharynx) (1)
 Krebs des Nasenrachens (Nasopharynx) (1) Epidemiologie: Malignome des Nasopharynx sind in Zentraleuropa und Nordamerika selten, mit einer Inzidenz von schätzungsweise 0,5 bis 1 auf 100 000 Einwohner, häufiger
Krebs des Nasenrachens (Nasopharynx) (1) Epidemiologie: Malignome des Nasopharynx sind in Zentraleuropa und Nordamerika selten, mit einer Inzidenz von schätzungsweise 0,5 bis 1 auf 100 000 Einwohner, häufiger
Rektumtumor (1) D37.5 Neubildung unsicheren oder unbekannten Verhaltens des Rektums
 Rektumtumor (1) Epidemiologie: Die Inzidenzzahlen des Rektumkarzinoms werden in Deutschland in die Inzidenzzahlen für kolorektale Karzinome eingerechnet. Knapp 55 % aller kolorektalen Karzinome finden
Rektumtumor (1) Epidemiologie: Die Inzidenzzahlen des Rektumkarzinoms werden in Deutschland in die Inzidenzzahlen für kolorektale Karzinome eingerechnet. Knapp 55 % aller kolorektalen Karzinome finden
Harnblasenkrebs (1) C C67.9 entsprechen den Lokalisationsschlüsseln nach ICD-O-3 von 2013.
 Harnblasenkrebs (1) Epidemiologie: Das Robert-Koch-Institut in Berlin gibt für 2008 die Zahl der Harnblasenkrebs-Neuerkrankungen pro 100 000 Einwohner für Männer mit 28,5 und für Frauen mit 10,8 pro Jahr
Harnblasenkrebs (1) Epidemiologie: Das Robert-Koch-Institut in Berlin gibt für 2008 die Zahl der Harnblasenkrebs-Neuerkrankungen pro 100 000 Einwohner für Männer mit 28,5 und für Frauen mit 10,8 pro Jahr
Analtumor (1) D01.3 Carcinoma in situ des Analkanals und des Anus (ohne Haut)
 Analtumor (1) Epidemiologie: Das Analkarzinom tritt eher selten auf. Insgesamt erkranken in Deutschland pro Jahr 0,5-1,5 pro 100.000 Einwohner daran, mit steigender Tendenz. Frauen sind etwa dreimal so
Analtumor (1) Epidemiologie: Das Analkarzinom tritt eher selten auf. Insgesamt erkranken in Deutschland pro Jahr 0,5-1,5 pro 100.000 Einwohner daran, mit steigender Tendenz. Frauen sind etwa dreimal so
Originalarbeit: James et al., N Engl J Med 2012; 366:
 Originalarbeit: James et al., N Engl J Med 2012; 366: 1477-1488 Kommentar zur Originalarbeit: Shipley & Zietman N Engl J Med 2012; 366: 1540-41 Meilenstein BC2001-Studie: Design randomisierte Studie mit
Originalarbeit: James et al., N Engl J Med 2012; 366: 1477-1488 Kommentar zur Originalarbeit: Shipley & Zietman N Engl J Med 2012; 366: 1540-41 Meilenstein BC2001-Studie: Design randomisierte Studie mit
1 EINLEITUNG Definition und Klassifikation neuroendokriner Tumoren des gastroenteropankreatischen Systems
 1 EINLEITUNG 6 1. EINLEITUNG 1.1 Definition und Klassifikation neuroendokriner Tumoren des gastroenteropankreatischen Systems Neuroendokrine Tumoren des Gastrointestinaltraktes stellen eine heterogene
1 EINLEITUNG 6 1. EINLEITUNG 1.1 Definition und Klassifikation neuroendokriner Tumoren des gastroenteropankreatischen Systems Neuroendokrine Tumoren des Gastrointestinaltraktes stellen eine heterogene
Studienzentrum der Deutschen Gesellschaft für f. SYNCHRONOUS Trial
 Studienzentrum der Deutschen Gesellschaft für f Chirurgie SYNCHRONOUS Trial Resection of the primary tumor vs. no resection prior to systemic therapy in patients with colon cancer and synchronous unresectable
Studienzentrum der Deutschen Gesellschaft für f Chirurgie SYNCHRONOUS Trial Resection of the primary tumor vs. no resection prior to systemic therapy in patients with colon cancer and synchronous unresectable
Ab durch die Mitte: Radiotherapie beim Pankreaskarzinom
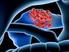 Ab durch die Mitte: Radiotherapie beim Pankreaskarzinom Alexandros Papachristofilou Pankreaskarzinom: Eine Herausforderung 0 1 Pankreaskarzinom: Eine Herausforderung 7.8/8.7 = 90% 10.1/10.7 = 94% 0 23.9/110.5
Ab durch die Mitte: Radiotherapie beim Pankreaskarzinom Alexandros Papachristofilou Pankreaskarzinom: Eine Herausforderung 0 1 Pankreaskarzinom: Eine Herausforderung 7.8/8.7 = 90% 10.1/10.7 = 94% 0 23.9/110.5
Oesophaguskarzinom. Welche Bildgebung ist notwendig? MENSCH + MEDIZIN Krankenhausgruppe Ev.Stiftung
 Oesophaguskarzinom Welche Bildgebung ist notwendig? Feußner H, Feith M. Tumoren des Ösophagus - was benöigt der Chirurg vom Radiologen? Der Radiologe 2007; 47: 97-100 Naunheim KS et al: Multimodality therapy
Oesophaguskarzinom Welche Bildgebung ist notwendig? Feußner H, Feith M. Tumoren des Ösophagus - was benöigt der Chirurg vom Radiologen? Der Radiologe 2007; 47: 97-100 Naunheim KS et al: Multimodality therapy
Operative Strategien beim NSCLC Zwischen Radikalität und Funktionserhalt. Dr. med Marcus Albert Abteilung für Thoraxchirurgie Lungenklinik Hemer
 Dr. med Marcus Albert Abteilung für Thoraxchirurgie Lungenklinik Hemer Fakten zum Bronchial CA 25 Prozent aller Malignome sind Bronchialkarzinome Beim Mann ist es weltweit die häufigste Krebsart (in Deutschland
Dr. med Marcus Albert Abteilung für Thoraxchirurgie Lungenklinik Hemer Fakten zum Bronchial CA 25 Prozent aller Malignome sind Bronchialkarzinome Beim Mann ist es weltweit die häufigste Krebsart (in Deutschland
Seite Diskussion
 Seite 99 4 Diskussion In der Behandlung lokal fortgeschrittener oder inflammatorischer Mammakarzinome gilt die neoadjuvante Chemotherapie schon lange als Standard. Dass diese Therapieform in Hinblick auf
Seite 99 4 Diskussion In der Behandlung lokal fortgeschrittener oder inflammatorischer Mammakarzinome gilt die neoadjuvante Chemotherapie schon lange als Standard. Dass diese Therapieform in Hinblick auf
Perioperative Radiochemotherapie beim Magenkarzinomen
 Perioperative Radiochemotherapie beim Magenkarzinomen Frank Zimmermann und Alexandros Papachristofilou Das Magenkarzinom: eine heterogene Erkrankung Lokalisation: Ösophagogastraler 35% Übergang (proximal)
Perioperative Radiochemotherapie beim Magenkarzinomen Frank Zimmermann und Alexandros Papachristofilou Das Magenkarzinom: eine heterogene Erkrankung Lokalisation: Ösophagogastraler 35% Übergang (proximal)
Harnröhrentumor (1) D09.1 Carcinoma in situ sonstiger und nicht näher bezeichneter Harnorgane
 Harnröhrentumor (1) Epidemiologie: Malignome der Urethra sind sehr selten. Ihre Inzidenz pro 100 000 Einwohner und Jahr wird auf 0,4 bei Männern und 1,5 bei Frauen geschätzt. Frauen sind aufgrund ihrer
Harnröhrentumor (1) Epidemiologie: Malignome der Urethra sind sehr selten. Ihre Inzidenz pro 100 000 Einwohner und Jahr wird auf 0,4 bei Männern und 1,5 bei Frauen geschätzt. Frauen sind aufgrund ihrer
Multimodale Therapie des Bronchialkarzinoms
 Multimodale Therapie des Bronchialkarzinoms Vorlesung 11/2007 Andreas Granetzny Klinik für Thoraxchirurgie Evangelisches Krankenhaus Duisburg-Nord Sir Evarts Graham 1883-1957 Dr. James Gilmore Stadiengerechte
Multimodale Therapie des Bronchialkarzinoms Vorlesung 11/2007 Andreas Granetzny Klinik für Thoraxchirurgie Evangelisches Krankenhaus Duisburg-Nord Sir Evarts Graham 1883-1957 Dr. James Gilmore Stadiengerechte
Grundlagen der Medizinischen Klinik I + II. Dr. Friedrich Mittermayer Dr. Katharina Krzyzanowska
 Grundlagen der Medizinischen Klinik I + II Dr. Friedrich Mittermayer Dr. Katharina Krzyzanowska 1 Magen Darmtrakt I. Teil 2 Ösophaguserkrankungen a) Dysphagie (Schluckstörung) b) Achalasie (Schlucklähmung)
Grundlagen der Medizinischen Klinik I + II Dr. Friedrich Mittermayer Dr. Katharina Krzyzanowska 1 Magen Darmtrakt I. Teil 2 Ösophaguserkrankungen a) Dysphagie (Schluckstörung) b) Achalasie (Schlucklähmung)
Neues aus Diagnostik und Therapie beim Lungenkrebs. Jürgen Wolf Centrum für Integrierte Onkologie Universitätsklinikum Köln
 Neues aus Diagnostik und Therapie beim Lungenkrebs Jürgen Wolf Centrum für Integrierte Onkologie Universitätsklinikum Köln Über was ich Ihnen heute berichten will: Lungenkrebs ist nicht gleich Lungenkrebs
Neues aus Diagnostik und Therapie beim Lungenkrebs Jürgen Wolf Centrum für Integrierte Onkologie Universitätsklinikum Köln Über was ich Ihnen heute berichten will: Lungenkrebs ist nicht gleich Lungenkrebs
Darum liegt in mehr als der Hälfte der Fälle bereits bei Diagnosestellung ein fortgeschritteneres Stadium der Erkrankung vor.
 OVARIALKARZINOM EPIDEMIOLOGIE Das Ovarialkarzinom (Eierstockkrebs) stellt die häufigste Todesursache durch ein Malignom bei der Frau dar. In Österreich erkranken jährlich rund 936 Frauen an einem Eierstockkrebs.
OVARIALKARZINOM EPIDEMIOLOGIE Das Ovarialkarzinom (Eierstockkrebs) stellt die häufigste Todesursache durch ein Malignom bei der Frau dar. In Österreich erkranken jährlich rund 936 Frauen an einem Eierstockkrebs.
1. Vorbemerkung Ziel der vorliegenden Arbeit Das Mammakarzinom Historischer Überblick 2
 INHALTSVERZEICHNIS Seite I. EINLEITUNG 1. Vorbemerkung 1 2. Ziel der vorliegenden Arbeit 1 3. Das Mammakarzinom 2 3.1. Historischer Überblick 2 3.2. Ätiologie 4 3.2.1. Genetische und familiäre Disposition
INHALTSVERZEICHNIS Seite I. EINLEITUNG 1. Vorbemerkung 1 2. Ziel der vorliegenden Arbeit 1 3. Das Mammakarzinom 2 3.1. Historischer Überblick 2 3.2. Ätiologie 4 3.2.1. Genetische und familiäre Disposition
Therapie und Nachsorge differenzierter Schilddrüsenkarzinome in Göttingen Abteilung Nuklearmedizin
 Therapie und Nachsorge differenzierter Schilddrüsenkarzinome in Göttingen 1990-2008 Abteilung Nuklearmedizin Hintergrund Therapie differenzierter SD-CAs: multimodal und interdisziplinär (Chirurgie und
Therapie und Nachsorge differenzierter Schilddrüsenkarzinome in Göttingen 1990-2008 Abteilung Nuklearmedizin Hintergrund Therapie differenzierter SD-CAs: multimodal und interdisziplinär (Chirurgie und
0-14. Mortalitätsrate. und mehr 137,2 124,2 111,8. bis unter. bis unter 124,2 100,0 88,9. bis unter. bis unter 111,8 78,4 68,6
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN ÖSOPHAGUS (C15) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN ÖSOPHAGUS (C15) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland
Sonographie und Endosonographie zum Staging von Ösophagus- und Magentumoren
 KLINIK UND POLIKLINIK FÜR INNERE MEDIZIN I Sonographie und Endosonographie zum Staging von Ösophagus- und Magentumoren I. Zuber-Jerger Endosonographie zum Staging von Ösophagus- und Magenkarzinom EUS beste
KLINIK UND POLIKLINIK FÜR INNERE MEDIZIN I Sonographie und Endosonographie zum Staging von Ösophagus- und Magentumoren I. Zuber-Jerger Endosonographie zum Staging von Ösophagus- und Magenkarzinom EUS beste
Pathologie Bochum Aktuelles zur Pathologie von Pankreastumoren (einschließlich NET)
 Pathologie Bochum Aktuelles zur Pathologie von Pankreastumoren (einschließlich NET) Andrea Tannapfel Institut für Pathologie Ruhr-Universität Bochum Andrea.Tannapfel@rub.de Neuroendokrine Tumoren (NET)
Pathologie Bochum Aktuelles zur Pathologie von Pankreastumoren (einschließlich NET) Andrea Tannapfel Institut für Pathologie Ruhr-Universität Bochum Andrea.Tannapfel@rub.de Neuroendokrine Tumoren (NET)
Langzeitüberleben nach Operation des. kleinzelligen Bronchialkarzinoms
 Aus der Chirurgischen Klinik und Poliklinik- Großhadern der Ludwig-Maximilians-Universität zu München Direktor: Prof. Dr. med. K.- W. Jauch Langzeitüberleben nach Operation des kleinzelligen Bronchialkarzinoms
Aus der Chirurgischen Klinik und Poliklinik- Großhadern der Ludwig-Maximilians-Universität zu München Direktor: Prof. Dr. med. K.- W. Jauch Langzeitüberleben nach Operation des kleinzelligen Bronchialkarzinoms
Gute Überlebensqualität Trastuzumab beim metastasierten Magenkarzinom
 Gute Überlebensqualität Trastuzumab beim metastasierten Magenkarzinom München (24. April 2012) - Mit dem monoklonalen Antikörper Trastuzumab (Herceptin ) steht bislang die einzige zielgerichtete Substanz
Gute Überlebensqualität Trastuzumab beim metastasierten Magenkarzinom München (24. April 2012) - Mit dem monoklonalen Antikörper Trastuzumab (Herceptin ) steht bislang die einzige zielgerichtete Substanz
Kolorektale Lebermetastasen:
 Kolorektale Lebermetastasen: Resektabilität und Sicherheitsabstand Hans J. Schlitt Klinik und Poliklinik für Chirurgie Klinikum der Universität Regensburg Resektabilität als relativer Begriff Generelle
Kolorektale Lebermetastasen: Resektabilität und Sicherheitsabstand Hans J. Schlitt Klinik und Poliklinik für Chirurgie Klinikum der Universität Regensburg Resektabilität als relativer Begriff Generelle
Palliative Thoraxchirurgie
 Palliative Thoraxchirurgie Wünsche und Realität Ernst E. Förster, Ltd. Arzt Bereich Thoraxchirurgie Ubbo Emmius Klinik Aurich Wünsche an die Palliative Thoraxchirurgie: Lebensbedrohliche Zustände verhindern
Palliative Thoraxchirurgie Wünsche und Realität Ernst E. Förster, Ltd. Arzt Bereich Thoraxchirurgie Ubbo Emmius Klinik Aurich Wünsche an die Palliative Thoraxchirurgie: Lebensbedrohliche Zustände verhindern
Aktuelles zur Pathologie von Pankreastumoren einschließlich neuroendokriner Tumoren
 Aktuelles zur Pathologie von Pankreastumoren einschließlich neuroendokriner Tumoren Prof. Dr. med. Andrea Tannapfel Institut für Pathologie, Ruhr-Universität Bochum Neuroendokrine Tumoren: Einheitliche
Aktuelles zur Pathologie von Pankreastumoren einschließlich neuroendokriner Tumoren Prof. Dr. med. Andrea Tannapfel Institut für Pathologie, Ruhr-Universität Bochum Neuroendokrine Tumoren: Einheitliche
Absolute Neuerkrankungen und Neuerkrankungsraten je Einwohner
 Durchschnittlich erfasste Erkrankungszahlen Zeitraum Geschlecht rohe Rate alterstandardisierte Rate (ESR)* arithm. Alter Jahre medianes Alter Jahre Vergleich medianes Alter Vergleichsquelle 2011-2015 männlich
Durchschnittlich erfasste Erkrankungszahlen Zeitraum Geschlecht rohe Rate alterstandardisierte Rate (ESR)* arithm. Alter Jahre medianes Alter Jahre Vergleich medianes Alter Vergleichsquelle 2011-2015 männlich
Aus dem Fachbereich Medizin der Johann Wolfgang Goethe-Universität Frankfurt am Main
 Aus dem Fachbereich Medizin der Johann Wolfgang Goethe-Universität Frankfurt am Main Klinik für Hals-, Nasen-, Ohrenheilkunde Direktor. Prof. Dr. med. Timo Stöver Prävalenz der high-risk HP-Viren 16 und
Aus dem Fachbereich Medizin der Johann Wolfgang Goethe-Universität Frankfurt am Main Klinik für Hals-, Nasen-, Ohrenheilkunde Direktor. Prof. Dr. med. Timo Stöver Prävalenz der high-risk HP-Viren 16 und
Leitliniengerechte Therapie bei metastasiertem kolorektalem Karzinom
 Leitliniengerechte Therapie bei metastasiertem kolorektalem Karzinom Case Report NZW Dresden 2010 Stefan Schalbaba stefan.schalbaba@klinikum-memmingen.de Patientenidentität und Subjektive Daten Patient
Leitliniengerechte Therapie bei metastasiertem kolorektalem Karzinom Case Report NZW Dresden 2010 Stefan Schalbaba stefan.schalbaba@klinikum-memmingen.de Patientenidentität und Subjektive Daten Patient
Cervix uteri. 3.5 Cervix uteri
 87 3.5 Das Zervixkarzinom ist der zweithäufigste bösartige Tumor der Frau in der Welt [Par97]. In Deutschland steht es an sechster Stelle (nach Brust- und Darmkrebs, Tumoren der Atmungsorgane und der Gebärmutter,
87 3.5 Das Zervixkarzinom ist der zweithäufigste bösartige Tumor der Frau in der Welt [Par97]. In Deutschland steht es an sechster Stelle (nach Brust- und Darmkrebs, Tumoren der Atmungsorgane und der Gebärmutter,
Bronchus - Karzinom. Bronchus - Karzinom. 2. Screening. Bronchus Karzinom - Allgemein. 1. Einleitung allgemeine Informationen. 3.
 Bronchus - Karzinom J. Barandun LungenZentrum Hirslanden Zürich Screening Abklärung - Therapie Bronchus - Karzinom 1. Einleitung allgemeine Informationen 2. Screening 3. Abklärung 4. Therapie Bronchus
Bronchus - Karzinom J. Barandun LungenZentrum Hirslanden Zürich Screening Abklärung - Therapie Bronchus - Karzinom 1. Einleitung allgemeine Informationen 2. Screening 3. Abklärung 4. Therapie Bronchus
Diskussion Radiotherapie Osteosarkome Osteosarkome des appendikulären Skeletts werden in der Regel nicht intensiv mit Bestrahlung therapiert, da
 Diskussion Radiotherapie Osteosarkome Osteosarkome des appendikulären Skeletts werden in der Regel nicht intensiv mit Bestrahlung therapiert, da entweder durch Amputation oder durch gliedmaßenerhaltende
Diskussion Radiotherapie Osteosarkome Osteosarkome des appendikulären Skeletts werden in der Regel nicht intensiv mit Bestrahlung therapiert, da entweder durch Amputation oder durch gliedmaßenerhaltende
0-14. Mortalitätsrate. und mehr 137,2 124,2 111,8. bis unter. bis unter 124,2 100,0 88,9. bis unter. bis unter 111,8 78,4 68,6
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN MAGEN (C16) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 212
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN MAGEN (C16) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 212
Auslegungshinweise Kennzahlenbogen Darm (Stand ) - basierend auf dem Erhebungsbogen vom
 Allgemeine Anmerkungen In dem Dokument Auslegungshinweise Kennzahlenbogen Darm werden weitergehende ErlÄuterungen zu den einzelnen Kennzahlen gemacht. Dieses Dokument befindet sich im Moment in Diskussion
Allgemeine Anmerkungen In dem Dokument Auslegungshinweise Kennzahlenbogen Darm werden weitergehende ErlÄuterungen zu den einzelnen Kennzahlen gemacht. Dieses Dokument befindet sich im Moment in Diskussion
Mammakarzinom II. Diagnostik und Therapie
 Mammakarzinom II Diagnostik und Therapie MR - Mammographie Empfehlung einer MRT: lokales Staging (Exzisionsgrenzen) beim lobulären Mammakarzinom Multizentrizität? okkultes Mammakarzinom? MR - Mammographie
Mammakarzinom II Diagnostik und Therapie MR - Mammographie Empfehlung einer MRT: lokales Staging (Exzisionsgrenzen) beim lobulären Mammakarzinom Multizentrizität? okkultes Mammakarzinom? MR - Mammographie
Moderne Behandlung. des. Bronchialkarzinoms
 Moderne Behandlung des Bronchialkarzinoms Dr. med. Reiner Neu Abteilung für Thoraxchirurgie Bild: Deutsche Krebsgesellschaft 1 ist Individualisiert und Personalisiert weil Lungenkrebs nicht gleich Lungenkrebs
Moderne Behandlung des Bronchialkarzinoms Dr. med. Reiner Neu Abteilung für Thoraxchirurgie Bild: Deutsche Krebsgesellschaft 1 ist Individualisiert und Personalisiert weil Lungenkrebs nicht gleich Lungenkrebs
Pathologie und Prognoseparameter. AGO e.v. in der DGGG e.v. sowie in der DKG e.v. Dietmar Schmidt Institut für Pathologie A2,2; Mannheim
 Pathologie und Prognoseparameter Dietmar Schmidt Institut für Pathologie A2,2; Mannheim Endometriales Adenokarzinom Histologische Typen (WHO 2003) Endometrioid Muzinös Serös Klarzellig Undifferenziert
Pathologie und Prognoseparameter Dietmar Schmidt Institut für Pathologie A2,2; Mannheim Endometriales Adenokarzinom Histologische Typen (WHO 2003) Endometrioid Muzinös Serös Klarzellig Undifferenziert
Analyse der klinischen und epidemiologischen Daten des Tumorregister München. Bronchialkarzinom. Datenquellen, Befundverteilung und Prognose
 Analyse der klinischen und epidemiologischen Daten des Tumorregister München Bronchialkarzinom Datenquellen, Befundverteilung und Prognose M.Schmidt, D.Hölzel Abb. 1: Titel und Autoren des Vortrags Neuerkrankungen
Analyse der klinischen und epidemiologischen Daten des Tumorregister München Bronchialkarzinom Datenquellen, Befundverteilung und Prognose M.Schmidt, D.Hölzel Abb. 1: Titel und Autoren des Vortrags Neuerkrankungen
Der Darm. Der Magen Darmtrakt. Prof. Dr. Max Reinshagen Medizinische Klinik I Klinikum Braunschweig. Das Verdauungssystem - Funktion und Erkrankungen
 Der Darm Prof. Dr. Max Reinshagen Medizinische Klinik I Klinikum Braunschweig 01.06.2012 Seite 1 Der Magen-Darmtrakt des Menschen 01.06.2012 Seite 2 Funktion des Gastrointestinaltraktes(Magen-Darmtrakt)
Der Darm Prof. Dr. Max Reinshagen Medizinische Klinik I Klinikum Braunschweig 01.06.2012 Seite 1 Der Magen-Darmtrakt des Menschen 01.06.2012 Seite 2 Funktion des Gastrointestinaltraktes(Magen-Darmtrakt)
Vulvakarzinom Epitheliales Ovarialkarzinom Zervixkarzinom Endometriumkarzinom
 Vulvakarzinom Epitheliales Ovarialkarzinom Zervixkarzinom Endometriumkarzinom Verantwortlich: M. Bossart, K.Henne Freigabe: interdisziplinärer Qualitätszirkel Stand: 06/16, gültig bis 07/18 Version 3.1
Vulvakarzinom Epitheliales Ovarialkarzinom Zervixkarzinom Endometriumkarzinom Verantwortlich: M. Bossart, K.Henne Freigabe: interdisziplinärer Qualitätszirkel Stand: 06/16, gültig bis 07/18 Version 3.1
arithm. Alter Jahre medianes Alter Jahre
 Durchschnittlich erfasste Erkrankungszahlen Zeitraum Geschlecht N rohe Rate altersstandardisierte Rate (ESR)* arithm. Alter Jahre medianes Alter Jahre Vergleich medianes Alter 2011-2016 118 2,7 1,6 69,5
Durchschnittlich erfasste Erkrankungszahlen Zeitraum Geschlecht N rohe Rate altersstandardisierte Rate (ESR)* arithm. Alter Jahre medianes Alter Jahre Vergleich medianes Alter 2011-2016 118 2,7 1,6 69,5
CUP-Syndrom: Therapie
 CUP-Syndrom: Therapie Harald Schmalenberg IV. Medizinischen Klinik, Hämatologie, Onkologie und Palliativmedizin Städtisches Klinikum Dresden, Standort Friedrichstadt Grundsätze der Therapie des CUP-Syndroms
CUP-Syndrom: Therapie Harald Schmalenberg IV. Medizinischen Klinik, Hämatologie, Onkologie und Palliativmedizin Städtisches Klinikum Dresden, Standort Friedrichstadt Grundsätze der Therapie des CUP-Syndroms
Chemnitz, Stadt, Erzgebirgskreis, Mittelsachsen, Zwickau. medianes Alter Jahre. arithm. Alter Jahre
 Durchschnittlich erfasste Erkrankungszahlen Zeitraum Geschlecht N rohe Rate altersstandardisierte Rate (ESR)* arithm. Alter Jahre medianes Alter Jahre Vergleich medianes Alter 2011-2015 52 2,5 1,5 69,3
Durchschnittlich erfasste Erkrankungszahlen Zeitraum Geschlecht N rohe Rate altersstandardisierte Rate (ESR)* arithm. Alter Jahre medianes Alter Jahre Vergleich medianes Alter 2011-2015 52 2,5 1,5 69,3
Dissertation. zur Erlangung des akademischen Grades Doktor der Medizin (Dr.med.) vorgelegt der Martin-Luther-Universität Halle Wittenberg
 Aus dem Klinikum der Medizinischen Fakultät Zentrum für Chirurgie Univeritätsklinik und Poliklinik für Allgemein-,Visceral-und Gefäßchirurgie der Martin-Luther-Universität Halle Wittenberg Direktor: Prof.
Aus dem Klinikum der Medizinischen Fakultät Zentrum für Chirurgie Univeritätsklinik und Poliklinik für Allgemein-,Visceral-und Gefäßchirurgie der Martin-Luther-Universität Halle Wittenberg Direktor: Prof.
2.1 Was gibt es Neues beim Ösophagus und Magen?
 2.1 Was gibt es Neues beim Ösophagus und Magen? W. SCHRÖDER, A.H. HÖLSCHER, E. BOLLSCHWEILER, S.P. MÖNIG 1 Funktionelle Erkrankungen des Ösophagus und Magens 1.1 Achalasie Im letzten Jahrbuch wurde über
2.1 Was gibt es Neues beim Ösophagus und Magen? W. SCHRÖDER, A.H. HÖLSCHER, E. BOLLSCHWEILER, S.P. MÖNIG 1 Funktionelle Erkrankungen des Ösophagus und Magens 1.1 Achalasie Im letzten Jahrbuch wurde über
3.3 Magen. ein zu hoher Verzehr von gepökelten und geräucherten Lebensmitteln. Rauchen und übermäßiger Alkoholkonsum erhöhen das Magenkrebsrisiko,
 ICD-10 C16 Ergebnisse zur 29 3.3 Magen Kernaussagen Inzidenz und Mortalität: Seit mehr als 30 en ist in Deutschland ein stetiger Rückgang der Erkrankungen an Magenkrebs zu beobachten. Die altersstandardisierten
ICD-10 C16 Ergebnisse zur 29 3.3 Magen Kernaussagen Inzidenz und Mortalität: Seit mehr als 30 en ist in Deutschland ein stetiger Rückgang der Erkrankungen an Magenkrebs zu beobachten. Die altersstandardisierten
Die aktuelle S3-Leitlinie zur Diagnsotik, Therapie und Nachsorge des Ovarialkarzinoms. Diagnostik
 Die aktuelle S3-Leitlinie zur Diagnsotik, Therapie und Nachsorge des Ovarialkarzinoms Diagnostik Diagnostik: Zielsetzung und Fragestellungen Diagnostik (siehe Kapitel 3.3) Welche Symptome weisen auf ein
Die aktuelle S3-Leitlinie zur Diagnsotik, Therapie und Nachsorge des Ovarialkarzinoms Diagnostik Diagnostik: Zielsetzung und Fragestellungen Diagnostik (siehe Kapitel 3.3) Welche Symptome weisen auf ein
Wir erfaßten in der Studie 209 Patienten mit Magenkarzinom, welche im Zeitraum von 03/1994 bis 03/1999 therapiert wurden.
 51 2 Fragestellung In der vorliegenden Arbeit soll geklärt werden, von welchen tumorbiologischen Faktoren eine Tumorzelldisseminierung in das Knochenmark von Magenkarzinompatienten abhängt und ob ein Nachweis
51 2 Fragestellung In der vorliegenden Arbeit soll geklärt werden, von welchen tumorbiologischen Faktoren eine Tumorzelldisseminierung in das Knochenmark von Magenkarzinompatienten abhängt und ob ein Nachweis
