Kappenberg. Die Ammoniak Synthese V 15A
|
|
|
- Fritzi Waltz
- vor 7 Jahren
- Abrufe
Transkript
1 Es soll am Beispiel der Ammoniaksynthese versucht werden, einen kleinen Einblick in die Komplexität und Denkweise industrieller Chemie zu geben. Geschichtliches Zu Anfang des 20. Jahrhunderts war die Produktion von Nahrungsmitteln weltweit in Gefahr. In nicht allzu ferner Zeit zeichnete sich eine Hungerkatastrophe über die ganze Welt ab. Es fehlte an Düngemitteln. So konnten 1880 z. B. von 100 ha Land nur 130 Menschen ernährt werden. Durch die Einführung von Mineraldünger konnten die Pflanzenerträge erhöht werden. Heute können von 100 ha Land ca. 460 Menschen ernährt werden. Die Einfuhr von stickstoffhaltigem Salpeter aus Chile konnte von Jahrzehnt zu Jahrzehnt gesteigert werden, und von 1850 ab versuchte man, Stickstoff aus Steinkohle zu gewinnen konnte die Hälfte des Stickstoffbedarfs mit Ammonsulfat aus den Kokereien gedeckt werden. Aber auch das reichte noch nicht aus. Man kam auf den Gedanken, den für die Landwirtschaft so dringend notwendigen Stickstoff aus der Luft zu gewinnen. Fritz Haber, einem deutschen Chemiker, gelang die direkte Stickstoffgewinnung aus der Luft durch die Ammoniaksynthese als erstem im Labormaßstab. Diese Synthese konnte industriell verwertet werden und damit war ein wichtiges Mittel zur Hebung der Landwirtschaft und dem Wohlstand der Menschen geschaffen. Doch es war nicht Fritz Haber, sondern Carl Bosch, der die großtechnische Synthese durchführte und 1931 dafür den Nobelpreis erhielt. Immer mehr Leute glauben, dass Fritz Haber seine Forschungen nicht mehr dem Welt Hunger Problem widmete, sondern eher der Vorbereitung und Durchführung des ersten Weltkrieges. Das Deutsche Reich musste sich von den Einfuhren des Chile Salpeters unabhängig machen, um einen Krieg zu führen. Doch ohne Nitrate gab es keine Sprengstoffe, und das durch die Haber Ammoniak Synthese gewonnene Ammoniak ist eine wichtige Vorstufe. Haber erhielt dafür 1919 den Nobelpreis, da die anderen Kandidaten in Haber den Vater des Gaskrieges sahen und so den Nobelpreis ablehnten. Und wirklich war es Haber, der den ersten Giftgaseinsatz in Ypern (Flandern) leitete, bei dem es Tote und Verletzte gab. Haber hatte eine sehr patriotische Einstellung, mit der er diesen Giftgaseinsatz entschuldigte: Er meinte, dass ein Wissenschaftler im Frieden der Welt gehöre, im Krieg aber dem Vaterland. Habers Frau litt sehr unter seiner Verwicklung in diesen Giftkrieg und brachte sich schließlich selbst um. Trotz seines Verdienstes für das Deutsche Reich wurde Haber wegen seiner jüdischen Herkunft verfolgt und starb 1934 auf der Flucht nach Palästina Allgemeine Vorüberlegungen. Die Ammoniaksynthese sieht auf den ersten Blick recht einfach aus: 1 N H 2 2 NH 3 H R = 92 kj/mol Bei der praktischen Durchführung ergeben sich jedoch vielfältige Schwierigkeiten. Stickstoff und Wasserstoff reagieren nicht vollständig miteinander, sondern es stellt sich ein Gleichgewicht zwischen Ammoniak und den Ausgangsstoffen ein. Wie aus der Gleichung hervorgeht, verläuft die Bildung von Ammoniak exotherm und unter Volumenabnahme. Der Graph verdeutlicht die Zusammenhänge. Beispiel: Bei 450 C und einem Druck von 300 bar ist der Anteil an Ammoniak im Gleichgewicht etwa 38%. Anteil an Ammoniak in % im Gleichgewicht in Abhängigkeit von der Temperatur bei verschiedenen Drucken Materialien Die industrielle Ammoniak Synthese 10/2011 1
2 Nach dem Prinzip vom kleinsten Zwang muss man bei einer möglichst niedrigen Temperatur und erhöhtem Druck arbeiten, damit im Gleichgewicht ein möglichst hoher Ammoniakanteil vorliegt. Bei niedrigen Temperaturen ist jedoch die Reaktionsgeschwindigkeit für ein kontinuierliches Verfahren zu gering. Also muss man einen Kompromiss unter Verwendung eines Katalysators eingehen. Allerdings beginnt der Katalysator erst ab etwa 400 C vernünftig zu arbeiten. Die Ammoniaksynthese frei nach dem Computerprogramm des VCI Nachfolgend soll die technische Synthese von Ammoniak nach dem Haber Bosch Verfahren in sechs einzelnen Blöcken besprochen werden. 1. Der Primärreformer Der Primärreformer dient in erster Linie dazu, einen Ausgangsstoff für die Ammoniaksynthese, nämlich Wasserstoff, zu erzeugen und die Ausgangsprodukte vorzuwärmen. Dazu wird Erdgas, das hauptsächlich aus Methan (CH 4 ) besteht, mit Wasserdampf zur Reaktion gebracht. CH 4 + H 2 O CO + 3 H 2 H R = 206 kj / mol Außer dieser Gleichgewichtsreaktion reagiert das Kohlenmonooxid in einer weiteren mit Wasser Als Katalysator für diese Reaktion wird meist Nickel bzw. Nickeloxid benutzt. Die Reaktionstemperatur beträgt etwa 500 C, der Druck etwa 30 bar. Die erforderlichen hohen Reaktionstemperaturen werden durch Beheizen des Reaktors mit weiterem Erdgas, aber auch mit brennbaren Gasen, die aus der Synthese zurückgeführt werden, erzeugt. Dazu kann das methanreiche CO 2 FIashgas aus der CO 2 Wäsche (Block 4) ebenso dienen wie das wasserstoffreiche Purgegas aus dem Synthesekreislauf (Block 6). Im Primärreformer entsteht im wesentlichen ein Gemisch aus Wasserstoff, CO und CO 2 mit nicht umgesetztem Methan und Wasserdampf. 2. Der Sekundärreformer Der Sekundärreformer dient in erster Linie dazu, die zweite Komponente für die Ammoniaksynthese, nämlich Stickstoff bereitzustellen. Dieser wird aus der Luft genommen, dazu muss der in der Luft vorhandene Sauerstoff "vernichtet" werden. Dies geschieht in erster Linie mit dem in Block 1 hergestellten Wasserstoff und mit überschüssigem Erdgas. Außerdem laufen die Reaktionen, die im Primärreformer ablaufen, auch hier ab. 4 N 2 + O H 2 4 N H 2 O HR= 484 kj / mol CH 4 + H 2 O CO + 3 H 2 H R = 206 kj / mol Die Temperatur beträgt etwa 750 C. Man benutzt wieder Nickel oder Aluminiumoxid Katalysatoren. Durch Steuerung der Luftmenge kann man auch das für die Ammoniaksynthese richtige Verhältnis von Stickstoff zu Wasserstoff ( 1 zu 3) einstellen. 3. Die Konvertierung Die Kohlenstoffoxide machen den Katalysator im Synthesekreislauf unschädlich und müssen deshalb aus dem Gasgemisch entfernt werden. In dieser Stufe wird der CO Anteil des Rohgases möglichst weitgehend mit den Wasseranteilen zu Wasserstoff und Kohlenstoffdioxid umgesetzt. Das Kohlenstoffdioxid lässt sich einfacher aus dem Gas heraustrennen. Je niedriger dabei die Reaktionstemperatur gewählt werden kann, umso weiter liegt das Materialien Die industrielle Ammoniak Synthese 10/2011 2
3 Gleichgewicht auf der Seite von CO 2 und H 2. Daher besteht dieser Funktionsblock hauptsächlich aus zwei Reaktoren: Hochtemperaturreaktor: 400 C Chromoxid Eisenoxid Katalysator schafft etwa 3% CO und Niedertemperaturreaktor mit 220 C und Katalysator aus Kupfer oder Zinkoxiden. Es bleiben nur etwa 0,3 % CO. 4. CO 2 Gaswäsche Die nächste Aufgabe besteht in der Abtrennung der CO 2 Anteile aus dem Rohgas. Dies wird durch eine Wäsche bewirkt, in der dem Rohgas ein Lösemittel im Gegenstrom zugeführt wird. Unter den gewählten Bedingungen das Gas CO 2 in zwei Stufen absorbiert. Das Lösungsmittel ist eine organische Base man benutzt z.b. Methyldiethanolamin. Die Aufarbeitung dieses Lösemittels, das heißt die Abtrennung des CO 2 (durch Entspannung auf Normaldruck bzw. Austreiben durch Erhitzen des Lösemittels) und die Rückführung des gereinigten Lösemittels zur Wäsche, finden ebenfalls in diesem Funktionsblock statt. Das Kohlenstoffdioxid wird gereinigt und der Rest, der noch Anteile an Methan, Wasserstoff etc. enthält, wird als FLASH Gas abgetrennt und zur Heizung des Primärreformers mitbenutzt wird. In dieser Stufe wird auch der im Gas enthaltene Wasserdampf durch Abkühlen auf Raumtemperatur verflüssigt und so abgetrennt. Das Kohlenstoffdioxid ist das erste echte Reaktionsprodukt bei der Ammoniaksynthese und wird zum Beispiel zur Herstellung von Harnstoff (Grundchemikalie) weiterverwendet. Nach der Wäsche verbleiben immer noch Spuren von Kohlenstoffoxiden (ca. 0.1 %) im Rohgas. 5. Methanisierung Da die Kohlenstoffoxide den Katalysator der Ammoniaksynthese empfindlich schädigen, wird in der Methanisierung unter Umkehrung der Reaktionen, die im Primärreformer ablaufen, aus Resten der Kohlenstoffoxide mit jetzt im Überschuss vorhandenem Wasserstoff wieder Methan gebildet. CO 2 + H 2 CO + H 2 O H R = 41 kj / mol CO + 3 H 2 CH 4 + H 2 O H R = 206 kj / mol Die Reaktionstemperatur beträgt ca. 300 C. Als Katalysator wird Nickel eingesetzt. Der neu entstandene Wasserdampf wird am Ende der Stufe durch Kondensieren abgetrennt. Das entstehende Methan stört die eigentliche Ammoniaksynthese nicht so sehr. Es ist allerdings Bestandteil des Synthesegases, das weder Wasserstoff noch Stickstoff ist. Der Anteil an CO und CO2 ist kleiner als %. 6.Synthesekreislauf Der sechste Block des Verfahrensschemas umfasst die eigentliche Ammoniaksynthese. Dazu zählt die Verdichtung des Rohgases auf Reaktionsdruck (ca. 300 bar), das Umpumpen des Reaktionsgemisches in einem Kreislauf durch meist mehrere hintereinander geschaltete Reaktoren (450 C), entsprechende Wärmetauscher und Abscheider ( 20 C), die Aufarbeitung des gewonnenen Ammoniaks und die Abtrennung eines Teiles des Kreislaufstromes als "Purgegas", um den Anteil der nicht reagierenden Komponenten (Methan, Edelgase) im Kreisgas möglichst nicht steigen zu lassen. Im Kontaktofen durchströmt das Gasgemisch, das noch weit vom Gleichgewichtszustand entfernt ist, zunächst einen Raum mit einer verhältnismäßig hohen Temperatur, um die Reaktionsgeschwindigkeit zu erhöhen. Dahinter senkt man die Temperatur auf etwa 450 C, um einen möglichst großen Ammoniakanteil im Gleichgewichtszustand zu erhalten. Nach einem einmaligen Durchgang durch den Kontaktofen beträgt der Ammoniakanteil des Gasgemisches nur 15%; das ist immer noch weit vom Gleichgewichtszustand entfernt. Das entstandene Ammoniak wird durch Abkühlung des Gasgemisches verflüssigt (Verschiebung des Gleichgewichtes durch Entnahme einer Komponente) und das Restgas in einem Kreislauf wiederum dem Kontaktofen zugeführt. Materialien Die industrielle Ammoniak Synthese 10/2011 3
4 Bei einem Hochdruckverfahren wie der Ammoniaksynthese werden hohe Anforderungen an das Material der Anlage gestellt. Gewöhnlicher Stahl hält zwar den hohen Drucken stand, nicht aber dem chemischen Angriff des Wasserstoffs bei diesen Bedingungen. Der Wasserstoff diffundiert durch den Stahl und verbindet sich mit dem Kohlenstoff des Stahls zu Methan. Der Stahlmantel könnte dadurch seine Festigkeit verlieren und schließlich wegen des hohen Gasdrucks platzen. BOSCH entwickelte daher ein doppelwandiges Reaktionsrohr. Die Innenwand besteht aus kohlenstofffreiem Eisen, durch das der Wasserstoff diffundieren kann, ohne das Material zu verändern. Die Außenwand aus Stahl gibt dem Reaktionsrohr die Festigkeit. Für eine Tagesproduktion von 1500 Tonnen Ammoniak setzt man einen Reaktor von 2,40 m Durchmesser, 30 m Länge und einem Gewicht von ca. 400 Tonnen ein. Er fasst etwa 100 Tonnen Katalysator (heute meist Eisen mit Zusätzen von Oxiden des Calciums, Aluminiums und Siliziums sowie Kaliumcarbonat). Wichtig für die industrielle Planung und das wirtschaftliche Arbeiten ist aber letztendlich der Profit. Bei einer Ammoniakanlage sind in erster Linie die Kosten des Ammoniaks und des Erdgases (und damit der Energie), die Lebensdauer des Katalysators und die Abschreibung (Lebensdauer) der Anlage zu berücksichtigen. Zur Zeit arbeitet in Deutschland nur noch eine Ammoniak Anlage in Ludwigshafen, die auch nur deshalb halbwegs rentabel ist, weil sie in Bezug auf Prozessdampf und Kohlenstoffdioxid im Verbund mit anderen chemischen Produktionsanlagen im gleichen Werk arbeitet. Verwendung von Ammoniak: Die Hauptmenge des Ammoniaks wird zu Düngesalzen verarbeitet, zum Beispiel Ammoniumnitrat, Ammoniumphospat, Harnstoff und zu Ammonsulfat. Proportional zur Zunahme der Weltbevölkerung wächst auch der Bedarf an Düngemitteln (siehe Diagramm), und daher an Ammoniak. Eine Hauptaufgabe für die nächsten Jahrzehnte wird die Sicherung der Ernährung für die stark wachsende Weltbevölkerung sein. Die technische Verwirklichung und ständige Verbesserung der Ammoniaksynthese trägt zur Lösung dieser Aufgabe bei, da sie die Grundlage für die ausreichende Produktion von Düngemitteln bietet. Auf dem heutigen Stand der Technik trägt Mineraldünger zur Verbesserung der Nahrungsgrundlage in den Industrienationen bei. In der Bundesrepublik werden heute etwa 30 Menschen von einem Landwirt ernährt; in einigen Ländern der Erde sind es sogar noch mehr. In einigen Ländern ist die Nahrungsmittelproduktion jedoch wesentlich geringer, dies ist vor allem in Ländern der 3. Welt, in Afrika, Lateinamerika oder Asien der Fall. Am höchsten ist die Produktion in den Vereinigten Staaten Materialien Die industrielle Ammoniak Synthese 10/2011 4
5 und der G.U.S. Nur etwa 20% des Ammoniaks ist Rohstoff für die vielen sonstigen Stickstoffverbindungen wie zum Beispiel Salpetersäure oder Harnstoff. Große Mengen an Ammoniak reagieren mit sogenannten Platin Drahtnetz Katalysatoren zu Stickoxiden (Oxidation), die zu Salpetersäure weiterbearbeitet werden. Salpetersäure wird mit Ammoniak neutralisiert, es entsteht Ammoniumnitrat und nach Hinzufügen von Kalkmilch zu Kalkammonsalpeter. Auch dieser wird zu Düngemitteln verarbeitet. Auch ist Ammoniak Ausgangs, Roh und Hilfsstoff für zahlreiche Güter des täglichen Bedarfs. Produkte aus Ammoniak: Düngemittel Faserkunststoffe Kältemittel Amoniumsalze Farbstoffe Unkrautvernichter Soda Kunstseide Kunststoffe Produkte aus Salpetersäure: Arzneimittel Farbstoffe Lacke & Kunstharze synthetische Fasern Kunststoffe Klebemittel Filme Metallbearbeitung Schädlingsbekämpfung Düngemittel Nitrate Raketentreibstoffe Sprengstoffe Nitrolacke Zellulose Produkte aus Harnstoff: Düngemittel Futtermittel Schaumstoffe knitterfeste Textilien reißfestes Papier Materialien Die industrielle Ammoniak Synthese 10/2011 5
Uebersicht. Vorgehen. Wissenserwerb. Anwendungen des chemischen Gleichgewichtes 36
 Anwendungen des chemischen Gleichgewichtes 36 Gruppe1: Gruppe 4 Ammoniakherstellung: Eine bedeutsame Synthese Uebersicht Ammoniak ist eine der wichtigsten Grundchemikalien. Die Ammoniaksynthese ist eine
Anwendungen des chemischen Gleichgewichtes 36 Gruppe1: Gruppe 4 Ammoniakherstellung: Eine bedeutsame Synthese Uebersicht Ammoniak ist eine der wichtigsten Grundchemikalien. Die Ammoniaksynthese ist eine
Ammoniaksynthese. Erstellt von Daniel Flanz und Paul Fehren
 Ammoniaksynthese Erstellt von Daniel Flanz und Paul Fehren Inhaltsverzeichnis Geschichte der Ammoniaksynthese Eigenschaften von Ammoniak Herstellungsverfahren Haber-Bosch-Verfahren Alternativen Schwachpunkte
Ammoniaksynthese Erstellt von Daniel Flanz und Paul Fehren Inhaltsverzeichnis Geschichte der Ammoniaksynthese Eigenschaften von Ammoniak Herstellungsverfahren Haber-Bosch-Verfahren Alternativen Schwachpunkte
Ammoniaksynthese nach Haber-Bosch
 Sarah Kiefer, Thomas Richter Ammoniaksynthese nach Haber-Bosch 1. Allgemeine Einführung 2. Chemisches Grundprinzip 3. Industrielle Umsetzung 4. Anwendung und Auswirkungen 1. Allgemeine Einführung Steckbrief:
Sarah Kiefer, Thomas Richter Ammoniaksynthese nach Haber-Bosch 1. Allgemeine Einführung 2. Chemisches Grundprinzip 3. Industrielle Umsetzung 4. Anwendung und Auswirkungen 1. Allgemeine Einführung Steckbrief:
Verrechnungspunkte: Gesamtpunkte: Note:
 Säure-Base-Reaktionen: E. 5. 2 Die Base Ammoniak Bearbeitungszeit: zweimal 45 Minuten Hilfsmittel: Taschenrechner Verrechnungspunkte: Gesamtpunkte: Note: Aufgaben 1 Ammoniak wird heute großtechnisch nach
Säure-Base-Reaktionen: E. 5. 2 Die Base Ammoniak Bearbeitungszeit: zweimal 45 Minuten Hilfsmittel: Taschenrechner Verrechnungspunkte: Gesamtpunkte: Note: Aufgaben 1 Ammoniak wird heute großtechnisch nach
Lernen mit der BASF. Die Ammoniaksynthese
 Lernen mit der BASF Die Ammoniaksynthese Geschichte und Entwicklung Die Entwicklungsgeschichte der Ammoniaksynthese ist die Geschichte eines Wettlaufs gegen eine drohende weltweite Hungerkatastrophe. Um
Lernen mit der BASF Die Ammoniaksynthese Geschichte und Entwicklung Die Entwicklungsgeschichte der Ammoniaksynthese ist die Geschichte eines Wettlaufs gegen eine drohende weltweite Hungerkatastrophe. Um
Haber Bosch-Verfahren Referat von Tobias Rosendahl und Carsten Müller zum Seminar zum analytischen Grundpraktikum am Donnerstag, dem
 Haber Bosch-Verfahren Referat von Tobias Rosendahl und Carsten Müller zum Seminar zum analytischen Grundpraktikum am Donnerstag, dem 17.12.98 Grundgliederung - allg. Einführung - chemisches Grundprinzip
Haber Bosch-Verfahren Referat von Tobias Rosendahl und Carsten Müller zum Seminar zum analytischen Grundpraktikum am Donnerstag, dem 17.12.98 Grundgliederung - allg. Einführung - chemisches Grundprinzip
Das Haber-Bosch-Verfahren
 Das Haber-Bosch-Verfahren 3 + 2 NH 3 H = - 92 kj/mol Ammoniak, NH 3 - Eigenschaften - farbloses Gas - charakteristischer, stechender, zu Tränen reizender Geruch, - Sdp.: - 33 C - gutes Lösungsmittel für
Das Haber-Bosch-Verfahren 3 + 2 NH 3 H = - 92 kj/mol Ammoniak, NH 3 - Eigenschaften - farbloses Gas - charakteristischer, stechender, zu Tränen reizender Geruch, - Sdp.: - 33 C - gutes Lösungsmittel für
Salpetersäure. Herstellung und Bedeutung. von
 Salpetersäure Herstellung und Bedeutung von Patrick Götte Stefan Jovanovic Salpetersäure Herstellung und Bedeutung Salpetersäure und deren Eigenschaften Geschichtliches Herstellung Bedeutung / Verwendung
Salpetersäure Herstellung und Bedeutung von Patrick Götte Stefan Jovanovic Salpetersäure Herstellung und Bedeutung Salpetersäure und deren Eigenschaften Geschichtliches Herstellung Bedeutung / Verwendung
Ammoniaksynthese. von Nico Voss und Hendrik Pfumfel
 Ammoniaksynthese von Nico Voss und Hendrik Pfumfel Datum: 21. April 2008 Gliederung Geschichte und Entwicklung Eigenschaften Herstellungsverfahren Das Haber-Bosch-Verfahren Alternativ-Methoden Bedeutung
Ammoniaksynthese von Nico Voss und Hendrik Pfumfel Datum: 21. April 2008 Gliederung Geschichte und Entwicklung Eigenschaften Herstellungsverfahren Das Haber-Bosch-Verfahren Alternativ-Methoden Bedeutung
Anorganische-Chemie. Dr. Stefan Wuttke Butenandstr. 11, Haus E, E
 Dr. Stefan Wuttke Butenandstr. 11, Haus E, E 3.039 stefan.wuttke@cup.uni-muenchen.de www.wuttkegroup.de norganische-chemie Grundpraktikum für Biologen 2017 Chemische Gleichungen Chemische Reaktionen können
Dr. Stefan Wuttke Butenandstr. 11, Haus E, E 3.039 stefan.wuttke@cup.uni-muenchen.de www.wuttkegroup.de norganische-chemie Grundpraktikum für Biologen 2017 Chemische Gleichungen Chemische Reaktionen können
Die Herstellung von Stickstoffdünger: Ammoniumnitrat. Best.-Nr Dauer: 20 min. - Klassenstufe : Klasse
 BAD_ M_2022409 Die Herstellung von Stickstoffdünger: Ammoniumnitrat Die Herstellung von Stickstoffdünger: Ammoniumnitrat Best.-Nr. 2042409 Dauer: 20 min. - Klassenstufe : 8.-10. Klasse In diesem Film sehen
BAD_ M_2022409 Die Herstellung von Stickstoffdünger: Ammoniumnitrat Die Herstellung von Stickstoffdünger: Ammoniumnitrat Best.-Nr. 2042409 Dauer: 20 min. - Klassenstufe : 8.-10. Klasse In diesem Film sehen
3. Übung Grundlagen der Hauptgruppenchemie
 Allgemeine und Anorganische Chemie 3. Übung Grundlagen der Hauptgruppenchemie Aufgabe 1: Beschreiben Sie die Herstellung von Schwefelsäure nach dem Kontaktverfahren mit Hilfe von chemischen Gleichungen
Allgemeine und Anorganische Chemie 3. Übung Grundlagen der Hauptgruppenchemie Aufgabe 1: Beschreiben Sie die Herstellung von Schwefelsäure nach dem Kontaktverfahren mit Hilfe von chemischen Gleichungen
Die Herstellung von Stickstoffdünger: Ammoniumnitrat. Best.-Nr. MC20976 Dauer: 20 min. - Klassenstufe : Klasse
 Die Herstellung von Stickstoffdünger: Ammoniumnitrat Best.-Nr. MC20976 Dauer: 20 min. - Klassenstufe : 8.-10. Klasse In diesem Film sehen die Schüler einmal eine moderne industrielle Herstellung von Düngern.
Die Herstellung von Stickstoffdünger: Ammoniumnitrat Best.-Nr. MC20976 Dauer: 20 min. - Klassenstufe : 8.-10. Klasse In diesem Film sehen die Schüler einmal eine moderne industrielle Herstellung von Düngern.
Anorganische-Chemie. Dr. Stefan Wuttke Butenandstr. 11, Haus E, E
 Dr. Stefan Wuttke Butenandstr. 11, Haus E, E 3.039 stefan.wuttke@cup.uni-muenchen.de www.wuttkegroup.de norganische-chemie Grundpraktikum für Biologen 2014/2015 Chemische Bindung - Bindungsarten Stefan
Dr. Stefan Wuttke Butenandstr. 11, Haus E, E 3.039 stefan.wuttke@cup.uni-muenchen.de www.wuttkegroup.de norganische-chemie Grundpraktikum für Biologen 2014/2015 Chemische Bindung - Bindungsarten Stefan
Das Chemische Gleichgewicht
 Das Chemische Gleichgewicht 2 Ein chemisches Gleichgewicht herrscht dann, wenn Hin- sowie Rückreaktion gleich schnell ablaufen. Die Reaktionsgeschwindigkeit der Gesamtreaktion erscheint daher gleich null,
Das Chemische Gleichgewicht 2 Ein chemisches Gleichgewicht herrscht dann, wenn Hin- sowie Rückreaktion gleich schnell ablaufen. Die Reaktionsgeschwindigkeit der Gesamtreaktion erscheint daher gleich null,
Grundlagen der Chemie Verschieben von Gleichgewichten
 Verschieben von Gleichgewichten Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu Prinzip des kleinsten Zwangs Das
Verschieben von Gleichgewichten Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu Prinzip des kleinsten Zwangs Das
Fachschule für f. r Technik. Dipl.FL. D.Strache
 Dipl.FL. Chemie Grundlagen Stoffe Eisen, Sauerstoff, Schwefelsäure, Benzin, Luft Reine Stoffe Eisen, Sauerstoff, Schwefelsäure, Benzin Chemische Elemente Eisen, Sauerstoff Chemische Verbindungen Schwefelsäure,
Dipl.FL. Chemie Grundlagen Stoffe Eisen, Sauerstoff, Schwefelsäure, Benzin, Luft Reine Stoffe Eisen, Sauerstoff, Schwefelsäure, Benzin Chemische Elemente Eisen, Sauerstoff Chemische Verbindungen Schwefelsäure,
Nutzung von CO 2 in fossilen Energieumwandlungskreisläufen 13. Brandenburger Energietag. K. Büker Cottbus, 15. September 2011
 Nutzung von CO 2 in fossilen Energieumwandlungskreisläufen 13. Brandenburger Energietag K. Büker Cottbus, 15. September 2011 2 Mehr als 2.000 von Uhde gebaute Anlagen auf allen Kontinenten. Düngemittel
Nutzung von CO 2 in fossilen Energieumwandlungskreisläufen 13. Brandenburger Energietag K. Büker Cottbus, 15. September 2011 2 Mehr als 2.000 von Uhde gebaute Anlagen auf allen Kontinenten. Düngemittel
Themen heute: Reaktionsgleichungen, chemische Gleichgewichte
 Wiederholung der letzten Vorlesungsstunde: Ionenbindung, Coulomb-Gesetz, Ionen- (Kristall-)strukturen, NaCl, CsCl, ZnS, Elementarzelle, 7 Kristallsysteme Themen heute: Reaktionsgleichungen, chemische Gleichgewichte
Wiederholung der letzten Vorlesungsstunde: Ionenbindung, Coulomb-Gesetz, Ionen- (Kristall-)strukturen, NaCl, CsCl, ZnS, Elementarzelle, 7 Kristallsysteme Themen heute: Reaktionsgleichungen, chemische Gleichgewichte
Biomass-to-Liquid-Kraftstoffe (BtL)
 Biomass-to-Liquid-Kraftstoffe (BtL) Die aktuelle Diskussion um den Verbrauch und die Endlichkeit fossiler Energieträger, den Klimawandel und den Umweltschutz fokussiert sich sehr stark auf den Anteil,
Biomass-to-Liquid-Kraftstoffe (BtL) Die aktuelle Diskussion um den Verbrauch und die Endlichkeit fossiler Energieträger, den Klimawandel und den Umweltschutz fokussiert sich sehr stark auf den Anteil,
Abschlussklausur Anorganische Chemie für Geowissenschaftler II Modul BGEO2.5.1
 Abschlussklausur Anorganische Chemie für Geowissenschaftler II Modul BGEO2.5.1 Name, Vorname:... MatrikelNr.:... 1. Bei der Anionenanalyse (Analyse 4) gab es eine wichtige Vorprobe, nämlich die Probe darauf,
Abschlussklausur Anorganische Chemie für Geowissenschaftler II Modul BGEO2.5.1 Name, Vorname:... MatrikelNr.:... 1. Bei der Anionenanalyse (Analyse 4) gab es eine wichtige Vorprobe, nämlich die Probe darauf,
3.4 Energieumsatz bei Reaktionen
 3.4 Energieumsatz bei Reaktionen Versuch: Verbrennen eines Stückes Holz Beobachtung: Energie wird freigesetzt in Form von Wärme. Jede Reaktion ist mit einem Energieumsatz gekoppelt. Reaktionen, bei denen
3.4 Energieumsatz bei Reaktionen Versuch: Verbrennen eines Stückes Holz Beobachtung: Energie wird freigesetzt in Form von Wärme. Jede Reaktion ist mit einem Energieumsatz gekoppelt. Reaktionen, bei denen
Lösungen (ohne Aufgabenstellungen)
 Kapitel 1 Das chemische Gleichgewicht Lösungen (ohne Aufgabenstellungen) Aufgaben A 1 Die Hin- und die Rückreaktion läuft nach der Einstellung des Gleichgewichts mit derselben Geschwindigkeit ab, d. h.
Kapitel 1 Das chemische Gleichgewicht Lösungen (ohne Aufgabenstellungen) Aufgaben A 1 Die Hin- und die Rückreaktion läuft nach der Einstellung des Gleichgewichts mit derselben Geschwindigkeit ab, d. h.
Haber Bosch Verfahren. Petra Schürmann & Max Fabian Volhard
 Haber Bosch Verfahren Petra Schürmann & Max Fabian Volhard Übersicht Geschichte Chemische Grundlagen Technische Herausforderungen Hb Haber Bosch Verfahren h Produkte und Anwendungsgebiete gg des Ammoniaks
Haber Bosch Verfahren Petra Schürmann & Max Fabian Volhard Übersicht Geschichte Chemische Grundlagen Technische Herausforderungen Hb Haber Bosch Verfahren h Produkte und Anwendungsgebiete gg des Ammoniaks
Katalysatoren - Chemische Partnervermittlung im virtuellen Labor
 Seite 1 von 6 Katalysatoren - Chemische Partnervermittlung im virtuellen Labor Katalysatoren Der Katalysator in der Großindustrie Was passiert im Inneren? Das virtuelle Labor. Katalysatoren Katalysatoren
Seite 1 von 6 Katalysatoren - Chemische Partnervermittlung im virtuellen Labor Katalysatoren Der Katalysator in der Großindustrie Was passiert im Inneren? Das virtuelle Labor. Katalysatoren Katalysatoren
INGENIEURBÜRO FÜR ELEKTROTECHNIK
 BEDEUTUNG DER LUFTAUFBEREITUNG BEI DER ZNERZEUGUNG Eine im hohen Grad getrocknete Luft ist die Voraussetzung für die Herstellung von starken zonkonzentrationen unter normalen industriellen Bedingungen.
BEDEUTUNG DER LUFTAUFBEREITUNG BEI DER ZNERZEUGUNG Eine im hohen Grad getrocknete Luft ist die Voraussetzung für die Herstellung von starken zonkonzentrationen unter normalen industriellen Bedingungen.
Wasserstoffbrückenbindung, H 2 O, NH 3, HF, Wasserstoff im PSE, Isotope, Vorkommen, exotherme Reaktion mit Sauerstoff zu Wasser, Energieinhalt,
 Wiederholung der letzten Vorlesungsstunde: Das Element Wasserstoff und seine Verbindungen Wasserstoffbrückenbindung, H 2 O, NH 3, HF, Wasserstoff im PSE, Isotope, Vorkommen, exotherme Reaktion mit Sauerstoff
Wiederholung der letzten Vorlesungsstunde: Das Element Wasserstoff und seine Verbindungen Wasserstoffbrückenbindung, H 2 O, NH 3, HF, Wasserstoff im PSE, Isotope, Vorkommen, exotherme Reaktion mit Sauerstoff
Planung, Bau und Betrieb von Chemieanlagen - Übung Allgemeine Chemie. Allgemeine Chemie. Rückblick auf vorherige Übung
 Planung, Bau und Betrieb von Chemieanlagen - Übung Allgemeine Chemie 1 Allgemeine Chemie Rückblick auf vorherige Übung 2 Löslichkeit Was ist eine Lösung? - Eine Lösung ist ein einphasiges (homogenes) Gemisch
Planung, Bau und Betrieb von Chemieanlagen - Übung Allgemeine Chemie 1 Allgemeine Chemie Rückblick auf vorherige Übung 2 Löslichkeit Was ist eine Lösung? - Eine Lösung ist ein einphasiges (homogenes) Gemisch
Fossile Rohstoffe. Kohlenwasserstoffe als Energieträger
 nwasserstoffe als Energieträger Erdöl,, Erdgas und Torf sind im Laufe von Millionen von Jahren aus Kleinlebwesen und Pflanzen entstanden und werden deswegen als fossile Energieträger bezeichnet. Da sie
nwasserstoffe als Energieträger Erdöl,, Erdgas und Torf sind im Laufe von Millionen von Jahren aus Kleinlebwesen und Pflanzen entstanden und werden deswegen als fossile Energieträger bezeichnet. Da sie
Anorganische-Chemie. Dr. Stefan Wuttke Butenandstr. 11, Haus E, E
 Dr. Stefan Wuttke Butenandstr. 11, Haus E, E 3.039 stefan.wuttke@cup.uni-muenchen.de www.wuttkegroup.de Anorganische-Chemie Grundpraktikum für Biologen 2014/2015 Wie zählen wir Mengen in der Chemie? Stefan
Dr. Stefan Wuttke Butenandstr. 11, Haus E, E 3.039 stefan.wuttke@cup.uni-muenchen.de www.wuttkegroup.de Anorganische-Chemie Grundpraktikum für Biologen 2014/2015 Wie zählen wir Mengen in der Chemie? Stefan
Ammoniaksynthese. Nadine Engbers Datum:
 Ammoniaksynthese Nadine Engbers Datum: 19.04.2006 Inhalt Geschichte und Bedeutung der Ammoniaksynthese Ammoniak Darstellung Haber-Bosch-Verfahren Verwendung von Ammoniak Geschichte und Bedeutung Zunahme
Ammoniaksynthese Nadine Engbers Datum: 19.04.2006 Inhalt Geschichte und Bedeutung der Ammoniaksynthese Ammoniak Darstellung Haber-Bosch-Verfahren Verwendung von Ammoniak Geschichte und Bedeutung Zunahme
Chemie, Kapitel 4 : Chemische Reaktionen und Luft
 Lesen Sie aufmerksam das Kapitel 4.4 und lösen Sie die folgenden Aufgaben: a) Definieren Sie die drei Begriffe in jeweils einem Satz b) Geben Sie ein Beispiel aus dem Alltag Exotherme Reaktion: Endotherme
Lesen Sie aufmerksam das Kapitel 4.4 und lösen Sie die folgenden Aufgaben: a) Definieren Sie die drei Begriffe in jeweils einem Satz b) Geben Sie ein Beispiel aus dem Alltag Exotherme Reaktion: Endotherme
Labor- und Pilotuntersuchungen für Waschsysteme zur Herstellung von Biomethan"
 Labor- und Pilotuntersuchungen für Waschsysteme zur Herstellung von Biomethan" Lutherstadt Wittenberg, 27.10.2006 Fachtagung INNOGAS: Herstellung von Biomethan aus Biogas Dr. J. Hofmann, U. Freier Zielstellung
Labor- und Pilotuntersuchungen für Waschsysteme zur Herstellung von Biomethan" Lutherstadt Wittenberg, 27.10.2006 Fachtagung INNOGAS: Herstellung von Biomethan aus Biogas Dr. J. Hofmann, U. Freier Zielstellung
KSO METALLE (SEKP) Skript Metalle (SekP) V1.0 04/15 Bor
 1 KSO METALLE (SEKP) Skript Metalle (SekP) V1.0 04/15 Bor 2 INHALTSVERZEICHNIS "METALLE" 1. Einleitung...03 2. Reaktionen von Metallen... 05 3. Gewinnung von Metallen... 07 4. Domino: Eigenschaften der
1 KSO METALLE (SEKP) Skript Metalle (SekP) V1.0 04/15 Bor 2 INHALTSVERZEICHNIS "METALLE" 1. Einleitung...03 2. Reaktionen von Metallen... 05 3. Gewinnung von Metallen... 07 4. Domino: Eigenschaften der
Chemie Fragenkatalog Jahrgang 8
 Chemie Fragenkatalog Jahrgang 8 - Stoffe und ihre Eigenschaften - Stoffgemische und Trennverfahren - Vom Aufbau der Stoffe - Die chemische Reaktion - Luft und Verbrennung - Gewinnung von Metallen Redoxreaktionen
Chemie Fragenkatalog Jahrgang 8 - Stoffe und ihre Eigenschaften - Stoffgemische und Trennverfahren - Vom Aufbau der Stoffe - Die chemische Reaktion - Luft und Verbrennung - Gewinnung von Metallen Redoxreaktionen
Was haben wir gelernt?
 Was haben wir gelernt? - Gesetze chemischer Reaktionen - Atommodell von Dalton - Elementsymbole - Die atomare Masseneinheit u - Die Avogadro-Zahl und deren Umkehrung - Von Massenverhältnissen zu Teilchenverhältnissen
Was haben wir gelernt? - Gesetze chemischer Reaktionen - Atommodell von Dalton - Elementsymbole - Die atomare Masseneinheit u - Die Avogadro-Zahl und deren Umkehrung - Von Massenverhältnissen zu Teilchenverhältnissen
Das Chemische Gleichgewicht
 Das Chemische Gleichgewicht Geschwindigkeit der Hinreaktion: v hin = k hin c(a 2 ) c(x 2 ) Geschwindigkeit der Rückreaktion: v rück = k rück c 2 (AX) Gleichgewicht: v hin = v rück k hin c(a 2 ) c(x 2 )
Das Chemische Gleichgewicht Geschwindigkeit der Hinreaktion: v hin = k hin c(a 2 ) c(x 2 ) Geschwindigkeit der Rückreaktion: v rück = k rück c 2 (AX) Gleichgewicht: v hin = v rück k hin c(a 2 ) c(x 2 )
4.3 Reaktionsgeschwindigkeit und Katalysator
 4.3 Reaktionsgeschwindigkeit und Katalysator - Neben der thermodynamischen Lage des chemischen Gleichgewichts ist der zeitliche Ablauf der Reaktion, also die Geschwindigkeit der Ein- Einstellung des Gleichgewichts,
4.3 Reaktionsgeschwindigkeit und Katalysator - Neben der thermodynamischen Lage des chemischen Gleichgewichts ist der zeitliche Ablauf der Reaktion, also die Geschwindigkeit der Ein- Einstellung des Gleichgewichts,
Verbrennungsrechnung als kinetischer Simulationsansatz
 Verbrennungsrechnung als kinetischer Simulationsansatz Simulationsansatz mit CHEMCAD Die Daten für Flammpunkt, Zündtemperatur, Explosionsgrenzen diverser Stoffe sind weitestgehend bekannt. Methoden zur
Verbrennungsrechnung als kinetischer Simulationsansatz Simulationsansatz mit CHEMCAD Die Daten für Flammpunkt, Zündtemperatur, Explosionsgrenzen diverser Stoffe sind weitestgehend bekannt. Methoden zur
V. Vom Experiment zur Reaktionsgleichung. Themen dieses Kapitels:
 Hinweise zum Kapitel V. Vom Experiment zur Reaktionsgleichung Themen dieses Kapitels: - Stoffmengen (Mole), molare Massen und Massen von Stoffportionen und ihre mathematische Bestimmung - Stoffnamen und
Hinweise zum Kapitel V. Vom Experiment zur Reaktionsgleichung Themen dieses Kapitels: - Stoffmengen (Mole), molare Massen und Massen von Stoffportionen und ihre mathematische Bestimmung - Stoffnamen und
Musterklausur 1 zur Allgemeinen und Anorganischen Chemie
 Musterklausur 1 zur Allgemeinen und Anorganischen Chemie Achtung: Taschenrechner ist nicht zugelassen. Aufgaben sind so, dass sie ohne Rechner lösbar sind. Weitere Hilfsmittel: Periodensystem der Elemente
Musterklausur 1 zur Allgemeinen und Anorganischen Chemie Achtung: Taschenrechner ist nicht zugelassen. Aufgaben sind so, dass sie ohne Rechner lösbar sind. Weitere Hilfsmittel: Periodensystem der Elemente
Film der Einheit Gleichgewichte
 Film der Einheit Gleichgewichte Gleichgewichte in verschiedenen Disziplinen Richtung und Vollständigkeit einer Reaktion Chemisches Gleichgewicht Was ist das? Chemisches Gleichgewicht als dynamischer Prozess
Film der Einheit Gleichgewichte Gleichgewichte in verschiedenen Disziplinen Richtung und Vollständigkeit einer Reaktion Chemisches Gleichgewicht Was ist das? Chemisches Gleichgewicht als dynamischer Prozess
Anorganische-Chemie. Dr. Stefan Wuttke Butenandstr. 11, Haus E, E
 Dr. Stefan Wuttke Butenandstr. 11, Haus E, E 3.039 stefan.wuttke@cup.uni-muenchen.de www.wuttkegroup.de Anorganische-Chemie Grundpraktikum für Biologen 2016 Wie zählen wir Mengen in der Chemie? Stefan
Dr. Stefan Wuttke Butenandstr. 11, Haus E, E 3.039 stefan.wuttke@cup.uni-muenchen.de www.wuttkegroup.de Anorganische-Chemie Grundpraktikum für Biologen 2016 Wie zählen wir Mengen in der Chemie? Stefan
Kohlenstoffverbindungen und Gleichgewichtsreaktionen (EF)
 Kohlenstoffverbindungen und Gleichgewichtsreaktionen (EF)... zeigen Vor- und Nachteile ausgewählter Produkte des Alltags (u.a. Aromastoffe, Alkohole) und ihre Anwendung auf, gewichten diese und beziehen
Kohlenstoffverbindungen und Gleichgewichtsreaktionen (EF)... zeigen Vor- und Nachteile ausgewählter Produkte des Alltags (u.a. Aromastoffe, Alkohole) und ihre Anwendung auf, gewichten diese und beziehen
Europäisches Patentamt European Patent Office Veröffentlichungsnummer: Office europeen des brevets EUROPÄISCHE PATENTANMELDUNG
 Europäisches Patentamt European Patent Office Veröffentlichungsnummer: 0 200 880 Office europeen des brevets A2 EUROPÄISCHE PATENTANMELDUNG Anmeldenummer: 86103064.1 Int. Cl.4: C07C 29/15 C01C 1/04 Anmeldetag:
Europäisches Patentamt European Patent Office Veröffentlichungsnummer: 0 200 880 Office europeen des brevets A2 EUROPÄISCHE PATENTANMELDUNG Anmeldenummer: 86103064.1 Int. Cl.4: C07C 29/15 C01C 1/04 Anmeldetag:
Grundlagen der Chemie Chemisches Gleichgewicht
 Chemisches Gleichgewicht Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu Das Massenwirkungsgesetz Wenn Substanzen
Chemisches Gleichgewicht Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu Das Massenwirkungsgesetz Wenn Substanzen
FWU Schule und Unterricht. FWU-Klassiker Ammoniaksynthese. Der Griff in die Luft. FWU das Medieninstitut der Länder
 FWU Schule und Unterricht DVD 46 10257 14 min, Farbe FWU-Klassiker Ammoniaksynthese Der Griff in die Luft FWU das Medieninstitut der Länder 00 Lernziele nach Lehrplänen und Schulbüchern Erkennen der Bedeutung
FWU Schule und Unterricht DVD 46 10257 14 min, Farbe FWU-Klassiker Ammoniaksynthese Der Griff in die Luft FWU das Medieninstitut der Länder 00 Lernziele nach Lehrplänen und Schulbüchern Erkennen der Bedeutung
Reaktionsgleichungen und was dahinter steckt
 Reaktionsgleichungen und was dahinter steckt Prinzipien Bestehende Formeln dürfen nicht verändert werden. Bei Redoxreaktionen kann H, OH oder H 2 O ergänzt werden. Links und rechts vom Reaktionspfeil muss
Reaktionsgleichungen und was dahinter steckt Prinzipien Bestehende Formeln dürfen nicht verändert werden. Bei Redoxreaktionen kann H, OH oder H 2 O ergänzt werden. Links und rechts vom Reaktionspfeil muss
Stoffplan GLF Chemie 4Mb
 Organische Chemie Stoffplan GLF Chemie 4Mb Theorie: Organische Chemie: -Kohlenwasserstoffe -Aromatische Kohlenwasserstoffe: z.b. Benzol -Organische Sauerstoffverbindungen: z.b. Ethanol -Von der Organik
Organische Chemie Stoffplan GLF Chemie 4Mb Theorie: Organische Chemie: -Kohlenwasserstoffe -Aromatische Kohlenwasserstoffe: z.b. Benzol -Organische Sauerstoffverbindungen: z.b. Ethanol -Von der Organik
VERSTEHEN UND VERARBEITEN EINES LESETEXTES
 VERSTEHEN UND VERARBEITEN EINES LESETEXTES Justus Liebig einer der bedeutendsten deutschen Chemiker 1 2 3 4 5 6 Die deutsche Regierung und wichtige Chemieorganisationen haben das Jahr 2003 zum Jahr der
VERSTEHEN UND VERARBEITEN EINES LESETEXTES Justus Liebig einer der bedeutendsten deutschen Chemiker 1 2 3 4 5 6 Die deutsche Regierung und wichtige Chemieorganisationen haben das Jahr 2003 zum Jahr der
Effizienzsteigerung von Biogasanlagen mittels katalytischer Methangasreaktoren
 Effizienzsteigerung von Biogasanlagen mittels katalytischer Methangasreaktoren Dr. rer. nat. Manfred Grigo, Berlin, Rostock Prof. a. D. Dr.-Ing. Karl-Hermann Busse, Berlin, Rostock 1. Biogasanlagen 1.1
Effizienzsteigerung von Biogasanlagen mittels katalytischer Methangasreaktoren Dr. rer. nat. Manfred Grigo, Berlin, Rostock Prof. a. D. Dr.-Ing. Karl-Hermann Busse, Berlin, Rostock 1. Biogasanlagen 1.1
Effizienzsteigerung von Biogasanlagen mittels katalytischer Methangasreaktoren
 Effizienzsteigerung von Biogasanlagen mittels katalytischer Methangasreaktoren Dr. rer. nat. Manfred Grigo, Berlin, Rostock Prof. a. D. Dr.-Ing. Karl-Hermann Busse, Berlin, Rostock 1. Biogasanlagen 1.1
Effizienzsteigerung von Biogasanlagen mittels katalytischer Methangasreaktoren Dr. rer. nat. Manfred Grigo, Berlin, Rostock Prof. a. D. Dr.-Ing. Karl-Hermann Busse, Berlin, Rostock 1. Biogasanlagen 1.1
Steckbrief von Sauerstoff, O 2
 Steckbrief von Sauerstoff, O 2 farblos, d.h. unsichtbar, nur in sehr dicken Schichten himmelblau geruch- und geschmacklos - Etwas schwerer als Luft - notwendig für die Verbrennung, brennt aber nicht selbst
Steckbrief von Sauerstoff, O 2 farblos, d.h. unsichtbar, nur in sehr dicken Schichten himmelblau geruch- und geschmacklos - Etwas schwerer als Luft - notwendig für die Verbrennung, brennt aber nicht selbst
Alte Technologien für innovative Verfahren zur Wasserstofferzeugung und Verwendung
 Alte Technologien für innovative Verfahren zur Wasserstofferzeugung dena Jahrestagung 2016 Dr. Steffen Schirrmeister Motivation Systemübergreifende Technologie Quelle: dena 2 Wasserstofferzeugung Produktionsmengen
Alte Technologien für innovative Verfahren zur Wasserstofferzeugung dena Jahrestagung 2016 Dr. Steffen Schirrmeister Motivation Systemübergreifende Technologie Quelle: dena 2 Wasserstofferzeugung Produktionsmengen
Einführung in die Chemie der Kunststoffe
 Einführung in die Chemie der Kunststoffe Handout zur Powerpoint-Präsentation von Lena Großjung und Noreen Lange Der Bergiff Kunststoffe umfasst im weitesten Sinne: Organische Werkstoffe, die als Makromoleküle
Einführung in die Chemie der Kunststoffe Handout zur Powerpoint-Präsentation von Lena Großjung und Noreen Lange Der Bergiff Kunststoffe umfasst im weitesten Sinne: Organische Werkstoffe, die als Makromoleküle
Allgemeine Chemie für r Studierende der Zahnmedizin
 Allgemeine Chemie für r Studierende der Zahnmedizin Allgemeine und Anorganische Chemie Teil 3 Dr. Ulrich Schatzschneider Institut für Anorganische und Angewandte Chemie, Universität Hamburg Lehrstuhl für
Allgemeine Chemie für r Studierende der Zahnmedizin Allgemeine und Anorganische Chemie Teil 3 Dr. Ulrich Schatzschneider Institut für Anorganische und Angewandte Chemie, Universität Hamburg Lehrstuhl für
D1 Abhängigkeit der Reaktionsgeschwindigkeit von der Temperatur
 Chemische Reaktionen verlaufen nicht alle mit der gleichen Geschwindigkeit. Sehr schnelle Reaktionen, wie z.b. die Neutralisationsreaktion oder die Knallgasreaktion erfolgen in Bruchteilen einer Sekunde.
Chemische Reaktionen verlaufen nicht alle mit der gleichen Geschwindigkeit. Sehr schnelle Reaktionen, wie z.b. die Neutralisationsreaktion oder die Knallgasreaktion erfolgen in Bruchteilen einer Sekunde.
Homologe Reihe der unverzweigten Alkane C n H (2n+2)
 Organische hemie I 3.01 Homologe Reihe der unverzweigten Alkane n H (2n+2) (Paraffine) (veraltet: normale Alkane = n-alkane) Name Konstitution Siedepunkt ausführliche Schreibweise Stenographie [ ] Methan
Organische hemie I 3.01 Homologe Reihe der unverzweigten Alkane n H (2n+2) (Paraffine) (veraltet: normale Alkane = n-alkane) Name Konstitution Siedepunkt ausführliche Schreibweise Stenographie [ ] Methan
Grundlagen der Chemie
 1 Das Massenwirkungsgesetz Verschiebung von Gleichgewichtslagen Metastabile Systeme/Katalysatoren Löslichkeitsprodukt Das Massenwirkungsgesetz Wenn Substanzen miteinander eine reversible chemische Reaktion
1 Das Massenwirkungsgesetz Verschiebung von Gleichgewichtslagen Metastabile Systeme/Katalysatoren Löslichkeitsprodukt Das Massenwirkungsgesetz Wenn Substanzen miteinander eine reversible chemische Reaktion
Prüfungsaufgaben zur Reaktionsgeschwindigkeit und zum chemischem Gleichgewicht
 Prüfungsaufgaben zur Reaktionsgeschwindigkeit und zum chemischem Gleichgewicht Hilfsmittel: Tabellenbuch, Taschenrechner (nicht programmierbar) 1. Folgende Reaktionen finden in geschlossenen Systemen statt.
Prüfungsaufgaben zur Reaktionsgeschwindigkeit und zum chemischem Gleichgewicht Hilfsmittel: Tabellenbuch, Taschenrechner (nicht programmierbar) 1. Folgende Reaktionen finden in geschlossenen Systemen statt.
Manchmal muss man etwas nachhelfen Energieumsatz bei chemischen Reaktionen
 1 von 26 Manchmal muss man etwas nachhelfen Energieumsatz bei chemischen Reaktionen Ein Beitrag von Dr. Leena Bröll, Gundelingen Mit Illustrationen von Dr. Leena Bröll, Gundelingen, und Katja Rau, Berglen
1 von 26 Manchmal muss man etwas nachhelfen Energieumsatz bei chemischen Reaktionen Ein Beitrag von Dr. Leena Bröll, Gundelingen Mit Illustrationen von Dr. Leena Bröll, Gundelingen, und Katja Rau, Berglen
Folgende Punkte kommen jedoch nicht dran: Blindproben, Berechnungen mit der atomaren Masseneinheit in u! Räumlicher Bau von Molekülen!
 Liebe Schüler der Klassen 9c/d Ihr findet in diesem Word Dokument Aufgaben zur quantitativen Analytik, die Ihr zur Vorbereitung auf die SA durchrechnen könnt. Auf Seite zwei seht ihr dann ebenso die Lösungen,
Liebe Schüler der Klassen 9c/d Ihr findet in diesem Word Dokument Aufgaben zur quantitativen Analytik, die Ihr zur Vorbereitung auf die SA durchrechnen könnt. Auf Seite zwei seht ihr dann ebenso die Lösungen,
Schriftliche Abschlussprüfung Chemie
 Sächsisches Staatsministerium für Kultus Schuljahr 1999/ Geltungsbereich: für Klassen 10 an - Mittelschulen - Förderschulen - Abendmittelschulen Schriftliche Abschlussprüfung Chemie Realschulabschluss
Sächsisches Staatsministerium für Kultus Schuljahr 1999/ Geltungsbereich: für Klassen 10 an - Mittelschulen - Förderschulen - Abendmittelschulen Schriftliche Abschlussprüfung Chemie Realschulabschluss
Funktionsweise eines Absorberkühlschranks
 Funktionsweise eines Absorberkühlschranks Prinzip... 1 Gerätekomponenten... 1 Austreiber mit Blasenpumpe... 1 Wasserabscheider (Dephlegmator)... 2 Kondensator... 2 Verdampfer... 2 Absorber... 2 Vorratsbehälter...
Funktionsweise eines Absorberkühlschranks Prinzip... 1 Gerätekomponenten... 1 Austreiber mit Blasenpumpe... 1 Wasserabscheider (Dephlegmator)... 2 Kondensator... 2 Verdampfer... 2 Absorber... 2 Vorratsbehälter...
2. Chemische Reaktionen und chemisches Gleichgewicht
 2. Chemische Reaktionen und chemisches Gleichgewicht 2.1 Enthalpie (ΔH) Bei chemischen Reaktionen reagieren die Edukte zu Produkten. Diese unterscheiden sich in der inneren Energie. Es gibt dabei zwei
2. Chemische Reaktionen und chemisches Gleichgewicht 2.1 Enthalpie (ΔH) Bei chemischen Reaktionen reagieren die Edukte zu Produkten. Diese unterscheiden sich in der inneren Energie. Es gibt dabei zwei
Beeinflussung des chemischen Gleichgewichts (Leitprogramm)
 Beeinflussung des chemischen Gleichgewichts (Leitprogramm) In diesem Leitprogramm lernen Sie, wie Konzentrationen, Druck und Temperatur ein chemisches Gleichgewicht beeinflussen. 1. Die Auswirkung von
Beeinflussung des chemischen Gleichgewichts (Leitprogramm) In diesem Leitprogramm lernen Sie, wie Konzentrationen, Druck und Temperatur ein chemisches Gleichgewicht beeinflussen. 1. Die Auswirkung von
Helmut Stapf Grundlagenchemie für technische Berufe. Neunte, verbesserte und erweiterte Auflage 149 Bilder und 4 Tafeln Fachbuchverlag Leipzig, 1955
 Helmut Stapf Grundlagenchemie für technische Berufe Neunte, verbesserte und erweiterte Auflage 149 Bilder und 4 Tafeln Fachbuchverlag Leipzig, 1955 Inhaltsverzeichnis I. Allgemeine Chemie A. Gebietsabgrenzung
Helmut Stapf Grundlagenchemie für technische Berufe Neunte, verbesserte und erweiterte Auflage 149 Bilder und 4 Tafeln Fachbuchverlag Leipzig, 1955 Inhaltsverzeichnis I. Allgemeine Chemie A. Gebietsabgrenzung
Chemisches Rechnen für Bauingenieure
 Chemisches Rechnen für Bauingenieure PD Dr. Martin Denecke Sprechstunde: Freitag, 13.30 14.30 martin.denecke@uni-due.de ++49 201 183 2742 Raum: V15 R05 H18 Periodensystem der Elemente Chemie im Netz http://www.arnold-chemie.de/downloads/molrechnen.pdf
Chemisches Rechnen für Bauingenieure PD Dr. Martin Denecke Sprechstunde: Freitag, 13.30 14.30 martin.denecke@uni-due.de ++49 201 183 2742 Raum: V15 R05 H18 Periodensystem der Elemente Chemie im Netz http://www.arnold-chemie.de/downloads/molrechnen.pdf
1. Klausur: Veranstaltung Allgemeine und Anorganische Chemie
 1. Klausur: Veranstaltung Allgemeine und Anorganische Chemie Geowissenschaften (BSc, Diplom), Mathematik (BSc, Diplom), Informatik mit Anwendungsfach Chemie und andere Naturwissenschaften 1. Klausur Modulbegleitende
1. Klausur: Veranstaltung Allgemeine und Anorganische Chemie Geowissenschaften (BSc, Diplom), Mathematik (BSc, Diplom), Informatik mit Anwendungsfach Chemie und andere Naturwissenschaften 1. Klausur Modulbegleitende
Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I Dr. Helge Klemmer
 Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I 12.12.2014 Gase Flüssigkeiten Feststoffe Wiederholung Teil 2 (05.12.2014) Ideales Gasgesetz: pv Reale Gase: Zwischenmolekularen Wechselwirkungen
Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I 12.12.2014 Gase Flüssigkeiten Feststoffe Wiederholung Teil 2 (05.12.2014) Ideales Gasgesetz: pv Reale Gase: Zwischenmolekularen Wechselwirkungen
Orientierungstest für angehende Industriemeister. Vorbereitungskurs Chemie
 Orientierungstest für angehende Industriemeister Vorbereitungskurs Chemie Weiterbildung Technologie Erlaubte Hilfsmittel: Periodensystem der Elemente Taschenrechner Maximale Bearbeitungszeit: 60 Minuten
Orientierungstest für angehende Industriemeister Vorbereitungskurs Chemie Weiterbildung Technologie Erlaubte Hilfsmittel: Periodensystem der Elemente Taschenrechner Maximale Bearbeitungszeit: 60 Minuten
Aufgaben zu chemischen Gleichgewichten und zum Massenwirkungsgesetz
 Aufgaben zu chemischen Gleichgewichten und zum Massenwirkungsgesetz CC Vereinbarung (=Konvention): Zahlenwert und Einheit von Gleichgewichtskonstanten sind vom gewählten Koeffizientensatz abhängig! Wir
Aufgaben zu chemischen Gleichgewichten und zum Massenwirkungsgesetz CC Vereinbarung (=Konvention): Zahlenwert und Einheit von Gleichgewichtskonstanten sind vom gewählten Koeffizientensatz abhängig! Wir
Fragen zum Thema chemische Reaktionen Klasse 4 1. Was gehört zu einer chemische Reaktionsgleichung? 2. Wie nennt man die Stoffe, die vor der Reaktion
 1. Was gehört zu einer chemische Reaktionsgleichung? 2. Wie nennt man die Stoffe, die vor der Reaktion vorliegen? 3. Wie nennt man die Stoffe, die nach der Reaktion vorliegen? 4. Womit wird die Richtung
1. Was gehört zu einer chemische Reaktionsgleichung? 2. Wie nennt man die Stoffe, die vor der Reaktion vorliegen? 3. Wie nennt man die Stoffe, die nach der Reaktion vorliegen? 4. Womit wird die Richtung
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Wer spannt wem den Sauerstoff aus? Das komplette Material finden Sie hier:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Wer spannt wem den Sauerstoff aus? Das komplette Material finden Sie hier: School-Scout.de 2 von 24 17. Metalloxide (Kl. 8/9) Stoffe
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Wer spannt wem den Sauerstoff aus? Das komplette Material finden Sie hier: School-Scout.de 2 von 24 17. Metalloxide (Kl. 8/9) Stoffe
Lösungen Thema: Stoffe und ihre Eigenschaften
 Lösungen Thema: Stoffe und ihre Eigenschaften zu 1: Siedetemperatur, Schmelztemperatur, Dichte (Löslichkeit) zu 2: Brennbarkeit, Härte, Löslichkeit, Farbe, Geruch zu 3: zu 4: Bei der Flüssigkeit handelt
Lösungen Thema: Stoffe und ihre Eigenschaften zu 1: Siedetemperatur, Schmelztemperatur, Dichte (Löslichkeit) zu 2: Brennbarkeit, Härte, Löslichkeit, Farbe, Geruch zu 3: zu 4: Bei der Flüssigkeit handelt
Fossile Rohstoffe. Erdöl
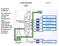 Fraktionierte Destillation Die stufenweise Abtrennung einzelner Komponenten eines Stoffgemisches aufgrund der unterschiedlichen Siedepunkte wird als fraktionierte Destillation bezeichnet. 1 Fraktionierte
Fraktionierte Destillation Die stufenweise Abtrennung einzelner Komponenten eines Stoffgemisches aufgrund der unterschiedlichen Siedepunkte wird als fraktionierte Destillation bezeichnet. 1 Fraktionierte
KULTUSMINISTERIUM DES LANDES SACHSEN-ANHALT. Abitur April/Mai Chemie (Grundkurs) Elemente der IV. Hauptgruppe
 KULTUSMINISTERIUM DES LANDES SACHSEN-ANHALT Abitur April/Mai 2004 Chemie (Grundkurs) Einlesezeit: Bearbeitungszeit: 30 Minuten 210 Minuten Thema 1 Elemente der IV. Hauptgruppe Thema 2 Struktur und Reaktionsverhalten
KULTUSMINISTERIUM DES LANDES SACHSEN-ANHALT Abitur April/Mai 2004 Chemie (Grundkurs) Einlesezeit: Bearbeitungszeit: 30 Minuten 210 Minuten Thema 1 Elemente der IV. Hauptgruppe Thema 2 Struktur und Reaktionsverhalten
Löschversuche mit Wasser sowie Feuchtigkeit führen zur Spaltung von Wasser und erzeugen Knallgas
 Thermit / Blatt 1 Einleitung Gegen Ende des 19. Jahrhunderts entdeckte Hans Goldschmidt in Essen die technische Gewinnung von Schwermetallen aus ihren Oxiden durch die Oxidation von Aluminium. Thermit
Thermit / Blatt 1 Einleitung Gegen Ende des 19. Jahrhunderts entdeckte Hans Goldschmidt in Essen die technische Gewinnung von Schwermetallen aus ihren Oxiden durch die Oxidation von Aluminium. Thermit
c C 2 K = c A 2 c B 2mol /l 2 0,5mol /l 2 4 mol /l K =4l /mol
 Berechnungen zum Massenwirkungsgesetz 1/13 Jakob 2010 Fall 1a: Gegeben: Gleichgewichtskonzentrationen aller Stoffe; Gesucht: Gleichgewichtskonstante Die Reaktion 2A + B 2C befindet sich im Gleichgewicht.
Berechnungen zum Massenwirkungsgesetz 1/13 Jakob 2010 Fall 1a: Gegeben: Gleichgewichtskonzentrationen aller Stoffe; Gesucht: Gleichgewichtskonstante Die Reaktion 2A + B 2C befindet sich im Gleichgewicht.
Labor- und Pilotuntersuchungen für Waschsysteme zur Herstellung von Biomethan"
 Labor- und Pilotuntersuchungen für Waschsysteme zur Herstellung von Biomethan" Oranienbaum, 10.05.2007 Symposium: Biogas- und Biokraftstoffaufarbeitung 2. Fachtagung NEMO-Netzwerk INNOGAS Dr. J. Hofmann,
Labor- und Pilotuntersuchungen für Waschsysteme zur Herstellung von Biomethan" Oranienbaum, 10.05.2007 Symposium: Biogas- und Biokraftstoffaufarbeitung 2. Fachtagung NEMO-Netzwerk INNOGAS Dr. J. Hofmann,
LB1 Stoffe. LB1 Stoffe. LB1 Stoffe. Womit beschäftigt sich die Chemie?
 Lernkartei Klasse 7 LB1: Stoffe Womit beschäftigt sich die Chemie? LB1 Stoffe mit den Stoffen, ihren Eigenschaften und ihren Veränderungen (Stoffumwandlungen) Was sind Stoffe? LB1 Stoffe Stoffe sind die
Lernkartei Klasse 7 LB1: Stoffe Womit beschäftigt sich die Chemie? LB1 Stoffe mit den Stoffen, ihren Eigenschaften und ihren Veränderungen (Stoffumwandlungen) Was sind Stoffe? LB1 Stoffe Stoffe sind die
Kinetik: a) Reaktionsgeschwindigkeit (zeitlicher Verlauf) b) Reaktionsweg (Mechanismus)
 Kinetik Kinetik: a) Reaktionsgeschwindigkeit (zeitlicher Verlauf) b) Reaktionsweg (Mechanismus) Klassifizierung chem. Reaktionen nach kinetischen Aspekten a) Reaktionsmolekularität: wie viele Teilchen
Kinetik Kinetik: a) Reaktionsgeschwindigkeit (zeitlicher Verlauf) b) Reaktionsweg (Mechanismus) Klassifizierung chem. Reaktionen nach kinetischen Aspekten a) Reaktionsmolekularität: wie viele Teilchen
Heterogen katalysierte Reaktionen sind von enormer technischer Bedeutung.
 Heterogene Katalyse Heterogen katalysierte Reaktionen sind von enormer technischer Bedeutung. Zahlreiche Prozesse laufen an der Oberfläche fester Katalysatoren mit hoher Geschwindigkeit und Selektivität
Heterogene Katalyse Heterogen katalysierte Reaktionen sind von enormer technischer Bedeutung. Zahlreiche Prozesse laufen an der Oberfläche fester Katalysatoren mit hoher Geschwindigkeit und Selektivität
6. Tag: Chemisches Gleichgewicht und Reaktionskinetik
 6. Tag: Chemisches Gleichgewicht und Reaktionskinetik 1 6. Tag: Chemisches Gleichgewicht und Reaktionskinetik 1. Das chemische Gleichgewicht Eine chemische Reaktion läuft in beiden Richtungen ab. Wenn
6. Tag: Chemisches Gleichgewicht und Reaktionskinetik 1 6. Tag: Chemisches Gleichgewicht und Reaktionskinetik 1. Das chemische Gleichgewicht Eine chemische Reaktion läuft in beiden Richtungen ab. Wenn
CHEMISCHE REAKTIONEN (SEKP)
 KSO CHEMISCHE REAKTIONEN (SEKP) Skript Chemische Reaktionen (SekP) V1.0 01/15 Bor 2 INHALTSVERZEICHNIS "CHEMISCHE REAKTIONEN" 1. Einleitung...03 2. Stoffe wandeln sich um... 04 2.1 Kupfer reagiert mit
KSO CHEMISCHE REAKTIONEN (SEKP) Skript Chemische Reaktionen (SekP) V1.0 01/15 Bor 2 INHALTSVERZEICHNIS "CHEMISCHE REAKTIONEN" 1. Einleitung...03 2. Stoffe wandeln sich um... 04 2.1 Kupfer reagiert mit
Saurer Regen, was ist das?
 Saurer Regen, was ist das? 1. SO x (x=2,3) => SO 2 und SO 3 SO 2 + H 2 O H 2 SO 3 (schwefelige Säure) SO 3 + H 2 O H 2 SO 4 (Schwefelsäure) 2. NO x (x=1,2) 2 NO + H 2 O + ½O 2 2 H NO 2 (salpetrige Säure)
Saurer Regen, was ist das? 1. SO x (x=2,3) => SO 2 und SO 3 SO 2 + H 2 O H 2 SO 3 (schwefelige Säure) SO 3 + H 2 O H 2 SO 4 (Schwefelsäure) 2. NO x (x=1,2) 2 NO + H 2 O + ½O 2 2 H NO 2 (salpetrige Säure)
Chemisches Gleichgewicht in homogenen Systemen I Seminarvortrag SoSe 08
 Chemisches Gleichgewicht in homogenen Systemen I Seminarvortrag SoSe 08 Sebastian Meiss 14. Mai 2008 1 Historischer Einstieg Erstmals wurde das Massenwirkungsgesetz 1867 von dem norwegischen Mathematiker
Chemisches Gleichgewicht in homogenen Systemen I Seminarvortrag SoSe 08 Sebastian Meiss 14. Mai 2008 1 Historischer Einstieg Erstmals wurde das Massenwirkungsgesetz 1867 von dem norwegischen Mathematiker
Grundkenntnisse der Chemie und der Physik. Was ihr hier findet
 Grundkenntnisse der hemie und der Physik P Was ihr hier findet Wissensgebiete der hemie und der Physik Formeln Elemente Metalle Kohlenstoff Analyse Synthese Basen Laugen Salze Atome Moleküle Akustik Optik
Grundkenntnisse der hemie und der Physik P Was ihr hier findet Wissensgebiete der hemie und der Physik Formeln Elemente Metalle Kohlenstoff Analyse Synthese Basen Laugen Salze Atome Moleküle Akustik Optik
Abschlussklausur Allgemeine und Anorganische Chemie Teil 2 (Geologie, Geophysik und Mineralogie)
 Abschlussklausur Allgemeine und Anorganische Chemie Teil 2 (Geologie, Geophysik und Mineralogie) Teilnehmer/in:... Matrikel-Nr.:... - 1. Sie sollen aus NaCl und Wasser 500 ml einer Lösung herstellen, die
Abschlussklausur Allgemeine und Anorganische Chemie Teil 2 (Geologie, Geophysik und Mineralogie) Teilnehmer/in:... Matrikel-Nr.:... - 1. Sie sollen aus NaCl und Wasser 500 ml einer Lösung herstellen, die
Zusammenfassung. Einleitung und Zielsetzung
 IV Zusammenfassung Einleitung und Zielsetzung Die Durchführung der partiellen Oxidation von Methan mit Sauerstoff zu Synthesegas stellt aufgrund ihrer leichten Exothermie eine wirtschaftlich interessante
IV Zusammenfassung Einleitung und Zielsetzung Die Durchführung der partiellen Oxidation von Methan mit Sauerstoff zu Synthesegas stellt aufgrund ihrer leichten Exothermie eine wirtschaftlich interessante
4.3 Reaktionsgeschwindigkeit und Katalysator
 4.3 Reaktionsgeschwindigkeit und Katalysator Neben der thermodynamischen Lage des chemischen Gleichgewichts ist der zeitliche Ablauf der Reaktion, also die Geschwindigkeit der Einstellung des Gleichgewichts,
4.3 Reaktionsgeschwindigkeit und Katalysator Neben der thermodynamischen Lage des chemischen Gleichgewichts ist der zeitliche Ablauf der Reaktion, also die Geschwindigkeit der Einstellung des Gleichgewichts,
Allgemeine Chemie für Studierende mit Nebenfach Chemie Andreas Rammo
 Allgemeine Chemie für Studierende mit Nebenfach Chemie Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de innere Energie U Energieumsatz bei
Allgemeine Chemie für Studierende mit Nebenfach Chemie Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de innere Energie U Energieumsatz bei
Synthesegas - Herstellung und Verwendung
 Synthesegas - Herstellung und Verwendung Synthesegas - wasserstoffhaltige Gasmischungen zum Einsatz in Synthesereaktionen N 2 H 2 CO Ammoniaksynthese N 2 + 3 H 2 2 NH 3 1 3 Methanolsynthese CO + 2 H 2
Synthesegas - Herstellung und Verwendung Synthesegas - wasserstoffhaltige Gasmischungen zum Einsatz in Synthesereaktionen N 2 H 2 CO Ammoniaksynthese N 2 + 3 H 2 2 NH 3 1 3 Methanolsynthese CO + 2 H 2
Kälte erzeugen. Warum ist es in hohen Luftschichten kälter als in tiefen? Verdunstungskälte. - frieren nach dem Bad - schwitzen zur Körperkühlung
 Kälte erzeugen Warum ist es in hohen Luftschichten kälter als in tiefen? Verdunstungskälte - frieren nach dem Bad - schwitzen zur Körperkühlung - Luft komprimieren -> Erwärmung - Luft dekomprimieren (
Kälte erzeugen Warum ist es in hohen Luftschichten kälter als in tiefen? Verdunstungskälte - frieren nach dem Bad - schwitzen zur Körperkühlung - Luft komprimieren -> Erwärmung - Luft dekomprimieren (
Eine chemische Reaktion läuft ab, wenn reaktionsfähige Teilchen mit genügend Energie zusammenstoßen.
 1) DEFINITIONEN DIE CHEMISCHE REAKTION Eine chemische Reaktion läuft ab, wenn reaktionsfähige Teilchen mit genügend Energie zusammenstoßen. Der Massenerhalt: Die Masse ändert sich im Laufe einer Reaktion
1) DEFINITIONEN DIE CHEMISCHE REAKTION Eine chemische Reaktion läuft ab, wenn reaktionsfähige Teilchen mit genügend Energie zusammenstoßen. Der Massenerhalt: Die Masse ändert sich im Laufe einer Reaktion
4 Anwendung I: Gestaltung einer günstigen Reaktorstruktur
 4 Anwendung I: Gestaltung einer günstigen Reaktorstruktur Die folgende Studie zeigt als Anwendungsbeispiel die Ermittlung einer günstigen Reaktorstruktur und einer sicheren sowie wirtschaftlichen Betriebsweise
4 Anwendung I: Gestaltung einer günstigen Reaktorstruktur Die folgende Studie zeigt als Anwendungsbeispiel die Ermittlung einer günstigen Reaktorstruktur und einer sicheren sowie wirtschaftlichen Betriebsweise
Dies ist eine Auswahl der in der Vorlesung Einführung in die Anorganische Chemie im WS 2007/08 gezeigten Powerpoint-Folien im pdf-format, ohne
 Dies ist eine Auswahl der in der Vorlesung Einführung in die Anorganische Chemie im WS 2007/08 gezeigten Powerpoint-Folien im pdf-format, ohne Abbildungen. Ausschließlich als Lehrmaterialien für den universitätsinternen
Dies ist eine Auswahl der in der Vorlesung Einführung in die Anorganische Chemie im WS 2007/08 gezeigten Powerpoint-Folien im pdf-format, ohne Abbildungen. Ausschließlich als Lehrmaterialien für den universitätsinternen
Allgemeine Chemie für r Studierende der Medizin
 Allgemeine Chemie für r Studierende der Medizin Allgemeine und Anorganische Chemie Teil 4+5 Dr. Ulrich Schatzschneider Institut für Anorganische und Angewandte Chemie, Universität Hamburg Lehrstuhl für
Allgemeine Chemie für r Studierende der Medizin Allgemeine und Anorganische Chemie Teil 4+5 Dr. Ulrich Schatzschneider Institut für Anorganische und Angewandte Chemie, Universität Hamburg Lehrstuhl für
Einführung in die CO 2 -Nutzung
 Einführung in die CO 2 -Nutzung Niklas von der Assen Arbeitsgruppe Energiesystemtechnik Lehrstuhl für Technische Thermodynamik RWTH Aachen University, Nachbarschaftsforum Niederaußem Lehrstuhl für Technische
Einführung in die CO 2 -Nutzung Niklas von der Assen Arbeitsgruppe Energiesystemtechnik Lehrstuhl für Technische Thermodynamik RWTH Aachen University, Nachbarschaftsforum Niederaußem Lehrstuhl für Technische
Thema: Alternative Antriebsformen für Kraftfahrzeuge
 Thema: Alternative Antriebsformen für Kraftfahrzeuge vorgelegt von Name: Cem Koc Inhaltsverzeichnis 1. Einleitung 3 1. Begründung des Themas 3 2. Hauptteil 3 1. Benzin, bald Vergangenheit? 3 2. Neue Energieformen
Thema: Alternative Antriebsformen für Kraftfahrzeuge vorgelegt von Name: Cem Koc Inhaltsverzeichnis 1. Einleitung 3 1. Begründung des Themas 3 2. Hauptteil 3 1. Benzin, bald Vergangenheit? 3 2. Neue Energieformen
