Prospektive Studie zu der Diagnostik beim Karpaltunnelsyndrom: Bildgebung durch Ultraschall gegenüber der elektrophysiologischen Untersuchung
|
|
|
- Alexandra Adler
- vor 7 Jahren
- Abrufe
Transkript
1 Aus der Klinik für Plastische Chirurgie und Schwerbrandverletzte, Handchirurgiezentrum im Berufsgenossenschaftlichen Universitätsklinikum Bergmannsheil der Ruhr-Universität Bochum Direktor: Prof. Dr. med. H. U. Steinau Prospektive Studie zu der Diagnostik beim Karpaltunnelsyndrom: Bildgebung durch Ultraschall gegenüber der elektrophysiologischen Untersuchung Inaugural-Dissertation zur Erlangung des Doktorgrades der Medizin einer Hohen Medizinischen Fakultät der Ruhr-Universität Bochum vorgelegt von Lutz Schreiber aus Gelsenkirchen 2012
2 Dekan: Prof. Dr. med. K. Überla Referent: Prof. Dr. med. L. Steinsträßer Korreferent: Prof. Dr. med. U. Eickhoff Tag der mündlichen Prüfung: 6. November 2012
3 Abstract Lutz Schreiber Diagnostik beim Karpaltunnelsyndrom: Bildgebung durch Ultraschall gegenüber der Elektrophysiologischen Untersuchung des Nervus medianus Problem Das Karpaltunnelsyndrom (KTS) ist das häufigste Nervenkompressionssyndrom der erwachsenen Bevölkerung. Zur Diagnosesicherung gilt die elektrophysiologische Untersuchung des N. medianus als etabliert und wird empfohlen. Die Untersuchung wird von einigen Patienten allerdings als unangenehm empfunden und ist zudem mit einem erhöhten Zeitaufwand für die Patienten und Kostenaufwand für das Gesundheitssystem verbunden, da sie meist in neurologischen Kliniken oder Praxen durchgeführt wird. Hinzu kommt, dass bis zu 34 % der Patienten mit typischer KTS-Symptomatik keine pathologischen Veränderungen in der elektrophysiologischen Untersuchung zeigen. Aus diesen Gründen sollten alternative Verfahren zur Diagnosesicherung eines KTS nicht außer Acht gelassen werden. In diesem Zusammenhang ist die hochauflösende Sonographie des N. medianus und hier besonders die Messung der Querschnittsfläche innerhalb des Karpaltunnels zu nennen, die in den letzten Jahren immer mehr in den Fokus der Forschung gerückt ist. Methodik In diese Studie wurden 40 Patienten eingeschlossen, die sich im Zeitraum von eineinhalb Jahren ( ) in dem Handchirurgiezentrum des Universitätsklinikums Bergmannsheil in Bochum zur operativen Behandlung eines Karpaltunnelsyndroms vorstellten. Es wurde eine prospektive Studie mit fünf Untersuchungen pro Patient im Laufe eines Jahres nach erfolgter Operation durchgeführt. Die Patienten erhielten jeweils eine elektroneurographische Untersuchung des N. medianus beider Hände sowie Ultraschalluntersuchungen beider Unterarme und Hände in jeweils vier Ebenen zur Messung der Querschnittsfläche des N. medianus. Des Weiteren wurde die Beweglichkeit des N. medianus innerhalb des Karpaltunnels untersucht und eine Kraftmessung des Faustschlusses mittels Handdynamometer durchgeführt. Zusätzlich erfolgten klinische Provokationstests (Phalen, Hoffmann-Tinel) sowie eine ausführliche Schmerzanamnese beider Hände. Ein besonderes Augenmerk galt der sensiblen Nervenleitgeschwindigkeit, der distal-motorischen Latenz und der Querschnittsfläche des N. medianus innerhalb des Karpaltunnels. Die ermittelten Messdaten wurden im zeitlichen Verlauf sowie im Vergleich der operierten mit der nicht operierten Hand betrachtet. Ergebnisse Die elektroneurographische Untersuchung des N. medianus der betroffenen Hand zeigte im Laufe von zwölf Monaten postoperativ einen statistisch signifikanten Anstieg der sensiblen Nervenleitgeschwindigkeit (NLG; p < 0,001) sowie einen statistisch signifikanten Abfall der distal-motorischen Latenz (dml; p = 0,003). Der Vergleich der Querschnittsflächen des N. medianus innerhalb des Karpaltunnels ergab für den N. medianus der operierten Hand präoperativ statistisch signifikant höhere Werte als für den N. medianus der nicht operierten Hand (p = 0,004). Dieser pathologische, präoperative Unterschied war postoperativ nicht mehr nachweisbar, allerdings stieg die Querschnittsfläche des Nervs der operierten Hand ab sechs Monaten postoperativ wieder an. Vergleicht man die Ergebnisse der operierten mit der nicht operierten Hand lässt sich feststellen, dass bei präoperativ bestehenden statistisch signifikanten Unterschieden der sensiblen NLG (p < 0,001), der dml (p = 0,008) und der Querschnittsfläche des N. medianus in einer der gemessenen Ebenen (innerhalb des Karpaltunnels; p = 0,004) zwölf Monate postoperativ keine statistisch signifikante Differenz mehr nachzuweisen war (NLG: p=0,072; dml: p=1,000; Querschnittsfläche: p=0,059) Diskussion Die Untersuchungen haben gezeigt, dass die Elektroneurographie zur Diagnostik und zur Verlaufsbegutachtung eines KTS nach erfolgter Operation gut geeignet scheint. Die Ultraschalluntersuchung konnte durch Messung der Querschnittsfläche des N. medianus innerhalb des Karpaltunnels in Zusammenschau mit der klinischen Symptomatik die Diagnose Karpaltunnelsyndrom ermöglichen. Sie ist schnell und für den Patienten im Vergleich zur Elektroneurographie angenehmer durchführbar. Es existieren bislang allerdings keine einheitlichen Referenzwerte für die Querschnittsfläche des N. medianus, die eine standardisierte Untersuchung ermöglichen würde. Der direkte Seitenvergleich ist z.b. auf Grund beidseitigen Befalls jedoch nicht immer möglich. Somit kann die Ultraschalluntersuchung zur Diagnostik eines Karpaltunnelsyndroms zwar beitragen, ist mangels einheitlicher Referenzwerte aber zur Zeit noch erschwert einsetzbar.
4 Für Lea
5 Inhalt 1. Einleitung Definition des Karpaltunnelsyndroms Anatomie Pathogenese Ursachen und Risikofaktoren Vorkommen und klinisches Bild Diagnostik Therapie Differentialdiagnosen Komorbiditäten Problematik und Zielsetzung Methodik Studiendesign Patientenkollektiv Untersuchungsablauf Elektrophysiologische Untersuchung Klinische Untersuchung Ultraschalluntersuchung Datenverarbeitung und statistische Auswertung Ergebnisse Elektrophysiologische Untersuchung Distal-motorische Latenz Sensible Nervenleitgeschwindigkeit Kraftmessung, Schmerzstärke und Provokationstests Handdynamometermessung Schmerzstärke Provokationstests Ultraschalluntersuchung Beweglichkeit des N. medianus innerhalb des Karpaltunnels Querschnittsfläche des Nervus medianus Zusammenfassung der Ultraschallergebnisse Diskussion Diskussion der Studienergebnisse Fazit und Ausblick Zusammenfassung Literaturverzeichnis Anhang
6 Abkürzungsverzeichnis ENG Elektroneurographie cm Zentimeter CT Computertomographie dml distal-motorische Latenz KTS Karpaltunnelsyndrom Lig. Ligamentum M. Musculus MRT Magnetresonanztomographie ms Millisekunde m/s Meter pro Sekunde mv Millivolt N. Nervus NLG Nervenleitgeschwindigkeit PNP Polyneuropathie R. Ramus s. Sekunde 6
7 Tabellenverzeichnis Seite Tabelle 1: Einschluss- und Ausschlusskriterien der KTS-Studie 40 Tabelle 2: Distal-motorische Latenz, operierte Hand 51 Tabelle 3: Distal-motorische Latenz, operierte Hand; Vergleich: präoperativ vs. postoperativ 52 Tabelle 4: Distal-motorische Latenz, nicht operierte Hand. 54 Tabelle 5: Distal-motorische Latenz, nicht operierte Hand; Vergleich: präoperativ vs. postoperativ 55 Tabelle 6: Distal-motorische Latenz; Vergleich: operiert vs. nicht operiert 55 Tabelle 7: Sensible Nervenleitgeschwindigkeit, operierte Hand 56 Tabelle 8: Sensible Nervenleitgeschwindigkeit, operierte Hand Vergleich: präoperativ vs. postoperativ 58 Tabelle 9: Sensible Nervenleitgeschwindigkeit, nicht operierte Hand 58 Tabelle 10: Sensible Nervenleitgeschwindigkeit, nicht operierte Hand Vergleich: präoperativ vs. postoperativ Tabelle 11: 59 Sensible Nervenleitgeschwindigkeit; Vergleich: operiert vs. nicht operiert 60 Tabelle 12: Handdynamometermessung, operierte Hand 62 Tabelle 13: Handdynamometermessung; Vergleich: präoperativ vs. postoperativ 63 Tabelle 14: Handdynamometermessung, nicht operierte Hand 63 Tabelle 15: Handdynamometermessung; Vergleich: präoperativ vs. postoperativ 64 Tabelle 16: Handdynamometermessung; Vergleich: operiert vs. nicht operiert 65 Tabelle 17: Schmerzstärke 66 Tabelle 18: Schmerzstärke; Vergleich präoperativ vs. postoperativ 67 Tabelle 19: Phalen-Test, prozentuale Verteilung 68 Tabelle 20: Hoffmann-Tinel-Zeichen, prozentuale Verteilung 69 Tabelle 21: Beweglichkeit des N. medianus, operierte Hand 70 Tabelle 22: Beweglichkeit des N. medianus, operierte Hand Tabelle 23: Vergleich: präoperativ vs. postoperativ 71 Beweglichkeit des N. medianus, nicht operierte Hand 72 7
8 Tabelle 24: Beweglichkeit des N. medianus, nicht operierte Hand Vergleich: präoperativ vs. postoperativ Tabelle 25: Beweglichkeit des N. medianus; Vergleich operiert vs. nicht operiert Tabelle 26: 74 Querschnittsfläche des N. medianus, operierte Hand 4 cm proximal der Rascetta; Vergleich: präoperativ vs. postoperativ Tabelle 28: 76 Querschnittsfläche des N. medianus, nicht operierte Hand 4 cm proximal der Rascetta; Vergleich: präoperativ vs. postoperativ Tabelle 30: 79 Querschnittsfläche des N. medianus, operierte Hand 2 cm proximal der Rascetta; Vergleich: präoperativ vs. postoperativ Tabelle 33: 81 Querschnittsfläche des N. medianus, nicht operierte Hand 2 cm proximal der Rascetta; Vergleich: präoperativ vs. postoperativ Tabelle 35: 84 Querschnittsfläche des N. medianus, operierten Hand auf Höhe der Rascetta; Vergleich: präoperativ vs. postoperativ Tabelle 38: 86 Querschnittsfläche des N. medianus, nicht operierte Hand auf Höhe der Rascetta; Vergleich: präoperativ vs. postoperativ Tabelle 40: 85 Querschnittsfläche des N. medianus, nicht operierte Hand auf Höhe der Rascetta Tabelle 39: 82 Querschnittsfläche des N. medianus, operierte Hand auf Höhe der Rascetta. Tabelle 37: 82 Querschnittsfläche des N. medianus 2 cm proximal der Rascetta; Vergleich: operiert vs. nicht operiert Tabelle 36: 80 Querschnittsfläche des N. medianus, nicht operierte Hand 2 cm proximal der Rascetta Tabelle 34: 78 Querschnittsfläche des N. medianus, operierte Hand 2 cm proximal der Rascetta Tabelle 32: 77 Querschnittsfläche des N medianus 4 cm proximal der Rascetta; Vergleich: operiert vs. nicht operiert Tabelle 31: 75 Querschnittsfläche des N. medianus, nicht operierte Hand 4 cm proximal der Rascetta. Tabelle 29: 73 Querschnittsfläche des N. medianus, operierte Hand 4 cm proximal der Rascetta Tabelle 27: Querschnittsfläche des N. medianus auf Höhe der Rascetta; Vergleich: operiert vs. nicht operiert 8 87
9 Tabelle 41: Querschnittsfläche des N. medianus, operierte Hand 1 cm distal der Rascetta Tabelle 42: 89 Querschnittsfläche des N. medianus, operierte Hand 1 cm distal der Rascetta; Vergleich: präoperativ vs. postoperativ Tabelle 43: Querschnittsfläche des Nervus medianus, nicht operierte Hand 1 cm distal der Rascetta Tabelle 44: 90 Querschnittsfläche des N. medianus, nicht operierte Hand 1 cm distal der Rascetta; Vergleich: präoperativ vs. postoperativ Tabelle 45: 92 Querschnittsflächen des N. medianus, operierte Hand Vier Ultraschallebenen Tabelle 47: 91 Querschnittsfläche des Nervus medianus 1 cm distal der Rascetta; Vergleich: operiert vs. nicht operiert Tabelle 46: Querschnittsflächen des N. medianus, nicht operierte Hand Vier Ultraschallebenen 93 9
10 Abbildungsverzeichnis Seite Abbildung 1: Abgangsvariationen des R. thenaris des Nervus medianus 15 Abbildung 2: Knochen und Bandstrukturen des Canalis carpi 16 Abbildung 3: Proximaler Karpaltunnel im Querschnitt 17 Abbildung 4: Distaler Karpaltunnel im Querschnitt 17 Abbildung 5: Karpalkanal 18 Abbildung 6: Thenaratrophie bei langjährig bestehendem KTS 23 Abbildung 7: Phalen-Test 27 Abbildung 8: Schienenbehandlung bei Karpaltunnelsyndrom 29 Abbildung 9: KTS-Operation 31 Abbildung 10: KTS-Operation; Hautinzision 31 Abbildung 11: KTS-Operation; Präparation in die Tiefe 32 Abbildung 12: KTS-Operation; Darstellung des N. medianus 32 Abbildung 13: KTS-Operation; Verschluss der Wunde 33 Abbildung 14: Dermatome C6 und C7 34 Abbildung 15: Sensible Innervationsgebiete der Hand; Nerven und Dermatome 34 Abbildung 16: Dantec Neuromatic 2000M 41 Abbildung 17: Handdynamometermessung 42 Abbildung 18: Sonosite Micromaxx 43 Abbildung 19: Ultraschall Ebene 1 44 Abbildung 20: Ultraschall Ebene 2 44 Abbildung 21: Ultraschall Ebene 3 44 Abbildung 22: Ultraschall Ebene 4 44 Abbildung 23: Ultraschallebenen, anatomisches Präparat. 45 Abbildung 24: Ultraschallebenen, anatomisches Präparat. 45 Abbildung 25: Ultraschallbild des Karpaltunnels 46 Abbildung 26: Darstellung des Karpaltunnels, transversale Schnittführung. 46 Abbildung 27: Altersverteilung der Studienpopulation 49 Abbildung 28: Geschlechterverteilung der Studienpopulation 50 Abbildung 29: Distal-motorische Latenz, operierte Hand, Boxplots 52 Abbildung 30: Mittelwerte der distal-motorischen Latenz, operierte Hand 53 Abbildung 31: Distal-motorische Latenz, nicht operierte Hand, Boxplots 54 Abbildung 32: Distal-motorische Latenz; Vergleich: operiert vs. nicht operiert 56 Abbildung 33: Sensible Nervenleitgeschwindigkeit, operierte Hand, Boxplots 10 57
11 Abbildung 34: Sensible Nervenleitgeschwindigkeit, Median, operierte Hand 57 Abbildung 35: Sensible Nervenleitgeschwindigkeit, nicht operierte Hand, Boxplots 59 Abbildung 36: Sensible Nervenleitgeschwindigkeit. Mediane Vergleich: operiert vs. nicht operiert, Liniendiagramm 60 Abbildung 37: Sensible Nervenleitgeschwindigkeit. Mediane Vergleich: operiert vs. nicht operiert, Balkendiagramm 61 Abbildung 38: Handdynamometermessung, operierte Hand, Boxplots 62 Abbildung 39: Handdynamometermessung, nicht operierte Hand, Boxplots 64 Abbildung 40: Handdynamometermessung, Vergleich operiert vs. nicht operiert, Balkendiagramm 65 Abbildung 41: Handdynamometermessung Vergleich: operiert vs. nicht operiert, Liniendiagramm 66 Abbildung 42: Schmerzstärke im zeitlichen Verlauf 67 Abbildung 43: Phalen-Test; Prozentuale Verteilung 68 Abbildung 44: Hoffmann-Tinel-Zeichen; Prozentuale Verteilung 69 Abbildung 45: Beweglichkeit des N. medianus im Karpaltunnel, operierte Hand 71 Abbildung 46: Beweglichkeit des N. medianus im Karpaltunnel, nicht operierte Hand 72 Abbildung 47: Beweglichkeit des Nervus medianus im Karpaltunnel; Vergleich: operiert vs. nicht operiert, Balkendiagramm 73 Abbildung 48: Beweglichkeit des N. medianus im Karpaltunnel; Vergleich: operiert vs. nicht operiert, Liniendiagramm 74 Abbildung 49: Querschnittsfläche des N. medianus, operierte Hand 4 cm proximal der Rascetta, Boxplots 75 Abbildung 50: Querschnittsfläche des N. medianus, operierte Hand 4 cm proximal der Rascetta, Liniendiagramm 76 Abbildung 51: Querschnittsfläche des N. medianus, nicht operierten Hand 4 cm proximal der Rascetta, Boxplots 77 Abbildung 52: Querschnittsfläche des N. medianus 4 cm proximal der Rascetta; Vergleich: operiert vs. nicht operiert 78 Abbildung 53: Querschnittsfläche des N. medianus, operierte Hand 2 cm proximal der Rascetta, Boxplots 79 Abbildung 54: Querschnittsfläche des N. medianus, operierte Hand 2cm proximal der Rascetta; Liniendiagramm 11 80
12 Abbildung 55: Querschnittsfläche des N. medianus, nicht operierte Hand 2 cm proximal der Rascetta, Boxplots 81 Abbildung 56: Querschnittsfläche des N. medianus 2cm proximal der Rascetta; Vergleich: operiert vs. nicht operiert Abbildung 57: Querschnittsfläche des Nervus medianus, operierte Hand auf Höhe der Rascetta, Boxplots Abbildung 58: Querschnittsfläche des Nervus medianus, operierte Hand auf Höhe der Rascetta, Liniendiagramm 85 Abbildung 59: Querschnittsfläche des N. medianus, nicht operierte Hand auf Höhe der Rascetta, Boxplots 86 Abbildung 60: Querschnittsfläche des Nervus medianus auf Höhe der Rascetta; Vergleich: operiert vs. nicht operiert 88 Abbildung 61: Querschnittsfläche des Nervus medianus, operierte Hand 1 cm distal der Rascetta, Boxplots 89 Abbildung 62: Querschnittsfläche des N. medianus, nicht operierte Hand 1 cm distal der Rascetta, Boxplots 91 Abbildung 63: Querschnittsfläche des N. medianus 1 cm distal der Rascetta; Vergleich: operiert vs. nicht operiert 92 Abbildung 64: Querschnittsflächen des N. medianus, operierte Hand Vier Ultraschallebenen 94 Abbildung 65: Querschnittsflächen des N. medianus, nicht operierte Hand Vier Ultraschallebenen 94 Abbildung 66: Querschnittsflächen des N. medianus; Vergleich: operiert vs. nicht operiert, 4 cm proximal der Rascetta 95 Abbildung 67: Querschnittsflächen des N. medianus; Vergleich: operiert vs. nicht operiert, 2 cm proximal der Rascetta 95 Abbildung 68: Querschnittsflächen des N. medianus; Vergleich: operiert vs. nicht operiert, auf Höhe der Rascetta 95 Abbildung 69: Querschnittsflächen des N. medianus; Vergleich: operiert vs. nicht operiert, 1 cm distal der Rascetta 12 95
13 1. Einleitung Das Karpaltunnelsyndrom ist das häufigste Nervenkompressionssyndrom eines peripheren Nervs und hat somit eine hohe klinische Relevanz. In der erwachsenen Bevölkerung wird eine Prävalenz von 2,5 % - 11% beschrieben 25, 28, 61. Die Inzidenz des KTS beträgt 0,125-1 % 6, 73, 83, 108. Bis zu 14,4 % der Allgemeinbevölkerung haben Symptome, die auf ein Karpaltunnelsyndrom (KTS) hinweisen 10. Die Patienten leiden unter typischen Schmerzen und Missempfindungen innerhalb der Hand, die initial meist nachts auftreten (Brachialgia parästhetica nocturna) und den Tag-Nacht-Rhythmus dadurch erheblich stören können 25. Familiäre Häufungen sind vermehrt zu beobachten (bis zu 40 %) und Frauen sind mit einem Verhältnis von 3:1 deutlich häufiger betroffen als Männer 7, 14, 39, 109. Das mittlere Erkrankungsalter bei Diagnosestellung liegt zwischen dem 45. und dem 54. Lebensjahr 39, 109. Das Karpaltunnelsyndrom kann beidseitig auftreten, die dominante Hand ist aber bevorzugt betroffen 15, 25, 45. In bis zu 50 % der Fälle ist dem neu aufgetretenen Karpaltunnelsyndrom keine direkte Ursache zuzuordnen und es handelt sich somit um ein idiopathisches KTS 6. In der Diagnostik des Karpaltunnelsyndroms gelten die ausführliche (Schmerz-)Anamnese sowie die inspektorische und palpatorische Begutachtung von Hand und Arm als wegweisende Untersuchungen. Die Diagnose wird somit primär klinisch gestellt und kann durch verschiedene Diagnostikverfahren bestätigt werden. Die Elektroneurographie (ENG) des N. medianus ist in diesem Zusammenhang die am weitesten verbreitete und etablierteste Untersuchung und wird in der KTS-Leitlinie der Arbeitsgemeinschaft Wissenschaftlicher Medizinischer Fachgesellschaften (AWMF) empfohlen 8. Auch die American Association of Electrodiagnostic Medicine (AAEM) rät zur elektrophysiologische Untersuchung des N. medianus 1. Die ENG wird zwar nicht einheitlich als Goldstandard angesehen 14, 28, 70, kommt aber in zahlreichen Studien als Referenzverfahren zum Einsatz 17, 57, 72, 86, da kein alternatives Verfahren mit einer höheren Aussagekraft (sowohl Sensitivität als auch Spezifität) existiert 9. Die hochauflösende Sonographie des N. medianus als bildgebendes Verfahren rückt im Rahmen der Diagnosebestätigung eines Karpaltunnelsyndroms zunehmend in den Mittelpunkt der Forschung. Sie ist im Gegensatz zu der ENG schnell und für den Patienten angenehm durchführbar und scheint in der Beurteilung eines Karpaltunnelsyndroms zunehmend aussagekräftiger zu werden 71, 72, 113, 119. Die vorliegende wissenschaftliche Untersuchung soll die hochauflösende 13
14 Sonographie des N. medianus der elektroneurographischen Untersuchung gegenüberstellen und Unterschiede sowie Vor- und Nachteile beider Verfahren beleuchten. 1.1 Definition des Karpaltunnelsyndroms Beim Karpaltunnelsyndrom (KTS) handelt es sich um ein Beschwerdebild aufgrund einer Druckschädigung des N. medianus (Mittelnerv) im Karpalkanal (knöchern - bindegewebiger Kanal an der Handwurzel) durch ein Missverhältnis zwischen Weite und Inhalt des Tunnels mit dem Leitsymptom einschlafender Hände im MedianusVersorgungsgebiet 8. Synonyme: Distales Medianuskompressionssyndrom, Handgelenkstunnelsyndrom, Brachialgia paraesthetica nocturna. 1.2 Anatomie Nervus medianus Der Nervus medianus entspringt aus dem Fasziculus medialis und dem Fasziculus lateralis des Plexus brachialis. Er führt Nervenfasern aus den Segmenten C6 bis Th1. Der N. medianus ist ein gemischt motorisch-sensibler Nerv. Seine sensiblen Anteile stammen aus den Segmenten C6 und C7, seine motorischen Fasern erhält der Nerv aus C6 bis Th1. Die beiden Hauptstämme des N. medianus bilden im Bereich der Axilla die sogenannte Medianusgabel bzw. -schlinge, in der die A. axillaris verläuft. Am Oberarm liegt der N. medianus im Sulcus biccipitalis medialis und folgt der A. brachialis zunächst lateral. Auf Höhe der Insertionsstelle des M. coracobrachialis überkreuzen sich Arterie und Nerv. Der N. medianus folgt der A. brachialis von nun an medial gelegen nach distal und passiert so auch die Ellenbeuge. Am Unterarm tritt der N. medianus zunächst durch die beiden Köpfe des M. pronator teres und verläuft dann nach Abgabe des N. interosseus (antebrachii) anterior zwischen den tiefen und den oberflächigen Fingerbeugern in Richtung Handgelenk. Im Bereich des distalen Drittels des Unterarms steigt der N. medianus aus der Tiefe auf und zieht oberflächlich weiter Richtung 14
15 Karpalkanal. Proximal des Retinaculum flexorum gibt der N. medianus den Ramus palmaris ab, der sensibel die Haut im Bereich des Thenars und der radialen Hohlhand innerviert. Der Ramus palmaris N. medianus verläuft oberflächlich als einzelner Ast oder in mehrere Äste aufgeteilt zum Thenar und kann in seinem Verlauf das Retinaculum flexorum perforieren 7. Unmittelbar distal des Karpalkanals geht der Ramus thenaris aus dem N. medianus hervor, zieht zur Thenarmuskulatur und innerviert diese motorisch. Abbildung 1: Abgangsvariationen des R. thenaris des N. medianus. Variationen und Häufigkeiten, 96. Der Nervus medianus verläuft gemeinsam mit den Sehnen des M. digitorum profundus, des M. digitorum superficialis sowie der Sehne des M. pollicis longus durch den Karpaltunnel zum mittleren Fach der Hohlhand. Unmittelbar distal des Retinaculum flexorum teilt er sich in seine Endäste auf (Nn. digitalis palmaris communis, Nn digitalis palmaris proprii, R. thenaris N. medianus) und versorgt dort motorisch die laterale Thenarmuskulatur (M. abductor pollicis brevis, M. opponens pollicis) sowie sensibel die radialseitige Hohlhand und die palmare Seite von Strahl I-III. Der dorsale Bereich der Mittel- und Endglieder von Strahl I-IV wird sensibel ebenfalls durch den N. medianus innerviert. Die Sensibilität von Strahl IV wird radialseitig durch den N. medianus und ulnarseitig durch den N. ulnaris gewährleistet. Canalis Carpi (Karpaltunnel, Karpalkanal) Der Karpaltunnel ist ein osteofibröser Kanal, der durch verschiedene anatomische Strukturen gebildet wird. Dorsalseitig wird der Kanal durch die Handwurzelknochen (Ossa 15
16 carpi) und palmarseitig durch das Retinaculum mm. flexorum (Lig. carpi transversum) begrenzt. Ossa carpi Proximale Reihe (von radial nach ulnar): Os scaphoideum (Kahnbein), Os lunatum (Mondbein), Os triquetrum (Dreiecksbein), Os pisiforme (Erbsenbein). Distale Reihe (von radial nach ulnar): Os trapezium (großes Vieleckbein), Os trapezoideum (kleines Vieleckbein), Os capitatum (Kopfbein), Os hamatum (Hakenbein). Der Boden des Canalis carpi wird durch das Os hamatum, das Os capitatum und das Os trapezoideum gebildet. Ulnarseitig befindet sich die Eminentia carpi ulnaris (Hamulus ossis hamati und Os pisiforme) und radialseitig wird der Kanal durch die Eminentia carpi radialis (Tuberculum ossis trapezii und Tuberculum ossis scaphoidei) begrenzt. Abbildung 2: Knochen und Bandstrukturen des Canalis carpi,
17 Das Retinaculum mm. flexorum spannt sich von der Eminentia carpi ulnaris zur Eminentia carpi radialis 22. Die Dicke des Retinaculums misst proximal und distal ca. 0,6 mm und in der Mitte bis zu 1,6 mm 96. Abbildung 3: Proximaler Karpaltunnel im Querschnitt, 96 S: Os scaphoideum C: Os capitatum Tri: Os triquetrum P: Os pisiforme Abbildung 4: distaler Karpaltunnel im Querschnitt, 96 MI: Os metacarpale I T: Os trapezium C: Os capitatum H: Os hamatum 17 H: Os hamatum t: Os trapezoideum Var.: Os hamati proprium
18 Durch den Canalis carpi verlaufen folgende Strukturen: N. medianus, vier Sehnen des M. flexor digitorum profundus, vier Sehnen des M. flexor digitorum superficialis, M. flexor pollicis longus. Abbildung 5: Karpalkanal; 1: Canalis carpi; 2: A. u. N. ulnaris; 3: Hypothenarmuskulatur; 4: Os hamatum; 5: Thenarmuskulatur; 6: Retinaculum flexorum; 7: N. medianus; 8: Os metacarpale I; 9: Flexor pol. longus, Flexor dig. sup.; 10: A. radialis; 11: Os trapezium, Os trapezoideum; 12: Os capitatum, 92 Der Bereich über der Reihe der distalen Handwurzelknochen bildet die engste Stelle des Canalis Carpi (ca. 1,6 cm² 56, 96) und ist somit besonders relevant für die Entstehung eines Karpaltunnelsyndroms. 18
19 1.3 Pathogenese Durch ein Missverhältnis zwischen vorhandenem Raum im Canalis carpi und dem Volumen der ihn durchlaufenden Strukturen kann es zur Kompression des N. medianus mit konsekutiver Schädigung kommen. Patienten, die an einem Karpaltunnelsyndrom leiden, haben je nach Stellung der Hand und des Handgelenks stark erhöhte Druckverhältnisse innerhalb des Karpaltunnels. Die Drücke schwanken zwischen 32 und 100 mmhg. Bei gesunden Patienten herrschen Drücke zwischen 2 und 31 mmhg 14. Das Bild eines Karpaltunnelsyndroms kommt zustande, wenn die Blutversorgung der Nervenhüllen des N. medianus durch diesen erhöhten Druck beeinträchtigt wird. Dies führt zu einer Nervenschädigung, die im Anfangsstadium meist noch reversibel ist. Begünstigend für die Entstehung eines KTS wirkt sich ein anatomisch primär enger, als konstitutionelle Variante anzusehender Karpalkanal 55 aus. Kommt es durch verschiedene Ursachen (s. 1.4) zu einer Schwellung der Sehnenscheiden oder zu anderen raumfordernden Prozessen, führt dies zu einer Drucksteigerung innerhalb des Karpalkanals. In den meisten Fällen ist diese Drucksteigerung allerdings nicht auf eine bestimmte Ursache zurückzuführen und es handelt sich somit um ein idiopathisches KTS. Durch den chronisch erhöhten Druck in dem engen Karpalkanal kommt es zu einer Minderperfusion der Venolen des Epi- und Perineuriums. In späteren Stadien sind auch die Kapillaren und die den N. medianus versorgenden Arteriolen betroffen 7, 8. Es folgt eine Ischämie des Nervs mit darauf folgendem intraneuralem Ödem 6, 101. Die dadurch hervorgerufene Demyelinisierung des Nervs 55, 64 und letztendliche Axonschädigung 14 betrifft zuerst die markhaltigen Nervenfasern 64. Ettema et al. und Pickering et al. haben zudem pathologische Veränderungen in dem die Beugesehnen umgebenden Bindegewebe nachweisen können 37, 85. Bei den betroffenen Patienten kommt es zu einer Herabsetzung der Nervenleitgeschwindigkeit und klinisch zu Kribbel-Parästhesien, Taubheitsgefühlen und Schmerzen der Finger I-III (IV). Die vorerst noch reversiblen Veränderungen des N. medianus werden bei zeitlichem Fortbestehen der Druckerhöhung durch Einsprossung von Fibroblasten zunehmend irreversibel 37, sodass eine frühzeitige (operative) Entlastung des Nervs angestrebt werden sollte 7, 8. 19
20 1.4 Ursachen und Risikofaktoren Dem Karpaltunnelsyndrom liegt häufig eine anatomische als konstitutionelle Variante anzusehende Enge des Karpalkanals zu Grunde 13, 16, 55. Diese konstitutionelle Verengung verursacht meist erst dann Beschwerden im Sinne eines KTS, wenn es zu einer Volumenzunahme innerhalb des Karpaltunnels kommt. Auch geringe Volumenzunahmen können ausreichen, um Symptome zu verursachen 8. Aus diesem Grund können als Ursache für ein KTS alle Erkrankungen angesehen werden, die zu einer Veränderung des Verhältnisses zwischen Inhalt und vorhandenem Raum innerhalb des Karpaltunnels führen. Folgende Ursachen kommen für ein Karpaltunnelsyndrom in Frage 2, 6, 8, 29, 75, 93: - Trauma des distalen Radius oder der Handwurzelknochen, - Handwurzelluxationen, - Stoffwechselerkrankungen: Hypothyreose, Akromegalie, Gicht u. a., - Erkrankungen des rheumatischen Formenkreises, die mit einer Schwellung und/ oder Entzündung der Sehnen bzw. Sehnenscheiden der Fingerbeuger einhergehen (z.b. rheumatoide Arthritis), - Gravidität (v.a. letztes Trimenon), - Handgelenksarthrose, - Dialyse (bei Dialysepatienten kann es zu vermehrten Wassereinlagerungen und zur Amyloidose der Beugesehnen kommen), - Raumforderungen innerhalb des Karpaltunnels (Zysten, Ganglien, Lipome, Osteophyten), - überlastungsbedingte Schwellung der Sehnen im Karpaltunnel, - vibrationsbedingte Schädigung des N. medianus (z. B. durch regelmäßige Tätigkeit mit Maschinen, die starke Vibrationen erzeugen; Presslufthammer u. ä.), - schwere körperliche Arbeit, repetitive Bewegungsabläufe der Hand, - Entzündungen der Hand, Handphlegmone (akutes KTS). Insgesamt betrachtet ist allerdings das idiopathische Karpaltunnelsyndrom mit bis zu 50 % die weitaus häufigste Erscheinungsform 6, 91. Folgende anatomische Variationen des Karpalkanals beziehungsweise der ihn durchlaufenden Strukturen können ein Karpaltunnelsyndrom bedingen oder begünstigen: 20
21 - Anatomische Variante des Os hamatum 21, - Muskelbäuche der Fingerflexoren im Karpaltunnel (akzessorisch oder bis in den Karpaltunnel reichend) 7, 114, 118, - persistierende A. mediana antebrachii mit hoher Teilung des N. medianus 31, Vorkommen und klinisches Bild Das Karpaltunnelsyndrom ist das häufigste Nervenkompressionssyndrom eines peripheren Nervs. Bis zu 14,4 % der Bevölkerung klagen über Schmerzen, Taubheitsgefühle oder Kribbelparästhesien im Bereich des sensiblen Versorgungsgebietes des N. medianus 10, 44. Das mittlere Erkrankungsalter liegt zwischen 46 und 54 Jahren 39, 108, 109. Ein weiterer Altersgipfel wurde von Bland et al. zwischen dem 75 und 84 Lebensjahr beschrieben 15. Das Karpaltunnelsyndrom kann sich als akute oder chronische Erscheinungsform manifestieren. Die akute Form ist relativ selten und wird durch einen raschen Anstieg des Druckniveaus im Karpaltunnel ausgelöst 11. Diese akute Drucksteigerung kann z. B. durch distale Radiusfrakturen oder Entzündungen der Hand (Handphlegmone) ausgelöst werden 6, 98. Die chronische Form des KTS kann sich über Monate und Jahre hinweg mit langsamer Progredienz manifestieren und lässt sich auf einen langsamen Anstieg des Drucks innerhalb des Karpaltunnels zurückführen, der idiopathisch (ca. 50%) oder durch unter 1.4 genannte Ursachen bedingt sein kann % der nicht traumatischen Nervenläsionen des N. medianus sind auf ein KTS zurückzuführen 86. Der Großteil der Patienten, die sich wegen des Verdachts auf ein Karpaltunnelsyndrom vorstellen, berichtet über typische klinische Symptome, die je nach Ausprägung pathognomonisch für ein Karpaltunnelsyndrom sind. Initial treten, meist nächtliche, Parästhesien im sensiblen Versorgungsgebiet des N. medianus auf (Brachialgia paraesthetica nocturna), die die Patienten als Taubheitsgefühl ( Einschlafen ), Kribbeln oder Spannung innerhalb der Hand beschreiben 14. Die Endphalangen der Finger I-III sind meist zuerst betroffen. Die soeben genannten Parästhesien führen in fortgeschrittenen Stadien eines KTS zu nächtlichem Erwachen und bessern sich erst, wenn die Patienten die Lageposition der betroffenen Hand ändern, aus dem Bett aufstehen oder die betroffene Hand ausschütteln 21
22 26. Das Ausschütteln geschieht meist durch rasches Flektieren und Extendieren der Hand (Flicking), wodurch es zu einem wechselnden Druckniveau im Karpaltunnel und somit zu einer Förderung der Durchblutung des N. medianus (s. 1.3) und einer Besserung der Beschwerden kommen kann 48. Dieses Flicking zur Beschwerdebesserung in der Anamnese ist nahezu pathognomonisch für ein KTS und korreliert in bis zu 93% mit pathologischen Veränderungen in der elektroneurographischen Untersuchung 67, 88. Besonders häufig treten die Beschwerden nach starker körperlicher Belastung am Vortag (Gartenarbeit, Renovierungsarbeiten etc.) oder bei Patienten auf, die einen Beruf mit schwerer körperlicher Arbeit ausüben 115. Die anfänglichen Missempfindungen gehen bei Fortbestehen des KTS zunehmend in Schmerzen über. Da es bei einem deutlich ausgeprägten KTS zu rezidivierenden Beschwerden innerhalb einer Nacht kommen kann, ist der Nachtschlaf erheblich beeinträchtigt und die Patienten empfinden die daraus resultierende Tagesmüdigkeit als starke Belastung im Alltag. Viele Patienten klagen über eine Morgensteifigkeit der Finger und über eine deutliche Einschränkung der Feinmotorik und Sensibilität, die sich vor allem beim Knöpfen von Kleidungsstücken, Nähen oder Ergreifen von kleinen Gegenständen bemerkbar macht 76. Die rheumatoide Arthritis ist bei der soeben beschriebenen klinischen Symptomatik differentialdiagnostisch stets in Erwägung zu ziehen beziehungsweise abzugrenzen, da sich die Beschwerdebilder beider Erkrankungsbilder gleichen oder ähneln können. Bei Vorliegen eines KTS sind die Dysästhesien bzw. Schmerzen jedoch zumeist auf das Versorgungsgebiet des N. medianus beschränkt. Die Sensibilität im Bereich des Thenars hingegen kann auch in fortgeschrittenen Stadien eines KTS noch erhalten sein, da der R. palmaris des N. medianus proximal des Karpalkanals seinen Ursprung hat und deshalb durch die Kompression und Reizung des N. medianus im Karpaltunnel nicht oder erst spät beeinträchtigt wird. Die Schweißproduktion im Versorgungsgebiet des N. medianus kann eingeschränkt sein (Ninhydrintest) 45. Da die dünnen, nicht myelinisierten vegetativen Fasern weniger empfindlich gegenüber Druckbelastungen sind, kommt es erst in späteren Stadien oder bei längerem Fortbestehen des KTS zu Einschränkungen der vegetativen Funktion. In seltenen Fällen können trophische Störungen der Nägel und Fingerkuppen im Sinne eines AfföldiZeichens im sensiblen Versorgungsgebiet des N. medianus auftreten 7. Die Propriozeption und die Kraft des Faustschlusses können vermindert sein, so dass die Betroffenen Schwierigkeiten haben, Gegenstände festzuhalten oder zu erfühlen. Der Faustschluss ist bei Patienten mit ausgeprägtem KTS häufig nur inkomplett möglich 7, 45, 22
23 76. Bei ausgeprägtem und lang bestehendem Karpaltunnelsyndrom kommt es zu einer lateralen Thenaratrophie, da der M. abductor pollicis und M. opponens pollicis durch den geschädigten N. medianus (Ramus thenaris) vermindert innerviert werden 7, 69, 105. Diese isolierte laterale Thenaratrophie darf nicht mit einer Inaktivitätsatrophie des gesamten Thenars, wie sie zum Beispiel bei ausgeprägter Rhizarthrose auftreten kann, verwechselt werden 7. Abbildung 6: Thenaratrophie ( ) bei langjährig bestehendem KTS einer 80 jährigen Patientin Durch die Schädigung beziehungsweise die Atrophie der beiden oben genannten Muskeln kann es bei Patienten mit KTS zu einer Abduktions- und Oppositionsschwäche des Daumens kommen. Wenn die Beschwerden persistieren, progredient sind oder motorische Ausfälle im Sinne der soeben beschriebenen Abduktion- bzw. Oppositionsschwäche hinzukommen, sollten weiterführende Diagnostiken und Therapien eingeleitet werden. 1.6 Diagnostik Für die Diagnostik eines Karpaltunnelsyndroms existiert derzeit kein klinischer Goldstandard 28, 107. Ausführliche anamnestische Erhebungen und klinische Untersuchungen des Patienten gelten als wegweisend 14. Die von den Patienten berichteten Beschwerden sind meist typisch und nahezu pathognomonisch (Brachialgia parästhetica nocturna, s. 1.5) 14 und es lässt sich in Zusammenschau mit klinischen Testungen (Phalen-Test, Tinel-Zeichen u. a.) die Diagnose Karpaltunnelsyndrom häufig 23
24 bereits nach gründlicher Untersuchung und Befragung des Patienten stellen 6, 17, 40, 54. Dennoch kommen im klinischen Alltag verschiedene Verfahren zur Diagnosesicherung zum Einsatz, die vor allem bei milden und/oder unklaren Fällen eines KTS hilfreich sind. Das etablierteste und am häufigsten angewandte Verfahren ist die elektrophysiologische Untersuchung des N. medianus der betroffenen Hand. Die deutschen Gesellschaften für Handchirurgie, Neurochirurgie, Neurologie und Orthopädie sowie die American Association of Electrodiagnostic Medicine (AAEM) raten zur Durchführung einer elektrophysiologischen Untersuchung bei Verdacht auf ein Karpaltunnelsyndrom 1, 8. Als ein weiteres Verfahren zur Diagnosebestätigung eines KTS ist die hochauflösende Sonographie des Nervus medianus zu nennen, deren klinischer Einsatz seit einigen Jahren erforscht und diskutiert wird 72. Die hochauflösende Magnetresonanztomographie (MRT) kann zur Diagnostik des Karpaltunnelsyndroms ebenfalls eingesetzt werden, findet allerdings wegen des im Vergleich zur Elektroneurographie oder aber des hochauflösenden Ultraschalls hohen klinischen und auch finanziellen Aufwands, meist nur bei spezieller Indikation Anwendung (Rezidiv-KTS, erschwerte Diagnosestellung etc.). Elektrophysiologische Untersuchung Mit Hilfe der elektrophysiologischen Untersuchung lässt sich das Vorliegen eines KTS nachweisen sowie der Schweregrad der Erkrankung bestimmen bzw. abschätzen 57. Bei der Untersuchung sollten einige Rahmenbedingungen gegeben sein, um laut der deutschen Gesellschaft für Klinische Neurophysiologie (DGKN) reproduzierbare Messwerte zu erhalten 7: Einsatz geeigneter geeichter EMG-Geräte der MedGV entsprechend Hinreichende Expertise des Untersuchers (z. B. EMG-Zertifikat der DGKN) Beachtung der empfohlenen Geräteeinstellungen Messung ggf. Korrektur der Hauttemperatur Exakte Messung der Distanzen. Über Reizstromimpulse, die von Elektroden, die auf die Haut geklebt werden, ausgesandt und von Referenzelektroden gemessen werden, lassen sich verschiedene Parameter messen, die bei Vorliegen eines KTS pathologisch verändert sein können. Zwei der wichtigsten Parameter für die Diagnosesicherung sind die sensible Nervenleitgeschwindigkeit und die distal-motorische Latenz des N. medianus. Die sensible 24
25 Nervenleitgeschwindigkeit (NLG) ist bei Vorliegen eines Karpaltunnelsyndroms auf Grund der kompressionsbedingten Demyelinisierung des Nervs herabgesetzt 7. Kommt es in fortgeschrittenen Stadien zu einem Axonschaden sind auch die ermittelten Amplituden vermindert. Die sensible Nervenleitgeschwindigkeit hat eine Sensitivität von 65 % und eine Spezifität von 98 %. Die distal-motorische Latenz weist eine Sensitivität von 63 % und eine Spezifität von 98 % auf 1. Ist mit Hilfe der beiden soeben genannten Parameter die Diagnose des KTS nicht eindeutig zu sichern, sind zusätzliche Parameterbestimmungen und Messverfahren möglich und sollten in diesen Fällen als erweiterte elektrophysiologische Diagnostik durchgeführt werden 1. Eine Diagnosesicherung ist mit Hilfe der verschiedenen bestimmbaren Parameter häufig möglich und gleichzeitig können andere Erkrankungen wie z. B. die Polyneuropathie oder das Sulcus ulnaris-syndrom ausgeschlossen werden. Trotz der in vielen Fällen möglichen Diagnosesicherung sind bei 16 bis 34 % der Patienten mit klinisch gesichertem KTS keinerlei pathologische Veränderungen in der elektrophysiologischen Untersuchung des N. medianus nachzuweisen 33, 62, 87. Deshalb ist es notwendig, alternative Verfahren zur Diagnosesicherung eines KTS nicht außer Acht zulassen. Höchauflösende Sonographie des N. medianus Die hochauflösende Ultraschalluntersuchung des N. medianus zur Diagnostik eines KTS hat in den letzten Jahren stark an Bedeutung zugenommen 12, 30, 72, 94. Buchberger et al. haben bereits im Jahre 1992 gezeigt, dass die Hochauflösende Sonographie als reliables Verfahren zur Diagnosefindung eines Karpaltunnelsyndroms eingesetzt werden kann 20. Sonographische Untersuchungen sind schnell und für den Patienten angenehm durchführbar und in vielen Kliniken und Praxen verfügbar. Außerdem kann die Sonographie am Krankenbett in einem Untersuchungsablauf mit der klinischen Untersuchung erfolgen. Die Diagnosestellung bzw. -bestätigung eines Karpaltunnelsyndroms würde somit vereinfacht 119 und für den Patienten angenehmer durchführbar 112. Rhamani et al. haben im Jahr 2011 nachweisen können, dass die Sonographie bei Patienten, die ein klinisch diagnostiziertes KTS aufweisen, aber einen physiologischen Befund in der ENG haben, zur Bestätigung der Diagnose beitragen kann 90. Der Nerv kann mittels Sonographie in seinem Verlauf dargestellt werden. Anatomische Besonderheiten (z.b. persistierende A. antebrachii) oder pathologische Veränderungen (Zysten, Tumore u.a.) können somit während der Untersuchung dargestellt bzw. ausgeschlossen werden. Da es sich bei der Ultraschalluntersuchung um ein dynamisches 25
26 Verfahren handelt, kann die Lage und Beweglichkeit des Nervs während aktiver und/oder passiver Bewegung von Fingern und Hand untersucht werden. In der Beurteilung des N. medianus können verschiedene Parameter ermittelt werden. Bei den drei bedeutsamsten handelt es sich um die Echogenität des Nervs, die bei vorliegendem KTS vermindert sein kann 7, die Bestimmung der Beweglichkeit innerhalb des Karpaltunnels und die Bestimmung der Querschnittsfläche des N. medianus 120. Es hat sich gezeigt, dass die Querschnittsfläche des N. medianus die höchste Aussagekraft zu haben scheint 51, 70, 94, 120. Die Bestimmung sollte im proximalen Karpaltunnel erfolgen, da der Nerv in diesem Bereich gut darstellbar ist und die Sensitivität und Spezifität in dieser Ebene am höchsten zu sein scheinen (Sensitivität: bis zu 89%; Spezifität bis zu 96 %) 34, 58, 72, 122. Laut Assmus et al. (2008) und Kele et al. (2003) sollte die Messung der Querschnittsfläche während der Untersuchung durch Umfahren des Nervs automatisch geschehen und nicht über die Bestimmung des anteroposterioren und mediolateralen Diameters des Nervs und anschließender Berechnung der Fläche als Ellipse erfolgen 7, 58. Moran et al. (2009) haben hingegen keinerlei statistisch signifikante Unterschiede zwischen beiden Verfahren ermitteln können 75. Problematisch im täglichen klinischen Alltag gestaltet sich jedoch die Tatsache, dass bislang keine einheitlichen Referenzwerte für die physiologische Querschnittsfläche des N. medianus existieren. Magnetresonanztomographie (MRT) und Computertomographie (CT) Der Einsatz der MRT ist in der Diagnostik eines KTS nur selten notwendig. Die Strukturen innerhalb des Karpaltunnels lassen sich zwar gut abgrenzen, die Diagnose eines KTS lässt sich aber meist über die klinische Untersuchung, die ENG und/oder die Sonographie stellen. Die MRT kommt vor allem bei therapieresistenten oder rezidivierenden Beschwerden nach erfolgter Retinakulum-Spaltung zum Einsatz 97. In der CT lassen sich die knöchernen Strukturen des Karpaltunnels gut darstellen. Sie wird bei Verdacht auf Frakturen oder Handwurzelluxationen, die je nach Lokalisation ebenfalls ein Karpaltunnelsyndrom verursachen können, eingesetzt 97. Klinische Untersuchung Wie weiter oben bereits aufgeführt, ist die klinische Untersuchung einer der wichtigsten Bestandteile der Diagnostik eines Karpaltunnelsyndroms. So können bei ausgeprägtem KTS bereits inspektorisch eine Thenaratropie oder atrophische Störungen der Hände im Seitenvergleich auffallen (s. 1.5). Als klinische Testungen kommen verschiedene 26
27 Verfahren zum Einsatz (Phalen-Test, Hoffmann-Tinel-Zeichen; Flaschentest, Extensionstest u. a.). Der Phalen-Test und das Hoffmann-Tinelsche Zeichen gehören zu den bekanntesten und am häufigsten angewandten Testungen 18, 66, 67 und sollen im Folgenden kurz vorgestellt werden. Phalen-Test Bei Durchführung des Phalen-Tests wird durch passive Flexion des Handgelenks der betroffenen Hand um 90 über 60 Sekunden eine Drucksteigerung innerhalb des Karpaltunnels provoziert. Durch diese Drucksteigerung kommt es zu einer Verschlechterung der Durchblutung des N. medianus und zu direkter Kompression des Nervs im Karpaltunnel. Die Nervenleitgeschwindigkeit wird vorübergehend und reversibel herabgesetzt 36 und die Symptome des KTS werden provoziert. Patienten, bei denen der Phalen-Test positiv ist, berichten über neu auftretende Kribbelparästhesien und Taubheitsgefühle sowie eventuelle Schmerzen, die in die Finger I-III ausstrahlen oder sich auf die Endphalangen dieser Finger beschränken. Die Sensitivität des Phalen-Tests wird mit 85% angegeben. Die Spezifität beträgt 89% 18. Abbildung 7: Durchführung des Phalen-Tests Hoffmann-Tinel-Zeichen Das Hoffmann-Tinelsche Zeichen wird ausgelöst beziehungsweise getestet, indem der Nervus medianus auf Höhe des Handgelenks, das sich in Neutralstellung befindet, durch den Untersucher beklopft wird. Kommt es zu elektrisierenden Missempfindungen oder Schmerzen, die in die Finger I-III ausstrahlen, ist das Zeichen als positiv zu werten. Das Hoffmann-Tinel-Zeichen wird in der Literatur mit einer Sensitivität von 67% und einer Spezifität von 68% angegeben
28 1.7 Therapie Es gibt mehrere Therapieansätze zur Behandlung des Karpaltunnelsyndroms. Alle zielen darauf ab, den Druck im Karpaltunnel zu senken. Die Kompression des N. medianus wird durch diese Drucksenkung reduziert und die Symptome werden so gelindert. Eine voranschreitende Schädigung des N. medianus soll durch die Therapien verhindert werden Die bis zu dem Zeitpunkt der Therapie aufgetretenen Veränderungen des Nervs können zu einem gewissen Prozentsatz, abhängig von Ursache und Dauer des KTS, reversibel sein. Es existieren viele Therapieansätze und Behandlungsmöglichkeiten eines Karpaltunnelsyndroms, die der Symptomatik und der wahrscheinlichsten Ursache des KTS individuell angepasst werden müssen. Therapiert wird abhängig von dem subjektiven Leidensdruck des Patienten und von der Ausprägung der Beschwerden, nicht jedoch ausschließlich nach elektroneurographischem Befund 7. Sind Grunderkrankungen (rheumatoide Arthritis, Hypothyreose etc, s. 1.4) als Ursache eruierbar oder wahrscheinlich, sollte der Fokus auf der Behandlung der Grunderkrankung liegen und eventuell mit therapeutischen Verfahren des KTS (Schienung, ggf. OP) kombiniert werden. Wenn andere Ursachen ausgeschlossen sind und -wie in einem Großteil der Fälle- ein idiopathisches Karpaltunnelsyndrom vorliegt, kommen mehrere Therapiemöglichkeiten in Frage. Drei Therapieformen werden zurzeit in der Behandlung eines KTS vor allem angewendet und werden in der AWMF-Karpaltunnelsyndrom-S3-Leitlinie besonders empfohlen 8, 104. Nächtliche Schienung des Handgelenks Als erste, nicht invasive und deshalb meist gut anwendbare Therapie kommt häufig eine Schiene zum Einsatz, die volar angelegt und nachts getragen wird. Durch Flexion und Extension des Handgelenks werden Drucksteigerungen im Karpaltunnel provoziert, die zu einer Verschlechterung der Durchblutung des N. medianus führen 80, 96. Die Schienung des Handgelenks verhindert ein nächtliches Beugen oder Strecken des Handgelenks. Die Durchblutung wird somit optimiert und die Symptome werden gemindert. Diese Methode ist gut anwendbar, kostengünstig und verschafft vielen Patienten vorerst eine Linderung der Beschwerden 116. Allerdings ist die Ursache des Karpaltunnelsyndroms nicht behoben und die Patienten können ein Rezidiv erleiden oder beschreiben eine Verschlechterung der Beschwerden, sobald die Schiene nicht mehr 28
29 getragen wird. Folglich ist meist ein nur vorübergehender Nutzen dieser Behandlungsmöglichkeit zu erwarten 79. Bei stärker ausgeprägten Symptomen oder bei langem Fortbestehen des KTS ist die nächtliche Schienung meist nicht mehr ausreichend und es muss über alternative Behandlungsmöglichkeiten nachgedacht werden. Kommt es zu einer Progredienz der Beschwerden oder zu motorischen Ausfällen, sollte zu operativen Behandlungen übergegangen werden. Abbildung 8: Schienenbehandlung bei Karpaltunnelsyndrom, 95 Lokale Kortikoidinfiltration in den Karpalkanal Die Kortikoidinfiltration in den Karpaltunnel führt zu einer Verminderung von Schwellungen und lokalen Reizzuständen (z. B. der Beugesehnen) innerhalb des Karpaltunnels und auf diese Weise zu einer Volumenabnahme des Tunnelinhalts mit konsekutiver Senkung des Druckniveaus. Die Symptome werden somit gelindert 27. Die Besserung des KTS lässt sich in elektrophysiologischen Tests des N. medianus nachweisen 46. Die lokale Kortikoidinfiltration birgt allerdings die Gefahr der Nerv- und Sehnenschädigung. Die Infiltrationstherapie führt nach Ly-Pen et al. (2005) kurzfristig zu einer schnelleren Linderung der Symptomatik als die chirurgische Dekompression des N. medianus 65. Im langfristigen Vergleich sind die Schienung des Handgelenks sowie die operative Therapie der Infiltrationtherapie allerdings überlegen 5, 27, 49, 102. Ist die Diagnose eines KTS unklar oder liegt der Verdacht auf ein Double-CrushSyndrom (KTS und gleichzeitige cervikale Radikulopathie, s. 1.9) vor, kann die lokale Kortikoidinjektion in den Karpaltunnel zur Differenzierung der beiden Erkrankungen hilfreich sein 7. Ist nach Injektion eine deutliche Linderung der Beschwerden zu beobachten, liegt der Schwerpunkt des Double-Crush-Syndroms eher auf dem Karpaltunnelsyndrom und weniger auf der cervikalen Radikulopathie. Operative Spaltung des Retinaculum flexorum Die operative Sanierung eines Karpaltunnelsyndroms ist von den drei genannten Therapien als einzige kausale anzusehen 6. Wenn der Patient über anhaltende oder progrediente Beschwerden oder motorische Ausfälle im Sinne einer zunehmenden Abduktion- oder 29
30 Oppositionsschwäche der Hand berichtet oder wenn diese Befunde in der klinischen Untersuchung sichtbar werden, ist die Indikation zur Operation gegeben 69. Die Operation kann endoskopisch oder als offener Eingriff durchgeführt werden. Die Operationsergebnisse beider Verfahren sind vergleichbar 4, 50, 99. Die postoperativen Narbenreizungen sind bei der endoskopischen Vorgehensweise geringer und der Zugang ist kleiner, allerdings können Komplikationen häufiger auftreten 103, 110. Die offene Operationsmethode bietet trotz kleinem Zugangsweg eine gute Übersicht und somit eine geringere Chance auf Nervenverletzungen. Sie gilt derzeit als sicherste Standardmethode % der Patienten, die sich einer offenen KTS-Operation unterzogen haben, haben gute bis sehr gute Langzeitergebnisse 111. Im Vergleich zu den beiden zuvor genannten Therapiemöglichkeiten hat die operative Retinakulumspaltung die höchsten Erfolgsquoten 41, 50 Vorgehensweise: Der Eingriff erfolgt ambulant und dauert ca Minuten. Es herrscht Blutleere. Meist an der Rascetta beginnend und in Richtung Interdigitalspalt III-IV zielend wird eine ca. 2 2,5 cm lange Hautinzision durchgeführt. Anschließend folgt die Präparation in die Tiefe zur Darstellung des N. medianus und des Retinaculum mm. flexorum. Intraoperativ sollte auf Grund möglicher Lage- und Abgangsvariationen des Ramus thenaris und des Ramus palmaris ein besonderes Augenmerk auf diese beiden Nervenabgänge des N. medianus gelegt werden 96. Nach Präparation und Durchtrennung des Retinakulums und erfolgter Blutstillung wird die Wunde unter Einlage einer Drainage vernäht. Auf Subcutannähte kann meist verzichtet werden. Anschließend wird die Hand mit einem Watteverband verbunden. Eine Ruhigstellung der Hand mittels Schiene ist nicht erforderlich. Nach Entfernung der Drainage am folgenden Tag ist ein Pflasterverband ausreichend. 30
31 Abbildung 9: KTS-Operation; Rötung im Bereich des sensiblen Innervationsgebietes des N. medianus nach Infiltration eines Lokalanästhetikums in den Karpalkanal Abbildung 10: KTS-Operation; Hautinzision 31
32 Abbildung 11: KTS-Operation; Präparation in die Tiefe, Darstellung des Retinaculum mm. flexorum Abbildung 12: KTS-Operation; Darstellung des N. medianus nach Spaltung des Retinaculum flexorum 32
33 Abbildung 13: KTS-Operation; Verschluss der Wunde mit Einlage einer eintägigen Drainage Es gibt verschiedene weitere Therapieverfahren, die zur Behandlung eines KTS zur Anwendung kommen, die aber zumeist nicht ausreichend evaluiert sind oder deren Effektivität derer der oben genannten Methoden nachsteht oder nicht ausreichend nachgewiesen ist 79. Einige der folgenden Verfahren werden praktiziert: Orale Gabe eines Kortikoidpräparates, Akupunktur, Diuretika-Therapie, Therapie mit nicht-steroidalen Antiphlogistika, Physiotherapie, Yoga u. a. 14, 60, Differentialdiagnosen Als Differentialdiagnose des Karpaltunnelsyndroms kommen alle Erkrankungen in Betracht, die sich als Missempfindungen und/oder Schmerzen im Bereich der Hand und des Unterarms bis hinauf zur Schulter äußern können. Hierbei handelt es sich meist um Erkrankungen, die entweder zu Kompressionen des N. medianus in seinem Verlauf oder zu Einengungen der ihn versorgenden Nervenwurzeln und Faszikeln oder des Plexus brachialis führen oder die durch direkte Nerven-(hüllen-) pathologien zu den soeben beschriebenen Symptomen führen. 33
34 Als häufige Differentialdiagnose des KTS kommen vor allem zwei Erkrankungen in Betracht: Radikuläres Syndrom C6 und C7, Polyneuropathien (PNP) unterschiedlicher Genese (am häufigsten: diabetische PNP). Abbildung 14: Dermatome C6 und C7 farbig markiert, Schmerzausstrahlungen innerhalb dieser Dermatome bei radikulären Syndromen können der Symptomatik beim KTS gleichen, 68. Abbildung 15: Sensible Innervationsgebiete der Hand, Gegenüberstellung: Nerven und Dermatome; Oben: U: N. ulnaris, M: N. medianus, R: N. radialis Unten: Dermatomausbreitung innerhalb der Hand: C6, C7, C8, 53. Bei atypischen oder trotz Therapie persistierenden Beschwerden sollte immer auch an oben genannte Erkrankungen gedacht werden. Diabetische Polyneuropathien kommen überdurchschnittlich häufig in Kombination mit einem KTS vor 3. 34
35 Die Polyneuropathie kann in der elektroneurographischen Untersuchung zur Sicherung des KTS mituntersucht und gegebenenfalls diagnostiziert beziehungsweise ausgeschlossen werden. Die Kombination einer cervicalen, radikulären Nervenwurzelkompression (radikuläres Syndrom) mit einer Kompression des N. medianus innerhalb des Karpaltunnels wird als Double-crush-Syndrom bezeichnet. Besteht ein Verdacht auf ein radikuläres Syndrom der cervikalen Halswirbelsäule, sollten klinische Test (z. B. Sensibilitätsprüfungen, Nackenkompressionstest nach Spurling) und bildgebende Verfahren (MRT, CT) zum Einsatz kommen 35. Hinweise auf cervikale, radikuläre Syndrome können sein 35: - Kontinuierliche, nicht von der Tageszeit abhängige Schmerzen und Parästhesien, - Schmerzen und Parästhesien, die sich über das Innervationsgebiet des N. medianus hinaus ausbreiten, - Schmerzen und Parästhesien, die sich durch ausschütteln nicht bessern, - Symptomverstärkung durch Kopfbewegungen, Husten und Pressen. Seltenere Differentialdiagnosen eines Karpaltunnelsyndroms sind 7, 84: Kompressionsyndrome im Verlauf des N. medianus / Plexus brachialis: Scalenussyndrom, Thoracic-outlet-Syndrom, Pronator-teres-Syndrom, spinale Pathologien (zervikale Melopathie, cervicale Syringomyelie, spinale Muskelatrophie), sonstige Erkrankungen (direktes Trauma mit Verletzung des N. medianus, Polymyalgie, Raynaud-Syndrom, Borreliose u.a.). Es sollte darauf geachtet werden, dass die genannten Krankheitsbilder auch zeitgleich vorliegen können 7. In diesem Falle ist zu eruieren und präoperativ zu sichern, welche Erkrankung bzw. Pathologie die Symptome hauptsächlich verursacht. Nach erfolgter Ursachenforschung erfolgt dann ein individueller, symptomorientierter Behandlungsplan
36 1.9 Komorbiditäten Tendovaginitis de Quervain (schnellender Finger) Die Tendovaginitis de Quervain hat eine hohe Ko-Inzidenz mit dem Karpaltunnelsyndrom. Kumar und Chakrabarti haben bei 41 % der von ihnen untersuchten Studienpopulation mit diagnostiziertem schnellenden Finger ebenfalls ein KTS nachweisen können 59. Auch wenn die beiden Erkrankungen vermehrt gemeinsam auftreten, bedingen sie sich nicht unmittelbar. Die Ursache der Koinzidenz ist nicht ausreichend geklärt und bedarf weiterer Forschung 59. Double-crush-Syndrom Das gemeinsame Auftreten eines Karpaltunnelsyndroms und eines cervicalen radikulären Syndroms wird als double-crush-syndrom bezeichnet. Da es bei einer radikulären Symptomatik der Wurzel C6 oder C7 zu Schmerzausstrahlungen innerhalb der entsprechenden Dermatome kommt und diese dem Versorgungsgebiet des N. medianus in der Hand gleichen (aber nicht identisch sind, s. Abbildung 15), können die Erkrankungen gemeinsam auftreten, ohne dass primär an beide Erkrankungen gedacht wird. Besteht der Verdacht auf diese Komorbidität, muss vor Einleitung der Therapie weitere Diagnostik durchgeführt werden (s. 1.8). 2. Problematik und Zielsetzung Die Diagnosestellung eines Karpaltunnelsyndroms (KTS) erfolgt durch klinische Untersuchung des Patienten und genaue anamnestische Erhebung des Schmerzcharakters und des Krankheitsverlaufs 14. Zur Diagnosesicherung oder bei klinisch unklaren Fällen eines KTS kommt häufig die elektroneurographische Untersuchung des Nervus medianus zum Einsatz 54. Die Elektroneurographie (ENG) wird zwar nicht einheitlich als Goldstandard angesehen 28, 70, ist aber zur Diagnosesicherung empfohlen und gilt als zuverlässig und etabliert 1, 6, 8. Allerdings kann bei 16-34% der Patienten mit typischer KTS-Symptomatik in der ENG keine pathologische Veränderung festgestellt werden 33, 62, 87. Die ENG wird von einigen Patienten zudem als sehr unangenehm beschrieben und ist dadurch, dass sie meist nur in neurologischen Kliniken oder Praxen durchgeführt wird, für die Patienten mit einem erhöhten Zeitaufwand und für das Gesundheitssystem mit 36
37 erhöhten Kosten verbunden. Aus den soeben genannten Gründen sollten alternative Verfahren zur Diagnosebestätigung eines KTS nicht außer Acht gelassen werden. In diesem Zusammenhang ist die hochauflösende Sonographie des Nervus medianus als bildgebendes Verfahren zu nennen. Dieses Verfahren ist in den letzten Jahren zunehmend in den Mittelpunkt der klinischen Forschung gerückt 12, 70, 72, 89, 119. Die Sonographie ist im Gegensatz zu der ENG schnell, kostengünstig und für die Patienten komfortabel durchführbar, da durch die Untersuchung keinerlei Schmerzen provoziert werden und die Untersuchung zusammen mit der klinischen Untersuchung und ggf. am Krankenbett erfolgen kann. Hochauflösende Ultraschalluntersuchungen sind in vielen Krankenhäusern verfügbar und sind, im Gegensatz zu der elektrophysiologischen Untersuchung des N. medianus, nicht an die Präsenz neurologischer Kliniken innerhalb eines Krankenhauses gebunden. Der alltägliche und unkomplizierte Einsatz diagnostischer Verfahren zur Diagnosesicherung eines KTS kann durch den standardisierten Einsatz hochauflösender Ultraschalluntersuchungen zur Diagnosebestätigung somit erheblich verbessert werden. In der sonographischen Untersuchung des Nervus medianus können verschiedene Parameter bestimmt werden, wobei die Bestimmung der Querschnittsfläche des Nervs im proximalen Karpaltunnel am aussagekräftigsten zu sein scheint 34, 58, 72, 122. Es existieren allerdings bislang keine einheitlichen Referenzwerte für die Querschnittsfläche des N. medianus. Der Einsatz der Sonographie zur Diagnostik eines KTS wird dadurch im klinischen Alltag erschwert. Mehrere Studien haben sich bereits mit den Vor- und Nachteilen der Ultraschalluntersuchung in der Diagnostik eines KTS beschäftigt 12, 30, 56, 61, 75. Korrelationen zwischen der Sonographie und der ENG als etabliertes Verfahren konnten bereits nachgewiesen werden 72, 123. Es gilt allerdings, die Wertigkeit der Ultraschalluntersuchung als bildgebendes Verfahren, das schnell, für die Patienten komfortabel und obendrein kostengünstig durchgeführt werden kann, in der Diagnostik des KTS durch weitere Studien zu untersuchen und zu optimieren. In der vorliegenden prospektiven Studie sollen Veränderungen der sensiblen Nervenleitgeschwindigkeit sowie der distal-motorischen Latenz und der Querschnittsfläche des N. medianus in vier verschiedenen Ebenen im Laufe eines Jahres nach erfolgter Operation untersucht und ausgewertet werden. Die erlangten Ergebnisse sollen Aufschluss darüber geben, ob es statistisch signifikante Veränderungen der soeben genannten Größen im zeitlichen Verlauf sowie im Vergleich zu den Größen der nicht operierten Hand gibt. Aus diesen eventuell zu beobachtenden Veränderungen sollen Rückschlüsse auf die Einsetzbarkeit und die Aussagekraft der Verfahren im postoperativen Verlauf gezogen 37
38 sowie Vorteile und Nachteile beider Verfahren in der präoperativen Diagnostik beleuchtet werden. 3. Methodik 3.1 Studiendesign Es wurde eine prospektive, monozentrische, vergleichende Querschnittsstudie mit 40 Probanden durchgeführt, um die Ultraschalluntersuchung in der Diagnostik des KTS der elektroneurographischen Untersuchung gegenüberzustellen. Das untersuchte Patientenkollektiv bestand aus 40 Patienten, die sich in dem Zeitraum vom 15. November 2007 bis zum 05. Mai 2009 in dem Universitätsklinikum Bergmannsheil in der Handchirurgischen Abteilung mit der Erstdiagnose eines Karpaltunnelsyndroms vorstellten und bei denen eine chirurgische Sanierung geplant war. Die Patienten erhielten eine präoperative Voruntersuchung sowie vier postoperative Nachuntersuchungen im Laufe eines Jahres. Die einzelnen Untersuchungen wurden an Hand von Untersuchungsprotokollen durchgeführt, die für die vorliegende Studie entwickelt wurden (s. Anhang) und bestanden jeweils aus einer elektrophysiologischen Untersuchung und einer hochauflösenden Sonographie des N. medianus beidseits sowie einer klinischen Untersuchung und Befragung des Patienten. Am 25. Juni 2010 konnte die Studie mit der Abschlussuntersuchung des 40. Patienten abgeschlossen werden. Die Studie wurde von der Ethikkommission der Ruhr-Universität Bochum als ethisch unbedenklich beurteilt. Ethikreferenznummer: Patientenkollektiv Die Patientenrekrutierung erfolgte im Zeitraum von 18 Monaten (November 2007 Mai 2009). Alle an der Studie teilnehmenden Patienten (n = 40) wurden zur chirurgischen Erstbehandlung eines Karpaltunnelsyndroms vorstellig und beschrieben deutliche klinische Symptome eines KTS. Die Diagnose des KTS wurde durch einen Handchirurgen gestellt. Der Teilnahme an der Studie ging eine ausführliche mündliche und schriftliche Aufklärung über Nutzen und eventuelle Risiken sowie Vor- und Nachteile für die Patienten voraus. 38
39 Von jedem Probanden lag eine unterschriebene schriftliche Einverständniserklärung vor. Die Patienten wurden präoperativ voruntersucht und nahmen postoperativ an vier Nachuntersuchungen im Laufe eines Jahres teil. Bei allen Patienten wurde die offene Retinakulumspaltung als Operationsmethode unter ambulanten Bedingungen angewandt. Das Karpaltunnelsyndrom wurde bei allen Patienten als Ersteingriff operiert. Patienten, bei denen Rezidivoperationen durchgeführt wurden, wurden nicht berücksichtigt. Die Vorbehandlungen (Volare Schiene, Kortikoidinjektion etc.) wurden zwar eruiert, aber als Ein- oder Ausschlusskriterium nicht berücksichtigt. Auch die Zeitspanne zwischen der Erstdiagnose des Karpaltunnelsyndroms und dem Zeitpunkt der Operation spielte für die Auswahl des Patientenguts keine Rolle. Als Einschlusskriterium wurden eine deutliche und typische KTS-Anamnese und ein zu einem KTS passender Untersuchungsbefund der Hände (im Sinne positiver Provokationstests bzw. typischer palpatorischer und inspektorischer Zeichen wie z. B. Thenaratrophie und/oder trophische Störungen der Hände) festgelegt. Bei 35 der 40 Patienten konnten in der neurologischen Untersuchung pathologische Veränderungen nachgewiesen werden. Die übrigen 5 Patienten wurden aufgrund ihrer pathognomonischen Anamnese (s. 1.5) und des eindeutigen und mit einem KTS in Verbindung zu bringenden Untersuchungsbefunds in die Studie eingeschlossen. Patienten mit Vorerkrankungen, die ebenfalls zu Nervenleitgeschwindigkeits- veränderungen führen können (z. B. Polyneuropathien unterschiedlicher Genese), wurden nicht in die Studie aufgenommen, da die Bewertung der Elektroneurographie durch diese Komorbiditäten erschwert sein kann 38. Ebenfalls ausgeschlossen wurden Patienten, die in ihrer Anamnese über KTS-Beschwerden berichteten, die im Rahmen eines Traumas des Unterarms oder des Handgelenks erstmalig auftraten. Postoperativ wäre eventuell keine Verbesserung der Nervenleitgeschwindigkeit sowie der Symptomatik zu erwarten, da in diesem Zusammenhang an eine direkte, traumatische Schädigung des N. medianus gedacht werden muss. 39
40 Tabelle 1: Einschluss- und Ausschlusskriterien zur Teilnahme an der KTS-Studie Einschlusskriterien - Typische KTS-Anamnese und/oder positive Provokationstests (Phalen, Hoffmann-Tinel) und/oder inspektorische oder palpatorische Zeichen eines KTS (Thenaratrophie) Ausschlusskriterien - KTS-Rezidiv nach früherer Operation, Trauma des Unterarms oder Handgelenks in der Anamnese, Vorerkrankungen, die Nervenleitgeschwindigkeitsveränderungen hervorrufen können (Polyneuropathien etc.). 3.3 Untersuchungsablauf Die Probanden wurden präoperativ voruntersucht und an vier Terminen innerhalb eines Jahres postoperativ nachuntersucht: - Untersuchung 1: präoperativ - Untersuchung 2: 1 Monat postoperativ - Untersuchung 3: 3 Monate postoperativ - Untersuchung 4: 6 Monate postoperativ - Untersuchung 5: 12 Monate postoperativ. Die Untersuchungstermine umfassten jeweils eine neurologische, elektroneurographische Untersuchung des N. medianus beider Hände, eine Kraftmessung des Faustschlusses beider Hände sowie eine Ultraschalluntersuchung des N. medianus der operierten und der nicht operierten Hand in vier Ebenen. Des Weiteren wurde die Beweglichkeit des N. medianus innerhalb des Karpalkanals und die subjektive Schmerzstärke im sensiblen Versorgungsgebiet des N. medianus erfasst. Die Untersuchungen wurden über den Studienzeitraum von einem Jahr hinweg von stets denselben Untersuchern durchgeführt, um die untersucherabhängige Variabilität zu minimieren. 40
41 3.3.1 Elektrophysiologische Untersuchung Die neurologische Untersuchung wurde in der Klinik für Neurologie im Universitätsklinikum Bergmannsheil in Bochum in Zusammenarbeit mit einer erfahrenen MTA für Elektroneurophysiologie durchgeführt. Es erfolgte eine elektroneurographische Beurteilung des N. medianus beider Hände. Bei dem verwendeten Untersuchungsgerät handelte es sich um ein Dantec Neuromatic 2000M (Dantec, Kopenhagen, Denmark). Abbildung 16: Dantec Neuromatic 2000M, 24 Die Untersuchungsbedingungen erfüllten alle von der deutschen Gesellschaft für klinische Neurophysiologie empfohlenen und in der AWMF-KTS-Leitlinie der Gesellschaft für Handchirurgie, Neurochirurgie, Neurologie und Orthopädie gelisteten Kriterien 8. Die neurologische Untersuchung erfolgte zeitlich vor den anderen, unten aufgeführten Untersuchungen, um einen Einfluss der Testungen auf die erfassten neurologischen Parameter zu vermeiden. Emad et al. haben im Jahre 2010 den Einfluss von klinischen Provokationstests auf neurologisch erfasste Werte nachgewiesen 36. Es wurden folgende Parameter bestimmt: - Distale Reizung: - Latenz (distal-motorische Latenz) (ms) - Amplitude (mv) - Proximale Reizung: - Nervenleitgeschwindigkeit (m/s) - Amplitude (mv) - Sensible Reizung: - Nervenleitgeschwindigkeit (m/s) - Amplitude (μv). 41
42 Für die Diagnostik des Karpaltunnelsyndroms spielen vor allem die distal-motorische Latenz sowie die sensible Nervenleitgeschwindigkeit eine Rolle. Zur Ermittlung der distalmotorischen Latenz wurde eine Distanz von 6 cm gewählt. Eine distal-motorische Latenz > 4,0 ms gilt bei 6 cm Distanz als pathologisch. Mit Hilfe der anderen Parameter können Diffentialdiagnosen (z.b. Polyneuropathien, Sulcus ulnaris Syndrom) ausgeschlossen werden. Aus den soeben aufgeführten Gründen wurde in der folgenden Arbeit vor allem Wert auf die distal-motorische Latenz und die sensible Nervenleitgeschwindigkeit des N. medianus gelegt Klinische Untersuchung Die klinische Untersuchung umfasste eine inspektorische und palpatorische Begutachtung beider Hände sowie eine Anamnese des genauen Schmerzcharakters innerhalb der operierten Hand. Die Schmerzstärke wurde von den Patienten auf einer Skala von 1 10 eingeteilt. Es wurde der Phalen-Provokationstest durchgeführt und das Hoffmann-TinelZeichen getestet (s. 1.6). Diese beiden klinischen Provokationtests gehören zu den geläufigsten und am häufigsten angewendeten Testverfahren in der Diagnostik eines KTS 66, 67. Zusätzlich wurde bei jeder Untersuchung die Kraft (kg) des Faustschlusses mit Hilfe eines hydraulischen Handdynamometers Baseline der Firma FEI (Fabrication Enterprises Incorporation, New York, USA) gemessen. Abbildung 17: Handdynamometer zur Messung der Kraft des Faustschlusses 42
43 3.3.3 Ultraschalluntersuchung Die Ultraschalluntersuchungen wurden jeweils an beiden Händen in transversaler Ebene durch denselben Untersucher mit einem hochauflösendem Micromaxx Ultraschallgerät der Firma Sonosite (Sonosite, Bothell, USA) (Artikel-Nr. P07632) durchgeführt. Die Ultraschallsonde war eine HFL-38 E -Linear-Sonde mit 6-13 MHz. Abbildung 18: Sonosite Micromaxx, 106 Der zu untersuchende Patient hatte seinen Arm in suppinierter Haltung auf einer Untersuchungsliege abgelegt. Das Handgelenk befand sich in Neutralstellung, die Finger waren entspannt gebeugt. Mit Hilfe des Ultraschalls wurde die Höhe und die Breite des N. medianus in vier verschiedenen Ebenen (s. Abbildung 23, Abbildung 24) gemessen und die Beweglichkeit des N. medianus innerhalb des Karpaltunnels erfasst. Die Beweglichkeitsüberprüfung erfolgte während aktiver Fingerbewegungen des Patienten. Eine Beweglichkeit von 2 mm in transversaler Ebene gilt als physiologisch 78. Die Erfassung der Fläche des Nervus medianus erfolgte in vier Ebenen: 4 cm proximal Rascetta (distale Handgelenksfurche) / Ebene 1 2 cm proximal Rascetta (distale Handgelenksfurche) / Ebene 2 auf Höhe der Rascetta (distale Handgelenksfurche) / Ebene 3 1 cm distal der Rascetta (distale Handgelenksfurche) / Ebene 4. 43
44 Abbildung 19: Ultraschall - Ebene 1 Abbildung 20: Ultraschall - Ebene 2 Abbildung 21: Ultraschall - Ebene 3 Abbildung 22: Ultraschall - Ebene 4 44
45 Abbildung 23: Markierung der 4 Ultraschallebenen mit grünen Markern, anatomisches Präparat. Abbildung 24: Markierung der 4 Ultraschallebenen mit blauen Markern, anatomisches Präparat. Der anteroposteriore Diameter (Abbildung 25, 1) und der mediolaterale Diameter (Abbildung 25, 2) des N. medianus wurden in den soeben genannten Ebenen vermessen und die Querschnittsfläche anschließend mit der mathematischen Flächenformel einer Ellipse berechnet. 45
46 Abbildung 25: Ultraschallbild des Karpaltunnels; Der N. medianus wurde vermessen und ist mit Kreuzen (+) gekennzeichnet, Des Weiteren sind die Sehne des Flexor pollicis longus (*) und die vier Sehnen des Flexor digitorum superficialis ( ) markiert. Abbildung 26: Darstellung des Karpaltunnels, transversale Schnittführung, 96 1: M. flexor carpi radialis 2: M. flexor pollicis longus 3: N. medianus 4: Sehnen des Flexor digitorum superficialis et profundus 46
47 3.4 Datenverarbeitung und statistische Auswertung Die gesammelten Daten wurden in Tabellen erfasst und mit verschiedenen statistischen Testverfahren nach Rücksprache mit dem Institut für Prävention und Arbeitsmedizin der Deutschen Gesetzlichen Unfallversicherung (IPA) ausgewertet. Deskriptive Statistik Der Phalen-Test und das Hoffmann-Tinel-Zeichen (s ) wurden mittels deskriptiver statistischer Auswertung zusammengefasst und ausgewertet. Mittelwert, Median und T-Test Von allen ermittelten numerischen Werte-Kategorien (z.b. Schmerzstärke, Handdynamometermessung, Nervenleitgeschwindigkeit etc.) wurden die Mittelwerte, die Standardabweichung, der Median sowie Minimum und Maximum erfasst und in Einzeltabellen aufgenommen. Die Mittelwerte der operierten Hand und der nicht operierten Hand wurden im zeitlichen Verlauf in Diagrammen als Boxplots dargestellt. Die Mittelwerte der postoperativen Nachuntersuchungen wurden jeweils mittels gepaartem T-Test mit den präoperativ ermittelten Mittelwerten verglichen und die p-werte wurden in Tabellen erfasst sowie teilweise in die Boxplot-Diagramme mit aufgenommen. Des Weiteren wurden die Mittelwerte der operierten Hand und der nicht operierten Hand zu jedem Untersuchungszeitpunkt (präoperativ, 1 Monat postoperativ, 3 Monate postoperativ, 6 Monate postoperativ, 12 Monate postoperativ) über den T-Test miteinander verglichen. Die p-werte wurden zusammen mit den Differenzen der Mittelwerte und der Standardabweichung in Tabellen erfasst und in Linien- oder Balken-Diagramme überführt. Wilcoxon-Vorzeichen-Rang-Test Es wurden 20 Probanden in die Studie aufgenommen (von n=40), die stark veränderte sensible Nervenleitgeschwindigkeiten des N. medianus aufwiesen (es konnte kein Antwortpotential ermittelt werden), um zu untersuchen, inwieweit und in welchem Zeitraum sich derart deutlich veränderte Nervenleitgeschwindigkeiten wieder bessern können. 47
48 Zudem wurden fünf Probanden in die Studie integriert, die keinerlei pathologische Veränderungen in der elektroneurographischen Untersuchung zeigten, aber deutliche KTSSymptomatiken beschrieben. Da der Median in der statistischen Auswertung gegenüber Ausreißern als stabiler als der Mittelwert gilt, wurde in dem Fall der Nervenleitgeschwindigkeits-Auswertung der Wilcoxon-Vorzeichen-Rang-Test für verbundene Stichproben und nicht der soeben beschriebene T-Test angewandt
49 4. Ergebnisse Die vorliegende prospektive Studie untersucht die Veränderungen der sensiblen Nervenleitgeschwindigkeit sowie der distal-motorischen Latenz des N. medianus im zeitlichen Verlauf. Ferner wurde die Querschnittsfläche des N. medianus in vier Ebenen in Unterarm und Hand untersucht und ebenfalls im zeitlichen Verlauf betrachtet. Die vorhandenen Ergebnisse der operierten Hand wurden jeweils den Ergebnissen der nicht operierten Hand gegenübergestellt, um statistisch signifikante Unterschiede aufzudecken. In dem Zeitraum vom 15. November 2007 bis zum 05. Mai 2009 konnten 40 Patienten in die KTS-Diagnostik-Studie eingeschlossen werden. Der jüngste Patient war 32 Jahre und der älteste Patient war 82 Jahre alt. Das Durchschnittsalter der Probanden lag bei 56,6 Jahren (Median = 55,5 Jahre). Abbildung 27: Altersverteilung der Studienpopulation, n =
50 In die Studie wurden vier männliche und 36 weibliche Patienten eingeschlossen. 10 % männlich weiblich 90 % Abbildung 28: Geschlechterverteilung der Studienpopulation, n = 40. Jeder Patient erhielt eine Vor- und vier Nachuntersuchungen, die sich auf den Zeitraum eines Jahres wie folgt verteilten: Voruntersuchung bis zu einer Woche präoperativ Nachuntersuchung 1 1 Monat postoperativ Nachuntersuchung 2 3 Monate postoperativ Nachuntersuchung 3 6 Monate postoperativ Nachuntersuchung 4 12 Monate postoperativ. Der Untersuchungsablauf wurde standardisiert durchgeführt und innerhalb des Studienzeitraums von jeweils denselben Untersuchern befolgt. Jede Untersuchung enthielt die unter 2.3 beschriebenen Einzeluntersuchungen und dauerte insgesamt ca Minuten. 50
51 4.1 Elektrophysiologische Untersuchung Die elektrophysiologische bzw. elektroneurographische Untersuchung des N. medianus gilt als zuverlässige Methode in der Diagnostik eines Karpaltunnelsyndroms 1, 8. Es wurden pro Untersuchungszeitpunkt und Hand sechs verschiedene Parameter (s ) ermittelt, um die Diagnose des KTS zu sichern, den Schweregrad einschätzen zu können und andere Erkrankungen auszuschließen. In der Ergebnisdarstellung wurde speziell auf die distal-motorische Latenz und die Nervenleitgeschwindigkeit des N. medianus eingegangen, da diese beiden Werte für die Diagnosestellung und die Verlaufsbeurteilung eines KTS evaluiert sind und mit dem Schweregrad korrelieren 7, Distal-motorische Latenz Die distal motorische Latenz wurde bei n = 40 Patienten im Laufe eines Jahres nach KTSOperation kontrolliert. Eine distal-motorische Latenz von mehr als 4,0 ms gilt als pathologisch. Operierte Hand Tabelle 2: Distal-motorische Latenz der operierten Hand im zeitlichen Verlauf Mittelwert (ms) Standardabweichung Median (ms) Minimum (ms) Maximum (ms) Präoperativ 4,30 1,62 3,8 0,0 7,8 1 Monat postoperativ 3,90 1,08 3,8 0,0 5,8 3 Monate postoperativ 3,73 0,88 3,6 0,0 5,2 6 Monate postoperativ 3,57 0,79 3,7 0,0 4,8 12 Monate postoperativ 3,62 0,77 3,8 0,0 4,8 Wie in der Tabelle zu erkennen, lag die distal-motorische Latenz bei der präoperativen Voruntersuchung der Patienten im pathologischen Bereich. Bereits einen Monat postoperativ ist der Mittelwert der distalen Latenz wieder auf physiologische Werte abgesunken. 51
52 Abbildung 29: Distal-motorische Latenz der operierten Hand im zeitlichen Verlauf, n = 40. Tabelle 3: Distal-motorische Latenz der operierten Hand im Vergleich zu der präoperativen Voruntersuchung, p-werte. Zeitlicher Verlauf Präoperativ 1 Monat postoperativ Präoperativ 3 Monate postoperativ Präoperativ 6 Monate postoperativ Präoperativ 12 Monate postoperativ Differenz der Mittelwerte (ms) 0,41 Standardabweichung p-wert 1,12 0,028 0,58 1,18 0,004 0,73 1,24 0,001 0,68 1,35 0,003 52
53 Abbildung 30: Mittelwerte der distal-motorischen Latenz der operierten Hand im zeitlichen Verlauf, n = 40. Im Laufe eines Jahres nach erfolgter KTS-Operation ist eine statistisch signifikante Abnahme der distal-motorischen Latenz nachzuweisen (p = 0,003). Die ermittelten Werte zeigen eine kontinuierliche Abnahme der distal-motorischen Latenz im zeitlichen Verlauf. Bereits einen Monat postoperativ ist ein statistisch signifikanter Unterschied im Vergleich zur präoperativen Voruntersuchung festzustellen (p = 0,028). Zwölf Monate postoperativ ist der Unterschied noch deutlicher mit einer statistischen Signifikanz von p = 0,003 zu erkennen. 53
54 Dem gegenüberzustellen ist die distal-motorische Latenz (dml) der nicht operierten Hand. Der Mittelwert sowie der Median der dml lagen bei der Voruntersuchung im physiologischen Bereich (s. Tabelle 4). Nicht operierte Hand Tabelle 4: Distal-motorische Latenz der nicht operierten Hand im zeitlichen Verlauf. Mittelwert (ms) Standardabweichung Median (ms) Minimum (ms) Maximum (ms) Präoperativ 3,55 1,23 3,4 0,00 7,00 1 Monat postoperativ 3,61 1,19 3,6 0,00 6,40 3 Monate postoperativ 3,51 1,84 3,6 0,00 5,80 6 Monate postoperativ 3,42 0,99 3,5 0,00 5,60 12 Monate postoperativ 3,62 1,25 3,6 0,00 8,00 Abbildung 31: Distal-motorische Latenz der nicht operierten Hand im zeitlichen Verlauf; n =
55 Tabelle 5: Distal-motorische Latenz der nicht operierten Hand im Vergleich zu der präoperativen Voruntersuchung, p-werte. Zeitlicher Verlauf Präoperativ 1 Monat postoperativ Präoperativ 3 Monate postoperativ Präoperativ 6 Monate postoperativ Präoperativ 12 Monate postoperativ Differenz der Mittelwerte (ms) -0,065 Standardabweichung p-wert 0,433 0,348 0,040 0,621 0,686 0,130 0,641 0,207-0,075 1,190 0,692 Bis zu zwölf Monate postoperativ zeigte sich keine statistisch signifikante Veränderung der distal-motorischen Latenz der nicht operierten Hand (p = 0,692). Der Vergleich der distalen Latenz der operierten und der nicht operierten Hand wies präoperativ einen statistisch signifikanten Unterschied (p = 0,008) auf. Zwölf Monate postoperativ hatten sich die Werte soweit angenähert, dass kein statistisch signifikanter Unterschied (p = 1,000) zwischen der distal-motorischen Latenz der operierten und der nicht operierten Hand mehr bestand (s. Abb.). Der Mittelwert der distalen Latenz der operierten Hand war wieder soweit abgesunken beziehungsweise hatte sich so stark verbessert, dass er bereits einen Monat postoperativ wieder im physiologischen Bereich lag. Vergleich: operierte Hand vs. nicht operierte Hand Tabelle 6: Distal-motorische Latenz; Mittelwerte im Vergleich: Operierte Hand vs. nicht operierte Hand Zeitlicher Verlauf Präoperativ 1 Monat postoperativ 3 Monate postoperativ 6 Monate postoperativ 12 Monate postoperativ Differenz der Mittelwerte, Operierte Hand nicht operierte Hand 0,76 Standardabweichung p-wert 1,71 0,008 0,29 1,28 0,167 0,22 0,95 0,151 0,16 0,92 0,294 0,00 1,13 1,000 55
56 Abbildung 32: Distal-motorische Latenz im Vergleich, operierte Hand vs. nicht operierte Hand; p-werte, n = Sensible Nervenleitgeschwindigkeit Im Folgenden wird die Veränderung der sensiblen Nervenleitgeschwindigkeit beider Hände im zeitlichen Verlauf sowie im Vergleich zur nicht operierten Hand dargestellt. Operierte Hand Tabelle 7: Sensible Nervenleitgeschwindigkeit der operierten Hand im zeitlichen Verlauf. Präoperativ 1 Monat postoperativ 3 Monate postoperativ 6 Monate postoperativ 12 Monate postoperativ Mittelwert (m/s) 21,60 Standardabweichung 22,65 Median (m/s) 17,5 Minimum (m/s) 0,0 Maximum (m/s) 70,0 30,33 23,54 40,0 0,0 64,0 36,15 22,15 44,0 0,0 64,0 39,78 21,24 47,5 0,0 70,0 42,48 16,05 46,5 0,0 70,0 56
57 Man erkennt einen deutlichen und kontinuierlichen Anstieg des Mittelwerts und des Medians der sensiblen Nervenleitgeschwindigkeit der operierten Hand während des Untersuchungszeitraums von einem Jahr. Abbildung 33: Sensible Nervenleitgeschwindigkeit der operierten Hand im zeitlichen Verlauf, p-wert, n = 40. Abbildung 34: Veränderung des Medians der sensiblen Nervenleitgeschwindigkeit im zeitlichen Verlauf, n= 40 57
58 Im Folgenden werden die postoperativen Untersuchungsergebnisse, in diesem Fall der Median der NLG, mittels Willcoxon-Vorzeichen-Rang-Test (s. 0) mit dem Median der präoperativen Voruntersuchung auf statistisch signifikante Veränderungen hin untersucht. Tabelle 8: Sensible Nervenleitgeschwindigkeit der operierten Hand im Vergleich zur präoperativen Untersuchung; Mittelwerte und Mediane. Zeitlicher Verlauf 1 Monat postoperativ Präoperativ 3 Monate postoperativ Präoperativ 6 Monate postoperativ Präoperativ 12 Monate postoperativ - Präoperativ Differenz der Mittelwerte 8,73 Standardabweichung p-wert (T-Test) <0,001 Differenz der Mediane 22,5 p-wert (WillcoxonRang-Test) <0,001 13,26 14,55 16,47 <0,001 26,5 <0,001 18,18 18,66 < ,0 <0,001 20,88 20,64 <0,001 29,0 <0,001 Es zeigte sich bereits einen Monat postoperativ eine statistisch signifikante Verbesserung (p < 0,001) der sensiblen Nervenleitgeschwindigkeit des Nervus medianus der operierten Hand. Der Median der sensiblen NLG war innerhalb von zwölf Monaten postoperativ von 17,5 m/s auf 46,5 m/s gestiegen. Eine sensible Nervenleitgeschwindigkeit < 46,9 m/s gilt als pathologisch. Somit befand sich der Median der NLG zwar noch im pathologischen Bereich, war aber im Laufe eines Jahres nach der Operation statistisch signifikant gestiegen (s. Tabelle 7, Tabelle 8). Um eine Aussage darüber treffen zu können, ob diese Steigerung der NLG auf die Operation zurückgeführt werden kann, folgt eine Betrachtung der Veränderungen der Werte der nicht operierten Hand. Nicht operierte Hand Tabelle 9: Sensible Nervenleitgeschwindigkeit der nicht operierten Hand im zeitlichen Verlauf. Mittelwert (m/s) Standardabweichung Präoperativ 32,75 23,72 44,5 0,0 62,0 1 Monat postoperativ 3 Monate postoperativ 6 Monate postoperativ 12 Monate postoperativ 33,18 23,85 46,5 0,0 60,0 37,03 22,56 47,0 0,0 64,0 37,96 21,82 46,5 0,0 64,0 36,73 21,18 44,0 0,0 64,0 58 Median (m/s) Minimum (m/s) Maximum (m/s)
59 Vergleicht man die präoperativen Werte mit den Werten der Voruntersuchung, so ist im Median-Vergleich keine Steigerung zu erkennen. Der Mittelwert stieg von 32,75 m/s auf 36,73 m/s. Das entspricht, vergleicht man die Werte mittels gepaartem T-Test, keiner statistisch signifikanten Steigerung (p = 0,187, s. Tabelle 10). Abbildung 35: Sensible Nervenleitgeschwindigkeit der nicht operierten Hand im zeitlichen Verlauf; p-wert aus Median-Vergleich (s. Tabelle 10), n = 40. Tabelle 10: Sensible Nervenleitgeschwindigkeit der nicht operierten Hand im Vergleich zur präoperativen Untersuchung; Mittelwerte und Mediane. Zeitlicher Verlauf 1 Monat postoperativ präoperativ 3 Monate postoperativ präoperativ 6 Monate postoperativ präoperativ 12 Monate postoperativpräoperativ Differenz der Mittelwerte 0,43 Standardabweichung p-wert (T-Test) 0,779 Differenz der Mediane 2,0 p-wert (WillcoxonRang-Test) 0,431 9,51 4,28 11,64 0,025 2,5 0,027 5,23 13,34 0,018 2,0 0,048 3,98 18,72 0,187-0,5 0,393 59
60 Um statistische Signifikanzen zwischen den Veränderungen der operierten Hand und der nicht operierten Hand festzustellen, wurden die Mediane der sensiblen Nervenleitgeschwindigkeit miteinander verglichen. Vergleich: operierte Hand vs. nicht operierte Hand Tabelle 11: Sensible Nervenleitgeschwindigkeit im zeitlichen Verlauf, Vergleich: operierte Hand vs. nicht operierte Hand, p-werte. Zeitlicher Verlauf Präoperativ 1 Monat postoperativ 3 Monate postoperativ 6 Monate postoperativ 12 Monate postoperativ Differenz der Mediane, operierte Hand nicht operierte Hand -27,0-6,5-3,0 1,0 2,5 p-wert (Wilcoxon-VorzeichenRang-Test) < 0,001 0,254 0,720 0,443 0,072 Abbildung 36: Sensible Nervenleitgeschwindigkeit. Median im zeitlichen Verlauf, Vergleich: operierte Hand vs. nicht operierte Hand, n =
61 Abbildung 37: Sensible Nervenleitgeschwindigkeit. Mediane im zeitlichen Verlauf. Vergleich: operierte Hand vs. nicht operierte Hand, n = 40. Es ergab sich bei der präoperativen Voruntersuchung eine statistisch signifikante Differenz (p < 0,001) zwischen den Medianen der sensiblen NLG der operierten und der nicht operierten Hand. Bereits ein Monat postoperativ konnte eine deutliche Zunahme des Medians verzeichnet werden. Zwischen den Werten der gesunden und der erkrankten Hand bestand kein statistisch signifikanter Unterschied mehr (p = 0,254, vergl. Tabelle 11). 61
62 4.2 Kraftmessung, Schmerzstärke und Provokationstests Nachdem der Nervus medianus beider Hände elektroneurographisch untersucht worden war, erfolgte die Anamnese, die klinische Untersuchung sowie die Kraftmessung des Faustschlusses mittels Handdynamometermessung der Hände Handdynamometermessung Operierte Hand Tabelle 12: Messung der Kraft des Faustschlusses der operierten Hand mittels Handdynamometer im zeitlichen Verlauf. Mittelwert (kg) Standardabweichung Median (kg) Minimum (kg) Maximum (kg) Präoperativ 24,75 9,13 24,95 8,00 45,20 1 Monat postoperativ 3 Monate postoperativ 6 Monate postoperativ 12 Monate postoperativ 16,73 7,19 15,65 3,80 32,10 22,43 7,84 22,35 7,20 43,10 24,21 8,06 22,95 10,40 46,30 25,88 8,56 25,40 11,20 51,20 Abbildung 38: Messung der Kraft des Faustschlusses der operierten Hand mittels Handdynamometer im zeitlichen Verlauf, n= 40 62
63 Es war ein deutlicher und statistisch signifikanter (p < 0,001) Abfall der Kraft des Faustschlusses einen Monat nach erfolgter Operation zu erkennen. Im weiteren Verlauf stieg die Kraft wieder an, bis sie zwölf Monate postoperativ bei der Abschlussuntersuchung der Studie den Ausgangswert überstieg (prä-op: 24,75 kg, 12 Monate post-op: 25,88 kg). Tabelle 13: Kraftmessung des Faustschlusses der operierten Hand mittels Handdynamometer im Vergleich zu der präoperativen Voruntersuchung, p-werte. Präoperativ 1 Monat postoperativ Präoperativ 3 Monate postoperativ Präoperativ 6 Monate postoperativ Präoperativ 12 Monate postoperativ Differenz der Mittelwerte (kg) 8,03 Standardabweichung p-wert 6,41 <0,001 2,32 7,14 0,046 0,55 5,65 0,545-1,13 6,49 0,278 Bei den Untersuchungen einen Monat und drei Monate postoperativ konnten statistisch signifikante Veränderungen im Vergleich zur präoperativen Voruntersuchung festgestellt werden (p < 0,001; p = 0,046). Im weiteren Verlauf war die Kraft des Faustschlusses gestiegen und es bestand bei den folgenden Untersuchungen kein statistisch signifikanter Unterschied mehr (p = 0,545; p = 0,278). Die Kraftmessungen der nicht operierten Hand ergaben folgende Ergebnisse: Nicht operierte Hand Tabelle 14: Kraftmessung des Faustschlusses der nicht operierten Hand mittels Handdynamometer im zeitlichen Verlauf. Präoperativ 1 Monat postoperativ 3 Monate postoperativ 6 Monate postoperativ 12 Monate postoperativ Mittelwert (kg) 25,09 Standardabweichung 8,17 Median (kg) 23,25 Minimum (kg) 6,70 Maximum (kg) 45,80 25,94 8,10 25,75 7,90 49,10 27,03 7,83 27,20 8,60 50,10 26,61 8,46 26,15 9,20 52,60 26,76 8,29 27,05 12,70 54,60 63
64 Abbildung 39: Kraftmessung des Faustschlusses der nicht operierten Hand mittels Handdynamometer im zeitlichen Verlauf, n = 40. Tabelle 15: Kraftmessung des Faustschlusses der nicht operierten Hand mittels Handdynamometer im Vergleich zu der präoperativen Voruntersuchung. Zeitlicher Verlauf 1 Monat postoperativ präoperativ 3 Monate postoperativ präoperativ 6 Monate postoperativ präoperativ 12 Monate postoperativ präoperativ Differenz der Mittelwerte (kg) 0,855 Standardabweichung p-wert 3,81 0,164 1,945 3,99 0,004 1,525 5,18 0,070 1,675 5,58 0,065 Drei Monate postoperativ zeigte sich eine statistisch signifikante Veränderung der Kraft des Faustschlusses durch Anstieg der Mittelwerte (p = 0,004), die allerdings bei der Abschlussuntersuchung zwölf Monate postoperativ nicht mehr nachzuweisen war (p = 0,065). 64
65 Die Mittelwerte der Kraftmessung der operierten Hand werden im Folgenden mit den Mittelwerten der Kraftmessung der nicht operierten Hand verglichen. Vergleich: operierte Hand vs. nicht operierte Hand Tabelle 16: Kraftmessung des Faustschlusses mittels Handdynamometer im zeitlichen Verlauf Mittelwerte im Vergleich: operierte Hand vs. nicht operierte Hand Zeitlicher Verlauf Differenz der Mittelwerte Operiert - Nicht Operiert -0,34 Präoperativ -9,22 1 Monat postoperativ -4,61 3 Monate postoperativ -2,41 6 Monate postoperativ -0,89 12 Monate postoperativ Standardabweichung p-wert 5,37 5,94 6,81 4,22 3,65 0,693 < 0,001 < 0,001 0,001 0,133 Abbildung 40: Kraftmessung des Faustschlusses mittels Handdynamometer im zeitlichen Verlauf; Vergleich: operierte Hand vs. nicht operierte Hand; p-werte; n =
66 Abbildung 41: Kraftmessung des Faustschlusses mittels Handdynamometer im zeitlichen Verlauf; Vergleich: operierte Hand vs. nicht operierte Hand, n = 40. Nach der Operation fiel die Kraft des Faustschlusses der operierten Hand statistisch signifikant ab (p < 0,001). Im weiteren Verlauf stieg die Kraft des Faustschlusses wieder an, lag nach zwölf Monate postoperativ über dem Ausgangswert und näherte sich dem Niveau der nicht operierten Hand Schmerzstärke Die Schmerzstärke wurde von den Patienten bei jeder Untersuchung auf einer Skala von eins bis zehn angegeben. Die Angaben bezogen sich jeweils auf die operierte Hand. Tabelle 17: Schmerzstärke (1-10) im Bereich der Narbe und/oder des sensiblen Innervationsgebietes des N. medianus im zeitlichen Verlauf. Präoperativ 1 Monat postoperativ 3 Monate postoperativ 6 Monate postoperativ 12 Monate postoperativ Mittelwert Standardabweichung Median Minimum Maximum 6,85 3,35 1,78 0,85 0,30 2,17 1,94 2,12 1,78 0,99 7,0 3,0 1,0 0,0 0,
67 Abbildung 42: Schmerzstärke (1-10) im Bereich der Narbe und/oder des sensiblen Innervationsgebietes des N. medianus im zeitlichen Verlauf, n = 40. Tabelle 18: Schmerzstärke im Bereich der Narbe und/oder des sensiblen Innervationsgebietes des N. medianus im Vergleich zu der präoperativen Voruntersuchung, p-werte, n = 40. Zeitlicher Verlauf Differenz der Mittelwerte 3,50 Präoperativ 1 Monat postoperativ 5,08 Präoperativ 3 Monate postoperativ 6,00 Präoperativ 6 Monate postoperativ 6,55 Präoperativ 12 Monate postoperativ Standardabweichung 2,34 p-wert < 0,001 2,52 < 0,001 2,45 < 0,001 2,40 < 0,001 Bereits einen Monat postoperativ zeigte sich ein statistisch signifikanter Abfall der Schmerzstärke im Vergleich zu den angegebenen Schmerzstärken der präoperativen Voruntersuchung (p < 0,001). Der Mittelwert der Schmerzstärke war innerhalb eines Jahres nach erfolgter Operation kontinuierlich gesunken, sodass er zwölf Monate postoperativ bei 0,3 (präoperativ: 6,85) lag. Insgesamt gaben nach zwölf Monaten noch 4 Probanden Schmerzen im Bereich der Hand an. Die weiteren 36 Patienten konnten die Studie schmerzfrei abschließen. 67
68 4.2.3 Provokationstests Jede Untersuchung beinhaltete die Überprüfung des Phalen-Tests und des HoffmannTinel-Zeichens. Phalen-Test Tabelle 19: Phalen-Test; Prozentuale Verteilung und Anzahl der Probanden im zeitlichen Verlauf. Präoperativ 1 Monat postoperativ 3 Monate postoperativ 6 Monate postoperativ 12 Monate postoperativ Prozentualer Anteil Anzahl der Probanden positiv 82,5 42,5 30,0 15,0 2,5 positiv negativ 17,5 57,5 70,0 85,0 97,5 negativ Abbildung 43: Phalen-Test; Prozentuale Verteilung im zeitlichen Verlauf, n = 40. Bei Abschluss der Studie wies lediglich ein Patient (2,5 %) noch einen positiven PhalenTest auf. Präoperativ war der Phalen-Test bei 33 Probanden (82,5%) positiv. Zwölf Monate nach erfolgter Operation konnten 39 Patienten (97,5%) die Studie mit negativem Testergebnis abschließen. 68
69 Hoffmann-Tinel-Zeichen Es wurde bei jeder Untersuchung versucht, das Hoffmann-Tinelsche-Klopfzeichen zu provozieren. Folgende Ergebnisse konnten zusammengestellt werden: Tabelle 20: Hoffmann-Tinel-Zeichen; Prozentuale Verteilung und Anzahl der Probanden im zeitlichen Verlauf Präoperativ 1 Monat postoperativ 3 Monate postoperativ 6 Monate postoperativ 12 Monate postoperativ Prozentualer Anteil Anzahl der Probanden positiv 67,5 42,5 27, ,5 positiv negativ 32,5 57,5 72, ,5 negativ Abbildung 44: Hoffmann-Tinel-Zeichen; Prozentuale Verteilung im zeitlichen Verlauf, n = 40. Es war ein deutlicher Abfall des prozentualen Anteils der Patienten zu erkennen, die ein positives Hoffmann-Tinel-Klopfzeichen aufwiesen. Von präoperativ 27 Probanden (67,5 %), die ein positives Testergebnis zeigten, war die Anzahl zwölf Monate postoperativ auf fünf Probanden (12,5 %) gesunken. 69
70 4.3 Ultraschalluntersuchung Der Nervus medianus der Probanden wurde mittels Ultraschall in vier verschiedenen Ebenen untersucht und vermessen (s ). Zusätzlich wurde die Beweglichkeit des Nervs innerhalb des Karpalkanals während aktiver Fingerbewegungen begutachtet und auf einer Skala von eins bis zehn eingeteilt. In der folgenden Ergebnisdarstellung wurde besonderer Wert auf die Betrachtung der Flächenveränderungen des N. medianus im Laufe eines Jahres nach erfolgter KTS-Operation gelegt. Die ermittelten Ergebnisse der operierten Hand werden den Ergebnissen der nicht operierten Hand jeweils gegenübergestellt Beweglichkeit des N. medianus innerhalb des Karpaltunnels Die Messung der Beweglichkeit des N. medianus innerhalb des Karpaltunnels wurde während aktiver Fingerbewegungen durchgeführt (s ). Operierte Hand Tabelle 21: Beweglichkeit (1-10) des N. medianus der operierten Hand innerhalb des Karpaltunnels im zeitlichen Verlauf. Präoperativ 1 Monat postoperativ 3 Monate postoperativ 6 Monate postoperativ 12 Monate postoperativ Mittelwert (1-10) Standardabweichung Median (1-10) Minimum (1-10) Maximum (1-10) 3,65 5,78 6,68 7,10 7,70 1,67 2,18 1,83 1,43 1,45 3,0 6,0 7,0 7,0 8,0 1,0 2,0 3,0 2,0 3,0 7,0 10,0 10,0 10,0 10,0 70
71 Abbildung 45: Beweglichkeit des N. medianus der operierten Hand innerhalb des Karpaltunnels im zeitlichen Verlauf, p-werte, n = 40. Tabelle 22: Beweglichkeit des N. medianus der operierten Hand im Vergleich zu der präoperativen Voruntersuchung, p-werte. Zeitlicher Verlauf Differenz der Mittelwerte 8,73 1 Monat postoperativ Präoperativ 14,55 3 Monate postoperativ Präoperativ 18,18 6 Monate postoperativ Präoperativ 20,88 12 Monate postoperativ Präoperativ Standardabweichung 13,26 p-wert < 0,001 16,47 < 0,001 18,66 < 0,001 20,64 < 0,001 Bereits einen Monat postoperativ war eine deutliche und statistisch signifikante Zunahme (p < 0,001) der Beweglichkeit des N. medianus innerhalb des Karpaltunnels zu erkennen. Zwölf Monate nach erfolgter Operation war der Mittelwert der Beweglichkeit von ursprünglich 3,65 (Median=3,0) auf 7,7 (Median=8) angestiegen. Es folgen die Ergebnisse der nicht operierten Hand. 71
72 Nicht operierte Hand Tabelle 23: Beweglichkeit des N. medianus der nicht operierten Hand innerhalb des Karpaltunnels im zeitlichen Verlauf. Präoperativ 1 Monat postoperativ 3 Monate postoperativ 6 Monate postoperativ 12 Monate postoperativ Mittelwert (1-10) Standardabweichung Median (1-10) 5,90 6,35 6,55 6,85 6,90 2,18 2,06 2,00 1,63 1,55 6,0 7,0 7,0 7,0 7,0 Minimum (1-10) 1,0 1,0 1,0 2,0 3,0 Maximum (1-10) 10,0 10,0 10,0 10,0 10,0 Abbildung 46: Beweglichkeit des N. medianus der nicht operierten Hand innerhalb des Karpaltunnels im zeitlichen Verlauf, p-wert, n = 40. Tabelle 24: Beweglichkeit des N. medianus der nicht operierten Hand innerhalb des Karpaltunnels im Vergleich zu der präoperativen Voruntersuchung, p-werte. Zeitlicher Verlauf Differenz der Mittelwerte 0,45 1 Monat postoperativ Präoperativ 0,65 3 Monate postoperativ Präoperativ 0,95 6 Monate postoperativ Präoperativ 1,00 12 Monate postoperativ Präoperativ 72 Standardabweichung 1,36 p-wert 0,043 1,37 0,005 1,87 0,003 2,14 0,005
73 Die Ergebnisse der Messung der Beweglichkeit des N. medianus der nicht operierten Hand zeigten im zeitlichen Verlauf ebenfalls eine statistisch signifikante Zunahme der Beweglichkeit. Bereits einen Monat postoperativ musste die Zunahme der Beweglichkeit als statistisch signifikant gewertet werden (p = 0,043). Der Vergleich der Ergebnisse der operierten Hand mit den Ergebnissen der nicht operierten Hand ergab folgende Resultate. Vergleich: operierte Hand vs. nicht operierte Hand Tabelle 25: Beweglichkeit des N. medianus innerhalb des Karpaltunnels im zeitlichen Verlauf; Mittelwerte im Vergleich: operierte Hand vs. nicht operierte Hand, p-werte. Zeitlicher Verlauf Präoperativ 1 Monat postoperativ 3 Monate postoperativ 6 Monate postoperativ 12 Monate postoperativ Mittelwert der Differenz Operierte Hand nicht operierte Hand -2,25-0,68 0,13 0,25 0,80 Standardabweichung 2,04 2,20 1,99 1,74 1,74 p-wert 0,000 0,060 0,693 0,368 0,006 Abbildung 47: Beweglichkeit des Nervus medianus innerhalb des Karpaltunnels; Mittelwerte im Vergleich: operierte Hand vs. nicht operierte Hand, p-werte, n =
74 Abbildung 48: Beweglichkeit des N. medianus innerhalb des Karpaltunnels; Mittelwerte im zeitlichen Verlauf, n = 40. Die präoperativ erhobenen Werte zeigten einen statistisch signifikanten Unterschied zwischen der Beweglichkeit des N. medianus der operierten und der nicht operierten Hand innerhalb des Karpaltunnels (p < 0,001). Während der Verlaufsbeobachtungen ein, drei, und sechs Monate postoperativ war kein statistisch signifikanter Unterschied mehr erkennbar. Bei der Abschlussuntersuchung nach zwölf Monaten überstieg die Beweglichkeit des Nervs der operierten Hand die Beweglichkeit des Nervs der nicht operierten Hand deutlich und statistisch signifikant (p = 0,006) Querschnittsfläche des Nervus medianus 4cm proximal der Rascetta Operierte Hand Tabelle 26: Querschnittsfläche des N. medianus der operierten Hand 4 cm proximal der Rascetta im zeitlichen Verlauf. Präoperativ 1 Monat postoperativ 3 Monate postoperativ 6 Monate postoperativ 12 Monate postoperativ Mittelwert (cm²) Standardabweichung Median (cm²) Minimum (cm²) Maximum (cm²) 0,093 0,093 0,095 0,093 0,097 0,020 0,029 0,029 0,021 0,023 0,093 0,089 0,090 0,092 0,096 0,05 0,05 0,05 0,06 0,06 0,15 0,20 0,22 0,16 0,15 74
75 Abbildung 49: Querschnittsfläche des N. medianus der operierten Hand 4 cm proximal der Rascetta im zeitlichen Verlauf, n = 40. Tabelle 27: Querschnittsfläche des N. medianus der operierten Hand 4 cm proximal der Rascetta im zeitlichen Verlauf; Vergleich zu der präoperativen Voruntersuchung; p-werte. Zeitlicher Verlauf Differenz der Mittelwerte -0, Monat postoperativ präoperativ 0, Monate postoperativ präoperativ -0, Monate postoperativ präoperativ 0, Monate postoperativ präoperativ Standardabweichung 0,029 p-wert 0,997 0,028 0,682 0,020 0,986 0,024 0,219 Im zeitlichen Verlauf nach Retinaculum flexorum-spaltung war ein Anstieg der Querschnittsfläche zu erkennen, der aber nicht als statistisch signifikant zu werten ist (p = 0,219). 75
76 Abbildung 50: Querschnittsfläche des N. medianus der operierten Hand 4 cm proximal der Rascetta; Mittelwerte im zeitlichen Verlauf, n = 40. Auch die Querschnittsfläche des N. medianus der nicht operierten Hand zeigte keine statistische Signifikanz in der Veränderung der Querschnittsfläche 4 cm proximal der Rascetta. Nicht operierte Hand Tabelle 28: Querschnittsfläche des N. medianus der nicht operierten Hand im zeitlichen Verlauf. Präoperativ 1 Monat postoperativ 3 Monate postoperativ 6 Monate postoperativ 12 Monate postoperativ Mittelwert (cm²) Standardabweichung Median (cm²) Minimum (cm²) Maximum (cm²) 0,094 0,093 0,096 0,091 0,097 0,029 0,023 0,026 0,030 0,028 0,088 0,087 0,094 0,082 0,092 0,05 0,05 0,05 0,06 0,05 0,17 0,17 0,16 0,19 0,17 76
77 Abbildung 51: Querschnittsfläche des N. medianus der nicht operierten Hand 4 cm proximal der Rascetta im zeitlichen Verlauf, n = 40. Tabelle 29: Querschnittsfläche des Nervus medianus der nicht operierten Hand 4 cm proximal der Rascetta im zeitlichen Verlauf; Vergleich zu der präoperativen Voruntersuchung; p-werte. Zeitlicher Verlauf Differenz der Mittelwerte -0, Monat postoperativ Präoperativ 0, Monate postoperativ Präoperativ -0, Monate postoperativ Präoperativ 0, Monate postoperativ Präoperativ Standardabweichung 0,028 p-wert 0,738 0,026 0,781 0,026 0,401 0,031 0,648 Zu keinem Zeitpunkt der Nachuntersuchungen war eine statistisch signifikante Veränderung der Querschnittsfläche des N. medianus der nicht operierten Hand 4 cm proximal der Rascetta feststellbar. Im Folgenden werden die ermittelten Mittelwerte der Querschnittsfläche der operierten und der nicht operierten Hand miteinander verglichen. 77
78 Vergleich: operierte Hand vs. nicht operierte Hand Tabelle 30: Querschnittsfläche des N medianus 4 cm proximal der Rascetta im zeitlichen Verlauf; Mittelwerte im Vergleich: Operierte Hand vs. nicht operierte Hand, p-werte. Zeitlicher Verlauf Differenz der Mittelwerte operierte Hand nicht operierte Hand -0,0018 Präoperativ -0, Monat postoperativ -0, Monate postoperativ 0, Monate postoperativ 0, Monate postoperativ Standardabweichung p-wert 0,026 0,023 0,028 0,024 0,027 0,657 0,920 0,811 0,656 0,872 Abbildung 52: Querschnittsfläche des N. medianus 4 cm proximal der Rascetta; Mittelwerte im zeitlichen Verlauf, n = 40. Im Vergleich der Mittelwerte der Querschnittsfläche des N. medianus der operierten und der nicht operierten Hand ergab sich 4 cm proximal der Rascetta kein statistisch signifikanter Unterschied (p-werte siehe Tabelle). 78
79 Die zweite Ebene, in der die Querschnittsfläche des N. medianus gemessen wurde, befand sich 2 cm proximal der Rascetta. 2cm proximal der Rascetta Operierte Hand Tabelle 31: Querschnittsfläche des N. medianus der operierten Hand 2 cm proximal der Rascetta im zeitlichen Verlauf. Präoperativ 1 Monat postoperativ 3 Monate postoperativ 6 Monate postoperativ 12 Monate postoperativ Mittelwert (cm²) Standardabweichung Median (cm²) Minimum (cm²) Maximum (cm²) 0,108 0,108 0,110 0,115 0,122 0,040 0,033 0,028 0,036 0,034 0,101 0,099 0,107 0,112 0,119 0,06 0,05 0,07 0,06 0,06 0,24 0,19 0,19 0,19 0,20 Es war ein Anstieg des Mittelwertes der Querschnittsfläche von 0,108 cm² auf 0,122 cm² erkennbar. Wie im Folgenden gezeigt, ist dieser Anstieg als statistisch signifikant zu werten (p = 0,021). Abbildung 53: Querschnittsfläche des N. medianus der operierten Hand 2 cm proximal der Rascetta im zeitlichen Verlauf, n =
80 Tabelle 32: Querschnittsfläche des N. medianus der operierten Hand 2 cm proximal der Rascetta im Vergleich zu der präoperativen Voruntersuchung; p-werte. Zeitlicher Verlauf 1 Monat postoperativ Präoperativ 3 Monate postoperativ Präoperativ 6 Monate postoperativ Präoperativ 12 Monate postoperativ Präoperativ Differenz der Mittelwerte (cm²) 0,0003 Standardabweichung p-wert 0,031 0,959 0,0026 0,033 0,628 0,0069 0,036 0,233 0,0141 0,037 0,021 Feststellbar war eine statistisch signifikante Zunahme der Querschnittsfläche des Nervs 2 cm proximal der Rascetta (p = 0,021). Abbildung 54: Querschnittsfläche des N. medianus, operierte Hand, 2cm proximal der Rascetta; Mittelwerte im zeitlichen Verlauf, n =
81 Die Querschnittsfläche des Nervs der nicht operierten Hand zeigte ebenfalls eine Zunahme der Querschnittsfläche des N. medianus. Nicht operierte Hand Tabelle 33: Querschnittsfläche des N. medianus der nicht operierten Hand 2 cm proximal der Rascetta im zeitlichen Verlauf. Zeitlicher Verlauf Präoperativ 1 Monat postoperativ 3 Monate postoperativ 6 Monate postoperativ 12 Monate postoperativ Mittelwert (cm²) Standardabweichung Median (cm²) Minimum (cm²) Maximum (cm²) 0,102 0,110 0,114 0,111 0,119 0,024 0,027 0,028 0,033 0,031 0,099 0,105 0,113 0,104 0,115 0,05 0,06 0,07 0,06 0,06 0,15 0,16 0,17 0,21 0,23 Abbildung 55: Querschnittsfläche des N. medianus der nicht operierten Hand 2 cm proximal der Rascetta im zeitlichen Verlauf, n =
82 Tabelle 34: Querschnittsfläche des N. medianus der nicht operierten Hand 2 cm proximal der Rascetta im Vergleich zu der präoperativen Voruntersuchung; p-werte. Zeitlicher Verlauf Differenz der Mittelwerte 0, Monat postoperativ präoperativ 0, Monate postoperativ präoperativ 0, Monate postoperativ präoperativ 0, Monate postoperativ präoperativ Standardabweichung 0,028 p-wert 0,094 0,031 0,021 0,027 0,037 0,030 0,001 Es war eine statistisch signifikante Vergrößerung der Querschnittsfläche des N. medianus der nicht operierten Hand innerhalb eines Jahres (p = 0,001) nachweisbar. Im Folgenden werden die Flächen der operierten Hand und der nicht operierten Hand im zeitlichen Verlauf miteinander verglichen. Vergleich: operierte Hand vs. nicht operierte Hand Tabelle 35: Querschnittsfläche des N. medianus 2 cm proximal der Rascetta im zeitlichen Verlauf; Vergleich: operierte Hand vs. nicht operierte Hand, p-werte. Zeitlicher Verlauf Differenz der Mittelwerte operierte Hand nicht operierte Hand 0,0058 Präoperativ -0, Monat postoperativ -0, Monate postoperativ 0, Monate postoperativ 0, Monate postoperativ 82 Standardabweichung p-wert 0,036 0,028 0,031 0,034 0,025 0,310 0,744 0,499 0,516 0,477
83 Abbildung 56: Querschnittsfläche des N. medianus 2cm proximal der Rascetta im zeitlichen Verlauf; Mittelwerte im Vergleich: operierte Hand vs. nicht operierte Hand, n = 40. Im Vergleich der Mittelwerte der Querschnittsfläche des N. medianus beider Hände war 2 cm proximal der Rascetta zu keinem Untersuchungszeitpunkt ein statistisch signifikanter Unterschied nachweisbar. 83
84 Auf Höhe der Rascetta Die Querschnittsfläche des N. medianus wurde in Ebene 3 auf Höhe der Rascetta gemessen und wird im Folgenden dargestellt. Operierte Hand Tabelle 36: Querschnittsfläche des N. medianus auf Höhe der Rascetta im zeitlichen Verlauf. Zeitlicher Verlauf Präoperativ 1 Monat postoperativ 3 Monate postoperativ 6 Monate postoperativ 12 Monate postoperativ Mittelwert (cm²) Standardabweichung Median (cm²) Minimum (cm²) Maximu m (cm²) 0,155 0,154 0,148 0,150 0,165 0,036 0,033 0,034 0,037 0,043 0,159 0,153 0,151 0,146 0,156 0,08 0,09 0,08 0,06 0,09 0,23 0,22 0,22 0,28 0,33 Abbildung 57: Querschnittsfläche des Nervus medianus auf Höhe der Rascetta im zeitlichen Verlauf. n =
85 Es zeigte sich über zwölf Monate hinweg keine statistisch signifikante Veränderung der Querschnittsfläche des N. medianus der operierten Hand auf Höhe der Rascetta. Tabelle 37: Querschnittsfläche des N. medianus der operierten Hand auf Höhe der Rascetta im Vergleich zu der präoperativen Untersuchung, p-werte. Zeitlicher Verlauf Differenz der Mittelwerte -0, Monat postoperativ Präoperativ -0, Monate postoperativ Präoperativ -0, Monate postoperativ Präoperativ 0, Monate postoperativ Präoperativ Standardabweichung 0,039 p-wert 0,786 0,039 0,254 0,035 0,396 0,046 0,207 Es konnte eine Zunahme der Querschnittsfläche innerhalb von zwölf Monaten von 0,198 cm² auf 0,210cm² beobachtet werden, die nicht als statistisch signifikant anzusehen ist (p = 0,207). Abbildung 58: Querschnittsfläche des Nervus medianus der operierten Hand auf Höhe der Rascetta, Mittelwerte im zeitlichen Verlauf 85
86 Die Messungen der Querschnittsfläche des N. medianus der nicht operierten Hand zeigten auf Höhe der Rascetta folgende Ergebnisse: Nicht operierte Hand Tabelle 38: Querschnittsfläche des N. medianus der nicht operierten Hand auf Höhe der Rascetta im zeitlichen Verlauf. Zeitlicher Verlauf Präoperativ 1 Monat postoperativ 3 Monate postoperativ 6 Monate postoperativ 12 Monate postoperativ Mittelwert (cm²) 0,146 0,143 0,147 0,160 0,158 Standardabweichung 0,045 0,048 0,049 0,055 0,052 Median (cm²) 0,132 0,133 0,140 0,148 0,147 Minimum (cm²) 0,09 0,07 0,07 0,08 0,09 Maximum (cm²) 0,32 0,34 0,34 0,35 0,31 Abbildung 59: Querschnittsfläche des N. medianus der nicht operierten Hand auf Höhe der Rascetta im zeitlichen Verlauf, n = 40. Nach zwölf Monaten zeigte sich eine statistisch signifikante Veränderung der Mittelwerte der Querschnittsfläche des Nervs der nicht operierten Hand (p = 0,029). 86
87 Tabelle 39: Querschnittsfläche des N. medianus der nicht operierten Hand auf Höhe der Rascetta im Vergleich zu der präoperativen Voruntersuchung, p-werte. Zeitlicher Verlauf Differenz der Mittelwerte -0, Monat postoperativ Präoperativ 0, Monate postoperativ Präoperativ 0,014 6 Monate postoperativ Präoperativ 0, Monate postoperativ Präoperativ Standardabweichung 0,028 p-wert 0,509 0,035 0,797 0,033 0,008 0,034 0,029 Im Folgenden werden die Ergebnisse der operierten und der nicht operierten Hand gemessen auf Höhe der Rascetta im zeitlichen Verlauf gegenübergestellt: Vergleich: operierte Hand vs. nicht operierte Hand Tabelle 40: Querschnittsfläche des N. medianus auf Höhe der Rascetta im zeitlichen Verlauf, Mittelwerte im Vergleich: operierte Hand vs. nicht operierte Hand, p-werte. Zeitlicher Verlauf Differenz der Mittelwerte operierte Hand nicht operierte Hand 0,0092 Präoperativ 0, Monat postoperativ 0, Monate postoperativ -0, Monate postoperativ 0, Monate postoperativ 87 Standardabweichung p-wert 0,046 0,048 0,036 0,047 0,039 0,213 0,178 0,910 0,193 0,309
88 Abbildung 60: Querschnittsfläche des Nervus medianus auf Höhe der Rascetta im zeitlichen Verlauf, Mittelwerte im Vergleich: operierte Hand vs. nicht operierte Hand, p-werte. Im Laufe eines Jahres nach erfolgter Operation war kein statistisch signifikanter Unterschied zwischen den Querschnittsflächen des N. medianus der operierten und der nicht operierten Hand auf Höhe der Rascetta feststellbar (p = 0,309; s. Tabelle 40). 88
89 1 cm distal der Rascetta Die Messung der Querschnittsfläche des N. medianus 1 cm distal der Rascetta hat folgende Ergebnisse ergeben. Die Ebene 4 befindet sich je nach individueller Anatomie auf Höhe des bzw. direkt distal des Karpaltunnels 22. Operierte Hand Tabelle 41: Querschnittsfläche des N. medianus 1 cm distal der Rascetta im zeitlichen Verlauf Präoperativ 1 Monat postoperativ 3 Monate postoperativ 6 Monate postoperativ 12 Monate postoperativ Mittelwert (cm²) Standardabweichung Median (cm²) Minimum (cm²) Maximum (cm²) 0,175 0,165 0,159 0,168 0,174 0,054 0,048 0,049 0,050 0,058 0,169 0,161 0,154 0,158 0,158 0,09 0,07 0,07 0,09 0,09 0,33 0,27 0,25 0,29 0,30 Abbildung 61: Querschnittsfläche des Nervus medianus 1 cm distal der Rascetta im zeitlichen Verlauf, n =
90 Tabelle 42: Querschnittsfläche des N. medianus der operierten Hand 1 cm distal der Rascetta im Vergleich zu der präoperativen Voruntersuchung, p-werte. Zeitlicher Verlauf Differenz der Mittelwerte -0, Monat postoperativ Präoperativ -0, Monate postoperativ Präoperativ -0, Monate postoperativ Präoperativ -0, Monate postoperativ Präoperativ Standardabweichung 0,049 p-wert 0,194 0,053 0,062 0,051 0,367 0,056 0,901 Innerhalb von zwölf Monaten nach erfolgter Operation zeigte sich 1 cm distal der Rascetta keine statistisch signifikante Veränderung der Querschnittsfläche des N. medianus der operierten Hand (p = 0,901). Die Messung der Querschnittsfläche der nicht operierten Hand ergab folgende Ergebnisse: Nicht operierte Hand Tabelle 43: Querschnittsfläche des Nervus medianus der nicht operierten Hand 1 cm distal der Rascetta im zeitlichen Verlauf. Präoperativ 1 Monat postoperativ 3 Monate postoperativ 6 Monate postoperativ 12 Monate postoperativ Mittelwert (cm²) Standardabweichung Median (cm²) Minimum (cm²) Maximum (cm²) 0,150 0,144 0,156 0,162 0,160 0,053 0,042 0,058 0,056 0,057 0,141 0,141 0,147 0,155 0,155 0,07 0,08 0,08 0,09 0,07 0,32 0,32 0,41 0,40 0,36 90
91 Abbildung 62: Querschnittsfläche des N. medianus der nicht operierten Hand 1 cm distal der Rascetta im zeitlichen Verlauf, n = 40. Es ergab sich, vergleicht man die Werte der Nachuntersuchung nach zwölf Monaten mit den Werten der Voruntersuchung, kein statistisch signifikanter Unterschied (p = 0,162). Tabelle 44: Querschnittsfläche des N. medianus der nicht operierten Hand 1 cm distal der Rascetta im Vergleich zu der präoperativen Voruntersuchung, p-werte. Zeitlicher Verlauf Differenz der Mittelwerte -0, Monat postoperativ Präoperativ 0, Monate postoperativ Präoperativ 0, Monate postoperativ Präoperativ 0, Monate postoperativ Präoperativ 91 Standardabweichung 0,035 p-wert 0,290 0,043 0,383 0,041 0,084 0,044 0,162
92 Im Folgenden werden die ermittelten Flächen des N. medianus der operierten Hand denen der nicht operierten Hand gegenübergestellt. Vergleich: operierte Hand vs. nicht operierte Hand Tabelle 45: Querschnittsfläche des Nervus medianus 1 cm distal der Rascetta, Mittelwerte im Vergleich: operierte Hand vs. nicht operierte Hand, p-werte. Zeitlicher Verlauf Differenz der Mittelwerte operierte Hand nicht operierte Hand 0,0255 Präoperativ 0, Monat postoperativ 0, Monate postoperativ 0, Monate postoperativ 0, Monate postoperativ Standardabweichung p-wert 0,053 0,045 0,058 0,047 0,047 0,004 0,005 0,709 0,386 0,059 Abbildung 63: Querschnittsfläche des N. medianus 1 cm distal der Rascetta, Mittelwerte im Vergleich: Operierte Hand vs. nicht operierte Hand Erkennbar ist, dass sich die Querschnittsflächen des Nervus medianus der operierten und der nicht operierten Hand präoperativ sowie einen Monat postoperativ statistisch signifikant unterschieden (p = 0,004, p = 0,005; s. Tabelle 45). Drei Monate nach erfolgter 92
93 Operation haben sich die Querschnittsflächen soweit angenähert, dass kein statistisch signifikanter Unterschied mehr nachzuweisen war (p = 0,709) Zusammenfassung der Ultraschallergebnisse Um die Ergebnisse der Ultraschalluntersuchung besser begutachten und beurteilen zu können, folgt nun eine Gegenüberstellung der Querschnittsflächen des N. medianus in Form von Linien-Diagrammen, die vereinzelt bereits in Kapitel 4.3, dort allerdings isoliert, vorgestellt wurden. Tabelle 46: Mittelwerte der Querschnittsflächen des N. medianus der operierten Hand in verschiedenen Ebenen im zeitlichen Verlauf (s. Abbildung 64). Präoperativ 1 Monat postoperativ 3 Monate postoperativ 6 Monate postoperativ 12 Monate postoperativ 4 cm proximal der Rascetta 0,093 2 cm proximal der Rascetta 0,108 Auf Höhe der Rascetta 0,155 1 cm distal der Rascetta 0,175 0,093 0,108 0,154 0,165 0,095 0,110 0,148 0,159 0,093 0,115 0,150 0,168 0,097 0,122 0,165 0,174 Tabelle 47: Mittelwerte der Querschnittsflächen des N. medianus der nicht operierten Hand in verschiedenen Ebenen im zeitlichen Verlauf (s. Abbildung 65). 4 cm proximal der Rascetta 2 cm proximal der Rascetta Auf Höhe der Rascetta 1 cm distal der Rascetta Präoperativ 0,094 0,102 0,146 0,150 1 Monat postoperativ 3 Monate postoperativ 6 Monate postoperativ 12 Monate postoperativ 0,093 0,110 0,143 0,144 0,096 0,114 0,147 0,156 0,091 0,111 0,160 0,162 0,097 0,119 0,158 0,160 93
94 Abbildung 64: Mittelwerte der Querschnittsfläche des N. medianus der operierten Hand in allen vier Ebenen im zeitlichen Verlauf, n = 40 (s. Tab. Tabelle 46). Abbildung 65: Mittelwerte der Querschnittsfläche des Nervus medianus der nicht operierten Hand in allen vier Ebenen im zeitlichen Verlauf, n = 40 (s. Tab. Tabelle 47). 94
95 Abbildung 66: Querschnittsfläche des N. medianus 4cm proximal der Rascetta, Mittelwerte im Vergleich (s. Tabelle 30). Abbildung 67: Querschnittsfläche des N. medianus 2 cm proximal der Rascetta; Mittelwerte im Vergleich (s. Tabelle 35). Abbildung 68: Querschnittsfläche des N. medianus auf Höhe der Abbildung 69: Querschnittsfläche des N. medianus 1 cm distal der Rascetta; Mittelwerte im Vergleich (s. Tabelle 45). Rascetta; Mittelwerte im Vergleich (s. Tabelle 40). 95
96 5. Diskussion Das Karpaltunnelsyndrom hat einen hohen klinischen Stellenwert, da die Prävalenz in der Bevölkerung, je nach Einschlusskriterien der Studien und Definition des KTS, mit 2,5% bis 11 % angegeben wird 28, 61. Diagnostik und Therapie erfordern meist ein interdisziplinäres Zusammenarbeiten. Die vorliegende Dissertation hat sich mit der Gegenüberstellung zweier diagnostischer Verfahren beschäftigt, die im klinischen Alltag zur Diagnostik des Karpaltunnelsyndroms zusätzlich zur klinischen Untersuchung zur Anwendung kommen. Die elektrophysiologische / elektroneurographische Untersuchung (ENG) des N. medianus gilt in der Diagnostik eines Karpaltunnelsyndroms als etabliert und wird in der AWMFKTS-Leitlinie der deutschen Gesellschaften für Handchirurgie, Neurochirurgie, Neurologie und Orthopädie zur Diagnosesicherung eines KTS empfohlen 8. Auch die American Association of Electrodiagnostic Medicine (AAEM) rät zur elektrophysiologischen Untersuchung in der Diagnostik eines KTS 1. Die Aussagekraft der ENG in der KTS-Diagnostik konnte in mehreren Studien bestätigt werden 9, 52, 81. Die elektroneurographische Untersuchung kann zwar nicht als Goldstandard angesehen werden 28, 70, wird aber, wie soeben erwähnt, zur Diagnosesicherung empfohlen und in zahlreichen Studien als Referenzverfahren für andere Diagnostiken eingesetzt 17, 30, 38, 57, 72. Es ist allerdings zu erwähnen, dass bislang kein alternatives diagnostisches Verfahren existiert, dass in seiner Aussagekraft höher erscheint oder als Goldstandard angesehen werden könnte 9. Somit kann die Sensitivität und Spezifität des Verfahrens nicht an einem Goldstandard festgemacht werden, sondern muss in klinisch-vergleichenden Studien ermittelt werden 9. Des Weiteren muss die Sensitivität und Spezifität für einzelne Parameter und verschiedene elektrophysiologische Testungen berücksichtigt werden. Eine Übersicht wurde von der American Association of Electrodiagnostic Medicine (AAEM) zusammengestellt 1. In der vorliegenden Studie wurden bei jeder elektrophysiologischen Untersuchung sechs Parameter bestimmt (s ). Ein besonderes Augenmerk galt der sensiblen Nervenleitgeschwindigkeit des N. medianus und der distal-motorischen Latenz, die als wichtige Parameter in der Diagnosesicherung eines KTS Verwendung finden 1, 9. Die Sensitivität der sensiblen Nervenleitgeschwindigkeit beträgt 65 %, die Spezifität 98 %. 96
97 Die distal-motorische Latenz weist ähnliche Werte auf: Sensitivität 63 %, Spezifität 98 % 1. Die ENG ist in der Diagnosebestätigung eines Karpaltunnelsyndroms zwar etabliert, wird von vielen Patienten allerdings als unangenehm empfunden und ist mit einem erhöhten Zeitaufwand verbunden, da sie meist in neurologischen Kliniken oder Praxen durchgeführt wird. Bei milder KTS-Symptomatik kann die ENG zwar hilfreich sein 72, die Diagnosestellung erfolgt allerdings primär an Hand anamnestischer Erhebungen und klinischer Untersuchungen 7. Da die ENG mit einem erhöhten Zeitaufwand, unangenehmen Empfindungen für die Patienten und mit einem erhöhten Kostenaufwand für das Gesundheitssystem verbunden ist, ist es wichtig, alternative Diagnoseverfahren zu suchen und zu erforschen 119. In diesem Zusammenhang spielt die Ultraschalluntersuchung als bildgebendes Verfahren eine immer größere Rolle 12, 70, 72, 89, 119. Die Sonographie ist allgemein häufiger verfügbar als die ENG. Zudem ist die Sonographie im Gegensatz zu der ENG schmerzfrei, schnell und kostengünstig durchführbar 19. Bei der sonographischen Beurteilung eines Karpaltunnelsyndroms gilt die Bestimmung der Querschnittsfläche des N. medianus als wichtigster Parameter 51, 70, 119. Als Messebene für die Beurteilung sollte der proximale Karpaltunnel gewählt werden, da die Messung der Querschnittsfläche an dieser Stelle die höchste Aussagekraft zu haben scheint 7, 72, 120, 122 und zudem für unerfahrene Untersucher am leichtesten durchführbar ist 47. Die sonographische Orientierung sollte an Hand der Darstellung des Retinaculum flexorum 119, 120 oder der Darstellung des Os pisiforme 47 erfolgen. Die Angaben zu Sensitivitäten und Spezifitäten der sonographischen Untersuchung des N. medianus variieren stark. Die Sensitivität wird je nach Studie mit 48% bis 89% und die Spezifität mit bis zu 96 % angegeben 34, 58, 72, 122. Es bestehen bislang keine einheitlichen Referenzwerte für die Querschnittsfläche des N. medianus, sodass auch die Festlegung des Cut-Off für pathologische Werte Einfluss auf die Bestimmung der Sensitivität und Spezifität nimmt 72. Variable Angaben kommen somit durch unterschiedliche Festlegungen des Cut-Off und/oder unterschiedliche Messebenen zustande. Am häufigsten werden Querschnittsflächen von mehr als 0,90 cm² - 0,11 cm² als pathologisch definiert 7, 34, 58, 72, 122. Wong et al. haben in einer großen prospektiven Studie aus dem Jahre 2002 (195 Handgelenke; 120 Patienten) bei Werten > 0,98 cm² (gemessen im proximalen Karpaltunnel) eine Sensitivität von 89 % und eine Spezifität von 83% beschrieben 120. Die Sensitivität ist somit höher als die der elektroneuro97
98 graphischen Untersuchung (63% bzw. 65%), die Spezifität allerdings geringer (ENG: 98%). Die Beweglichkeit innerhalb des Karpaltunnels und die Beurteilung der Echogenität des N. medianus kann ebenfalls untersucht werden. Diese beiden Verfahren gelten aber als nicht so aussagekräftig wie die Bestimmung der Querschnittsfläche des N. medianus 7, 94, 120. Wie soeben erwähnt, konnte in mehreren Studien nachgewiesen werden, dass die hochauflösende Sonographie die Diagnose eines Karpaltunnelsyndroms sichern kann 34, 71, 90. Es konnte auch nachgewiesen werden, dass Korrelationen zwischen den Veränderungen der sensiblen Nervenleitgeschwindigkeit, der distal-motorischen Latenz und der sonographisch ermittelten Querschnittsfläche des N. medianus bestehen 72, 123. Die Ultraschalluntersuchung kann zudem laut Rahmani et al. (2011) bei Patienten mit negativem Befund in der elektrophysiologischen Untersuchung des N. medianus Hinweise auf das Vorliegen eines KTS geben 90. Die hochauflösende Sonographie kommt somit als alternatives Verfahren zur elektroneurographischen Untersuchung in Frage 119. Allerdings mangelt es noch an einheitlichen Referenzwerten, die die pathologischen Werte für die Querschnittsfläche des N. medianus definieren und somit die Diagnosestellung eines Karpaltunnelsyndroms mittels hochauflösender Sonographie standardisiert ermöglichen. Es scheint sich aber ein Cut-Off für die Querschnittsfläche des N. medianus im proximalen Karpaltunnel zwischen 9mm² und 11mm² abzuzeichnen Diskussion der Studienergebnisse Die vorliegende Studie hat bei n = 40 Patienten mit der Erstdiagnose eines Karpaltunnelsyndroms die Entwicklung der Messergebnisse der elektroneurographischen Untersuchung sowie der hochauflösenden Sonographie des N. medianus im Laufe eines Jahres untersucht. Die Probanden erhielten insgesamt fünf Untersuchungen, die wie folgt gestaffelt wurden: Untersuchung 1 präoperativ Untersuchung 2 1 Monat postoperativ Untersuchung 3 3 Monate postoperativ Untersuchung 4 6 Monate postoperativ Untersuchung 5 12 Monate postoperativ 98
99 Die Ergebnisse der postoperativen Untersuchungen wurden denen der präoperativen Untersuchung gegenübergestellt und Unterschiede im direkten Vergleich der operierten Hand mit der nicht operierten Hand herausgearbeitet. Die Diagnose Karpaltunnelsyndrom wurde bei allen in die Studie eingeschlossenen Patienten durch einen Handchirurgen klinisch gestellt und durch die Elektroneurographie (ENG) bestätigt. Zeigten sich bei Betrachtung der sensiblen Nervenleitgeschwindigkeit oder der distal-motorischen Latenz keinerlei pathologische Veränderungen, wurden weitere elektrophysiologische Testungen gemäß der AAEM-Empfehlung 1 durchgeführt. Bei fünf Probanden (12,5 %) ließ sich, trotz erweiterter Testungen und trotz klinisch gesichertem KTS kein Hinweis auf elektrophysiologische Veränderungen des N. medianus finden. Dieser Anteil (12,5 %) liegt unterhalb der in der aktuellen Literatur angegebenen Werte, denn % der Patienten mit klinisch gesichertem KTS zeigen in der elektrophysiologischen Untersuchung keinerlei Veränderungen, die auf ein KTS hinweisen könnten 33, 62, 87. Die soeben beschriebenen fünf Patienten wurden ebenfalls in die Studie eingeschlossen, da allein die klinisch gesicherte Diagnose eines KTS als Einschlusskriterium galt (s. 3.1). Mondelli et al. (2008) haben beschrieben, dass die Diagnosestellung bei KTS-Diagnostik-Studien lediglich durch klinische Kriterien und Untersuchungen erfolgen sollte, um eine Vergleichbarkeit der Diagnoseverfahren zu gewährleisten 72. Der jüngste rekrutierte Patient war 32 Jahre und der älteste Patient 82 Jahre alt. Das mittlere Alter des Patientenkollektivs lag bei 56,6 Jahren (Median 55 Jahre). Das Haupterkrankungsalter des Karpaltunnelsyndroms liegt zwischen 45 und 54 Jahren 39, 109. Von Bland et al. wird ein zweiter Altersgipfel zwischen dem 74. und 80. Lebensjahr beschrieben 15. Da in die vorliegende Studie Patienten eingeschlossen wurden, die dem von Bland et al. beschriebenen Alter entsprechen, ist bei der Altersverteilung der Studienpopulation von einer für ein KTS normalen Verteilung auszugehen. Die Geschlechterverteilung des Patientenguts lag bei einem Verhältnis von Frauen zu Männern von 9:1 deutlich über den in der Literatur zu findenden Angaben von bis zu 3:1 39,
100 Elektrophysiologische Untersuchung Die elektrophysiologischen Untersuchungen wurden alle von derselben MTA für Elektroneurophysiologie der neurologischen Klinik des Universitätsklinikums Bergmannsheil in Bochum durchgeführt. Es wurden alle von der Deutschen Gesellschaft für Elektroneurophysiologie (DGKN) genannten und in der AWMF-KTS-S3-Leitlinie gelisteten Kriterien für eine standardisierte Untersuchung relevanten Kriterien erfüllt bzw. eingehalten (s. 1.6) 8. Eine Vergleichbarkeit der Ergebnisse konnte somit gewährleistet werden. Die vorliegende Studie hat die sensible Nervenleitgeschwindigkeit und die distal motorische Latenz als zwei wichtige Parameter 8, 9, 43, 82 in der elektroneurographischen Erfassung von pathologischen Veränderungen des N. medianus im Rahmen eines KTS untersucht. Im Laufe eines Jahres war eine deutliche und statistisch signifikante Verbesserung der beiden soeben genannten Parameter zu erkennen. Die distal-motorische Latenz ist von im Mittel 4,30 ms auf 3,62 ms abgesunken und lag bereits einen Monat postoperativ im physiologischen Bereich (< 4,0 ms). Im Vergleich zu der präoperativen Voruntersuchung zeigte sich zu diesem Zeitpunkt bereits ein statistisch signifikanter Unterschied (p = 0,028), der zwölf Monate postoperativ noch ausgeprägter war (p = 0,003). Es ließ sich also eine kontinuierliche Verbesserung der distal-motorischen Latenz des N. medianus der operierten Hand nachweisen. Die sensible Nervenleitgeschwindigkeit (NLG) des N. medianus der operierten Hand zeigte ebenfalls eine statistisch signifikante Verbesserung im Laufe des Untersuchungszeitraums. Der Median der NLG stieg von im Mittel 17,5 m/s auf 46,5 m/s. Bereits einen Monat postoperativ konnte ein statistisch signifikanter Unterschied im Vergleich zu der präoperativen Voruntersuchung festgestellt werden (p < 0,001). Es konnte somit nachgewiesen werden, dass die distal-motorische Latenz und die sensible Nervenleitgeschwindigkeit des N. medianus nach operativer Sanierung des KTS eine rasche und statistisch signifikante Verbesserung zeigen. Diese Ergebnisse decken sich mit den Ergebnissen aktueller Literatur. El-Hajj et al. (2010) haben eine statistisch signifikante Besserung der distal-motorischen Latenz und der sensiblen Nervenleitgeschwindigkeit 18 und 42 Wochen nach erfolgter Operation nachgewiesen 32. Ginanneschi et al (2008) haben ebenfalls statistisch signifikant verbesserte Werte nach Retinakulum-Spaltung nachgewiesen und bezeichnen die elektrophysiologische Untersuchung als wichtiges und objektives Untersuchungsverfahren zur Registrierung des Outcomes nach chirurgischer Intervention bei KTS-Patienten
101 Klinische Untersuchung Die klinische Untersuchung umfasste eine Inspektion und Palpation beider Hände und die Durchführung des Phalen-Tests sowie eine Auslösung des Hoffmann-Tinel-Zeichens. Diese beiden Tests gelten zu den am häufigsten durchgeführten Provokationstests in der Diagnosestellung eines Karpaltunnelsyndroms 14, 66. Die Sensitivität des Phalen-Tests wird mit 85 % angegeben. Die Spezifität beträgt 89 %. Die Sensitivität des HoffmannTinel-Zeichens beträgt laut Bruske et al. (2002) 67 %. Die Spezifität beläuft sich auf 68 % 18. In der durchgeführten Studie fiel der Phalen-Test in der präoperativen Voruntersuchung bei 33 Patienten (82,5 %) positiv aus. Zwölf Monate nach erfolgter operativer Sanierung des Karpaltunnelsyndroms war der Phalen-Test noch lediglich bei einem Patienten (2,5 %) als positiv zu werten. Auch bei der Auslösung des HoffmannTinel-Zeichens zeigte sich im zeitlichen Verlauf postoperativ ein deutlicher Abfall der positiven Testergebnisse. Von initial 27 Patienten (67,5 %) mit positivem Hoffmann-TinelZeichen fiel der Test zwölf Monate postoperativ nur noch bei fünf Probanden (12,5%) positiv aus. Im postoperativen Verlauf ging somit bei beiden Provokationstestungen der Anteil an Patienten deutlich zurück, die ein positives Testergebnis aufwiesen. Die Durchführung der Provokationstests kann laut den Ergebnissen dieser Studie zur postoperativen Kontrolle des KTS also durchaus sinnvoll sein. In einer Studie von Mondelli et al (2001) wurden in der präoperativen Diagnostik geringere Anteile von Patienten mit positiven Testergebnissen festgestellt. So wiesen lediglich 59 % der von Mondelli et al. untersuchten Patienten einen positiven Phalen-Test auf. Bei 41 % der für die Studie von Mondelli et al. rekrutierten Patienten ließ sich das Hoffmann-Tinel-Zeichen auslösen 74. Diese Tatsache lässt sich eventuell darauf zurückführen, dass von Mondelli in diese Studie nicht ausschließlich klinisch diagnostizierte KTS-Patienten aufgenommen wurden, sondern auch pathologisch veränderte elektrophysiologische Tests als Einschlusskriterium gewertet wurden. Wird die Diagnose des KTS primär durch klinische Untersuchungen gestellt, sind die Provokationstests schon an der Auswahl des zu rekrutierenden Patientengutes beteiligt und der Anteil der Patienten mit positivem Testergebnis fällt wie in der dieser Dissertation zu Grunde liegenden Studie höher aus. Neben den Provokationstestungen wurden eine Kraftmessung des Faustschlusses mittels Handdynamometer sowie eine ausführliche Schmerzanamnese durchgeführt. Durch die Handdynamometermessung konnten postoperative Entwicklungen der Kraft des Faustschlusses, die bei Karpaltunnelsyndrom-Patienten eingeschränkt sein kann 7, festgehalten werden. 101
102 Es zeigte sich postoperativ ein statistisch signifikanter Abfall (p < 0,001) der Kraft der operierten Hand. Im weiteren Verlauf konnte eine Zunahme der Kraft beobachtet werden. Zwölf Monate postoperativ zeigte sich im Vergleich zu der präoperativen Voruntersuchung kein statistisch signifikanter Unterschied der Kraft des Faustschlusses. Diese Entwicklung der Kraft kann eventuell auf die direkt postoperativen Irritationen der operierten Hand zurückgeführt werden. Im Laufe eines Jahres zeigte sich eine vollständige Wiederherstellung der Kraft. Die Patienten sollten zusätzlich zu den durchgeführten Tests ihre subjektive Schmerzstärke im Bereich der von dem KTS betroffenen und operierten Hand auf einer Skala von eins bis zehn angeben. Es konnte beobachtet werden, dass die Schmerzen, die präoperativ im Mittel mit 6,85 angegeben wurden, zwölf Monate postoperativ auf 0,30 gesenkt werden konnten. Bereits einen Monat postoperativ war der Mittelwert der angegebenen Schmerzstärke statistisch signifikant (p < 0,001) auf einen Wert von 3,35 gesunken. Es hat sich in den Ergebnissen der Studie also gezeigt, dass aus der operativen Sanierung des Karpaltunnelsyndroms für die Patienten eine rasche und deutliche Reduktion von Schmerzen resultiert. Ultraschalluntersuchung In der vorliegenden Studie wurde die Querschnittsfläche des N. medianus in vier verschiedenen Ebenen über einen Zeitraum von zwölf Monaten nach erfolgter KTSOperation bestimmt. Die Querschnittsfläche gilt als der wichtigste Parameter in der sonographischen Beurteilung eines Karpaltunnelsyndroms 51, 70, 119. Die Sensitivität wird mit bis zu 89 % und die Spezifität mit bis zu 96 % abgegeben 34, 58, 72. Die gemessenen Ebenen wurden an Hand des Abstandes von der Rascetta festgelegt: - 4 cm proximal der Rascetta (Ebene 1), - 2 cm proximal der Rascetta (Ebene 2), - auf Höhe der Rascetta (Ebene 3), - 1 cm distal der Rascetta (Ebene 4). Der Nachteil dieser Lokalisationswahl ist, dass individuelle anatomische Gegebenheiten nicht berücksichtigt werden. Auch wenn Ebene 3 meist unmittelbar proximal des Karpaltunnels und Ebene 4 auf Höhe des Karpaltunnels liegen 22, 96 und somit die Querschnittsfläche des N. medianus in dem besonders relevanten Bereich untersucht wurde 70, sollte die Wahl der Ebenen mittels anatomischer Landmarken, wie z. B. durch 102
103 Darstellung des Retinaculum flexorum oder des Os pisiforme, festgemacht werden 119, 120. Die Querschnittsfläche des Nervus medianus wurde durch Messung der Höhe und Breite (anteroposteriorer und mediolateraler Diameter) des in transversaler Ebene geschallten Nervs und anschließender Berechnung der Fläche als Ellipse erfasst. Die Erfassung der Querschnittsfläche durch Umfahren des Nervs und automatische Berechnung während der Ultraschalluntersuchung soll größere Genauigkeit mit sich bringen 7, 58, 77 und sollte der Berechnung der Fläche als Ellipse laut Assmus et al. (2008) und Kele et al. (2003) vorgezogen werden 7, 58. Moran et al. (2009) haben hingegen keinen statistisch signifikanten Unterschied zwischen beiden Messverfahren nachweisen können 75. In der Zusammenschau der Ergebnisse zeigte sich in Ebene 4 präoperativ ein statistisch signifikanter Unterschied zwischen den Querschnittsflächen des N. medianus der operierten und der nicht operierten Hand (p = 0,004). Die Querschnittsfläche der operierten Hand war im Bereich des Karpaltunnels statistisch signifikant größer als die Querschnittsfläche des Nervs der nicht operierten Hand. Die pathologische Vergrößerung der Querschnittsfläche des N. medianus innerhalb des Karpaltunnels ist das aussagekräftigste Kriterium bei der sonographischen Diagnosesicherung eines KTS 7, 72, 75, 119, 121. Wong et al (2002) haben bei Patienten mit Karpaltunnelsyndrom im Vergleich zu einer gesunden Kontrollgruppe eine statistisch signifikant größere Querschnittsfläche des N. medianus im Bereich des Karpaltunneleingangs feststellen können 120. Die Ergebnisse von Wong et al. decken sich mit den Ergebnissen der in Ebene 4 gemessenen Werte dieser Studie. Allerdings konnten Wong et al. auch einen statistisch signifikanten Unterschied der Querschnittsflächen beider Gruppen proximal des Karpaltunnels nachweisen. Diese Messebene entspricht in etwa der Ebene 3 der dieser Dissertation zu Grunde liegenden Studie. Es konnten in Ebene 3 allerdings keinerlei statistisch signifikante Differenzen zwischen den Querschnittsflächen des N. medianus der operierten und der nicht operierten Hand festgestellt werden (p = 0,231). Die Ebenen 1 und 2 zeigten im Vergleich der operierten und der nicht operierten Hand ebenfalls keine statistisch signifikanten Unterschiede (Ebene 1: p=0,657; Ebene 2: p=0,310). Beide Ebenen befinden sich im Bereich des distalen Drittels des Unterarms. Die ermittelten Ergebnisse korrelieren mit den Ergebnissen der von Wong et al. durchgeführten Studie, in der im Bereich des Unterarms ebenfalls keine statistisch signifikanten Unterschiede zwischen den Probanden der KTS-Gruppe und denen der Kontrollgruppe bestanden
104 Die Ergebnisse wurden im Laufe eines Jahres ermittelt und Veränderungen im postoperativen Verlauf ausgearbeitet. Mondelli et al. (2008) haben eine postoperative Abnahme der Querschnittsfläche des Nervs im proximalen Karpaltunnel und eine postoperative Zunahme der Querschnittsfläche im distalen Karpaltunnel nachweisen können 71. Auch Colak et al. (2007) beschrieben eine postoperative Abnahme der Querschnittsfläche des Nervus medianus 23. Diese Beobachtungen werden von Mondelli et al. (2008) auf ein präoperativ bestehendes Nervenödem im proximalen Karpaltunnel zurückgeführt 71, das sich postoperativ zurückbildet. Die meist später einsetzende Vergrößerung der Querschnittsfläche im distalen Karpaltunnel wird am wahrscheinlichsten durch die Aufhebung der Kompression im Karpaltunnel ausgelöst 71. In der vorliegenden Studie war, entsprechend den Ergebnissen von Mondelli et al. (2008), in Ebene 4 postoperativ zunächst eine Abnahme der Querschnittsfläche zu verzeichnen, die allerdings nicht als statistisch signifikant anzusehen ist (1 Monat postoperativ: p=0,194; 3 Monate postoperativ: p=0,062). Sechs Monate postoperativ wurde allerdings ein Anstieg der Querschnittsfläche der operierten Hand beobachtet. Diese von der Literatur abweichende Beobachtung kann im Ansatz möglicherweise darauf zurückgeführt werden, dass die Querschnittsfläche in Ebene 4 lediglich im Bereich des Karpaltunnels gemessen wurde und nicht wie in vielen Studien 72, 94, 119 nach proximalem und distalem Karpaltunnel unterschieden wurde. Kwon et al (2008) haben nachgewiesen, dass es wichtig ist, die Lokalisation der Messebene innerhalb des Karpaltunnels zu differenzieren 61. So konnte in der soeben genannten Studie im proximalen Karpaltunnel (Karpaltunneleingang) ein statistisch signifikanter Unterschied zwischen der KTSProbanden-Gruppe und der Kontrollgruppe festgestellt werden. Im distalen Karpaltunnel (Karpaltunnelausgang) hingegen war keine statistische Signifikanz zwischen beiden Gruppen feststellbar 61. Es kann also festgehalten werden, dass die Bestimmung der Querschnittsfläche des N. medianus innerhalb des Karpaltunnels sowohl für die präoperative Diagnostik als auch für postoperative Kontrollen des Behandlungserfolgs geeignet ist. Es ist allerdings wichtig, die Messebenen an Hand von anatomischen Landmarken, wie z. B. durch Aufsuchen des Os pisiforme, festzumachen, um eine Reproduzierbarkeit der Ergebnisse zu erhalten 104
105 5.2 Fazit und Ausblick Die Diagnosestellung eines Karpaltunnelsyndroms (KTS) erfolgt primär klinisch durch Anamnese und klinische Untersuchung des Patienten. Diagnoseverfahren wie die elektrophysiologische Untersuchung oder die hochauflösende Sonographie des Nervus medianus kommen zur Diagnosesicherung und in unklaren oder milden Fällen eines KTS zum Einsatz. Die elektrophysiologische Untersuchung wird allerdings nicht einheitlich als Goldstandard angesehen, auch wenn sie im klinischen Alltag etabliert ist und häufig zur Diagnosesicherung eines KTS zum Einsatz kommt. Die in der vorliegenden Studie ermittelten Ergebnisse der sensiblen Nervenleitgeschwindigkeit und der distal-motorischen Latenz haben gezeigt, dass diese beiden elektrophysiologisch bestimmbaren Parameter des Nervus medianus sowohl zur präoperativen Diagnosebestätigung eines KTS als auch zur postoperativen Kontrolle des Behandlungserfolgs eingesetzt werden können. Es zeigten sich bei beiden Parametern statistisch signifikante Besserungen im Laufe eines Jahres nach erfolgter operativer Sanierung des Karpaltunnelsyndroms. In den letzten Jahren wurde vermehrt die Entwicklung beziehungsweise der standardisierte Einsatz alternativer Diagnostikverfahren, wie zum Beispiel die hochauflösenden Sonographie des N. medianus, zur Bestätigung eines KTS erforscht. Es konnte in der vorliegenden Studie und in weiteren Studien der aktuellen Literatur nachgewiesen werden, dass es bei Patienten, die an einem Karpaltunnelsyndrom leiden, zu einer Zunahme der Querschnittsfläche des Nervus medianus, wahrscheinlich durch Ausbildung eines Nervenödems, innerhalb des Karpaltunnels kommt. Es fehlt jedoch noch an einheitlichen Referenzwerten für den physiologischen Bereich der Querschnittsfläche des Nervus medianus. Auch wenn sich ein Cut-Off für pathologische Werte bei ca. 911mm² Querschnittsfläche abzeichnet, sind weitere Studien nötig, um exakte Werte definieren zu können. In mehreren Studien wurde zwar nachgewiesen, dass die Sonographie zum Nachweis eines KTS hilfreich sein kann. Die Sonographie kann im klinischen Alltag allerdings erst dann standardisiert zum Einsatz kommen, wenn einheitliche Standardwerte für die physiologische Querschnittsfläche des N. medianus definiert wurden. 105
106 6. Zusammenfassung Das Karpaltunnelsyndrom (KTS) ist ein in der erwachsenen Bevölkerung häufig vorkommendes Syndrom, das auf Grund seiner hohen Prävalenz (2,5%- 11%) und Inzidenz (0,25% - 1%) einen besonderen klinischen Stellenwert hat. Wegweisend für die Diagnosestellung eines Karpaltunnelsyndroms ist zumeist die pathognomonische Beschwerdesymptomatik (Brachialgia parästhetica nocturna). Zur apparativen Diagnosebestätigung bzw. -sicherung existiert derzeit allerdings kein klinischer Goldstandard. Verschiedene Verfahren stehen zur Verfügung, die die Diagnosesicherung eines KTS erlauben. Im Hinblick auf Sensitivität und Spezifität sowie unter Berücksichtigung klinischer Einsetzbarkeit und für den Patienten gut erreichbarer Diagnostik ist es wichtig, diese Verfahren zu untersuchen und miteinander zu vergleichen. Das etablierteste Verfahren zur Diagnosesicherung eines KTS ist die elektrophysiologische Untersuchung des N. medianus, die Aufschluss über eine durch das KTS bereits eingetretene Funktionseinschränkung des N. medianus gibt. Als bildgebende Verfahren kommen der hochauflösende Ultraschall, der in jüngster Vergangenheit immer mehr in den Vordergrund klinischer Studien gerückt ist, sowie die hochauflösende MRT, die strukturelle Veränderungen innerhalb des Karpaltunnels ebenfalls darstellen kann, in Betracht. Die MRT wird im klinischen Alltag nur in speziellen Fällen zur Diagnosesicherung eingesetzt und stand in der vorliegenden Arbeit nicht im Mittelpunkt. In den letzten Jahren sind die hochauflösende Sonographie als relativ neues und die Elektroneurographie (ENG) als etabliertes Verfahren immer häufiger als Untersuchungsmethoden diskutiert und gegenübergestellt worden. Da die Sonographie im Gegensatz zu der ENG im Rahmen der klinischen Untersuchung direkt durchgeführt werden kann und daher mit wenig Zeit- und Kostenaufwand verbunden ist, würde sie im klinischen Alltag bei vergleichbarer Aussagekraft Vorteile mit sich bringen. Wie die aktuelle Studienlage zeigt, ist die hochauflösende Sonographie, bezogen auf Sensitivität und Spezifität, mittlerweile mit der elektrophysiologischen Untersuchung gleichzusetzen. Da noch keine einheitlichen Referenzwerte für die sonographisch bestimmbare Querschnittsfläche des N. medianus existieren, ist ein standardisierter Einsatz allerdings derzeit erschwert und nur im Seitenvergleich möglich. In der vorliegenden prospektiven Arbeit wurden die elektrophysiologische Untersuchung des N. medianus und die hochauflösende Ultraschalluntersuchung bei vierzig Patienten mit 106
107 deutlichem klinischem Bild eines Karpaltunnelsyndroms gegenüber gestellt. Des Weiteren wurden etablierte klinische Testungen wie das Hoffmann-Tinel sche Zeichen und der Phalen-Test in die Studie einbezogen. Die untersuchten Verfahren und Testungen wurden im zeitlichen Verlauf eines Jahres nach erfolgter Retinakulum-Flexorum-Spaltung mit der präoperativ durchgeführten Ausgangsuntersuchung verglichen und den Werten der nicht operierten Hand gegenübergestellt. Die vorliegende Arbeit hat gezeigt, dass die Anzahl der pathologischen klinischen Tests im Rahmen eines KTS nach erfolgter Operation statisch signifikant gesunken ist. Ferner konnte nachgewiesen werden, dass in der elektrophysiologischen Testung des N. medianus sowohl die sensible Nervenleitgeschwindigkeit als auch die distal motorische Latenz als die beiden aussagekräftigsten Parameter der elektrophysiologischen Untersuchung innerhalb eines Jahres nach stattgehabter KTS-Operation statistisch signifikante Veränderungen aufweisen und beide Parameter nach operativer Therapie und präoperativ pathologischer Werte in physiologische Grenzwerte zurücksinken bzw. -steigen. Die hochauflösende Sonographie konnte ebenfalls statistisch signifikante Änderungen nachweisen. In der vorliegenden Studie konnte, übereinstimmend mit der aktuellen Studienlage, gezeigt werden, dass die Querschnittsfläche des N. medianus innerhalb des Karpaltunnels als präoperatives Verfahren zur Diagnosesicherung geeignet ist und dass die Querschnittsfläche des N. medianus der betroffenen Hand im Vergleich zu der Querschnittsfläche des N. medianus der nicht betroffenen Hand statistisch signifikant höhere Werte aufweist. Außerhalb des Karpalkanals bestimmte und in der Studie miterfasste Messebenen zeigten keine aussagekräftigen Ergebnisse. Eine statistisch signifikante Änderung der Querschnittsfläche des N. medianus nach erfolgter operativer Therapie des KTS konnte innerhalb eines Jahres nicht festgestellt werden. Somit konnte nachgewiesen werden, dass sowohl die klinischen Tests als auch die elektrophysiologische Testung als Diagnosebestätigung eines Karpaltunnelsyndroms aussagekräftige Ergebnisse liefern. Die hochauflösende Sonographie bietet im klinischen Alltag im Seitenvergleich ebenfalls aussagekräftige Werte. Eine beidseitige Messung ist daher bei sonographischer Darstellung des N. medianus anzustreben. Die Bestimmung der Querschnittsfläche des N. medianus kann somit bereits als suffizienter Parameter zur Diagnosesicherung eines KTS angesehen werden, ist allerdings auf Grund fehlender einheitlicher Referenzwerte der Querschnittsfläche des N. medianus im standardisierten klinischen Einsatz derzeit nur erschwert einsetzbar und sollte stets im Seitenvergleich bestimmt werden. Es sollte somit angestrebt werden, durch weitere klinische Studien die Verfestigung der sich bereits abzeichnenden Referenzwerte voranzutreiben. 107
108 7. Literaturverzeichnis 1 AAEM (2002). Practice parameter for electrodiagnostic studies in carpal tunnel syndrome: summary statement. Muscle Nerve 25 (6), Academic (2010). (Zugriff 3 Albers, J. W., Brown, M. B., Sima, A. A. and Greene, D. A. (1996). Frequency of median mononeuropathy in patients with mild diabetic neuropathy in the early diabetes intervention trial (EDIT). Tolrestat Study Group For Edit (Early Diabetes Intervention Trial). Muscle Nerve 19 (2), Antoniadis, G., Rath, S. A., Mir-Ali, L., Oberle, J. and Richter, H. P. (1997). Experiences with endoscopic surgery in treatment of carpal tunnel syndrome. Preliminary results of a prospective study. Nervenarzt 68 (6), Armstrong, T., Devor, W., Borschel, L. and Contreras, R. (2004). Intracarpal steroid injection is safe and effective for short-term management of carpal tunnel syndrome. Muscle Nerve 29 (1), Aroori, S. and Spence, R. A. (2008). Carpal tunnel syndrome. Ulster Med J 77 (1), Assmus, H. and Antoniadis, G. (2008). Nervenkompressionssyndrome. Steinkopff Verlag Heidelberg, Assmus, H., Antoniadis, G., Bischoff, C., Haussmann, P., Martini, A. K., Mascharka, Z., Scheglmann, K., Schwerdtfeger, K., Selbmann, H. K., Towfigh, H., Vogt, T., Wessels, K. D. and Wustner-Hofmann, M. (2007). Diagnosis and therapy of carpal tunnel syndrome--guideline of the German Societies of Handsurgery, Neurosurgery, Neurology, Orthopaedics, Clinical Neurophysiology and Functional Imaging, Plastic, Reconstructive and Aesthetic Surgery, and Surgery for Traumatology. Handchir Mikrochir Plast Chir 39 (4), Atroshi, I., Gummesson, C., Johnsson, R. and Ornstein, E. (2003). Diagnostic properties of nerve conduction tests in population-based carpal tunnel syndrome. BMC Musculoskelet Disord 4, 9 10 Atroshi, I., Gummesson, C., Johnsson, R., Ornstein, E., Ranstam, J. and Rosen, I. (1999). Prevalence of carpal tunnel syndrome in a general population. Jama 282 (2), Balakrishnan, C., Jarrahnejad, P., Balakrishnan, A. and Huettner, W. C. (2008). Acute carpal tunnel syndrome as a result of spontaneous bleeding. Can J Plast Surg 16 (3), vom ).
109 12 Beekman, R. and Visser, L. H. (2003). Sonography in the diagnosis of carpal tunnel syndrome: a critical review of the literature. Muscle Nerve 27 (1), Bekkelund, S. I. and Pierre-Jerome, C. (2003). Does carpal canal stenosis predict outcome in women with carpal tunnel syndrome? Acta Neurol Scand 107 (2), Bland, J. D. (2007). Carpal tunnel syndrome. BMJ 335 (7615), Bland, J. D. and Rudolfer, S. M. (2003). Clinical surveillance of carpal tunnel syndrome in two areas of the United Kingdom, J Neurol Neurosurg Psychiatry 74 (12), Bleecker, M. L., Bohlman, M., Moreland, R. and Tipton, A. (1985). Carpal tunnel syndrome: role of carpal canal size. Neurology 35 (11), Bridges, M. J., Robertson, D. C. and Chuck, A. J. (2011). Predicting the result of nerve conduction tests in carpal tunnel syndrome using a questionnaire. Hand Surg 16 (1), Bruske, J., Bednarski, M., Grzelec, H. and Zyluk, A. (2002). The usefulness of the Phalen test and the Hoffmann-Tinel sign in the diagnosis of carpal tunnel syndrome. Acta Orthop Belg 68 (2), Buchberger, W. (1997). Radiologic imaging of the carpal tunnel. Eur J Radiol 25 (2), Buchberger, W., Judmaier, W., Birbamer, G., Lener, M. and Schmidauer, C. (1992). Carpal tunnel syndrome: diagnosis with high-resolution sonography. AJR Am J Roentgenol 159 (4), Chow, J. C., Weiss, M. A. and Gu, Y. (2005). Anatomic variations of the hook of hamate and the relationship to carpal tunnel syndrome. J Hand Surg Am 30 (6), Cobb, T. K., Dalley, B. K., Posteraro, R. H. and Lewis, R. C. (1993). Anatomy of the flexor retinaculum. J Hand Surg Am 18 (1), Colak, A., Kutlay, M., Pekkafali, Z., Saracoglu, M., Demircan, N., Simsek, H., Akin, O. N. and Kibici, K. (2007). Use of sonography in carpal tunnel syndrome surgery. A prospective study. Neurol Med Chir (Tokyo) 47 (3), ; discussion Dantec-Neuromatic-2000M (2006). (Zugriff 25 de Krom, M. C., Knipschild, P. G., Kester, A. D., Thijs, C. T., Boekkooi, P. F. and Spaans, F. (1992). Carpal tunnel syndrome: prevalence in the general population. J Clin Epidemiol 45 (4), vom ).
110 26 de Krom, M. C., van Croonenborg, J. J., Blaauw, G., Scholten, R. J. and Spaans, F. (2008). Guideline 'Diagnosis and treatment of carpal tunnel syndrome'. Ned Tijdschr Geneeskd 152 (2), Demirci, S., Kutluhan, S., Koyuncuoglu, H. R., Kerman, M., Heybeli, N., Akkus, S. and Akhan, G. (2002). Comparison of open carpal tunnel release and local steroid treatment outcomes in idiopathic carpal tunnel syndrome. Rheumatol Int 22 (1), Descatha, A., Dale, A. M., Franzblau, A., Coomes, J. and Evanoff, B. (2011). Comparison of research case definitions for carpal tunnel syndrome. Scand J Work Environ Health, 29 Dodds, W. N. (1997). Carpal tunnel syndrome as a herald of autoimmune rheumatic disorders. J R Soc Med 90 (6), Domanasiewicz, A., Koszewicz, M. and Jablecki, J. (2009). Comparison of the diagnostic value of ultrasonography and neurography in carpal tunnel syndrome. Neurol Neurochir Pol 43 (5), Eiken, O., Carstam, N. and Eddeland, A. (1971). Anomalous distal branching of the median nerve. Case reports. Scand J Plast Reconstr Surg 5 (2), El-Hajj, T., Tohme, R. and Sawaya, R. (2010). Changes in electrophysiological parameters after surgery for the carpal tunnel syndrome. J Clin Neurophysiol 27 (3), El Miedany, Y., Ashour, S., Youssef, S., Mehanna, A. and Meky, F. A. (2008). Clinical diagnosis of carpal tunnel syndrome: old tests-new concepts. Joint Bone Spine 75 (4), El Miedany, Y. M., Aty, S. A. and Ashour, S. (2004). Ultrasonography versus nerve conduction study in patients with carpal tunnel syndrome: substantive or complementary tests? Rheumatology (Oxford) 43 (7), Ellenberg, M. R., Honet, J. C. and Treanor, W. J. (1994). Cervical radiculopathy. Arch Phys Med Rehabil 75 (3), Emad, M. R., Najafi, S. H. and Sepehrian, M. H. (2010). The effect of provocative tests on electrodiagnosis criteria in clinical carpal tunnel syndrome. Electromyogr Clin Neurophysiol 50 (6), Ettema, A. M., Amadio, P. C., Zhao, C., Wold, L. E. and An, K. N. (2004). A histological and immunohistochemical study of the subsynovial connective tissue in idiopathic carpal tunnel syndrome. J Bone Joint Surg Am 86-A (7), Gazioglu, S., Boz, C. and Cakmak, V. A. (2011). Electrodiagnosis of carpal tunnel syndrome in patients with diabetic polyneuropathy. Clin Neurophysiol, 39 Geoghegan, J. M., Clark, D. I., Bainbridge, L. C., Smith, C. and Hubbard, R. (2004). Risk factors in carpal tunnel syndrome. J Hand Surg Br 29 (4),
111 40 Geraets, J. J., Geijer, R. M. and Goudswaard, A. N. (2010). Dutch College of General Practitioners' practice guideline on symptoms of the hand and wrist: a summary. Ned Tijdschr Geneeskd 154 (1), A Gerritsen, A. A., de Vet, H. C., Scholten, R. J., Bertelsmann, F. W., de Krom, M. C. and Bouter, L. M. (2002). Splinting vs surgery in the treatment of carpal tunnel syndrome: a randomized controlled trial. Jama 288 (10), Ginanneschi, F., Milani, P., Reale, F. and Rossi, A. (2008). Short-term electrophysiological conduction change in median nerve fibres after carpal tunnel release. Clin Neurol Neurosurg 110 (10), Goyal, V., Bhatia, M., Padma, M. V., Jain, S. and Maheshwari, M. C. (2001). Electrophysiological evaluation of 140 hands with carpal tunnel syndrome. J Assoc Physicians India 49, Gurcay, E., Unlu, E., Gurcay, A. G., Tuncay, R. and Cakci, A. (2010). Assessment of phonophoresis and iontophoresis in the treatment of carpal tunnel syndrome: a randomized controlled trial. Rheumatol Int, 45 Hacke, W. (2010). Neurologie. Springer Medizin Verlag Heidelberg, Hagebeuk, E. E. and de Weerd, A. W. (2004). Clinical and electrophysiological follow-up after local steroid injection in the carpal tunnel syndrome. Clin Neurophysiol 115 (6), Hammer, H. B., Hovden, I. A., Haavardsholm, E. A. and Kvien, T. K. (2006). Ultrasonography shows increased cross-sectional area of the median nerve in patients with arthritis and carpal tunnel syndrome. Rheumatology (Oxford) 45 (5), Hansen, P. A., Micklesen, P. and Robinson, L. R. (2004). Clinical utility of the flick maneuver in diagnosing carpal tunnel syndrome. Am J Phys Med Rehabil 83 (5), Hui, A. C., Wong, S., Leung, C. H., Tong, P., Mok, V., Poon, D., Li-Tsang, C. W., Wong, L. K. and Boet, R. (2005). A randomized controlled trial of surgery vs steroid injection for carpal tunnel syndrome. Neurology 64 (12), Huisstede, B. M., Randsdorp, M. S., Coert, J. H., Glerum, S., van Middelkoop, M. and Koes, B. W. (2010). Carpal tunnel syndrome. Part II: effectiveness of surgical treatments--a systematic review. Arch Phys Med Rehabil 91 (7), Impink, B. G., Gagnon, D., Collinger, J. L. and Boninger, M. L. (2010). Repeatability of ultrasonographic median nerve measures. Muscle Nerve 41 (6), Jablecki, C. K., Andary, M. T., So, Y. T., Wilkins, D. E. and Williams, F. H. (1993). Literature review of the usefulness of nerve conduction studies and electromyography for the evaluation of patients with carpal tunnel syndrome. AAEM Quality Assurance Committee. Muscle Nerve 16 (12),
112 53 Jerosch, J. (2010). Sensible Innervationsgebite der Hand. (Zugriff vom ) 54 Kamath, V. and Stothard, J. (2003). A clinical questionnaire for the diagnosis of carpal tunnel syndrome. J Hand Surg Br 28 (5), Kamolz, L. P., Beck, H., Haslik, W., Hogler, R., Rab, M., Schrogendorfer, K. F. and Frey, M. (2004). Carpal tunnel syndrome: a question of hand and wrist configurations? J Hand Surg Br 29 (4), Kamolz, L. P., Schrogendorfer, K. F., Rab, M., Girsch, W., Gruber, H. and Frey, M. (2001). The precision of ultrasound imaging and its relevance for carpal tunnel syndrome. Surg Radiol Anat 23 (2), Kaymak, B., Ozcakar, L., Cetin, A., Candan Cetin, M., Akinci, A. and Hascelik, Z. (2008). A comparison of the benefits of sonography and electrophysiologic measurements as predictors of symptom severity and functional status in patients with carpal tunnel syndrome. Arch Phys Med Rehabil 89 (4), Kele, H., Verheggen, R., Bittermann, H. J. and Reimers, C. D. (2003). The potential value of ultrasonography in the evaluation of carpal tunnel syndrome. Neurology 61 (3), Kumar, P. and Chakrabarti, I. (2009). Idiopathic carpal tunnel syndrome and trigger finger: is there an association? J Hand Surg Eur Vol 34 (1), Kumnerddee, W. and Kaewtong, A. (2010). Efficacy of acupuncture versus night splinting for carpal tunnel syndrome: a randomized clinical trial. J Med Assoc Thai 93 (12), Kwon, B. C., Jung, K. I. and Baek, G. H. (2008). Comparison of sonography and electrodiagnostic testing in the diagnosis of carpal tunnel syndrome. J Hand Surg Am 33 (1), Lama, M. (2009). Carpal tunnel release in patients with negative neurophysiological examinations: clinical and surgical findings. Neurosurgery 65 (4 Suppl), A Lo, S. F., Chou, L. W., Meng, N. H., Chen, F. F., Juan, T. T., Ho, W. C. and Chiang, C. F. (2011). Clinical characteristics and electrodiagnostic features in patients with carpal tunnel syndrome, double crush syndrome, and cervical radiculopathy. Rheumatol Int, 64 Lundborg, G. (2000). A 25-year perspective of peripheral nerve surgery: evolving neuroscientific concepts and clinical significance. J Hand Surg Am 25 (3), Ly-Pen, D., Andreu, J. L., de Blas, G., Sanchez-Olaso, A. and Millan, I. (2005). Surgical decompression versus local steroid injection in carpal tunnel syndrome: a one-year, prospective, randomized, open, controlled clinical trial. Arthritis Rheum 52 (2),
113 66 MacDermid, J. C. and Wessel, J. (2004). Clinical diagnosis of carpal tunnel syndrome: a systematic review. J Hand Ther 17 (2), Megele, R. (1991). Diagnostic tests in carpal tunnel syndrome. Nervenarzt 62 (6), Meier, K. C. (1998). Cervicale Dermatome. (Zugriff vom ) 69 Modi, C. S., Ho, K., Hegde, V., Boer, R. and Turner, S. M. (2010). Diagnosis of motor fascicle compression in carpal tunnel syndrome. Orthop Traumatol Surg Res 96 (4), Mohammadi, A., Afshar, A., Etemadi, A., Masoudi, S. and Baghizadeh, A. (2010). Diagnostic value of cross-sectional area of median nerve in grading severity of carpal tunnel syndrome. Arch Iran Med 13 (6), Mondelli, M., Filippou, G., Aretini, A., Frediani, B. and Reale, F. (2008). Ultrasonography before and after surgery in carpal tunnel syndrome and relationship with clinical and electrophysiological findings. A new outcome predictor? Scand J Rheumatol 37 (3), Mondelli, M., Filippou, G., Gallo, A. and Frediani, B. (2008). Diagnostic utility of ultrasonography versus nerve conduction studies in mild carpal tunnel syndrome. Arthritis Rheum 59 (3), Mondelli, M., Giannini, F. and Giacchi, M. (2002). Carpal tunnel syndrome incidence in a general population. Neurology 58 (2), Mondelli, M., Passero, S. and Giannini, F. (2001). Provocative tests in different stages of carpal tunnel syndrome. Clin Neurol Neurosurg 103 (3), Moran, L., Perez, M., Esteban, A., Bellon, J., Arranz, B. and del Cerro, M. (2009). Sonographic measurement of cross-sectional area of the median nerve in the diagnosis of carpal tunnel syndrome: correlation with nerve conduction studies. J Clin Ultrasound 37 (3), Mumenthaler, M. and Mattle, H. (2008). Neurologie. Georg Thieme Verlag Stuttgart, Nakamichi, K. and Tachibana, S. (1998). Distance between the median nerve and ulnar neurovascular bundle: clinical significance with ultrasonographically assisted carpal tunnel release. J Hand Surg Am 23 (5), Nakamichi, K. and Tachibana, S. (1992). Transverse sliding of the median nerve beneath the flexor retinaculum. J Hand Surg Br 17 (2), O'Connor, D., Marshall, S. and Massy-Westropp, N. (2003). Non-surgical treatment (other than steroid injection) for carpal tunnel syndrome. Cochrane Database Syst Rev (1), CD
114 80 Okutsu, I., Ninomiya, S., Hamanaka, I., Kuroshima, N. and Inanami, H. (1989). Measurement of pressure in the carpal canal before and after endoscopic management of carpal tunnel syndrome. J Bone Joint Surg Am 71 (5), Padua, L., Giannini, F., Girlanda, P., Insola, A., Luchetti, R., Lo Monaco, M., Padua, R., Uncini, A. and Tonali, P. (1999). Usefulness of segmental and comparative tests in the electrodiagnosis of carpal tunnel syndrome: the Italian multicenter study. Italian CTS Study Group. Ital J Neurol Sci 20 (5), Padua, L., LoMonaco, M., Gregori, B., Valente, E. M., Padua, R. and Tonali, P. (1997). Neurophysiological classification and sensitivity in 500 carpal tunnel syndrome hands. Acta Neurol Scand 96 (4), Patijn, J., Vallejo, R., Janssen, M., Huygen, F., Lataster, A., van Kleef, M. and Mekhail, N. (2011). 19. Carpal Tunnel Syndrome. Pain Pract, 84 Petiot, P. and Bernard, E. (2011). Diagnostic pitfalls in carpal tunnel syndrome. Rev Neurol (Paris) 167 (1), Pickering, S. A., Stevens, A. and Davis, T. R. (2004). Work practices and histopathological changes in the tenosynovium in carpal tunnel syndrome in men. J Hand Surg Br 29 (4), Polykandriotis, E., Premm, W. and Horch, R. E. (2007). Carpal tunnel syndrome in young adults--an ultrasonographic and neurophysiological study. Minim Invasive Neurosurg 50 (6), Prick, J. J., Blaauw, G., Vredeveld, J. W. and Oosterloo, S. J. (2003). Results of carpal tunnel release. Eur J Neurol 10 (6), Pryse-Phillips, W. E. (1984). Validation of a diagnostic sign in carpal tunnel syndrome. J Neurol Neurosurg Psychiatry 47 (8), Pyun, S. B., Kang, C. H., Yoon, J. S., Kwon, H. K., Kim, J. H., Chung, K. B. and Oh, Y. W. (2011). Application of 3-dimensional ultrasonography in assessing carpal tunnel syndrome. J Ultrasound Med 30 (1), Rahmani, M., Ghasemi Esfe, A. R., Bozorg, S. M., Mazloumi, M., Khalilzadeh, O. and Kahnouji, H. (2011). The ultrasonographic correlates of carpal tunnel syndrome in patients with normal electrodiagnostic tests. Radiol Med, 91 Robinson, A. J., Basheer, M. H. and Herbert, K. (2010). An unusual cause of carpal tunnel syndrome. J Plast Reconstr Aesthet Surg 63 (11), e Rohen, J. W., Yokochi, C. and Lütjen-Drecoll, E. (2002). Anatomie des Menschen, Fotografischer Atlas. Schattauer-Verlag Stuttgart, Roquelaure, Y., Ha, C., Pelier-Cady, M. C., Nicolas, G., Descatha, A., Leclerc, A., Raimbeau, G., Goldberg, M. and Imbernon, E. (2008). Work increases the incidence of carpal tunnel syndrome in the general population. Muscle Nerve 37 (4),
115 94 Sarria, L., Cabada, T., Cozcolluela, R., Martinez-Berganza, T. and Garcia, S. (2000). Carpal tunnel syndrome: usefulness of sonography. Eur Radiol 10 (12), Schiene-bei-Carpaltunnelsyndrom (2006) Schmidt, H.-M. and Lanz, U. (2003). Chirurgische Anatomie der Hand. Georg Thieme Verlag Stuttgart, Schmitt, R. and Lanz, U. (1996). Bildgebende Diagnostik der Hand. Hippokrates Verlag Stuttgart, Schnetzler, K. A. (2008). Acute carpal tunnel syndrome. J Am Acad Orthop Surg 16 (5), Scholten, R. J., Mink van der Molen, A., Uitdehaag, B. M., Bouter, L. M. and de Vet, H. C. (2007). Surgical treatment options for carpal tunnel syndrome. Cochrane Database Syst Rev (4), CD (Zugriff vom ). 100 Schüncke, M., Schulte, E. and Schumacher, U. (2005). Prometheus, Atlas der Anatomie. Georg Thieme Verlag Stuttgart, 101 Seiler, J. G., 3rd, Milek, M. A., Carpenter, G. K. and Swiontkowski, M. F. (1989). Intraoperative assessment of median nerve blood flow during carpal tunnel release with laser Doppler flowmetry. J Hand Surg Am 14 (6), Sevim, S., Dogu, O., Camdeviren, H., Kaleagasi, H., Aral, M., Arslan, E. and Milcan, A. (2004). Long-term effectiveness of steroid injections and splinting in mild and moderate carpal tunnel syndrome. Neurol Sci 25 (2), Shinya, K., Lanzetta, M. and Conolly, W. B. (1995). Risk and complications in endoscopic carpal tunnel release. J Hand Surg Br 20 (2), Shores, J. T. and Lee, W. P. (2010). An evidence-based approach to carpal tunnel syndrome. Plast Reconstr Surg 126 (6), Siewert, J. R. (2006). Chirurgie. Springer Medizin Verlag Heidelberg, 839, Sonosite-Micromaxx (2008). (Zugriff vom ). 107 Stevens, J. C. (1997). AAEM minimonograph #26: the electrodiagnosis of carpal tunnel syndrome. American Association of Electrodiagnostic Medicine. Muscle Nerve 20 (12), Stevens, J. C., Sun, S., Beard, C. M., O'Fallon, W. M. and Kurland, L. T. (1988). Carpal tunnel syndrome in Rochester, Minnesota, 1961 to Neurology 38 (1),
116 109 Tanaka, S., Wild, D. K., Seligman, P. J., Behrens, V., Cameron, L. and PutzAnderson, V. (1994). The US prevalence of self-reported carpal tunnel syndrome: 1988 National Health Interview Survey data. Am J Public Health 84 (11), Thoma, A., Veltri, K., Haines, T. and Duku, E. (2004). A meta-analysis of randomized controlled trials comparing endoscopic and open carpal tunnel decompression. Plast Reconstr Surg 114 (5), Turner, A., Kimble, F., Gulyas, K. and Ball, J. (2010). Can the outcome of open carpal tunnel release be predicted?: a review of the literature. ANZ J Surg 80 (1-2), Visser, L. H., Smidt, M. H. and Lee, M. L. (2008). High-resolution sonography versus EMG in the diagnosis of carpal tunnel syndrome. J Neurol Neurosurg Psychiatry 79 (1), Vogelin, E., Nuesch, E., Juni, P., Reichenbach, S., Eser, P. and Ziswiler, H. R. (2010). Sonographic follow-up of patients with carpal tunnel syndrome undergoing surgical or nonsurgical treatment: prospective cohort study. J Hand Surg Am 35 (9), Weissenborn, W. and Sabri, W. (1987). Muscle anomalies as a cause of carpal tunnel syndrome. Handchir Mikrochir Plast Chir 19 (3), Werner, R. A. (2006). Evaluation of work-related carpal tunnel syndrome. J Occup Rehabil 16 (2), Werner, R. A., Franzblau, A. and Gell, N. (2005). Randomized controlled trial of nocturnal splinting for active workers with symptoms of carpal tunnel syndrome. Arch Phys Med Rehabil 86 (1), Wilcoxon-Vorzeichen-Rang-Test (2010). (Zugriff vom ) Willis, C. B., Alderman, A. and Louis, D. S. (1999). Anatomic anomalies and carpal tunnel syndrome: a review. Tech Hand Up Extrem Surg 3 (2), Wong, S. M., Griffith, J. F., Hui, A. C., Lo, S. K., Fu, M. and Wong, K. S. (2004). Carpal tunnel syndrome: diagnostic usefulness of sonography. Radiology 232 (1), Wong, S. M., Griffith, J. F., Hui, A. C., Tang, A. and Wong, K. S. (2002). Discriminatory sonographic criteria for the diagnosis of carpal tunnel syndrome. Arthritis Rheum 46 (7), Yazdchi, M., Tarzemani, M. K., Mikaeili, H., Ayromlu, H. and Ebadi, H. (2012). Sensitivity and specificity of median nerve ultrasonography in diagnosis of carpal tunnel syndrome. Int J Gen Med 5,
117 122 Yesildag, A., Kutluhan, S., Sengul, N., Koyuncuoglu, H. R., Oyar, O., Guler, K. and Gulsoy, U. K. (2004). The role of ultrasonographic measurements of the median nerve in the diagnosis of carpal tunnel syndrome. Clin Radiol 59 (10), Ziswiler, H. R., Reichenbach, S., Vogelin, E., Bachmann, L. M., Villiger, P. M. and Juni, P. (2005). Diagnostic value of sonography in patients with suspected carpal tunnel syndrome: a prospective study. Arthritis Rheum 52 (1),
118 8. Anhang 118
119 Berufsgenossenschaftliche Kliniken Bergmannsheil Universitätsklinik Juniorprofessor Privatdozent Dr. med. L. Steinsträßer BG-Kliniken Bergmannsheil Universitätsklinik Klinik für plastische Chirurgie u. Schwerbrandverletzte Handchirurgiezentrum Operatives Referenzzentrum für Gliedmassentumoren Postfach Bochum Klinik für Plastische Chirurgie und Schwerbrandverletzte Handchirurgie-Zentrum Direktor: Univ.-Prof. Dr. med. H. U. Steinau Telefon: 0234/ Telefax: 0234/ Patienteninformation Bürkle-de-la-Camp-Platz Bochum Datum: Der Vergleich von hochauflösendem Ultraschall und elektrophysiologischer Untersuchungen bei der Diagnostik und Behandlung des Karpaltunnelsyndroms Sehr geehrte Patientin, sehr geehrter Patient. Wir laden Sie ein, an der oben genannten klinischen Prüfung teilzunehmen. Die Aufklärung darüber erfolgt in einem ausführlichen ärztlichen Gespräch. Die Teilnahme an einer klinischen Prüfung ist freiwillig und kann jederzeit ohne Angabe von Gründen durch Sie beendet werden, ohne dass Ihnen hierdurch Nachteile in Ihrer medizinischen Betreuung entstehen. Klinische Prüfungen sind notwendig, um verlässliche neue medizinische Forschungsergebnisse zu gewinnen. Unverzichtbare Voraussetzung für die Durchführung einer klinischen Prüfung ist jedoch, dass Sie Ihr Einverständnis zur Teilnahme an dieser klinischen Prüfung schriftlich erklären. Bitte lesen Sie den folgenden Text als Ergänzung zum Informationsgespräch mit Ihrem Arzt sorgfältig durch und zögern Sie nicht, Fragen zu stellen. Bitte unterschreiben Sie die Einwilligungserklärung nur - wenn Sie Art und Ablauf der klinischen Prüfung vollständig verstanden haben, - wenn Sie bereit sind, der Teilnahme zuzustimmen und - wenn Sie sich über Ihre Rechte als Teilnehmer an dieser klinischen Prüfung im Klaren sind. Diese klinische Prüfung, die Patienteninformation und Einwilligungserklärung wurden von der zuständigen Ethikkommission geprüft und positiv beurteilt. 119
120 9. Was ist der Zweck der klinischen Prüfung? Der Zweck dieser klinischen Prüfung ist, verschiedene Untersuchungsverfahren in der Diagnostik des Karpaltunnelsyndroms zu vergleichen. Im Rahmen dieser vorrausschauenden (prospektiven) Studie soll die Aussagekraft des hochauflösenden Ultraschalls bei Patienten mit Karpaltunnelsyndrom gegenüber den derzeitigen Untersuchungsmethoden beurteilt werden. Ziel ist es, die Wertigkeit des hochauflösenden Ultraschallverfahrens in der Diagnostik und Therapieverlaufskontrolle zu überprüfen und mit dem derzeitig als unübertroffenen Untersuchungsverfahren, der neurophysiologischen Untersuchung, zu vergleichen. 10. Welche anderen Behandlungsmöglichkeiten gibt es? Die ausschließliche Therapie liegt in der Operation. Die Studie dient zur Hilfe bei der Diagnosestellung und der Beurteilung des Krankheitsverlaufes. 11. Wie läuft die klinische Prüfung ab? An 5 Terminen, die über ein Jahr verteilt liegen, werden jeweils folgende Untersuchungen durchgeführt: - eine elektrophysiologische Untersuchung erhalten, bei der die motorischen und sensiblen Nervenleitgeschwindigkeiten des Medianusnerven gemessen werden, - eine Ultraschalluntersuchung des Nerven (15-30 Minuten) - Provokationstests, mit denen man bei fast allen Patienten Symptome auslösen kann, um die Beschwerden zu objektivieren. - Faustschluss Test und Dynamometer Messung. Zu welchen Zeitpunkten werden diese Untersuchungen durchgeführt? Vor der Operation, 30 Tage nach der Operation sowie 3, 6 und 12 Monate nach der Operation. Sie werden dazu gebeten in das Bergmannsheil Bochum, Bürkle-de-laChamp-Platz 1, zu kommen. Die Einhaltung der Besuchstermine, einschließlich der Anweisungen des Prüfarztes ist von entscheidender Bedeutung für den Erfolg dieser klinischen Prüfung. 12. Was ist eine elektrophysiologische Untersuchung und hochauflösender Ultraschall? Die Funktion des N. medianus wird mit einem elektrophysiologischen Untersuchungsverfahren überprüft. Dabei werden oberflächliche Elektroden auf die Daumenballenmuskulatur geklebt und der Medianusnerv im Bereich des Ellenbogens und im Handgelenksbereich mit niedrigen Stromstärken stimuliert. Die durch diese Nervenstimulation hervorgerufenen sensiblen und motorischen Antworten im Bereich der Hand werden mit den Oberflächenelektroden abgeleitet und daraus die Nervenleitgeschwindigkeiten rechnerisch ermittelt. Diese Untersuchung ist ein gängiges Diagnostikverfahren, wird seit Jahren routinemäßig eingesetzt und führt zu keiner Beeinträchtigung der Patienten. Die hochauflösende Ultraschalldarstellung ist ein bildgebendes Verfahren mit dem selbst kleine Strukturen wie Nerven sehr genau dargestellt können. Für die Diagnose des Karpaltunnelsyndroms durch Ultraschall liegen zwar bereits erste Studien vor, 120
121 allerdings befindet sich dieses Verfahren noch in der klinischen Erprobung für diese Fragestellung. 13. Worin liegt der Nutzen einer Teilnahme an der Klinischen Prüfung? Es ist nicht zu erwarten, dass Sie aus Ihrer Teilnahme an dieser klinischen Prüfung direkten gesundheitlichen Nutzen ziehen werden. Es könnte jedoch für sie als Patient von Vorteil sein, dass eine engmaschigere Verlaufskontrolle und eine detailliertere Beobachtung des Heilungsverlaufes gegenüber Patienten ohne Studienteilnahme erfolgt. Die Ergebnisse dieser klinischen Prüfung könnten dazu beitragen, dass für andere Patienten, die dieselbe Erkrankung haben wie Sie, die Behandlung des Karpaltunnelsyndromes verbessert wird. Wir erhoffen uns von dieser Untersuchung Rückschlüsse auf die Beschwerdebesserung gewinnen zu können. In der Zukunft können dann die bestmöglichen Untersuchungstechniken eingesetzt werden. 14. Gibt es Risiken, Beschwerden und Begleiterscheinungen? Die Bildgebung durch Ultraschall ist ein schmerz- und gefahrloses Verfahren. Um die bestmögliche Untersuchungsqualität mit Ultraschall zu erreichen, wird der Kontakt von Schallkopf und Haut durch ein Gel hergestellt. Allergische Reaktionen auf Ultraschallgel sind außerordentlich selten. Die funktionellen Untersuchung der Hand und die elektrophysiologische Untersuchung sind schmerzlos. 15. Zusätzliche Einnahme von Arzneimitteln? Nein. Im Zusammenhang mit der Teilnahme an dieser klinischen Prüfung ist keine zusätzliche Einnahme von Medikamenten erforderlich. 16. Hat die Teilnahme an der klinischen Prüfung sonstige Auswirkungen auf die Lebensführung und welche Verpflichtungen ergeben sich daraus? Mit der Teilnahme an dieser klinischen Prüfung sollten Sie sich zu den vereinbarten Terminen in der Klinik einzufinden, um an den oben genannten Untersuchungen teilzunehmen. 17. Was ist zu tun beim Auftreten von Symptomen, Begleiterscheinungen und/oder Verletzungen? Sollten im Verlauf der klinischen Prüfung irgendwelche Symptome, Begleiterscheinungen oder Verletzungen auftreten, müssen Sie diese Ihrem Arzt mitteilen, bei schwerwiegenden Begleiterscheinungen umgehend, ggf. telefonisch (Telefonnummern und Ansprechpersonen siehe unten). 18. Versicherung Als Teilnehmer an dieser klinischen Prüfung besteht für Sie der gesetzlich vorgeschriebene Versicherungsschutz der allgemeinen Patientenversicherung des Bergmannsheils: Zürich Versicherungs AG, Rieler Straße 90, Köln, Tel: 0221 / Eine Wegeversicherung besteht nicht und weitere Versicherungen im Rahmen dieser Studie sind nicht erforderlich. 121
122 19. Wann wird die klinische Prüfung vorzeitig beendet? Ihre Teilnahme an der Studie ist freiwillig. Sie können jederzeit, auch ohne Angabe von Gründen, Ihre Teilnahmebereitschaft ablehnen oder widerrufen und aus der klinischen Prüfung ausscheiden, ohne dass Ihnen dadurch irgendwelche Nachteile für Ihre weitere medizinische Betreuung entstehen. Ihr Prüfarzt wird Sie über alle neuen Erkenntnisse, die in Bezug auf diese klinische Prüfung bekannt werden, und für Sie wesentlich werden könnten, umgehend informieren. Auf dieser Basis können Sie dann Ihre Entscheidung zur weiteren Teilnahme an dieser klinischen Prüfung neu überdenken. Es ist aber auch möglich, dass Ihr Prüfarzt (oder gegebenenfalls der Auftraggeber dieser klinischen Prüfung) entscheidet, Ihre Teilnahme an der klinischen Prüfung vorzeitig zu beenden. 20. In welcher Weise werden die im Rahmen dieser klinischen Prüfung gesammelten Daten verwendet? Sofern gesetzlich nichts anderes vorgesehen ist, haben nur die Prüfer und deren Mitarbeiter, Zugang zu den vertraulichen Daten, in denen Sie namentlich genannt werden. Diese Personen unterliegen der Schweigepflicht. Die Weitergabe der Daten im In- und Ausland erfolgt ausschließlich zu wissenschaftlichen Zwecken. Patientenname und die entsprechenden Patienteninformationen werden ausschließlich anonymisiert verwendet. Dies gilt auch für etwaige Veröffentlichungen der Studienergebnisse in wissenschaftlichen Organen. Beim Umgang mit den Daten werden ausschließlich die Bestimmungen des Datenschutzgesetzes beachtet. 21. Entstehen für die Teilnehmer Kosten? Gibt es einen Kostenersatz oder eine Vergütung? Durch Ihre Teilnahme an dieser klinischen Prüfung entstehen für Sie keine zusätzlichen Kosten. 122
123 14. Möglichkeit zur Diskussion weiterer Fragen Für weitere Fragen im Zusammenhang mit dieser klinischen Prüfung stehen Ihnen Ihr Prüfarzt und seine Mitarbeiter gern zur Verfügung. Auch Fragen, die Ihre Rechte als Patient und Teilnehmer an dieser klinischen Prüfung betreffen, werden Ihnen gerne beantwortet. Name der Kontaktperson: Privatdozent Dr. Lars Steinstraesser (Plastische Chirurgie) Ständig erreichbar unter: Name der Kontaktperson: Privatdozent Dr. Thomas Grau (Anästhesie, Ultraschall) Ständig erreichbar unter: Name der Kontaktperson: Professor Dr. Matthias Vorgerd (Neurologie, Elektrophysiologie) Ständig erreichbar unter: Name der Kontaktperson: Lutz Schreiber (Doktorand / Mitarbeiter der Plastischen Chirurgie) Ständig erreichbar unter:
124 EINVERSTÄNDNISERKLÄRUNG Name des Patienten in Druckbuchstaben:... Geb.Datum:... Code:... Ich erkläre mich bereit, an der klinischen Prüfung Prospektive Studie zu der Diagnostik beim Karpaltunnelsyndrom: Bildgebung durch Ultraschall gegenüber der elektrophysiologischen Untersuchung teilzunehmen. Ich bin von Herrn/Frau (Dr. med.) ausführlich und verständlich über mögliche Belastungen und Risiken, sowie über Wesen, Bedeutung und Tragweite der klinischen Prüfung, das studienbedingt keine Wegeversicherung besteht, sowie die sich für mich daraus ergebenden Anforderungen aufgeklärt worden. Aufgetretene Fragen wurden mir vom Prüfarzt verständlich und genügend beantwortet. Ich hatte ausreichend Zeit, mich zu entscheiden. Ich habe zur Zeit keine weiteren Fragen mehr. Ich werde den ärztlichen Anordnungen, die für die Durchführung der klinischen Prüfung erforderlich sind, Folge leisten. Ich behalte mir jedoch das Recht vor, meine freiwillige Mitwirkung jederzeit zu beenden, ohne dass mir daraus Nachteile für meine weitere medizinische Betreuung entstehen. Ich bin zugleich damit einverstanden, dass meine im Rahmen dieser klinischen Prüfung ermittelten Daten aufgezeichnet werden. Um die Richtigkeit der Datenaufzeichnung zu überprüfen, dürfen Beauftragte des Auftraggebers und der zuständigen Behörden beim Prüfarzt Einblick in meine personenbezogenen Krankheitsdaten nehmen. Beim Umgang mit den Daten werden die Bestimmungen des Datenschutzgesetzes beachtet. Eine Kopie dieser Patienteninformation und Einwilligungserklärung habe ich erhalten. Das Original verbleibt beim Prüfarzt.... (Datum und Unterschrift des Patienten)... (Datum, Name und Unterschrift des verantwortlichen Arztes) (Der Patient erhält eine unterschriebene Kopie der Patienteninformation und Einwilligungserklärung, das Original verbleibt im Studienordner des Prüfarztes.) 124
125 Berufsgenossenschaftliche Kliniken Bergmannsheil Universitätsklinik Juniorprofessor Privatdozent Dr. med. L. Steinsträßer BG-Kliniken Bergmannsheil Universitätsklinik Klinik für plastische Chirurgie u. Schwerbrandverletzte Handchirurgiezentrum Operatives Referenzzentrum für Gliedmassentumoren Postfach Bochum Klinik für Plastische Chirurgie und Schwerbrandverletzte Handchirurgie-Zentrum Direktor: Univ.-Prof. Dr. med. H. U. Steinau Telefon: 0234/ Telefax: 0234/ Bürkle-de-la-Camp-Platz Bochum Patientenaufkleber UNTERSUCHUNGSPROTOKOLL Prospektive Studie zu der Diagnostik beim Karpaltunnelsyndrom: Bildgebung durch Ultraschall gegenüber der elektrophysiologischen Untersuchung Checkliste: Prüfung auf Vollständigkeit OP-Termin der Patientin: / /20 Untersuchung Präoperativ / /20 30 Tage postoperativ / /20 3 Monate postoperativ / /20 6 Monate postoperativ / /20 12 Monate postoperativ / /20 Ultraschall Elektroneuro- / /20 / /20 / /20 / /20 / /20 / /20 / /20 / /20 / /20 / /20 graphie GripDynamometer Hoffmann- re Tinel-Zeichen li Phalen re Test li 125
Carpal-Tunnel-Syndrom. Operative Entlastung des Nervus medianus im Carpal-Tunnel
 Carpal-Tunnel-Syndrom Operative Entlastung des Nervus medianus im Carpal-Tunnel Anatomische Grundlagen und Symptome Was ist ein Carpal-Tunnel-Syndrom? Das Carpal-Tunnel-Syndrom, abgekürzt CTS, ist eine
Carpal-Tunnel-Syndrom Operative Entlastung des Nervus medianus im Carpal-Tunnel Anatomische Grundlagen und Symptome Was ist ein Carpal-Tunnel-Syndrom? Das Carpal-Tunnel-Syndrom, abgekürzt CTS, ist eine
Carpal-Tunnel-Syndrom
 Wir machen mobil Die Schulthess Klinik ist Swiss Olympic Medical Center und FIFA Medical Centre of Excellence Orthopädie Obere Extremitäten Carpal-Tunnel-Syndrom Operative Entlastung des Nervus medianus
Wir machen mobil Die Schulthess Klinik ist Swiss Olympic Medical Center und FIFA Medical Centre of Excellence Orthopädie Obere Extremitäten Carpal-Tunnel-Syndrom Operative Entlastung des Nervus medianus
Nervenkompressionssyndrome an Ellenbogen und Hand. Sportmedizinischer Grundkurs OTP III Podersdorf am See, 24. April 2015 Dr.
 Nervenkompressionssyndrome an Ellenbogen und Hand Sportmedizinischer Grundkurs OTP III Podersdorf am See, 24. April 2015 Dr. Christoph StoKer Allgemein I Chronische Druckschädigung peripherer Nerven Meist
Nervenkompressionssyndrome an Ellenbogen und Hand Sportmedizinischer Grundkurs OTP III Podersdorf am See, 24. April 2015 Dr. Christoph StoKer Allgemein I Chronische Druckschädigung peripherer Nerven Meist
Sonographische Diagnostik peripherer Nervenläsionen
 Sonographische Diagnostik peripherer Nervenläsionen Matthias Bußmeyer Klinik für Neurologie und klinische Neurophysiologie 26.01.2013 1 Sonographische Diagnostik peripherer 26.01.2013 Nervenläsionen Nervensonographie?
Sonographische Diagnostik peripherer Nervenläsionen Matthias Bußmeyer Klinik für Neurologie und klinische Neurophysiologie 26.01.2013 1 Sonographische Diagnostik peripherer 26.01.2013 Nervenläsionen Nervensonographie?
Karpaltunnel- Syndrom
 KliniK für HAnD- und PlAStiSCHe CHiRuRgie Karpaltunnel- Syndrom therapiemöglichkeiten und nachbehandlung Sehr geehrte Patientin, sehr geehrter Patient Mit dieser Broschüre möchten wir Sie über die Abläufe
KliniK für HAnD- und PlAStiSCHe CHiRuRgie Karpaltunnel- Syndrom therapiemöglichkeiten und nachbehandlung Sehr geehrte Patientin, sehr geehrter Patient Mit dieser Broschüre möchten wir Sie über die Abläufe
CTS (Carpal-Tunnel-Syndrom)
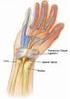 CTS (Carpal-Tunnel-Syndrom) Operative Entlastung des Nervus medianus im Carpal- Tunnel Was ist ein Carpaltunnelsyndrom? Das CTS (Carpal-Tunnel-Syndrom) ist eine Einengung des Nervus medianus (Handmittelnerv)
CTS (Carpal-Tunnel-Syndrom) Operative Entlastung des Nervus medianus im Carpal- Tunnel Was ist ein Carpaltunnelsyndrom? Das CTS (Carpal-Tunnel-Syndrom) ist eine Einengung des Nervus medianus (Handmittelnerv)
KARPALTUNNELSYNDROM (KTS)
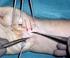 KARPALTUNNELSYNDROM (KTS) Synonyme Distales Medianuskompressionssyndrom, Handgelenkstunnelsyndrom, Brachialgia paraesthetica nocturna, Engl. Carpal tunnel syndrome Definition Beim Karpaltunnelsyndrom (KTS)
KARPALTUNNELSYNDROM (KTS) Synonyme Distales Medianuskompressionssyndrom, Handgelenkstunnelsyndrom, Brachialgia paraesthetica nocturna, Engl. Carpal tunnel syndrome Definition Beim Karpaltunnelsyndrom (KTS)
Was ist der Karpaltunnel?
 Was ist der Karpaltunnel? Der Karpaltunnel ist eine tunnelartige Röhre, die sich in der Tiefe zwischen der Daumenballen- und der Kleinfingermuskulatur befindet. Er beheimatet neben den Beugesehnen den
Was ist der Karpaltunnel? Der Karpaltunnel ist eine tunnelartige Röhre, die sich in der Tiefe zwischen der Daumenballen- und der Kleinfingermuskulatur befindet. Er beheimatet neben den Beugesehnen den
N. medianus (C 5 Th 1)
 330 Erkrankungen des peripheren Nervensystems Abb..37 Fallhand rechts bei Läsion des N.radialis rechts. Gelb eingefärbtist diezoneder autonomensensi- bilität im Ausbreitungsgebiet des Ramus superficialis
330 Erkrankungen des peripheren Nervensystems Abb..37 Fallhand rechts bei Läsion des N.radialis rechts. Gelb eingefärbtist diezoneder autonomensensi- bilität im Ausbreitungsgebiet des Ramus superficialis
5. Ärztetreffen der Praxis im KölnTriangle. 28. September 2011
 5. Ärztetreffen der Praxis im KölnTriangle 28. September 2011 Fallvorstellung: H., A.. Epicondylitis radialis humeri OP am 11.5.2011 Persistierende Beschwerden Großer OP Defekt Läsion laterales ulnares
5. Ärztetreffen der Praxis im KölnTriangle 28. September 2011 Fallvorstellung: H., A.. Epicondylitis radialis humeri OP am 11.5.2011 Persistierende Beschwerden Großer OP Defekt Läsion laterales ulnares
Obere Extremität lll Hand
 Funktionelle Anatomie des menschlichen Bewegungsapparates Fabian Hambücher, deutscher Kunstturner Obere Extremität lll Hand Clay Buchholz, Boston Red Socks FS 2014 Dr. Colacicco Dr. Amrein Ray Charles,
Funktionelle Anatomie des menschlichen Bewegungsapparates Fabian Hambücher, deutscher Kunstturner Obere Extremität lll Hand Clay Buchholz, Boston Red Socks FS 2014 Dr. Colacicco Dr. Amrein Ray Charles,
Neurologie für Physiotherapeuten
 Neurologie für Physiotherapeuten physiolehrbuch Krankheitslehre Bearbeitet von Michel Jesel 1. Auflage 2004. aschenbuch. 312 S. Paperback ISBN 978 3 13 132111 4 Format (B x L): 17 x 24 cm Weitere Fachgebiete
Neurologie für Physiotherapeuten physiolehrbuch Krankheitslehre Bearbeitet von Michel Jesel 1. Auflage 2004. aschenbuch. 312 S. Paperback ISBN 978 3 13 132111 4 Format (B x L): 17 x 24 cm Weitere Fachgebiete
Karpaltunnelsyndrom. Von Priv.-Doz. Dr. med. J. Carls; Orthopädische Klinik im Annastift, Hannover
 Karpaltunnelsyndrom Von Priv.-Doz. Dr. med. J. Carls; Orthopädische Klinik im Annastift, Hannover Synonyme Distales Medianuskompressionssyndrom. Brachialgia paraesthetica nocturna Definition Das Karpaltunnelsyndrom
Karpaltunnelsyndrom Von Priv.-Doz. Dr. med. J. Carls; Orthopädische Klinik im Annastift, Hannover Synonyme Distales Medianuskompressionssyndrom. Brachialgia paraesthetica nocturna Definition Das Karpaltunnelsyndrom
Karpaltunnelsyndrom. Klinik für Handchirurgie. der Herz- und Gefäß-Klinik GmbH Bad Neustadt / Saale
 Karpaltunnelsyndrom Klinik für Handchirurgie der Herz- und Gefäß-Klinik GmbH Bad Neustadt / Saale Klinik für Handchirurgie KARPALTUNNELSYNDROM Definition Das Karpaltunnelsyndrom (KTS) ist das häufigste
Karpaltunnelsyndrom Klinik für Handchirurgie der Herz- und Gefäß-Klinik GmbH Bad Neustadt / Saale Klinik für Handchirurgie KARPALTUNNELSYNDROM Definition Das Karpaltunnelsyndrom (KTS) ist das häufigste
Neuropathie. Prof. Dr. R. Schmitt. Trainingswoche Muskuloskelettale Radiologie September 2017 Portals Nous, Mallorca
 Ellenbogen - Neuropathie Anatomie, Degeneration Trainingswoche Muskuloskelettale Radiologie 18. - 22. September 2017 Portals Nous, Mallorca Prof. Dr. R. Schmitt Diagnostische und Interventionelle Radiologie
Ellenbogen - Neuropathie Anatomie, Degeneration Trainingswoche Muskuloskelettale Radiologie 18. - 22. September 2017 Portals Nous, Mallorca Prof. Dr. R. Schmitt Diagnostische und Interventionelle Radiologie
Kompressionsneuropathie N. ulnaris/n. radialis am Ellbogen
 Kompressionsneuropathie N. ulnaris/n. radialis am Ellbogen Stephan Schindele 25.10.2012 Cubitaltunnel-Syndrom Loge de Guyon-Syndrom zweithäufigste Kompressions-Syndrom (nach CTS) Inzidenz: 1/13 der Häufigkeits
Kompressionsneuropathie N. ulnaris/n. radialis am Ellbogen Stephan Schindele 25.10.2012 Cubitaltunnel-Syndrom Loge de Guyon-Syndrom zweithäufigste Kompressions-Syndrom (nach CTS) Inzidenz: 1/13 der Häufigkeits
Anatomische Landmarken. Muskel-Sehnen-Übergang. Retinaculum flexorum
 Anatomische Landmarken Muskel-Sehnen-Übergang Retinaculum flexorum Anatomische Varianten des Nervus Medianus multiple Thenaräste, ulnarer Abgang Anatomische Varianten des Nervus Medianus Proximaler akzessorischer
Anatomische Landmarken Muskel-Sehnen-Übergang Retinaculum flexorum Anatomische Varianten des Nervus Medianus multiple Thenaräste, ulnarer Abgang Anatomische Varianten des Nervus Medianus Proximaler akzessorischer
Grundlagen der Anatomie Unterarmmuskulatur O. Sievers -0- ANATOMIE UNTERARMMUSKULATUR MODUL VII
 Grundlagen der Anatomie Unterarmmuskulatur O. Sievers -0- ANATOMIE UNTERARMMUSKULATUR MODUL VII Grundlagen der Anatomie Unterarmmuskulatur O. Sievers -1- UNTERARMMUSKULATUR oberflächliche und tiefe Flexoren
Grundlagen der Anatomie Unterarmmuskulatur O. Sievers -0- ANATOMIE UNTERARMMUSKULATUR MODUL VII Grundlagen der Anatomie Unterarmmuskulatur O. Sievers -1- UNTERARMMUSKULATUR oberflächliche und tiefe Flexoren
XXVII Nervenkompressionssyndrome
 Drucksyndrome des Nervus medianus XXVII 1 XXVII Nervenkompressionssyndrome Nervenkompressionssyndrome an der oberen und unteren Extremität Von Nervenkompressionssyndromen spricht man, wenn Nerven chronisch
Drucksyndrome des Nervus medianus XXVII 1 XXVII Nervenkompressionssyndrome Nervenkompressionssyndrome an der oberen und unteren Extremität Von Nervenkompressionssyndromen spricht man, wenn Nerven chronisch
Inhaltsverzeichnis. 1 Zur Ätiopathogenese, Definition und Behandlung der Nervenkompressionssyndrome eine Einleitung...
 Inhaltsverzeichnis 1 Zur Ätiopathogenese, Definition und Behandlung der Nervenkompressionssyndrome eine Einleitung... 1 2 Klinische Untersuchung... 5 Anamnese... 5 Motorik... 5 Sensibilität... 6 Trophik...
Inhaltsverzeichnis 1 Zur Ätiopathogenese, Definition und Behandlung der Nervenkompressionssyndrome eine Einleitung... 1 2 Klinische Untersuchung... 5 Anamnese... 5 Motorik... 5 Sensibilität... 6 Trophik...
QIDB für Gremien 2007
 ...2 Indikation...3 10929...4 Spezifische postoperative Komplikationen...6 10945...7 10946...8 10947...9 QIDB 2007 Version v1.0 Seite 1 von 9 Leistungsbereich Leistungsbereich Historie Laienverständliche
...2 Indikation...3 10929...4 Spezifische postoperative Komplikationen...6 10945...7 10946...8 10947...9 QIDB 2007 Version v1.0 Seite 1 von 9 Leistungsbereich Leistungsbereich Historie Laienverständliche
Risikofaktoren für eine ernsthafte Wirbelsäulenerkrankung
 Risikofaktoren für eine ernsthafte Wirbelsäulenerkrankung Anamnese Alter 55 Trauma Bekannter Tumor Fieber Gewichtsverlust Nachtschmerzen Inkontinenz Sensibilitätsstörung perianal / Gesäss Neurologisches
Risikofaktoren für eine ernsthafte Wirbelsäulenerkrankung Anamnese Alter 55 Trauma Bekannter Tumor Fieber Gewichtsverlust Nachtschmerzen Inkontinenz Sensibilitätsstörung perianal / Gesäss Neurologisches
005/003 Karpaltunnels yndrom, Diagnostik und Therapie (Kurzfassung)
 publiziert bei: AWMF-Register Nr. 005/003 Klasse: S3 Leitlinie der Deutschen Gesellschaften für Handchirurgie, Neurochirurgie, Neurologie und rthopädie Karpaltunnelsyndrom Diagnostik und Therapie Kurzfassung
publiziert bei: AWMF-Register Nr. 005/003 Klasse: S3 Leitlinie der Deutschen Gesellschaften für Handchirurgie, Neurochirurgie, Neurologie und rthopädie Karpaltunnelsyndrom Diagnostik und Therapie Kurzfassung
Schmerz-Wegweiser: Ellenbogen, Unterarm und Hand
 Kapitel 6: Schmerzen in Ellenbogen, Unterarm und Hand 171 Schmerz-Wegweiser: Ellenbogen, Unterarm und Hand Ein primäres Schmerzmuster ist in Fettschrift gesetzt. In Normalschrift gesetzter Text bezieht
Kapitel 6: Schmerzen in Ellenbogen, Unterarm und Hand 171 Schmerz-Wegweiser: Ellenbogen, Unterarm und Hand Ein primäres Schmerzmuster ist in Fettschrift gesetzt. In Normalschrift gesetzter Text bezieht
11. Die Nekrose des Lunatums (Mondbein) oder die Krankheit von Kienböck
 11. Die Nekrose des Lunatums (Mondbein) oder die Krankheit von Kienböck Um was handelt es sich? Die von Kienböck beschriebene Krankheit ist eine Nekrose (Devitalisation) eines der 8 Knochen des Handgelenkes,
11. Die Nekrose des Lunatums (Mondbein) oder die Krankheit von Kienböck Um was handelt es sich? Die von Kienböck beschriebene Krankheit ist eine Nekrose (Devitalisation) eines der 8 Knochen des Handgelenkes,
Das Karpaltunnelsyndrom
 Praxis Das Karpaltunnelsyndrom Lisa Reissner, Stephan Schindele, Daniel Herren Schulthess Klinik Zürich Hauptteil Quintessenz P Das Karpaltunnelsyndrom (KTS) ist die häufigste Kompressionsneuro pathie
Praxis Das Karpaltunnelsyndrom Lisa Reissner, Stephan Schindele, Daniel Herren Schulthess Klinik Zürich Hauptteil Quintessenz P Das Karpaltunnelsyndrom (KTS) ist die häufigste Kompressionsneuro pathie
Ganglion (Überbein) Es gibt 3 verschiedene Formen eines Ganglions im Bereich der Handchirurgie:
 Ganglion (Überbein) Ein Ganglion, auch Überbein genannt, ist eine mit Flüssigkeit gefüllte Zyste, die sich unter der Haut bildet. Diese Zysten sind mit der Gelenkkapsel einer der Hand- oder Fingergelenke
Ganglion (Überbein) Ein Ganglion, auch Überbein genannt, ist eine mit Flüssigkeit gefüllte Zyste, die sich unter der Haut bildet. Diese Zysten sind mit der Gelenkkapsel einer der Hand- oder Fingergelenke
Obere Extremität II Ellbogen
 Funktionelle Anatomie des menschlichen Bewegungsapparates Fabian Hambücher, deutscher Kunstturner Obere Extremität II Ellbogen Clay Buchholz, Boston Red Socks FS 2014 Dr. Colacicco Dr. Amrein Ray Charles,
Funktionelle Anatomie des menschlichen Bewegungsapparates Fabian Hambücher, deutscher Kunstturner Obere Extremität II Ellbogen Clay Buchholz, Boston Red Socks FS 2014 Dr. Colacicco Dr. Amrein Ray Charles,
Definition. Entsprechend der Anatomie des Oberarms kann der Bruch folgende vier Knochenanteile betreffen: = Schultergelenkanteil des Oberarms
 Definition Die proximale Humerusfraktur ist ein Bruch des schulternahen Oberarmknochens, der häufig bei älteren Patienten mit Osteoporose diagnostiziert wird. Entsprechend der Anatomie des Oberarms kann
Definition Die proximale Humerusfraktur ist ein Bruch des schulternahen Oberarmknochens, der häufig bei älteren Patienten mit Osteoporose diagnostiziert wird. Entsprechend der Anatomie des Oberarms kann
Die Thrombin-Therapie beim Aneurysma spurium nach arterieller Punktion
 Aus der Universitätsklinik und Poliklinik für Innere Medizin III der Martin-Luther-Universität Halle-Wittenberg (Direktor: Prof. Dr. med. K. Werdan) und dem Herzzentrum Coswig Klinik für Kardiologie und
Aus der Universitätsklinik und Poliklinik für Innere Medizin III der Martin-Luther-Universität Halle-Wittenberg (Direktor: Prof. Dr. med. K. Werdan) und dem Herzzentrum Coswig Klinik für Kardiologie und
Taschenatlas Anatomie, Band 1: Bewegungsapparat
 Taschenatlas Anatomie, and : ewegungsapparat and : ewegungsapparat von Werner Platzer überarbeitet Taschenatlas Anatomie, and : ewegungsapparat Platzer schnell und portofrei erhältlich bei beck-shop.de
Taschenatlas Anatomie, and : ewegungsapparat and : ewegungsapparat von Werner Platzer überarbeitet Taschenatlas Anatomie, and : ewegungsapparat Platzer schnell und portofrei erhältlich bei beck-shop.de
Periphere Neuropathien: Klassische und neue Untersuchungsmethoden
 Periphere Neuropathien: Klassische und neue Untersuchungsmethoden Dr. med. Olivier Scheidegger Oberarzt Neuromuskuläres Zentrum Support Center for Advanced Neuroimaging Fallvignette: 27 jährig, weiblich
Periphere Neuropathien: Klassische und neue Untersuchungsmethoden Dr. med. Olivier Scheidegger Oberarzt Neuromuskuläres Zentrum Support Center for Advanced Neuroimaging Fallvignette: 27 jährig, weiblich
Aus der Klinik für Unfallchirurgie und Orthopädie der DRK-Kliniken-Köpenick, akademisches Lehrkrankenhaus der Charité Universität Berlin DISSERTATION
 Aus der Klinik für Unfallchirurgie und Orthopädie der DRK-Kliniken-Köpenick, akademisches Lehrkrankenhaus der Charité Universität Berlin DISSERTATION Untersuchungen zur Ätiologie des Karpaltunnelsyndroms
Aus der Klinik für Unfallchirurgie und Orthopädie der DRK-Kliniken-Köpenick, akademisches Lehrkrankenhaus der Charité Universität Berlin DISSERTATION Untersuchungen zur Ätiologie des Karpaltunnelsyndroms
Taschenatlas Anatomie, Band 1: Bewegungsapparat
 Taschenatlas Anatomie, Band : Bewegungsapparat Band : Bewegungsapparat von Werner Platzer überarbeitet Taschenatlas Anatomie, Band : Bewegungsapparat Platzer schnell und portofrei erhältlich bei beck-shop.de
Taschenatlas Anatomie, Band : Bewegungsapparat Band : Bewegungsapparat von Werner Platzer überarbeitet Taschenatlas Anatomie, Band : Bewegungsapparat Platzer schnell und portofrei erhältlich bei beck-shop.de
7 Arm-Hand. 7.1 Topographische Anatomie. 7.2 Screening W. KUHN 52 7 ARM-HAND
 7 Arm-Hand W. KUHN 7.1 Topographische Anatomie Am Ellenbogengelenk sind drei Gelenke in einer Kapsel vereint. Das humeroulnare Gelenk ist das Scharniergelenk, in dem die eigentlichen Extensions-und Flexionsbewegungen
7 Arm-Hand W. KUHN 7.1 Topographische Anatomie Am Ellenbogengelenk sind drei Gelenke in einer Kapsel vereint. Das humeroulnare Gelenk ist das Scharniergelenk, in dem die eigentlichen Extensions-und Flexionsbewegungen
Westerhuis P / Wiesner R. Klinische Muster in der Manuellen Therapie
 Westerhuis P / Wiesner R. Klinische Muster in der Manuellen Therapie Leseprobe Klinische Muster in der Manuellen Therapie von Westerhuis P / Wiesner R. Herausgeber: MVS Medizinverlage Stuttgart http://www.narayana-verlag.de/b15987
Westerhuis P / Wiesner R. Klinische Muster in der Manuellen Therapie Leseprobe Klinische Muster in der Manuellen Therapie von Westerhuis P / Wiesner R. Herausgeber: MVS Medizinverlage Stuttgart http://www.narayana-verlag.de/b15987
Muskelfunktionen am Schultergürtel. ~30 o
 Muskelfunktionen am Schultergürtel 5 ~30 o Muskelfuntionen am Schultergelenk ll e b f c d g a i h 3 fache Muskelsicherung des Schultergelenks: > Rotatorenmanschette > Oberes Schulterdach mit M. deltoideus
Muskelfunktionen am Schultergürtel 5 ~30 o Muskelfuntionen am Schultergelenk ll e b f c d g a i h 3 fache Muskelsicherung des Schultergelenks: > Rotatorenmanschette > Oberes Schulterdach mit M. deltoideus
«Mein Arm schläft ein»
 «Mein Arm schläft ein» - was ist das? Dr. med. Daniel Grob Winterthur Zuweisung Zuweisung vom Hausarzt Lieber Dani, gerne möchte ich dich um Aufgebot obiger, Dir bereits bekannter Patientin bitten. Sie
«Mein Arm schläft ein» - was ist das? Dr. med. Daniel Grob Winterthur Zuweisung Zuweisung vom Hausarzt Lieber Dani, gerne möchte ich dich um Aufgebot obiger, Dir bereits bekannter Patientin bitten. Sie
Karpaltunnelsyndrom. Wenn die Hände einschlafen und "anschwellen"
 Karpaltunnelsyndrom Man versteht darunter die chronische Kompression (Zusammendrücken) des Medianus-Nerven im Karpalkanal, d.h. bei seinem Durchtritt unter einem Band, (dem Retinaculum flexorum), ohne
Karpaltunnelsyndrom Man versteht darunter die chronische Kompression (Zusammendrücken) des Medianus-Nerven im Karpalkanal, d.h. bei seinem Durchtritt unter einem Band, (dem Retinaculum flexorum), ohne
DAS HANDGELENK. 1. Einführung
 DAS HANDGELENK Im Überblick Im Alltag und im Berufsleben ist das Handgelenk vielleicht das wichtigste Gelenk überhaupt. Nicht nur in vielen handwerklichen Berufen, sondern auch beim Sport ist es Belastungen
DAS HANDGELENK Im Überblick Im Alltag und im Berufsleben ist das Handgelenk vielleicht das wichtigste Gelenk überhaupt. Nicht nur in vielen handwerklichen Berufen, sondern auch beim Sport ist es Belastungen
Armmuskeln in Karteikarten schreiben
 Add-On zur Vorlesung "Armmuskeln": U A I F - Listen und Mal-Bögen 1 Armmuskeln in Karteikarten schreiben Auf den folgenden Seiten finden Sie die Ursprünge (U), Ansätze (A), die Innervation (I) und die
Add-On zur Vorlesung "Armmuskeln": U A I F - Listen und Mal-Bögen 1 Armmuskeln in Karteikarten schreiben Auf den folgenden Seiten finden Sie die Ursprünge (U), Ansätze (A), die Innervation (I) und die
Wann muss ein Neurologe die Operation empfehlen und wie ist die Prognose? Christian Lanz. Klinik
 Wann muss ein Neurologe die Operation empfehlen und wie ist die Prognose? Christian Lanz Klinik Hypästhesie, Parästhesie (intermittierend/ konstant) Paresen/ Atrophien intrinsische Handmuskulatur Schmerzen
Wann muss ein Neurologe die Operation empfehlen und wie ist die Prognose? Christian Lanz Klinik Hypästhesie, Parästhesie (intermittierend/ konstant) Paresen/ Atrophien intrinsische Handmuskulatur Schmerzen
Klinische Herangehensweise an den Patienten mit Sensibilitätsstörungen
 Klinische Herangehensweise an den Patienten mit Sensibilitätsstörungen Prof. Dr. med. Andrew Chan Universitäres Ambulantes Neurozentrum Kribbeln und Taubheitsgefühl 27jährige Frau Bis anhin gesund Kribbelparästhesien
Klinische Herangehensweise an den Patienten mit Sensibilitätsstörungen Prof. Dr. med. Andrew Chan Universitäres Ambulantes Neurozentrum Kribbeln und Taubheitsgefühl 27jährige Frau Bis anhin gesund Kribbelparästhesien
DEUTSCHE GESELLSCHAFT FÜR KARDIOLOGIE HERZ- UND KREISLAUFFORSCHUNG e.v. German Cardiac Society
 Die Herz-Magnet-Resonanz-Tomographie kann Kosten um 50% senken gegenüber invasiven Tests im Rahmen der Abklärung und Behandlung von Patienten mit Verdacht auf eine koronare Herzkrankheit: Resultate von
Die Herz-Magnet-Resonanz-Tomographie kann Kosten um 50% senken gegenüber invasiven Tests im Rahmen der Abklärung und Behandlung von Patienten mit Verdacht auf eine koronare Herzkrankheit: Resultate von
RELEVANTE ANATOMISCHE URSPRUNGS-VARIATION DER THENAR- UND HYPOTHENAR-MUSKULATUR FÜR DIE OPERATION DES KARPALTUNNELSYNDROMS
 AUS DER FAKULTÄT FÜR MEDIZIN DER UNIVERSITÄT REGENSBURG PRIV. DOZ. DR. MED. RICHARD MEGELE NEUROCHIRURGIE RELEVANTE ANATOMISCHE URSPRUNGS-VARIATION DER THENAR- UND HYPOTHENAR-MUSKULATUR FÜR DIE OPERATION
AUS DER FAKULTÄT FÜR MEDIZIN DER UNIVERSITÄT REGENSBURG PRIV. DOZ. DR. MED. RICHARD MEGELE NEUROCHIRURGIE RELEVANTE ANATOMISCHE URSPRUNGS-VARIATION DER THENAR- UND HYPOTHENAR-MUSKULATUR FÜR DIE OPERATION
Therapie. Klinik. Grundlage der RA Therapie ist die konservative Behandlung
 Klinik und Poliklinik für Orthopädie und orthopädische Chirurgie Direktor : Univ.-Prof. Dr. H. Merk Entzündliche Gelenkerkrankungen und Rheumatoide Arthritis Univ.-Prof. Dr. med. H. Merk Pathologie akut
Klinik und Poliklinik für Orthopädie und orthopädische Chirurgie Direktor : Univ.-Prof. Dr. H. Merk Entzündliche Gelenkerkrankungen und Rheumatoide Arthritis Univ.-Prof. Dr. med. H. Merk Pathologie akut
Pathophysiologie 3 Möglichkeiten werden diskutiert: 1. Entzündung Dolor Rubor Tumor Calor Schmerz Rötung Schwellung Wärme 2. Sympathische Störungen
 Pathophysiologie 3 Möglichkeiten werden diskutiert: 1. Entzündung Dolor Rubor Tumor Calor Schmerz Rötung Schwellung Wärme 2. Sympathische Störungen ausgeprägte autonome Störungen beim CRPS 3. Maladaptive
Pathophysiologie 3 Möglichkeiten werden diskutiert: 1. Entzündung Dolor Rubor Tumor Calor Schmerz Rötung Schwellung Wärme 2. Sympathische Störungen ausgeprägte autonome Störungen beim CRPS 3. Maladaptive
www. handchirurgie.org AGAPLESION DIAKONIEKLINIKUM HAMBURG
 Dr. Paul Preisser Arzt für Chirurgie/Unfallchirurgie Handchirurgie/Plastische Chirurgie www. handchirurgie.org AGAPLESION DIAKONIEKLINIKUM HAMBURG Karpaltunnelsyndrom Der so genannte Mittelnerv ( Nervus
Dr. Paul Preisser Arzt für Chirurgie/Unfallchirurgie Handchirurgie/Plastische Chirurgie www. handchirurgie.org AGAPLESION DIAKONIEKLINIKUM HAMBURG Karpaltunnelsyndrom Der so genannte Mittelnerv ( Nervus
Sebastian Antes, Klinik für Neurochirurgie, UKS Homburg. Periphere Nerven
 Sebastian Antes, Klinik für Neurochirurgie, UKS Homburg Periphere Nerven Wiederholung Grundlagen Motorik Sensorik Periphere Nerven: Bindeglied zwischen ZNS und Effektororgan bzw. Affektororgan und ZNS
Sebastian Antes, Klinik für Neurochirurgie, UKS Homburg Periphere Nerven Wiederholung Grundlagen Motorik Sensorik Periphere Nerven: Bindeglied zwischen ZNS und Effektororgan bzw. Affektororgan und ZNS
Funktionelle Anatomie Vorlesung , FS 2013
 Funktionelle Anatomie Vorlesung 376-0905-00, FS 2013 D. Obere Extremität D.P. Wolfer, I. Amrein, A. Rhyner, M.M. Müntener Bei den Zeichenvorlagen handelt es sich zum Teil um modifizierte Abbildungen aus
Funktionelle Anatomie Vorlesung 376-0905-00, FS 2013 D. Obere Extremität D.P. Wolfer, I. Amrein, A. Rhyner, M.M. Müntener Bei den Zeichenvorlagen handelt es sich zum Teil um modifizierte Abbildungen aus
Nierenschmerzen bei Zystennieren (ADPKD) Autosomal-dominante polyzystische Nierenerkrankung
 Nierenschmerzen bei Zystennieren (ADPKD) Autosomal-dominante polyzystische Nierenerkrankung 3 Informationen für Patienten sowie Hilfestellungen und Tipps bei Nierenschmerzen 01 Zystennieren (ADPKD) Bei
Nierenschmerzen bei Zystennieren (ADPKD) Autosomal-dominante polyzystische Nierenerkrankung 3 Informationen für Patienten sowie Hilfestellungen und Tipps bei Nierenschmerzen 01 Zystennieren (ADPKD) Bei
Dekompression bei Sulcus-ulnaris-Syndrom
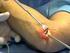 49 Kapitel 5 Dekompression bei Sulcus-ulnaris-Syndrom BQS-Projektleiter Dr. Frank Thölen Dr. Bernd Gruber Jan Hendrik Seidel Mitglieder der Fachgruppe Nervenkompressionssyndrome Prof. Dr. Johannes Giehl
49 Kapitel 5 Dekompression bei Sulcus-ulnaris-Syndrom BQS-Projektleiter Dr. Frank Thölen Dr. Bernd Gruber Jan Hendrik Seidel Mitglieder der Fachgruppe Nervenkompressionssyndrome Prof. Dr. Johannes Giehl
4. Ergebnisbeschreibung: 4.1 Zahlen:
 Copyright (c) by Foxit Software Company, 24 4. Ergebnisbeschreibung: Berücksichtigt wurden nach den unter 3. beschriebenen Ausschlusskriterien insgesamt 1 Fälle von gesichertem Karpaltunnelsyndrom bei
Copyright (c) by Foxit Software Company, 24 4. Ergebnisbeschreibung: Berücksichtigt wurden nach den unter 3. beschriebenen Ausschlusskriterien insgesamt 1 Fälle von gesichertem Karpaltunnelsyndrom bei
Muskelbeschreibung. M. scalenus anterior. M. scalenus medius. Ursprung: Tubercula anteriora der Processus transversi des 3. bis 6. Halswirbels.
 206 Mm. scaleni anterior, medius et posterior Muskelbeschreibung M. scalenus anterior Ursprung: Tubercula anteriora der Processus transversi des 3. bis 6. Halswirbels. Ansatz: Tuberculum M. scaleni anterioris
206 Mm. scaleni anterior, medius et posterior Muskelbeschreibung M. scalenus anterior Ursprung: Tubercula anteriora der Processus transversi des 3. bis 6. Halswirbels. Ansatz: Tuberculum M. scaleni anterioris
Spezialisierte Behandlung schmerzhafter Arthrosen der Hände
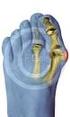 Spezialisierte Behandlung schmerzhafter Arthrosen der Hände Die Hände sind das aufwendigste und vielseitigste Werkzeug des menschlichen Bewegungsapparates. Sind sie gesund, ermöglichen sie präzise Greiffunktionen
Spezialisierte Behandlung schmerzhafter Arthrosen der Hände Die Hände sind das aufwendigste und vielseitigste Werkzeug des menschlichen Bewegungsapparates. Sind sie gesund, ermöglichen sie präzise Greiffunktionen
Das Karpaltunnelsyndrom Ergebnisse der offenen Karpaltunnelspaltung in der Kurzschnitttechnik
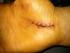 Aus der Klinik für Unfallchirurgie und Orthopädie Vivantes Humboldt-Klinikum DISSERTATION Das Karpaltunnelsyndrom Ergebnisse der offenen Karpaltunnelspaltung in der Kurzschnitttechnik zur Erlangung des
Aus der Klinik für Unfallchirurgie und Orthopädie Vivantes Humboldt-Klinikum DISSERTATION Das Karpaltunnelsyndrom Ergebnisse der offenen Karpaltunnelspaltung in der Kurzschnitttechnik zur Erlangung des
Anatomischer Aufbau der Wirbelsäule Bandscheibenvorfall
 Anatomischer Aufbau der Wirbelsäule Bandscheibenvorfall Definition, Ursachen, Ausprägung, Häufigkeit Symptome Diagnostik Therapie Pflege bei konservativer Therapie Bandscheibenoperation Prae- und postoperative
Anatomischer Aufbau der Wirbelsäule Bandscheibenvorfall Definition, Ursachen, Ausprägung, Häufigkeit Symptome Diagnostik Therapie Pflege bei konservativer Therapie Bandscheibenoperation Prae- und postoperative
Kapitel 16 Nervenaffektionen am Fuß
 Kapitel 16 Nervenaffektionen am Fuß 1. Definition / Ätiologie Nervenaffektionen am Fuß können entweder als Nervenengpaßsyndrom oder in Folge von einer Schädigung des Nervs auftreten. Als Nervenengpaßsydrom
Kapitel 16 Nervenaffektionen am Fuß 1. Definition / Ätiologie Nervenaffektionen am Fuß können entweder als Nervenengpaßsyndrom oder in Folge von einer Schädigung des Nervs auftreten. Als Nervenengpaßsydrom
Checkliste zur Kausalitätsattribuierung bei vermuteter toxischer Polyneuropathie
 Aus dem Fachbereich Medizin der Johann Wolfgang Goethe-Universität Frankfurt am Main Zentrum für Gesundheitswissenschaften Institut für Arbeitsmedizin, Sozialmedizin und Umweltmedizin Direktor: Prof. Dr.
Aus dem Fachbereich Medizin der Johann Wolfgang Goethe-Universität Frankfurt am Main Zentrum für Gesundheitswissenschaften Institut für Arbeitsmedizin, Sozialmedizin und Umweltmedizin Direktor: Prof. Dr.
Jahresauswertung 2002 Modul 01/1: Dekompression bei Carpaltunnelsyndrom. Qualitätsmerkmale. Sachsen Gesamt
 Qualitätssicherung bei Fallpauschalen und Sonderentgelten Modul 01/1: Qualitätsmerkmale Sachsen Teiln. Krankenhäuser Sachsen: 59 Auswertungsversion: 29 August 2003 Datensatzversion: 2002 5.0.1 Mindestanzahl
Qualitätssicherung bei Fallpauschalen und Sonderentgelten Modul 01/1: Qualitätsmerkmale Sachsen Teiln. Krankenhäuser Sachsen: 59 Auswertungsversion: 29 August 2003 Datensatzversion: 2002 5.0.1 Mindestanzahl
FAQ Handchirurgie. Priv. Doz. Dr.Peter Hahn Wichtig! Wichtig! Unbedingt lesen! 3
 FAQ Handchirurgie Priv. Doz. Dr.Peter Hahn hahn@hand.franken.de 18.03.2000 Inhaltsverzeichnis 1 Wichtig! Wichtig! Unbedingt lesen! 3 2 Karpaltunnelsyndrom 4 2.1 Was ist das?.............................
FAQ Handchirurgie Priv. Doz. Dr.Peter Hahn hahn@hand.franken.de 18.03.2000 Inhaltsverzeichnis 1 Wichtig! Wichtig! Unbedingt lesen! 3 2 Karpaltunnelsyndrom 4 2.1 Was ist das?.............................
Einfluss viszeraler osteopathischer Interventionen bei Kindern mit funktionellen Bauchschmerzen : Eine experimentelle Pilotstudie
 Einfluss viszeraler osteopathischer Interventionen bei Kindern mit funktionellen Bauchschmerzen : Eine experimentelle Pilotstudie Abschlussarbeit zur Erlangung des Titels: Bachelor of Science vorgelegt
Einfluss viszeraler osteopathischer Interventionen bei Kindern mit funktionellen Bauchschmerzen : Eine experimentelle Pilotstudie Abschlussarbeit zur Erlangung des Titels: Bachelor of Science vorgelegt
Elle und Speiche. Membrana interosseus (Zwischenknochenmembran)
 Elle und Speiche Die Elle ist proximal stärker und wird distal schmaler Die Speiche ist proximal schwach und zum Handgelenk hin distal stärker Die Dicke kommt aufgrund der Funktion zustande Membrana interosseus
Elle und Speiche Die Elle ist proximal stärker und wird distal schmaler Die Speiche ist proximal schwach und zum Handgelenk hin distal stärker Die Dicke kommt aufgrund der Funktion zustande Membrana interosseus
S. Vogel, 2003: Ergebnisse nach ventraler Fusion bei zervikalen Bandscheibenvorfällen
 7 Ergebnisse der Titangruppe Von den 46 Patienten, die ein Titancage als Distanzhalter erhielten, waren 26 männlich (56,5%) und 20 weiblich (43,5%). Auch bei diesen wurde eine Einteilung in 6 Altersgruppen
7 Ergebnisse der Titangruppe Von den 46 Patienten, die ein Titancage als Distanzhalter erhielten, waren 26 männlich (56,5%) und 20 weiblich (43,5%). Auch bei diesen wurde eine Einteilung in 6 Altersgruppen
Homöopathie für die Gelenke
 Homöopathie für die Gelenke Dr. med. M. Berger April 2016 Sich regelmäßig zu bewegen sowie eine geeignete Ernährung zu beachten liegt im Rahmen eines umfassenden Behandlungskonzeptes in der Hand jedes
Homöopathie für die Gelenke Dr. med. M. Berger April 2016 Sich regelmäßig zu bewegen sowie eine geeignete Ernährung zu beachten liegt im Rahmen eines umfassenden Behandlungskonzeptes in der Hand jedes
Ergebnisse. Klinische Charakteristik
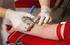 25 Ergebnisse 19 der 105 Patientinnen waren bis zum Zeitpunkt der Nachuntersuchung bereits verstorben, in 13 Fällen als Folge des Tumorleidens. Die durchschnittliche Überlebenszeit betrug 6,72 Jahren (95%
25 Ergebnisse 19 der 105 Patientinnen waren bis zum Zeitpunkt der Nachuntersuchung bereits verstorben, in 13 Fällen als Folge des Tumorleidens. Die durchschnittliche Überlebenszeit betrug 6,72 Jahren (95%
MUSKULATUR DER OBEREN EXTREMITÄTEN
 MUSKULATUR DER OBEREN EXTREMITÄTEN 1 M. BRACHIALIS (ARMBEUGER) Distal von der Tuberositas deltoidea Tuberositas ulnae Flexion im Ellenbogengelenk N. muskulocutaneus Oberarmvorderfläche Ellenrauhigkeit
MUSKULATUR DER OBEREN EXTREMITÄTEN 1 M. BRACHIALIS (ARMBEUGER) Distal von der Tuberositas deltoidea Tuberositas ulnae Flexion im Ellenbogengelenk N. muskulocutaneus Oberarmvorderfläche Ellenrauhigkeit
Indikation Vollständige oder > 40%-ige Durchtrennung der Sehne, eventuell mehrere Strukturen durch Schnittverletzung.
 Behandlungsleitlinie Beugesehnenverletzungen Operation Die Beugesehnen werden durch palmare zick-zack-förmige Hautschnitte oder durch z-förmige Erweiterungen der Wunde dargestellt. Das Ringbandsystem wird
Behandlungsleitlinie Beugesehnenverletzungen Operation Die Beugesehnen werden durch palmare zick-zack-förmige Hautschnitte oder durch z-förmige Erweiterungen der Wunde dargestellt. Das Ringbandsystem wird
Monate Präop Tabelle 20: Verteilung der NYHA-Klassen in Gruppe 1 (alle Patienten)
 Parameter zur Beschreibung der Leistungsfähigkeit Klassifikation der New-York-Heart-Association (NYHA) Gruppe 1 (alle Patienten): Die Eingruppierung der Patienten in NYHA-Klassen als Abbild der Schwere
Parameter zur Beschreibung der Leistungsfähigkeit Klassifikation der New-York-Heart-Association (NYHA) Gruppe 1 (alle Patienten): Die Eingruppierung der Patienten in NYHA-Klassen als Abbild der Schwere
Dekompression bei Karpaltunnelsyndrom
 40 Kapitel 4 Dekompression bei Karpaltunnelsyndrom BQS-Projektleiter Dr. Frank Thölen Dr. Bernd Gruber Jan Hendrik Seidel Mitglieder der Fachgruppe Nervenkompressionssyndrome Prof. Dr. Johannes Giehl Tübingen
40 Kapitel 4 Dekompression bei Karpaltunnelsyndrom BQS-Projektleiter Dr. Frank Thölen Dr. Bernd Gruber Jan Hendrik Seidel Mitglieder der Fachgruppe Nervenkompressionssyndrome Prof. Dr. Johannes Giehl Tübingen
Aus der Klinik und Poliklinik für kleine Haustiere der Freien Universität Berlin
 Aus der Klinik und Poliklinik für kleine Haustiere der Freien Universität Berlin Klinische Doppelblindstudie über den präoperativen Einsatz von Methylprednisolonsuccinat beim thorakolumbalen Bandscheibenvorfall
Aus der Klinik und Poliklinik für kleine Haustiere der Freien Universität Berlin Klinische Doppelblindstudie über den präoperativen Einsatz von Methylprednisolonsuccinat beim thorakolumbalen Bandscheibenvorfall
12.1 a Elektroneurographie und Elektromyographie
 1 12.1 a Elektroneurographie und Elektromyographie Elektrophysiologische Untersuchungen (Elektroneurographie ENG; Elektromyographie EMG) kommen bei der Lyme-Neuroborreliose häufig zum Einsatz. Diese Untersuchungsmethoden
1 12.1 a Elektroneurographie und Elektromyographie Elektrophysiologische Untersuchungen (Elektroneurographie ENG; Elektromyographie EMG) kommen bei der Lyme-Neuroborreliose häufig zum Einsatz. Diese Untersuchungsmethoden
Langzeit-Video-EEG-Monitoring. Patienteninformation
 Langzeit-Video-EEG-Monitoring Patienteninformation Sehr geehrte Damen und Herren, liebe Patienten, Epilepsie ist eine der häufigsten chronischen Erkrankungen des Nervensystems. Etwa zehn Prozent aller
Langzeit-Video-EEG-Monitoring Patienteninformation Sehr geehrte Damen und Herren, liebe Patienten, Epilepsie ist eine der häufigsten chronischen Erkrankungen des Nervensystems. Etwa zehn Prozent aller
Stephanie Rieger Dr.med.
 Stephanie Rieger Dr.med. Maligne Tumoren am knöchernen Becken, einschließlich des Multiplen Myeloms Untersuchung am Patientengut der Orthopädischen Universitätsklinik Heidelberg von 1974 bis 1998 Geboren
Stephanie Rieger Dr.med. Maligne Tumoren am knöchernen Becken, einschließlich des Multiplen Myeloms Untersuchung am Patientengut der Orthopädischen Universitätsklinik Heidelberg von 1974 bis 1998 Geboren
Elektrophysiologischer Nachweis langsam leitender Pyramidenbahnfasern
 Medizinische Fakultät Charité Universitätsmedizin Berlin Campus Benjamin Franklin Aus der Klinik für Neurologie Direktor Prof. Dr. med M. Endres Abteilung klinische Neurophysiologie Abteilungsleiter Prof.
Medizinische Fakultät Charité Universitätsmedizin Berlin Campus Benjamin Franklin Aus der Klinik für Neurologie Direktor Prof. Dr. med M. Endres Abteilung klinische Neurophysiologie Abteilungsleiter Prof.
Guillain-Barré syndrome and SIADH Saifudheen K, Jose J, Gafoor VA and Musthafa M Neurology 2011;76(8):
 Guillain-Barré syndrome and SIADH Saifudheen K, Jose J, Gafoor VA and Musthafa M Neurology 2011;76(8):701-704 Ziele Aufschluss über die Inzidenz und Charakteristik des SIADH bei GBS-Patienten zu erlangen
Guillain-Barré syndrome and SIADH Saifudheen K, Jose J, Gafoor VA and Musthafa M Neurology 2011;76(8):701-704 Ziele Aufschluss über die Inzidenz und Charakteristik des SIADH bei GBS-Patienten zu erlangen
Dupuytren sche Erkrankung
 Dupuytren sche Erkrankung Krankhaftes Zusammenziehen des Bindegewebes der Handinnenfläche Abb. I Beispiel einer Dupuytren sche Kontraktur an der Hand 1 Was ist die Dupuytren`sche-Erkrankung? Im Bereich
Dupuytren sche Erkrankung Krankhaftes Zusammenziehen des Bindegewebes der Handinnenfläche Abb. I Beispiel einer Dupuytren sche Kontraktur an der Hand 1 Was ist die Dupuytren`sche-Erkrankung? Im Bereich
Gangstörung? Demenz? Blasenschwäche? Altershirndruck (NPH) ist behandelbar!
 Gangstörung? Demenz? Blasenschwäche? Altershirndruck (NPH) ist behandelbar! EINLEITUNG Gangstörungen und Stürze, Gedächtnis- und Konzentrationsstörungen, Blasenschwäche. Dies sind Symptome, von denen viele
Gangstörung? Demenz? Blasenschwäche? Altershirndruck (NPH) ist behandelbar! EINLEITUNG Gangstörungen und Stürze, Gedächtnis- und Konzentrationsstörungen, Blasenschwäche. Dies sind Symptome, von denen viele
LEXIKON ELLENBOGEN/HAND
 Orthopädische Praxis Professor Dr. med. Markus Maier Ferdinand-Maria Str. 6 82319 Starnberg Fon: 08151-268 368 Fax: 08151-268 962 info@doc-maier.com www.doc-maier.com Arthrolyse Lösung von im Gelenk liegenden
Orthopädische Praxis Professor Dr. med. Markus Maier Ferdinand-Maria Str. 6 82319 Starnberg Fon: 08151-268 368 Fax: 08151-268 962 info@doc-maier.com www.doc-maier.com Arthrolyse Lösung von im Gelenk liegenden
Grundlagen der Medizinischen Klinik I + II. Dr. Friedrich Mittermayer Dr. Katharina Krzyzanowska
 Grundlagen der Medizinischen Klinik I + II Dr. Friedrich Mittermayer Dr. Katharina Krzyzanowska 1 Was ist Bluthochdruck? Der ideale Blutdruck liegt bei 120/80 mmhg. Bluthochdruck (Hypertonie) ist eine
Grundlagen der Medizinischen Klinik I + II Dr. Friedrich Mittermayer Dr. Katharina Krzyzanowska 1 Was ist Bluthochdruck? Der ideale Blutdruck liegt bei 120/80 mmhg. Bluthochdruck (Hypertonie) ist eine
Grundlagen. Lernerfolg. Übersicht. Klinische Untersuchung. Hirn und seine Hüllen. Gefäße. Rückenmark. Klinik für Neurochirurgie, Hüllen und Stützen
 Neurochirurgische Notfälle Neurochirurgie A. Nabavi Klinik für Neurochirurgie, Direktor Professor H.M. Mehdorn Hirn und seine Hüllen Gefäße Rückenmark Hüllen und Stützen periphere Nerven UKSH Campus Kiel
Neurochirurgische Notfälle Neurochirurgie A. Nabavi Klinik für Neurochirurgie, Direktor Professor H.M. Mehdorn Hirn und seine Hüllen Gefäße Rückenmark Hüllen und Stützen periphere Nerven UKSH Campus Kiel
Periphere Nervenläsionen bei Sjögren-Syndrom Dr. A. Rosenbohm Neurologische Universitätsklinik Ulm
 Periphere Nervenläsionen bei Sjögren-Syndrom 22.09.2012 Dr. A. Rosenbohm Neurologische Universitätsklinik Ulm Diagnosestellung in der Neurologie Befragung (Anamneseerhebung) Körperliche Untersuchung (Befunderhebung)
Periphere Nervenläsionen bei Sjögren-Syndrom 22.09.2012 Dr. A. Rosenbohm Neurologische Universitätsklinik Ulm Diagnosestellung in der Neurologie Befragung (Anamneseerhebung) Körperliche Untersuchung (Befunderhebung)
EMG NLG Elektromyographie und Nervenleitungsuntersuchungen
 EMG NLG Elektromyographie und Nervenleitungsuntersuchungen Elektromyographie Nervenleitungsuntersuchungen von Christian Bischoff, Reinhard Dengler, Hans Christian Hopf Neuausgabe Thieme 2008 Verlag C.H.
EMG NLG Elektromyographie und Nervenleitungsuntersuchungen Elektromyographie Nervenleitungsuntersuchungen von Christian Bischoff, Reinhard Dengler, Hans Christian Hopf Neuausgabe Thieme 2008 Verlag C.H.
Verbesserung des Tuberkulose-Screenings bei Patienten mit rheumatischen Erkrankungen vor Beginn einer Therapie mit TNFα-Blockern
 Rheumatologie / Klinische Immunologie Prof. Dr. H.P. Tony (Leiter des Schwerpunktes) Prof. Dr. med. Ch. Kneitz Medizinische Poliklinik Klinikstr. 6-8 97070 Würzburg Abstract: 1 / 10 Verbesserung des Tuberkulose-Screenings
Rheumatologie / Klinische Immunologie Prof. Dr. H.P. Tony (Leiter des Schwerpunktes) Prof. Dr. med. Ch. Kneitz Medizinische Poliklinik Klinikstr. 6-8 97070 Würzburg Abstract: 1 / 10 Verbesserung des Tuberkulose-Screenings
Nerv - Muskel - Schmerz
 Nerv - Muskel - Schmerz Diagnostik und Therapie peripherer Läsionen Mit 126 Abbildungen und 14 Tabellen von Prof. Dr. med. Wilfred A. Nix Neurologische Universitätsklinik Mainz vfm Verlag für Medizin Dr.
Nerv - Muskel - Schmerz Diagnostik und Therapie peripherer Läsionen Mit 126 Abbildungen und 14 Tabellen von Prof. Dr. med. Wilfred A. Nix Neurologische Universitätsklinik Mainz vfm Verlag für Medizin Dr.
Tendovaginitis und Tendovaginitis stenosans (de Quervain) (Trigger finger De Quervain s tenosynovitis)
 1 Tendovaginitis und Tendovaginitis stenosans (de Quervain) (Trigger finger De Quervain s tenosynovitis) von Priv.-Doz. Dr. med. Jörg Carls, Medizinische Hochschule Hannover im Annastift Korrespondenzadresse:
1 Tendovaginitis und Tendovaginitis stenosans (de Quervain) (Trigger finger De Quervain s tenosynovitis) von Priv.-Doz. Dr. med. Jörg Carls, Medizinische Hochschule Hannover im Annastift Korrespondenzadresse:
Aus der Klinik für Allgemein-, Viszeral- und Gefäßchirurgie der Martin-Luther-Universität Halle-Wittenberg Direktor: Prof. Dr. med. H.
 Aus der Klinik für Allgemein-, Viszeral- und Gefäßchirurgie der Martin-Luther-Universität Halle-Wittenberg Direktor: Prof. Dr. med. H. Dralle Gastric-banding als Operationsmethode bei morbider Adipositas
Aus der Klinik für Allgemein-, Viszeral- und Gefäßchirurgie der Martin-Luther-Universität Halle-Wittenberg Direktor: Prof. Dr. med. H. Dralle Gastric-banding als Operationsmethode bei morbider Adipositas
5 Unterarm. Ellenbogenbruch (Olecranon-Fraktur) Ellenbogenverrenkung. Speichenköpfchenbruch (Radiusköpfchenfraktur)
 5 Unterarm Ellenbogenbruch (Olecranon-Fraktur) Bei dieser Bruchform zieht die am Ellenbogen ansetzende Oberarmstreckmuskulatur die Bruchenden auseinander. Hier muß fast ausnahmslos operiert werden (Drahtzuggurtung
5 Unterarm Ellenbogenbruch (Olecranon-Fraktur) Bei dieser Bruchform zieht die am Ellenbogen ansetzende Oberarmstreckmuskulatur die Bruchenden auseinander. Hier muß fast ausnahmslos operiert werden (Drahtzuggurtung
Chirurgische Schmerz- und Engpass-Syndrome der Unteren Extremität Mai 2008, Klagenfurt
 Chirurgische Schmerz- und Engpass-Syndrome der Unteren Extremität 2. - 3. Mai 2008, Klagenfurt 09.00 09.10 Uhr Begrüßung durch Dr. Albin Obiltschnig 09.10 11.00 Uhr Programm Freitag, 2. Mai 2008 TEIL I
Chirurgische Schmerz- und Engpass-Syndrome der Unteren Extremität 2. - 3. Mai 2008, Klagenfurt 09.00 09.10 Uhr Begrüßung durch Dr. Albin Obiltschnig 09.10 11.00 Uhr Programm Freitag, 2. Mai 2008 TEIL I
Arthrodese des Daumensattelgelenkes
 110 ] Eingriffe am Daumen Arthrodese des Daumensattelgelenkes ] Prinzip Versteifung des Daumensattelgelenkes in Funktionsstellung. ] Indikation Arthrose oder Instabilität des Daumensattelgelenkes bei jungen,
110 ] Eingriffe am Daumen Arthrodese des Daumensattelgelenkes ] Prinzip Versteifung des Daumensattelgelenkes in Funktionsstellung. ] Indikation Arthrose oder Instabilität des Daumensattelgelenkes bei jungen,
Multiple Sklerose (MS)
 Bild: Kurzlehrbuch Neurologie, Thieme Multiple Sklerose 2 Multiple Sklerose (MS) Inhalt» Pathogenese» Symptome» Diagnostik» Therapie Multiple Sklerose 4 Multiple Sklerose 3 Klinischer Fall..\3) Sammlung\Klinischer
Bild: Kurzlehrbuch Neurologie, Thieme Multiple Sklerose 2 Multiple Sklerose (MS) Inhalt» Pathogenese» Symptome» Diagnostik» Therapie Multiple Sklerose 4 Multiple Sklerose 3 Klinischer Fall..\3) Sammlung\Klinischer
Die Verletzungen und Brüche des Oberarmes
 Die Verletzungen und Brüche des Oberarmes Bruch des körpernahen Oberarmes (proximale Humerusfraktur) Etwa 5% aller Knochenbrüche im Erwachsenenalter und 4% bei Kindern und Jugendlichen, betreffen den körpernahen
Die Verletzungen und Brüche des Oberarmes Bruch des körpernahen Oberarmes (proximale Humerusfraktur) Etwa 5% aller Knochenbrüche im Erwachsenenalter und 4% bei Kindern und Jugendlichen, betreffen den körpernahen
Langzeitergebnisse nach LAUP / UPPP bei Patienten mit obstruktiver Schlafapnoe und primärem Schnarchen
 Medizinische Fakultät der Charité Universitätsmedizin Berlin Campus Benjamin Franklin aus der Klinik für Hals-Nasen-Ohren-Heilkunde Direktor: Univ.-Prof. Dr. med. Scherer Langzeitergebnisse nach LAUP /
Medizinische Fakultät der Charité Universitätsmedizin Berlin Campus Benjamin Franklin aus der Klinik für Hals-Nasen-Ohren-Heilkunde Direktor: Univ.-Prof. Dr. med. Scherer Langzeitergebnisse nach LAUP /
