Der photographische Prozess
|
|
|
- Kevin Scholz
- vor 8 Jahren
- Abrufe
Transkript
1 Universität Regensburg Institut für Anorganische Chemie - Lehrstuhl Prof. Dr. A. Pfitzner Demonstrationsversuche im Wintersemester 2011/ Betreuung: Dr. M. Andratschke Referentin: Natalie Leidinger Der photographische Prozess I) Einführung Definition: Photographie (oder Fotografie) ist ein Verfahren zur Herstellung dauerhafter, durch elektromagnetische Strahlen oder Licht, erzeugter Bilder. [1] Der Begriff stammt aus den griechischen Wörtern φῶς, phos, Licht, Helligkeit und γράφειν, grafeïn, zeichnen, ritzen, malen, schreiben. [2] Grundlage der Schwarz-Weiß-Photographie sind die lichtempfindlichen Eigenschaften der Silberhalogenide. Diese Stoffe zersetzen sich am Licht unter Graufärbung langsam in die Elemente. [3] Zu den grundlegenden Schritten zählen die Belichtung, die Entwicklung und das Fixieren. Aber welche chemischen Prozesse stecken dahinter und was hat Gelatine mit der Photographie zu tun? II) Geschichte der Photographie Bereits im 4. Jhd. v. Chr. beobachtet Aristoteles ( v. Chr.) erstmals die Erzeugung eines auf dem Kopf stehenden Bildes, wenn das Licht durch ein kleines Loch in einen dunklen Raum fällt. In dem Werk "Problemata physica" beschreibt er diese Erscheinung (s. Abb. 1) und somit das Grundprinzip der Camera Obscura (s. Abb. 2). [4] Bereits dem deutschen Physiker Johann Heinrich Schulze ( ) war 1717 die Färbung chemischer Substanzen durch Sonnenlicht bekannt (siehe Versuch 1). Abb. 1 Prinzip einer Lochkamera Abb. 2 Camera Obscura Abb. 3 Erstes dauerhaftes Foto von Joseph Nicéphore Nièpce 1826 schaffte es der Franzose Joseph Nicéphore Niepce ( ) das erste beständige Bild anzufertigen. Es zeigt den Blick aus dem Fenster seines Arbeitszimmers (s. Abb. 3). Die Belichtungszeit betrug mehrere Stunden. Somit war es unmöglich, Menschen oder sich bewegende Gegenstände zu fotografieren gelang es dem französischen Maler Louis Jacques Mandé Daguerre eine mit Silberjodid beschichtete Silberplatte in Quecksilberdämpfen zu entwickeln und anschließend in warmer Kochsalzlösung zu fixieren stellte William Henry Fox Talbot das erste Negativ-Verfahren vor, das er als Kalotypie (auch Talbotypie genannt) bezeichnete. Die Trennung von Aufnahme und Entwicklung des Bildes gelang durch die Gelatine-Trockenplatten, die 1871 von Richard Leach Maddox vorgestellt wurden begann durch George Eastman die Industrialisierung der Photographie mit der in größerem Maßstab industriell gefertigten Rollfilmkamera Kodak Nr. 1. [5] 1
2 III) Photographische Prozesse im Überblick 3.1 Ohne Silber läuft nichts Die Lichtempfindlichkeit von Silbersalzen erkannte, wie bereits erwähnt, im 18. Jahrhundert der Physiker Johann Heinrich Schulze, der damit den Grundstein für die Schwarz-Weiß-Photographie legte. Bis zu der Umstellung auf digitale Abbildungstechnik Ende der 1990er Jahre, war Silber ein wichtiger Bestandteil der Photographie. Silber gehört zur Gruppe der Edelmetalle. Es ist ein weiches, gut verformbares (duktiles) Schwermetall mit der höchsten elektrischen Leitfähigkeit aller Elemente. Das meiste Silber wird aus Silbererzen gewonnen, die oft zusammen mit Blei-, Kupfer- und Zinkerzen als Sulfide oder Oxide vorkommen. [6] Alle Silberverbindungen sind lichtempfindlich. Bis auf Silberfluorid sind seine Halogenide schwerlöslich, aber sie sind durch Komplexbildner in Lösung zu bringen. [6] 3.2 Aufbau eines Schwarz-Weiß-Filmes In den Versuchen wurde als Träger für die Silberhalogenide ein Filterpapier verwendet, bei den üblichen Schwarzweiß-Filmen ist die lichtempfindliche Substanz in eine Emulsion, die Gelatine enthält, eingebettet (Abb. 4): Schutzschicht (Gelatine) bewahrt die Emulsion vor mechanischen Verletzungen. Die Emulsion (Gelatine und Silberhalogenid) enthält lichtempfindliche Partikel. Ein Schichtträger aus Acetylcellulose trägt die Emulsion. Der Lichthofschutz (eingefärbte Gelatine) verhindert die Reflexion des auffallenden Lichtes. Abb. 4 Aufbau eines Schwarz-Weiß-Filmes Die Gelatine hat mehrere Aufgaben zu erfüllen, zum einen ist sie Bindemittel oder Träger der Silberhalogenidmikrokristalle. Sie hält die Kriställchen fein verteilt in der Schwebe und befestigt sie nach dem Vergießen und Trocknen auf der Unterlage. Weiterhin übt sie einen nicht zu unterschätzenden Einfluss auf das Kristallwachstum während der Fällung aus, und schließlich hängen die fotografischen Eigenschaften der fertigen Emulsion sehr wesentlich von der Qualität der Gelatine ab. [7] 3.3 Versuch 1: Die Belichtung von Silberbromid Material/ Chemikalien: Silbernitrat (AgNO 3 ), Kaliumbromid (KBr), Rundfilter, Schablone, Kristallisierschale, UV- Lampe Durchführung: Man stellt Silberbromid (AgBr) her, indem man Silbernitratlösung in eine Kaliumbromidlösung tropft. Der gelbliche Niederschlag (= Silberbromid) wird abfiltriert und dann auf dem Filterpapier gleichmäßig zu einer Schicht ausgestrichen. Darauf legt man eine lichtundurchlässige Schablone (z. B. ein Blatt) und setzt das Ganze einige Minuten UV-Licht aus. ([8] modifiziert) Beobachtung: Während das Silberbromid unter der Schablone unverändert bleibt, hat sich das übrige durch den Einfluss des Lichtes dunkel gefärbt. Erklärung: Das Licht katalysiert die Reduktion der Silberkationen zu Silber, Bromid wird dabei zu Brom oxidiert: Reduktion: Ag + + e - Ag /x2 Oxidation: 2 Br - Br e Redoxreaktion: 2 AgBr 2 Ag + Br 2 2
3 Um diesen Prozess genauer verstehen zu können, muss man jedoch zunächst erwähnen, dass ideale Silberhalogenid-Kristalle (s. Abb. 5), die ausschließlich aus einem regelmäßigen Gitteraufbau bestehen, praktisch nicht lichtempfindlich sind. Im Gegensatz zu anderen Festkörpern gibt der reale Silberbromidkristall einen relativ großen Anteil der absorbierten Lichtquanten nicht wieder in Form von Wärme oder Licht anderer Wellenlänge ab, sondern erleidet irreversible chemische Veränderung. [7] Man spricht von der fotolytischen Zersetzung. Hervorgerufen wird diese Lichtempfindlichkeit in der Regel durch Verunreinigungen. Wenn Silberionen infolge thermischer Anregung von ihren Gitterplätzen ins Zwischengitter springen, wo sie leichter beweglich sind, wird dies als Frenkelsche Fehlordnung bezeichnet (s. Abb. 6). Die zurückgelassene Leerstelle führt zu einer negativen Überschussladung an der Vakanz und einer positiven Überschussladung an dem neuen Zwischengitterplatz. Bei der Belichtung (Absorption eines Photons) wird nun ein Elektron von einem Halogenid (Br - ) in dem Silberbromid- Kristall abgespalten (s. Abb. 7), welches sich frei im Kristall bewegen kann. Das Elektron wandert durch den Kristall, bis es von einem schon vorhandenen positiv geladenen Silberion (Reifekeim) eingefangen wird. Folglich wird dieses Ion zu Silber reduziert. Die Ladung des Keims wird also neutralisiert (s. Abb. 8). Durch mehrmaliges Wiederholen dieses Prozesses kann sich letztlich aus einer Ansammlung von bis zu 10 Silberatomen ein sogenannter Latentbildkeim (= Silberfleck) bilden. Genauer gesagt ist ein Latentbildkeim ein Silberfaden, der die Information speichert, dass an dieser Stelle Licht aufgetroffen ist. Der Latentbildkeim vergrößert sich, je mehr Licht auftrifft und je mehr Elektronen für die Silberionen zur Verfügung stehen, die sich am Silberfaden anlagern können. Das gleichzeitig gebildete Brom wird durch die Gelatine gebunden. Die ausgeschiedene Silbermenge ist im Ganzen genommen aber so gering, dass das auf diese Weise gewonnene Bild dem Auge unsichtbar ist ( latentes Bild ). Es muss daher erst noch zum sichtbaren Bild entwickelt werden. [3, 7, 9] Abb. 5 Idealer Silberhologenid-Kristall Abb. 6 Silberhologenid-Kristall mit Frenkel-Defekt Abb. 7 Absorption eines Lichtquants Abb. 8 Reduktion zu Silber 3
4 3.4 Versuch 2: Das Entwickeln Reduktion der Silberionen durch Hydrochinon Material/ Chemikalien: Reagenzglas, Pipetten, Silbernitratlösung (AgNO 3 ), Kaliumbromidlösung (KBr), Natronlauge (NaOH), Hydrochinon (C 6 H 6 O 2 ) Durchführung: Die Kaliumbromid- und die Silbernitratlösung werden in einem Reagenzglas vermischt. Es entsteht Silberbromid. Der leicht gelbliche Niederschlag setzt sich ab. Die überstehende Flüssigkeit wird abgegossen und der Niederschlag mit 1 ml verdünnter Natronlauge versetzt. Zusätzlich werden einige Hydrochinon-Kristalle zugegeben. Beobachtung: Die Lösung färbt sich schwarz. Erklärung: Während der Belichtung entstehen in den vom Licht getroffenen Bromsilberkristallen entwicklungsfähige Silberkeime (Latentbildkeime). Diese sind notwendig, da sie bei der Entwicklung als Katalysatoren wirken. An der Phasengrenze des Latentbildkeimes zur Entwicklerlösung wird der Entwickler (z. B. Hydrochinon, s. Abb. 9) oxidiert und überträgt Elektronen auf den Silberkeim. Das überschüssige Elektron im Silberkeim neutralisiert nun ein Zwischengittersilberion. Das so entwickelte Silber schiebt sich als "Faden" aus dem Kristall heraus. Außerdem verlässt für jedes entladene Zwischengittersilberion formal ein Bromid den Kristall, der so insgesamt abgebaut wird. In seiner Wirkung entspricht der Entwickler einem millionenfachen chemischen Verstärker. Die Bildpartien, die mehr Licht erhielten, werden stärker geschwärzt als die weniger intensiv belichteten. Das Resultat ist ein in seinen Tonwerten umgekehrtes, negatives Bild des Objektes. Die unbelichteten (silberkeimfreien) Stellen der photographischen Schicht werden vom Entwickler erst bei sehr langen Entwicklungszeiten angegriffen, das Bild verschleiert. Um dies zu verhindern, wird rechtzeitig durch ein saures Stoppbad die Entwicklung beendet (Entwicklung läuft normal in basischem Milieu ab). [3, 7, 10] Hydrochinon Chinon Abb. 9: Redoxreaktion der Silberionen durch Hydrochinon [entnommen aus 10, erstellt mit 11] Während des Entwickelns werden ständig Hydroxidionen verbraucht, so daß der ph-wert und damit das Entwicklungsvermögen der Entwicklersubstanz allmählich sinkt. Daher setzt man eine schwache Base mit Pufferwirkung zu. 3.5 Versuch 3 [12]: Fixieren Lösen der Silberhalogenide durch Natriumthiosulfat Materialien/ Chemikalien: Reagenzglas, Pipette, Silbernitratlösung (AgNO 3 ), Kaliumbromidlösung (KBr), Natriumthiosulfatlösung (Na 2 S 2 O 3 ) Durchführung: In einem Reagenzglas wird etwas Silbernitratlösung mit derselben Menge Kaliumbromidlösung versetzt. Zum entstandenen Silberbromid wird anschließend etwas Natriumthiosulfatlösung gegeben. Beobachtung: Der gelbliche Silberbromidniederschlag verschwindet. Es entsteht eine klare Lösung. 4
5 Erklärung: Die fertig entwickelten Silberhalogenidschichten enthalten an den unbelichteten Stellen noch unverändertes Silberhalogenid und müssen erst gegenüber weiteren Lichteinwirkungen stabilisiert werden, weil sie sonst mehr oder weniger schnell verschleiern würden. [7] Mit dem Natriumthiosulfat wird das nicht umgesetzte Silberbromid aus der Schicht entfernt. Die Thiosulfationen bilden mit den Silberionen einen löslichen Komplex (Dithiosulfatoargentat(I)): AgBr(s) + 2 S 2 O 3 2- (aq) [Ag(S 2 O 3 ) 2 ] 3- + Br Vom Negativ zum Positiv Durch das Belichten eines Negativs auf ein lichtempfindliches Fotopapier entsteht nach anschließender Entwicklung (siehe vorangegangenen Schritte) ein in seinen Tonwerten umgekehrtes, nunmehr positives, der Wirklichkeit entsprechendes Bild. [13] IV) Lehrplanbezug Der photographische Prozess ist nicht explizit im Lehrplan für die sechsstufige Realschule aufgeführt. Es wäre aber denkbar, dieses Thema als Exkurs oder Projektarbeit bei dem Stoffgebiet Metalle/Silber (8. Klasse, mathematischnaturwissenschaftlicher Bereich; Ch. 8.7 Atombau und Periodensystem) oder in der 9. Klasse (Ch. 9.2 Redoxreaktionen als Elektronenübertragungen) bei dem Thema Redoxreaktionen als Elektronenübertragung einzuführen. [14] V) Quellenangaben: Abbildungen:.. Abb. 1: (Stand ) Abb. 2: (Stand ) Abb. 3: (Stand ) Abb. 4-8: erstellt mit Microsoft Word 2010 Abb. 9: erstellt mit ChemDraw Ultra 11 von Cambridgesoft Literatur: [1] (Stand ) [2] (Stand ) [3] M. Binnewies, M. Jäckel, H. Willner, G. Rayner-Canham: Allgemeine und Anorganische Chemie, 2. Auflage, Spektrum Akademischer Verlag, 2011, S [4] (Stand ) [5] (Stand ) [6] (Stand ) [7] K. W. Junge, G. Hübner: Fotografische Chemie, 3., verbesserte Auflage, VEB Kinoverlag Leipzig, Leipzig, 1979, S , 20-22, 25-27, 35-36, 43, 52, [8] K. Häusler, H. Rampf, R. Reichelt: Experimente für den Chemieunterricht, 2. Auflage, Oldenbourg Schulbuchverlag GmbH, München, Düsseldorf, Stuttgart, 1991, S. 60, Versuch 3.9 [9] A. Fr. Holleman, E. Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, Walter de Gruyter, Berlin, New York, 2007, S [10] H. K. Kerner, H. W. Kerner: Lexikon der Reprotechnik, Welz, Reinhard, Vermittlerverlag Mannheim, 2007, S. 328 [11] ChemDraw Ultra 11 von Cambridgesoft [12] H. Boeck: Chemische Schulexperimente, Band 1 Anorganische Chemie, 1. Auflage, Volk und Wissen Verlag GmbH, Berlin 1998, S. 286 [13] E. A. Weber: Foto Praktikum, 4. Auflage, Birkhäuser Verlag, Basel, Boston, Berlin, 2004, S. 12 [14] 5
Demonstrationsvorträge in Anorganischer Chemie für Studierende des Lehramtes an Gymnasien. Der Photographische Prozess
 Universität Regensburg Naturwissenschaftliche Fakultät IV Institut für Anorganische Chemie - Lehrstuhl Prof. Dr. A. Pfitzner Dozentin: Dr. M. Andratschke Demonstrationsvorträge in Anorganischer Chemie
Universität Regensburg Naturwissenschaftliche Fakultät IV Institut für Anorganische Chemie - Lehrstuhl Prof. Dr. A. Pfitzner Dozentin: Dr. M. Andratschke Demonstrationsvorträge in Anorganischer Chemie
Cyanotype eines Gurkengewächses. Foto: Juanita Schläpfer
 Cyanotype eines Gurkengewächses Foto: Juanita Schläpfer 108 4.1 Pflanzenstrukturen mit Cyanotypie erkennen Mit dem Verfahren der Cyanotypie können Bilder von Pflanzenteilen hergestellt werden. Die Kinder
Cyanotype eines Gurkengewächses Foto: Juanita Schläpfer 108 4.1 Pflanzenstrukturen mit Cyanotypie erkennen Mit dem Verfahren der Cyanotypie können Bilder von Pflanzenteilen hergestellt werden. Die Kinder
Kapitel 13: Laugen und Neutralisation
 Kapitel 13: Laugen und Neutralisation Alkalimetalle sind Natrium, Kalium, Lithium (und Rubidium, Caesium und Francium). - Welche besonderen Eigenschaften haben die Elemente Natrium, Kalium und Lithium?
Kapitel 13: Laugen und Neutralisation Alkalimetalle sind Natrium, Kalium, Lithium (und Rubidium, Caesium und Francium). - Welche besonderen Eigenschaften haben die Elemente Natrium, Kalium und Lithium?
Rost und Rostschutz. Beobachtung: Nach wenigen Momenten steigt das Wasser im Glasröhrchen an.
 Universität Regensburg Institut für Anorganische Chemie Lehrstuhl Prof. Dr. A. Pfitzner Demonstrationsvortrag im Wintersemester 2010/2011 26.11.2010 Dozentin: Dr. M. Andratschke Referenten: Forster, Robert
Universität Regensburg Institut für Anorganische Chemie Lehrstuhl Prof. Dr. A. Pfitzner Demonstrationsvortrag im Wintersemester 2010/2011 26.11.2010 Dozentin: Dr. M. Andratschke Referenten: Forster, Robert
SUPERABSORBER. Eine Präsentation von Johannes Schlüter und Thomas Luckert
 SUPERABSORBER Eine Präsentation von Johannes Schlüter und Thomas Luckert Inhalt: Die Windel Die Technik des Superabsorbers Anwendungsgebiete des Superabsorbers Ein kurzer Abriss aus der Geschichte der
SUPERABSORBER Eine Präsentation von Johannes Schlüter und Thomas Luckert Inhalt: Die Windel Die Technik des Superabsorbers Anwendungsgebiete des Superabsorbers Ein kurzer Abriss aus der Geschichte der
Lichtbrechung an Linsen
 Sammellinsen Lichtbrechung an Linsen Fällt ein paralleles Lichtbündel auf eine Sammellinse, so werden die Lichtstrahlen so gebrochen, dass sie durch einen Brennpunkt der Linse verlaufen. Der Abstand zwischen
Sammellinsen Lichtbrechung an Linsen Fällt ein paralleles Lichtbündel auf eine Sammellinse, so werden die Lichtstrahlen so gebrochen, dass sie durch einen Brennpunkt der Linse verlaufen. Der Abstand zwischen
Lineargleichungssysteme: Additions-/ Subtraktionsverfahren
 Lineargleichungssysteme: Additions-/ Subtraktionsverfahren W. Kippels 22. Februar 2014 Inhaltsverzeichnis 1 Einleitung 2 2 Lineargleichungssysteme zweiten Grades 2 3 Lineargleichungssysteme höheren als
Lineargleichungssysteme: Additions-/ Subtraktionsverfahren W. Kippels 22. Februar 2014 Inhaltsverzeichnis 1 Einleitung 2 2 Lineargleichungssysteme zweiten Grades 2 3 Lineargleichungssysteme höheren als
Oxidation und Reduktion Redoxreaktionen Blatt 1/5
 Oxidation und Reduktion Redoxreaktionen Blatt 1/5 1 Elektronenübertragung, Oxidation und Reduktion Gibt Natrium sein einziges Außenelektron an ein Chloratom (7 Außenelektronen) ab, so entsteht durch diese
Oxidation und Reduktion Redoxreaktionen Blatt 1/5 1 Elektronenübertragung, Oxidation und Reduktion Gibt Natrium sein einziges Außenelektron an ein Chloratom (7 Außenelektronen) ab, so entsteht durch diese
unterschiedliche Gruppen technischer Gläser, unterkühlte Schmelzen, kein fester Schmelzpunkt, Glas- (Netzwerk-)bildner, Glaswandler, oxidische
 Wiederholung der letzten Vorlesungsstunde: Thema: Gläser und Keramiken, Werkstoffeigenschaften, amorphe Stoffe, unterschiedliche Gruppen technischer Gläser, unterkühlte Schmelzen, kein fester Schmelzpunkt,
Wiederholung der letzten Vorlesungsstunde: Thema: Gläser und Keramiken, Werkstoffeigenschaften, amorphe Stoffe, unterschiedliche Gruppen technischer Gläser, unterkühlte Schmelzen, kein fester Schmelzpunkt,
Selbst-Test zur Vorab-Einschätzung zum Vorkurs Chemie für Mediziner
 Liebe Studierende der Human- und Zahnmedizin, mithilfe dieses Tests können Sie selbst einschätzen, ob Sie den Vorkurs besuchen sollten. Die kleine Auswahl an Aufgaben spiegelt in etwa das Niveau des Vorkurses
Liebe Studierende der Human- und Zahnmedizin, mithilfe dieses Tests können Sie selbst einschätzen, ob Sie den Vorkurs besuchen sollten. Die kleine Auswahl an Aufgaben spiegelt in etwa das Niveau des Vorkurses
Musterprüfung Chemie Klassen: MPL 09 Datum: 14. 16. April 2010
 1 Musterprüfung Chemie Klassen: MPL 09 Datum: 14. 16. April 2010 Themen: Metallische Bindungen (Skript S. 51 53, inkl. Arbeitsblatt) Reaktionsverlauf (Skript S. 54 59, inkl. Arbeitsblatt, Merke, Fig. 7.2.1
1 Musterprüfung Chemie Klassen: MPL 09 Datum: 14. 16. April 2010 Themen: Metallische Bindungen (Skript S. 51 53, inkl. Arbeitsblatt) Reaktionsverlauf (Skript S. 54 59, inkl. Arbeitsblatt, Merke, Fig. 7.2.1
Rost und Rostschutz. Oxidation: Fe Fe 2+ + 2 e - Reduktion: ½ O 2 + H 2 O + 2 e - 2 OH - Redoxgleichung: Fe + ½ O 2 + H 2 O Fe 2+ + 2 OH -
 Universität Regensburg Institut für Anorganische Chemie - Lehrstuhl Prof. Dr. A. Pfitzner Demonstrationsvortrag im Sommersemester 2010 23.06.2010 Dozentin: Dr. M. Andratschke Referenten: Schlichting, Matthias/Will,
Universität Regensburg Institut für Anorganische Chemie - Lehrstuhl Prof. Dr. A. Pfitzner Demonstrationsvortrag im Sommersemester 2010 23.06.2010 Dozentin: Dr. M. Andratschke Referenten: Schlichting, Matthias/Will,
AGROPLUS Buchhaltung. Daten-Server und Sicherheitskopie. Version vom 21.10.2013b
 AGROPLUS Buchhaltung Daten-Server und Sicherheitskopie Version vom 21.10.2013b 3a) Der Daten-Server Modus und der Tresor Der Daten-Server ist eine Betriebsart welche dem Nutzer eine grosse Flexibilität
AGROPLUS Buchhaltung Daten-Server und Sicherheitskopie Version vom 21.10.2013b 3a) Der Daten-Server Modus und der Tresor Der Daten-Server ist eine Betriebsart welche dem Nutzer eine grosse Flexibilität
PCD Europe, Krefeld, Jan 2007. Auswertung von Haemoccult
 Auswertung von Haemoccult Ist das positiv? Nein! Ja! Im deutschen Krebsfrüherkennungsprogramm haben nur etwa 1 % der Frauen und 1,5 % der Männer ein positives Haemoccult -Ergebnis, da dieser Test eine
Auswertung von Haemoccult Ist das positiv? Nein! Ja! Im deutschen Krebsfrüherkennungsprogramm haben nur etwa 1 % der Frauen und 1,5 % der Männer ein positives Haemoccult -Ergebnis, da dieser Test eine
Schneiden der Alkalimetalle und Autoxidation
 Reaktionsgleichungen 4 Li s + O 2 g 2 Li 2 O s 2 Na s + O 2 g Na 2 O 2 s K s + O 2 g KO 2 s Zeitbedarf Vorbereitung: 1 min. Durchführung: 10 min. Nachbereitung: 1 min. Chemikalienliste Edukte Chemikalien
Reaktionsgleichungen 4 Li s + O 2 g 2 Li 2 O s 2 Na s + O 2 g Na 2 O 2 s K s + O 2 g KO 2 s Zeitbedarf Vorbereitung: 1 min. Durchführung: 10 min. Nachbereitung: 1 min. Chemikalienliste Edukte Chemikalien
Wie bestimmt ein Chemiker Säuren und Laugen?
 Wie bestimmt ein Chemiker Säuren und Laugen? Mit den Zahlen von 0 14 wird der ph Wert angegeben. 1 ist eine sehr starke Säure, 14 ist eine sehr starke Lauge. Aus: onlineenzyklopaedie.de Das Forscherlabor
Wie bestimmt ein Chemiker Säuren und Laugen? Mit den Zahlen von 0 14 wird der ph Wert angegeben. 1 ist eine sehr starke Säure, 14 ist eine sehr starke Lauge. Aus: onlineenzyklopaedie.de Das Forscherlabor
Name: Klasse: Datum:
 Arbeitsblatt 10.1 Versuch 1: Man füllt eine mittelgroße Glasschale mit Wasser und legt vorsichtig eine Büroklammer auf die Oberfläche des Wassers. Anschließend gibt man mit einer Pipette am Rand der Glasschale
Arbeitsblatt 10.1 Versuch 1: Man füllt eine mittelgroße Glasschale mit Wasser und legt vorsichtig eine Büroklammer auf die Oberfläche des Wassers. Anschließend gibt man mit einer Pipette am Rand der Glasschale
Im Prinzip wie ein Fotokopierer
 Im Prinzip wie ein Fotokopierer Mit diesem Experiment kannst Du das Grundprinzip verstehen, wie ein Fotokopierer funktioniert. Du brauchst : Styropor-Kügelchen Im Bild sind welche abgebildet, die es in
Im Prinzip wie ein Fotokopierer Mit diesem Experiment kannst Du das Grundprinzip verstehen, wie ein Fotokopierer funktioniert. Du brauchst : Styropor-Kügelchen Im Bild sind welche abgebildet, die es in
Diese Prozesse und noch viele andere Tricks werden in der Digitalfotografie mit Hilfe von Bildbearbeitungsprogrammen, wie z. B. Gimp, bewältigt.
 Workflows mit Gimp Workflows sind Arbeitsabläufe, in denen man ein rohes Bildmaterial in ein ansehnliches Foto verwandelt. Denn das, was die Kamera sieht, entspricht selten unseren Vorstellungen eines
Workflows mit Gimp Workflows sind Arbeitsabläufe, in denen man ein rohes Bildmaterial in ein ansehnliches Foto verwandelt. Denn das, was die Kamera sieht, entspricht selten unseren Vorstellungen eines
Ein süsses Experiment
 Ein süsses Experiment Zuckerkristalle am Stiel Das brauchst du: 250 Milliliter Wasser (entspricht etwa einer Tasse). Das reicht für 4-5 kleine Marmeladengläser und 4-5 Zuckerstäbchen 650 Gramm Zucker (den
Ein süsses Experiment Zuckerkristalle am Stiel Das brauchst du: 250 Milliliter Wasser (entspricht etwa einer Tasse). Das reicht für 4-5 kleine Marmeladengläser und 4-5 Zuckerstäbchen 650 Gramm Zucker (den
Anleitung über den Umgang mit Schildern
 Anleitung über den Umgang mit Schildern -Vorwort -Wo bekommt man Schilder? -Wo und wie speichert man die Schilder? -Wie füge ich die Schilder in meinen Track ein? -Welche Bauteile kann man noch für Schilder
Anleitung über den Umgang mit Schildern -Vorwort -Wo bekommt man Schilder? -Wo und wie speichert man die Schilder? -Wie füge ich die Schilder in meinen Track ein? -Welche Bauteile kann man noch für Schilder
Anleitungen Einzelsituation
 5 Anleitungen Einzelsituation 5.1 Lesen Seite 30 5.1.1 Einzelbuchstaben benennen Seite 30 5.1.2 Übungsblätter Einzelbuchstaben benennen Seite 32 5.1.3 Buchstaben zusammenziehen Seite 33 5.1.4 Übungsblätter
5 Anleitungen Einzelsituation 5.1 Lesen Seite 30 5.1.1 Einzelbuchstaben benennen Seite 30 5.1.2 Übungsblätter Einzelbuchstaben benennen Seite 32 5.1.3 Buchstaben zusammenziehen Seite 33 5.1.4 Übungsblätter
Physik & Musik. Stimmgabeln. 1 Auftrag
 Physik & Musik 5 Stimmgabeln 1 Auftrag Physik & Musik Stimmgabeln Seite 1 Stimmgabeln Bearbeitungszeit: 30 Minuten Sozialform: Einzel- oder Partnerarbeit Voraussetzung: Posten 1: "Wie funktioniert ein
Physik & Musik 5 Stimmgabeln 1 Auftrag Physik & Musik Stimmgabeln Seite 1 Stimmgabeln Bearbeitungszeit: 30 Minuten Sozialform: Einzel- oder Partnerarbeit Voraussetzung: Posten 1: "Wie funktioniert ein
Kreatives Occhi. - V o r s p a n n - Alle Knoten und Knüpfelemente sowie ihre Verwendbarkeit. Die Knoten
 Kreatives Occhi - V o r s p a n n - Alle Knoten und Knüpfelemente sowie ihre Verwendbarkeit Die Knoten Der Doppelknoten: Er wird mit nur 1 Schiffchen gearbeitet (s. page Die Handhabung der Schiffchen )
Kreatives Occhi - V o r s p a n n - Alle Knoten und Knüpfelemente sowie ihre Verwendbarkeit Die Knoten Der Doppelknoten: Er wird mit nur 1 Schiffchen gearbeitet (s. page Die Handhabung der Schiffchen )
1/6. Welche Antwort ist richtig: Wie entsteht aus organischen Kohlenstoffverbindungen das gasförmige Kohlendioxid?
 1/6 Der Kohlenstoffkreislauf Arbeitsblatt B Material: Inhalte des Factsheets Grundlagen zum Klimawandel Der Wasserkreislauf (siehe Arbeitsblatt A) ist leicht erklärt: Wasser verdunstet, in höheren Schichten
1/6 Der Kohlenstoffkreislauf Arbeitsblatt B Material: Inhalte des Factsheets Grundlagen zum Klimawandel Der Wasserkreislauf (siehe Arbeitsblatt A) ist leicht erklärt: Wasser verdunstet, in höheren Schichten
SCHÜEX RHEINLAND-PFALZ
 DEUTSCHE GESELLSCHAFT FÜR ZERSTÖRUNGSFREIE PRÜFUNG E.V. ZfP-Sonderpreis der DGZfP beim Landeswettbewerb Jugend forscht SCHÜEX RHEINLAND-PFALZ Die Lebensmittelampel: Verdorben oder noch essbar? Florian
DEUTSCHE GESELLSCHAFT FÜR ZERSTÖRUNGSFREIE PRÜFUNG E.V. ZfP-Sonderpreis der DGZfP beim Landeswettbewerb Jugend forscht SCHÜEX RHEINLAND-PFALZ Die Lebensmittelampel: Verdorben oder noch essbar? Florian
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Übungsbuch für den Grundkurs mit Tipps und Lösungen: Analysis
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Übungsbuch für den Grundkurs mit Tipps und Lösungen: Analysis Das komplette Material finden Sie hier: Download bei School-Scout.de
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Übungsbuch für den Grundkurs mit Tipps und Lösungen: Analysis Das komplette Material finden Sie hier: Download bei School-Scout.de
Outlook. sysplus.ch outlook - mail-grundlagen Seite 1/8. Mail-Grundlagen. Posteingang
 sysplus.ch outlook - mail-grundlagen Seite 1/8 Outlook Mail-Grundlagen Posteingang Es gibt verschiedene Möglichkeiten, um zum Posteingang zu gelangen. Man kann links im Outlook-Fenster auf die Schaltfläche
sysplus.ch outlook - mail-grundlagen Seite 1/8 Outlook Mail-Grundlagen Posteingang Es gibt verschiedene Möglichkeiten, um zum Posteingang zu gelangen. Man kann links im Outlook-Fenster auf die Schaltfläche
Professionelle Seminare im Bereich MS-Office
 Der Name BEREICH.VERSCHIEBEN() ist etwas unglücklich gewählt. Man kann mit der Funktion Bereiche zwar verschieben, man kann Bereiche aber auch verkleinern oder vergrößern. Besser wäre es, die Funktion
Der Name BEREICH.VERSCHIEBEN() ist etwas unglücklich gewählt. Man kann mit der Funktion Bereiche zwar verschieben, man kann Bereiche aber auch verkleinern oder vergrößern. Besser wäre es, die Funktion
2.9 Aufbau und Funktion eines Bunsenbrenners. Aufgabe. Wie ist der Bunsenbrenner aufgebaut?
 Naturwissenschaften - Chemie - Anorganische Chemie - 2 Luft und andere Gase (P75400) 2.9 Aufbau und Funktion eines Bunsenbrenners Experiment von: Seb Gedruckt: 24.03.204 ::49 intertess (Version 3.2 B24,
Naturwissenschaften - Chemie - Anorganische Chemie - 2 Luft und andere Gase (P75400) 2.9 Aufbau und Funktion eines Bunsenbrenners Experiment von: Seb Gedruckt: 24.03.204 ::49 intertess (Version 3.2 B24,
Kulturelle Evolution 12
 3.3 Kulturelle Evolution Kulturelle Evolution Kulturelle Evolution 12 Seit die Menschen Erfindungen machen wie z.b. das Rad oder den Pflug, haben sie sich im Körperbau kaum mehr verändert. Dafür war einfach
3.3 Kulturelle Evolution Kulturelle Evolution Kulturelle Evolution 12 Seit die Menschen Erfindungen machen wie z.b. das Rad oder den Pflug, haben sie sich im Körperbau kaum mehr verändert. Dafür war einfach
Einen Wiederherstellungspunktes erstellen & Rechner mit Hilfe eines Wiederherstellungspunktes zu einem früheren Zeitpunkt wieder herstellen
 Einen Wiederherstellungspunktes erstellen & Rechner mit Hilfe eines Wiederherstellungspunktes zu einem früheren Zeitpunkt wieder herstellen 1 Hier einige Links zu Dokumentationen im WEB Windows XP: http://www.verbraucher-sicher-online.de/node/18
Einen Wiederherstellungspunktes erstellen & Rechner mit Hilfe eines Wiederherstellungspunktes zu einem früheren Zeitpunkt wieder herstellen 1 Hier einige Links zu Dokumentationen im WEB Windows XP: http://www.verbraucher-sicher-online.de/node/18
Der Kälteanlagenbauer
 Der Kälteanlagenbauer Band : Grundkenntnisse Bearbeitet von Karl Breidenbach., überarbeitete und erweiterte Auflage. Buch. XXVIII, S. Gebunden ISBN 00 Format (B x L):,0 x,0 cm Zu Inhaltsverzeichnis schnell
Der Kälteanlagenbauer Band : Grundkenntnisse Bearbeitet von Karl Breidenbach., überarbeitete und erweiterte Auflage. Buch. XXVIII, S. Gebunden ISBN 00 Format (B x L):,0 x,0 cm Zu Inhaltsverzeichnis schnell
Berechnung der Erhöhung der Durchschnittsprämien
 Wolfram Fischer Berechnung der Erhöhung der Durchschnittsprämien Oktober 2004 1 Zusammenfassung Zur Berechnung der Durchschnittsprämien wird das gesamte gemeldete Prämienvolumen Zusammenfassung durch die
Wolfram Fischer Berechnung der Erhöhung der Durchschnittsprämien Oktober 2004 1 Zusammenfassung Zur Berechnung der Durchschnittsprämien wird das gesamte gemeldete Prämienvolumen Zusammenfassung durch die
40-Tage-Wunder- Kurs. Umarme, was Du nicht ändern kannst.
 40-Tage-Wunder- Kurs Umarme, was Du nicht ändern kannst. Das sagt Wikipedia: Als Wunder (griechisch thauma) gilt umgangssprachlich ein Ereignis, dessen Zustandekommen man sich nicht erklären kann, so dass
40-Tage-Wunder- Kurs Umarme, was Du nicht ändern kannst. Das sagt Wikipedia: Als Wunder (griechisch thauma) gilt umgangssprachlich ein Ereignis, dessen Zustandekommen man sich nicht erklären kann, so dass
Anwendungsbeispiele. Neuerungen in den E-Mails. Webling ist ein Produkt der Firma:
 Anwendungsbeispiele Neuerungen in den E-Mails Webling ist ein Produkt der Firma: Inhaltsverzeichnis 1 Neuerungen in den E- Mails 2 Was gibt es neues? 3 E- Mail Designs 4 Bilder in E- Mails einfügen 1 Neuerungen
Anwendungsbeispiele Neuerungen in den E-Mails Webling ist ein Produkt der Firma: Inhaltsverzeichnis 1 Neuerungen in den E- Mails 2 Was gibt es neues? 3 E- Mail Designs 4 Bilder in E- Mails einfügen 1 Neuerungen
1 topologisches Sortieren
 Wolfgang Hönig / Andreas Ecke WS 09/0 topologisches Sortieren. Überblick. Solange noch Knoten vorhanden: a) Suche Knoten v, zu dem keine Kante führt (Falls nicht vorhanden keine topologische Sortierung
Wolfgang Hönig / Andreas Ecke WS 09/0 topologisches Sortieren. Überblick. Solange noch Knoten vorhanden: a) Suche Knoten v, zu dem keine Kante führt (Falls nicht vorhanden keine topologische Sortierung
Zeichen bei Zahlen entschlüsseln
 Zeichen bei Zahlen entschlüsseln In diesem Kapitel... Verwendung des Zahlenstrahls Absolut richtige Bestimmung von absoluten Werten Operationen bei Zahlen mit Vorzeichen: Addieren, Subtrahieren, Multiplizieren
Zeichen bei Zahlen entschlüsseln In diesem Kapitel... Verwendung des Zahlenstrahls Absolut richtige Bestimmung von absoluten Werten Operationen bei Zahlen mit Vorzeichen: Addieren, Subtrahieren, Multiplizieren
geben. Die Wahrscheinlichkeit von 100% ist hier demnach nur der Gehen wir einmal davon aus, dass die von uns angenommenen
 geben. Die Wahrscheinlichkeit von 100% ist hier demnach nur der Vollständigkeit halber aufgeführt. Gehen wir einmal davon aus, dass die von uns angenommenen 70% im Beispiel exakt berechnet sind. Was würde
geben. Die Wahrscheinlichkeit von 100% ist hier demnach nur der Vollständigkeit halber aufgeführt. Gehen wir einmal davon aus, dass die von uns angenommenen 70% im Beispiel exakt berechnet sind. Was würde
Die Invaliden-Versicherung ändert sich
 Die Invaliden-Versicherung ändert sich 1 Erklärung Die Invaliden-Versicherung ist für invalide Personen. Invalid bedeutet: Eine Person kann einige Sachen nicht machen. Wegen einer Krankheit. Wegen einem
Die Invaliden-Versicherung ändert sich 1 Erklärung Die Invaliden-Versicherung ist für invalide Personen. Invalid bedeutet: Eine Person kann einige Sachen nicht machen. Wegen einer Krankheit. Wegen einem
Zerlegung der Verbindung Wasser. Weiterbildung für fachfremd unterrichtende Lehrkräfte
 Zerlegung der Verbindung Wasser Weiterbildung für fachfremd unterrichtende Lehrkräfte Chromatografi e von Blattfarbstoffen Destillation von Rotwein Titration Herstellung von Natronlauge Öltröpfchen versuch
Zerlegung der Verbindung Wasser Weiterbildung für fachfremd unterrichtende Lehrkräfte Chromatografi e von Blattfarbstoffen Destillation von Rotwein Titration Herstellung von Natronlauge Öltröpfchen versuch
KÜNSTLER: ROLF BÖKEMEIER // TITEL: BLUMEN SCHWARZWEIß BILDBEWERTUNG. Bewertet von Georg Banek
 KÜNSTLER: ROLF BÖKEMEIER // TITEL: BLUMEN SCHWARZWEIß BILDBEWERTUNG Bewertet von Georg Banek Die seen.by Bildbewertungen wurden von Fachleuten entwickelt um ambitionierten Fotografen ein professionelles
KÜNSTLER: ROLF BÖKEMEIER // TITEL: BLUMEN SCHWARZWEIß BILDBEWERTUNG Bewertet von Georg Banek Die seen.by Bildbewertungen wurden von Fachleuten entwickelt um ambitionierten Fotografen ein professionelles
Belichtung mit Tonwertkorrektur verbessern
 Belichtung mit Tonwertkorrektur verbessern Die meisten Digitalfotos müssen vor dem Ausdruck bearbeitet werden: Helligkeit und Kontrast sollten für ein besseres Ergebnis reguliert werden. Die Tonwertkorrektur
Belichtung mit Tonwertkorrektur verbessern Die meisten Digitalfotos müssen vor dem Ausdruck bearbeitet werden: Helligkeit und Kontrast sollten für ein besseres Ergebnis reguliert werden. Die Tonwertkorrektur
Abbildung durch eine Lochblende
 Abbildung durch eine Lochblende Stand: 26.08.2015 Jahrgangsstufen 7 Fach/Fächer Benötigtes Material Natur und Technik/ Schwerpunkt Physik Projektor mit F, für jeden Schüler eine Lochblende und einen Transparentschirm
Abbildung durch eine Lochblende Stand: 26.08.2015 Jahrgangsstufen 7 Fach/Fächer Benötigtes Material Natur und Technik/ Schwerpunkt Physik Projektor mit F, für jeden Schüler eine Lochblende und einen Transparentschirm
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Lernwerkstatt für die Klassen 7 bis 9: Linsen und optische Geräte
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt für die Klassen 7 bis 9: Linsen und optische Geräte Das komplette Material finden Sie hier: Download bei School-Scout.de
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt für die Klassen 7 bis 9: Linsen und optische Geräte Das komplette Material finden Sie hier: Download bei School-Scout.de
Inhalt. Thema: Energie. Gedanke. Experiment/Spiel. Thema. Batterietests. Batterie. Batterien haben zwei Pole. Strom erzeugen
 Inhalt Experiment/Spiel Thema Gedanke Batterietests Batterie Batterien haben zwei Pole. Experiment Elektrizität herstellen Strom erzeugen Elektrizität kann durch Bewegung erzeugt werden. Experiment Stromkreis
Inhalt Experiment/Spiel Thema Gedanke Batterietests Batterie Batterien haben zwei Pole. Experiment Elektrizität herstellen Strom erzeugen Elektrizität kann durch Bewegung erzeugt werden. Experiment Stromkreis
Papa - was ist American Dream?
 Papa - was ist American Dream? Das heißt Amerikanischer Traum. Ja, das weiß ich, aber was heißt das? Der [wpseo]amerikanische Traum[/wpseo] heißt, dass jeder Mensch allein durch harte Arbeit und Willenskraft
Papa - was ist American Dream? Das heißt Amerikanischer Traum. Ja, das weiß ich, aber was heißt das? Der [wpseo]amerikanische Traum[/wpseo] heißt, dass jeder Mensch allein durch harte Arbeit und Willenskraft
Was bedeutet Inklusion für Geschwisterkinder? Ein Meinungsbild. Irene von Drigalski Geschäftsführerin Novartis Stiftung FamilienBande.
 Was bedeutet Inklusion für Geschwisterkinder? unterstützt von Ein Meinungsbild - Irene von Drigalski Geschäftsführerin Novartis Stiftung FamilienBande Haben Sie Kontakt zu Geschwistern schwer chronisch
Was bedeutet Inklusion für Geschwisterkinder? unterstützt von Ein Meinungsbild - Irene von Drigalski Geschäftsführerin Novartis Stiftung FamilienBande Haben Sie Kontakt zu Geschwistern schwer chronisch
Löschen. 1. einen : Das Material muss sein. kein Feuer entstehen oder unterhalten werden. Zündtemperatur erreicht, kann ebenfalls kein Feuer
 Löschen 1. Was braucht man, damit ein Feuer brennt? Zum Entfachen eines Feuers braucht man: 1. einen : Das Material muss sein 2. : Ohne den notwendigen kann kein Feuer entstehen oder unterhalten werden
Löschen 1. Was braucht man, damit ein Feuer brennt? Zum Entfachen eines Feuers braucht man: 1. einen : Das Material muss sein 2. : Ohne den notwendigen kann kein Feuer entstehen oder unterhalten werden
Info zum Zusammenhang von Auflösung und Genauigkeit
 Da es oft Nachfragen und Verständnisprobleme mit den oben genannten Begriffen gibt, möchten wir hier versuchen etwas Licht ins Dunkel zu bringen. Nehmen wir mal an, Sie haben ein Stück Wasserrohr mit der
Da es oft Nachfragen und Verständnisprobleme mit den oben genannten Begriffen gibt, möchten wir hier versuchen etwas Licht ins Dunkel zu bringen. Nehmen wir mal an, Sie haben ein Stück Wasserrohr mit der
3. Halbleiter und Elektronik
 3. Halbleiter und Elektronik Halbleiter sind Stoe, welche die Eigenschaften von Leitern sowie Nichtleitern miteinander vereinen. Prinzipiell sind die Elektronen in einem Kristallgitter fest eingebunden
3. Halbleiter und Elektronik Halbleiter sind Stoe, welche die Eigenschaften von Leitern sowie Nichtleitern miteinander vereinen. Prinzipiell sind die Elektronen in einem Kristallgitter fest eingebunden
Das große ElterngeldPlus 1x1. Alles über das ElterngeldPlus. Wer kann ElterngeldPlus beantragen? ElterngeldPlus verstehen ein paar einleitende Fakten
 Das große x -4 Alles über das Wer kann beantragen? Generell kann jeder beantragen! Eltern (Mütter UND Väter), die schon während ihrer Elternzeit wieder in Teilzeit arbeiten möchten. Eltern, die während
Das große x -4 Alles über das Wer kann beantragen? Generell kann jeder beantragen! Eltern (Mütter UND Väter), die schon während ihrer Elternzeit wieder in Teilzeit arbeiten möchten. Eltern, die während
Fachbericht zum Thema: Anforderungen an ein Datenbanksystem
 Fachbericht zum Thema: Anforderungen an ein Datenbanksystem von André Franken 1 Inhaltsverzeichnis 1 Inhaltsverzeichnis 1 2 Einführung 2 2.1 Gründe für den Einsatz von DB-Systemen 2 2.2 Definition: Datenbank
Fachbericht zum Thema: Anforderungen an ein Datenbanksystem von André Franken 1 Inhaltsverzeichnis 1 Inhaltsverzeichnis 1 2 Einführung 2 2.1 Gründe für den Einsatz von DB-Systemen 2 2.2 Definition: Datenbank
REDOXPROZESSE. Die Redoxreaktion setzt sich aus einer Oxidation und einer Reduktion zusammen. [1, 2]
![REDOXPROZESSE. Die Redoxreaktion setzt sich aus einer Oxidation und einer Reduktion zusammen. [1, 2] REDOXPROZESSE. Die Redoxreaktion setzt sich aus einer Oxidation und einer Reduktion zusammen. [1, 2]](/thumbs/29/13620695.jpg) Universität Regensburg Institut für Anorganische Chemie: Lehrstuhl Prof. Dr. A. Pfitzner Demonstrationsvorträge im Wintersemester 2012/13 23.11.2012 Dozentin: Dr. M. Andratschke Referentinnen: Stefanie
Universität Regensburg Institut für Anorganische Chemie: Lehrstuhl Prof. Dr. A. Pfitzner Demonstrationsvorträge im Wintersemester 2012/13 23.11.2012 Dozentin: Dr. M. Andratschke Referentinnen: Stefanie
Fotografie auf einer anderen Wellenlänge
 Fotografie auf einer anderen Wellenlänge Digitale Infrarot-Fotografie von Dietmar v.d.linden Bosch-Fotogruppe Fotografie auf einer anderen Wellenlänge Grundlagen - Was ist Infrarot? Infrarotstrahlung (IR-Strahlung)
Fotografie auf einer anderen Wellenlänge Digitale Infrarot-Fotografie von Dietmar v.d.linden Bosch-Fotogruppe Fotografie auf einer anderen Wellenlänge Grundlagen - Was ist Infrarot? Infrarotstrahlung (IR-Strahlung)
Primzahlen und RSA-Verschlüsselung
 Primzahlen und RSA-Verschlüsselung Michael Fütterer und Jonathan Zachhuber 1 Einiges zu Primzahlen Ein paar Definitionen: Wir bezeichnen mit Z die Menge der positiven und negativen ganzen Zahlen, also
Primzahlen und RSA-Verschlüsselung Michael Fütterer und Jonathan Zachhuber 1 Einiges zu Primzahlen Ein paar Definitionen: Wir bezeichnen mit Z die Menge der positiven und negativen ganzen Zahlen, also
Navigieren auf dem Desktop
 Navigieren auf dem Desktop Sie kennen Windows 7 noch nicht? Obwohl Windows 7 viel mit den Versionen von Windows gemein hat, die Ihnen ggf. bereits vertraut sind, werden Sie möglicherweise an der einen
Navigieren auf dem Desktop Sie kennen Windows 7 noch nicht? Obwohl Windows 7 viel mit den Versionen von Windows gemein hat, die Ihnen ggf. bereits vertraut sind, werden Sie möglicherweise an der einen
Eva Douma: Die Vorteile und Nachteile der Ökonomisierung in der Sozialen Arbeit
 Eva Douma: Die Vorteile und Nachteile der Ökonomisierung in der Sozialen Arbeit Frau Dr. Eva Douma ist Organisations-Beraterin in Frankfurt am Main Das ist eine Zusammen-Fassung des Vortrages: Busines
Eva Douma: Die Vorteile und Nachteile der Ökonomisierung in der Sozialen Arbeit Frau Dr. Eva Douma ist Organisations-Beraterin in Frankfurt am Main Das ist eine Zusammen-Fassung des Vortrages: Busines
Wasserkraft früher und heute!
 Wasserkraft früher und heute! Wasserkraft leistet heute einen wichtigen Beitrag zur Stromversorgung in Österreich und auf der ganzen Welt. Aber war das schon immer so? Quelle: Elvina Schäfer, FOTOLIA In
Wasserkraft früher und heute! Wasserkraft leistet heute einen wichtigen Beitrag zur Stromversorgung in Österreich und auf der ganzen Welt. Aber war das schon immer so? Quelle: Elvina Schäfer, FOTOLIA In
Waschmittel. 1. Inhaltsstoffe der Waschmittel. 1.1. Tenside
 Universität Regensburg 06.11.2009 Institut für Anorganische Chemie Lehrstuhl Prof. Dr. A. Pfitzner Wintersemester 2009/2010 Gruppenversuche in Anorganischer Chemie mit Demonstrationen Betreuung: Dr. M.
Universität Regensburg 06.11.2009 Institut für Anorganische Chemie Lehrstuhl Prof. Dr. A. Pfitzner Wintersemester 2009/2010 Gruppenversuche in Anorganischer Chemie mit Demonstrationen Betreuung: Dr. M.
Versetzungsgefahr als ultimative Chance. ein vortrag für versetzungsgefährdete
 Versetzungsgefahr als ultimative Chance ein vortrag für versetzungsgefährdete Versetzungsgefährdete haben zum Großteil einige Fallen, die ihnen das normale Lernen schwer machen und mit der Zeit ins Hintertreffen
Versetzungsgefahr als ultimative Chance ein vortrag für versetzungsgefährdete Versetzungsgefährdete haben zum Großteil einige Fallen, die ihnen das normale Lernen schwer machen und mit der Zeit ins Hintertreffen
Copyright Sophie Streit / Filzweiber /www.filzweiber.at. Fertigung eines Filzringes mit Perlen!
 Fertigung eines Filzringes mit Perlen! Material und Bezugsquellen: Ich arbeite ausschließlich mit Wolle im Kardenband. Alle Lieferanten die ich hier aufliste haben nat. auch Filzzubehör. Zu Beginn möchtest
Fertigung eines Filzringes mit Perlen! Material und Bezugsquellen: Ich arbeite ausschließlich mit Wolle im Kardenband. Alle Lieferanten die ich hier aufliste haben nat. auch Filzzubehör. Zu Beginn möchtest
1 Mathematische Grundlagen
 Mathematische Grundlagen - 1-1 Mathematische Grundlagen Der Begriff der Menge ist einer der grundlegenden Begriffe in der Mathematik. Mengen dienen dazu, Dinge oder Objekte zu einer Einheit zusammenzufassen.
Mathematische Grundlagen - 1-1 Mathematische Grundlagen Der Begriff der Menge ist einer der grundlegenden Begriffe in der Mathematik. Mengen dienen dazu, Dinge oder Objekte zu einer Einheit zusammenzufassen.
Entwicklungsförderung
 - Neuropädiatrie Homöopathie Manuelle Medizin Entwicklungsförderung Durch Spielen können Sie die gesunde Entwicklung Ihres Kindes fördern, dabei sind ihren Ideen beim Spielen mit Ihren Kind kaum Grenzen
- Neuropädiatrie Homöopathie Manuelle Medizin Entwicklungsförderung Durch Spielen können Sie die gesunde Entwicklung Ihres Kindes fördern, dabei sind ihren Ideen beim Spielen mit Ihren Kind kaum Grenzen
Objektorientierte Programmierung für Anfänger am Beispiel PHP
 Objektorientierte Programmierung für Anfänger am Beispiel PHP Johannes Mittendorfer http://jmittendorfer.hostingsociety.com 19. August 2012 Abstract Dieses Dokument soll die Vorteile der objektorientierten
Objektorientierte Programmierung für Anfänger am Beispiel PHP Johannes Mittendorfer http://jmittendorfer.hostingsociety.com 19. August 2012 Abstract Dieses Dokument soll die Vorteile der objektorientierten
Oberflächenspannung. Von Centstücken, Wasserläufern und Büroklammern. Oberflächenspannung
 Oberflächenspannung Von Centstücken, Wasserläufern und Büroklammern Bezug zum Bildungsplan 2004 der Realschule: Ein wichtiges Ziel des Bildungsplans 2004 bezüglich des Faches NWA ist es, die Schüler und
Oberflächenspannung Von Centstücken, Wasserläufern und Büroklammern Bezug zum Bildungsplan 2004 der Realschule: Ein wichtiges Ziel des Bildungsplans 2004 bezüglich des Faches NWA ist es, die Schüler und
h- Bestimmung mit LEDs
 h- Bestimmung mit LEDs GFS im Fach Physik Nicolas Bellm 11. März - 12. März 2006 Der Inhalt dieses Dokuments steht unter der GNU-Lizenz für freie Dokumentation http://www.gnu.org/copyleft/fdl.html Inhaltsverzeichnis
h- Bestimmung mit LEDs GFS im Fach Physik Nicolas Bellm 11. März - 12. März 2006 Der Inhalt dieses Dokuments steht unter der GNU-Lizenz für freie Dokumentation http://www.gnu.org/copyleft/fdl.html Inhaltsverzeichnis
DER SELBST-CHECK FÜR IHR PROJEKT
 DER SELBST-CHECK FÜR IHR PROJEKT In 30 Fragen und 5 Tipps zum erfolgreichen Projekt! Beantworten Sie die wichtigsten Fragen rund um Ihr Projekt für Ihren Erfolg und für Ihre Unterstützer. IHR LEITFADEN
DER SELBST-CHECK FÜR IHR PROJEKT In 30 Fragen und 5 Tipps zum erfolgreichen Projekt! Beantworten Sie die wichtigsten Fragen rund um Ihr Projekt für Ihren Erfolg und für Ihre Unterstützer. IHR LEITFADEN
Wie sieht unsere Welt im Kleinen aus?
 Skriptum Wie sieht unsere Welt im Kleinen aus? 1 Wie sieht unsere Welt im Kleinen aus? Atom- und Quantenphysik für Kids Seminar im Rahmen der KinderUni Wien, 12. 7. 2005 Katharina Durstberger, Franz Embacher,
Skriptum Wie sieht unsere Welt im Kleinen aus? 1 Wie sieht unsere Welt im Kleinen aus? Atom- und Quantenphysik für Kids Seminar im Rahmen der KinderUni Wien, 12. 7. 2005 Katharina Durstberger, Franz Embacher,
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Lernwerkstatt: Die wichtigsten Elementfamilien
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Die wichtigsten Elementfamilien Das komplette Material finden Sie hier: Download bei School-Scout.de SCHOOL-SCOUT Elementfamilien
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Die wichtigsten Elementfamilien Das komplette Material finden Sie hier: Download bei School-Scout.de SCHOOL-SCOUT Elementfamilien
Leit-Bild. Elbe-Werkstätten GmbH und. PIER Service & Consulting GmbH. Mit Menschen erfolgreich
 Leit-Bild Elbe-Werkstätten GmbH und PIER Service & Consulting GmbH Mit Menschen erfolgreich Vorwort zu dem Leit-Bild Was ist ein Leit-Bild? Ein Leit-Bild sind wichtige Regeln. Nach diesen Regeln arbeiten
Leit-Bild Elbe-Werkstätten GmbH und PIER Service & Consulting GmbH Mit Menschen erfolgreich Vorwort zu dem Leit-Bild Was ist ein Leit-Bild? Ein Leit-Bild sind wichtige Regeln. Nach diesen Regeln arbeiten
Die Lernumgebung des Projekts Informationskompetenz
 Beitrag für Bibliothek aktuell Die Lernumgebung des Projekts Informationskompetenz Von Sandra Merten Im Rahmen des Projekts Informationskompetenz wurde ein Musterkurs entwickelt, der den Lehrenden als
Beitrag für Bibliothek aktuell Die Lernumgebung des Projekts Informationskompetenz Von Sandra Merten Im Rahmen des Projekts Informationskompetenz wurde ein Musterkurs entwickelt, der den Lehrenden als
Säure-Base-Reaktionen
 Säure-Base-Reaktionen Versuch 1: Wir schmecken Lebensmittel! Material: Kleine Trinkbecher Getränkeproben Füllt von jeder bereitstehenden Probe zunächst etwas in einen Trinkbecher und probiert einen kleinen
Säure-Base-Reaktionen Versuch 1: Wir schmecken Lebensmittel! Material: Kleine Trinkbecher Getränkeproben Füllt von jeder bereitstehenden Probe zunächst etwas in einen Trinkbecher und probiert einen kleinen
Übungsaufgaben Prozentrechnung und / oder Dreisatz
 Übungsaufgaben Prozentrechnung und / oder Dreisatz 1. Bei der Wahl des Universitätssprechers wurden 800 gültige Stimmen abgegeben. Die Stimmen verteilten sich so auf die drei Kandidat/innen: A bekam 300,
Übungsaufgaben Prozentrechnung und / oder Dreisatz 1. Bei der Wahl des Universitätssprechers wurden 800 gültige Stimmen abgegeben. Die Stimmen verteilten sich so auf die drei Kandidat/innen: A bekam 300,
Wie oft soll ich essen?
 Wie oft soll ich essen? Wie sollen Sie sich als Diabetiker am besten ernähren? Gesunde Ernährung für Menschen mit Diabetes unterscheidet sich nicht von gesunder Ernährung für andere Menschen. Es gibt nichts,
Wie oft soll ich essen? Wie sollen Sie sich als Diabetiker am besten ernähren? Gesunde Ernährung für Menschen mit Diabetes unterscheidet sich nicht von gesunder Ernährung für andere Menschen. Es gibt nichts,
Photographie - Grundlagen
 Photographie - Grundlagen Im Rahmen dieses Vortrages soll zunächst eine Einführung in die Grundlagen der Photographie bzw. der Silberphotographie geben werden. Die Schwerpunkte liegen hierbei in der Beschreibung
Photographie - Grundlagen Im Rahmen dieses Vortrages soll zunächst eine Einführung in die Grundlagen der Photographie bzw. der Silberphotographie geben werden. Die Schwerpunkte liegen hierbei in der Beschreibung
Algorithmische Kryptographie
 Algorithmische Kryptographie Walter Unger Lehrstuhl für Informatik I 16. Februar 2007 Quantenkryptographie 1 Einleitung Grundlagen aus der Physik 2 Datenübertragung 1. Idee 2. Idee Nochmal Physik 3 Sichere
Algorithmische Kryptographie Walter Unger Lehrstuhl für Informatik I 16. Februar 2007 Quantenkryptographie 1 Einleitung Grundlagen aus der Physik 2 Datenübertragung 1. Idee 2. Idee Nochmal Physik 3 Sichere
Ätzen von Platinen. Stephan Matz Betreuer: Ulrich Pötter
 Ätzen von Platinen Stephan Matz Betreuer: Ulrich Pötter Gliederung 1. Ätzverfahren 2. Ätzbare Materialien 3. Ätzmittel 4. Gefahren beim Ätzen 5. Beispiele für Ätzteile 6. Vorteile des Ätzverfahrens 7.
Ätzen von Platinen Stephan Matz Betreuer: Ulrich Pötter Gliederung 1. Ätzverfahren 2. Ätzbare Materialien 3. Ätzmittel 4. Gefahren beim Ätzen 5. Beispiele für Ätzteile 6. Vorteile des Ätzverfahrens 7.
10.1 Auflösung, Drucken und Scannen
 Um einige technische Erläuterungen kommen wir auch in diesem Buch nicht herum. Für Ihre Bildergebnisse sind diese technischen Zusammenhänge sehr wichtig, nehmen Sie sich also etwas Zeit und lesen Sie dieses
Um einige technische Erläuterungen kommen wir auch in diesem Buch nicht herum. Für Ihre Bildergebnisse sind diese technischen Zusammenhänge sehr wichtig, nehmen Sie sich also etwas Zeit und lesen Sie dieses
Mehr Energie-Effizienz mit dem exklusiven es-transformer - Stromsparmodul
 Mehr Energie-Effizienz mit dem exklusiven es-transformer - Stromsparmodul - Made in Austria - Stromspargarantie von mindestens 5 % oder Geld zurück! Die Vorteile im Überblick: Benötigt selbst keine Energie
Mehr Energie-Effizienz mit dem exklusiven es-transformer - Stromsparmodul - Made in Austria - Stromspargarantie von mindestens 5 % oder Geld zurück! Die Vorteile im Überblick: Benötigt selbst keine Energie
2.8 Laugenbildung durch Reaktion von Metalloxiden mit Wasser. Aufgabe. Woraus lassen sich Laugen herstellen? (2)
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - 2 Basen (P759200) 2.8 Laugenbildung durch Reaktion von Metalloxiden mit Wasser Experiment von: Phywe Gedruckt: 5.0.203 2:6:25 intertess (Version 3.06
Naturwissenschaften - Chemie - Säuren, Basen, Salze - 2 Basen (P759200) 2.8 Laugenbildung durch Reaktion von Metalloxiden mit Wasser Experiment von: Phywe Gedruckt: 5.0.203 2:6:25 intertess (Version 3.06
Katalysatoren - Chemische Partnervermittlung im virtuellen Labor
 Seite 1 von 6 Katalysatoren - Chemische Partnervermittlung im virtuellen Labor Katalysatoren Der Katalysator in der Großindustrie Was passiert im Inneren? Das virtuelle Labor. Katalysatoren Katalysatoren
Seite 1 von 6 Katalysatoren - Chemische Partnervermittlung im virtuellen Labor Katalysatoren Der Katalysator in der Großindustrie Was passiert im Inneren? Das virtuelle Labor. Katalysatoren Katalysatoren
Übungsblatt zu Säuren und Basen
 1 Übungsblatt zu Säuren und Basen 1. In einer wässrigen Lösung misst die Konzentration der Oxoniumionen (H 3 O + ) 10 5 M. a) Wie gross ist der ph Wert? b) Ist die Konzentration der OH Ionen grösser oder
1 Übungsblatt zu Säuren und Basen 1. In einer wässrigen Lösung misst die Konzentration der Oxoniumionen (H 3 O + ) 10 5 M. a) Wie gross ist der ph Wert? b) Ist die Konzentration der OH Ionen grösser oder
Emergency Room für Projektleiter
 Emergency Room für Projektleiter Handlungsfähigkeit schnell zurückgewinnen Präsentation P0540 Copyright hyperskill GmbH 2010-2013 www.hyperskill.de Version 5.1 Emergency Room für Projektleiter Der Nutzen
Emergency Room für Projektleiter Handlungsfähigkeit schnell zurückgewinnen Präsentation P0540 Copyright hyperskill GmbH 2010-2013 www.hyperskill.de Version 5.1 Emergency Room für Projektleiter Der Nutzen
Durch Wissen Millionär WerDen... Wer hat zuerst die Million erreicht? spielanleitung Zahl der spieler: alter: redaktion / autor: inhalt:
 Spielanleitung Durch Wissen Millionär werden... Diesen Traum kann man sich in diesem beliebten Quiz-Spiel erfüllen. Ob allein oder in der geselligen Runde dieses Quiz enthält 330 Fragen und 1.320 Multiple-Choice-Antworten.
Spielanleitung Durch Wissen Millionär werden... Diesen Traum kann man sich in diesem beliebten Quiz-Spiel erfüllen. Ob allein oder in der geselligen Runde dieses Quiz enthält 330 Fragen und 1.320 Multiple-Choice-Antworten.
Letzte Krankenkassen streichen Zusatzbeiträge
 Zusatzbeiträge - Gesundheitsfonds Foto: D. Claus Einige n verlangten 2010 Zusatzbeiträge von ihren Versicherten. Die positive wirtschaftliche Entwicklung im Jahr 2011 ermöglichte den n die Rücknahme der
Zusatzbeiträge - Gesundheitsfonds Foto: D. Claus Einige n verlangten 2010 Zusatzbeiträge von ihren Versicherten. Die positive wirtschaftliche Entwicklung im Jahr 2011 ermöglichte den n die Rücknahme der
4. AUSSAGENLOGIK: SYNTAX. Der Unterschied zwischen Objektsprache und Metasprache lässt sich folgendermaßen charakterisieren:
 4. AUSSAGENLOGIK: SYNTAX 4.1 Objektsprache und Metasprache 4.2 Gebrauch und Erwähnung 4.3 Metavariablen: Verallgemeinerndes Sprechen über Ausdrücke von AL 4.4 Die Sprache der Aussagenlogik 4.5 Terminologie
4. AUSSAGENLOGIK: SYNTAX 4.1 Objektsprache und Metasprache 4.2 Gebrauch und Erwähnung 4.3 Metavariablen: Verallgemeinerndes Sprechen über Ausdrücke von AL 4.4 Die Sprache der Aussagenlogik 4.5 Terminologie
Präsentation vom 13.10.2011 im Rahmen der Fachberatertagung der Unfallkasse NRW in Haltern.
 Präsentation vom 13.10.2011 im Rahmen der Fachberatertagung der Unfallkasse NRW in Haltern. Martin Kraft, VMS, Deutsche Verkehrswacht. Kontakt: mk@dvw-ev.de 1 Entgegen dem allgemeinen Trend beim Unfallgeschehen
Präsentation vom 13.10.2011 im Rahmen der Fachberatertagung der Unfallkasse NRW in Haltern. Martin Kraft, VMS, Deutsche Verkehrswacht. Kontakt: mk@dvw-ev.de 1 Entgegen dem allgemeinen Trend beim Unfallgeschehen
Zoom-Mikroskop ZM. Das universell einsetzbare Zoom-Mikroskop
 Zoom-Mikroskop ZM Das universell einsetzbare Zoom-Mikroskop Die Vorteile im Überblick Zoom-Mikroskop ZM Mikroskopkörper Kernstück des ZM ist ein Mikroskopkörper mit dem Zoom-Faktor 5 : 1 bei einem Abbildungsmaßstab
Zoom-Mikroskop ZM Das universell einsetzbare Zoom-Mikroskop Die Vorteile im Überblick Zoom-Mikroskop ZM Mikroskopkörper Kernstück des ZM ist ein Mikroskopkörper mit dem Zoom-Faktor 5 : 1 bei einem Abbildungsmaßstab
Gruppe 01: Verbesserung Weißer Zucker... Schwarze Kohle
 Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 01: Verbesserung Weißer Zucker... Schwarze Kohle Reaktion: Saccharose
Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 01: Verbesserung Weißer Zucker... Schwarze Kohle Reaktion: Saccharose
Ein Spiel für 2-3 goldhungrige Spieler ab 8 Jahren.
 Ein Spiel für 2-3 goldhungrige Spieler ab 8 Jahren. Gold! Gold! Nichts als Gold, soweit das Auge reicht. So ein Goldesel ist schon was Praktisches. Doch Vorsicht: Die störrischen Viecher können einem auch
Ein Spiel für 2-3 goldhungrige Spieler ab 8 Jahren. Gold! Gold! Nichts als Gold, soweit das Auge reicht. So ein Goldesel ist schon was Praktisches. Doch Vorsicht: Die störrischen Viecher können einem auch
Der Kalender im ipad
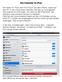 Der Kalender im ipad Wir haben im ipad, dem ipod Touch und dem iphone, sowie auf dem PC in der Cloud einen Kalender. Die App ist voreingestellt, man braucht sie nicht laden. So macht es das ipad leicht,
Der Kalender im ipad Wir haben im ipad, dem ipod Touch und dem iphone, sowie auf dem PC in der Cloud einen Kalender. Die App ist voreingestellt, man braucht sie nicht laden. So macht es das ipad leicht,
Ebenenmasken Grundlagen
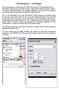 Ebenenmasken Grundlagen Was sind Ebenmasken? Was machen sie? Wofür braucht man sie? Wie funktionieren sie? Ebenmasken sind eines der sinnvollsten Tools in anspruchvollen EBV Programmen (EBV = elektronische
Ebenenmasken Grundlagen Was sind Ebenmasken? Was machen sie? Wofür braucht man sie? Wie funktionieren sie? Ebenmasken sind eines der sinnvollsten Tools in anspruchvollen EBV Programmen (EBV = elektronische
Steinmikado I. Steinmikado II. Steinzielwerfen. Steinwerfen in Dosen
 Steinmikado I Steinmikado II : ab 4 : ab 4 : 20 Steine : 20 Steine Spielregel : M 10-01 In der Mitte des Raumes schichten wir einen Steinberg auf. Die Aufgabe besteht darin, vom Fuße des Berges jeweils
Steinmikado I Steinmikado II : ab 4 : ab 4 : 20 Steine : 20 Steine Spielregel : M 10-01 In der Mitte des Raumes schichten wir einen Steinberg auf. Die Aufgabe besteht darin, vom Fuße des Berges jeweils
Herzlich Willkommen beim Webinar: Was verkaufen wir eigentlich?
 Herzlich Willkommen beim Webinar: Was verkaufen wir eigentlich? Was verkaufen wir eigentlich? Provokativ gefragt! Ein Hotel Marketing Konzept Was ist das? Keine Webseite, kein SEO, kein Paket,. Was verkaufen
Herzlich Willkommen beim Webinar: Was verkaufen wir eigentlich? Was verkaufen wir eigentlich? Provokativ gefragt! Ein Hotel Marketing Konzept Was ist das? Keine Webseite, kein SEO, kein Paket,. Was verkaufen
Batterie richtig prüfen und laden
 Batterie richtig prüfen und laden Vor allem kleine Mopeds, Motorräder und Roller, also 50er und 125er, kämpfen häufig mit Elektrikproblemen. Hauptursache ist meist eine schwache Batterie. Die Licht- und
Batterie richtig prüfen und laden Vor allem kleine Mopeds, Motorräder und Roller, also 50er und 125er, kämpfen häufig mit Elektrikproblemen. Hauptursache ist meist eine schwache Batterie. Die Licht- und
Text-Zahlen-Formatieren
 Text-Zahlen-Formatieren Beobachtung: Bei der Formatierung einer Zahl in eine Textzahl und umgekehrt zeigt Excel ein merkwürdiges Verhalten, welches nachfolgend skizziert werden soll: Wir öffnen eine neue
Text-Zahlen-Formatieren Beobachtung: Bei der Formatierung einer Zahl in eine Textzahl und umgekehrt zeigt Excel ein merkwürdiges Verhalten, welches nachfolgend skizziert werden soll: Wir öffnen eine neue
Die chemischen Grundgesetze
 Die chemischen Grundgesetze Ausgangsproblem Beim Verbrennen von Holz im Ofen bleibt Asche übrig, die Masse der Asche ist deutlich geringer als die Masse des ursprünglichen Holzes. Lässt man einen Sack
Die chemischen Grundgesetze Ausgangsproblem Beim Verbrennen von Holz im Ofen bleibt Asche übrig, die Masse der Asche ist deutlich geringer als die Masse des ursprünglichen Holzes. Lässt man einen Sack
Meet the Germans. Lerntipp zur Schulung der Fertigkeit des Sprechens. Lerntipp und Redemittel zur Präsentation oder einen Vortrag halten
 Meet the Germans Lerntipp zur Schulung der Fertigkeit des Sprechens Lerntipp und Redemittel zur Präsentation oder einen Vortrag halten Handreichungen für die Kursleitung Seite 2, Meet the Germans 2. Lerntipp
Meet the Germans Lerntipp zur Schulung der Fertigkeit des Sprechens Lerntipp und Redemittel zur Präsentation oder einen Vortrag halten Handreichungen für die Kursleitung Seite 2, Meet the Germans 2. Lerntipp
AUSBILDUNG eines OBEDIENCE HUNDES
 Beginners, CH (Box, Carré), 15 m entfernt Beginners, CH ab 2017 FCI - 1 (Box, Carré), 15 m entfernt mit Platz, 15 m FCI - 2 FCI - 3 mit Platz und Abrufen, 23 m Voransenden in einen Kreis, dann in ein Viereck
Beginners, CH (Box, Carré), 15 m entfernt Beginners, CH ab 2017 FCI - 1 (Box, Carré), 15 m entfernt mit Platz, 15 m FCI - 2 FCI - 3 mit Platz und Abrufen, 23 m Voransenden in einen Kreis, dann in ein Viereck
