1.2 Vergleichen Sie die Reaktionsbedingungen für die Bromierung von A und B und begründen Sie unter Mitverwendung von Grenzformeln den Unterschied!
|
|
|
- Guido Bäcker
- vor 7 Jahren
- Abrufe
Transkript
1 Aufgabe II Die aromatischen Ringsysteme folgender Verbindungen sollen zu Monobromderivaten umgesetzt werden: Benzol (A), Anilin (B) und Aniliniumchlorid (C). 1.1 Erläutern Sie unter Mitverwendung von Strukturformeln den Reaktionsmechanismus der Bromierung von Benzol! 1.2 Vergleichen Sie die Reaktionsbedingungen für die Bromierung von A und B und begründen Sie unter Mitverwendung von Grenzformeln den Unterschied! 1.3 Bei der Bromierung von Aniliniumchlorid entsteht als organisches Produkt fast ausschließlich 3-Bromaniliniumchlorid. Begründen Sie diesen Reaktionsverlauf unter Mitverwendung von Grenzformeln und vergleichen Sie die Geschwindigkeit dieser Reaktion mit den Geschwindigkeiten der Reaktionen von A und B! 2.3 Bei der Nitrierung von Phenol entstehen drei verschiedene organische Monosubstitutionsprodukte in sehr unterschiedlicher Menge. Begründen Sie unter Mitverwendung von Grenzformeln, warum eines der Produkte nur in sehr geringer, die beiden anderen dagegen in deutlich höherer Ausbeute entstehen!
2 Lösungen
3 Aufgabe II Lösung 1.1. Bei der Reaktion handelt es sich um eine elektrophile Substitution. Als Elektrophil agiert der aus dem Brommolekül und dem Eisen(III)-bromid-Molekül gebildete Lewis-Säure-Base-Komplex (FeBr 3 entsteht aus einem Teil des Broms und dem zugesetzten Eisen). Das FeBr 3 -Molekül unterstützt die Polarisierung des Brom-Moleküls und erleichtert dadurch den elektrophilen Angriff und die darauf folgende Heterolyse des Brom-Moleküls. Elektrophiler Angriff: Rearomatisierung durch Protolyse: Durch die Protolyse entsteht ein energetisch günstiger aromatischer Zustand (Delokalisation von 6 pi-elektronen über 6 Zentren). Das abgespaltene Proton reagiert mit FeBr 4 - zu Hydrogenbromid und Eisen(III)-bromid, welches also als Katalysator fungiert. 1.2 Die Bromierung von Benzol verläuft nur bei Anwesenheit eines Katalysators, der die Polarisierung des Brom-Moleküls, und damit seinen elektrophilen Charakter verstärkt. Das aromatische System des Anilins ist auf Grund des +M-Effekts des Stickstoffatoms der Aminogruppe stärker aktiviert (größere Elektronendichte) und erleichtert die Ausbildung des pi-komplexes, so dass kein Katalysator notwendig ist. 1.3 Vergleich der Reaktionsgeschwindigkeiten: Die Bromierung des Aniliniumions verläuft langsamer als die Bromierung von Benzol oder Anilin, da die Ammoniumgruppe einen starken -I-Effekt ausübt. Dieser desaktivierende Effekt verringert die Elektronendichte im aromatischen System und erschwert so den elektrophilen Angriff. Ein +M-Effekt, wie er im Anilin auftritt, ist hier wegen des fehlenden freien Elektronenpaares am N-Atom nicht möglich.
4 Bildung von 3-Bromaniliniumchlorid: Die Reaktion verläuft zunächst über einen pi-komplex, aus dem -nach Addition eines Br + -Ionsein sigma-komplex gebildet wird. Prinzipiell sind 3 verschiedene sigma-komplexe denkbar: - einer, der zur Bildung eines 2-Bromaniliniumions führt - einer, der zur Bildung eines 4-Bromaniliniumions führt - und der, der die Bildung des 3-Bromaniliniumions beschreibt. Vergleich der Stabilitäten dieser sigma-komplexe: In ortho- und in para-stellung sind in den Grenzstrukturen C jeweils 2 positive Ladungen einander benachbart. Dies ist energetisch ungünstig, so dass diese Grenzstrukturen nur einen geringen Beitrag zur Beschreibung der tatsächlichen Elektronenverteilung leisten. In meta-stellung tritt dieser Effekt nicht auf, so dass in diesem Fall 3 energiegleiche Grenzstrukturen zur Beschreibung der Elektronenverteilung herangezogen werden können. Der sigma-komplex in meta-stellung ist deshalb energieärmer und wird bevorzugt gebildet.
5 2.3 Für die Entscheidung, welches der drei Substitutionsprodukte bevorzugt gebildet wird, ist die Stabilität der möglichen sigma-komplexe auschlaggebend. Aussagen über die Stabilität und die bevorzugte Bildung eines sigma-komplexes sind durch den Vergleich der jeweiligen Mesomeriestabilisierung möglich. Das Ausmaß der Mesomeriestabilisierung ist in meta-stellung am geringsten (nur 3 energiegleiche Grenzstrukturen) - der entsprechende sigma-komplex ist energetisch nicht bevorzugt. meta-nitrophenol wird nur in sehr geringer Ausbeute gebildet. Für den sigma-komplex mit der Nitrogruppe in ortho- und para-stellung existieren jeweils 4 energiegleiche Grenzstrukturen, das Ausmaß der Mesomeriestabilisierung ist größer (O-Atom der Hydroxygruppe ist hier mit einbezogen: -M-Effekt der Hydroxygruppe). bevorzugte Bildung von ortho- und para-nitrophenol.
1.4 Die elektrophile aromatische Substitution
 1.4 Die elektrophile aromatische Substitution Versuch: Bromierung von Toluol mit Eisen V In einem RG werden 2ml Toluol mit 0,5 g Eisenspänen gemischt. Hierzu werden 5 Tropfen Brom gegeben B Es bildet sich
1.4 Die elektrophile aromatische Substitution Versuch: Bromierung von Toluol mit Eisen V In einem RG werden 2ml Toluol mit 0,5 g Eisenspänen gemischt. Hierzu werden 5 Tropfen Brom gegeben B Es bildet sich
Lösung :Aromatische Kohlenwasserstoffe Kursleiter Klaus Bentz/ Kollegiat Andreas Maier Abiturjahrgang
 Lösung :Aromatische Kohlenwasserstoffe Kursleiter Klaus Bentz/ Kollegiat Andreas Maier Abiturjahrgang 2004 1985/IV/1 Zunächst wird Methan bei Licht bromiert: 4 2 3 Gemäß der FriedelraftSynthese unter Verwendung
Lösung :Aromatische Kohlenwasserstoffe Kursleiter Klaus Bentz/ Kollegiat Andreas Maier Abiturjahrgang 2004 1985/IV/1 Zunächst wird Methan bei Licht bromiert: 4 2 3 Gemäß der FriedelraftSynthese unter Verwendung
6. Rechenübung Organik (27.01./ )
 1 6. Rechenübung Organik (27.01./03.02.2009) Literatur: 2.) Mortimer : hemie Basiswissen hemie ISBN 3 13 484308 0 Paula Y. Bruice : Organische hemie ISBN 978 3 8273 7190 4 Gesättigtes Atom Atom, nur mit
1 6. Rechenübung Organik (27.01./03.02.2009) Literatur: 2.) Mortimer : hemie Basiswissen hemie ISBN 3 13 484308 0 Paula Y. Bruice : Organische hemie ISBN 978 3 8273 7190 4 Gesättigtes Atom Atom, nur mit
3. Aromatische Verbindungen Benzol(en)
 3. Aromatische Verbindungen Benzol(en) Benzol erweist sich merkwürdigerweise als ungewöhnlich stabil gegen viele angreifende Reagenzien. So finden die typischen Additionen an die Doppelbindungen nicht
3. Aromatische Verbindungen Benzol(en) Benzol erweist sich merkwürdigerweise als ungewöhnlich stabil gegen viele angreifende Reagenzien. So finden die typischen Additionen an die Doppelbindungen nicht
Nr. Aufgabe Pkt. 2.2 Erklären Sie die ungewöhnliche Stabilität aromatischer Systeme gegenüber Additionsversuchen!
 aromatische Kohlenwasserstoffe Jahrgang Index Nr. Aufgabe Pkt 15/IV 1 o-bromtoluol soll aus Benzol, Methan und Brom mit geeigneten Katalysatoren hergestellt werden. Beschreiben Sie unter Verwendung von
aromatische Kohlenwasserstoffe Jahrgang Index Nr. Aufgabe Pkt 15/IV 1 o-bromtoluol soll aus Benzol, Methan und Brom mit geeigneten Katalysatoren hergestellt werden. Beschreiben Sie unter Verwendung von
Reaktionstypen der Aromate
 Radikalische Reaktionspartner sind Atome bzw. Atomgruppen mit einem ungepaarten Elektron, wie z. B. das Chlorradikal Cl oder das Ethylradikal C 3 C 2. Radikale sind in der Regel sehr unbeständig, kurzlebig
Radikalische Reaktionspartner sind Atome bzw. Atomgruppen mit einem ungepaarten Elektron, wie z. B. das Chlorradikal Cl oder das Ethylradikal C 3 C 2. Radikale sind in der Regel sehr unbeständig, kurzlebig
Bundesrealgymnasium Imst. Chemie Klasse 8. Aromaten und deren Reaktionen
 Bundesrealgymnasium Imst Chemie 2010-11 und deren Reaktionen Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter
Bundesrealgymnasium Imst Chemie 2010-11 und deren Reaktionen Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter
Chemie Stufe 13 / Aromaten / Phenol Folie 01. Das Phenol-Molekül. δ δ+ sp 3. sp 2
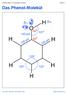 Chemie Stufe 13 / Aromaten / Phenol Folie 01 Das Phenol-Molekül δ δ+ sp 3 sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 02 Das Phenolat-Ion sp 3 H + sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 03 Grenzstrukturen
Chemie Stufe 13 / Aromaten / Phenol Folie 01 Das Phenol-Molekül δ δ+ sp 3 sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 02 Das Phenolat-Ion sp 3 H + sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 03 Grenzstrukturen
Aromatische Kohlenwasserstoffe.
 Aromatische Kohlenwasserstoffe. Benzol und dessen Homologe. Mechanismus der S E 2-Ar-Reaktion. Orientierung in aromatischem Kern, abhängig vom ersten Substituent. Elektrophiler Mechanismus der Substitutionsreaktionen.
Aromatische Kohlenwasserstoffe. Benzol und dessen Homologe. Mechanismus der S E 2-Ar-Reaktion. Orientierung in aromatischem Kern, abhängig vom ersten Substituent. Elektrophiler Mechanismus der Substitutionsreaktionen.
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Elektrophile Reaktionsmechanismen Erkennungsmerkmale und Reaktionsschritte
 Elektrophile Reaktionsmechanismen Erkennungsmerkmale und Reaktionsschritte H. Wünsch 2012 Signale für elektrophile Reak;onen Signale am organischen Molekül: π- Elektronen (Mehrfachbindungen), π- Elektronensysteme
Elektrophile Reaktionsmechanismen Erkennungsmerkmale und Reaktionsschritte H. Wünsch 2012 Signale für elektrophile Reak;onen Signale am organischen Molekül: π- Elektronen (Mehrfachbindungen), π- Elektronensysteme
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag)
 Pharmazeutische Chemie Seite 1 Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag) Fragen zu der sp³ Hybridisierung (S. 124-128): 1.) Notieren Sie die Elektronenverteilung
Pharmazeutische Chemie Seite 1 Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag) Fragen zu der sp³ Hybridisierung (S. 124-128): 1.) Notieren Sie die Elektronenverteilung
2. Übungsblatt. Organische Chemie für Studierende mit Nebenfach Chemie
 Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
1. Umwandlung funktioneller Gruppen Geben Sie Reagenzien an, mit denen Sie die folgenden Umwandlungen durchführen würden!
 Übung r. 8 Mi. 25.04.2012 bzw. Fr. 7.05.2 1. Umwandlung funktioneller Gruppen Geben Sie Reagenzien an, mit denen Sie die folgenden Umwandlungen durchführen würden! 2 CH 3 H a) b) I H c) d) C F e) f) H
Übung r. 8 Mi. 25.04.2012 bzw. Fr. 7.05.2 1. Umwandlung funktioneller Gruppen Geben Sie Reagenzien an, mit denen Sie die folgenden Umwandlungen durchführen würden! 2 CH 3 H a) b) I H c) d) C F e) f) H
Organische Chemie für MST 5. Lienkamp/ Prucker/ Rühe
 Organische Chemie für MST 5 Lienkamp/ Prucker/ Rühe Inhalt 5 Aromaten Struktur und Bindung im Benzol, Hückel-Regel, mesomeregrenzstrukturen, ortho-, meta-, para-substitution, elektrophile Substitution
Organische Chemie für MST 5 Lienkamp/ Prucker/ Rühe Inhalt 5 Aromaten Struktur und Bindung im Benzol, Hückel-Regel, mesomeregrenzstrukturen, ortho-, meta-, para-substitution, elektrophile Substitution
Darstellung von Phenolphthalein und Fluorescein
 Philipps-Universität Marburg 04. Juli 2007 Fachbereich 15: Chemie rganisch-chemisches Grundpraktikum für Lehramtskandidaten Praktikumsleiter: Dr. Philipp Reiß SS 2007 Mario Gerwig Versuch: Darstellung
Philipps-Universität Marburg 04. Juli 2007 Fachbereich 15: Chemie rganisch-chemisches Grundpraktikum für Lehramtskandidaten Praktikumsleiter: Dr. Philipp Reiß SS 2007 Mario Gerwig Versuch: Darstellung
Versuch: Bromierung von Phenol
 Philipps-Universität Marburg 01.12.2007 Organisches Grundpraktikum (LA) Katrin ohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 4, Aromaten Versuch: omierung von Phenol Zeitbedarf: Vorbereitung:
Philipps-Universität Marburg 01.12.2007 Organisches Grundpraktikum (LA) Katrin ohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 4, Aromaten Versuch: omierung von Phenol Zeitbedarf: Vorbereitung:
2. Übungsblatt. Organische Chemie für Studierende mit Nebenfach Chemie
 Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
Übungen zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe. 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit
 O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
Chemie für Biologen, 2017
 Chemie für Biologen, 2017 Übung 11 Organisch chemische Reaktionen (Thema 12.1 12.6) Aufgabe 1: a) Erklären Sie folgende Begriffe: i) Übergangszustand Zustand der höchsten Energie in einer Reaktion, kann
Chemie für Biologen, 2017 Übung 11 Organisch chemische Reaktionen (Thema 12.1 12.6) Aufgabe 1: a) Erklären Sie folgende Begriffe: i) Übergangszustand Zustand der höchsten Energie in einer Reaktion, kann
Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen.
 1 Lösung 5 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen. Falls Sie Fragen zur Vorlesung/Übung/generellen Konzepten haben schreiben
1 Lösung 5 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen. Falls Sie Fragen zur Vorlesung/Übung/generellen Konzepten haben schreiben
2. Elektroneneffekte in den organischen Molekülen
 2. Elektroneneffekte in den organischen Molekülen Induktive und mesomere Effekte Die Ladungsverteilung in einer Kohlenwasserstoffkette wird durch Substituenten (Halogen, OH, NH 2 usw.) beeinflusst. Man
2. Elektroneneffekte in den organischen Molekülen Induktive und mesomere Effekte Die Ladungsverteilung in einer Kohlenwasserstoffkette wird durch Substituenten (Halogen, OH, NH 2 usw.) beeinflusst. Man
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
9 Aromaten. 1 Elemente Chemie Oberstufe NRW Ernst Klett Verlag GmbH, Stuttgart Lösungen zu den Durchblick-Seiten
 Lösungen zu den Durchblick-Seiten 9.15 Durchblick Zusammenfassung und Übung Zu den Aufgaben A1 1. Aromaten sind ebene, cyclische Moleküle. 2. Das Ringmolekül weist ein durchgehendes System konjugierter
Lösungen zu den Durchblick-Seiten 9.15 Durchblick Zusammenfassung und Übung Zu den Aufgaben A1 1. Aromaten sind ebene, cyclische Moleküle. 2. Das Ringmolekül weist ein durchgehendes System konjugierter
Radikalische Substitution von Alkanen
 adikalische Substitution von Alkanen KW mit sp³-hybridisierten C-Atomen (z.b. in Alkanen) und alogene Gemisch aus alogenalkanen und alogenwasserstoff Licht C n n à C n n1 eaktionsmechanismus z.b. Chlorierung
adikalische Substitution von Alkanen KW mit sp³-hybridisierten C-Atomen (z.b. in Alkanen) und alogene Gemisch aus alogenalkanen und alogenwasserstoff Licht C n n à C n n1 eaktionsmechanismus z.b. Chlorierung
Übungen zur VL Chemie für Biologen und Humanbiologen Lösung Übung 9
 Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
(Anmerkung: Es sind weitere möglich. Spektren zeigen Diradikal.)
 eispielaufgaben IChO 2. Runde 2017 Aromaten, Lösungen Aromaten eispiel 1: a) b) (Zeichnungen hier und unten teilweise ohne Wasserstoff-Atome) c) Das Anion ist planar und hat ein cyclisch konjugiertes π-elektronensystem
eispielaufgaben IChO 2. Runde 2017 Aromaten, Lösungen Aromaten eispiel 1: a) b) (Zeichnungen hier und unten teilweise ohne Wasserstoff-Atome) c) Das Anion ist planar und hat ein cyclisch konjugiertes π-elektronensystem
Organische Chemie 2 SPF BCH am Inhaltsverzeichnis Sie kennen alle Karteikärtchen zum Thema... 2
 Organische Chemie 2 Inhaltsverzeichnis Sie kennen alle Karteikärtchen zum Thema.... 2 Sie kennen vier Grundtypen von Reaktionen mit ihren Mechanismen (S. 239) mit aliphatischen, organischen Stoffen und
Organische Chemie 2 Inhaltsverzeichnis Sie kennen alle Karteikärtchen zum Thema.... 2 Sie kennen vier Grundtypen von Reaktionen mit ihren Mechanismen (S. 239) mit aliphatischen, organischen Stoffen und
Beispiele. Polysubstituierte Benzole. Chapter 16. Organic Chemistry. Reaktionen of Substituierter Benzole. Bezeichnung durch Numerierung oder Präfix
 Organic Chemistry 4 th Edition Paula Yurkanis Bruice Beispiele Chapter 16 Reaktionen of Substituierter Benzole Irene Lee Case Western Reserve University Cleveland, OH 2004, Prentice Hall Bezeichnung durch
Organic Chemistry 4 th Edition Paula Yurkanis Bruice Beispiele Chapter 16 Reaktionen of Substituierter Benzole Irene Lee Case Western Reserve University Cleveland, OH 2004, Prentice Hall Bezeichnung durch
Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) OH H + - H 2 O. (aus H 3 PO 4 H 2 SO 4 ) - H + Stichpunkte zum E1-Mechanismus:
 Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) + (aus 3 P 4 2 S 4 ) - 2 - + Stichpunkte zum E1-Mechanismus: 2-Schritt-eaktion über ein Carbenium-Ion (1. Schritt ist Abspaltung der Abgangsgruppe (im
Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) + (aus 3 P 4 2 S 4 ) - 2 - + Stichpunkte zum E1-Mechanismus: 2-Schritt-eaktion über ein Carbenium-Ion (1. Schritt ist Abspaltung der Abgangsgruppe (im
Indanon ist das Produkt einer Friedel-Crafts-Acylierung Geben Sie die Reaktionsgleichung zu seiner Synthese an.
 Aromatenchemie für Fortgeschrittene 1.Wiederholung: Elektrophile aromatische Substitutionen 1.1. Geben Sie die Bruttogleichung für die zweistufige Synthese von Styren an. 1.2. Formulieren Sie die Reaktionsgleichung
Aromatenchemie für Fortgeschrittene 1.Wiederholung: Elektrophile aromatische Substitutionen 1.1. Geben Sie die Bruttogleichung für die zweistufige Synthese von Styren an. 1.2. Formulieren Sie die Reaktionsgleichung
Beispiel für eine Anionenaustausch-Matrix. Als funktionelle Gruppe dient hier eine Diethylaminoethylgruppe.
 Aufgabe 1 Essigsäure exansäure Der Laugenverbrauch ist im Falle der Essigsäure höher. Essigsäure verteilt sich besser in die Wasserphase, exansäure aufgrund der höheren Anzahl unpolarer Alkylreste besser
Aufgabe 1 Essigsäure exansäure Der Laugenverbrauch ist im Falle der Essigsäure höher. Essigsäure verteilt sich besser in die Wasserphase, exansäure aufgrund der höheren Anzahl unpolarer Alkylreste besser
Lösungen zu Übungsaufgaben Mechanismen 1 LK 12/1 Chemie
 1. Die radikalische Substitution 2-Methylbutan soll mit Brom im Sinne einer radikalischen Substitution reagieren. Betrachtet sei zunächst nur die Monobromierung. a) Formulieren Sie die Summengleichung
1. Die radikalische Substitution 2-Methylbutan soll mit Brom im Sinne einer radikalischen Substitution reagieren. Betrachtet sei zunächst nur die Monobromierung. a) Formulieren Sie die Summengleichung
Nucleophile Substitution: S N 2-Reaktion
 Nucleophile Substitution: S N 2-Reaktion Diese teilweise Verschiebung von Elektronendichte und die damit einhergehende Polarisierung kann z.b. durch den griechischen Buchstaben und das hochgestellte entsprechende
Nucleophile Substitution: S N 2-Reaktion Diese teilweise Verschiebung von Elektronendichte und die damit einhergehende Polarisierung kann z.b. durch den griechischen Buchstaben und das hochgestellte entsprechende
1. Teilprüfung (30 P) - Gruppe A
 Chemisches Grundpraktikum IIB (270062) und Spezielle Synthesechemie (270222) W2016 24.10.2016 1. Teilprüfung (30 P) - Gruppe A NAME: Vorname: Matrikel Nr.: Bitte alle Fragen möglichst an dem dafür vorgesehenen
Chemisches Grundpraktikum IIB (270062) und Spezielle Synthesechemie (270222) W2016 24.10.2016 1. Teilprüfung (30 P) - Gruppe A NAME: Vorname: Matrikel Nr.: Bitte alle Fragen möglichst an dem dafür vorgesehenen
Bromierung von Cycloalkenen
 hemie Q1 / 4. Reaktionswege der organischen hemie / 4.2 Alkene und elektrophile Addition 1/ omierung von ycloalkenen Zufällig kommt ein 2-Molekül in die Nähe der elektronenreichen Doppelbindung. Ulrich
hemie Q1 / 4. Reaktionswege der organischen hemie / 4.2 Alkene und elektrophile Addition 1/ omierung von ycloalkenen Zufällig kommt ein 2-Molekül in die Nähe der elektronenreichen Doppelbindung. Ulrich
Übungen zur VL Chemie für Biologen und Humanbiologen
 Übungen zur VL Chemie für Biologen und Humanbiologen 28.01.2011 1. Zeichnen Sie die Valenzstrichformeln folgender Verbindungen und benutzen Sie im Falle unbestimmter Alkylreste ein R: a) ein tertiärer
Übungen zur VL Chemie für Biologen und Humanbiologen 28.01.2011 1. Zeichnen Sie die Valenzstrichformeln folgender Verbindungen und benutzen Sie im Falle unbestimmter Alkylreste ein R: a) ein tertiärer
Lösungen zur Übung 23 Aufgabe 1 Funktionelle Gruppen: Progesteron hat 2 Carbonylgruppen und eine C=C Doppelbindung.
 rganische hemie I Lösungen zur Übung 23 Aufgabe 1 Funktionelle Gruppen: Progesteron hat 2 arbonylgruppen und eine = Doppelbindung. 3 () 3 3 Progesteron Das Molekül hat 6 hiralitätszentren (mit * bezeichnet).
rganische hemie I Lösungen zur Übung 23 Aufgabe 1 Funktionelle Gruppen: Progesteron hat 2 arbonylgruppen und eine = Doppelbindung. 3 () 3 3 Progesteron Das Molekül hat 6 hiralitätszentren (mit * bezeichnet).
Grundkurs Chemie Alkane
 Grundkurs Chemie Alkane Abituraufgaben 1975/I Monobrompropan soll auf zwei verschiedenen Synthesewegen aus zwei verschiedenen Kohlenwasserstoffen hergestellt werden. 1. Bennen Sie die dafür geeigneten
Grundkurs Chemie Alkane Abituraufgaben 1975/I Monobrompropan soll auf zwei verschiedenen Synthesewegen aus zwei verschiedenen Kohlenwasserstoffen hergestellt werden. 1. Bennen Sie die dafür geeigneten
Organische Chemie für Studierende mit Nebenfach Chemie Andreas Rammo
 Organische Chemie für Studierende mit Nebenfach Chemie Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de Arene Arene sind cyclisch konjugierte
Organische Chemie für Studierende mit Nebenfach Chemie Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de Arene Arene sind cyclisch konjugierte
1. a) Geben sie den Reaktionsmechanismus für die Nitrierung und die Sulfonierung von Benzol an. Beginnen sie mit der Erzeugung des Elektrophils.
 Übungsblatt 05 - C I - SoSe 2014 (Prof. Bunz) 1. a) Geben sie den Reaktionsmechanismus für die itrierung und die Sulfonierung von Benzol an. Beginnen sie mit der rzeugung des lektrophils. I) rzeugung lektrophil:
Übungsblatt 05 - C I - SoSe 2014 (Prof. Bunz) 1. a) Geben sie den Reaktionsmechanismus für die itrierung und die Sulfonierung von Benzol an. Beginnen sie mit der rzeugung des lektrophils. I) rzeugung lektrophil:
Inhaltsverzeichnis. Teil I Volle Kraft voraus: Die Chemie des Kohlenstoffs 23. Einführung 17. Kapitel 1 Die wundervolle Welt der organischen Chemie 25
 Inhaltsverzeichnis Inhaltsverzeichnis Über den Autor 7 Einführung 17 Über dieses Buch 18 Konventionen in diesem Buch 19 Törichte Annahmen über den Leser 19 Wie dieses Buch aufgebaut ist 20 Teil I: Es war
Inhaltsverzeichnis Inhaltsverzeichnis Über den Autor 7 Einführung 17 Über dieses Buch 18 Konventionen in diesem Buch 19 Törichte Annahmen über den Leser 19 Wie dieses Buch aufgebaut ist 20 Teil I: Es war
Herstellung und Oxidation von 2,4,6-Tri-tert-butylphenol
 2.9B erstellung und xidation von 2,4,6-Tri-tert-butylphenol Chemikalien 4,7 g (50 mmol) Phenol R: 24, 25, 45 S: 28.2, 45 17,6 g (200 mmol) tertylmethylether R: 11, 36, 37, 38 Kp = 55 C S: 9, 16, 26, 29,
2.9B erstellung und xidation von 2,4,6-Tri-tert-butylphenol Chemikalien 4,7 g (50 mmol) Phenol R: 24, 25, 45 S: 28.2, 45 17,6 g (200 mmol) tertylmethylether R: 11, 36, 37, 38 Kp = 55 C S: 9, 16, 26, 29,
Präparat Nr. 2: Darstellung von Methyl-1-naphtylketon
 Präparat Nr. 2: Darstellung von Methyl-1-naphtylketon 3 3 l 1,2-Dichlorethan Naphthalin Acetylchlorid Methyl-1-naphtylketon ( 10 8 ) ( 2 3 l) ( 12 10 ) M=128.18 M=78.50 M=133.34 M=170.21 1. Ansatz: Es
Präparat Nr. 2: Darstellung von Methyl-1-naphtylketon 3 3 l 1,2-Dichlorethan Naphthalin Acetylchlorid Methyl-1-naphtylketon ( 10 8 ) ( 2 3 l) ( 12 10 ) M=128.18 M=78.50 M=133.34 M=170.21 1. Ansatz: Es
a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten!
 Übung Nr. 9 Mi. 02.05.2012 bzw. Fr. 04.05.2012 1. Aromatensynthese a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten! b) Was passiert bei der Umsetzung von
Übung Nr. 9 Mi. 02.05.2012 bzw. Fr. 04.05.2012 1. Aromatensynthese a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten! b) Was passiert bei der Umsetzung von
Darstellung von Malachitgrün Präparat 5
 Janine Schneider 22.05.00 Darstellung von Malachitgrün Präparat 5 1. Reaktionstyp: säurekatalysierte Kondensation (elektrophile Substitution) 2. Reaktionsgleichung: O + 2 ( + ) Benzaldehyd N,N- Dimethylanilin
Janine Schneider 22.05.00 Darstellung von Malachitgrün Präparat 5 1. Reaktionstyp: säurekatalysierte Kondensation (elektrophile Substitution) 2. Reaktionsgleichung: O + 2 ( + ) Benzaldehyd N,N- Dimethylanilin
Kohlenstoffverbindungen und Gleichgewichtsreaktionen (EF)
 Kohlenstoffverbindungen und Gleichgewichtsreaktionen (EF)... interpretieren den zeitlichen Ablauf chemischer Reaktionen in Abhängigkeit von verschiedenen Parametern (u.a. Oberfläche, Konzentration, Temperatur)
Kohlenstoffverbindungen und Gleichgewichtsreaktionen (EF)... interpretieren den zeitlichen Ablauf chemischer Reaktionen in Abhängigkeit von verschiedenen Parametern (u.a. Oberfläche, Konzentration, Temperatur)
Seminar zum Organisch-Chemischen Praktikum für Lehramtsstudierende Wintersemester 2015/2016. Aromatische Substitution. Dr. Florian Achrainer AK Zipse
 Seminar zum rganisch-chemischen Praktikum für Lehramtsstudierende Wintersemester 2015/2016 Aromatische Substitution Sicherheitsbelehrung: egeln für das Arbeiten im Labor Dr. Florian Achrainer AK Zipse
Seminar zum rganisch-chemischen Praktikum für Lehramtsstudierende Wintersemester 2015/2016 Aromatische Substitution Sicherheitsbelehrung: egeln für das Arbeiten im Labor Dr. Florian Achrainer AK Zipse
Kohlenstoffverbindungen und Gleichgewichtsreaktionen (EF)
 Kohlenstoffverbindungen und Gleichgewichtsreaktionen (EF)... beschreiben Zusammenhänge zwischen Vorkommen, Verwendung und Eigenschaften wichtiger Vertreter der Stoffklassen der Alkohole, Aldehyde, Ketone,
Kohlenstoffverbindungen und Gleichgewichtsreaktionen (EF)... beschreiben Zusammenhänge zwischen Vorkommen, Verwendung und Eigenschaften wichtiger Vertreter der Stoffklassen der Alkohole, Aldehyde, Ketone,
Darstellung von 4-Acetylcumol (1-Acetyl-4-isopropylbenzol) [1] Präparat 2
![Darstellung von 4-Acetylcumol (1-Acetyl-4-isopropylbenzol) [1] Präparat 2 Darstellung von 4-Acetylcumol (1-Acetyl-4-isopropylbenzol) [1] Präparat 2](/thumbs/95/126253543.jpg) Janine Schneider 05.05.00 Darstellung von 4-Acetylcumol (1-Acetyl-4-isopropylbenzol) [1] Präparat 2 1. Reaktionstyp: Friedel-rafts-Acylierung 2. Reaktionsgleichung: + Al 3 9 12 2 3 Al 3 11 14 M=120.2 g/mol
Janine Schneider 05.05.00 Darstellung von 4-Acetylcumol (1-Acetyl-4-isopropylbenzol) [1] Präparat 2 1. Reaktionstyp: Friedel-rafts-Acylierung 2. Reaktionsgleichung: + Al 3 9 12 2 3 Al 3 11 14 M=120.2 g/mol
Organische Chemie 1 SS2011 Tutorium Übungsblatt 12 Seite 1
 Organische Chemie 1 SS2011 Tutorium Übungsblatt 12 Seite 1 1) Ordnen Sie die folgenden aromatischen Verbindungen nach steigender Reaktivität in der elektrophilen aromatischen Substitution. Chlorbenzol,
Organische Chemie 1 SS2011 Tutorium Übungsblatt 12 Seite 1 1) Ordnen Sie die folgenden aromatischen Verbindungen nach steigender Reaktivität in der elektrophilen aromatischen Substitution. Chlorbenzol,
Substituenten-Effekt auf die Orientierung der Zweitsubstituenten Orientierung bei der Toluolsubstitution
 Substituenten-Effekt auf die rientierung der Zweitsubstituenten rientierung bei der Toluolsubstitution I_folie215 3 3 3 3 meta para 58 % Nitrierung 4 % 38 % = N 2 N 3 / 2 S 4 Sulfonierung 32 % 6 % 62 %
Substituenten-Effekt auf die rientierung der Zweitsubstituenten rientierung bei der Toluolsubstitution I_folie215 3 3 3 3 meta para 58 % Nitrierung 4 % 38 % = N 2 N 3 / 2 S 4 Sulfonierung 32 % 6 % 62 %
Bundesrealgymnasium Imst. Chemie Klasse 8. Reaktionsmechanismen der Aliphate
 Bundesrealgymnasium Imst Chemie 2010-11 Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter aufgearbeitet
Bundesrealgymnasium Imst Chemie 2010-11 Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter aufgearbeitet
 hemie-protokoll 11.11.02, Seite 1 von 5 Lukman Iwan, 12.11.02 Stundenprotokoll vom Montag, 11. ovember 2002 Es fehlen: Janine und Jeannette Zettel 1&2: Aromatische eterocyclen http://www.oci.unizh.ch/edu/lectures/material/a_bii/kap6/kap6.html
hemie-protokoll 11.11.02, Seite 1 von 5 Lukman Iwan, 12.11.02 Stundenprotokoll vom Montag, 11. ovember 2002 Es fehlen: Janine und Jeannette Zettel 1&2: Aromatische eterocyclen http://www.oci.unizh.ch/edu/lectures/material/a_bii/kap6/kap6.html
Teil 1 Aufgaben zum Stoff der Vorlesung OC1a (Grundvorlesung Organische Chemie) Maximale Punktezahl: 20 Notwendige Mindestpunkte: 8
 2. Klausur OC1 (BA-Studiengang) PIN: 12.03.2014 13:00 16:00 Uhr N2 Name: Punkte: Matrikel Nr. Note: Notenskala: 80-78=1.0 77-75=1.3 74-71=1.5 70-67=1.7 66-63=2.0 62-59=2.3 58-56=2.5 55-53=2.7 52-50=3.0
2. Klausur OC1 (BA-Studiengang) PIN: 12.03.2014 13:00 16:00 Uhr N2 Name: Punkte: Matrikel Nr. Note: Notenskala: 80-78=1.0 77-75=1.3 74-71=1.5 70-67=1.7 66-63=2.0 62-59=2.3 58-56=2.5 55-53=2.7 52-50=3.0
Übungsblatt 9: Reaktionsdiversität
 1 Übungsblatt 9: Reaktionsdiversität Warm Up Benennen Sie die folgenden (Thio )Ether: Aufgaben 1) Alkohole und Thiole i. Während das 1,2 Dibromethan bevorzugt in der fully staggered Konformation vorliegt,
1 Übungsblatt 9: Reaktionsdiversität Warm Up Benennen Sie die folgenden (Thio )Ether: Aufgaben 1) Alkohole und Thiole i. Während das 1,2 Dibromethan bevorzugt in der fully staggered Konformation vorliegt,
Gruppe 03: Umsetzung von Hexan und Hexen mit Bromwasser
 Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 03: Umsetzung von Hexan und Hexen mit Bromwasser Reaktion: Chemikalien:
Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 03: Umsetzung von Hexan und Hexen mit Bromwasser Reaktion: Chemikalien:
Die elektrophile Addition
 Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
4. Alkene und Alkine : Reaktionen und Darstellung
 Inhalt Index 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann sich unter Bildung eines Carbeniumions an eine
Inhalt Index 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann sich unter Bildung eines Carbeniumions an eine
Prüfungsaufgaben von und zu Aromaten (incl. Aryldiazoniumsalzen)
 Prüfungsaufgaben von und zu Aromaten (incl. Aryldiazoniumsalzen) Die Aufgaben lehnen sich an Prüfungsaufgaben aus der Abschlussprüfung für Chemielaboranten der vergangenen Jahre an. äufig erstrecken sich
Prüfungsaufgaben von und zu Aromaten (incl. Aryldiazoniumsalzen) Die Aufgaben lehnen sich an Prüfungsaufgaben aus der Abschlussprüfung für Chemielaboranten der vergangenen Jahre an. äufig erstrecken sich
Zweite Klausur zum Organisch-Chemischen Grundpraktikum
 Prof. Dr. Jens Christoffers 12. Juni 2006 Universität ldenburg Zweite Klausur zum rganisch-chemischen Grundpraktikum Vorname: Name: Matrikelnummer: Studiengang: Falls Sie zusätzliche Seiten verwenden,
Prof. Dr. Jens Christoffers 12. Juni 2006 Universität ldenburg Zweite Klausur zum rganisch-chemischen Grundpraktikum Vorname: Name: Matrikelnummer: Studiengang: Falls Sie zusätzliche Seiten verwenden,
3. Klausur zum Praktikum Organische Chemie I für Studierende der Chemie und der Biochemie im SS 2000
 Prof. Dr. B. König Prof. Dr. Th. Troll 3. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 2000 am Donnerstag, dem 27. Juli 2000 ame: Mustermann...Vorname: Max...
Prof. Dr. B. König Prof. Dr. Th. Troll 3. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 2000 am Donnerstag, dem 27. Juli 2000 ame: Mustermann...Vorname: Max...
Organik-Beispiel. Inhaltsverzeichnis
 Inhaltsverzeichnis I. Säure-Basen-Gleichungen... 2 a) Nach Arrhenius:... 2 b) Nach Broensted:... 2 c) Nach Lewis:... 2 II. H 2 O + HCl?... 4 a) Was ist in der Reaktion passiert? Welche Produkte entstehen?...
Inhaltsverzeichnis I. Säure-Basen-Gleichungen... 2 a) Nach Arrhenius:... 2 b) Nach Broensted:... 2 c) Nach Lewis:... 2 II. H 2 O + HCl?... 4 a) Was ist in der Reaktion passiert? Welche Produkte entstehen?...
Bitte verwenden Sie Konzeptpapier und schreiben Sie dann Ihre Antworten geordnet unter der
 1 Institut für Organische Chemie 9.10.2014 Prof. Dr. Stefan Bräse Punkte: 1. (16). Nachholklausur zur OC-I-Vorlesung für Chemiker, Lebensmittelchemiker, Biologen, Chemische Biologen und Studierende des
1 Institut für Organische Chemie 9.10.2014 Prof. Dr. Stefan Bräse Punkte: 1. (16). Nachholklausur zur OC-I-Vorlesung für Chemiker, Lebensmittelchemiker, Biologen, Chemische Biologen und Studierende des
Wird vom Korrektor ausgefüllt: Aufgabe Punkte
 1. Wiederholungsklausur zur Vorlesung Grundlagen der Chemie für Mediziner und Biologen & Chemie-Praktikum für Molekulare Medizin und Biologie Gehalten im Wintersemester 2008/2009 Bitte diese 3 Felder ausfüllem:
1. Wiederholungsklausur zur Vorlesung Grundlagen der Chemie für Mediziner und Biologen & Chemie-Praktikum für Molekulare Medizin und Biologie Gehalten im Wintersemester 2008/2009 Bitte diese 3 Felder ausfüllem:
Modul: BS Chemie II Organische Chemie Nachklausur zum Organisch-Chemischen Grundpraktikum für. Studierende der Biologie
 Chemisches Praktikum für Studierende der Biologie (Bachelor) Universität zu Köln Institut für rganische Chemie Prof. Dr. A. G. Griesbeck Greinstr. 4 50939 Köln Modul: BS Chemie II rganische Chemie Nachklausur
Chemisches Praktikum für Studierende der Biologie (Bachelor) Universität zu Köln Institut für rganische Chemie Prof. Dr. A. G. Griesbeck Greinstr. 4 50939 Köln Modul: BS Chemie II rganische Chemie Nachklausur
Versuch: Reaktivität von primären, sekundären und tertiären Alkylbromiden gegenüber ethanolischer Silbernitratlösung. keine Reaktion.
 Philipps-Universität Marburg 15.01.2008 rganisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 5, Halogenalkane Versuch: Reaktivität von primären, sekundären
Philipps-Universität Marburg 15.01.2008 rganisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 5, Halogenalkane Versuch: Reaktivität von primären, sekundären
4. Alkene und Alkine : Reaktionen und Darstellung
 Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
alte Klausur; von 1999 ÜBUNGSKLAUSUR
 alte Klausur; von 1999 ÜBUNGSKLAUSUR Name: Bitte nicht mit Bleistift und nicht mit Rotstift ausfüllen! Telefonnummer: Studienfach: Fachsemester: Matrikelnummer: Ausweisnummer: Unterschrift:...... Diese
alte Klausur; von 1999 ÜBUNGSKLAUSUR Name: Bitte nicht mit Bleistift und nicht mit Rotstift ausfüllen! Telefonnummer: Studienfach: Fachsemester: Matrikelnummer: Ausweisnummer: Unterschrift:...... Diese
Organische Chemie I Molekül der Woche - Azulen
 I Molekül der Woche - Azulen 1 I Alkine C n H 2n-2 Bindungslängen Der C-H-Abstand verringert sich in dem Maße, wie der s-anteil an der Hybridisierung des C-Atoms wächst Schwermetallacetylide Ag 2 C 2 und
I Molekül der Woche - Azulen 1 I Alkine C n H 2n-2 Bindungslängen Der C-H-Abstand verringert sich in dem Maße, wie der s-anteil an der Hybridisierung des C-Atoms wächst Schwermetallacetylide Ag 2 C 2 und
Abituraufgaben Benzol und Derivate 1978/II 1979/II/3 1983/II/2 1985/IV/1 1986/II/4
 Abituraufgaben Benzol und Derivate 1978/II 1. Welche Experimentalbefunde (Isomerieverhältnisse betreffend) stützen die als Lösung des "Benzolproblems" von Kekule vorgeschlagene Beschreibung des Benzolmoleküls?
Abituraufgaben Benzol und Derivate 1978/II 1. Welche Experimentalbefunde (Isomerieverhältnisse betreffend) stützen die als Lösung des "Benzolproblems" von Kekule vorgeschlagene Beschreibung des Benzolmoleküls?
Arbeitsheft Ionische Reaktionsmechanismen Inhalt Jakob 1 Inhaltsverzeichnis: Seite: Vorkenntnisse:
 Arbeitsheft Ionische Reaktionsmechanismen Inhalt Jakob 1 Inhaltsverzeichnis: Seite: Vorkenntnisse: 1 Laung, Teillaung, Oxiationszahl, Formale Laung 2 Atombinung, Nichtmetalle, Valenzelektronen, Binene
Arbeitsheft Ionische Reaktionsmechanismen Inhalt Jakob 1 Inhaltsverzeichnis: Seite: Vorkenntnisse: 1 Laung, Teillaung, Oxiationszahl, Formale Laung 2 Atombinung, Nichtmetalle, Valenzelektronen, Binene
Übungen Kapitel 1 Alkane- Radikalische Substitution
 Übungen Kapitel 1 Alkane- Radikalische Substitution 1. Ein Gemisch aus Halogen und Alkan reagiert bei Bestrahlung mit UV- Licht oder höheren Temperaturen (Bsp. die Gase Methan und Chlor erst bei 250-400
Übungen Kapitel 1 Alkane- Radikalische Substitution 1. Ein Gemisch aus Halogen und Alkan reagiert bei Bestrahlung mit UV- Licht oder höheren Temperaturen (Bsp. die Gase Methan und Chlor erst bei 250-400
Reaktionstypen der Aliphate
 Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
H δ+ H H H H. Addition von HBr an Ethen. Zufällig kommt ein HBr-Molekül in die Nähe der elektronenreichen Doppelbindung. Schritt 1
 hemie Q1 / 4. Reaktionswege der Organik / 4.2 Alkene und elektrophile Addition Addition von an Ethen Schritt 1 1/ Zufällig kommt ein -Molekül in die Nähe der elektronenreichen δ- δ+ Ulrich elmich 2015
hemie Q1 / 4. Reaktionswege der Organik / 4.2 Alkene und elektrophile Addition Addition von an Ethen Schritt 1 1/ Zufällig kommt ein -Molekül in die Nähe der elektronenreichen δ- δ+ Ulrich elmich 2015
Alkene 1975/III Äthan und Athen reagieren mit Brom! a) Unter welchen Versuchsbedingungen laufen diese Reaktionen ab? b) Formulieren Sie die
 Alkene 1975/III Äthan und Athen reagieren mit Brom! a) Unter welchen Versuchsbedingungen laufen diese Reaktionen ab? b) Formulieren Sie die Reaktionsgleichungen und benennen Sie die Reaktionsprodukte!
Alkene 1975/III Äthan und Athen reagieren mit Brom! a) Unter welchen Versuchsbedingungen laufen diese Reaktionen ab? b) Formulieren Sie die Reaktionsgleichungen und benennen Sie die Reaktionsprodukte!
Organische Chemie der Freien Universität Berlin. Klausur SS 2007 Teil 2
 rganische Chemie der Freien Universität Berlin C I Grundlagen der rganischen Chemie (LV 21 21a) Klausur SS 27 Teil 2 Verfasser: Prof. Dr..-U. Reißig Datum: 21.7.27 Semester: SS 7 öchstpunktzahl: 2 (in
rganische Chemie der Freien Universität Berlin C I Grundlagen der rganischen Chemie (LV 21 21a) Klausur SS 27 Teil 2 Verfasser: Prof. Dr..-U. Reißig Datum: 21.7.27 Semester: SS 7 öchstpunktzahl: 2 (in
Chemisches Praktikum für Studierende der Humanmedizin, der Zahnheilkunde und Biologie/Lehramt
 Chemisches Praktikum für Studierende der umanmedizin, der Zahnheilkunde und Biologie/Lehramt Fachbereich Chemie der Philipps-Universität Marburg 2. Klausur zum 2. Praktikumsteil (C) vom 25.07.17 NAME;
Chemisches Praktikum für Studierende der umanmedizin, der Zahnheilkunde und Biologie/Lehramt Fachbereich Chemie der Philipps-Universität Marburg 2. Klausur zum 2. Praktikumsteil (C) vom 25.07.17 NAME;
Vorlesung Organische Chemie II, Teil 2, WS 2008/09. Trainings-Aufgabenset Nr. 3: Eliminierungsreaktionen
 Vorlesung rganische Chemie II, Teil 2, WS 2008/09 rof. r. Christoph A. Schalley Trainings-Aufgabenset r. 3: Eliminierungsreaktionen Aufgabe 1 a) Welche drei prototypische Eliminierungsmechanismen kennen
Vorlesung rganische Chemie II, Teil 2, WS 2008/09 rof. r. Christoph A. Schalley Trainings-Aufgabenset r. 3: Eliminierungsreaktionen Aufgabe 1 a) Welche drei prototypische Eliminierungsmechanismen kennen
Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen.
 1 Übung 13 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen. Ms: Mesyl-Gruppe (CH 3 SO 3 -), Tf: Triflyl-Gruppe (CF 3 SO 3 -), Ts:
1 Übung 13 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen. Ms: Mesyl-Gruppe (CH 3 SO 3 -), Tf: Triflyl-Gruppe (CF 3 SO 3 -), Ts:
Name, Vorname: Matrikelnummer: Studienrichtung: Fragen auf den folgenden Seiten: Musterlösung zur Klausur zur Experimentalvorlesung Organische Chemie
 rganisch-chemisches nstitut Fakultät für Chemie und Geowissenschaften Universität eidelberg 23. Juni 2015 Musterlösung zur Klausur zur Experimentalvorlesung rganische Chemie von Prof. Stephen ashmi Name,
rganisch-chemisches nstitut Fakultät für Chemie und Geowissenschaften Universität eidelberg 23. Juni 2015 Musterlösung zur Klausur zur Experimentalvorlesung rganische Chemie von Prof. Stephen ashmi Name,
Klausur zur Vorlesung Bioorganische Chemie für Studenten der Biologie, der Bioinformatik, Lehramt (L2) und Nebenfächer (
 Klausur zur Vorlesung Bioorganische Chemie für Studenten der Biologie, der Bioinformatik, Lehramt (L2) und ebenfächer ( 05.07.2012, 8 10 Uhr ) Erreichbare Punkte: max. 100 Prof. Dr. J. Engels / Dr. Th.
Klausur zur Vorlesung Bioorganische Chemie für Studenten der Biologie, der Bioinformatik, Lehramt (L2) und ebenfächer ( 05.07.2012, 8 10 Uhr ) Erreichbare Punkte: max. 100 Prof. Dr. J. Engels / Dr. Th.
5. Aromatische Kohlenwasserstoffe
 Inhalt Index 5. Aromatische Kohlenwasserstoffe Aufgrund der starken Aromas, das viele Benzolderivate ausströmen, nennt man sie aromatische Verbindungen. Deshalb gilt Benzol als Stammverbindung der Aromaten.
Inhalt Index 5. Aromatische Kohlenwasserstoffe Aufgrund der starken Aromas, das viele Benzolderivate ausströmen, nennt man sie aromatische Verbindungen. Deshalb gilt Benzol als Stammverbindung der Aromaten.
Ein kurzer Hinweis vorab:
 Ein kurzer inweis vorab: Die Folien 1 18 sind lediglich eine lockere Einführung in die Materie. Konzentriert lesen und mitdenken sollten Sie ab Folie 19. und ein Ratschlag für diejenigen, die massive Probleme
Ein kurzer inweis vorab: Die Folien 1 18 sind lediglich eine lockere Einführung in die Materie. Konzentriert lesen und mitdenken sollten Sie ab Folie 19. und ein Ratschlag für diejenigen, die massive Probleme
Organische Synthese. Sommersemester 2015 Technische Universität München. Nachholklausur am
 Organische Synthese Sommersemester 2015 Technische Universität München Nachholklausur am 30.09.2015 Name, Vorname... Matrikel-Nr.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie
Organische Synthese Sommersemester 2015 Technische Universität München Nachholklausur am 30.09.2015 Name, Vorname... Matrikel-Nr.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie
3. Übungsblatt. Organische Chemie für Studierende mit Nebenfach Chemie
 Allgemeine und Anorganische Chemie 3. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Beschreiben Sie den Reaktionsmechanismus einer S N 1- und einer S N 2- Reaktion. 2.
Allgemeine und Anorganische Chemie 3. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Beschreiben Sie den Reaktionsmechanismus einer S N 1- und einer S N 2- Reaktion. 2.
Bitte beachten Sie die Folgendes: WICHTIG:
 Institut für Chemie und Biochemie der Freien Universität Berlin Nachklausur zur Vorlesung OC I - Teil 1 Datum: 23.09.2013 Verfasser: Prof. Dr. Christoph Schalley Höchstpunktzahl 100 Erreichte Punkte: WICHTIG:
Institut für Chemie und Biochemie der Freien Universität Berlin Nachklausur zur Vorlesung OC I - Teil 1 Datum: 23.09.2013 Verfasser: Prof. Dr. Christoph Schalley Höchstpunktzahl 100 Erreichte Punkte: WICHTIG:
Übung zu den Vorlesungen Organische und Anorganische Chemie
 Übung zu den Vorlesungen Organische und Anorganische Chemie für Biologen und Humanbiologen 12.11.08 1. Stellen sie die Reaktionsgleichung für die Herstellung von Natriumsulfid aus den Elementen auf. Wieviel
Übung zu den Vorlesungen Organische und Anorganische Chemie für Biologen und Humanbiologen 12.11.08 1. Stellen sie die Reaktionsgleichung für die Herstellung von Natriumsulfid aus den Elementen auf. Wieviel
Fragen aus dem ersten Abschnitt der pharmazeutischen Prüfung
 Agenda Molekül der Woche Fragen aus dem ersten Abschnitt der pharmazeutischen Prüfung Elektrophile und nucleophile Substitution am Aromaten Molekül der Woche Rolle von Kathepsin K bei der Knochenresorption
Agenda Molekül der Woche Fragen aus dem ersten Abschnitt der pharmazeutischen Prüfung Elektrophile und nucleophile Substitution am Aromaten Molekül der Woche Rolle von Kathepsin K bei der Knochenresorption
Carbonyle. Inhalt des Tutoriums
 Carbonyle Inhalt des Tutoriums a. Welche funktionellen Gruppen werden unter dem Begriff Carbonyle zusammengefasst? Welche allgemeinen Eigenschaften (Elektronendichte, Oxidationsstufen) besitzen diese Verbindungen?
Carbonyle Inhalt des Tutoriums a. Welche funktionellen Gruppen werden unter dem Begriff Carbonyle zusammengefasst? Welche allgemeinen Eigenschaften (Elektronendichte, Oxidationsstufen) besitzen diese Verbindungen?
Institut für Chemie und Biochemie
 Institut für Chemie und Biochemie der Freien Universität Berlin 2. Klausur zur Vorlesung OC I 17.02.2014 Prof. Dr. Christoph Schalley Höchstpunktzahl: 100 Davon erreicht Bitte füllen Sie den nachfolgenden
Institut für Chemie und Biochemie der Freien Universität Berlin 2. Klausur zur Vorlesung OC I 17.02.2014 Prof. Dr. Christoph Schalley Höchstpunktzahl: 100 Davon erreicht Bitte füllen Sie den nachfolgenden
Lösungen 3. Übungsblatt SS 2002
 Lösungen 3. Übungsblatt SS 2002 1. Aufgabe: omenklatur und Stereochemie a) (E)-7-(S)-om-4-nonen-2-on b) H 3- Methoxy-4-methyl-benzaldehyd 2. Aufgabe: Alkene a) A B C D E Stabilitätsbeeinflussende Faktoren
Lösungen 3. Übungsblatt SS 2002 1. Aufgabe: omenklatur und Stereochemie a) (E)-7-(S)-om-4-nonen-2-on b) H 3- Methoxy-4-methyl-benzaldehyd 2. Aufgabe: Alkene a) A B C D E Stabilitätsbeeinflussende Faktoren
SCHRIFTLICHE ABITURPRÜFUNG 2006 CHEMIE (Grundkursniveau)
 CHEMIE (Grundkursniveau) Einlesezeit: Bearbeitungszeit: 30 Minuten 210 Minuten Der Prüfling wählt je ein Thema aus den Gebieten G (Grundlagen) und V (Vertiefung) zur Bearbeitung aus. Die zwei zur Bewertung
CHEMIE (Grundkursniveau) Einlesezeit: Bearbeitungszeit: 30 Minuten 210 Minuten Der Prüfling wählt je ein Thema aus den Gebieten G (Grundlagen) und V (Vertiefung) zur Bearbeitung aus. Die zwei zur Bewertung
13. Amine und ihre Derivate
 Inhalt Index 13. Amine und ihre Derivate Amine sind Derivate des Ammoniaks, bei dem ein bis drei Wasserstoffatome durch Alkyloder Arylgruppen ersetzt wurden. Entsprechend gibt es primäre Amine, sekundäre
Inhalt Index 13. Amine und ihre Derivate Amine sind Derivate des Ammoniaks, bei dem ein bis drei Wasserstoffatome durch Alkyloder Arylgruppen ersetzt wurden. Entsprechend gibt es primäre Amine, sekundäre
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Jan Schäfer Name: Johannes Hergt Datum: 23.11.2010 Gruppe 4: Aromaten Versuch (elektr.
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Jan Schäfer Name: Johannes Hergt Datum: 23.11.2010 Gruppe 4: Aromaten Versuch (elektr.
