ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
|
|
|
- Sofie Schenck
- vor 8 Jahren
- Abrufe
Transkript
1 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1
2 1. BEZEICHNUNG DES ARZNEIMITTELS Afinitor 5 mg Tabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Jede Tablette enthält 5 mg Everolimus. Sonstige Bestandteile Jede Tablette enthält 149 mg Lactose. Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt DARREICHUNGSFORM Tablette Weiße bis leicht gelbliche, längliche Tabletten mit abgeschrägten Kanten, ohne Bruchkerbe, mit der Prägung 5 auf der einen und NVR auf der anderen Seite. 4. KLINISCHE ANGABEN 4.1 Anwendungsgebiete Afinitor ist zur Behandlung von Patienten mit fortgeschrittenem Nierenzellkarzinom indiziert, bei denen es während oder nach einer gegen VEGF gerichteten Therapie zu einer Krankheitsprogression kommt. 4.2 Dosierung, Art und Dauer der Anwendung Die Behandlung mit Afinitor sollte von einem Arzt eingeleitet und überwacht werden, der Erfahrung in der Anwendung von Krebstherapien besitzt. Dosierung Die empfohlene Dosis beträgt 10 mg Everolimus einmal täglich. Die Behandlung sollte fortgesetzt werden, solange ein klinischer Nutzen beobachtet wird oder bis inakzeptable toxische Nebenwirkungen auftreten. Dosisanpassung bei Nebenwirkungen Die Therapie von schwerwiegenden und/oder inakzeptablen vermuteten Nebenwirkungen kann eine Anpassung der Dosierung erfordern. Die Behandlung mit Afinitor kann mit einer reduzierten Dosis erfolgen oder vorübergehend (z. B. für eine Woche) unterbrochen und anschließend mit 5 mg täglich wieder aufgenommen werden. Sollte eine Dosisreduktion notwendig sein, beträgt die empfohlene tägliche Dosis 5 mg (siehe auch Abschnitt 4.4). Besondere Patientengruppen Pädiatrische Patienten (<18 Jahre) Afinitor wird nicht empfohlen für die Anwendung bei Kindern und Jugendlichen aufgrund des Fehlens von Daten zur Unbedenklichkeit und Wirksamkeit. Ältere Patienten ( 65 Jahre) Es ist keine Dosisanpassung erforderlich (siehe Abschnitt 5.2). 2
3 Eingeschränkte Nierenfunktion Es ist keine Dosisanpassung erforderlich (siehe Abschnitt 5.2). Eingeschränkte Leberfunktion Bei Patienten mit mäßig eingeschränkter Leberfunktion (Child-Pugh Klasse B) sollte die tägliche Dosis auf 5 mg reduziert werden. Everolimus wurde nicht bei Patienten mit stark eingeschränkter Leberfunktion (Child-Pugh Klasse C) geprüft. Daher wird die Anwendung für diese Patientengruppe nicht empfohlen (siehe Abschnitte 4.4 und 5.2). Art der Anwendung Afinitor sollte einmal täglich immer zur gleichen Tageszeit und dann immer entweder während oder außerhalb der Mahlzeiten eingenommen werden (siehe Abschnitt 5.2). Die Afinitor-Tabletten sollten im Ganzen mit einem Glas Wasser geschluckt werden. Die Tabletten dürfen nicht zerkaut oder zerstoßen werden. Wenn eine Dosis versäumt wurde, soll der Patient die Einnahme nicht nachholen, sondern die nächste vorgeschriebene Dosis wie gewohnt einnehmen. 4.3 Gegenanzeigen Überempfindlichkeit gegen den Wirkstoff, andere Rapamycin-Derivate oder einen der sonstigen Bestandteile. 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Nicht infektiöse Pneumonitis Bei der nicht infektiösen Pneumonitis handelt es sich um einen Klasseneffekt der Rapamycin- Derivate, einschließlich Afinitor. Fälle von nicht infektiöser Pneumonitis (einschließlich interstitieller Lungenerkrankung) wurden bei 12% der Patienten unter Afinitor beschrieben (siehe Abschnitt 4.8). Einige Krankheitsfälle waren schwerwiegend und verliefen vereinzelt tödlich. Die Diagnose einer nicht infektiösen Pneumonitis sollte bei Patienten in Betracht gezogen werden, die unspezifische respiratorische Anzeichen und Symptome wie Hypoxie, Pleuraerguss, Husten oder Dyspnoe zeigen, und bei welchen infektiöse, neoplastische oder andere nicht medizinische Ursachen durch entsprechende Untersuchungen ausgeschlossen wurden. Die Patienten sollten angewiesen werden, alle neu auftretenden oder sich verschlechternden respiratorischen Symptome unverzüglich zu melden. Bei Patienten, die radiologisch sichtbare Veränderungen entwickeln, welche auf eine nicht infektiöse Pneumonitis hindeuten, jedoch wenige oder keine Symptome zeigen, kann die Behandlung mit Afinitor ohne Dosisänderung fortgesetzt werden. Wenn mäßige Symptome auftreten, sollte eine Unterbrechung der Behandlung erwogen werden, bis eine Besserung der Symptome eingetreten ist. Der Einsatz von Kortikosteroiden kann angezeigt sein. Danach kann die Behandlung mit Afinitor mit 5 mg täglich wieder aufgenommen werden. In Fällen schwerer Symptome einer nicht infektiösen Pneumonitis sollte die Behandlung mit Afinitor abgesetzt werden. Der Einsatz von Kortikosteroiden kann bis zum Verschwinden der klinischen Symptome angezeigt sein. Danach kann die Behandlung mit Afinitor entsprechend der individuellen klinischen Situation mit 5 mg täglich wieder aufgenommen werden. Infektionen Afinitor hat immunsuppressive Eigenschaften und kann Infektionen, vor allem Infektionen mit opportunistischen pathogenen Keimen, begünstigen (siehe Abschnitt 4.8). Lokale und systemische Infektionen, z. B. Pneumonie, andere bakterielle Infektionen und invasive Pilzinfektionen wie Aspergillose oder Candidiasis sind bei Patienten unter Afinitor beschrieben worden. Einige dieser Infektionen waren schwerwiegend (z. B. bis hin zu respiratorischer Insuffizienz) und verliefen vereinzelt tödlich. Ärzte und Patienten sollten über das erhöhte Infektionsrisiko während einer 3
4 Therapie mit Afinitor informiert sein, aufmerksam auf Anzeichen einer Infektion achten und umgehend mit einer entsprechenden Behandlung beginnen. Bestehende Infektionen sollten entsprechend behandelt werden und völlig abgeklungen sein, bevor die Therapie mit Afinitor begonnen wird. Wenn eine invasive systemische Pilzinfektion diagnostiziert wird, ist die Behandlung sofort und endgültig abzubrechen und der Patient mit einer entsprechenden antimykotischen Therapie zu behandeln. Überempfindlichkeitsreaktionen Überempfindlichkeitsreaktionen, die sich durch Symptome wie Anaphylaxie, Atemnot, Hitzewallungen, Schmerzen in der Brust oder Angioödeme (z. B. Anschwellen der Atemwege oder der Zunge mit oder ohne Verschlechterung der Atemfunktion) äußern, aber nicht darauf beschränkt sind, wurden im Zusammenhang mit Everolimus beobachtet (siehe Abschnitt 4.3). Orale Ulzerationen Bei Patienten unter Afinitor wurden Mundulzera, Stomatitis und orale Mukositis beobachtet (siehe Abschnitt 4.8). In diesen Fällen empfiehlt sich eine topische Behandlung, wobei alkohol- oder peroxidhaltige Mundspülungen vermieden werden sollten, da sie den Zustand verschlechtern können. Antimykotika sollten nur eingesetzt werden, wenn eine Pilzinfektion diagnostiziert worden ist (siehe Abschnitt 4.5). Labortests und Überwachung Nierenfunktion In klinischen Studien wurde über einen meist geringfügigen Anstieg des Serum-Kreatinins berichtet (siehe Abschnitt 4.8). Die Überwachung der Nierenfunktion, einschließlich Messungen von Blut-Harnstoff-Stickstoff (BUN) und Serum-Kreatinin, wird vor Behandlungsbeginn mit Afinitor und danach in regelmäßigen Intervallen empfohlen. Serumglukose und Lipide In klinischen Studien wurde über Hyperglykämie, Hyperlipidämie und Hypertriglyzeridämie berichtet (siehe Abschnitt 4.8). In der Mehrzahl der Fälle von Hyperglykämie wiesen die Patienten bereits vor Behandlungsbeginn mit Afinitor einen abnormen Nüchtern-Blutglukosespiegel auf. Eine Überwachung der Nüchternglukose vor Behandlungsbeginn mit Afinitor und danach in regelmäßigen Intervallen wird empfohlen. Wenn möglich, sollte vor Behandlungsbeginn mit Afinitor eine optimale glykämische Kontrolle erreicht werden. Hämatologische Parameter In klinischen Studien kam es zu einer Abnahme von Hämoglobin, Lymphozyten, neutrophilen Granulozyten und Thrombozyten (siehe Abschnitt 4.8). Eine Kontrolle des Differentialblutbildes vor Behandlungsbeginn mit Afinitor und danach in regelmäßigen Intervallen wird empfohlen. Wechselwirkungen Die gleichzeitige Gabe von Inhibitoren und Induktoren von CYP3A4 und/oder des Multidrug- Resistance-Proteins p-glycoprotein (p-gp) sollte vermieden werden. Wenn die gleichzeitige Gabe eines moderaten CYP3A4- und/oder p-gp-inhibitors nicht vermieden werden kann, kann eine Dosisanpassung von Afinitor auf der Grundlage der vorausberechneten AUC erwogen werden (siehe Abschnitt 4.5). Die gleichzeitige Behandlung mit starken CYP3A4-Inhibitoren führt zu drastisch erhöhten Plasmakonzentrationen von Everolimus (siehe Abschnitt 4.5). Zurzeit gibt es keine ausreichenden Daten, die in dieser Situation Dosierungsempfehlungen erlauben würden. Die gleichzeitige Behandlung mit Afinitor und starken Inhibitoren wird daher nicht empfohlen. Eingeschränkte Leberfunktion Afinitor sollte bei Patienten mit stark eingeschränkter Leberfunktion (Child-Pugh Klasse C) nicht angewendet werden (siehe Abschnitte 4.2 und 5.2). 4
5 Impfungen Der Einsatz von Lebendimpfstoffen sollte während der Behandlung mit Afinitor vermieden werden (siehe Abschnitt 4.5). Lactose Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose- Malabsorption sollten dieses Arzneimittel nicht anwenden. Komplikationen bei der Wundheilung Eine verzögerte Wundheilung ist ein Klasseneffekt von Rapamycin-Derivaten, einschließlich Afinitor. Daher ist perioperativ Vorsicht bei der Anwendung von Afinitor geboten. 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Everolimus ist ein CYP3A4-Substrat und außerdem ein Substrat und mäßiger Inhibitor des p-gp. Deshalb kann die Absorption und anschließende Elimination von Everolimus durch Produkte beeinflusst werden, die auf CYP3A4 und/oder p-gp wirken. In vitro wirkt Everolimus als kompetitiver Inhibitor von CYP3A4 und als gemischter Inhibitor von CYP2D6. In Tabelle 1 sind bekannte und theoretische Wechselwirkungen mit ausgewählten CYP3A4- und p-gp-inhibitoren und -Induktoren gelistet. CYP3A4- und p-gp-inhibitoren, die die Blutkonzentrationen von Everolimus erhöhen Substanzen, die CYP3A4- oder p-gp-inhibitoren sind, können durch Reduktion des Metabolismus oder den Efflux von Everolimus aus intestinalen Zellen die Blutkonzentrationen von Everolimus erhöhen. CYP3A4- und p-gp-induktoren, die die Blutkonzentrationen von Everolimus vermindern Substanzen, die CYP3A4- oder p-gp-induktoren sind, können die Blutkonzentrationen von Everolimus durch Erhöhung des Metabolismus oder des Effluxes von Everolimus aus intestinalen Zellen vermindern. Tabelle 1 Wirkungen von anderen Wirkstoffen auf Everolimus Wirkstoff nach Wechselwirkung Wechselwirkung Änderung der AUC/C max von Everolimus Geometrisches Durchschnittsverhältnis (beobachteter Bereich) Empfehlungen bezüglich gleichzeitiger Gabe Starke CYP3A4-/p-GP-Inhibitoren Ketoconazol AUC 15,3-fach (Bereich 11,2-22,5) C max 4,1-fach (Bereich 2,6-7,0) Itraconazol, Posaconazol, Nicht untersucht. Starker Anstieg Voriconazol der Everolimus-Blutkonzentration Telithromycin, wird erwartet. Clarithromycin Nefazodon Ritonavir, Atazanavir, Saquinavir, Darunavir, Indinavir, Nelfinavir Die gleichzeitige Behandlung mit Afinitor und starken Inhibitoren wird nicht empfohlen. 5
6 Moderate CYP3A4-/p-GP-Inhibitoren Erythromycin AUC 4,4-fach (Bereich 2,0-12,6) C max 2,0-fach (Bereich 0,9-3,5) Verapamil AUC 3,5-fach (Bereich 2,2-6,3) C max 2,3-fach (Bereich 1,3-3,8) Orales Ciclosporin AUC 2,7-fach (Bereich 1,5-4,7) C max 1,8-fach (Bereich 1,3-2,6) Fluconazol Nicht untersucht. Erhöhte Diltiazem Exposition erwartet. Amprenavir, Nicht untersucht. Erhöhte Fosamprenavir Exposition erwartet. Grapefruitsaft oder andere Lebensmittel, die CYP3A4/p-GP beeinflussen Nicht untersucht. Erhöhte Exposition erwartet (Die Wirkung variiert stark). Starke CYP3A4-Induktoren Rifampicin AUC 63% (Bereich 0-80%) C max 58% (Bereich 10-70%) Carbamazepin, Nicht untersucht. Verminderte Phenobarbital, Phenytoin Efavirenz, Nevirapin Johanniskraut (Hypericum perforatum) Exposition erwartet. Nicht untersucht. Verminderte Exposition erwartet. Nicht untersucht. Stark verminderte Exposition erwartet. Vorsicht ist geboten, wenn die gleichzeitige Gabe von moderaten CYP3A4- oder p-gp-inhibitoren nicht vermieden werden kann. Wenn Patienten die gleichzeitige Gabe eines moderaten CYP3A4- oder p-gp- Inhibitors benötigen, kann eine Dosisreduktion auf 5 mg täglich oder auf 5 mg jeden zweiten Tag erwogen werden. Es gibt jedoch keine klinischen Daten zu dieser Dosisanpassung. Wegen der interindividuellen Schwankungen sind die empfohlenen Dosisanpassungen möglicherweise nicht für alle Patienten optimal. Daher wird eine enge Überwachung der Nebenwirkungen empfohlen. Die Kombination sollte vermieden werden. Die gleichzeitige Gabe von starken CYP3A4-Induktoren sollte vermieden werden. Wenn Patienten die gleichzeitige Gabe eines starken CYP3A4-Induktors benötigen, sollte eine Dosiserhöhung von Afinitor von 10 mg/tag auf bis zu 20 mg/tag in Einzelschritten von 5 mg, gegeben an den Tagen 4 und 8 nach erstmaliger Gabe des Induktors, erwogen werden. Diese Dosis von Afinitor ist berechnet im Hinblick auf die Anpassung der AUC an den Bereich, der ohne Induktoren beobachtet wurde. Es gibt jedoch keine klinischen Daten zu dieser Dosisanpassung. Wenn die Behandlung mit dem starken Induktor abgesetzt wird, sollte zur Afinitor- Dosierung, die vor Beginn der gleichzeitigen Behandlung gegeben wurde, zurückgekehrt werden. Arzneimittel, die Johanniskraut enthalten, sollten während der Behandlung mit Everolimus nicht angewendet werden. 6
7 Substanzen, deren Plasmakonzentrationen durch Everolimus verändert werden können Basierend auf In-vitro-Ergebnissen lassen die systemischen Konzentrationen, die nach täglicher oraler Gabe von 10 mg beobachtet wurden, die Inhibierung von p-gp, CYP3A4 und CYP2D6 unwahrscheinlich erscheinen. Jedoch kann die Inhibierung von CYP3A4 und p-gp im Darm nicht ausgeschlossen werden; daher könnte Everolimus die Bioverfügbarkeit von gleichzeitig gegebenen Stoffen, die CYP3A4- und/oder p-gp-substrate sind, beeinflussen. Impfungen Während der Behandlung mit Afinitor ist die Immunreaktion auf die Impfung möglicherweise beeinträchtigt und Impfungen können deshalb weniger wirksam sein. Der Einsatz von Lebendimpfstoffen sollte während der Behandlung mit Afinitor vermieden werden (siehe Abschnitt 4.4). Beispiele für Lebendimpfstoffe sind: intranasal angewendete Influenza-, Masern-, Mumps-, Röteln-, orale Polio-, BCG (Bacillus Calmette-Guérin)-, Gelbfieber-, Varizellen- und Typhus-TY21a- Vakzine. 4.6 Schwangerschaft und Stillzeit Fertilität Basierend auf präklinischen Ergebnissen könnte es bei der Behandlung mit Afinitor zu einer Einschränkung der männlichen Fertilität kommen (siehe Abschnitt 5.3). Frauen im gebärfähigen Alter Frauen im gebärfähigen Alter müssen während der Behandlung mit Everolimus eine zuverlässige Verhütungsmethode anwenden. Schwangerschaft Es liegen keine oder nur begrenzte Daten für die Verwendung von Everolimus bei Schwangeren vor. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt (siehe Abschnitt 5.3). Die Anwendung von Everolimus während der Schwangerschaft und bei gebärfähigen Frauen, die keine Verhütungsmethode anwenden, wird nicht empfohlen. Stillzeit Es ist nicht bekannt, ob Everolimus beim Menschen in die Muttermilch ausgeschieden wird. Im Tierexperiment gingen Everolimus und/oder seine Metaboliten jedoch leicht in die Milch laktierender Ratten über. Deshalb sollten Frauen, die Everolimus einnehmen, nicht stillen. 4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt. Patienten sind darauf hinzuweisen, bei der Teilnahme am Straßenverkehr und bei der Bedienung von Maschinen vorsichtig zu sein, wenn während der Behandlung mit Afinitor Ermüdung auftritt. 4.8 Nebenwirkungen Die folgenden Daten basieren auf einer randomisierten Phase-III-Studie zur Behandlung des fortgeschrittenen Nierenzellkarzinoms, in der Everolimus (n=274) mit Placebo (n=137) verglichen wurde. Insgesamt wurden 165 Patienten mindestens 4 Monate lang mit einer Tagesdosis von 10 mg Everolimus behandelt. Das mediane Alter der Patienten war 61 Jahre (Bereich Jahre). Die häufigsten Nebenwirkungen Grad 3-4 (Inzidenz 2%) waren verminderte Lymphozytenzahl, erhöhte Glucose, vermindertes Hämoglobin, vermindertes Phosphat, erhöhter Cholesterinwert, Infektionen, Stomatitis, Ermüdung und Pneumonitis. 7
8 Die mediane Dauer der verblindeten Studienbehandlung betrug 141 Tage (Bereich Tage) für Patienten unter Afinitor und 60 Tage (Bereich Tage) für Patienten unter Placebo. Die Rate der Nebenwirkungen, die zu einem dauerhaften Therapieabbruch führten, betrug 7% für die Afinitor- bzw. 0% für die Placebo-Gruppe. Die meisten Nebenwirkungen waren vom Schweregrad 1 oder 2. Tabelle 2 zeigt die Inzidenz der Nebenwirkungen bei Patienten, die mit 10 mg Everolimus/Tag behandelt wurden. Die Nebenwirkungen in Tabelle 2 sind gemäß MedDRA nach Systemorganklasse und Häufigkeit gelistet. Bei der Bewertung werden folgende Häufigkeitsangaben zugrunde gelegt: Sehr häufig ( 1/10); häufig ( 1/100, <1/10); gelegentlich ( 1/1.000, <1/100); selten ( 1/10.000, <1/1.000); sehr selten (<1/10.000); nicht bekannt (auf Grundlage der verfügbaren Daten nicht abschätzbar). Innerhalb jeder Häufigkeitsgruppe werden die Nebenwirkungen nach abnehmendem Schweregrad angegeben. Tabelle 2 Nebenwirkungen Infektionen und parasitäre Erkrankungen Sehr häufig Infektionen a Erkrankungen des Blutes und des Lymphsystems Sehr häufig Verminderte Lymphozytenzahl b, vermindertes Hämoglobin b, verminderte Thrombozytenzahl b, verminderte Neutrophilenzahl b Erkrankungen des Immunsystems Nicht bekannt Hypersensibilität Stoffwechsel- und Ernährungsstörungen Sehr häufig Erhöhte Glucose b, erhöhter Cholesterinwert b, erhöhte Triglyzeride b, vermindertes Phosphat b, Appetitlosigkeit Häufig Dehydratation Gelegentlich Entwicklung eines Diabetes mellitus Psychiatrische Erkrankungen Häufig Schlaflosigkeit Erkrankungen des Nervensystems Sehr häufig Geschmacksstörung Häufig Kopfschmerzen Augenerkrankungen Häufig Konjunktivitis, Ödeme der Augenlider Herzerkrankungen Gelegentlich Herzinsuffizienz Gefäßerkrankungen Häufig Hypertonie Nicht bekannt Blutungen Erkrankungen der Atemwege, des Brustraums und Mediastinums Sehr häufig Pneumonitis c, Dyspnoe, Epistaxis, Husten Häufig Bluthusten Erkrankungen des Gastrointestinaltrakts Sehr häufig Stomatitis d, Durchfall, Mukositis, Erbrechen, Übelkeit Häufig Mundtrockenheit, Abdominalschmerzen, Dysphagie, Dyspepsie Leber- und Gallenerkrankungen Sehr häufig Erhöhte Alaninaminotransferase b, erhöhte Aspartataminotransferase b Häufig Erhöhter Bilirubinwert b Erkrankungen der Haut und des Unterhautzellgewebes Sehr häufig Hautausschlag, Hauttrockenheit, Pruritus Häufig Hand-Fuß-Syndrom, Erythem, Exfoliation, Nagelveränderungen, akneförmige Dermatitis, Brüchigwerden der Nägel Gelegentlich Angioödem Erkrankungen der Nieren und Harnwege Sehr häufig Erhöhter Kreatininwert b 8
9 Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Sehr häufig Ermüdung, Asthenie, peripheres Ödem Häufig Brustschmerzen, Pyrexie Gelegentlich Verzögerte Wundheilung Untersuchungen Häufig Gewichtsverlust a Schließt alle unter die Rubrik Infektionen und parasitäre Erkrankungen fallenden Ereignisse bei systemischen Organklassen ein (wie Pneumonien, Sepsis und opportunistische Infektionen [z. B. Aspergillose und Candidiasis (siehe auch Abschnitt 4.4)]) b Häufigkeit basierend auf der Bestimmung abnormer Laborwerte (als Teil der Routinelaboruntersuchungen) c Beinhaltet Pneumonitis, interstitielle Lungenerkrankung, Lungeninfiltration, pulmonal-alveoläre Blutung, Lungentoxizität und Alveolitis d Beinhaltet Stomatitis und aphthöse Stomatitis sowie Mund- und Zungenulzera 4.9 Überdosierung Die Erfahrung mit Überdosierung beim Menschen ist sehr begrenzt. Die akute Verträglichkeit war bei Gabe von Einzeldosen bis zu 70 mg akzeptabel. In allen Fällen von Überdosierung sollten allgemein unterstützende Maßnahmen eingeleitet werden. 5. PHARMAKOLOGISCHE EIGENSCHAFTEN 5.1 Pharmakodynamische Eigenschaften Pharmakotherapeutische Gruppe: Proteinkinase-Inhibitoren, ATC-Code: L01XE10 Wirkmechanismus Everolimus ist ein selektiver mtor-(mammalian Target of Rapamycin)Inhibitor. mtor besitzt eine Schlüsselfunktion als Serin-Threoninkinase, deren Aktivität bekannterweise bei etlichen humanen Tumoren hochreguliert ist. Everolimus bindet an das intrazelluläre Protein FKBP-12. Dabei wird ein Komplex gebildet, der die Aktivität des mtor-komplex-1 (mtorc1) inhibiert. Die Inhibierung des mtorc1-signalweges interferiert mit der Translation und Synthese von Proteinen, die an der Regulation des Zellzyklus, der Angiogenese und der Glykolyse beteiligt sind, durch Reduktion der Aktivität der S6-ribosomalen Proteinkinase (S6K1) und eukaryotischen Elongationsfaktor-4E- Bindungsproteins (4EBP-1). Everolimus reduziert den Spiegel des vaskulären endothelialen Wachstumsfaktors (VEGF), der die Prozesse der Tumorangiogenese fördert. Everolimus ist ein starker Wachstums- und Proliferationsinhibitor von Tumorzellen, Endothelzellen, Fibroblasten und blutgefäßassoziierten glatten Muskelzellen. Es wurde gezeigt, dass es in vitro und in vivo die Glykolyse in soliden Tumoren vermindert. Klinische Wirksamkeit In einer internationalen, multizentrischen, randomisierten, doppelblinden Phase-III-Studie wurden Patienten mit fortgeschrittenem Nierenzellkarzinom und Krankheitsprogression während oder nach Behandlung mit einem VEGFR-TKI (vaskulärer endothelialer Wachstumsfaktorrezeptor- Tyrosinkinaseinhibitor) (Sunitinib, Sorafenib oder beide, Sunitinib und Sorafenib) mit Everolimus 10 mg/tag oder Placebo behandelt, beides in Verbindung mit bester supportiver Therapie. Als Vorbehandlung waren auch Bevacizumab und Interferon-α erlaubt. Die Patienten wurden nach Risikoscore des Memorial Sloan-Kettering Cancer Center (MSKCC) (günstiges vs. intermediäres vs. hohes Risiko) und der vorausgegangenen Tumortherapie (1 vs. 2 vorausgegangene VEGFR-TKI- Therapien) stratifiziert. Primärer Endpunkt war das progressionsfreie Überleben, dokumentiert gemäß RECIST-Kriterien (Response Evaluation Criteria in Solid Tumours) und bewertet durch verblindete, unabhängige, zentrale Gutachter. Die sekundären Endpunkte beinhalteten Sicherheit, objektive Tumoransprechrate, 9
10 Gesamtüberleben, krankheitsbezogene Symptome und Lebensqualität. Nach einer radiologisch dokumentierten Progression konnten die Patienten durch den Prüfarzt entblindet werden: Die in den Placebo-Arm randomisierten Patienten konnten dann unverblindet mit Everolimus 10 mg/tag behandelt werden. Nach der zweiten Interimsanalyse empfahl das unabhängige Datenüberwachungskomitee (Independent Data Monitoring Committee), die Studie vorzeitig zu beenden, da der primäre Endpunkt erreicht worden war. Insgesamt wurden 416 Patienten im Verhältnis 2:1 in den Afinitor- (n=277) bzw. den Placebo-Arm (n=139) randomisiert. Die demographischen Daten waren gut ausgewogen (gepooltes medianes Alter [61 Jahre; Bereich Jahre], 78% männlich, 88% Kaukasier, Anzahl vorausgegangener VEGFR- TKI-Therapien [1-74%, 2-26%]). Afinitor war Placebo hinsichtlich des primären Endpunkts progressionsfreies Überleben überlegen: Das Progressions- oder Mortalitätsrisiko war statistisch signifikant um 67% vermindert (siehe Tabelle 3 und Abbildung 1). Tabelle 3 Ergebnisse für das progressionsfreie Überleben Population n Afinitor n=277 Primäranalyse Alle (verblindete, unabhängige, zentrale Bewertung) Placebo n=139 Medianes progressionsfreies Überleben (Monate) (95% KI) 416 4,9 (4,0-5,5) 1,9 (1,8-1,9) Unterstützende Analysen/Sensitivitätsanalysen Alle (lokale Bewertung durch Prüfarzt) 416 5,5 (4,6-5,8) 1,9 (1,8-2,2) Risikoscore nach MSKCC (verblindete, unabhängige, zentrale Bewertung) Günstiges Risiko 120 5,8 1,9 (4,0-7,4) (1,9-2,8) Intermediäres Risiko 235 4,5 1,8 (3,8-5,5) (1,8-1,9) Hohes Risiko 61 3,6 1,8 (1,9-4,6) (1,8-3,6) a Stratifizierter Log-Rank-Test Hazard Ratio (95% KI) 0,33 (0,25-0,43) 0,32 (0,25-0,41) 0,31 (0,19-0,50) 0,32 (0,22-0,44) 0,44 (0,22-0,85) p-wert <0,0001 a <0,0001 a <0,0001 <0,0001 0,007 10
11 Abbildung 1 Kaplan-Meier-Kurve des progressionsfreien Überlebens Wahrscheinlichkeit (%) Hazard Ratio = 0,33 95% CI [0,25, 0,43] Zensierungszeitpunkte Everolimus (n/n = 155/277) Placebo (n/n = 111/139) Kaplan-Meier-Mediane Everolimus: 4,90 Monate Placebo: 1,87 Monate Logrank p-werte = <0,0001 Anzahl der verbleibenden Risikopatienten Zeit (Monate) Afinitor Placebo Zeit (Monate) Die PFS-Raten nach sechs Monaten betrugen für Afinitor 36% im Vergleich zu 9% für Placebo. Ein bestätigtes objektives Tumoransprechen wurde bei 5 Patienten (2%) unter Afinitor und bei keinem Patienten unter Placebo beobachtet. Der progressionsfreie Überlebensvorteil spiegelt demnach in erster Linie die Population mit stabilisierter Erkrankung wider (entspricht 67% der Afinitor- Behandlungsgruppe). Es wurden keine statistisch signifikanten behandlungsabhängigen Unterschiede im Gesamtüberleben beobachtet (Hazard Ratio 0,87; Konfidenzintervall 0,65 1,17; p=0,177). Durch den Wechsel vom Placebo-Arm zur unverblindeten Behandlung mit Afinitor nach Krankheitsprogression wurde die Feststellung eines behandlungsabhängigen Unterschieds im Gesamtüberleben verhindert. 5.2 Pharmakokinetische Eigenschaften Absorption Bei Patienten mit fortgeschrittenen soliden Tumoren werden Spitzenkonzentrationen (C max ) von Everolimus bei täglicher oraler Gabe von 5 und 10 mg Everolimus unter Nüchtern-Bedingungen oder nach einem leichten, fettfreien Imbiss nach einer medianen Zeitspanne von einer Stunde erreicht. Die C max ist zwischen 5 und 10 mg dosisproportional. Everolimus ist ein Substrat und mäßiger Inhibitor von p-gp. Beeinflussung durch Nahrung: Bei gesunden Probanden verminderte eine fettreiche Mahlzeit die systemische Exposition gegenüber Afinitor 10 mg (ausgedrückt durch den AUC-Wert) um 22% und die maximale Plasmakonzentration C max um 54%. Bei Einnahme einer leichten Mahlzeit waren die AUC um 32% und die C max um 42% reduziert. Eine Beeinflussung des Konzentrations-Zeit-Profils der Postabsorptionsphase durch die Einnahme von Nahrungsmitteln konnte jedoch nicht festgestellt werden. 11
12 Verteilung Das Blut-Plasma-Verhältnis von Everolimus beträgt im Bereich von 5 bis ng/ml konzentrationsabhängig 17% bis 73%. Ungefähr 20% der Gesamtblutkonzentrationen an Everolimus befindet sich im Plasma von Krebspatienten unter Afinitor 10 mg/tag. Die Plasmaproteinbindung liegt bei Gesunden und Patienten mit mäßigen Leberschädigungen bei ungefähr 74%. Bei Patienten mit fortgeschrittenen soliden Tumoren betrug das Verteilungsvolumen V d für das apparente zentrale Kompartiment 191 l und für das periphere Kompartiment 517 l. Metabolismus Everolimus ist ein Substrat von CYP3A4 und p-gp. Nach oraler Gabe ist Everolimus die wichtigste zirkulierende Komponente im menschlichen Blut. Im menschlichen Blut wurden sechs Hauptmetaboliten von Everolimus nachgewiesen, nämlich drei monohydroxylierte Metaboliten, zwei hydrolytische, ringgeöffnete Produkte und ein Phosphatidylcholin-Konjugat von Everolimus. Diese Metaboliten wurden auch bei Tierspezies in Toxizitätsstudien gefunden und zeigten ungefähr 100-mal weniger Aktivität als Everolimus selbst. Deshalb wird davon ausgegangen, dass Everolimus den Hauptteil zur gesamten pharmakologischen Aktivität beiträgt. Elimination Bei Patienten mit fortgeschrittenen soliden Tumoren war die mittlere CL/F von Everolimus nach Gabe von 10 mg täglich 24,5 l/h. Die mittlere Eliminationshalbwertszeit von Everolimus beträgt etwa 30 Stunden. Es wurden keine spezifischen Exkretionsstudien bei Krebspatienten durchgeführt, jedoch sind Daten aus Studien mit Transplantationspatienten verfügbar. Nach Gabe einer Einzeldosis von radioaktiv markiertem Everolimus zusammen mit Ciclosporin wurden 80% der Radioaktivität in den Fäzes gefunden, während 5% mit dem Urin ausgeschieden wurden. Die Muttersubstanz konnte weder im Urin noch in den Fäzes nachgewiesen werden. Steady-State-Pharmakokinetik Nach Gabe von Everolimus an Patienten mit fortgeschrittenen soliden Tumoren war die Steady-State- AUC 0-τ im Bereich von 5 bis 10 mg/tag dosisproportional. Der Steady-State wurde innerhalb von zwei Wochen erreicht. Die C max ist zwischen 5 und 10 mg dosisproportional. t max wird 1 bis 2 Stunden nach Gabe erreicht. Im Steady-State gab es eine signifikante Korrelation zwischen AUC 0-τ und dem Talspiegel vor der Gabe. Besondere Patientengruppen Eingeschränkte Leberfunktion Die durchschnittliche AUC von Everolimus war bei 8 Patienten mit mäßig eingeschränkter Leberfunktion (Child-Pugh Klasse B) doppelt so hoch wie jene von 8 gesunden Probanden mit normaler Leberfunktion. Die AUC korrelierte positiv mit der Serumbilirubin-Konzentration und einer Verlängerung der Prothrombinzeit und negativ mit der Serumalbumin-Konzentration. Die Auswirkung einer stark eingeschränkten Leberfunktion (Child-Pugh Klasse C) auf die Pharmakokinetik von Everolimus wurde nicht untersucht (siehe Abschnitte 4.2 und 4.4). Eingeschränkte Nierenfunktion In einer populationspharmakokinetischen Analyse von 170 Patienten mit fortgeschrittenen soliden Tumoren wurde kein signifikanter Einfluss der Kreatinin-Clearance ( ml/min) CL/F von Everolimus gefunden. Die Pharmakokinetik von Everolimus wurde durch Nierenschädigungen nach der Transplantation (Bereich der Kreatinin-Clearance ml/min) nicht beeinflusst. Ältere Patienten In einer populationspharmakokinetischen Untersuchung an Krebspatienten wurde keine signifikante Auswirkung des Alters (27-85 Jahre) auf die orale Clearance von Everolimus gefunden. 12
13 Ethnische Zugehörigkeit Die orale Clearance (CL/F) ist bei japanischen und kaukasischen Krebspatienten mit ähnlicher Leberfunktion vergleichbar. Basierend auf einer populationspharmakokinetischen Analyse ist die orale Clearance (CL/F) bei Transplantationspatienten mit schwarzer Hautfarbe im Durchschnitt um 20% höher. 5.3 Präklinische Daten zur Sicherheit Das präklinische Sicherheitsprofil von Everolimus wurde bei Mäusen, Ratten, Zwergschweinen, Affen und Kaninchen untersucht. Die Hauptzielorgane waren männliche und weibliche Fortpflanzungssysteme (Degeneration der Tubuli seminiferi, reduzierte Spermienanzahl in den Nebenhoden und Uterusatrophie) bei mehreren Spezies; Lunge (erhöhte Anzahl von Alveolarmakrophagen) bei Ratten und Mäusen; Pankreas (Degranulation und Vakuolisierung exokriner Zellen bei Affen bzw. Zwergschweinen sowie Degeneration von Inselzellen bei Affen) und Augen (Trübungen des vorderen Nahtsterns der Linse) nur bei Ratten. Geringfügige Nierenveränderungen fanden sich bei Ratten (vermehrte, altersabhängige Lipofuszin-Ablagerungen im Tubulusepithel, vermehrte Hydronephrose) und bei Mäusen (Verschlechterung von Hintergrundläsionen). Es gab keine Hinweise auf Nierentoxizität bei Affen und Zwergschweinen. Everolimus schien Grunderkrankungen (chronische Myokarditis bei Ratten, Coxsackie-Virus- Infektionen im Plasma und im Herzen bei Affen, Kokzidienbefall im Gastrointestinaltrakt bei Zwergschweinen, Hautläsionen bei Mäusen und Affen) spontan zu verschlechtern. Diese Erscheinungen wurden im Allgemeinen bei systemischen Expositionen im Bereich der therapeutischen Exposition oder darüber beobachtet, mit Ausnahme der Befunde bei Ratten, die aufgrund einer hohen Gewebeverteilung unterhalb der therapeutischen Exposition auftraten. In einer Studie zur männlichen Fertilität an Ratten zeigte sich ab einer Dosierung von 0,5 mg/kg ein Effekt auf die Hodenmorphologie. Die Spermienbeweglichkeit, die Spermienzahl und die Plasma- Testosteronspiegel waren ab 5 mg/kg, im Bereich der therapeutischen Exposition, vermindert und führten zu einer Abnahme der männlichen Fertilität. Es gab Anzeichen auf eine Reversibilität. Die weibliche Fertilität war nicht beeinflusst, Everolimus konnte aber die Plazentarschranke überwinden und hatte eine toxische Wirkung auf den Fetus. Bei Ratten verursachte Everolimus bei systemischer Exposition unterhalb der therapeutischen Exposition Embryo-/Fetotoxizität, welche sich als Mortalität und vermindertes Gewicht des Fetus manifestierte. Die Inzidenz von Skelettveränderungen und Missbildungen (z. B. Sternumspalte) war bei Dosen von 0,3 und 0,9 mg/kg erhöht. Bei Kaninchen wurde Embryotoxizität in Form einer erhöhten Häufigkeit von Resorptionen im späten Stadium beobachtet. Genotoxizitätsstudien mit relevanten genotoxischen Endpunkten zeigten keine Hinweise auf eine klastogene oder mutagene Aktivität. Bei einer Gabe von Everolimus an Mäuse und Ratten für eine Dauer von bis zu zwei Jahren zeigte sich kein onkogenes Potential bis zu den höchsten Dosen, die dem 4,3- bzw. 0,2-fachen der geschätzten klinischen Exposition entsprachen. 6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile Butylhydroxytoluol (E321) Magnesiumstearat Lactose-Monohydrat Hypromellose Crospovidon Typ A Lactose 13
14 6.2 Inkompatibilitäten Nicht zutreffend. 6.3 Dauer der Haltbarkeit 2 Jahre 6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung In der Originalverpackung aufbewahren, um den Inhalt vor Licht und Feuchtigkeit zu schützen. 6.5 Art und Inhalt des Behältnisses Aluminium/Polyamid/Aluminium/PVC-Blisterpackung mit 10 Tabletten. Packungen zu 30, 60 oder 90 Tabletten. Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht. 6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung Keine besonderen Anforderungen. 7. INHABER DER ZULASSUNG Novartis Europharm Limited Wimblehurst Road Horsham West Sussex, RH12 5AB Vereinigtes Königreich 8. ZULASSUNGSNUMMER(N) EU/0/00/000/ DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG 10. STAND DER INFORMATION 14
15 1. BEZEICHNUNG DES ARZNEIMITTELS Afinitor 10 mg Tabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Jede Tablette enthält 10 mg Everolimus. Sonstige Bestandteile Jede Tablette enthält 297 mg Lactose. Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt DARREICHUNGSFORM Tablette Weiße bis leicht gelbliche, längliche Tabletten mit abgeschrägten Kanten, ohne Bruchkerbe, mit der Prägung UHE auf der einen und NVR auf der anderen Seite. 4. KLINISCHE ANGABEN 4.1 Anwendungsgebiete Afinitor ist zur Behandlung von Patienten mit fortgeschrittenem Nierenzellkarzinom indiziert, bei denen es während oder nach einer gegen VEGF gerichteten Therapie zu einer Krankheitsprogression kommt. 4.2 Dosierung, Art und Dauer der Anwendung Die Behandlung mit Afinitor sollte von einem Arzt eingeleitet und überwacht werden, der Erfahrung in der Anwendung von Krebstherapien besitzt. Dosierung Die empfohlene Dosis beträgt 10 mg Everolimus einmal täglich. Die Behandlung sollte fortgesetzt werden, solange ein klinischer Nutzen beobachtet wird oder bis inakzeptable toxische Nebenwirkungen auftreten. Dosisanpassung bei Nebenwirkungen Die Therapie von schwerwiegenden und/oder inakzeptablen vermuteten Nebenwirkungen kann eine Anpassung der Dosierung erfordern. Die Behandlung mit Afinitor kann mit einer reduzierten Dosis erfolgen oder vorübergehend (z. B. für eine Woche) unterbrochen und anschließend mit 5 mg täglich wieder aufgenommen werden. Sollte eine Dosisreduktion notwendig sein, beträgt die empfohlene tägliche Dosis 5 mg (siehe auch Abschnitt 4.4). Besondere Patientengruppen Pädiatrische Patienten (<18 Jahre) Afinitor wird nicht empfohlen für die Anwendung bei Kindern und Jugendlichen aufgrund des Fehlens von Daten zur Unbedenklichkeit und Wirksamkeit. Ältere Patienten ( 65 Jahre) Es ist keine Dosisanpassung erforderlich (siehe Abschnitt 5.2). 15
16 Eingeschränkte Nierenfunktion Es ist keine Dosisanpassung erforderlich (siehe Abschnitt 5.2). Eingeschränkte Leberfunktion Bei Patienten mit mäßig eingeschränkter Leberfunktion (Child-Pugh Klasse B) sollte die tägliche Dosis auf 5 mg reduziert werden. Everolimus wurde nicht bei Patienten mit stark eingeschränkter Leberfunktion (Child-Pugh Klasse C) geprüft. Daher wird die Anwendung für diese Patientengruppe nicht empfohlen (siehe Abschnitte 4.4 und 5.2). Art der Anwendung Afinitor sollte einmal täglich immer zur gleichen Tageszeit und dann immer entweder während oder außerhalb der Mahlzeiten eingenommen werden (siehe Abschnitt 5.2). Die Afinitor-Tabletten sollten im Ganzen mit einem Glas Wasser geschluckt werden. Die Tabletten dürfen nicht zerkaut oder zerstoßen werden. Wenn eine Dosis versäumt wurde, soll der Patient die Einnahme nicht nachholen, sondern die nächste vorgeschriebene Dosis wie gewohnt einnehmen. 4.3 Gegenanzeigen Überempfindlichkeit gegen den Wirkstoff, andere Rapamycin-Derivate oder einen der sonstigen Bestandteile. 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Nicht infektiöse Pneumonitis Bei der nicht infektiösen Pneumonitis handelt es sich um einen Klasseneffekt der Rapamycin- Derivate, einschließlich Afinitor. Fälle von nicht infektiöser Pneumonitis (einschließlich interstitieller Lungenerkrankung) wurden bei 12% der Patienten unter Afinitor beschrieben (siehe Abschnitt 4.8). Einige Krankheitsfälle waren schwerwiegend und verliefen vereinzelt tödlich. Die Diagnose einer nicht infektiösen Pneumonitis sollte bei Patienten in Betracht gezogen werden, die unspezifische respiratorische Anzeichen und Symptome wie Hypoxie, Pleuraerguss, Husten oder Dyspnoe zeigen, und bei welchen infektiöse, neoplastische oder andere nicht medizinische Ursachen durch entsprechende Untersuchungen ausgeschlossen wurden. Die Patienten sollten angewiesen werden, alle neu auftretenden oder sich verschlechternden respiratorischen Symptome unverzüglich zu melden. Bei Patienten, die radiologisch sichtbare Veränderungen entwickeln, welche auf eine nicht infektiöse Pneumonitis hindeuten, jedoch wenige oder keine Symptome zeigen, kann die Behandlung mit Afinitor ohne Dosisänderung fortgesetzt werden. Wenn mäßige Symptome auftreten, sollte eine Unterbrechung der Behandlung erwogen werden, bis eine Besserung der Symptome eingetreten ist. Der Einsatz von Kortikosteroiden kann angezeigt sein. Danach kann die Behandlung mit Afinitor mit 5 mg täglich wieder aufgenommen werden. In Fällen schwerer Symptome einer nicht infektiösen Pneumonitis sollte die Behandlung mit Afinitor abgesetzt werden. Der Einsatz von Kortikosteroiden kann bis zum Verschwinden der klinischen Symptome angezeigt sein. Danach kann die Behandlung mit Afinitor entsprechend der individuellen klinischen Situation mit 5 mg täglich wieder aufgenommen werden. Infektionen Afinitor hat immunsuppressive Eigenschaften und kann Infektionen, vor allem Infektionen mit opportunistischen pathogenen Keimen, begünstigen (siehe Abschnitt 4.8). Lokale und systemische Infektionen, z. B. Pneumonie, andere bakterielle Infektionen und invasive Pilzinfektionen wie Aspergillose oder Candidiasis sind bei Patienten unter Afinitor beschrieben worden. Einige dieser Infektionen waren schwerwiegend (z. B. bis hin zu respiratorischer Insuffizienz) und verliefen vereinzelt tödlich. Ärzte und Patienten sollten über das erhöhte Infektionsrisiko während einer Therapie mit Afinitor informiert sein, aufmerksam auf Anzeichen einer Infektion achten und umgehend mit einer entsprechenden Behandlung beginnen. 16
17 Bestehende Infektionen sollten entsprechend behandelt werden und völlig abgeklungen sein, bevor die Therapie mit Afinitor begonnen wird. Wenn eine invasive systemische Pilzinfektion diagnostiziert wird, ist die Behandlung sofort und endgültig abzubrechen und der Patient mit einer entsprechenden antimykotischen Therapie zu behandeln. Überempfindlichkeitsreaktionen Überempfindlichkeitsreaktionen, die sich durch Symptome wie Anaphylaxie, Atemnot, Hitzewallungen, Schmerzen in der Brust oder Angioödeme (z. B. Anschwellen der Atemwege oder der Zunge mit oder ohne Verschlechterung der Atemfunktion) äußern, aber nicht darauf beschränkt sind, wurden im Zusammenhang mit Everolimus beobachtet (siehe Abschnitt 4.3). Orale Ulzerationen Bei Patienten unter Afinitor wurden Mundulzera, Stomatitis und orale Mukositis beobachtet (siehe Abschnitt 4.8). In diesen Fällen empfiehlt sich eine topische Behandlung, wobei alkohol- oder peroxidhaltige Mundspülungen vermieden werden sollten, da sie den Zustand verschlechtern können. Antimykotika sollten nur eingesetzt werden, wenn eine Pilzinfektion diagnostiziert worden ist (siehe Abschnitt 4.5). Labortests und Überwachung Nierenfunktion In klinischen Studien wurde über einen meist geringfügigen Anstieg des Serum-Kreatinins berichtet (siehe Abschnitt 4.8). Die Überwachung der Nierenfunktion, einschließlich Messungen von Blut-Harnstoff-Stickstoff (BUN) und Serum-Kreatinin, wird vor Behandlungsbeginn mit Afinitor und danach in regelmäßigen Intervallen empfohlen. Serumglukose und Lipide In klinischen Studien wurde über Hyperglykämie, Hyperlipidämie und Hypertriglyzeridämie berichtet (siehe Abschnitt 4.8). In der Mehrzahl der Fälle von Hyperglykämie wiesen die Patienten bereits vor Behandlungsbeginn mit Afinitor einen abnormen Nüchtern-Blutglukosespiegel auf. Eine Überwachung der Nüchternglukose vor Behandlungsbeginn mit Afinitor und danach in regelmäßigen Intervallen wird empfohlen. Wenn möglich, sollte vor Behandlungsbeginn mit Afinitor eine optimale glykämische Kontrolle erreicht werden. Hämatologische Parameter In klinischen Studien kam es zu einer Abnahme von Hämoglobin, Lymphozyten, neutrophilen Granulozyten und Thrombozyten (siehe Abschnitt 4.8). Eine Kontrolle des Differentialblutbildes vor Behandlungsbeginn mit Afinitor und danach in regelmäßigen Intervallen wird empfohlen. Wechselwirkungen Die gleichzeitige Gabe von Inhibitoren und Induktoren von CYP3A4 und/oder des Multidrug- Resistance-Proteins p-glycoprotein (p-gp) sollte vermieden werden. Wenn die gleichzeitige Gabe eines moderaten CYP3A4- und/oder p-gp-inhibitors nicht vermieden werden kann, kann eine Dosisanpassung von Afinitor auf der Grundlage der vorausberechneten AUC erwogen werden (siehe Abschnitt 4.5). Die gleichzeitige Behandlung mit starken CYP3A4-Inhibitoren führt zu drastisch erhöhten Plasmakonzentrationen von Everolimus (siehe Abschnitt 4.5). Zurzeit gibt es keine ausreichenden Daten, die in dieser Situation Dosierungsempfehlungen erlauben würden. Die gleichzeitige Behandlung mit Afinitor und starken Inhibitoren wird daher nicht empfohlen. Eingeschränkte Leberfunktion Afinitor sollte bei Patienten mit stark eingeschränkter Leberfunktion (Child-Pugh Klasse C) nicht angewendet werden (siehe Abschnitte 4.2 und 5.2). 17
18 Impfungen Der Einsatz von Lebendimpfstoffen sollte während der Behandlung mit Afinitor vermieden werden (siehe Abschnitt 4.5). Lactose Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose- Malabsorption sollten dieses Arzneimittel nicht anwenden. Komplikationen bei der Wundheilung Eine verzögerte Wundheilung ist ein Klasseneffekt von Rapamycin-Derivaten, einschließlich Afinitor. Daher ist perioperativ Vorsicht bei der Anwendung von Afinitor geboten. 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Everolimus ist ein CYP3A4-Substrat und außerdem ein Substrat und mäßiger Inhibitor des p-gp. Deshalb kann die Absorption und anschließende Elimination von Everolimus durch Produkte beeinflusst werden, die auf CYP3A4 und/oder p-gp wirken. In vitro wirkt Everolimus als kompetitiver Inhibitor von CYP3A4 und als gemischter Inhibitor von CYP2D6. In Tabelle 1 sind bekannte und theoretische Wechselwirkungen mit ausgewählten CYP3A4- und p-gp-inhibitoren und -Induktoren gelistet. CYP3A4- und p-gp-inhibitoren, die die Blutkonzentrationen von Everolimus erhöhen Substanzen, die CYP3A4- oder p-gp-inhibitoren sind, können durch Reduktion des Metabolismus oder den Efflux von Everolimus aus intestinalen Zellen die Blutkonzentrationen von Everolimus erhöhen. CYP3A4- und p-gp-induktoren, die die Blutkonzentrationen von Everolimus vermindern Substanzen, die CYP3A4- oder p-gp-induktoren sind, können die Blutkonzentrationen von Everolimus durch Erhöhung des Metabolismus oder des Effluxes von Everolimus aus intestinalen Zellen vermindern. Tabelle 1 Wirkungen von anderen Wirkstoffen auf Everolimus Wirkstoff nach Wechselwirkung Wechselwirkung Änderung der AUC/C max von Everolimus Geometrisches Durchschnittsverhältnis (beobachteter Bereich) Empfehlungen bezüglich gleichzeitiger Gabe Starke CYP3A4-/p-GP-Inhibitoren Ketoconazol AUC 15,3-fach (Bereich 11,2-22,5) C max 4,1-fach (Bereich 2,6-7,0) Itraconazol, Posaconazol, Nicht untersucht. Starker Anstieg Voriconazol der Everolimus-Blutkonzentration Telithromycin, wird erwartet. Clarithromycin Nefazodon Ritonavir, Atazanavir, Saquinavir, Darunavir, Indinavir, Nelfinavir Die gleichzeitige Behandlung mit Afinitor und starken Inhibitoren wird nicht empfohlen. 18
19 Moderate CYP3A4-/p-GP-Inhibitoren Erythromycin AUC 4,4-fach (Bereich 2,0-12,6) C max 2,0-fach (Bereich 0,9-3,5) Verapamil AUC 3,5-fach (Bereich 2,2-6,3) C max 2,3-fach (Bereich 1,3-3,8) Orales Ciclosporin AUC 2,7-fach (Bereich 1,5-4,7) C max 1,8-fach (Bereich 1,3-2,6) Fluconazol Nicht untersucht. Erhöhte Diltiazem Exposition erwartet. Amprenavir, Nicht untersucht. Erhöhte Fosamprenavir Exposition erwartet. Grapefruitsaft oder andere Lebensmittel, die CYP3A4/p-GP beeinflussen Nicht untersucht. Erhöhte Exposition erwartet (Die Wirkung variiert stark). Starke CYP3A4-Induktoren Rifampicin AUC 63% (Bereich 0-80%) C max 58% (Bereich 10-70%) Carbamazepin, Nicht untersucht. Verminderte Phenobarbital, Phenytoin Efavirenz, Nevirapin Johanniskraut (Hypericum perforatum) Exposition erwartet. Nicht untersucht. Verminderte Exposition erwartet. Nicht untersucht. Stark verminderte Exposition erwartet. Vorsicht ist geboten, wenn die gleichzeitige Gabe von moderaten CYP3A4- oder p-gp-inhibitoren nicht vermieden werden kann. Wenn Patienten die gleichzeitige Gabe eines moderaten CYP3A4- oder p-gp- Inhibitors benötigen, kann eine Dosisreduktion auf 5 mg täglich oder auf 5 mg jeden zweiten Tag erwogen werden. Es gibt jedoch keine klinischen Daten zu dieser Dosisanpassung. Wegen der interindividuellen Schwankungen sind die empfohlenen Dosisanpassungen möglicherweise nicht für alle Patienten optimal. Daher wird eine enge Überwachung der Nebenwirkungen empfohlen. Die Kombination sollte vermieden werden. Die gleichzeitige Gabe von starken CYP3A4-Induktoren sollte vermieden werden. Wenn Patienten die gleichzeitige Gabe eines starken CYP3A4-Induktors benötigen, sollte eine Dosiserhöhung von Afinitor von 10 mg/tag auf bis zu 20 mg/tag in Einzelschritten von 5 mg, gegeben an den Tagen 4 und 8 nach erstmaliger Gabe des Induktors, erwogen werden. Diese Dosis von Afinitor ist berechnet im Hinblick auf die Anpassung der AUC an den Bereich, der ohne Induktoren beobachtet wurde. Es gibt jedoch keine klinischen Daten zu dieser Dosisanpassung. Wenn die Behandlung mit dem starken Induktor abgesetzt wird, sollte zur Afinitor- Dosierung, die vor Beginn der gleichzeitigen Behandlung gegeben wurde, zurückgekehrt werden. Arzneimittel, die Johanniskraut enthalten, sollten während der Behandlung mit Everolimus nicht angewendet werden. 19
20 Substanzen, deren Plasmakonzentrationen durch Everolimus verändert werden können Basierend auf In-vitro-Ergebnissen lassen die systemischen Konzentrationen, die nach täglicher oraler Gabe von 10 mg beobachtet wurden, die Inhibierung von p-gp, CYP3A4 und CYP2D6 unwahrscheinlich erscheinen. Jedoch kann die Inhibierung von CYP3A4 und p-gp im Darm nicht ausgeschlossen werden; daher könnte Everolimus die Bioverfügbarkeit von gleichzeitig gegebenen Stoffen, die CYP3A4- und/oder p-gp-substrate sind, beeinflussen. Impfungen Während der Behandlung mit Afinitor ist die Immunreaktion auf die Impfung möglicherweise beeinträchtigt und Impfungen können deshalb weniger wirksam sein. Der Einsatz von Lebendimpfstoffen sollte während der Behandlung mit Afinitor vermieden werden (siehe Abschnitt 4.4). Beispiele für Lebendimpfstoffe sind: intranasal angewendete Influenza-, Masern-, Mumps-, Röteln-, orale Polio-, BCG (Bacillus Calmette-Guérin)-, Gelbfieber-, Varizellen- und Typhus-TY21a- Vakzine. 4.6 Schwangerschaft und Stillzeit Fertilität Basierend auf präklinischen Ergebnissen könnte es bei der Behandlung mit Afinitor zu einer Einschränkung der männlichen Fertilität kommen (siehe Abschnitt 5.3). Frauen im gebärfähigen Alter Frauen im gebärfähigen Alter müssen während der Behandlung mit Everolimus eine zuverlässige Verhütungsmethode anwenden. Schwangerschaft Es liegen keine oder nur begrenzte Daten für die Verwendung von Everolimus bei Schwangeren vor. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt (siehe Abschnitt 5.3). Die Anwendung von Everolimus während der Schwangerschaft und bei gebärfähigen Frauen, die keine Verhütungsmethode anwenden, wird nicht empfohlen. Stillzeit Es ist nicht bekannt, ob Everolimus beim Menschen in die Muttermilch ausgeschieden wird. Im Tierexperiment gingen Everolimus und/oder seine Metaboliten jedoch leicht in die Milch laktierender Ratten über. Deshalb sollten Frauen, die Everolimus einnehmen, nicht stillen. 4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt. Patienten sind darauf hinzuweisen, bei der Teilnahme am Straßenverkehr und bei der Bedienung von Maschinen vorsichtig zu sein, wenn während der Behandlung mit Afinitor Ermüdung auftritt. 4.8 Nebenwirkungen Die folgenden Daten basieren auf einer randomisierten Phase-III-Studie zur Behandlung des fortgeschrittenen Nierenzellkarzinoms, in der Everolimus (n=274) mit Placebo (n=137) verglichen wurde. Insgesamt wurden 165 Patienten mindestens 4 Monate lang mit einer Tagesdosis von 10 mg Everolimus behandelt. Das mediane Alter der Patienten war 61 Jahre (Bereich Jahre). Die häufigsten Nebenwirkungen Grad 3-4 (Inzidenz 2%) waren verminderte Lymphozytenzahl, erhöhte Glucose, vermindertes Hämoglobin, vermindertes Phosphat, erhöhter Cholesterinwert, Infektionen, Stomatitis, Ermüdung und Pneumonitis. 20
WAS finde ich WO im Beipackzettel
 WAS finde ich WO im Beipackzettel Sie haben eine Frage zu Ihrem? Meist finden Sie die Antwort im Beipackzettel (offiziell "Gebrauchsinformation" genannt). Der Aufbau der Beipackzettel ist von den Behörden
WAS finde ich WO im Beipackzettel Sie haben eine Frage zu Ihrem? Meist finden Sie die Antwort im Beipackzettel (offiziell "Gebrauchsinformation" genannt). Der Aufbau der Beipackzettel ist von den Behörden
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Heumann s Blasen- und Nierentee Solubitrat Wirkstoffe: Dickextrakt aus Birkenblättern, Dickextrakt aus Riesengoldrutenkraut Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Heumann s Blasen- und Nierentee Solubitrat Wirkstoffe: Dickextrakt aus Birkenblättern, Dickextrakt aus Riesengoldrutenkraut Lesen Sie die gesamte Packungsbeilage
Anhang III. Ergänzungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Ergänzungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage 20 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS [Der unten genannte Wortlaut
Anhang III Ergänzungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage 20 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS [Der unten genannte Wortlaut
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. PROGESTOGEL 1 % Gel. Progesteron
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER PROGESTOGEL 1 % Gel Progesteron Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. Heben
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER PROGESTOGEL 1 % Gel Progesteron Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. Heben
Wirkstoffe: Trockenextrakt aus Birkenblättern, Trockenextrakt aus Goldrutenkraut
 Gebrauchsinformation: Information für Anwender HEUMANN Blasen- und Nierentee SOLUBITRAT uro Teeaufgusspulver Wirkstoffe: Trockenextrakt aus Birkenblättern, Trockenextrakt aus Goldrutenkraut Lesen Sie die
Gebrauchsinformation: Information für Anwender HEUMANN Blasen- und Nierentee SOLUBITRAT uro Teeaufgusspulver Wirkstoffe: Trockenextrakt aus Birkenblättern, Trockenextrakt aus Goldrutenkraut Lesen Sie die
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Legalon SIL - Trockensubstanz zur Infusionsbereitung
 PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Legalon SIL - Trockensubstanz zur Infusionsbereitung Wirkstoff: Silibinin-C-2,3-bis(hydrogensuccinat), Dinatriumsalz Lesen Sie die gesamte
PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Legalon SIL - Trockensubstanz zur Infusionsbereitung Wirkstoff: Silibinin-C-2,3-bis(hydrogensuccinat), Dinatriumsalz Lesen Sie die gesamte
Patienteninformationsbroschüre Valproat
 Patienteninformationsbroschüre Valproat Informationen für Patientinnen Die Informationen in dieser Broschüre sind für Frauen bestimmt, denen Valproat verschrieben wird und die schwanger werden können (Frauen
Patienteninformationsbroschüre Valproat Informationen für Patientinnen Die Informationen in dieser Broschüre sind für Frauen bestimmt, denen Valproat verschrieben wird und die schwanger werden können (Frauen
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Viscosan - Augentropfen Wirkstoff: Hypromellose
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Viscosan - Augentropfen Wirkstoff: Hypromellose Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Viscosan - Augentropfen Wirkstoff: Hypromellose Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
Erratum Benkert, Pocket Guide, Psychopharmaka von A bis Z. 3.Aufl. ISBN (print): 978-3-642-54766-9/ DOI 10.1007/978-3-642-54767-6
 Erratum Benkert, Pocket Guide, Psychopharmaka von A bis Z. 3.Aufl. ISBN (print): 978-3-642-54766-9/ DOI 10.1007/978-3-642-54767-6 Trotz sorgfältiger Erstellung des Buchs Benkert, Pocket Guide, Psychopharmaka
Erratum Benkert, Pocket Guide, Psychopharmaka von A bis Z. 3.Aufl. ISBN (print): 978-3-642-54766-9/ DOI 10.1007/978-3-642-54767-6 Trotz sorgfältiger Erstellung des Buchs Benkert, Pocket Guide, Psychopharmaka
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Kamillosan -Mundspray. Kamillenblütenauszug Pfefferminzöl Anisöl
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Kamillosan -Mundspray Kamillenblütenauszug Pfefferminzöl Anisöl Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Kamillosan -Mundspray Kamillenblütenauszug Pfefferminzöl Anisöl Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
1. Was sind Dorithricin Halstabletten und wofür werden sie angewendet?
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Dorithricin - Halstabletten Wirkstoffe: Tyrothricin, Benzalkoniumchlorid, Benzocain Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Dorithricin - Halstabletten Wirkstoffe: Tyrothricin, Benzalkoniumchlorid, Benzocain Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
Nasa Rhinathiol 0,1 %ige Nasenspray, Lösung Xylometazolinhydrochlorid
 Seite 1/5 Packungsbeilage Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mir der Anwendung dieses Arzneimittels beginnen. Sie enthält wichtige Informationen für Ihre Behandlung. Wenn
Seite 1/5 Packungsbeilage Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mir der Anwendung dieses Arzneimittels beginnen. Sie enthält wichtige Informationen für Ihre Behandlung. Wenn
Gebrauchsinformation: Information für Anwender. LOMUSOL Augentropfen. Wirkstoff: Dinatriumcromoglicat
 Gebrauchsinformation: Information für Anwender LOMUSOL Augentropfen Wirkstoff: Dinatriumcromoglicat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für Anwender LOMUSOL Augentropfen Wirkstoff: Dinatriumcromoglicat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für Patienten. Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench)
 Gebrauchsinformation: Information für Patienten Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench) Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Gebrauchsinformation: Information für Patienten Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench) Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Sidroga Blasentee akut Wirkstoffe: Bärentraubenblätter, Birkenblätter, Goldrutenkraut, Orthosiphonblätter
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Sidroga Blasentee akut Wirkstoffe: Bärentraubenblätter, Birkenblätter, Goldrutenkraut, Orthosiphonblätter Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Sidroga Blasentee akut Wirkstoffe: Bärentraubenblätter, Birkenblätter, Goldrutenkraut, Orthosiphonblätter Lesen Sie die gesamte Packungsbeilage sorgfältig
1. WAS IST DAFALGAN Zäpfchen UND WOFÜR WIRD ES ANGEWENDET?
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER DAFALGAN Säuglinge 80 mg Zäpfchen DAFALGAN Kleinkinder 150 mg Zäpfchen DAFALGAN große Kinder 300 mg Zäpfchen Paracetamol Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER DAFALGAN Säuglinge 80 mg Zäpfchen DAFALGAN Kleinkinder 150 mg Zäpfchen DAFALGAN große Kinder 300 mg Zäpfchen Paracetamol Lesen Sie die gesamte Packungsbeilage
Labortests für Ihre Gesundheit. Therapie nach Maß 26
 Labortests für Ihre Gesundheit Therapie nach Maß 26 01IPF Labortests für Ihre Gesundheit Therapie nach Maß Die individuelle Dosis finden Jeder Mensch ist einzigartig. Keiner gleicht dem anderen nicht nur
Labortests für Ihre Gesundheit Therapie nach Maß 26 01IPF Labortests für Ihre Gesundheit Therapie nach Maß Die individuelle Dosis finden Jeder Mensch ist einzigartig. Keiner gleicht dem anderen nicht nur
Sumatriptan Antrag auf Freistellung von der Verschreibungspflicht mit Beschränkungen
 Sumatriptan Antrag auf Freistellung von der Verschreibungspflicht mit Beschränkungen Sachverständigen-Ausschuss für Verschreibungspflicht 62. Sitzung am 13.01.2009 im Bundesinstitut für Arzneimittel- und
Sumatriptan Antrag auf Freistellung von der Verschreibungspflicht mit Beschränkungen Sachverständigen-Ausschuss für Verschreibungspflicht 62. Sitzung am 13.01.2009 im Bundesinstitut für Arzneimittel- und
MS und Impfungen. DAS KLEINE IMPF-1x1. DAS KLEINE IMPF-1x1. Christian Lampl. Abteilung für Allgemeine Neurologie und Schmerzmedizin
 MS und Impfungen Christian Lampl Abteilung für Allgemeine Neurologie und Schmerzmedizin DAS KLEINE IMPF-1x1 Impfungen stellen sehr wirksame und wichtige präventivmedizinische Maßnahmen dar. Das unmittelbare
MS und Impfungen Christian Lampl Abteilung für Allgemeine Neurologie und Schmerzmedizin DAS KLEINE IMPF-1x1 Impfungen stellen sehr wirksame und wichtige präventivmedizinische Maßnahmen dar. Das unmittelbare
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Vitagutt Vitamin E 670 mg, Weichkapsel Zur Anwendung bei Erwachsenen Wirkstoff: 1000 mg all-rac-alpha-tocopherolacetat (entsprechend 670 mg RRR-alpha- Tocopherol-Äquivalente).
Gebrauchsinformation: Information für Anwender Vitagutt Vitamin E 670 mg, Weichkapsel Zur Anwendung bei Erwachsenen Wirkstoff: 1000 mg all-rac-alpha-tocopherolacetat (entsprechend 670 mg RRR-alpha- Tocopherol-Äquivalente).
Sandoz Pharmaceuticals AG
 Die Pille danach. Was ist eine Notfallverhütung oder die sogenannte «Pille danach»? 1 Wann wird NorLevo Uno eingenommen? 2 Bei der «Pille danach» handelt es sich um eine Notfallverhütung, die eine unerwünschte
Die Pille danach. Was ist eine Notfallverhütung oder die sogenannte «Pille danach»? 1 Wann wird NorLevo Uno eingenommen? 2 Bei der «Pille danach» handelt es sich um eine Notfallverhütung, die eine unerwünschte
Gebrauchsinformation: Information für den Anwender
 Wortlaut der für die Gebrauchsinformation vorgesehenen Angaben Stand: Mai 2008 1 Gebrauchsinformation: Information für den Anwender Harntee-Steiner, Teeaufgusspulver Zur Anwendung bei Heranwachsenden ab
Wortlaut der für die Gebrauchsinformation vorgesehenen Angaben Stand: Mai 2008 1 Gebrauchsinformation: Information für den Anwender Harntee-Steiner, Teeaufgusspulver Zur Anwendung bei Heranwachsenden ab
APOTHEKIA SPECIAL DIE PILLE DANACH
 APOTHEKIA SPECIAL DIE PILLE DANACH Die zwei Pillen danach In Deutschland sind aktuell zwei Wirkstoffe für die Pille danach zugelassen, Ulipristalacetat (Handelsname ellaone) und Levonorgestrel (Handelsname
APOTHEKIA SPECIAL DIE PILLE DANACH Die zwei Pillen danach In Deutschland sind aktuell zwei Wirkstoffe für die Pille danach zugelassen, Ulipristalacetat (Handelsname ellaone) und Levonorgestrel (Handelsname
Packungsbeilage CORSODYL Mundspüllösung / Spray 03-2012 Seite 1/5 BE106802 / BE191764 Belgien GEBRAUCHINFORMATION: INFORMATION FÜR DEN ANWENDER
 Seite 1/5 BE106802 / BE191764 Belgien GEBRAUCHINFORMATION: INFORMATION FÜR DEN ANWENDER CORSODYL 200mg/100ml mundwasser CORSODYL 200mg/100ml spray zur Anwendung in der Mundhöhle Chlorhexidindigluconat
Seite 1/5 BE106802 / BE191764 Belgien GEBRAUCHINFORMATION: INFORMATION FÜR DEN ANWENDER CORSODYL 200mg/100ml mundwasser CORSODYL 200mg/100ml spray zur Anwendung in der Mundhöhle Chlorhexidindigluconat
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Protagent-Einmalaugentropfen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 ml Lösung (= ca. 30 Tropfen) enthält 20 mg
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Protagent-Einmalaugentropfen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 ml Lösung (= ca. 30 Tropfen) enthält 20 mg
Gebrauchsinformation: Information für Patienten
 Gebrauchsinformation: Information für Patienten Esberitox -Tabletten Trockenextrakt aus einer Mischung von Lebensbaumspitzen und -blättern, Purpursonnenhutwurzel, Blassfarbener Sonnenhutwurzel und Färberhülsenwurzel
Gebrauchsinformation: Information für Patienten Esberitox -Tabletten Trockenextrakt aus einer Mischung von Lebensbaumspitzen und -blättern, Purpursonnenhutwurzel, Blassfarbener Sonnenhutwurzel und Färberhülsenwurzel
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Tantum Verde 3 mg Pastillen mit Minzgeschmack Wirkstoff: Benzydaminhydrochlorid
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tantum Verde 3 mg Pastillen mit Minzgeschmack Wirkstoff: Benzydaminhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tantum Verde 3 mg Pastillen mit Minzgeschmack Wirkstoff: Benzydaminhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
PHV-issue: Codein for the treatment of cough or cold in paediatric patients
 BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 27.05.2015 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 27.05.2015 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
Avastin First-Line Überzeugendes Therapiekonzept bei fortgeschrittenem Nierenzellkarzinom
 Prof. Dr. Gerald Mickisch: Avastin First-Line - Überzeugendes Therapiekonzept bei fortgeschrittenem Ni Avastin First-Line Überzeugendes Therapiekonzept bei fortgeschrittenem Nierenzellkarzinom Von Prof.
Prof. Dr. Gerald Mickisch: Avastin First-Line - Überzeugendes Therapiekonzept bei fortgeschrittenem Ni Avastin First-Line Überzeugendes Therapiekonzept bei fortgeschrittenem Nierenzellkarzinom Von Prof.
Fachinformation (Zusammenfassung der Merkmale des Arzneimittels/SmPC)
 1. BEZEICHNUNG DER ARZNEIMITTEL 2,5 mg Tabletten 5 mg Tabletten 10 mg Tabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Afinitor 2,5 mg Tabletten Jede Tablette enthält 2,5 mg Everolimus. Sonstiger
1. BEZEICHNUNG DER ARZNEIMITTEL 2,5 mg Tabletten 5 mg Tabletten 10 mg Tabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Afinitor 2,5 mg Tabletten Jede Tablette enthält 2,5 mg Everolimus. Sonstiger
Wie unsere Augen Erfahren Sie, wie wir sehen, und wie Sie Ihre Vision zu schützen.
 Wie unsere Augen Erfahren Sie, wie wir sehen, und wie Sie Ihre Vision zu schützen. Levobunolol ist ein Beta-Blocker, der den Druck im Inneren des Auges reduziert. Levobunolol Augen (Auge) ist für die Behandlung
Wie unsere Augen Erfahren Sie, wie wir sehen, und wie Sie Ihre Vision zu schützen. Levobunolol ist ein Beta-Blocker, der den Druck im Inneren des Auges reduziert. Levobunolol Augen (Auge) ist für die Behandlung
Atronase 0,3 mg/ml Nasenspray, Lösung (Ipratropiumbromid)
 GEBRAUCHSINFORMATION ATRONASE 0,3 MG/ML NASENSPRAY, LÖSUNG Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses Arzneimittel ist auch ohne Verschreibung
GEBRAUCHSINFORMATION ATRONASE 0,3 MG/ML NASENSPRAY, LÖSUNG Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses Arzneimittel ist auch ohne Verschreibung
Diabetes mellitus : Folgeschäden
 Diabetes mellitus : Folgeschäden Warum ist der Diabetes mellitus eine wichtige Erkrankung? a. Akute Probleme: Hypoglykämie Hyperglykämie Ketoazidose b. Chronische Probleme: Folgeschäden: Typische Schäden:
Diabetes mellitus : Folgeschäden Warum ist der Diabetes mellitus eine wichtige Erkrankung? a. Akute Probleme: Hypoglykämie Hyperglykämie Ketoazidose b. Chronische Probleme: Folgeschäden: Typische Schäden:
DAS GRÜNE REZEPT. Für eine sichere Medikation mit rezeptfreien Arzneimitteln
 DAS GRÜNE REZEPT Für eine sichere Medikation mit rezeptfreien Arzneimitteln Was ist das Grüne Rezept? Obwohl das Grüne Rezept schon seit Jahren in Arztpraxen verwendet wird, ist es vielen Patienten und
DAS GRÜNE REZEPT Für eine sichere Medikation mit rezeptfreien Arzneimitteln Was ist das Grüne Rezept? Obwohl das Grüne Rezept schon seit Jahren in Arztpraxen verwendet wird, ist es vielen Patienten und
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Tebofortan 40 mg - Filmtabletten. Wirkstoff: Trockenextrakt aus Ginkgo-biloba-Blättern
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tebofortan 40 mg - Filmtabletten Wirkstoff: Trockenextrakt aus Ginkgo-biloba-Blättern Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tebofortan 40 mg - Filmtabletten Wirkstoff: Trockenextrakt aus Ginkgo-biloba-Blättern Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
? Kann ich mit Karotten zu viel Vitamin A
 Schwangere aus sozial schwachen Schichten Schwangere, die alkohol-, drogen- oder nikotinabhängig sind Schwangere, die aufgrund einer chronischen Erkrankung Medikamente einnehmen müssen, welche die Nährstoffverwertung
Schwangere aus sozial schwachen Schichten Schwangere, die alkohol-, drogen- oder nikotinabhängig sind Schwangere, die aufgrund einer chronischen Erkrankung Medikamente einnehmen müssen, welche die Nährstoffverwertung
Orale Antikoagulation
 A. Plehn? Orale Antikoagulation NOAC Rivaroxaban (Xarelto) // Faktor-Xa-Hemmung Dabigatran (Pradaxa) // Faktor-IIa-Hemmung (Thrombin) Apixaban (Eliquis) // Faktor-Xa-Hemmung (Edoxaban // Faktor-Xa-Hemmung)
A. Plehn? Orale Antikoagulation NOAC Rivaroxaban (Xarelto) // Faktor-Xa-Hemmung Dabigatran (Pradaxa) // Faktor-IIa-Hemmung (Thrombin) Apixaban (Eliquis) // Faktor-Xa-Hemmung (Edoxaban // Faktor-Xa-Hemmung)
Patientenleitfaden für das Gespräch mit dem Arzt. Liebe Patientin, lieber Patient!
 Patientenleitfaden für das Gespräch mit dem Arzt Liebe Patientin, lieber Patient! Je besser Sie sich auf das Gespräch mit Ihrem Arzt vorbereiten, desto leichter wird es für sie/ihn sein, eine Diagnose
Patientenleitfaden für das Gespräch mit dem Arzt Liebe Patientin, lieber Patient! Je besser Sie sich auf das Gespräch mit Ihrem Arzt vorbereiten, desto leichter wird es für sie/ihn sein, eine Diagnose
Moderne Behandlung des Grauen Stars
 Katarakt Moderne Behandlung des Grauen Stars Sehr geehrte Patientin, sehr geehrter Patient, Bei Ihnen wurde eine Trübung der Augenlinse festgestellt, die umgangssprachlich auch Grauer Star genannt wird.
Katarakt Moderne Behandlung des Grauen Stars Sehr geehrte Patientin, sehr geehrter Patient, Bei Ihnen wurde eine Trübung der Augenlinse festgestellt, die umgangssprachlich auch Grauer Star genannt wird.
Faltschachtel. Unverkäufliches Muster (Eindruck auf Linie) Teil einer Klinikpackung, Einzelverkauf unzulässig (Eindruck auf Linie)
 Packmittelmanuskript Nr. 64000/009/94/6 Seite 2 Faltschachtel HEUMANN PHARMA GmbH & Co. Generica KG Südwestpark 50 90449 Nürnberg Urso 400 Heumann Filmtabletten mit 400 mg Ursodeoxycholsäure Zur Auflösung
Packmittelmanuskript Nr. 64000/009/94/6 Seite 2 Faltschachtel HEUMANN PHARMA GmbH & Co. Generica KG Südwestpark 50 90449 Nürnberg Urso 400 Heumann Filmtabletten mit 400 mg Ursodeoxycholsäure Zur Auflösung
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Postinor 1500 Mikrogramm - Tablette Wirkstoff: Levonorgestrel
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Postinor 1500 Mikrogramm - Tablette Wirkstoff: Levonorgestrel Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Postinor 1500 Mikrogramm - Tablette Wirkstoff: Levonorgestrel Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen
PACKUNGSBEILAGE. CORSODYL Zahngel, 10 mg Chlorhexidin digluconat pro g Zahngel
 Seite 1/5 981 IS 153 F7 Belgien PACKUNGSBEILAGE Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Wenn Sie weitere Fragen haben, wenden Sie sich an
Seite 1/5 981 IS 153 F7 Belgien PACKUNGSBEILAGE Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Wenn Sie weitere Fragen haben, wenden Sie sich an
!!! Folgeerkrankungen
 Ein zu hoher Blutzuckerspiegel kann Folgen auf Ihr Herzkreislaufsystem haben und zu Erkrankungen wie der Schaufensterkrankheit, einer Angina pectoris, einem Herzinfarkt oder einem Schlaganfall führen.
Ein zu hoher Blutzuckerspiegel kann Folgen auf Ihr Herzkreislaufsystem haben und zu Erkrankungen wie der Schaufensterkrankheit, einer Angina pectoris, einem Herzinfarkt oder einem Schlaganfall führen.
Die östrogenfreie Pille
 Alle wichtigen Infos über Sexualität und Verhütung unter: www.frau-und-pille.de Mit bester Empfehlung Die östrogenfreie Pille Verhütung für Frauen mit besonderem Anspruch. Einscannen und mehr erfahren...
Alle wichtigen Infos über Sexualität und Verhütung unter: www.frau-und-pille.de Mit bester Empfehlung Die östrogenfreie Pille Verhütung für Frauen mit besonderem Anspruch. Einscannen und mehr erfahren...
Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva
 Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva Darmstadt (19. Februar 2009) Die Merck KGaA hat heute bekannt gegeben, dass die europäische Arzneimittelbehörde EMEA
Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva Darmstadt (19. Februar 2009) Die Merck KGaA hat heute bekannt gegeben, dass die europäische Arzneimittelbehörde EMEA
Fachinformation (Zusammenfassung der Merkmale des Arzneimittels/SmPC)
 1. BEZEICHNUNG DER ARZNEIMITTEL Votubia 2,5 mg Tabletten Votubia 5 mg Tabletten Votubia 10 mg Tabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Votubia 2,5 mg Tabletten Jede Tablette enthält 2,5
1. BEZEICHNUNG DER ARZNEIMITTEL Votubia 2,5 mg Tabletten Votubia 5 mg Tabletten Votubia 10 mg Tabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Votubia 2,5 mg Tabletten Jede Tablette enthält 2,5
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Postinor 750 Mikrogramm Tabletten Levonorgestrel
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Postinor 750 Mikrogramm Tabletten Levonorgestrel Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Postinor 750 Mikrogramm Tabletten Levonorgestrel Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
LANSOYL Paraffine Gel zum Einnehmenv3.0_B2.0 1/5
 PIL September 2015 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER LANSOYL PARAFFINE 78,230 g/100 g Gel zum Einnehmen Paraffinöl Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
PIL September 2015 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER LANSOYL PARAFFINE 78,230 g/100 g Gel zum Einnehmen Paraffinöl Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Bijsluiter DE versie Imaverol 100 mg (glas) B. PACKUNGSBEILAGE 1
 B. PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION Imaverol 100 mg, Konzentrat zur örtlichen Anwendung 1.NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE
B. PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION Imaverol 100 mg, Konzentrat zur örtlichen Anwendung 1.NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE
Milch und Milchprodukte
 Tag der Apotheke 2014: Kurztexte zu acht häufigen Wechselwirkungen Rückfragen an Dr. Ursula Sellerberg, ABDA-Pressestelle, Mail: u.sellerberg@abda.aponet.de Milch und Milchprodukte 95 % 1 der Bundesbürger
Tag der Apotheke 2014: Kurztexte zu acht häufigen Wechselwirkungen Rückfragen an Dr. Ursula Sellerberg, ABDA-Pressestelle, Mail: u.sellerberg@abda.aponet.de Milch und Milchprodukte 95 % 1 der Bundesbürger
Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen:
 BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 06.11.2014 Veronika Iro REGA +43 (0) 505 55 36247 pv-implementation@ages.at
BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 06.11.2014 Veronika Iro REGA +43 (0) 505 55 36247 pv-implementation@ages.at
Intraoperative Strahlentherapie bei Brustkrebs
 Intraoperative Strahlentherapie bei Brustkrebs Uniklinik Köln 1 Kein Grund für Verzweiflung Wenn die Diagnose Brustkrebs festgestellt wird, ist erst einmal die Sorge groß. Beruhigend zu wissen, dass es
Intraoperative Strahlentherapie bei Brustkrebs Uniklinik Köln 1 Kein Grund für Verzweiflung Wenn die Diagnose Brustkrebs festgestellt wird, ist erst einmal die Sorge groß. Beruhigend zu wissen, dass es
Durchfall in der Pflege. Der kleine Ratgeber von Aplona
 Durchfallerkrankungen Durchfall in der Pflege Der kleine von Aplona Der kleine von Aplona 3 Fotos: Titel, Seite 2, 3 und 4: Fotolia.com Durchfall in der Pflege Akute Durchfallerkrankungen stellen eine
Durchfallerkrankungen Durchfall in der Pflege Der kleine von Aplona Der kleine von Aplona 3 Fotos: Titel, Seite 2, 3 und 4: Fotolia.com Durchfall in der Pflege Akute Durchfallerkrankungen stellen eine
Bericht über die Untersuchung zur Erblichkeit von Herzerkrankungen beim PON
 1 Bericht über die Untersuchung zur Erblichkeit von Herzerkrankungen beim PON Einleitung Bei der Rasse PON wurden im APH in der letzten Zeit auffällig viele Herzkrankheiten und Herzveränderungen unterschiedlicher
1 Bericht über die Untersuchung zur Erblichkeit von Herzerkrankungen beim PON Einleitung Bei der Rasse PON wurden im APH in der letzten Zeit auffällig viele Herzkrankheiten und Herzveränderungen unterschiedlicher
Ein neues System für die Allokation von Spenderlungen. LAS Information für Patienten in Deutschland
 Ein neues System für die Allokation von Spenderlungen LAS Information für Patienten in Deutschland Ein neues System für die Allokation von Spenderlungen Aufgrund des immensen Mangels an Spenderorganen
Ein neues System für die Allokation von Spenderlungen LAS Information für Patienten in Deutschland Ein neues System für die Allokation von Spenderlungen Aufgrund des immensen Mangels an Spenderorganen
Medikament zur Behandlung der Muskeldystrophie Duchenne jetzt in Deutschland VERFÜGBAR:
 München, den 08.01.2015 Medikament zur Behandlung der Muskeldystrophie Duchenne jetzt in Deutschland VERFÜGBAR: TRANSLARNA TM mit dem Wirkstoff Ataluren Liebe Patienten, liebe Eltern, In einem Schreiben
München, den 08.01.2015 Medikament zur Behandlung der Muskeldystrophie Duchenne jetzt in Deutschland VERFÜGBAR: TRANSLARNA TM mit dem Wirkstoff Ataluren Liebe Patienten, liebe Eltern, In einem Schreiben
24-STUNDEN-SAMMELURIN
 Blutfarbstoffs (Hämoglobin), wird normalerweise nicht mit dem Urin ausgeschieden. Erst bei einer erhöhten Konzentration im Blutserum enthält auch der Urin Bilirubin dies ist der Fall, wenn eine Funktionsstörung
Blutfarbstoffs (Hämoglobin), wird normalerweise nicht mit dem Urin ausgeschieden. Erst bei einer erhöhten Konzentration im Blutserum enthält auch der Urin Bilirubin dies ist der Fall, wenn eine Funktionsstörung
Behandlung von Diabetes
 04 Arbeitsanweisung Arbeitsauftrag Anhand des Foliensatzes werden die verschiedenen Behandlungsmethoden bei Diabetes Typ 1 und Typ 2 besprochen. Anschliessend werden noch kurz die Folgen bei einer Nichtbehandlung
04 Arbeitsanweisung Arbeitsauftrag Anhand des Foliensatzes werden die verschiedenen Behandlungsmethoden bei Diabetes Typ 1 und Typ 2 besprochen. Anschliessend werden noch kurz die Folgen bei einer Nichtbehandlung
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Androfin 5 mg - Filmtabletten Wirkstoff: Finasterid
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Androfin 5 mg - Filmtabletten Wirkstoff: Finasterid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Androfin 5 mg - Filmtabletten Wirkstoff: Finasterid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
Wenn Ihnen etwas auf den Magen schlägt, dann schlagen Sie zurück! Aber fragen Sie vorher besser Ihren Apotheker!
 Wenn Ihnen etwas auf den Magen schlägt, dann schlagen Sie zurück! Aber fragen Sie vorher besser Ihren Apotheker! Selbstmedikation Selbstmedikation ist ein weltweiter Trend Selbstmedikation ist praktisch
Wenn Ihnen etwas auf den Magen schlägt, dann schlagen Sie zurück! Aber fragen Sie vorher besser Ihren Apotheker! Selbstmedikation Selbstmedikation ist ein weltweiter Trend Selbstmedikation ist praktisch
Indikationserweiterungen für JANUVIA (Sitagliptin, MSD) in der EU - Kombination mit Sulfonylharnstoff n
 Indikationserweiterungen für JANUVIA (Sitagliptin, MSD) in der EU Kombination mit Sulfonylharnstoff nun ebenfalls zugelassen Haar (März 2008) - Die europäische Arzneimittelbehörde EMEA hat JANUVIA für
Indikationserweiterungen für JANUVIA (Sitagliptin, MSD) in der EU Kombination mit Sulfonylharnstoff nun ebenfalls zugelassen Haar (März 2008) - Die europäische Arzneimittelbehörde EMEA hat JANUVIA für
Gebrauchsinformation: Information für Anwender. Cevitol 500 mg-kautabletten Wirkstoff: Ascorbinsäure (Vitamin C)
 Gebrauchsinformation: Information für Anwender Cevitol 500 mg-kautabletten Wirkstoff: Ascorbinsäure (Vitamin C) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
Gebrauchsinformation: Information für Anwender Cevitol 500 mg-kautabletten Wirkstoff: Ascorbinsäure (Vitamin C) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
Diabetes. Zulassungserweiterung: Levemir (Insulin detemir) als Add-on Therapie zu Victoza (Liraglutid) bei Mens
 Zulassungserweiterung Levemir (Insulin detemir) als Add-on Therapie zu Victoza (Liraglutid) bei Menschen mit Typ 2 Diabetes Mainz (16. November 2011) Die Europäische Kommission hat die Zulassung des modernen
Zulassungserweiterung Levemir (Insulin detemir) als Add-on Therapie zu Victoza (Liraglutid) bei Menschen mit Typ 2 Diabetes Mainz (16. November 2011) Die Europäische Kommission hat die Zulassung des modernen
Die HIT ist keine Allergie! Da die von ihr ausgelösten. Krankheitsbild. Was ist eine Histamin- Intoleranz?
 Was ist eine Histamin- Intoleranz? Die Histamin-Intoleranz ist eine Pseudoallergie. Die HIT ist keine Allergie! Da die von ihr ausgelösten Gesundheitsstörungen jedoch von allergiebedingten Beschwerden
Was ist eine Histamin- Intoleranz? Die Histamin-Intoleranz ist eine Pseudoallergie. Die HIT ist keine Allergie! Da die von ihr ausgelösten Gesundheitsstörungen jedoch von allergiebedingten Beschwerden
Trockenes Auge. Haben Sie Trockene Augen?
 Trockenes Auge Jeder 3 bis 5 Patient, der den Augenarzt besucht, an der Krankheit Trockenes Auge leidet. Ein Trockenes Auge entsteht, wenn der Körper zu wenig Tränenflüssigkeit produziert oder die Zusammensetzung
Trockenes Auge Jeder 3 bis 5 Patient, der den Augenarzt besucht, an der Krankheit Trockenes Auge leidet. Ein Trockenes Auge entsteht, wenn der Körper zu wenig Tränenflüssigkeit produziert oder die Zusammensetzung
Gebrauchsinformation: Information für Patienten. Desloratadin Genericon 5 mg Filmtabletten. Wirkstoff: Desloratadin
 Gebrauchsinformation: Information für Patienten Desloratadin Genericon 5 mg Filmtabletten Wirkstoff: Desloratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
Gebrauchsinformation: Information für Patienten Desloratadin Genericon 5 mg Filmtabletten Wirkstoff: Desloratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
TOP 3: Loperamid (flüssige Darreichungsformen)
 TOP 3: Loperamid (flüssige Darreichungsformen) Antrag auf Ausweitung der Ausnahme von der Verschreibungspflicht auch für flüssige Darreichungsformen 1 Historie und aktuell: Seit 1993 D. h. folgende Darreichungsformen
TOP 3: Loperamid (flüssige Darreichungsformen) Antrag auf Ausweitung der Ausnahme von der Verschreibungspflicht auch für flüssige Darreichungsformen 1 Historie und aktuell: Seit 1993 D. h. folgende Darreichungsformen
1.1. Aufschriften auf der Außenseite von ME-Geräten oder ME-Geräte-Teilen
 1. Bezeichnung, Aufschriften und Begleitpapiere 1.1. Aufschriften auf der Außenseite von ME-Geräten oder ME-Geräte-Teilen 1.1.1. Aufschriften auf der Außenseite von ME-Geräten oder ME-Geräte-Teilen, die
1. Bezeichnung, Aufschriften und Begleitpapiere 1.1. Aufschriften auf der Außenseite von ME-Geräten oder ME-Geräte-Teilen 1.1.1. Aufschriften auf der Außenseite von ME-Geräten oder ME-Geräte-Teilen, die
INFORMATIONEN FÜR TYP-2-DIABETIKER. Warum der HbA 1c -Wert für Sie als Typ-2-Diabetiker so wichtig ist!
 INFORMATIONEN FÜR TYP-2-DIABETIKER Warum der HbA 1c -Wert für Sie als Typ-2-Diabetiker so wichtig ist! Liebe Leserin, lieber Leser, Wer kennt das nicht: Kurz vor dem nächsten Arztbesuch hält man sich besonders
INFORMATIONEN FÜR TYP-2-DIABETIKER Warum der HbA 1c -Wert für Sie als Typ-2-Diabetiker so wichtig ist! Liebe Leserin, lieber Leser, Wer kennt das nicht: Kurz vor dem nächsten Arztbesuch hält man sich besonders
Cytomegalie & Co. Häufige Virusinfektionen in der Schwangerschaft. Deutsches Grünes Kreuz e.v.
 Cytomegalie & Co Häufige Virusinfektionen in der Schwangerschaft Schwangerschaft Eine ganz besondere Zeit der Vorfreude Verantwortung Sorge Die werdenden Eltern möchten alles richtig machen für das Wohl
Cytomegalie & Co Häufige Virusinfektionen in der Schwangerschaft Schwangerschaft Eine ganz besondere Zeit der Vorfreude Verantwortung Sorge Die werdenden Eltern möchten alles richtig machen für das Wohl
Ihre Protein Analyse
 Ihre Protein Analyse Patient Max Dusan Mustermann Sladek... geboren am 17.10.1986... Gewicht 83 kg... Probennummer P07245... Probenmaterial Plasma... Eingang 18.6.2014... Ausgang 7.7.2014 Sehr geehrter
Ihre Protein Analyse Patient Max Dusan Mustermann Sladek... geboren am 17.10.1986... Gewicht 83 kg... Probennummer P07245... Probenmaterial Plasma... Eingang 18.6.2014... Ausgang 7.7.2014 Sehr geehrter
CARTERS PILLEN "NEUE FORMULA" 5 mg magensaftresistente Tabletten
 13.01.2004 1 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittel beginnen. Wenn Sie weitere Fragen haben, wenden Sie sich bitte an Ihren Arzt oder Apotheker.
13.01.2004 1 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittel beginnen. Wenn Sie weitere Fragen haben, wenden Sie sich bitte an Ihren Arzt oder Apotheker.
Besser leben mit Gicht. Seite 3 Seite 4 Seite 5 Seite 6. Zu starke Schweißbildung. besser natürlich behandeln. Gicht-Telegramm
 Besser leben mit Gicht GT II-2014 Seite 3 Seite 4 Seite 5 Seite 6 Purinrechner jetzt auf i-phone und Android Warnung vor dem Einsatz von NSAR wie Diclofenac Zu starke Schweißbildung besser natürlich behandeln
Besser leben mit Gicht GT II-2014 Seite 3 Seite 4 Seite 5 Seite 6 Purinrechner jetzt auf i-phone und Android Warnung vor dem Einsatz von NSAR wie Diclofenac Zu starke Schweißbildung besser natürlich behandeln
Verschreibungsfreie Arzneimittel wieder in der Erstattung
 Satzungsleistungen Verschreibungsfreie Arzneimittel wieder in der Erstattung Was sind Satzungsleistungen? Der Rahmen für die Leistungen der gesetzlichen Krankenversicherung wird im Fünften Sozialgesetzbuch
Satzungsleistungen Verschreibungsfreie Arzneimittel wieder in der Erstattung Was sind Satzungsleistungen? Der Rahmen für die Leistungen der gesetzlichen Krankenversicherung wird im Fünften Sozialgesetzbuch
Häufig wiederkehrende Fragen zur mündlichen Ergänzungsprüfung im Einzelnen:
 Mündliche Ergänzungsprüfung bei gewerblich-technischen und kaufmännischen Ausbildungsordnungen bis zum 31.12.2006 und für alle Ausbildungsordnungen ab 01.01.2007 Am 13. Dezember 2006 verabschiedete der
Mündliche Ergänzungsprüfung bei gewerblich-technischen und kaufmännischen Ausbildungsordnungen bis zum 31.12.2006 und für alle Ausbildungsordnungen ab 01.01.2007 Am 13. Dezember 2006 verabschiedete der
Krank durch Schlafstörungen
 Seite 1 von 6 I n f o r m a t i o n s m a t e r i a l v o m 1 2. 0 1. 2 0 1 2 Krank durch Schlafstörungen "Die meisten Menschen sterben an ihren Medikamenten und nicht an ihren Krankheiten", meinte der
Seite 1 von 6 I n f o r m a t i o n s m a t e r i a l v o m 1 2. 0 1. 2 0 1 2 Krank durch Schlafstörungen "Die meisten Menschen sterben an ihren Medikamenten und nicht an ihren Krankheiten", meinte der
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Magnevist 2 mmol/l Injektionslösung. Gadopentetsäure, Dimeglumin
 1 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Magnevist 2 mmol/l Injektionslösung Gadopentetsäure, Dimeglumin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor dieses Arzneimittel bei
1 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Magnevist 2 mmol/l Injektionslösung Gadopentetsäure, Dimeglumin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor dieses Arzneimittel bei
Betreff: Citalopram hältige Arzneispezialitäten Änderungen der Fach- und Gebrauchsinformationen
 Datum: 15.11.2011 Kontakt: Mag. pharm. Dr. Ulrike Rehberger Abteilung: Tel. / Fax: +43(0)505 55 36258, DW.Fax-36207 E-Mail: ulrike.rehberger@ages.at Unser Zeichen: 16c-111114-23425-A-PHV Ihr Zeichen: Betreff:
Datum: 15.11.2011 Kontakt: Mag. pharm. Dr. Ulrike Rehberger Abteilung: Tel. / Fax: +43(0)505 55 36258, DW.Fax-36207 E-Mail: ulrike.rehberger@ages.at Unser Zeichen: 16c-111114-23425-A-PHV Ihr Zeichen: Betreff:
10 Antworten zum Thema Generika
 10 Antworten zum Thema Generika Die mit dem Regenbogen Liebe Leserin, Lieber Leser Immer mehr Schweizerinnen und Schweizer leiden unter den jährlich steigenden Gesundheitskosten und Krankenkassenprämien.
10 Antworten zum Thema Generika Die mit dem Regenbogen Liebe Leserin, Lieber Leser Immer mehr Schweizerinnen und Schweizer leiden unter den jährlich steigenden Gesundheitskosten und Krankenkassenprämien.
Screening Das Programm. zur Früherkennung von Brustkrebs
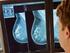 Mammographie Screening Das Programm zur Früherkennung von Brustkrebs das Mammographie Screening Programm Wenn Sie zwischen 50 und 69 Jahre alt sind, haben Sie alle zwei Jahre Anspruch auf eine Mammographie-Untersuchung
Mammographie Screening Das Programm zur Früherkennung von Brustkrebs das Mammographie Screening Programm Wenn Sie zwischen 50 und 69 Jahre alt sind, haben Sie alle zwei Jahre Anspruch auf eine Mammographie-Untersuchung
SVEN-DAVID MÜLLER CHRISTIANE WEISSENBERGER
 SVEN-DAVID MÜLLER CHRISTIANE WEISSENBERGER Ernährungsratgeber Typ-2-Diabetes Genießen erlaubt 18 Diabetes mellitus wichtig zu wissen Alkohol ist generell für Diabetiker nicht geeignet. Fettleber sollten
SVEN-DAVID MÜLLER CHRISTIANE WEISSENBERGER Ernährungsratgeber Typ-2-Diabetes Genießen erlaubt 18 Diabetes mellitus wichtig zu wissen Alkohol ist generell für Diabetiker nicht geeignet. Fettleber sollten
Fruchtbarkeit ist messbar!
 Fruchtbarkeit ist messbar! I n d i v i d u e l l & a u s s a g e k r ä f t i g Bestimmung der individuellen Fruchtbarkeitsreserve Hätten Sie s so genau gewusst? Weibliche Fruchtbarkeit und Lebensalter
Fruchtbarkeit ist messbar! I n d i v i d u e l l & a u s s a g e k r ä f t i g Bestimmung der individuellen Fruchtbarkeitsreserve Hätten Sie s so genau gewusst? Weibliche Fruchtbarkeit und Lebensalter
INFORMATIONEN ZUR NACHSORGE VON ZAHNIMPLANTATEN
 INFORMATIONEN ZUR NACHSORGE VON ZAHNIMPLANTATEN WORIN BESTEHT DIE NACHSORGE? Straumann-Implantate sind eine moderne Möglichkeit für Zahnersatz, wenn ein oder mehrere Zähne fehlen. Diese bekannte und hochwertige
INFORMATIONEN ZUR NACHSORGE VON ZAHNIMPLANTATEN WORIN BESTEHT DIE NACHSORGE? Straumann-Implantate sind eine moderne Möglichkeit für Zahnersatz, wenn ein oder mehrere Zähne fehlen. Diese bekannte und hochwertige
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Clarityn 10 mg - Brausetabletten Wirkstoff: Loratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Clarityn 10 mg - Brausetabletten Wirkstoff: Loratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen
Das NEUE Leistungspaket der Sozialversicherung. Mehr Zahngesundheit für Kinder und Jugendliche bis zum 18. Lebensjahr. Fragen und Antworten
 Das NEUE Leistungspaket der Sozialversicherung Mehr Zahngesundheit für Kinder und Jugendliche bis zum 18. Lebensjahr Fragen und Antworten Stand: Juni 2015 1 Grundsatzfragen zum neuen Leistungspaket 1.1
Das NEUE Leistungspaket der Sozialversicherung Mehr Zahngesundheit für Kinder und Jugendliche bis zum 18. Lebensjahr Fragen und Antworten Stand: Juni 2015 1 Grundsatzfragen zum neuen Leistungspaket 1.1
Boehringer Ingelheim RCV GmbH & Co KG 06.10.2010 / Mac GI Mucosolvan 15 mg - Lutschpastillen Version 2.0 C 1 PACKUNGSBEILAGE
 Mucosolvan 15 mg - Lutschpastillen Version 2.0 C 1 PACKUNGSBEILAGE Mucosolvan 15 mg - Lutschpastillen Version 2.0 C 2 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Mucosolvan 15 mg - Lutschpastillen
Mucosolvan 15 mg - Lutschpastillen Version 2.0 C 1 PACKUNGSBEILAGE Mucosolvan 15 mg - Lutschpastillen Version 2.0 C 2 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Mucosolvan 15 mg - Lutschpastillen
Hirnödeme bei HAE was Patienten wissen sollten
 Hirnödeme bei HAE was Patienten wissen sollten Dieser immer stärker werdende Druck... Starke Kopfschmerzen? Bei HAE kann auch ein Hirnödem die Ursache sein. 2 Ein kaum beachteter Zusammenhang Verspannungen,
Hirnödeme bei HAE was Patienten wissen sollten Dieser immer stärker werdende Druck... Starke Kopfschmerzen? Bei HAE kann auch ein Hirnödem die Ursache sein. 2 Ein kaum beachteter Zusammenhang Verspannungen,
Der Medizinkamm fürs Haar Ein Ratgeber bei Haarausfall für Sie und Ihn
 Der Medizinkamm fürs Haar Ein Ratgeber bei Haarausfall für Sie und Ihn Ein Wort zuvor: Etwas Haarverlust ist ganz natürlich Das große Problem: Erblich bedingter Haarausfall as Leben eines Haares dauert
Der Medizinkamm fürs Haar Ein Ratgeber bei Haarausfall für Sie und Ihn Ein Wort zuvor: Etwas Haarverlust ist ganz natürlich Das große Problem: Erblich bedingter Haarausfall as Leben eines Haares dauert
Soja-Lebensmittel - Quelle von hochwertigem Eiweiß
 Soja-Lebensmittel - Quelle von hochwertigem Eiweiß Thesenpapier des wissenschaftlichen Beirats der ENSA Einleitung Eiweiß ist ein wichtiger Grundnährstoff, der für das Wachstum und die Reparatur aller
Soja-Lebensmittel - Quelle von hochwertigem Eiweiß Thesenpapier des wissenschaftlichen Beirats der ENSA Einleitung Eiweiß ist ein wichtiger Grundnährstoff, der für das Wachstum und die Reparatur aller
Die monatliche Selbstuntersuchung der Brust
 Die monatliche Selbstuntersuchung der Brust Kein Problem: die monatliche Selbstuntersuchung der Brust Hormone steuern nicht nur den weiblichen Monats zyklus, sondern beeinflussen auch das Brustgewebe.
Die monatliche Selbstuntersuchung der Brust Kein Problem: die monatliche Selbstuntersuchung der Brust Hormone steuern nicht nur den weiblichen Monats zyklus, sondern beeinflussen auch das Brustgewebe.
Lineargleichungssysteme: Additions-/ Subtraktionsverfahren
 Lineargleichungssysteme: Additions-/ Subtraktionsverfahren W. Kippels 22. Februar 2014 Inhaltsverzeichnis 1 Einleitung 2 2 Lineargleichungssysteme zweiten Grades 2 3 Lineargleichungssysteme höheren als
Lineargleichungssysteme: Additions-/ Subtraktionsverfahren W. Kippels 22. Februar 2014 Inhaltsverzeichnis 1 Einleitung 2 2 Lineargleichungssysteme zweiten Grades 2 3 Lineargleichungssysteme höheren als
BAnz AT 25.04.2014 B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Wie oft soll ich essen?
 Wie oft soll ich essen? Wie sollen Sie sich als Diabetiker am besten ernähren? Gesunde Ernährung für Menschen mit Diabetes unterscheidet sich nicht von gesunder Ernährung für andere Menschen. Es gibt nichts,
Wie oft soll ich essen? Wie sollen Sie sich als Diabetiker am besten ernähren? Gesunde Ernährung für Menschen mit Diabetes unterscheidet sich nicht von gesunder Ernährung für andere Menschen. Es gibt nichts,
Komplexität der oralen Tumortherapie. Justyna Rawluk 11.11.2015
 Komplexität der oralen Tumortherapie Justyna Rawluk 11.11.2015 Orale Tumortherapie Bessere Kentnisse der molekulargenetischen Biologie des Tumors => Entdeckung der zahlreichen molekularen therapeutischen
Komplexität der oralen Tumortherapie Justyna Rawluk 11.11.2015 Orale Tumortherapie Bessere Kentnisse der molekulargenetischen Biologie des Tumors => Entdeckung der zahlreichen molekularen therapeutischen
Gebrauchsinformation: Information für Anwender. Cyprostol - Tabletten Wirkstoff: Misoprostol
 1 Gebrauchsinformation: Information für Anwender Cyprostol - Tabletten Wirkstoff: Misoprostol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
1 Gebrauchsinformation: Information für Anwender Cyprostol - Tabletten Wirkstoff: Misoprostol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
Orale Target-Therapie mit dem mtor-inhibitor Everolimus (Afinitor )
 221 18 18.3 Zweitlinientherapie 18.3.1 Orale Target-Therapie mit dem mtor-inhibitor Everolimus (Afinitor ) Orale Target-Therapie mit dem mtor-inhibitor Everolimus (Afinitor ) Fortgeschrittenes Nierenzellkarzinom
221 18 18.3 Zweitlinientherapie 18.3.1 Orale Target-Therapie mit dem mtor-inhibitor Everolimus (Afinitor ) Orale Target-Therapie mit dem mtor-inhibitor Everolimus (Afinitor ) Fortgeschrittenes Nierenzellkarzinom
