BIOCHEMIE des Stoffwechsels ( )
|
|
|
- Felix Bieber
- vor 7 Jahren
- Abrufe
Transkript
1 BIOCHEMIE des Stoffwechsels ( ) 11. Einheit Protein und Aminosäure Stoffwechsel
2 Abbau von Proteinen aus der Nahrung Abbau von zellulären Proteinen Transaminasen und Glutamat-Dehydrogenase Harnstoff-Cyclus Abbau von Aminosäuren
3 Abbau von Proteinen aus der Nahrung
4 Proteine aus der Nahrung sind eine lebenswichtige Aminosäurequelle. Einige Aminosäuren aus der Nahrung sind für den Menschen essentiell, d.h. der Mensch kann sie nicht selbst synthetisieren. Für den Menschen essentielle Aminosäuren sind: Histidin und Lysin Phenylalanin und Tryptophan Threonin Methionin Leucin, Isoleucin und Valin Eine weitere Quelle für Aminosäuren ist der Abbau von zellulären Proteinen, die defekt sind oder nicht benötigt werden.
5 Die Proteinverdauung beginnt im Magen. ph-wert ~ 2. Die meisten Proteine denaturieren in diesem Milieu. Dadurch werden sie für die Proteolyse zugänglich. Sezernierung von Pepsin: unspezifisch, Aktivitätsmaximum bei ph 2.0! Pepsin ist eine saure Endopeptidase mit zwei Asp im aktiven Zentrum
6 Im Dünndarmlumen wird dann der Proteinabbau fortgesetzt. Das Pankreas sezerniert eine Reihe proteolytischer Enzyme als inaktive Zymogene in das Darmlumen, wo sie anschließend in aktive Enzyme umgewandelt werden. Beispiele: Chymotrypsinogen zu Chymotrypsin oder Trypsinogen zu Trypsin. Beides sind Serinproteasen (siehe Einheit 1)
7 Im Dünndarmlumen erfolgt der Abbau zu Tri- und Dipeptiden und freien Aminosäuren. In der Plasmamembran der Dünndarmzellen sitzt das Zn 2+ -hältige Enzym Aminopeptidase N, das Peptide vom N-terminalen Ende verdaut. Anschließend werden die Aminosäuren, Di- und Tripeptide ins Lumen der Dünndarmzellen transportiert und hydrolytisch gespalten. Die freien Aminosäuren werden in den Blutstrom freigesetzt.
8 Abbau von Proteinen aus der Nahrung Abbau von zellulären Proteinen
9 Zelluläre Proteine werden ständig abgebaut und synthetisiert. Manche Proteine haben eine sehr lange Halbwertszeit (z.b. Augenlinsenprotein Crystallin), manche eine kurze Lebenszeit (z.b. die Peptidhormone Insulin oder Glucagon). Auch fehlerhaft synthetisierte (Translationsfehler) oder oxidative geschädigte Proteine müssen entfernt werden. Die Halbwertszeit cytoplasmatischer Proteine hängt von der Natur ihrer aminoterminalen Reste ab (N-Terminus Regel): Beispiel Hefe: Hochgradig stabilisierend: t 1/2 > 20 Stunden: Ala, Cys, Gly, Met, Pro, Ser, Thr, Val Destabilisierende Reste: t 1/ Minuten: Arg, His, Ile, Leu, Lys, Phe, Trp, Tyr Manche Reste destabilisieren nach chemischer Veränderung (Asn, Asp, Gln, Glu)
10 Wie können Zellen erkennen, welche Proteine abgebaut werden sollen? Ubiquitin (8,5 kda, 76 Reste) fungiert in Eukaryoten als Marker. Der carboxyterminale Glycinrest des Ubiquitin (Ub) bindet kovalent an die -Aminogruppen mehrerer Lysinreste an dem jeweiligen abzubauenden Protein.
11 Drei Enzyme sind an der Anheftung des Ubiquitins an das abzubauende Protein beteiligt. E1: ubiquitinaktivierendes Enzym E2: ubiquitinkonjugierendes Enzym E3: Ubiquitin-Protein-Ligase
12 E1: ubiquitinaktivierendes Enzym Aktivierung der Säurefunktion zur Verknüpfung von Ubiquitin über eine (energiereiche) Thioesterbindung mit Sulfhydrylgruppe von E1.
13 E2: ubiquitinkonjugierendes Enzym: Übertragung des aktivierten Ubiquitins auf Sulfhydrylgruppe von E2. E3: Ubiquitin-Protein-Ligase: Transfer des Ubiquitins von E2 auf eine -Aminogruppe des Zielproteins
14 An einem Zielprotein kann eine Kette von Ubiquitinmolekülen hängen. Dies kann das Signal zum Proteinabbau verstärken. Kette entsteht durch Verküpfung der -Aminogruppe des Lys48 eines Ubiquitins an das C-terminale Ende eines weiteren Ubiquitins usw. Halbwertszeit folgt der N-Terminus-Regel. Destabilisierende N-terminale Reste (z.b. Arg oder Leu) begünstigen die rasche Anlagerung von Ubiquitin, Gruppen wie Met oder Pro jedoch nicht.
15 Die N-terminalen Reste werden von E3 gelesen. Im Gegensatz zu E1 und E2 sind E3-Enzyme sehr heterogen, gehören zu unterschiedlichen Proteinfamilien. Die E3-Familie bildet eine der größten Genfamilien des Menschen. Offenbar erfordert die große Vielfalt an Zielproteinen eine große Zahl von E3-Enzymen. Es gibt auch noch andere Signale, die Proteine für den Abbau identifizieren, z.b. Cyclinabbauboxen (cyclin destruction boxes). Das sind Aminosäuresequenzen, die Zellzyklusproteine für den Abbau markieren. Oder PEST-Sequenzen (P-E-S-T: Pro-Glu-Ser-Thr).
16 Letztendlich werden die durch Ubiquitin markierten Proteine an einem riesigen Proteasekomplex, dem Proteasom oder 26S-Proteasom (ATP-abhängige Protease) verdaut. Das Proteasom ist ein Komplex aus einer katalytischen 20S Untereinheit und zwei regulatorischen 19S-Untereinheiten (Caps). Die 20S- Einheit ist aus zwei Homologen Untereinheiten aufgebaut (700 kda). Anordnung: vier Ringe zu je sieben Untereinheiten.
17 Die 20S-Untereinheit ist ein geschlossenes Fass. Der Zugang wird durch die beiden regulatorischen 19S-Untereinheiten gesteuert. Diese binden spezifisch an Polyubiquitinketten. Sie enthalten verschiedene ATPasen. Die Hydrolyse von ATP unterstützt die Entfaltung der Zielproteine und deren Transport in das 20S Proteasom. Im 20S Proteasom werden die Zielproteine, aber nicht die Ubiquitinmoleküle proteolytisch abgebaut. Letztere werden wiederverwendet.
18 Die proteolytisch aktiven Zentren im Inneren der Fassstruktur des 20S-Proteasom sind abgeschirmt. Die -Untereinheiten haben drei Typen von aktiven Zentren mit unterchiedlicher Spezifität. Prominenter Rest: Nucleophile Hydroxylgruppe eines konservierten Threonins (Mechanismus ähnlich den Serinproteasen, siehe Einheit 1)
19 Die Substrate werden sukzessive abgebaut, ohne dass Zwischenstufen freigesetzt werden. Restlänge: 7-9 Aminosäuren Schließlich spaltet eine Isopeptidase in der 19S-Untereinheit intakte Ubiquitin-Moleküle von diesen Peptiden ab. Das Ubiquitin wird wiederverwertet und die Peptidprodukte werden durch andere zelluläre Prozesse zu Aminosäuren abgebaut. Diese werden entweder für Biosynthesen gebraucht oder abgebaut (siehe unten).
20 Mit dem gezielten Proteinabbau über den Ubiquitin-Proteasom- Weg werden auch viele physiologische Prozesse gesteuert. Die abgebauten Proteine sind dann meist regulatorische Proteine. Beispiel: Transkriptionsfaktor NF- B, der Entzündungsreaktionen kontrolliert (NF, nuclear factor). Dieser Faktor wird wiederun durch das (inhibitorische) Protein I- B inaktiviert. Bei Entzündungssignalen, die an membrangebundenen Rezeptoren binden, wird I-kB an zwei Serinresten phosphoryliert. Dadurch entsteht eine E3- Bindungsstelle und I-kB wird nach Ubiquinylierung abgebaut. So wird NF-kB freigesetzt, wandert zum Zellkern und stimuliert die Transkription von Zielgenen. Andere durch gezielten Proteinabbau regulierte Prozesse umfassen Gentranskription, Zellzyklus, Organbildung, circadiane Rythmen, Entzündungsreaktionen, Tumorsuppression, Cholesterinstoffwechsel, Antigenprozessierung usw.)
21 Ubiquitinweg und Proteasom kommen bei allen Eukaryonten vor. Bei Prokaryoten gibt es Homologe zum Proteasom, deren physiologische Rolle ist aber noch in Diskussion. Dagegen ist das Proteasom einiger Archaea sehr ähnlich dem der Eukaryoten (Gesamtstruktur ähnlich, aber unterschiedliche Untereinheitenstruktur und Substratspezifität). Proteasom von Eukaryoten Proteasom von Archaea
22 Ubiquitin kommt bei Prokaryoten nicht vor. Man fand aber homologe Proteine, die an der Biosynthese des Cofaktors Thiamin beteiligt sind: ThiS, ThiF Die Funktionalität ist sehr ähnlich. ThiS (ähnliche Struktur wie Ubiquitin) wird durch das Enzym ThiF aktiviert. ThiF hat hohe Homologie zu eukaryotischem E1. Hat sich aus einem prokaroytischen Biosyntheseweg für Thiamin der eukaryotische Ubiquitin-Proteasom Weg entwickelt?
23 Abbau von Proteinen aus der Nahrung Abbau von zellulären Proteinen Transaminasen und Glutamat-Dehydrogenase
24 Erster Schritt im Aminosäureabbau ist die Abspaltung der -Aminogruppe mittels Aminotransferasen. In Säugern findet diese Reaktion hauptsächlich in der Leber, zu einem geringeren Teil auch im Muskelgewebe statt. Kompartiment: Cytosol und Matrix der Mitochondrien. Es erfolgt der Transfer einer -Aminogruppe von einer -Aminosäure auf eine -Ketosäure ( -Ketoglutarat) unter Bildung von Glutamat. Die Reaktionen sind vollkommen reversibel (siehe auch Einheiten 7 & 8). Zwei Beispiele: Aspartat + -Ketoglutarat Oxalacetat + Glutamat Alanin + -Ketoglutarat Pyruvat + Glutamat
25 Alle Aminotransferasen enthalten die prosthetische Gruppe Pyridoxalphosphat (PLP), das sich vom Pyridoxin (Vitamin B 6 ) ableitet (siehe auch Glycogen-Stoffwechsel). Knüpfung von (intermediär) kovalenter Schiff-Base Leicht basischer Pyridinring und leicht saure phenolische Gruppe: Bildung stabiler tautomere Derivate
26 Die Vitamine werden aus der Nahrung aufgenommen. Vitamine B sind wasserlöslich! Bereits besprochene Vitamine sind in rot dargestellt: Vitamin Thiamin (Vitamin B 1 ) Riboflavin (Vitamin B 2 ) Cofaktor Thiaminpyrophosphat FAD Niacin (Vitamin B 3 ) NAD + Pantothenat (Vitamin B 5 ) Pyridoxin (Vitamin B 6 ) Vitamin B 12 Coenzym A Pyridoxalphosphat: Glykogen- und Aminosäurestoffwechsel Cobalamin (Aminosäure- und Fettsäurestoffwechsel)
27 Pyridoxalphosphat ist in Abwesenheit des Substrates (=Aminosäure) kovalent über eine Schiff-Base mit dem Lysinrest der Transaminase verbunden. In Gegenwart des Substrates verdrängt dieses aber das Lysin:
28 Im nächsten Schritt wird durch das Enzym Transaminase ein Proton am -Kohlenstoffatom der gebundenen Aminosäure abgespalten und ein chinoides Zwischenprodukt entsteht, das am Aldehydkohlenstoffatom reprotoniert wird. Ein Ketimin entsteht. Das Ketimin wird dann zu einer -Ketosäure und Pyridoxaminphosphat (PMP) hydrolysiert: Aminosäure 1 + E-PLP + Ketosäure 1 + E-PMP
29 In weiterer Folge reagiert die zweite -Ketosäure in umgekehrter Reihenfolge mit dem Enzym-Pyridoxaminphosphat (E-PMP) unter Bildung einer zweiten Aminosäure und Regenerierung des Enzym-Pyridoxalphosphat-Komplexes (E-PLP): -Ketosäure 2 + E-PMP Aminosäure 2 + E-PLP Summe beider Teilreaktionen: Aminosäure 1 + -Ketosäure 2 -Ketosäure 1 + Aminosäure 2
30 Transaminase Benachbart zur Bindungsstelle des PLP an Lysin befindet sich ein hochkonserviertes Arginin, das die -Carboxylatgruppe des Substrats (=Aminosäure) bindet und das Substrat richtig orientiert.
31 Von PLP-Enzymen werden auch andere Umwandlungen von Aminosäuren katalysiert, nicht nur Transaminierungen. PLP-Enzyme katalysieren am -Kohlenstoffatom von Aminosäuren auch Decarboxylierungsreaktionen, Desaminierungen, Racemisierungen und Aldolspaltungen. Aminotransferasen labilisieren die Bindung a, Decarboxylasen b und Aldolasen c. Daneben können PLP-Enzyme auch Eliminierungs- und Austauschreaktionen am -Kohlenstoffatom und am -Kohlenstoffatom der der Aminosäuresubstrate durchführen.
32 PLP-Enzyme sind also im Aminosäurestoffwechsel (neben dem Glycogen-Stoffwechsel) weit verbreitet. Folgendes haben sie gemeinsam: 1. Bildung einer Schiff-Base aus dem Aminosäuresubstrat und dem PLP 2. Die protonierte Form des PLP wirkt als Elektronenfalle (Stabilisierung von negativ geladenen Katalyse-Intermediaten, da Elektronen im Pyridinring delokalisiert werden können): elektrophiler Katalysator 3. Die Schiff-Base wird zum Abschluss der Reaktion gespalten.
33 Wie schaffen es aber nun die PLP-Enzyme eine bestimmte der Bindungen am -Kohlenstoffatom zu spalten? Stereoelektronische Kontrolle: Die Bindung, die gespalten werden soll, muss senkrecht zu den delokalisierten -Orbitalen des PLP stehen (dafür sorgt die Enzymarchitektur). In einer Aminosäuretransferase bindet das Aminosäurederivat so, dass die C Bindung senkrecht zu den -Orbitalen steht. Dies begünstigt die Spaltung.
34 Für die notwendige Konformation des Substrates sorgt natürlich die Architektur des aktiven Zentrums des jeweiligen Enzyms.
35 Letztendlich landen die Aminogruppen der Transaminierungsreaktionen am -Ketoglurat und Glutamat entsteht. Glutamat wird dann durch oxidative Desaminierung (Glutamat-Dehydrogenase) zu einem freien Ammonium-Ion umgewandelt. Das Enzym Glutamat-Dehydrogenase ist in der Matrix der Mitochondrien lokalisiert. Dadurch kann das entstehende freie toxische Ammonium abgetrennt werden (der Harnstoff-Cyclus startet in den Mitochondrien).
36 Glutamat-Dehydrogenase: Oxidative Desaminierung mit NAD + oder NADP + als Elektronenakzeptor. Vollkommen reversibel. Normalerweise durch Entfernen von NH 4 + (Harnstoff-Cyclus) angetrieben. Heterolytische Bindungsspaltung Bilanz der durch Aminotransferasen und Glutamat- Dehydrogenase katalysierten Reaktionen: -Aminosäure + NAD + (NADP + ) -Ketosäure + NH 4+ + NADH (NADPH) + H +
37 Zwei Aminosäuren, nämlich Serin und Threonin können durch Dehydratasen auch direkt desaminiert werden (ohne Transaminasen): Serin-Dehydratase: Serin NH Pyruvat Threonin-Dehydratase: Threonin NH Ketobutyrat Mechanismus: Abspaltung eines Protons vom -Kohlenstoffatom und Eliminierung der Hydroxylgruppe vom -Kohlenstoffatom. Ausbildung eines instabilen Intermediats mit einer Doppelbindung.
38 1. Glycogen-Abbau (Einheit 10) 2. Glycolyse (Einheiten 4 & 5) 3. Citrat-Cyclus (Einheit 7) 4. Oxidative Phosphorylierung (Einheit 8) 5. Gluconeogenese (Einheit 9) 6. Harnstoff-Cyclus (Einheit 11) Der Aminosäureabbau findet großteils in der Leber statt. Teilweise können auch andere Gewebe Aminosäuren abbauen. Muskel nutzen z.b. bei längerer Anstrengung und in Fastenperioden (verzeigtkettige) Aminosäuren als Brennstoffquelle. Die Kohlenstoffgerüste werden im Citrat-Cyclus oxidiert, der abgespaltene Stickstoff muss aber zur Leber transportiert werden, da den Muskeln der Harnstoff-Cyclus fehlt. Er wird in Form von Alanin und Glutamin transportiert.
39 1. Glycogen-Abbau (Einheit 10) 2. Glycolyse (Einheiten 4 & 5) 3. Citrat-Cyclus (Einheit 7) 4. Oxidative Phosphorylierung (Einheit 8) 5. Gluconeogenese (Einheit 9) 6. Harnstoff-Cyclus (Einheit 11) Glucose-Alanin- Cyclus Stickstoff wird in Form von Alanin von der Muskulatur zur Leber transportiert. Alanin entsteht durch Transaminierung von Pyruvat: Glutamat + Pyruvat -Ketoglutarat + Alanin Alanin wird ins Blut ausgeschwemmt und von der Leber aufgenommen. Es entsteht wieder Pyruvat, das zur Gluconeogenese verwendet werden kann.
40 Daneben kann Stickstoff auch als Glutamin transportiert werden. Enzym: Glutamin-Synthetase
41 Abbau von Proteinen aus der Nahrung Abbau von zellulären Proteinen Transaminasen und Glutamat-Dehydrogenase Harnstoff-Cyclus
42 Bei den meisten landlebenden Wirbeltieren (und daher auch beim Menschen) wird das Ammonium-Ion in Harnstoff umgewandelt und in dieser Form ausgeschieden. Diese Organismen heißen ureotelisch. Reaktionsweg: Harnstoff-Cyclus. Ort: Leber. Ein Teil wird auch zur Biosynthese stickstoffhaltiger Verbindungen verbraucht. Biosynthese stickstoffhältiger Verbindungen
43 Ureotelische Organismen scheiden überschüssiges Ammonium in Form von Harnstoff aus. Der Harnstoff-Cyclus wurde bereits 1932 von Hans Krebs und Kurt Henseleit vorgeschlagen. Erster aufgeklärter cyclischer Stoffwechselweg. Es ist zu beachten, dass nur ein Stickstoffatom des Harnstoffs aus freiem Ammonium entsteht, das andere stammt aus Aspartat. Der Kohlenstoff stammt aus dem Hydrogencarbonat. Der Harnstoff-Cyclus startet in der Matrix der Mitochondrien und verläuft dann im Cytoplasma.
44 Ammoniak, NH 3, ist eine Base, daher liegt sie in wässriger Form als NH 4 + vor. Die Transportform des CO 2 ist HCO 3 - (Bildung durch Carboanhydrase) Enzym: Carbamoylposphat-Synthetase. Lokalisation: Matrix von Lebermitochondrien. Carbamoylphospat: gemischtes Anhydrid. Hohes Gruppenübertragungspotenzial der Carbamoylgruppe.
45 Die nächste Reaktion des Harnstoff- Cyclus findet ebenfalls noch in der Matrix der Mitochondrien statt. Enzym: Ornithin-Transcarbamoylase Ornithin und Citrullin sind Aminosäuren.
46 Die nachfolgenden Reaktionen des Harnstoff-Cyclus finden im Cytoplasma statt. Citrullin wird ins Cytosol transportiert und kondensiert dort mit Aspartat. Aspartat ist der zweite Stickstoff-Donor des Harnstoffs. Enzym: Argininosuccinat-Synthetase Reaktion durch Spaltung von ATP in AMP und PP i und PP i - Spaltung angetrieben.
47 Die Argininosuccinase spaltet dann das Argininosuccinat in Arginin und Fumarat. Das Kohlenstoffskellett des Aspartats bleibt also in Form von Fumarat erhalten. Fumarat ist Intermediat des Citronensäure-Cyclus.
48 Im letzten Schritt wird Ornithin wieder regeneriert und Harnstoff gebildet. Enzym: Arginase Das Ornithin wird zurück in die Matrix der Mitochondrien transportiert. Harnstoff wird ausgeschieden. Ein Mensch produziert pro Jahr etwa 10 kg Harnstoff (täglich etwa 30 g).
49 CO 2 + NH ATP + Aspartat + 2 H 2 O Harnstoff + 2 ADP + 2 P i + AMP + PP i + Fumarat
50 CO 2 + NH ATP + Aspartat + 2 H 2 O Harnstoff + 2 ADP + 2 P i + AMP + PP i + Fumarat Durch die Synthese von Fumarat ist der Harnstoff-Cyclus auch mit dem Citronensäure-Cyclus verknüpft. Fumarat kann zu Malat hydratisiert werden, Malat zu Oxalacetat oxidiert werden und Oxalacetat ist Ausgangsstoff für die Gluconeogenese.
51 Warum ist Ammonium eigentlich giftig? Sämtliche Defekte des Harnstoff-Cyclus führen zu erhöhten NH 4+ -Spiegel im Blut (Hyperammonämie), die extrem schädlich sind (z.b. irreversible Hirnschädigungen bei Säuglingen). Mögliche Ursache: erhöhter Glutaminspiegel, der osmotische Effekte hervorruft und das Gehirn anschwellen lässt.
52 Terrestrische Vertebraten sind ureotelisch. Sie scheiden überschüssigen Stickstoff als Harnstoff aus. Ammoniotelische Organismen, wie z.b. aquatische Vertebraten und Invertebraten, setzen Stickstoff direkt als NH 4+ frei. Die wässrige Umgebung verdünnt die toxische Substanz. Uricotelische Organismen (Vögel und Reptilien) geben reine Harnsäure ab. Diese wird als ziemlich feste Masse ausgeschieden, enthält nur wenig Wasser. Harnsäure ist auch das Endprodukt des Nukleinsäureabbaus (Salze: Urate).
53 Abbau von Proteinen aus der Nahrung Abbau von zellulären Proteinen Transaminasen und Glutamat-Dehydrogenase Harnstoff-Cyclus Abbau von Aminosäuren
54 So wie bei Kohlenhydraten werden auch die Kohlenstoffe der Aminosäuren letztendlich im Citrat-Cyclus final zu CO 2 oxidiert und die dabei gebildeten Reduktionsäquivalente in der Atmungskette oxidiert. Leucin und Lysin werden ausschließlich zu Acetyl-CoA umgewandelt (ketogene Aminosäuren) und mittels Citrat-Synthase eingeschleust, die anderen Aminosäuren können zu Intermediaten des Citronensäure-Cyclus abgebaut werden (siehe auch anaplerotische Reaktionen des Citronensäure- Cyclus, Einheit 7). geradzahlige
55 Stellen an denen Zwischenprodukte aus dem TCA-Cyclus für anabole Stoffwechselwege abgezogen werden (Citrat, -Ketoglutarat, Succinyl- CoA, Malat, Oxalacetat) Stellen, an denen anaplerotische Reaktionen knapp gewordene Zwischenprodukte nachliefern ( -Ketoglutarat, Succinyl-CoA, Fumarat, Oxalacetat) CO 2 Aminosäuren, Glucose Glucose Aspartat Phenylalanin Tyrosin Fumarat Porphyrine Isoleucin Methionin Valin Oxalacetat Malat Succinat Succinyl-CoA Pyruvat Acetyl-CoA Amphibole Natur des Citrat-Cyclus Fettsäuren Citrat Isocitrat Ketoglutarat Aminosäuren Purine Ungeradzahlige Fettsäuren Steroide
56 Daher können (außer Leucin und Lysin) alle Aminosäuren (und daher Proteine generell) zur Glucose-Synthese verwendet werden. Gluconeogenese: Biosynthese von Glucose aus Vorstufen, die definitionsgemäß keine Kohlenhydrate sind (siehe Einheit 9). Die wichtigsten Vorstufen sind Lactat, Alanin, Pyruvat und Oxalacetat. Prinzipiell aber alle Zwischenprodukte des Citrat-Cyclus, die meisten Aminosäuren (mit Ausnahme Leucin und Lysin) und Glycerin. Man spricht in diesem Zusammenhang auch von glucogenen Aminosäuren. In Säugetieren können geradzahlige Fettsäuren und die Aminosäuren Leucin und Lysin (ketogene Aminosäuren) nicht als Glucose-Vorstufen fungieren. Geradzahlige Fettsäuren und die beiden genannten Aminosäuren werden zu Acetyl-CoA abgebaut und aus Acetyl-CoA kann in Tieren keine Nettosynthese von Zuckern durchgeführt werden (es gibt keinen Glyoxylat-Cyclus, Einheit 7).
57
58 Von den 20 Aminosäuren sind nur Leucin und Lysin vollständig ketogen. Isoleucin, Phenylalanin, Tryptophan und Tyrosin sind sowohl glucogen als auch ketogen. Die restlichen 14 Aminosäuren sind vollständig glucogen.
59 Die auf den folgenden Seiten angeführten detailierten Abbauwege der individuellen Aminosäuren sind nicht Prüfungsstoff.
60 C3-Familie - Umwandlung in Pyruvat Alanin wird direkt durch Transaminierung in Pyruvat umgewandelt: Alanin + -Ketoglutarat Pyruvat + Glutamat Serin wird durch die Serin-Dehydratase desaminiert (siehe vorne): Serin Pyruvat + NH 4 + Cystein kann auf verschiedene Weise in Pyruvat übergeführt werden. Das Schwefelatom kann in verschiedensten chemischen Formen im Stoffwechsel auftreten: H 2 S, SO 3 2-, SCN - etc. Auch Threonin, Glycin und Tryptophan liefern letztendlich Pyruvat.
61
62 C4-Familie - Umwandlung in Oxalacetat Aspartat wird direkt zu Oxalacetat transaminiert: Aspartat + -Ketoglutarat Oxalacetat + Glutamat Aspartat kann aber auch über den Harnstoff-Cyclus in Fumarat übergehen (siehe vorne). Asparagin wird von der Asparaginase zu NH 4+ und Aspartat hydrolysiert.
63 C5-Familie - Umwandlung in -Ketoglutarat Diese Aminosäuren werden zuerst in Glutamat überführt, das dann durch die Glutamat- Dehydrogenase oxidativ zu -Ketoglutarat desaminiert wird. Glutamin wird durch die Glutaminase direkt zu Glutamat und NH 4+ hydrolysiert.
64 Histidin wird in 4-Imidazolon-5-propionat umgewandelt. Anschließend wird die Amidbindung im Ring hydrolytisch gespalten. Die Formiminogruppe wird auf Tetrahydrofolat übertragen (Carrier aktivierter Ein-Kohlenstoff-Einheiten).
65 Arginase
66 Succinyl-CoA Eintrittsstelle für unpolare Aminosäuren Einige Kohlenstoffe der Aminosäuren Methionin, Isoleucin und Valin werden über Succinyl-CoA eingeschleust. Als Zwischenprodukte treten Propionyl-CoA und Methylmalonyl-CoA auf (wie beim Abbau ungeradzahliger Fettsäuren, siehe Einheit 12). HCO 3-, ATP Propionyl-CoA-Carboxylase Methylmalonyl-CoA-Mutase (Vitamin B12-abhängig)
67 Die Vitamine werden aus der Nahrung aufgenommen. Vitamine B sind wasserlöslich! Die Cofaktoren sind in enzymatischen Reaktionen essentiell. Vitamin Thiamin (Vitamin B 1 ) Riboflavin (Vitamin B 2 ) Cofaktor Thiaminpyrophosphat FAD Niacin (Vitamin B 3 ) NAD + Pantothenat (Vitamin B 5 ) Pyridoxin (Vitamin B 6 ) Coenzym A Pyridoxalphosphat: Glykogen- und Aminosäurestoffwechsel Cobalamin (Vitamin B 12 ) Methylcobalamin und 5 - Desoxyadenosylcobalamin (Aminosäure- und Fettsäurestoffwechsel)
68 Beim Abbau von Methionin entsteht S-Adenosylmethionin (SAM) ein verbreiteter Methylgruppendonor in Zellen.
69 Aus Aminosäuren mit verzweigten Seitenketten entstehen Acetyl-CoA, Acetacetat oder Propionyl-CoA.
70 Reduktionsmittel Tetrahydrobiopterin Für den Abbau aromatischer Aminosäuren sind Monooxygenasen und Dioxygenasen nötig.
71
- der oxidative Abbau von Acetyl-CoA (und die somit gebildeten Reduktionsäquivalente) - Lieferung von Substraten für verschiedene Synthesen
 Die Aufgabe des Citratcyklus ist: - der oxidative Abbau von Acetyl-CoA (und die somit gebildeten Reduktionsäquivalente) - Lieferung von Substraten für verschiedene Synthesen Die Aufgabe des Citratcyklus
Die Aufgabe des Citratcyklus ist: - der oxidative Abbau von Acetyl-CoA (und die somit gebildeten Reduktionsäquivalente) - Lieferung von Substraten für verschiedene Synthesen Die Aufgabe des Citratcyklus
Proteinstoffwechsel. Bildung der Aminosäuren. Protein-Abbau der Körperproteine. Protein-Abbau der Nahrungsproteine. Verwertung der Aminosäuren
 Bildung der Aminosäuren Körperproteine 10000 g Nahrungsproteine Proteinstoffwechsel Proteolyse (300 400 g/d) AminosäurePool Verdauung (50 100 g/d) 100 g Vortragender: Dr. W. Helliger Neusynthese aus z.b.
Bildung der Aminosäuren Körperproteine 10000 g Nahrungsproteine Proteinstoffwechsel Proteolyse (300 400 g/d) AminosäurePool Verdauung (50 100 g/d) 100 g Vortragender: Dr. W. Helliger Neusynthese aus z.b.
Wirkungsmechanismen regulatorischer Enzyme
 Wirkungsmechanismen regulatorischer Enzyme Ein Multienzymsystem ist eine Aufeinanderfolge von Enzymen, bei der das Produkt eines vorstehenden Enzyms das Substrat des nächsten Enzyms wird. Ein regulatorisches
Wirkungsmechanismen regulatorischer Enzyme Ein Multienzymsystem ist eine Aufeinanderfolge von Enzymen, bei der das Produkt eines vorstehenden Enzyms das Substrat des nächsten Enzyms wird. Ein regulatorisches
Citratzyklus. Citratzyklus
 Der hat in der Zelle verschiedene Aufgaben. Teilschritte werden z.b. bei manchen Gärungen eingesetzt (Methyl-Malonyl-CoA-Weg). Er ist wichtig zur Bereitstellung verschiedener Vorstufen für Biosynthesen,
Der hat in der Zelle verschiedene Aufgaben. Teilschritte werden z.b. bei manchen Gärungen eingesetzt (Methyl-Malonyl-CoA-Weg). Er ist wichtig zur Bereitstellung verschiedener Vorstufen für Biosynthesen,
Gluconeognese Neusynthese von Glucose aus Pyruvat
 Gluconeognese Neusynthese von Glucose aus Pyruvat Warum notwendig? Das Gehirn ist auf eine konstante Versorgung mit Glucose angewiesen. Eine Unterzuckerung (< 3 4 mmol/l) führt unweigerlich zur Bewußtlosigkeit
Gluconeognese Neusynthese von Glucose aus Pyruvat Warum notwendig? Das Gehirn ist auf eine konstante Versorgung mit Glucose angewiesen. Eine Unterzuckerung (< 3 4 mmol/l) führt unweigerlich zur Bewußtlosigkeit
Stoffwechsel der essentiellen Aminosäuren
 Stoffwechsel der essentiellen Aminosäuren Andrea Schulte aus: Löffler/Petrides, Biochemie und Pathobiochemie, 7. Aufl., Kap. 15.3 Gliederung Einleitung: essentielle Aminosäuren, Biosynthese Abbau, Stoffwechselbedeutung
Stoffwechsel der essentiellen Aminosäuren Andrea Schulte aus: Löffler/Petrides, Biochemie und Pathobiochemie, 7. Aufl., Kap. 15.3 Gliederung Einleitung: essentielle Aminosäuren, Biosynthese Abbau, Stoffwechselbedeutung
Biochemie Übungsblatt Nr Fettsäuresynthese:
 Fettsäuresynthese: 1) Mit Hilfe des mitochondriale ACP? AcetylCoA Carrboxylase (Biothin als prosth. Gruppe) AcetylCoA + Kohlendioxid + ATP MalonylCoA + ADP + P 2)? Reguliert durch Insulin (Insulin hemmt
Fettsäuresynthese: 1) Mit Hilfe des mitochondriale ACP? AcetylCoA Carrboxylase (Biothin als prosth. Gruppe) AcetylCoA + Kohlendioxid + ATP MalonylCoA + ADP + P 2)? Reguliert durch Insulin (Insulin hemmt
Der Energiestoffwechsel eukaryotischer Zellen
 Der Energiestoffwechsel eukaryotischer Zellen Der Abbau (Katabolismus/Veratmung/Verbrennung) reduzierter Kohlenstoffverbindungen (Glukose, Fettsäuren, Aminosäuren) bzw. deren makromolekularer Speicher
Der Energiestoffwechsel eukaryotischer Zellen Der Abbau (Katabolismus/Veratmung/Verbrennung) reduzierter Kohlenstoffverbindungen (Glukose, Fettsäuren, Aminosäuren) bzw. deren makromolekularer Speicher
Was ist denn NAD / NADP??
 Exkurs Oxidative Desaminierung: Was ist denn NAD / NADP?? Exkurs Oxidative Desaminierung: NAD / NADP gehört zum Vitamin B2- Komplex Nikotinsäureamid = Nikotinamid= Vit B3 Exkurs Oxidative Desaminierung:
Exkurs Oxidative Desaminierung: Was ist denn NAD / NADP?? Exkurs Oxidative Desaminierung: NAD / NADP gehört zum Vitamin B2- Komplex Nikotinsäureamid = Nikotinamid= Vit B3 Exkurs Oxidative Desaminierung:
Aminosäuren 1. Aufbau der Aminosäuren
 Aminosäuren 1 Aufbau der Aminosäuren Aminosäuren bestehen aus einer Carbonsäuregruppe und einer Aminogruppe. Die einfachste Aminosäure ist das Glycin mit 2 Kohlenstoffatomen. Das Kohlenstoffatom nach der
Aminosäuren 1 Aufbau der Aminosäuren Aminosäuren bestehen aus einer Carbonsäuregruppe und einer Aminogruppe. Die einfachste Aminosäure ist das Glycin mit 2 Kohlenstoffatomen. Das Kohlenstoffatom nach der
Klausurbogen im Studiengang B.Sc. Biologie Modul BSc-Bio-7, Teilklausur Biochemie vom
 Johann Wolfgang Goethe-Universität Frankfurt am Main Deckblatt Fachbereich Biowissenschaften Klausurbogen im Studiengang B.Sc. Biologie Modul BSc-Bio-7, Teilklausur Biochemie vom 08.12.2008 Name: Vorname:
Johann Wolfgang Goethe-Universität Frankfurt am Main Deckblatt Fachbereich Biowissenschaften Klausurbogen im Studiengang B.Sc. Biologie Modul BSc-Bio-7, Teilklausur Biochemie vom 08.12.2008 Name: Vorname:
Peptide Proteine. 1. Aminosäuren. Alle optisch aktiven proteinogenen Aminosäuren gehören der L-Reihe an: 1.1 Struktur der Aminosäuren
 1. Aminosäuren Aminosäuren Peptide Proteine Vortragender: Dr. W. Helliger 1.1 Struktur 1.2 Säure-Basen-Eigenschaften 1.2.1 Neutral- und Zwitterion-Form 1.2.2 Molekülform in Abhängigkeit vom ph-wert 1.3
1. Aminosäuren Aminosäuren Peptide Proteine Vortragender: Dr. W. Helliger 1.1 Struktur 1.2 Säure-Basen-Eigenschaften 1.2.1 Neutral- und Zwitterion-Form 1.2.2 Molekülform in Abhängigkeit vom ph-wert 1.3
Mathematik und Naturwissenschaften, Biologie, Biochemie. Biochemie II - Tutorium
 Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 20.10.2016 Alexander Götze 3.Semester Molekulare Biotechnologie a.goetze2207@googlemail.com Mi. 2DS DRU. 68 H Michel
Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 20.10.2016 Alexander Götze 3.Semester Molekulare Biotechnologie a.goetze2207@googlemail.com Mi. 2DS DRU. 68 H Michel
Citratzyklus. Biochemie Maria Otto,Bo Mi Ok Kwon Park
 Citratzyklus Biochemie 13.12.2004 Maria Otto,Bo Mi Ok Kwon Park O CH 3 C Acetyl-CoA + H 2 O HO C COO C NADH O C H Citrat Cis-Aconitat H C Malat Citratzyklus HO C H Isocitrat CH H 2 O Fumarat C = O FADH
Citratzyklus Biochemie 13.12.2004 Maria Otto,Bo Mi Ok Kwon Park O CH 3 C Acetyl-CoA + H 2 O HO C COO C NADH O C H Citrat Cis-Aconitat H C Malat Citratzyklus HO C H Isocitrat CH H 2 O Fumarat C = O FADH
Klausur zur Vorlesung Biochemie I im WS 2001/02
 (insgesamt 100 Punkte, mindestens 40 erforderlich) Klausur zur Vorlesung Biochemie I im WS 2001/02 am 18.02.2002 von 08.15 09.45 Uhr Gebäude 52, Raum 207 Bitte Namen, Matrikelnummer und Studienfach unbedingt
(insgesamt 100 Punkte, mindestens 40 erforderlich) Klausur zur Vorlesung Biochemie I im WS 2001/02 am 18.02.2002 von 08.15 09.45 Uhr Gebäude 52, Raum 207 Bitte Namen, Matrikelnummer und Studienfach unbedingt
Fettsäurebiosynthese
 Fettsäurebiosynthese Inhalt Fettsäuren Triacylglyceride FS-Biosynthese und einzelne Schritte Fettsäuren Lange CH-Ketten mit einer endständigen Carboxylgruppe 3 Gruppen: -> gesättigte FS -> einfach ungesättigte
Fettsäurebiosynthese Inhalt Fettsäuren Triacylglyceride FS-Biosynthese und einzelne Schritte Fettsäuren Lange CH-Ketten mit einer endständigen Carboxylgruppe 3 Gruppen: -> gesättigte FS -> einfach ungesättigte
Primärstoffwechsel. Prof. Dr. Albert Duschl
 Primärstoffwechsel Prof. Dr. Albert Duschl Aufgaben Der Primärstoffwechsel sorgt für Aufbau (Anabolismus) und Abbau (Katabolismus) biologischer Moleküle, wie Aminosäuren, Lipide, Kohlenhydrate und Nukleinsäuren.
Primärstoffwechsel Prof. Dr. Albert Duschl Aufgaben Der Primärstoffwechsel sorgt für Aufbau (Anabolismus) und Abbau (Katabolismus) biologischer Moleküle, wie Aminosäuren, Lipide, Kohlenhydrate und Nukleinsäuren.
Was bisher geschah 1
 Was bisher geschah 1 Zellatmung (Übersicht) Der Citratcyclus ist die erste Stufe der Zellatmung 2 Citratzyklus Synonyme: Tricarbonsäurezyklus (TCA-Zyklus) Krebszyklus, Zitronensäurezyklus Der Zyklus ist
Was bisher geschah 1 Zellatmung (Übersicht) Der Citratcyclus ist die erste Stufe der Zellatmung 2 Citratzyklus Synonyme: Tricarbonsäurezyklus (TCA-Zyklus) Krebszyklus, Zitronensäurezyklus Der Zyklus ist
Regulation der Glykolyse: Phosphofructokinase
 Regulation der Glykolyse: Phosphofructokinase Abbauwege des Pyruvats Weitere Oxidation (zu CO 2 ) Alkoholische Gärung Pyruvat- Decarboxylase Alkohol- Dehydrogenase NAD + wird bei der Gärung regneriert,
Regulation der Glykolyse: Phosphofructokinase Abbauwege des Pyruvats Weitere Oxidation (zu CO 2 ) Alkoholische Gärung Pyruvat- Decarboxylase Alkohol- Dehydrogenase NAD + wird bei der Gärung regneriert,
Biochemie (für Bioinformatiker) WS 2010/2011, 2. Klausur (50 Punkte)
 Datum: 07.02.2011 Name: Matrikel-Nr.: Vorname: Studiengang: Bioinformatik Biochemie (für Bioinformatiker) WS 2010/2011, 2. Klausur (50 Punkte) Modulnr.: FMI-BI0027 Hiermit bestätige ich meine Prüfungstauglichkeit.
Datum: 07.02.2011 Name: Matrikel-Nr.: Vorname: Studiengang: Bioinformatik Biochemie (für Bioinformatiker) WS 2010/2011, 2. Klausur (50 Punkte) Modulnr.: FMI-BI0027 Hiermit bestätige ich meine Prüfungstauglichkeit.
Energie aus Aminosäuren - Wundermittel Protein?
 Jeder von uns kennt die Versprechen der Eiweißshakes: Mehr Proteine machen dich schlank, jung und wunderschön. Aber was haben Proteine an sich, das diese Versprechen rechtfertigt? Dies ist der vierte Teil
Jeder von uns kennt die Versprechen der Eiweißshakes: Mehr Proteine machen dich schlank, jung und wunderschön. Aber was haben Proteine an sich, das diese Versprechen rechtfertigt? Dies ist der vierte Teil
-Klausur Biochemie Name: Matrikelnr.: 1. a) Erklären Sie, warum ist Wasser gutes Lösungsmittel von Salzen und polaren Biomolekülen ist.
 4.07.205 Name: Matrikelnr.:. a) Erklären Sie, warum ist Wasser gutes Lösungsmittel von Salzen und polaren Biomolekülen ist. 2. Was bedeutet es, wenn eine schwache Säure einen pks von 5 hat? 3. Nennen Sie
4.07.205 Name: Matrikelnr.:. a) Erklären Sie, warum ist Wasser gutes Lösungsmittel von Salzen und polaren Biomolekülen ist. 2. Was bedeutet es, wenn eine schwache Säure einen pks von 5 hat? 3. Nennen Sie
Z11 GRUNDLAGEN DER BIOCHEMIE STOFFWECHSELWEGE 1) DIE WICHTIGSTEN STOFFWECHSELWEGE: 2) ÜBERSICHT ÜBER DEN ENERGIESTOFFWECHSEL
 GRUNDLAGEN DER BIOCHEMIE STOFFWECHSELWEGE 1) DIE WICHTIGSTEN STOFFWECHSELWEGE: Fette und Kohlenhydrate aus der Nahrung nutzt der Körper hauptsächlich zur Energiegewinnung. Proteine aus der Nahrung werden
GRUNDLAGEN DER BIOCHEMIE STOFFWECHSELWEGE 1) DIE WICHTIGSTEN STOFFWECHSELWEGE: Fette und Kohlenhydrate aus der Nahrung nutzt der Körper hauptsächlich zur Energiegewinnung. Proteine aus der Nahrung werden
15. Aminosäuren, Peptide und Proteine
 15. Aminosäuren, Peptide und Proteine 1 Proteine (Polypeptide) erfüllen in biologischen ystemen die unterschiedlichsten Funktionen. o wirken sie z.b. bei vielen chemischen eaktionen in der atur als Katalysatoren
15. Aminosäuren, Peptide und Proteine 1 Proteine (Polypeptide) erfüllen in biologischen ystemen die unterschiedlichsten Funktionen. o wirken sie z.b. bei vielen chemischen eaktionen in der atur als Katalysatoren
Punkte 1. a) Erklären Sie wieso das Wassermolekül ein Dipol ist (gerne mit Zeichnung).
 -Klausur Biochemie - 20.07.6 Nur vollständige Reaktionsgleichungen, Berechnungen und Antworten werden als Lösung der Aufgaben gewertet, das Ergebnis alleine genügt nicht. Der Rechengang muß ersichtlich
-Klausur Biochemie - 20.07.6 Nur vollständige Reaktionsgleichungen, Berechnungen und Antworten werden als Lösung der Aufgaben gewertet, das Ergebnis alleine genügt nicht. Der Rechengang muß ersichtlich
Z 11 GRUNDLAGEN DER BIOCHEMIE STOFFWECHSELWEGE 1) DIE WICHTIGSTEN STOFFWECHSELWEGE: 2) ÜBERSICHT ÜBER DEN ENERGIESTOFFWECHSEL
 GRUNDLAGEN DER BIOCHEMIE STOFFWECHSELWEGE Zusammenfassung Zusammenfassung Kapitel 11 1) DIE WICHTIGSTEN STOFFWECHSELWEGE: Fette und Kohlenhydrate aus der Nahrung nutzt der Körper hauptsächlich zur Energiegewinnung.
GRUNDLAGEN DER BIOCHEMIE STOFFWECHSELWEGE Zusammenfassung Zusammenfassung Kapitel 11 1) DIE WICHTIGSTEN STOFFWECHSELWEGE: Fette und Kohlenhydrate aus der Nahrung nutzt der Körper hauptsächlich zur Energiegewinnung.
Kataboler und Anaboler Stoffwechsel
 Vorlesung Vom Molekül zur Zelle Ao.Univ.Prof. Dr. Georg Weitzer Fortsetzung von Block 3 nach Prof. Müllner, ab 8.1. Kataboler und Anaboler Stoffwechsel Aktuelle Folien unter http://homepage.univie.ac.at/georg.weitzer/lectures.html
Vorlesung Vom Molekül zur Zelle Ao.Univ.Prof. Dr. Georg Weitzer Fortsetzung von Block 3 nach Prof. Müllner, ab 8.1. Kataboler und Anaboler Stoffwechsel Aktuelle Folien unter http://homepage.univie.ac.at/georg.weitzer/lectures.html
52: Welche der Coenzyme sind an der oxidativen Decarboxylierung von Pyruvat beteiligt? 1) Thiaminpyrophosphat
 2. Testat Biochemie 93/94 - Teil B (Leider ist dies nur ein Teil der Fragen!) 52: Welche der Coenzyme sind an der oxidativen Decarboxylierung von Pyruvat beteiligt? 1) Thiaminpyrophosphat 3) Biotin 2)
2. Testat Biochemie 93/94 - Teil B (Leider ist dies nur ein Teil der Fragen!) 52: Welche der Coenzyme sind an der oxidativen Decarboxylierung von Pyruvat beteiligt? 1) Thiaminpyrophosphat 3) Biotin 2)
Atmung Übersicht. Atmung der Mitochondrien
 Atmung der Mitochondrien Atmung Übersicht e - Transportkette REAKTION: C 6 H 12 O 6 + 6O 2 6CO 2 + 6H 2 O + Energie (Glucose) (Sauerstoff) (Kohlendioxid) (Wasser) Nur ca. 40% der Energie wird zu ATP Der
Atmung der Mitochondrien Atmung Übersicht e - Transportkette REAKTION: C 6 H 12 O 6 + 6O 2 6CO 2 + 6H 2 O + Energie (Glucose) (Sauerstoff) (Kohlendioxid) (Wasser) Nur ca. 40% der Energie wird zu ATP Der
Biochemie II - Tutorium
 Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 16.11.2016 Ablauf des Tutoriums Einführung und Wiederholung Vorlesungszusammenfassung Übungsaufgaben Selbststudium
Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 16.11.2016 Ablauf des Tutoriums Einführung und Wiederholung Vorlesungszusammenfassung Übungsaufgaben Selbststudium
Musterlösung. Frage Summe Note Punkte 1, ,5 1,0
 Biochemische Teilklausur zum Grundmodul 0 im Bachelor-Studiengang Biowissenschaften (neue Prüfungsordnung Dauer Std.), 2. 2. 203, 8:00-9:00 Uhr, Sporthalle, sowie Biochemische Teilklausur zum Grundmodul
Biochemische Teilklausur zum Grundmodul 0 im Bachelor-Studiengang Biowissenschaften (neue Prüfungsordnung Dauer Std.), 2. 2. 203, 8:00-9:00 Uhr, Sporthalle, sowie Biochemische Teilklausur zum Grundmodul
Aufgabe 2: (Aminosäuren)
 Aufgabe 2: (Aminosäuren) Aufgabenstellung Die 20 Aminosäuren (voller Name, 1- und 3-Buchstaben-Code) sollen identifiziert und mit RasMol grafisch dargestellt werden. Dann sollen die AS sinnvoll nach ihren
Aufgabe 2: (Aminosäuren) Aufgabenstellung Die 20 Aminosäuren (voller Name, 1- und 3-Buchstaben-Code) sollen identifiziert und mit RasMol grafisch dargestellt werden. Dann sollen die AS sinnvoll nach ihren
Proteinogene Aminosäuren. Unpolare, aliphatische Seitenketten Monoaminomonocarbonsäuren
 Proteinogene Aminosäuren Unpolare, aliphatische Seitenketten Monoaminomonocarbonsäuren Proteinogene Aminosäuren Unpolare, heterozyklische Seitenkette Monoaminomonocarbonsäuren Proteinogene Aminosäuren
Proteinogene Aminosäuren Unpolare, aliphatische Seitenketten Monoaminomonocarbonsäuren Proteinogene Aminosäuren Unpolare, heterozyklische Seitenkette Monoaminomonocarbonsäuren Proteinogene Aminosäuren
Pentosephosphat-Weg: alternativer Abbau von Glucose. Wird auch als Hexosemonophosphatweg (HMW) oder Phosphogluconat-Cyclus bezeichnet.
 Pentosephosphat-Weg: alternativer Abbau von Glucose Wird auch als Hexosemonophosphatweg (HMW) oder Phosphogluconat-Cyclus bezeichnet. Er liefert NADPH und Ribose-5-phosphat. NADPH ist die 2. Währung der
Pentosephosphat-Weg: alternativer Abbau von Glucose Wird auch als Hexosemonophosphatweg (HMW) oder Phosphogluconat-Cyclus bezeichnet. Er liefert NADPH und Ribose-5-phosphat. NADPH ist die 2. Währung der
Zellulärer Abbau von Proteinen in Aminosäuren:! Proteine werden in Zellen durch Proteasom-Komplexe in! einzelne Aminosäuren abgebaut.!
 Zellulärer Abbau von Proteinen in Aminosäuren: Proteine werden in Zellen durch Proteasom-Komplexe in einzelne Aminosäuren abgebaut. Abbau von Aminosäuren: Uebersicht über den Aminosäureabbau Als erster
Zellulärer Abbau von Proteinen in Aminosäuren: Proteine werden in Zellen durch Proteasom-Komplexe in einzelne Aminosäuren abgebaut. Abbau von Aminosäuren: Uebersicht über den Aminosäureabbau Als erster
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Die gentechnische Produktion von Insulin - Selbstlerneinheit zur kontextorientierten Wiederholung der molekularen Genetik Das komplette
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Die gentechnische Produktion von Insulin - Selbstlerneinheit zur kontextorientierten Wiederholung der molekularen Genetik Das komplette
Folsäure. Struktur = Pteroylglutamat; PteGLU n
 Folsäure Struktur = Pteroylglutamat; PteGLU n Biochemische Wirkungsweise Übertragung von C1-Einheiten; Wirksame Form ist das Tetrahydrofolat (H 4 -Folat), das durch Serin in das N 5,N 10 -Methylentetrahydrofolat
Folsäure Struktur = Pteroylglutamat; PteGLU n Biochemische Wirkungsweise Übertragung von C1-Einheiten; Wirksame Form ist das Tetrahydrofolat (H 4 -Folat), das durch Serin in das N 5,N 10 -Methylentetrahydrofolat
-Klausur Biochemie Name:
 -Klausur Biochemie -03.02.5 Name: Nur vollständige Reaktionsgleichungen, Berechnungen und Antworten werden als Lösung der Aufgaben gewertet, das Ergebnis alleine genügt nicht. Der Rechengang muß ersichtlich
-Klausur Biochemie -03.02.5 Name: Nur vollständige Reaktionsgleichungen, Berechnungen und Antworten werden als Lösung der Aufgaben gewertet, das Ergebnis alleine genügt nicht. Der Rechengang muß ersichtlich
Nichtessentielle Aminosäuren. Stoffwechsel Nahrungskarenz
 Nichtessentielle Aminosäuren Stoffwechsel Nahrungskarenz Einleitung 11 nichtessentielle AS Können von Säugetierzellen selbstsynthetisiert werden. Im Vergleich zu essentiellen AS einfache Synthesewege Nichtessentiell
Nichtessentielle Aminosäuren Stoffwechsel Nahrungskarenz Einleitung 11 nichtessentielle AS Können von Säugetierzellen selbstsynthetisiert werden. Im Vergleich zu essentiellen AS einfache Synthesewege Nichtessentiell
Praktikum Biochemie B.Sc. Water Science WS Enzymregulation. Marinja Niggemann, Denise Schäfer
 Praktikum Biochemie B.Sc. Water Science WS 2011 Enzymregulation Marinja Niggemann, Denise Schäfer Regulatorische Strategien 1. Allosterische Wechselwirkung 2. Proteolytische Aktivierung 3. Kovalente Modifikation
Praktikum Biochemie B.Sc. Water Science WS 2011 Enzymregulation Marinja Niggemann, Denise Schäfer Regulatorische Strategien 1. Allosterische Wechselwirkung 2. Proteolytische Aktivierung 3. Kovalente Modifikation
Der Fettsäurestoffwechsel. Basierend auf Stryer Kapitel 22
 Der Fettsäurestoffwechsel Basierend auf Stryer Kapitel 22 1 CoA 2 3 Überblick 4 Ein paar Grundlagen... Carbonsäure Alkohol Carbonsäureester Eine Acyl-Gruppe 5 Eine Acyl-Gruppe H O Formyl H 3 C O Acetyl
Der Fettsäurestoffwechsel Basierend auf Stryer Kapitel 22 1 CoA 2 3 Überblick 4 Ein paar Grundlagen... Carbonsäure Alkohol Carbonsäureester Eine Acyl-Gruppe 5 Eine Acyl-Gruppe H O Formyl H 3 C O Acetyl
BIOCHEMIE des Stoffwechsels ( )
 BIOCHEMIE des Stoffwechsels (772.113) 7. Einheit Citrat- und Glyoxylat-Cyclus Citrat-Cyclus Allgemeines Reaktionsfolge Thermodynamik und Regulation Amphibole Natur des Citrat-Cyclus Anaplerotische Reaktionen
BIOCHEMIE des Stoffwechsels (772.113) 7. Einheit Citrat- und Glyoxylat-Cyclus Citrat-Cyclus Allgemeines Reaktionsfolge Thermodynamik und Regulation Amphibole Natur des Citrat-Cyclus Anaplerotische Reaktionen
Biochemie II - Tutorium
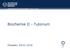 Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 04.01.2016 Zellkern Lipidtröpfchen Nucleotidmetabolismus Glykogen- Stoffwechsel Pentosephosephatweg Glucose Glucose
Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 04.01.2016 Zellkern Lipidtröpfchen Nucleotidmetabolismus Glykogen- Stoffwechsel Pentosephosephatweg Glucose Glucose
Energiestoffwechsel --- Aminosäuren. Prof. Dr. Martin van der Laan
 Energiestoffwechsel --- Aminosäuren Prof. Dr. Martin van der Laan Stoffwechsel von Aminosäuren (Überblick) Aminosäure N 3 + R C α Desaminierung Transaminierung Decarboxylierung CO 2 N 3 + R C (Biogenes)
Energiestoffwechsel --- Aminosäuren Prof. Dr. Martin van der Laan Stoffwechsel von Aminosäuren (Überblick) Aminosäure N 3 + R C α Desaminierung Transaminierung Decarboxylierung CO 2 N 3 + R C (Biogenes)
Pharmazeutische Biologie Grundlagen der Biochemie
 Pharmazeutische Biologie Grundlagen der Biochemie Prof. Dr. Theo Dingermann Institut für Pharmazeutische Biologie Goethe-Universität Frankfurt Dingermann@em.uni-frankfurt.de Aminosäure... chirale Moleküle
Pharmazeutische Biologie Grundlagen der Biochemie Prof. Dr. Theo Dingermann Institut für Pharmazeutische Biologie Goethe-Universität Frankfurt Dingermann@em.uni-frankfurt.de Aminosäure... chirale Moleküle
Aminosäuren & Ketosäuren BIOGENE AMINE
 BIOGENE AMINE Von Mohammed Jaber BIOGENE AMINE: Biogene Amine sind AS ohne COOH-Gruppe! Und warum sind sie so wichtig? Von Mohammed Jaber und Proteine BIOGENE AMINE: Durch die Abspaltung der COOH- Gruppe
BIOGENE AMINE Von Mohammed Jaber BIOGENE AMINE: Biogene Amine sind AS ohne COOH-Gruppe! Und warum sind sie so wichtig? Von Mohammed Jaber und Proteine BIOGENE AMINE: Durch die Abspaltung der COOH- Gruppe
Aminosäuren - Proteine
 Aminosäuren - Proteine ÜBERBLICK D.Pflumm KSR / MSE Aminosäuren Überblick Allgemeine Formel für das Grundgerüst einer Aminosäure Carboxylgruppe: R-COOH O Aminogruppe: R-NH 2 einzelnes C-Atom (α-c-atom)
Aminosäuren - Proteine ÜBERBLICK D.Pflumm KSR / MSE Aminosäuren Überblick Allgemeine Formel für das Grundgerüst einer Aminosäure Carboxylgruppe: R-COOH O Aminogruppe: R-NH 2 einzelnes C-Atom (α-c-atom)
10 BIOGENE-AMINE 4 NICHT-PROTEINOGENE- AS. 20 PROTEINOGENE AS glucoplastisch/ketoplastisch 8 ESSENTIELLE AS
 Für uns! - es gibt 20 AS Diese sind wiederum aufgeteilt in: Neutrale AS Saure AS Basische AS Schwefelhaltige AS Aromatische AS Heterocyklische AS - es gibt 20 AS - davon sind 8 essentiell d.h.: der Körper
Für uns! - es gibt 20 AS Diese sind wiederum aufgeteilt in: Neutrale AS Saure AS Basische AS Schwefelhaltige AS Aromatische AS Heterocyklische AS - es gibt 20 AS - davon sind 8 essentiell d.h.: der Körper
Die Pyrimidinsynthese
 Die Pyrimidinsynthese Bei der Pyrimidinsynthese wird zunächst der 6-Ring, also die Base zusammengefügt. Erst anschließend kommt es zum Anknüpfen der Ribose. Lokalisation: Zytoplasma Der Ausgang, der
Die Pyrimidinsynthese Bei der Pyrimidinsynthese wird zunächst der 6-Ring, also die Base zusammengefügt. Erst anschließend kommt es zum Anknüpfen der Ribose. Lokalisation: Zytoplasma Der Ausgang, der
Aminosäurestoffwechsel I. Grundlagen und Ammoniak-Stoffwechsel COO- +H 3 C R. Johannes Schmidt; Matthias Schnepper
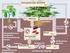 Aminosäurestoffwechsel I Grundlagen und Ammoniak-Stoffwechsel OO- 3 N R Johannes Schmidt; Matthias Schnepper Einführung Gliederung: Struktur und Einteilung der Aminosäuren Grundzüge des Aminosäurestoffwechsels
Aminosäurestoffwechsel I Grundlagen und Ammoniak-Stoffwechsel OO- 3 N R Johannes Schmidt; Matthias Schnepper Einführung Gliederung: Struktur und Einteilung der Aminosäuren Grundzüge des Aminosäurestoffwechsels
- Biochemieklausur Name: Matrikelnr.:
 07.02.207 Name: Matrikelnr.: Nur vollständige Reaktionsgleichungen, Berechnungen und Antworten werden als Lösung der Aufgaben gewertet, das Ergebnis alleine genügt nicht. Der Rechengang muß ersichtlich
07.02.207 Name: Matrikelnr.: Nur vollständige Reaktionsgleichungen, Berechnungen und Antworten werden als Lösung der Aufgaben gewertet, das Ergebnis alleine genügt nicht. Der Rechengang muß ersichtlich
Reaktionen der Zellatmung (1)
 ARBEITSBLATT 1 Reaktionen der Zellatmung (1) 1. Benennen Sie den dargestellten Stoffwechselweg und die beteiligten Substanzen! CoA-S Acetyl-CoA Citrat Oxalacetat Isocitrat Malat Citratzyklus α-ketoglutarat
ARBEITSBLATT 1 Reaktionen der Zellatmung (1) 1. Benennen Sie den dargestellten Stoffwechselweg und die beteiligten Substanzen! CoA-S Acetyl-CoA Citrat Oxalacetat Isocitrat Malat Citratzyklus α-ketoglutarat
Hemmung der Enzym-Aktivität
 Enzym - Inhibitoren Wie wirkt Penicillin? Wie wirkt Aspirin? Welche Rolle spielt Methotrexat in der Chemotherapie? Welche Wirkstoffe werden gegen HIV entwickelt? Hemmung der Enzym-Aktivität Substrat Kompetitiver
Enzym - Inhibitoren Wie wirkt Penicillin? Wie wirkt Aspirin? Welche Rolle spielt Methotrexat in der Chemotherapie? Welche Wirkstoffe werden gegen HIV entwickelt? Hemmung der Enzym-Aktivität Substrat Kompetitiver
Metabolisierung des Aminosäure-Kohlestoffgerüstes
 Metabolisierung des Aminosäure-Kohlestoffgerüstes Abbau zu 7 wichtigen Molekülen: Pyruvat, Acetyl-CoA, Acetoacetyl-CoA, -Ketoglutarat, Succinyl-CoA, Fumarat, Oxalacetat >> also zu 4 Intermediaten des Citratzyklus,
Metabolisierung des Aminosäure-Kohlestoffgerüstes Abbau zu 7 wichtigen Molekülen: Pyruvat, Acetyl-CoA, Acetoacetyl-CoA, -Ketoglutarat, Succinyl-CoA, Fumarat, Oxalacetat >> also zu 4 Intermediaten des Citratzyklus,
Organische Chemie der biologischen Stoffwechselwege
 Organische Chemie der biologischen Stoffwechselwege John McMurry / Tadhg Begley aus dem Amerikanischen übersetzt von Karin Beifuss ELSEVIER SPEKTRUM AKADEMISCHER VERLAG Spektrum k_/l AKADEMISCHER VERLAG
Organische Chemie der biologischen Stoffwechselwege John McMurry / Tadhg Begley aus dem Amerikanischen übersetzt von Karin Beifuss ELSEVIER SPEKTRUM AKADEMISCHER VERLAG Spektrum k_/l AKADEMISCHER VERLAG
1. Biochemie-Klausur Zahnmediziner, WS 03/04
 1. Biochemie-Klausur Zahnmediziner, WS 03/04 1. Welche Aussage zur ß-Oxidation von Fettsäuren in Peroxisomen ist falsch? A) Die Aufnahme langkettiger Fettsäuren in die Peroxisomen erfolgt Carnitin-unabhängig!
1. Biochemie-Klausur Zahnmediziner, WS 03/04 1. Welche Aussage zur ß-Oxidation von Fettsäuren in Peroxisomen ist falsch? A) Die Aufnahme langkettiger Fettsäuren in die Peroxisomen erfolgt Carnitin-unabhängig!
Biochemie II - Tutorium
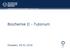 Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 09.01.2016 Ablauf des Tutoriums Einführung und Wiederholung Vorlesungszusammenfassung Übungsaufgaben Selbststudium
Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 09.01.2016 Ablauf des Tutoriums Einführung und Wiederholung Vorlesungszusammenfassung Übungsaufgaben Selbststudium
KOHLENHYDRATE PYRUVAT-DEHYDROGENASE
 PYRUVAT-DEHYDROGENASE PYRUVAT-DEHYDROGENASE: Um ein Optimum Beute garantieren zu können, Wird das entstandene Pyruvat (bei der aeroben) Glykolyse, durch die PDH in Acetyl-CoA umgewandelt, um dann, Teil
PYRUVAT-DEHYDROGENASE PYRUVAT-DEHYDROGENASE: Um ein Optimum Beute garantieren zu können, Wird das entstandene Pyruvat (bei der aeroben) Glykolyse, durch die PDH in Acetyl-CoA umgewandelt, um dann, Teil
Versuch 6. Leitenzyme
 Versuch 6 Leitenzyme Protokollant: E-mail: Studiengang: Gruppen-Nr: Semester: Betreuer: Max Mustermann max@quantentunnel.de X X X Dr. Kojro Einleitung Ziel dieses Versuches ist der Nachweis von bestimmten
Versuch 6 Leitenzyme Protokollant: E-mail: Studiengang: Gruppen-Nr: Semester: Betreuer: Max Mustermann max@quantentunnel.de X X X Dr. Kojro Einleitung Ziel dieses Versuches ist der Nachweis von bestimmten
Vorlesung Biophysik I - Molekulare Biophysik Kalbitzer/Kremer/Ziegler
 Vorlesung Biophysik I - Molekulare Biophysik Kalbitzer/Kremer/Ziegler 23.10. Zelle 30.10. Biologische Makromoleküle I 06.11. Biologische Makromoleküle II 13.11. Nukleinsäuren-Origami (DNA, RNA) 20.11.
Vorlesung Biophysik I - Molekulare Biophysik Kalbitzer/Kremer/Ziegler 23.10. Zelle 30.10. Biologische Makromoleküle I 06.11. Biologische Makromoleküle II 13.11. Nukleinsäuren-Origami (DNA, RNA) 20.11.
Grundlagen der Physiologie
 Grundlagen der Physiologie Abbau eines Zuckermoleküls www.icbm.de/pmbio Lebensweise eines heterotrophen Aerobiers 1 Überblick Stoffwechsel Glykolyse Citratcyklus Chemiosmotische Prinzipien Anabolismus
Grundlagen der Physiologie Abbau eines Zuckermoleküls www.icbm.de/pmbio Lebensweise eines heterotrophen Aerobiers 1 Überblick Stoffwechsel Glykolyse Citratcyklus Chemiosmotische Prinzipien Anabolismus
Biochemie II - Tutorium
 Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 04.01.2016 Ablauf des Tutoriums Einführung und Wiederholung Vorlesungszusammenfassung Übungsaufgaben Selbststudium
Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 04.01.2016 Ablauf des Tutoriums Einführung und Wiederholung Vorlesungszusammenfassung Übungsaufgaben Selbststudium
Klausur zur Vorlesung Biochemie I im WS 1993/1994. am 18. Februar Nachklausur zur Vorlesung Biochemie I im WS 1993/1994. am 30. Mai 1994.
 Biochemie 1, WS 93 http://www.uni-kl.de/fb-biologie/fs/klausur/chemie/biochem/bc1ws93.htm 1 von 2 17.07.01 20:50 Klausur zur Vorlesung Biochemie I im WS 1993/1994 am 18. Februar 1994 1 (16 Punkte) Formulieren
Biochemie 1, WS 93 http://www.uni-kl.de/fb-biologie/fs/klausur/chemie/biochem/bc1ws93.htm 1 von 2 17.07.01 20:50 Klausur zur Vorlesung Biochemie I im WS 1993/1994 am 18. Februar 1994 1 (16 Punkte) Formulieren
Biologische Katalysatoren
 Biologische Katalysatoren Die Entdeckung der biologischen Katalysatoren (Enzyme) ist eng mit der Entstehungsgeschichte der Biochemie verknüpft: Ende 19. Jhdt: Speichel - Fleischverdauung durch Magensäfte
Biologische Katalysatoren Die Entdeckung der biologischen Katalysatoren (Enzyme) ist eng mit der Entstehungsgeschichte der Biochemie verknüpft: Ende 19. Jhdt: Speichel - Fleischverdauung durch Magensäfte
schnell und portofrei erhältlich bei
 Kurzlehrbuch Biochemie Kurzlehrbuch Biochemie Bearbeitet von Melanie Königshoff, Timo Brandenburger 2. überarb. Aufl. 2007. Taschenbuch. 46 S. Paperback ISBN 978 3 13 136412 8 Format (B x L): 24 x 17 cm
Kurzlehrbuch Biochemie Kurzlehrbuch Biochemie Bearbeitet von Melanie Königshoff, Timo Brandenburger 2. überarb. Aufl. 2007. Taschenbuch. 46 S. Paperback ISBN 978 3 13 136412 8 Format (B x L): 24 x 17 cm
Asmaa Mebrad Caroline Mühlmann Gluconeogenese
 Gluconeogenese Asmaa Mebrad Caroline Mühlmann 06.12.2004 Definition: wichtiger Stoffwechselweg, bei dem Glucose aus Nicht-Kohlenhydrat-Vorstufen synthetisiert wird Ablauf bei längeren Hungerperioden dient
Gluconeogenese Asmaa Mebrad Caroline Mühlmann 06.12.2004 Definition: wichtiger Stoffwechselweg, bei dem Glucose aus Nicht-Kohlenhydrat-Vorstufen synthetisiert wird Ablauf bei längeren Hungerperioden dient
Biochemie und Stoffwechsel Biochemie Aufklärung der Stoffwechselwege und -teilschritte
 Biochemie und Stoffwechsel Biochemie Aufklärung der Stoffwechselwege und -teilschritte Identifikation der Ausgangs-, Zwischen- und Endprodukte (Stoffwechselprodukte) Enzyme sind Proteine mit Katalysatorwirkung.
Biochemie und Stoffwechsel Biochemie Aufklärung der Stoffwechselwege und -teilschritte Identifikation der Ausgangs-, Zwischen- und Endprodukte (Stoffwechselprodukte) Enzyme sind Proteine mit Katalysatorwirkung.
-Klausur Biochemie Name: Matrikelnr.:
 25.07.207 Name: Matrikelnr.: Nur vollständige Reaktionsgleichungen, Berechnungen und Antworten werden als Lösung der Aufgaben gewertet, das Ergebnis alleine genügt nicht. Der Rechengang muß ersichtlich
25.07.207 Name: Matrikelnr.: Nur vollständige Reaktionsgleichungen, Berechnungen und Antworten werden als Lösung der Aufgaben gewertet, das Ergebnis alleine genügt nicht. Der Rechengang muß ersichtlich
LIPIDE. Periphere Gruppe mit Cysteinylrest. FS-Synthase. Zentrale Gruppe Phosphopanthetinarm kovalente Bindung
 Periphere Gruppe mit Cysteinylrest FS-Synthase Zentrale Gruppe Phosphopanthetinarm kovalente Bindung Die FS-Biosynthse aus Acetyl-CoA und Malonyl-CoA, wird komplett an dem dimeren Multienzymkomplex FETTSÄURESYNTHETASE
Periphere Gruppe mit Cysteinylrest FS-Synthase Zentrale Gruppe Phosphopanthetinarm kovalente Bindung Die FS-Biosynthse aus Acetyl-CoA und Malonyl-CoA, wird komplett an dem dimeren Multienzymkomplex FETTSÄURESYNTHETASE
9. Abbau der Glukose zum Pyruvat
 9. Abbau der Glukose zum Pyruvat 236 9.1. Übersicht: Abbau von Glucose Pentosephosphate Pathway (PPP) NADP + NADPH Glucose Glycolysis Oxidative Phosphorylation PDH Complex Citric Acid Citric Acid Cycle
9. Abbau der Glukose zum Pyruvat 236 9.1. Übersicht: Abbau von Glucose Pentosephosphate Pathway (PPP) NADP + NADPH Glucose Glycolysis Oxidative Phosphorylation PDH Complex Citric Acid Citric Acid Cycle
10.2 Der Citratzyklus 203
 10.2 Der Citratzyklus 203 Ketonkörper-Biosynthese. Bei den Ketonkörpern handelt es sich um die verschiffbare Form von Acetyl-CoA. Staut sich viel Acetyl-CoA in der Leber an im Hungerzustand, dann werden
10.2 Der Citratzyklus 203 Ketonkörper-Biosynthese. Bei den Ketonkörpern handelt es sich um die verschiffbare Form von Acetyl-CoA. Staut sich viel Acetyl-CoA in der Leber an im Hungerzustand, dann werden
Abschlussklausur zur Vorlesung Biomoleküle II WS 2004/05
 16.02.2005 Abschlussklausur zur Vorlesung Biomoleküle II WS 2004/05 Name: Studienfach: Matrikelnummer: Fachsemester: Hinweise: 1. Bitte tragen Sie Ihren Namen, Matrikelnummer, Studienfach und Semesterzahl
16.02.2005 Abschlussklausur zur Vorlesung Biomoleküle II WS 2004/05 Name: Studienfach: Matrikelnummer: Fachsemester: Hinweise: 1. Bitte tragen Sie Ihren Namen, Matrikelnummer, Studienfach und Semesterzahl
Kapitel 5: 1. Siderophore assistieren dem Transfer welcher der folgenden Makronährstoffe über Membranen? A. Stickstoff B. Phosphor C. Eisen D.
 Kapitel 5: 1 Siderophore assistieren dem Transfer welcher der folgenden Makronährstoffe über Membranen? A. Stickstoff B. Phosphor C. Eisen D. Kalium Kapitel 5: 2 Welcher der folgenden Makronährstoffe ist
Kapitel 5: 1 Siderophore assistieren dem Transfer welcher der folgenden Makronährstoffe über Membranen? A. Stickstoff B. Phosphor C. Eisen D. Kalium Kapitel 5: 2 Welcher der folgenden Makronährstoffe ist
Oxidative Phosphorylierung
 BICEMIE DER ERÄRUG II Grundzüge des Metabolismus xidative Phosphorylierung 24.04.2012 xidative Phosphorylierung xidative Phosphorylierung -Die Elektronen in AD und in FAD 2 (hohes Übertragungspotential)
BICEMIE DER ERÄRUG II Grundzüge des Metabolismus xidative Phosphorylierung 24.04.2012 xidative Phosphorylierung xidative Phosphorylierung -Die Elektronen in AD und in FAD 2 (hohes Übertragungspotential)
Stoffwechsel - Energiebereitstellung - Biomoleküle
 Biochemie und Stoffwechsel Biochemie Aufklärung der Stoffwechselwege und -teilschritte Identifikation der Ausgangs-, Zwischen- und Endprodukte (Stoffwechselprodukte) Enzyme sind Proteine mit Katalysatorwirkung.
Biochemie und Stoffwechsel Biochemie Aufklärung der Stoffwechselwege und -teilschritte Identifikation der Ausgangs-, Zwischen- und Endprodukte (Stoffwechselprodukte) Enzyme sind Proteine mit Katalysatorwirkung.
Beispiele für Prüfungsfragen zu den Einheiten. 2, 3, 5, 9-12, 15, 16, und 21 (Hartig)
 Beispiele für Prüfungsfragen zu den Einheiten 2, 3, 5, 9-12, 15, 16, und 21 (Hartig) Untenstehendes Molekül ist ein Peptidhormon. Wieviele Peptidbindungen besitzt dieses Molekül (zeichnen Sie diese ein)?
Beispiele für Prüfungsfragen zu den Einheiten 2, 3, 5, 9-12, 15, 16, und 21 (Hartig) Untenstehendes Molekül ist ein Peptidhormon. Wieviele Peptidbindungen besitzt dieses Molekül (zeichnen Sie diese ein)?
pk S der α-carbonsäure = 1,88; pk S der β-carbonsäure = 3,65 Die beiden Carbonsäuregruppen unterscheiden sich auch in ihrer chemischen Reaktivität
 Aminosäuren mit sauren Seitengruppen Asparaginsäure (Asp,D) pk S der α-carbonsäure = 1,88; pk S der β-carbonsäure = 3,65 Die beiden Carbonsäuregruppen unterscheiden sich auch in ihrer chemischen Reaktivität
Aminosäuren mit sauren Seitengruppen Asparaginsäure (Asp,D) pk S der α-carbonsäure = 1,88; pk S der β-carbonsäure = 3,65 Die beiden Carbonsäuregruppen unterscheiden sich auch in ihrer chemischen Reaktivität
Präsentation STOFFWECHSEL STOFFWECHSEL. Fettstoffwechsel im Sport. Biologische Oxidation Zitratzyklus und Atmungskette
 STOFFWESEL GRUNDLAGEN STÖRUNGEN:Diagnose, Therapie, Prävention 6 Bedeutung der körperlichen Aktivität Präsentation Fettstoffwechsel im Sport Glukose exokinase 1ATP -> 1ADP Glukose-6-Phosphat Phosphohexoisomerase
STOFFWESEL GRUNDLAGEN STÖRUNGEN:Diagnose, Therapie, Prävention 6 Bedeutung der körperlichen Aktivität Präsentation Fettstoffwechsel im Sport Glukose exokinase 1ATP -> 1ADP Glukose-6-Phosphat Phosphohexoisomerase
Serinpeptidasen.
 Serinpeptidasen http://www.biochem-caflisch.uzh.ch/static/pdf/nonpeptide_wnv09.pdf 1 Klassifizierung der Peptidasen Peptidasen (alt, Proteasen) Endopeptidasen (Proteinasen) Exopeptidasen Endopeptidasen
Serinpeptidasen http://www.biochem-caflisch.uzh.ch/static/pdf/nonpeptide_wnv09.pdf 1 Klassifizierung der Peptidasen Peptidasen (alt, Proteasen) Endopeptidasen (Proteinasen) Exopeptidasen Endopeptidasen
1) Erklären sie die Begriffe Primär Sekundär und Tertiärstruktur von Proteinen. Nennen Sie drei typische Sekundärstrukturelemente (6P)
 1. Klausur zum Modul 5.3 Biochemie WS 09/10 12.2.2010 1) Erklären sie die Begriffe Primär Sekundär und Tertiärstruktur von Proteinen. Nennen Sie drei typische Sekundärstrukturelemente (6P) 2) Welche Funktion
1. Klausur zum Modul 5.3 Biochemie WS 09/10 12.2.2010 1) Erklären sie die Begriffe Primär Sekundär und Tertiärstruktur von Proteinen. Nennen Sie drei typische Sekundärstrukturelemente (6P) 2) Welche Funktion
Lösungsblatt zu Aufbau von Aminosäuren
 Lösungsblatt zu Aufbau von Aminosäuren 1. Zeichnen Sie die allgemeine Formel einer α-aminosäure, welche am α-c- Atom eine Seitenkette R trägt. 2. Welche der zwanzig natürlich vorkommenden L-α-Aminosäuren
Lösungsblatt zu Aufbau von Aminosäuren 1. Zeichnen Sie die allgemeine Formel einer α-aminosäure, welche am α-c- Atom eine Seitenkette R trägt. 2. Welche der zwanzig natürlich vorkommenden L-α-Aminosäuren
Aliphatische Aminosäuren. Aromatische Aminosäuren
 Prof. Dr..-U. eißig rganische Chemie I 17.1 Aliphatische Aminosäuren systematischer ame (Trivialname) truktur Vorkommen, Bedeutung 2-Aminoethansäure (α-aminoessigsäure, Glycin) 3 C 2 C 2 α Proteine, Peptide
Prof. Dr..-U. eißig rganische Chemie I 17.1 Aliphatische Aminosäuren systematischer ame (Trivialname) truktur Vorkommen, Bedeutung 2-Aminoethansäure (α-aminoessigsäure, Glycin) 3 C 2 C 2 α Proteine, Peptide
- Biochemieklausur Name: Matrikelnr.:
 08.07.20 Name: Matrikelnr.: Nur vollständige Reaktionsgleichungen, Berechnungen und Antworten werden als Lösung der Aufgaben gewertet, das Ergebnis alleine genügt nicht. Der Rechengang muß ersichtlich
08.07.20 Name: Matrikelnr.: Nur vollständige Reaktionsgleichungen, Berechnungen und Antworten werden als Lösung der Aufgaben gewertet, das Ergebnis alleine genügt nicht. Der Rechengang muß ersichtlich
Schrittweise Oxidation und Decarboxylierung von Glucose-6-phosphat zu Ribulose-5- phosphat
 1. Der plastidäre oxidative Pentosephosphatweg Abbau von Hexose unter NADPH+H + -Synthese Schlüsselenzym=Glucose-6-phosphat-Dehydrogenase Glucose-6-phosphat-Dehydrogenase wird durch Thioredoxin im reduzierten
1. Der plastidäre oxidative Pentosephosphatweg Abbau von Hexose unter NADPH+H + -Synthese Schlüsselenzym=Glucose-6-phosphat-Dehydrogenase Glucose-6-phosphat-Dehydrogenase wird durch Thioredoxin im reduzierten
Seminar Biochemie. Lipide und Lipidstoffwechsel. Dr. Christian Hübbers
 Seminar Biochemie Lipide und Lipidstoffwechsel Dr. Christian Hübbers Lernziele Lipidklassen: Fettsäuren, Triglyceride, Phospholipide, Cholesterin, Sphingolipide, Glykolipide. ß-Oxidation, FS-Biosynthese,
Seminar Biochemie Lipide und Lipidstoffwechsel Dr. Christian Hübbers Lernziele Lipidklassen: Fettsäuren, Triglyceride, Phospholipide, Cholesterin, Sphingolipide, Glykolipide. ß-Oxidation, FS-Biosynthese,
Seminar Biochemie. Lipide und Lipidstoffwechsel. Dr. Christian Hübbers
 Seminar Biochemie Lipide und Lipidstoffwechsel Dr. Christian Hübbers Lernziele Lipidklassen: Fettsäuren, TG, Phospholipide, Cholesterin, Sphingolipide, Glykolipide. ß-Oxidation, FS-Biosynthese, MalonylCoA,
Seminar Biochemie Lipide und Lipidstoffwechsel Dr. Christian Hübbers Lernziele Lipidklassen: Fettsäuren, TG, Phospholipide, Cholesterin, Sphingolipide, Glykolipide. ß-Oxidation, FS-Biosynthese, MalonylCoA,
Stoffwechsel. Metabolismus (3)
 Vorlesung Zell- und Molekularbiologie Stoffwechsel Metabolismus (3) Überblick Stoffwechsel Glykolyse Citratcyklus Chemiosmotische Prinzipien 1 Glykolyse 1 Glucose und in der Glykolyse daraus gebildete
Vorlesung Zell- und Molekularbiologie Stoffwechsel Metabolismus (3) Überblick Stoffwechsel Glykolyse Citratcyklus Chemiosmotische Prinzipien 1 Glykolyse 1 Glucose und in der Glykolyse daraus gebildete
Bachelorstudiengang Biologie. Vorlesung Biochemie I Klausur am 11. Oktober 2012, 9:00 11:00, H18
 Bachelorstudiengang Biologie Vorlesung Biochemie I Klausur am 11. Oktober 2012, 9:00 11:00, H18 1. (a) Welche Aminosäuren mit positiv geladenen Seitenketten kennen Sie? Bitte geben Sie die Strukturformel
Bachelorstudiengang Biologie Vorlesung Biochemie I Klausur am 11. Oktober 2012, 9:00 11:00, H18 1. (a) Welche Aminosäuren mit positiv geladenen Seitenketten kennen Sie? Bitte geben Sie die Strukturformel
Klausur zur Vorlesung Biochemie I im WS 2004/05
 Klausur zur Vorlesung Biochemie I im W 2004/05 am 9.03.2005 von 0.00 -.30 Uhr Gebäude 42, örsaal 5 Lösungen in rot Punkte in grün Aufgabe : Formulieren ie die repetitiven chritte in der -xidation von Fettsäuren
Klausur zur Vorlesung Biochemie I im W 2004/05 am 9.03.2005 von 0.00 -.30 Uhr Gebäude 42, örsaal 5 Lösungen in rot Punkte in grün Aufgabe : Formulieren ie die repetitiven chritte in der -xidation von Fettsäuren
Der Stoffwechsel: Konzepte und Grundmuster
 Der Stoffwechsel: Konzepte und Grundmuster 1 Lebende Organismen Was unterscheidet lebende Organismen von toter Materie? Lebende Organismen haben einen hohen Gehalt an chemischer Komplexität und Organisation
Der Stoffwechsel: Konzepte und Grundmuster 1 Lebende Organismen Was unterscheidet lebende Organismen von toter Materie? Lebende Organismen haben einen hohen Gehalt an chemischer Komplexität und Organisation
1. Zeichnen und beschriften Sie die stereochemische Struktur von L- Threonin. Geben Sie an, ob R- oder S-Konfiguration vorliegt.
 Übung und Lösung zur Übung Aminosäuren 1. Zeichnen und beschriften Sie die stereochemische Struktur von L- Threonin. Geben Sie an, ob R- oder S-Konfiguration vorliegt. 2. Das Tripeptid Glutathion ( -Glu-Cys-Gly)
Übung und Lösung zur Übung Aminosäuren 1. Zeichnen und beschriften Sie die stereochemische Struktur von L- Threonin. Geben Sie an, ob R- oder S-Konfiguration vorliegt. 2. Das Tripeptid Glutathion ( -Glu-Cys-Gly)
Hemmung der Enzym-Aktivität
 Hemmung der Enzym-Aktivität Substrat Kompetitiver Inhibitor Enzym Enzym Substrat Nichtkompetitiver Inhibitor Irreversibler Inhibitor Enzym Enzym Enzym - Kinetik Michaelis Menten Gleichung Lineweaver -
Hemmung der Enzym-Aktivität Substrat Kompetitiver Inhibitor Enzym Enzym Substrat Nichtkompetitiver Inhibitor Irreversibler Inhibitor Enzym Enzym Enzym - Kinetik Michaelis Menten Gleichung Lineweaver -
Aminosäuren und Proteine
 Aminosäuren und Proteine Von Mohammed Jaber Aminosäuren und Proteine Kleinigkeit: 23 proteinogene AS 250 nicht-proteinogene AS (Anzahl synthetisch erzeugten erheblich größer) Aminosäuren und Proteine Kleinigkeit:
Aminosäuren und Proteine Von Mohammed Jaber Aminosäuren und Proteine Kleinigkeit: 23 proteinogene AS 250 nicht-proteinogene AS (Anzahl synthetisch erzeugten erheblich größer) Aminosäuren und Proteine Kleinigkeit:
Versuch 5. Isocitrat-Dehydrogenase
 Versuch 5 Isocitrat-Dehydrogenase Protokollant: E-mail: Studiengang: Gruppen-Nr: Semester: Betreuer: Max Mustermann max@quantentunnel.de X X X PD Dr. Gimpl Einleitung Ziel des Versuches ist es, die Abhängigkeit
Versuch 5 Isocitrat-Dehydrogenase Protokollant: E-mail: Studiengang: Gruppen-Nr: Semester: Betreuer: Max Mustermann max@quantentunnel.de X X X PD Dr. Gimpl Einleitung Ziel des Versuches ist es, die Abhängigkeit
Johann Wolfgang Goethe-Universität Frankfurt am Main
 Johann Wolfgang Goethe-Universität Frankfurt am Main Fachbereich Biowissenschaften Teilklausur Biochemie Studiengang Biowissenschaften Modul BSc-Biowiss-7 Studiengang Bioinformatik Modul BSc-Bioinf-8,
Johann Wolfgang Goethe-Universität Frankfurt am Main Fachbereich Biowissenschaften Teilklausur Biochemie Studiengang Biowissenschaften Modul BSc-Biowiss-7 Studiengang Bioinformatik Modul BSc-Bioinf-8,
Johann Wolfgang Goethe-Universität Frankfurt am Main
 Johann Wolfgang Goethe-Universität Frankfurt am Main Fachbereich Biowissenschaften Teilklausur Biochemie Studiengang Biowissenschaften Modul BSc-Biowiss-7 Studiengang Bioinformatik Modul BSc-Bioinf-8.Studiengang
Johann Wolfgang Goethe-Universität Frankfurt am Main Fachbereich Biowissenschaften Teilklausur Biochemie Studiengang Biowissenschaften Modul BSc-Biowiss-7 Studiengang Bioinformatik Modul BSc-Bioinf-8.Studiengang
1. Fragentyp A Welche der folgenden Aminosäuren ergibt beim Abbau Propionyl-CoA? A) Isoleucin B) Tyrosin C) Glutaminsäure D) Glycin E) Asparaginsäure
 1. Fragentyp A Welche der folgenden Aminosäuren ergibt beim Abbau Propionyl-CoA? A) Isoleucin B) Tyrosin C) Glutaminsäure D) Glycin E) Asparaginsäure 2. Fragentyp D Welche der folgenden Aussagen ist (sind)
1. Fragentyp A Welche der folgenden Aminosäuren ergibt beim Abbau Propionyl-CoA? A) Isoleucin B) Tyrosin C) Glutaminsäure D) Glycin E) Asparaginsäure 2. Fragentyp D Welche der folgenden Aussagen ist (sind)
