1 Einleitung. 1.1 Proteinbiosynthese. 1.2 Struktur des Ribosoms. Einleitung
|
|
|
- Erwin Kuntz
- vor 7 Jahren
- Abrufe
Transkript
1 1 Einleitung 1.1 Proteinbiosynthese Die Proteinbiosynthese ist einer der zentralen Prozesse der Zelle. Die Umsetzung der genetischen Information, die in der DNA gespeichert ist, erfolgt durch Transkription der DNA in Messenger-RNA (mrna), die in die dreidimensionale Proteinstruktur durch Translation übersetzt wird. Während der Transkription erfolgt die Synthese der mrna aus den Ribonukleotidtriphosphaten unter Nutzung des codogenen Stranges der DNA als basengenaue Matrize. Die entstandene mrna kann nun durch den Prozess der Translation in die Aminosäuresequenz umgesetzt werden. Das Ablesen der kodierenden Region der mrna erfolgt am Ribosom. Drei aufeinander folgende Basen (Codon) kodieren für eine Aminosäure. Die 64 möglichen Basentripletts ergeben den so genannten universellen genetischen Code. Der genetische Code ist degeneriert, das heißt einige Aminosäuren werden durch mehrere Codone kodiert. Die drei Codone UAA, UAG und UGA fungieren als Stoppsignale (Stoppcodone). Die Umsetzung des genetischen Codes erfolgt auf der Ebene der Aminoacyl- Transfer-RNA-Synthetasen. Diese erkennen die spezifische Transfer-RNA (trna) und verknüpfen sie mit der entsprechenden Aminosäure. Die Aminoacyl-tRNAs (Aa-tRNA) bilden die Adaptermoleküle, die die Umsetzung des Basentripletts in die Aminosäuresequenz am Ribosom ermöglichen. Die Proteinbiosynthese findet am Ribosom statt, indem schrittweise die wachsende Aminosäurekette auf die nächste kodierte Aminosäure übertragen wird. 1.2 Struktur des Ribosoms Alle Ribosomen, ob eukaryotischer oder prokaryotischer Herkunft, bestehen aus zwei ungleichen Untereinheiten. Diese Untereinheiten setzen sich aus verschiedenen ribosomalen Proteinen und den ribosomalen RNAs (rrnas) zusammen. Obwohl die Ribosomen von Organismen der drei Domänen des Lebens (Eukaryota, Bacteria und Archaea) in ihrer Größe und der Anzahl der Bausteine variieren, lassen sich strukturelle und funktionelle Gemeinsamkeiten erkennen (Ramakrishnan and Moore, 2001 ) (Doudna and Rath, 2002) (Schuwirth et al., 2005). Das Ribosom des Eubakteriums Escherichia coli (E. coli) ist 14
2 strukturell und funktionell sehr gut charakterisiert. Es ist ein Ribonukleoproteinkomplex aus drei verschiedenen rrna und 54 Proteinen mit einem Molekulargewicht von ca. 2,6-2,8 MDa. Es zeigt einen relativen Sedimentationskoeffizienten von 70 Svedberg (S). Kürzlich wurde die Struktur des 70S Ribosoms aus E. coli mit einer Auflösung von 3,5 Å gelöst (Schuwirth et al., 2005). Das bakterielle 70S Ribosom dissoziiert unter geeigneten ionischen Bedingungen (in vitro) oder in bestimmten funktionellen Stadien (in vivo) in zwei Untereinheiten. Diese Untereinheiten werden entsprechend ihrer relativen Sedimentationskoeffizienten als 50S (große) und 30S (kleine) ribosomale Untereinheit bezeichnet. Abbildung 1.1 zeigt schematisch die Zusammensetzung des E. coli Ribosoms. Abbildung 1.1 Aufbaus des E. coli Ribosoms. Kryoelektronenmikroskopische Darstellung des 70S Ribosoms und der 50S und 30S Untereinheit, sowie schematische Darstellung der Protein- und RNA-Bausteine der Untereinheiten. Die 16S rrna (1542 nt) bildet mit 21 Proteinen (S1- S21) die kleine 30S Untereinheit des E. coli Ribosoms. Die große Untereinheit besteht aus der 23S rrna (2904 nt), der 5S rrna (120 nt) und 33 verschiedenen Proteinen (L1-L36). Die Bezeichnungen L1-L36 ergaben sich aus der Proteinanalyse der großen Untereinheit. Spätere Untersuchungen zeigten, dass L7 N-Acetyl-L12, L8 der pentamere Komplex (L7/L12) 4 L10 und L26 gleich dem Protein S20 der kleinen Untereinheit ist. 15
3 Kristallstrukturen des 70S Ribosoms liegen auch aus Thermus thermophilus (Cate et al., 1999 ) (Yusupov et al., 2001) in nahezu atomarer Auflösung vor. Ribosomale Strukturen dieses Organismus und Strukturen der ribosomalen Untereinheiten aus Haluarcula marismortui und Deinococcus radiodurans (Schmeing et al., 2005b ) (Tu et al., 2005); (Ogle et al., 2003; Ogle et al., 2001)} (Schlünzen et al., 2001 ) (Wilson et al., 2005)] lieferten kürzlich neue Einblicke in die molekularen Details der Proteinbiosynthese und der Wirkungsweise von Antibiotika. Die Kombination von Kristallstrukturanalyse und kryoelektronenmikroskopischen Untersuchungen (Kryo EM) (Agrawal et al., 2000 ; Frank, 2001 ; Frank, 2003); erlauben die höher aufgelösten Kristallstrukturen in die geringer aufgelösten Kryo EM Strukturen funktioneller Komplexe hinein zu projizieren. Somit ergeben sich Modelle für biologisch aktive Ribosomenkomplexe mit quasi atomare Auflösungen (Valle et al., 2003) (Gao et al., 2003; Halic et al., 2004). Diese neuen hochaufgelösten Modelle haben unser Verständnis der funktionalen Vorgänge am Ribosom deutlich verbessert. Abbildung 1.2 Röntgenkristallstruktur der 50S und 30S Untereinheiten aus Thermus thermophilus mit wichtigen funktionellen Orten des Ribosoms. A, P und E markieren die t-rna Bindestellen. Modifiziert aus [Ramakrishnan, 2002 #13266]. Im Jahre 1964 beschrieb Watson (Watson, 1964) ein zwei-stellen-modell der Proteinbiosynthese. In diesem Model, das bis weit in die 1980er Jahre als Referenz angesehen wurde, existierten nur zwei trna Bindestellen, nämlich die A- und die P-Stelle. Die Entdeckung der E-Stelle (Rheinberger and Nierhaus, 1980) (Rheinberger et al., 1981) (Grajevskaja et al., 1982) und deren Bedeutung für die Proteinbiosynthese führten zu heftigen Kontroversen innerhalb der Forschungsgemeinde. Obwohl die Existenz der E-Stelle mittlerweile generell anerkannt ist, werden die Besetzung der E-Stelle mit einer deacylierten trna über spezifische Codon-Anticodon-Wechselwirkungen (Rheinberger, 1991 ) (Gnirke and Nierhaus, 1986), sowie die Bedeutung der Besetzung der E-Stelle für zum Beispiel die 16
4 Auswahl der Aminoacyl-tRNA in der A-Stelle (Hausner et al., 1988 ) (Blaha and Nierhaus, 2001 ) (Nierhaus, 2006a) oder den Erhalt des Leserasters (Márquez et al., 2002) immer noch diskutiert. Das Zentrum der Dekodierung ist innerhalb der A-Stelle in der kleinen Untereinheit lokalisiert. (Abbildung 1.2). Der Dekodierungsprozess, die Auswahl der AminoacyltRNA (Aa-tRNA) mit dem komplementären Anticodon (cognate Aminoacyl-tRNA) und die Zurückweisung der Aminoacyl-tRNA mit nichtkomplementären Anticodonen (nah-cognate bzw. nicht Abbildung 1.3 Molekularer Mechanismus zur Erkennung der korrekten Codon-Anticodon- cognate Aminoacyl-tRNA) Wechselwirkung in der ribosomalen A Stelle. Zwei universell konservierte Basen der Helix 44 (h44), A1592 findet in der ribosomalen A- und A1593 ragen aus der Helix 44 heraus und bilden A Stelle statt. Einblicke in den Minor Motive mit der kleinen Furche der Codon- Anticodon-Helix. Streptomycin und Paromomycin, zwei molekularen Mechanismus der Fehler induzierende Antibiotika, binden in der Nähe des Dekodierung anhand von Dekodierungszentrums. Paromomycin führt zu einem dauerhaften Herausragen der Basen A1592 und A1593 und Kristallstrukturen der kleinen auch nah-verwandte Codone können damit stabil gebunden werden. Dies erklärt die erhöhte Fehlerrate in Gegenwart Untereinheit in Komplex mit von Paromomycin. Nach (Ogle et al., 2003) cognatem oder nahe cognatem Anticodonbereich (Anticodonstem-loops) einer trna zeigte, wie die Unterscheidung zwischen cognaten und nah-cognaten Codonen innerhalb des Dekodierungszentrums erfolgt (Ogle et al., 2003; Ogle et al., 2001), Abbildung 1.3.) Im Dekodierungszentrum wird nicht die Stabilität der Wasserstoffbrücken der Codon- Anticodon-Wechselwirkung getestet, sondern die Geometrie der ersten beiden Basen der Codon-Anticodon-Wechselwirkung geprüft. Nur im Falle einer korrekten Watson-Crick- Geometrie können sich Tertiärstrukturen, die so genannten A-Minor-Motive, ausbilden, die zur Stabilisierung der Codon-Anticodon-Wechselwirkung führen (Abbildung 1.4). 17
5 Im Falle der nah-cognaten Codon-Anticodon- Wechselwirkung kommt es zu einem nicht-kompensierten Verlust von Wasserstoffbrücken und somit zur Instabilität der Codon-Anticodon- Wechselwirkung. Dem Erkennen der korrekten Watson-Crick- Geometrie durch lokale Konformationsänderung folgt eine weiterreichende Konformationsänderung innerhalb der kleinen ribosomalen Untereinheit, was zur Einpassung (Akkomodation) der Aa-tRNA in die ribosomale A-Stelle führt. Das Ribosom befindet sich nun im prätranslokationalen Zustand (PRE) und ist bereit für die Peptidyltransferase-Reaktion (PT Reaktion). Die PT Reaktion ist die zentrale enzymatische Aktivität der großen Untereinheit. Das Zentrum der PT Reaktion liegt in einer Spalte auf der, der kleinen Untereinheit zugewandten Seite (intersubunit side) der großen Untereinheit, Abbildung 1.2 und 1.5. Abbildung 1.4 Strukturelle Erkennung der korrekten Watson-Crick Geometrie innerhalb des Dekodierungszentrum: a) Basenpaar der ersten Codon Position: Die Base A1593 bildet ein Netzwerk von Wasserstoffbrücken innerhalb der kleine Furche, das so genannte type I A-Minor motiv. b) Basenpaar der zweiten Codonposition: Zwei Nukleotide, A1592 und G530 bilden jeweils ein type II A-Minor Motiv, die beide von Serin 50 des Protein S12 und C518 stabilisiert werden. c) Dritte Position des Codons (wobble position): Die dritte Position wird weniger restriktiv stabilisiert. G530, C518 und Prolin 48 des S12 bilden Wasserstoffbrücken zur 2 OH der Ribose des dritten Nukleotids des Codons. Die Base behält Ihre Flexibilität und Wobble Geometrie ist erlaubt. Nach (Ogle et al., 2001) 18
6 Kristallographische Analysen haben gezeigt, dass das Peptidyltransferase Zentrum (PT Zentrum) ausschließlich aus rrna besteht und nicht wie ursprünglich angenommen Proteine die PT Reaktion katalysieren. In der Gruppe von Steitz wurde die Struktur der großen Untereinheit aus Haluarcula marismortui im Komplex mit dem so genannten Yarus Inhibitor gelöst (Welch et al., 1995). In dieser Struktur lagen die Proteine L2, L3, L4 und L10e (Homolog des bakteriellen L16) mindestens 18 Å von dem Yarus Inhibitor entfernt (Abbildung 1.5). Abbildung 1.5 Kristallstuktur der 50S Untereinheit aus Haloarcula marismortui mit Übergangszustands-Analogon und Sekundärstruktur des PTF Zentrum (E. coli): Das Peptidyltransferase Zentrum besteht ausschließlich aus rrna. Die Proteine L2, L3, L4 und L10e liegen mindestens 18Å entfernt. In der Sekundärstruktur (PTF Ring) sind die Basen markiert, die zur Stabilisierung der Substrate beitragen. Im prätranslokationalen Zustand (PRE), wenn die ribosomale P-Stelle mit der Peptidyl-tRNA besetzt und die neue Aa-tRNA in die A-Stelle eingepasst ist, erfolgt die Übertragung des Peptidylrestes der P-Stellen trna auf die Aminosäure der A-Stellen Aa-tRNA. Die beiden L- förmigen trnas schließen einem Winkel von 40 ein, wohingegen die Akzeptorarmstämme der trnas (CCA Enden) innerhalb des PT Zentrums einen Winkel von 180 bilden, so dass die 3 -Ribose Positionen mit Peptidyl- bzw. Aminoacylrest nebeneinander liegen (Bashan et al., 2003). Die Bindung der CCA Enden der trnas in das PT Zentrum wird unterstützt durch Nukleotide der so genannten A- und P- Schleifen der rrna (Abbildung 1.6). 19
7 Das CCA Ende der Aa-tRNA in der A-Stelle wird durch Watson- Crick Basenpaarung zwischen C75 (trna) und G2553 (rrna) und einem A-Minor Motiv des A76 (trna) und dem Basenpaar G2583- U2506 (rrna) sowie einer Wasserstoffbrücke zwischen der 2 OH Gruppe des A76 (trna) und U2585 (rrna) fixiert. In der P- Stelle erfolgt die Fixierung über zwei Watson-Crick Basenpaarungen (C74 mit G2252 und C75 mit G2251) sowie ein A- Minor Motiv von A76 mit dem Basenpaar A2450-C2501 (siehe Übersichtsartikel (Wilson et al., 2002; Wilson and Nierhaus, 2003). Diese stabile Fixierung der Substrate setzt sich im inneren des PT Zentrums fort. Vier Nukleotide (A2451, U2506, U2585, und A2602) der inneren Lage des PT Zentrum sorgen durch ein Netzwerk von Wasserstoffbrücken für die Abbildung 1.6 Fixierung der CCA Enden der P- Stellen trna (grün) und der A-Stellen trna (rot). Ausrichtung der Substrate und Erklärung siehe Text. Nach (Wilson and Nierhaus, 2003) erleichtern die Bildung des Übergangszustandes (Schmeing et al., 2005a; Schmeing et al., 2005b ; Youngman et al., 2004). Die Kristallstrukturanalysen von Ribosomen in Komplex mit A- und P-Stellen Substraten, sowie mit Übergangszustand- Analoga, lieferten die strukturelle Hinweise für einen induced fit Mechanismus zur Aktivierung des katalytischen Zentrums (Schmeing et al., 2005b). Die beteiligten Nukleotide des PT Zentrums und möglicherweise ein Wassermolekül platzieren die Substrate in einer Weise, die das Erreichen des Übergangszustandes erleichtern. Die Reduktion der 20
8 Reaktionsentropie durch die physikalische Substratpositionierung ist ausreichend, um die Beschleunigung der Peptidübertragungsreaktion gegenüber einer unkatalysierten Reaktion mit Modellsubstraten zu erklären (Krayevsky and Kukhanova, 1979 ; Nierhaus et al., 1980). Biochemische Analysen zeigten, dass die 2 OH der Ribose des A76 der P-Stelle trna und das 2 OH der Ribose des A2451 der rrna für die Katalyse der Peptidübertragung von entscheidender Bedeutung sind (Erlacher et al., 2005). Dabei schält sich das folgende einfache Modell für den Mechanismus der Peptidbindung heraus: es findet ein Protonenübertrag von der -Aminogruppe des angreifenden Stickstoffs auf den Sauerstoff der 2 -OH Gruppe der P- trna statt, diese gibt ihr Proton an den 3 -Sauerstoff der P-tRNA nach erfolgter Spaltung ihrer Esterbindung weiter. Die Wasserstoffbrücke des 2 -OHs des A2451 Restes mit der 2 - OH Gruppe der P-tRNA erleichtert diesen proton-shuttle erheblich und beschleunigt den Peptidtransfer um einige Größenordnungen (Erlacher et al., 2006; Schmeing et al., 2005a; Trobro and Aqvist, 2005), (Abbildung 1.7 B und C). 1.7 Prinzip der Peptidylübertragungsreaktion: (A), Modell des möglichen Protonenübertragungswegs zur Auflösung des Übergangszustandes der Peptidyltransferase Reaktion (B) und Modell Beteiligung eines Wassermoleküls (C); (Schmeing et al., 2005a). 21
9 Eine ursprünglich diskutierte Säure-Basen-Katalyse der PT Reaktion konnte kürzlich ausgeschlossen werden (Schmeing et al., 2005b; Sievers et al., 2004). Die zweite enzymatische Aktivität des PT Zentrums ist die Katalyse der hydrolytischen Spaltung der Peptidyl-tRNA und das Freisetzen des Proteins im Zuge der Termination der Proteinbiosynthese. Hier konnte gezeigt werden, dass das Nukleotid A2602 von entscheidender Bedeutung für die Termination der Proteinbiosynthese, für die PT Reaktion jedoch entbehrlich ist (Polacek et al., 2003). Nach der PT Reaktion erfolgt die Translokationsreaktion, die mrna und die trnas werden um ein Codon verschoben. Dadurch wird die Peptidyl-tRNA in die P-Stelle platziert und die deacyl-trna in die E-Stelle verschoben. Die E-Stellen trna verlässt das Ribosom nachdem die neue Aa-tRNA in der A-Stelle dekodiert ist (Dinos et al., 2005). Ausgehend vom PT Zentrum verläuft der Ribosomentunnel durch die große Untereinheit hindurch, um auf der, der kleinen Untereinheit abgewandten Seite (solvent side) das synthetisierte Protein ins Zytosol zu leiten (Abbildung 1.8). Abbildung 1.8 Querschnitt durch die große Untereinheit: Der ribosomale Tunnel verläuft ausgehend vom PT Zentrum durch die große Untereinheit. An der engsten Stelle des Tunnels liegen die Ausläufer der Proteine L4 und L22. Am Tunnelausgang liegt das Protein L23, das an der Bindung des Trigger Factor (TF) und des Signal Recognition Particle (SRP) beteiligt ist, sowie während des Proteinexports in Kontakt zum Translokon steht. Modifiziert nach (Jenni and Ban, 2003). 22
10 Die Tunnelwand ist fast vollständig mit rrna ausgekleidet, nur in der Tunnelverengung kommen die langen Fortsätze der Proteine L4 und L22 der naszierenden Proteinkette nahe. Diese beiden Proteine bilden zusammen mit der rrna einen Knick des Tunnels, der für Regulationsprozesse der Translation von Bedeutung ist (Nakatogawa et al., 2004) Weiterhin wird diskutiert, ob der Tunnel die Proteinfaltung des naszierenden Proteins unterstützt (Lu and Deutsch, 2005 ) (Gilbert et al., 2004). 1.3 Ablauf der Proteinbiosynthese Die Proteinbiosynthese kann in vier funktionelle Phasen unterteilt werden: (a) Initiation, (b) Elongation, (c) Termination und (d) Recycling (Abbildung 1.9). 1.9 Schematische Darstellung der Proteinbiosynthese in ihren vier Phasen (a) Initiation (gelb) (b) Elongation (grün), (c) Termination (rot) und (d) Recycling (orange). Erläuterungen siehe Text. 23
11 1.3.1 Initiation S De novo Initiation In der Initiationsphase der Proteinbiosynthese der Eubakterien wird das Ribosom für die Proteinbiosynthese programmiert. Die mrna wird an die 30S Untereinheit gebunden und das Startcodon wird über die Shine-Dalgarno-Wechselwirkung der mrna mit der 16S rrna positioniert. Die Initiator-Aminoacyl-tRNA (Formyl-Methionyl-tRNA Met f ) wird als ternärer Komplex an das Startcodon gebunden. Die große Untereinheit bindet an den 30S Initiationskomplex und die Initiator-Aminoacyl-tRNA besetzt die P-Stelle. Der Initiationskomplex (P i ) ist somit ausgebildet und das Leseraster bestimmt. Die AminoacyltRNA-Stelle (A-Stelle) des Ribosoms ist frei. Dieser Prozess wird durch Initiationsfaktoren (IF) gesteuert. Die exakte Rolle der Initiationsfaktoren und der chronologische Ablauf der Initiation sind immer noch nicht vollständig geklärt (Gualerzi et al., 2000 ) (Pestova and Hellen, 2000 ) (Pestova et al., 2001). Das Ribosom liegt nun als Initiatorkomplex (P i Komplex) vor und ist bereit für den Übergang in die Elongationsphase. Abbildung S De novo Initiation: a) Initiationsfaktor 3 (IF3) führt zur Dissoziation der 70S Ribosomen in die Untereinheiten und hilft bei der Bindung und Positionierung der mrna in die 30S Untereinheit (b). IF1 und der ternäre Komplex aus Initiator-tRNA IF2 und GTP binden und Bilden den 30S Initiationskomplex (c). Die große Untereinheit bindt an den 30S Initiationskomplex und IF1 und IF3 verlassen das Ribosom (d). Der ternäre Komplex besetzt die ribosomale P Stelle und das Leseraster ist ausgewählt. Nach Hydrolyse von GTP erfolgt die Dissoziation von IF2 (e). Der 70S Initiationskomplex ist gebildet und bereit für den Übergang in die folgenden Phasen der Proteinsynthese (Elongation, Termination und Ribosomrecycling) (f). 24
12 S Initiation Einen alternativen Weg der bakteriellen Initiation der Proteinbiosynthese beschreibt die 70S Initiation, die insbesondere für die regulierte und gekoppelte Translation der ribosomalen Proteine von Bedeutung ist. Die meisten bakteriellen mrnas sind polycistronisch und entstehen durch Transkription benachbarter Gene, die in Transkriptionseinheiten (Operonen) organisiert sind und die Informationen für verschiedene, aber oft funktionell zusammengehörige Proteine tragen. In E. coli enthalten polycistronische mrnas durchschnittlich vier Cistrone. Theoretisch ist die Translation der Cistrone unabhängig voneinander durch 30S de novo Initiation möglich. Oft liegt, wie zum Beispiel bei den Operonen für ribosomale Proteine, die Initiationsstellen der darauf folgenden Cistrone in Sekundärstrukturen verborgen, so dass eine 30S de novo Initiation nicht möglich ist. Eine Initiation an diesen verborgenen Initiationsstellen kann nur erfolgen, wenn die Sekundärstruktur durch die Translation des vorangegangenen Cistrons aufgelöst wird. Dieses Phänomen wird Translationskopplung (translational coupling) genannt. Die Translationskopplung wird bei der autogenen Translationsregulation der Expression der ribosomalen Proteine genutzt. Die Translationsregulation erfolgt durch ein Repressorprotein, das häufig auf der zu regulierenden mrna selbst kodiert ist. Dieses Repressorprotein bindet an die mrna und unterdrückt die Translation der nachfolgenden Cistrone. Ohne Repression erfolgt die Re-Initiation auf dem nachfolgenden Cistron durch 70S Initiation. Nach der Translationstermination des vorhergegangenen Cistrons und dem Freisetzen des Proteins, dissoziiert das 70S Ribosom nicht in die Untereinheiten, sondern schreitet mit der Translation des nächsten Cistrons fort. Die nächste Initiationsstelle kann dabei durch eindimensionale Diffusion entlang der mrna durch das leere Ribosom erkannt werden. Dabei ist es möglich, dass das 70S Ribosom bis zu 40 Nukleotide in 5 oder 3 Richtung der mrna diffundiert, um eine erneute Initiation auszuführen. Eine 70S Initiation wurde auch für so genannte leaderless mrnas beschrieben (Moll et al., 2004). Leaderless mrnas zeichnen sich durch das Fehlen des 5 nichttranslatierten Bereichs aus, sie beginnen mit dem Startcodon (AUG) unmittelbar am 5 -Ende Elongation In der Elongationsphase erfolgt die schrittweise Übersetzung der Ribonukleinsäuresequenz der mrna in die Aminosäuresequenz. Die Elongation ist ein zyklischer Prozess (Abbildung 1.9) in dem das Ribosom zwischen zwei definierten Zuständen (PRE und POST) oszilliert. 25
13 Die beiden Zustände sind durch eine hohe Energiebarriere (120 kj/mol) von einander getrennt (Schilling-Bartetzko et al., 1992a; Schilling-Bartetzko et al., 1992b). Die Energiebarriere kann durch die Elongationsfaktoren EF-Tu (POST zu PRE) und EF-G (PRE zu POST) herabgesetzt werden. EF-Tu bildet mit GTP und der Aminoacyl-tRNA einen ternären Komplex, der die Aminoacyl-tRNA in die freie A-Stelle des Ribosoms leitet. Nach erfolgter Dekodierung findet die Akkomodation und anschließend der Peptidyltransfer von der Peptidyl-tRNA (oder der Initiator-Aminoacyl-tRNA) auf die Aminosäure der A-Stellen Aminoacyl-tRNA statt. Durch die Bindung des ternären Komplexes wird der POST Zustand in den PRE Zustand überführt. Der Peptidyltransferreaktion folgt die Translokation des mrna*trna 2 Komplexes um ein Codon bzw. drei Nukleotide. Unter Beteiligung von EF- G*GTP wird der PRE Zustand in den POST Zustand überführt. Bei diesem Prozess erfolgt die GTP-Hydrolyse und EF-G verlässt das Ribosom in der GDP-gebundenen Form. Durch die Wirkung der beiden G-Proteine erfolgt die Elongation gerichtet vom 5 - in Richtung 3 -OH- Ende der mrna Elongationsmodelle Die Translokation von zwei trna Molekülen und der mrna ohne Verlust des Leserasters innerhalb des Ribosoms ist ein entscheidender Prozess während der Proteinbiosynthese. Die Überführung von PRE zu POST und POST zu PRE ist begleitet von strukturellen Änderungen innerhalb des Ribosoms (Polacek et al., 2000). Zwei Modelle des Elongationszyklus versuchen die strukturellen Änderungen sowie auch funktionelle Aspekte zu beschreiben: (a) Hybridzustand-Modell (Hybrid-State Model) (Moazed and Noller, 1989b) und (b) - -Modell (Nierhaus, 1996 ) (Dabrowski et al., 1998), das eine Weiterentwicklung des allosterischen Drei-Stellen Modells ist Hybridzustand-Modell Das Hybridzustand-Modell (Abbildung 1.11) beruht auf der Beobachtung, dass bestimmte Nukleotide der rrnas durch die Stellen spezifische Bindung von trnas in A-, P-, und E- Stelle vor chemischen Reagenzien (Ketoxal und Dimethylsulfat (DMS)) geschützt werden. Dieses Modell beschreibt eine sequentielle Wanderung der trnas innerhalb der Untereinheiten. Nach der Peptidübertragungsreaktion wandert der Akzeptorstamm der trnas innerhalb der 50S Untereinheit, der Anticodonstamm verbleibt dabei unverändert in der 30S Untereinheit. Dadurch gelangen die trnas in die Hybridzustände. Die zwei in der 26
14 Abbildung 1.11 Hybridzustand-Modell Während eines Elogationszyklus durchwandern die trna neben den klassischen Bindungsstellen auch hybride Bindungszustände, Erläuterungen siehe Text. Elongationsphase entstehenden Hybridzustände werden mit A/P und P/E bezeichnet. Hier bezeichnet der Buchstabe vor dem Schrägstrich die Art des Schutzmusters in der 30S Untereinheit und der Buchstabe hinter dem Schrägstrich die Art des Schutzmusters in der 50S Untereinheit. Durch die Wirkung von EF-G erfolgt die Translokation der trnas aus den hybriden Zuständen in die klassischen Bindungsstellen (P- und E-Stelle). Die E-Stelle zeigt in diesem Modell nur ein Schutzmuster auf der 23S rrna (50S Untereinheit), nicht aber für die 16S rrna (30S Untereinheit). Die Bindung eines ternären Komplex zu einem posttranslokationalen Zustand eines Ribosoms mit einer Peptidyl-tRNA in der P-Stelle liefert einen weiteren Hybridzustand A/T, bei der sich der Anticodonstamm der trna des ternären Komplexes in der A-Stelle der 30S Untereinheit befindet, aber der Akzeptorstamm durch die Wechselwirkung von EF-Tu mit dem Ribosom nicht in die A-Stelle der 50S Untereinheit eintreten kann. Die Definition der drei Hybridzustände beruht auf der Beobachtung von 16 geschützten Positionen der 23S rrna (Moazed and Noller, 1989b ) (Moazed and Noller, 1991), die unter Verwendung des konventionellen Puffersystems (hohe Magnesiumkonzentration, keine 27
15 Polyamine) erhalten wurden. 14 dieser 16 geschützten Positionen innerhalb der 23S rrna beruhen auf dem flexiblen 3 -CCA Ende des Akzeptorstammes der trna (Moazed and Noller, 1991). Im konventionellen Puffersystem konnten die Hybridzustände kryoelektronenmikroskopisch nachgewiesen werden, in den so genannten in vivo nahen Pufferbedingungen (geringe Magnesiumkonzentration, Polyaminsystem) waren diese Hybridstellen jedoch nicht detektierbar (Agrawal et al., 1999b; Agrawal et al., 2000 ). Kürzlich publizierte Ergebnisse mit fluoreszenzmarkierten trna Molekülen erfordern eine Modifikation des Hybridzustand-Modells. Die Gruppe von Cooperman ermittelte ein zusätzliches Hybrid-Intermediat, das unter Verwendung des Antibiotikums Viomycin detektiert wurde (Pan et al., 2007). In diesem Intermediat liegt die Peptidyl-tRNA in der klassischen A-Stelle (A/A) während das Akzeptorende der deacyl-trna der P-Stelle sich bereits in die E-Stelle bewegt hat (P/E). Die Analyse in der Gruppe von Blanchard konnte zeigen, dass es sich bei den Hybridzuständen (A/A und P/E), sowie (A/P und P/E), um metastabile Intermediate handelt, die im Millisekundenbereich aus dem klassischen PRE Zustand (A/A und P/P) hervorgehen können und wieder in diesen zurückgewandelt werden konnten (Munro et al., 2007). Der klassische PRE Zustand lag unter den gegebenen Experimentalbedingungen mit 60% als dominierender Zustand vor. Diese Ergebnisse zeigen deutlich, dass eine sequentielle Wanderung der trna durch das Ribosom während der Translokation wahrscheinlich ist, diese Intermediate aber nur unter bestimmten Experimentalbedingungen beobachtet werden können Modell Das zweite Modell, das - -Modell basiert auf einer anderen Methode von Schutzexperimenten. Bei dieser Methode, der Thiophosphat-Methode (Dabrowski et al., 1998), werden Positionen des Zucker-Phosphatrückrats innerhalb der trnas durch die Stellen spezifische Bindung der trna an das Ribosom vor der Spaltung durch Jod geschützt. Die Schutzmuster der trnas für die verschiedenen funktionellen Stadien des Ribosoms (P i, A, P PRE und P POST ) wurden unter in vivo nahen Pufferbedingungen (geringe Magnesiumkonzentration, Polyaminsystem) bestimmt. Die Ergebnisse dieser Schutzexperimente zeigen, dass sich das Schutzmuster einer trna in der A-Stelle von dem Schutzmuster einer trna der P-Stelle unterscheidet, sich jedoch dieses Schutzmuster während des Elongationsschrittes kaum ändert. Obwohl im Verlauf der Translokation die trna von der A-Stelle in die P-Stelle und die trna von der P-Stelle in die E-Stelle bewegt wird, zeigen die trnas vor und nach der Translokation ein identisches Schutzmuster. Diese 28
16 Abbildung Modell: Die Bewegung der beiden trna während des Translokationsschrittes erfolgt simultan durch eine bewegliche Domäne. Die Bewegliche Domäne trägt die - und die Bindestellen. Die Dekodierungsdomäne ( ) ist in der A Stelle lokalisiert. Modifiziert nach Dabrowski, 1998 #11781 Beobachtung führte zur Annahme, dass durch eine bewegliche Domäne mit zwei Bindestellen die A-Stellen trna in die P-Stelle und gleichzeitig die P-Stellen trna in die E-Stelle bewegt werden. Die Entdeckung, dass die trnas in A- und P-Stelle und die rrna innerhalb des PT Zentrums Rotationssymmetrie zeigen (Bashan and Yonath, 2005), verstärkt die Annahme, dass eine bewegliche Domäne zur Beförderung der trnas existiert. Eine dieser Bindestellen liefert das -Schutzmuster, die andere Bindestelle liefert das - Schutzmuster. Die Selektion der cognaten trna in der ribosomalen A-Stelle erfordert eine spezielle Dekodierungsdomäne ( ), die nicht beweglich ist. Diese befindet sich auf der 30S Untereinheit und verbleibt stabil in der A-Stelle. Im prätranslokationalen Zustand (PRE) des Ribosoms überlagern sich die - und die -Bindestelle (Abbildung 1.12). Das - -Modell ist eine Weiterentwicklung des allosterischen Drei-Stellen-Modells (Rheinberger and Nierhaus, 1983 ; Rheinberger, 1991), dass bereits die reziproke Kopplung zwischen E-Stellen trna und A-Stellen Aminoacyl-tRNA beschreibt. Über das Drei-Stellen- Modell hinaus erklärt das - -Modell die reziproke Kopplung über die beweglichen Domänen. Im posttranslokationalen Zustand (POST) weist die A-Stelle nur eine geringe Affinität für trnas auf, da sich die beiden Bindestellen und in der P- und E-Stelle befinden. Im 29
17 prätranslokationalen Zustand (PRE) überlagert die -Bindestelle die Dekodierungsstelle und schafft so eine hochaffine A-Stelle im Ribosom, während die -Bindestelle in der P-Stelle lokalisiert ist. Die E-Stelle ist nun ohne Bindestelle und zeigt eine niedrige Affinität für die trna (vgl. Abbildung 1.12). Das - -Modell steht nicht im Widerspruch zum Hybridzustand Modell, sondern liefert eine strukturelle Erklärung für die Bewegung der trnas durch das Ribosomen ohne Verlust des Leserasters, da in diesem Modell die ribosomale Umgebung für definierte Bewegungen der trnas sorgt. Diese Bewegung könnte prinzipiell auch sequentiell für die Untereinheiten erfolgen. 1.4 Termination der Proteinbiosynthese Die Elongation schreitet mit Aminosäureverknüpfungen pro Sekunde voran, bis eines der Stoppcodone (UAA, UAG oder UGA) in die A-Stelle des Ribosoms eintritt und die Termination einleitet. Die basalen Ereignisse der Termination sind das Erkennen des Stoppcodons der mrna in der A-Stelle und das Freisetzen des Proteins von der PeptidyltRNA in der P-Stelle. Diese beiden Ereignisse erfolgen durch Terminationsfaktoren der Klasse I (class 1 peptide release factors), die auch als Entlassungsfaktoren der Klasse I oder Dekodierungsterminationsfaktoren bezeichnet werden. In den meisten Eubakterien gibt es zwei der Klasse I Terminationsfaktoren, RF1 und RF2, die sich in der Dekodierungsmöglichkeit der Stoppcodone unterscheiden. RF1 erkennt UAA und UAG, während RF2 UGA und UAA dekodiert (Caskey et al., 1969 ) (Scolnick et al., 1968). In Eukaryoten und Archaebakterien werden die Stoppcodone nur durch einen einzigen Faktor erkannt (erf1 und arf1) (Frolova et al., 1994 ) (Dontsova et al., 2000). Obwohl zwischen den bakteriellen und den eukaryotischen Terminationsfaktoren keine Sequenz- oder Faltungsähnlichkeiten bestehen, d.h. dass sich die Mechanismen der Termination erst nach der Domäntrennung vor etwa 2.7 Milliarden Jahren heausgebildet haben, konnte innerhalb der Klasse I Terminationsfaktoren aller drei Domänen des Lebens eine konservierte Aminosäure- Triade gefunden werden: Das konservierte Aminosäure-Sequenzmotiv, das Tripeptid GGQ, ist in allen Klasse I Faktoren zu finden (Frolova et al., 1999). Dieses Motiv ist wichtig für die Hydrolyse des Polypeptides. Die Notwendigkeit des GGQ Motivs für die Peptidfreisetzung konnte in vitro (Zavialov et al., 2002) und in vivo (Mora et al., 2003) für RF1 und RF2 aus E. coli gezeigt werden, obwohl die genaue Funktion des Sequenzmotivs weiterhin offen bleibt. 30
18 Ein zweites, weniger stark konserviertes Sequenzmotiv der Terminationsfaktoren der Klasse 1, TASNIKS für erf1 und arf1, sowie die in E. coli gefundenen Motive PAT (in RF1) und SPF (in RF2) sind maßgeblich an der Dekodierung der Stoppcodone beteiligt (Ito et al., 1998; Ito et al., 2000 ) (Nakamura et al., 2000). Somit erfüllen die Klasse I Terminationsfaktoren zwei Funktionen: I) Erkennung (Dekodierung) der Stoppsignale und II) das Freisetzen der Polypeptidkette. Nach erfolgtem Freisetzen des Polypeptids wird der Terminationsfaktor der Klasse I durch die Wirkung eines Terminationsfaktors der Klasse II (RF3, erf3) vom Ribosom entfernt. RF3 und erf3 zeigen die typische Struktur eines G-Proteins, aber eine atypische Funktion (Pel et al., 1998). Die Funktionsweise von RF3 in E. coli wurde in einer Serie von Experimenten von Ehrenberg und Mitarbeitern aufgeklärt (Freistroffer et al., 1997 ) (Pavlov et al., 1997a; Pavlov et al., 1997b ) (Zavialov et al., 2001 ) (Zavialov et al., 2002). RF3 bindet in der GDP Form an den Terminationskomplex. Nach Hydrolyse des Peptids erfolgt der Austausch von GDP durch GTP. Dies führt zu einer Konformationsänderung innerhalb des RF3 und zur Entlassung des Klasse I Terminationsfaktors. Anschließend erfolgt die GTP Hydrolyse und die Dissoziation von RF3*GDP. Im Gegensatz zum RF3 Gen (prfc) aus E. coli ist das eukaryotische Gen für erf3 (sup35 in S.cerevisiae) ein essentielles Gen, die Wirkungsweise des erf3 unterscheidet sich von dem bakteriellen RF3 (Inge-Vechtomov et al., 2003; Kisselev et al., 2003 ). Mit der Bindung des RF3 beginnt der Prozess des Recyclings des eubakteriellen Ribosoms. 1.4 Ribosomrecycling Das Ribosomrecycling wird als vierte Phase der Proteinbiosynthese angesehen. Obwohl eine Vielzahl von Experimenten zum Ablauf des Ribosomrecyclings der Eubakterien innerhalb der letzten 40 Jahren veröffentlicht wurden, lässt sich noch kein klares Bild für das Ribosomrecycling zeichnen (Hirokawa et al., 2006 ; Vesper and Wilson, 2006). In Eubakterien sind ein weiterer Terminationsfaktor der Klasse II, der Ribosomrecycling Faktor (RRF), und EF-G an diesem Prozess beteiligt (Hirashima and Kaji, 1972a; Hirashima and Kaji, 1973). Weiterhin wird die Teilnahme des Initiationsfaktors 3 am Prozess der Dissoziation des 70S Ribosoms in die Untereinheiten diskutiert (Karimi et al., 1999 ) (Umekage and Ueda, 2006 ) (Peske et al., 2005). 31
19 Abbildung 1.13 Molekulare Mimikry-Modell. Die Kristallstruktur des RRF (links) zeigt strukturelle Ähnlichkeit mit der trna aus dem ternären Komplex aus Aminoacyl-tRNA*EF- Tu*GTP links. Zur Verdeutlichung wurde die RRF Struktur in die trna platziert (Mitte), aus (Selmer et al., 1999) Die Kristallstruktur des RRF aus Thermotoga maritima zeigt eine erstaunliche Ähnlichkeit zu der Struktur einer trna (Selmer et al., 1999) und führte zu der Idee der molekularen Mimikry der Terminationsfaktoren, Abbildung Kaji und Mitarbeiter schlagen für die Wirkung des RRF einen Mechanismus der strukturellen und funktionellen Mimikry vor. Die Ähnlichkeit der Kristallstruktur von RRF mit einer trna lieferte die Idee, dass RRF in der ribosomalen A-Stelle bindet und wie eine trna transloziert werden könnte. Eine Codon-RRF-Wechselwirkung und eine Akzeptorarm-Wechselwirkung mit dem Peptidylübertragungszentrum werden in diesem Modell nicht vorausgesetzt. Aus der ribosomalen A-Stelle erfolgt durch die Wirkung von EF-G, analog der Funktion im Elongationszyklus, die Translokation des RRF anstelle einer trna in die P-Stelle. Es entsteht dadurch ein instabiler Ribosom*Protein*mRNA*tRNA-Komplex, der ohne Codon- Anticodon-Wechselwirkung in der P-Stelle in seine Bestandteile dissoziiert (Hirokawa et al., 2002 ) (Selmer et al., 1999). Initiationsfaktor 3 (IF3) bindet an die kleine Untereinheit und verhindert eine Reassoziation der Untereinheiten (Abbildung 1.14A). Ehrenberg und Mitarbeiter schlagen ein Modell vor, bei dem das Ribosom durch die Wirkung von RRF und EF-G in die Untereinheiten dissoziiert wird, aber sowohl die mrna als auch die trna der P-Stelle an der kleinen Untereinheit gebunden bleiben. Die Entfernung der 32
20 mrna und der trna von der kleinen Untereinheit erfolgte bei diesem Modell durch den IF3 (Karimi et al., 1999), (Abbildung 1.14B). Abbildung 1.14 Modelle des Ribosomen Recycling A) Der Post-Terminations-Komplex trägt zwei deacyl-trnas in P- und E-Stelle. Unter der Wirkung des RRF und des EF-G erfolgt das Freisetzen der trna (I), das 70S Ribosom wird instabil, und dissoziiert in die Untereinheiten (II). Die mrna verlässt die kleine Untereinheit. IF3 bindet an die kleine Untereinheit und verhindert die Reassoziation der Untereinheiten. B) Recyclingmodell nach Ehrenberg. Der Post-Terminations-Komplex verliert durch die Bindung von RRF die E -Stellen trna, die P-Stellen trna wird in die Hybride P/E Position gedrängt (I). EF-G und RRF führen zur Dissoziation der großen Untereinheit, mrna und trna bleiben an der kleinen Untereinheit gebunden (II). IF3 bindet und entfernt die trna von der kleinen Untereinheit (III). Die mrna diffundiert von der kleinen Untereinheit. Aus Hirokawa, 2006 #15075 Eine andere Möglichkeit des Ribosomrecycling, die auf der Annahme einer Translokation von RRF durch EF-G beruht, besteht darin, dass durch die Translokation von RRF die Untereinheiten auseinandergedrückt werden können und dadurch die Dissoziation des Ribosoms eingeleitet wird. Strukturanalysen und Bindungsstudien zeigten eine Bindungsstelle von RRF innerhalb des Ribosoms, in der RRF gänzlich unerwartet die beiden trna Bindestellen, A- und P-Stelle überlappt und nicht, wie ursprünglich angenommen, die trna Mimikry nutzt und in die ribosomale A-Stelle bindet (Gao et al., 2005; Lancaster et al., 2002 ; Nakano et al., 2003 ; Wilson et al., 2005 ). Ein anderes Modell, in dem EF-G die Domäne II von RRF gegen eine der wichtigsten Brücken (Bridge 2a) zwischen den Untereinheiten drückt und damit die Dissoziation einleitet, wurde vorgeschlagen (Gao et al., 2005; Wilson et al., 2005 ). 33
21 Das zur Zeit wahrscheinlichste Szenario des Ribosomrecycling ist, das RRF und EF-G*GTP ausreichend sind, um den Post-Terminations-Komplex in die ribosomalen Untereinheiten zu spalten, also eine transiente Dissoziation herbeizuführen. Der Initiationsfaktor 3 ist notwendig, um die Reassoziation der Untereinheiten zu verhindern und somit eine stabile Dissoziation aufrecht zu erhalten. (Hirokawa et al., 2006; Vesper and Wilson, 2006 ). 1.5 Inhibition der Proteinbiosynthese durch Antibiotika Die komplexen Vorgänge der Proteinbiosynthese und die Interaktionen des Ribosoms mit den Initiationsfaktoren, Elongationsfaktoren und Aminoacyl-tRNAs bieten zahlreiche Angriffstellen für die Hemmung durch Antibiotika. Nahezu jeder Schritt der Initiation und der Elongation kann spezifisch durch Antibiotika inhibiert werden (Abbildung 1.15). Abbildung 1.15 Angriffspunkte einiger Antibiotika in der Proteinsynthese. Die Kombination aus Biochemie und Strukturbiologie ermöglicht den Einsatz der Antibiotika zur Aufklärung der molekularen Details der Proteinbiosynthese. Im Umkehrschluß lassen sich 34
22 mit den etablierten Methoden und der Strukturbiologie die Funktionsweise der Antibiotika und deren Derivate untersuchen. Gerade die Entwicklung neuer Antibiotika und die zielgerichtete Veränderung bekannter Antibiotika erfolgten durch die Kenntnis der Ribosomenstruktur. Die immer häufiger auftretenden multiplen Resistenzen einiger Bakterienstämme gegen die klinisch verwendeten Antibiotika durch unsachgemäße Verwendung der zur Verfügung stehenden Antibiotika, macht eine Entwicklung neuer oder derivatisierter Antibiotika zwingend notwendig. 1.6 Zielsetzung Mit der Lösung der Kristallstruktur des E. coli 70S Ribosoms erfolgte ein weiterer Schritt zum besseren Verständnis der Vorgänge der Proteinbiosynthese im Modellorganismus E. coli. Die hohe Konservierung des Mechanismus der Proteinbiosynthese, der Ribosomenstruktur und der Elongationsfaktoren boten die Möglichkeit Experimente und Strukturen der Faktoren und des Ribosoms aus verschiedenen Organismen zu nutzen, um ein Gesamtbild der Proteinsynthese zu erstellen. Und obwohl die generellen Vorgänge der Proteinsynthese immer klaren werden, kam es zu fehlerhaften Interpretationen der Ergebnisse. Die biochemische Aufklärung, meistens in E. coli durchgeführt, passte gelegentlich nicht mit den strukturellen Daten, z.b. aus T. thermophilus oder H. marismortui, überein (Tu et al., 2005; Wilson, 2004 ). Die Kombination aus biochemischen Daten aus in vitro und in vivo Experimenten können zusammen mit Strukturdaten zur Aufklärung der Mechanismen der Proteinsynthese genutzt werden. Eine Fehlerquelle, die zur Fehlinterpretation der Daten über die ribosomale E-Stelle führte, war die Verwendung der konventionellen Pufferbedingungen in in vitro Experimenten (Rheinberger and Nierhaus, 1987 ; Wintermeyer et al., 1990 ) (Agrawal et al., 1999b ; Blaha and Nierhaus, 2001). Erst die Einführung des Polyaminpuffersystems (Bartetzko and Nierhaus, 1988) ermöglichte die stabile Bindung der E-Stellen trna und erleichtere die Analyse der Bedeutung der deacyl-trna der E-Stelle in der Proteinbiosynthese (Übersichtsartikel von (Dinos et al., 2005; Márquez et al., 2002 )). Ziel dieser Doktorarbeit war es, bestehende in vitro Systeme zur weiteren Analyse der molekularen Details der Elongationsprozesse zu optimieren. Die optimierten Systeme sollen in odifizierter For in der Analyse der Prozesse der Termination und des Ribosomrecyclings Anwendung finden. Die Optimierung der in vitro Systeme dient dazu ein in vivo-nahe in vitro-systeme zu erstellen. Hierfür sollen etablierte Systeme (Stellenspezifische trna Bindung (Watanabe) und Poly Uridin-abhängige Poly-Phenylalaninsynthese) bezüglich 35
23 Effizienz und Genauigkeit verbessert werden. Neue Testsysteme zur Aktivitätsprüfung isolierter Proteine (RFs, RRF und EF4 (LepA) und RelA) sollen entwickelt werden. Die Analyse von Elongationsprozessen mittels toeprint Experimenten soll unter in vivo-nahen Pufferbedingungen etabliert werden, um neue Aspekte der Translokationsreaktion bzw. der Termination und des Ribosomrecyclings zu erhalten. Die Bindung von RelA an das Ribosomen und die Aufklärung der Bindungsposition sollen Aufschlüsse über den Regulationsmechanismus des RelA in Aminosäuremangelsituationen (stringent response) geben. Zum Aufbau eines in vivo-nahen Terminations- und Ribosomrecycling-Systems sollten die beteiligten Komponenten (Ribosomen, mrnas, trnas und Proteinfaktoren) isoliert und auf ihre Aktivität getestet werden. Zur Ermittlung der Funktion und der Wirkungsweise des Ribosomrecycling Faktors (RRF, ribosome recycling factor), wurden synthetische mrnas entworfen, hergestellt und isoliert, die in einem toeprint -Experiment eingesetzt werden können (Hartz et al., 1989). Mit diesem toeprint -Experiment soll eine mögliche Translokation der mrna, bzw. der trna(s) durch RRF und EF-G geprüft werden. Die Kombination der biochemischen Methoden mit der kryoelektronenmikroskopischen Rekonstruktion von ribosomalen Komplexen soll die noch offenen Fragen der Termination und des Ribosomrecycling beantworten. Insbesondere der Zeitpunk des Freisetzens der trnas und die Bindeposition des RRF sind von großem Interesse für das Verständnis des Mechanismus des Ribosomrecycling. 36
Posttranskriptionale RNA-Prozessierung
 Posttranskriptionale RNA-Prozessierung Spaltung + Modifikation G Q Spleissen + Editing U UUU Prozessierung einer prä-trna Eukaryotische messenger-rna Cap-Nukleotid am 5 -Ende Polyadenylierung am 3 -Ende
Posttranskriptionale RNA-Prozessierung Spaltung + Modifikation G Q Spleissen + Editing U UUU Prozessierung einer prä-trna Eukaryotische messenger-rna Cap-Nukleotid am 5 -Ende Polyadenylierung am 3 -Ende
Eukaryotische messenger-rna
 Eukaryotische messenger-rna Cap-Nukleotid am 5 -Ende Polyadenylierung am 3 -Ende u.u. nicht-codierende Bereiche (Introns) Spleißen von prä-mrna Viele Protein-codierende Gene in Eukaryoten sind durch nicht-codierende
Eukaryotische messenger-rna Cap-Nukleotid am 5 -Ende Polyadenylierung am 3 -Ende u.u. nicht-codierende Bereiche (Introns) Spleißen von prä-mrna Viele Protein-codierende Gene in Eukaryoten sind durch nicht-codierende
KV: Translation Michael Altmann
 Institut für Biochemie und Molekulare Medizin KV: Translation Michael Altmann Herbstsemester 2008/2009 Übersicht VL Translation 1.) Genexpression 2.) Der genetische Code ist universell 3.) Punktmutationen
Institut für Biochemie und Molekulare Medizin KV: Translation Michael Altmann Herbstsemester 2008/2009 Übersicht VL Translation 1.) Genexpression 2.) Der genetische Code ist universell 3.) Punktmutationen
Translation. Auflesung- Proteinsynthese
 Translation Auflesung- Proteinsynthese Proteinsynthese DNA mrna Transkription elágazási hely Translation Polypeptid Vor dem Anfang Beladen der trnas spezifische Aminosäure + spezifische trna + ATP Aminoacyl-tRNA
Translation Auflesung- Proteinsynthese Proteinsynthese DNA mrna Transkription elágazási hely Translation Polypeptid Vor dem Anfang Beladen der trnas spezifische Aminosäure + spezifische trna + ATP Aminoacyl-tRNA
Translation benötigt trnas und Ribosomen. Genetischer Code. Initiation Elongation Termination
 8. Translation Konzepte: Translation benötigt trnas und Ribosomen Genetischer Code Initiation Elongation Termination 1. Welche Typen von RNAs gibt es und welches sind ihre Funktionen? mouse huma n bacter
8. Translation Konzepte: Translation benötigt trnas und Ribosomen Genetischer Code Initiation Elongation Termination 1. Welche Typen von RNAs gibt es und welches sind ihre Funktionen? mouse huma n bacter
Translation benötigt trnas und Ribosomen. Genetischer Code. Initiation Elongation Termination
 8. Translation Konzepte: Translation benötigt trnas und Ribosomen Genetischer Code Initiation Elongation Termination 1. Welche Typen von RNAs gibt es und welches sind ihre Funktionen? mouse huma n bacter
8. Translation Konzepte: Translation benötigt trnas und Ribosomen Genetischer Code Initiation Elongation Termination 1. Welche Typen von RNAs gibt es und welches sind ihre Funktionen? mouse huma n bacter
Translation Teil 3 Proteinfaktoren und ihre Rolle in der Proteinsynthese
 Translation Teil 3 Proteinfaktoren und ihre Rolle in der Proteinsynthese Damit die Proteinsynthese beginnen kann, müssen m-rna und fmet-trna zum Ribosom gebracht werden. Wie geschieht das??? Von entscheidender
Translation Teil 3 Proteinfaktoren und ihre Rolle in der Proteinsynthese Damit die Proteinsynthese beginnen kann, müssen m-rna und fmet-trna zum Ribosom gebracht werden. Wie geschieht das??? Von entscheidender
Gen Protein Aufgaben: Edel LK-Bio BI-3
 Proteinbiosynthese Von der DNA zum Protein Dieses Lernprogramm zeigt Ihnen in einem vereinfachten Modell den im Zellinneren ablaufenden Prozess vom Gen auf der DNA zum Protein. Aufgaben: 1 Betrachten Sie
Proteinbiosynthese Von der DNA zum Protein Dieses Lernprogramm zeigt Ihnen in einem vereinfachten Modell den im Zellinneren ablaufenden Prozess vom Gen auf der DNA zum Protein. Aufgaben: 1 Betrachten Sie
mrna S/D UTR: untranslated region orf: open reading frame S/D: Shine-Dalgarno Sequenz
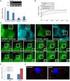 1. Nennen Sie die verschiedenen RNA-Typen, die bei der Translation wichtig sind. Erklären Sie die Funktion der verschiedenen RNA-Typen. Skizzieren Sie die Struktur der verschiedenen RNA-Typen und bezeichnen
1. Nennen Sie die verschiedenen RNA-Typen, die bei der Translation wichtig sind. Erklären Sie die Funktion der verschiedenen RNA-Typen. Skizzieren Sie die Struktur der verschiedenen RNA-Typen und bezeichnen
Das ist der Ort, wo die Proteine Synthetisiert werden. Zusammen mit mrna und trna bilden sie eine Einheit, an der die Proteine synthetisiert werden.
 DAS RIBOSOM Das ist der Ort, wo die Proteine Synthetisiert werden. Zusammen mit mrna und trna bilden sie eine Einheit, an der die Proteine synthetisiert werden. Das Ribosom besteht aus 2 zusammengelagerten
DAS RIBOSOM Das ist der Ort, wo die Proteine Synthetisiert werden. Zusammen mit mrna und trna bilden sie eine Einheit, an der die Proteine synthetisiert werden. Das Ribosom besteht aus 2 zusammengelagerten
8. Translation. Konzepte: Translation benötigt trnas und Ribosomen. Genetischer Code. Initiation - Elongation - Termination
 8. Translation Konzepte: Translation benötigt trnas und Ribosomen Genetischer Code Initiation - Elongation - Termination 1. Welche Typen von RNAs gibt es und welches sind ihre Funktionen? mouse human bacteria
8. Translation Konzepte: Translation benötigt trnas und Ribosomen Genetischer Code Initiation - Elongation - Termination 1. Welche Typen von RNAs gibt es und welches sind ihre Funktionen? mouse human bacteria
PROTEINBIOSYNTHESE "Das zentrale Dogma der Molekularbiologie"
 PROTEINBIOSYNTHESE "Das zentrale Dogma der Molekularbiologie" Die für die Synthese von Eiweißstoffen notwendigen Schritte sind: (1) Replikation der DNA: Vor jeder Zellteilung wird die gesamte zelluläre
PROTEINBIOSYNTHESE "Das zentrale Dogma der Molekularbiologie" Die für die Synthese von Eiweißstoffen notwendigen Schritte sind: (1) Replikation der DNA: Vor jeder Zellteilung wird die gesamte zelluläre
Zentrales Dogma der Biologie
 Zentrales Dogma der Biologie Transkription: von der DNA zur RNA Biochemie 01/1 Transkription Biochemie 01/2 Transkription DNA: RNA: Biochemie 01/3 Transkription DNA: RNA: Biochemie 01/4 Transkription RNA:
Zentrales Dogma der Biologie Transkription: von der DNA zur RNA Biochemie 01/1 Transkription Biochemie 01/2 Transkription DNA: RNA: Biochemie 01/3 Transkription DNA: RNA: Biochemie 01/4 Transkription RNA:
Auszug der Seiten der Max-Planck Arbeitsgruppe Ribosomenstruktur Leitung: Prof. Dr. Ada Yonath
 Auszug der Seiten der Max-Planck Arbeitsgruppe Ribosomenstruktur Leitung: Prof. Dr. Ada Yonath Die Gruppe Ribosomenstruktur beschäftigt sich mit der Aufklärung der Struktur und Funktion des Ribosoms, eines
Auszug der Seiten der Max-Planck Arbeitsgruppe Ribosomenstruktur Leitung: Prof. Dr. Ada Yonath Die Gruppe Ribosomenstruktur beschäftigt sich mit der Aufklärung der Struktur und Funktion des Ribosoms, eines
Elektronenmikroskopie zeigte die Existenz der A-, P- und E- trna-bindungsstellen. Abb. aus Stryer (5th Ed.)
 Elektronenmikroskopie zeigte die Existenz der A-, P- und E- trna-bindungsstellen Die verschiedenen Ribosomen-Komplexe können im Elektronenmikroskop beobachtet werden Durch Röntgenkristallographie wurden
Elektronenmikroskopie zeigte die Existenz der A-, P- und E- trna-bindungsstellen Die verschiedenen Ribosomen-Komplexe können im Elektronenmikroskop beobachtet werden Durch Röntgenkristallographie wurden
Molekularbiologie 6c Proteinbiosynthese. Bei der Proteinbiosynthese geht es darum, wie die Information der DNA konkret in ein Protein umgesetzt wird
 Molekularbiologie 6c Proteinbiosynthese Bei der Proteinbiosynthese geht es darum, wie die Information der DNA konkret in ein Protein umgesetzt wird 1 Übersicht: Vom Gen zum Protein 1. 2. 3. 2 Das Dogma
Molekularbiologie 6c Proteinbiosynthese Bei der Proteinbiosynthese geht es darum, wie die Information der DNA konkret in ein Protein umgesetzt wird 1 Übersicht: Vom Gen zum Protein 1. 2. 3. 2 Das Dogma
RNA und Expression RNA
 RNA und Expression Biochemie RNA 1) Die Transkription. 2) RNA-Typen 3) RNA Funktionen 4) RNA Prozessierung 5) RNA und Proteinexpression/Regelung 1 RNA-Typen in E. coli Vergleich RNA-DNA Sequenz 2 Die Transkriptions-Blase
RNA und Expression Biochemie RNA 1) Die Transkription. 2) RNA-Typen 3) RNA Funktionen 4) RNA Prozessierung 5) RNA und Proteinexpression/Regelung 1 RNA-Typen in E. coli Vergleich RNA-DNA Sequenz 2 Die Transkriptions-Blase
Es ist die Zeit gekommen, zu verstehen, wie es zur Proteinbiosynthese kommt?! Wobei jeweils eine AS von 3 Basen codiert wird..
 Proteinbiosynthese Es ist die Zeit gekommen, zu verstehen, wie es zur Proteinbiosynthese kommt?! Alle Proteine, sind über die DNA codiert Wobei jeweils eine AS von 3 Basen codiert wird.. GENETISCHER CODE
Proteinbiosynthese Es ist die Zeit gekommen, zu verstehen, wie es zur Proteinbiosynthese kommt?! Alle Proteine, sind über die DNA codiert Wobei jeweils eine AS von 3 Basen codiert wird.. GENETISCHER CODE
Vom Gen zum Protein. Zusammenfassung Kapitel 17. Die Verbindung zwischen Gen und Protein. Gene spezifizieren Proteine
 Zusammenfassung Kapitel 17 Vom Gen zum Protein Die Verbindung zwischen Gen und Protein Gene spezifizieren Proteine Zellen bauen organische Moleküle über Stoffwechselprozesse auf und ab. Diese Prozesse
Zusammenfassung Kapitel 17 Vom Gen zum Protein Die Verbindung zwischen Gen und Protein Gene spezifizieren Proteine Zellen bauen organische Moleküle über Stoffwechselprozesse auf und ab. Diese Prozesse
In den Proteinen der Lebewesen treten in der Regel 20 verschiedene Aminosäuren auf. Deren Reihenfolge muss in der Nucleotidsequenz der mrna und damit
 In den Proteinen der Lebewesen treten in der Regel 20 verschiedene Aminosäuren auf. Deren Reihenfolge muss in der Nucleotidsequenz der mrna und damit in der Nucleotidsequenz der DNA verschlüsselt (codiert)
In den Proteinen der Lebewesen treten in der Regel 20 verschiedene Aminosäuren auf. Deren Reihenfolge muss in der Nucleotidsequenz der mrna und damit in der Nucleotidsequenz der DNA verschlüsselt (codiert)
Biologie für Mediziner
 Biologie für Mediziner - Zellbiologie 1 - Zellkern Endoplasmatisches Retikulum Golgi-Apparat Eukaryoten: Kompartimentierung Zellkern: Aufbau umgeben von einer Doppelmembran äussere Membran geht direkt
Biologie für Mediziner - Zellbiologie 1 - Zellkern Endoplasmatisches Retikulum Golgi-Apparat Eukaryoten: Kompartimentierung Zellkern: Aufbau umgeben von einer Doppelmembran äussere Membran geht direkt
Institut für Biochemie und Molekulare Medizin. Lecture 1 Translational components. Michael Altmann FS 2011
 Institut für Biochemie und Molekulare Medizin Lecture 1 Translational components Michael Altmann FS 2011 Gene Expression Fliessdiagramm der eukaryotischen Genexpression Die Expression eines Gens kann auf
Institut für Biochemie und Molekulare Medizin Lecture 1 Translational components Michael Altmann FS 2011 Gene Expression Fliessdiagramm der eukaryotischen Genexpression Die Expression eines Gens kann auf
Bei der Translation wird die Aminosäuresequenz eines Polypeptids durch die Sequenz der Nukleotide in einem mrna- Molekül festgelegt
 Bei der Translation wird die Aminosäuresequenz eines Polypeptids durch die Sequenz der Nukleotide in einem mrna- Molekül festgelegt 5 mrna Nukleotid 3 N-Terminus Protein C-Terminus Aminosäure Es besteht
Bei der Translation wird die Aminosäuresequenz eines Polypeptids durch die Sequenz der Nukleotide in einem mrna- Molekül festgelegt 5 mrna Nukleotid 3 N-Terminus Protein C-Terminus Aminosäure Es besteht
5. Endoplasmatisches Reticulum und Golgi-Apparat
 5. Endoplasmatisches Reticulum und Golgi-Apparat Institut für medizinische Physik und Biophysik Ramona Wesselmann Endoplasmatisches Reticulum Umfangreiches Membransystem endoplasmatisch im Cytoplasma reticulum
5. Endoplasmatisches Reticulum und Golgi-Apparat Institut für medizinische Physik und Biophysik Ramona Wesselmann Endoplasmatisches Reticulum Umfangreiches Membransystem endoplasmatisch im Cytoplasma reticulum
Transkription Teil 2. - Transkription bei Eukaryoten -
 Transkription Teil 2 - Transkription bei Eukaryoten - Inhalte: Unterschiede in der Transkription von Pro- und Eukaryoten Die RNA-Polymerasen der Eukaryoten Cis- und trans-aktive Elemente Promotoren Transkriptionsfaktoren
Transkription Teil 2 - Transkription bei Eukaryoten - Inhalte: Unterschiede in der Transkription von Pro- und Eukaryoten Die RNA-Polymerasen der Eukaryoten Cis- und trans-aktive Elemente Promotoren Transkriptionsfaktoren
Musterlösung - Übung 5 Vorlesung Bio-Engineering Sommersemester 2008
 Aufgabe 1: Prinzipieller Ablauf der Proteinbiosynthese a) Erklären Sie folgende Begriffe möglichst in Ihren eigenen Worten (1 kurzer Satz): Gen Nukleotid RNA-Polymerase Promotor Codon Anti-Codon Stop-Codon
Aufgabe 1: Prinzipieller Ablauf der Proteinbiosynthese a) Erklären Sie folgende Begriffe möglichst in Ihren eigenen Worten (1 kurzer Satz): Gen Nukleotid RNA-Polymerase Promotor Codon Anti-Codon Stop-Codon
Protein Metabolismus
 Protein Metabolismus Stufen der Genexpression Wie wird die Basensequenz der RNA in die Aminosäuresequenz der Proteine umgewandelt? Der genetische Code Der genetische Code ist ein Triplett Code: 1 Aminosäure
Protein Metabolismus Stufen der Genexpression Wie wird die Basensequenz der RNA in die Aminosäuresequenz der Proteine umgewandelt? Der genetische Code Der genetische Code ist ein Triplett Code: 1 Aminosäure
Überblick von DNA zu Protein. Biochemie-Seminar WS 04/05
 Überblick von DNA zu Protein Biochemie-Seminar WS 04/05 Replikationsapparat der Zelle Der gesamte Replikationsapparat umfasst über 20 Proteine z.b. DNA Polymerase: katalysiert Zusammenfügen einzelner Bausteine
Überblick von DNA zu Protein Biochemie-Seminar WS 04/05 Replikationsapparat der Zelle Der gesamte Replikationsapparat umfasst über 20 Proteine z.b. DNA Polymerase: katalysiert Zusammenfügen einzelner Bausteine
Dr. Jens Kurreck. Otto-Hahn-Bau, Thielallee 63, Raum 029 Tel.: 83 85 69 69 Email: jkurreck@chemie.fu-berlin.de
 Dr. Jens Kurreck Otto-Hahn-Bau, Thielallee 63, Raum 029 Tel.: 83 85 69 69 Email: jkurreck@chemie.fu-berlin.de Prinzipien genetischer Informationsübertragung Berg, Tymoczko, Stryer: Biochemie 5. Auflage,
Dr. Jens Kurreck Otto-Hahn-Bau, Thielallee 63, Raum 029 Tel.: 83 85 69 69 Email: jkurreck@chemie.fu-berlin.de Prinzipien genetischer Informationsübertragung Berg, Tymoczko, Stryer: Biochemie 5. Auflage,
Studienprojekt DaMocles. Puromycin. von J. Primozic, A. Röblitz, M. Schorstein, D. Seelinger, Candeniz Simsek
 Studienprojekt DaMocles 1. Einleitung von J. Primozic, A. Röblitz, M. Schorstein, D. Seelinger, Candeniz Simsek ist ein Nucleosid-Antibiotikum, das erstmals 1954 aus der Bakterien-Gattung Streptomycin
Studienprojekt DaMocles 1. Einleitung von J. Primozic, A. Röblitz, M. Schorstein, D. Seelinger, Candeniz Simsek ist ein Nucleosid-Antibiotikum, das erstmals 1954 aus der Bakterien-Gattung Streptomycin
Einleitung. Replikation
 (C) 2014 - SchulLV 1 von 9 Einleitung Der Action-Film von gestern Abend war wieder ziemlich spannend. Mal wieder hat es der Superheld geschafft, alle Zeichen richtig zu deuten, diverse Geheimcodes zu knacken
(C) 2014 - SchulLV 1 von 9 Einleitung Der Action-Film von gestern Abend war wieder ziemlich spannend. Mal wieder hat es der Superheld geschafft, alle Zeichen richtig zu deuten, diverse Geheimcodes zu knacken
DNA mrna Protein. Initiation Elongation Termination. RNA Prozessierung. Unterschiede Pro /Eukaryoten
 7. Transkription Konzepte: DNA mrna Protein Initiation Elongation Termination RNA Prozessierung Unterschiede Pro /Eukaryoten 3. Aus welchen vier Nukleotiden ist RNA aufgebaut? 4. DNA RNA 5. Ein Wissenschaftler
7. Transkription Konzepte: DNA mrna Protein Initiation Elongation Termination RNA Prozessierung Unterschiede Pro /Eukaryoten 3. Aus welchen vier Nukleotiden ist RNA aufgebaut? 4. DNA RNA 5. Ein Wissenschaftler
Transkription und Translation sind in Eukaryoten räumlich und zeitlich getrennt. Abb. aus Stryer (5th Ed.)
 Transkription und Translation sind in Eukaryoten räumlich und zeitlich getrennt Die Initiation der Translation bei Eukaryoten Der eukaryotische Initiationskomplex erkennt zuerst das 5 -cap der mrna und
Transkription und Translation sind in Eukaryoten räumlich und zeitlich getrennt Die Initiation der Translation bei Eukaryoten Der eukaryotische Initiationskomplex erkennt zuerst das 5 -cap der mrna und
DNA mrna Protein. Initiation Elongation Termination. RNA Prozessierung. Unterschiede Pro /Eukaryoten
 7. Transkription Konzepte: DNA mrna Protein Initiation Elongation Termination RNA Prozessierung Unterschiede Pro /Eukaryoten 1. Aus welchen vier Nukleotiden ist RNA aufgebaut? 2. RNA unterscheidet sich
7. Transkription Konzepte: DNA mrna Protein Initiation Elongation Termination RNA Prozessierung Unterschiede Pro /Eukaryoten 1. Aus welchen vier Nukleotiden ist RNA aufgebaut? 2. RNA unterscheidet sich
DNA mrna Protein. Initiation Elongation Termination. RNA Prozessierung. Unterschiede Pro /Eukaryoten
 7. Transkription Konzepte: DNA mrna Protein Initiation Elongation Termination RNA Prozessierung Unterschiede Pro /Eukaryoten 1. Aus welchen vier Nukleotiden ist RNA aufgebaut? 2. RNA unterscheidet sich
7. Transkription Konzepte: DNA mrna Protein Initiation Elongation Termination RNA Prozessierung Unterschiede Pro /Eukaryoten 1. Aus welchen vier Nukleotiden ist RNA aufgebaut? 2. RNA unterscheidet sich
Beschreiben Sie in Stichworten zwei der drei Suppressormutationen, die man in Hefe charakterisiert hat. Starzinski-Powitz, 6 Fragen, 53 Punkte Name
 Starzinski-Powitz, 6 Fragen, 53 Punkte Name Frage 1 8 Punkte Nennen Sie 2 Möglichkeiten, wie der Verlust von Heterozygotie bei Tumorsuppressorgenen (Z.B. dem Retinoblastomgen) zum klompletten Funktionsverlust
Starzinski-Powitz, 6 Fragen, 53 Punkte Name Frage 1 8 Punkte Nennen Sie 2 Möglichkeiten, wie der Verlust von Heterozygotie bei Tumorsuppressorgenen (Z.B. dem Retinoblastomgen) zum klompletten Funktionsverlust
Struktur der Ribosomen Structure of the Ribosomes
 Struktur der Ribosomen Structure of the Ribosomes Schlünzen, Frank; Harms, Jörg M.; Yonath, Ada Max-Planck-Arbeitsgruppen für strukturelle Molekularbiologie am DESY, Hamburg Korrespondierender Autor E-Mail:
Struktur der Ribosomen Structure of the Ribosomes Schlünzen, Frank; Harms, Jörg M.; Yonath, Ada Max-Planck-Arbeitsgruppen für strukturelle Molekularbiologie am DESY, Hamburg Korrespondierender Autor E-Mail:
TRANSKRIPTION I. Die Herstellung von RNA bei E-Coli
 TRANSKRIPTION I Die Herstellung von RNA bei E-Coli Inhalt Aufbau der RNA-Polymerase Promotoren Sigma-Untereinheit Entwindung der DNA Elongation Termination der Transkription Modifizierung der RNA Antibiotika
TRANSKRIPTION I Die Herstellung von RNA bei E-Coli Inhalt Aufbau der RNA-Polymerase Promotoren Sigma-Untereinheit Entwindung der DNA Elongation Termination der Transkription Modifizierung der RNA Antibiotika
Expression der genetischen Information Skript: Kapitel 5
 Prof. A. Sartori Medizin 1. Studienjahr Bachelor Molekulare Zellbiologie FS 2013 12. März 2013 Expression der genetischen Information Skript: Kapitel 5 5.1 Struktur der RNA 5.2 RNA-Synthese (Transkription)
Prof. A. Sartori Medizin 1. Studienjahr Bachelor Molekulare Zellbiologie FS 2013 12. März 2013 Expression der genetischen Information Skript: Kapitel 5 5.1 Struktur der RNA 5.2 RNA-Synthese (Transkription)
Proteinbiosynthese. Prof. Dr. Albert Duschl
 Proteinbiosynthese Prof. Dr. Albert Duschl DNA/RNA/Protein Im Bereich von Genen sind die beiden Stränge der DNA nicht funktionell äquivalent, weil nur einer der beiden Stränge transkribiert, d.h. in RNA
Proteinbiosynthese Prof. Dr. Albert Duschl DNA/RNA/Protein Im Bereich von Genen sind die beiden Stränge der DNA nicht funktionell äquivalent, weil nur einer der beiden Stränge transkribiert, d.h. in RNA
1. Beschriften Sie in der Abbildung die verschiedenen Bereiche auf der DNA und beschreiben Sie ihre Funktion! nicht-codogener Strang.
 ARBEITSBLATT 1 Transkription 1. Beschriften Sie in der Abbildung die verschiedenen Bereiche auf der DNA und beschreiben Sie ihre Funktion! Bindungsstelle für RNA-Polymerase RNA-Polymerase nicht-codogener
ARBEITSBLATT 1 Transkription 1. Beschriften Sie in der Abbildung die verschiedenen Bereiche auf der DNA und beschreiben Sie ihre Funktion! Bindungsstelle für RNA-Polymerase RNA-Polymerase nicht-codogener
Datenspeicherung und Datenfluß in der Zelle - Grundlagen der Biochemie
 Datenspeicherung und Datenfluß in der Zelle - Grundlagen der Biochemie Datenspeicherung und Datenfluß der Zelle Transkription DNA RNA Translation Protein Aufbau I. Grundlagen der organischen Chemie und
Datenspeicherung und Datenfluß in der Zelle - Grundlagen der Biochemie Datenspeicherung und Datenfluß der Zelle Transkription DNA RNA Translation Protein Aufbau I. Grundlagen der organischen Chemie und
DNA Replikation ist semikonservativ. Abb. aus Stryer (5th Ed.)
 DNA Replikation ist semikonservativ Entwindung der DNA-Doppelhelix durch eine Helikase Replikationsgabel Eltern-DNA Beide DNA-Stränge werden in 5 3 Richtung synthetisiert DNA-Polymerasen katalysieren die
DNA Replikation ist semikonservativ Entwindung der DNA-Doppelhelix durch eine Helikase Replikationsgabel Eltern-DNA Beide DNA-Stränge werden in 5 3 Richtung synthetisiert DNA-Polymerasen katalysieren die
Molekulargenetik Biologie am Inhaltsverzeichnis Die Begriffe DNA, Nukleotid, Gen, Chromosom und Epigenom definieren...
 Molekulargenetik Inhaltsverzeichnis Die Begriffe DNA, Nukleotid, Gen, Chromosom und Epigenom definieren... 2 Beschreiben, wie die DNA aufgebaut ist... 3 Den Ablauf der Replikation erklären und dabei die
Molekulargenetik Inhaltsverzeichnis Die Begriffe DNA, Nukleotid, Gen, Chromosom und Epigenom definieren... 2 Beschreiben, wie die DNA aufgebaut ist... 3 Den Ablauf der Replikation erklären und dabei die
Was ist der Promotor? Antwort: Eine spezielle Nucleotidsequenz auf der DNA, an der die RNA-Polymerase bindet um die Transkription zu starten.
 Was ist der Promotor? Antwort: Eine spezielle Nucleotidsequenz auf der DNA, an der die RNA-Polymerase bindet um die Transkription zu starten. Wie bezeichnet man den Strang der DNA- Doppelhelix, der die
Was ist der Promotor? Antwort: Eine spezielle Nucleotidsequenz auf der DNA, an der die RNA-Polymerase bindet um die Transkription zu starten. Wie bezeichnet man den Strang der DNA- Doppelhelix, der die
Vererbung. Die durch Fortpflanzung entstandene Nachkommenschaft gleicht den Elternorganismen weitgehend
 Vererbung Die durch Fortpflanzung entstandene Nachkommenschaft gleicht den Elternorganismen weitgehend Klassische Genetik Äußeres Erscheinungsbild: Phänotypus setzt sich aus einer Reihe von Merkmalen (Phänen))
Vererbung Die durch Fortpflanzung entstandene Nachkommenschaft gleicht den Elternorganismen weitgehend Klassische Genetik Äußeres Erscheinungsbild: Phänotypus setzt sich aus einer Reihe von Merkmalen (Phänen))
Antibiotika sind oft Inhibitoren der Genexpression
 Antibiotika sind oft Inhibitoren der Genexpression Inhibitoren der Transkription: Rifampicin, Actinomycin α-amanitin Inhibitoren der Translation: Puromycin, Streptomycin, Tetracycline, Chloramphenicol
Antibiotika sind oft Inhibitoren der Genexpression Inhibitoren der Transkription: Rifampicin, Actinomycin α-amanitin Inhibitoren der Translation: Puromycin, Streptomycin, Tetracycline, Chloramphenicol
KV: Genexpression und Transkription Michael Altmann
 Institut für Biochemie und Molekulare Medizin KV: Genexpression und Transkription Michael Altmann Herbstsemester 2008/2009 Übersicht VL Genexpression / Transkription 1.) Was ist ein Gen? 2.) Welche Arten
Institut für Biochemie und Molekulare Medizin KV: Genexpression und Transkription Michael Altmann Herbstsemester 2008/2009 Übersicht VL Genexpression / Transkription 1.) Was ist ein Gen? 2.) Welche Arten
W i e P r o t e i n e f e r t i g g e m a c h t w e r d e n
 EINSICHTEN 2007 N E W S L E T T E R 0 1 l e b e n s w i s s e n s c h a f t e n Susanne Wedlich W i e P r o t e i n e f e r t i g g e m a c h t w e r d e n Etwa 10.000 verschiedene Proteine enthält eine
EINSICHTEN 2007 N E W S L E T T E R 0 1 l e b e n s w i s s e n s c h a f t e n Susanne Wedlich W i e P r o t e i n e f e r t i g g e m a c h t w e r d e n Etwa 10.000 verschiedene Proteine enthält eine
Antibakterielle Naturstoffe in der medizinischen Chemie
 OC 07-Vortrag Antibakterielle Naturstoffe in der medizinischen Chemie Tobias Geid Schlagwort: Selektive Toxizität (Paul Ehrlich) 1 Unterschiede zwischen menschlicher (eukaryotischer) und bakterieller (prokaryotischer)
OC 07-Vortrag Antibakterielle Naturstoffe in der medizinischen Chemie Tobias Geid Schlagwort: Selektive Toxizität (Paul Ehrlich) 1 Unterschiede zwischen menschlicher (eukaryotischer) und bakterieller (prokaryotischer)
Struktur der Ribosomen
 Schlünzen, Frank et al. Struktur der Ribosomen Tätigkeitsbericht 2004 Struktur- und Zellbiologie Struktur der Ribosomen Schlünzen, Frank; Harms, Jörg M.; Yonath, Ada Max-Planck-Arbeitsgruppen für strukturelle
Schlünzen, Frank et al. Struktur der Ribosomen Tätigkeitsbericht 2004 Struktur- und Zellbiologie Struktur der Ribosomen Schlünzen, Frank; Harms, Jörg M.; Yonath, Ada Max-Planck-Arbeitsgruppen für strukturelle
Übung 11 Genregulation bei Prokaryoten
 Übung 11 Genregulation bei Prokaryoten Konzepte: Differentielle Genexpression Positive Genregulation Negative Genregulation cis-/trans-regulation 1. Auf welchen Ebenen kann Genregulation stattfinden? Definition
Übung 11 Genregulation bei Prokaryoten Konzepte: Differentielle Genexpression Positive Genregulation Negative Genregulation cis-/trans-regulation 1. Auf welchen Ebenen kann Genregulation stattfinden? Definition
Das Ribosom: ein vielseitiges Mega-Ribozym The ribosome: a versatile mega-ribozyme
 Das Ribosom: ein vielseitiges Mega-Ribozym The ribosome: a versatile mega-ribozyme Rodnina, Marina V. Max-Planck-Institut für biophysikalische Chemie, Göttingen Korrespondierender Autor E-Mail: rodnina@mpibpc.mpg.de
Das Ribosom: ein vielseitiges Mega-Ribozym The ribosome: a versatile mega-ribozyme Rodnina, Marina V. Max-Planck-Institut für biophysikalische Chemie, Göttingen Korrespondierender Autor E-Mail: rodnina@mpibpc.mpg.de
Biochemie Tutorium 10. Genetischer Code, Translation & Regulation der Proteinbiosynthese
 Biochemie Tutorium 10 Genetischer Code, Translation & Regulation der Proteinbiosynthese IMPP-Gegenstandskatalog 3 Genetik 3.1 Nukleinsäuren 3.1.1 Molekulare Struktur, Konformationen und Funktionen der
Biochemie Tutorium 10 Genetischer Code, Translation & Regulation der Proteinbiosynthese IMPP-Gegenstandskatalog 3 Genetik 3.1 Nukleinsäuren 3.1.1 Molekulare Struktur, Konformationen und Funktionen der
Biologie I/B: Klassische und molekulare Genetik, molekulare Grundlagen der Entwicklung Theoretische Übungen SS 2016
 Biologie I/B: Klassische und molekulare Genetik, molekulare Grundlagen der Entwicklung Theoretische Übungen SS 2016 Fragen für die Übungsstunde 4 (20.06. 24.06.) Regulation der Transkription II, Translation
Biologie I/B: Klassische und molekulare Genetik, molekulare Grundlagen der Entwicklung Theoretische Übungen SS 2016 Fragen für die Übungsstunde 4 (20.06. 24.06.) Regulation der Transkription II, Translation
Um welches Molekül handelt es sich? Was ist dessen Funktion? Benennen Sie die funktionellen Gruppen. (2)
 Prüfungsfragen Biochemie; Teil Schroeder Ad Einheit 1 Vergleichen Sie die Stärke von molekularen Wechselwirkungen in kj/mol. In welcher Größenordnung ist der Abstand dieser Wechselwirkungen? Im Vergleich
Prüfungsfragen Biochemie; Teil Schroeder Ad Einheit 1 Vergleichen Sie die Stärke von molekularen Wechselwirkungen in kj/mol. In welcher Größenordnung ist der Abstand dieser Wechselwirkungen? Im Vergleich
Praktikum Biochemie B.Sc. Water Science WS Enzymregulation. Marinja Niggemann, Denise Schäfer
 Praktikum Biochemie B.Sc. Water Science WS 2011 Enzymregulation Marinja Niggemann, Denise Schäfer Regulatorische Strategien 1. Allosterische Wechselwirkung 2. Proteolytische Aktivierung 3. Kovalente Modifikation
Praktikum Biochemie B.Sc. Water Science WS 2011 Enzymregulation Marinja Niggemann, Denise Schäfer Regulatorische Strategien 1. Allosterische Wechselwirkung 2. Proteolytische Aktivierung 3. Kovalente Modifikation
Die DNA Replikation. Exakte Verdopplung des genetischen Materials. Musterstrang. Neuer Strang. Neuer Strang. Eltern-DNA-Doppelstrang.
 Die DNA Replikation Musterstrang Neuer Strang Eltern-DNA-Doppelstrang Neuer Strang Musterstrang Exakte Verdopplung des genetischen Materials Die Reaktion der DNA Polymerase 5`-Triphosphat Nächstes Desoxyribonucleosidtriphosphat
Die DNA Replikation Musterstrang Neuer Strang Eltern-DNA-Doppelstrang Neuer Strang Musterstrang Exakte Verdopplung des genetischen Materials Die Reaktion der DNA Polymerase 5`-Triphosphat Nächstes Desoxyribonucleosidtriphosphat
Proteinbiosynthese. Prof. Dr. Albert Duschl
 Proteinbiosynthese Prof. Dr. Albert Duschl DNA/RNA/Protein Im Bereich von Genen sind die beiden Stränge der DNA nicht funktionell äquivalent, weil nur einer der beiden Stränge transkribiert, d.h. in RNA
Proteinbiosynthese Prof. Dr. Albert Duschl DNA/RNA/Protein Im Bereich von Genen sind die beiden Stränge der DNA nicht funktionell äquivalent, weil nur einer der beiden Stränge transkribiert, d.h. in RNA
15.2 Transkription bei E. coli
 494 15 Genexpression und ihre Kontrolle Abb. 15.3 Schema des Transkriptions-/Translationskomplexes in E. coli. Aus dem dichten Knäuel der chromosomalen DNA im Nucleoid (rot) ragen DNA-Domänen hervor, die
494 15 Genexpression und ihre Kontrolle Abb. 15.3 Schema des Transkriptions-/Translationskomplexes in E. coli. Aus dem dichten Knäuel der chromosomalen DNA im Nucleoid (rot) ragen DNA-Domänen hervor, die
Biochemie Vorlesung Die ersten 100 Seiten
 Biochemie Vorlesung 11-15 Die ersten 100 Seiten 1. Unterschiede der Zellen Eukaryoten- Prokaryoten Eukaryoten: - Keine Zellwand - Intrazelluläre Membransysteme - Kernhülle mit 2 Membranen und Kernporen
Biochemie Vorlesung 11-15 Die ersten 100 Seiten 1. Unterschiede der Zellen Eukaryoten- Prokaryoten Eukaryoten: - Keine Zellwand - Intrazelluläre Membransysteme - Kernhülle mit 2 Membranen und Kernporen
Transkription 3. Teil. Posttranskriptionale Modifikationen
 Transkription 3. Teil Posttranskriptionale Modifikationen Gliederung des Vortrags 1. Reifung der t-rna 2. Modifikationen der Prä-mRNA 5 Capping 3 Schwanzbildung RNA-Editing Spleißen Alternatives Spleißen
Transkription 3. Teil Posttranskriptionale Modifikationen Gliederung des Vortrags 1. Reifung der t-rna 2. Modifikationen der Prä-mRNA 5 Capping 3 Schwanzbildung RNA-Editing Spleißen Alternatives Spleißen
Von der DNA zum Eiweißmolekül Die Proteinbiosynthese. Ribosom
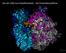 Von der DNA zum Eiweißmolekül Die Proteinbiosynthese Ribosom Wiederholung: DNA-Replikation und Chromosomenkondensation / Mitose Jede Zelle macht von Teilung zu Teilung einen Zellzyklus durch, der aus einer
Von der DNA zum Eiweißmolekül Die Proteinbiosynthese Ribosom Wiederholung: DNA-Replikation und Chromosomenkondensation / Mitose Jede Zelle macht von Teilung zu Teilung einen Zellzyklus durch, der aus einer
Der Träger aller genetischen Informationen ist die D N A - Desoxyribonucleic acid (Desoxyribonucleinsäure, DNS)
 N U C L E I N S Ä U R E N Der Träger aller genetischen Informationen ist die D N A - Desoxyribonucleic acid (Desoxyribonucleinsäure, DNS) BAUSTEINE DER NUCLEINSÄUREN Die monomeren Bausteine der Nucleinsäuren
N U C L E I N S Ä U R E N Der Träger aller genetischen Informationen ist die D N A - Desoxyribonucleic acid (Desoxyribonucleinsäure, DNS) BAUSTEINE DER NUCLEINSÄUREN Die monomeren Bausteine der Nucleinsäuren
Mechanismus der Enzymkatalyse
 Mechanismus der Enzymkatalyse Allgemeine Prinzipien Annäherung des Substrats an das aktive Zentrum des Enzyms Enzym und Substrat treten in Wechselwirkung: Bildung des [ES]-Komplexes. Konformationsänderung
Mechanismus der Enzymkatalyse Allgemeine Prinzipien Annäherung des Substrats an das aktive Zentrum des Enzyms Enzym und Substrat treten in Wechselwirkung: Bildung des [ES]-Komplexes. Konformationsänderung
Ribosomen, die Eiweißfabriken der Zelle, lüften ihre Geheimnisse Ribosomes, the cellular production plants of proteins, loose their secrets
 Ribosomen, die Eiweißfabriken der Zelle, lüften ihre Ribosomes, the cellular production plants of proteins, loose their secrets Fucini, Paola; Nierhaus, Knud H. Max-Planck-Institut für molekulare Genetik,
Ribosomen, die Eiweißfabriken der Zelle, lüften ihre Ribosomes, the cellular production plants of proteins, loose their secrets Fucini, Paola; Nierhaus, Knud H. Max-Planck-Institut für molekulare Genetik,
Biochemie Tutorium 9. RNA, Transkription
 Biochemie Tutorium 9 RNA, Transkription IMPP-Gegenstandskatalog 3 Genetik 3.1 Nukleinsäuren 3.1.1 Molekulare Struktur, Konformationen und Funktionen der Desoxyribonukleinsäure (DNA); Exon, Intron 3.1.2
Biochemie Tutorium 9 RNA, Transkription IMPP-Gegenstandskatalog 3 Genetik 3.1 Nukleinsäuren 3.1.1 Molekulare Struktur, Konformationen und Funktionen der Desoxyribonukleinsäure (DNA); Exon, Intron 3.1.2
Das zentrale Dogma der Molekularbiologie:
 Das zentrale Dogma der Molekularbiologie: DNA Transkription RNA Translation Protein 1 Begriffserklärungen GENOM: Ist die allgemeine Bezeichnung für die Gesamtheit aller Gene eines Organismus GEN: Ist ein
Das zentrale Dogma der Molekularbiologie: DNA Transkription RNA Translation Protein 1 Begriffserklärungen GENOM: Ist die allgemeine Bezeichnung für die Gesamtheit aller Gene eines Organismus GEN: Ist ein
Promotor kodierende Sequenz Terminator
 5.2 Genexpression Sequenz in eine RNA-Sequenz. Die Enzyme, die diese Reaktion katalysieren, sind die DNA-abhängigen RNA-Polymerasen. Sie bestehen aus mehreren Untereinheiten, die von den Pro- bis zu den
5.2 Genexpression Sequenz in eine RNA-Sequenz. Die Enzyme, die diese Reaktion katalysieren, sind die DNA-abhängigen RNA-Polymerasen. Sie bestehen aus mehreren Untereinheiten, die von den Pro- bis zu den
Vorlesung Molekulare Humangenetik
 Vorlesung Molekulare Humangenetik WS 2013/2014 Dr. Shamsadin DNA-RNA-Protein Allgemeines Prüfungen o. Klausuren als indiv. Ergänzung 3LP benotet o. unbenotet Seminar Block 2LP Vorlesung Donnerstags 14-16
Vorlesung Molekulare Humangenetik WS 2013/2014 Dr. Shamsadin DNA-RNA-Protein Allgemeines Prüfungen o. Klausuren als indiv. Ergänzung 3LP benotet o. unbenotet Seminar Block 2LP Vorlesung Donnerstags 14-16
Der molekulare Bauplan des Lebens; biologische Nano- und Mikrobausteine von Lebewesen. RNA und DNA als sich selbst replizierende Informationsspeicher
 Der molekulare Bauplan des Lebens; biologische Nano- und Mikrobausteine von Lebewesen RNA und DNA als sich selbst replizierende Informationsspeicher Quelle: Biochemie, J.M. Berg, J.L. Tymoczko, L. Stryer,
Der molekulare Bauplan des Lebens; biologische Nano- und Mikrobausteine von Lebewesen RNA und DNA als sich selbst replizierende Informationsspeicher Quelle: Biochemie, J.M. Berg, J.L. Tymoczko, L. Stryer,
Genaktivierung und Genexpression
 Genaktivierung und Genexpression Unter Genexpression versteht man ganz allgemein die Ausprägung des Genotyps zum Phänotyp einer Zelle oder eines ganzen Organismus. Genotyp: Gesamtheit der Informationen
Genaktivierung und Genexpression Unter Genexpression versteht man ganz allgemein die Ausprägung des Genotyps zum Phänotyp einer Zelle oder eines ganzen Organismus. Genotyp: Gesamtheit der Informationen
Inhaltsverzeichnis. Teil I Die chemischen Grundlagen des Lebens. Teil II Die Zelle. Vorwort... 1 Einführung: Schlüsselthemen der Biologie...
 Inhaltsverzeichnis Vorwort............................................... 1 Einführung: Schlüsselthemen der Biologie............................... 1 1.1 Theorien und Konzepte verbinden die Disziplinen
Inhaltsverzeichnis Vorwort............................................... 1 Einführung: Schlüsselthemen der Biologie............................... 1 1.1 Theorien und Konzepte verbinden die Disziplinen
Übung 11 Genregulation bei Prokaryoten
 Übung 11 Genregulation bei Prokaryoten Konzepte: Differentielle Genexpression Positive Genregulation Negative Genregulation cis-/trans-regulation 1. Auf welchen Ebenen kann Genregulation stattfinden? Definition
Übung 11 Genregulation bei Prokaryoten Konzepte: Differentielle Genexpression Positive Genregulation Negative Genregulation cis-/trans-regulation 1. Auf welchen Ebenen kann Genregulation stattfinden? Definition
Klausur zur Vorlesung Biochemie III im WS 2000/01
 Klausur zur Vorlesung Biochemie III im WS 2000/01 am 15.02.2001 von 15.30 17.00 Uhr (insgesamt 100 Punkte, mindestens 40 erforderlich) Bitte Name, Matrikelnummer und Studienfach unbedingt angeben (3 1.
Klausur zur Vorlesung Biochemie III im WS 2000/01 am 15.02.2001 von 15.30 17.00 Uhr (insgesamt 100 Punkte, mindestens 40 erforderlich) Bitte Name, Matrikelnummer und Studienfach unbedingt angeben (3 1.
Signale und Signalwege in Zellen
 Signale und Signalwege in Zellen Zellen müssen Signale empfangen, auf sie reagieren und Signale zu anderen Zellen senden können Signalübertragungsprozesse sind biochemische (und z.t. elektrische) Prozesse
Signale und Signalwege in Zellen Zellen müssen Signale empfangen, auf sie reagieren und Signale zu anderen Zellen senden können Signalübertragungsprozesse sind biochemische (und z.t. elektrische) Prozesse
DNA: Aufbau, Struktur und Replikation
 DNA: Aufbau, Struktur und Replikation Biochemie Die DNA als Träger der Erbinformation Im Genom sind sämtliche Informationen in Form von DNA gespeichert. Die Information des Genoms ist statisch, d. h. in
DNA: Aufbau, Struktur und Replikation Biochemie Die DNA als Träger der Erbinformation Im Genom sind sämtliche Informationen in Form von DNA gespeichert. Die Information des Genoms ist statisch, d. h. in
Aufgabe 1. Bakterien als Untersuchungsgegenstand!
 Genetik I Aufgabe 1. Bakterien als Untersuchungsgegenstand 1. Beschriften Sie die Abbildung zu den Bakterien. 2. Nennen Sie Vorteile, die Bakterien wie Escherichia coli so wertvoll für die genetische Forschung
Genetik I Aufgabe 1. Bakterien als Untersuchungsgegenstand 1. Beschriften Sie die Abbildung zu den Bakterien. 2. Nennen Sie Vorteile, die Bakterien wie Escherichia coli so wertvoll für die genetische Forschung
Einführung in die Biochemie Wirkungsweise von Enzymen
 Wirkungsweise von en Am Aktiven Zentrum kann ein nur in einer ganz bestimmten Orientierung anlegen, wie ein Schlüssel zum Schloss. Dieses Prinzip ist die Ursache der spezifität von en. Dies resultiert
Wirkungsweise von en Am Aktiven Zentrum kann ein nur in einer ganz bestimmten Orientierung anlegen, wie ein Schlüssel zum Schloss. Dieses Prinzip ist die Ursache der spezifität von en. Dies resultiert
Spleißen und Prozessieren von mrna
 Spleißen und Prozessieren von mrna Spleißen, die Aneinanderreihung von Exons: Prä-mRNAs sind 4-10x länger als die eigentlichen mrnas. Funktionelle Sequenzabschnitte in den Introns der Prä-mRNA: 5 -Spleißstelle
Spleißen und Prozessieren von mrna Spleißen, die Aneinanderreihung von Exons: Prä-mRNAs sind 4-10x länger als die eigentlichen mrnas. Funktionelle Sequenzabschnitte in den Introns der Prä-mRNA: 5 -Spleißstelle
GENETIK. für Studierende. Michaela Aubele. für Ahnungslose. Eine Einstiegshilfe. 2. Auflage. Dr. Michaela Aubele, München.
 Michaela Aubele GENETIK für Ahnungslose Eine Einstiegshilfe für Studierende 2. Auflage von Prof. Dr. Michaela Aubele, München Mit 52 Abbildungen und 33 Tabellen S. Hirzel Verlag die VII Vorwort V Kurzer
Michaela Aubele GENETIK für Ahnungslose Eine Einstiegshilfe für Studierende 2. Auflage von Prof. Dr. Michaela Aubele, München Mit 52 Abbildungen und 33 Tabellen S. Hirzel Verlag die VII Vorwort V Kurzer
Crystal structure of the eukaryotic 40S ribosomal subunit in complex with initiation factor 1
 Research Collection Doctoral Thesis Crystal structure of the eukaryotic 40S ribosomal subunit in complex with initiation factor 1 Author(s): Rabl, Julius Publication Date: 2011 Permanent Link: https://doi.org/10.3929/ethz-a-006882846
Research Collection Doctoral Thesis Crystal structure of the eukaryotic 40S ribosomal subunit in complex with initiation factor 1 Author(s): Rabl, Julius Publication Date: 2011 Permanent Link: https://doi.org/10.3929/ethz-a-006882846
Entwicklungs /gewebespezifische Genexpression. Coexpression funktional überlappender Gene
 Übung 11 Genregulation bei Prokaryoten Konzepte: Entwicklungs /gewebespezifische Genexpression Coexpression funktional überlappender Gene Positive Genregulation Negative Genregulation cis /trans Regulation
Übung 11 Genregulation bei Prokaryoten Konzepte: Entwicklungs /gewebespezifische Genexpression Coexpression funktional überlappender Gene Positive Genregulation Negative Genregulation cis /trans Regulation
Hemmung der Enzym-Aktivität
 Enzym - Inhibitoren Wie wirkt Penicillin? Wie wirkt Aspirin? Welche Rolle spielt Methotrexat in der Chemotherapie? Welche Wirkstoffe werden gegen HIV entwickelt? Hemmung der Enzym-Aktivität Substrat Kompetitiver
Enzym - Inhibitoren Wie wirkt Penicillin? Wie wirkt Aspirin? Welche Rolle spielt Methotrexat in der Chemotherapie? Welche Wirkstoffe werden gegen HIV entwickelt? Hemmung der Enzym-Aktivität Substrat Kompetitiver
Grundlagen der Molekularen Biophysik WS 2011/12 (Bachelor) Dozent: Prof Dr. Ulrike Alexiev (R , Tel /Sekretariat Frau Endrias Tel.
 Grundlagen der Molekularen Biophysik WS 2011/12 (Bachelor) Dozent: Prof Dr. Ulrike Alexiev (R.1.2.34, Tel. 55157/Sekretariat Frau Endrias Tel. 53337) Tutoren: Dr. Kristina Kirchberg, Alex Boreham 6-stündig
Grundlagen der Molekularen Biophysik WS 2011/12 (Bachelor) Dozent: Prof Dr. Ulrike Alexiev (R.1.2.34, Tel. 55157/Sekretariat Frau Endrias Tel. 53337) Tutoren: Dr. Kristina Kirchberg, Alex Boreham 6-stündig
1. Welche Auswirkungen auf die Expression des lac-operons haben die folgenden Mutationen:
 Übung 10 1. Welche Auswirkungen auf die Expression des lac-operons haben die folgenden Mutationen: a. Eine Mutation, die zur Expression eines Repressors führt, der nicht mehr an den Operator binden kann.
Übung 10 1. Welche Auswirkungen auf die Expression des lac-operons haben die folgenden Mutationen: a. Eine Mutation, die zur Expression eines Repressors führt, der nicht mehr an den Operator binden kann.
Versuch von Beadle und Tatum Verändertes Gen -> veränderter Phänotyp
 Versuch von Beadle und Tatum Verändertes Gen -> veränderter Phänotyp Neurospora crassa Ein-Gen-ein-Enzym Hypothese Ein-Gen-ein-Polypeptid-Hypothese Ein-Gen-ein-Genprodukt-Hypothese Purves et al. 12.1 1
Versuch von Beadle und Tatum Verändertes Gen -> veränderter Phänotyp Neurospora crassa Ein-Gen-ein-Enzym Hypothese Ein-Gen-ein-Polypeptid-Hypothese Ein-Gen-ein-Genprodukt-Hypothese Purves et al. 12.1 1
Inhalt Genexpression Microarrays E-Northern
 Inhalt Genexpression Microarrays E-Northern Genexpression Übersicht Definition Proteinbiosynthese Ablauf Transkription Translation Transport Expressionskontrolle Genexpression: Definition Realisierung
Inhalt Genexpression Microarrays E-Northern Genexpression Übersicht Definition Proteinbiosynthese Ablauf Transkription Translation Transport Expressionskontrolle Genexpression: Definition Realisierung
Verbesserte Basenpaarung bei DNA-Analysen
 Powered by Seiten-Adresse: https://www.gesundheitsindustriebw.de/de/fachbeitrag/aktuell/verbesserte-basenpaarungbei-dna-analysen/ Verbesserte Basenpaarung bei DNA-Analysen Ein Team aus der Organischen
Powered by Seiten-Adresse: https://www.gesundheitsindustriebw.de/de/fachbeitrag/aktuell/verbesserte-basenpaarungbei-dna-analysen/ Verbesserte Basenpaarung bei DNA-Analysen Ein Team aus der Organischen
BIOWISSENSCHAFTEN. Die Biowissenschaften. Biochemie. Molekularbiologie. Mikrobiologie. Botanik, Zoologie. Genetik. Biotechnologie.
 Die Biowissenschaften Mikrobiologie Biotechnologie Biochemie Genetik Molekularbiologie Botanik, Zoologie weitere Disziplinen Physiologie Zellbiologie Zentrum f. Angew. Genetik BIOWISSENSCHAFTEN Genetik
Die Biowissenschaften Mikrobiologie Biotechnologie Biochemie Genetik Molekularbiologie Botanik, Zoologie weitere Disziplinen Physiologie Zellbiologie Zentrum f. Angew. Genetik BIOWISSENSCHAFTEN Genetik
Frage 1 A: Wieviele Codone des "Universellen genetisches Codes" kodieren:
 Frage 1 A: Wieviele Codone des "Universellen genetisches Codes" kodieren: Aminosäuren Translationsstart Translationsstop? B: Welche biochemische Reaktion wird von Aminoazyl-tRNA-Synthetasen katalysiert?
Frage 1 A: Wieviele Codone des "Universellen genetisches Codes" kodieren: Aminosäuren Translationsstart Translationsstop? B: Welche biochemische Reaktion wird von Aminoazyl-tRNA-Synthetasen katalysiert?
Katalyse. höhere Reaktionsgeschwindigkeit bei derselben Temperatur! Achtung: Gleichgewicht der chemischen Reaktion wird nicht verschoben
 Katalyse Ein Katalysator setzt Aktivierungsenergie einer Reaktion herab, indem er einen anderen Reaktionsweg ermöglicht, so dass der geschwindigkeitsbestimmende Schritt der nicht-katalysierten Reaktion
Katalyse Ein Katalysator setzt Aktivierungsenergie einer Reaktion herab, indem er einen anderen Reaktionsweg ermöglicht, so dass der geschwindigkeitsbestimmende Schritt der nicht-katalysierten Reaktion
1. Skizzieren Sie schematisch ein Gen mit flankierender Region. Bezeichnen und beschriften Sie:
 1. Skizzieren Sie schematisch ein Gen mit flankierender Region. Bezeichnen und beschriften Sie: - 5 UTR (leader) - 3 UTR (trailer) - Terminator - Stopp-Kodon - Initiationskodon - Transkriptionsstartstelle
1. Skizzieren Sie schematisch ein Gen mit flankierender Region. Bezeichnen und beschriften Sie: - 5 UTR (leader) - 3 UTR (trailer) - Terminator - Stopp-Kodon - Initiationskodon - Transkriptionsstartstelle
Structure of the transfer-rna domain of tmrna in complex with SmpB
 Research Collection Doctoral Thesis Structure of the transfer-rna domain of tmrna in complex with SmpB Author(s): Gutmann, Sascha Michael Publication Date: 2004 Permanent Link: https://doi.org/10.3929/ethz-a-004938713
Research Collection Doctoral Thesis Structure of the transfer-rna domain of tmrna in complex with SmpB Author(s): Gutmann, Sascha Michael Publication Date: 2004 Permanent Link: https://doi.org/10.3929/ethz-a-004938713
Bioorganische Chemie Enzymatische Katalyse 2011
 Ringvorlesung Chemie B - Studiengang Molekulare Biotechnologie Bioorganische Chemie Enzymatische Katalyse 2011 Prof. Dr. A. Jäschke INF 364, Zi. 308, Tel. 54 48 51 jaeschke@uni-hd.de Lehrziele I Kenntnis
Ringvorlesung Chemie B - Studiengang Molekulare Biotechnologie Bioorganische Chemie Enzymatische Katalyse 2011 Prof. Dr. A. Jäschke INF 364, Zi. 308, Tel. 54 48 51 jaeschke@uni-hd.de Lehrziele I Kenntnis
Weitergabe genetischer Information: DNA-Replikation Beispiel: Escherichia coli.
 Weitergabe genetischer Information: DNA-Replikation Beispiel: Escherichia coli. zirkuläres bakterielles Chromosom Replikation (Erstellung einer identischen Kopie des genetischen Materials) MPM 1 DNA-Polymerasen
Weitergabe genetischer Information: DNA-Replikation Beispiel: Escherichia coli. zirkuläres bakterielles Chromosom Replikation (Erstellung einer identischen Kopie des genetischen Materials) MPM 1 DNA-Polymerasen
Max-Planck-Gesellschaft Arbeitsgruppen für Strukturelle Molekularbiologie
 Max-Planck-Gesellschaft Arbeitsgruppen für Strukturelle Molekularbiologie Leiter: H.-D. Bartunik, E. Mandelkow (Sprecher), A. Yonath Die Max-Planck-Arbeitsgruppen beschäftigen sich mit den Beziehungen
Max-Planck-Gesellschaft Arbeitsgruppen für Strukturelle Molekularbiologie Leiter: H.-D. Bartunik, E. Mandelkow (Sprecher), A. Yonath Die Max-Planck-Arbeitsgruppen beschäftigen sich mit den Beziehungen
Molekulargenetik der Eukaryoten WS 2014/15, VL 11. Erwin R. Schmidt Institut für Molekulargenetik
 Molekulargenetik der Eukaryoten WS 2014/15, VL 11 Erwin R. Schmidt Institut für Molekulargenetik Abhängig von der Genklasse: Genstruktur der Eukaryoten 1. RNA Pol I Gene: 18S, 5,8S, 28S rrna 2. RNA Pol
Molekulargenetik der Eukaryoten WS 2014/15, VL 11 Erwin R. Schmidt Institut für Molekulargenetik Abhängig von der Genklasse: Genstruktur der Eukaryoten 1. RNA Pol I Gene: 18S, 5,8S, 28S rrna 2. RNA Pol
27 Funktionelle Genomanalysen Sachverzeichnis
 Inhaltsverzeichnis 27 Funktionelle Genomanalysen... 543 27.1 Einleitung... 543 27.2 RNA-Interferenz: sirna/shrna-screens 543 Gunter Meister 27.3 Knock-out-Technologie: homologe Rekombination im Genom der
Inhaltsverzeichnis 27 Funktionelle Genomanalysen... 543 27.1 Einleitung... 543 27.2 RNA-Interferenz: sirna/shrna-screens 543 Gunter Meister 27.3 Knock-out-Technologie: homologe Rekombination im Genom der
