Moderne Methoden in der Organischen Chemie
|
|
|
- Irmgard Baumgartner
- vor 6 Jahren
- Abrufe
Transkript
1 oderne ethoden in der rganischen Chemie Seite 0. Allgemeines 1 Chemoselektivität 1 egioselektivität 1 Stereoselektivität 1 1. xidationsreaktionen xidationen von C--Bindungen icht aktivierte C--Bindungen Allylische/benzylische C--Bindungen 2 - mit Selendioxid xidation α zu C-X-Bindungen 3 Alkohole 3 a) Chromat-eagentien 3 b) offat-swern-xidation (DS-xidationen) 4 c) Dess-artin-xidation xidationen α zu Carbonylgruppen 5 1) nolat-xidationen 5 a) lektrophile α-ydroxylierung 5 b) α-selenierung xidationen von C-C-Bindungen xidative Spaltungen 6 a) Glykolspaltung 6 b) poxidspaltung 7 c) Baeyer-Villiger-xidation 7 d) Beckmann-Umlagerung xidationen von C-C-ehrfachbindungen poxidierung lektrophile poxidierung 8 a) Persäuren 8 b) Dioxiran 8 c) Übergangsmetalle 9 Vanadin 9 Titan ucleophile poxidierung 10 I
2 1.3.2 Dihydroxylierung trans-diole cis-diole 11 mit s 4 11 Sharpless Dihydroxylierung alooxygenierung ydratisierung 13 a) xymercurierung / eduktion 13 b) ydroborierung / xidation eduktionsreaktionen 14 Übersicht über gängige eduktionsverfahren eduktion mit komplexen ydriden Aldehyde und Ketone 15 a) Aldehyde neben Ketonen 15 b) Ketone neben Aldehyden 15 c) 1,2- neben 1,4-eduktion 16 d) 1,4- neben 1,2-eduktion Carbonsäuren und Derivate 16 1) zum Alkohol 16 a) 1,2- neben 1,4-eduktion 16 b) 1,4- neben 1,2-eduktion 16 2) zum Aldehyd 17 a) ster 17 b) Amide Desoxygenierung 17 a) eduktion von Tosylaten 17 b) adikalische Desoxygenierung Dehalogenierung eduktive Decarboxylierung eduktion von C C-ehrfachbindungen 19 Alkine zu Alkenen Ionische ydrierung eduktion durch katalytische ydrierung 20 II
3 2.2.1 eduktion von C C-Doppelbindungen eduktion von C -Doppelbindungen eduktion von C C-Dreifachbindungen eduktion durch auflösende etalle eduktion von Aromaten eduktion von nonen eduktion von Dreifachbindungen eduktion mit Diimid 23 III
4 oderne ethoden in der rganischen Chemie 0. Allgemeines: Wichtig für alle chemischen eaktionen: Selektivität Chemoselektivität: egioselektivität: + Stereoselektivät: - nantioselektivität: -Diastereosektivität: ' ' ' ' -Stereospezifität: ' Br Br 2 ' ' Br 2 Br Br ' Br 1
5 1. xidationsreaktionen 1.1 xidationen von C -Bindungen icht aktivierte C -Bindungen Barton eaktion C 3 Cl C 3 Ac Pyr Ac hν. C 2. C 3.. Ac Ac 2 C C Ac Ac J. Chem. Soc., Perkin I 1979, Allylische/benzylische C -Bindungen - mit Selendioxid Se C C C 'n' Se [2.3]-sigmatrope Umlagerung Se - Se, Se 2 xid. 2
6 C Se 2,, C J. rg. Chem. 1978, xidation α zu C X-Bindungen Alkohole viele öglichkeiten eagentienwahl sehr wichtig Übersicht: Cr 3 /Pyr; Cr 3 / 2 S 4 e 2 C/Al/iPr) 3 (ppenauer, etc.) DS/DCC (CCl 2 ) (Swern, offatt) -C -C Cr 2 (tbu) 2, Pb(Ac) 4 starke x-ittel (Kn 4 ) n 2 a) Chromat-eagentien Cr 3 /Pyr. 20 h, rt 89% J. Am. Chem. Soc. 1954, 76, echanismus: Cr Cr 3 C C C + Cr ' ' ' 3
7 Alkohol Aldehyd: mit Cr 2 (tbu) 2 oder Cr 3 -C 2 Cr 3 -C -C in C 2 Cl 2, Py "nichtwässrig" "wässrig" 2 b) offatt-swern-xidation (DS-xidationen) Prinzip: Alkohol + DS + (CCl) 2 / CCl 2 / DCC / Ac 2 / P 4 10 (wasserentz. ittel) DS (CF 3 C) 2 61% C 3 C C 3 C J. rg. Chem. 1978, 43, echanismus: Swern-xidation C 2 S C 3 C 3 Cl C 3 C 2 - Cl - C, - C 2 S C 3 + C Cl 3 C C 3 2 S + C 2 S - C Cl 3 C 3 Cl + S Cl - Cl Cl - C - + S Cl + Cl - C 2 -C 2 - Cl t 3 - Cl C 3 C 2 S + - C 2 C + (C 3 ) 2 S 4
8 c) Dess-artin-xidation erstellung der eagenzes: echanismus: I C 1) KBr 3 / 2 S 4 2) Ac 2 / Ac 40 min, 100 C Ac Ac I Ac 87% Periodinan (DP) J. rg. Chem. 1983, 48, C Ac + - Ac I I Ac Ac Ac Ac Ac I Ac DP 79% C 3 C C 3 C J. Am. Chem. Soc. 1991, 113, xidationen α zu Carbonylgruppen 1) nolat-xidationen a) lektrophile α-ydroxylierung 1) LDA, -78 C 2) TiCl 2 (Cp) 2, -78 C 3), - 78 C 54 % 92 de J. rg. Chem. 1984, 59,
9 b) α-selenierung - mit LDA und PhSeCl bzw. PhSeSePh Prinzip: PhSeCl oder PhSeSePh SePh xid. Ph Se - PhSe 1) LDA 2) PhSeSePh 3) ai 4 4) CaC 3, Toluol, 90% Tetrahedron Lett. 1989, 30, mit Se 2 n-typ-xidation Prinzip: Se Se [2.3] Se Se rganic eactions 1949, 5, 331; 1976, 24, 261. Ph Ph Se 2 / 2 Ac, 4 h 97% J. rg. Chem. 1970, 35, xidationen von C C-Bindungen xidative Spaltungen a) Glykolspaltung Ac Ac Ph C Pb(Ac) 4 2 Benzol + Pb(Ac) 2 elv. Chim. Acta 1936, 19, 519ff. 6
10 b) poxidspaltung I 4 / 2 45 C C C 70% Tetrahedron Lett. 1973, Wichtige Sequenz: Diol lefin Dialdehyd poxid c) Baeyer-Villiger-xidation Prinzip: ' Persäure ' '' ' Wanderungstendenz: t-alkyl > s-alkyl > benzyl > phenyl > n-alkyl > methyl Bz Bz Bz Ac tac 6 d, 55 C Bz 70% C C J. Am. Chem. Soc. 1978, 10, 4618ff. d) Beckmann-Umlagerung Prinzip: TosCl a Tos - Tos 2 C 1) 2 Cl C Pyridin S 2) Polyphosphorsäure S J. Am. Chem. Soc. 1978, 100,
11 1.3 xidationen von C X-ehrfachbindungen poxidierung lektrophile poxidierung a) Persäuren Prileshaev-poxidierung Prinzip: + + = C 3 Ph 3-Cl-Ph 4-2 -Ph CF 3 pk s = < 0 eaktivität der Persäure C Bz C Benzol, Dioxan 1d, rt Tetrahedron 1958, 2, 1. Steuerung über koordinierende Gruppen möglich CPBA K 2 C 3, C 2 Cl 2 J. Am. Chem. Soc. 1978, 100, 4618ff. b) Dioxiran Bn Bn Bn Bn Bn Bn Chem. Ber. 1991, 124,
12 c) Übergangsmetalle Vanadin Selektive poxidierung von Allylalkoholen (Sharpless) V(acac) 2 Toluol J. Am. Chem. Soc. 1973, 95, Intermediat: V Titan 1. asymmetrische poxidierung (Sharpless poxidierung), Ti(iPr) 70-90% 4 > 90% ee vereinfachter echanismus: Ti(iPr) 4 + () 2 Ti + 2 Ti() 2 (Tartrat) Ti()(Allylalk)(Tartrat) TBP TBP Ti()(TBP)(Tartrat) Ti(Allylalk)(TBP)(Tartrat) poxidierung Ti(poxyalk)(tBu)(Tartrat) 9
13 generell gilt: wahrscheinlicher Übergangszustand: ( ) -Tartrat (unnatürlich) '' ' ''' Ti Ti (+) -Tartrat (natürlich) Anwendungen: kinetische acematspaltungen a) racemische Allylalkohole b) prochirale Substrate ' Ti(iPr) Äq. TBP (+) -DIPT ' + ' 40-49% 40-49% > 99% ee > 99% ee Ti(iPr) 4 1Äq. TBP (+) -DIPT Tandemreaktionen: Angew. Chem 1986, 98, 89. Ti(iPr) 4 1Äq. TBP (+) -DIPT 75% Tetrahedron Lett. 1986, 27, ucleophile poxidierung selektive poxidierung e -armer Doppelbind. mit 2 2 / (Scheffer-Weitz-poxid.) Prinzip: tbu, a Toluol, 2 + J. rg. Chem. 1980, 45,
14 1.3.2 Dihydroxylierung trans-diole durch ydrolyse von poxiden Bn a 3, 3 + Br Toluol, a, Bn 3 52% Payne- Umlagerung a 3 Bn Tetrahedron Lett. 1985, 26, cis-diole mit s 4 Dihydroxylierung bevorzugt von der sterisch weniger gehinderten Seite Beispiel : Thp 5% s Äq. Aceton, 2 Thp 89% J. Am. Chem. Soc. 1978, 100, 8031ff. Sharpless Dihydroxylierung Chirale Liganden auf Chinin-Basis Beispiele: odell: (DQ) 2 Phal (abgeleitet vom Chinin) (DQD) 2 Phal β (DQD) 2 Phal (abgeleitet vom Chinidin) J. rg. Chem. 1992, 57, s l m α (DQ) 2 Phal J. Am. Chem. Soc. 1988, 110,
15 Beispiele: Ph Ce AD-ix α Ce 72% Ph 99% ee J. rg. Chem. 1994, 59, AD-ix α 79% 98% ee Science 1993, 259, 64. C s 4 C ++ C ohne Ligand 2.8 : 1 (DQD) 2 Phal 39 : 1 (DQ) 2 Phal 1 : 1.3 Tetrahedron Lett. 1993, 34, alooxygenierung analog alogenaddition in Gegenwart von -ucleophilen I 2 2 I 97% ds Tetrahedron 1984, 40, alolactonisierung: C Br 2, KBr 2 Br 91% J. Am. Chem. Soc. 1978, 100,
16 1.3.4 ydratisierung a) xymercurierung / eduktion Prinzip: + g Ac Ac Ac g + Ac 2 gac ab hohe egioselektivität Addition nach arkownikow Itramolekulare Variante: Ph 3 C Ph 3 C 1) g(ac) 2 2) KCl gcl 82% 95% ds Tetrahedron Lett. 1984, 25, b) ydroborierung / xidation Prinzip: B 2 B 2 B B 2 2 ' '' '' ' '' ' '' ' B 2 '' ' Addition an sterische weniger gehinderte Position Addition nach anti-arkownikow eaktivität Selektivität 2 B B 2 B 3 Gängige Borane: B 2 "B 3 " (B 2 6 ) B Thexylboran Diboran 9-BB Beispiele: Thexylboran TF, 15 min B a % 72% J. Am. Chem. Soc. 1972, 94,
17 eaktion Katalytische ydrierung aalt22 Dibal- LiBt3 Al3 in TF LiAl4 in ther LiAl(e)3 in TF LiAl(tBu)3 in TF 9-BB Disiamylboran in TF B3 in TF ab4 + AlCl3 ab4 + LiCl ab4 in t C C C C CCl C oder C Lacton Diol ± ± poxid Alkohol ± ± ± C C ± ± ± C C ± C C C 2 C 2 2 oder C C C ± ± oder = C=C C 2 C Übersicht über gängige eduktionsverfahren 2. eduktionsreaktionen 14
18 2.1 eduktion mit komplexen ydriden Aldehyde und Ketone a) Aldehyde neben Ketonen ab 4 e / C 2 Cl 2-78 C b) Ketone neben Ketonen - sterische Differenzierung (sbu) 3 B Li + (L-Selektrid) - durch achbargruppenbeteiligung Beispiele: e 3 + B(Ac) 3 t, Ac - 40 C J. rg. Chem. 1991, 56, 741. e 3 + B(Ac) 3 t, Ac - 40 C J. Am. Chem. Soc. 1988, 110, Intermediat: + ' Ac B - Ac 15
19 c) 1,2- neben 1,4-eduktion ' ' Luche-eduktion mit ab 4 / CeCl 3 ab. 4 CeCl % e, 5 min Chem. Commun. 1978, 601. d) 1,4- neben 1,2-eduktion 6 % Dibal ecu TF, - 50 C 2 h 84 % J. rg. Chem. 1986, 51, Carbonsäuren und Derivate 1) zum Alkohol a) 1,2- neben 1,4-eduktion tc Tbs Dibal- TF, 0 C 1 h Tbs J. rg. Chem. 1994, 59, b) 1,4- neben 1,2-eduktion Cu(I)-eagentien aal 2 ( ) 2 CuBr 75% Angew. Chem. 1983, 95,
20 2) zum Aldehyd a) ster Beispiele: Dibal- 3 + Si 3 CC 3 C 2 Cl 2-78 C, 30 min Si 3 C J. Am. Chem. Soc. 1975, 97, b) Amide ethode der Wahl: Weinreb-Amide Prinzip: Al LA 2 + Boc LA TF, 0 C 92% Boc J. Amer. Chem. Soc. 1992, 114, Desoxygenierung a) eduktion von Tosylaten b) adikalische Desoxygenierung Beispiele: Tos S ab 4 DS, 90 min 90 C 61% Angew. Chem. 1982, 96, 81. C 3 S C 3 S S C 3 AIB Ph 2 Si 2 Toluol, C % Tetrahedron Lett. 1991, 32,
21 S AlB Bu 3 Sn Ph Toluol, 110 C 2 h Bu 3 Sn. Bu 3 Sn Bu 3 Sn Ph Bu 3 Sn S S. + Ph. J. Am. Chem. Soc. 1981, 103, Dehalogenierung radikalisch Br Bu 3 Sn AIB Benzol, 75 C 87% ds. J. Am. Chem. Soc. 1978, 100, 4618ff eduktive Decarboxylierung C Ac 1) ClCiBu S, hν Ac 73% 2) S, t 3 J. Am. Chem. Soc. 1990, 112, Prinzip: S + S.. S S +. 2 S S 18
22 2.1.6 eduktion von C C-ehrfachbindungen Alkine zu Alkenen Dibal-eduktion (eview: Synthesis 1975, 617) Cl 1) Dibal- Cl 82% 2) 20% 2 S 4 J. rg. Chem. 1963, 28, echanismus: 2 Al + Al 2 Beispiele: Propargylakohole Al LA 3 + TP TP LA Al. Allene Acta Chem. Scand B 1987, 41, Ionische ydrierung ydrierung durch Übertragung von + und eduktion von C=C, C=X und C X Prinzip: + + Beispiele: C 3 CF 3 CC t 3 Si C 3 90% J. Am. Chem. Soc. 1986, 108,
23 2.2 eduktion durch katalytische ydrierung geeignete etalle: i, Pd, Pt, u, h, etc. etallische Katalysatoren: heterogene ydrierung Komplexe Katalysatoren: homogene ydrierung echanismus: eduktion von C C-Doppelbindungen CC 3 CC 3 CC Pd/C (Ph 3 P) 3 hcl J. Am. Chem. Soc. 1979, 101, asymmetrische katalytische ydrierung Zusatz chiraler Liganden e P P PPh 2 PPh 2 e Dipamp (Knowles) Binap (oyori) 20
24 Asymmetrische Synthese von Aminosäuren Bz C h(i) Bz C ()-Binap (,)-Dipamp 100 % ee 93 % ee J. Am. Chem. Soc. 1977, 99, 5946; J. Am. Chem. Soc. 1980, 102, eduktion von C--Doppelbindungen besonders gut mit u-komplexen, bevorzugte Substrate: β-ketoester t Ac 2 u[()-binap]br 2 t Ac 98% ee 99% ds J. Am. Chem. Soc. 1989, 111, eduktion von C C-Dreifachbindungen Selektive ydrierung von Dreifachbindung zur Doppelbindung mit Lindlar-Katalysator (Pd/BaS 4 oder Pd/CaC 3 mit Pb(Ac) 2 oder Chinolin vergiftet) 2 Lindlar Benzol 97% J. Chem. Soc. 1955,
25 2.3 eduktion durch auflösende etalle Anwendung: eduktion von Aromaten, nonen, Alkinen trans-alkenen eduktion von Aromaten echanismus: X Y e - e -.. Y Y Y X X X X Y t 1) Li/ 3 /D 2) 3 + J. Am. Chem. Soc. 1973, 95, eduktion von nonen echanismus: e - + e -.. e Beispiele: 1) Li/ 3 /t 2 2) 4 Cl 92% 95% ds J. Chem. Soc. 1956, ) Li/ 3 /TF 2) Cl 74% J. rg. Chem. 1967, 32,
26 2.3.2 eduktion von Dreifachbindungen echanismus: ' e -. ' 3-2. e - ' 3-2 ' Beispiele: C Li/ 3 /TF C 98% J. Am. Chem. Soc. 1963, 85, eduktion mit Diimid (=) rzeugung: od. 2 2 Cu(II) C + KC CK echanismus: Bn Bn Bn Ts KC CK Ac Bn 40 C, 40 h Bn Ts Bn J. rg. Chem. 1985, 50,
27 LITATU xidationen Allgemeine Lehrbücher: F. A. Carey,. J. Sundberg: rganische Chemie; inweiterführendes Lehrbuch, Wiley-VC J. arch: Advanced rganic Chemistry, Wiley. Brückner: eaktionsmechanismen, Spektrum J. Fuhrhop, G. Penzlin: rganic Synthesis, Wiley-VC Aktuelle eviews zum Thema xidationen: ecent advances in the asymmetric dihydroxylation of alkenes; Tetrahedron Asym. 1992, 3, The Baeyer-Villiger oxidation of ketones and aldehydes; rg. eactions 1993, 43, 251. Catalytic asymmetric dihydroxylations; Chem. ev. 1994, Chemical and biological synthesis of chiral epoxides; Tetrahedron 1994, 50, Dioxiranes highly reactive oxidants for stereoselective oxyfunctionalizations; J. Prakt. Chem. / Chem. Ztg. 1995, 337, 162; J. Prakt. Chem. / Chem. Ztg. 1997, 339, 298. Asymmetric epoxidation of allylic alcohols: The Katsuki-Sharpless epoxidation reaction; rg. eactions 1996, 48, 1. Chemical transformations induced by hypervalent iodine reagents; Tetrahedron 1997, 53, Polymer supported catalytic asymmetric Sharpless dihydroxylation of olefins; ur. J. rg. Chem. 1998, Years of Baeyer-Villiger-oxidations; ur. J. rg. Chem. 1999, 737. Iodocarbocyclization and iodoaminocyclization reactions mediated by a metallic reagent; Synlett 1999, Asymmetric epoxidation of electron-deficient olefins; Chem. Commun. 2000, eduktionen Allgemeine Lehrbücher: F. A. Carey,. J. Sundberg: rganische Chemie; inweiterführendes Lehrbuch, Wiley-VC J. arch: Advanced rganic Chemistry, Wiley. Brückner: eaktionsmechanismen, Spektrum J. Fuhrhop, G. Penzlin: rganic Synthesis, Wiley-VC 24
28 Aktuelle eviews zum Thema eduktionen: The use of chiral organoboranes in organic synthesis; Synthesis 1986, 973. nantioselective u-mediated hydrogensations; developments and applications; J. rgano met. Chem. 1989, 567, 163. Boranes in rganic Synthesis; J. rganomet. Chem. 1993, 457, 1. nantioselective transition metal catalyzed hydrogenations concerning the asymmetric amine synthesis; Angew. Chem. 1993, 105, 245. Zinc borohydride, a reducing agent with high potential; Synlett 1993, 885. ecent advances in the boron route to asymmetric synthesis; Pure & Appl. Chem. 1994, 66, 201. Low valent titanium a versatile reagent for deoxygenation and carbonyl coupling; J. Prakt. Chem. / Chem. Ztg. 1995, 337, 250. ew reagents for the old pinacol coupling reaction; Angew. Chem. 1996, 108, 65. nantioselective catalytic hydrogenation; Angew. Chem. 1996, 108, 444. Weinreb amides in modern organic synthesis; J. Prakt. Chem. / Chem. Ztg. 1997, 339, 517. ydroboration catalyzed by transition metal complexes; Tetrahedron 1997, 53, nantioselective reduction of ketones; rganic eactions 1998, 52, Asym. transfer hydrogenation of C= and C= bonds; Tetrahedron Asym. 1999, 10,
Moderne Methoden in der Organischen Chemie
 Moderne Methoden in der rganischen Chemie 0. Allgemeines: Wichtig für alle chemischen eaktionen: Selektivität Chemoselektivität: egioselektivität: Stereoselektivät: - nantioselektivität: -Diastereosektivität:
Moderne Methoden in der rganischen Chemie 0. Allgemeines: Wichtig für alle chemischen eaktionen: Selektivität Chemoselektivität: egioselektivität: Stereoselektivät: - nantioselektivität: -Diastereosektivität:
Reaktionsmechanismen nach dem gleichnahmigen Buch von R. Brückner
 eaktionsmechanismen nach dem gleichnahmigen Buch von. ückner Kap. 17 xidation und eduktion Dr. ermann A. Wegner hermann.wegner@unibas.ch xidationszahlen in organisch chemischen Verbindungen Bestimmung
eaktionsmechanismen nach dem gleichnahmigen Buch von. ückner Kap. 17 xidation und eduktion Dr. ermann A. Wegner hermann.wegner@unibas.ch xidationszahlen in organisch chemischen Verbindungen Bestimmung
Crom(VI)-Reagenzien. bzw. Reagenzien: a) K 2. SO 4 ( wasserhaltig ) b) CrO 3. CrO 7. , verd. H 2. , Aceton (Jones-Reagenz)
 xidationen 1. (xidation von aktivierten Methyl- u. Methylengruppen) 2. Prim. Alkohol Aldehyd Carbonsäure Sek. Alkohol Keton 3. xidation von Doppelbindungen 4. xidative Spaltungen 5. (xidationen an eteroatomen)
xidationen 1. (xidation von aktivierten Methyl- u. Methylengruppen) 2. Prim. Alkohol Aldehyd Carbonsäure Sek. Alkohol Keton 3. xidation von Doppelbindungen 4. xidative Spaltungen 5. (xidationen an eteroatomen)
Ausgewählte wichtige Reaktionen (Transformationen) für die Syntheseplanung
 Ausgewählte wichtige Reaktionen (Transformationen) für die Syntheseplanung folie267 TGT Structure Retron Transform Precursor(s) (1) C 2 t-bu C C C (E)-Enolate Aldol C + C 2 t-bu (2) C C C C C Michael +
Ausgewählte wichtige Reaktionen (Transformationen) für die Syntheseplanung folie267 TGT Structure Retron Transform Precursor(s) (1) C 2 t-bu C C C (E)-Enolate Aldol C + C 2 t-bu (2) C C C C C Michael +
Übung zur Vorlesung Organische Chemie II Reaktivität (Dr. St. Kirsch, Dr. A. Bauer) Wintersemester 2008/09 O 2 N
 Übung zur Vorlesung rganische Chemie II eaktivität (Dr. St. Kirsch, Dr. A. Bauer) zu 7.1-70: C [pts] (PhMe) 110 C Entfernung mit ilfe eines Wasserabscheiders Zusatzfrage: i) Was bedeutet die Abkürzung
Übung zur Vorlesung rganische Chemie II eaktivität (Dr. St. Kirsch, Dr. A. Bauer) zu 7.1-70: C [pts] (PhMe) 110 C Entfernung mit ilfe eines Wasserabscheiders Zusatzfrage: i) Was bedeutet die Abkürzung
5 Radikalreaktionen 79
 5 adikalreaktionen 79 5.1 rzeugung von adikalen 79 5.1.1 adikale durch homolytische Bindungsspaltung 79 5.1.2 adikale durch edoxprozesse 80 a) adikale durch eduktion 80 b) adikale durch xidation 80 5.1.3
5 adikalreaktionen 79 5.1 rzeugung von adikalen 79 5.1.1 adikale durch homolytische Bindungsspaltung 79 5.1.2 adikale durch edoxprozesse 80 a) adikale durch eduktion 80 b) adikale durch xidation 80 5.1.3
7 Reaktionen von Carbonylverbindungen
 Übung zur Vorlesung rganische Chemie II eaktivität (Dr. St. Kirsch, Dr. A. Bauer) 7 eaktionen von Carbonylverbindungen 7.1 Ketone/Aldehyde und eteroatomnucleophile 7.1-70 Vervollständigen Sie die folgenden
Übung zur Vorlesung rganische Chemie II eaktivität (Dr. St. Kirsch, Dr. A. Bauer) 7 eaktionen von Carbonylverbindungen 7.1 Ketone/Aldehyde und eteroatomnucleophile 7.1-70 Vervollständigen Sie die folgenden
2. Gruppe: Carbonsäuren und Derivate
 1 1) Eigenschaften der Carbonsäuren: Carbonsäuren gehen Wasserstoffbrückenbindungen ein. C 2 2 C 2 3 pk a = 5 vgl. pk a ( 2 ) = 16 K a = Bsp.: [C 2 ] [ ] [C 2 ] stabilisiert durch somerie Säure C 3 C 2
1 1) Eigenschaften der Carbonsäuren: Carbonsäuren gehen Wasserstoffbrückenbindungen ein. C 2 2 C 2 3 pk a = 5 vgl. pk a ( 2 ) = 16 K a = Bsp.: [C 2 ] [ ] [C 2 ] stabilisiert durch somerie Säure C 3 C 2
Julia-Colonna- Epoxidierung Nadzeya Sigle Johanna Lauer
 Julia-Colonna- Epoxidierung 04.06.2009 Nadzeya Sigle Johanna Lauer Überblick Epoxide und Varianten der erstellung Asymmetrische Variante: Julia-Colonna-Epoxidierung Allgemeine Darstellung als 3-asenreaktion
Julia-Colonna- Epoxidierung 04.06.2009 Nadzeya Sigle Johanna Lauer Überblick Epoxide und Varianten der erstellung Asymmetrische Variante: Julia-Colonna-Epoxidierung Allgemeine Darstellung als 3-asenreaktion
Reduktion und asymmetrische Reduktion. Monika Vogt und Stefanie Röker
 Reduktion und asymmetrische Reduktion Monika Vogt und Stefanie Röker Reduktion: Aufnahme von Elektronen durch Substrat Organik: äufig mit der Aufnahme von Wasserstoff verbunden Reduktionsmittel in der
Reduktion und asymmetrische Reduktion Monika Vogt und Stefanie Röker Reduktion: Aufnahme von Elektronen durch Substrat Organik: äufig mit der Aufnahme von Wasserstoff verbunden Reduktionsmittel in der
O + + R' Die langsamere Weiterreaktion des Sulfoxids führt zum Sulfon:
 6.7 xidation von eteroatomen Sulfide, Selenide, Amine und Phosphane haben freie Elektronenpaare und können daher leicht oxidiert werden. Verschiedene Peroxyverbindungen sind als xidationsmittel geeignet.
6.7 xidation von eteroatomen Sulfide, Selenide, Amine und Phosphane haben freie Elektronenpaare und können daher leicht oxidiert werden. Verschiedene Peroxyverbindungen sind als xidationsmittel geeignet.
7. Syntheseübung WS 2008/09
 7. Syntheseübung WS 2008/09 4 9 11 1 1 1 1 16 16 ( )-kilactomycin 4 Se 14 9 11 ap A. B. Smith III, K Basu, T. Bosanac J. Am. Chem. Soc. 2007, 129, 14872-14874. Amos. B. Smith III University of Pennsylvania
7. Syntheseübung WS 2008/09 4 9 11 1 1 1 1 16 16 ( )-kilactomycin 4 Se 14 9 11 ap A. B. Smith III, K Basu, T. Bosanac J. Am. Chem. Soc. 2007, 129, 14872-14874. Amos. B. Smith III University of Pennsylvania
Aldolreaktion und ihre Stereokontrolle. Stefan Benson und Tobias Brodmann
 Aldolreaktion und ihre Stereokontrolle Stefan Benson und Tobias Brodmann 13.12.2004 0 Gliederung Allgemeine Grundlagen zur Aldoladditions-Reaktion Stereokontrolle bei d. Bildung von Li-Enolaten Stereokontrolle
Aldolreaktion und ihre Stereokontrolle Stefan Benson und Tobias Brodmann 13.12.2004 0 Gliederung Allgemeine Grundlagen zur Aldoladditions-Reaktion Stereokontrolle bei d. Bildung von Li-Enolaten Stereokontrolle
Organische Chemie III
 rganische Chemie III Sommersemester 2010 Technische Universität München Klausur am 03.08.2010 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie Bachelor
rganische Chemie III Sommersemester 2010 Technische Universität München Klausur am 03.08.2010 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie Bachelor
Schutzgruppen in der organischen Synthesechemie
 Schutzgruppen in der organischen Synthesechemie Warum Schutzgruppen? Umgehen die Inkompatibilität funktioneller Gruppen bei der Synthese komplexer organischer Strukturen. Schutzgruppen sollen eine funktionelle
Schutzgruppen in der organischen Synthesechemie Warum Schutzgruppen? Umgehen die Inkompatibilität funktioneller Gruppen bei der Synthese komplexer organischer Strukturen. Schutzgruppen sollen eine funktionelle
Organische Chemie III
 Seite A-1 rganische Chemie III Sommersemester 2001 Technische Universität München Klausur am 12.10.2001 Name; Vorname... Matrikel-Nr.... (Druckbuchstaben) geboren am... in...... (Eigenhändige Unterschrift)
Seite A-1 rganische Chemie III Sommersemester 2001 Technische Universität München Klausur am 12.10.2001 Name; Vorname... Matrikel-Nr.... (Druckbuchstaben) geboren am... in...... (Eigenhändige Unterschrift)
Totalsynthese von Citrafungin A
 Totalsynthese von Citrafungin A HC HC R S HC R HC H H R R Fanny Epperlein, Michael Hans, Anja Hartmann, René Jatzke, Marco Kunaschk, Christian Pätzold, Anne-Kathrin Weniger Quelle: TU Dresden, 17.12.2009
Totalsynthese von Citrafungin A HC HC R S HC R HC H H R R Fanny Epperlein, Michael Hans, Anja Hartmann, René Jatzke, Marco Kunaschk, Christian Pätzold, Anne-Kathrin Weniger Quelle: TU Dresden, 17.12.2009
11. Syntheseübung WS 2006/2007
 11. Syntheseübung WS 2006/2007 isoliert aus Streptomyces sp.#9885 potente Antitumorverbindung, stabilisiert Microtubuli Totalsynthesen durch die Gruppen von - Erik Sorensen (Princeton University) JACS
11. Syntheseübung WS 2006/2007 isoliert aus Streptomyces sp.#9885 potente Antitumorverbindung, stabilisiert Microtubuli Totalsynthesen durch die Gruppen von - Erik Sorensen (Princeton University) JACS
ORGANISCHE CHEMIE 1. Stoff der 21. Vorlesung: Reaktionen... I. Reaktionen der Carbonylgruppe I. mit C-Nukleophilen Grignard Organolithium Wittig
 Stoff der 21. Vorlesung: eaktionen... GANISCE CEMIE 1 21. Vorlesung, Freitag, 05. Juli 2013 I. eaktionen der Carbonylgruppe I. mit C-Nukleophilen Grignard rganolithium Wittig arald Schwalbe Institut für
Stoff der 21. Vorlesung: eaktionen... GANISCE CEMIE 1 21. Vorlesung, Freitag, 05. Juli 2013 I. eaktionen der Carbonylgruppe I. mit C-Nukleophilen Grignard rganolithium Wittig arald Schwalbe Institut für
Neuere organisch-chemische Synthesemethoden
 euere organisch-chemische Synthesemethoden orst Kunz Institut für rganische Chemie Universität Mainz aturstoffsynthese in den 60/70iger Jahren: Die technische Synthese von Vitamin A der BASF orst Pommer,
euere organisch-chemische Synthesemethoden orst Kunz Institut für rganische Chemie Universität Mainz aturstoffsynthese in den 60/70iger Jahren: Die technische Synthese von Vitamin A der BASF orst Pommer,
Ester aus Carbonsäure-Salzen und Alkylhalogeniden (vgl. Kap. 2) S N. Methylester aus Carbonsäuren und Diazomethan (vgl. Kap. 2) P + OH.
 Ester aus arbonsäure-salzen und Alkylhalogeniden (vgl. Kap. 2) : : a X 2 ' S 2 2 ' X = Br, I Stereochemie! Methylester aus arbonsäuren und Diazomethan (vgl. Kap. 2) 2.. : 3 Wegen der Toxizität und Explosivität
Ester aus arbonsäure-salzen und Alkylhalogeniden (vgl. Kap. 2) : : a X 2 ' S 2 2 ' X = Br, I Stereochemie! Methylester aus arbonsäuren und Diazomethan (vgl. Kap. 2) 2.. : 3 Wegen der Toxizität und Explosivität
7. Oxidationsreaktionen
 7. xidationsreaktionen xidation Entzug von Elektronen durch ein geeignetes eagens, das xidationsmittel entweder wird Wasserstoff aus dem Molekül entfernt oder Sauerstoff eingefügt Industriell bzw. optimal:
7. xidationsreaktionen xidation Entzug von Elektronen durch ein geeignetes eagens, das xidationsmittel entweder wird Wasserstoff aus dem Molekül entfernt oder Sauerstoff eingefügt Industriell bzw. optimal:
Hoch effiziente asymmetrische Katalyse durch doppelte Aktivierung von Nucleophil und Elektrophil Jun-An Ma und Dominique Cahard Angew. Chem.
 och effiziente asymmetrische Katalyse durch doppelte Aktivierung von ucleophil und Elektrophil Jun-An Ma und Dominique Cahard Angew. Chem. 2004, 116, 4666-4683 1. Einleitung ymmetrische Katalysereaktionen
och effiziente asymmetrische Katalyse durch doppelte Aktivierung von ucleophil und Elektrophil Jun-An Ma und Dominique Cahard Angew. Chem. 2004, 116, 4666-4683 1. Einleitung ymmetrische Katalysereaktionen
Organische Chemie II Reaktivität
 2. Klausur zur Vorlesung rganische Chemie II eaktivität Wintersemester 2008/09 Klausur am 11.02.2009 (ame, Vorname) im. Fachsemester (Studiengang) (Unterschrift) (Matrikel-ummer) 1. Teilnahme 1. Wiederholung
2. Klausur zur Vorlesung rganische Chemie II eaktivität Wintersemester 2008/09 Klausur am 11.02.2009 (ame, Vorname) im. Fachsemester (Studiengang) (Unterschrift) (Matrikel-ummer) 1. Teilnahme 1. Wiederholung
Totalsynthesen von Colchizin
 Totalsynthesen von Colchizin Prof. Dr. H. G. Schmalz Dipl. Chem. T. Graening 1 Überblick Eigenschaften von Colchizin: medizinische Wirkung Struktureigenschaften Totalsynthese nach Woodward Totalsynthese
Totalsynthesen von Colchizin Prof. Dr. H. G. Schmalz Dipl. Chem. T. Graening 1 Überblick Eigenschaften von Colchizin: medizinische Wirkung Struktureigenschaften Totalsynthese nach Woodward Totalsynthese
Organische Chemie III
 rganische Chemie III Sommersemester 2006 Technische Universität München Klausur am 09.08.2006 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie Bachelor
rganische Chemie III Sommersemester 2006 Technische Universität München Klausur am 09.08.2006 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie Bachelor
Organische Chemie III
 1 rganische Chemie III Sommersemester 2003 Technische Universität München Klausur am 15.10.2003 ame; Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang (Diplom/ Bachelor)......
1 rganische Chemie III Sommersemester 2003 Technische Universität München Klausur am 15.10.2003 ame; Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang (Diplom/ Bachelor)......
Reaktionsmechanismen nach dem gleichnahmigen Buch von R. Brückner
 Reaktionsmechanismen nach dem gleichnahmigen Buch von R. Brückner Kap. 6 Nucleophile Substitutionsreaktionen (außer durch Enolate) am Carboxyl-Kohlenstoff Dr. Hermann A. Wegner hermann.wegner@unibas.ch
Reaktionsmechanismen nach dem gleichnahmigen Buch von R. Brückner Kap. 6 Nucleophile Substitutionsreaktionen (außer durch Enolate) am Carboxyl-Kohlenstoff Dr. Hermann A. Wegner hermann.wegner@unibas.ch
Künstliche Peptide aus b-aminosäuren
 Künstliche Peptide aus b-aminosäuren Seminar zum CF-Praktikum WS 03/04 Übersicht Struktur und omenklatur von ß-Aminosäuren Synthese von ß-Aminosäuren Methoden zur Peptidsynthese Schutzgruppen Aktivierung
Künstliche Peptide aus b-aminosäuren Seminar zum CF-Praktikum WS 03/04 Übersicht Struktur und omenklatur von ß-Aminosäuren Synthese von ß-Aminosäuren Methoden zur Peptidsynthese Schutzgruppen Aktivierung
Organische Chemie II Reaktivität
 Wiederholungs-Klausur zur Vorlesung rganische Chemie II Reaktivität Wintersemester 2007/08 Klausur am 28.03.2008 (ame, Vorname) im. Fachsemester (Studiengang) (Unterschrift) (Matrikel-ummer) 1. Teilnahme
Wiederholungs-Klausur zur Vorlesung rganische Chemie II Reaktivität Wintersemester 2007/08 Klausur am 28.03.2008 (ame, Vorname) im. Fachsemester (Studiengang) (Unterschrift) (Matrikel-ummer) 1. Teilnahme
(+) - Boronolid. O OAc. OAc. 4. Syntheseübung SS Bestandteil der Rinde und Blätter verschiedener Pflanzen
 4. Syntheseüung SS 2007 Ac Ac Ac () - oronolid - estandteil der inde und lätter verschiedener Pflanzen - Planzenzuereitungen finden Verwendung als Naturheilmittel gegen Malaria und als Emetikum (rechmittel)
4. Syntheseüung SS 2007 Ac Ac Ac () - oronolid - estandteil der inde und lätter verschiedener Pflanzen - Planzenzuereitungen finden Verwendung als Naturheilmittel gegen Malaria und als Emetikum (rechmittel)
6 Reduktionen und Oxidationen
 6 eduktionen und xidationen 6.1 Allgemeines Zur Bestimmung der xidationszahlen in anorganischen Verbindungen werden die Elektronen einer kovalenten Bindung A B, die verschiedene Atomsorten A und B miteinander
6 eduktionen und xidationen 6.1 Allgemeines Zur Bestimmung der xidationszahlen in anorganischen Verbindungen werden die Elektronen einer kovalenten Bindung A B, die verschiedene Atomsorten A und B miteinander
Name: Matrikelnummer: Studienfach (bitte ankreuzen): LC Chemie-Bachelor Chemie-Diplom
 Fachrichtung Chemie Professur für rganische Chemie II rganisch-chemisches Praktikum zum Modul C II http://www.chm.tu-dresden.de/oc2/modul_c_ii.shtml ame: Matrikelnummer: Studienfach (bitte ankreuzen):
Fachrichtung Chemie Professur für rganische Chemie II rganisch-chemisches Praktikum zum Modul C II http://www.chm.tu-dresden.de/oc2/modul_c_ii.shtml ame: Matrikelnummer: Studienfach (bitte ankreuzen):
4 Addition an Kohlenstoff-Mehrfachbindungen
 Übung zur Vorlesung rganische Chemie Reaktivität (Dr. St. Kirsch, Dr. A. Bauer) 4 Addition an Kohlenstoff-Mehrfachbindungen 4.1 Grundsätzliche Unterscheidung 4.1-39 Elektrophile Additionsreaktionen (A
Übung zur Vorlesung rganische Chemie Reaktivität (Dr. St. Kirsch, Dr. A. Bauer) 4 Addition an Kohlenstoff-Mehrfachbindungen 4.1 Grundsätzliche Unterscheidung 4.1-39 Elektrophile Additionsreaktionen (A
Metallorganik Teil 2. OFP-Seminar. Marburg, 31.01.06
 Metallorganik Teil 2 FP-Seminar Marburg, 31.01.06 Einleitung Teil 2: Titan, smium, Zirkonium Bor Silizium Mangan, uthenium Palladium Zusammenfassung Wiederholung? 2 Stufen Et NC Wiederholung Cuprat Et
Metallorganik Teil 2 FP-Seminar Marburg, 31.01.06 Einleitung Teil 2: Titan, smium, Zirkonium Bor Silizium Mangan, uthenium Palladium Zusammenfassung Wiederholung? 2 Stufen Et NC Wiederholung Cuprat Et
Retrosynthese Ketten. Verwendung von Alkinen
 etrosynthese Ketten Konstruktion von Ketten relativ einfache Strukturen: gesättigte oder ungesättigte Ketten Biologie: Ketten (aus Fettsäure- oder Terpenbiosynthese) sind oft Vorläufer für cyclische Moleküle
etrosynthese Ketten Konstruktion von Ketten relativ einfache Strukturen: gesättigte oder ungesättigte Ketten Biologie: Ketten (aus Fettsäure- oder Terpenbiosynthese) sind oft Vorläufer für cyclische Moleküle
Organische Chemie II Reaktivität
 2. Klausur zur Vorlesung rganische Chemie II eaktivität Wintersemester 2007/08 15.02.2008 (Name, Vorname) im. Fachsemester (Studiengang) (Unterschrift) (Matrikel-Nummer) 1. Teilnahme 1. Wiederholung 2.
2. Klausur zur Vorlesung rganische Chemie II eaktivität Wintersemester 2007/08 15.02.2008 (Name, Vorname) im. Fachsemester (Studiengang) (Unterschrift) (Matrikel-Nummer) 1. Teilnahme 1. Wiederholung 2.
Graphisches Inhaltsverzeichnis
 Kapitel I Graphisches Inhaltsverzeichnis Einübung von ausgewählten Reinigungs- und Trennverfahren............ 65 R C 2 S Ph 2 R C 2 Ph 3 S R C 2 Ph R 3 R C 2 Ph R 2 R C 2 R C 2 Trennung dieser Diastereomere
Kapitel I Graphisches Inhaltsverzeichnis Einübung von ausgewählten Reinigungs- und Trennverfahren............ 65 R C 2 S Ph 2 R C 2 Ph 3 S R C 2 Ph R 3 R C 2 Ph R 2 R C 2 R C 2 Trennung dieser Diastereomere
Aufg Σ Note max erz.
 1 Institut für rganische Chemie der TU Braunschweig Prof. Dr. Thomas Lindel Grundpraktikum rganische Chemie, SS 08 Klausur 1, 9. Mai 2008 Name: Vorname: Matrikel-Nr.: Studienfach: Unterschrift: Punkteverteilung
1 Institut für rganische Chemie der TU Braunschweig Prof. Dr. Thomas Lindel Grundpraktikum rganische Chemie, SS 08 Klausur 1, 9. Mai 2008 Name: Vorname: Matrikel-Nr.: Studienfach: Unterschrift: Punkteverteilung
O O. O Collins-Reagenz. AcO. K 2 CO 3 (MeOH) DIBAL-H (Tol) -78 C. COOH AcOH (H 2 O) OTHP
 Übung zur Vorlesung rganische Chemie II Reaktivität (Dr. St. Kirsch, Dr. A. Bauer) zu 10.1-100 a) Zn(B ) 2 Collins-Reagenz = Cr 3 * 2 py Kap. 6 - xidation (Siehe Zusatzmaterial) Das Collins-Reagenz ermöglicht
Übung zur Vorlesung rganische Chemie II Reaktivität (Dr. St. Kirsch, Dr. A. Bauer) zu 10.1-100 a) Zn(B ) 2 Collins-Reagenz = Cr 3 * 2 py Kap. 6 - xidation (Siehe Zusatzmaterial) Das Collins-Reagenz ermöglicht
Carbonyl- und Enolatchemie
 Carbonyl- und Enolatchemie 1 Addition von rganometall-eagenzien an Carbonylverbindungen eformatzky-eaktion: Zn-eagenz weniger reaktiv als Grignard, greift keine Ester an! Br 2 Zn ZnBr 2 Br Zn 2 1 2 Barbier-eaktion:
Carbonyl- und Enolatchemie 1 Addition von rganometall-eagenzien an Carbonylverbindungen eformatzky-eaktion: Zn-eagenz weniger reaktiv als Grignard, greift keine Ester an! Br 2 Zn ZnBr 2 Br Zn 2 1 2 Barbier-eaktion:
D D. D endo-cis exo-cis trans p = 1 bar: 58.4 : 38.6 : 3.0 cis- stereoselectivity: 97% p = 6.8 kbar: 72.0 : 27.0 : <1.0 cis-stereoselectivity: >99%
 4_folie100 [4 + 2] endo-cis exo-cis trans p = 1 bar: 58.4 : 38.6 : 3.0 cis- stereoselectivity: 97% + 120 p = 6.8 kbar: 72.0 : 27.0 : 99% V (endo-exo) -2.5 cm 3 /mol [2 + 2]
4_folie100 [4 + 2] endo-cis exo-cis trans p = 1 bar: 58.4 : 38.6 : 3.0 cis- stereoselectivity: 97% + 120 p = 6.8 kbar: 72.0 : 27.0 : 99% V (endo-exo) -2.5 cm 3 /mol [2 + 2]
Organische Chemie III
 rganische Chemie III Sommersemester 2008 Technische Universität München Klausur am 29.07.2008 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl. Semester.....
rganische Chemie III Sommersemester 2008 Technische Universität München Klausur am 29.07.2008 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl. Semester.....
1. Übung zur Vorlesung OC IV
 1. Übung zur Vorlesung C IV 19.05.03 ufgabe 1 a) Zeichnen Sie in das unten abgebildete Schema für die Reaktionsgleichung I das Produkt (wählen Sie ein beliebiges Enantiomer) bzw. für die Reaktionsgleichung
1. Übung zur Vorlesung C IV 19.05.03 ufgabe 1 a) Zeichnen Sie in das unten abgebildete Schema für die Reaktionsgleichung I das Produkt (wählen Sie ein beliebiges Enantiomer) bzw. für die Reaktionsgleichung
Entschlüsseln Sie die Bedeutung der folgenden Abkürzungen: PMB tbu TBS Ph Ts Bz TPS MOM Bn Ms TES
 rganisch-chemisches Grundpraktikum Leseauftrag: rganikum (23. Auflage): Kapitel D3 Brückner (3. Auflage): Kapitel 4 Leseempfehlung: Carey, Sundberg (4. engl. Auflage): Band A, Kapitel 1(!) und 6 P. Y.
rganisch-chemisches Grundpraktikum Leseauftrag: rganikum (23. Auflage): Kapitel D3 Brückner (3. Auflage): Kapitel 4 Leseempfehlung: Carey, Sundberg (4. engl. Auflage): Band A, Kapitel 1(!) und 6 P. Y.
1. Übung zur Vorlesung OC III
 . Übung zur Vorlesung C III 8.04.05 Aufgabe Schlagen Sie vier verschiedene retrosynthetische Schnitte für die gezeigte Verbindung vor und beurteilt ihre Praktikabilität. F Aufgabe 2 a) Die Deprotonierung
. Übung zur Vorlesung C III 8.04.05 Aufgabe Schlagen Sie vier verschiedene retrosynthetische Schnitte für die gezeigte Verbindung vor und beurteilt ihre Praktikabilität. F Aufgabe 2 a) Die Deprotonierung
Vortag OC07 Moderne Synthesemethoden Jessica Hilschmann
 Vortag OC07 Moderne Synthesemethoden Jessica Hilschmann 26.10.2011 1. Definition 2. Was macht ein stabiles Radikal stabil? 3. Kohlenstoffradikale - Gomberg 3.1. Entdeckung 3.2. Stabilisierung 3.3. Verwendung
Vortag OC07 Moderne Synthesemethoden Jessica Hilschmann 26.10.2011 1. Definition 2. Was macht ein stabiles Radikal stabil? 3. Kohlenstoffradikale - Gomberg 3.1. Entdeckung 3.2. Stabilisierung 3.3. Verwendung
Aufg Σ Note max erz.
 1 Institut für rganische Chemie der TU Braunschweig Prof. Dr. Thomas Lindel Grundpraktikum rganische Chemie, WS 07/08 Klausur 1, 23. November 2007 Name: Vorname: Matrikel-Nr.: Studienfach: Unterschrift:
1 Institut für rganische Chemie der TU Braunschweig Prof. Dr. Thomas Lindel Grundpraktikum rganische Chemie, WS 07/08 Klausur 1, 23. November 2007 Name: Vorname: Matrikel-Nr.: Studienfach: Unterschrift:
Organische Chemie III
 1 rganische Chemie III Sommersemester 2004 Technische Universität München Klausur am 28.07.2004 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie Bachelor
1 rganische Chemie III Sommersemester 2004 Technische Universität München Klausur am 28.07.2004 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie Bachelor
Übungslösungen Organische Chemie 1 (13)
 Übungslösungen rganische Chemie 1 (13) 13.1 a) Die Carbonsäure reagiert zunächst mit CDI zum Imidazolid welches, genau wie die Carbonsäure selbst, aufgrund der 1,3-Dicarbonylbeziehungen stark enolisiert
Übungslösungen rganische Chemie 1 (13) 13.1 a) Die Carbonsäure reagiert zunächst mit CDI zum Imidazolid welches, genau wie die Carbonsäure selbst, aufgrund der 1,3-Dicarbonylbeziehungen stark enolisiert
M U S T E R L Ö S U N G
 Universität egensburg Institut für rganische Chemie Prof. Dr.. eiser 3. Klausur zum rganisch-chemischen Praktikum I für Studierende der Chemie und der Biochemie im SS 999 am Freitag, dem 3. Juli 999 M
Universität egensburg Institut für rganische Chemie Prof. Dr.. eiser 3. Klausur zum rganisch-chemischen Praktikum I für Studierende der Chemie und der Biochemie im SS 999 am Freitag, dem 3. Juli 999 M
Übungsblatt I Drei- und Vierringe
 C VI: eterocyclen W 2002/2003 eite von 0 Übungsblatt I Drei- und Vierringe. Ergänzen ie die in den Kästchen fehlenden Produkte bzw. Reagentien und Reaktionsbedingungen. a) Et LiAl 4 (TF) b) CMe CMe 2 [Pd()
C VI: eterocyclen W 2002/2003 eite von 0 Übungsblatt I Drei- und Vierringe. Ergänzen ie die in den Kästchen fehlenden Produkte bzw. Reagentien und Reaktionsbedingungen. a) Et LiAl 4 (TF) b) CMe CMe 2 [Pd()
Suzuki-Reaktion. - Kupplung einer Aryl- oder Vinylboronsäure mit einem Aryloder Vinylhalogenid - verläuft Palladiumkatalysiert
 Suzuki-Reaktion - Kupplung einer Aryl- oder Vinylboronsäure mit einem Aryloder Vinylhalogenid - verläuft Palladiumkatalysiert Allgemein: R-X + R -B-R R-R + X-B-R R-X + R -B-() 2 R-R + X-B-() 2 R, R = Aryl-
Suzuki-Reaktion - Kupplung einer Aryl- oder Vinylboronsäure mit einem Aryloder Vinylhalogenid - verläuft Palladiumkatalysiert Allgemein: R-X + R -B-R R-R + X-B-R R-X + R -B-() 2 R-R + X-B-() 2 R, R = Aryl-
1. Gruppe: Nucleophile Substitution
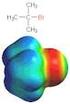 1. Gruppe: ucleophile ubstitution 1 1. ubstitutionstypen: C Y C Y Klassifizierung der ubstitution je nach atur von Y: - Y kann ein ukleophil sein: (ersetzt das ukleophil => Lewis - Base): δ δ a, 3, BuMg
1. Gruppe: ucleophile ubstitution 1 1. ubstitutionstypen: C Y C Y Klassifizierung der ubstitution je nach atur von Y: - Y kann ein ukleophil sein: (ersetzt das ukleophil => Lewis - Base): δ δ a, 3, BuMg
8 Carbonsäuren und Derivate
 8 arbonsäuren und Derivate 8.1 Allgemeine Darstellungsverfahren xidation primärer Alkohole und Aldehyde (s. Kap. 6) 2 2 xidation durch r 3 /, KMn 4 /, N 3 aloform-eaktion (s. Kap. 9) 3 Br 2 xidation von
8 arbonsäuren und Derivate 8.1 Allgemeine Darstellungsverfahren xidation primärer Alkohole und Aldehyde (s. Kap. 6) 2 2 xidation durch r 3 /, KMn 4 /, N 3 aloform-eaktion (s. Kap. 9) 3 Br 2 xidation von
Totalsynthese von (+)-Neopeltolid nach Sasaki et al.
 Totalsynthese von ()-eopeltolid nach Sasaki et al. S. Freitag, A. Wolf, P. Strubel, K. Schnaars,. Zimmermann. Fuwa, A.Saito, M. Sasaki, Angew. Chemie 2010, 122, 3105-3108 1. Allgemeines Entdeckung 2007
Totalsynthese von ()-eopeltolid nach Sasaki et al. S. Freitag, A. Wolf, P. Strubel, K. Schnaars,. Zimmermann. Fuwa, A.Saito, M. Sasaki, Angew. Chemie 2010, 122, 3105-3108 1. Allgemeines Entdeckung 2007
O Br. o-xylol Wie könnte man folgende Verbindungen aus mono-substituierten Benzolen herstellen? Br
 Grundlagen der rganischen Chemie, SS 2002, Kroutil Übungszettel 10 10.1. Benennen sie nomenklaturgerecht N 10.2. Zeichnen sie die Struktur von 2-Chlor-6-methyl naphthalin N 2 10.3. Was entsteht bei folgender
Grundlagen der rganischen Chemie, SS 2002, Kroutil Übungszettel 10 10.1. Benennen sie nomenklaturgerecht N 10.2. Zeichnen sie die Struktur von 2-Chlor-6-methyl naphthalin N 2 10.3. Was entsteht bei folgender
Elektrophile Additionen von HX an die CC-Doppelbindung (Vollhardt, 3. Aufl., S , 4. Aufl., S ; Hart, S ; Buddrus, S.
 Vorlesung 19 Elektrophile Additionen von X an die -Doppelbindung (Vollhardt, 3. Aufl., S. 504-514, 4. Aufl., S. 566-577; art, S. 96-105; Buddrus, S. 149-155) Die Elektronenwolke der π-bindung verleiht
Vorlesung 19 Elektrophile Additionen von X an die -Doppelbindung (Vollhardt, 3. Aufl., S. 504-514, 4. Aufl., S. 566-577; art, S. 96-105; Buddrus, S. 149-155) Die Elektronenwolke der π-bindung verleiht
VII INHALTSVERZEICHNIS
 VII INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 3.2 Chemische Reaktionstypen 12 3.3 Stereochemie 30 3.4 Alkane, Cycloalkane 46 3.5 Alkene, Alkine 47 3.6 Aromatische
VII INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 3.2 Chemische Reaktionstypen 12 3.3 Stereochemie 30 3.4 Alkane, Cycloalkane 46 3.5 Alkene, Alkine 47 3.6 Aromatische
O H H 3 C. Methanol. Molekulargewicht Siedepunkt Löslichkeit in Wasser H 3 C-OH. unbegrenzt H 3 C-Cl. 7.4 g/l H 3 C-CH 3 -24/C -88/C
 Struktur und Eigenschaften 3 C 3 C C 3 105 109 112 Wasser Methanol Dimethylether Vektoraddition der einzelnen Dipolmomente eines Moleküls zum Gesamtdipolmoment Anmerkung zu aktuellen Ereignissen: itrofen
Struktur und Eigenschaften 3 C 3 C C 3 105 109 112 Wasser Methanol Dimethylether Vektoraddition der einzelnen Dipolmomente eines Moleküls zum Gesamtdipolmoment Anmerkung zu aktuellen Ereignissen: itrofen
 INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 Säuren und Basen der organischen Chemie 5 3.2 Chemische Reaktionstypen 15 3.3 Stereochemie 39 3.4 Alkane, Cycloalkane
INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 Säuren und Basen der organischen Chemie 5 3.2 Chemische Reaktionstypen 15 3.3 Stereochemie 39 3.4 Alkane, Cycloalkane
4 Übergangsmetall-katalysierte Reaktionen 48
 4 Übergangsmetall-katalysierte eaktionen 48 4.1 Allgemeines 49 4.1.1 xidationsstufen 49 4.1.2 Koordinative Sättigung, 18e - -egel 49 4.1.3 inteilung der iganden 50 4.1.4 Bindungsmodelle 51 4.2 echanismen
4 Übergangsmetall-katalysierte eaktionen 48 4.1 Allgemeines 49 4.1.1 xidationsstufen 49 4.1.2 Koordinative Sättigung, 18e - -egel 49 4.1.3 inteilung der iganden 50 4.1.4 Bindungsmodelle 51 4.2 echanismen
Technische Universität Dresden Fachrichtung Chemie Organisch-chemisches Praktikum zum Modul OCII
 rganisch-chemisches Praktikum zum Modul CII http://www.chm.tu-dresden.de/oc2/modul_cii.shtml Name: Matrikelnummer: Fachsemester: Studienfach (bitte ankreuzen): LC Chemie-Bachelor Chemie-Diplom Praktikumsteilnehmer
rganisch-chemisches Praktikum zum Modul CII http://www.chm.tu-dresden.de/oc2/modul_cii.shtml Name: Matrikelnummer: Fachsemester: Studienfach (bitte ankreuzen): LC Chemie-Bachelor Chemie-Diplom Praktikumsteilnehmer
Organische Chemie III
 rganische Chemie III Sommersemester 2006 Technische Universität München Klausur am 13.06.2006 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie Bachelor
rganische Chemie III Sommersemester 2006 Technische Universität München Klausur am 13.06.2006 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie Bachelor
Der Natur auf der Spur Möglichkeiten und Grenzen der Organokatalyse Lutz Ackermann
 3 rganokatalyse Der atur auf der Spur Möglichkeiten und Grenzen der rganokatalyse Lutz Ackermann Asymmetrische Katalyse 3.1 Einleitung B A Y A B Y A B A Y B Beispiel: thylphenidat (Ritalin ) 3 C 2 C (R,R):
3 rganokatalyse Der atur auf der Spur Möglichkeiten und Grenzen der rganokatalyse Lutz Ackermann Asymmetrische Katalyse 3.1 Einleitung B A Y A B Y A B A Y B Beispiel: thylphenidat (Ritalin ) 3 C 2 C (R,R):
Klausur WS 03/04. 1 Schutzgruppen 10
 Institut für rganische Chemie rganisch-chemisches Fortgeschrittenenpraktikum http://www.chm.tu-dresden.de/organik/hierse/c_fp.htm Name: Erfolgreiche Teilnahme am Praktikum: WS Erfolgreiche Teilnahme am
Institut für rganische Chemie rganisch-chemisches Fortgeschrittenenpraktikum http://www.chm.tu-dresden.de/organik/hierse/c_fp.htm Name: Erfolgreiche Teilnahme am Praktikum: WS Erfolgreiche Teilnahme am
CH-Aktivierung. MCII - Seminar Christoph Sonnenschein und David Schrempp
 C-Aktivierung MCII - Seminar 17.12.09 Christoph Sonnenschein und David Schrempp 1 Inhalt 1. Einleitung 2. Aktivierung über σ-komplexe 3. Intramolekularer Verlauf 4. Murai-Reaktion 5. Intermolekularer Verlauf
C-Aktivierung MCII - Seminar 17.12.09 Christoph Sonnenschein und David Schrempp 1 Inhalt 1. Einleitung 2. Aktivierung über σ-komplexe 3. Intramolekularer Verlauf 4. Murai-Reaktion 5. Intermolekularer Verlauf
Organokatalyse durch asymmetrische
 rganokatalyse durch asymmetrische Protonierung? R Nachrichten aus der Chemie 2008, 56, 73-76. P H R Vortragsseminar des FP WS 2008/2009 04.12.08 Themenübersicht Vortragsseminar des FP WS 2008/2009 04.12.08
rganokatalyse durch asymmetrische Protonierung? R Nachrichten aus der Chemie 2008, 56, 73-76. P H R Vortragsseminar des FP WS 2008/2009 04.12.08 Themenübersicht Vortragsseminar des FP WS 2008/2009 04.12.08
Reaktionen der Alkene
 Addition an die π-bindung eaktionen der Alkene CI_folie144 C C X Y C C X Y 1) Katalytische ydrierung von Alkenen Beispiele: Katalysator C C Pt C C C C C C C C C C C C, 5 C C -Methyl--hexen (Lösungsmittel)
Addition an die π-bindung eaktionen der Alkene CI_folie144 C C X Y C C X Y 1) Katalytische ydrierung von Alkenen Beispiele: Katalysator C C Pt C C C C C C C C C C C C, 5 C C -Methyl--hexen (Lösungsmittel)
9. Syntheseübung WS 2006/2007. Thapsigargine
 9. Syntheseübung WS 2006/2007 Thapsigargine isoliert aus der mediterranen Pflanze Thapsia garganica R 1 R 2 Thapsigargin Tribolid Nortribolid Thapsivillosin R 1 = ctanoyl, R 2 = Butanoat R 1 =, R 2 = (S)-2-thylbutanoat
9. Syntheseübung WS 2006/2007 Thapsigargine isoliert aus der mediterranen Pflanze Thapsia garganica R 1 R 2 Thapsigargin Tribolid Nortribolid Thapsivillosin R 1 = ctanoyl, R 2 = Butanoat R 1 =, R 2 = (S)-2-thylbutanoat
1. Übungsblatt Radikale
 Prof. Dr. liver Reiser Institut für rganische Chemie Universität Regensburg 1. Übungsblatt Radikale Aufgabe 1: Mittels radikalischer Chlorierung oder omierung können Alkylhalogenie aus Alkanen effektiv
Prof. Dr. liver Reiser Institut für rganische Chemie Universität Regensburg 1. Übungsblatt Radikale Aufgabe 1: Mittels radikalischer Chlorierung oder omierung können Alkylhalogenie aus Alkanen effektiv
Hydroborierung und Folgereaktionen
 O-F F Seminar WS 03/04: ydroborierung und Folgereaktionen oris Weidenhof Überblick kurzer geschichtlicher ückblick chanismus der ydroborierung oranreagenzien eaktionen von Organoboranen 19.11.2003 O-F
O-F F Seminar WS 03/04: ydroborierung und Folgereaktionen oris Weidenhof Überblick kurzer geschichtlicher ückblick chanismus der ydroborierung oranreagenzien eaktionen von Organoboranen 19.11.2003 O-F
Palladiumkatalysierte Kreuzkupplungen in der Totalsynthese. Brigitte Czepukojc, Anton Bayer
 Kreuzkupplungen in der Totalsynthese Brigitte Czepukojc, Anton Bayer Kreuzkupplungnen in der Totalsynthese 2 Inhalt Einleitung chanismen, Syntheserouten und ausgewählte Beispiele eck-reaktionen Stille-Reaktionen
Kreuzkupplungen in der Totalsynthese Brigitte Czepukojc, Anton Bayer Kreuzkupplungnen in der Totalsynthese 2 Inhalt Einleitung chanismen, Syntheserouten und ausgewählte Beispiele eck-reaktionen Stille-Reaktionen
Übergangsmetall-π-Komplexe
 Übergangsmetall-π-Komplexe ausschließlich π-wechselwirkungen von Liganden- mit etallorbitalen Alken od. Olefin Diolefin Alkenkomplexe Alkin od. Acetylen Allyl yclopentadienyl sehr häufig, Beispiele mit
Übergangsmetall-π-Komplexe ausschließlich π-wechselwirkungen von Liganden- mit etallorbitalen Alken od. Olefin Diolefin Alkenkomplexe Alkin od. Acetylen Allyl yclopentadienyl sehr häufig, Beispiele mit
Seminar zum Organisch-Chemischen Praktikum für Biologen Sommersemester 2017
 Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2017 xidation und eduktion Sicherheitsbelehrung: egeln für das Arbeiten im Labor Prof. Dr. asmus Linser September 2017 Die Übungsfragen
Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2017 xidation und eduktion Sicherheitsbelehrung: egeln für das Arbeiten im Labor Prof. Dr. asmus Linser September 2017 Die Übungsfragen
7 Aldehyde und Ketone
 7 Aldehyde und Ketone 7.1 Allgemeines 2 eaktivitätszentren: : δ : X: α-wasserstoff (Kap. 9) δ eaktionen an der arbonylgruppe X = : Aldehyde X = Alkyl, Aryl: Ketone X = al,, 2 : arbonsäurederivate Kapitel
7 Aldehyde und Ketone 7.1 Allgemeines 2 eaktivitätszentren: : δ : X: α-wasserstoff (Kap. 9) δ eaktionen an der arbonylgruppe X = : Aldehyde X = Alkyl, Aryl: Ketone X = al,, 2 : arbonsäurederivate Kapitel
ORGANISCHE CHEMIE 1. Stoff der 19. Vorlesung: Reaktionen...
 Stoff der 19. Vorlesung: eaktionen... GAISE EMIE 1 19. Vorlesung, Dienstag, 25. Juni 2013 I. eaktionen der arbonylgruppe I. mit -ukleophilen II. mit -ukleophilen III. mit -ukleophilen arald Schwalbe Institut
Stoff der 19. Vorlesung: eaktionen... GAISE EMIE 1 19. Vorlesung, Dienstag, 25. Juni 2013 I. eaktionen der arbonylgruppe I. mit -ukleophilen II. mit -ukleophilen III. mit -ukleophilen arald Schwalbe Institut
Technische Universität Dresden Institut für Organische Chemie Organisch-chemisches Grundpraktikum. Aufgabe Max. Punkte Punkte
 Name: Praktikum SS 003: Platz-Nr.: Assistent: Nachschreiber: Praktikum SS Platz-Nr.: Aufgabe 5 6-6 Max. Punkte 33 33 3 100 Punkte Zeichnen Sie sorgfältig und richtig! Die Fähigkeit richtig zeichnen zu
Name: Praktikum SS 003: Platz-Nr.: Assistent: Nachschreiber: Praktikum SS Platz-Nr.: Aufgabe 5 6-6 Max. Punkte 33 33 3 100 Punkte Zeichnen Sie sorgfältig und richtig! Die Fähigkeit richtig zeichnen zu
Pagodan- und Dodecahedran-Synthesen von Horst Prinzbach (Universität Freiburg) - zusamengestellt von Reinhard Brückner (ibid.)
 Pagodan- und Dodecahedran-ynthesen von orst Prinzbach (Universität Freiburg) - zusamengestellt von Reinhard ückner (ibid.) Erste ynthese von Pagodan tufe 0: M. A. Battiste, J. F. Timberlake,. Malkus, Tetrahedron
Pagodan- und Dodecahedran-ynthesen von orst Prinzbach (Universität Freiburg) - zusamengestellt von Reinhard ückner (ibid.) Erste ynthese von Pagodan tufe 0: M. A. Battiste, J. F. Timberlake,. Malkus, Tetrahedron
Klausur (Modulabschlussprüfung)
 rganisch-chemisches Institut 02.08.202 der Universität Münster Klausur (Modulabschlussprüfung) zum Modul Moderne Synthesechemie rganische Chemie im Sommersemester 202 Lösung Name: Vorname: Matrikelnummer:
rganisch-chemisches Institut 02.08.202 der Universität Münster Klausur (Modulabschlussprüfung) zum Modul Moderne Synthesechemie rganische Chemie im Sommersemester 202 Lösung Name: Vorname: Matrikelnummer:
Reaktionsmechanismen und Konzepte der Organischen Chemie
 Reaktionsmechanismen und Konzepte der Organischen Chemie 1. Radikalreaktionen Struktur von C-Radikalen Stabilität von C-Radikalen o Mesomeriestabilisierung über π-delokalisation o Hyperkonjugation über
Reaktionsmechanismen und Konzepte der Organischen Chemie 1. Radikalreaktionen Struktur von C-Radikalen Stabilität von C-Radikalen o Mesomeriestabilisierung über π-delokalisation o Hyperkonjugation über
Organische Synthese. Sommersemester 2012 Technische Universität München. Nachholklausur am
 rganische Synthese Sommersemester 2012 Technische Universität München achholklausur am 04.10.2012 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie
rganische Synthese Sommersemester 2012 Technische Universität München achholklausur am 04.10.2012 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie
Name: 1 Reaktion von Carbonylverbindungen mit Kohlenstoffnukleophilen 71
 Institut für rganische Chemie rganisch-chemisches Grundpraktikum ame: Praktikum Platz-r.: Assistent: SS 2002: achschreiber Praktikum SS Bemerkungen: Achtung: 0 Zusatzpunkte können erreicht werden 1 2 3
Institut für rganische Chemie rganisch-chemisches Grundpraktikum ame: Praktikum Platz-r.: Assistent: SS 2002: achschreiber Praktikum SS Bemerkungen: Achtung: 0 Zusatzpunkte können erreicht werden 1 2 3
Übungsklausur mit Lösungen
 DECKBLATT PRÜFUGLEITUG PERÖLICE AGABE: mit Lösungen ame und Vorname:... Matrikelnummer:.. Diplom Chemie oder Wirtschaftschemie Diplom Biochemie/Molekularbiologie B.c. Chemie oder Wirtschaftschemie B.c.
DECKBLATT PRÜFUGLEITUG PERÖLICE AGABE: mit Lösungen ame und Vorname:... Matrikelnummer:.. Diplom Chemie oder Wirtschaftschemie Diplom Biochemie/Molekularbiologie B.c. Chemie oder Wirtschaftschemie B.c.
Übungen zur Vorlesung Organische Chemie (Teil 2)
 Übungen zur Vorlesung rganische Chemie (Teil 2) K. Hohmann/ J. Massoth/ F. Lehner/ H. Schwalbe Blatt 5 1) Enolat und Enamin Geben Sie das bevorzugte Deprotonierungsprodukt an a) Thermodynamisch kontrolliert
Übungen zur Vorlesung rganische Chemie (Teil 2) K. Hohmann/ J. Massoth/ F. Lehner/ H. Schwalbe Blatt 5 1) Enolat und Enamin Geben Sie das bevorzugte Deprotonierungsprodukt an a) Thermodynamisch kontrolliert
Organische Chemie III
 rganische Chemie III Wintersemester 2008/09 Technische Universität München Nachholklausur am 10.10.2008 Name, Vorname... Matrikel-Nr.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl....
rganische Chemie III Wintersemester 2008/09 Technische Universität München Nachholklausur am 10.10.2008 Name, Vorname... Matrikel-Nr.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl....
7.9 Reaktionen mit Kohlenstoff-Nucleophilen
 7.9 eaktionen mit Kohlenstoff-Nucleophilen Die Addition von yanwasserstoff ist reversibel und wird durch Basen katalysiert. N N N yanhydrin Beim Behandeln der yanhydrine mit einer stöchiometrischen Menge
7.9 eaktionen mit Kohlenstoff-Nucleophilen Die Addition von yanwasserstoff ist reversibel und wird durch Basen katalysiert. N N N yanhydrin Beim Behandeln der yanhydrine mit einer stöchiometrischen Menge
Ionische Flüssigkeiten (IL)
 Ionische Flüssigkeiten (IL) Wolfgang Binder Technische Universität Wien Institut f. Angewandte Synthesechemie Inhalte : 1. Strukturen / Eigenschaften 2. Herstellung 3. Stabilität / Löslichkeit 4. Säure/Basen-Eigenschaften
Ionische Flüssigkeiten (IL) Wolfgang Binder Technische Universität Wien Institut f. Angewandte Synthesechemie Inhalte : 1. Strukturen / Eigenschaften 2. Herstellung 3. Stabilität / Löslichkeit 4. Säure/Basen-Eigenschaften
Wichtig: Unterschied zwischen Konstitution, Konformation und Konfiguration
 Prof. Christoffers, Vorlesung rganische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 3. Alkene 3.1 Nomenklatur, Konfiguration 3.1.1 Nomenklatur 1-exen 3-exen 1,3-exadien
Prof. Christoffers, Vorlesung rganische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 3. Alkene 3.1 Nomenklatur, Konfiguration 3.1.1 Nomenklatur 1-exen 3-exen 1,3-exadien
Morita Baylis Hillman Reaktion
 Morita Baylis Hillman Reaktion Johannes Straub und Sven Wiesner 20.11.2008 Gliederung 1. Einleitung 2. allg. Reaktionsgleichung/Komponenten 3. Mechanismus 4. Asymmetrische MBH Reaktion 5. Aza MBH Reaktion
Morita Baylis Hillman Reaktion Johannes Straub und Sven Wiesner 20.11.2008 Gliederung 1. Einleitung 2. allg. Reaktionsgleichung/Komponenten 3. Mechanismus 4. Asymmetrische MBH Reaktion 5. Aza MBH Reaktion
Reaktionsmechanismen nach dem gleichnahmigen Buch von R. Brückner
 eaktionsmechanismen nach dem gleichnahmigen ch von. Brückner Kap. 12 Chemie der Enole und Enamine Dr. ermann A. Wegner hermann.wegner@unibas.ch Keto/Enol-Tautomerie; Enolgehalt von Carbonyl- und Carboxylverbindungen
eaktionsmechanismen nach dem gleichnahmigen ch von. Brückner Kap. 12 Chemie der Enole und Enamine Dr. ermann A. Wegner hermann.wegner@unibas.ch Keto/Enol-Tautomerie; Enolgehalt von Carbonyl- und Carboxylverbindungen
Verzeichnis der Wortabkürzungen... Verzeichnis der Zeichen und Symbole...XVII
 VII Verzeichnis der Wortabkürzungen... XIII Verzeichnis der Zeichen und Symbole...XVII Organische Chemie 3.1 Chemische Bindung... 3 3.1.1 Orbitale, deren Hybridisierung und Überlappung... 3 3.1.2 Einfachbindungen...
VII Verzeichnis der Wortabkürzungen... XIII Verzeichnis der Zeichen und Symbole...XVII Organische Chemie 3.1 Chemische Bindung... 3 3.1.1 Orbitale, deren Hybridisierung und Überlappung... 3 3.1.2 Einfachbindungen...
1. Übung zur Vorlesung OC III
 1. Übung zur Vorlesung C III 26.04.03 Aufgabe 1 Für eine retrosynthetische Zerlegung eines Zielmoleküls bietet es sich an dieses zuerst in sinnvolle Synthone zu zerlegen und anschließend die dafür denkbaren
1. Übung zur Vorlesung C III 26.04.03 Aufgabe 1 Für eine retrosynthetische Zerlegung eines Zielmoleküls bietet es sich an dieses zuerst in sinnvolle Synthone zu zerlegen und anschließend die dafür denkbaren
OC07: Click -Reaktionen: Ein vielseitiges Werkzeug zur Synthese
 OC07: Click -Reaktionen: Ein vielseitiges Werkzeug zur Synthese 06.01.2016 Von Christian Rohrbacher & Marc Schneider Inhalt 1. Einleitung 1.1 Was sind Click -Reaktionen? 1.2 Anwendungsbeispiel: Peptid-Konjugate
OC07: Click -Reaktionen: Ein vielseitiges Werkzeug zur Synthese 06.01.2016 Von Christian Rohrbacher & Marc Schneider Inhalt 1. Einleitung 1.1 Was sind Click -Reaktionen? 1.2 Anwendungsbeispiel: Peptid-Konjugate
Organische Chemie IV: Metallkatalyse
 rganische Chemie IV: Metallkatalyse Sommersemester 2003 Technische Universität München Klausur am 13.06.2003 13 00 15 00 h ame; Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang......
rganische Chemie IV: Metallkatalyse Sommersemester 2003 Technische Universität München Klausur am 13.06.2003 13 00 15 00 h ame; Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang......
Seminar zum Organisch-Chemischen Praktikum für Biologen Sommersemester 2016
 Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2016 Aromatische Substitution Sicherheitsbelehrung: egeln für das Arbeiten im Labor Prof. Dr. asmus Linser September 2016 Gruppe A
Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2016 Aromatische Substitution Sicherheitsbelehrung: egeln für das Arbeiten im Labor Prof. Dr. asmus Linser September 2016 Gruppe A
Cyclisierung von freien Radikalen (Baldwin-Regel) Konkurrenz der Bildung von Fünf- und Sechsringen
 yclisierung von freien adikalen (Baldwin-egel) Konkurrenz der Bildung von Fünf- und Sechsringen 4_folie048 + + = : 98 : 2 = 3 : 99 : 1 33 : 66 Angriff des adikals auf das disubstituierte sp 2 - Atom sterisch
yclisierung von freien adikalen (Baldwin-egel) Konkurrenz der Bildung von Fünf- und Sechsringen 4_folie048 + + = : 98 : 2 = 3 : 99 : 1 33 : 66 Angriff des adikals auf das disubstituierte sp 2 - Atom sterisch
Moderne Aldol-Reaktionen
 Moderne Aldol-Reaktionen Katrina Brendle Institut für Organische Chemie Seminar zum Fortgeschrittenenpraktium KIT Universität des Landes Baden-Württemberg und nationales Großforschungszentrum in der Helmholtz-Gemeinschaft
Moderne Aldol-Reaktionen Katrina Brendle Institut für Organische Chemie Seminar zum Fortgeschrittenenpraktium KIT Universität des Landes Baden-Württemberg und nationales Großforschungszentrum in der Helmholtz-Gemeinschaft
Wiederholungsklausur LÖSUNGEN. (ohne Gewähr)
 tto Diels-Institut für rganische Chemie der Christian-Albrechts-Universität zu Kiel 17.11.2008 Wiederholungsklausur LÖSUGE (ohne Gewähr) zum rganisch-chemischen Grundpraktikum im SS 2008 für Diplomstudierende
tto Diels-Institut für rganische Chemie der Christian-Albrechts-Universität zu Kiel 17.11.2008 Wiederholungsklausur LÖSUGE (ohne Gewähr) zum rganisch-chemischen Grundpraktikum im SS 2008 für Diplomstudierende
