Korrosion und Korrosionsschutz
|
|
|
- Louisa Bella Geisler
- vor 6 Jahren
- Abrufe
Transkript
1 Schulversuchspraktikum Alexander König Sommersemester 2015 Klassenstufen 7 & 8 Korrosion und Korrosionsschutz
2 Auf einen Blick: Diese Unterrichtseinheit für die Klassen 7 & 8 enthält 1 Schülerversuch und 1 Lehrerversuche zum Thema Korrosion und Korrosionsschutz in der Unterrichtseinheit Die chemische Reaktion mit Sauerstoff. Der Lehrerversucht zeigt den Vorgang einer beschleunigten Eisenkorrosion und dient als Veranschaulichung einer sonst langsamen Reaktion. Im Schülerversuch lernen die SuS Sauerstoff als zweiten Reaktionspartner der Eisenkorrosion experimentell kennen. Inhalt 1. Beschreibung des Themas und zugehörige Lernziele Relevanz des Themas für SuS der 7. und 8. Jahrgangsstufe und didaktische Reduktion Lehrerversuch V1 - Schnellrost Schülerexperiment V2 Rosten als Reaktion mit Sauerstoff Didaktischer Kommentar zum Arbeitsblatt Erwartungshorizont (Kerncurriculum) Erwartungshorizont (Inhaltlich) Literatur... 13
3 1 Beschreibung des Themas und zugehörige Lernziele 1. Beschreibung des Themas und zugehörige Lernziele Im Kerncurriculum der 7 und 8 Klasse nimmt das Basiskonzept der chemische Reaktion einen wichtigen Teil des Chemieunterrichtes ein. Die Schülerinnen und Schüler (SuS) kommen in dieser Klassenstufe das erste Mal mit diesem Basiskonzept in Verbindung. Die wichtigen Merkmale sind hier eine Änderung der Ausgangsstoffe in neue Stoffe sowie der damit verbundene Energieumsatz. Im Kerncurriculum finden sich die Korrosion und der Korrosionsschutz im Anhang mit Anregungen für die Umsetzung. Wichtig wird dieses Thema in der Klassenstufe 9 bzw. 10 im Rahmen von Donator-Akzeptor Modellen. In den Klassenstufen 7 und 8 bietet es sich an, diese Prozesse phänomenologisch zu untersuchen und die Produkte und Edukte zu hinterfragen, zu analysieren, wie sie entstehen und wie diese Reaktion umgekehrt werden. Des Weiteren beschreiben die SuS die Korrosion als eine Sauerstoffübertragungsreaktion, welche mit einem Energieumsatz verbunden ist. So wird Wärme frei, oder es wird dem Systemen Wärme zuführt. Im Versuch 1 Schnellrost findet eine exotherme Reaktion statt. Um Eisenwolle an der Luft zu oxidieren, muss diese erst entzündet werden (Aktivierungsenergie) und verbrennt dann exotherm. Im Bezug auf die Erkenntnisgewinnung sollen die SuS die alltägliche chemische Reaktion des Rostens als Sauerstoffübertragungsreaktion kennen lernen sowie Möglichkeiten diese zu beeinflussen. Im Lehrerversuch werden die Energetik und der Stoffumsatz für die SuS erkennbar gemacht. Sie lernen hier die Faktoren des Rostvorganges kennen. Des Weiteren erfahren die SuS die chemische Reaktion optisch und haptisch. Sie wird für sie erfahrbarer und zugänglicher. Sie sehe während der schnellen Korrosionsreaktion wie ein brauner Stoff ausfällt und spüren, wie sich das Reagenzglas erwärmt. Sie erkennen die Korrosion von Eisen als exotherme Reaktion. Dies wird über die große Oberfläche der Eisenwolle und durch Wasserstoffperoxid, als Sauerstofflieferant, beschleunigt. Im Schülerversuch untersuchen die SuS die Notwendigkeit aller Faktoren das Rosten von Eisen, indem sie diese systematisch untersuchen und somit aufklären, welche nötig sind um diese chemische Reaktion ablaufen zu lassen. Die Ergebnisse können die SuS im Anschluss verallgemeinern. In beiden Versuchen lernen die SuS Natriumchloriod als Katalysator und seine reaktionsbeschleunigende Wirkung für bestimmte Reaktionen kennen.
4 2 Relevanz des Themas für SuS der 7. und 8. Jahrgangsstufe und didaktische Reduktion 2. Relevanz des Themas für SuS der 7. und 8. Jahrgangsstufe und didaktische Reduktion Korrosion und Korrosionsschutz ist ein wichtiges Gebiet in der Technik. Sie ist im Bereich der Werkstoffe allgegenwärtig. Werkstoffe haben eine begrenzte Lebensdauer und unterliegen Zerfallsprozessen. In Industrieländern vernichtet die Korrosion bis zu 3% des Bruttoinlandproduktes [1]. Die SuS kennen Korrosion aus eigener Erfahrung beispielsweise von Rostflecken an Fahrräder, Autos und verrostendem Werkzeug. Die chemische Reaktion ist eine wichtige Grundlage für das Verständnis von Naturprozessen und chemischen Sachverhalten. Um die Vorgänge in den Klassenstufen 7./8. sachgerecht untersuchen zu können, sind jedoch an mehreren Stellen didaktische Reduktionen notwendig. Die Energetik der chemischen Reaktion wird von der Änderung der Gibbs Energie auf eine Veränderung der Enthalpie (Reaktionswärme) reduziert. Dies erleichtert den SuS das Verständnis über die Eigenschaften chemischer Reaktionen und überfordert sie nicht mit komplexen mathematischen Konstrukten Ebenso wird auf den Begriff der Redoxreaktion und die Elektronenübergänge verzichtet. Diese Themen werden in den Klassenstufen 9 & 10 thematisiert. Im Lehrerversuch werden die wichtigen Komponenten einer chemischen Reaktion veranschaulicht und optisch sowie akustisch erfahrbar gemacht. Reaktionsgleichungen werden vernachlässigt bzw. auf eine simple Form reduziert. Auch hier lernen die SuS die Formelschreibweise am der 9. Klasse. In Klassenstufe 7 & 8 werden hierfür die Grundlagen durch Wortgleichungen gelegt und das Verständnis der SuS für chemische Gleichungen geschult. Im Schülerversuch ergründen die SuS selbständig die notwendigen Edukte für eine Reaktion. Gleichzeitig muss an dieser Stelle der Begriff des Katalysators als Beschleuniger chemischer Reaktionen genannt und erörtert werden. Vertieft wird die Katalyse dann in der Sek II. Betrachtet werden die Versuche rein phänomenologisch, daher ist kein spezielles Vorwissen notwendig. Wird die Korrosion jedoch vertieft und der Korrosionsschutz mittel Opferanoden (siehe Kurzversuche) behandelt, ist es notwendig, dass die SuS sich mit edlen und unedlen Metallen auseinander setzen.
5 3 Lehrerversuch V1 - Schnellrost 3. Lehrerversuch V1 - Schnellrost Dieses Experiment soll den Vorgang der Korrosion von Eisen beschleunigt zeigen und so den SuS näher bringen. Des Weiteren lernen sie Natriumchlorid als Katalysator der Korrosionsreaktion kennen. Materialien: Chemikalien: Durchführung: 200 ml Becherglas, 50g Eisenwolle, Löffelspatel, Wasser. Wasserstoffperoxid (w=3%), Natriumchlorid (Kochsalz) 20 ml Wasser, 80 ml Wasserstoffperoxid (w=3%) und 2 Spatellöffel Natriumchlorid werden in ein 100 ml Becherglas gegeben und das Salz vollständig aufgelöst. Die Eisenwolle wird in die Lösung gegeben. Es ist auch hier möglich systematisch eine Reagenzien (Wasserstoffperoxid, Wasser) und den Katalysator (Natriumchlorid) weg zu lassen und mehrere Ansätze zu erstellen. Die SuS können hier die einzelnen Reaktionen vergleichend beobachten. Abbildung 1 rostende Stahlwolle nach 2 Minuten Deutung: Entsorgung: Es fällt sofort ein brauner Niederschlag aus. Es steigen Blasen auf und das Becherglas wird warm. Bei dieser Reaktion rostet die Eisenwolle sehr schnell. Das Wasser wird braun. Das Natriumchlorid fungiert als Katalysator und das Wasserstoffperoxid beschleunigt die Reaktion indem es Sauerstoff liefert. Das Gemisch wird filtriert. Der Rückstand wird in den Feststoffabfall entsorgt, das Filtrat in den Ausguss gegeben.
6 4 Schülerexperiment V2 Rosten als Reaktion mit Sauerstoff 4. Schülerexperiment V2 Rosten als Reaktion mit Sauerstoff Dieser Versuch soll zeigen, dass für den Rostvorgang Sauerstoff notwendig ist. Durch systematischen Ausschluss einzelner Faktoren erschließen sich die SuS die notwendigen Edukte für den Vorgang der Korrosion von Eisen. Die SuS müssen wissen, dass Kaliumhexacyanoferrat(II) eine Nachweisreaktion für Eisenteilchen ist. Sind diese vorhanden, so verfärbt sich die orange/gelbe Lösung blau. (Berliner Blau) Gefahrenstoffe Kaliumhexacyanoferrat (II) H: 412 P: 273 Materialien: Chemikalien: Durchführung: 5 Reagenzgläser, Reagenzglasständer, 5 Nägel, Löffelspatel, 2 Bechergläser, Heizplatte Wasser, Wasserstoffperoxid (w = 3%), Natriumchlorid, Pflanzenöl, Kaliumhexacyanoferrat(III) 100 ml Wasser wird zu Beginn gekocht, bis kein Gas mehr aufsteigt. Es wird eine Spatelspitze Kaliumhexacyanoferrat (III) zugegeben (= Lösung 1). 80 ml von Lösung 1 werden in einem neuen Becherglas mit einem Spatellöffel Natriumchlorid versetzt (= Lösung 2). Es werden 5 Reagenzgläser in folgenden Ansätzen aufgebaut: 1. Ein Spatellöffel Natriumchlorid ml Lösung ml Lösung ml Lösung ml Öl ml Lösung 2/Wasserstoffperoxid im Verhältnis 4:1 + 2 ml Öl In jeden Ansatz wird nun ein Eisennagel gegeben.
7 4 Schülerexperiment V2 Rosten als Reaktion mit Sauerstoff Deutung: Im Reagenzglas (1) mit Natriumchlorid ist nichts zu beobachten. Im Reagenzglas (2) ist eine leichte Blaufärbung zu beobachten. In Reagenzglas (3) ist eine starke Blaufärbung um den Nagel zu beobachten. In Reagenzglas (4) ist keine Blaufärbung zu beobachten. In Reagenzglas (4) ist keine Blaufärbung zu bobachten. In Reagenzglas 5entsteht sofort Rost, welcher sich im Becherglas verteilt. Gas steigt auf und der Kolben erwärmt sich. Durch das Kochen wurde ein Großteil des Sauerstoffs entfernt. Kaliumhexacynoferrat(III) ist ein Nachweisreagenz für Eisenteilchen im Wasser. Die Blaufärbung, veranschaulicht, wie schnell Eisenteilchen aus dem Nagel in das Wasser gehen. Kommen diese später mit Sauerstoff in Berührung, würde Rost entstehen. Es ist zu sehen, dass diese bei Lösungen mit Natriumchlorid stärker Eisenteilchen ins Wasser abgegeben werden. In Reagenzglas 1 läuft keine Reaktion ab, da Wasser fehlt. Im zweiten Reagenzglas ist nur eine langsame Reaktion zu beobachten, da hier nur wenig Sauerstoff im Wasser ist und die Wasseroberfläche für einen Gasaustausch nur sehr klein ist. Im Becherglas kommt es zu einer schnellen Blaufärbung, da Natriumchlorid das Rosten beschleunigt. Bei Luftabschluss im vierten Reagenzglas fällt die Reaktion schwächer aus, da wieder Sauerstoff fehlt. Im fünften Reagenzglas entsteht Eisenhydroxid ohne, das Ionen an das Wasser abgegeben werden. Die Eisenteilchen kommen hier sofort mit dem Sauerstoff aus dem Wasserstoffperoxid in Kontakt und Rost entsteht. Daher bleibt eine Blaufärbung hier aus, da die Eisenteilchen mit Sauerstoff verbunden sind.
8 4 Schülerexperiment V2 Rosten als Reaktion mit Sauerstoff Abbildung 1. Rostvorgang nach 2 Minuten. Das Wasser ist durch Hexacyanoferrat(III) gelblich verfärbt. Entsorgung: Flüssigkeiten können in den Ausguss. Feststoffe in den Feststoffabfall gegeben werden. Der Versuch kann auch ohne Kaliumhexacyanoferrat(III) durchgeführt werden. Hier empfiehlt es sich jedoch den Aufbau einen Tag stehen zu lassen und danach erneut zu beobachten.
9 Warum korrodiert Eisen? Korrodiertes Eisen bzw. Rost findet sich überall. An Brücken, Autos, an unseren Fahrrädern und an altem Werkzeug. Es richtet in Deutschland jährlich Schäden im Wert von 100 Millionen Euro an. Doch wie kann es sein, dass Eisen überhaupt rostet? Führt zu dieser Frage folgendes Experiment durch: Materialien: Chemikalien: Durchführung: 5 Reagenzgläser, Reagenzglasständer, 5 Nägel, Löffelspatel, 2 Bechergläser, Heizplatte Wasser (H 2O), Wasserstoffperoxid (H 2O 2) (w = 3%), Natriumchlorid, Pflanzenöl, Kaliumhexacyanoferrat(III) 100 ml Wasser werden zu Beginn gekocht, bis kein Gas mehr aufsteigt. Es wird eine Spatelspitze Kaliumhexacyanoferrat(III) zugegeben. Diese Chemikalie wird benutzt um Eisenteilchen im Wasser sichtbar zu machen. Sind diese im Wasser ist an dieser Stelle eine blaue Farbe sichtbar. Es werden 5 Reagenzgläser in folgenden Ansätzen aufgebaut: 1. Ein Spatellöffel Natriumchlorid ml Wasser, ml Wasser + 1 Spatel Natriumchlorid, mlwasser + 1 Spatel Natriumchlorid + Ölschicht ml Wasser + 5 ml Wasserstoffperoxid+ 1 Spatel Natriumchlorid+ 2 ml Öl In alle Ansätze wird nun gleichzeitig rostfreier Nagel gegeben und 10 Minuten gewartet.
10 Reagenzglas 1: Reagenzglas 2: Reagenzglas 3: Reagenzglas 4: Reagenzglas 5: Auswertung: Aufgabe 1 (Gruppenarbeit) Führe das oben aufgeführte Experiment durch. Protokolliere die Beobachtungen und deute diese im Vergleich mit den anderen Ansätzen. Aufgabe 2 Erkläre, unter Berücksichtigung der Experimentieransätze, welche Stoffe notwendig sind, um Eisen zum Rosten zu bringen und nennt die Wortgleichung der chemischen Reaktion des Rostens von Eisen. Aufgabe 3 Begründet, warum es sinnvoll ist vor dem Winter sein Auto in der Waschanlage mit Wachs versiegeln zu lassen. Bedenke dabei, dass im Winter auf Grund der Glätte, Streusalz auf das Eis gegeben wird.
11 5 Didaktischer Kommentar zum Arbeitsblatt 5. Didaktischer Kommentar zum Arbeitsblatt Das Arbeitsblatt behandelt das Basiskonzept der chemischen Reaktion im Allgemeinen und setzt den Schülerversuch V2 um. Es kann somit als Arbeitsauftrag in die Klasse gegeben werden. Die SuS erkunden die Umstände des Rostvorganges und entwickeln selbständig Hypothesen über die Edukte der chemischen Reaktion. Bei Versuchsansatz 5 müssen sie erkenne, dass der Sauerstoff hier nicht aus der Luft kommt, sondern über eine weitere Reaktion aus dem Wasserstoffperoxid gelöst wird. Auch ist das Natriumchlorid nicht direkt an der Reaktion beteiligt, beschleunigt diese aber stark und dient somit als Katalysator. Es bietet sich hier an, den SuS zu erklären, dass ein Katalysator eine Reaktion beschleunigt. Andere Eigenschaften von Katalysatoren werden in den höheren Klassenstufen behandelt. 5.1 Erwartungshorizont (Kerncurriculum) Im Folgenden soll der Bezug der Aufgaben zum Kerncurriculum exemplarisch aufgezeigt werden. Fachwissen: Erkenntnisgewinnung: Die SuS beschreiben, dass nach einer chemischen Reaktion die Ausgangsstoffe nicht mehr vorliegen und gleichzeitig immer neue Stoffe entstehen (Aufgabe 2) Die SuS formulieren Vorstellungen zu Produkten und Edukten (Aufgabe 2) Die SuS wenden Nachweisreaktionen an. (Aufgabe 2) Die SuS führen qualitative und quantitative einfache Experimente durch und protokollieren diese. Die SuS erkennen, die Bedeutung der Protokollführung für den Erkenntnisprozess. (Aufgabe 1) Kommunikation: Bewerten: Die SuS argumentieren fachlich korrekt und folgerichtig über ihre Versuche. (Aufgabe 1) Die SuS erkennen, dass chemische Reaktionen im Alltag stattfinden (Aufgabe 3) Das Lernziel von Aufgabe 1 ist die Durchführung eines einfachen qualitativen Experimentes. Bei dem ersten Teil von Aufgabe 1 handelt es sich um Aufgaben im Anforderungsbereich I es muss lediglich bekanntes Wissen wiedergegeben werden. Die Deutung der Beobachtung fällt jedoch schon in Anforderungsbereich II, da die SuS ihr Wissen anwenden und strukturieren müssen.
12 5 Didaktischer Kommentar zum Arbeitsblatt Auch die zweite Aufgabe fällt in den Anforderungsbereich II, da die SuS sich die wichtigen Produkte und Edukte der Reaktion aus ihrem Experiment herleiten müssen. Bei Aufgabe drei handelt es sich um eine Transferaufgabe. Die SuS müssen hier erkennen, dass im Winter mit Salz bzw. Natriumchlorid gestreut wird. In Verbindung mit Wasser würde dies die Korrosion des Fahrzeugs beschleunigen. Eine Wachsversieglung verhindert den Kontakt mit Wasser und Salz. 5.2 Erwartungshorizont (Inhaltlich) Aufgabe 1 Beobachtung Deutung Reagenzglas 1 (Natriumchlorid): Es findet keine sichtbare Reaktion statt. Reagenzglas 2 (20 ml Wasser): Es sind einzelne blaue Stellen am Nagel sichtbar. An dieser Stelle sind Eisenteilchen ins Wasser gelangt. Reagenzglas 3 (20 ml Wasser + 1 Spatel Natriumchlorid): Um den Nagel ist viel blaue Farbe zu sehen. - Es sind mehr Eisenteilchen ins Wasser gelangt. Das Natriumchlorid beschleunigt diesen Vorgang. Reagenzglas 4 (20 ml Wasser + 1 Spatel Natriumchlorid + Ölschicht): Am Nagel hat sich kaum blaue Farbe gebildet. Es sind sehr wenige Eisenteilchen ins Wasser gelangt. Die Ölschicht verhindert, dass Luft (Sauerstoff) an den Nagel kommt. Reagenzglas 5 (15 ml Wasser + 5 ml Wasserstoffperoxid+ 1 Spatel Natriumchlorid+ Ölschicht). Es ist zu sehen, dass sehr viele Blasen aufsteigen und sich ein brauner Farbstoff bildet; ein blauer ist nicht zu sehen. Das Wasserstoffperoxid beschleunigt die Korrosion von Eisen stark. Aufgabe 2 Eisen und Sauerstoff reagieren im Wasser zu Rost. (evtl. Natriumchlorid als Katalysator) Im Ansatz 1 gab es keine Reaktion, da Wasser gefehlt hat. Im Ansatz 2 waren nur wenige blau gefärbte Stellen vorhanden. In Ansatz 3 war der Nagel am stärksten blau. Natriumchlorid beschleunigt die Abgabe von Eisenteilchen in die Lösung. In Ansatz 4 kann keine Luft in das Wasser gelangen und es werden keine Eisenteilchen ins Wasser abgegeben. Ansatz 5 zeigt ein sehr schnelles Rosten obwohl genauso viel Natriumchlorid im Wasser ist, wie in den anderen Versuchen. Wasserstoffperoxid beschleunigt folglich ebenfalls die Reaktion. Aufgabe 3 Im Winter wird Salz (also Natriumchlorid) gestreut, um Eis zum Schmelzen zu bringen. Gelangt dies zusammen mit Wasser an das Auto, können ungeschützte Metallteile anfange zu rosten und das Auto beschädigen. Durch das Wachs kommen kein Wasser und kein Salz an die Metallteile.
13 6 Literatur 6. Literatur [1] Donner, S., ( , 0:00 Uhr) Abgerufen am
Warum korrodiert Eisen?
 Warum korrodiert Eisen? Korrodiertes Eisen bzw. Rost findet sich überall. An Brücken, Autos, an unseren Fahrrädern und an altem Werkzeug. Es richtet in Deutschland jährlich Schäden im Wert von 100 Millionen
Warum korrodiert Eisen? Korrodiertes Eisen bzw. Rost findet sich überall. An Brücken, Autos, an unseren Fahrrädern und an altem Werkzeug. Es richtet in Deutschland jährlich Schäden im Wert von 100 Millionen
Arbeitsblatt Ist groß besser als klein?
 Arbeitsblatt Ist groß besser als klein? Aufgabe 1: Führe folgendes Experiment durch und notiere deine Beobachtungen. Materialien: 4 Reagenzgläser, Reagenzglasständer, Spatel Chemikalien: Gefahrenstoffe
Arbeitsblatt Ist groß besser als klein? Aufgabe 1: Führe folgendes Experiment durch und notiere deine Beobachtungen. Materialien: 4 Reagenzgläser, Reagenzglasständer, Spatel Chemikalien: Gefahrenstoffe
Merkmale einer chemischen Reaktion
 Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 7 & 8 Merkmale einer chemischen Reaktion 1 Auf Beschreibung einen Blick: des Themas und zugehörige Lernziele Im Folgenden werden
Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 7 & 8 Merkmale einer chemischen Reaktion 1 Auf Beschreibung einen Blick: des Themas und zugehörige Lernziele Im Folgenden werden
Reaktionen von Metallen mit Sauerstoff und mit Luft
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die
Arbeitsblatt Verändert sich die Masse von Edukten und Produkten während einer
 Arbeitsblatt Verändert sich die Masse von Edukten und Produkten während einer chemischen Reaktion? In der letzten Chemiestunde hast du eine Hypothese zu der Frage formuliert: Verändert sich die Masse von
Arbeitsblatt Verändert sich die Masse von Edukten und Produkten während einer chemischen Reaktion? In der letzten Chemiestunde hast du eine Hypothese zu der Frage formuliert: Verändert sich die Masse von
Thema: Sauerstoff Klasse 7 / 8. Schulversuchspraktikum. Bastian Hollemann. Sommersemester Klassenstufen 7 & 8. Sauerstoff
 Thema: Sauerstoff Klasse 7 / 8 Schulversuchspraktikum Bastian Hollemann Sommersemester 2015 Klassenstufen 7 & 8 Sauerstoff Thema: Sauerstoff Klasse 7 / 8 Auf einen Blick: Diese Unterrichtseinheit für die
Thema: Sauerstoff Klasse 7 / 8 Schulversuchspraktikum Bastian Hollemann Sommersemester 2015 Klassenstufen 7 & 8 Sauerstoff Thema: Sauerstoff Klasse 7 / 8 Auf einen Blick: Diese Unterrichtseinheit für die
Schulversuchspraktikum. Alexander König. Sommersemester Klassenstufen 11 & 12. Katalysatoren
 Schulversuchspraktikum Alexander König Sommersemester 2015 Klassenstufen 11 & 12 Katalysatoren Auf einen Blick: Diese Unterrichtseinheit für die Klassen 11 und 12 enthält einen Schülerversuch und einen
Schulversuchspraktikum Alexander König Sommersemester 2015 Klassenstufen 11 & 12 Katalysatoren Auf einen Blick: Diese Unterrichtseinheit für die Klassen 11 und 12 enthält einen Schülerversuch und einen
Fluoreszierende Verbindungen
 Thema: Fluoreszierende Verbindungen Klasse 11 / 12 Schulversuchspraktikum Bastian Hollemann Sommersemester 2015 Klassenstufen 11 & 12 Fluoreszierende Verbindungen Thema: Fluoreszierende Verbindungen Klasse
Thema: Fluoreszierende Verbindungen Klasse 11 / 12 Schulversuchspraktikum Bastian Hollemann Sommersemester 2015 Klassenstufen 11 & 12 Fluoreszierende Verbindungen Thema: Fluoreszierende Verbindungen Klasse
3.3.1 Basiskonzept: Stoff-Teilchen
 3.3.1 Basiskonzept: Stoff-Teilchen Schuljahrgänge 7 und 8 Fachwissen Erkenntnisgewinnung Kommunikation Bewertung Chemische Fragestellungen entwickeln, untersuchen und einfache Ergebnisse aufbereiten Die
3.3.1 Basiskonzept: Stoff-Teilchen Schuljahrgänge 7 und 8 Fachwissen Erkenntnisgewinnung Kommunikation Bewertung Chemische Fragestellungen entwickeln, untersuchen und einfache Ergebnisse aufbereiten Die
Korrosion und Korrosionsschutz
 Schulversuchspraktikum Christian Köhler Sommersemester 2016 Klassenstufen 7&8 Korrosion und Korrosionsschutz Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll beinhaltet drei weitere Schülerversuche
Schulversuchspraktikum Christian Köhler Sommersemester 2016 Klassenstufen 7&8 Korrosion und Korrosionsschutz Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll beinhaltet drei weitere Schülerversuche
Arbeitsblatt Pip und Lucky: Was atmen Tiere im Wasser?
 http://www.kostenloseausmalbilder.de/media/.gallery/main606.jpg (02.08.2015) Arbeitsblatt Pip und Lucky: Was atmen Tiere im Wasser? Pip, die kleine Maus, benötigt zum Atmen Luft, vor allem den Sauerstoff,
http://www.kostenloseausmalbilder.de/media/.gallery/main606.jpg (02.08.2015) Arbeitsblatt Pip und Lucky: Was atmen Tiere im Wasser? Pip, die kleine Maus, benötigt zum Atmen Luft, vor allem den Sauerstoff,
Merkmale chemischer Reaktionen
 Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 7 & 8 Merkmale chemischer Reaktionen Kurzprotokoll Auf einen Blick: Im Folgenden werden weitere Versuche zum Thema Merkmale einer
Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 7 & 8 Merkmale chemischer Reaktionen Kurzprotokoll Auf einen Blick: Im Folgenden werden weitere Versuche zum Thema Merkmale einer
Endotherm und Exotherm
 Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 7 & 8 Endotherm und Exotherm Auf einen Blick: Das Protokoll enthält für die Klassen 7 und 8 einen Lehrerversuch und einen Schülerversuch
Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 7 & 8 Endotherm und Exotherm Auf einen Blick: Das Protokoll enthält für die Klassen 7 und 8 einen Lehrerversuch und einen Schülerversuch
Basiskonzept: Stoff-Teilchen (3/7)
 Basiskonzept: Stoff-Teilchen (3/7) 1 Schuljahrgänge 7 und 8 Stoffe besitzen quantifizierbare Eigenschaften Die Schülerinnen und Schüler... unterscheiden Stoffe anhand von Schmelz- und Siedetemperatur.
Basiskonzept: Stoff-Teilchen (3/7) 1 Schuljahrgänge 7 und 8 Stoffe besitzen quantifizierbare Eigenschaften Die Schülerinnen und Schüler... unterscheiden Stoffe anhand von Schmelz- und Siedetemperatur.
Schulversuchspraktikum. Jans Manjali. Sommersemester. Klassenstufen 11 & 12. Löslichkeitsprodukt
 Schulversuchspraktikum Jans Manjali Sommersemester Klassenstufen 11 & 12 Löslichkeitsprodukt 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll wird das Thema Löslichkeit
Schulversuchspraktikum Jans Manjali Sommersemester Klassenstufen 11 & 12 Löslichkeitsprodukt 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll wird das Thema Löslichkeit
3.3.1 Basiskonzept: Stoff-Teilchen
 3.3.1 Basiskonzept: Stoff-Teilchen 1 Fachwissen Erkenntnisgewinnung Kommunikation Bewertung Stoffeigenschaften lassen sich nutzen erklären Trennverfahren mit Hilfe ihrer Kenntnisse über Stoffeigenschaften.
3.3.1 Basiskonzept: Stoff-Teilchen 1 Fachwissen Erkenntnisgewinnung Kommunikation Bewertung Stoffeigenschaften lassen sich nutzen erklären Trennverfahren mit Hilfe ihrer Kenntnisse über Stoffeigenschaften.
Eine Reaktion mit Kupfer und Schwefel
 Eine Reaktion mit Kupfer und Schwefel Materialien: Chemikalien: Duranglas, Stativstange mit Stativklemme, Gasbrenner Schwefelpulver, Kupferblech Durchführung: Fülle vorsichtig ca. 1cm breit Schwefelpulver
Eine Reaktion mit Kupfer und Schwefel Materialien: Chemikalien: Duranglas, Stativstange mit Stativklemme, Gasbrenner Schwefelpulver, Kupferblech Durchführung: Fülle vorsichtig ca. 1cm breit Schwefelpulver
Schulversuchspraktikum. Constanze Koch. Sommersemester Klassenstufen 5 & 6. Wasser als Lösungsmittel. Kurzprotokoll
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 5 & 6 Wasser als Lösungsmittel Kurzprotokoll Auf einen Blick: In diesem Protokoll werden ein Lehrerversuch und vier Schülerversuche
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 5 & 6 Wasser als Lösungsmittel Kurzprotokoll Auf einen Blick: In diesem Protokoll werden ein Lehrerversuch und vier Schülerversuche
Schulversuchspraktikum. Name Thomas Polle. Sommersemester Klassenstufen 5 & 6. Feuer und Kerzen
 Schulversuchspraktikum Name Thomas Polle Sommersemester 2015 Klassenstufen 5 & 6 Feuer und Kerzen 2 Auf einen Blick: Es werden je ein Schüler- und Lehrerversuch zum Thema Kerzen und Feuer für den 5. und
Schulversuchspraktikum Name Thomas Polle Sommersemester 2015 Klassenstufen 5 & 6 Feuer und Kerzen 2 Auf einen Blick: Es werden je ein Schüler- und Lehrerversuch zum Thema Kerzen und Feuer für den 5. und
Schulversuchspraktikum. Anna Hille. Sommersemester Klassenstufen 7 & 8. Korrosion
 Schulversuchspraktikum Anna Hille Sommersemester 2013 Klassenstufen 7 & 8 Korrosion 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Dieses Protokoll beinhaltet Versuche zum Thema
Schulversuchspraktikum Anna Hille Sommersemester 2013 Klassenstufen 7 & 8 Korrosion 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Dieses Protokoll beinhaltet Versuche zum Thema
Kerncurriculum Chemie Eichsfeld-Gymnasium Duderstadt Juni 2012
 Kerncurriculum Chemie Eichsfeld-Gymnasium Duderstadt Juni 2012 Jahrgänge 7 und 8 Jeweils 1 Jahreswochenstunde pro Schuljahr (epochal, entspricht 40 Stunden pro Schuljahr). Basiskonzepte: BK1: Stoff-Teilchen;
Kerncurriculum Chemie Eichsfeld-Gymnasium Duderstadt Juni 2012 Jahrgänge 7 und 8 Jeweils 1 Jahreswochenstunde pro Schuljahr (epochal, entspricht 40 Stunden pro Schuljahr). Basiskonzepte: BK1: Stoff-Teilchen;
Wir untersuchen Mineralwasser
 Wir untersuchen Mineralwasser Jeder von uns kennt es: Mineralwasser. Im Geschäft wird es mit viel, wenig oder gar keiner Kohlensäure angeboten. Kohlensäure beschreibt die Form, in der das Gas Kohlenstoffdioxid
Wir untersuchen Mineralwasser Jeder von uns kennt es: Mineralwasser. Im Geschäft wird es mit viel, wenig oder gar keiner Kohlensäure angeboten. Kohlensäure beschreibt die Form, in der das Gas Kohlenstoffdioxid
Schwimmen, Schweben, Sinken
 Schulversuchspraktikum Patricia Hiller Sommersemester 2015 Klassenstufen 5 & 6 Schwimmen, Schweben, Sinken 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll werden
Schulversuchspraktikum Patricia Hiller Sommersemester 2015 Klassenstufen 5 & 6 Schwimmen, Schweben, Sinken 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll werden
Dichte und Nachweis von Kohlenstoffdioxid
 Schulversuchspraktikum Name: Lydia Reinhardt Semester: Sommersemester 2014 Klassenstufen 7 & 8 Dichte und Nachweis von Kohlenstoffdioxid 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Schulversuchspraktikum Name: Lydia Reinhardt Semester: Sommersemester 2014 Klassenstufen 7 & 8 Dichte und Nachweis von Kohlenstoffdioxid 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Von Arrhenius zu Brönsted
 Schulversuchspraktikum Name Annika Münch Sommersemester 2015 Klassenstufen 9/10 Von Arrhenius zu Brönsted Kurzprotokoll Auf einen Blick: Für die Unterrichtseinheit zum Themas Säure-Base-Konzepte und im
Schulversuchspraktikum Name Annika Münch Sommersemester 2015 Klassenstufen 9/10 Von Arrhenius zu Brönsted Kurzprotokoll Auf einen Blick: Für die Unterrichtseinheit zum Themas Säure-Base-Konzepte und im
Aktivierungsenergie und Katalyse
 1 Beschreibung des Themas und zugehörige Lernziele Schulversuchspraktikum Marie-Lena Gallikowski Sommersemester 2015 Klassenstufen 7 & 8 Aktivierungsenergie und Katalyse 1 Beschreibung des Themas und zugehörige
1 Beschreibung des Themas und zugehörige Lernziele Schulversuchspraktikum Marie-Lena Gallikowski Sommersemester 2015 Klassenstufen 7 & 8 Aktivierungsenergie und Katalyse 1 Beschreibung des Themas und zugehörige
Endotherm und Exotherm
 Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 7 & 8 Endotherm und Exotherm Kurzprotokoll Auf einen Blick: Das Protokoll enthält für die Klassen 7 und 8 einen Lehrerversuch und einen
Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 7 & 8 Endotherm und Exotherm Kurzprotokoll Auf einen Blick: Das Protokoll enthält für die Klassen 7 und 8 einen Lehrerversuch und einen
Synthese, Analyse, Umsetzung
 Schulversuchspraktikum Carl Föst Sommersemester 2015 Klassenstufen 7&8 Synthese, Analyse, Umsetzung Auf einen Blick Die Thematik Synthese, Analyse und Umsetzung umfasst die Grundtypen chemischer Reaktionen.
Schulversuchspraktikum Carl Föst Sommersemester 2015 Klassenstufen 7&8 Synthese, Analyse, Umsetzung Auf einen Blick Die Thematik Synthese, Analyse und Umsetzung umfasst die Grundtypen chemischer Reaktionen.
Konsequenzen der Ozeanversauerung
 Thema: Stoffkreisläufe Jahrgang 9 & 10 Konsequenzen der Ozeanversauerung Lies den Ausschnitt aus dem nachfolgenden Zeitungsartikel eines Wissenschaftsmagazins aufmerksam durch und betrachte im Diagramm
Thema: Stoffkreisläufe Jahrgang 9 & 10 Konsequenzen der Ozeanversauerung Lies den Ausschnitt aus dem nachfolgenden Zeitungsartikel eines Wissenschaftsmagazins aufmerksam durch und betrachte im Diagramm
1 Arbeitsblatt. 1.1 Erwartungshorizont
 1 Arbeitsblatt Das Arbeitsblatt dient der Protokollierung und der Auswertung des Lehrerversuches V1. Während die Versuchsdurchführung und Versuchbeobachtung wenig strukturiert ist, ist die Deutung des
1 Arbeitsblatt Das Arbeitsblatt dient der Protokollierung und der Auswertung des Lehrerversuches V1. Während die Versuchsdurchführung und Versuchbeobachtung wenig strukturiert ist, ist die Deutung des
Aggregatzustände und deren Temperaturabhängigkeit
 Name: Sissy Freund Semester: Sommersemester 2013 Klassenstufen: 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit Beschreibung des Themas und zugehörige Lernziele 2 Auf einen Blick: Dieses Protokoll
Name: Sissy Freund Semester: Sommersemester 2013 Klassenstufen: 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit Beschreibung des Themas und zugehörige Lernziele 2 Auf einen Blick: Dieses Protokoll
Schulversuchspraktikum. Isabel Böselt. Sommersemester Klassenstufen 5 & 6. Aggregatzustände. und deren Temperaturabhängigkeit
 Schulversuchspraktikum Isabel Böselt Sommersemester 2014 Klassenstufen 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit 1 Konzept und Lernziele 1 Auf einen Blick: In diesem Protokoll werden einfache
Schulversuchspraktikum Isabel Böselt Sommersemester 2014 Klassenstufen 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit 1 Konzept und Lernziele 1 Auf einen Blick: In diesem Protokoll werden einfache
Nichtmetalle mit Sauerstoff und mit Luft
 Schulversuchspraktikum Lars Lichtenberg Sommersemester 2015 Klassenstufen 7 und 8 Nichtmetalle mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Das folgende
Schulversuchspraktikum Lars Lichtenberg Sommersemester 2015 Klassenstufen 7 und 8 Nichtmetalle mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Das folgende
Qualitativer Nachweis von Säuren und Basen
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 9 & 10 Qualitativer Nachweis von Säuren und Basen Kurzprotokoll Auf einen Blick: In diesem Protokoll wird ein Lehrerversuch, der
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 9 & 10 Qualitativer Nachweis von Säuren und Basen Kurzprotokoll Auf einen Blick: In diesem Protokoll wird ein Lehrerversuch, der
Schulversuchspraktikum. Miriam Jarrar. Sommersemester Klassenstufen 7 & 8. Korrosion
 Schulversuchspraktikum Miriam Jarrar Sommersemester 2012 Klassenstufen 7 & 8 Korrosion 1 Kontext und Ziele 1 Auf einen Blick: Dieses Protokoll beinhaltet 2 Lehrerversuche und 4 Schülerversuche für die
Schulversuchspraktikum Miriam Jarrar Sommersemester 2012 Klassenstufen 7 & 8 Korrosion 1 Kontext und Ziele 1 Auf einen Blick: Dieses Protokoll beinhaltet 2 Lehrerversuche und 4 Schülerversuche für die
Schulversuchspraktikum. Friederike Kellner. Sommersemester Klassenstufen 11 & 12. Alkanone
 Schulversuchspraktikum Friederike Kellner Sommersemester 2014 Klassenstufen 11 & 12 Alkanone 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Die im Folgenden vorgestellte Unterrichtseinheit
Schulversuchspraktikum Friederike Kellner Sommersemester 2014 Klassenstufen 11 & 12 Alkanone 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Die im Folgenden vorgestellte Unterrichtseinheit
Reaktionen von Metallen mit Sauerstoff und mit Luft; Zerteilungsgrad
 Schulversuchspraktikum Mona-Christin Maaß Sommersemester 2013 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft; Zerteilungsgrad 1 Beschreibung des Themas und zugehörige Lernziele
Schulversuchspraktikum Mona-Christin Maaß Sommersemester 2013 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft; Zerteilungsgrad 1 Beschreibung des Themas und zugehörige Lernziele
Energie und Energieumwandlung
 Schulversuchspraktikum Maximilian Wolf Sommersemester Klassenstufen 7 & 8 Energie und Energieumwandlung Kurzprotokoll Auf einen Blick: In Versuch 1 werden Lycopodium-Sporen (Bärlapp) in der Gasbrennerflamme
Schulversuchspraktikum Maximilian Wolf Sommersemester Klassenstufen 7 & 8 Energie und Energieumwandlung Kurzprotokoll Auf einen Blick: In Versuch 1 werden Lycopodium-Sporen (Bärlapp) in der Gasbrennerflamme
Nährstoffe und Nahrungsmittel
 1 Weitere Lehrerversuche Schulversuchspraktikum Annika Nüsse Sommersemester 2016 Klassenstufen 5 & 6 Nährstoffe und Nahrungsmittel Kurzprotokoll 1 Weitere Lehrerversuche Auf einen Blick: Der Lehrerversuch
1 Weitere Lehrerversuche Schulversuchspraktikum Annika Nüsse Sommersemester 2016 Klassenstufen 5 & 6 Nährstoffe und Nahrungsmittel Kurzprotokoll 1 Weitere Lehrerversuche Auf einen Blick: Der Lehrerversuch
Reaktion von Nichtmetallen mit Sauerstoff und mit Luft
 Schulversuchspraktikum Isabel Böselt Sommersemester 2014 Klassenstufen 7 & 8 Reaktion von Nichtmetallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Schulversuchspraktikum Isabel Böselt Sommersemester 2014 Klassenstufen 7 & 8 Reaktion von Nichtmetallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Wasser als Lösungsmittel
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 5 & 6 Wasser als Lösungsmittel 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die Versuche zum Thema Wasser
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 5 & 6 Wasser als Lösungsmittel 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die Versuche zum Thema Wasser
Klassischer Redoxbegriff
 Schulversuchspraktikum Elena von Hoff Sommersemester 2014 Klassenstufen 7&8 Klassischer Redoxbegriff (Affinitätsreihe) 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Diese Unterrichtseinheit
Schulversuchspraktikum Elena von Hoff Sommersemester 2014 Klassenstufen 7&8 Klassischer Redoxbegriff (Affinitätsreihe) 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Diese Unterrichtseinheit
Schulversuchspraktikum. Name: Jennifer Kölling. Sommersemester: Klassenstufen: 7/8. Sauerstoff. Das Gas des Lebens
 Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 7/8 Sauerstoff Das Gas des Lebens 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:. Die Themeneinheit
Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 7/8 Sauerstoff Das Gas des Lebens 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:. Die Themeneinheit
Gefahrenstoffe. 7 Bechergläser (100 ml), 1 Becherglas (1 L), Spatel, Wasser, Messzylinder, Glaswanne, Kartoffel
 1.1 Zersetzung von H 2O 2 mithilfe verschiedener Katalysatoren [4] Der Zerfall von Wasserstoffperoxid kann mithilfe vieler verschiedener Katalysatoren beschleunigt werden. In diesem Versuch sollen einige
1.1 Zersetzung von H 2O 2 mithilfe verschiedener Katalysatoren [4] Der Zerfall von Wasserstoffperoxid kann mithilfe vieler verschiedener Katalysatoren beschleunigt werden. In diesem Versuch sollen einige
Chemische Gesetzmäßigkeiten I Erhaltung der Masse und konstante Proportionen. Kurzprotokoll. Schulversuchspraktikum.
 Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 7 & 8 Chemische Gesetzmäßigkeiten I Erhaltung der Masse und konstante Proportionen Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll
Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 7 & 8 Chemische Gesetzmäßigkeiten I Erhaltung der Masse und konstante Proportionen Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll
Energie, Energieumwandlung, exotherme und endotherme Reaktionen
 Schulversuchspraktikum Tatjana Müller Sommersemester 2017 Klassenstufen 7 & 8 Energie, Energieumwandlung, exotherme und endotherme Reaktionen Auf einen Blick: In diesem Protokoll werden verschiedene Versuche
Schulversuchspraktikum Tatjana Müller Sommersemester 2017 Klassenstufen 7 & 8 Energie, Energieumwandlung, exotherme und endotherme Reaktionen Auf einen Blick: In diesem Protokoll werden verschiedene Versuche
Arbeitsblatt Sollte eine Wasserflasche aus Glas im Gefrierfach gekühlt werden?
 Arbeitsblatt Sollte eine Wasserflasche aus Glas im Gefrierfach gekühlt werden? Beschrifte die Kästchen mit je einem Aggregatzustand. Benenne die Nummern, es handelt sich dabei um Fachbegriffe für die Übergänge
Arbeitsblatt Sollte eine Wasserflasche aus Glas im Gefrierfach gekühlt werden? Beschrifte die Kästchen mit je einem Aggregatzustand. Benenne die Nummern, es handelt sich dabei um Fachbegriffe für die Übergänge
Erweiterter Redoxbegriff (Einführung)
 Schulversuchspraktikum Sissy Freund Sommersemester 2013 Klassenstufen 7 & 8 Erweiterter Redoxbegriff (Einführung) 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Die Versuche in diesem
Schulversuchspraktikum Sissy Freund Sommersemester 2013 Klassenstufen 7 & 8 Erweiterter Redoxbegriff (Einführung) 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Die Versuche in diesem
Merkmale einer chemischen Reaktion
 Schulversuchspraktikum Sina Bachsmann Sommersemester Klassenstufen 7 & 8 Merkmale einer chemischen Reaktion 1 Lehrerversuche 1 Auf einen Blick: Dieses Protokoll enthält zwei Lehrerversuche und drei Schülerversuche
Schulversuchspraktikum Sina Bachsmann Sommersemester Klassenstufen 7 & 8 Merkmale einer chemischen Reaktion 1 Lehrerversuche 1 Auf einen Blick: Dieses Protokoll enthält zwei Lehrerversuche und drei Schülerversuche
Gefahrenstoffe. P: Zinknitrat-Hexahydrat-Lösung H: P:
 Redoxreihe Der Versuch führt den SuS vor Augen, dass sich nicht jedes Metall von jeder Metallsalz-Lösung oxidieren lässt, sondern dass es viel mehr eine experimentell zu ermittelnde Gesetzmäßigkeit dahintersteckt.
Redoxreihe Der Versuch führt den SuS vor Augen, dass sich nicht jedes Metall von jeder Metallsalz-Lösung oxidieren lässt, sondern dass es viel mehr eine experimentell zu ermittelnde Gesetzmäßigkeit dahintersteckt.
Schulversuchspraktikum. Rainer Mucha. Sommersemester Klassenstufen 7 & 8. Sauerstoff
 Schulversuchspraktikum Rainer Mucha Sommersemester 2013 Klassenstufen 7 & 8 Sauerstoff Auf einen Blick: In diesem Protokoll sollen Versuche zu Sauerstoff vorgestellt werden. Dabei werden zwei Lehrer- und
Schulversuchspraktikum Rainer Mucha Sommersemester 2013 Klassenstufen 7 & 8 Sauerstoff Auf einen Blick: In diesem Protokoll sollen Versuche zu Sauerstoff vorgestellt werden. Dabei werden zwei Lehrer- und
Reaktion von Metallen und Nichtmetallen mit Sauerstoff
 Schulversuchspraktikum Sommersemester 2016 Klassenstufen 7 & 8 Reaktion von Metallen und Nichtmetallen mit Sauerstoff Auf einen Blick: Das Protokoll,,Reaktion von Metall und Nichtmetall mit Sauerstoff
Schulversuchspraktikum Sommersemester 2016 Klassenstufen 7 & 8 Reaktion von Metallen und Nichtmetallen mit Sauerstoff Auf einen Blick: Das Protokoll,,Reaktion von Metall und Nichtmetall mit Sauerstoff
Schulversuchspraktikum. Sommersemester 2014 Klassenstufen 7 & 8. Reaktionen von Metallen mit Sauerstoff und mit Luft.
 Schulversuchspraktikum Sommersemester 2014 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft Zerteilungsgrad 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Schulversuchspraktikum Sommersemester 2014 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft Zerteilungsgrad 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
GEO UE 1 Quantifizierbare Eigenschaften Jahrgang 7
 GEO UE 1 Quantifizierbare Eigenschaften Jahrgang 7 Bezug zu den Themenfeldern Stoffe besitzen quantifizierbare Eigenschaften Ziel der Einheit Die SuS erkennen, dass reine Stoffe feste Eigenschaften besitzen.
GEO UE 1 Quantifizierbare Eigenschaften Jahrgang 7 Bezug zu den Themenfeldern Stoffe besitzen quantifizierbare Eigenschaften Ziel der Einheit Die SuS erkennen, dass reine Stoffe feste Eigenschaften besitzen.
Schulversuchspraktikum. Sommersemester Klassenstufen 7 & 8. Vom Erz zum Metall. (oxidische und sulfidische Erze)
 Schulversuchspraktikum Sommersemester 2014 Klassenstufen 7 & 8 Vom Erz zum Metall (oxidische und sulfidische Erze) Auf einen Blick: In der 7./8. Klasse wird noch statt von Redoxreaktionen von Sauerstoffübertragungsreaktionen
Schulversuchspraktikum Sommersemester 2014 Klassenstufen 7 & 8 Vom Erz zum Metall (oxidische und sulfidische Erze) Auf einen Blick: In der 7./8. Klasse wird noch statt von Redoxreaktionen von Sauerstoffübertragungsreaktionen
Korrosion und Korrosionsschtz
 Schulversuchspraktikum Christian Köhler Sommersemester 2016 Klassenstufen 7 & 8 Korrosion und Korrosionsschtz 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll stehen
Schulversuchspraktikum Christian Köhler Sommersemester 2016 Klassenstufen 7 & 8 Korrosion und Korrosionsschtz 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll stehen
11/2 Alles im Gleichgewicht Zuordnung der Kompetenzen aus dem KC Sek II
 Fachgruppe Chemie Kurshalbjahr 11/2 Alles im Gleichgewicht Stand SJ 2010/2011 11/2 Alles im Gleichgewicht Zuordnung der Kompetenzen aus dem KC Sek II Basiskonzept Stoff-Teilchen / unterscheiden anorganische
Fachgruppe Chemie Kurshalbjahr 11/2 Alles im Gleichgewicht Stand SJ 2010/2011 11/2 Alles im Gleichgewicht Zuordnung der Kompetenzen aus dem KC Sek II Basiskonzept Stoff-Teilchen / unterscheiden anorganische
Schulversuchspraktikum. Olga Streck. Sommersemester Klassenstufen 5 & 6. Papier
 Schulversuchspraktikum Olga Streck Sommersemester 2012 Klassenstufen 5 & 6 Papier 2 Auf einen Blick: Diese Unterrichtseinheit für die Klassen 5 & 6 enthält 2 Lehrerversuche und 2 Schülerversuche zum Thema
Schulversuchspraktikum Olga Streck Sommersemester 2012 Klassenstufen 5 & 6 Papier 2 Auf einen Blick: Diese Unterrichtseinheit für die Klassen 5 & 6 enthält 2 Lehrerversuche und 2 Schülerversuche zum Thema
Schulversuchspraktikum. Sommersemester Klassenstufen 5 & 6. Feuer und Kerzen
 Schulversuchspraktikum Sommersemester 2013 Klassenstufen 5 & 6 Feuer und Kerzen Text zuzuweisen, der hier Fehler! Verwenden Sie 2 Auf einen Blick: In diesem Protokoll werden sechs Versuche dargestellt,
Schulversuchspraktikum Sommersemester 2013 Klassenstufen 5 & 6 Feuer und Kerzen Text zuzuweisen, der hier Fehler! Verwenden Sie 2 Auf einen Blick: In diesem Protokoll werden sechs Versuche dargestellt,
Saure, neutrale und alkalische Lösungen
 Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen Kurzprotokoll Auf einen Blick: Das Protokoll enthält für die Klassen 5 und 6 einen Lehrerversuch
Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen Kurzprotokoll Auf einen Blick: Das Protokoll enthält für die Klassen 5 und 6 einen Lehrerversuch
Schwimmen, Schweben, Sinken
 Schulversuchspraktikum Patricia Hiller Sommersemester 2015 Klassenstufen 5 & 6 Schwimmen, Schweben, Sinken Kurzprotokoll Auf einen Blick: In diesem Kurzprotokoll werden weitere Versuche rund um das Thema
Schulversuchspraktikum Patricia Hiller Sommersemester 2015 Klassenstufen 5 & 6 Schwimmen, Schweben, Sinken Kurzprotokoll Auf einen Blick: In diesem Kurzprotokoll werden weitere Versuche rund um das Thema
V 1 Herstellung von Natriumchlorid
 1 V 1 Herstellung von Natriumchlorid In diesem Versuch wird Natriumchlorid, im Alltag als Kochsalz bekannt, aus den Edukten Natrium und Chlorgas hergestellt. Dieser Versuch ist eine Reaktion zwischen einem
1 V 1 Herstellung von Natriumchlorid In diesem Versuch wird Natriumchlorid, im Alltag als Kochsalz bekannt, aus den Edukten Natrium und Chlorgas hergestellt. Dieser Versuch ist eine Reaktion zwischen einem
Korrosion und Korrosionsschutz
 Schulversuchspraktikum Sommersemester 2013 Klassenstufen 11 & 12 Korrosion und Korrosionsschutz 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll werden ein Lehrerversuch
Schulversuchspraktikum Sommersemester 2013 Klassenstufen 11 & 12 Korrosion und Korrosionsschutz 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll werden ein Lehrerversuch
Chemische Gesetzmäßigkeiten I Erhaltung der Masse und konstante Proportionen
 Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 7 & 8 Chemische Gesetzmäßigkeiten I Erhaltung der Masse und konstante Proportionen 1 Beschreibung des Themas und zugehörige Lernziele
Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 7 & 8 Chemische Gesetzmäßigkeiten I Erhaltung der Masse und konstante Proportionen 1 Beschreibung des Themas und zugehörige Lernziele
Saure, neutrale und alkalische Lösungen
 Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen Auf einen Blick: Das Protokoll enthält für die Klassen 5 und 6 einen Lehrerversuch und
Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen Auf einen Blick: Das Protokoll enthält für die Klassen 5 und 6 einen Lehrerversuch und
Schulversuchspraktikum. Dennis Roggenkämper. Sommersemester Klassenstufen 5 & 6. Brandbekämpfung
 Schulversuchspraktikum Dennis Roggenkämper Sommersemester 2015 Klassenstufen 5 & 6 Brandbekämpfung 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Das Protokoll umfasst ein Lehrer-
Schulversuchspraktikum Dennis Roggenkämper Sommersemester 2015 Klassenstufen 5 & 6 Brandbekämpfung 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Das Protokoll umfasst ein Lehrer-
Schulversuchspraktikum. Isabelle Faltiska. Sommersemester Klassenstufen 11 & 12. Quantitative Analyse von. Kohlenwasserstoffen
 Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 11 & 12 Quantitative Analyse von Kohlenwasserstoffen 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Im Folgenden
Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 11 & 12 Quantitative Analyse von Kohlenwasserstoffen 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Im Folgenden
Qualitativer Nachweis von Säuren und Basen
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 9 & 10 Qualitativer Nachweis von Säuren und Basen 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 9 & 10 Qualitativer Nachweis von Säuren und Basen 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll
Gruppe I : Darstellung und Nachweis von Säuren
 Gruppe I : Darstellung und Nachweis von Säuren Behauptung: Säuren lassen sich durch die Reaktion von Nichtmetalloxiden mit Wasser darstellen. 1. Überprüfen Sie experimentell die aufgeführte Behauptung
Gruppe I : Darstellung und Nachweis von Säuren Behauptung: Säuren lassen sich durch die Reaktion von Nichtmetalloxiden mit Wasser darstellen. 1. Überprüfen Sie experimentell die aufgeführte Behauptung
Erscheinungsformen und Eigenschaften des Wassers
 Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 5 & 6 Erscheinungsformen und Eigenschaften des Wassers 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In
Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 5 & 6 Erscheinungsformen und Eigenschaften des Wassers 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In
Schulversuchspraktikum. Moritz Pemberneck. Sommersemester Klassenstufen 7 & 8. Fällungsreaktionen. Kurzprotokoll
 Schulversuchspraktikum Moritz Pemberneck Sommersemester 2016 Klassenstufen 7 & 8 Fällungsreaktionen Kurzprotokoll Auf einen Blick: In diesem Protokoll werden weitere Schülerversuche zum Thema Fällungsreaktionen
Schulversuchspraktikum Moritz Pemberneck Sommersemester 2016 Klassenstufen 7 & 8 Fällungsreaktionen Kurzprotokoll Auf einen Blick: In diesem Protokoll werden weitere Schülerversuche zum Thema Fällungsreaktionen
Schulversuchspraktikum. Jannik Nöhles. Sommersemester Klassenstufen 9 & 10. Erdalkalimetalle
 Schulversuchspraktikum Jannik Nöhles Sommersemester 2016 Klassenstufen 9 & 10 Erdalkalimetalle Auf einen Blick: Dieses Protokoll beinhaltet vier Versuche zum Thema Erdalkalimetalle für die 9. & 10. Klassenstufe.
Schulversuchspraktikum Jannik Nöhles Sommersemester 2016 Klassenstufen 9 & 10 Erdalkalimetalle Auf einen Blick: Dieses Protokoll beinhaltet vier Versuche zum Thema Erdalkalimetalle für die 9. & 10. Klassenstufe.
Vom Alkohol zum Alken
 1 Schulversuchspraktikum Olga Streck Sommersemester 2012 Klassenstufe 9 & 10 Vom Alkohol zum Alken 2 Auf einem Blick: Diese Unterrichtseinheit für die Klasse 9 & 10 enthält Lehrerversuche und 1 Schülerversuch
1 Schulversuchspraktikum Olga Streck Sommersemester 2012 Klassenstufe 9 & 10 Vom Alkohol zum Alken 2 Auf einem Blick: Diese Unterrichtseinheit für die Klasse 9 & 10 enthält Lehrerversuche und 1 Schülerversuch
Schulversuchspraktikum. Julia Müller. Klassenstufen 5/6. Feuer und Kerzen
 Schulversuchspraktikum Name Julia Müller Semester SoSe 2012 Klassenstufen 5/6 Feuer und Kerzen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Diese Unterrichtseinheit für die Klassenstufen
Schulversuchspraktikum Name Julia Müller Semester SoSe 2012 Klassenstufen 5/6 Feuer und Kerzen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Diese Unterrichtseinheit für die Klassenstufen
Verfahren zur Stofftrennung
 Schulversuchspraktikum Marie-Lena Gallikowski Sommersemester 2015 Klassenstufen 5 & 6 Reinstoffe und Stoffgemische Verfahren zur Stofftrennung Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll enthält
Schulversuchspraktikum Marie-Lena Gallikowski Sommersemester 2015 Klassenstufen 5 & 6 Reinstoffe und Stoffgemische Verfahren zur Stofftrennung Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll enthält
Erweiterung des Redoxbegriffs
 Schulversuchspraktikum Sissy Freund Sommersemester 2013 Klassenstufen 11 & 12 Erweiterung des Redoxbegriffs 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Dieses Protokoll beinhaltet
Schulversuchspraktikum Sissy Freund Sommersemester 2013 Klassenstufen 11 & 12 Erweiterung des Redoxbegriffs 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Dieses Protokoll beinhaltet
Schulversuchspraktikum. Name: Jennifer Kölling. Sommersemester: Klassenstufen: 9/10. Salze
 Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 9/10 Salze 1 Schulversuchspraktikum 1 Auf einen Blick:. Die Thematik der Salze ist sehr umfangreich. Die hier dargestellten
Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 9/10 Salze 1 Schulversuchspraktikum 1 Auf einen Blick:. Die Thematik der Salze ist sehr umfangreich. Die hier dargestellten
Endotherm und Exotherm
 Schulversuchspraktikum Sommersemester 2014 Klassenstufen 7 & 8 Endotherm und Exotherm 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Das Protokoll enthält 6 Versuche, 3 Schüler und
Schulversuchspraktikum Sommersemester 2014 Klassenstufen 7 & 8 Endotherm und Exotherm 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Das Protokoll enthält 6 Versuche, 3 Schüler und
Schulversuchspraktikum. Dennis Roggenkämper. Sommersemester Klassenstufen 11 & 12. Kohlenhydrate
 Schulversuchspraktikum Dennis Roggenkämper Sommersemester 2015 Klassenstufen 11 & 12 Kohlenhydrate 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Das Protokoll umfasst ein Lehrer-
Schulversuchspraktikum Dennis Roggenkämper Sommersemester 2015 Klassenstufen 11 & 12 Kohlenhydrate 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Das Protokoll umfasst ein Lehrer-
Schulversuchspraktikum Sebastian Gerke Sommersemester 2012 Klassenstufen 9 & 10. Die Brennstoffzelle
 Schulversuchspraktikum Sebastian Gerke Sommersemester 2012 Klassenstufen 9 & 10 Die Brennstoffzelle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll sind drei Lehrerversuche
Schulversuchspraktikum Sebastian Gerke Sommersemester 2012 Klassenstufen 9 & 10 Die Brennstoffzelle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll sind drei Lehrerversuche
Schulcurriculum Chemie - Jahrgang 7 (60 Std.)
 Schulcurriculum Chemie - Jahrgang 7 (60 Std.) Abkürzungen: F = Fachwissen E = Erkenntnisgewinnung K= Kommunikation B = Bewertung Unterrichtseinheit UE: Stoffe und ihre Eigenschaften (ca. 12 Stunden) ergänzend
Schulcurriculum Chemie - Jahrgang 7 (60 Std.) Abkürzungen: F = Fachwissen E = Erkenntnisgewinnung K= Kommunikation B = Bewertung Unterrichtseinheit UE: Stoffe und ihre Eigenschaften (ca. 12 Stunden) ergänzend
Schulcurriculum Chemie Klasse 7
 Schulcurriculum Chemie Klasse 7 Inhaltsfeld 1: Stoffe und Stoffveränderungen 3:Wasser und Luft 2: Stoff- und Energieumsätze bei chemischen Reaktionen 4: Metalle und Metallgewinnung Kl. Prozessbezogene
Schulcurriculum Chemie Klasse 7 Inhaltsfeld 1: Stoffe und Stoffveränderungen 3:Wasser und Luft 2: Stoff- und Energieumsätze bei chemischen Reaktionen 4: Metalle und Metallgewinnung Kl. Prozessbezogene
Säuren und Laugen im Haushalt
 Schulversuchspraktikum Maximilian Konrad Sommersemester 2012 Klassenstufen 9 & 10 Säuren und Laugen im Haushalt Auf einen Blick: Diese Unterrichtseinheit für die Klassen 9 und 10 enthält 2 Lehrerversuche,
Schulversuchspraktikum Maximilian Konrad Sommersemester 2012 Klassenstufen 9 & 10 Säuren und Laugen im Haushalt Auf einen Blick: Diese Unterrichtseinheit für die Klassen 9 und 10 enthält 2 Lehrerversuche,
Schulversuchspraktikum. Johanna Schakowske Sommersemester 2013 Klassenstufen 7 & 8. Aktivierungsenergie
 Schulversuchspraktikum Johanna Schakowske Sommersemester 2013 Klassenstufen 7 & 8 Aktivierungsenergie 1 Konzept und Ziele 1 Auf einen Blick: In diesem Protokoll sind SuS- uns LuL-Versuche aufgeführt, die
Schulversuchspraktikum Johanna Schakowske Sommersemester 2013 Klassenstufen 7 & 8 Aktivierungsenergie 1 Konzept und Ziele 1 Auf einen Blick: In diesem Protokoll sind SuS- uns LuL-Versuche aufgeführt, die
Thema: Die Luftbatterie
 Klasse: 9/10 Name: Datum: Thema: Die Luftbatterie Gefahrenstoffe Natriumchlorid - - Materialien: Graphit-Elektrode, Aluminium-Folie, Küchenpapier oder Handpapier, Pipette Chemikalien: Durchführung: Natriumchlorid-Lösung
Klasse: 9/10 Name: Datum: Thema: Die Luftbatterie Gefahrenstoffe Natriumchlorid - - Materialien: Graphit-Elektrode, Aluminium-Folie, Küchenpapier oder Handpapier, Pipette Chemikalien: Durchführung: Natriumchlorid-Lösung
Rost und Rostschutz. Oxidation: Fe Fe 2+ + 2 e - Reduktion: ½ O 2 + H 2 O + 2 e - 2 OH - Redoxgleichung: Fe + ½ O 2 + H 2 O Fe 2+ + 2 OH -
 Universität Regensburg Institut für Anorganische Chemie - Lehrstuhl Prof. Dr. A. Pfitzner Demonstrationsvortrag im Sommersemester 2010 23.06.2010 Dozentin: Dr. M. Andratschke Referenten: Schlichting, Matthias/Will,
Universität Regensburg Institut für Anorganische Chemie - Lehrstuhl Prof. Dr. A. Pfitzner Demonstrationsvortrag im Sommersemester 2010 23.06.2010 Dozentin: Dr. M. Andratschke Referenten: Schlichting, Matthias/Will,
Temperaturabhängigkeit, Schmelz- und Siedetemperatur
 Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit, Schmelz- und Siedetemperatur Auf einen 1 Beschreibung Blick: des Themas
Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit, Schmelz- und Siedetemperatur Auf einen 1 Beschreibung Blick: des Themas
Metalle und Nichtmetalle
 Schulversuchspraktium Bastian Hollemann Sommersemester 2015 Klassenstufen 9 & 10 Metalle und Nichtmetalle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Diese Unterrichtseinheit für
Schulversuchspraktium Bastian Hollemann Sommersemester 2015 Klassenstufen 9 & 10 Metalle und Nichtmetalle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Diese Unterrichtseinheit für
Schulversuchspraktikum. Dörte Hartje. Sommersemester 2013. Klassenstufen 7 & 8. Vom Erz zum Metall
 Schulversuchspraktikum Dörte Hartje Sommersemester 2013 Klassenstufen 7 & 8 Vom Erz zum Metall Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Dieses Protokoll enthält drei Lehrer- und
Schulversuchspraktikum Dörte Hartje Sommersemester 2013 Klassenstufen 7 & 8 Vom Erz zum Metall Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Dieses Protokoll enthält drei Lehrer- und
Die SuS erklären die Entstehung saurer Lösungen mit dem Konzept von Arrhenius als Dissoziation von Chlorwasserstoff zu Hydoniumionen und
 1 Arbeitsblatt Das Arbeitsblatt dient der Protokollierung und der Auswertung des Lehrerversuches V1. Während die Versuchsdurchführung und Versuchbeobachtung wenig strukturiert sind, da die SuS über diese
1 Arbeitsblatt Das Arbeitsblatt dient der Protokollierung und der Auswertung des Lehrerversuches V1. Während die Versuchsdurchführung und Versuchbeobachtung wenig strukturiert sind, da die SuS über diese
Verfahren zur Stofftrennung
 Schulversuchspraktikum Marie-Lena Gallikowski Sommersemester 2015 Klassenstufen 5 & 6 Reinstoffe und Stoffgemische Verfahren zur Stofftrennung Auf einen Blick: Dieses Protokoll enthält 3 Schülerversuche
Schulversuchspraktikum Marie-Lena Gallikowski Sommersemester 2015 Klassenstufen 5 & 6 Reinstoffe und Stoffgemische Verfahren zur Stofftrennung Auf einen Blick: Dieses Protokoll enthält 3 Schülerversuche
Wasserhärtebestimmung
 Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 9 & 10 Wasserhärtebestimmung Auf einen Blick: Im Folgenden wird ein Schüler- und ein Lehrerversuch zum Thema Wasserhärtebestimmung
Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 9 & 10 Wasserhärtebestimmung Auf einen Blick: Im Folgenden wird ein Schüler- und ein Lehrerversuch zum Thema Wasserhärtebestimmung
Arbeitsblatt Wie entstehen Farben?
 Arbeitsblatt Wie entstehen Farben? Der für das menschliche Auge sichtbare Wellenlängenbereich liegt bei 380-750 nm. Farbstoffe sind in der Lage bestimmte Wellenlängen des Lichts zu absorbieren und eine
Arbeitsblatt Wie entstehen Farben? Der für das menschliche Auge sichtbare Wellenlängenbereich liegt bei 380-750 nm. Farbstoffe sind in der Lage bestimmte Wellenlängen des Lichts zu absorbieren und eine
Rost und Rostschutz. Beobachtung: Nach wenigen Momenten steigt das Wasser im Glasröhrchen an.
 Universität Regensburg Institut für Anorganische Chemie Lehrstuhl Prof. Dr. A. Pfitzner Demonstrationsvortrag im Wintersemester 2010/2011 26.11.2010 Dozentin: Dr. M. Andratschke Referenten: Forster, Robert
Universität Regensburg Institut für Anorganische Chemie Lehrstuhl Prof. Dr. A. Pfitzner Demonstrationsvortrag im Wintersemester 2010/2011 26.11.2010 Dozentin: Dr. M. Andratschke Referenten: Forster, Robert
1.1 V 1 Überprüfung des Satzes von Hess mit der Reaktion von Calcium und Salzsäure
 1.1 V 1 Überprüfung des Satzes von Hess mit der Reaktion von Calcium und Salzsäure In diesem Versuch soll der Satz von Hess (die umgesetzte Wärmemenge ist bei einer chemischen Reaktion unabhängig vom Weg)
1.1 V 1 Überprüfung des Satzes von Hess mit der Reaktion von Calcium und Salzsäure In diesem Versuch soll der Satz von Hess (die umgesetzte Wärmemenge ist bei einer chemischen Reaktion unabhängig vom Weg)
Saure, neutrale und alkalische Lösungen
 Schulversuchspraktikum Sina Bachsmann Sommersemester 2014 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Im Folgenden
Schulversuchspraktikum Sina Bachsmann Sommersemester 2014 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Im Folgenden
Fluoreszierende organische Verbindungen
 Schulversuchspraktikum Moritz Pemberneck Sommersemester 2016 Klassenstufen 11, 12 und 13 Fluoreszierende organische Verbindungen 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem
Schulversuchspraktikum Moritz Pemberneck Sommersemester 2016 Klassenstufen 11, 12 und 13 Fluoreszierende organische Verbindungen 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem
Arbeitsblatt Wasserkreislauf der Erde
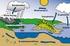 Arbeitsblatt Wasserkreislauf der Erde Aufgabe 1) Du hast im Unterricht bereits den Begriff des Aggregatzustands kennengelernt. Benenne die Übergänge zwischen den Aggregatzuständen, indem du die Pfeile
Arbeitsblatt Wasserkreislauf der Erde Aufgabe 1) Du hast im Unterricht bereits den Begriff des Aggregatzustands kennengelernt. Benenne die Übergänge zwischen den Aggregatzuständen, indem du die Pfeile
Arbeitsblatt zum Thema Einfache Messinstrumente
 Arbeitsblatt zum Thema Einfache Messinstrumente Das Flüssigkeitsthermometer dient zur Messung der Temperatur, welche in der Einheit Grad Celsius gemessen wird. Materialien: Chemikalien: Heizplatte, Stativ,
Arbeitsblatt zum Thema Einfache Messinstrumente Das Flüssigkeitsthermometer dient zur Messung der Temperatur, welche in der Einheit Grad Celsius gemessen wird. Materialien: Chemikalien: Heizplatte, Stativ,
Schulinternes Curriculum für Chemie 8.Schuljahr (Anfangsunterricht)
 Schulinternes Curriculum für Chemie 8.Schuljahr (Anfangsunterricht) Stoffe und ihre Eigenschaften kennen die Sicherheitsregeln im Chemieunterricht und beachten sie beim Experimentieren untersuchen Stoffe
Schulinternes Curriculum für Chemie 8.Schuljahr (Anfangsunterricht) Stoffe und ihre Eigenschaften kennen die Sicherheitsregeln im Chemieunterricht und beachten sie beim Experimentieren untersuchen Stoffe
