Synthese und Optimierung. sequenzselektiver künstlicher Rezeptoren. für biologisch relevante Oligopeptide
|
|
|
- Lars Meinhardt
- vor 6 Jahren
- Abrufe
Transkript
1 Synthese und ptimierung sequenzselektiver künstlicher Rezeptoren für biologisch relevante ligopeptide Dissertation zur Erlangung des naturwissenschaftlichen Doktorgrades der Bayerischen Julius-Maximilians- Universität Würzburg vorgelegt von Diplom Chemiker Daniel Rupprecht aus Köln Würzburg2006
2 Eingereicht am:... bei der Fakultät für Chemie und Pharmazie 1. Gutachter: Gutachter:... der Dissertation 1. Prüfer: Prüfer: Prüfer:... des Öffentlichen Promotionskolloquiums Tag des Öffentlichen Promotionskolloquiums:... Doktorurkunde ausgehändigt am:
3 Wo kämen wir hin, wenn alle sagten, wo kämen wir hin, und niemand ginge, um zu schauen, wohin man käme, wenn man ginge. Kurt Marti
4
5 Die vorliegende Dissertation wurde unter Anleitung von Prof. Dr. Carsten Schmuck von ovember 2002 bis September 2006 am Institut für rganische Chemie der Julius- Maximilians-Universität Würzburg angefertigt. Teilergebnisse der vorliegenden Arbeit sind an folgenden Stellen veröffentlicht worden oder zur Veröffentlichung eingereicht: Posterpräsentation auf der RCEM: Design, Synthesis and Physical Properties of an Artificial Receptor for D-Ala-D-Ala-, Bad auheim, Vortrag auf dem Joint Ph.D. Students Meeting des SFB 630 und SFB 544: ew Trends in Infectious Disease Research, Würzburg, C. Schmuck, D. Rupprecht, C. Urban,. Walden: Syntheses of rthogonally Protected Pyrrole Tricarboxylic Acid Derivatives: Versatile Building Blocks for Pyrrole Containing Compounds. Synthesis 2006, C. Schmuck, D. Rupprecht, W. Wienand: Sequence-Dependent Binding of Dipeptides by an Artificial Receptor in Water. Chem. Eur. J. 2006, online veröffentlicht am C. Schmuck, D. Rupprecht, M. Junkers, T. Schrader: Artificial Ditopic RGD Receptors J. rg. Chem. 2006, eingereicht.
6
7 Danke an Prof. Dr. C. Schmuck für die Möglichkeit der Promotion auf einem so interessanten Themengebiet wie der supramolekularen Chemie. Sein stetes Interesse und seine fachliche Unterstützung, sowie die unkomplizierte Art der wissenschaftlichen Kommunikation haben sehr zum Gelingen dieser Arbeit beigetragen. Besonders positiv ist zu bemerken, dass der Begriff der Freiheit der Forschung für ihn nicht nur eine leere Worthülse ist.... an den Fonds der Chemischen Industrie für die ideelle und finanzielle Unterstützung meiner Promotion.... an die analytische Abteilung des Instituts für rganische Chemie für die Durchführung und die ilfe bei der Interpretation von MR- (Frau E. Ruckdeschel und Dr. M. Grüne) und MS-Messungen (err F. Dadrich und Dr. M. Büchner). Ferner möchte ich Dr. R. Bertermann vom Institut für Anorganische Chemie für die MAS- MR-Messungen danken.... an die zahlreichen elfer aller hierarchischen Ebenen vom Praktikanten bis hin zum Professor, die ich hier aus Platzgründen nicht alle nennen kann.... an die Verwaltung und die Werkstatt des Instituts, besonders errn M. Braun und Dipl. Ing. (F) B. Brunner für prompte ilfestellung bei Problemen aller Art.... an Dipl. Chem.. Walden, Dipl. Chem. J. Dudaczek, Dipl. Chem. V. Bickert sowie errn M. Johannes, Dipl. Chem. U. Machon, Dipl. Chem. T. Rehm und Dr. M. Schwegmann für das Korrekturlesen dieser Arbeit.... an den gesamten Arbeitskreis Schmuck, insbesondere meinen Laborkollegen Dipl. Chem.. Walden, Dipl. Chem. V. Bickert, Dipl. Chem. M. Schiller und Dipl. Chem. C. Rether für eine stets sehr positive Atmosphäre beim Zusammensein innerhalb und außerhalb der Universität.... meinen Eltern und meiner Familie für ihren in vielfältiger Form geleisteten Beistand. Danke dass Ihr mir meinen Weg ermöglicht habt und dass Ihr mich von Zeit zu Zeit auch daran erinnert, was wirklich wichtig ist im Leben.... meinen Freunden an allen rten dieser Welt. Von den Würzburgern danke ich besonders Thorsten und Conny für mein zweites Zuhause in dieser Zeit. Außerdem verdienen La Katharina, Il Stefano, Kalle, Stefan, Tilly, Cuong, Mille, Glane, Flo, Matze, JB, Alex und Amela aus verschiedensten Gründen eine Erwähnung an dieser Stelle.
8
9 Inhaltsverzeichnis 1 EILEITUG 1 2 PRJEKT UD KZEPTI Zielstruktur 1: Der D-Ala-D-Ala-C-Terminus Antibiotika Vancomycin Zielstruktur 2: Das Tripeptid Arg-Gly-Asp (RGD) Zell-Zell- und Zell-Matrix-Erkennung Peptid-Mimetika Künstliche Peptidrezeptoren durch synthetische Derivatisierung von aturstoffen Künstliche Peptidrezeptoren durch klassisch-organische Synthese Künstliche Peptidrezeptoren durch kombinatorische Chemie Aufgabenstellung 1: Entwicklung eines künstlichen Rezeptor für das C-terminale Dipeptid D-Ala-D-Ala Carboxylatbindung durch Guanidinderivate Ein hydrophobes Bindungsmotiv für Methylreste Entwurf des Rezeptors Aufgabenstellung 2: Entwicklung eines künstlichen Rezeptors für die interne RGD-Sequenz Benzylische Bisphosphonate zur Argininerkennung Entwurf des Rezeptors Aufgabenstellung 3: Entwicklung eines Festphasenprotokolls zur ptimierung des internen Spacers für den RGD-Rezeptor 38 3 ERGEBISSE UD DISKUSSI Ein künstlicher Rezeptor für das C-terminale Peptid D-Ala-D-Ala Voruntersuchungen Methoden zur Bestimmung von Bindungskonstanten 44
10 II Inhaltsverzeichnis UV- und Fluoreszenzspektroskopie Bestimmung der Assoziationskonstanten von 1 und D-Ala-D-Ala Substratselektivität von Ein wasserlösliches Derivat des Rezeptors Bindungsstudien mit dem wasserlöslichen Rezeptor Ein künstlicher Rezeptor für die interne RGD-Sequenz Entwurf und Vorarbeiten Synthese von flexiblen RGD-Rezeptoren Bindungsstudien mit flexiblen RGD-Rezeptoren Entwurf eines rigiden RGD-Rezeptors Synthese des arylverbrückten RGD-Rezeptors Bindungsstudien mit dem arylverbrückten RGD-Rezeptor Entwicklung eines Festphasenscreenings für Guanidiniocarbonylpyrrolverbindungen Synthese der Pyrrolverbindungen Einfach geschützte Guanidine für die Festphasensynthese Synthese der geschützten Guanidiniocarbonylpyrrolverbindungen zur Immobilisierung Festphasensynthese 1: Der Einsatz der photospaltbaren Schutzgruppe Dmbc Festphasensynthese 2: Der Einsatz der Fmoc-Schutzgruppe Festphasensynthese 3: Der Einsatz der Cbz-Schutzgruppe ZUSAMMEFASSUG UD AUSBLICK SUMMARY AD UTLK EXPERIMETELLER TEIL Allgemeine experimentelle Bedingungen Generelle analytische Methoden Synthese der geschützten Guanidinverbindungen Synthese von Cbz-guanidin (73) Synthese von Fmoc-guanidiniumchlorid (151 Cl) Synthese von 3,5-Dimethoxybenzyl-4-nitrophenylcarbonat (158) 158
11 Inhaltsverzeichnis III Synthese von 3,5-Dimethoxybenzyloxycarbonylguanidin Cl (159 Cl) Synthesen bezüglich des künstlichen Rezeptors für D-Ala-D-Ala Charakterisierung des unsubstituierten Rezeptors Synthese von Ac-D-Ala-D-Lac- (27) Synthese von Boc-P/M-D-Ctb-(C 2 ) 2 Cbz (68) Synthese von 2-tert-Butyl-5-ethyl-3,4-bis(TEG-methyl)-1-pyrrol-2,5- dicarboxylat (72) Synthese von 5-(Benzyloxy)carbonyl-3,4-bis(TEG-methyl)-1-pyrrol- 2-carbonsäure (181) Synthese von tert-butyl-3,4-bis(teg-methyl)-5-(cbz-guanidino)carbonyl- 1-pyrrol-2-carboxylat (74) Synthese von 2-tert-Butyl-5-ethyl-3,4-bis(TBS-TEG-methyl)-1-pyrrol- 2,5-dicarboxylat (82) Synthese von 2-tert-Butyl-5-benzyl-3,4-bis(TEG-methyl)-1-pyrrol- 2,5-dicarboxylat (84) Synthese von 2-tert-Butyl-5-benzyl-3,4-bis(TBS-TEG-methyl)-1-pyrrol- 2,5-dicarboxylat (83) Synthese von 5-(Benzyloxy)carbonyl-3,4-bis(TEG-methyl)-1-pyrrol- 2-carbonsäure (86) Synthese von Benzyl-3,4-bis(TEG-methyl)-5-(Boc-guanidino)carbonyl-1pyrrol-2-carboxylat (88) Synthese von Benzyl-3,4-bis(TBS-TEG-methyl)-5-(Bocguanidino)carbonyl-1-pyrrol-2-carboxylat (79) Synthese von 3,4-Bis(TBS-TEG-methyl)-5-(Boc-guanidino)carbonyl-1pyrrol-2-carbonsäure (70) Synthese von {3,4-Bis(TBS-TEG-methyl)-5-(Boc-guanidino)carbonyl-1pyrrol-2-carbonyl}-{-P/M-D-Ctb- 2 } (80) Synthese von {3,4-Bis(TEG-methyl)-5-(Boc-guanidino)carbonyl-1pyrrol-2-carbonyl}-{-P/M-D-Ctb- 2 } (81) Synthese von {3,4-Bis(TEG-methyl)-5-(guanidinio)carbonyl-1-pyrrol- 2-carbonyl}-{-P/M-D-Ctb- 2 }-chlorid (2 Cl) Synthese des künstlichen Rezeptors für die RGD-Sequenz Synthese von {Boc-CBS}-{m-aminobenzoesäurebenzylester} (105) Synthese von {Boc-CBS}-{m-aminobenzoesäure} (106) Synthese von {Boc-CBS}-{m-aminobenzoesäure}- {3,5bis((dimethylphosphoryl)methyl)anilin} (107) 180
12 IV Inhaltsverzeichnis Synthese von {CBS}-{m-aminobenzoesäure}- {3,5bis((dimethylphosphoryl)methyl)anilin} (108 TFA) Synthese von {CBS}-{m-aminobenzoesäure}- {3,5bis((monomethylphosphoryl)methyl)anilin} (3 Et 3 ) Pyrrolsynthesen der Triesterroute Synthese von Methyl-4-acetyl-5-oxohexanoat (129) Synthese von Dibenzyl-2-hydroxyiminomalonat (132) Synthese von 4-(2-Methoxycarbonyl-ethyl)-3,5-dimethyl-1-pyrrol-2- carbonsäure-tert-butylester (134) Synthese von 3-(2-Methoxycarbonyl-ethyl)-4-methyl-1-pyrrol- 2,5-dicarbonsäure 5-tert-butylester (136) Synthese von Benzyl-4-(2-(benzyloxycarbonyl)ethyl)-3,5-dimethyl-1pyrrol-2-carboxylat (141) Synthese von Benzyl-4-(2-(methoxycarbonyl)ethyl)-3,5-dimethyl- 1-pyrrolcarboxylat (126) Synthese von 3-(2-(Benzyloxycarbonyl)ethyl)-5-(tert-butoxycarbonyl)- 4-methyl-1-pyrrol-2-carbonsäure (142) Synthese von 3,4-Dimethyl-4-(3-oxopropyl)-1pyrrolcarbonsäureethylester (143) Guanidinocarbonylpyrrole für die Festphasensynthese Synthese von tert-butyl-5-(cbz-guanidinocarbonyl)- 4-(2-(methoxycarbonyl)ethyl)-3-methyl-1-pyrrol-2-carboxylat (163) Synthese von tert-butyl-5-(cbz-guanidinocarbonyl)-4-(2-carboxyethyl)- 3-methyl-1-pyrrol-2-carboxylat (162) Synthese von tert-butyl-5-(dmbc-guanidinocarbonyl)- 4-(2-(methoxycarbonyl)ethyl)-3-methyl-1-pyrrol-2-carboxylat (164) Synthese von tert-butyl-5-(dmbc-guanidinocarbonyl)-4-(2-carboxyethyl)- 3-methyl-1-pyrrol-2-carboxylat (160) Synthese von 5-(Dmbc-guanidinocarbonyl)-4-(2-carboxyethyl)-3-methyl- 1-pyrrol-2-carbonsäure (171) Allgemeines Protokoll zur Reaktionsdurchführung und PLC-Analytik der Spaltung der Dmbc-Schutzgruppe Synthese von tert-butyl-5-(boc-guanidinocarbonyl)- 4-(2-(benzyloxycarbonyl)ethyl)-3-methyl-1-pyrrol-2-carboxylat (169) Synthese von 3-(2-((Methoxy)carbonyl)ethyl)-5-(tert-Butoxycarbonyl)- 4-methyl-1-pyrrol-2-carbonylguanidin Cl (167 Cl) 199
13 Inhaltsverzeichnis V Synthese von tert-butyl-5-(fmoc-guanidinocarbonyl)- 4-(2-(methoxycarbonyl)ethyl)-3-methyl-1-pyrrol-2-carboxylat (177) Allgemeines Protokoll zur Kontrolle der Stabilität von 177 und der Spaltung der Fmoc-Schutzgruppe mittels PLC-Analytik Synthese von 3-(2-((Benzyloxy)carbonyl)ethyl)-5-(tert-Butoxycarbonyl)- 4-methyl-1-pyrrol-2-carbonylguanidin TFA (168 TFA) Synthese von tert-butyl-5-(fmoc-guanidinocarbonyl)- 4-(2-((benzyloxy)carbonyl)ethyl)-3-methyl-1-pyrrol-2-carboxylat (165) Synthese von tert-butyl-5-(fmoc-guanidinocarbonyl)-4-(2-carboxyethyl)- 3-methyl-1-pyrrol-2-carboxylat (161) Synthese von (3-(2-Carbamoylethyl)-4-methyl)-CBS-Gly-Phe-Val- 2 Cl (178 Cl) Bindungsstudien Untersuchungen zu Löslichkeit von 1 Cl vs. Ac-D-Ala-D-Ala- (UV) vs. Ac-D-Ala-D-Ala- (Fluoreszenz) vs. Ac-Ala-Ala- (UV) vs. Ac-D-Ala-D-Lac- (UV) vs. Ac-D-Ala-Gly- (UV) vs. Ac-Gly-D-Ala- (UV) vs. Ac-D-Ala-D-Val- (Floureszenz) vs. Ac-D-Val-D-Ala- (UV) vs. Ac-Gly-Gly- (UV) vs. Ac-RGD- 2 (UV) vs. Ac-RGD- 2 (Fluoreszenz) vs. Ac-RGD- 2 (UV) 214 Appendix A: Literaturverzeichnis Appendix B: Abkürzungsverzeichnis Appendix C: Lebenslauf
14
15 1 Einleitung Das Verständnis intermolekularer Wechselwirkungen ist für das Verständnis vieler chemischer und biologischer Prozesse von essentieller Bedeutung. Als besonders prominente Beispiele seien hier die Biowissenschaften, [1] in neuerer Zeit auch als Life Sciences bezeichnet, sowie die Materialwissenschaften [2] genannt. In beiden Bereichen gibt es zahlreiche Beispiele dafür, wie ein Effekt oder eine makroskopische Eigenschaft erst durch die Interaktion zwischen zwei oder mehreren Molekülen verursacht wird. Ebenso können viele Phänomene in der Komplexchemie durch nicht-kovalente Effekte erklärt werden. Der Begriff der Supramolekularen Chemie wurde von J. M. Lehn geprägt. Er definierte diese als Chemie der intermolekularen Bindung, die sich mit Strukturen und Funktionen von Einheiten, die durch Assoziation von zwei oder mehr chemischen Spezies gebildet werden, beschäftigt. [3] Lehn war einer der ersten, der die chemische Synthese benutzte, um maßgeschneiderte Moleküle herzustellen, deren Aggregationsverhalten in gewissem Maße vorhersagbar ist. Diese benutzte er zur Darstellung und Charakterisierung supramolekularer Konstrukte. Für die Entwicklung und den Gebrauch von Molekülen mit strukturspezifischen Wechselwirkungen von hoher Selektivität wurde Lehn, Pedersen und Cram 1987 der obelpreis für Chemie verliehen. [4] Ein Meilenstein für das Verständnis dieser Vorgänge wurde schon 1894 von E.. Fischer gesetzt. Er beschrieb die Bedeutung der Konfiguration der Enzyme für die Interaktion mit ihrem Zielsubstrat. In diesem Zusammenhang formulierte er das untrennbar mit seinem amen verbundene Schlüssel-Schloss-Prinzip. [5] Dieses Postulat hat bis heute seine Gültigkeit, beschreibt jedoch viele Vorgänge noch unzureichend, da es Enzym und Substrat als starre Gebilde betrachtet. Aus diesem Grunde wurde sein Konzept um den Begriff des induced fit erweitert. iermit wird berücksichtigt, dass in vielen Fällen die Konfiguration des isolierten Enzyms und des isolierten Substrates in Lösung nicht mit der im Komplex identisch ist. Um dieser Flexibilität Rechnung zu tragen, werden solche Vorgänge häufig auch mit der Metapher and und andschuh beschrieben. [6] Die Bedeutung der supramolekularen Kräfte in der atur wird auch bei der Betrachtung der Struktur des Tabakmosaikvirus deutlich. Dabei handelt es sich um einen Ribonukleinsäurestrang aus ca Basen, der von ca identischen üllproteinen umgeben ist. Die dreidimensionale Struktur des Virus wird erst durch die Ausbildung von Wasserstoffbrücken erreicht, die den Ribonukleinsäurestrang in einer helikalen
16 2 Einleitung Struktur stabilisieren. Um diese elix herum werden die üllproteine ebenfalls durch nicht-kovalente Wechselwirkungen fixiert. Die DA-Doppelhelix ist ein weiteres Beispiel dafür, wie eine hoch komplexe dreidimensionale Struktur erst durch die Assoziation von zwei komplementären DA-Strängen, also durch supramolekulare Wechselwirkungen stabilisiert wird. Abbildung 1.1: Links: Struktur des Tabakmosaikvirus. Der Ribonukleinsäurestrang ist in rot dargestellt, umgeben von den in blau dargestellten üllproteinen. Rechts: Eine DA-Doppelhelix. Wenn zwei oder mehrere identische Moleküle ein Aggregat bilden, spricht man von Selbstassoziation. Bilden unterschiedliche Moleküle ein Aggregat, so wird häufig der Begriff der molekularen Erkennung verwendet. Dabei wird ein Substrat erkannt, welches ideal in eine Bindungsstelle eines Rezeptors passt, und durch die Assoziation einen Effekt auslöst. Die Komplementarität der beiden Partner spielt in diesen Prozessen eine entscheidende Rolle, so wie ein passender Schlüssel komplementär zu seinem Schloss ist. Beispielsweise löst das Acetylcholin in der postsynaptischen Endung einen elektrischen Reiz aus, indem es von einem Transmembranprotein erkannt wird. Das Protein induziert nach der Erkennung des Acetylcholins einen atrium- bzw. Calciumeinstrom in die Zellen und verursacht dadurch ein elektrisches Membranpotential. Eine besonders exponierte Rolle in diesen Mechanismen übernehmen die Peptide. Deren molekulare Erkennung spielt eine entscheidende Rolle in vielen biologischen Vorgängen. Eine Übersicht über diese Prozesse gibt die Abbildung 1.2.
17 Einleitung 3 Zell-Zell-Erkennung RGD-Schleife Antibiotika Vancomycin Immunabwehr MC-Proteine Peptide Stoffwechsel ormone, Enzyme Tier- & Pflanzengifte Schlangengift Zellwachstum Ras, p53 Abbildung 1.2: Beispiele für Prozesse, bei denen die molekulare Erkennung von Peptiden eine Rolle spielt. Die stärkste bekannte supramolekulare Wechselwirkung ist die Metall-Ligand- Wechselwirkung. Bei der Erkennung von Proteinen bedient sich die atur zwar auch, aber keineswegs in allen Fällen dieser Wechselwirkung. ur ungefähr die älfte aller Enzyme ist metallabhängig. Weitere für die supramolekulare Chemie wichtige Wechselwirkungen sind die Wasserstoffbrückenbindung, die Kation-π-Wechselwirkung und die hydrophobe Wechselwirkung. Von besonderer Bedeutung ist das Zusammenspiel all dieser Beiträge, um aus vielen kleinen Effekten eine starke Wechselwirkung zu erzielen. In diesem Zusammenhang spricht man auch vom Gulliver-Prinzip. [7,8] Synthetische Rezeptoren sind Moleküle, die eine zu ihrem Zielsubstrat komplementäre Struktur aufweisen. Diese Moleküle können prinzipiell auch durch ein rationales Design entworfen werden, wenn die Struktur der Zielmoleküle bekannt ist. In diesem Fall spricht man auch von maßgeschneiderten Rezeptoren. Derartige Verbindungen könnten in der Lage sein, in biologische Prozesse einzugreifen. Ziel dieser Arbeit ist der Einsatz der organisch-chemischen Synthese zur Entwicklung und ptimierung solcher Rezeptoren für biologisch relevante ligopeptide. Sollten sich effektive und selektive künstliche Rezeptoren für derartige Moleküle finden lassen, so ist langfristig der Einsatz dieser Moleküle auch in vivo zur Beeinflussung physiologischer Prozesse denkbar. [9] Vor allem aber soll diese Arbeit dazu beitragen, die Grundlagen der supramolekularen Wechselwirkungen besser zu verstehen. Ein besseres Verständnis dieser Effekte ermöglicht auch ein besseres Verständnis der biologischen Prozesse, denen diese Effekte zugrunde liegen. Dies ist die Voraussetzung einer möglichen Beeinflussung der biologischen Abläufe, was in letzter Konsequenz zu neuartigen Medikamenten führen kann. Eine Erweiterung dieses Verständnisses ist auptziel der vorliegenden Arbeit.
18 2 Projekt und Konzeption Die vorliegende Arbeit besteht aus drei Teilen. Der erste Teil beschäftigt sich mit dem Design, der Synthese und der Charakterisierung eines künstlichen Rezeptors für den peptidischen D-Alanin-D-Alanin-C-Terminus. Dieser spielt eine entscheidende Rolle im Wirkmechanismus des Antibiotikums Vancomycin. Der zweite Teil widmet sich der Entwicklung eines Rezeptormoleküls für die Tripeptidsequenz Arg-Gly-Asp (RGD). Diese ist ebenfalls von großer biologischer Bedeutung, beispielsweise für die Zell-Zell- Erkennung. Zunächst werden die beiden Zielstrukturen vorgestellt und erläutert, warum sie für diese Arbeit ausgewählt wurden. Danach wird ein Überblick über den Stand der Forschung gegeben. Dann wird der konzeptionelle Ansatz zur Entwicklung dieser beiden Rezeptoren erläutert. In einem dritten Teil soll ein kombinatorisches Festphasenprotokoll zur ptimierung solcher Rezeptoren entwickelt werden. 2.1 Zielstruktur 1: Der D-Ala-D-Ala-C-Terminus Antibiotika Seit der Entdeckung des Penicillins durch Fleming im Jahre 1928 wurde eine Vielzahl von Antibiotika entwickelt, die Bakterien entweder töten (bakteriozid) oder ihr Wachstum hemmen bzw. zum Stillstand bringen (bakteriostatisch). Die meisten dieser Wirkstoffe sind aturstoffe und wurden durch die Untersuchung von Bodenproben entdeckt. Bis zum Ende des 20. Jahrhunderts waren die Fluorochinolone (z. B. Ciprofloaxin ) die einzige bedeutende Klasse von Antibiotika, die totalsynthetisch zugänglich waren. [10] In den ersten Jahrzehnten nach ihrer Entdeckung wurde eine Vielzahl von verschiedenen Antibiotika gefunden und durch Modifikation bekannter Strukturen konnten Medikamente der zweiten und dritten Generation entwickelt werden. So entstand noch vor einigen Jahren der Eindruck, dass das Problem der infektiösen Erkrankungen mit den vorhandenen Medikamenten dauerhaft gelöst sei. Dementsprechend wenig wurde seitens der pharmazeutischen Industrie in die Entwicklung neuer Antibiotika investiert. Gleichwohl wurde bereits Ende der 90er Jahre klar, dass resistente Keime ein signifikantes Problem im Gesundheitswesen darstellen. [11] Diese Erkenntnis wurde 2002 noch bestärkt, als die ersten Stämme von Staphylococcus aureus bei einem Patienten aus Pennsylvania isoliert wurden, die vollständig gegen das Antibiotikum Vancomycin resistent waren. [12] Besonders alarmierend ist dies, da es sich bei Vancomycin um ein sogenanntes Reserveantibiotikum handelt. Diese werden zur Vermeidung von Resistenzbildungen nicht in
19 Projekt und Konzeption 5 der Therapie normaler Infektionen eingesetzt, sondern kommen nur bei schweren Infektionen mit gegen andere Antibiotika unempfindlichen Keimen zur Anwendung. Darüber hinaus hat Vancomycin starke ebenwirkungen, was ein weiterer Grund dafür ist, dass es nur in Ausnahmefällen zum Einsatz kommt. Ein gutes Antibiotikum muss das Bakterium effektiv bekämpfen, ohne negative Effekte auf seinen Wirt, den Patienten, auszuüben. Ziel des Wirkmechanismus eines Antibiotikums sollte daher ein Prozess sein, der entweder nur im Bakterium vorhanden ist oder aber sich im prokaryotischen Bakterium signifikant von dem des eukaryotischen Wirtes unterscheidet. ach diesen Überlegungen bieten sich drei auptangriffspunkte für Antibiotika an: Erstens die Zellwandbiosynthese, welche im menschlichen rganismus nicht vorhanden ist, zweitens die Proteinbiosynthese, die sich ebenso wie der dritte Angriffspunkt, die DA-Replikation bzw. -Reparatur im Bakterium von der im menschlichen rganismus unterscheidet. Für jeden dieser drei Prozesse existieren effektive Wirkstoffe, die im humanmedizinischen Bereich zum Einsatz kommen. Abbildung 2.1: Schema einer bakteriellen Zelle mit möglichen Angriffspunkten für antibiotisch wirksame Substanzen. Die bakterielle Zellwand besteht aus Polysacchariden, die zusätzlich über Peptidstränge quervernetzt sind. Es handelt sich also um eine Peptidoglycanschicht. Ihre Biosynthese ist für Bakterien essentiell, um osmotischen Drücken in sich ändernden Medien standzuhalten. In diesem Prozess ist das Enzym Transpeptidase wichtig, welches die Knüpfung einer Zellwand-stärkenden Bindung katalysiert. ier greift die bekannteste Klasse der Antibiotika, die Penicilline, ein. Sie werden von der Transpeptidase koordiniert und bilden dann eine kovalente Bindung zum aktiven Zentrum des Proteins. Dadurch wird das aktive Zentrum blockiert und das Enzym deaktiviert.
20 6 Projekt und Konzeption Die beiden anderen von Antibiotika inhibierten Mechanismen finden sich zwar auch im menschlichen rganismus, unterscheiden sich dort aber von denen im Bakterium. Auch für diese Prozesse wurden Verbindungen gefunden, die im Bakterium inhibierend wirken, ohne die humanen Prozesse signifikant zu stören. Die Wirkmechanismen von Antibiotika sind somit sehr verschieden, dies spiegelt sich auch in der strukturellen Diversität der chemischen Verbindungen wider. F Penicillin G (ein β-lactam) S C C Et Me Me 2 Ciprofloaxin (ein Fluorochinolon) Erythromycin A (ein Makrolid) Abbildung 2.2: Strukturformeln von drei exemplarisch ausgewählten Antibiotika. Eine schnelle Generationsfolge sowie eine hohe Mutationsrate erlauben den Bakterien jedoch innerhalb einer (für den Menschen) kurzen Zeit durch evolutive Selektion Resistenzmechanismen zu entwickeln. Bei diesen Zeiträumen handelt es sich eher um Tage und Monate als um Jahre. [13] Um Resistenzen auszubilden, greifen die Mikroben auf verschiedene Strategien zurück. Die wohl einfachste dabei ist die Zerstörung des Antibiotikums durch chemische Inaktivierung. Diese findet bei den Penicillinen Anwendung. Die Mikrobe exprimiert ein Protein, die β-lactamase, welche den Lactamring im Penicillin öffnet. Das so veränderte Molekül ist für das Bakterium unschädlich. [14] Eine andere Strategie ist es, das Antibiotikum von seinem Wirkort fernzuhalten. Diese wird vor allem bei Inhibitoren der Proteinbiosynthese sowie der DA-Replikation und -Reparatur eingesetzt. Für eine Inhibition dieser Prozesse muss der Wirkstoff erst in die Zelle hinein gelangen. Das Bakterium synthetisiert also Transmembranproteine, die als aktive Pumpen das Antibiotikum einfach wieder hinaus transportieren. [15] Auf diese Weise wird die Wirkstoffkonzentration innerhalb der Zelle auf einem unwirksamen iveau gehalten. Eine dritte Methode ist die Veränderung der vom Antibiotikum angegriffenen zellulären Zielstruktur im Bakterium selbst in einer Weise, die den Wirkmechanismus außer Kraft setzt. Dies ist eine Abwehrstrategie, die
21 Projekt und Konzeption 7 von Vancomycin-resistenten Keimen angewendet wird. Im folgenden Kapitel wird dieser Resistenzmechanismus genauer vorgestellt Vancomycin Eine häufig vorgenommene Klassifizierung für Bakterien ist die Unterscheidung zwischen Gram-positiven und Gram-negativen Stämmen. Diese Klassifizierung geht zurück auf den dänischen Bakteriologen. C. Gram, der zwischen 1883 und 1885 eine Methode entwickelte um Bakterienstämme anzufärben. Der Assay färbt die Zellwand an, die alle Bakterien auf ihrer inneren Zellmembran tragen. Bei der Zellwand handelt es sich um eine Peptidoglycanschicht. Gram-negative Bakterien verfügen über eine zusätzliche äußere Zellmembran, welche die Peptidoglycanschicht vom Medium trennt. In diesem Fall kann sie nicht von Grams Reagenz angefärbt werden. Abbildung 2.3: Alle Bakterien verfügen über eine Peptidoglycanschicht, diese wird bei Gramnegativen Bakterien von einer zweiten äußeren Zellmembran vom umgebenden Medium abgeschirmt. [16] Ausgangspunkt für die Biosynthese der Zellwand sind in der Zellmembran verankerte Disaccharideinheiten. Diese werden in einem ersten Schritt, katalysiert durch das Enzym Transglycosylase, zu einem Glycan verknüpft. Auf diesem Glycanstrang ist nun das Pentapeptid Ala-D-Glu-Lys-D-Ala-D-Ala (AqKaa) lokalisiert. Zur hinreichenden Stabilisierung der Zellwand ist die Quervernetzung der Peptidoglycanstränge erforderlich. Dies geschieht durch die Knüpfung einer Peptidbindung zwischen zwei AqKaa-Peptiden. Dabei greift die Aminogruppe der Seitenkette des Lysins des einen Peptides nucleophil in die Peptidbindung zwischen den C-terminalen D-Alaninresten des anderen Peptides ein. Diese Reaktion wird von der Transpeptidase katalysiert. Das terminale D-Alanin fungiert dabei als Abgangsgruppe.
22 8 Projekt und Konzeption D-Ala D-Ala L-Lys D-Glu L-Ala Transglycosylase 2 Ac P P Transpeptidase 11 Abbildung 2.4: Schematische Darstellung des Mechanismus der Synthese bakterieller Zellwände. Vancomycin inhibiert diese Quervernetzung, indem es den C-Terminus des AqKaa- Peptides wie ein andschuh umhüllt. Dadurch wird der nucleophile Angriff auf die Peptidbindung zwischen den C-terminalen Alaninresten und damit die Quervernetzung verhindert. Die Assoziationskonstante für den Komplex aus Vancomycin und seinem peptidischen Substrat wurde bei verschiedenen äußeren Bedingungen auf K a M -1 bestimmt. [17] Bei der wirksamen Spezies handelt es sich um ein omodimer aus zwei Vancomycineinheiten. Eine optimale Bindung findet in einem p-bereich statt, in dem ein sekundäres Amin im Vancomycin protoniert sowie die Carboxylateinheit im Substrat deprotoniert vorliegt. Dies ist ein erster inweis auf die Ausbildung einer ionischen Wechselwirkung zwischen diesen beiden Untereinheiten. [18] Die starke Bindung zwischen den beiden Partnern ist allerdings das Resultat aus einem komplexen Zusammenspiel von ionischen und hydrophoben Wechselwirkungen sowie Wasserstoffbrückenbindungen. Diese sind in dem starren Wirtsmolekül Vancomycin 4 in idealer Weise komplementär zum Substrat präorganisiert. [19] In Abbildung 2.5 ist der Komplex aus beiden skizziert. eben der bereits erwähnten ionischen Wechselwirkung zwischen dem Carboxylat des Peptides und dem sekundären Amin im Vancomycin ist ein Muster aus fünf Wasserstoffbrückenbindungen zu erkennen. Darüber hinaus trägt eine hydrophobe Wechselwirkung zwischen der Methylseitenkette des Kaa-Alanins und der Tris-Aryl-Untereinheit im nördlichen Teil des Vancomycin 4 zur Bindung bei.
23 Projekt und Konzeption 9 4 R Cl 4 R Cl 3 Cl Ac Cl Ac hydrophobe WW 2 2 elektrostatische WW 5 Abbildung 2.5: Die Komplexstruktur aus Vancomycin 4 und dem Tripeptid Ac-Lys-D-Ala-D-Ala- 5 als Modell für das C-terminale Ende des ligopeptides im Peptidoglycan. In rot sind die Wasserstoffbrückenbindungen eingezeichnet (links), außerdem ist die hydrophobe und die elektrostatische Wechselwirkung skizziert (rechts). Der Rest R ist in Abbildung 2.6 dargestellt. Um die Wachstumsinhibierung durch Vancomycin 4 zu umgehen, kann das Bakterium nun Veränderungen im Peptidoglycan vornehmen. So existieren Stämme von Staphylococcus aureus, die anstatt des C-terminalen D-Alanin (Ala) ein D-Lactat (Lac) inkorporieren. Die Glycopeptide sind isostrukturell und haben in vivo die gleiche Funktionalität. Es ist lediglich eine Amid- durch eine Ester-Funktion ersetzt worden, die Effekte auf die Wirksamkeit von Vancomycin sind jedoch drastisch. Eine zuvor attraktive Wechselwirkung wird zu einer repulsiven. Dies bewirkt eine Absenkung der Assoziationskonstante für den Komplex um den Faktor [20]
24 10 Projekt und Konzeption R Cl Cl 2 2 4: R = 2 C 2 3 Ac 6 Abbildung 2.6: Komplex aus Vancomycin 4 und dem Depsipeptid Ac-Lys-D-Ala-D-Lac- 6 als Modell für den D-Ala-D-Lac-Terminus. Eine attraktive wurde durch eine repulsive Wechselwirkung ersetzt. Künstliche Rezeptoren für diesen Peptid-C-Terminus könnten einen Beitrag zur Aufklärung leisten, wie groß die Anteile von Wasserstoffbrückenbindungen, hydrophober und elektrostatischer Wechselwirkung an der Gesamtbindungsstärke sind. Auf der Grundlage dieser Erkenntnisse könnten bestehende Moleküle so verändert werden, dass sie auch die veränderte Struktur effektiv koordinieren. Dies wäre ein großer Schritt hin zu Antibiotika mit Wirksamkeit gegen derart resistente Bakterienstämme. 2.2 Zielstruktur 2: Das Tripeptid Arg-Gly-Asp (RGD) Zell-Zell- und Zell-Matrix-Erkennung Die Erkennung und Wechselwirkung zwischen den Zellen bzw. zwischen Zellen und einer physiologischen Matrix ist für mehrzellige rganismen unabdingbar. Um eine selektive Wechselwirkung zu gewährleisten, ist es notwendig, dass die Zelle (bzw. die Matrix, mit der die Zelle wechselwirken soll) eindeutig identifizierbar ist. Sie muss sich also von anderen Substraten, die nicht Ziel einer Wechselwirkung sind, unterscheiden. Zu diesem Zweck trägt die Zelle auf ihrer berfläche eine Art Visitenkarte. Diese Funktion erfüllen in der atur verschiedene in der Membran verankerte Strukturen. äufig sind solche Funktionalitäten Saccharide, die von anderen Zellen erkannt werden können. Sie weisen durch ihre Art, Konformation und Sequenz eine große strukturelle Diversität auf. [21] Diese Saccharide können direkt in der Zellmembran verankert sein, indem sie kovalent an ein Lipid in der Membran gebunden sind. Sie können aber auch auf einem Transmembranprotein lokalisiert sein. Eine weitere Möglichkeit ist die
25 Projekt und Konzeption 11 direkte Erkennung von Teilen des Membranproteins, z. B. einer definierten Peptidsequenz. [22,23] Abbildung 2.7: Schema einer Zellmembran mit Transmembranproteinen. Die Identifizierung der Zelle erfolgt entweder über einen Saccharidrest (rot) oder direkt über Teile des Membranproteins (blau). Es gibt vier Klassen von Membranproteinen, die an den oben genannten Wechselwirkungen beteiligt sind: Die Cadherine, die Selektine, die Rezeptoren der Immunglobulin-Klasse und die Integrine. [24] Letztere werden im Folgenden kurz vorgestellt. Integrine sind Transmembranproteine, die sich heterodimer aus zwei Untereinheiten zusammensetzen. Diese Untereinheiten werden mit α und β bezeichnet. Es gibt 9 bekannte β- und 17 bekannte α-untereinheiten, die Kombination aus jeweils einer α- und einer β-einheit liefert eine große Zahl bekannter Integrine. Diese spielen eine wichtige Rolle in verschiedensten biologischen Prozessen, wie der Zell-Zell- und der Zell-Matrix-Adhäsion, dem Knochenwachstum und der Angiogenese (Bildung neuer Blutgefäße). [25] Dementsprechend viele Krankheiten korrelieren mit einer Fehlfunktion in diesem Steuerungssystem. An der Wechselwirkung mit den Integrinen sind verschiedene extrazelluläre Proteine beteiligt. Viele dieser Proteine tragen auf einer dem Lösemittel zugewandten Schleife die Tripeptidsequenz Arg-Gly-Asp (RGD), daher wird diese Sequenz oft auch als universelle Zellerkennungssequenz bezeichnet. [26]
26 12 Projekt und Konzeption 2 2 Arg Gly Asp Abbildung 2.8: Die universelle Zellerkennungssequenz Arginin-Glycin-Aspartat (RGD). Solche RGD-tragenden Proteine sind beispielsweise Kollagen, Fibronectin, Thrombospondin, Fibrinogen oder steospontin. [27] In all diesen Proteinen kommt die RGD-Sequenz vor, dennoch interagieren sie hoch selektiv mit dem jeweiligen Zielintegrin. Die Gründe dafür sind noch Gegenstand wissenschaftlicher Diskussionen, mögliche Ursachen sind die konformelle Rigidität der Sequenz und/oder die Abfolge der benachbarten Aminosäuren. Um in diese Prozesse eingreifen zu können, gibt es prinzipiell zwei verschiedene Ansätze. Zum einen ist es möglich, die RGD-Sequenz selbst nachzuahmen. Ein umgekehrter Ansatz ist die Entwicklung von Molekülen, die die RGD-Sequenz selektiv komplexieren. Solche Moleküle könnten in derartige Prozesse regulierend eingreifen, indem sie das Integrin kompetetiv inhibieren. 2.3 Peptid-Mimetika Am speziellen Beispiel der RGD-Schleife werden nun einige Ansätze zur achahmung von Peptiden vorgestellt. Die einfachste Methode, ein Peptid nachzuahmen, stellt die Verwendung von Teilen dieses Peptides dar. ft kann schon durch sehr kurze Peptidsequenzen ein Effekt erzielt werden, der sonst von dem sehr viel größeren Protein verursacht wird. So gelang beispielsweise die Besiedelung von Sepharosekügelchen durch Fibroblasten, indem auf der berfläche der Kügelchen RGD-haltige ligopeptide immobilisiert wurden. Umgekehrt können diese Zellen durch Zugabe von RGD-haltigen ligopeptiden zur umgebenden Lösung auch wieder abgelöst werden. Das einfachste wirksame Peptid stellte in dieser Studie das freie Tetrapeptid -Arg-Gly-Asp-Ser- dar. [28] In einer anderen Studie konnte von Samanen et al. mit einem noch kleineren Peptid ein mimetischer Effekt erzielt werden. Als Testsystem wurde hier das Fibrinogen gewählt. Dieses Protein wechselwirkt im Prozess der Blutplättchenaggregation mit den Integrinen. Bereits das rückgratgeschützte Tripeptid Ac-RGD- 2 inhibiert die Blutplättchenaggregation mit einer Inhibitorkonzentration von IC 50 = 138 μm. [29] Die freien ligopeptide zeichnen sich durch eine hohe konformative Flexibilität aus, was allerdings auch einen Mangel an Selektivität zur Folge hat. Kessler et al. gelang es durch Fixierung einer Konformation und die richtige Wahl an flankierenden
27 Projekt und Konzeption 13 Aminosäuren, einen hoch selektiven Inhibitor für das α v β 3 -Integrin herzustellen. [24] Das konformativ fixierte crgdfv 7 inhibiert das α v β 3 -Integrin mit einem IC 50 -Wert von 2 nm C 8 3 C Abbildung 2.9: RGD-Mimetika, die als α v β 3 -Antagonisten wirksam sind. Dargestellt ist das peptidische cyclo(-rgdfv-) 7 sowie ein nicht-peptidisches RGD-Mimetikum 8. Die Ähnlichkeit in Anordnung und Struktur des Carboxylates und der Guanidin(oiden)- Untereinheit ist erkennbar. Für pharmazeutische Anwendungen sind auch nicht-peptidische Strukturen von großem Interesse, da diese eine orale Applikation ermöglichen. Lineare Peptide werden im Verdauungstrakt oft von Proteasen gespalten und stehen dem rganismus dann nicht mehr zur Verfügung. Die Verbindung 8 ist nicht-peptidisch und daher von Proteasen nicht spaltbar, weist aber eine ähnlich hohe Selektivität und inhibitorische Aktivität gegenüber dem α v β 3 -Integrin auf. Die zentralen strukturellen Analogien, besonders was die achahmung der beiden funktionellen Seitenketten des Arginins und des Aspartats betrifft, sind leicht wieder zu erkennen. Für ein Derivat der Struktur 7 hat die Firma Merck KGaA die Zulassung als Krebsmedikament beantragt, derzeit befindet sich das Projekt in der klinischen Phase II. Die Firma GlaxoSmithKline besitzt ebenfalls ein Patent für ein cyclisches, RGD-haltiges Peptid, welches unter dem andelsnamen Integrilin als zugelassenes Medikament auf dem Markt ist. Integrilin inhibiert die Blutplättchenkoagulation und wird beispielsweise zur Behandlung von Angina pectoris und drohendem Myokardinfarkt eingesetzt. Jedoch spielt diese Peptidsequenz nicht nur in der Zell-Zell-Wechselwirkung eine große Rolle, auch in der Zell-Matrix-Wechselwirkung kann durch achahmen der RGD- Sequenz ein medizinischer Effekt erzielt werden. So gelang beispielsweise durch kovalente Anbindung von RGD-haltigen Peptiden auf Implantatoberflächen nicht nur das Vermeiden einer Abstoßungsreaktion, sondern es konnte sogar eine Besiedelung der Implantatoberfläche durch steoblasten induziert werden. [30] Diese Erfolge machen es um so interessanter, den umgekehrten Weg der Inhibierung der RGD-Sequenz durch künstliche Rezeptoren ebenfalls zu erforschen.
28 14 Projekt und Konzeption 2.4 Künstliche Peptidrezeptoren durch synthetische Derivatisierung von aturstoffen Bei der Entwicklung von künstlichen Rezeptoren für Peptide gibt es verschiedene Ansätze. Aus theoretischer Sicht ist der einfachste Ansatz die chemische Modifikation eines aturstoffes, der als Peptidrezeptor in der Praxis erfolgreich fungiert. Wenn der Bindungsmodus des Rezeptors bekannt ist, kann dieser an geeigneten Stellen so modifiziert werden, dass er auch andere Peptide binden kann. Beispielsweise ist das bereits vorgestellte Vancomycin 4 als Rezeptor für die C-terminale D-Ala-D-Ala- Sequenz bekannt (vgl. Abschnitt 2.1.2). Zur Umgehung eines bakteriellen Resistenzmechanismus wäre es von Interesse, auch die modifizierte C-terminale D-Ala-D-Lac- Sequenz zu binden. In Abbildung 2.10 ist der Komplex aus dem Vancomycin 4 und den beiden C-Termini erneut dargestellt. Für D-Ala-D-Lac ergibt sich mit einer zentralen Peptidbindung in Vancomycin eine repulsive Wechselwirkung. Des Weiteren sind drei Möglichkeiten einer chemischen Modifikation dargestellt, die diese repulsive Wechselwirkung eliminieren (a und b) oder durch eine attraktive Wechselwirkung ersetzen (c). 4: R = 9: R = 2 C 2 Cl R Cl 2 2 (a) (b) (c) 10 (R = ) 3 Ac X 5: X = 6: X = : Abbildung 2.10: Komplex aus Vancomycin 4 und dem C-Terminus D-Ala- D-Ala (5) bzw. D-Ala- D-Lac (6). Ferner sind drei mögliche Modifikationen der rot umrandeten zentralen Peptidbindungsstelle skizziert. Sowohl Evans et al. als auch icolaou et al. haben bereits chemische Totalsynthesen für Vancomycin 4 entwickelt. [31,32] Dies eröffnet prinzipiell die ption der strukturellen Variation. Die Synthese dieses komplizierten Moleküls ist jedoch aufwändig und vielstufig, was sich u. a. negativ auf die Gesamtausbeute auswirkt. Weiter erschwert wird sie durch unkonventionelle stereochemische Fragestellungen, wie die Arbeitsgruppe um Evans noch in der gleichen Ausgabe der Angewandten Chemie
29 Projekt und Konzeption 15 bemerkt. [33] Darüber hinaus können Änderungen der funktionellen Gruppen eine Konformationsänderung des gesamten Moleküls bewirken, so dass auch im Falle einer Wiederherstellung der betroffenen Wasserstoffbrückenbindung möglicherweise die Präorganisation des Gesamtmoleküls nicht mehr komplementär zum Zielpeptid ist. Boger et al. gelang trotz der eben genannten Probleme die Synthese eines im zentralen Bindungsmotiv derivatisierten Vancomycins. Dabei wurde nicht das riginalmolekül 4, sondern das Aglycon 9 untersucht. Es unterscheidet sich vom riginalmolekül lediglich durch das Fehlen eines peripheren Disaccharides. Durch chemische Totalsynthese wurde das nach Möglichkeit (a) derivatisierte Aglycon 10 erhalten. Ein Vergleich der Bindungsstärken dieses Moleküls mit dem Ursprungsmolekül 9 lieferte interessante Ergebnisse. Für den Komplex aus dem Derivat 10 und dem D-Ala-D-Ala-Terminus (5) ist eine im ursprünglichen Komplex vorhandene attraktive Wechselwirkung eliminiert. Das vermindert die Bindungskonstante um den Faktor 35. Für die Bindung zum D-Ala- D-Lac-Terminus (6) ist jedoch eine repulsive Wechselwirkung eliminiert. Dies erhöht die Assoziationskonstante um den Faktor stellt also ein Derivat dar, welches beide C-terminalen Peptidsequenzen ähnlich effektiv bindet. Eine Derivatisierung nach Möglichkeit (b) und insbesondere (c) wäre ein viel versprechender Ansatz für eine noch bessere Bindung des D-Ala-D-Lac-Terminus. Sie stellen aber eine anspruchsvolle erausforderung an die organische Synthese dar und bleiben Gegenstand aktueller Forschung. [34] Darüber hinaus existieren zahlreiche weitere Ansätze zur Synthese von Vancomycin- Analoga. Jedoch betreffen diese Modifikationen lediglich die Peripherie und greifen nicht in das zentrale Bindungsmotiv zur Komplexierung des C-terminalen D-Ala-D-Ala ein. Einige dieser Moleküle erzielen zwar eine gewisse Aktivität gegen multiresistente Stämme, jedoch bleibt die Wirkungsweise sowie die Bindungsstärke zum Zielpeptid völlig ungeklärt. [35,36,37,38] Künstliche Peptidrezeptoren durch klassisch-organische Synthese Zur effektiven und selektiven Bindung von Peptiden in polar-protischen Medien wie z. B. Wasser existieren relativ wenige Ansätze. Die meisten künstlichen Rezeptoren zur Komplexierung von Peptiden funktionieren nur in organischen Lösemitteln und basieren auf elektrostatischen Wechselwirkungen und Wasserstoffbrückenbindungen. Diese sind in solchen Medien wesentlich stärker als in wässriger Umgebung. Schneider et al. entwickelten einen Peptidrezeptor, dessen Bindungsstärke vor allem durch die Komplexierung der elektrostatisch geladenen Enden eines Peptides funktioniert. Zur Bindung der in neutraler Lösung positiv geladenen Ammoniumgruppe des -Terminus des Peptides befindet sich ein 18-Krone-6-Ether im Rezeptormolekül, während das
30 16 Projekt und Konzeption Carboxylat-Ende durch eine Salzbrücke zum ebenfalls im Rezeptor befindlichen quartären Ammoniumion gebunden wird. Durch die Verwendung eines vergleichsweise starren Spacers kann eine Längenselektivität erreicht werden. Durch zusätzliche Wechselwirkungen des Peptides mit dem Spacer wurde auch eine moderate Sequenzselektivität beobachtet. R 11: R = 12: R = S Abbildung 2.11: Peptidrezeptoren nach Schneider. Der vorgestellte Rezeptor 11 bindet bevorzugt Tripeptide. Die Bindungskonstanten konnten mittels MR-Titration in Methanol auf K a = (10-13) 10 3 M -1 bestimmt werden. Bei der Verwendung von Wasser als Lösemittel sinken die Bindungskonstanten drastisch auf K a = M -1. Verursacht wird diese Abnahme durch die Abschirmung der Ladungen in der ydrathülle des Wassers. Auch die Stärke der Salzbrücke sowie den Energiegewinn der Komplexierung durch den Kronenether wird auf diese Weise stark reduziert. Für den Rezeptor 12 wurden Fluoreszenztitrationen in Wasser durchgeführt. Die Bindungskonstanten sind insgesamt höher als die aus der MR- Titration erhaltenen. Ursache dafür ist unter anderem die niedrigere Konzentration der Lösungen bei einer Fluoreszenztitration. Dadurch nimmt die Ionenstärke der Lösung ab und die ionischen Wechselwirkungen zwischen Rezeptor und Substrat werden gestärkt. Darüber hinaus werden Substrate, die in der Lage sind, π-wechselwirkungen mit dem Dansylrest des Rezeptors 12 auszubilden, deutlich besser gebunden. So wird beispielsweise das Tripeptid -Phe-Gly-Gly- in Wasser von 11 mit K a = 135 M -1 (erhalten aus einer MR-Titration) und von 12 mit K a = 220 M -1 (erhalten aus einer Fluoreszenztitration) gebunden. [39] Einen anderen Ansatz wählen Mizutani et al. mit der Verwendung von Zink-Porphyrin- Molekülen zur Komplexierung von Peptiden. Die Bindungsstärke dieser Rezeptoren beruht zum einen auf einer hydrophoben Wechselwirkung des Porphyringerüstes mit den aromatischen Substrukturen der von Mizutani verwendeten Substrate, vor allem aber auf der metallischen Wechselwirkung des Zinks mit Lewis-Basen, also dem freien -Terminus oder den verwendeten istidin-seitenketten in den Substraten.
31 Projekt und Konzeption 17 R = (C 2 ) 10 C 2 K R' R' R' = C 2 K R' R' R' R R R R Zn R R R R Zn R R R R R' R R Zn R R R R Zn R R R' R' R' R' Abbildung 2.12: Peptidrezeptoren nach Mizutani. Diese Rezeptoren binden ausgewählte, istidin-haltige Di- und Tripeptide mit Bindungskonstanten von K a = M -1 in gepuffertem Wasser. [40] Allerdings weisen die zu erkennenden Peptide, ebenso wie bei den Rezeptoren nach Schneider einen freien -Terminus auf. Diese Ansätze sind für die Erkennung von internen oder C-terminalen Peptidsequenzen ungeeignet. Eine weitere Möglichkeit zur molekularen Erkennung von Peptiden besteht in der Ausbildung von β-faltblattstrukturen. Diesen Weg wählten Kelly et al. mit dem Chelatrezeptor 15. Der Rezeptor ist in der Lage, durch Ausbildung einer antiparallelen β-faltblattstruktur das Tetrapeptid 16 selektiv zu erkennen. Dies wurde mittels CD- Spektroskopie nachgewiesen. Besondere Stabilität erhält der Komplex durch die alternierende Abfolge von hydrophoben Aminosäuren (Val, Leu) und positiv geladenen Aminosäuren (Lys) im Rezeptor einerseits und der komplementär alternierenden Abfolge von hydrophoben Aminosäuren (Leu) und negativ geladenen Aminosäuren (Glu) im Substrat andererseits. Weiterhin stabilisierend wirkt die Salzbrücke zwischen den terminalen Ammoniumionen von 15 und dem negativen Carboxyterminus in 16. Die π-π-wechselwirkung zwischen der Benzylgruppe in 16 mit der verbrückenden Dibenzofuraneinheit des Rezeptors liefert zusätzliche Bindungsenergie. [41]
32 18 Projekt und Konzeption Abbildung 2.13: Kellys Chelatrezeptor 15 ist in der Lage, das Tetrapeptid 16 unter Ausbildung einer β-faltblattstruktur selektiv zu komplexieren. Zur Verdeutlichung der Wechselwirkungen sind die Moleküle in den Ladungszuständen dargestellt, wie sie in neutraler wässriger Lösung zu erwarten sind. Eine Seitenkettenselektive Erkennung von Aminosäuren gelang Breslow et al. indem sie die in ihrem Arbeitskreis vielfach eingesetzten Cyclodextrine über verschiedene starre Spacer miteinander verbunden haben. Abbildung 2.14 zeigt den Rezeptor 17 und das cyclische Peptidsubstrat 18, welche zusammen mit K a = 2590 M -1 einen stabilen Komplex in Wasser bilden. Die Bindungskonstanten für diesen Komplex wurden mittels Mikrokalorimetrie in gepuffertem Wasser bestimmt. Der Rezeptor 17 bindet dabei nicht wie in den vorangegangenen Beispielen das Peptidrückgrat, sondern die hydrophobe Seitenkette des Phenylalanins. 18 wurde im Vergleich mit anderen cyclischen und nicht-cyclischen ligopeptiden mindestens um den Faktor 2 stärker komplexiert. Problematisch ist dieser Rezeptor jedoch, da keine klare 1:1-Stöchiometrie im Komplex vorliegt, die Bindung eines zweiten Moleküls 18 findet ebenfalls mit einer relativ hohen Bindungskonstante von K a2 = 1120 M -1 statt. [42] Abbildung 2.14: Breslows Peptidrezeptor 17 bindet selektiv das cyclische exapeptid 18. Einen synthetischen Rezeptor für die Erkennung von Aspartatseitenketten entwickelten amilton et al. durch die Kombination von zwei Guanidiniumeinheiten. Dabei zeigte sich abermals die Wichtigkeit der richtigen Präorganisation der Erkennungsmotive. Der Rezeptor 19 bindet α-helikale ligopeptide, die zwei Aspartatseitenketten enthalten, mit Bindungskonstanten von bis zu K a = 390 M -1 in Wasser-Methanol-Gemischen. Sowohl der flexiblere Rezeptor 20, als auch die monokationische Struktur 21 binden
33 Projekt und Konzeption 19 wesentlich schlechter an derartige α-elices. Auch das Dikation 22 erkennt Aspartatpaare in α-elices, jedoch mit einer schwächeren Bindungskonstante als 19. [43,44] 2 2 n n n = 0: 19 n = 1: 20 Me 3 Me 3 22 R S S 2 R R = : 23 R = SitBuPh 2 : 24 Abbildung 2.15: Peptidrezeptoren nach amilton (19-22) und Giralt (23-24). Ebenfalls zur Erkennung von Aspartat-haltigen α-elices entwarfen Giralt et al. den künstlichen Rezeptor 23. Auch dieser Rezeptor beruht auf der Wechselwirkung zwischen Guanidiniumstrukturen und den Carboxylatseitenketten des Aspartats. Tetraaspartat-haltige Peptide werden mit Bindungskonstanten von K a 10 5 M -1 koordiniert und in der α-helikalen Konformation stabilisiert. [45] Allerdings sind die Bindungsstudien für die in Abbildung 2.15 vorgestellten Rezeptorsysteme ausschließlich in % Wasser in Methanol durchgeführt worden, für rein wässrige Lösungen sind also deutlich schwächere Bindungskonstanten zu erwarten. Schmuck et al. entwickelten Peptidrezeptoren auf der Basis von Guanidiniocarbonylpyrrolen. Die in Abbildung 2.16 dargestellte Verbindung 25 ist ein solcher Rezeptor. Dabei wurde eine Imidazoleinheit über einen starren Spacer mit der Pyrroleinheit verknüpft. Der Rezeptor bindet -acylierte Dipeptide mit Bindungskonstanten von M -1 in Wasser. Der auptteil der Bindungsenergie resultiert allerdings aus einer Komplexierung des Peptidrückgrates, was sich in einer nur moderaten Sequenzselektivität äußert. Es ist lediglich die generelle Tendenz zu erkennen, das stärker hydrophobe Reste besser gebunden werden. [46]
34 20 Projekt und Konzeption Abbildung 2.16: Schmucks Rezeptor 25 für -acylierte Dipeptide. Dargestellt ist der Komplex mit Ac-D-Ala-D-Ala- 26. Einen synthetischen Peptidrezeptor auf der Basis eines verbrückten Calix[4]arens stellten Ungaro et al. vor. Dieser bindet das -acylierte Dipeptid Ac-D-Ala-D-Ala- 26 in Chloroform mit einer abgeschätzten Bindungskonstante von K a > 10 5 M -1. bwohl bezüglich der Struktur des Komplexes keine Aussagen getroffen wurden, ist es wahrscheinlich, dass im Komplex das sekundäre Amin in 34 von der Säurefunktion aus 26 protoniert wird und sich eine Salzbrücke ausbildet. Das Dipeptid 26 wurde als Modellverbindung für das Peptidoglycan in bakteriellen Zellwänden herangezogen. Daher waren auch Untersuchungen bezüglich einer biologischen Aktivität von 34 interessant. In einer ersten Charakterisierung wurde eine bakteriozide Wirkung gegen S. aureus nachgewiesen. [47] Abbildung 2.17: Ungaros Rezeptor 34 zeigt zwar biologische Aktivität, komplexiert jedoch das Zielpeptid wie z. B. Ac-D-Ala-D-Ala- 26 nur in unpolaren Medien. Spätere Bindungsstudien mit 34 in verschiedenen Lösemittelgemischen zeigten den deutlichen Einfluss des umgebenden Mediums auf die Bindungskonstante. Im Vergleich zu trockenem Chloroform war die Bindungskonstante in mit Wasser gesättigtem Chloroform bereits um eine Größenordnung geringer. Auch nach Zugabe von lediglich 3 % DMS bildete sich der Komplex nur noch mit K a = 10 3 M -1, ein Rückgang um mehr als zwei Größenordnungen. Bindungsstudien in wässrigen Medien wurden nicht durchgeführt. [48] Ein weiteres sehr interessantes Zielmolekül ist das Peptid Arg-Gly-Asp (RGD). Als Rezeptor für diese Sequenz wurde von Schrader et al. die Verbindung 35 entworfen.
35 Projekt und Konzeption 21 Dieser Rezeptor wurde mittels MR-Titration in Wasser gegen drei RGD-Derivate untersucht: (a) das freie RGD-Tripeptid -Arg-Gly-Asp- 36, (b) das cyclische Peptid c(rgdfv) 7 und (c) das nicht-peptidische RGD-Mimetikum 39. [49] Me P 35 Et P P Me Abbildung 2.18: Schraders RGD-Rezeptor 35 und die drei untersuchten Substrate: das freie RGD- Tripeptid 36, Kesslers c(rgdfv) 7 und das nicht-peptidische Fibrinogen- Mimetikum 39. In der Tat koordiniert 35 das freie RGD-Tripeptid in Wasser mit K a = 1300 M -1, 36 wird damit von den drei genannten Substraten am effektivsten gebunden. Jedoch muss in Betracht gezogen werden, dass neben den geladenen Seitenketten (Arg und Asp) zwei weitere Ladungen durch den freien -Terminus sowie durch das Carboxylat des freien C-Terminus vorliegen. Da es sich bei der natürlichen Peptidsequenz jedoch um ein internes ligopeptid handelt, liegen diese Ladungen im eigentlichen Zielsubstrat nicht vor. Umso bedeutender ist daher die beobachtete Assoziation von 7, welche noch mit beachtlichen 700 M -1 beschrieben wurde. Theoretische Berechnungen von Schrader (MacroModel 7.0, PLS-AA) deuten an, dass das arylische Trisphosphonat die Guanidiniumseitenkette des Arginins komplexiert, während das Carboxylat aus der Seitenkette des Aspartats eine Salzbrücke zum Aniliniumion ausbildet.
36 22 Projekt und Konzeption Abbildung 2.19: Stabilste Konformation des Komplexes aus c(rgdfv) 7 und dem Rezeptor 35, nach Schrader [49] (links). Ebenfalls dargestellt ist derselbe Komplex nach Berechnungen von Gilson [52] (rechts), hier ist das Substrat in gelber Farbe gezeigt. Unpolare Wasserstoffatome sind nicht dargestellt. Der Protonierungsgrad der Verbindungen entspricht dem aus Abbildung Für das nicht-peptidische Fibrinogen-Mimetikum 39 konnte keine Bindung detektiert werden. Als Erklärung dafür kommt neben einer möglichen Konformationsselektivität des Rezeptors 35 auch die Substitution des Guanidiniumrestes durch eine Guanidinartige Struktur in 39 sowie der sterisch wesentlich höhere Anspruch der Benzamidineinheit in Frage. Die Titrationen wurden allerdings in ungepuffertem Wasser durchgeführt. Daher kann nicht ausgeschlossen werden, dass die beobachteten Änderungen im MR-Spektrum im Verlauf der Titration ursächlich auf p- Schwankungen zurückzuführen sind. Deshalb werden die Ergebnisse der experimentellen Bindungsstudien unter anderem in der Dissertation von M. Junkers aus dem Arbeitskreis Schrader zumindest in Frage gestellt. [50] Dennoch waren diese Ergebnisse jüngst Gegenstand einer theoretischen Untersuchung zur Struktur des Komplexes aus 35 und 7. Dafür wählten Gilson et al. die M2- Methode. [51] Dabei handelt es sich um eine spezielle Kraftfeldmethode, die in guter Übereinstimmung mit den experimentellen Daten von Schrader die Komplexierung des Zielsubstrates erklärt. In quantitativer insicht stimmen die Berechnungen von Gilson mit den experimentellen Daten von Schrader überein. Überraschenderweise wird aber eine völlig andere Komplexstruktur vorgeschlagen (siehe Abbildung 2.19 rechts). Während in den Berechnungen von Schrader die Argininseitenkette vom Trisphosphonat zangenartig eingeschlossen wird, befindet sich diese nach Gilsons Berechnungen in einer dem Lösemittel zugewandten peripheren Position des
37 Projekt und Konzeption 23 Komplexes. Ebenfalls in der Peripherie lokalisiert sind zwei der drei Phosphonatgruppen, welche danach nicht zur Koordinierung beitragen. Der größere Teil der Bindungsenergie resultiert nach Gilson aus hydrophoben Wechselwirkungen zwischen den Valin- bzw. Phenylalaninseitenketten und dem aromatischen Kern des Rezeptors. Darüber hinaus wird sowohl für den isolierten Rezeptor, als auch für die Komplexe mit -RGD- 36 und 7 eine intramolekulare Selbstassoziation von 35 mit einer elektrostatischen Wechselwirkung zwischen Aniliniumion und Phosphonat beschrieben. [52] Diese Möglichkeit wird in der Publikation von Schrader nicht diskutiert Künstliche Peptidrezeptoren durch kombinatorische Chemie Für das Auffinden synthetischer Rezeptoren für ligopeptide bietet sich die kombinatorische Chemie an. [53] Dabei werden molekulare Strukturen systematisch variiert und auf ihre Eigenschaften beispielsweise bezüglich der Bindung von Zielsubstraten hin untersucht. Als kombinatorische Standardmethode hat sich die Synthese von Peptiden an der festen Phase vom C- zum -Terminus etabliert. R 1 R 2 R 3 2 Vom C-Terminus......zum -Terminus. Abbildung 2.20: Die Festphasensynthese von Peptiden nach dem C zu Standardprotokoll. Die Reste R können kombinatorisch variiert werden. Ausgangspunkt dieses Verfahrens ist ein auf einem arz immobilisiertes ucleophil, z. B. eine Aminfunktion. Dann wird eine aktivierte Aminosäure, deren Aminfunktion mit einer Schutzgruppe versehen ist, an dieses ucleophil gekuppelt. ach erfolgter Kupplung wird die Schutzgruppe entfernt und mit dem freigesetzten Amin steht das nächste immobilisierte ucleophil zur Kupplung bereit. Durch die Verwendung von unterschiedlichen Aminosäuren können die Reste R variiert werden. Eine Gruppe von Verbindungen, die unter Verwendung desselben Protokolls hergestellt und gemeinsam untersucht wird, nennt man eine Bibliothek. Außerdem kann abschließend eine Kopfgruppe, beispielsweise ein supramolekulares Bindungsmotiv, an den letzten freien -Terminus gekuppelt werden. Die so synthetisierten Strukturen können noch an der festen Phase über so genannte on-bead-assays untersucht und charakterisiert werden. Wenn über ein solches Assay eine Struktur identifiziert wurde, die die gewünschten Eigenschaften aufweist, so kann sie als lösliches Molekül hergestellt und in Lösung untersucht werden. So gelang Schmuck et al. das Auffinden von effektiven Rezeptoren
38 24 Projekt und Konzeption für verschiedene Zielsubstrate. Eine 512 Mitglieder umfassende Rezeptorbibliothek wurde mit einem Standardprotokoll an Tentagel erstellt. ach Abschluss der Aminosäurevariation wurde an den freien -Terminus ein Bindungsmotiv für Carboxylate gekuppelt. [54,55] Auf diese Weise gelang es, einen Rezeptor für den C-Terminus des β-amyloid-peptides zu finden. Dieses Peptid nimmt im Prozess der Alzheimer schen Krankheit eine zentrale Rolle ein. Es zeigt eine starke Selbstassoziation und bildet Ablagerungen, so genannte Plaques, im Gehirn des Patienten. Der Rezeptor 40 bindet mit Assoziationskonstanten von K a = M -1 in Wasser an das β-amyloid. Durch die Zugabe des Rezeptors zu einer Lösung des β-amyloides gelang sogar Inhibierung seiner Selbstassoziation. [56] 2 40 R R R = Abbildung 2.21: Durch kombinatorische Chemie gefundene Rezeptoren für das C-terminale β-amyloid (40) und das Tetrapeptid ekaa (41). Der Rest R stellt ein bekanntes supramolekulares Bindungsmotiv für Carboxylate dar. Durch die Untersuchung derselben Bibliothek gelang auch die Identifizierung und Charakterisierung eines künstlichen Rezeptors für das Tetrapeptid D-Glu-Lys-D-Ala- D-Ala (ekaa). Dieses Peptid dient als Modell für den C-Terminus des Peptidoglycans in bakteriellen Zellwänden (vgl. Abschnitt 2.1.2). [57] 41 bindet das oben genannte Zielpeptid mit K a = M -1 in gepuffertem Wasser. Dieser Rezeptor wurde nun auch auf seine Substratselektivität hin untersucht. Zunächst wurde die Affinität der Mitglieder der Bibliothek zum sequenzinvertierten Tetrapeptid D-Ala-D-Ala-Lys-D-Glu (aake) bestimmt. Sollte die gefundene Selektivität lediglich auf diffuse berflächeneigenschaften des Tetrapeptides zurückzuführen sein, so müsste für das invertierte Peptid eine ähnliche Assoziationskonstante zu finden sein. Tatsächlich aber wird es von der gesamten Bibliothek um den Faktor zwei bis drei schlechter gebunden. 41 koordiniert das inverse Peptid mit K a = 4800 M -1 und damit um den Faktor 3.6 schlechter. [58] Dennoch ist mit diesem Ansatz lediglich die Selektivität bzgl. ekaa und aake nachgewiesen. Deshalb wurde die kombinatorische Variation umgekehrt und an der festen Phase eine Bibliothek von Tetrapetiden hergestellt, deren Bestandteil unter anderem das Zielpeptid ekaa sowie das im Fall von Resistenzen relevante D-Glu-Lys- D-Ala-D-Lac war. Die Bindungseigenschaften gegenüber einem wasserlöslichen Derivat
39 Projekt und Konzeption 25 des Rezeptors 41 wurden an der festen Phase untersucht. Dieses Screening ergab, dass die stabilste Bindung zum Rezeptor nicht durch das eigentliche Zielsubstrat ekaa, sondern durch das Tetrapeptid D-Glu-D-Glu-D-Glu-D-Glu (eeee) mit K a = M -1 ausgebildet wird. [59] Da bei dem für die Bindungsstudien eingestellten p-wert das Substrat eeee fünffach anionisch und der Rezeptor 41 dreifach kationisch vorliegt, ist die starke Bindung trotz der Flexibilität der Moleküle gut zu erklären. Dennoch zeigt das System, wo die Probleme bei der Suche nach einem künstlichen Rezeptor liegen. Affinität und Selektivität sind zwei verschiedene Eigenschaften für die ein ptimum gefunden werden muss. Ein hoch affiner Rezeptor ist für den medizinischen Einsatz unbrauchbar, wenn er nicht die gewünschte Selektivität aufweist. So binden in dem vorliegenden Screening die eigentlichen Zielsubstrate ekaa sowie D-Glu-Lys-D-Ala- D-Lac um mehr als den Faktor zehn schlechter als eeee. [60] Auch Ellman et al. bedienten sich der kombinatorischen Chemie auf der Suche nach einem Rezeptor für den D-Ala-D-Ala-C-Terminus. Sie erstellten eine Tripeptidbibliothek mit Mitgliedern. Während von Schmuck ausschließlich natürliche Aminosäuren zur erstellung der Bibliothek eingesetzt wurden, verwendete Ellman zusätzlich nicht natürliche Aminosäuren. Deshalb ist Ellmans Bibliothek wesentlich größer und aufwändiger in der erstellung. ach der Synthese des Peptidstranges, wurde eine dem Vancomycin nachempfundene Carboxylatbindungsstelle an den freien -Terminus gekuppelt. Die Darstellung der Bibliothek und die Synthese der Carboxylatbindungsstelle erfordern also einen wesentlich höheren Aufwand. 42 wurde als Rezeptor für das Zielpeptid identifiziert. 2 C C 2 Me 42 Abbildung 2.22: Der Peptidrezeptor 42 nach Ellman setzt sich aus einem kombinatorisch variierten Tripeptid (blau) und einer dem Vancomycin nachempfundenen Carboxylatbindungsstelle (rot) zusammen. Die die Assoziationskonstante für 42 und -Ac 2 -Lys-D-Ala-D-Ala- in Wasser wurde mittels Mikrokalorimetrie auf K a = 10 5 M -1 bestimmt. Der Rezeptor komplexiert auch das Depsipeptid -Ac 2 -Lys-D-Ala-D-Lac-. Ebenso wie im oben vorgestellten Resistenzmechanismus ist in diesem Substrat das C-terminale Alanin gegen ein Lactat
40 26 Projekt und Konzeption ausgetauscht. Allerdings wird das Depsipeptid deutlich schlechter mit K a = M -1 gebunden. [61] Bisher sind jedoch keine weiteren Daten bezüglich der Substratselektivität des Rezeptors publiziert worden. Bei den bisher vorgestellten Bibliotheken handelt es sich um einarmige Rezeptorbibliotheken. Es ist jedoch auch die Synthese von mehrarmigen Bibliotheken denkbar, bei denen mehrere Peptidstränge kombinatorisch variiert werden. Bei diesem Ansatz wird eine Kopfgruppe an eine feste Phase gebunden, wobei diese Kopfgruppe gleichzeitig bereits als Bindungsmotiv für funktionelle Gruppen im Zielsubstrat fungieren kann. An diese Kopfgruppe können nun eine beliebige Anzahl von kombinatorisch variierbaren Peptidsträngen angebunden werden. Ist die Sequenz der Aminosäuren in den verschiedenen Peptidsträngen eines Moleküls identisch, so spricht man von symmetrischen mehrarmigen Bibliotheken. Die Synthese von asymmetrischen Bibliotheken ist wesentlich anspruchsvoller. In diesem Fall müssen separat abspaltbare, also zueinander orthogonale Schutzgruppen verwendet werden. X AA 1 AA 2 AA 3 X Kopfgruppe Kopfgruppe X AA 1 AA 2 AA 3 Abbildung 2.23: Prinzip einer symmetrischen zweiarmigen Bibliothek. AA = Aminosäure. Auf dem Gebiet der symmetrischen pinzettenartigen Rezeptoren war insbesondere die Arbeitsgruppe um Kilburn sehr erfolgreich. Die Kopfgruppe ist bei diesen Ansätzen gleichzeitig als Bindungsstelle für das Carboxylat des ligopeptides zu verstehen. Es handelt sich dabei um Diaminopyridin- [62,63] oder um Guanidinderivate. [64] Diese Strukturen sind mit zwei nucleophilen Gruppen versehen, die für eine weitere Funktionalisierung zur Verfügung stehen. Auf diese Weise wurden zweiarmige symmetrische Rezeptorbibliotheken dargestellt.
41 Projekt und Konzeption 27 AA 1 AA 2 AA 3 Fmoc AA 1 AA 2 AA 3 Fmoc 43 S AA 1 AA 2 AA 3 Fmoc AA 1 AA 2 AA 3 Fmoc 44 Abbildung 2.24: Kilburns kombinatorische Bibliotheken. Abgebildet sind Beispiele für eine Diaminopyridin-basierte (43) bzw. eine Guanidin-basierte (44) Kopfgruppe. Die symmetrischen Bibliotheken wurden mittels Split-and-Mix-Synthese [65] hergestellt und mit einem on-bead-assay auf ihre Bindungseigenschaften für verschiedene Peptide untersucht. Die Peptidsequenz wurde dann durch Edman-Abbau bestimmt, der betreffende Rezeptor nachsynthetisiert und auf seine Bindungseigenschaften bezüglich des getesteten Peptides in Lösung untersucht. Mit dieser Methode konnten Rezeptoren gefunden werden, die verschiedene Tripeptide mit Bindungskonstanten von bis zu 10 4 M -1 in Wasser-DMS-Gemischen binden. Unter Verwendung einer orthogonalen Schutzgruppenstrategie gelang Kilburn et al. auch die Darstellung von asymmetrischen zweiarmigen Bibliotheken. Auf der Basis der in 43 verwendeten Kopfgruppe wurde eine solche Bibliothek dargestellt und auf ihre Affinität gegenüber einem Modellpeptid für den D-Ala-D-Ala-C-Terminus untersucht. Als Modell wurde die Verbindung Ac-Lys-D-Ala-D-Ala- untersucht. Einige viel versprechende Kandidaten wurden in Lösung hergestellt, jedoch gelang keine Analyse der Bindungseigenschaften. In einem on-bead-assay ergab sich für das genannte Tripeptid eine Assoziationskonstante von K a 250 M -1. [66] Über mit der Synthese einer zweiarmigen symmetrischen Bibliothek konnten auch Wennemers et al. einen Pinzettenrezeptor 45 für verschiedene Di- und Tripeptide finden. In diesem Fall wurde ein Diketopiperazid als Kopfgruppe eingesetzt. Eine effektive Bindung ist allerdings nur unter Verwendung von Chloroform als Lösemittel beschrieben. In diesem Medium werden Bindungskonstanten von bis zu K a = 3900 M -1 beschrieben. In wässrigen Medien sind aber deutlich schlechtere Assoziationskonstanten zu erwarten. [67]
42 28 Projekt und Konzeption R 1 R 4 R 2 R 5 R 3 R 6 45 Abbildung 2.25: Peptidrezeptor 45 nach Wennemers. Eine dreiarmige Bibliothek zum Auffinden künstlicher Rezeptoren wurde von Liskamp et al. vorgestellt. Dabei wurde der erste Rezeptorarm an der festen Phase synthetisiert, dann die Kopfgruppe, eine Cyclotriveratrylen-Einheit (46), eingeführt. Diese Gruppe trägt zwei weitere freie nucleophile Funktionen, die mittels Fmoc- bzw. Boc- Schutzgruppenstrategie weiter umgesetzt und kombinatorisch variiert werden können. [68] Eine solche Bibliothek wurde in einem on-bead-assay auf ihre Bindungseigenschaften gegenüber unterschiedlichen Peptiden mit C-terminalem D-Ala- D-Ala bzw. D-Ala-D-Lac in wässrigem Puffer untersucht. Darüber hinaus wurden die Bindungseigenschaften gegenüber einem Peptidoglycan als Modell für die bakterielle Zellwand getestet. Viel versprechende Rezeptoren aus der Bibliothek wurden als lösliche Moleküle synthetisiert und auf ihre Affinität und Selektivität gegenüber den Zielsubstraten untersucht. In semiquantitativen Studien konnten gute Bindungskonstanten und eine hohe Selektivität gegenüber der C-terminalen D-Ala-D-Ala- Sequenz beobachtet werden. Dabei wurden Bindungskonstanten im Bereich von K a M -1 in wässrigem Puffer bestimmt. Diese Rezeptoren wurde auch auf ihre biologische Aktivität gegen einen S. aureus Stamm untersucht, allerdings konnte keine Inhibierung des bakteriellen Wachstums beobachtet werden. [69]
43 Projekt und Konzeption 29 AA n R m+1 AA m 2 AA m AA n 2 2 R m+1 46 AA m 47 2 AA o 2 Abbildung 2.26: Kombinatorische Rezeptorbibliotheken nach Liskamp. Als Kopfgruppe wurde eine Cyclotriveratrylen-(46) bzw. eine Triazacyclophan-(47) Einheit verwendet. Eine weitere dreiarmige Rezeptorbibliothek mit Triazacyclophan als Kopfgruppe (47) wurde ebenfalls von Liskamp et al. vorgestellt. Dabei ist es gelungen, eine orthogonale Schutzgruppenstrategie einzuführen, die die separate Variation jeder einzelnen der drei Positionen erlaubt. [70] Diese wurde in einem Festphasenassay auf ihre Affinität bezüglich der Tripeptide Gly-D-Ala-D-Lac und Gly-D-Ala-D-Ala untersucht. Dieses Screening fand jedoch in Chloroform [71] statt und ist deshalb nicht mit den anderen hier vorgestellten Daten vergleichbar. Eine später synthetisierte, dreiarmige Bibliothek des gleichen Typs, aber noch höherer Diversität wurde zwar in wässriger Pufferlösung untersucht, jedoch wurden nur qualitative Ergebnisse erhalten, aber keine Bindungskonstanten bestimmt. [72] Dreiarmige kombinatorische Peptidbibliotheken wurden auch in der Arbeitsgruppe von Anslyn entwickelt. Diese wurden aber bisher lediglich auf ihre Bindungseigenschaften gegenüber phosphathaltigen Substraten wie ATP und GTP getestet. [73] Darüber hinaus existieren einige interessante Ansätze für künstliche Rezeptoren zur Bindung von einfachen Aminosäuren [74,75,76] oder posttranslational modifizierten Proteinen und Peptiden. [77] Diese werden aber an dieser Stelle nicht besprochen, da es sich bei den Zielmolekülen der vorliegenden Arbeit um nicht-modifizierte ligopeptide handelt. 2.5 Aufgabenstellung 1: Entwicklung eines künstlichen Rezeptor für das C-terminale Dipeptid D-Ala-D-Ala In Abschnitt 2.4 wurden bereits einige Rezeptoren für den D-Ala-D-Ala-C-Terminus vorgestellt. Die meisten davon sind jedoch nur bezüglich ihrer biologischen Wirksamkeit oder bezüglich ihrer Affinität zu verschiedenen Modellsubstraten getestet worden. Untersuchungen zur Komplexstruktur in Wasser wurden in keinem der vorgestellten Fälle durchgeführt. Eine Ursache dafür ist die oftmals geringe Assoziationskonstante dieser Komplexe in Wasser. In dem vorgeschlagenen Bindungsmodus des Antibiotikums Vancomycin zum D-Ala-D-Ala-C-Terminus spielt
44 30 Projekt und Konzeption die hydrophobe Wechselwirkung jedoch eine wichtige Rolle. [78] Diese Wechselwirkung kann jedoch nur in wässrigem Medium beobachtet werden. Ein Ziel der vorliegenden Arbeit ist die Synthese eines Rezeptors für D-Ala-D-Ala auf der Basis eines rationalen Designs. Als Ankerpunkt soll das freie Carboxylat am C-Terminus des Peptides dienen. Zusätzliche Bindungsstärke soll eine hydrophobe Wechselwirkung mit der Methyl- Seitenkette im Alanin liefern. Für diese beiden Ankerpunkte werden also supramolekulare Bindungsmotive benötigt, welche im Folgenden etwas detaillierter vorgestellt werden Carboxylatbindung durch Guanidinderivate Die Guanidineinheit stellt in der atur ein zentrales Motiv für die Koordination von xoanionen dar. Prominente Beispiele sind die Bindung von Substraten in aktiven Zentren von Enzymen ebenso wie die Wicklung der im Rückgrat phosphathaltigen DA um die Arginin-reichen, und daher stark Guanidin-haltigen istone. [79] Auch in der supramolekularen Chemie nehmen die Guanidine eine zentrale Rolle ein, wie nicht nur die bereits vorgestellten Systeme von Kilburn, amilton und Giralt zeigen. In Abbildung 2.27 sind einige weitere Beispiele für supramolekulare Carboxylatrezeptoren auf Guanidiniumbasis dargestellt Et Et 52 Et C 2 Et R R 49 R R Abbildung 2.27: Rezeptoren auf der Basis von Guanidinen, entwickelt von Lehn (48) [80], Schmidtchen und de Mendoza (49) [81,82], amilton (50) [83] und Anslyn (51-52) [84,85]. achteil all dieser Rezeptoren ist, dass sie entweder nur in unpolaren Lösemitteln binden oder ihre Bindungsstärke von einer multivalenten ionischen Wechselwirkung abhängt. Letzteres ist zwar kein prinzipieller achteil, macht den Rezeptor jedoch extrem empfindlich gegenüber der Zugabe von Salzen zur Lösung. Diese können
45 Projekt und Konzeption 31 konkurrierende Salzbrücken ausbilden und schwächen dadurch die Bindungsstärke des Rezeptors zum eigentlichen Zielsubstrat. Außerdem könnte die otwendigkeit, mehrere geladene Bindungsmotive auf engem Raum zu vereinen, sowohl sterische Probleme, als auch Komplikationen mit der Vollständigkeit der Protonierung bei einem gegebenen p-wert bergen. Darüber hinaus ist es auch für multivalente Rezeptoren von Interesse, das einzelne Bindungsmotiv in seiner Affinität gegenüber seinem Zielsubstrat zu maximieren. Aus diesem Grund wurde von Schmuck das Guanidiniocarbonylpyrrol als neuartiges Bindungsmotiv für xoanionen entworfen. [86] Dieses ist in der Lage, auch in wässrigen Medien Carboxylate effektiv zu komplexieren. So bildet beispielsweise die Verbindung 53 mit verschiedenen Carboxylaten in Wasser-DMS-Gemischen stabile Komplexe mit Assoziationskonstanten von K a 10 3 M -1. [87] R R' 2 53: R = Et Abbildung 2.28: Bindung von Carboxylaten (blau) durch Schmucks Bindungsmotiv (rot). Für die hohe Assoziationskonstante sind mehrere Effekte verantwortlich: (a) Die Acylierung der Guanidineinheit senkt den pk a -Wert der Protonen am Guanidin, was deren Tendenz zur Ausbildung von Wasserstoffbrückenbindungen erhöht. (b) Zusätzliche Wasserstoffbrücken können zum Carboxylat ausgebildet werden, beispielsweise vom Pyrrol- oder vom Amid-. (c) Durch seine Planarität ist das Guanidiniocarbonylpyrrol optimal präorganisiert für die Komplexierung von ebenfalls planaren Substraten wie z. B. Carboxylaten. Die Möglichkeit der Einführung einer Seitenkette R in ein Bindungsmotiv vom Typ 53 macht diese Verbindung zu einem sehr interessanten Baustein für die supramolekulare Chemie. Durch zusätzliche Wechselwirkungen der Seitenketten R mit einer weiteren Seitenkette R im Substrat kann die Bindungsstärke erhöht bzw. eine Substratselektivität hervorgerufen werden. Ein besonders stabiles Aggregat bildet sich aus, wenn das Carboxylat ebenso starr und günstig präorganisiert ist. Wenn dieses dann auch noch in demselben Molekül geschieht, so potenzieren sich die Effekte und es kann eine sehr starke Selbstassoziation
46 32 Projekt und Konzeption beobachtet werden. So dimerisiert das Zwitterion 54 noch in reinem Wasser mit einer Assoziationskonstante von K = 170 M @54 55@55 Abbildung 2.29: Vergleich der Dimerisierung des Zwitterions 54 mit dem neutralen Strukturanalogon 55. Die von Schmuck charakterisierten Verbindungen tragen noch Löslichkeits-vermittelnde Reste in 3- und 4-Position des Pyrrols, diese sind aus Gründen der Übersichtlichkeit nicht abgebildet. Um den Beitrag der ionischen Wechselwirkung zu quantifizieren synthetisierten Schmuck et al. ein strukturelles Knock-out -Analogon 55, welches eine deckungsgleiche Anordnung der Atome aufwies, aber den ionischen Wechselwirkungen völlig entbehrte. Die Bestätigung, dass die beiden Verbindungen tatsächlich isostrukturell dimerisieren, wurde neben der Interpretation der Shiftänderungen während der MR-Titration auch durch eine Festkörperstrukturanalyse der Verbindungen erbracht. Die Verbindung 55 zeigt jedoch nur in Chloroform eine Selbstassoziation, während bereits kleine Mengen an DMS in der Lösung zum völligen Zusammenbruch der Selbstassoziation führen. Dies liefert einen weiteren inweis für den großen Einfluss der ionischen Wechselwirkung auf die Komplexbildung. [88,89] Ein hydrophobes Bindungsmotiv für Methylreste Um eine hydrophobe Wechselwirkung zur Seitenkette des Alanins auszubilden, soll nun ein supramolekulares Bindungsmotiv für Methylgruppen gewählt werden. Um die Wechselwirkung möglichst selektiv zu gestalten, ist eine Bindungstasche erforderlich, welche sich von der Größe her eignet, einen Methylrest zu beherbergen. Reste, die größer als der Methylrest sind, sollten nicht in die Bindungstasche passen. Diese Anforderungen erfüllt das Cyclotribenzylen. [90] Es bildet in seiner Vorzugskonformation eine albschale, in die ein Methylrest in einer Raum füllenden Weise hineinpasst.
47 Projekt und Konzeption 33 R 56: R = 57: R = I 56 (perspektivisch) Abbildung 2.30: Cyclotribenzylen als Lewis-Strukturformel (links) und die Verbindung 56 in perspektivischer Darstellung der Vorzugskonformation (rechts), aus Gründen der Übersichtlichkeit wurde auf die Darstellung der Wasserstoffatome verzichtet. Für den Einsatz in der supramolekularen Chemie ist darüber hinaus noch ein Ankerpunkt an diesem Bindungsmotiv erforderlich, um weitere Teile eines potentiellen Rezeptors kovalent an diese hydrophobe albschale zu binden. Daher wurde ebenfalls im Arbeitskreis Schmuck ein 4-Iod-substituiertes Cyclotribenzylen 57 synthetisiert und charakterisiert. [91] Gegenüber 56, welches C 3v -Symmetrie aufweist, gehen die parallel zur Rotationsachse stehenden Spiegelebenen verloren. Bei 57 handelt es sich also um ein planar-chirales Molekül. Theoretisch können die beiden Enantiomere durch einen Ring-Flip im zentralen 9-Ring ineinander überführt werden. Die Inversionsbarriere dafür wurde mittels MR-Koaleszenzuntersuchungen auf über 100 kj mol -1 bestimmt. Die Enantiomere sind also bei Raumtemperatur stabil, lassen sich an einer chiralen PLC-Säule trennen und mittels CD-Spektroskopie charakterisieren. Eine Racemisierung findet erst bei einer Temperatur deutlich oberhalb von 120 C statt Entwurf des Rezeptors Diese beiden Bindungsmotive wurden von Schmuck und Wienand zu einem Rezeptorentwurf vereint. Durch computergestütztes Design wurde die Verbindung 1 entworfen. Diese verbindet die beiden supramolekularen Bindungsmotive über eine Aminosäurefunktion. [92] Theoretische Berechnungen legen nahe, dass 1 in der Lage ist, mit dem D-Ala-D-Ala-C-Terminus einen stabilen Komplex zu bilden. Als Modellpeptid für den C-Terminus wurde Ac-D-Ala-D-Ala- 26 gewählt. In der berechneten Komplexstruktur ist zu erkennen, dass das Carboxylat tatsächlich von der Guanidiniumeinheit des Pyrrols koordiniert werden kann. Außerdem kann der Methylrest des -terminalen Alanins von der hydrophoben Kavität des Cyclotribenzylens umgeben werden, wie im hinteren Bereich der in Abbildung 2.31 dargestellten berechneten Komplexstruktur deutlich wird.
48 34 Projekt und Konzeption Abbildung 2.31: Lewis-Strukturformeln des Rezeptors 1 und des Substrates 26 und der berechnete Rezeptor-Substrat-Komplex, [92] 1 ist in grün und ohne die unpolaren Wasserstoffatome dargestellt. Die hydrophobe Cyclotribenzylenhalbschale (dünne Linien) umschließt die -terminale Methylgruppe des in grau dargestellten Substrates. Für die Analytik von 1 ist die eben erwähnte planare Chiralität des substituierten Cyclotribenzylens von Bedeutung. Der Rezeptor 1 wurde bis zur Stufe des am Guanidin -Boc-geschützten Vorläufers Boc-1 in der Dissertationsschrift von Wienand beschrieben. Zur Synthese des Rezeptors wurde die Aminosäure Iodalanin enantiomerenrein eingesetzt und mit einem Racemat des Iodocyclotribenzylens 57 über eine egeshi-kupplung verknüpft. Bei der daraus entstehenden künstlichen Aminosäure handelt es sich also um ein Diastereomerengemisch. Da diese auch im weiteren Verlauf der Synthese nicht getrennt wurden, liegt auch der Rezeptor 1 als Diastereomerengemisch vor. Beide Diastereomere sind sich in ihrer Konformation sehr ähnlich. Der Unterschied liegt lediglich in einer Anknüpfung der albschale über die 4- oder alternativ über die die 5-Position des Aromaten. Theoretische Berechnungen liefern für beide Diastereomere eine fast identische Komplexstruktur. Dennoch würde eine Trennung der Diastereomere die Analytik sehr vereinfachen. Die Abspaltung der Boc-Schutzgruppe unter Freisetzung der Verbindung 1 wurde zwar noch von Wienand durchgeführt, jedoch ohne das Produkt vollständig zu charakterisieren. Ziel dieser Arbeit ist es nun, nach erfolgter spektroskopischer Charakterisierung von 1 die Bindungseigenschaften gegenüber dem Zielsubstrat experimentell zu bestimmen. eben der Untersuchung der Bindungsstärke in wässrigen Medien liegt hier ein besonderes Augenmerk auf der Substratselektivität. Von Interesse wäre beispielsweise eine enantiooder sequenzselektive Erkennung von -acylierten Dipeptiden. In ersten Versuchen zur Löslichkeit, die noch von Wienand durchgeführt wurden, stellte sich schnell heraus, dass die Löslichkeit des Rezeptors in wässrigen Medien für eine MR-spektroskopische Charakterisierung nicht ausreicht. Um Aussagen über die
49 Projekt und Konzeption 35 Struktur des Komplexes treffen zu können, ist aber eine MR-spektroskopische Untersuchung in Wasser erforderlich. Alternative Lösemittel wie DMS oder Methanol sind zwar zum Lösen des Rezeptors geeignet, jedoch ist eine Analytik der Komplexbildung in diesen Medien nicht zielführend, da der Einfluss des Lösemittels auf Komplexstruktur und -stabilität nicht quantitativ interpretiert werden kann. Die beiden Effekte, die dem Entwurf des Rezeptors entsprechend hauptsächlich zur Koordinierung beitragen sollten, reagieren genau gegenläufig auf die Polarität des Lösemittels. Während elektrostatische Wechselwirkungen und Wasserstoffbrückenbindungen in organischen Medien deutlich an Stabilität gewinnen, nimmt die Bedeutung der hydrophoben Wechselwirkung in dieser Umgebung drastisch ab. Deshalb war ein weiteres Ziel der vorliegenden Arbeit, ein wasserlösliches Derivat des Rezeptors 1 zu entwerfen, zu synthetisieren und auf seine Bindungseigenschaften hin zu untersuchen. 2.6 Aufgabenstellung 2: Entwicklung eines künstlichen Rezeptors für die interne RGD-Sequenz In einem weiteren Projekt der vorliegenden Arbeit, soll ein künstlicher Rezeptor für die RGD-Sequenz gefunden werden. Um diese Peptidsequenz zu komplexieren, werden supramolekulare Bindungsmotive für die beiden funktionellen Seitenketten benötigt. Dabei handelt es sich zum einen um ein Carboxylat in der Seitenkette des Aspartats und zum anderen um ein Alkylguanidin in der Seitenkette des Arginins. Die beiden Motive sollen über einen geeigneten Spacer verbunden werden. Abbildung 2.32: Schema des Rezeptorentwurfes für die RGD-Sequenz, Bindungsmotive für Alkylguanidine und Carboxylate sollen über einen Spacer verknüpft werden. Als Bindungsmotiv für das Carboxylat soll das bereits in Abschnitt vorgestellte Guanidiniocarbonylpyrrol verwendet werden. Zur Koordinierung der Argininseitenkette
50 36 Projekt und Konzeption sollen die von Schrader eingeführten benzylischen Phosphonate zum Einsatz kommen. Daher wird dieser Teil der Arbeit in Kooperation mit M. Junkers vom Arbeitskreis Schrader durchgeführt. Das verwendete Bindungsmotiv wird im Folgenden genauer vorgestellt Benzylische Bisphosphonate zur Argininerkennung Um eine effektive molekulare Erkennung von Arginin zu gewährleisten, bietet sich die Komplexierung der Guanidiniumfunktion in der Seitenkette an. Für dessen Koordinierung gibt es einige interessante Ansätze. [93] Das Guanidinium eignet sich besonders aufgrund seiner Eigenschaft als Kation, welches Kation-π-Wechselwirkungen ausbilden kann. Darüber hinaus ist es ein multivalenter Wasserstoffbrückendonor. Ebenso können Salzbrücken zu anionischen Funktionen in einem Rezeptor ausgebildet werden. In Kapitel wurde die Bindung von xoanionen durch Guanidiniumfunktionen vorgestellt. Daher liegt an dieser Stelle die umgekehrte Vorgehensweise, also die Bindung des Guanidinium-Restes unter Verwendung von xo-anionen nahe. Schrader entwickelte auf der Grundlage dieser Überlegungen aromatische Phosphonsäurederivate, die in der Lage sind, Alkylguanidine zu komplexieren. Dabei stellte sich heraus, dass insbesondere die chelatartige Koordinierung des Arginins durch zwei Phosphonatfunktionen zu hohen Bindungskonstanten führt. [94] Die Kombination aus der pinzettenartigen Komplexierung mit zusätzlichen Kation-π-Wechselwirkungen vergrößert die Bindungsstärke zur Guanidiniumfunktionen. Zur Untersuchung dieser Effekte synthetisierte Schrader eine Reihe von aromatischen Mono- und Bisphosphonaten und untersuchte diese bezüglich ihres Bindungsverhaltens gegenüber Alkylguanidinen. Dabei zeigte besonders das meta-substituierte, arylische Bisphosphonat 58 gute Bindungseigenschaften. Im Komplex mit Methylguanidinium 59 bilden die Phosphonatreste jeweils zwei Wasserstoffbrücken zum Substrat aus und koordinieren dieses chelatartig. So wird das Substrat direkt über der Aryleinheit des Rezeptors in einem Abstand von 3.4 Å fixiert. Dies ist für die Ausbildung einer Kationπ-Wechselwirkung ideal. Die Summe all dieser Effekte bewirkt eine Assoziationskonstante für diesen Komplex von K a = M -1 in DMS. [95] In Methanol bildet sich der Komplex aus diesen beiden Partnern mit einer Bindungskonstante von nur noch K a = 800 M -1, was abermals den starken Einfluss des umgebenden und in diesem Fall stärker polar protischen Lösemittels zeigt.
51 Projekt und Konzeption 37 2 Me 2 59 Me P P Me 58 Abbildung 2.33: Schraders Bisphosphonat 58 und das von diesem koordinierte Methylguanidinium 59 als Lewis-Strukturformeln (links) und die Vorzugskonformation im Komplex in perspektivischer Darstellung (rechts). Dieses Guanidinbindungsmotiv kann nun in 5-Position am Aromaten weiter funktionalisiert werden. An dieser Stelle ist eine kovalente Bindung zu einem höhermolekularen Rezeptor synthetisch einfach zugänglich. So können weitere Funktionalitäten eingeführt werden, die entweder die Assoziation mit dem Zielsubstrat verstärken oder eine erhöhte Selektivität bewirken. Darüber hinaus konnte durch die Modifizierung des Rezeptors an dieser Position der Einfluss der Kationπ-Wechselwirkung belegt werden. Dazu wurden Elektronen-ziehende bzw. schiebende Substituenten eingebaut und die verschiedenen Bindungsstärken zum identischen Substrat verglichen. Durch eine weitere Funktionalisierung in 5-Position gelang Schrader et al. auch die Darstellung eines deutlich verbesserten Arginin-Rezeptors 60. Die erhöhte Bindungsstärke zur Guanidiniumeinheit wurde durch die Einführung einer dritten Phosphonatgruppe erreicht. Diese ist in der Lage, zusätzliche Wechselwirkungen zum Zielsubstrat in Form von Wasserstoff- und Salzbrücken auszubilden. Me P Me P Et P Me Abbildung 2.34: Schraders Rezeptor 60 der zweiten Generation zur Erkennung von Methylguanidinium oder Arginin bzw. des Derivates 61. Dadurch ergibt sich für die Bindung an das Methylguanidin 59 so wie an das Argininderivat 61 eine Bindungskonstante von K a 3500 M -1 in Methanol. Erfreulich ist die Tatsache, dass auch sterisch anspruchsvollere Reste an der Guanidineinheit deren Erkennung nicht behindern. [96] Außerdem wurde die Selektivität von 60 untersucht, indem eine vergleichende Reihe von Aminosäuren mit basischen Seitenketten gegen das Trisphosphonat titriert wurde. In Methanol wird der Argininmethylester
52 38 Projekt und Konzeption -Arg-Me 2Cl mit einer Bindungskonstante von K a = M -1 und damit um den Faktor 15 besser als das istidin- und um den Faktor 36 besser als das Lysinderivat gebunden. Die hohe Bindungskonstante im Vergleich zum Argininderivat 61 erklärt sich aus der zusätzlichen Ladung in -Arg-Me 2Cl, welches sogar noch in Wasser mit K a = 800 M -1 gebunden wird. Diese Ergebnisse indizieren, dass benzylische Bisphosphonate hoch interessante Kandidaten für die Entwicklung von Rezeptoren für die RGD-Sequenz sind Entwurf des Rezeptors Die beiden Bindungsmotive für das Alkylguanidin und das Carboxylat in den Seitenketten des RGD-Peptides sollen nun über einen geeigneten Spacer verbunden werden. Einen vergleichbaren Ansatz wählten schon Schrader et al. bei der Vorstellung des ersten künstlichen Rezeptors für die RGD-Sequenz. [49] Allerdings wurde hier zur Koordinierung des Carboxylates lediglich ein Aniliniumion gewählt, der Einsatz des Guanidiniocarbonylpyrrols nach Schmuck sollte eine wesentlich effektivere Bindung gewährleisten. Darüber hinaus zeigen die Berechnungen von Gilson, dass der von Schrader gewählte benzylische Spacer nicht in der Lage ist, eine intramolekulare Selbstassoziation zu verhindern, so dass auch in diesem Punkt eine ptimierung des Rezeptors möglich ist. Da es sich bei dem Zielmolekül um ein Zwitterion handelt, ist die Vermeidung der intramolekularen Assoziation für eine effektive Komplexierung des Zielsubstrates essentiell. Insbesondere vor dem indergrund, dass die Argininbindungsstelle von Schrader xoanionen enthält, die von Schmucks Guanidiniocarbonylpyrrol gebunden werden können. Umgekehrt enthält auch die Carboxylatbindungsstelle eine Guanidiniumeinheit, welche potentiell von dem benzylischen Bisphosphonat von Schrader koordiniert werden kann. Zunächst sollen zur Kombination der beiden Bindungsmotive einige einfache Spacer verwendet werden, um zu untersuchen, ob der vorgestellte Ansatz prinzipiell funktioniert. Im nächsten Schritt soll dann ein Festphasenprotokoll zur ptimierung dieses Spacers entwickelt werden. Für diese ptimierung soll die kombinatorische Chemie eingesetzt werden. 2.7 Aufgabenstellung 3: Entwicklung eines Festphasenprotokolls zur ptimierung des internen Spacers für den RGD-Rezeptor Wie in den bisherigen Ausführungen bereits deutlich wurde, ist die Wahl des richtigen Spacers für die Verknüpfung von zwei Bindungsmotiven in der Entwicklung eines künstlichen Rezeptors sehr wichtig. Dies gilt generell um eine korrekte Präorganisation der Bindungsmotive für eine optimale Komplementarität zum Zielmolekül zu erreichen. Im Falle eines Rezeptors für die RGD-Sequenz ist es jedoch von besonderer Bedeutung,
53 Projekt und Konzeption 39 wie die unerwünschte intramolekulare Selbstassoziation von Schraders erstem RGD- Rezeptor (35, vgl. Seite 22) zeigt. Um den Spacer zu optimieren bietet sich die kombinatorische Chemie an. In erster Linie kommen peptidische Spacer in Frage, da die Synthese von Peptiden wohl die am weitesten entwickelte Festphasenmethode ist. Allerdings sind die kombinatorische Chemie und die Festphasensynthese nicht auf Peptide beschränkt. Um eine kombinatorische Chemie durchführen zu können, muss der potentielle Rezeptor zunächst auf der festen Phase immobilisiert werden. Dabei bieten sich drei Ansätze an: (a) entweder die kovalente Bindung findet über das Bindungsmotiv für die Guanidiniumeinheit, (b) über den zu variierenden Spacer oder (c) über das Bindungsmotiv für Carboxylate statt. Abbildung 2.35: Schema der Immobilisierung eines Rezeptors (grün) für die RGD-Sequenz zur ptimierung des Spacers. Diese kann über die Anknüpfung des Bindungsmotives für das Alkylguanidin (a) bzw. für das Carboxylat (c), sowie über den zu variierenden Spacer (b) erfolgen. Um eine möglichst hohe strukturelle Diversität des Spacers zu gewährleisten, ist die kovalente Bindung desselben an die feste Phase sicherlich die schlechteste Wahl. Bisher ist jedoch noch keine Festphasensynthese unter Immobilisierung von Schraders Bisphosphonaten oder Schmucks Guanidiniocarbonylpyrrolen beschrieben. Schmucks Bindungsmotiv wurde zwar bereits in Festphasenuntersuchungen eingesetzt, dabei wurde der Pyrrolbaustein aber erst nach kombinatorischer Variation eines Peptides an den freien -Terminus gebunden. Ein derartiges Protokoll ist jedoch für die ptimierung eines internen Spacers ungeeignet. Daher ist die Entwicklung eines adäquaten Festphasenprotokolls zur ptimierung dieses Spacers eine weitere erausforderung dieser Arbeit. Bei erfolgreicher Immobilisierung von Schmucks Carboxylatbindungsmotiv wäre dies aufgrund der vielseitigen Einsatzmöglichkeiten der Struktur ein Fortschritt nicht nur für die hier vorgestellte spezielle Anwendung. Darüber hinaus können immobilisierte Guanidiniocarbonylpyrrole in vielen weiteren Gebieten verwendet werden. Beispiele hierfür sind Untersuchungen zur heterogenen Katalyse, die Entwicklung von Rezeptoren nicht nur für Peptide oder chromatographische Anwendungen.
54 3 Ergebnisse und Diskussion 3.1 Ein künstlicher Rezeptor für das C-terminale Peptid D-Ala-D-Ala In diesem Abschnitt wird die Entwicklung eines künstlichen Rezeptors für den D-Ala- D-Ala-C-Terminus von Peptiden vorgestellt. Dabei wurde auf die Vorarbeiten von Wienand zurückgegriffen, der einen ersten Rezeptor 1 bereits synthetisiert, aber noch nicht charakterisiert hatte. [92] Voruntersuchungen Zunächst wurde die zur Verfügung stehende Probe des Rezeptors 1 Cl spektroskopisch charakterisiert und die molekulare Struktur bestätigt. Aufgrund der in Kapitel erwähnten Chiralität der Cyclotribenzyleneinheit enthält 1 zwei stereogene Einheiten. Während der Synthese für 1 wurde die Aminosäure Iodalanin enantiomerenrein eingesetzt und mit einem Racemat des Iodocyclotribenzylens gekuppelt. Auch im weiteren Verlauf der Synthese wurde keine Trennung der Diastereomere unternommen, so dass es sich bei 1 um ein Diastereomerengemisch handelt. Im Rahmen dieser Arbeit wurde eine Trennung dieses Gemisches mit ilfe der RP18-PLC versucht. Allerdings konnte für den betreffenden Peak auch nach einer Retentionszeit von mehr als 20 min auf der Säule keinerlei Antrennung der Diastereomere erreicht werden.
55 Ergebnisse und Diskussion 41 Abbildung 3.1: PL-Chromatogramm des Rezeptors 1 (Diastereomerengemisch). Bedingungen: Supelcosil LC-18, 25 cm 4.6 mm, 5μm; 5 min 2 /Me 2:3, jeweils % TFA, 1.0 ml/min. Dies ist ein ersten inweis darauf, dass die beiden Diastereomere sterisch und elektronisch sehr ähnlich sind. Darüber hinaus stellt man bei genauerer Betrachtung der Struktur des Rezeptors fest, dass der Unterschied lediglich in einer Anknüpfung des Cyclotribenzylens über die 4- bzw. die 5-Position am Aromaten liegt. In der berechneten Struktur des Komplexes (vgl. Abbildung 2.31) stellt dies jedoch nur einen marginalen Unterschied dar. Theoretische Berechnungen ergeben für beide Diastereomere eine nahezu identische Komplexstruktur. Die Versuche zur Trennung der beiden Diastereomere wurden daraufhin eingestellt. Der Rezeptor 1 wird im Folgenden immer als Diastereomerengemisch verwendet. Der Rezeptor wurde nun auf seine Löslichkeit in wässrigen Medien hin überprüft. Dabei stellte sich heraus, dass in reinem Wasser keine für Bindungsstudien ausreichende Löslichkeit erzielt werden konnte. Da jedoch mit der Zielsetzung der Beobachtung der hydrophoben Wechselwirkung in wässrigen Medien gearbeitet werden sollte, wurden Versuche unternommen, durch sukzessive Zugabe von DMS eine Lösung herzustellen. In qualitativen Vorversuchen deutete sich an, dass nach Zugabe von 10 % DMS zu einer wässrigen Suspension der Rezeptor sich aufzulösen begann. un wurde eine Versuchsreihe durchgeführt, um die Löslichkeit von 1 näherungsweise zu quantifizieren. Dazu wurden Lösungen mit variierender Konzentration von 1 in 10 % DMS in gepuffertem Wasser bei p 6 hergestellt. Die genaue Vorgehensweise ist in Abschnitt beschrieben. Die Lösungen wurden im Ultraschallbad äquilibriert, danach filtriert und UV-spektroskopisch vermessen. Falls sich also ein iederschlag bilden sollte, wird der ausgefallene Teil von 1 durch die Filtration entfernt. Für diesen Fall ist also eine geringere Absorption im Vergleich mit der nach Lambert-Beer berechneten zu erwarten. Zunächst wurde die Lösung über einen Cellulose-Rundfilter
56 42 Ergebnisse und Diskussion mit einer Porengröße von ca. 2 μm filtriert und die Absorption bei 300 nm (Pyrrol- Bande) bestimmt. Bis zu einer Konzentration von ca. 80 μm kann ein linearer Anstieg beobachtet werden, wie er nach Lambert-Beer zu erwarten ist. In Konzentrationsbereichen oberhalb von 80 μm wird eine Abweichung nach unten beobachtet. Dies ist durch eine beginnende Selbstaggregation von 1 oder der Bildung eines durch die Filtration abgetrennten iederschlages zu erklären. Die experimentelle Beobachtung wird gestützt durch die makroskopisch erkennbare Schaumbildung für Lösungen mit c(1) > 110μM. Der Rezeptor verfügt mit der Guanidiniumeinheit über einen sehr hydrophilen Teil und mit der Cyclotribenzyleneinheit über einen sehr hydrophoben Teil. Dieser tensidische Charakter ist vermutlich für die Schaumbildung verantwortlich Abbildung 3.2: Absorption bei 300 nm einer Lösung variierender Konzentration von 1 nach Filtration über (a) einen Cellulose-Rundfilter der Porengröße 2 μm und (b) nach Filtration über einen Spritzenaufsatzfilter der Porengröße 0.45 μm. Die gestrichelte Linie zeigt das erwartete Verhalten nach Lambert-Beer bei idealer Löslichkeit an. Stichprobenartig wurden nun einige dieser Lösungen ein weiteres Mal über einen Spritzenaufsatzfilter mit einer Porengröße von 0.45 μm filtriert und vermessen, um auszuschließen, dass ein feiner, kolloidartiger iederschlag den Rundfilter passiert haben könnte. Dieser Verdacht lag zunächst nahe, da eine Filtration über den Spritzenaufsatzfilter eine Verminderung der UV-Absorptionen der Lösung verursachte. Bei näherer Betrachtung der Werte stellt man jedoch fest, dass die Absorption zunächst fast überhaupt nicht ansteigt, bei höheren Konzentrationen aber wieder nahezu parallel zur ersten Datenreihe verläuft. Eine Antwort auf diese Frage findet man nach näherer Betrachtung der erstellerangaben. Die verwendete Membran weist, im Gegensatz zum Cellulose-Rundfilter, hydrophobe Eigenschaften auf. Vermutlich wird die berfläche der Membran mit dem stark hydrophoben Rest der Cyclotribenzyleneinheit in 1 gesättigt. Erst nach Eintritt dieser Sättigung kann 1 den Filter passieren und in der
57 Ergebnisse und Diskussion 43 Lösung eine UV-Absorption verursachen, deshalb steigt sie erst bei höheren Konzentrationen wieder linear an. Insgesamt konnte mit dieser Methode bestätigt werden, dass für den Konzentrationsbereich, der für eine Charakterisierung mittels UVoder Fluoreszenztitration erforderlich ist (c M), eine ausreichende Löslichkeit des Rezeptors 1 vorlag. In einem weiteren Versuch sollte die Frage geklärt werden, ob im Falle einer Verdünnung, wie sie im Verlaufe einer UV-Titration zur Bestimmung von Assoziationskonstanten zu erwarten ist, eine Abweichung vom idealen Verhalten, welches nach dem Lambert-Beerschen Gesetz berechnet werden kann, auftritt. eben einer, möglicherweise kinetisch gehinderten, iederschlagsbildung, kann auf diese Weise auch der Einfluss einer ggf. stattfindenden Selbstassoziation von 1 auf den UV- Absorptionskoeffizienten ausgeschlossen werden. Es wurde also eine Lösung des Rezeptors in 10 % DMS in gepuffertem Wasser bei p = 6 hergestellt und mit demselben Lösemittel verdünnt. Wie in Abbildung 3.3 zu erkennen ist, stimmt die experimentell beobachtete UV-Absorption mit der theoretisch berechneten sehr gut überein. Abbildung 3.3: Verdünnungsreihe des Rezeptors 1. Das in die UV-Küvette vorgelegte Volumen von 1.8 ml (x = 0) wurde sukzessive auf 3.28 ml verdünnt. Die Punkte zeigen die Messdaten an, die gestrichelte Linie indiziert das nach Lambert-Beer berechnete Verhalten. Mit absoluter Sicherheit kann eine Selbstassoziation auf diese Weise nicht ausgeschlossen werden. Denkbar ist beispielsweise, dass die UV-Absorption bei 300 nm durch die Assoziation nicht beeinträchtigt wird. Es werden aber für UV- Messungen ohnehin Lösungen mit sehr niedrigen Konzentrationen verwendet und die
58 44 Ergebnisse und Diskussion auftretende Verdünnung im Verlauf der Titration ist gering. Sollte also in späteren Titrationen eine Abweichung von der UV-Absorption beobachtet werden, so kann aufgrund der verwendeten Methode ausgeschlossen werden, dass diese von Selbstassoziations- oder Verdünnungseffekten verursacht wird. Eine auftretende Abweichung muss also durch eine Wechselwirkung des Rezeptors 1 mit dem Substrat, also durch eine Komplexbildung verursacht werden Methoden zur Bestimmung von Bindungskonstanten Die Bindungskonstante oder Assoziationskonstante eines Komplexes beschreibt mit ilfe des Massenwirkungsgesetzes das Verhältnis aus frei in Lösung vorliegenden Molekülen einerseits und dem daraus gebildeten Komplex andererseits. Assoziationskonstante K a und Dissoziationskonstante K Diss verhalten sich reziprok zueinander. Bilden ein Rezeptor R und ein Substrat S mit einer 1:1-Stöchiometrie einen Komplex RS so gilt: K a [ RS] 1 = [ R] [ S] K Diss = (3-1) Zur Bestimmung der Assoziationskonstante eines Rezeptors und seines Substrates in Lösung stehen mehrere Methoden zur Verfügung. [97,98] Diese können eingeteilt werden in thermochemische oder spektroskopische Methoden. Eine thermochemische Methode ist die Kalorimetrie. Dabei wird die Energie Δ gemessen, die beim Mischen der Moleküle durch die Bildung des Komplexes frei bzw. verbraucht wird. Der achteil dieser Methode ist jedoch die notwendige Anschaffung eines sehr empfindlichen Messgerätes zur Bestimmung der bei der Komplexbildung normalerweise recht klein ausfallenden Wärmetönung. Prinzipiell können alle spektroskopischen Methoden zur Bestimmung einer Bindungskonstante herangezogen werden, die die folgenden zwei Voraussetzungen erfüllen: Die in Lösung befindlichen Moleküle müssen ein quantifizierbares Signal (Absorption, Fluoreszenz, chemische Verschiebung, o. ä.) liefern und mit der gewählten Methode ein messbarer Unterschied zwischen den frei in Lösung befindlichen Molekülen einerseits und dem Komplex aus beiden andererseits detektierbar sein. Limitiert sind die Methoden prinzipiell nur durch ihre Empfindlichkeit. Während für die Aufnahme eines UV- oder Fluoreszenzspektrums bereits Konzentrationen von 10-5 M oder noch weniger ausreichend sind, so erfordert die MR-Spektroskopie (ebenso wie die Mikrokalorimetrie) Konzentrationen von 10-3 M. Unabhängig von der Methode
59 Ergebnisse und Diskussion 45 wird im Verlaufe einer solchen Titration eine Lösung des einen Bindungspartners vorgelegt und eine Lösung des anderen Bindungspartners sukzessive zugegeben. Eine mathematische Analyse der Bindungsisotherme, also der Änderung des beobachteten Signals im Titrationsverlauf bei konstanter Temperatur, liefert dann die Assoziationskonstante. Bevor eine quantitative Bestimmung von K a durchgeführt werden kann, muss zunächst die Stöchiometrie des Komplexes bestimmt werden um zu untersuchen, ob Formel 3-1 überhaupt zutrifft. Als einzige etablierte Methode für die Bestimmung der Stöchiometrie in Lösung steht die Methode der kontinuierlichen Variation der molaren Zusammensetzung zur Verfügung. [99] Dabei wird bei konstanter Gesamtmolarität ([Rezeptor] + [Substrat]) der Molenbruch X variiert, der wie folgt definiert ist: [ R] [ R] [ S] X = R + (3-2) Für jeden Molenbruch X wird nun die von der Komplexbildung verursachte Änderung einer konzentrationsunabhängigen bservablen (z. B. Δδ, Δε, o. ä.) ermittelt. Diese wird nochmals mit dem Molenbruch multipliziert. Die so erhaltenen Werte werden als Funktion von X aufgetragen. Der erhaltene Graph wird Job-Plot genannt. Anhand der Lage des Maximums ist die Stöchiometrie des Komplexes erkennbar. Ein Wert von X R = 0.5 indiziert eine 1:1-Stöchiometrie, während X R = 0.33 einem Komplex aus einem Rezeptor- mit zwei Substratmolekülen entspricht. Um ein eindeutiges Maximum zu erhalten, sind jedoch ein stabiler Komplex sowie eine deutliche Änderung der jeweiligen bservablen Voraussetzung. Ein weiterer achteil der Methode ist, dass nicht zwischen 1:1-Komplexen und deren Vielfachen (2:2, 3:3, etc.) unterschieden werden kann. Ein eindeutigeres Ergebnis bezüglich der Komplexstöchiometrie liefert die massenspektroskopische Analyse. Anhand des Isotopenmusters kann sogar zwischen einem 1:1- und einem 2:2-Komplex unterschieden werden. Allerdings vermitteln MS- Methoden immer nur ein Bild der Gasphase, dieses muss nicht zwangsläufig mit dem Verhalten der Moleküle in Lösung übereinstimmen. Weitere Effekte wie die Ionisierbarkeit des Komplexes oder seine Stabilität in der Gasphase spielen eine bedeutende Rolle. Bessere Ergebnisse über die Situation in Lösung können jedoch ESI- MS-Experimente liefern. Bei dieser Methode findet die Ionisierung aus der Lösung heraus statt. Ein starkes MS-Signal des Komplexes stellt zumindest einen guten inweis dar. Dennoch kann nicht ausgeschlossen werden, dass dieses Signal durch unspezifische Assoziation verursacht wird. Die Abwesenheit eines Komplex-Signals
60 46 Ergebnisse und Diskussion spricht jedoch nicht gegen ein in Lösung vorliegendes Assoziat, da eine Destabilisierung des Komplexes durch die Ionisierung verursacht werden kann. Als weitere Methode kann auch die Kristallstrukturanalyse herangezogen werden. Diese liefert ein eindeutiges Bild der Struktur der analysierten Probe, allerdings haben hier Packungseffekte bei der Ausbildung der Kristallstruktur einen starken Einfluss. Deshalb sollten auch aus dieser Methode keinesfalls unkritisch Rückschlüsse auf den Komplex in Lösung gezogen werden. Darüber hinaus werden für die Kristallstrukturanalyse Einkristalle benötigt. Deren erstellung durch Kristallisation ist aber oftmals problematisch UV- und Fluoreszenzspektroskopie Für den Rezeptor 1 kommen aufgrund seiner begrenzten Löslichkeit nur UV- oder Fluoreszenz-spektroskopische Bindungsstudien in Frage. Voraussetzung dafür ist eine Absorption im UV/Vis-Bereich bzw. eine messbare Fluoreszenz. Die Absorption ist durch die Gegenwart des eteroaromaten des Guanidiniocarbonylpyrrols gegeben, das Pyrrol absorbiert typischerweise im Bereich von 300 nm. Der Rezeptor wurde gelöst und ein definiertes Volumen einer bekannten Konzentration in einer UV-Küvette vorgelegt. ach Aufnahme des Spektrums dieser Lösung konnte der Absorptionskoeffizient α R des Rezeptors bei einer gegebenen Wellenlänge bestimmt werden. Zu der Lösung wurden nun definierte Volumina einer Substratlösung bekannter Konzentration sukzessive zutitriert. Falls keinerlei Wechselwirkungen zwischen den beiden Molekülen auftreten und das zutitrierte Substrat keine Absorption bei der beobachteten Wellenlänge aufweist, so wird eine Verdünnung nach dem Lambert-Beerschen Gesetz (Gleichung 3-5) beobachtet, wie sie z. B. in Abbildung 3.3 zu erkennen ist. Die Absorption geht mit unendlicher Verdünnung asymptotisch gegen null. Falls der Einfluss einer möglichen Selbstaggregation auf die Absorption ausgeschlossen wurde, so ist jede Abweichung von diesem Verhalten als Bildung eines Komplexes aus Rezeptor und Substrat interpretierbar. Eine Abweichung vom Lambert-Beer-Verhalten tritt dann auf, wenn sich die Absorption des Komplexes von der Summe der Absorptionen seiner Bestandteile unterscheidet. Sobald dieser Komplex in Lösung vollständig gebildet wurde, ändert sich die relative Absorption auch bei weiterer Zugabe von Substrat nicht mehr. Eine weitere Volumenzugabe im Verlauf der Titration führt dann nur noch zu einer Verdünnung, die im Idealfall ebenso dem Lambert-Beerschen Gesetz gehorcht. Je früher diese Sättigung erreicht ist, desto größer ist die Assoziationskonstante. Im Folgenden werden die mathematischen Grundlagen dieser Methode vorgestellt. Dabei werden die folgenden Variablen verwendet:
61 Ergebnisse und Diskussion 47 A = Absorption (dimensionslos) ΔA = Änderung der Absorption α R = Absorptionskoeffizient des Rezeptors R (analog S und RS) in L mol -1 cm -1 c = Konzentration in mol L -1 d = Schichtdicke der Probe in cm [R] = Konzentration des an einem Punkt des Titrationsverlaufes frei in Lösung vorliegenden Rezeptors (analog S und RS) in mol L -1 [R Σ ] = Konzentration des an einem Punkt des Titrationsverlaufes insgesamt (also sowohl frei, als auch im Komplex) in Lösung vorliegenden Rezeptors (analog S) in mol L -1 [R 0 ] = Konzentration der Rezeptorstammlösung (analog S) in mol L -1 V v = In die Küvette vorgelegtes Volumen in L V z = Volumen der bis zum betreffenden Datenpunkt zutitrierten Lösung in L ach Formel 3-1 ist die Assoziationskonstante abhängig von der frei in Lösung vorliegenden Konzentration von Rezeptor, Substrat sowie des Rezeptor-Substrat- Komplexes. Da diese im Gegensatz zu [R Σ ] nicht durch die Kenntnis der Konzentration der Stammlösung zugänglich ist, benötigen wir den folgenden Zusammenhang: [ R ] [ R] + [ RS] [ R] = [ R ] [ RS] = (3-3) Analog gilt für das Substrat: [ S ] [ S] + [ RS] [ S] = [ S ] [ RS] = (3-4) Das Lambert-Beersche Gesetz lautet: A = α c d (3-5) Da der Absorptionskoeffizient α in L mol -1 cm -1 angegeben ist und auch die in dieser Arbeit verwendeten Küvetten alle eine Dicke von 1 cm aufweisen, entfällt dieser Term und die beobachtete Absorption ergibt sich direkt als Summe der Produkte aller Absorptionskoeffizienten mit den dazugehörigen Konzentrationen:
62 48 Ergebnisse und Diskussion [ R] + α [ S] + [ RS] A = α α (3-6) R S RS Außerdem wird Δα definiert als Abweichung des Absorptionskoeffizienten des Rezeptor-Substrat-Komplexes von der Summe der einzelnen Absorptionskoeffizienten des Rezeptors und des Substrates: Δ α = α α α (3-7) RS R S In Gleichung 3-6 wird nun [R] durch Gleichung 3-3 und [S] durch Gleichung 3-4 ersetzt. Unter Berücksichtigung von 3-7 wird die folgende Gleichung erhalten: A [ R ] + α [ S ] + Δα [ RS] = R S α (3-8) Substitution der Rezeptor-Substrat-Konzentration durch das Massenwirkungsgesetz 3-1 liefert: A [ R ] + α [ S ] + Δα K [ R] [ S] = R S a α (3-9) Linearkombination von 3-1 und 3-3 unter Eliminierung von [RS] ergibt: [ R ] [ R] [ R] [ S] [ R] [ R ] [ S] + 1 K a = = (3-10) K a So dass nun [R] in 3-9 mit ilfe von 3-10 eliminiert werden kann: [ R ] [ S] [ S] + 1 Δα K a A = α R [ R ] + α S [ S ] + (3-11) K a eben der zu bestimmenden Variablen K a sind in Gleichung 3-11 noch zwei weitere, experimentell nicht direkt zugängliche Variablen enthalten. Dies sind Δα (da α RS nicht gemessen werden kann) und die freie Substratkonzentration [S]. Letztere ergibt sich aus der Abnahme der Gesamtkonzentration [S Σ ] durch Komplexbildung. Diese kann durch ein Taylorpolynom approximiert werden, welches nach der Entwicklung des ersten Gliedes abgebrochen wird: [100]
63 Ergebnisse und Diskussion 49 [ S] [ S ] K a [ R ] [ S ] 2 ( 1 + K [ S ]) + K [ R ] a a (3-12) Einsetzen von 3-12 in 3-11 ergibt: [ R ] + α [ S ] Δα K 2 2 Δα Ka [ ][ ] [ R ] [ S ] a R S 2 ( 1 + Ka [ S ]) + Ka [ R ] 2 Ka [ ] [ R ][ S ] S ( 1 + K [ S ]) + K [ R ] A = α R S + (3-13) K a a a In dieser Gleichung gibt es nur noch zwei nicht direkt zugängliche Variablen, nämlich Δα und K a. [R Σ ] und [S Σ ] sind zwar bei Kenntnis der Konzentration der Stammlösungen zugänglich, verändern sich aber im Titrationsverlauf. Das vorgelegte Rezeptorvolumen wird mit V v und das Volumen der zutitrierten Substratlösung wird mit V z bezeichnet. Dann gilt: [ R ] = [ R ] V 0 v (3-14) v V + V z Ebenso gilt für die vorliegende Substratgesamtkonzentration [S Σ ]: [ S ] = [ S ] V 0 z (3-15) v V + V z Die Gleichungen 3-14 und 3-15 gelten natürlich nur unter der Prämisse, dass die Rezeptorlösung keine Substratmoleküle enthält und ebenso die Substratlösung frei von Rezeptormolekülen ist. Werden 3-14 und 3-15 in 3-13 eingesetzt, so erhält man den zugegebenermaßen recht unübersichtlichen Term Dieser setzt sich aus drei Summanden zusammen. Der erste Summand beschreibt die Absorption des Rezeptors, der zweite die Absorption des Substrates und der dritte und entscheidende Teil beschreibt die Abweichung von dieser Absorption, die durch die Bildung eines Komplexes verursacht wird. Diese hängt nur von Δα und K a ab.
64 50 Ergebnisse und Diskussion [ ] [ ] [ ] [ ] ( ) [ ] [ ] ( ) [ ] [ ] [ ] [ ] [ ] ( ) [ ] [ ] Δ + Δ = z v v a z v z a z v z v a z v z a z v v a z v z a z v z v a z v z v a z v z S z v v R V V V R K V V V S K V V V S V R K V V V S K V V V R K V V V S K V V V S V R K V V V S V R K V V V S V V V R A α α α α (3-16) Bei Kenntnis der vorgelegten und zutitrierten Volumina, der Konzentration der Rezeptor- und Substratstammlösung und den Absorptionskoeffizienten von Rezeptor und Substrat kann durch eine Regressionsanalyse Δα und die Bindungskonstante K a bestimmt werden. Diese mathematische Analyse wurde für die UV-Methode beschrieben. Für die Fluoreszenzspektroskopie gilt jedoch ebenfalls, unter der Prämisse der Abwesenheit von Quenching-Effekten, das Lambert-Beersche Gesetz. Daher ist Gleichung 3-16 auch für die Analyse einer Fluoreszenztitration geeignet Bestimmung der Assoziationskonstanten von 1 und D-Ala-D-Ala Bisher wurden also die mathematischen Grundlagen geklärt und durch Voruntersuchungen konnte der Einfluss einer Aggregatbildung von 1 auf die UV- Absorption im Verlauf einer Titration ausgeschlossen werden. un soll das Bindungsverhalten von 1 gegenüber seinem Zielsubstrat, dem D-Ala-D-Ala-C-Terminus geklärt werden. Als Modellpeptid dafür wurde das -acylierte Dipeptid Ac-D-Ala- D-Ala- 26 gewählt. Die Berechnungen zur Komplexstruktur wurden ebenfalls mit diesem Substrat durchgeführt (vgl. Abbildung 2.31). Zunächst wurde auch für den Komplex aus 1 und 26 versucht, die Stöchiometrie zu bestimmen. Dem Entwurf nach sollte es sich um einen 1:1-Komplex handeln, außerdem lässt die ideale elektrostatische Komplementarität dies erwarten. Diese Annahmen sollten jedoch durch experimentelle Beweise bestätigt werden, deshalb wurde ein Job-Plot mit einer Gesamtkonzentration von [R] + [S] = M aufgenommen. Als Lösemittel wurde 10 % DMS in gepuffertem Wasser bei p 6 gewählt. Leider sind die beobachteten Änderungen der Pyrrol-Bande bei 300 nm im UV-Spektrum sehr klein, so dass aus dieser Messreihe die Lage des Maximums nicht eindeutig bestimmt werden konnte. Zwar liegt der höchste gemessene Wert Δα R X R genau bei 0.5, was einem 1:1-Komplex entspräche, dennoch variieren die Werte zu stark, als dass allein hieraus die Stöchiometrie abgeleitet werden kann. eben der Aufnahme eines Job-Plots mit konstanter Gesamtmolarität kann dieser
65 Ergebnisse und Diskussion 51 auch aus den Molenbrüchen im Verlaufe einer Titration berechnet werden. Dabei wird allerdings die im Verlaufe der Titration zunehmende Ionenstärke, welche die elektrostatische Wechselwirkung schwächt, nicht berücksichtigt. Für jeden Messpunkt wird nun der Molenbruch X R bestimmt und die Abweichung Δα R berechnet. Entsprechend der nicht vollständig zutreffenden äherungen sehen diese Job-Plots oft asymmetrisch aus. Die Vielzahl der so erhaltenen Job-Plots aus den im Laufe dieser Arbeit durchgeführten Titrationen von 1 mit 26 lassen jedoch den Rückschluss zu, dass eine 1:1-Stöchiometrie vorliegt. Ferner wurden ESI-MS-Experimente mit diesen beiden Bindungspartnern durchgeführt. Die Ionisierung wurde aus einer wässrigen Lösung bei p = 6 vorgenommen. Leider ließ sich weder im positiven, noch im negativen Modus ein Peak detektieren, der einem Komplex zugeordnet werden kann. Dies ist jedoch nicht überraschend, da die Positionen, die mit Abstand am leichtesten (de-)protonierbar sind (Acylguanidin und Aminosäure), zentral am vorgeschlagenen Bindungsmodus teilnehmen. Eine Änderung der Protonierung würde die elektrostatische Wechselwirkung ausschalten und zu einer Destabilisierung des Komplexes in der Gasphase führen. Die Bestimmung der Stöchiometrie wurde in diesem Fall aber auch semiempirisch versucht. Zur Bestätigung der mit der Formel 3-16 berechneten Bindungskonstanten wurde auch das Programm SpecFit herangezogen. [101] Dabei handelt es sich um ein Programm zur Analyse von Titrationsverläufen. Vor der Bestimmung der Bindungskonstante muss eine Stöchiometrie vorgegeben werden. Dabei kann neben der 1:1- auch eine 1:2- oder eine 2:1-Stöchiometrie oder die Koexistenz mehrerer Komplexe nebeneinander eingestellt werden. Sämtliche mathematischen Analysen der Titrationen, die keine 1:1-Stöchiometrie vorgaben, hatten ein physikalisch nicht sinnvolles Ergebnis zur Folge bzw. der Fehler der mathematischen Anpassung wurde extrem hoch. Aus der Summe all dieser Beobachtungen wird nun geschlossen, dass der Komplex eine 1:1-Stöchiometrie aufweist. Deshalb wird die nun folgende Analytik mit ilfe der Formel 3-16 vorgenommen. Zunächst wurde der Rezeptor 1 gegen das Modellpeptid Ac-D-Ala-D-Ala- 26 titriert und die Änderungen im UV-Spektrum beobachtet. Eine Lösung von 1 in 10 % DMS in gepuffertem Wasser wurde vorgelegt und eine Lösung von 26 in demselben Lösemittel wurde sukzessive zugegeben. Um zu vermeiden, dass die beobachteten Änderungen im Spektrum lediglich auf den Einfluss des p-wertes zurückzuführen sind, wurde dieser vor und nach der Messung bestimmt. Als maximale Toleranz wurde eine p-änderung von Δp < 0.1 vorgegeben. Derartige Schwankungen können aufgrund des Messfehlers der p-bestimmung nie ganz ausgeschlossen werden. Messungen, bei denen der Toleranzwert überschritten wurde, wurden verworfen. In
66 52 Ergebnisse und Diskussion Abbildung 3.4 ist das UV-Spektrum im Verlauf der Titration abgebildet. Erwartungsgemäß nimmt die Absorption im Verlauf der Titration ab, da die Konzentration von 1 abnimmt und 26 über kein Chromophor im beobachteten Wellenlängenbereich verfügt Abbildung 3.4: Verlauf der Titration des Rezeptors 1 mit dem Substrat 26. Aus Gründen der Übersichtlichkeit sind nicht alle aufgenommenen UV-Spektren abgebildet. Zur Bestimmung der Assoziationskonstanten wurde nun die Absorption bei 300 nm analysiert. Deren Verlauf ist in Abbildung 3.5 dargestellt. Die Absorption weicht von der nach Lambert-Beer berechneten Verdünnung nach unten ab, was einem geringeren Absorptionskoeffizienten α RS für den Rezeptor-Substrat-Komplex in Vergleich zur Summe der einzelnen Absorptionskoeffizienten α R und α S entspricht. Im Verlauf der Titration geht diese Änderung in eine Sättigung über und die Abweichung von der Verdünnung bleibt konstant. Die Beobachtung einer Abnahme des Absorptionskoeffizienten (α RS < α R ) entspricht der Erwartung bei der Koordinierung eines Carboxylates durch ein Guanidiniocarbonylpyrrol, da ersteres Elektronendichte in den Aromaten schiebt. Diese Beobachtung wurde bereits für einfachere Guanidiniocarbonylpyrrole bei der Komplexierung von Carboxylaten gemacht.
67 Ergebnisse und Diskussion 53 Abbildung 3.5: Analyse der Absorption bei 300 nm im Verlauf der Titration von 1 vs. 26. Die Punkte zeigen die experimentell bestimmte Absorption bei 300 nm und die Linie den Verlauf der angepassten Funktion 3-16, aus der K a bestimmt wurde, an. Die gestrichelte Linie deutet den Verlauf bei einfacher Verdünnung nach Lambert-Beer an. Auf der Abszisse (die dem zugegebenen Volumen V z entspricht) sind die auf 1 bezogenen zutitrierten Äquivalente von 26 angegeben. Eine mathematische Analyse liefert eine sehr hohe Assoziationskonstante von K a = M -1. Der ebenfalls aus der Anpassung erhaltene mathematische Fehler wird an dieser Stelle nicht angegeben, da er ein irreführendes Bild der Genauigkeit der Bestimmung der Assoziationskonstanten liefert. Dieser Fehler gibt lediglich Auskunft über die Präzision der mathematischen Anpassung. Informationen über den Fehler der Methode können aber nur durch mehrfaches Wiederholen der Titration erhalten werden. Auch geringfügig veränderte absolute und relative Konzentrationen von Rezeptor und Substrat sollten zur gleichen Bindungskonstante führen. Die Titration von 1 und 26 wurde mehrfach wiederholt und der Fehler dieser Methode mit ΔK a = 25 % abgeschätzt. Darüber hinaus wurden die erhaltenen Bindungskonstanten durch eine Analyse der Titration mit dem Computerprogramm SpecFit bestätigt. Diese basiert auf den gleichen Annahmen wie sie bereits in Kapitel vorgestellt wurden. Allerdings können mit ilfe dieses Programms mehrere verschiedene Wellenlängen gleichzeitig analysiert und miteinander korreliert werden. ach erfolgreicher Bestimmung der Bindungskonstante mittels UV-Titration sollte die Bindungsstärke mit einer zweiten Methode unabhängig reproduziert werden. Aufgrund der begrenzten Löslichkeit des Rezeptors kam dafür nur die Fluoreszenzspektroskopie in Frage. Der Verlauf dieser Titration ist in Abbildung 3.6 dargestellt. Die Analyse mit ilfe von SpecFit lieferte für den Wellenlängenbereiches von 280 bis 380 nm eine
68 54 Ergebnisse und Diskussion Bindungskonstante von M -1. Auch dieser Wert wurde durch eine Analyse unter Verwendung der Formel 3-16 bestätigt. Abbildung 3.6: Verlauf der Titration des Rezeptors 1 mit dem Substrat 26. Aus Gründen der Übersichtlichkeit sind nicht alle aufgenommenen Fluoreszenzspektren abgebildet. Die gestrichelte Linie stellt das Spektrum der Bis-Tris-Pufferlösung ohne Substrat und ohne Rezeptor dar. Die in diesem Kapitel vorgestellten Titrationen sind nur zwei aus einer umfangreichen Reihe von Titrationen von 1 mit Ac-D-Ala-D-Ala- 26. Die Ergebnisse liegen jedoch für beide Methoden, die UV- und die Fluoreszenzspektroskopie, in derselben Größenordnung (K a = ± M -1 ). So konnte die hohe Bindungskonstante unabhängig bestätigt werden. Im nächsten Kapitel soll die Selektivität des Rezeptors untersucht werden Substratselektivität von 1 Um Informationen über die Selektivität des Rezeptors zu erhalten, wurden die Bindungskonstanten verschiedener Substrate gegenüber 1 bestimmt. Zunächst wurde der Rezeptor auf eine mögliche Enantioselektivität hin untersucht. Zu diesem Zweck wurden vergleichende Titrationen mit Ac-D-Ala-D-Ala- 26 und Ac-Ala-Ala- ent-26 durchgeführt. Ferner wurde bei diesen Studien die Konzentration des Bis-Tris- Puffers variiert. Mit einer Konzentration von 1-30 mm ist der Puffer im Verlauf der Titration die Komponente, die am meisten zur Ionenstärke der Lösung beiträgt. Mit dieser Messreihe sollen also Erkenntnisse über den Einfluss der Ionenstärke auf die Bindungskonstante gewonnen werden. Ferner sollen Messungen des p-wertes vor und nach der Titration die Frage klären, welche Pufferkonzentration für die Gewährleistung
69 Ergebnisse und Diskussion 55 eines stabilen p-wertes im Verlauf der Titration notwendig ist. Die Ergebnisse sind in Abbildung 3.7 zusammengefasst. Abbildung 3.7: Die Bindungskonstanten (logarithmische Auftragung) von 1 vs. 26 (DD) bzw. ent-26 (LL) in Abhängigkeit der verwendeten Pufferkonzentration. Aus der Auftragung ist zunächst zu erkennen, dass der Rezeptor im Rahmen der Fehlertoleranz (ΔK a = ± 25 %) keinerlei Enantioselektivität zeigt. Dies ist mit der hohen Flexibilität der Aminosäurenseitenkette in 1 durchaus zu erklären. Die Cyclotribenzylenhalbschale ist über ein sp 3 -Zentrum mit dem Rest des Moleküls verknüpft und daher frei drehbar. Weiterhin ist der Einfluss der Ionenstärke auf die Assoziationskonstante erkennbar, bei hohen Pufferkonzentrationen nimmt sie zwar leicht, aber messbar ab. Bei einer erhöhten Ionenstärke wird die Salzbrücke zwischen dem Carboxylat in 26 und der Guanidineinheit in 1 geschwächt. Die Zunehmende Ionenstärke stärkt zwar die hydrophobe Wechselwirkung, jedoch kann diese Stärkung die gleichzeitige Schwächung der Carboxylatkoordinierung nicht kompensieren. Erfreulich ist jedoch die Beobachtung, dass sich der p-wert auch bei den Messungen mit geringerer Pufferkonzentration im Verlauf der Titration nicht signifikant geändert hat. ffenbar sind Pufferkonzentrationen im Bereich von 10-3 M ausreichend, um stabile p-werte während der Titration zu gewährleisten und die Bindungskonstanten innerhalb des Fehlerbereiches reproduzierbar zu messen. Um eine mögliche Sequenzselektivität des Rezeptors zu klären, wurde dieser nun auf seine Bindungseigenschaften gegenüber anderen -acylierten Dipeptiden untersucht. Dabei wurden die Reste des Zielpeptides gezielt verändert, indem entweder ein Rest gewählt wurde, der sterisch zu anspruchsvoll ist, um in die Cyclotribenzylenhalbschale
70 56 Ergebnisse und Diskussion zu passen oder der Methylrest, der für die hydrophobe Wechselwirkung verantwortlich ist, fehlte. Für den ersten Fall wurde die Aminosäure Valin (R = ipr) gewählt, der zweite Fall wird durch die Aminosäure Glycin (R = ) repräsentiert. So wurden ein oder beide D-Ala-Reste in 26 durch Gly bzw. D-Val ersetzt. Die -acylierten Dipeptide, die nicht kommerziell erhältlich waren, wurden selbst an der festen Phase synthetisiert. Dies geschah unter Anwendung eines Standard-Fmoc-Protokolls an Wang-arz. eben diesen Dipeptiden wurde auch das Depsipeptid Ac-D-Ala-D-Lac- 27 hergestellt. Dieses spielt, wie in Kapitel ausführlich beschrieben, eine zentrale Rolle im Resistenzmechanismus u. a. von S. aureus Stämme. 27 konnte jedoch nicht über ein Standardprotokoll hergestellt werden, da das -ucleophil zur Knüpfung der Esterbindung nicht stark genug ist. Deshalb wurde 27 in Lösung hergestellt und nach semipräparativer PLC-Reinigung für die Bindungsstudien eingesetzt. Die Ergebnisse dieser Untersuchungen sind unten zusammengefasst. Tabelle 3-1: Zusammenfassung der Bindungskonstanten von 1 mit verschiedenen Substraten. Die Bestimmung der Bindungskonstanten erfolgte in 10 % DMS in gepuffertem Wasser ([Bis-Tris] 10-3 M, p 6.1). Der Fehler der Methode wird mit ΔK a ± 25 % angenommen. Substrat K a [M -1 ] log K Ac-D-Ala-D-Ala- (26) Ac-Ala-Ala- (ent-26) Ac-D-Ala-D-Lac- (27) Ac-D-Ala-Gly- (31) Ac-Gly-D-Ala- (30) Ac-D-Ala-D-Val- (29) Ac-D-Val-D-Ala- (28) Ac-Gly-Gly- (33) Ac-D-Val-D-Val- (32) - < 3.0 Ac-Ala- (ent-62) - < 3.0 Ac-Gly- (63) - < 3.0
71 Ergebnisse und Diskussion 57 Abbildung 3.8: Assoziationskonstanten des Komplexes von 1 mit verschiedenen -acylierten Dipeptiden in logarithmischer Auftragung. Zunächst ist festzustellen, dass das Zielpeptid 26 von allen Substraten am effektivsten gebunden wird. Wie bereits zuvor gezeigt wurde, weist 1 keine Enantioselektivität bei der Erkennung der Dipeptide auf, daher wird ent-26 mit nahezu identischer Assoziationskonstante erkannt. Das Depsipeptid Ac-D-Ala-D-Lac- 27 wird um ca. eine halbe Größenordnung schlechter gebunden, als das eigentliche Zielsubstrat, aber immer noch besser als die anderen Dipeptide. Dies ist ein guter inweis auf die Bedeutung der Seitenketten des Dipeptides, dennoch scheint auch die Amidbindung zwischen den beiden Aminosäuren von Bedeutung zu sein. Diese Erkenntnis deckt sich mit analogen Untersuchungen zur Struktur derartiger Komplexe aus Guanidiniocarbonylpyrrolen und Aminosäuren. [102] Verglichen mit dem Einbruch der Bindungsstärke im analogen Vergleich für das Vancomycinmolekül (ΔK a = 10 3 M -1 ) ist der Rückgang in diesem Fall jedoch noch moderat. Von größerer Bedeutung scheint dem Entwurf entsprechend die Seitenkette zu sein. Finden sich dort nicht zwei Methylreste in einer dem Alanin isosterischen Anordnung, so ist die Bindungskonstante um den Faktor 10 kleiner. Interessanterweise scheint es nicht von signifikanter Bedeutung zu sein, an welcher Position des Dipeptides die Alaninseitenkette angeordnet ist, da die vier Substrate Ac-D-Val-D-Ala- 28, Ac-D-Ala-D-Val- 29, Ac-Gly-D-Ala- 30 und Ac-D-Ala-Gly- 31 im Rahmen der Fehlertoleranz alle gleich gut binden. Da sie aber signifikant schlechter als 26 gebunden werden, kann es sich nicht um eine diffuse hydrophobe Wechselwirkung handeln. Diese These wird auch gestützt durch die schlechte Bindung von 1 zu Ac-D-Val-D-Val- 32, welches einen deutlich stärker hydrophoben Charakter hat. Trotz mehrfach durchgeführter UV-
72 58 Ergebnisse und Diskussion Titration konnte in keinem Fall eine Komplexbildung mit 32 dokumentiert werden. Dies indiziert, dass die Bindungskonstante unterhalb von K a < 10 3 M -1 liegt. Für diesen Fall wäre die gewählte Methode zur Bestimmung von K a nicht geeignet, da optimalerweise in einem Konzentrationsbereich von c (10 ±1 K Diss ) M gearbeitet werden sollte. Die Assoziationskonstante für den Komplex aus 1 und Ac-Gly-Gly- 33 liegt mit K a = M -1 ebenfalls an der unteren Grenze der Empfindlichkeit dieser Methode und unterhalb der der Alanin-haltigen Dipeptide. Die Aminosäuren Ac-Ala- ent-62 und Ac-Gly- 63 wurden ebenfalls untersucht. Es konnte aber in keinem der beiden Fälle eine Assoziation beobachtet oder eine Bindungskonstante bestimmt werden. Für den Rezeptor 1 kann abschließend gesagt werden, dass dieser dem Entwurf entsprechend das C-terminale Dipeptid D-Ala-D-Ala von allen untersuchten Substraten am besten bindet. Die als Modell gewählte Verbindung Ac-D-Ala-D-Ala- 26 wird in Wasser mit einer sehr guten Bindungskonstante komplexiert. Allerdings ist die Cyclotribenzylenseitenkette im Rezeptor zu flexibel, um eine Enantioselektivität zu erreichen, 26 und ent-26 werden innerhalb der Fehlertoleranz gleich gut gebunden. Auch die Position des Alanins im Dipeptid kann nicht erkannt werden, jedoch führt dessen Abwesenheit zu einem drastischen Abfall der Bindungsstärke. Die Experimente zur Ionenstärke des Lösemittels (Abbildung 3.7) deuten an, dass der auptteil der Bindungsenergie durch die Koordinierung des Carboxylates vom Guanidiniocarbonylpyrrol erreicht wird. Dennoch kann die hohe Assoziationskonstante damit allein nicht erklärt werden. Bis zu diesem Zeitpunkt liegen noch keine experimentellen Daten vor, die die Struktur des Komplexes im Detail aufklären können. Dennoch deuten alle Daten darauf hin, dass der computergestütze de novo Entwurf erfolgreich war und die Berechnungen zur Komplexstruktur zutreffen Ein wasserlösliches Derivat des Rezeptors 1 Um Informationen bezüglich der Komplexstruktur in Lösung zu erhalten, ist die MR- Spektroskopie ein sehr geeignetes Mittel. Bereits der Betrag der Änderung der chemischen Verschiebung (Δδ) der verschiedenen Signale im Verlauf der MR- Titration lässt gewisse Rückschlüsse auf die Komplexstruktur zu. Darüber hinaus liefern mehrdimensionale MR-Methoden zahlreiche Informationen, beispielsweise über die relative räumliche Anordnung der Atome im Komplex. Leider war eine Analytik von 1 mit ilfe der MR-Spektroskopie aufgrund der begrenzten Löslichkeit in wässrigen Lösemitteln nicht möglich. Deshalb wurde versucht, den Rezeptor in einer Weise zu modifizieren, die die Löslichkeit erhöht. Die Synthese und Analytik eines solchen wasserlöslichen Derivates ist Ziel dieses Abschnittes.
73 Ergebnisse und Diskussion Konzeption Um die Löslichkeit des Rezeptors zu erhöhen, können Löslichkeits-vermittelnde Reste an verschiedenen Stellen im Molekül kovalent gebunden werden. Dabei ist besonders dafür Sorge zu tragen, dass die Reste an einer Position angebracht werden, die die Komplexierung des Zielsubstrates strukturell nicht stört. Da keine experimentellen Daten zur Struktur des Komplexes vorliegen, basieren die Annahmen auf den theoretischen Berechnungen. In Abbildung 3.9 sind einige Beispiele zur Einführung eines Restes dargestellt, die im Folgenden diskutiert werden. (b) (a) (c) (c) (b) (b) 2 (d) Abbildung 3.9: Positionen im Rezeptor 1, an die Löslichkeits-vermittelnde Reste kovalent gebunden werden können. Zunächst bietet sich die Amid-Position (a) zur Funktionalisierung an. Diese Amidbindung wird in der Totalsynthese von 1 durch Transamidierung aus dem Methylester mit 3 dargestellt. Durch die Wahl eines substituierten Stickstoffnucleophils 2 R wäre eine die Einführung eines Restes relativ einfach möglich. Auch der hydrophobe Cyclotribenzylenrest ist modifizierbar, wobei sich die benzylischen Positionen (b) anbieten würden. Allerdings ist bereits die Synthese des monosubstituierten Cyclotribenzylens recht anspruchsvoll, daher wäre eine solche Substitution sicherlich eine große erausforderung, welche an dieser Stellt nicht angenommen wurde. Auch am Acylguanidin ist die Einführung eines Substituenten in Position (d) denkbar. Zu diesem Zweck stünde eine in unserem Arbeitskreis entwickelte Triflatroute bereit, [103] allerdings würde eine Veränderung an dieser Position relativ zentral am Bindungsmotiv eingreifen, indem sie beispielsweise den pk a -Wert der Guanidineinheit verändern würde. Dies muss sich nicht zwangsläufig negativ auf die Bindungsstärke auswirken. Dennoch würde sich deshalb ein Vergleich mit den in Abschnitt erhaltenen Daten schwieriger gestalten. Daher wurde auf eine Derivatisierung am Guanidin im Rahmen dieser Arbeit verzichtet. Die Funktionalisierung in 3- bzw. 4-Position des Pyrrols bietet sich an, da auf diesem Gebiet in unserem Arbeitskreis bereits gute Erfahrungen gesammelt wurden. Eine retrosynthetische Analyse mit den angestrebten Ausgangsverbindungen zur Synthese des wasserlöslichen Analogons ist in Abbildung 3.10 skizziert.
74 60 Ergebnisse und Diskussion R 1 R 2 R R 2 R 2 R 3 69: R 2 = C 2 -TEG- R 3 = Cbz 70: R 2 = C 2 -TEG-TBS R 3 = Boc 1: R 1,R 2 = R 1 2 TEG = 64: R 1 = 65: R 1 = (C 2 ) 2 Cbz Abbildung 3.10: Retrosynthetische Analyse von 1 unter Einführung der angestrebten Löslichkeitsvermittelnden Substituenten (R 1, R 2 ) und Schutzgruppen (R 3, TBS). ach der retrosynthetischen Spaltung der zentralen Amidbindung werden der Pyrrolbaustein und eine künstliche Aminosäure erhalten. Zur Erhöhung der Löslichkeit des Pyrrolbausteins können in 3- und 4-Position (R 2 ) Löslichkeits-vermittelnde Reste eingeführt werden. Zu diesem Zweck wurden Triethylenglykolketten gewählt. Diese können abermals terminal geschützt werden, beispielsweise mit einer tert-butyldimethylsilyl-schutzgruppe. Außerdem ist es sinnvoll, die Guanidineinheit mit einer Schutzgruppe (R 3 ) zu versehen und erst nach der Kupplung mit der künstlichen Aminosäure zu entschützen. Die künstliche Aminosäure kann entweder völlig analog zu 1 verwendet werden (64) oder es wird durch Transamidierung ein einfach Cbzgeschützter Ethylendiaminrest eingeführt (65) Erste Vorversuche zur Synthese des wasserlöslichen Analogons Zunächst wurde die Synthese der Ethylendiamin-funktionalisierten Aminosäure 65 versucht. ach der Kupplung zum fertigen Rezeptor kann die Cbz-Schutzgruppe durch katalytische ydrierung abgespalten werden. Dadurch wird in dieser Position ein primäres Amin erhalten, welches im wässrigen Medium positiv geladen ist. Dies sollte die Löslichkeit des Rezeptors in Wasser erhöhen. Es wurde das einfach Cbz-geschützte Ethylendiamin 66 Cl nach einer Literaturvorschrift synthetisiert. [104] Dies sollte nun mit dem Methylester der künstlichen Aminosäure (67) umgesetzt werden. 67 stand noch aus den Vorarbeiten von Wienand zur Verfügung. Eine einfache Transamidierung in
75 Ergebnisse und Diskussion 61 einem Methanol-Dichlormethan-Gemisch schlug fehl. Auch nach mehreren Tagen Rühren bei Raumtemperatur konnte auf der DC nur das Edukt 67 detektiert werden. Daher wurde der Methylester nach einer Standardmethode [105] basisch gespalten und die entstandene freie Säure mittels CTU an 66 Cl gekoppelt. 3 Cl + Me Boc (a), (b) Cbz Boc 66 Cl Abbildung 3.11: Synthese der funktionalisierten künstlichen Aminosäure 68: (a) 4 eq. Li, Me, C 2 Cl 2, 2, RT, 15 h, quant. (b) 66 Cl, CTU, 6-Cl-Bt, MM, DMF, RT, 15 h, 58 %. 68 wurde isoliert und eine spektroskopische Charakterisierung durchgeführt. 1 - und 13 C-MR-Spektren enthalten alle charakteristischen Signale der Verbindung 68. Die detaillierte Interpretation gestaltet sich jedoch schwierig, da es sich um ein Diastereomerengemisch mit zwei Carbamatschutzgruppen (Cbz und Boc) handelt, die jeweils zwei Rotamere aufweisen. Daher zeigt die Verbindung einen bis zu achtfachen Signalsatz. Aufgrund der albschalenkonformation der Cyclotribenzyleneinheit, sind auch die benzylischen Protonen im zentralen 9-Ring magnetisch nicht äquivalent. Dies führt insbesondere im 1 -MR-Spektrum zu unübersichtlichen und vielfachen Multipletts. Massenspektren wurden mit EI- und CI-Methoden aufgenommen, ein Molekül-Peak konnte jedoch nicht detektiert werden. Da zu diesem Zeitpunkt der Arbeit weder MALDI- noch ESI-MS zur Verfügung standen und die Route später verworfen wurde, erfolgte keine weitergehende Charakterisierung von 68 im Rahmen der vorliegenden Arbeit. Ein weiterer Ansatz zur Erhöhung der Löslichkeit in Wasser ist die Einführung von polaren Substituenten in 3- und 4-Position des Pyrrols. Dafür wurden Triethylenglykolreste gewählt. Diese erhöhen aufgrund ihrer stark polaren Eigenschaften und der guten Mischbarkeit mit Wasser die Löslichkeit von Strukturen, an die sie kovalent gebunden werden. Dennoch verfügen sie im wässrigen Medium über keine Ladungen. Aufgrund ihrer Fähigkeit zur Ausbildung von Salzbrücken sind geladene Einheiten im Rezeptor grundsätzlich in der Lage, die Komplexstöchiometrie oder struktur zu beeinflussen. Dieses Problem wird durch die Verwendung von Triethylenglykolketten umgangen. Ferner haben diese Reste bereits ihre Zweckmäßigkeit in ähnlichen Strukturen unter Beweis gestellt. [88] Zunächst wurde
76 62 Ergebnisse und Diskussion versucht, den substituierten Pyrrolbaustein ohne die Verwendung zusätzlicher Schutzgruppen auf den Triethylenglykolketten mit der künstlichen Aminosäure zu kuppeln. Ein erstes Ziel war also die Synthese des in Abbildung 3.10 dargestellten Pyrrolbausteins 69. Dazu wurde das Dibromid 71 in Triethylenglykol gelöst, mit Triethylamin versetzt und 24 Stunden bei 100 C gerührt. Im Gegensatz zur riginalliteratur wurde danach allerdings auf die wässrige Aufarbeitung verzichtet, da aufgrund der guten Löslichkeit des Produktes in Wasser bei diesem Schritt deutliche Ausbeuteverluste vermutet wurden. Stattdessen wurde die Lösung mit fünf Äquivalenten Wasser verdünnt und über eine RP18-Filtrationssäule mit einem Gradienten (Wasser Methanol) vorgereinigt. Auf diese Weise kann das Triethylenglykol aus der Mischung entfernt werden. Alle Fraktionen, die eine UV- Aktivität bei λ = 300 nm (Pyrrol-Bande) aufwiesen, wurden vereinigt und das Lösemittel entfernt. Das so erhaltene Rohprodukt wurde erneut durch eine Umkehrphasen-MPLC gereinigt. Auf diese Weise konnte die Ausbeute von 46 % auf gute 64 % gesteigert werden. Br Br (a) Abbildung 3.12: Synthese des wasserlöslichen Pyrrols 72: (a) 5 eq. Et 3, -TEG-, 100 C, 24 h, 64 %. un wurde der Ethylester in 72 basisch hydrolysiert. Die relativ schlechte Ausbeute der Spaltung von nur 56 % wurde im Rahmen dieser Arbeit bei α-pyrrolcarbonsäureestern häufig beobachtet. Sie beruht vermutlich auf dem positiven induktiven Effekt des elektronenreichen Pyrrols auf die Carbonsäure. Dieser Effekt wirkt sich negativ auf die Elektrophilie der Carbonylfunktion aus. Daher sind basische Verseifungen oder Umesterungen in dieser Position vergleichsweise schlecht durchzuführen. ach erfolgter Spaltung wurde ein Cbz-geschütztes Guanidin 73 [106] mit der entstandenen Carbonsäure verknüpft. Die schlechte Ausbeute von nur 12 % erklärt sich aus der sehr kurzen Reaktionszeit von nur 2 Stunden und kann sicherlich problemlos gesteigert werden. Da diese Route zur die Synthese eines wasserlöslichen Derivates von 1 aber letztendlich nicht erfolgreich war, wurde auf eine ptimierung der Schritte verzichtet. In dem auf diese Weise dargestellte Baustein können die beiden Schutzgruppen
77 Ergebnisse und Diskussion 63 voneinander unabhängig gespalten werden. Der tert-butylester in α-position des Pyrrols liefert unter sauren Bedingungen wie z. B. Trifluoressigsäure in Dichlormethan die Carbonsäure. [107,108] Unter diesen Bedingungen ist die Cbz-Schutzgruppe auf dem Guanidin stabil, kann aber durch katalytische ydrierung entfernt werden. -TEG TEG- -TEG TEG- tbu Et (a), (b) tbu Cbz Abbildung 3.13: Synthese des TEG-substituierten Bausteins 74: (a) 2 eq. Li, TF: 2 5:1, RT, 8 Tage, 56 %. (b) 73, CTU, DMAP, C 2 Cl 2, DMF, RT, 2 h, 12 %. Der tert-butylester in 74 konnte durch Rühren in einem Trifluoressigsäure- Dichlormethan-Gemisch zur Säure (69) gespalten werden. Dies wurde durch 1 -MR- Spektren bestätigt. Als Derivate der Cyclotribenzylen-Aminosäure standen die -Bocgeschützten Verbindungen 68 und 75 zur Verfügung. Die Synthese von 68 ist in Abbildung 3.11 skizziert, 75 wurde nach einer Vorschrift von Wienand dargestellt. [92] R 2 Boc (a), (b) R 2 -TEG TEG- R 3 + R 1 74: R 1 = tbu 69: R 1 = Cbz 75: R 2 = 68: R 2 = (C 2 ) 2 Cbz (c) 76: R 2 =, R 3 = Cbz 77: R 2 = (C 2 ) 2 Cbz, R 3 = Cbz 2: R 2 =, R 3 = 78: R 2 = (C 2 ) 2 2, R 3 = Abbildung 3.14: Versuche zur Synthese eines wasserlöslichen Derivates von 1 über die Cbz- Schutzgruppenstrategie am Guanidin: (a) Cl oder TFA. (b) CTU oder PyBP, MM. (c) 2, 10 % Pd/C. ESI-MS-Experimente einiger dieser Schritte zeigten eine erfolgreiche Reaktion an. Es gelang aber trotz umfangreicher Versuche im Rahmen dieser Synthesestrategie nicht, 2 oder 78 sauber zu isolieren. auptsächlich sind dafür zwei Gründe verantwortlich: Die chromatographische Reinigung dieser Verbindungen ist prinzipiell mit dem Problem des stark amphiphilen Charakters von 2 und 78 verbunden. Es werden sehr hydrophobe Reste wie das Cyclotribenzylen mit sehr hydrophilen Resten wie dem Triethylenglykol oder sogar Ladungen (primäres Amin in 78) in einem Molekül vereint.
78 64 Ergebnisse und Diskussion Ferner stellte sich die Verwendung der Cbz-Schutzgruppe in diesem Fall als sehr problematisch dar. Sowohl die Edukte, als auch die Produkte ergaben keine scharfen Spots auf der DC, sondern schmierten, falls sie überhaupt einen R f > 0 zeigten. Dies erschwert die Reaktionskontrolle enorm. Auch mit ilfe der MR-Spektroskopie konnte eine quantitative Spaltung schlecht nachgewiesen werden. eben den Aryl- und Benzylsignalen in der Cbz-Gruppe liegen zahlreiche weitere Aryl- bzw. Benzylgruppen im Molekül vor. Deshalb verschwinden die MR-Signale in diesem Bereich nicht vollständig. Besonders im Fall von 78 führt dies zu Schwierigkeiten, weil die vollständige Abspaltung von zwei Cbz-Schutzgruppen nachgewiesen werden muss. Darüber hinaus kann nicht ausgeschlossen werden, dass Teile der Cyclotribenzylenstruktur sensitiv auf eine katalytische ydrierung reagieren. Aus diesen Gründen wurde entschieden, als Schutzgruppe für das Guanidin die tert-butoxycarbonylgruppe (Boc) zu verwenden. Diese wurde bereits in strukturell verwandten Systemen erfolgreich eingesetzt. Außerdem ist der achweis einer quantitativen Spaltung wesentlich einfacher. Die tert-butylprotonen der Boc-Gruppe verursachen ein MR-Signal in einem Bereich, in dem der entschützte Rezeptor sonst keine Signale hat. Außerdem sollten die terminalen ydroxyfunktionen der Triethylenglykolketten geschützt werden. Dies verhindert ebenreaktionen im Verlauf der Synthese, bei denen die ydroxygruppe als konkurrierendes ucleophil eingreifen könnte. Vor allem aber wird die Aufarbeitung des geschützten Rezeptors dadurch wesentlich vereinfacht, weil der amphiphile Charakter des Moleküls reduziert wird. Boc Si Si 70 Abbildung 3.15: Voll geschützte Pyrrolcarbonsäure 70 als Synthesebaustein für den wasserlöslichen Rezeptor für den D-Ala-D-Ala-C-Terminus. Als Schutzgruppe für die ydroxygruppen in der Triethylenglykolkette wurde ein Silylether gewählt. Diese sind aufgrund ihrer xophilie leicht aus Alkoholen zu erhalten. Außerdem weisen sie eine gute Stabilität gegenüber schwach basischen Bedingungen auf. Dies ist notwendig, da die weitere Umsetzung der Carbonsäure unter basischen Kupplungsbedingungen stattfindet. Als idealer Baustein für die Verwendung zur Synthese des wasserlöslichen Rezeptors wurde also 70 postuliert. Die Synthese dieser Verbindung ist im folgenden Kapitel erläutert.
79 Ergebnisse und Diskussion Synthese des vollständig geschützten Pyrrolbausteins Zunächst wurde 70 retrosynthetisch analysiert. Die Freisetzung der Carbonsäure im letzten Schritt sollte möglichst quantitativ und unter milden (weder saueren, noch stark basischen) Bedingungen stattfinden. Deshalb wurde als Synthon der Benzylester gewählt. Dieser kann auch von derart elektronenreichen Carbonsäuren durch katalytische ydrierung leicht abgespalten werden. Vor der Abspaltung des Benzylesters sollen die Triethylenglykolketten TBS-geschützt werden. Retrosynthetisch lässt 70 auf die bereits vorgestellte Verbindung 72 zurückführen. TBS-TEG TEG-TBS R-TEG TEG-R -TEG TEG- Boc Bn Et tbu 70 85: R = TBS 86: R = 72 Abbildung 3.16: Retrosynthetische Analyse des voll geschützten Pyrrolbausteins 70. Wegen der bereits beschriebenen Probleme bei der Isolierung organischer Verbindungen mit ungeschützten Triethylenglykolketten wurde versucht, die TBS- Schutzgruppe zu einem möglichst frühen Zeitpunkt in das Molekül einzuführen. Es wurden die beiden ydroxyfunktionen in 72 mit atriumhydrid deprotoniert und tert-butyldimethylsilylchlorid zugegeben. Zur Katalyse dieser Reaktion und zum Abfangen von frei werdendem Cl wurde DMAP zugegeben, um eine Spaltung des tert-butylesters zu verhindern. Das an beiden Triethylenglykolsubstituenten TBSgeschützte Analogon 82 wurde so mit einer guten Ausbeute von 70 % erhalten. Der Ethylester in 82 wurde nun mit atriumbenzylat basisch umgeestert. Die Reaktion wurde im Vakuum durchgeführt, um das entstehende Ethanol durch den Rückflusskühler aus der Reaktionsmischung zu entfernen. Die moderate Ausbeute von nur 31 % 83 ist ebenfalls erklärbar. Die TBS-Gruppe weist zwar einen sterisch anspruchsvollen tert-butylrest auf, ist aber offenbar unter den stark basischen Bedingungen der Umesterung nicht vollständig inert gegenüber einem nucleophilen Rückseitenangriff.
80 66 Ergebnisse und Diskussion -TEG TEG- TBS-TEG TEG-TBS Et tbu (a) Et tbu (c) (b) -TEG TEG- TBS-TEG TEG-TBS Bn tbu (d) Bn tbu Abbildung 3.17: Synthese der Zwischenstufe 83: (a) a, TBS-Cl, DMAP, TF, 0 C auf RT, 14 h, 74 %. (b) abn, Bn, 20 mbar, 65 C, 1 h, 31 %. (c) ex. abn, Bn, 1 mbar, Rückfluss, 3 h, 70 %. (d) a, TBS-Cl, TF, 0 C auf RT, 14 h, 13 %. Aufgrund dieser schlechten Ausbeuten wurde eine alternative Synthese von 83 versucht. Es sollte erst basisch umgeestert und dann der TBS-Rest eingeführt werden. Der Benzylester 84 wurde durch Umesterung von 72 in atriumbenzylat in Benzylalkohol erhalten. Erneut wurde zur Entfernung des entstehenden Ethanols im Vakuum gearbeitet. Bei dieser Reaktion ist jedoch zu beachten, dass die Triethylenglykolseitenkette noch nicht geschützt vorliegt. Der pk a -Wert von ydroxygruppen am Glykol ist geringfügig niedriger als der von Alkoholen. [109] Im Fall einer Verwendung von weniger als zwei Äquivalenten Base würden also zunächst die beiden ydroxyfunktionen der Triethylenglykolketten deprotoniert werden. Die reaktive Spezies stellt bei der basischen Umesterung die deprotonierte ydroxyfunktion dar. So würde also trotz der Verwendung von Benzylalkohol als Lösemittel der Triethylenglykolsubstituent in 72 (ebenso in 84) als ucleophil reagieren. Auf diese Weise würde die unerwünschte intramolekulare Cyclisierung oder eine intermolekulare Reaktion von zwei Teilen 72 (oder 84) begünstigt. Dies kann durch die Verwendung eines Überschusses an Base vermieden werden. 84 wurde also aus einer Reaktion mit 13.5 Äquivalenten atrium in Benzylalkohol in einer guten Ausbeute von 70 % erhalten. Der Benzylester 84 wurde nun mit TBS-Cl unter Verwendung von atriumhydrid als Base umgesetzt. Dabei wurde eine Ausbeute von nur 13 % 83 (neben 42 % des einfach TBS-geschützten Analogons) beobachtet. Der Einsatz von atriumhydrid ist jedoch aufgrund seiner ungenauen Stöchiometrie kritisch. Es wird in einer Weißölsuspension von % Gehalt vorgelegt. Beim Einsatz von zwei Äquivalenten ergibt sich also bereits ein Fehler von ± 17 %. Ein Überschuss der Base würde das Pyrrol- abstrahieren, was den eteroaromaten destabilisiert und die
81 Ergebnisse und Diskussion 67 -Position zu einem guten Reaktionspartner für TBS-Cl macht. Ein Mangel an Base würde die bei der Reaktion von R und TBS-Cl frei werdende Salzsäure unvollständig abfangen. Es reichen jedoch schon katalytische Mengen an Säure aus, um den tert-butylester oder die TBS-Gruppen im Molekül zu spalten. Von den im Rahmen dieser Arbeit untersuchten Bedingungen lieferte die Verwendung von bis zu zwei Äquivalenten atriumhydrid und zusätzlichem DMAP die besten Ergebnisse. Aus Zeitgründen wurden jedoch nicht alle Versuche zur TBS-Schützung in dieser insicht optimiert. Es wurden nun zahlreiche Versuche unternommen, den tert-butylester in 83 zu spalten. Erfahrungsgemäß kann auch die TBS-Gruppe in Gegenwart von Trifluoressigsäure gespalten werden. Daher wurde ein unpolares aprotisches Lösemittel gewählt, in dem die verwendete Trifluoressigsäure nicht vollständig dissoziiert vorliegt und die freie Protonenkonzentration entsprechend niedrig bleiben sollte. Außerdem wurde versucht durch Erniedrigung der Temperatur die Selektivität zu erhöhen. Dennoch gelang es nicht, den Ester unter Erhaltung der TBS-Gruppen zum gewünschten Produkt 85 zu spalten. Es wurden lediglich Zersetzungsprodukte oder der Benzylester 86 erhalten, in dem auch die TBS-Gruppen gespalten sind. -TEG TEG- TBS-TEG TEG-TBS TBS-TEG TEG-TBS Bn (a) Bn tbu (a) Bn Abbildung 3.18: Fehlgeschlagene Versuche zur Synthese von 85, stattdessen konnte 86 isoliert werden. (a) TFA, C 2 Cl 2, wechselnde Volumenanteile und Temperaturen. Die ersten Versuche zur Synthese von 85 aus 83 wurden bei Raumtemperatur und Trifluoressigsäureanteilen von 20 % durchgeführt. achdem diese jedoch fehlgeschlagen waren, wurde 83 unter Argon in Dichlormethan gelöst und unter Verwendung eines Kryostaten auf -20 C gekühlt. un wurde tropfenweise Trifluoressigsäure zugegeben und gerührt. ach Zugabe von insgesamt ca. 30 Tropfen der Säure zeigte die DC-Kontrolle eine beginnende Reaktion an. Die Säurezugabe wurde also gestoppt und die Lösung bei -20 C gerührt. ach Rühren über acht konnte zwar das Verschwinden des Eduktes 83 nachgewiesen, jedoch kein Zielprodukt 85 isoliert werden. Es wurden lediglich Spaltprodukte wie 86 isoliert. ffenbar ist es also nicht möglich, den tert-butylester der α-pyrrolcarbonsäure in Gegenwart der TBS-Schutzgruppe zu spalten. Deshalb wurde diese Route verworfen und versucht, zunächst den tert-butylester zu spalten und erst danach die TBS-
82 68 Ergebnisse und Diskussion Schutzgruppe einzuführen. Zu diesem Zweck wurde 84 in einem -20 C kalten Trifluoressigsäure-Dichlormethan-Gemisch (1:4) gelöst. Unter DC-Kontrolle wurde das Gemisch langsam erwärmt und bei 5 C begann die Umsetzung des Eduktes. ach zwei Stunden konnte neben dem Produkt 86 und dem Edukt 84 auf der DC noch ein dritter Spot oberhalb dieser beiden Verbindungen (R f > R f (84) > R f (86)) detektiert werden. Dieser Spot indizierte eine beginnende Zersetzung von Produkt oder Edukt. Deshalb wurde die Reaktion abgebrochen und aufgearbeitet. Es konnten 40 % der Carbonsäure 86 isoliert werden. Darüber hinaus wurden ebenfalls 40 % des Eduktes 84 reisoliert, diese können erneut umgesetzt werden. -TEG TEG- -TEG TEG- TBS-TEG TEG-TBS Bn tbu (a) Bn (b) Bn Abbildung 3.19: Synthese von 86 und Versuch der TBS-Schützung der Substituenten: (a) 20 % TFA, C 2 Cl 2, 5 C, 2 h, 40 %. (b) a, 3 eq. TBS-Cl, 0 C auf RT, 2 h. achdem nun der tert-butylester gespalten war, wurde versucht die Triethylenglykolketten der Säure 86 als TBS-Ether zu schützen. Diese Schützung wäre von Vorteil, da in der nächsten Reaktion die Pyrrolcarbonsäure mit Boc-Guanidin 87 gekuppelt werden soll. In dieser Reaktion könnten die ydroxygruppen der Substituenten als konkurrierende ucleophile agieren und die Ausbeute verringern. Leider schlug jedoch der Versuch der TBS-Schützung der Verbindung 86 zur Synthese von 85 fehl. Aus diesem Grund wurde die Carbonsäure 86 direkt mit Boc-Guanidin 87 gekuppelt. Dies geschah unter Verwendung von CTU als Aktivierungsreagenz. Außerdem wurde ein leichter Überschuss (3.0 Äquivalente) von 87 eingesetzt, um den Ausbeuteverlust durch konkurrierende ucleophile wie die ydroxyfunktionen des Triethylenglykolrestes zu reduzieren. 88 wurde in einer Ausbeute von 45 % erhalten. Entscheidend für diese Stufe sind die sorgfältige Trocknung von 86 vor der Reaktion sowie die lange Reaktionszeit von drei Tagen. Die Ausbeute von 45 % wird als gutes Ergebnis eingestuft, da sich wie eben erwähnt konkurrierende ucleophile im Molekül befinden.
83 Ergebnisse und Diskussion 69 -TEG TEG- -TEG TEG- Bn (a) Bn Boc TBS-TEG TEG-TBS TBS-TEG TEG-TBS (b) Bn Boc (c) Boc Abbildung 3.20: Synthese des Pyrrolbausteins 70: (a) 87, CTU, DMAP, C 2 Cl 2, DMF, RT, 3 d, 45 %. (b) TBS-Cl, MM, Et 3, TF, RT, 3 d, 67 %. (c) 2, 5 % Pd/C, TF, 40 C, 2 h, quant. Die ydroxygruppen der Triethylenglykolkette in 88 konnten nun als TBS-Ether geschützt werden. Zu diesem Zweck wurde 88 in Tetrahydrofuran gelöst und mit -Methylmorpholin und TBS-Cl umgesetzt. Der Fortschritt der Reaktion wurde mittels DC verfolgt. Dies war gut möglich, da das Edukt 88, das einfach TBS-geschützte Zwischenprodukt und das Produkt 79 deutlich unterschiedliche R f -Werte aufweisen. Über mehrere Tage verteilt wurde unter Rühren bei Raumtemperatur sukzessive TBS-Cl zugegeben, bis das Edukt verschwunden war und 79 entsprechend der qualitativen UV-Detektion auf der DC den auptteil der Reaktionsmischung darstellte. ach Abbruch der Reaktion konnte das Produkt mit ilfe einer einfachen Säulenchromatographie an Si 2 in einer Ausbeute von 67 % isoliert werden. Mit der Verbindung 79 steht nun ein universell einsetzbarer Guanidiniocarbonylpyrrolbaustein mit Löslichkeits-vermittelnden Substituenten in 3- und 4-Position zur Verfügung. Dieser ist prinzipiell nach Freisetzung der Säure aus dem Benzylester durch Standard- Kupplungsbedingungen weiter zu verwenden. Diese ption soll im Rahmen der vorliegenden Arbeit genutzt werden. Besonders positiv ist bezüglich 79 zu bemerken, dass 79 ebenso wie die daraus synthetisierten Folgeprodukte mit ilfe einer ormalphasenchromatographie einfach zu isolieren sind. Ungeschützte Triethylenglykolsubstituenten bereiten üblicherweise Probleme bei dieser Art von Reinigung. Sie sind in der Lage im Laufmittel befindliche Wasseranteile zu koordinieren und zeigen daher häufig keinen klaren R f -Wert. Bis zu einem gewissen Maß kann dieses Problem durch Verwendung absolutierter Lösemittel und der Trocknung der stationären Phase umgangen werden. Dies ist allerdings sehr aufwändig und führt oft nicht zu guten Resultaten.
84 70 Ergebnisse und Diskussion Die für diese Arbeit relevante Zielverbindung 70 wurde durch katalytische ydrierung des Benzylesters in 79 dargestellt. Der Benzylester wurde in Tetrahydrofuran bei 40 C für zwei Stunden hydriert und 70 in quantitativer Ausbeute als Reinsubstanz erhalten. Auf diese Weise konnte also ein effizienter und einfacher synthetischer Zugang zum Pyrrolbaustein 70 geschaffen werden. Dessen weitere Verwendung zur Synthese eines wasserlöslichen Rezeptors für den D-Ala-D-Ala-C-Terminus wird im nächsten Kapitel vorgestellt Synthese eines wasserlöslichen Rezeptors für den D-Ala-D-Ala-C-Terminus Der Pyrrolbaustein 70 kann nun mit der künstlichen Aminosäure, die einen Cyclotribenzylenrest in der Seitenkette trägt, gekuppelt werden. Bisher wurden zwei Aminosäuren dieses Typs vorgestellt: Einerseits das einfache Amid 75, andererseits das Ethylendiamin-substituierte Aminosäurederivat Boc Cbz Boc Abbildung 3.21: -boc-geschützte Aminosäuren für die Kupplung mit dem Pyrrolbaustein 70. Die Verwendung von 68 birgt allerdings einige Probleme. Zum einen befindet sich in dem Molekül eine Cbz-Schutzgruppe. Aufgrund der schlechten Erfahrungen mit dieser Schutzgruppe im vorliegenden System (vgl. Abschnitt ) sollte deren Verwendung umgangen werden. Darüber hinaus gewährleistet der Gebrauch von 75 eine bessere Vergleichbarkeit mit den Ergebnissen aus den Bindungsstudien mit dem nichtsubstituierten Rezeptor 1. Dieser trägt ebenfalls in der C-terminalen Position ein einfaches Amid und wurde aus 75 synthetisiert. Deshalb wurde auf den Einsatz von 68 verzichtet und die Anstrengungen auf das einfache Amid 75 fokussiert. Da von 75 nur noch wenige Milligramm zur Verfügung standen, sollte diese Komponenten im Unterschuss eingesetzt werden. Zunächst wurde die Boc- Schutzgruppe in 75 nach einer Standardvorschrift von Wienand entfernt und die Verbindung 64 erhalten. [92] Diese wurde mit 1.2 Äquivalenten des Pyrrolbausteins 70 unter Verwendung von CTU umgesetzt. ach Säulenchromatographie an Silicagel konnte das vollständig geschützte Zielmolekül 80 in einer Ausbeute von 26 % isoliert werden.
85 Ergebnisse und Diskussion Cl 3 Cl + TBS-TEG TEG-TBS 70 Boc (a) 2 TBS-TEG TEG-TBS Boc 80 Abbildung 3.22: Der Schlüsselschritt zur Synthese des wasserlöslichen Rezeptoranalogons ist die Knüpfung der zentralen Amidbindung: (a) CTU, DMAP, C 2 Cl 2, DMF, RT, 24 h, 26 %. Die Ausbeute von 26 % liegt unterhalb der Erwartungen, insbesondere weil das vorliegende Amin 64 ein deutlich besseres ucleophil als die zuvor verwendeten acylierten Guanidine darstellt. Als ein möglicher Grund ist der gewählte Reaktionsmaßstab zu nennen, da nur 40 mg 64 Cl eingesetzt wurden. In einem derart kleinen Maßstab haben Verunreinigungen wie z. B. durch Lösemittel eingetragene Feuchtigkeitsspuren einen stärker störenden Effekt. Außerdem sind Triethylenglykolhaltige Verbindungen wie 70 oft hygroskopisch und daher aufwändiger zu Trocknen. Dennoch konnte 80 mit ilfe einer ormalphasen-chromatographie gut von den Verunreinigungen und den deutlich polareren Edukten abgetrennt und in einem sehr hohen Reinheitsgrad erhalten werden. Zu diesem Zweck wurde weder die stationäre noch die mobile Phase einer besonderen Trocknung unterzogen. Dennoch konnten scharfe R f -Werte erhalten werden. Dies ist bei vergleichbaren, nicht TBS-geschützten Triethylenglykol-haltigen Verbindungen nicht der Fall, es wurde also eines der Ziele der TBS-Schützung erreicht. Ein weiteres Ziel dieser Schützung war auch eine mögliche Trennung der Diastereomere. Wie Eingangs erwähnt, wurde im Verlauf der Synthese von 64 zwar die Aminosäure enantiomerenrein eingesetzt. Das planar-chirale Cyclotribenzylen wurde jedoch als racemisches Gemisch verwendet. Es handelt sich also bei 64 ebenso wie bei seinem Folgeprodukt 80 um ein Diastereomerengemisch. Aufgrund der ermutigenden Ergebnisse im Laufe der Isolierung von 80 wurde versucht, die beiden Diastereomere säulenchromatographisch zu trennen. Jedoch konnte auch unter Verwendung der MPLC nicht einmal eine Bildung von Doppelpeaks erkannt werden. Deshalb wurden weitere Trennungsversuche auf dieser Stufe unterlassen. 80 wurde als Diastereomerengemisch weiter umgesetzt. Im nächsten Schritt sollten die Schutzgruppen (TBS und Boc) entfernt werden. Die Spaltbarkeit des Silylethers durch Trifluoressigsäure wurde bereits im Verlauf dieser Synthese von 70 beobachtet (vgl. Abbildung 3.18). Die TBS- und die Boc-Schutzgruppe könnten also in einem Schritt im sauren Milieu gespalten werden. Es wurde jedoch bewusst der Umweg einer
86 72 Ergebnisse und Diskussion sukzessiven Entschützung gewählt, um eine Trennung der Diastereomere auf einer weiteren Stufe versuchen zu können. Die Spaltung der Silylether zur Verbindung 81 wurde mit Tetrabutylammoniumfluorid unter Erhaltung der Boc-Schutzgruppe durchgeführt. Allerdings gelang keine Trennung der Diastereomere auf dieser Stufe, auch nicht unter Verwendung der RP18-PLC. 81 wurde daher ohne weitergehende Charakterisierung zum vollständig entschützten Rezeptor 2 umgesetzt. 80 (a) R (b) 81: R = Boc 2: R = 2 Abbildung 3.23: Finale Entschützung zum Rezeptor 2: (a) TBAF, TF, 1 h bei 0 C, dann 20 min bei RT, 56 % (81). (b) 50 % TFA, Me, RT, 1 h, 60 %. Die Abspaltung der Boc-Schutzgruppe in 81 zum Zielmolekül 2 wurde in einem Trifluoressigsäure-Methanol-Gemisch bei Raumtemperatur durchgeführt. bwohl bewusst ein sehr polares Lösemittel zur Erhöhung der relativen freien Protonenkonzentration eingesetzt wurde, konnten neben 60 % des Produktes 2 auch noch nach einer Stunde Rühren bei Raumtemperatur ca. 30 % des Eduktes 81 reisoliert werden. Dies verwundert doch, da die Boc-Gruppe normalerweise schon unter wesentlich weniger polaren Bedingungen (z. B. in Dichlormethan) und mit deutlich geringeren Säureanteilen gespalten werden kann. Dennoch wurde auf den Einsatz einer stärkeren Säure wie z. B. Salzsäure verzichtet, da der Pyrrolbaustein nicht sonderlich stabil im sauren Medium zu sein scheint. Dies implizierte zumindest die Umsetzung des tert-butylesters 84 zur Säure 86 (vgl. Abbildung 3.19). Der Fortschritt der Spaltung der Boc-Schutzgruppe in 81 wurde mit ilfe der PLC kontrolliert. Produkt und Edukt können getrennt detektiert werden. Für beide Substanzen werden Zwillingspeaks detektiert, wie dies für Diastereomerengemische zu erwarten ist. Darüber hinaus ist aber zu erkennen, dass der Unterschied in der Retentionszeit auf der Säule für eine Trennung der Diastereomerenpaare nicht ausreicht.
87 Ergebnisse und Diskussion 73 Abbildung 3.24: PLC eines Gemisches aus 81 und 2. Bedingungen: Supelcosil LC-18, 25 cm 4.6 mm, 5μm; 5 min 2 /Me 1:1 dann in 40 min auf 100 % Me, jeweils % TFA, 1.5 ml/min. In dem Chromatogramm ist für jeden Zwillingspeak auch eine Schulterbildung zu erkennen. Diese kann darauf zurückzuführen werden, dass die Substanz nur in reinem Methanol vollständig aufgelöst werden konnte. Zu Beginn des Gradienten zur PLC- Analyse wird aber ein 1:1-Gemisch aus Wasser und Methanol verwendet. Unter diesen Bedingungen verursacht der auf die Säule aufgetragene Injektionsbolus eine Verschiebung in der Zusammensetzung des Laufmittels. Eine Trennung von 2 in seine Diastereomere wurde noch unter anderen Bedingungen auf RP18-Säulenmaterial versucht. Es konnte aber keine Trennung erreicht werden, offensichtlich sind sich die beiden Diastereomere strukturell einfach zu ähnlich. Der Rezeptor 2 konnte aber in einer sehr hohen Reinheit erhalten werden. Im PL- Chromatogramm wurde ein Anteil von > 98 % nach Detektion im UV-Bereich beobachtet. Dennoch ist das 1 -MR-Spektrum recht unübersichtlich. eben dem Vorliegen von zwei Diastereomeren trägt dazu auch die magnetische ichtäquivalenz der benzylischen Cyclotribenzylensignale bei. Eine Integrierung der Multipletts konnte nicht erfolgreich durchgeführt werden, da die nicht deuterierten Anteile des Lösemittels Methanol und die Verunreinigungen durch Wasser mit den Multipletts überlagern. Außerhalb dieser beiden Multipletts liegt nur ein weiteres Multiplett im aromatischen Bereich vor, was eine Kalibrierung und die Analyse der relativen Integrale ausschließt. Die Aufnahme eines Spektrums in DMS wäre zwar möglich, jedoch könnte dies Probleme bei der Reisolierung der Substanz aus der Probe bergen. Außerdem sind von den nicht deuterierten Anteilen Signalüberlagerungen im gleichen Bereich zu erwarten.
88 74 Ergebnisse und Diskussion eben der PLC zeigt jedoch auch die ESI-MS Analytik, dass 2 sehr sauber erhalten wurde. eben den Produktpeaks (a + und + -Addukt) konnte kein weiteres Signal von einer Intensität I > 2 % detektiert werden. Auch im negativen Ionenmodus konnten keine signifikanten Verunreinigungen beobachtet werden. Abbildung 3.25: Ausschnitt aus dem 1 -MR-Spektrum (400 Mz) von 2 Cl in [D 4 ]MeD (links) sowie dem ESI-MS-Spektrum derselben Probe im positiven Ionenmodus (rechts). Leider konnte der in 3- und 4-Position Triethylenglykol-substituierte Rezeptor 2 trotz umfangreicher Versuche nicht diastereomerenrein erhalten werden. Dies ist insbesondere im inblick auf eine mögliche MR-Analytik der Komplexe von achteil. Es wurde jedoch schon für den nicht substituierten Rezeptor 1 erwähnt, dass für die beiden Diastereomere kein signifikanter Unterschied in der Komplexbildung mit dem Zielsubstrat Ac-D-Ala-D-Ala- 26 zu erwarten ist. Dieselben Überlegungen gelten auch für den Rezeptor 2. Als zentrales Ergebnis bleibt jedoch festzustellen, dass 2 wesentlich besser in Wasser löslich ist als sein unsubstituiertes Analogon 1. Das erklärte auptziel der Erhöhung der Löslichkeit des Rezeptors in wässrigen Medien konnte also mit der erfolgreichen Darstellung von 2 erreicht werden Bindungsstudien mit dem wasserlöslichen Rezeptor 2 ach erfolgreicher Darstellung des zweifach Triethylenglykol-substituierten Rezeptors 2 wurde dieser ebenfalls bezüglich seines Assoziationsverhaltens gegenüber seinem Zielsubstrat untersucht. Diese Untersuchungen wurden unter den gleichen Bedingungen durchgeführt, wie sie im Fall des nicht substituierten Rezeptors 1 (vgl. Abschnitt 3.1.4) angewendet worden waren. Es konnte für die UV-Bindungsstudien von 2 allerdings auf die Zugabe von DMS als Cosolvens verzichtet werden. Der Rezeptor zeigte im benötigten Konzentrationsbereich eine gute Löslichkeit in Wasser. Für die Assoziation mit Ac-D-Ala-D-Ala- 26 wurde mit dieser Methode eine Bindungskonstante von K a = M -1 ermittelt. Diese liegt unterhalb der Assoziationskonstante für den Komplex aus 1 und 26 (K a = M -1 ). Ein Blick auf die berechnete
89 Ergebnisse und Diskussion 75 Vorzugskonformation des Rezeptors 2 in Lösung liefert jedoch eine Erklärung für diese Beobachtung. Abbildung 3.26: Perspektivische Darstellung der theoretisch berechnete Vorzugskonformation von [2+] + in 2 (MacroModel V 8.0, Amber*, 2, Schritte). Aus Gründen der Übersichtlichkeit sind nur die polaren Wasserstoffatome dargestellt. Die Sauerstoffatome in benzylischer Position zum Pyrrol in 2 sind in der Lage, Wasserstoffbrücken zu den Amid--Protonen in α-position des Pyrrols auszubilden. Diese Wasserstoffbrücken sind in Abbildung 3.26 als grüne gepunktete Linien dargestellt. Sie fixieren den Guanidiniocarbonylrest in einer cisoiden Konformation zum Pyrrol. Diese Konformation ist aber für die Koordinierung von Carboxylaten ungünstig. Daher muss die Wasserstoffbrücke für die Bildung eines Komplexes mit dem Substrat gebrochen werden. Dies verursacht energetische Kosten, so dass der Energiegewinn durch die Bindung des Substrates wieder vermindert wird. Makroskopisch ist deshalb eine geringere Bindungskonstante zu beobachten. Darüber hinaus darf nicht außer Acht gelassen werden, dass für die Analytik von 2 auf die Zugabe von 10 % DMS verzichtet wurde. Ein noch höherer Wasseranteil (100 % anstatt 90 %) schwächt jedoch nochmals die Salzbrücke zwischen dem Carboxylat und dem Acylguanidinium. Dieser Effekt kann offenbar nicht vollständig von der zunehmenden hydrophoben Wechselwirkung kompensiert werden. Dennoch bleibt festzuhalten, dass auch 2 in der Lage ist, in wässrigem Medium Ac-D-Ala-D-Ala- 26 mit sehr hohen Assoziationskonstanten zu binden. Die Größenordnung der Bindung (K a > 10 4 M -1 ), die bereits für 1 festgestellt wurde, konnte bestätigt werden. Aufgrund der erhöhten Löslichkeit von 2 waren nun wesentlich bessere Voraussetzungen geschaffen worden, eine MR-Analytik durchzuführen. Durch MR- Studien in Wasser wurde nun versucht, Informationen über die Struktur des Komplexes zu erhalten. Zu diesem Zweck wurde das Substrat Ac-D-Ala-D-Ala- 26 vorgelegt.
90 76 Ergebnisse und Diskussion ach Zugabe des Rezeptors 2 sollte im Falle einer Komplexbildung eine Signalverschiebung zu beobachten sein. In der berechneten Komplexstruktur wird der Methylrest aus der Seitenkette des Alanins von der Cyclotribenzylenhalbschale umschlossen (vgl. Abbildung 2.31). Falls diese Annahmen zutreffen, so sollte für die Methylgruppe eine starke Signalverschiebung induziert werden. Die Methylprotonen befinden sich dabei oberhalb der aromatischen Ebene. ach dem Ringstrom-Modell sollten sie dadurch gegen das äußere Magnetfeld abgeschirmt werden. Dies würde eine ochfeldverschiebung verursachen. [188] Das Substrat Ac-D-Ala-D-Ala- 26 wurde also mit ilfe einer atriumhydroxid- Maßlösung in das Carboxylat überführt und lyophylisiert. Der so erhaltene Feststoff wurde in D 2 aufgelöst und eine Lösung der Konzentration c (26) = M erhalten. Da in D 2 die Amid-Protonen austauschen, wird für diese Probe ein sauberes 1 -MR-Spektrum ausschließlich mit den folgenden Signalen beobachtet: (a) Zwei Dupletts für die Methylgruppen der Alanin-Seitenkette, (b) ein Singulett der Methylgruppe des -Acetyls sowie (c) zwei Multipletts für die α-c-protonen an den beiden stereogenen Zentren des Moleküls. Zu dieser Lösung wurde eine Probe des Rezeptors 2 (c = M) sukzessive zugegeben. Bereits bei der Anfertigung dieser Stammlösung kamen Zweifel am idealen Lösungsverhalten von 2 auf, da eine starke Schaumbildung beobachtet wurde. Dennoch wurde die Titration durchgeführt, da es zunächst nur um eine qualitative Beobachtung der Änderungen der chemischen Verschiebungen ging. Leider konnte im Laufe der Titration keine signifikante Shiftänderung im Spektrum von 26 beobachtet werden. Darüber hinaus fiel auf, dass die relative Intensität der zu 2 gehörenden Signale wesentlich geringer ausfiel, als dies nach Berechnung der Konzentrationen von 2 und 26 erwartet wurde. ach einer Zugabe von mehr als sieben Äquivalenten 2 wurden im aromatischen Bereich (Abbildung 3.27: x) lediglich Signale mit einem Gesamtintegral von unter zehn Protonen detektiert. 2 verfügt jedoch über elf aromatische Protonen und diese sollten bereits nach einer Zugabe von einem Äquivalent der Verbindung im Spektrum zu beobachten sein. Auch die Integration der C 2 -Protonen der Triethylenglykolsubstituenten (Abbildung 3.27: y) lieferte einen Wert unterhalb von 24. Dies indiziert, dass der tatsächlich in Lösung befindliche Anteil des Rezeptors 2 nur knapp einem Äquivalent bezogen auf 26 entsprach.
91 Ergebnisse und Diskussion 77 Abbildung 3.27: 1 -MR-Spektrum (400 Mz, D 2 ) des atriumsalzes von 26 (rot) nach Zugabe von 7.44 eq. 2 Cl. Exemplarisch sind die indizierten Protonen eingezeichnet, die den Integralen zugeordnet werden können. Diese Beobachtung ist offenbar erneut auf den stark amphiphilen Charakter von 2 zurückzuführen, welches sich nur zu einem geringen Anteil in Lösung befindet. Darauf deuten neben den viel zu kleinen Integralflächen der zu dem Rezeptor gehörenden Protonen auch die stark verbreiterten Multipletts x und y hin. Außerdem bildete sich über acht in der MR-Probe eine gelartige Phase. Dies ist in Abbildung 3.28 dargestellt. In dem vergrößerten Ausschnitt sind die Grenzfläche und der Einschluss von Gasblässchen deutlich zu erkennen.
92 78 Ergebnisse und Diskussion Abbildung 3.28: MR-Probe des Spektrums in Abbildung 3.27 nach Lagerung über acht. In der höheren Auflösung ist deutlich die entstandene gelartige Phase zu erkennen. Durch den tensidischen Charakter von 2 und die insgesamt immer noch nicht ausreichende Löslichkeit in Wasser ist also eine Analyse der Komplexstruktur mit MR-spektroskopischen Methoden nicht möglich. Um ein nicht amphiphiles und trotzdem wasserlösliches Derivat von 1 herzustellen, müssten wahrscheinlich Löslichkeits-vermittelnde Gruppen im Bereich der hydrophoben albschale eingeführt werden. Da dies synthetisch sehr anspruchsvoll ist und den Rahmen der vorliegen Arbeit weit übersteigen würde, wurde die Analytik des Komplexes mittels MR unterlassen. eben der Erhöhung der Löslichkeit kann der Triethylenglykolsubstitutent aber noch eine andere für die Strukturaufklärung nützliche Funktion erfüllen. Mit der terminalen ydroxygruppe steht eine deprotonierbare Position zur Verfügung, wodurch eine negative Ladung in das Molekül eingeführt werden kann. Diese wäre räumlich relativ weit vom zentralen Bindungsmuster entfernt, so dass sie an dieser Stelle wahrscheinlich keinen destabilisierenden Einfluss auf den Komplex ausübt. Ein solcher Komplex aus Carboxylat-Anion und Rezeptor-Kation mit einer zusätzlichen negativen Ladung könnte also mit ilfe der Massenspektroskopie im negativen Ionenmodus untersucht werden. Zu diesem Zweck wurde eine 1:1-Mischung aus 2 und Ac-D-Ala-D-Ala- 26 hergestellt und mit der ESI-MS-Methode im negativen Ionenmodus charakterisiert. eben dem protonenabstrahierten Rezeptor ([2-] - ) sowie dem Chloridaddukt ([2+Cl] - ) ist ein intensives Signal bei m/z = a. u. zu erkennen. Dieses kann dem 1:1- Komplex aus 2 und 26 zugeordnet werden.
93 Ergebnisse und Diskussion 79 Abbildung 3.29: ESI-MS-Spektrum einer 1:1-Mischung von 2 und 26 in Wasser, aufgenommen im negativen Modus. Ferner ist eine relativ schwaches Signal bei m/z = a. u. zu erkennen. Dieses kann einem 1:2-Komplex dem Rezeptor 2 mit zwei Teilen des Substrates 26 zugeordnet werden. Die MS-Probe wurde auf einen p-wert von ungefähr sechs eingestellt. In diesem Bereich liegt 26 deprotoniert und 2 protoniert vor. Der beschriebene 1:2- Komplex ist also bereits negativ geladen. Dagegen muss der 1:1-Komplex erst durch Abstraktion eines Protons ionisiert werden, um im Massenspektrum detektierbar zu sein. Deshalb ist davon auszugehen, dass der 1:1- gegenüber dem 1:2-Komplex im Massenspektrum verglichen mit den Zuständen in Lösung deutlich unterrepräsentiert ist. Unter Anwendung dieser Methode wurde auch versucht, Aussagen über die relative Stabilität des Komplexes aus 2 mit verschiedenen Dipeptiden zu erhalten. Zu diesem Zweck wurden Mischungen des Rezeptors mit verschiedenen miteinander konkurrierenden Substraten angefertigt. Als Substrate wurden neben dem Zielsubstrat 26 abermals die sterisch anspruchvolleren (Val) und die den Seitenketten entbehrendenden (Gly) analogen Dipeptide gewählt. So wurde eine Mischung von 2 mit Ac-Gly-Gly- 33, Ac-D-Ala-D-Ala- 26 und Ac-D-Val-D-Val- 32 angefertigt und mit derselben Methode untersucht. Der Rezeptor 2 wurde als ydrochlorid und die -acylierten Dipeptide als protonierte Carbonsäuren vorgelegt. Durch sukzessive Zugabe einer atriumhydroxydlösung wurden die Peptide deprotoniert und eine elektrostatische Komplementarität zum Rezeptor 2 hergestellt. Auch in dieser Versuchsreihe konnte ein starkes Signal für den 1:1-Komplex aus 2 und dem Zielpeptid 26 nachgewiesen werden. Allerdings sind die Signale für die Komplexe des Rezeptors 2
94 80 Ergebnisse und Diskussion mit den Dipeptiden 32 und 33 von ähnlicher Intensität. Zumindest aus diesem Experiment kann also keine Präferenz des Rezeptors 2 für Ac-D-Ala-D-Ala- 26 abgeleitet werden kann. Die relative Stabilität der Komplexe in der Gasphase muss allerdings nicht mit der Stabilität in Lösung korrelieren, da beispielsweise die hydrophobe Wechselwirkung vollständig entfällt. Dennoch konnten auch in dieser Messreihe eine deutliche 1:1-Stöchiometrie für die Komplexe von 2 mit allen drei Dipeptiden beobachtet werden. Im Rahmen dieser Arbeit wurden mit dem de novo entworfenen Rezeptor 1 für den D-Ala-D-Ala-C-Terminus umfassende Bindungsstudien durchgeführt. Im wässrigen Medium ist 1 in der Lage, das Modellpeptid Ac-D-Ala-D-Ala- 26 mit einer sehr guten Assoziationskonstante von K a = M -1 zu binden. eben der gut beschriebenen Bindung von Carboxylaten durch die Guanidiniocarbonylpyrroleinheit liefert eine hydrophobe Wechselwirkung mit der Methylseitenkette des Alanins zusätzliche Bindungsstärke. Der Rezeptor zeigt außerdem eine hohe Selektivität gegenüber Alanin-haltigen Dipeptiden. Dipeptide, die kein Alanin enthalten werden ebenso wie einfache Aminosäuren wesentlich schlechter (K a < M -1 ) gebunden. Aufgrund der hohen Flexibilität der Cyclotribenzylen-Seitenkette von 1 konnte keine Enantioselektivität oder Selektivität bezüglich der Position des Alanins im Dipeptid beobachtet werden. Dennoch wird das Zielsubstrat Ac-D-Ala-D-Ala- 26 bzw. sein Enantiomer Ac-Ala-Ala- ent-26 um den Faktor 10 besser gebunden als alle anderen untersuchten Dipeptide. Außerdem wurde mit K a = M -1 eine effektive Bindung des biologisch relevanten Depsipeptides Ac-D-Ala-D-Lac- 27 beobachtet. Dieses Verfügt über eine zum Zielsubstrat 26 identische Seitenkettenstruktur. ffenbar trägt aber auch das in 27 nicht vorhandene Amid- durch die Ausbildung einer Wasserstoffbrücke zur Bindungsstärke bei. Darüber hinaus konnte das wasserlösliche Derivat 2 des de novo entworfenen Rezeptors 1 hergestellt werden. Leider konnten mit dieser Substanz aufgrund ihres stark amphiphilen Charakters keine MR- Bindungsstudien in Wasser durchgeführt werden. Mit 2 konnte aber der Komplex mit dem Zielsubstrat 26 in der Gasphase beobachtet werden. ESI-MS-Untersuchungen deuten auf einen starken 1:1-Komplex hin. Außerdem wurde die Größenordnung der Bindung von 26 auch für den Komplex mit dem Derivat 2 bestätigt. bwohl aufgrund der begrenzten Löslichkeit der Rezeptoren 1 und 2 in Wasser keine detaillierte Aufklärung der Komplexstruktur möglich war, deuten dennoch alle erhaltenen experimentellen Daten darauf hin, dass der computergestützte Entwurf zutreffend ist. Damit konnte erstmals ein maßgeschneiderter Rezeptor für ein Dipeptid synthetisiert und charakterisiert werden, dessen Selektivität richtig vorhergesagt wurde.
95 Ergebnisse und Diskussion Ein künstlicher Rezeptor für die interne RGD-Sequenz Entwurf und Vorarbeiten In einem weiteren Teilprojekt der vorliegenden Arbeit soll ein künstlicher Rezeptor für die RGD-Sequenz entwickelt werden. Diese Sequenz weist in den Seitenketten ein Alkylguanidin (Arg) und ein Carboxylat (Asp) auf. Als Bindungsmotiv für das Alkylguanidin soll ein von Schrader entwickeltes benzylisches Phosphonat verwendet werden. Zur Koordinierung des Carboxylates wurde das von Schmuck entwickelte Guanidiniocarbonylpyrrol gewählt. Diese beiden Bindungsmotive sollten über einen geeigneten Spacer zu einem Rezeptor für die RGD-Sequenz verbunden werden. Dieser Teil der Arbeit wurde in Kooperation mit Dr. M. Junkers aus dem Arbeitskreis von Prof. Dr. T. Schrader, Universität Marburg, durchgeführt. Zunächst wurde also ein universeller und unter milden Reaktionsbedingungen umsetzbarer Vorläufer des Guanidiniocarbonylpyrrols benötigt. Die ersten Synthesen derartiger Verbindungen erforderten noch relativ drastische Bedingungen, wie z. B. das Erhitzen zum Rückfluss in atriummethanolat-lösungen. Dies ist jedoch ungünstig, falls das Zielmolekül empfindliche Reste trägt. Beispielsweise racemisieren enantiomerenreine Aminosäuren unter stark basischen Bedingungen. Daher wurde von Schmuck et al. eine Synthese für dieses Bindungsmotiv entwickelt, die die Einführung einer Seitenkette unter Standard-Peptidkupplungsbedingungen ermöglicht. [110,111] In dem Pyrrolbaustein 89 ist die Guanidineinheit mit einer Boc-Schutzgruppe versehen. Deshalb sind ebenreaktionen, in denen das Acylguanidin als konkurrierendes ucleophil agiert, ausgeschlossen. Das macht 89 zu einer vielseitig einsetzbaren Struktur in der organisch-chemischen Synthese.
96 82 Ergebnisse und Diskussion (a),(b) (c),(d) (e) (f) Abbildung 3.30: Synthese des Pyrrolbausteins 89: (a) CCl 3 CCl, Et 2, 95 %; (b) Bn, CCl 3, 95 %; (c) PCl 3, DMF, C 2 Cl 2, 62 %; (d) KMn 4, Aceton, 2, 67 %; (e) Boc- Guanidin 87, PyBP, MM, DMF, 89 %; (f) 2, Pd/C, Me, 95 %. Zur Darstellung von 89 wird zunächst Pyrrol 90 in einer Friedel-Crafts-Acylierung mit Trichloressigsäurechlorid zum α-trichloracetylpyrrol umgesetzt. Anschließende basische Alkoholyse liefert den Benzylester 91. ach Vilsmeyer-aak-Formylierung und säulenchromatographischer Abtrennung des in 4-Position formylierten ebenproduktes wird zur Säure 92 oxidiert und mittels PyBP Boc-Guanidin 87 an den Pyrrolbaustein gekuppelt. Abschließende ydrierung des Benzylesters liefert den Guanidinocarbonylpyrrolbaustein 89. Damit stand ein vielseitig verwendbarer Baustein zur Synthese von Guanidiniocarbonylpyrrol-haltigen Verbindungen zur Verfügung. In einem ersten Entwurf eines RGD-Rezeptors hatte Schrader bereits das Trisphosphonat 35 vorgestellt. Dieser Rezeptor enthält zum Zwecke der Koordinierung des Carboxylates ein einfaches Aniliniumion. Die Bindungseigenschaften des Rezeptors 35 und die Struktur des Komplexes mit der RGD-Sequenz sind auf Seite 21ff zusammengefasst. Das von Schmuck entworfene Guanidiniocarbonylpyrrol bildet wesentlich stabilere Komplexe mit Carboxylaten aus, als dies von einem einfachen Kation zu erwarten ist. Daher wäre es in einem ersten Versuch nahe liegend, die Aminfunktion in 35 mit Schmucks Guanidiniocarbonylpyrrol weiter zu funktionalisieren. Die Kupplung des Trisphosphonates 94 mit dem Pyrrolbaustein 89 würde nach Entschützung den Rezeptor 95 liefern.
97 Ergebnisse und Diskussion 83 R 1 P P R 2 R 1 P 35: R 1, R 2 = 94: R 1 = Me R 2 = Et P P P Abbildung 3.31: Mögliche Synthese von 95: Aktivierung der Carbonsäure in 89 mit CTU und Umsetzung mit dem ucleophil 94, dann Boc-Abspaltung mit TFA gefolgt von LiBr-vermittelter Alkylphosphonatspaltung. Leider sind weder in der riginalpublikation von 35, noch in den Zusatzinformationen zu dem Artikel detaillierte Vorschriften oder spektroskopische Daten zur Synthese der Substanzen enthalten. [49] Ebenso konnte weder der Rezeptor 35 noch sein Vorläufer 94 vom Kooperationspartner zur Verfügung gestellt werden. bwohl diese Verbindungen beide in der riginalpublikation erwähnt sind, konnte ihre Synthese im Arbeitskreis Schrader nicht reproduziert werden. Deshalb wurde der in Abbildung 3.31 vorgestellte Ansatz nicht verfolgt. Daher musste ein alternatives Bindungsmotiv für Alkylguanidin im Zielsubstrat gefunden werden. Zu diesem Zweck bot sich das benzylische m-bisphosphonat (58, Abbildung 2.33) an. Zur synthetischen Verwendung in höhermolekularen Systemen kann diese Verbindung in 5-Position mit einem Amin funktionalisiert werden. Als Vorläufer einer solchen Substanz wurde der Bis-dimethylester-geschützte Baustein 96 verwendet. [112] Synthese von flexiblen RGD-Rezeptoren un sollte das Bisphosphonat über einen Spacer mit dem Pyrrolbaustein 89 verbunden werden. Zunächst wurde zur Verknüpfung der beiden Einheiten Diglycin ausgesucht, Ziel dieser Synthese ist der potentielle Rezeptor 99. Diglycin wurde gewählt, weil 98 (vgl. Abbildung 3.32) in ersten von Junkers durchgeführten Bindungsstudien eine hohe Affinität zum Tripeptid -RGD- 36 zeigte. Allerdings steht zur Bindung des Carboxylates im Tripeptid bei einer Komplexierung durch 98 erneut lediglich ein einfaches Amin zur Verfügung. Durch eine weitere Funktionalisierung mit einem Guanidiniocarbonylpyrrol sollte die Affinität zum Zielsubstrat RGD deutlich erhöht werden. Mehrere hundert Milligramm des Pyrrolbausteins 89 wurden im Rahmen dieser Arbeit nach der in Abbildung 3.30 erläuterten Route darstellt und dem
98 84 Ergebnisse und Diskussion Kooperationspartner zur Verfügung gestellt. Junkers synthetisierte unter Verwendung dieser Substanz die Verbindung 99. [50] Me P Me P Me Me 2 (a) (b) R P Me P Me R 96 97: R = Me (98: R = ) 2 2 (c),(d) (e) P Me P Me Abbildung 3.32: Von Junkers durchgeführte Synthese von 99: (a) Cbz-Gly-Gly-, CTU, DIEA, Cl-Bt, 82 %. (b) 2, Pd/C, Me, RT, 24 h, quant. (c) 89, PyBP, MM, DMF, C 2 Cl 2, RT, 40 h, 32 %. (d) TFA, C 2 Cl 2, RT, 3 h, Cl, quant. (e) LiBr, C 3 C, 16 h, reflux, quant. ach einem analogen Protokoll wurde darüber hinaus die Verbindung 101 hergestellt. Diese verknüpft die beiden Bindungsmotive unter Verwendung eines einfachen Glycins. Unter Verwendung eines ebenfalls in der Arbeitsgruppe Schmuck synthetisierten und zur Verfügung gestellten Arginin-Analogons [113] konnte von Junkers außerdem die Verbindung 100 hergestellt werden. [50] Mit 99, 100 und 101 standen also drei potentielle Rezeptoren für die RGD-Sequenz zur Verfügung. Diese Verbindungen unterscheiden sich vor allem in der Flexibilität der Verknüpfung der beiden Bindungsmotive. Aufgrund der zunehmenden Kettenlänge und Anzahl von sp 3 -Zentren kann die Flexibilität der Moleküle wie folgt klassifiziert werden: 99 > 100 > 101. P Me P Me P Me 2 2 Me 101 P Me Abbildung 3.33: Zwei weitere potentielle RGD-Rezeptoren, die die Bindungsmotive von Schmuck und Schrader in einem Molekül vereinen, wurden von Junkers unter Verwendung der zur Verfügung gestellten Guanidiniocarbonylpyrrole synthetisiert Bindungsstudien mit flexiblen RGD-Rezeptoren Mit den drei Verbindungen 99, 100 und 101 sollten nun Bindungsstudien mit RGDhaltigen Substraten durchgeführt werden. Zu diesem Zweck wurde das freie RGD- Tripeptid -RGD- 36 an Wang-arz sowie das Rückgrat-geschützte Analogon
99 Ergebnisse und Diskussion 85 Ac-RGD an Rink-Amid hergestellt. [29] Als Tripeptid ohne funktionelle Seitenketten wurde außerdem das Rückgrat-geschützte Triglycin Ac-GGG synthetisiert. [114] Dies soll als Blindprobe in Titrationen zum Einsatz kommen Abbildung 3.34: An Wang-arz (36) bzw. an Rink-Amid (37, 38) hergestellte Tripeptide. Die Protonierungsstufe ist so dargestellt, wie sie in neutraler wässriger Lösung erwartet wird. Die Verwendung von 36 als Substrat ist allerdings mit einigen achteilen verbunden, [115,116] die durch die Verwendung von 37 ausgeschlossen werden können. So bietet 36 dem Rezeptor zwei nahezu gleiche Carboxylate zur Koordinierung an. Diese befinden sich darüber hinaus in räumlicher ähe. Eine Deprotonierung der ersten Carbonsäure beeinflusst die zweite Deprotonierung aufgrund der dadurch erreichten hohen Ladungsdichte ungünstig. Falls also im verwendeten p-bereich nur eine der beiden Carbonsäuren deprotoniert vorliegen sollte, so wäre dies wohl die α-aminosäure im Rückgrat des Peptides. Diese weist einen niedrigeren pk a -Wert als die β-aminosäurefunktion in der Seitenkette auf. Eine Koordinierung des Carboxylates im Rückgrat ist aber nicht Ziel führend für die Entwicklung eines Rezeptors für die interne RGD-Sequenz. Bei der RGD-Sequenz in den Integrinen, die als Zielstruktur gewählt wurden, handelt es sich aber um ein internes Tripeptid. Analoge Annahmen gelten auch für den -Terminus in 36. Die Guanidineinheit ist zwar deutlich basischer als das Amin und ist auch räumlich weiter entfernt. Dennoch stellen beide in wässrig-neutraler Lösung Kationen auf Stickstoffbasis dar. Diese Überlegungen werden durch von Junkers durchgeführte Berechnungen zur Komplexstruktur aus dem Diglycinverbrückten Rezeptor 99 und -RGD- 36 bestätigt. In der verwendeten MonteCarlo- Simulation (MacroModel 7.2, Amber*, 2 ) wird für diese Struktur eine Koordinierung des Carboxylates im Rückgrat von 36 durch die Guanidiniocarbonylpyrroleinheit von 99 vorgeschlagen. Darüber hinaus bildet eines der beiden benzylischen Phosphonate Wasserstoffbrücken sowohl zum Guanidinium in der Seitenkette als auch zum Amin im Rückgrat des Substrates aus. [50] Diese unerwünschten Effekte können durch die Verwendung von Ac-RGD vermieden werden.
100 86 Ergebnisse und Diskussion Allerdings wird diese Problematik in der Dissertation von Junkers nicht diskutiert. bwohl auf das Problem mehrfach hingewiesen wurde, wurden alle vom Kooperationspartner durchgeführten Titrationen mit freien Peptiden wie z. Β. -RGD- 36 als Substrat durchgeführt. In ersten von Junkers unternommenen MR- Titrationen wurde der Diglycin-verbrückte Rezeptor 99 untersucht. Für den 1:1- Komplex aus 99 und -RGD- 36 in ungepuffertem Wasser wurde eine sehr hohe Assoziationskonstante von K a 10 4 M -1 erhalten. Diese sollte im Rahmen dieser Arbeit mit ilfe der UV-Titration reproduziert werden. Diese UV-Titrationen wurden mit 99 und den beiden Substraten -RGD- 36 und Ac-RGD in gepuffertem Wasser (Bis-Tris-Puffer, p = 6.0) durchgeführt. Trotz umfangreicher Experimente konnte in keinem Fall eine Komplexbildung beobachtet werden. Um die für den Komplex zu erwartenden elektrostatischen Wechselwirkungen zu stärken, wurden außerdem Titrationen in unpolareren Medien durchgeführt. Zu diesem Zweck wurde dem wässrigen Puffer ein Anteil von bis zu 50 % Methanol zugesetzt. Trotzdem konnte auch in diesen Titrationen keine Assoziation von Rezeptor und Substrat beobachtet werden. Im Rahmen dieser Arbeit wurde also nachgewiesen, das die Bindungskonstante von 99 zu den beiden Substraten 36 und 37 zu klein ist, um mit UV-Methoden nachgewiesen zu werden (K a < 10 3 M -1 ). Die zunächst von Junkers beschriebenen Bindungskonstanten wurden also im Rahmen dieser Arbeit widerlegt. ffenbar sind p-effekte im Verlauf der MR-Titration in ungepuffertem Wasser für die chemischen Verschiebungen verantwortlich. Die mathematische Analyse dieser Verschiebungen führt fälschlicherweise zu hohen Assoziationskonstanten. Daraufhin wurden die MR- Titrationen von Junkers in gepuffertem Wasser bei p 6.0 wiederholt und lieferten eine Assoziationskonstante von nur noch K a 200 M -1 für den Komplex aus 99 und -RGD- 36. Das Rückgrat-geschützte Substrat Ac-RGD wurde leider nicht untersucht. Die drei Verbindungen 99, 100 und 101 wurden nun von Junkers auf ihre Affinität gegenüber verschiedenen RGD-haltigen Peptiden untersucht. Diese Untersuchungen wurden in gepuffertem Wasser (Bis-Tris- oder Phosphatpuffer, p = ) mit MR- Titrationen durchgeführt. Leider wurden erneut ausschließliche die freien Peptide mit einem primären Ammoniumion am - und einem Carboxylat am C-Terminus verwendet. Auch die Wahl eines Phosphatpuffers kann als ungünstig bezeichnet werden. Dadurch befinden sich weitere xoanionen in Lösung, die eine Koordinierung des Carboxylates kompetetiv hemmen können. Aus diesen Gründen werden die Ergebnisse dieser Untersuchungen hier nicht im Detail diskutiert. Es wurden aber Assoziationskonstanten in der Größenordnung von K a = M -1 festgestellt. Diese fallen erstaunlich niedrig aus, insbesondere unter Beachtung der Tatsache, dass in allen verwendeten Rezeptormolekülen (99, 100 und 101) die beiden Bindungsmotive von
101 Ergebnisse und Diskussion 87 Schrader und Schmuck vereint sind. Die Größenordnung der Bindung bewegt sich aber in einem Bereich, der bereits für eine einfache Koordinierung von Carboxylaten durch Schmucks Guanidiniocarbonylpyrrol in Wasser erwartet wird. Dies ist doch recht überraschend, da das ebenfalls im Molekül vorhandene Bindungsmotiv für Alkylguanidine einen zusätzlichen Beitrag liefern und so eine deutlich erhöhte Assoziation mit den Zielpeptiden bewirken sollten. Als Ursache für die niedrigen Bindungskonstanten wurde von Junkers unter anderem eine intermolekulare Selbstassoziation vorgeschlagen und für 101 mit K a = 330 M -1 auch experimentell bestätigt. Der hohe Fehler (± 65 %) bei der experimentellen Bestimmung dieser Selbstassoziation erklärt sich aus einer nicht eindeutigen Stöchiometrie der Aggregate. Es können neben Dimeren auch ligo- und Polymere supramolekular gebildet werden. Für die beiden flexibleren Moleküle 99 und 100 konnte jedoch keine intermolekulare Aggregation beobachtet werden. Diese beiden Rezeptoren binden aber ebenfalls nur sehr schwach an die RGD-Sequenz. Eine intermolekulare Assoziation allein kann also nicht die Ursache für die schwache Bindung der Zielsubstrate sein. Ein bisher noch nicht diskutierter Grund für die niedrigen Bindungskonstanten ist eine mögliche intramolekulare Selbstassoziation der Rezeptoren. Insbesondere aufgrund der Ergebnisse von Gilson, der schon für das einfache Trisphosponat 35 eine intramolekulare Selbstassoziation postuliert (vgl. Seite 21ff), erscheinen derartige Überlegungen notwendig. Diese Möglichkeit wurde im Rahmen der vorliegenden Arbeit anhand von theoretischen Berechnungen der drei Rezeptoren 99, 100 und 101 untersucht. Bereits an dieser Stelle sei bemerkt, dass die Rechnungen nur qualitative Ergebnisse liefern. Dennoch können sie Aufschluss darüber geben, ob eine intramolekulare Assoziation sterisch und elektronisch möglich ist oder nicht. Es wurden also die Vorzugskonformationen der drei Rezeptoren in Wasser berechnet. Die Rechnungen wurden mit dem Programm MacroModel 8.0 unter Verwendung der Amber*-Methode vorgenommen. Die Ergebnisse sind in Abbildung 3.35 zusammengefasst.
102 88 Ergebnisse und Diskussion Abbildung 3.35: Berechnete Vorzugskonformationen der durch Kombination aus den Bindungsmotiven von Schrader und Schmuck erhaltenen Verbindungen (MacroModel 8.0, Amber*, 2, 5000 Schritte). Die Protonierungsgrade entsprechen denen bei einem p 6 erwarteten (vgl. Abbildung 3.32 und Abbildung 3.33). Der Spacer zwischen dem Aryl und dem Pyrrol ist in 101 mit fünf Atomen und nur einem sp 3 -hybridisiertem Zentrum am unflexibelsten. Trotzdem kann schon in dieser Verbindung eine intramolekulare Koordinierung eines Phosphonatrestes unter Ausbildung von drei Wasserstoffbrückenbindungen zwischen dem Phosphonat und dem Guanidiniocarbonylpyrrol auftreten. Der Spacer zwischen den Bindungsmustern ist in 100 mit sechs Atomen und zwei sp 3 -Zentren noch flexibler. eben der zu 101 isostrukturellen intramolekularen Komplexierung eines Phophonatrestes kann auch der zweite Phosphonatrest koordinierend eingreifen. Ferner wird das Guanidiniocarbonylpyrrol oberhalb des Arylrestes fixiert, was die Ausbildung von Kation-π- bzw. π-π- Wechselwirkungen ermöglicht. Mit acht Atomen und zwei sp 3 -Zentren ist der Spacer in 99 am flexibelsten. Für diese Verbindung wurde in den Rechnungen eine zur Koordinierung von Alkylguanidinen (vgl. Abbildung 2.33) isostrukturelle Komplexierung des Acylguanidiniums in 99 erhalten. Das Guanidinium wird zangenartig von den beiden Phosphonatresten koordiniert und unter Ausbildung einer Kation-π-Wechselwirkung oberhalb des Phenylrestes fixiert. Im Fall von 99 können sogar fünf Wasserstoffbrücken zwischen den beiden Enden des Moleküls ausgebildet werden. Diese Berechnungen sind konform mit der Beobachtung, dass nur für 101 eine intermolekulare Selbstassoziation beschrieben wurde. Für die anderen beiden Substanzen ist die konkurrierende intramolekulare Assoziation deutlich stärker zu erwarten. Der Diglycin-verbrückte Rezeptor 99 ist das flexibelste der drei vorgestellten RGD- Rezeptormoleküle. Deshalb wurde dieses Molekül zur experimentellen Untersuchung
103 Ergebnisse und Diskussion 89 einer möglichen intramolekularen Selbstassoziation gewählt. In der Dissertation von Junkers wird die Möglichkeit dieser intramolekularen Selbstassoziation verneint. [50] Als Argument dagegen wird die Abwesenheit der zu erwartenden Kreuzpeaks im ESY- Spektrum angeführt. Im Prinzip ist dies eine adäquate Methode zum achweis solcher Wechselwirkungen. Im vorliegenden Fall wurden die Spektren aber in D 2 aufgenommen. In diesem Lösemittel werden bekanntlich polare Wasserstoffatome wie die Amid- und Guanidiniumprotonen gegen Deuterium ausgetauscht. Deshalb sind alle Signale, die nach den oben vorgestellten Berechnungen Kreuzpeaks ergeben könnten, gelöscht. Weiter beschreibt Junkers im Temperaturbereich von 5 bis 80 C keine Änderungen der chemischen Verschiebungen im Protonenspektrum beobachtet zu haben. Dieses Ergebnis wurde ebenfalls als Argument gegen eine Selbstassoziation interpretiert. Allerdings wurden diese Experimente ohne Kontrolle des p-wertes in der MR-Probe durchgeführt. Für eine mögliche Selbstassoziation ist jedoch die richtige Protonierung der Untereinheiten essentiell. Da diese nur über die korrekte Einstellung des p-wertes gewährleistet werden kann, wurde entschieden, die Experimente im Rahmen dieser Arbeit zu wiederholen. Eine von Junkers zur Verfügung gestellte Probe von 99 wurde zunächst mit ilfe der semipräparativen PLC gereinigt. Dies geschah an RP18-Material mit Wasser als Laufmittel, dem 0.1 % Triethylamin zugesetzt wurden. Unter diesen Bedingungen wird sowohl die Phosphonsäure als auch das Acylguanidinium deprotoniert. 99 wurde also zunächst als Di-Triethylammoniumsalz erhalten und die gesammelten Fraktionen lyophylisiert. Mit dieser Substanz wurden Experimente zur Löslichkeit durchgeführt. Leider ist 99 jedoch weder in Wasser, noch in Methanol, Acetonitril, DMS, Dioxan oder DMF gut löslich. Deshalb wurde die Probe in Wasser suspendiert und die Suspension auf p = 5 eingestellt. In diesem Bereich sollten die Phosphonsäuren noch deprotoniert, das Acylguanidin aber als Kation vorliegen. Der feste Anteil der Suspension wurde nach Äquilibrierung im Ultraschallbad abzentrifugiert, die überstehende Lösung abdekantiert und mit weiteren 10 % Wasser verdünnt, um Sättigungseffekte zu vermeiden. Zur internen Kalibrierung wurde Dioxan zugegeben. Von dieser Probe wurde zunächst ein temperaturabhängiges 1 -MR-Spektrum aufgenommen.
104 90 Ergebnisse und Diskussion Abbildung 3.36: Ausschnitt aus dem 400 Mz- 1 -MR-Spektum von 99 bei verschiedenen Temperaturen. Die Signale sind auf Dioxan kalibriert. In den Spektren von 99 ist eine deutliche Änderung der chemischen Verschiebung im Falle einer Temperaturänderung zu erkennen. Diese ist mit Δδ 0.05 ppm zwar nicht groß, aber messbar. Ferner wurde festgestellt, dass diese Änderung reversibel ist, also nicht auf einer Zersetzung von 99 beruht. Im Falle einer korrekten Protonierung von 99 kann also durchaus einer Änderung der chemischen Verschiebung als Funktion der Temperatur festgestellt werden. Zum achweis einer intramolekularen Assoziation ist dies aber nicht ausreichend. Es wurde daher versucht, von der vorliegenden Probe von 99 ein ESY-Spektrum aufzunehmen. Dies schlug aufgrund der sehr geringen Konzentration der Lösung jedoch fehl. Wie oben bereits erwähnt wurde, ist 99 auch in anderen Lösemitteln nicht ausreichend löslich. Deshalb konnten keine weiteren Untersuchungen mit ilfe der MR-Spektroskopie unternommen werden. Ein abschließender Beweis einer intramolekularen Selbstassoziation konnte im Rahmen dieser Arbeit nicht erbracht werden. Dennoch deuten alle experimentellen Daten und die theoretischen Berechnungen darauf hin, dass dies die Ursache für die schlechte Koordination der RGD-Sequenz durch die drei bisher vorgestellten Rezeptoren 99, 100 und 101 ist. Deshalb wurde versucht, die beiden Bindungsmotive von Schrader und Schmuck über einen Spacer zu verknüpfen, der eine intramolekulare Selbstassoziation verhindert.
105 Ergebnisse und Diskussion Entwurf eines rigiden RGD-Rezeptors Das eben diskutierte Problem der Selbstassoziation des RGD-Rezeptors verhindert offenbar eine effektive Komplexierung des Zielpeptides. Deshalb wurde also ein Spacer zur Verbindung der beiden Bindungsmotive gesucht, der eine intramolekulare Selbstassoziation nicht zulässt. Da peptidische Spacer für diesen Zweck offenbar zu flexibel sind, wurde ein aromatischer Spacer angestrebt. Aufgrund der vielversprechenden ersten Ergebnisse mit dem benzylischen Trisphosphonat 35 (vgl. Seite 21ff) wurde ein meta-substituierter Benzolring gewählt. Allerdings sollte zur Erhöhung der Rigidität auf die benzylische C 2 -Gruppe verzichtet werden. Die so entworfene Verbindung 3 enthält einen m-aminobenzoesäure-spacer und ist in Abbildung 3.37 in ihrer berechneten Vorzugskonformation abgebildet. Abbildung 3.37: Berechnete Vorzugskonformation von 3 (MacroModel 8.0, Amber*, 2, 5000 Schritte), der Protonierungsgrad identisch mit dem in Abbildung In keiner der durchgeführten Rechnungen konnte eine intramolekulare Selbstassoziation beobachtet werden. Probehalber vorgegebene Wasserstoffbrückenbindungen zwischen der Guanidinium- und der Phosphonateinheit führten zu einer Verzerrung des Moleküls das nach Entfernung dieser Restriktion sofort wieder eine planare Konformation einnahm. In dieser Konformation ergibt die Rechnung aber einen Abstand zwischen dem Phosphonat und dem Guanidinium, der eine Wechselwirkung zwischen den beiden nicht zulässt. Aufgrund dieser Ergebnisse wurde als nächstes die Synthese von 3 angestrebt Synthese des arylverbrückten RGD-Rezeptors 3 Zunächst wurde die Zielverbindung 3 retrosynthetisch analysiert. Die Retrosynthese ist in Abbildung 3.38 skizziert. Zur Synthese des Zielmoleküls bieten sich zwei grundsätzlich unterschiedliche Wege an. Entweder der Spacer wird zuerst mit Schmucks Pyrrolbaustein und danach mit Schraders Bisphosphonat verknüpft (Route a) oder die umgekehrte Reihenfolge wird für die Synthese gewählt (Route b). Beide Routen wurden
106 92 Ergebnisse und Diskussion zur Synthese des Rezeptors versucht. Zu diesem Zweck wurden die Verbindungen 96 und 102 vom Arbeitskreis Schrader zur Verfügung gestellt. P Me P Me (a) (b) (b) (a) Me P Me Me P Me Boc Me P Me Me P Me Boc Abbildung 3.38: Retrosynthetische Analyse von 3. Das Molekül lässt sich nach Abspaltung von Schraders (Route a) oder Schmucks (Route b) Bindungsmotiv in drei identische Vorläufer zerlegen. Zunächst wurde die Synthese nach Route (a) untersucht. Der nach einer Literaturvorschrift als Toluolsulfonat hergestellte m-aminobenzoesäurebenzylester 104 [117] wurde in Wasser gelöst, mit Kaliumhydroxid auf p = 14 gebracht und nach Extraktion in Diethylether durch Einleiten von Salzsäure wieder ausgefällt. Das so erhaltene Chloridsalz wurde nach Umkristallisation aus iso-propanol unter Verwendung von CTU an 89 gekuppelt. bwohl damit ein schlechtes ucleophil mit einem schlechten Elektrophil umgesetzt wurde, konnte der Benzylester 105 in akzeptabler Ausbeute von 39 % erhalten werden. Eine Spaltung des Benzylesters durch katalytische ydrierung lieferte 106 in einer Ausbeute von ebenfalls 39 %. Allerdings mussten im Laufe der Aufarbeitung starke Ausbeuteverluste in Kauf genommen werden, da 106 in den gängigen organischen Lösemitteln weitgehend unlöslich ist.
107 Ergebnisse und Diskussion 93 Bn + 3 Cl 104 Boc (a) (b) Boc Abbildung 3.39: (a) CTU, MM, C 2 Cl 2, DMF, reflux, 24 h, 39 %. (b) 2, Pd/C, Me, 40 C, 4 h, 39 %. Bevor die Säure 106 mit dem Anilinderivat 96 umgesetzt wurde, musste 96 gereinigt werden. Bei der aus Marburg eingetroffenen Probe handelte es sich um ein dunkles Öl. Das Anilin lag unprotoniert vor. Für eine Lagerung wäre es aber von Vorteil, die Substanz als Chlorid- oder Trifluoracetatsalz zu isolieren. Das Amin ist in seiner protonierten Form nicht mehr nucleophil und deshalb wesentlich stabiler. Zunächst wurde mit Methanol-Wasser-Gemischen (+ 0.1 % Trifluoressigsäure) auf RP-18- Material eine Trennung mit ilfe der MPLC versucht. Es konnte bei λ = 250 nm aber kein Signal detektiert werden. Deshalb wurden alle Fraktionen gesammelt und lyophylisiert. Eine PLC-Analyse mit Detektion im Bereich von 200 bis 400 nm ergab für 96 ein sehr kurzwelliges Absorptionsmaximum von λ max = 211 nm. Dies bereitet bei der chromatographischen Reinigung unter Zugabe von Trifluoressigsäure und der Verwendung von Laufmittelgradienten prinzipiell Probleme. Die intergrundabsorption der Trifluoressigsäure ändert sich mit dem Gradienten und die Basislinie des Chromatogramms ist nicht mehr stabil. Das erschwert die Detektion im kurzwelligen Absorptionsbereich enorm. Abbildung 3.40: Links: Ausschnitt aus dem PL-Chromatogramm von 96, Bedingungen: Supelcosil LC-18, 25 cm 4.6 mm, 5μm; 5 min % TFA dann in 40 min auf Me % TFA, 1.5 ml/min. Rechts: UV-Spektrum bei t = 16.3 min. Aufgrund der Vorreinigung durch die MPLC war die Probe von 96 entsprechend der PLC-Detektion aber schon relativ sauber. Durch mehrmaliges Lyophylisieren mit Salzsäure wurde nun das Trifluoracetat gegen Chlorid ausgetauscht. Mit dem so erhaltenen ydrochlorid von 96 wurde unter Verwendung von CTU eine Kupplung an
108 94 Ergebnisse und Diskussion den Pyrrolbaustein 106 versucht. Leider konnte aus dieser Reaktion aber kein Produkt isoliert werden. Die Gründe dafür bleiben ungeklärt. Möglicherweise befand sich in der verwendeten Probe von 96 eine störende Verunreinigung, die nicht im UV-Bereich detektiert wurde. Es könnte aber auch sein, dass 96 unter den verwendeten Bedingungen als ucleophil nicht reaktiv genug ist. Da jedoch mit der Route (b) aus Abbildung 3.38 ein alternativer Zugang zu 3 möglich war, wurden weitere Versuche zur Synthese nach Route(a) unterlassen. Die vom Arbeitskreis Schrader für diese alternative Syntheseroute bereitgestellte Verbindung 102 lag erneut als schwarzes Öl vor. Durch das zusätzliche Chromophor im Molekül entfielen aber die zuvor für 96 beschriebenen Detektionsprobleme bei der chromatographischen Reinigung von 102. Aus dem schwarzen Öl wurde nach MPLC- Reinigung (Wasser-Methanol-Gradient mit 0.1 % Trifluoressigsäure) und mehrfachem Umsalzen mit Salzsäure an der Lyophyle 102 Cl als weißer, sehr hygroskopischer Feststoff erhalten. Dieser wurde nun mit dem Aktivester von 89 zur Reaktion gebracht. 107 konnte in einer Ausbeute von 31 % erhalten werden. Da sich die Bisphosphonate bisweilen sehr gut in Wasser lösen, sollte untersucht werden, ob die wässrige Aufarbeitung für eventuelle Produktverluste verantwortlich ist. Zu diesem Zweck wurden alle bei der Aufarbeitung der Reaktion anfallenden wässrigen Phasen vereinigt und an der Lyophyle getrocknet. Unter den nun bekannten säulenchromatographischen Bedingungen zur Isolierung von 107 konnte aber kein weiteres Produkt erhalten werden. Dies weist darauf hin, dass die niedrige Ausbeute tatsächlich auf die nur schwach nucleophilen Eigenschaften des phenylischen Amins zurückzuführen ist. Me Me P Cl P + Me Me 89 Boc (a) R 1 107: R 1 = Boc R 2 = Me R 2 P Me (b) P Me R 2 108: R 1 = R 2 = Me (c) 3: R 1 = R 2 = Abbildung 3.41: Synthese des arylverbrückten Rezeptors 3: (a) CTU, MM, C 2 Cl 2, DMF, reflux, 24 h, 31 %. (b) TFA, C 2 Cl 2, RT, ca. 2 h, 63 %. (c) LiBr, C 3 C, reflux, 4 d, 12 %. Die Schutzgruppen in 107 sollten nun sukzessive entfernt werden. Zunächst wurde die Boc-Schutzgruppe mit Trifluoressigsäure in Dichlormethan abgespalten. Während dieser Umsetzung wurde das Verschwinden des Eduktes 107 durch DC-Kontrolle nachgewiesen. 108 wurde in einer Ausbeute von 63 % erhalten. Vergleichbare Reaktionen verliefen normalerweise quantitativ. Auch bei der säulenchromato-
109 Ergebnisse und Diskussion 95 graphischen Isolierung von 108 wurden keine Probleme festgestellt. Möglicherweise lag das in dieser Reaktion verwendete Edukt 107 noch verunreinigt vor. Dies kann eine Folge der stark polaren Eigenschaften von 107 sein. Dadurch wird die Wahl eines sehr polaren Laufmittels (Ethylacetat/Ethanol) für die säulenchromatographische Isolierung an Silicagel notwendig. Deshalb können polare Verunreinigungen schlechter abgetrennt werden. Das Trifluoracetatsalz 108 TFA wurde nach RP-18-MPLC-Reinigung sehr sauber erhalten. Laut telefonischer Auskunft von Junkers sollte bei der nun folgenden Methylesterspaltung das Trifluoracetat-Anion eine quantitative Ausbeute nicht stören. Deshalb wurde auf einen Austausch des Anions gegen Chlorid verzichtet. 108 TFA wurde also mit Lithiumbromid in Acetonitril zum Rückfluss erhitzt und die Reaktion mittels RP18-PLC-Detektion verfolgt. Abbildung 3.42: Links: Ausschnitt aus dem PL-Chromatogramm zur Reaktionskontrolle der Methylesterspaltung in 108, Bedingungen: Supelcosil LC-18, 25 cm 4.6 mm, 5μm; 5 min % Et 3 dann in 35 min auf C 3 C % Et 3, 1.5 ml/min. Rechts: UV-Spektrum bei t = 2.5 min. eben dem Eduktpeak entstand nach einiger Zeit ein weiterer Peak bei t = 10.7 min. Dieser kann dem Zwischenprodukt zugeordnet werden, in dem nur eine der beiden Bisphosphonatgruppen zum Monomethylester gespalten wurde. Über mehrere Tage wurde sukzessive Lithiumbromid zugegeben und der Reaktionsfortschritt mit der PLC verfolgt. Als sich die relativen Integrale nach einer Reaktionszeit von vier Tagen über mehrere Stunden nicht mehr messbar veränderten, wurde die Reaktion abgebrochen und aufgearbeitet. ach der semipräparativen PLC konnte 3 in einer Ausbeute von lediglich 12 % isoliert werden. In dem zuletzt aufgenommen PL-Chromatogramm entsprach der Produktpeak einer Integralfläche von ca. 30 %. Da die Integrale nicht kalibriert wurden, ist dies nur ein äherungswert. Er indiziert aber dennoch, dass die schlechte Ausbeute an 3 nicht in einem Aufarbeitungsproblem begründet liegt. ffenbar funktioniert die Methylesterspaltung mit der verwendeten Vorschrift nicht sonderlich gut, zumindest konnten die vom Kooperationspartner beschriebenen quantitativen Ausbeuten nicht reproduziert werden. Die so erhaltene Substanzmenge von 3 war aber sehr sauber und die Menge reichte für Bindungsstudien mit UV-Titrationen aus.
110 96 Ergebnisse und Diskussion Bindungsstudien mit dem arylverbrückten RGD-Rezeptor 3 Mit dem Rezeptor 3 wurden zunächst qualitative Experimente zur Löslichkeit in Wasser durchgeführt. Leider stellte sich auch für diese Verbindung heraus, dass die Löslichkeit in Wasser nicht ausreichend für Untersuchungen mit ilfe der MR-Spektroskopie ist. Auch durch Zugabe von Methanol oder DMS zu den wässrigen Suspensionen gelang es nicht, Lösungen mit Konzentrationen im millimolaren Bereich herzustellen. Verglichen mit dem ebenfalls schlecht löslichen, Diglycin-verbrückten Rezeptor (99) ist 3 durch den m-aminobenzoesäurespacer nochmals unpolarer. Deshalb überrascht diese Beobachtung nicht. Im Bereich von c < 10-4 M war 3 aber löslich, weshalb die UV- Bindungsstudien nach der in Abschnitt 3.1 vorgestellten Vorgehensweise durchgeführt wurden. In Voruntersuchungen wurde bestätigt, dass im relevanten Konzentrationsbereich keine signifikante Abweichung der experimentell beobachteten Verdünnung von der nach Lambert-Beer berechneten detektierbar war. Eine intermolekulare Selbstassoziation kann dennoch nicht völlig ausgeschlossen werden. Aufgrund der Komplementarität der Bindungsmotive von Schrader (Anion) und Schmuck (Kation) ist diese sogar wahrscheinlich. Bereits für den zuvor beschriebenen flexiblen RGD-Rezeptor 101 wurde eine solche Aggregation beschrieben. 101 ist der rigideste der flexiblen Rezeptoren und theoretische Berechnungen legen nahe, dass ein planar gestapeltes Dimer gebildet wird. [50] Der hier vorgestellte Rezeptor ist aber noch starrer und könnte deshalb eine isostrukturelle Selbstaggregation zeigen. Möglicherweise ist die im Laufe der UV-Titration auftretende Verdünnung von unter 80 % lediglich zu gering, um einen beobachtbaren Effekt im UV-Spektrum zu erzielen. Eine Quantifizierung der intermolekularen Selbstassoziation wurde aber aufgrund folgender Probleme bezüglich der praktischen Durchführbarkeit unterlassen: Um die Assoziationskonstante einer möglichen Selbstassoziation von 3 zu bestimmen, müssten mehrere Lösungen verschiedener Konzentration angesetzt werden. ur so könnte ein Verdünnungsbereich untersucht werden, der eine Auswertung und Quantifizierung der Selbstassoziation zuließe. Allerdings sind die beobachteten Änderungen der Absorptionskoeffizienten in diesen Systemen so gering, dass der Fehler beim Mischen und Ansetzen der Lösungen relativ dazu einfach zu groß wäre. Die Bindungsstärke von 3 wurde für die beiden Substrate -RGD- 36 und Ac-RGD in UV-Titrationen bestimmt. Für 36 konnte keine Assoziation beobachtet werden. Es tritt zwar eine geringe Abweichung von der berechneten Verdünnung auf, eine mathematische Analyse dieser Abweichung führt aber zu keiner Bindungskonstante. Darüber hinaus ist 36 aus den bereits diskutierten Gründen als Substrat weniger geeignet. Deshalb wurden die Anstrengungen auf die Bestimmung der
111 Ergebnisse und Diskussion 97 Assoziationskonstante des Komplexes aus 3 und Ac-RGD fokussiert. Die 1:1- Stöchiometrie für diesen Komplex wurde durch die Berechnung von aus den Titrationen erhaltenen Job-Plots bestätigt. Außerdem deuten ESI-MS-Analysen im negativen Ionenmodus auf einen 1:1-Komplex hin, ein 1:2-Komplex konnte nicht detektiert werden. Die nun folgenden Messungen wurden deshalb unter der Annahme einer 1:1-Stöchiometrie ausgewertet. Der Aryl-verbrückte RGD-Rezeptor 3 zeigt im Vergleich zu einfacheren Pyrrolen einen leicht bathochromen Shift mit einem Maximum bei λ max = 307 nm. Das UV-Spektrum der Verbindung in Wasser ist in Abbildung 3.42 rechts dargestellt. Die drei aromatischen Untereinheiten sind über eine Peptidbindung delokalisiert, was den bathochromen Shift sowie einen relativ hohen Absorptionskoeffizienten α 307 nm erklärt. Die Analyse dieses Maximums im Verlauf der Zugabe einer Lösung von Ac-RGD lieferte eine Assoziationskonstante von K a = 2700 M -1 in gepuffertem Wasser. Abbildung 3.43: Analyse der Absorption bei 307 nm im Verlauf der Titration von 3 mit Ac-RGD Die Punkte zeigen die experimentell bestimmte Absorption bei 307 nm, die Linie den Verlauf der angepassten Funktion und die gestrichelte Linie den Verlauf der berechneten Verdünnung nach Lambert-Beer an. Zur Überprüfung dieses Ergebnisses wurden die Bindungsstudien unter den gleichen Titrationsbedingungen mit ilfe der Fluoreszenzspektroskopie wiederholt. Die Spektren und der Titrationsverlauf sind in Abbildung 3.44 skizziert. Zur Analyse bot sich insbesondere die Bande bei 460 nm an. Sie nahm im Verlauf der Titration an Intensität zu, ging dann aber in eine Sättigungkurve über, in der sich Abweichung von der berechneten Verdünnung nicht mehr signifikant änderte. Diese Bande korreliert offenbar mit der Entstehung eines Komplexes aus 3 und Ac-RGD Diese
112 98 Ergebnisse und Diskussion Komplexbildung ist nach Zugabe von ungefähr vier Äquivalenten Substrat größtenteils vollzogen. Eine mathematische Analyse dieses Verlaufes mit der Formel 3-16 liefert ebenso wie die Analyse des gesamten Spektralbereiches mit SpecFit für diesen Komplex eine Assoziationskonstante von K a = 2900 M -1. Innerhalb der angenommenen Fehlertoleranz von ΔK a = ± 25 % stimmt dieser Wert sehr gut mit dem aus der UV- Titration erhaltenen überein. Abbildung 3.44: Links: Fluoreszenztitration von 3 mit Ac-RGD- 2 37, das Signal bei 460 nm ist mit einem Stern gekennzeichnet. Rechts: Die mathematische Analyse (Linie) der Intensitäten bei 460 nm (Punkte) im Vergleich zur berechneten Verdünnung (gestrichelte Linie) im Verlauf der Titration. In einer Blindprobe wurde sowohl die UV- als auch die Fluoreszenztitration des Rezeptors 3 mit dem Tripeptid Ac-GGG wiederholt. 38 verfügt über keine funktionellen Seitenketten. Mit keiner der Methoden konnte eine Bindungskonstante aus den Verläufen der Titrationen erhalten werden. Diese Ergebnisse stützen die Vermutung, dass die Bindungsstärke auf Wechselwirkungen zwischen dem Rezeptor und den funktionellen Seitenketten des Substrates basiert. Deshalb wurden theoretische Berechnungen zur Struktur des Komplexes durchgeführt. Die berechnete Vorzugskonformation des Komplexes aus 3 und Ac-RGD ist in Abbildung 3.45 dargestellt. In der Tat ist eine Komplexierung des Seitenkettencarboxylates von 37 durch das Guanidiniocarbonylpyrrol in 3 bei gleichzeitiger Koordinierung der Argininseitenkette durch das benzylische Bisphosphonat möglich. Dabei kann ein etzwerk aus insgesamt neun Wasserstoffbrückenbindungen zwischen Rezeptor und Substrat ausgebildet werden.
113 Ergebnisse und Diskussion 99 Abbildung 3.45: Vorzugskonformation des Komplexes aus dem Rezeptor 3 und Ac-RGD (MacroModel 8.0, Amber*, 2, Schritte). Unpolare Wasserstoffatome sind aus Gründen der Übersichtlichkeit nicht dargestellt. Um den Beitrag der benzylischen Phosphonatgruppen zur Bindungsstärke zu untersuchen, wurde auch das Bis-dimethylphosphonat-Derivat 108 auf seine Affinität zum Substrat Ac-RGD untersucht. Mehrere UV-Titrationen lieferten für den Komplex aus 108 und 37 eine Bindungskonstante von K a = (5300 ± 600) M -1. R R Me 3: R = P 108: R = Me P Me Abbildung 3.46: Die untersuchten Rezeptoren 3 und 108 und das Substrat 37. Zunächst überrascht es, dass der am Phosphonat Methyl-geschützte Vorläufer 108 des eigentlich entworfenen Rezeptors 3 eine noch stärkere Assoziation gegenüber dem Substrat aufweist. Dies kann jedoch auch als inweis für eine intermolekulare Selbstassoziation von 3 interpretiert werden. Durch eine solche Aggregation würde die beobachtete Bindungsstärke zu 37 kompetetiv reduziert. Die Selbstassoziation tritt jedoch nur im Fall von 108 auf, weil die beiden Enden dieses Moleküls elektrostatisch zueinander komplementär sind. Der Vorläufer 108 trägt ausschließlich eine positive Ladung. Ein weiterer inweis ist die gute Löslichkeit von 108 in Wasser. bwohl durch
114 100 Ergebnisse und Diskussion die Entschützung zu 3 zwei weitere Ladungen im Molekül frei werden, wird die Löslichkeit in Wasser dadurch nicht signifikant erhöht. Darüber hinaus ist der Beitrag der Phosphonatgruppen zur Bindungsstärke fraglich. Beispielsweise spielen diese auch in der von Gilson berechneten Komplexstruktur des Phosphonat-basierten RGD-Rezeptors 35 mit dem cyclo(rgdfv) 7 nur eine untergeordnete Rolle (vgl. Abbildung 2.19). Der größte Teil der Bindungsenergie wird in diesem Modell von einer hydrophoben Wechselwirkung mit den aromatischen Anteilen des Rezeptors geliefert. Auch für den vorliegenden Rezeptor 3 ist denkbar, dass eine Spaltung des Methylesters in 108 zum einfach entschützten Bisphosphonat 3 eine intermolekulare Koordinierung durch das Guanidiniocarbonylpyrrol fördert. Damit wäre eine solche Entschützung für die Bindung des RGD-Peptides durch 3 sogar kontraproduktiv. Durch die Verwendung eines starren Spacers kann also offenbar die intra- aber nicht die intermolekulare Selbstassoziation verhindert werden. Dadurch wird die gemessene Bindungskonstante verringert. Die tatsächliche Affinität des Rezeptors 3 zum Zielsubstrat Ac-RGD ist vermutlich wesentlich größer als die hier bestimmte. Die Bindungskonstante für eine intermolekulare Selbstassoziation kann prinzipiell ebenfalls experimentell bestimmt werden. Wenn diese bekannt ist, kann auch die tatsächliche Assoziationskonstante für den Komplex aus 3 und 37 erhalten werden. Aus bereits diskutierten Gründen wurde die Selbstassoziationskonstante für 3 aber nicht bestimmt. Eine mit der molekularen Erkennung des RGD-Peptides konkurrierende Selbstassoziation bleibt aber für das verwendete System von intrinsischer atur. Schraders Bindungsmotiv koordiniert Alkylguanidinium, während Schmucks Bindungsmotiv ein Acylguanidinium enthält. Umgekehrt ist Schmucks Bindungsmotiv zur Erkennung von xoanionen geeignet, von denen Schraders Bisphosphonat gleich zwei enthält. Dies scheint die Koordinierung der eigentlichen Zielstrukturen aber nicht vollständig zu verhindern, offenbar werden Alkylguanidine bzw. Carboxylate besser gebunden, als deren in 3 enthaltenen Analoga. Prinzipiell konnte gezeigt werden, dass die beiden Bindungsmotive von Schrader und Schmuck erfolgreich zu einem Rezeptor für die RGD-Sequenz verknüpft werden können. Dennoch ist für die Kombination aus derartigen, potentiell zueinander komplementären Bindungsmotiven die richtige Wahl des Spacers von besonderer Bedeutung. Dies konnte bereits im Rahmen der bisher durchgeführten ptimierung auf der Grundlage von theoretischen Überlegungen gezeigt werden. Für das Auffinden eines optimalen Spacers ist insbesondere die kombinatorische Chemie geeignet. Die Entwicklung einer adäquaten Methode zur ptimierung von internen Spacern für Guanidiniocarbonylpyrrol-haltige Verbindungen wird im folgenden Kapitel vorgestellt.
115 Ergebnisse und Diskussion Entwicklung eines Festphasenscreenings für Guanidiniocarbonylpyrrolverbindungen Ziel dieses Kapitels ist die Entwicklung eines Verfahrens zur kombinatorischen ptimierung eines Spacers, der die beiden Bindungsmotive von Schrader und Schmuck verknüpft. Voraussetzung dafür ist eine Immobilisierung der Verbindung. Zu diesem Zweck bieten sich drei prinzipielle Möglichkeiten an. Dies ist die kovalente Verknüpfung der Bindungsstelle für das Alkylguanidin (Schrader) (a), des zu variierenden Spacers selbst bzw. eines definierten Teils davon (b) oder der Bindungsstelle für das Carboxylat (Schmuck) (c) mit einer festen Phase. Abbildung 3.47: Zur ptimierung eines RGD-Rezeptors (grün) unter Vereinigung der Bindungsmotive für Alkylguanidin und Carboxylat soll der Spacer kombinatorisch variiert werden. Dabei kann (a) das Bindungsmotiv für das Alkylguanidin, (b) der Spacer selbst oder (c) das Bindungsmotiv für das Carboxylat immobilisiert werden. Theoretisch ist es nach Route (b) möglich, einen Teil des Spacers an die feste Phase zu binden und die weiteren Teile kombinatorisch zu variieren. Dann könnten die beiden Bindungsmotive terminal verknüpft werden. Die dazu erforderliche kovalente Bindungsstelle schränkt jedoch die Spacer, die verwendet werden können, strukturell sehr stark ein. Deshalb wurde die Route (b) nicht verfolgt. Eine weitere Möglichkeit wäre die Immobilisierung der Bindungsstelle für das Alkylguanidin nach Route (a). Als Bindungsmotiv soll wieder das bereits verwendete Bisphosphonat vom Typ 96 zum Einsatz kommen. Eine Immobilisierung wurde von Schrader et al. bereits umgesetzt. Dafür wurde der Baustein am Amin funktionalisiert und später in ein Polyacrylat-artiges Copolymer überführt. [118]
116 102 Ergebnisse und Diskussion Me Me P Me P Me + Cl (a) Me Me P Me P Me (b) Me P P Me * * 111 Abbildung 3.48: Immobilisierung des Bisphosphonates 96: (a) Et 3, DMAP, C 2 Cl 2, 0 C auf RT, 2 h, 83 %. (b) LiBr, C 3 C, reflux, 8 h, quant., danach Copolymerisierung mit AIB in DMF bei 60 C. Zur Erkennung Arginin- und Lysin-reicher Proteinoberflächen sind derartige Copolymere gut geeignet. Die Methode ist für die vorliegende Aufgabenstellung jedoch aus zwei Gründen ungeeignet. Die feste Phase wird bei diesem Verfahren erst durch Polymerisation erhalten. Es wäre aber von Vorteil, das Bindungsmotiv an ein bereits bestehendes Polymer zu kuppeln. ur auf diese Weise kann eine klar definierte und mit anderen Messungen vergleichbare Struktur der festen Phase gewährleistet werden. Außerdem wird durch die Kupplung von 109 mit 96 die Anilin--Gruppe in 96 in ein Amid überführt. Dadurch verliert der Stickstoff seine schon vorher nur begrenzt ausgeprägten nucleophilen Eigenschaften. Dies erschwert eine weitere Funktionalisierung dieser Position enorm. Deshalb ist die in Abbildung 3.48 skizzierte Methode zur Immobilisierung von 96 für die an dieser Stelle gegebene Problemstellung untauglich. Weitere mögliche Ankerpunkte für eine Immobilisierung von 96 wären die aromatischen oder die benzylischen Positionen bzw. die Ester des Phosphonates. Alle diese Möglichkeiten greifen aber direkt in das vorgeschlagene Bindungsmuster für die Koordinierung eines Alkylguanidins ein. Darüber hinaus wäre eine weitere Derivatisierung in aromatischer oder benzylischer Position synthetisch sehr anspruchsvoll. achdem also die in Abbildung 3.47 skizzierten Immobilisierungsmethoden (a) und (b) ausgeschieden waren, wurde eine Methode zur Immobilisierung von Schmucks Bindungsmotiv für Carboxylate nach Weg (c) gesucht. Zur Immobilisierung von einfachen Pyrrolen existieren einige Ansätze [119], für den Guanidiniocarbonylpyrrolbaustein ist dies aber ein neues Verfahren. In allen bisher bekannten Verfahren unter Verwendung dieses Bindungsmotives wird es erst nach kombinatorischer Variation an die feste Phase gekuppelt. Also sollte der Guanidiniocarbonylpyrrolbaustein einfach funktionalisiert werden, um ihn über diese Funktion kovalent an die feste Phase binden zu können. Verschiedene Möglichkeiten zur Substitution des
117 Ergebnisse und Diskussion 103 Guanidiniocarbonylpyrrols wurden bereits bei der Fragestellung der Erhöhung der Löslichkeit vorgestellt (vgl. Abbildung 3.9). Auch zu Immobilisierung bietet sich eine Modifizierung des Pyrrols in 3- bzw. 4-Position an. Allerdings ist eine Funktionalisierung beider Positionen nicht wünschenswert, da eine kovalente Bindung ausreicht, um eine Immobilisierung zu erreichen. Jede überzählige reaktive Gruppe würde Probleme mit der Stöchiometrie späterer Reaktionen bergen oder könnte ebenreaktionen verursachen. Welche der beiden Positionen funktionalisiert wird, ist aber im Prinzip egal. In der klassischen Festphasensynthese werden Peptide an einem polymeren Träger vom C- zum -Terminus synthetisiert (vgl. Abschnitt 2.4.3). [120,121] Im Gegensatz dazu soll das Guanidiniocarbonylpyrrol aber an der Carbonsäure in α-position weiter umgesetzt werden. Daher ist eine inverse Festphasensynthese vom - zum C-Terminus hin notwendig. Aufgrund der guten Spaltbarkeit von tert-butylestern bieten diese sich für die Verwendung im Rahmen der zu C Festphasensynthese an. [122] Die Summe dieser Überlegungen führt zu einem in 3- oder 4-Position immobilisierten Pyrrol 112. Dieses ist geeignet, mit einem tert-butoxyrest in Position R 1 an der festen Phase weiter umgesetzt zu werden. ach kombinatorischer Variation in dieser Position kann terminal ein weiteres Bindungsmotiv aufgebracht werden. Auf diese Weise ist die ptimierung eines internen Spacers möglich R 3 R 1 X R 2 R 2 R R Abbildung 3.49: Mit dem immobilisierten Pyrrolbaustein 112 kann in Position R 1 kombinatorische Chemie betrieben werden. Die dazu benötigten Carbonsäuren 113 oder 114 (R 2 = Schutzgruppe) lassen sich auf das einfach geschützte Guanidin 116 und den R 3 -Ester 115 zurückführen. Als synthetischer Vorläufer von 112 ist die Carbonsäure 113 geeignet, sie kann mit einem ucleophil X auf der festen Phase gekuppelt und so immobilisiert werden. Die weitere Retrosynthese führt zum Pyrrol 115 und dem geschützten Guanidin 116. Da es
118 104 Ergebnisse und Diskussion nicht relevant ist, ob das Pyrrol über die 3- oder die 4-Position immobilisiert ist, wäre auch eine Verbindung vom Typ 114 als Baustein für die feste Phase interessant. Beide Verbindungen lassen sich auf synthetische Vorläufer des gleichen Typs zurückführen. Die zusätzliche Substitution der Pyrrole in 3- bzw. 4-Position durch eine Methylgruppe ist zwar nicht notwendig aber für die Koordinierung von Carboxylaten auch nicht störend. In den folgenden Abschnitten wird zunächst die Synthese relevanter Pyrrolbausteine und einfach geschützter Guanidine vorgestellt. Danach folgen Ausführungen zur Synthese der zu immobilisierenden Guanidinocarbonylpyrrolverbindungen sowie deren Charakterisierung für den Einsatz in der Festphasensynthese Synthese der Pyrrolverbindungen Die weitere retrosynthetische Analyse von 115 führt zu einem α-methyl-substituierten Pyrrol 117. Die Methylgruppe in α-position ist selektiv zur Säure oxidierbar. [123] 117 kann aus der β-diketoverbindung 118 und dem xim 119 erhalten werden. 115 R R R 3 R 4 R 4 R 5 R Abbildung 3.50: Retrosynthetische Analyse von 115. Für die Synthese substituierter Pyrrole stehen zwei klassische Methoden zur Verfügung. Knorr entwickelte ein Verfahren, in dem Ketone mit α-aminoketonen zum Pyrrol kondensiert werden. [124] In einer von Paal entwickelten Variante werden substituierte 1,4-Diketone mit Ammoniak zum Pyrrol zyklisiert, diese Methode ist vor allem zur Darstellung von -substituierten Pyrrolen geeignet. [125] Bei der im Rahmen dieser Arbeit eingesetzten Synthese handelt es sich um eine modifizierte Knorr- Pyrrolkondensation, deren Mechanismus in Abbildung 3.51 skizziert ist.
119 Ergebnisse und Diskussion 105 R 5 R R 3 X R 5 R 4 X R X = Me 118: X = Me (121: X = ) 117 X = Me R 3 R 5 R R 4 X Abbildung 3.51: Modifizierte Knorr-Pyrrolsynthese zur Darstellung von α-methyl-substituierten Pyrrolen. Die Verbindung 121 wurde nicht synthetisiert und ist nur zum Verständnis der späteren Diskussion skizziert. Dabei wird zunächst das xim 119 zum α-amino-β-diketon 120 reduziert. Aufgrund der Instabilität derartiger Verbindungen geschieht dies oft in situ. Die Aminfunktion in 120 ist nun in der Lage, nucleophil eine Ketofunktion des β-diketons 118 anzugreifen und nach Kondensation das Imin 122 zu bilden. Dieses kondensiert unter Abspaltung des R 5 -Carbonylrestes weiter zum Pyrrol 117. Bei dem Substituenten R 5 kann es sich sowohl um einen Alkoxy- als auch um einen Alkylrest handeln. [126] Bei genauer Betrachtung des Mechanismus wird auch klar, warum die vorgestellten Pyrrole alle in β-position Methyl-substituiert sind. Die Methylreste in 3- und 5-Position des Pyrrols 117 stammen originär von den beiden Methylgruppen der Acetylreste des β-diketons 118. Der Methylrest in 5-Position wird für die spätere xidation zur Säure benötigt. Eine Substitution der Methylgruppe in 3-Position durch ein Proton würde retrosynthetisch zum asymmetrischen β-keto-aldehyd-derivat 121 führen. Aufgrund der höheren Reaktivität im Vergleich zu Ketonen würde ein nucleophiler Angriff von 120 in einer solchen Verbindung aber am Aldehyd stattfinden. Das daraus resultierende Pyrrol wäre in 5-Position unsubstituiert und damit für die beabsichtigte xidation unbrauchbar. Zu Beginn dieser Arbeit waren im Arbeitskreis Schmuck bereits einige erfolgreiche Versuche zur Synthese von Pyrrolcarboxylaten des Typs 117 unternommen worden. [127,128,129] Dazu wurde als Edukt ausnahmslos das Diethylderivat 123 (R 3 = R 4 = Et) verwendet. [130] Dieses ist synthetisch in guten Ausbeuten zugänglich und nach der Zyklisierung können die Reste R 3 und R 4 ausgetauscht werden. Der Reaktivitätsunterschied zwischen den beiden Ethylestern reicht aus, um den Seitenkettenrest R 3 durch basische ydrolyse selektiv zu spalten. Der Unterschied in der
120 106 Ergebnisse und Diskussion Reaktivität der beiden Esterfunktionen resultiert aus der Deaktivierung der Carbonylgruppe in α-position durch den positiven mesomeren Effekt des Pyrrols. [131,132] ach dieser Verseifung kann R 4 basisch umgeestert werden, da die Carbonsäure nach ihrer Deprotonierung für einen nucleophilen Angriff nicht mehr zugänglich ist. Anschließende Veresterung in der Seitenkette führt zu dem umfunktionalisierten Diester. 123: R 3 = Et R 4 = Et (a) 124: R 3 = R 4 = Et R 4 R 3 (b) Bn 125 (c) Bn 126 Me Abbildung 3.52: Ein Beispiel zur Synthese eines orthogonal geschützten Pyrroldicarboxylates durch Umesterung: (a) a, Et, 2,60 C, 2 h, 79 %. (b) abn, Bn, mbar, reflux, 6 h, 64 %. (c) C 2 Cl 2, DMF, xalylchlorid, RT, 2 h, dann ame, Me, 40 C, 6 h, 82 %. [129] Diese Methode erfordert jedoch drei Reaktionsschritte um die gewünschten Substituenten in R 3 - und R 5 -Position ins Molekül einzuführen. Im Fall von 126 führte dies zu einem Ausbeuteverlust von 41 %. Außerdem erfordert die basische Umesterung des Substituenten R 4 in α-position des Pyrrols eine hohe ucleophilie des eingesetzten Alkoholates. Diese ist beispielsweise im Falle eines tert-butylalkohols nicht gegeben. Durch eine richtige Wahl der Substituenten schon in den Edukten, die zur Cyclisierung nach Knorr eingesetzt werden, können diese drei Reaktionsschritte jedoch vermieden werden. Deshalb ist der Einsatz von Edukten, welche die gewünschten funktionellen Gruppen bereits auf der Stufe des xims 119 und des 4-Acetyl-5-oxohexanoates 118 (vgl. Abbildung 3.51) tragen, wünschenswert. Zunächst lag bei der Darstellung der Pyrrole besonderes Augenmerk auf der Frage, welche funktionelle Gruppe in der Seitenkette (R 3 in 117) des Pyrrols sinnvoll ist. Diese muss im letzten Schritt vor der Immobilisierung der Verbindung zur Säure (113 oder 114 in Abbildung 3.49) umzuwandeln sein ohne den tert-butylester in α-position des Pyrrols oder die Schutzgruppe am Guanidin zu spalten. In einer ersten Reihe von Versuchen sollte an dieser Stelle ein Ester erhalten werden, der sich unter milden basischen Bedingungen spalten lässt. Der Ethylester in der Seitenkette von 123 ist zwar basisch spaltbar, reagiert aber deutlich schlechter als vergleichbare Methylester. In Abhängigkeit von den Reaktionsbedingungen unterscheiden sich die Reaktivitäten von Methyl- und Ethylester um den Faktor 2 bis über 70. [133] Prinzipiell ist es sogar möglich, Methylester in Gegenwart von Ethylestern selektiv zu spalten. [134] Das für einen
121 Ergebnisse und Diskussion 107 Methylester benötigte Synthon 129 wurde aus Acetylaceton 127 und Methylacrylat 128 hergestellt und nach Destillation in einer exzellenten Ausbeute von 92 % erhalten. [135,136] + Me (a) Me Abbildung 3.53: Synthese von 129: (a) K 2 C 3, 37 C, 24 h, 92 %. Eine Knorr-Pyrrolsynthese mit dem β-diketon 129 führt nun direkt zum gewünschten Methylester in der Seitenkette. Ein für diese Arbeit interessantes Pyrrol ist 130, welches nach Schützung der Säurefunktion als tert-butylester zum Festphasenbaustein des Typs 114 (siehe Abbildung 3.49) umgesetzt werden kann. Zur Synthese von 126 wurde zunächst das Dibenzylhydroximinomalonat 132 aus dem kommerziell erhältlichen Dibenzylmalonat 131 hergestellt. Bn Bn 131 Me Me Bn (a) Bn (b) Bn (c) Bn Abbildung 3.54: Versuchte Synthese von 130: (a) a 2, 2, Ac, 5 auf 100 C, 1.5 d, 41 %. (b) 129, aac, Ac, Zn, 90 C, 19 h, 15 %. (c) S 2 Cl 2, K 2 C 3, Et 2, 0 C auf reflux, 3 h. Das xim 132 wurde in einer Ausbeute von 41 % nach säulenchromatographischer Reinigung erhalten. In der Literatur sind für diese Reaktion Ausbeuten von über 80 % beschrieben. [137] Derart hohe Ausbeuten konnten aber im Rahmen dieser Arbeit nicht reproduziert werden. ffenbar hat die Feinabstimmung des Mischungsverhältnisses der Lösemittel Wasser und Essigsäure einen großen Einfluss, da sich atriumnitrit nur in Wasser und 131 nur in Essigsäure löst. Das so isolierte xim 132 wurde in situ mit Zink im Essigsauren zum Amin reduziert und mit 129 zur Reaktion gebracht. ach erneuter säulenchromatographischer Reinigung wurde 126 erhalten, allerdings in einer Ausbeute von nur 15 %. Die folgende xidation mit Sulfurylchlorid in Diethylether zur Verbindung 130 ist in der Literatur mit einer Ausbeute von 66 % beschrieben. [138] Die Reaktion wurde nach dieser Vorschrift versucht, konnte aber im Rahmen der vorliegenden Arbeit nicht reproduziert werden. Im Arbeitskreis Schmuck wurde
122 108 Ergebnisse und Diskussion außerdem eine Modifikation der Reaktionsbedingungen unter Verwendung von Essigsäure bei -15 C versucht. Jedoch schlug auch dieser Versuch fehl. [129] Parallel zu diesen Versuchen wurde jedoch ein wesentlich effizienterer Zugang zu den benötigten Tricarboxylaten gefunden, welcher nun vorgestellt wird. Weitere Versuche zur Synthese von 130 wurden deshalb nicht unternommen. Um durch die Cyclisierung nach Knorr direkt den gewünschten tert-butylester in α-position des Pyrrols zu erhalten, wurde tert-butylacetoacetat 133 als ximvorläufer gewählt. Für die Verwendung dieser Verbindung spricht, dass sie kommerziell erhältlich und relativ preisgünstig ist. Beide Punkte sind für die Etablierung eines Standardprotokolls für die Festphasensynthese durchaus relevant. 133 kann mit atriumnitrit zum xim 135 umgesetzt werden. Dies wird ohne weitere Isolierung in situ mit Zink zum Amin reduziert und mit dem β-diketon 129 umgesetzt. Es werden also drei Reaktionsschritte in einem durchgeführt, da weder das xim 135, noch das reduzierte Amin-Derivat isoliert wird. ach Aufarbeitung und einfacher Umkristallisierung des Rohproduktes konnte 134 in einer für derartige Umsetzungen exzellenten Ausbeute von 32 % erhalten werden. [139,140] (a) 134 Abbildung 3.55: (a) a 2, 2, Ac, 5 C, 15 h, dann 129, Zn, aac, Ac, 65 C, 15 h, 32 %. Die α-methylgruppe des Pyrrols sollte nun zur Säure oxidiert werden. Für derartige Reaktionen steht eine Vielzahl von Reaktionsbedingungen zur Verfügung, ohne dass sich eine davon als Standardmethode durchgesetzt hätte. [141] Die xidierung von 134 zu 136 ist in der Literatur beispielsweise unter Verwendung von Blei(IV)acetat beschrieben. [142] Mit dieser Methode wurde eine Ausbeute von 50 % erreicht. Voraussetzung für den Erfolg der Reaktion ist jedoch eine sorgsame Trocknung des Reagenzes. Außerdem stellen sich Schwermetallsalze bei der Entsorgung als recht problematisch dar. Deshalb wurde an dieser Stelle vom Einsatz von Bleisalzen abgesehen. Die xidierung von 134 ist in der Literatur auch unter Verwendung von Sulfurylchlorid beschrieben. [143] Allerdings wurde hier die entstehende Säure 136 nicht isoliert und ohne Charakterisierung weiter umgesetzt. ach der folgenden Reaktion wurde eine Ausbeute von lediglich 10 % für beide Schritte beschrieben.
123 Ergebnisse und Diskussion 109 Die Verwendung von Sulfurylchlorid ist für diese xidation von α-methylpyrrolen eine verbreitete Methode. Dabei werden drei Äquivalente Sulfurylchlorid zur dreifachen radikalischen Chlorierung der α-methylgruppe eingesetzt. Eine anschließende ydrolyse liefert dann die α-pyrrolcarbonsäure. [123] Prinzipiell kann das Trichlorid auch im Sinne einer Alkoholyse direkt zum Ester umgesetzt werden. Diese Methode ist besonders dann von Interesse, wenn die auf diese Weise zu umgehenden α-pyrrolcarbonsäuren sehr instabil sind. [144] Tendenziell neigen diese in saurem Medium zur Decarboxylierung. Das gilt besonders, wenn die zweite α-position nicht mit einem Elektronen-ziehenden, sonder einem schiebenden Substituenten versehen ist. So können 5-Methyl-2-carboxypyrrole im trifluoressigsauren Medium innerhalb weniger Minuten bei Raumtemperatur gezielt zum in 2-Position unsubstituierten Derivat decarboxyliert werden. [145] Aber auch die Monoester der Pyrrol- 2,5-dicarbonsäuren können im Sauren leicht decarboxylieren, bei sehr hohen Temperaturen reicht bereits die Acidität der Carbonsäure selbst, um die Decarboxylierung einzuleiten. [146] Für jede einzelne radikalische Chlorierung mit Sulfurylchlorid wird ein Äquivalent Salzsäure freigesetzt. [147] Da bei der xidation bis zur Carbonsäure eine dreifache Chlorierung der α-methylgruppe erforderlich ist, werden bereits im ersten Schritt drei Äquivalente Salzsäure gebildet. Die anschließende ydro- oder Alkoholyse des Trichlorids setzt drei weitere Äquivalente der Salzsäure frei. Da mit dem tert-butylester eine weitere säureempfindliche Gruppe in 134 enthalten ist, ist bei der xidation dieser Verbindung mit Sulfurylchlorid also besonders sorgfältig darauf zu achten, dass die entstehende Salzsäure basisch abgefangen wird. Für das Ethylester-Analogon 137 (134, Et statt Me) wurde von Frydman et al. durch xidation mit Sulfurylchlorid in Tetrachlormethan eine Ausbeute von 30 % erhalten. [148] In Abwandlung dieser Vorschrift wurde das Lösemittel gegen Diethylether ausgetauscht, um die Reaktionstemperatur niedrig zu halten. Auf diese Weise konnte aus 134 in einer für derartige xidationen sehr guten Ausbeute von 49 % die Carbonsäure 136 in kristalliner Form isoliert werden.
124 110 Ergebnisse und Diskussion 134 (a) (b) 136 Cl Cl Cl Abbildung 3.56: Die xidation von 134 wurde ohne Isolierung des dreifach chlorierten Intermediates durchgeführt: (a) S 2 Cl 2, K 2 C 3, Et 2, -20 C auf reflux, 7 h. (b) aac, 2, Dioxan,110 C, 2 h, 49 %. Das Pyrroltricarboxylat 136 konnte mit der hier vorgestellten Synthese in drei Schritten und einer Gesamtausbeute von über 14 % aus kommerziell erhältlichen und preisgünstigen Edukten in Chargen von mehreren Gramm synthetisiert werden. Während die Cyclisierung nach Knorr zu 134 bereits literaturbekannt war, [140] ist die xidierung mit anschließender Isolierung von 136 ein neues Verfahren. Aufgrund der guten Kristallisierbarkeit von 136 in Wasser-Methanol-Gemischen ist die Verbindung in sehr reiner Form zugänglich. Da auch die Darstellung der Edukte keinerlei Säulenchromatographie erfordert und einschließlich 136 alle Zwischenprodukte durch einfache Destillation bzw. Kristallisation zu reinigen sind, ist ein weiteres Scaling Up der Synthese möglich. Im Falle einer späteren Verwendung von basenlabilen Schutzgruppen auf dem Guanidin (vgl. Abbildung 3.49) ist ein Methylester in der Seitenkette aber unzweckmäßig. Eine Freisetzung der Säure in der Seitenkette des Pyrrols unter Erhalt der Schutzgruppe auf dem Guanidin wäre dann nicht mehr möglich. Für derartige Verbindungen wird ein Ester benötigt, der im neutralen Medium zur Säure gespalten werden kann. Benzylester sind für diese Zwecke sehr geeignet, da sie in neutraler Lösung durch katalytische ydrierung zur Säure umgesetzt werden können. [107] Prinzipiell sollte auch die in der Seitenkette als Benzylester geschützte Verbindung 138 nach Knorr direkt aus Benzyl- 5-acetyl-6-oxohexanoat 139 und tert-butylacetoacetat 133 herzustellen sein.
125 Ergebnisse und Diskussion 111 Bn (a) Bn 139 tbu 133 (b) tbu 138 Bn Abbildung 3.57: Syntheseplan zur direkten Zyklisierung nach Knorr zu 138: (a) K 2 C 3, 37 C. (b) 133, a 2, 2, Ac, dann 139, Zn, aac, Ac, 65 C. Das zur Darstellung von 139 benötigte Benzylacrylat 140 ist kommerziell erhältlich, seine Reinigung im Vergleich zum Methylacrylat 128 jedoch deutlich aufwändiger. Methylacrylat 128 siedet bereits bei 80 C (ormaldruck), während 140 mit einem Siedepunkt von 94 C (8 mbar) [149] im Vakuum destilliert werden muss. Leider ist die Verbindung 139 nicht literaturbekannt. [150,151] Für diese Substanz ist jedoch ist ein nochmals deutlich erhöhter Siedepunkt zu erwarten, da bereits das Methylester- Analogon 129 erst bei 97 C (1.2 mbar) siedet. Die Möglichkeit der Isolierung von 139 durch Destillation scheidet deshalb wahrscheinlich aus. Falls es sich also bei dem Produkt nicht um einen kristallisierbaren Feststoff handelt, müsste 139 wegen der strukturellen Ähnlichkeit zu seinen Edukten voraussichtlich durch Säulenchromatographie gereinigt werden. Damit wäre einer der auptvorteile der direkten Zyklisierung im Vergleich zur Umesterung aus verwandten Pyrrolen nicht mehr gegeben. Die Synthese des Benzylesters 138 wurde daher durch basische Umesterung des Ethylesters 137 [139] versucht. Da tert-butylester aufgrund der Syn-Pentanwechselwirkung normalerweise gegen eine basische Umesterung inert sind, wurden für die Synthese von 138 nach dieser Methode keine signifikanten ebenreaktionen erwartet. Die Umesterung lieferte jedoch in guten Ausbeuten den in beiden Positionen umgewandelten Dibenzylester 141.
126 112 Ergebnisse und Diskussion (a) tbu + - R C 2 R - tbu + Bn + tbu R - Bn + - Bn R C 2 C Abbildung 3.58: Basische Umesterung zum unerwarteten Produkt 141 mit einem Vorschlag zum Mechanismus. Das Keten-Zwischenprodukt kann auch zum Aldehyd Tautomerisieren, die reaktive Spezies ist aber das Keten. (a) abn, Bn, Toluol, Dean-Stark-Apparatur, reflux, 3 h, 58 %. Ein möglicher Mechanismus dieser Umesterung ist in der Abbildung ebenfalls skizziert. In dem stark basischen Medium ist offenbar eine Deprotonierung der α-methylgruppe des Pyrrols möglich. Das entstehende Anion kann unter Abspaltung des tert-butyoxylat-restes ein Keten bilden, welches durch Resonanz stabilisiert wird. Die Eliminierung von Proton und Alkoholat kann natürlich auch konzertiert ablaufen. Eine Addition von Benzylalkohol an das entstandene Keten führt zum Benzylester in dieser Position. Mit der verwendeten Dean-Stark-Apparatur werden beide entstehenden Alkohole (Ethanol und tert-butanol) aus der Reaktionsmischung entfernt. Dies erklärt die gute Ausbeute an 141. Die richtige Wahl der Reaktionsbedingungen lässt vermutlich dennoch eine Synthese von 138 mit dieser Methode zu. Selektiv in der Seitenkette stattfindende Umesterungen sind auch mit sterisch weniger anspruchsvollen Estern als dem tert-butylester in α-position bekannt. In jedem Fall bleibt es bemerkenswert, dass die strukturell relativ einfache Verbindung 138 in der Literatur nicht beschrieben ist. Darüber hinaus ist ungeklärt, ob und in welchen Ausbeuten die xidation der α-methylgruppe zur Säure durchführbar wäre. Die unerwünschte Umesterung des tert-butylesters nach dem oben abgebildeten Mechanismus lässt sich jedoch vermeiden, wenn keine basisch abstrahierbaren α-methylprotonen im Molekül vorhanden sind. Diese Überlegung sowie die effektive und einfache Synthese der Carbonsäure 136, die im Rahmen dieser Arbeit entwickelt wurde, legen eine Umesterung der Seitenkette in dieser Verbindung nahe. Für diese Reaktion muss die Säure deprotoniert vorliegen. Dies kann durch vorherige
127 Ergebnisse und Diskussion 113 Überführung in das Anion oder durch den Einsatz von mehr als einem Äquivalent des Alkoholates bei der Umesterung erfolgen. Um den Eintrag von Verunreinigungen, z. B. durch eine xidschicht auf dem verwendeten atrium so gering wie möglich zu halten, sollten aber nur katalytische Mengen atrium eingesetzt werden. Deshalb wurde die Säure 136 schon vor der Umesterung deprotoniert. Dies geschah aus einer wässrigen Suspension heraus durch Zugabe von einem Äquivalent atronlauge. Dabei löste sich der Feststoff auf. Das nach Trocknung an der Lyophyle erhaltene atriumcarboxylat von 136 wurde unter Entfernung des entstehenden Methanols zur Umesterung des Methylesters in der Seitenkette verwendet (a) Abbildung 3.59: (a) 1.0 eq a, Trocknung an Lyophyle, dann cat. abn, Bn, Toluol, mbar reflux, 3 d, 78 %. Auf diese Weise konnte mit 142 der zweite für die Festphasensynthese benötigte Pyrrolbaustein in sehr guten Ausbeuten von 78 % erhalten werden. Mit dem Methylester 136 und dem bisher nicht literaturbekannten Benzylester 142 stehen nun zwei Verbindungen zur Verfügung, die entweder basisch (136) oder hydrogenolytisch (142) die Carbonsäure in der Seitenkette freisetzen können. Für Verbindungen, die auch unter diesen Bedingungen nicht stabil sind, ist eine andere Schützung der Carbonsäure erforderlich. Säureempfindliche Ester kommen aufgrund der Anwesenheit des tert-butylesters in α-position, der für die Modifikation an der festen Phase benötigt wird, nicht in Frage. Die Carbonsäure kann aber als Aldehyd maskiert und im terminalen Schritt unter milden Bedingungen wieder zur Säure oxidiert werden. [152] Die erausforderung bei der Reduzierung von Estern zu Aldehyden liegt in der Verhinderung der weiteren Reduzierung des Aldehydes zum Alkohol. Die Carbonylgruppe des Aldehydes ist gegenüber Metallhydriden, die meistens für derartige Reduktionen eingesetzt werden, reaktiver als die des Esters. Um das Problem zu umgehen, kann der Ester vorher in eine funktionelle Gruppe überführt werden, die noch reaktiver ist, als ein Aldehyd (z. B. ein Säurechlorid). Alternativ kann die tetraedrische Zwischenstufe, die sich nach Addition eines ydriddonors an den Ester bildet, stabilisiert werden. Bei dieser Methode wird der Aldehyd erst bei der wässrigen Aufarbeitung gebildet. Für die letztgenannte Methode hat sich die vorherige Umwandlung des Esters in ein Amid nach Weinreb als Standardmethode etabliert. [153]
128 114 Ergebnisse und Diskussion Diese -Methyl--Methoxy-amide bilden sogar mit sehr reaktiven Metallhydriden wie z. B. Lithiumaluminiumhydrid einen stabilen Komplex. [154] bwohl die Synthese der Amide in guten Ausbeuten möglich ist, wird dadurch ein zusätzlicher Reaktionsschritt erforderlich. [155] Unter Vermeidung dieser zusätzlichen Transformation kann die tetraedrische Zwischenstufe auch durch die Wahl eines sterisch anspruchsvollen Metallhydrides stabilisiert werden. So gelang beispielsweise unter Verwendung von LiAl(tBu) 3 in TF die Synthese von Aldehyden aus ihren korrespondierenden Estern. Bei den in diesem Zusammenhang verwendeten Estern handelte es sich aber um Phenylester, die zu den aktiveren der bekannten Ester gehören. [156] Deutlich etablierter ist die Verwendung von Diisobutylaluminiumhydrid (DIBAL-) in weniger gut koordinierenden Lösemitteln wie Toluol oder Dichlormethan bei sehr tiefen Temperaturen. [157,158] Die in dieser Arbeit verwendeten stickstoffhaltigen aromatischen eterozyklen können tendenziell koordinierende Eigenschaften aufweisen und dadurch den tetraedrischen Komplex zerstören. Aus diesem Grund werden derartige - Gruppen häufig vor der Umsetzung mit DIBAL- geschützt, [159] dies ist jedoch nicht zwingend erforderlich. [160] Zur Untersuchung einer Reduktion des Seitenkettenesters der verwendeten Pyrrolsysteme wurde das Pyrrol 123 als Modellverbindung verwendet. Das Pyrrol wurde in Toluol gelöst und auf -78 C gekühlt. Dazu wurde unter DC-Kontrolle sukzessiv eine Lösung von DIBAL- in Toluol gegeben, bis 123 nahezu vollständig umgesetzt war. Auf diese Weise konnte der Aldehyd 143 in einer Ausbeute von 46 % erhalten werden. 123 Et (a) + Et Et Et Abbildung 3.60: Selektive Reduzierung des Esters 123 in 4-Postion des Pyrrols: (a) DIBAL-, Toluol, -78 C, 5 h, 46 %. Erfreulicherweise konnte festgestellt werden, dass der Reaktivitätsunterschied der beiden Ethylesterfunktionen in 123 auch bei dieser Reaktion ausreicht, um selektiv den Ester in der Seitenkette des Pyrrols zu reduzieren. Ein in 2-Position reduziertes Produkt konnte nicht isoliert werden. Leider scheinen die koordinierenden Eigenschaften einer in der Mischung vorhandenen Komponente aber auszureichen, um die tetraedrische Zwischenstufe schon während der Reaktion zum Aldehyd 143 zu spalten. Dieser kann
129 Ergebnisse und Diskussion 115 mit DIBAL- zum Alkohol 144 reagieren. Es wurden ohne den Anteil genau zu quantifizieren ca. 15 % 144 aus der Reaktionsmischung isoliert. Dennoch stellt diese Methode einen Ausweg für komplizierte Syntheseprobleme von hoch funktionalisierten Pyrrolsystemen dar. Für die im Rahmen dieser Arbeit aufkommenden Problemstellungen waren jedoch die zur Verfügung stehenden Ester 136 (R = Me) und 142 (R = Bn) ausreichend. Deshalb wird nun auf die Synthese der benötigten Guanidinverbindungen eingegangen Einfach geschützte Guanidine für die Festphasensynthese bwohl Guanidin (145) zwei Aminfunktionen enthält, weist es im Vergleich zu einfachen Aminen deutlich andere chemische Eigenschaften auf. Dies äußert sich beispielsweise in einer sehr viel höheren Basizität des Guanidins. [161,162] In struktureller insicht kann Guanidin aber auch als Imin-verbrücktes Diamin betrachtet werden. Wenn von den beiden Aminen nur eines geschützt und das zweite ungeschützt vorliegt, spricht man von einfach, im Falle der Schützung beider Aminfunktionen von zweifach geschützten Guanidinen. In der Literatur sind neben den auch für Amine üblichen Carbamaten einige spezielle Schutzgruppen für das Guanidin beschrieben. Einen Überblick vermittelt Abbildung SG SG = 2 CF einfach geschützt SG SG zweifach geschützt F 148 F tbu F F S R R Abbildung 3.61: Strukturformel des einfach und des zweifach geschützten Guanidins. Außerdem die von Kilburn (146), [163] Golding (147) [164] und Johnson (148) [165] für substituierte Guanidine verwendeten Schutzgruppen, sowie die allgemeine Struktur der Reste von Sulfonamid- (149) [166,167] und Carbamat- (150) Schutzgruppen. Die im Rahmen dieser Arbeit vorgestellten Guanidine sind als Carbamat geschützt. Auf diesem Gebiet steht eine Vielzahl von verschiedenen Schutzgruppen zur Verfügung, die unter unterschiedlichsten Bedingungen gespalten werden können. Ihre Verwendung ist für Amine bereits umfassend beschrieben. Für viele dieser Verbindungen sind die erforderlichen Edukte entweder kommerziell erhältlich oder synthetisch leicht zugänglich. Zweifach Carbamat-geschützte Guanidine sind literaturbekannt. [168,169] Für einige Carbamate sind sogar die dreifach, also,, -geschützten Derivate
130 116 Ergebnisse und Diskussion beschrieben. [170] Für die Synthese der zu immobilisierenden Bausteine werden jedoch die einfach geschützten Guanidine benötigt, da die zweite Aminfunktion als ucleophil für die spätere Kupplung mit der Pyrrolcarbonsäure erforderlich ist. In diesem Kapitel werden drei einfach geschützte Guanidine vorgestellt, die später zu diesem Zwecke eingesetzt werden sollen. Die Benzyloxycarbonylgruppe (Cbz) ist im Rahmen der Synthese des Rezeptors 2 für D-Ala-D-Ala (siehe Kapitel 3.1.6) bereits erwähnt worden. [171] Die Cbz-Schutzgruppe lässt sich durch katalytische ydrierung im neutralen Medium, also unter sehr milden Bedingungen abspalten. Außerdem kann sie unter sauren Bedingungen gespalten werden, allerdings sind zu diesem Zweck sehr starke Säuren wie z. B. Bromwasserstoffsäure notwendig. [172] Gegenüber weniger starken Säuren wie Trifluoressigsäure ist die Schutzgruppe aber stabil, daher ist die geplante, zum tert-butylester orthogonale Verwendung möglich. Cbz-Guanidin 73 wurde aus Guanidiniumchlorid 145 Cl durch Umsetzung mit atriumhydroxid und Benzylchloroformiat erhalten. (a) (b) Cl Cl Abbildung 3.62: Synthese des einfach Cbz-geschützten Guanidins(73): (a) 145 Cl, a, 2, 152 (Cbz-Cl) in Dioxan, 0 C auf RT, 15 h, 54 %. Das Fmoc-geschützte Guanidin (151) wurde als ydrochlorid erhalten: (b) 145 Cl, a, 2, 156 (Fmoc-Cl) in C 2 Cl 2, RT, 2 h, 66 %. Alternativ dazu sollte eine Schutzgruppe verwendet werden, die unter milden basischen Bedingungen spaltbar ist. Eine solche Schutzgruppe ist die 9-Fluorenylmethyloxycarbonylgruppe (Fmoc). Die Fmoc-Schutzgruppe ist gegenüber tertiären Aminobasen stabil und kann mit sekundären Aminen (z. B. Piperidin) abgespalten werden. Da einfach geschützte Guanidine immer noch leicht basische Eigenschaften aufweisen, ist eine Selbstentschützung des isolierten Fmoc-Guanidins 151 unter Umständen möglich. Deshalb wurde die Verbindung in der protonierten Form angestrebt. Die in der Literatur noch nicht beschriebene Verbindung 151 Cl konnte mit einer Ausbeute von 66 % als kristalliner weißer Feststoff dargestellt werden. Eine weitere, wenn auch in der organischen Synthese wenig verbreitete Methode zur Schützung von ucleophilen ist die Verwendung von photospaltbaren Schutzgruppen. [173] Für die vorliegende Arbeit wurde zu diesem Zweck die 3,5- Dimethoxybenzyloxycarbonyl-Gruppe (Dmbc) gewählt. Die allgemeine Struktur eines
131 Ergebnisse und Diskussion 117 mit dieser Gruppe geschützten Amins ist in Abbildung 3.63 dargestellt. Unter Bestrahlung mit einer Quecksilberdampfdrucklampe kann das Amin 155 mit Ausbeuten von bis zu 85 % aus seinem Dmbc-geschützten Vorläufer 153 freigesetzt werden. [174] Dabei nehmen die Methoxysubstituenten am Aromaten eine zentrale Rolle bei der Stabilisierung des als Zwischenstufe postulierten Benzylkations ein. [175] Die Dmbc- Schutzgruppe kann sogar in Gegenwart ihres nicht Methoxy-substituierten Analogons, der Cbz-Schutzgruppe, selektiv gespalten werden. R 153 Me Me h ν 2 C R + Me - C 2 Dioxan 2 R Me Me 154 Me Abbildung 3.63: Allgemeine Struktur eines 3,5-Dimethoxybenzyloxycarbonyl (Dmbc) geschützten Amins 153, ein Vorschlag zum Mechanismus der Photospaltung sowie die entstehenden Produkte. Für die Schützung des Guanidins mit der Dmbc-Gruppe musste zunächst aus 3,5-Dimethoxybenzylalkohol 154 und 4-itrophenylchloroformiat 157 der Aktivester 158 hergestellt werden. Zur Synthese von Dmbc-Guanidin 159 konnte das zuvor (vgl. Abbildung 3.62) verwendete Protokoll nicht direkt übertragen werden, da der Kohlensäurediester 158 eine andere Aktivität als die zuvor verwendeten Chloroformiate aufweist. Um konkurrierende ucleophile aus der Reaktionsmischung fernzuhalten, sollte das Guanidinium in seine deprotonierte Form, also das Guanidin, überführt werden. Auf diese Weise kann auf den Zusatz einer Base (z. B. atriumhydroxid), die das Guanidinium vor seiner Schützung deprotoniert, verzichtet werden. Zu diesem Zweck sollte das Chloridion aus dem Guanidiniumchlorid 213 Cl entfernt werden. Dies gelang mit ilfe einer Ionenaustauschersäule und das Guanidin 145 wurde nach Trocknung im ochvakuum über Phosphorpentoxid erhalten. Dieses Öl wurde mit 158 zur Reaktion gebracht. Dmbc-Guanidin wurde nach wässriger Aufarbeitung und Umkristallisierung als Chloridsalz 159 Cl in guter Ausbeute erhalten.
132 118 Ergebnisse und Diskussion Cl Me 158 Cl 2 (a) (b) Cl Me Me Me 154 Me Me Abbildung 3.64: Synthese des einfach Dmbc-geschützten Guanidins: (a) Aceton, Pyridin, 0 C, 3 h 97 %. (b) 145, Et 2, C 2 Cl 2, 1 h, 67 %. eben dem bekannten Cbz-Guanidin 73 konnten hier zwei neuartig mit Fmoc (151) bzw. mit Dmbc (159) geschützte Guanidine synthetisiert werden. Beide sind nicht literaturbekannt. Damit stehen vier Bedingungen zur Auswahl, unter denen später das Guanidin freigesetzt werden kann: Entweder durch ydrierung (Cbz), unter stark sauren Bedingungen (Cbz), schwach basischen Bedingungen (Fmoc) oder durch Photolyse (Dmbc). Die Verbindungen sollen im nächsten Abschnitt mit den in Kapitel dargestellten Pyrrolcarbonsäuren zu den für die Festphasensynthese benötigten Bausteinen verknüpft werden Synthese der geschützten Guanidiniocarbonylpyrrolverbindungen zur Immobilisierung Die bisher synthetisierten Guanidiniocarbonylpyrrole sollen nun mit den benötigten Bausteinen für die Festphasensynthese verbunden werden. Dabei werden alle drei bisher vorgestellten einfach geschützten Guanidine verwendet. Die entsprechenden drei Zielverbindungen sind in Abbildung 3.65 dargestellt. Über die Carbonsäure in der Seitenkette des Pyrrols kann dann eine Immobilisierung an der festen Phase durchgeführt werden.
133 Ergebnisse und Diskussion : R = 161: R = R 160: R = Abbildung 3.65: Zielverbindungen zur Immobilisierung auf der festen Phase, die Guanidineinheit ist Dmbc- (160), Fmoc- (161) oder Cbz- (162) geschützt. Bereits an dieser Stelle sei bemerkt, dass mit der Darstellung dieser Guanidinocarbonylpyrrolsysteme aus synthetischer Sicht völliges euland betreten wird. Keine der in Abbildung 3.65 dargestellten Verbindungen ist literaturbekannt. Ebenso ist keiner der in diesem Kapitel erwähnten synthetischen Vorläufer bisher beschrieben worden. Im Arbeitskreis Schmuck werden zwar umfangreiche Forschungen mit Guanidiniocarbonylpyrrolen unternommen. Dennoch sind nur analoge, aber keine identischen Verbindungen synthetisiert worden. Auch die Verwendung der oben vorgestellten Schutzgruppen für das Guanidiniocarbonylpyrrol ist erst im Rahmen der vorliegenden Arbeit etabliert worden. Zuvor wurde ausschließlich das Boc-Guanidin 87 zur Synthese eingesetzt. Zur Darstellung von 162 wurde das in der Seitenkette geschützte Methylesterderivat 163 angestrebt. Dafür wurde das Tricarboxylat 136 aktiviert und mit Cbz-Guanidin 73 zur Reaktion gebracht. Zur Aktivierung der Carbonsäure wurde das Kupplungsreagenz CTU eingesetzt. Die Edukte wurden in absolutem Dichlormethan suspendiert und so lange absolutes DMF zugetropft, bis sich alle Komponenten gelöst hatten. Auf diese Weise konnte in einer sehr guten Ausbeute von 82 % die Verbindung 163 erhalten werden.
134 120 Ergebnisse und Diskussion tbu 136 Me (a) tbu (b) R 163: R = Me 162: R = Cbz Abbildung 3.66: Synthese des Cbz-geschützten Bausteins 162: (a) CTU, DMAP, C 2 Cl 2, DMF, RT, 15 h, 82 %. (b) Me 3 Sn, (C 2 Cl) 2, reflux, 3 h, 93 %. Die Methylesterspaltung wurde mit Lithiumhydroxid in verschiedenen Lösemitteln versucht. ach Spaltung in Methanol-Wasser-Gemischen konnte kein Produkt isoliert werden. Möglicherweise ist dies auf die unerwartet guten Eigenschaften von Carbamatgeschützten Guanidinen als Abgangsgruppe zurückzuführen. Von Wienand wurde eine Spaltung der Amidbindung am Pyrrol unter Eliminierung von Boc-Guanidin 87 für ein ähnliches System beschrieben. [92] Auch die von Geiger optimierten Bedingungen unter Verwendung von Tetrahydrofuran-Wasser-Gemischen führten nur zu Ausbeuten von maximal 25 % für dieses System. [111] Außerdem gestaltete sich die chromatographische Isolierung von 162 aufgrund von nicht näher charakterisierten ebenprodukten mit ähnlichem R f -Wert schwierig. Ein von icolaou et al. entwickeltes Protokoll zur Methylesterspaltung unter Verwendung von Trimethylzinnhydroxid führte schließlich zu exzellenten Ergebnissen. [176] Auf diese Weise konnte 162 in einer Ausbeute von 93 % erhalten werden. Auch die säulenchromatographische Aufarbeitung war deutlich einfacher, da die eben erwähnten ebenprodukte unter diesen Bedingungen nicht auftraten. Der benötigte Festphasenbaustein 162 konnte also in einer konvergenten Synthese in nur sechs Stufen mit einer Gesamtausbeute von 13 % aus kommerziell erhältlichen Edukten dargestellt werden. Dabei wirkt sich noch negativ aus, dass das Cbz-Guanidin 73 lediglich mit einer Ausbeute von 54 % erhalten wurde. Diese Ausbeute kann sicherlich noch gesteigert werden, was auch die Gesamtausbeute von 162 nochmals verbessern würde. In Anbetracht der Tatsache, dass es sich bei 162 um ein neuartiges System handelt, kann dieses Ergebnis durchaus als exzellent betrachtet werden. Im nächsten Schritt sollte der Dmbc-geschützte Baustein 160 dargestellt werden. Dmbc- Guanidin 159 wurde ebenfalls an das in der Seitenkette als Methylester geschützte Pyrrol 136 gekuppelt. In einer zur Synthese von 163 analogen Vorschrift wurde die Guanidinverbindung als ydrochlorid 159 Cl mit der Aminobase DMAP im Überschuss eingesetzt. 164 wurde in einer guten Ausbeute von 65 % isoliert. Diese lag
135 Ergebnisse und Diskussion 121 unterhalb der des Cbz-Analogons 163, was vermutlich mit der schlechteren Löslichkeit und Kristallisierbarkeit von 164 zusammenhängt. tbu 136 Me 2 2 Cl 159-Cl + Me Me (a) tbu (b) R 164: R = Me 160: R = Dmbc Abbildung 3.67: Synthese des Dmbc-geschützten Bausteins 162: (a) CTU, DMAP, C 2 Cl 2, DMF, RT, 12 h, 65 %. (b) Li, TF/ 2 4:1, RT, 3 d, 56 %. Die Spaltung des Methylesters in 164 wurde mit Lithiumhydroxid in wässrigem Tetrahydrofuran durchgeführt und lieferte 160 in einer guten Ausbeute von 56 %. Dieses gute Ergebnis konnte erzielt werden, indem mit ilfe der DC der Zeitpunkt des vollständigen Verschwindens des Eduktes bestimmt und die Reaktion daraufhin umgehend abgebrochen und aufgearbeitet wurde. Dennoch wurden auch hier die bereits beschriebenen Probleme der Abtrennung von ebenprodukten mit ähnlichem säulenchromatographischem Laufverhalten beobachtet. Das vorliegende Ergebnis stammt aus der Zeit vor der Veröffentlichung des auf 163 angewendeten Protokolls von icolaou im Jahre Dieses Verfahrens wurde mit wenigen Milligramm von noch vorhandenem 164 getestet, lieferte aber nur eine Ausbeute von 37 %. Leider war keine weitere Substanzmenge zur Untersuchung dieser Reaktion mehr vorhanden, so dass keine weiteren Versuche zur ptimierung der Methylesterspaltung zu 160 unternommen wurden. Mit beiden Methoden (Lithiumhydroxid und Trimethylzinnhydroxid) ist aber eine Darstellung von des Pyrrolbausteins 160 möglich und wurde erfolgreich vollzogen. Damit war der synthetische Zugang zum zweiten, nun Dmbcgeschützten Baustein zur Immobilisierung auf der festen Phase geschaffen. Dieser konnte in sieben Schritten in einer immer noch guten Gesamtausbeute von 3.4 % aus kommerziell erhältlichen Edukten dargestellt werden. ach den guten Resultaten mit CTU bei der Kupplung von Pyrrolcarbonsäure und einfach geschütztem Guanidin, wurde dieses Verfahren auch bei der Kupplung mit Fmoc-Guanidin 151 versucht. Fmoc-geschützte Guanidine wurden zwar bereits unter Peptidkupplungsbedingungen eingesetzt, jedoch wurden in diesem Fall die nicht an der Reaktion beteiligten Seitenkette der Aminosäure Arginin (, -)Fmoc-geschützt. [177] Im vorliegenden Fall sollte das Fmoc-geschützte Guanidin 151 mit einem Triesterbaustein vom Typ 136 gekuppelt werden. Dabei ist der Methylester in der
136 122 Ergebnisse und Diskussion Seitenkette des Pyrrols allerdings ungeeignet, da dieser nach erfolgter Kupplung basisch gespalten werden müsste. Dies könnte in Gegenwart der basenempfindlichen Fmoc- Gruppe zu ebenreaktionen führen. Als einziger orthogonal zum tert-butylester und der Fmoc-Gruppe spaltbarer Ester kommt ein Benzylester in Frage. Daher wurde Fmoc- Guanidin 151 mit dem Benzylester 142 umgesetzt. Dieser könnte nach erfolgter Synthese von 165 durch katalytische ydrierung in neutraler Lösung zur Säure gespalten werden. 142 Bn + Cl 2 2 (a) (b) tbu 165 Bn Fmoc 151-Cl Abbildung 3.68: Versuche zur Kupplung von 151 an α-pyrrolcarbonsäuren: (a) CTU, DMAP, C 2 Cl 2, DMF, RT. (b) SCl 2, DIEA, Toluol, DCM, DMF. Die Kupplung von Fmoc-Guanidin 151 an 142 wurde unter Verwendung von CTU bei verschiedenen Bedingungen versucht. Die Verbindung 165 konnte aber nicht isoliert werden. Auch die Verwendung von Thionylchlorid und Diisopropylethylamin führte nicht zum gewünschten Erfolg. Als Ursache dafür wurde die unzureichende Stabilität der Verbindung 151 in Lösung vermutet. Daher sollte die Verwendung des einfach geschützten Fmoc-Guanidin 151 umgangen werden. Es wurde nun versucht, zunächst die Guanidineinheit an das Pyrrol zu kuppeln und diese dann nachträglich mit Fmoc-Cl zu schützen. 166: R = 168: R = Bn R 161: R = 165: R = Bn R 2 Fmoc Abbildung 3.69: Alternativer Syntheseplan für den Pyrrolbaustein 161. Dabei wird zuerst die Guanidineinheit an das Pyrrol gekuppelt und nachträglich Fmoc-geschützt. In einem ersten Versuch wurde die Schützung der Guanidineinheit in der Verbindung 166 mit der Fmoc-Gruppe untersucht. Auf diese Weise könnte direkt der zur Immobilisierung gewünschte Pyrrolbaustein 161 erhalten und die Synthese eines Benzylesters in der Seitenkette vermieden werden. Die Verbindung 166 ist durch Abspaltung der Cbz-Schutzgruppe in der bereits dargestellten Verbindung 162
137 Ergebnisse und Diskussion 123 zugänglich. Zu diesem Zweck wurde 162 katalytisch hydriert. Das Zwischenprodukt 166 wurde in quantitativer Ausbeute erhalten. Danach wurde 166 mit Fmoc-Cl 156 umgesetzt. Das gewünschte Produkt 161 konnte aber nicht isoliert werden. ffenbar stört die Carbonsäure in der Seitenkette, deren Schützung als Ester ist vermutlich für eine erfolgreiche Schützung der Guanidineinheit essentiell (a),(b) Cbz Fmoc Abbildung 3.70: Versuch zur Synthese von 161 durch Umschützung von 162: (a) 2, Pd/C, Me, 40 C, 2 h, quant., dann (b) 156, DMAP, C 2 Cl 2, DMF, RT, 5 h. Falls sich in der Seitenkette ein Ester befindet, kommt aber aus eben genannten Gründen dafür nur der Benzylester in Frage. Daher ist die Verbindung 168 mit dem Benzylester in der Seitenkette und einem ungeschützten Guanidiniocarbonyl in α-position des Pyrrols als Vorläufer notwendig. Diese Substanz könnte nachträglich mit Fmoc-Cl 156 am Guanidin geschützt und somit zur gewünschten Verbindung 165 umgesetzt werden. Abbildung 3.71 vermittelt einen Überblick über die in diesem Zusammenhang unternommenen Versuche zur Synthese von 168 ausgehend von (a) Boc 87 2 (b) (c) Fmoc-Cl (156) Abbildung 3.71: Alternative Synthese von 165 aus 168, Versuche zur Synthese von 168 aus 142 waren aber nicht erfolgreich: (a) SCl 2, C 2 Cl 2, DMF, RT, 1 h, dann 145, RT, 1 h. (b) CTU, DMAP, C 2 Cl 2, DMF, RT, 24 h, 85 %. (c) 10 % TFA, C 2 Cl 2, 0 C.
138 124 Ergebnisse und Diskussion Zunächst wurde das freie Guanidin 145 mit der Pyrrolcarbonsäure 142 umgesetzt. Zu diesem Zweck wurde Guanidiniumchlorid 145 Cl mit einer Ionenaustauschersäule vom Chlorid befreit und nach Trocknung das freie Guanidin 145 erhalten. Aufgrund der starken Basizität sollte das bisher verwendete Kupplungsverfahren vermieden werden, weil dabei die Edukte über acht bei Raumtemperatur gerührt wurden. Deshalb wurde 142 mit Thionylchlorid und Kaliumcarbonat zum Säurechlorid umgesetzt und nach einer Stunde ein Überschuss an Guanidin 145 zugegeben. ach einer weiteren Stunde wurde die Reaktion abgebrochen und aufgearbeitet. Das gewünschte Produkt 168 konnte jedoch nicht isoliert werden. Ein weiterer synthetischer Zugang zu 168 wäre die Kupplung von 142 mit einem einfach geschützten Guanidin und anschließender selektiver Abspaltung der Schutzgruppe auf dem Guanidin. Eine zu Benzyl- und tert-butylester orthogonal spaltbare Schutzgruppe am Guanidin stand jedoch nicht zur Verfügung. Diese Route wurde dennoch mit Boc-Guanidin 87 versucht. Dieses ist zwar ebenso wie der tert-butylester unter sauren Bedingungen zu spalten, diese Bedingungen sind aber über die Wahl des Lösemittels und über den Anteil der Säure in der Lösung sehr gut zu kontrollieren. Falls also die Boc-Gruppe auf dem Guanidin eine höhere Säureempfindlichkeit aufweist als der tert-butylester in α-position, könnte unter präziser Einstellung der Reaktionsbedingungen und DC-Kontrolle eine selektive Spaltung möglich sein. Die Synthese von 169 gelang unter Einsatz von CTU nach der etablierten Methode in einer sehr guten Ausbeute von 85 %. Zur selektiven Abspaltung der Boc-Gruppe auf dem Guanidin wurde 169 in Dichlormethan gelöst und auf 0 C gekühlt. Unter DC-Kontrolle wurde sukzessive Trifluoressigsäure zugegeben, bis bei 10 % Volumenanteil der Säure eine Reaktion einsetzte. Die Lösung wurde unter ständiger DC-Kontrolle bei 0 C weitergerührt, bis kein 169 mehr zu detektieren war. Dann wurde die Säure basisch abgefangen und die Reaktion aufgearbeitet. Es gelang jedoch keine Isolierung von 168, deshalb wurden die Versuche zu dessen Synthese mit 142 als Edukt unterlassen. Der Benzylester in der Seitenkette musste also nach Einführung der Guanidineinheit, jedoch vor Einführung der Fmoc-Schutzgruppe in das Molekül erfolgen. Deshalb wurde auf die bereits vorgestellte Verbindung 163 zurückgegriffen. Diese sollte nach Entschützung des Guanidins basisch zur gewünschten Verbindung 168 umgeestert werden.
139 Ergebnisse und Diskussion (a),(b) Abbildung 3.72: Geplante Synthese von 168: (a) katalytische ydrierung zur Spaltung der Cbz- Schutzgruppe mit sich anschließender (b) basischer Umesterung zum Benzylester. Die Spaltung der Cbz-Schutzgruppe vor der basischen Umesterung zum Benzylester in der Seitenkette ist aus zwei Gründen notwendig: Erstens ist der gebildete Benzylester nicht mehr zur Cbz-Schutzgruppe orthogonal, eine selektive Freisetzung des Guanidins wäre dann nicht mehr möglich. Zweitens kann das Cbz-Guanidin 73 unter den stark basisch-nucleophilen Bedingungen der Umesterung auch als Abgangsgruppe fungieren. Dieses unerwartete Verhalten von Carbamat-geschützten Guanidinen ist bei der mit Lithiumhydroxid durchgeführten Spaltung des Methylesters in 163 bereits beschrieben worden. Dies kann durch vorherige Entschützung vermieden werden, da eine nucleophile Spaltung der Amidbindung in einfachen Acylguanidinen, wenn überhaupt, dann nur unter sehr viel drastischeren Bedingungen möglich ist. Die katalytische ydrierung von 163 lieferte 167 in quantitativer Ausbeute. Die Möglichkeit einer quantitativen Abspaltung von Cbz unter Freisetzung eines Guanidiniocarbonylpyrrols wurde mit dieser Reaktion nachgewiesen und ermöglicht den umfassenden Einsatz dieser Schutzgruppe in der Synthese derartiger Systeme. 167 wurde mit einem Äquivalent Salzsäure versetzt und an der Lyophyle getrocknet. Das ydrochlorid wurde hergestellt, weil die Salze der Acylguanidine normalerweise Feststoffe und damit gut zu handhaben sind. Cl CF 3 C (a) 2 2 (b) Cl 168-TFA Abbildung 3.73: Synthese der Verbindung 168: (a) 2, Pd/C, Me, 40 C, 3 h, dann Lyophyle + 14 μm Cl, 99 %. (b) abn, Bn, 1 mbar, 12 h, reflux, 56 %. 167 wurde nun in Benzylalkohol basisch umgeestert. Die Ausbeute ist mit 56 % nur moderat, als ebenprodukt wurde das in der Seitenkette hydrolysierte Carbonsäurederivat 166 (Abbildung 3.69) isoliert. Die Bildung dieses ebenproduktes konnte trotz
140 126 Ergebnisse und Diskussion intensiver Trocknung von 167 und des Benzylalkohols nie vermieden werden. Ein Eintrag von ydroxid in die Reaktionsmischung ist allerdings auch durch eine xidschicht auf dem eingesetzten atrium möglich. Darüber hinaus ist die Trocknung von Benzylalkohol sehr aufwändig und möglicherweise lässt sich die Ausbeute steigern, indem das wesentlich leichter zu trocknende Toluol als Cosolvens und Benzylalkohol nur stöchiometrisch eingesetzt wird. Ferner sollten größere Ansätze bessere Resultate liefern, da ein minimaler Eintrag von ydroxid dann nicht so gravierende Auswirkungen auf die Ausbeute hätte. Die Verbindung 168 TFA wurde nun durch Lyophylisieren mit Salzsäure in das ydrochlorid überführt und der erhaltene Feststoff mit Fmoc-Cl 156 umgesetzt. Die Fmoc-geschützte Verbindung 165 konnte in einer guten Ausbeute von 75 % erhalten werden. Der so dargestellte, vollständig geschützte Baustein 165 wurde katalytisch hydriert und die Reaktion aufgearbeitet, als kein Edukt mehr in der Reaktionslösung vorhanden war. Die Zielverbindung 161 wurde in einer Ausbeute von 48 % erhalten. Dieses moderate Resultat erklärt sich durch Produktverluste bei der säulenchromatographischen Reinigung aufgrund der schlechten Löslichkeit von 161 in organischen Lösemitteln. Darüber hinaus ist auch die unerwartete, wenn auch langsame Spaltung von Fmoc-Carbamaten durch katalytische ydrierung literaturbekannt. [178] R 168-TFA (a) (b) 165: R = Bn 161: R = Abbildung 3.74: Synthese des Fmoc-geschützten Festphasenbausteines 161: (a) Lyophylisieren mit Cl, dann Fmoc-Cl (156), DMAP, C 2 Cl 2, DMF, RT, 2 h, 75 %. (b) 2, Pd/C, TF, Ac, 40 C, 5 h, 48 %. Auch wenn sich die Synthese des Fmoc-geschützten Festphasenbausteines 161 unerwartet schwierig gestaltete, konnte dennoch für alle drei Bausteine 160 (Dmbc), 161 (Fmoc) und 162 (Cbz) ein synthetischer Zugang entwickelt werden. Die drei Verbindungen wurden in ausreichendem Umfang dargestellt und ihr Einsatz in Festphasensynthese wird in den folgenden Kapiteln untersucht. Die bei den Versuchen zur Synthese des Fmoc-geschützten Bausteins 161 erhaltene Verbindung 169 (siehe Abbildung 3.71) war im Zusammenhang dieser Arbeit nicht Ziel führend, ist jedoch von großem synthetischen Interesse für ein anderes Gebiet. In der Entwicklung von supramolekularen Polymeren stellen Guanidiniocarbonylpyrrolcarboxylat-Zwitterionen eine interessante Ausgangsverbindung dar. Diese Zwitterionen
141 Ergebnisse und Diskussion 127 dimerisieren sehr effektiv auch in polaren Lösemitteln. Zwei über einen Spacer miteinander verknüpfte Zwitterionen sollten daher in der Lage sein, supramolekulare Polymere auszubilden. Dieser Ansatz ist Gegenstand aktueller Forschungen im Arbeitskreis Schmuck. [128] R 2 X 2 Spacer 170 X 2 2 R Abbildung 3.75: Supramolekulare Polymere auf der Basis von Guanidiniocarbonylpyrrolcarboxylat. 169 ermöglicht einen sehr effektiven Zugang zu supramolekularen Polymeren vom Typ 170. Eine selektive Spaltung des Benzylesters in der Seitenkette sollte quantitativ möglich sein. In dieser Position können dann zwei Pyrrolbausteine über einen Spacer verbunden werden. Danach können die Zwitterionen durch saure Spaltung des tert-butylesters in α-position und der Boc-Schutzgruppe auf dem Guanidin in einem Schritt freigesetzt werden. Durch den Benzylester in der Seitenkette von 169 kann der Einsatz des sehr kostenintensiven Trimethylzinnhydroxides, von dem bis zu zehn Äquivalente verwendet werden müssen, vermieden werden. Dieses Reagenz ist im Falle des Methylesters in der Seitenkette dieser Systeme jedoch zur effektiven Freisetzung der Säure erforderlich, wie die im Rahmen dieser Arbeit vorgestellten Ergebnisse zeigen. Die bisher durchgeführten Versuche zur Synthese derartiger Polymere [179] verwenden Trimethylzinnhydroxid. 169 stellt also eine deutliche Verbesserung der Synthese solcher Polymere dar Festphasensynthese 1: Der Einsatz der photospaltbaren Schutzgruppe Dmbc Vor der Verwendung des Dmbc-geschützten Guanidiniocarbonylpyrrols auf der festen Phase sollte die Reaktivität in Lösung untersucht werden. Zu diesem Zweck wurde der Methylester-geschützte Vorläufer 164 als Modellverbindung gewählt. Die Spaltbarkeit des tert-butylesters in saurer Lösung sollte experimentell bestätigt und die optimale Reaktionsbedingung und dauer gefunden werden. Zu diesem Zweck wurde 164 in einem Trifluoressigsäure-Dichlormethan-Gemisch (V TFA :V DCM = 1:2) bei Raumtemperatur gerührt. Bereits nach 30 min waren nur noch Spuren (< 2 %) des Eduktes mit der PLC nachweisbar. Die Reaktion wurde nach insgesamt 45 min unterbrochen
142 128 Ergebnisse und Diskussion und aufgearbeitet. Das erwünschte Produkt 171 konnte in quantitativer Ausbeute erhalten werden. Me (a) Me Dmbc Dmbc Abbildung 3.76: Untersuchung der Spaltbarkeit des tert-butylesters in 164: (a) TFA/C 2 Cl 2 1:2, RT, 45 min, quant. achdem also die Voraussetzungen für eine spätere Modifikation in α-position bestätigt wurden, sollte das Verhalten der photospaltbaren Schutzgruppe untersucht werden. Zu diesem Zweck wurde 164 in Methanol gelöst und unter Wasserkühlung mit einer Quecksilber-ochdrucklampe bestrahlt. Die genaue Vorgehensweise findet sich im experimentellen Teil (Abschnitt 6.7.6). tbu 164 Me Me Me h ν Me tbu 167 Me 2 Abbildung 3.77: Untersuchung der Photolyse der Modellverbindung 164 zu 167. Im ersten Versuch wurde nach der Bestrahlung das Lösemittel im Vakuum entfernt und die Reaktion aufgearbeitet. Auf diese Weise konnte das gewünschte Produkt 167 aber nicht erhalten werden. Auch der Versuch einer Fällung von 167 mit Pikrinsäure schlug fehl. Daher wurde ein umfassendes Protokoll zur Analyse der Reaktion entwickelt. Mit ilfe der RP18-PLC war es möglich, unter Verwendung eines Gradienten sowohl das Edukt 164, als auch das gewünschte Produkt 167 zu detektieren. Experimentelle Details hierzu sind ebenfalls in Abschnitt erläutert. Für eine Reaktionskontrolle der Photospaltung nach Immobilisierung auf der festen Phase war dies jedoch noch nicht ausreichend. Wenn das Pyrrol immobilisiert ist, so kann weder das Produkt, noch das Edukt mit ilfe der PLC analysiert werden, da es nach wie vor an die feste Phase gebunden ist. Ziel war daher die Detektion eines Produktes, welches sich nach erfolgreicher Photospaltung in der überstehenden Lösung befindet. In Abhängigkeit von der Frage, ob die photoinduzierte Bindungsspaltung homo- oder heterolytisch stattfindet, kann eine Vielzahl von Spaltprodukten aus dem entstehenden Benzylradikal bzw. Benzylkation entstehen.
143 Ergebnisse und Diskussion 129 Me 176 C Me Me Me Me (d) 172 R (e) (a) Me Me 154 Me R (c) Me Me (b) Me Me Me Me Me Abbildung 3.78: Einige Beispiele für mögliche Produkte der Photolyse von 172 in Methanol, die aus dem entstehenden Benzylkation (eterolyse) oder dem Benzylradikal (omolyse) gebildet werden können. Der Mechanismus dieser Photolyse wurde von Pincock et al. ausführlich diskutiert. [180] Für das Acetat (172, R = Me) konnte der Methylether 173 mit 56 % als auptprodukt der Photolyse in Methanol identifiziert werden. Dieser kann aus dem Benzylkation durch Reaktion mit Methanol und anschließender Abspaltung eines Protons gebildet werden. 173 wurde also als Vergleichssubstanz für die PLC-Analytik synthetisiert. [181] Aus der oben vorgestellten Synthese des Dmbc-Guanidins 159 stand außerdem noch der Benzylalkohol 154 zur Verfügung. Dieser könnte in Methanol durch homolytische Spaltung und anschließende Addition eines ydroxylradikals aus 172 gebildet werden und wurde als zweite Referenzsubstanz herangezogen. Diese vier Substanzen (Edukt 164, Produkt 167, 173 und 154) können in einem einzigen PL-Chromatogramm unter Verwendung eines Gradienten (Wasser/Methanol % Trifluoressigsäure) separat detektiert werden. ach Erstellung einer Eichgeraden konnten die Konzentrationen und damit die molaren Anteile der Verbindungen in Lösung direkt über das Integral der UV- Detektion erhalten werden. 164 wurde also erneut gelöst und mit einer Quecksilber- ochdrucklampe bestrahlt. In regelmäßigen Zeitabständen wurde eine Probe entnommen und auf ihre Zusammensetzung hin überprüft. Abbildung 3.79 zeigt exemplarisch das PL-Chromatogramm der Photolyse in Methanol nach 120 min. Das Edukt 164 und die Produkte 167 und 173 konnten eindeutig identifiziert und zugeordnet werden. Der Benzylalkohol 154 (τ R = 3.39 min) hingegen konnte in der Reaktionsmischung nicht detektiert werden.
144 130 Ergebnisse und Diskussion Abbildung 3.79: PL-Chromatogramm der Photolyse von 164 nach 120 min Reaktionszeit. Die Detektion bei λ = 300 nm (rot) und λ = 275 nm (blau) ist dargestellt. Die experimentellen Bedingungen sind in Abschnitt spezifiziert. Die Photospaltung wurde nun unter verschiedenen Bedingungen durchgeführt und die Zusammensetzung der Lösung analysiert. eben der Photolyse in neutralem Methanol wurde die Reaktion unter Säurezugabe (zwei Äquivalente Essigsäure) sowie unter Basenzugabe (ein Äquivalent Triethylamin) untersucht. Die Ergebnisse sind in Abbildung 3.80 zusammengefasst. In saurem und basischem Milieu ist eine maximale Ausbeute nach 40 bis 50 min erreicht. Danach nimmt die Konzentration des Produktes 167 wieder deutlich ab, die Verbindung ist unter den gegebenen Bedingungen also nicht stabil. Die besten Ausbeuten wurden in neutralem Methanol erreicht. Unter diesen Bedingungen bleibt der Anteil von 167 in Lösung nach ungefähr 120 min relativ konstant. Es konnte eine Ausbeute von 35 % erreicht werden.
145 Ergebnisse und Diskussion 131 Abbildung 3.80: Produktausbeute (167) der Photolyse in Methanol in Abhängigkeit von der Reaktionszeit. Die Reaktion wurde im neutralem (schwarz), basischem (+ 1 eq. Et 3, blau) und saurem (+ 2 eq. Ac) Methanol durchgeführt. Die moderate Produktausbeute ist recht überraschend, insbesondere bei qualitativer Betrachtung der PL-Chromatogramme. Diese zeigen nach 240 min in allen drei Fällen eine vollständige Umsetzung des Eduktes 164 an (c(164) < 5 %). Außerdem werden keine weiteren signifikanten Signale bei λ = 300 nm detektiert, eine ebenreaktion der Schutzgruppe nach dem Weg (c) in Abbildung 3.78 ist also unwahrscheinlich, da dieses Produkt auf der PLC detektierbar sein müsste. Vermutlich absorbiert 164 unter Zersetzung des eteroaromaten, so dass die Zersetzungsprodukte einer UV-Detektion nicht mehr zugänglich sind. Eine weitere mögliche Erklärung wäre auch eine Polymerisation des Eduktes, ein unlösliches Polymer würde ebenfalls nicht im PLC- Detektor zu sehen sein. ffenbar stellt also die photochemische Zersetzung des Eduktes 164 ein Problem dar. Deshalb wurde untersucht, ob eine selektive Bestrahlung der Schutzgruppe bei einer Wellenlänge, bei der das Pyrrolsystem keine oder nur eine relativ geringe Absorption aufweist, möglich ist. Zu diesem Zweck wurden qualitative UV-Spektren von verschiedenen Referenzsubstanzen aufgenommen. Vom Pyrrolring ausgehend wurde der zu entschützende Guanidinrest sukzessive eingeführt. Die am wenigsten funktionalisierte Verbindung ist dabei die Pyrrolcarbonsäure enthält bereits die Guanidiniocarbonylfunktion, aber noch keine Dmbc-Schutzgruppe. Die voll funktionalisierte Verbindung ist das Edukt der vorangegangenen Photolysereaktion, die Verbindung 164.
146 132 Ergebnisse und Diskussion 136: R = Me 167: R = tbu R 2 164: R = Me Me Abbildung 3.81: UV-Spektren der Verbindungen 136, 167 und 164 in Methanol. Der Vergleich der Spektren von 136 und 167 zeigt, dass die Einführung der Guanidingruppe zu einem deutlichen bathochromen Shift führt. Dieser ist mit der zusätzlichen Delokalisierung der π-elektronen gut zu erklären. Der Effekt wird in 164 durch die zusätzliche Carbonylfunktion in der Schutzgruppe nochmals leicht verstärkt. Eine dem 3,5-Dimethoxybenzylrest zuzuordnende zusätzliche Bande, die eine selektive Einstrahlung erlauben würde, ist im aufgenommenen Bereich jedoch nicht zu erkennen. Um eine Abspaltung der Schutzgruppe auf der festen Phase zu untersuchen, wurde die Säure 160 (= 164 mit C 2 statt C 2 Me in der Seitenkette) unter Verwendung von CTU auf Tentagel- 2 immobilisiert. Die erfolgreiche Kupplung wurde mittels MAS-MR-Spektroskopie des zuvor sorgsam gewaschenen arzes nachgewiesen. X Ph Ph Ph Ph Ph X R = X = n R Me Ph Me Abbildung 3.82: Struktur von Tengagel- 2 vor (R = ) und nach der Funktionalisierung mit 160. Tentagel-arz wurde gewählt, weil es in Wasser gute Quelleigenschaften besitzt und bereits in anderen Festphasenuntersuchungen sehr erfolgreich eingesetzt wurde. [182] Das so erhaltene Substrat wurde in Methanol suspendiert und nach dem bereits erläuterten Protokoll mit einer Quecksilber-ochdrucklampe unter Rühren bestrahlt. In der überstehenden Lösung konnte mittels PLC jedoch kein UV-aktives Spaltprodukt
147 Ergebnisse und Diskussion 133 nachgewiesen werden. Möglicherweise reicht die Absorption des Polystyrol-Anteils im Tentagel aus, um eine Photospaltung zu verhindern. Auch eine gehinderte Diffusion der entstehenden Zwischenprodukte (Benzylkation und Carboxylat) kommt als Erklärung in Frage, da in diesem Fall nach der Bindungsspaltung die Rückreaktion zum Ausgangsprodukt begünstigt ist. Aufgrund dieser Ergebnisse und der nur moderaten Ausbeuten der Spaltung in Lösung wurden keine weiteren Experimente zum Einsatz der Dmbc-geschützten Verbindung 160 in der Festphasensynthese unternommen. Dennoch stellt die für Guanidine völlig neue Dmbc-Schutzgruppe eine ption für komplexe Synthesen Guanidin-haltiger Verbindungen dar. Insbesondere für den Fall der Abwesenheit von weiteren, möglicherweise instabilen Chromophoren kommt die Verwendung von Dmbc auch für Guanidine in Frage. Es konnte nachgewiesen werden, dass die Gruppe bei der Photospaltung die gewünschte Verbindung freisetzt. Damit ist eine Entschützung von kombinatorisch hergestellten Bibliotheken nach Abspaltung der Produkte vom polymeren Träger möglich. Ferner sind deutliche Steigerungen der Ausbeuten denkbar, falls das Edukt unter UV-Bestrahlung eine geringere Tendenz zur Zersetzung als das an dieser Stelle verwendete System aufweist Festphasensynthese 2: Der Einsatz der Fmoc-Schutzgruppe Vor dem Einsatz des Fmoc-geschützten Derivates auf der festen Phase wurde die Stabilität der Schutzgruppe untersucht. Zu diesem Zweck ist ein zu oben analoges PLC-Protokoll (Details in Abschnitt ) zur Reaktionskontrolle eingesetzt worden. Deshalb wurde die Verbindung 177 als Modellverbindung dargestellt. Diese liefert im Falle einer erfolgreichen Abspaltung der Fmoc-Schutzgruppe mit 167 dasselbe Produkt wie die oben beschriebene Photospaltung der Dmbc-Schutzgruppe. Me (a) Me 2 (b) Abbildung 3.83: Synthese der Modellverbindung 177 und Spaltung der Fmoc-Schutzgruppe: (a) Fmoc-Cl (156), C 2 Cl 2, K 2 C 3, RT, 15 h, 23 %. (b) Piperidin/DMF 1:4, 20 min, RT, 91%. Zunächst wurde die Stabilität von Verbindung 177 gegenüber tertiären Aminobasen untersucht. Exemplarisch wurden DMAP, DIEA und MM als Basen gewählt und zu einer Lösung von 177 in Dichlormethan/DMF (V/V = 4:1) gegeben. Die Lösungen wurden nach 30 min mittels PLC auf ihren Gehalt an 177 untersucht und innerhalb der
148 134 Ergebnisse und Diskussion angenommenen Fehlertoleranz dieser Methode (± 3 %) konnte keine Abnahme der Anfangskonzentration des Eduktes beobachtet werden. Zur Spaltung der Fmoc-Schutzgruppe in 177 wurde die Substanz in 20 % Piperidin in DMF gelöst und 20 min bei Raumtemperatur gerührt. Die Lösemittel wurden nach mehrmaliger Wasserzugabe azeotrop entfernt und der zurückbleibende Feststoff in 2 ml Methanol gelöst. Die Bestimmung der Konzentration dieser Lösung über das PLC-Integral ergab eine sehr gute Ausbeute von 91 % an 167. Um die Verwendbarkeit des Fmoc-geschützten Guanidiniocarbonylpyrrols in der Festphasensynthese zu verifizieren, sollte der Baustein 161 immobilisiert und in 2-Position weiter funktionalisiert werden. Zu diesem Zweck wurde die Synthese der Modellverbindung 178 aus 161 an der festen Phase angestrebt tbu Fmoc 2 Val Phe Gly 2 Abbildung 3.84: Synthese der Modellverbindung 178 aus dem Fmoc-geschützten Baustein 161. Als erste Festphase wurde das Rink-Amid-arz getestet. [183] Von diesem arz kann das Produkt durch Umsetzung mit 95 % Trifluoressigsäure in Dichlormethan abgespalten werden. Eine Spaltung des tert-butylesters in α-position des Pyrrols ist aber schon mit 35 % Trifluoressigsäure möglich. 161 wurde also unter Verwendung von DIC an Rink- Amid-arz gekuppelt. Schon beim Versuch der Spaltung des tert-butylesters färbte sich das arz tief rot, was als Zeichen für eine Abspaltung des Produktes charakteristisch ist. Eine beginnende Abspaltung wurde von Wich ebenfalls schon bei Säureanteilen von deutlich weniger als 95 % Trifluoressigsäure beschrieben, ist für die in diesem Fall verwendeten Säureanteile von nur 35 % aber dennoch überraschend. [184] Die Abspaltung vom polymeren Träger mit 95 % Trifluoressigsäure nach vollständiger Durchführung eines zu C tert-butylester-kupplungsprotokolls (entsprechend Abschnitt ) lieferte dann auch nur noch Spuren eines Feststoffes. 178 konnte nicht isoliert werden. Da bei der Verwendung des Rink-Amides offenbar die partielle Abspaltung vom arz schon während der Synthese stattfindet, wurde ein arz verwendet, welches eine höhere Stabilität gegen Säuren aufweist. Ein solches arz ist das MBA-arz. Zur Abspaltung der aufgebrachten Substanz muss eine 10 %ige Trifluormethansulfonsäure-Lösung in Trifluoressigsäure verwendet werden. [122] 161 wurde an MBA-arz gebunden und
149 Ergebnisse und Diskussion 135 nach einem Standardprotokoll in einer inversen ( zu C) Festphasensynthese nacheinander die drei Aminosäuren Glycin, Phenylalanin (als tert-butylester) und schließlich Valinamid gebunden tbu Fmoc (a) - (e) 178-Cl Abbildung 3.85: Synthese von 178 aus 161: (a) Kupplung der Carbonsäure 161 an MBA-arz 179 mit PyBP/DMAP, (b) tert-butylesterspaltung mit TFA/C 2 Cl 2, (c) Kupplung eines Aminosäure-tert-Butylesters mit PyBP/DMAP, Wiederholung der Schritte (b) und (c), (d) Spaltung der Fmoc-Schutzgruppe, (e) Abspaltung des Produktes von der festen Phase mit TFMSA/TFA 1:9, MPLC-Reinigung und Umsalzen an der Lyophyle, 10 %. ach dem Kuppeln der letzten Aminosäure sollte noch vor der Abspaltung des Produktes die Fmoc-Schutzgruppe vom Guanidin entfernt werden. Dies geschah mit 20 % Piperidin in DMF. Über die Bestimmung der UV-Absorption des Fmoc-Piperidin- Adduktes in Lösung können Rückschlüsse über die Beladungsdichte mit Fmoc auf der festen Phase gezogen werden. [182] Leider konnte keine UV-Absorption der Abspaltlösung detektiert werden. Dafür sind zwei Erklärungen denkbar. Entweder die Kupplung des Pyrrolbausteins an die feste Phase hat nicht funktioniert, oder die Schutzgruppe wurde schon im Verlauf der Synthese nach und nach abgespalten. Die Stabilität der Fmoc-Gruppe wurde im nächsten Versuch untersucht. ach Abspaltung des Produktes dieses Versuches vom MBA-arz und anschließender MPLC- Reinigung wurde 178 Cl in einer Ausbeute von 10 % isoliert. Um die Stabilität der Fmoc-Gruppe auf der festen Phase zu untersuchen, wurde 161 erneut immobilisiert. Jedoch wurde als arz für diesen Versuch Tentagel- gewählt. Dies geschah aus zwei Gründen: Erstens trägt dieses arz auf der berfläche keine Amine sondern ydroxyfunktionen. Diese sind zwar weniger ucleophil, aber auch weniger basisch, weshalb die Gefahr der Induzierung einer Fmoc-Spaltung geringer ist. Zweitens ist Tentagel bereits für verschiedene Festphasenuntersuchungen erfolgreich getestet worden. Die Etablierung eines Protokolls zur Immobilisierung von Guanidiniocarbonylpyrrolen auf Tentagel ist daher von Interesse. 161 wurde also mit DIC unter Zugabe von DMAP aktiviert und mit Tentagel umgesetzt. Zur Kontrolle der Kupplung wurde ein 1 -MAS-MR-Spektrum vom arz aufgenommen. Um zu verhindern, dass der nicht immobilisierte Baustein 161 noch in der Mischung vorliegt,
150 136 Ergebnisse und Diskussion wurde das arz umfangreichen Waschzyklen, u. a. mit DMF und DMS unterzogen. Abschließend wurde mit deuterierten Lösemitteln (CDCl 3, [D 4 ]MeD, D 2, [D 6 ]DMS) gewaschen, um zu gewährleisten, dass im MR tatsächlich nur immobilisierte Komponenten und nicht etwa anhaftende Lösemittelreste zu erkennen sind. Abbildung 3.86: Ausschnitt des 400 Mz- 1 -MAS-MR-Spektrums von Tentagel- vor (blau) und nach (rot) der Funktionalisierung mit 161. Einige dem Pyrrolbaustein zuzuordnende Signale sind deutlich zu erkennen. Im MR-Spektrum sind einige Signale zu erkennen, die der immobilisierten Verbindung 161 zuzuordnen sind. Die erfolgreiche Kupplung des Pyrrolbausteins an die feste Phase wurde damit zum wiederholten Male bestätigt. Allerdings sind keine Signale im gesamten Spektrum detektierbar, die der Fmoc-Schutzgruppe zugeordnet werden können. Dies bestätigte den Verdacht, dass diese bereits unter den verwendeten Kupplungsbedingungen abgespalten wurde. Um die Fmoc-Gruppe (falls diese noch vorhanden sein sollte) nachzuweisen, wurde das Tentagel direkt nach der Immobilisierung von 161 und gründlichem Waschen für 30 min in 20 % Piperidin in DMF geschüttelt. Allerdings konnte in der überstehenden Lösung im Vergleich zur Blindprobe keinerlei erhöhte UV-Absorption nachgewiesen werden. Auch dieses Ergebnis deutet darauf hin, dass die Fmoc-Gruppe tatsächlich schon während der Kupplung gespalten wurde. Fmoc-Guanidin ist im Fall von 161 und unter den in dieser Arbeit gewählten basischen Kupplungsbedingungen also offenbar zu instabil. Dennoch konnte mit der Synthese des Modellpeptides 178 die grundsätzliche Verwendbarkeit eines solchen Pyrrolbausteines in der Festphasensynthese gezeigt werden. Trotzdem ist noch ptimierungsarbeit,
151 Ergebnisse und Diskussion 137 insbesondere hinsichtlich der Untersuchung der Stabilität gegenüber Aminobasen in verschiedenen Lösemitteln zu leisten. Anhand der Modellverbindung 177 konnte aber gezeigt werden, dass die Fmoc-Schutzgruppe in einer sehr guten Ausbeute von 91 % die gewünschte Zielverbindung 167 liefert. Diese Spaltung verläuft unter relativ milden basischen Bedingungen. Daher stellt auch die Fmoc-Schutzgruppe für die Verwendung in der Synthese, beispielsweise für die weitere Funktionalisierung am Guanidin über die Triflatroute [103] eine interessante ption dar Festphasensynthese 3: Der Einsatz der Cbz-Schutzgruppe Für die Cbz-Schutzgruppe auf dem Guanidin war aus den bisher vorgestellten Ergebnissen (vgl. Abschnitt 3.3.3) bereits die gute Spaltbarkeit und eine ausreichende Stabilität unter den gewählten Kupplungsbedingungen bestätigt worden. Ferner steht die Cbz-Schutzgruppe nicht im Verdacht, unter den Bedingungen der Kupplung oder der einfachen tert-butylesterspaltung in max. 50 % Trifluoressigsäure instabil zu sein. Deshalb wurde ohne weitere Voruntersuchungen die Festphasensynthese der Modellverbindung 178 aus dem Cbz-geschützten Vorläufer 162 versucht tbu Cbz 2 Val Phe Gly 2 Abbildung 3.87: Synthese der Modellverbindung 178 aus dem Cbz-geschützten Baustein 162. Bisher wurde die Cbz-Schutzgruppe in 162 mit ilfe der katalytischen ydrierung gespalten. Die heterogene Katalyse ist aber für die Festphasensynthese ungeeignet, u. a. weil der Katalysator nicht durch einfaches Waschen entfernt werden kann und die Zugänglichkeit der immobilisierten Edukte zum Katalysator nicht gewährleistet ist. Dies ist aber kein grundsätzliches Problem. Zum einen kann die Cbz-Schutzgruppe auch unter stark sauren Bedingungen, beispielsweise unter Verwendung von Br gespalten werden. [172] Falls dies am polymeren Träger nicht gelingen sollte, ist außerdem eine Abspaltung des geschützten Produktes von der festen Phase denkbar. Die Schutzgruppe könnte dann in Lösung durch katalytische ydrierung gespalten werden. 162 wurde also auf MBA-arz immobilisiert und 178 nach einem zu C tert-butylester- Standardprotokoll (siehe Abschnitt ) synthetisiert. Die Abspaltung des Produktes vom polymeren Träger erfolgte mit 10 % Trifluormethansulfonsäure in Trifluoressigsäure. 178 konnte in einer Gesamtausbeute von 31 % nach MPLC-
152 138 Ergebnisse und Diskussion Reinigung isoliert werden. Die Abspaltung der Cbz-Schutzgruppe war im stark sauren Medium also bereits erfolgt, ein Cbz-geschütztes Derivat konnte nicht isoliert werden tbu Cbz (a) - (d) 178-Cl Abbildung 3.88: Synthese von 178 aus 162: (a) Kupplung der Carbonsäure 162 an MBA-arz 179 mit PyBP/DMAP, (b) tert-butylesterspaltung mit TFA/C 2 Cl 2 (c) Kupplung eines Aminosäure-tert-Butylesters, Wiederholung der Schritte (b) und (c), (d) Abspaltung des Produktes vom polymeren Träger mit TFMSA/TFA 1:9, MPLC-Reinigung und Umsalzen an der Lyophyle, 31 %. bwohl noch durchaus ptimierungspotential vorhanden ist, kann eine Ausbeute von 31 % zur Bestätigung der grundsätzlichen Verwendbarkeit von 162 in der Festphasensynthese als gut betrachtet werden. Beispielsweise ist nichts über die Stabilität der Verbindung 178 unter Einfluss von Trifluormethansulfonsäure bekannt. Durch eine Reinigung des aus der Abspaltung erhaltenen Rohproduktes wurden 13 % der Masse als Verunreinigung abgetrennt. 178 lag also schon vor der Chromatographie in einer Reinheit von 87 % vor. Dies spricht eher für eine unvollständige Abspaltung vom Träger als Ursache für die mäßige Gesamtausbeute. Jedenfalls scheinen ebenprodukte, die sich etwa aus dem unvollständigen Einbau einer oder mehrerer Aminosäuren bzw. aus der Zersetzung von 178 im sauren Medium ableiten, nicht in signifikantem Maße zu entstehen. Es konnte also mit 162 die dritte Schutzgruppe für derartige Guanidiniocarbonylpyrrole erfolgreich etabliert werden. Im vorliegenden Abschnitt konnten drei völlig neuartige Guanidiniocarbonylpyrrolverbindungen erfolgreich synthetisiert und charakterisiert werden. Die Cbz- Schutzgruppe ist für Guanidine zwar bereits beschrieben, wurde aber noch nicht für die Synthese von Guanidiniocarbonylpyrrolen verwendet. Die Fmoc-Gruppe ist zwar auch für Guanidine literaturbekannt. Sie wurde aber bisher nur zur Schützung peripherer Molekülteile wie z. B. der Arginin-Seitenkette verwendet. Im Gegensatz dazu wurde sie in der vorliegenden Arbeit zentral zur Synthese des Guanidin-haltigen Bindungsmotives von Schmuck eingesetzt. Auch das einfach geschützte Fmoc-Guanidin 151 stellt eine neue Verbindung dar. Die dritte hier vorgestellte Schutzgruppe Dmbc ist für Guanidinverbindungen völlig neu. bwohl für alle drei Systeme noch ptimierungsbedarf besteht, konnte im Rahmen dieser Arbeit die allgemeine Anwendbarkeit der drei Schutzgruppen in der Synthese auch für
153 Ergebnisse und Diskussion 139 Guanidiniocarbonylpyrrolsysteme bestätigt werden. Für die beiden Schutzgruppen Fmoc und Cbz wurde darüber hinaus die grundsätzliche Verwendbarkeit in der Festphasensynthese bestätigt. Alle bisher bekannten immobilisierten Systeme unter Verwendung des Bindungsmotives von Schmuck erfordern einen freien -Terminus. An diesen kann erst nach kombinatorischer Variation das Guanidiniocarbonylpyrrol aufgebracht wird. Eine solche Methode ist aber für die ptimierung eines internen Spacer, der zwei Bindungsmotive verbindet, ungeeignet. Die hier vorgestellten Systeme erlauben die ptimierung eines internen Spacers. P Me P Me interner Spacer X 2 2 Abbildung 3.89: ach Immobilisierung der Pyrroleinheit kann der interne Spacer kombinatorisch variiert werden. Danach kann ein weiteres Bindungsmotiv, in diesem Beispiel ein benzylisches Bisphosphonat nach Schrader, kovalent gebunden werden. Ein zweites Bindungsmotiv kann auf diese Weise mit dem Guanidiniocarbonylpyrrol von Schmuck kombiniert werden und noch vor der Abspaltung vom polymeren Träger mit dem internen Spacer verknüpft werden. Die einzige Anforderung, die an ein solches zusätzliches Bindungsmotiv gestellt wird, ist eine Position zur kovalenten Verknüpfung mit dem freien C-Terminus des Spacers. ach Entschützung des Guanidiniocarbonylpyrrols kann eine auf diese Weise hergestellte kombinatorische Bibliothek auch an der festen Phase auf ihre Bindungseigenschaften gegenüber verschiedenen Substraten hin untersucht werden. Die ptimierung eines Spacers, wie er in Abschnitt 3.2 vorgestellt wurde, wurde damit grundsätzlich ermöglicht.
154 4 Zusammenfassung und Ausblick Im Rahmen der vorliegenden Arbeit wurden zwei sequenzselektive Rezeptoren (1 und 2) für die C-terminale D-Ala-D-Ala-Sequenz dargestellt und umfassend charakterisiert. Beide beruhen auf demselben Bindungsmodus. Zur Bindung des Carboxylates wurde ein Guanidiniocarbonylpyrrol verwendet, während die Methyl-Seitenkette des Alanins von einer Cyclotribenzylenhalbschale hydrophob koordiniert wird. Abbildung 4.1: Der künstliche Rezeptor 1 für den D-Ala-D-Ala-C-Terminus und das Modellsubstrat Ac-D-Ala-D-Ala- 26. Rechts ist der berechnete Komplex aus beiden dargestellt. Die Bindungsstudien mit dem Rezeptor 1 wurden mit ilfe der UV- und der Fluoreszenz-Spektroskopie unter Verwendung des Substrates Ac-D-Ala-D-Ala- 26 als Modellsubstanz für den D-Ala-D-Ala-C-Terminus durchgeführt. Für den Komplex aus 1 und 26 wurde in Wasser (Bis-Tris-Puffer, 10 % DMS, p = 6.2) eine sehr hohe Bindungskonstante von K a = M -1 festgestellt. Damit ist dieser Komplex einer der stabilsten aller bisher bekannten Komplexe aus einfachen ligopeptiden und künstlichen Rezeptoren in Wasser. Zur Untersuchung der Substratselektivität wurden verschiedene Derivate von 26 hergestellt und ihre Affinität zum Rezeptor 1 bestimmt.
155 Zusammenfassung und Ausblick 141 Ac-D-Ala-D-Lac- 27 Ac-D-Ala-D-Ala- 26 R 1 R 2 R 1 und/oder R 2, ipr Abbildung 4.2: Derivate von 26 zur Untersuchung der Substratselektivität von 1. Es stellte sich heraus, dass sowohl eine zu kleine (R =, Glycin), als auch eine sterisch zu anspruchsvolle (R = ipr, Valin) Seitenkette zu einer deutlich schwächeren Bindung im Komplex mit 1 führen. Das Depsipeptid Ac-D-Ala-D-Lac- 27 wird etwas schlechter als 26, aber aufgrund seiner zu 26 isostrukturellen Seitenketten deutlich besser als die anderen Dipeptide gebunden. Eine Enantioselektivität von 1 konnte aber nicht festgestellt werden. Das Enantiomer Ac-Ala-Ala- ent-26 wird im Rahmen der Fehlertoleranz der Methode (K a ± 25 %) ähnlich gut gebunden. Außerdem konnte keine Diskriminierung der Positionen in denen sich das Alanin im Dipeptid befindet, erreicht werden. Für diese beiden Beobachtungen ist offenbar die hohe Flexibilität der Seitenkette von 1 verantwortlich R 1 X R 2 R 1,R 2 =, Me, ipr X =, Abbildung 4.3: Bindungskonstanten (in logarithmischer Auftragung) des Rezeptors 1 mit verschiedenen -acylierten Peptiden in Wasser. Um eine Untersuchung der Komplexstruktur in Wasser mit ilfe der MR- Spektroskopie zu ermöglichen, wurde mit dem Ziel der Erhöhung der Löslichkeit das Derivat 2 synthetisiert. Dieser Rezeptor ist in 3- und 4-Position des Pyrrols mit Löslichkeits-vermittelnden Triethylenglykolresten substituiert.
156 142 Zusammenfassung und Ausblick 71 TBS Bn TBS 79 Boc Cl Cl Abbildung 4.4: Synthese des substituierten Rezeptors 2 aus dem Pyrrolbaustein 79. Aufgrund von im Verlauf der Synthese von 2 auftretenden Problemen mit der Reinigung der Substanzen wurde zunächst ein synthetischer Zugang zum Pyrrolbaustein 79 entwickelt. Dieser konnte aus dem literaturbekannten Dibromid 71 in fünf Stufen dargestellt werden. Die intermediäre Schützung der Triethylenglykolketten mit TBS führte dabei zu einer deutlich vereinfachten Isolierung der Produkte. TEG = 72: R 1 = Et R 2 = tbu 70 % tbu Br 71 Br Et 64 % R 1 -TEG TEG- R 2 84: R 1 = Bn R 2 = tbu 40 % 86: R 1 = Bn R 2 = -TEG TEG- TBS-TEG TEG-TBS 45 % 67 % Boc Bn 88 Bn 79 Boc Abbildung 4.5: Synthese eines vielseitig einsetzbaren und voll geschützten Guanidiniocarbonylpyrrolbausteins 79. Der Benzylester in 79 wurde unter Freisetzung der α-pyrrolcarbonsäure quantitativ gespalten und weiter zum Rezeptor 2 umgesetzt. Leider zeigte auch diese Verbindung keine ausreichende Löslichkeit in Wasser, um Untersuchungen zur Komplexstruktur mit ilfe der MR-Spektroskopie durchzuführen. Der Rezeptor bildete im millimolaren
157 Zusammenfassung und Ausblick 143 Bereich mit Wasser ein Gel (siehe Abbildung 4.6 links). In UV- und Fluoreszenz- Bindungsstudien konnte für den Komplex aus 2 und 26 eine Bindungskonstante von K a = M -1 in gepuffertem Wasser festgestellt werden. Diese im Vergleich zu 1 leicht verringerte Bindungskonstante ist mit der Vorzugskonformation von 2 in wässriger Lösung erklärbar. Außerdem war eine Beobachtung des Komplexes aus dem Rezeptor 2 und Ac-D-Ala-D-Ala- 26 in der Gasphase mit ESI-MS-Experimenten möglich. Abbildung 4.6: 2 bildete mit Wasser im millimolaren Konzentrationsbereich ein Gel (links). Im ESI- MS-Spektrum konnte aus einer wässrigen Lösung von 2 und 26 (1:1) ein deutliches Komplexsignal detektiert werden (rechts). Durch die Synthese und Untersuchung der beiden Verbindungen 1 und 2 konnte nachgewiesen werden, dass ein computergestützes de novo Design derartiger künstlicher Rezeptoren prinzipiell möglich ist. In einem weiteren Teilprojekt der Arbeit wurde ein künstlicher Rezeptor für die interne Peptidsequenz Arg-Gly-Asp (RGD) entwickelt. Zur Synthese dieses Rezeptors wurden zwei Bindungsstellen für die funktionellen Seitenketten des Peptides über einen geeigneten Spacer verbunden. Als Bindungsmotiv für das Alkylguanidin in der Seitenkette des Arginins wurde ein benzylisches Bisphosphonat nach Schrader verwendet. Zur Koordinierung des Carboxylates in der Seitenkette des Aspartats wurde das Guanidiniocarbonylpyrrol nach Schmuck herangezogen. In Kooperation mit dem Arbeitskreis Schrader (Universität Marburg) wurden vier Rezeptoren mit unterschiedlich flexiblen Spacern dargestellt. [50] Es stellte sich heraus, dass in den Verbindungen 99, 100 und 101 der Spacer so flexibel ist, dass eine intramolekulare Selbstassoziation stattfindet. Dabei werden die xo-anionen des
158 144 Zusammenfassung und Ausblick Bisphosphonates von der Guanidiniocarbonylpyrroleinheit koordiniert. Darüber hinaus ist zumindest bei 101 eine intermolekulare Selbstassoziation möglich. Diese beiden Effekte führen dazu, dass die RGD-Sequenz nur mit Assoziationskonstanten von K a < 400 M -1 in gepuffertem Wasser gebunden wird. Bindung von Alkylguanidinen P Me P Me Spacer 2 2 Bindung von Carboxylaten Me Zunahme der Flexibilität Abbildung 4.7: Übersicht über die unter Verknüpfung der beiden Bindungsmotive von Schrader und Schmuck dargestellten Rezeptoren für die RGD-Sequenz. Der aromatische Spacer im Rezeptor 3 ist hingegen ausreichend rigide, um eine intramolekulare Selbstassoziation zu verhindern. Dieser Rezeptor ist in der Lage, das RGD-Modellpeptid Ac-RGD in gepuffertem Wasser mit K a 3000 M -1 binden. Die Bindungsstudien deuten darauf hin, dass die Komplexbildung auf einer Koordinierung der funktionellen Seitenketten im RGD-Peptid durch 3 beruht. So wird beispielsweise das Tripeptid Ac-Gly-Gly-Gly- 38 nicht koordiniert. Auf diese Weise konnte bestätigt werden, dass eine Kombination der beiden Bindungsmotive von Schmuck und Schrader zum Entwurf eines künstlichen Rezeptors für die RGD-Sequenz möglich ist. zu
159 Zusammenfassung und Ausblick 145 Abbildung 4.8: Berechnete Struktur des Komplexes aus dem 3 und Ac-RGD (MacroModel 8.0, Amber*, 2, Schritte). Um eine weitere ptimierung des Spacers z. B. in einem kombinatorischen Ansatz zu ermöglichen, wurde in einem dritten Teilprojekt der vorliegenden Arbeit ein Festphasenprotokoll entwickelt. Zu diesem Zweck wurde das Bindungsmotiv von Schmuck in β-position des Pyrrols kovalent an einen polymeren Träger gebunden. ach Immobilisierung kann das Pyrrol dann in α-position u. a. durch kombinatorische Variation weiter funktionalisiert werden. P Me P Me interner Spacer X 2 2 Abbildung 4.9: Festphasenprotokoll zur ptimierung des internen Spacers. Zur Etablierung dieser Methode wurden geschützte Guanidiniocarbonylpyrrolverbindungen mit zueinander orthogonal spaltbaren Schutzgruppen synthetisiert. Zu diesem Zweck wurden die Dmbc- (160), die Fmoc- (161) und die Cbz- (162) Schutzgruppe untersucht.
160 146 Zusammenfassung und Ausblick Me 160: R = tbu 136 Me tbu 162: R = R 161: R = Me Abbildung 4.10: Im Rahmen dieser Arbeit synthetisierte Pyrrolverbindungen 160, 161 und 162 zur Immobilisierung an der festen Phase. Der zentrale Vorläufer dieser Verbindungen ist der Pyrrolbaustein 136. Um die benötigten Verbindungen zu synthetisieren, wurden umfangreiche Studien zur Synthese von Pyrroltricarboxylaten des Typs 136 durchgeführt. Die Synthese von 136 konnte im Rahmen dieser Arbeit optimiert werden. Die Verbindung kann nun in drei Schritten mit einer Gesamtausbeute von 14 % aus kommerziell erhältlichen Edukten dargestellt werden. Für die Synthese von 136 wurde keine Säulenchromatographie benötigt und das Produkt konnte in kristalliner Form und einem sehr hohen Reinheitsgrad erhalten werden. Ausgehend von 136 wurden die drei Verbindungen 160, 161 und 162 synthetisiert. Im Rahmen der Synthese von Guanidiniocarbonylpyrrolen sind alle drei Schutzgruppen neuartig. Die Dmbc-Schutzgruppe (160) ist durch Photolyse spaltbar. Ihre Verwendbarkeit für die Synthese von Guanidiniocarbonylverbindungen wurde im Rahmen dieser Arbeit bestätigt. Zur Analyse des Reaktionsverlaufes wurde ein umfassendes PLC-Protokoll entwickelt. Auf diese Weise konnte eine Ausbeute von 35 % für die Photospaltung nachgewiesen werden. Für die moderaten Ausbeuten ist eine offenbar nur mäßige Stabilität der Pyrrolsysteme unter Bestrahlung mit einer Quecksilber-ochdrucklampe, die für die Photolyse verwendet wurde, verantwortlich. Eine Photolyse der immobilisierten Dmbc- Verbindung konnte nicht nachgewiesen werden. Wahrscheinlich wird die UV-Strahlung durch das verwendete Polystyrol-basierte arz absorbiert. Für die Cbz-geschützte Verbindung 162 und die Fmoc-geschützte Verbindung 160 konnte eine prinzipielle Verwendbarkeit in der Festphasensynthese nachgewiesen werden. Zu diesem Zweck wurde jeweils das Modellpeptid 178 an einem polymeren Träger synthetisiert.
161 Zusammenfassung und Ausblick : R = Fmoc 162: R = Cbz tbu R 2 Val Phe Gly 2 Abbildung 4.11: Aus den beiden Verbindungen 161 und 162 konnte 178 unter Verwendung eines Festphasenprotokolls an MBA-arz synthetisiert werden. Die Synthese von 178 wurde mit einem tert-butylester-standardprotokoll an MBA- arz durchgeführt. Unter Verwendung der Cbz-geschützten Verbindung 161 wurde 178 in einer Ausbeute von 10 % synthetisiert. Aus 162 konnte das Modellpeptid 178 in einer Ausbeute von 31 % und einer Reinheit von 87 % dargestellt werden. Für beide Systeme besteht zwar noch ptimierungspotential, die generelle Anwendbarkeit konnte jedoch im Rahmen der vorliegenden Arbeit bewiesen werden. eben der erfolgreichen Synthese von sequenzselektiven Peptidrezeptoren für den D-Ala-D-Ala-C-Terminus und die interne RGD-Sequenz konnte im Rahmen der vorliegenden Arbeit die Immobilisierung des Guanidiniocarbonylpyrrolbausteins etabliert werden. Diese Ergebnisse eröffnen die Möglichkeit einer weiteren ptimierung von Rezeptoren, insbesondere unter Verwendung einer Kombination des Bindungsmotives von Schmuck mit weiteren Bindungsstellen für andere funktionelle Gruppen. Außerdem ist durch die Immobilisierung nun erstmals der Einsatz der Guanidiniocarbonylpyrrole in der Chromatographie möglich. Denkbar wären mit diesem Baustein funktionalisierte stationäre Phasen zur Trennung von xo-anionhaltigen Verbindungen. Beispielsweise könnte die Reinigung und Isolierung von posttranslational phosphorylierten Proteinen auf diese Weise deutlich vereinfacht werden. Schon während der Erstellung dieser Arbeit wurden die Ergebnisse im Rahmen weiterer Forschungen im Arbeitskreis Schmuck eingesetzt. Von Interesse ist dabei u. a. der Triethylenglykol-substituierte Baustein 79, der zur Erhöhung der Löslichkeit verschiedener Guanidiniocarbonylpyrrol-haltigen Rezeptoren eingesetzt wurde. [60] Außerdem wurden basierend auf den in Abbildung 4.10 vorgestellten Verbindungen supramolekulare Polymere, [179] potentielle Membrantransporter [185] sowie ein on-bead Assay für organische Katalysatoren [186] entwickelt. So konnte neben den grundsätzlichen Erkenntnissen zur Entwicklung von künstlichen Rezeptoren in der vorliegenden Arbeit besonders in synthetischer und methodischer insicht eine umfassende Grundlage für weitere Forschungsarbeiten auf dem Gebiet der supramolekularen Chemie geschaffen werden.
162 5 Summary and utlook The present thesis consists of three parts. The first one focuses on the development of artificial receptors for the D-Ala-D-Ala-C-terminus. Two receptors have been synthesized and characterized comprehensively. For substrate binding the guanidiniocarbonyl pyrrole binding motif for coordination of carboxylates has been combined with the bowl shaped cyclotribenzylene cavity for hydrophobic binding of the methyl side chain of alanine. Figure 5.1: The artificial receptor 1 and Ac-D-Ala-D-Ala- 26 as a model for the C-terminus. Furthermore the calculated complex structure is plotted. UV and fluorescence binding studies have been performed for the receptor 1 using Ac-D-Ala-D-Ala- 26 as a substrate. The binding constant for the complex of 1 and 26 has been determined in water (bis-tris buffer, 10 % DMS, p = 6.2) as K a = M -1. This complex is one of the most stable aggregates of artificial receptors and oligopeptides described in literature. To investigate the substrate selectivity of 1 derivatives of 26 have been prepared and investigated for their affinity to 1.
163 Summary and utlook 149 Ac-D-Ala-D-Lac- 27 Ac-D-Ala-D-Ala- 26 R 1 R 2 R 1 and/or R 2, ipr Figure 5.2: Derivatives of 26 for investigation of the selectivity of 1. The data show that for too small (R =, glycine) as well as for too bulky (R = ipr, valine) residues the complex stability decreases significantly. The depsipeptide Ac-D-Ala-D-Lac- 27 is bound slightly less efficient than 26. owever due to its isostructural substitution pattern in the side chain, it is still bound more effectively than other dipeptides with different side chains. o enantioselectivity of 1 could be observed. Ac-Ala-Ala- ent-26 is bound as well as 26 within the estimated error limit of this method (K a ± 25 %). Furthermore no discrimination of the position of the targeted side chain was observed, most likely caused by the high degree of flexibility of the cyclotribenylene moiety in R 1 X R 2 R 1,R 2 =, Me, ipr X =, Figure 5.3: Association constants (plotted logarithmically) of receptor 1 and various - acylated peptides in water. To investigate the structure of the complex in water by means of MR spectroscopy the water solubility of the receptor had to be increased. For this reason the substituted derivative 2 was synthesized. With triethylene glycol chains in 3 and 4 position of the pyrrole, the receptor 2 was expected to be soluble in water.
164 150 Summary and utlook 71 TBS Bn TBS 79 Boc Cl Cl Figure 5.4: Synthesis of the substituted receptor 2 from the building block 79. The protected building block 79 was a key intermediate in this synthesis. A synthetic approach to 79 in five steps from the known dibromide 71 has been established. The intermediate protection of the triethylene glycol side chains allows for a much easier isolation of the compounds. TEG = 72: R 1 = Et R 2 = tbu 70 % tbu Br 71 Br Et 64 % R 1 -TEG TEG- R 2 84: R 1 = Bn R 2 = tbu 40 % 86: R 1 = Bn R 2 = -TEG TEG- TBS-TEG TEG-TBS 45 % 67 % Boc Bn 88 Bn 79 Boc Figure 5.5: Synthesis of the versatile building block 79. The benzyl ester in 79 can be cleaved quantitatively for further reaction at this position as in the synthesis of 2. Unfortunately 2 neither exhibited a sufficient solubility for complex investigation by MR spectroscopy in water. The receptor showed gelation in a millimolar concentration range in water (see figure 5.6). The association constant of 2 with 26 was determined by means of UV and fluorescence titration in buffered water to K a = M -1. This slightly lower association constant (compared to 1) can be
165 Summary and utlook 151 explained by the conformation of 2 in water which was calculated theoretically. Furthermore investigation of the complex has been performed by means of ESI-MS. Figure 5.6: 2 exhibits gelation at a millimolar concentration range in water. The ESI-MS of an aqueous solution of 2 and 26 (1:1) showed an intense signal for the complex. Within the present work the proposed complexation behavior of the de novo designed receptors 1 and 2 has been confirmed indicating that this method is a feasible approach to new receptors with predictable selectivity. In another part of the work an artificial receptor for the internal peptide sequence Arg- Gly-Asp (RGD) has been developed. Two binding motifs for the functional side chains of RGD have been fused by a suitable spacer. Schrader s benzylic bisphosphonate for the complexation of arginine s alkyl guanidine was connected with Schmuck s guanidiniocarbonyl pyrrole for binding of the carboxylate in the side chain of aspartate. Four new receptors with spacers of different flexibility have been synthesized in cooperation with Schrader s workgroup at the University of Marburg. [50] The compounds 99, 100 and 101 were found to be too flexible therefore allowing an intramolecular self-aggregation. This self-aggregation occurs by recognition of the bisphosphonate anions by the guanidiniocarbonyl pyrrole moiety. Furthermore, for 101 an additional intermolecular self association was observed. Both effects result in a very weak binding of the RGD target in buffered water of K a < 400 M -1.
166 152 Summary and utlook coordination of alkyl guanidine P Me P Me spacer 2 2 coordination of carboxylate Me increase of flexibility Figure 5.7: Four new RGD receptors combining Schrader s bisphoshonate for coordination of alkyl guanidines and und Schmuck s guanidiniocarbonyl pyrrole for carboxylates. The rigid spacer in 3 prevents intramolecular self association. ence, 3 is capable to bind the model peptide Ac-RGD with K a 3000 M -1 in buffered water. Binding studies indicate a complexation based on recognition of RGD s two side chains by 3. E. g. the tripeptide Ac-Gly-Gly-Gly- 38 lacking any side chain is not bound. Thus the potential of a combination of Schmuck s and Schrader s binding motifs for preparation of effective receptors for RGD has been established. Figure 5.8: Calculated complex structure of 3 and Ac-RGD (MacroModel 8.0, Amber*, 2, steps). For further optimization of the spacer a solid phase protocol for guanidiniocarbonyl pyrroles has been developed in a third part of the thesis. ence, Schmuck s binding motif for carboxylates was bound covalently to a solid phase support via the β-position
5 Zusammenfassung und Ausblick
 5 Zusammenfassung und Ausblick Die Kopplung von sekundären- und primären Aminen an die freie α-carboxylgruppe von L-Glutaminsäure bildet den Zugang zu Monomeren, die zum Aufbau von γ- Peptiden genutzt
5 Zusammenfassung und Ausblick Die Kopplung von sekundären- und primären Aminen an die freie α-carboxylgruppe von L-Glutaminsäure bildet den Zugang zu Monomeren, die zum Aufbau von γ- Peptiden genutzt
Organische Experimentalchemie
 PD Dr. Alexander Breder (abreder@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 rganische Experimentalchemie Für Studierende der umanmedizin, Zahnmedizin und Biologie
PD Dr. Alexander Breder (abreder@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 rganische Experimentalchemie Für Studierende der umanmedizin, Zahnmedizin und Biologie
Synthese von Teroxazolen als Peptidmimetika
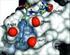 Synthese von Teroxazolen als Peptidmimetika Dissertation zur Erlangung des Doktorgrades der Naturwissenschaften vorgelegt beim Fachbereich Biochemie, Chemie und Pharmazie der Johann Wolfgang Goethe-Universität
Synthese von Teroxazolen als Peptidmimetika Dissertation zur Erlangung des Doktorgrades der Naturwissenschaften vorgelegt beim Fachbereich Biochemie, Chemie und Pharmazie der Johann Wolfgang Goethe-Universität
Antibakterielle Naturstoffe in der medizinischen Chemie
 OC 07-Vortrag Antibakterielle Naturstoffe in der medizinischen Chemie Tobias Geid Schlagwort: Selektive Toxizität (Paul Ehrlich) 1 Unterschiede zwischen menschlicher (eukaryotischer) und bakterieller (prokaryotischer)
OC 07-Vortrag Antibakterielle Naturstoffe in der medizinischen Chemie Tobias Geid Schlagwort: Selektive Toxizität (Paul Ehrlich) 1 Unterschiede zwischen menschlicher (eukaryotischer) und bakterieller (prokaryotischer)
Aminosäure Seitenkette pks. 20 Aminosäuren im genetischen Code verankert. α -Aminosäuren R. Fischer-projektion. COOH H 2 N H R D-Aminosäuren
 20 Aminosäuren im genetischen ode verankert. Gruppe aure Aminosäuren und ihre Amide Aminosäure eitenkette pks Asparaginsäure (D) - 2-3.9 Glutaminsäure (E) -( 2 ) 2-4.2 α -Aminosäuren 2 3 Zwitterion Fischer-projektion
20 Aminosäuren im genetischen ode verankert. Gruppe aure Aminosäuren und ihre Amide Aminosäure eitenkette pks Asparaginsäure (D) - 2-3.9 Glutaminsäure (E) -( 2 ) 2-4.2 α -Aminosäuren 2 3 Zwitterion Fischer-projektion
15. Aminosäuren, Peptide und Proteine
 15. Aminosäuren, Peptide und Proteine 1 Proteine (Polypeptide) erfüllen in biologischen ystemen die unterschiedlichsten Funktionen. o wirken sie z.b. bei vielen chemischen eaktionen in der atur als Katalysatoren
15. Aminosäuren, Peptide und Proteine 1 Proteine (Polypeptide) erfüllen in biologischen ystemen die unterschiedlichsten Funktionen. o wirken sie z.b. bei vielen chemischen eaktionen in der atur als Katalysatoren
Aminosäuren - Proteine
 Aminosäuren - Proteine ÜBERBLICK D.Pflumm KSR / MSE Aminosäuren Überblick Allgemeine Formel für das Grundgerüst einer Aminosäure Carboxylgruppe: R-COOH O Aminogruppe: R-NH 2 einzelnes C-Atom (α-c-atom)
Aminosäuren - Proteine ÜBERBLICK D.Pflumm KSR / MSE Aminosäuren Überblick Allgemeine Formel für das Grundgerüst einer Aminosäure Carboxylgruppe: R-COOH O Aminogruppe: R-NH 2 einzelnes C-Atom (α-c-atom)
Proteinogene Aminosäuren. Unpolare, aliphatische Seitenketten Monoaminomonocarbonsäuren
 Proteinogene Aminosäuren Unpolare, aliphatische Seitenketten Monoaminomonocarbonsäuren Proteinogene Aminosäuren Unpolare, heterozyklische Seitenkette Monoaminomonocarbonsäuren Proteinogene Aminosäuren
Proteinogene Aminosäuren Unpolare, aliphatische Seitenketten Monoaminomonocarbonsäuren Proteinogene Aminosäuren Unpolare, heterozyklische Seitenkette Monoaminomonocarbonsäuren Proteinogene Aminosäuren
Enzyme (Teil 1) Aminosäuren, Aufbau, Eigenschaften & Funktion. Mag. Gerald Trutschl
 Enzyme (Teil 1) Aminosäuren, Aufbau, Eigenschaften & Funktion Mag. Gerald Trutschl 1 Inhalt 1. Einführung 2. Aufbau: - Aminosäuren - Peptidbindung - Primärstruktur - Sekundärstruktur - Tertiär- und Quatärstrukturen
Enzyme (Teil 1) Aminosäuren, Aufbau, Eigenschaften & Funktion Mag. Gerald Trutschl 1 Inhalt 1. Einführung 2. Aufbau: - Aminosäuren - Peptidbindung - Primärstruktur - Sekundärstruktur - Tertiär- und Quatärstrukturen
2.2. Peptide. Peptide entstehen durch Kondensation der a-carboxylgruppe einer Aminosäure mit der a-aminogruppe einer anderen Aminosäure
 2.2. Peptide Peptide entstehen durch Kondensation der a-carboxylgruppe einer Aminosäure mit der a-aminogruppe einer anderen Aminosäure Peptid: bis zu ~30 linear über Peptidbindung verknüpfte Aminosäuren
2.2. Peptide Peptide entstehen durch Kondensation der a-carboxylgruppe einer Aminosäure mit der a-aminogruppe einer anderen Aminosäure Peptid: bis zu ~30 linear über Peptidbindung verknüpfte Aminosäuren
0.1 Eiweißstoffe (Proteine)
 1 22.06.2006 0.1 Eiweißstoffe (Proteine) 0.1.1 Die Aminosäuren Bausteine der Proteine Proteine sind aus einer Vielzahl (bis Tausende) von Baueinheiten zusammengesetzte Makromoleküle. Die einzelnen Bausteine,
1 22.06.2006 0.1 Eiweißstoffe (Proteine) 0.1.1 Die Aminosäuren Bausteine der Proteine Proteine sind aus einer Vielzahl (bis Tausende) von Baueinheiten zusammengesetzte Makromoleküle. Die einzelnen Bausteine,
Künstliche Peptide aus b-aminosäuren
 Künstliche Peptide aus b-aminosäuren Seminar zum CF-Praktikum WS 03/04 Übersicht Struktur und omenklatur von ß-Aminosäuren Synthese von ß-Aminosäuren Methoden zur Peptidsynthese Schutzgruppen Aktivierung
Künstliche Peptide aus b-aminosäuren Seminar zum CF-Praktikum WS 03/04 Übersicht Struktur und omenklatur von ß-Aminosäuren Synthese von ß-Aminosäuren Methoden zur Peptidsynthese Schutzgruppen Aktivierung
Vorlesung 47. Aminosäuren, Peptide und Proteine
 Vorlesung 47. Aminosäuren, Peptide und Proteine Bedeutung der Proteine in der atur: Vollhardt, 3. Aufl., S. 1285/1286, 4. Aufl., S. 1371; art S. 608-609; Buddrus, S. 753. Etwa 18% des menschlichen Körpers
Vorlesung 47. Aminosäuren, Peptide und Proteine Bedeutung der Proteine in der atur: Vollhardt, 3. Aufl., S. 1285/1286, 4. Aufl., S. 1371; art S. 608-609; Buddrus, S. 753. Etwa 18% des menschlichen Körpers
Wirkungsmechanismen regulatorischer Enzyme
 Wirkungsmechanismen regulatorischer Enzyme Ein Multienzymsystem ist eine Aufeinanderfolge von Enzymen, bei der das Produkt eines vorstehenden Enzyms das Substrat des nächsten Enzyms wird. Ein regulatorisches
Wirkungsmechanismen regulatorischer Enzyme Ein Multienzymsystem ist eine Aufeinanderfolge von Enzymen, bei der das Produkt eines vorstehenden Enzyms das Substrat des nächsten Enzyms wird. Ein regulatorisches
Hemmung der Enzym-Aktivität
 Enzym - Inhibitoren Wie wirkt Penicillin? Wie wirkt Aspirin? Welche Rolle spielt Methotrexat in der Chemotherapie? Welche Wirkstoffe werden gegen HIV entwickelt? Hemmung der Enzym-Aktivität Substrat Kompetitiver
Enzym - Inhibitoren Wie wirkt Penicillin? Wie wirkt Aspirin? Welche Rolle spielt Methotrexat in der Chemotherapie? Welche Wirkstoffe werden gegen HIV entwickelt? Hemmung der Enzym-Aktivität Substrat Kompetitiver
Aufgabe 5 (Supersekundärstruktur)
 Aufgabe 5 (Supersekundärstruktur) Fragestellung Bei der Untereinheit des Arthropodenhämocyanins aus Limulus polyphemus werden folgende Fragestellungen untersucht: - Welche Supersekundärstrukturen gibt
Aufgabe 5 (Supersekundärstruktur) Fragestellung Bei der Untereinheit des Arthropodenhämocyanins aus Limulus polyphemus werden folgende Fragestellungen untersucht: - Welche Supersekundärstrukturen gibt
Thomas Zöller (Autor) Verbesserung des Auflösungsverhaltens von schwer löslichen schwachen Säuren durch feste Lösungen und Cyclodextrin- Komplexe
 Thomas Zöller (Autor) Verbesserung des Auflösungsverhaltens von schwer löslichen schwachen Säuren durch feste Lösungen und Cyclodextrin- Komplexe https://cuvillier.de/de/shop/publications/334 Copyright:
Thomas Zöller (Autor) Verbesserung des Auflösungsverhaltens von schwer löslichen schwachen Säuren durch feste Lösungen und Cyclodextrin- Komplexe https://cuvillier.de/de/shop/publications/334 Copyright:
Eine Molekulare Fliegenfalle zur Erkennung von biologisch relevanten (poly)-anionischen Substraten
 Eine Molekulare Fliegenfalle zur Erkennung von biologisch relevanten (poly)-anionischen Substraten Dissertation zur Erlangung des naturwissenschaftlichen Doktorgrades der Bayerischen Julius-Maximilians-Universität
Eine Molekulare Fliegenfalle zur Erkennung von biologisch relevanten (poly)-anionischen Substraten Dissertation zur Erlangung des naturwissenschaftlichen Doktorgrades der Bayerischen Julius-Maximilians-Universität
Peptide. Peptidbindung. (Adapted from the handouts of Prof. AG Beck-Sickinger, Leipzig)
 Peptide Peptidbindung Alanin Glycin (Adapted from the handouts of Prof. AG Beck-Sickinger, Leipzig) Peptidbindung Bindungslänge in Å = - Kristallverband Gasphase 1,241 1,219 1,318 1,352 Dieder Winkel Φ
Peptide Peptidbindung Alanin Glycin (Adapted from the handouts of Prof. AG Beck-Sickinger, Leipzig) Peptidbindung Bindungslänge in Å = - Kristallverband Gasphase 1,241 1,219 1,318 1,352 Dieder Winkel Φ
Vorlesung Biophysik I - Molekulare Biophysik Kalbitzer/Kremer/Ziegler
 Vorlesung Biophysik I - Molekulare Biophysik Kalbitzer/Kremer/Ziegler 23.10. Zelle 30.10. Biologische Makromoleküle I 06.11. Biologische Makromoleküle II 13.11. Nukleinsäuren-Origami (DNA, RNA) 20.11.
Vorlesung Biophysik I - Molekulare Biophysik Kalbitzer/Kremer/Ziegler 23.10. Zelle 30.10. Biologische Makromoleküle I 06.11. Biologische Makromoleküle II 13.11. Nukleinsäuren-Origami (DNA, RNA) 20.11.
4. Naturstoffe 4.1 Kohlenhydrate 4.2 Lipide 4.3 Aminosäuren, Peptide und Proteine
 4. Naturstoffe 4.1 Kohlenhydrate 4.2 Lipide 4.3 Aminosäuren, Peptide und Proteine 1 4.1 Kohlenhydrate Einteilung der Kohlenhydrate in drei Gruppen: Monosaccharide (einfache Zucker) Beispiele: Glucose,
4. Naturstoffe 4.1 Kohlenhydrate 4.2 Lipide 4.3 Aminosäuren, Peptide und Proteine 1 4.1 Kohlenhydrate Einteilung der Kohlenhydrate in drei Gruppen: Monosaccharide (einfache Zucker) Beispiele: Glucose,
C R H H O H H O. Peptide
 Peptide Peptide: Ketten aus Aminosäuren Enzymatische Prozesse vermögen Aminosäuren im rganismus zu größeren Molekülen, den Peptiden, zu verknüpfen 1. Diese erfüllen vielfältige physiologische Aufgaben,
Peptide Peptide: Ketten aus Aminosäuren Enzymatische Prozesse vermögen Aminosäuren im rganismus zu größeren Molekülen, den Peptiden, zu verknüpfen 1. Diese erfüllen vielfältige physiologische Aufgaben,
Mechanismus der Enzymkatalyse
 Mechanismus der Enzymkatalyse Allgemeine Prinzipien Annäherung des Substrats an das aktive Zentrum des Enzyms Enzym und Substrat treten in Wechselwirkung: Bildung des [ES]-Komplexes. Konformationsänderung
Mechanismus der Enzymkatalyse Allgemeine Prinzipien Annäherung des Substrats an das aktive Zentrum des Enzyms Enzym und Substrat treten in Wechselwirkung: Bildung des [ES]-Komplexes. Konformationsänderung
Gramicidin S. DaMocles Projekt Stefanie Wolf, Daniela Steiger, Christian Merz, Sebastian Fabritz
 Gramicidin S DaMocles Projekt 2004 Stefanie Wolf, Daniela Steiger, Christian Merz, Sebastian Fabritz Gramicidin S Einleitung: Gramicidin S ist ein zyklisches antimikrobielles Decapeptid. Es wurde 1944
Gramicidin S DaMocles Projekt 2004 Stefanie Wolf, Daniela Steiger, Christian Merz, Sebastian Fabritz Gramicidin S Einleitung: Gramicidin S ist ein zyklisches antimikrobielles Decapeptid. Es wurde 1944
Weitere Übungsfragen
 1 Strategie bei multiple choice Fragen Wie unterscheidet sich Glucose von Fructose? (2 Punkte) Glucose hat 6 C Atome, Fructose hat nur 5 C Atome. In der Ringform gibt es bei Glucose α und β Anomere, bei
1 Strategie bei multiple choice Fragen Wie unterscheidet sich Glucose von Fructose? (2 Punkte) Glucose hat 6 C Atome, Fructose hat nur 5 C Atome. In der Ringform gibt es bei Glucose α und β Anomere, bei
Antibiotika und ihre Wirkung. Sonntag, den
 Antibiotika und ihre Wirkung Sonntag, den 23. 04. 2006 Die Bakterienzelle - einzellige Mikroorganismen (Größe:0,5-5Mikrometer) - Bakterienformen: Kokken Stäbchen Spirillen - Wachstum: Streptokokken Staphylokokken
Antibiotika und ihre Wirkung Sonntag, den 23. 04. 2006 Die Bakterienzelle - einzellige Mikroorganismen (Größe:0,5-5Mikrometer) - Bakterienformen: Kokken Stäbchen Spirillen - Wachstum: Streptokokken Staphylokokken
NMR-Methoden zur chiralen Erkennung
 Spektroskopie in der rganischen hemie NMR-Methoden zur chiralen Erkennung Mit Ausnahme der D-Spektroskopie (D = irculardichroismus) sind alle spektroskopischen Methoden auch die NMR achiral, d.h. sie können
Spektroskopie in der rganischen hemie NMR-Methoden zur chiralen Erkennung Mit Ausnahme der D-Spektroskopie (D = irculardichroismus) sind alle spektroskopischen Methoden auch die NMR achiral, d.h. sie können
Aufgabe 6 (Quartärstruktur)
 Aufgabe 6 (Quartärstruktur) Fragestellung Folgende Fragestellungen sollen beim Hämocyanin-Hexamer von Limulus polyphemus (1lla_Hexamer.pdb) untersucht werden: - Welche Symmetrien sind erkennbar? - Wenn
Aufgabe 6 (Quartärstruktur) Fragestellung Folgende Fragestellungen sollen beim Hämocyanin-Hexamer von Limulus polyphemus (1lla_Hexamer.pdb) untersucht werden: - Welche Symmetrien sind erkennbar? - Wenn
Einführung in die Biochemie Wirkungsweise von Enzymen
 Wirkungsweise von en Am Aktiven Zentrum kann ein nur in einer ganz bestimmten Orientierung anlegen, wie ein Schlüssel zum Schloss. Dieses Prinzip ist die Ursache der spezifität von en. Dies resultiert
Wirkungsweise von en Am Aktiven Zentrum kann ein nur in einer ganz bestimmten Orientierung anlegen, wie ein Schlüssel zum Schloss. Dieses Prinzip ist die Ursache der spezifität von en. Dies resultiert
MM Biopolymere. Michael Meyer. Vorlesung XV
 Biopolymere Vorlesung XV Simulation von Biomolekülen Modellierung von Proteinen Identifizierung und/oder Verwandtschaft mit anderen Proteinen Funktion eines Proteins oder Sequenzfragmentes Modellierung
Biopolymere Vorlesung XV Simulation von Biomolekülen Modellierung von Proteinen Identifizierung und/oder Verwandtschaft mit anderen Proteinen Funktion eines Proteins oder Sequenzfragmentes Modellierung
Peptide Proteine. 1. Aminosäuren. Alle optisch aktiven proteinogenen Aminosäuren gehören der L-Reihe an: 1.1 Struktur der Aminosäuren
 1. Aminosäuren Aminosäuren Peptide Proteine Vortragender: Dr. W. Helliger 1.1 Struktur 1.2 Säure-Basen-Eigenschaften 1.2.1 Neutral- und Zwitterion-Form 1.2.2 Molekülform in Abhängigkeit vom ph-wert 1.3
1. Aminosäuren Aminosäuren Peptide Proteine Vortragender: Dr. W. Helliger 1.1 Struktur 1.2 Säure-Basen-Eigenschaften 1.2.1 Neutral- und Zwitterion-Form 1.2.2 Molekülform in Abhängigkeit vom ph-wert 1.3
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Die gentechnische Produktion von Insulin - Selbstlerneinheit zur kontextorientierten Wiederholung der molekularen Genetik Das komplette
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Die gentechnische Produktion von Insulin - Selbstlerneinheit zur kontextorientierten Wiederholung der molekularen Genetik Das komplette
Kohlenhydrate Aminosäuren Peptide
 Kohlenhydrate Aminosäuren Peptide Kohlenhydrate Kohlenhydrate = Saccharide Sie stellen zusammen mit Fetten und Proteinen den quantitativ größten verwertbaren (z.b. Stärke) und nicht-verwertbaren (Ballaststoffe)
Kohlenhydrate Aminosäuren Peptide Kohlenhydrate Kohlenhydrate = Saccharide Sie stellen zusammen mit Fetten und Proteinen den quantitativ größten verwertbaren (z.b. Stärke) und nicht-verwertbaren (Ballaststoffe)
Fragen zum Thema funktionelle Gruppen Alkohol und Phenol
 1. Was sind Derivate? 2. Was sind Substituenten? 3. Wann werden neu angehängte Atome oder Gruppen als Substituent bezeichnet? 4. Warum sind Substituenten so wichtig für organische Verbindungen? Alkohol
1. Was sind Derivate? 2. Was sind Substituenten? 3. Wann werden neu angehängte Atome oder Gruppen als Substituent bezeichnet? 4. Warum sind Substituenten so wichtig für organische Verbindungen? Alkohol
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Biofunktionalisierung von metallischen Nanopartikeln
 Biofunktionalisierung von metallischen Nanopartikeln zur Entwicklung von Biosensoren Zur Erlangung des akademischen Grades eines DOKTORS DER NATURWISSENSCHAFTEN (Dr. rer. nat.) Fakultät für Chemie und
Biofunktionalisierung von metallischen Nanopartikeln zur Entwicklung von Biosensoren Zur Erlangung des akademischen Grades eines DOKTORS DER NATURWISSENSCHAFTEN (Dr. rer. nat.) Fakultät für Chemie und
b) Zeichnen Sie die beiden möglichen Isomere der Aldol-Kondensation und bezeichnen Sie die Stereochemie der Produkte.
 1. Aufgabe a) Formulieren Sie den Mechanismus der durch ydroxid-ionen katalysierten Aldol- Addition und Aldol-Kondensation zwischen den beiden unten gezeigten Molekülen. + 2 2 b) Zeichnen Sie die beiden
1. Aufgabe a) Formulieren Sie den Mechanismus der durch ydroxid-ionen katalysierten Aldol- Addition und Aldol-Kondensation zwischen den beiden unten gezeigten Molekülen. + 2 2 b) Zeichnen Sie die beiden
Dipolmomente + - a ohne Feld b mit Feld. δ + δ- δ + δ - δ + δ - δ + δ - δ + δ - δ + Dipolmoment: µ = q * d
 CI_folie29 Dipolmomente δ- + - a ohne Feld b mit Feld + + + + + + - - - - - - Effekt eines elektrostatischen Feldes auf die rientierung polarer Moleküle. Dipolmoment: µ = q * d d: Abstand zwischen den
CI_folie29 Dipolmomente δ- + - a ohne Feld b mit Feld + + + + + + - - - - - - Effekt eines elektrostatischen Feldes auf die rientierung polarer Moleküle. Dipolmoment: µ = q * d d: Abstand zwischen den
Chemie für Mediziner. Norbert Sträter
 Chemie für Mediziner Norbert Sträter Verlag Wissenschaftliche Scripten 2012 Inhaltsverzeichnis Allgemeine und Anorganische Chemie... 1 1 Atombau... 1 1.1 Fundamentale Begriffe... 1 1.2 Atome und Elemente...
Chemie für Mediziner Norbert Sträter Verlag Wissenschaftliche Scripten 2012 Inhaltsverzeichnis Allgemeine und Anorganische Chemie... 1 1 Atombau... 1 1.1 Fundamentale Begriffe... 1 1.2 Atome und Elemente...
Übungen zu den Vorlesungen Aminosäuren und Peptide Proteine
 Übungen zu den Vorlesungen Aminosäuren und Peptide Proteine Dr. Katja Arndt Institut für Biologie III http://www.molbiotech.uni-freiburg.de/ka Übungen zur Vorlesung Aminosäuren, Peptide, Proteine Dr. Katja
Übungen zu den Vorlesungen Aminosäuren und Peptide Proteine Dr. Katja Arndt Institut für Biologie III http://www.molbiotech.uni-freiburg.de/ka Übungen zur Vorlesung Aminosäuren, Peptide, Proteine Dr. Katja
Die Substratspezifität der Enzyme Trypsin und Chymotrypsin
 Die Substratspezifität der Enzyme Trypsin und Chymotrypsin Einleitung Die Proteine Trypsin und Chymotrypsin sind Enzyme, die im Magen von Säugetieren vorkommen und die Hydrolyse von Peptidbindungen katalysieren.
Die Substratspezifität der Enzyme Trypsin und Chymotrypsin Einleitung Die Proteine Trypsin und Chymotrypsin sind Enzyme, die im Magen von Säugetieren vorkommen und die Hydrolyse von Peptidbindungen katalysieren.
Übungsaufgaben zu Aminosäuren, Peptiden und Proteinen
 Übungsaufgaben zu Aminosäuren, Peptiden und Proteinen Techniker, Wahlpflichtfach ilfsmittel: Blatt mit den Strukturformeln aller proteinogenen AS (außer bei den Aufgaben, bei denen die Strukturformel einer
Übungsaufgaben zu Aminosäuren, Peptiden und Proteinen Techniker, Wahlpflichtfach ilfsmittel: Blatt mit den Strukturformeln aller proteinogenen AS (außer bei den Aufgaben, bei denen die Strukturformel einer
Die Staudinger-Ligation
 Die Staudinger-Ligation -ein Geschenk für die chemische Biologie Von C. Erger, M. Marek, T. ein, K. einsberg 1 Inhalt Staudinger eaktion Staudinger Ligation Anwendungen Peptidligation Synthese von Biokonjugaten
Die Staudinger-Ligation -ein Geschenk für die chemische Biologie Von C. Erger, M. Marek, T. ein, K. einsberg 1 Inhalt Staudinger eaktion Staudinger Ligation Anwendungen Peptidligation Synthese von Biokonjugaten
Referat : Aufbau v. Proteinen u. ihre Raumstruktur
 Referat : Aufbau v. Proteinen u. ihre Raumstruktur 1. Einleitung Unsere Körperzellen enthalten einige Tausend verschiedene Proteine wobei man schätzt, das insgesamt über 50 000 verschiedene Eiweißstoffe
Referat : Aufbau v. Proteinen u. ihre Raumstruktur 1. Einleitung Unsere Körperzellen enthalten einige Tausend verschiedene Proteine wobei man schätzt, das insgesamt über 50 000 verschiedene Eiweißstoffe
Selda Kabatas (Autor) Synthese Artifizieller Peptide zur Erzeugung von Supramolekularen Architekturen und zur Markie-rung von Biomolekülen
 Selda Kabatas (Autor) Synthese Artifizieller Peptide zur Erzeugung von Supramolekularen Architekturen und zur Markie-rung von Biomolekülen https://cuvillier.de/de/shop/publications/7277 Copyright: Cuvillier
Selda Kabatas (Autor) Synthese Artifizieller Peptide zur Erzeugung von Supramolekularen Architekturen und zur Markie-rung von Biomolekülen https://cuvillier.de/de/shop/publications/7277 Copyright: Cuvillier
insara: Hierarchische Netzwerke zur Analyse, Visualisierung und Vorhersage von Struktur-Aktivitäts-Beziehungen
 insara: Hierarchische Netzwerke zur Analyse, Visualisierung und Vorhersage von Struktur-Aktivitäts-Beziehungen Von der Fakultät für Lebenswissenschaften der Technischen Universität Carolo-Wilhelmina zu
insara: Hierarchische Netzwerke zur Analyse, Visualisierung und Vorhersage von Struktur-Aktivitäts-Beziehungen Von der Fakultät für Lebenswissenschaften der Technischen Universität Carolo-Wilhelmina zu
Einführung in die Biochemie Antworten zu den Übungsaufgaben
 Einführung in die Biochemie Antworten zu den Übungsaufgaben Dank Die vorliegenden Antworten zu den Übungsaufgaben für das Seminar zum Modul Einführung in die Biochemie wurden im Wintersemester 2014/2015
Einführung in die Biochemie Antworten zu den Übungsaufgaben Dank Die vorliegenden Antworten zu den Übungsaufgaben für das Seminar zum Modul Einführung in die Biochemie wurden im Wintersemester 2014/2015
Chemie für Biologen WS 2005/6 Arne Lützen Institut für Organische Chemie der Universität Duisburg-Essen (Teil 5: )
 Chemie für Biologen WS 2005/6 Arne Lützen Institut für rganische Chemie der Universität Duisburg-Essen (Teil 5: 23.11.2005) Kovalente Bindung Atome können sich Valenzelektronen unter Ausbildung von Bindungen
Chemie für Biologen WS 2005/6 Arne Lützen Institut für rganische Chemie der Universität Duisburg-Essen (Teil 5: 23.11.2005) Kovalente Bindung Atome können sich Valenzelektronen unter Ausbildung von Bindungen
Neue supramolekulare Bindungsmotive. Untersuchung nicht-kovalenter Wechselwirkungen in. polarer Umgebung
 Neue supramolekulare Bindungsmotive Untersuchung nicht-kovalenter Wechselwirkungen in polarer Umgebung Dissertation zur Erlangung des akademischen Grades eines Doktors der Naturwissenschaften Dr. rer.
Neue supramolekulare Bindungsmotive Untersuchung nicht-kovalenter Wechselwirkungen in polarer Umgebung Dissertation zur Erlangung des akademischen Grades eines Doktors der Naturwissenschaften Dr. rer.
Praktikum Biochemie B.Sc. Water Science WS Enzymregulation. Marinja Niggemann, Denise Schäfer
 Praktikum Biochemie B.Sc. Water Science WS 2011 Enzymregulation Marinja Niggemann, Denise Schäfer Regulatorische Strategien 1. Allosterische Wechselwirkung 2. Proteolytische Aktivierung 3. Kovalente Modifikation
Praktikum Biochemie B.Sc. Water Science WS 2011 Enzymregulation Marinja Niggemann, Denise Schäfer Regulatorische Strategien 1. Allosterische Wechselwirkung 2. Proteolytische Aktivierung 3. Kovalente Modifikation
Falschfaltung von Proteinen
 Falschfaltung von Proteinen - Aggregation - domain swapping - amyloidogene Strukturen Was determiniert die Faltung von Proteinen? Einfachstes System: Zwei-Zustandsmodell N U Energie U dg ÜS dg* N Molekulare
Falschfaltung von Proteinen - Aggregation - domain swapping - amyloidogene Strukturen Was determiniert die Faltung von Proteinen? Einfachstes System: Zwei-Zustandsmodell N U Energie U dg ÜS dg* N Molekulare
Synthese und biologische Aktivität neuer nichtklassischer ß-Lactam-Antibiotika
 0 Dissertation zur Erlangung des Doktorgrades der Fakultät für Chemie und Pharmazie der Ludwig-Maximilians-Universität München Synthese und biologische Aktivität neuer nichtklassischer ß-Lactam-Antibiotika
0 Dissertation zur Erlangung des Doktorgrades der Fakultät für Chemie und Pharmazie der Ludwig-Maximilians-Universität München Synthese und biologische Aktivität neuer nichtklassischer ß-Lactam-Antibiotika
COOH. Die Aminosäuren tragen laborübliche Abkürzungen, so stehen z. B. Gly für Glycin oder Phe für Phenylalanin.
 Aminosäuren 1. Textentwurf Allgemeine Formel der Aminosäuren Aminosäuren sind die Grundbestandteile der Proteine. Neben der -Gruppe 1 enthalten sie als charakteristisches Merkmal die Aminogruppe N. Zwei
Aminosäuren 1. Textentwurf Allgemeine Formel der Aminosäuren Aminosäuren sind die Grundbestandteile der Proteine. Neben der -Gruppe 1 enthalten sie als charakteristisches Merkmal die Aminogruppe N. Zwei
Bioorganische Chemie Enzymatische Katalyse 2011
 Ringvorlesung Chemie B - Studiengang Molekulare Biotechnologie Bioorganische Chemie Enzymatische Katalyse 2011 Prof. Dr. A. Jäschke INF 364, Zi. 308, Tel. 54 48 51 jaeschke@uni-hd.de Lehrziele I Kenntnis
Ringvorlesung Chemie B - Studiengang Molekulare Biotechnologie Bioorganische Chemie Enzymatische Katalyse 2011 Prof. Dr. A. Jäschke INF 364, Zi. 308, Tel. 54 48 51 jaeschke@uni-hd.de Lehrziele I Kenntnis
Design und Synthese neuartiger antiviral- und antiprionenwirksamer
 Design und Synthese neuartiger antiviral- und antiprionenwirksamer Acridinverbindungen Dissertation zur Erlangung des akademischen Grades doctor rerum naturalium (Dr. rer. nat.) vorgelegt der Mathematisch-Naturwissenschaftlich-Technischen
Design und Synthese neuartiger antiviral- und antiprionenwirksamer Acridinverbindungen Dissertation zur Erlangung des akademischen Grades doctor rerum naturalium (Dr. rer. nat.) vorgelegt der Mathematisch-Naturwissenschaftlich-Technischen
AntibiotikaResistenzmechanismen
 AntibiotikaResistenzmechanismen 20. Oktober 2011 Patricia Kahl Charlotte Schäfer Definition: Antimikrobielle Medikamentenresistenz Erworbene Fähigkeit eines Mikroorganismus, der Wirkung einer chemotherapeutisch
AntibiotikaResistenzmechanismen 20. Oktober 2011 Patricia Kahl Charlotte Schäfer Definition: Antimikrobielle Medikamentenresistenz Erworbene Fähigkeit eines Mikroorganismus, der Wirkung einer chemotherapeutisch
Die Chemie der DNA. Desoxyribonukleinsäure. Laborchemie. Zellchemie. Armin Geyer Fachbereich Chemie Philipps-Universität. Jun08
 Die Chemie der DA Desoxyribonukleinsäure Armin Geyer Fachbereich Chemie hilipps-universität Jun08 Laborchemie Zellchemie Sequentielle Änderung der chemischen Umgebung Selektivität durch getrennte Reaktionskolben
Die Chemie der DA Desoxyribonukleinsäure Armin Geyer Fachbereich Chemie hilipps-universität Jun08 Laborchemie Zellchemie Sequentielle Änderung der chemischen Umgebung Selektivität durch getrennte Reaktionskolben
Lösungen 3. Übungsblatt SS 2002
 Lösungen 3. Übungsblatt SS 2002 1. Aufgabe: omenklatur und Stereochemie a) (E)-7-(S)-om-4-nonen-2-on b) H 3- Methoxy-4-methyl-benzaldehyd 2. Aufgabe: Alkene a) A B C D E Stabilitätsbeeinflussende Faktoren
Lösungen 3. Übungsblatt SS 2002 1. Aufgabe: omenklatur und Stereochemie a) (E)-7-(S)-om-4-nonen-2-on b) H 3- Methoxy-4-methyl-benzaldehyd 2. Aufgabe: Alkene a) A B C D E Stabilitätsbeeinflussende Faktoren
Synthese und pharmakologische Untersuchung neuer Triaryl-1H-pyrrole mit estrogenen, zytotoxischen und COX-inhibitorischen Eigenschaften
 Synthese und pharmakologische Untersuchung neuer Triaryl-1H-pyrrole mit estrogenen, zytotoxischen und COX-inhibitorischen Eigenschaften Dissertation zur Erlangung des akademischen Grades des Doktors der
Synthese und pharmakologische Untersuchung neuer Triaryl-1H-pyrrole mit estrogenen, zytotoxischen und COX-inhibitorischen Eigenschaften Dissertation zur Erlangung des akademischen Grades des Doktors der
Vorname: Frage 1. Nennen Sie drei Metalle, die :für den Menschen essentiell sind und als Mengenelemente Körper vorkommen (3 P) Frage 2
 1\.1 Matrikelnummer: Name: Vorname: Bitte eintragen Bitte ankreuzen: Fachsemester: Fachrichtung: Chemie Sonstige Bitte prüfen Sie Ihre Klausur sofort auf Vollständigkeit (Seiten fortlaufend nummeriert
1\.1 Matrikelnummer: Name: Vorname: Bitte eintragen Bitte ankreuzen: Fachsemester: Fachrichtung: Chemie Sonstige Bitte prüfen Sie Ihre Klausur sofort auf Vollständigkeit (Seiten fortlaufend nummeriert
4 Zusammenfassung 111
 4 Zusammenfassung 4 Zusammenfassung 111 Die vorliegende Arbeit beschreibt Synthese, pharmakologische Prüfung und Struktur- Wirkungsbeziehungen von N α -substituierten Histaprodifenen, einer neuen Klasse
4 Zusammenfassung 4 Zusammenfassung 111 Die vorliegende Arbeit beschreibt Synthese, pharmakologische Prüfung und Struktur- Wirkungsbeziehungen von N α -substituierten Histaprodifenen, einer neuen Klasse
1 Zusammenfassung 1. 2 Einleitung Chemische Genetik Rezeptor-vermittelte Signaltransduktion 7
 Inhaltsverzeichnis 1 Zusammenfassung 1 2 Einleitung 3 2.1 Chemische Genetik 4 2.2 Rezeptor-vermittelte Signaltransduktion 7 2.3 Guaninnukleotid-bindende Proteine (G-Proteine/GTPasen) 7 2.3.1 Kleine GTPasen
Inhaltsverzeichnis 1 Zusammenfassung 1 2 Einleitung 3 2.1 Chemische Genetik 4 2.2 Rezeptor-vermittelte Signaltransduktion 7 2.3 Guaninnukleotid-bindende Proteine (G-Proteine/GTPasen) 7 2.3.1 Kleine GTPasen
Zur Entwicklung neuer. aza-analoger Benzo[c]phenanthridine. mit antitumoraler Wirkung
![Zur Entwicklung neuer. aza-analoger Benzo[c]phenanthridine. mit antitumoraler Wirkung Zur Entwicklung neuer. aza-analoger Benzo[c]phenanthridine. mit antitumoraler Wirkung](/thumbs/67/56999644.jpg) Zur Entwicklung neuer aza-analoger Benzo[c]phenanthridine mit antitumoraler Wirkung Dissertation zur Erlangung des Doktorgrades der Mathematisch Naturwissenschaftlichen Fakultät der Christian-Albrechts-Universität
Zur Entwicklung neuer aza-analoger Benzo[c]phenanthridine mit antitumoraler Wirkung Dissertation zur Erlangung des Doktorgrades der Mathematisch Naturwissenschaftlichen Fakultät der Christian-Albrechts-Universität
Klausur zu Teil 1 des Wahlpflichtmoduls "Nanochemie" ( )
 1 ame... Matrikel-r.... Klausur zu Teil 1 des Wahlpflichtmoduls "anochemie" (13-121-0223) 20. Mai 2008 (9.00-9.50 Uhr, R. 014) Schreiben Sie sauber und ordentlich! Für nicht lesbare Ausdrücke können leider
1 ame... Matrikel-r.... Klausur zu Teil 1 des Wahlpflichtmoduls "anochemie" (13-121-0223) 20. Mai 2008 (9.00-9.50 Uhr, R. 014) Schreiben Sie sauber und ordentlich! Für nicht lesbare Ausdrücke können leider
Bachelorprüfung im Fach Biologie, Teilfach Chemie am a) Zeichnen Sie bitte unten die Strukturformel einer Verbindung der Summenformel
 Bachelorprüfung im Fach Biologie, Teilfach Chemie am 26.08.2014 2 Aufgabe 1 a) Zeichnen Sie bitte unten die Strukturformel einer Verbindung der Summenformel C 3 H 6 O 3 ein, die die folgenden Eigenschaften
Bachelorprüfung im Fach Biologie, Teilfach Chemie am 26.08.2014 2 Aufgabe 1 a) Zeichnen Sie bitte unten die Strukturformel einer Verbindung der Summenformel C 3 H 6 O 3 ein, die die folgenden Eigenschaften
Lösungsblatt zu Aufbau von Aminosäuren
 Lösungsblatt zu Aufbau von Aminosäuren 1. Zeichnen Sie die allgemeine Formel einer α-aminosäure, welche am α-c- Atom eine Seitenkette R trägt. 2. Welche der zwanzig natürlich vorkommenden L-α-Aminosäuren
Lösungsblatt zu Aufbau von Aminosäuren 1. Zeichnen Sie die allgemeine Formel einer α-aminosäure, welche am α-c- Atom eine Seitenkette R trägt. 2. Welche der zwanzig natürlich vorkommenden L-α-Aminosäuren
10 BIOGENE-AMINE 4 NICHT-PROTEINOGENE- AS. 20 PROTEINOGENE AS glucoplastisch/ketoplastisch 8 ESSENTIELLE AS
 Für uns! - es gibt 20 AS Diese sind wiederum aufgeteilt in: Neutrale AS Saure AS Basische AS Schwefelhaltige AS Aromatische AS Heterocyklische AS - es gibt 20 AS - davon sind 8 essentiell d.h.: der Körper
Für uns! - es gibt 20 AS Diese sind wiederum aufgeteilt in: Neutrale AS Saure AS Basische AS Schwefelhaltige AS Aromatische AS Heterocyklische AS - es gibt 20 AS - davon sind 8 essentiell d.h.: der Körper
Punkte 1. a) Erklären Sie wieso das Wassermolekül ein Dipol ist (gerne mit Zeichnung).
 -Klausur Biochemie - 20.07.6 Nur vollständige Reaktionsgleichungen, Berechnungen und Antworten werden als Lösung der Aufgaben gewertet, das Ergebnis alleine genügt nicht. Der Rechengang muß ersichtlich
-Klausur Biochemie - 20.07.6 Nur vollständige Reaktionsgleichungen, Berechnungen und Antworten werden als Lösung der Aufgaben gewertet, das Ergebnis alleine genügt nicht. Der Rechengang muß ersichtlich
Carfilzomib (Kyprolis )
 Carfilzomib (Kyprolis ) Carfilzomib ist ein weiterer Proteasom-Inhibitor, der zur Behandlung des Multiplen Myeloms zugelassen ist (Strukturformel s. Abbildung 1). Der Arzneistoff ist als Pulver zur Herstellung
Carfilzomib (Kyprolis ) Carfilzomib ist ein weiterer Proteasom-Inhibitor, der zur Behandlung des Multiplen Myeloms zugelassen ist (Strukturformel s. Abbildung 1). Der Arzneistoff ist als Pulver zur Herstellung
Literatur. Supramolecular Chemistry, 2nd edition Jonathan W. Steed, Jerry L. Atwood Wiley
 A. Schiller Inhalt Einleitung Grundlagen Rezeptoren für Kationen Rezeptoren für Anionen Supramolekulare Koordinationschemie Rotaxane und Catenane Molekulare Maschinen Supramolekulare Katalyse FSU Jena
A. Schiller Inhalt Einleitung Grundlagen Rezeptoren für Kationen Rezeptoren für Anionen Supramolekulare Koordinationschemie Rotaxane und Catenane Molekulare Maschinen Supramolekulare Katalyse FSU Jena
Hemmung der Enzym-Aktivität
 Hemmung der Enzym-Aktivität Substrat Kompetitiver Inhibitor Enzym Enzym Substrat Nichtkompetitiver Inhibitor Irreversibler Inhibitor Enzym Enzym Enzym - Kinetik Michaelis Menten Gleichung Lineweaver -
Hemmung der Enzym-Aktivität Substrat Kompetitiver Inhibitor Enzym Enzym Substrat Nichtkompetitiver Inhibitor Irreversibler Inhibitor Enzym Enzym Enzym - Kinetik Michaelis Menten Gleichung Lineweaver -
Nach Terpenen und Kohlenhydraten nun eine weitere große Klasse an Naturstoffen
 260 17. Aminosäuren, Peptide ach Terpenen und Kohlenhydraten nun eine weitere große Klasse an aturstoffen 17.1 Übersicht Analog zu ydroxycarbonsäuren α-, β-, γ- Aminocarbonsäuren möglich: 2 3 2 2 α-amino-essigsäure
260 17. Aminosäuren, Peptide ach Terpenen und Kohlenhydraten nun eine weitere große Klasse an aturstoffen 17.1 Übersicht Analog zu ydroxycarbonsäuren α-, β-, γ- Aminocarbonsäuren möglich: 2 3 2 2 α-amino-essigsäure
8 Zusammenfassung der Ergebnisse
 Zusammenfassung der Ergebnisse und Ausblick 131 8 Zusammenfassung der Ergebnisse Die vorliegende Arbeit beschreibt die Synthese, Charakterisierung und beschichtungstechnische Anwendung von Übergangsmetall-substituierten
Zusammenfassung der Ergebnisse und Ausblick 131 8 Zusammenfassung der Ergebnisse Die vorliegende Arbeit beschreibt die Synthese, Charakterisierung und beschichtungstechnische Anwendung von Übergangsmetall-substituierten
Optimierung der Analytik von Peptiden und kleinen Proteinen
 Produkte & Applikationen LC 24 2017 Optimierung der Analytik von Peptiden und kleinen Proteinen Relativ kleine Änderungen der Bedingungen können in der Peptidanalytik mittels RP-Chromatografie größere
Produkte & Applikationen LC 24 2017 Optimierung der Analytik von Peptiden und kleinen Proteinen Relativ kleine Änderungen der Bedingungen können in der Peptidanalytik mittels RP-Chromatografie größere
Klausur zum chemischen Praktikum für Studierende mit Chemie als Nebenfach (SS2011)
 Klausur zum chemischen Praktikum für Studierende mit Chemie als Nebenfach (SS2011) Musterlösung 1. (10P) Was ist richtig (mehrere Richtige sind möglich)? a) Amylose und Amylopektin bestehen nur aus D-Glucose
Klausur zum chemischen Praktikum für Studierende mit Chemie als Nebenfach (SS2011) Musterlösung 1. (10P) Was ist richtig (mehrere Richtige sind möglich)? a) Amylose und Amylopektin bestehen nur aus D-Glucose
a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten!
 Übung Nr. 9 Mi. 02.05.2012 bzw. Fr. 04.05.2012 1. Aromatensynthese a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten! b) Was passiert bei der Umsetzung von
Übung Nr. 9 Mi. 02.05.2012 bzw. Fr. 04.05.2012 1. Aromatensynthese a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten! b) Was passiert bei der Umsetzung von
Wie bezeichnet man den Vorgang der Integration des Lambda-Phagen in das Bakteriengenom?
 2004: Wie bezeichnet man den Vorgang der Integration des Lambda-Phagen in das Bakteriengenom? Wie nennt man den Zustand des Bakteriums und des Lambda-Phagen nach erfolgreicher Integration des Phagen? (1,5)
2004: Wie bezeichnet man den Vorgang der Integration des Lambda-Phagen in das Bakteriengenom? Wie nennt man den Zustand des Bakteriums und des Lambda-Phagen nach erfolgreicher Integration des Phagen? (1,5)
Organische Chemie III
 Organische Chemie III Sommersemester 2012 Technische Universität München Klausur am 15.06.2012 Name, Vorname... Matrikel-Nr.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Bachelor... (Eigenhändige
Organische Chemie III Sommersemester 2012 Technische Universität München Klausur am 15.06.2012 Name, Vorname... Matrikel-Nr.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Bachelor... (Eigenhändige
Antibiotika (Einleitung) Penicillium Schimmelpilze
 Antibiotika (Einleitung) Penicillium Schimmelpilze Grundlagen I Definition Antibiotika sind natürliche Stoffwechselprodukte von Pilzen und Bakterien, die andere Mikroorganismen abtöten oder an ihrem Wachstum
Antibiotika (Einleitung) Penicillium Schimmelpilze Grundlagen I Definition Antibiotika sind natürliche Stoffwechselprodukte von Pilzen und Bakterien, die andere Mikroorganismen abtöten oder an ihrem Wachstum
Pharmazeutische Biologie Grundlagen der Biochemie
 Pharmazeutische Biologie Grundlagen der Biochemie Prof. Dr. Theo Dingermann Institut für Pharmazeutische Biologie Goethe-Universität Frankfurt Dingermann@em.uni-frankfurt.de Aminosäure... chirale Moleküle
Pharmazeutische Biologie Grundlagen der Biochemie Prof. Dr. Theo Dingermann Institut für Pharmazeutische Biologie Goethe-Universität Frankfurt Dingermann@em.uni-frankfurt.de Aminosäure... chirale Moleküle
ORGANISCHE CHEMIE-ÜBUNGEN für Studierende mit Chemie als Nebenfach
 Prof. Dr. Th. K. Lindhorst RGAISCE CEMIE-ÜBUGE für Studierende mit Chemie als ebenfach 1. a) Alanin ist 2-Aminopropansäure. Wählen Sie für die Darstellung der beiden enantiomeren Formen von Alanin eine
Prof. Dr. Th. K. Lindhorst RGAISCE CEMIE-ÜBUGE für Studierende mit Chemie als ebenfach 1. a) Alanin ist 2-Aminopropansäure. Wählen Sie für die Darstellung der beiden enantiomeren Formen von Alanin eine
Inhaltsverzeichnis. 3 Gesättigte Kohlenwasserstoffe (Alkane) 3.1 Offenkettige Alkane 3.2 Cyclische Alkane
 Inhaltsverzeichnis 1 Chemische Bindung in organischen Verbindungen 1.1 Einleitung 1.2 Grundlagen der chemischen Bindung 1.3 Die Atombindung (kovalente oder homöopolare Bindung) 1.4 Bindungslängen und Bindungsenergien
Inhaltsverzeichnis 1 Chemische Bindung in organischen Verbindungen 1.1 Einleitung 1.2 Grundlagen der chemischen Bindung 1.3 Die Atombindung (kovalente oder homöopolare Bindung) 1.4 Bindungslängen und Bindungsenergien
Wichtige (Säulen-)chromatographische Trennmethoden in der Proteinanalytik: Adsorptions-/Verteilungschromatographie
 Wichtige (Säulen-)chromatographische Trennmethoden in der Proteinanalytik: Gelfiltration Trennung nach Molekülgröße Ionenaustauschchromatographie Trennung nach Ladung Adsorptions-/Verteilungschromatographie
Wichtige (Säulen-)chromatographische Trennmethoden in der Proteinanalytik: Gelfiltration Trennung nach Molekülgröße Ionenaustauschchromatographie Trennung nach Ladung Adsorptions-/Verteilungschromatographie
Tyrosinkinase- Rezeptoren
 Tyrosinkinase- Rezeptoren für bestimmte Hormone gibt es integrale Membranproteine als Rezeptoren Aufbau und Signaltransduktionsweg unterscheiden sich von denen der G- Protein- gekoppelten Rezeptoren Polypeptide
Tyrosinkinase- Rezeptoren für bestimmte Hormone gibt es integrale Membranproteine als Rezeptoren Aufbau und Signaltransduktionsweg unterscheiden sich von denen der G- Protein- gekoppelten Rezeptoren Polypeptide
Vertiefendes Seminar zur Vorlesung Biochemie I Bearbeitung Übungsblatt 4
 Vertiefendes Seminar zur Vorlesung Biochemie I 20.11.2015 Bearbeitung Übungsblatt 4 Gerhild van Echten-Deckert Fon. +49-228-732703 Homepage: http://www.limes-institut-bonn.de/forschung/arbeitsgruppen/unit-3/
Vertiefendes Seminar zur Vorlesung Biochemie I 20.11.2015 Bearbeitung Übungsblatt 4 Gerhild van Echten-Deckert Fon. +49-228-732703 Homepage: http://www.limes-institut-bonn.de/forschung/arbeitsgruppen/unit-3/
6. Carbonyl-Verbindungen
 6. Carbonyl-Verbindungen Hierher gehören vor allem die Aldehyde und Ketone. (später: Die Carbonyl-Gruppe weisen auch die Carbonsäuren und ihre Derivate auf). Carbonylgruppe. Innerhalb der Sauerstoff-Kohlenstoff-Doppelbindung
6. Carbonyl-Verbindungen Hierher gehören vor allem die Aldehyde und Ketone. (später: Die Carbonyl-Gruppe weisen auch die Carbonsäuren und ihre Derivate auf). Carbonylgruppe. Innerhalb der Sauerstoff-Kohlenstoff-Doppelbindung
5 Zusammenfassung H 2 N O H. Abbildung 5-1: Synthese eines enantiomerenreinen geschützten 3-Amino-1,2-propandiol-Scaffolds (28) DMT-Cl N H 3 99.
 5 Zusammenfassung Kationische Lipide werden als sog. Transfektionsreagenzien für das Einschleusen von Fremd-DA in Zielzellinien verwendet. Gute Transfektionsreagenzien zeichnen sich durch eine hohe Transfektionseffizienz,
5 Zusammenfassung Kationische Lipide werden als sog. Transfektionsreagenzien für das Einschleusen von Fremd-DA in Zielzellinien verwendet. Gute Transfektionsreagenzien zeichnen sich durch eine hohe Transfektionseffizienz,
Biologie für Mediziner
 Biologie für Mediziner - Zellbiologie 1 - Prof. Dr. Reiner Peters Institut für Medizinische Physik und Biophysik/ CeNTech Robert-Koch-Strasse 31 Tel. 0251-835 6933, petersr@uni-muenster.de Dr. Martin Kahms
Biologie für Mediziner - Zellbiologie 1 - Prof. Dr. Reiner Peters Institut für Medizinische Physik und Biophysik/ CeNTech Robert-Koch-Strasse 31 Tel. 0251-835 6933, petersr@uni-muenster.de Dr. Martin Kahms
Uni Konstanz - Kristallinität als Schlüsselfunktion
 Powered by Seiten-Adresse: https://www.gesundheitsindustriebw.de/de/fachbeitrag/aktuell/uni-konstanz-kristallinitaetals-schluesselfunktion/ Uni Konstanz - Kristallinität als Schlüsselfunktion Nachwachsende
Powered by Seiten-Adresse: https://www.gesundheitsindustriebw.de/de/fachbeitrag/aktuell/uni-konstanz-kristallinitaetals-schluesselfunktion/ Uni Konstanz - Kristallinität als Schlüsselfunktion Nachwachsende
Posttranskriptionale RNA-Prozessierung
 Posttranskriptionale RNA-Prozessierung Spaltung + Modifikation G Q Spleissen + Editing U UUU Prozessierung einer prä-trna Eukaryotische messenger-rna Cap-Nukleotid am 5 -Ende Polyadenylierung am 3 -Ende
Posttranskriptionale RNA-Prozessierung Spaltung + Modifikation G Q Spleissen + Editing U UUU Prozessierung einer prä-trna Eukaryotische messenger-rna Cap-Nukleotid am 5 -Ende Polyadenylierung am 3 -Ende
Entstehung der Erde und Lebewesen Entwicklung der Zellforschung Kennzeichen des Lebens Grundbaupläne
 Entstehung der Erde und Lebewesen Entwicklung der Zellforschung Kennzeichen des Lebens Grundbaupläne Kennzeichen einer lebenden Zelle Zellen entstehen aus Zellen jede Zelle hat einen kompletten Satz Erbanlagen
Entstehung der Erde und Lebewesen Entwicklung der Zellforschung Kennzeichen des Lebens Grundbaupläne Kennzeichen einer lebenden Zelle Zellen entstehen aus Zellen jede Zelle hat einen kompletten Satz Erbanlagen
Übungsaufgaben zu Aminosäuren, Peptiden, Proteinen und DNA
 Übungsaufgaben zu Aminosäuren, Peptiden, Proteinen und DNA 1. Aminosäuren a) Benennen Sie die folgenden Aminosäuren nach den Regeln der IUPAC: Ala, Gly, Ile, Thr b) Die Aminosäuren in Proteinen sind α-aminocarbonsäuren
Übungsaufgaben zu Aminosäuren, Peptiden, Proteinen und DNA 1. Aminosäuren a) Benennen Sie die folgenden Aminosäuren nach den Regeln der IUPAC: Ala, Gly, Ile, Thr b) Die Aminosäuren in Proteinen sind α-aminocarbonsäuren
Synthese von eukaryotischen RNA-Modifikationen
 Dissertation zur Erlangung des Doktorgrades der Fakultät für Chemie und Pharmazie der Ludwig-Maximilians-Universität München Synthese von eukaryotischen RNA-Modifikationen und Quantifizierung nicht kanonischer
Dissertation zur Erlangung des Doktorgrades der Fakultät für Chemie und Pharmazie der Ludwig-Maximilians-Universität München Synthese von eukaryotischen RNA-Modifikationen und Quantifizierung nicht kanonischer
Enzyme SPF BCH am
 Enzyme Inhaltsverzeichnis Ihr kennt den Aufbau von Proteinen (mit vier Strukturelementen) und kennt die Kräfte, welche den Aufbau und die Funktion von Enzymen bestimmen... 3 Ihr versteht die Einteilung
Enzyme Inhaltsverzeichnis Ihr kennt den Aufbau von Proteinen (mit vier Strukturelementen) und kennt die Kräfte, welche den Aufbau und die Funktion von Enzymen bestimmen... 3 Ihr versteht die Einteilung
Proteinbestimmung. Diese Lerneinheit befasst sich mit der Beschreibung von verschiedenen Methoden der Proteinbestimmung mit den folgenden Lehrzielen:
 Diese Lerneinheit befasst sich mit der Beschreibung von verschiedenen Methoden der mit den folgenden Lehrzielen: Verständnis der Prinzipien der sowie deren praktischer Durchführung Unterscheidung zwischen
Diese Lerneinheit befasst sich mit der Beschreibung von verschiedenen Methoden der mit den folgenden Lehrzielen: Verständnis der Prinzipien der sowie deren praktischer Durchführung Unterscheidung zwischen
und Reinstruktur Die Sekundärstruktur ist die Anordnung der Aminosäurenkette, wobei man in zwei Arten unterscheidet: o Faltblatt- oder β- Struktur
 Aufbau von Proteinen insbesondere unter Betrachtung der Primär-,, Sekundär-,, Tertiär-,, Quartär-,, Supersekundär- und Reinstruktur Primärstruktur Unter Primärstruktur versteht man in der Biochemie die
Aufbau von Proteinen insbesondere unter Betrachtung der Primär-,, Sekundär-,, Tertiär-,, Quartär-,, Supersekundär- und Reinstruktur Primärstruktur Unter Primärstruktur versteht man in der Biochemie die
Synthese, Charakterisierung und Untersuchung von schwerlöslichen Harnstoffderivaten als Grundlage für Düngemittel
 Synthese, Charakterisierung und Untersuchung von schwerlöslichen Harnstoffderivaten als Grundlage für Düngemittel Inaugural-Dissertation zur Erlangung der Doktorwürde des Fachbereichs Biologie, Chemie
Synthese, Charakterisierung und Untersuchung von schwerlöslichen Harnstoffderivaten als Grundlage für Düngemittel Inaugural-Dissertation zur Erlangung der Doktorwürde des Fachbereichs Biologie, Chemie
Eukaryotische messenger-rna
 Eukaryotische messenger-rna Cap-Nukleotid am 5 -Ende Polyadenylierung am 3 -Ende u.u. nicht-codierende Bereiche (Introns) Spleißen von prä-mrna Viele Protein-codierende Gene in Eukaryoten sind durch nicht-codierende
Eukaryotische messenger-rna Cap-Nukleotid am 5 -Ende Polyadenylierung am 3 -Ende u.u. nicht-codierende Bereiche (Introns) Spleißen von prä-mrna Viele Protein-codierende Gene in Eukaryoten sind durch nicht-codierende
UAufgabe 12: (evolutiv konservierte Aminosäuren)
 UAufgabe 12: (evolutiv konservierte Aminosäuren) Aufgabenstellung Wählen Sie zur Darstellung evolutiv konservierter Aminosäure-Positionen in "1lla" eine ihnen sinnvoll erscheinende Anfärbung. Exportieren
UAufgabe 12: (evolutiv konservierte Aminosäuren) Aufgabenstellung Wählen Sie zur Darstellung evolutiv konservierter Aminosäure-Positionen in "1lla" eine ihnen sinnvoll erscheinende Anfärbung. Exportieren
