CHARAKTERISIERUNG VON STOFFEN
|
|
|
- Etta Müller
- vor 6 Jahren
- Abrufe
Transkript
1 1 KSO CHARAKTERISIERUNG VON STOFFEN Skript Charakterisierung von Stoffen V1.0 07/13 Bor
2 2 INHALTSVERZEICHNIS "CHARAKTERISIERUNG VON STOFFEN" 1. Einfache Möglichkeiten zur Unterscheidung von Stoffen Typen von Stoffeigenschaften Beispiele von Stoffeigenschaften Umgang mit dem Bunsenbrenner Aggregatzustände Schmelz- und Siedetemperatur Die Siedetemperatur Die Schmelztemperatur Dichte Dichtebestimmung eines Feststoffes Dichtebestimmung einer Flüssigkeit Dichtebestimmung eines Gases Löslichkeit Kelvin- und Celsiusskala Zusammenfassung Stoffeigenschaften Stoffklassen Eigenschaftskombination und Steckbrief Reinstoffe und Stoffgemische Gemenge Suspension Emulsion Nebel Schaum Rauch Heterogen vs. homogen... 24
3 3 1. Einfache Möglichkeiten zur Unterscheidung von Stoffen Wir kommen täglich mit einer Vielzahl von Gegenständen in Berührung. Sie haben alle eine bestimmte Form oder Gestalt. Gegenstände bestehen aus unterschiedlichen Materialien, solche Materialien werden in der Chemie Stoffe genannt. Zur genauen Beschreibung eines Gegenstands gibt man sowohl den Stoff als auch seine Form an: Man spricht von einem Becherglas (also einem Becher aus Glas), einem Eisendraht (ein Draht aus Eisen) oder von einem Holzstab (ein Stab aus Holz). Wir können den Begriff Stoff also folgendermassen definieren: Stoffe = unterschiedliche Materialien (Glaskugel, Eisendraht, etc,) Neben den Feststoffen gehören auch die Flüssigkeiten und die Gase zu den Stoffen. Vergleicht man verschiedene Stoffe miteinander, fällt auf, dass sie unterschiedliche Eigenschaften besitzen. Diese Stoffeigenschaften sind unabhängig von der Form und der Grösse der Stoffportionen. Aufgabe I Notieren Sie sich die gezeigten Gegenstände. Becherglas, Eisendraht, Holzstab 1.1 Typen von Stoffeigenschaften In den Naturwissenschaften unterscheidet man zwei Typen von Stoffeigenschaften: Lassen sich die Eigenschaften eines Stoffes feststellen, ohne dass dabei eine stoffliche Veränderung am untersuchten Stoff eintritt, spricht man von physikalischen Eigenschaften. Wandelt sich der Stoff bei der Feststellung seiner Eigenschaften hingegen um, so spricht man von chemischen Eigenschaften. Sowohl die einen wie auch die anderen Eigenschaften sind abhängig von äusseren Bedingungen wie Luftdruck, Temperatur, Anwesenheit anderer Stoffe etc. In der Folge wollen wir einige Beispiele von Stoffeigenschaften kennenlernen. Ich werde euch diese Beispiele anhand von Objekten erklären, damit ihr lernt, mit welchen Kriterien man chemische Stoffe unterscheiden kann.
4 4 1.2 Beispiele von Stoffeigenschaften Aufgabe II Beobachten Sie die gezeigten Beispiele und notieren Sie die neuen Erkenntnisse in den dafür vorgezeichneten Kästchen. Als erstes nehmen wir das Aussehen. Untersucht man einen Stoff, nimmt man zuerst seine Farbe wahr. Metalle haben neben ihrer Farbe auch einen typischen Glanz, der jedoch häufig erst nach dem Bearbeiten der Oberfläche zum Vorschein kommt. Andere Stoffe kann man an ihrer Kristallform erkennen. Viele Stoffe kann man allerdings an ihrem Aussehen allein nicht sicher erkennen: Puderzucker zum Beispiel lässt sich kaum von anderen weissen Pulvern unterscheiden. Stoffeigenschaft Unterscheidungspunkte Beispiele Aussehen Farbe, Glanz, Kristallform Glühbirnen, Klammern Gesteine, die glänzen Gesteine, weisser Kristall Ein weiteres Beispiel wie man Stoffe unterscheiden kann, ist der Geschmack. Viele Stoffe wie z.b. Salz und Zucker erkennt man an ihrem besonderen Geschmack. Es gibt aber zahlreiche Stoffe, die Vergiftungen verursachen, selbst wenn sie in geringen Mengen in den Mund gelangen. Deshalb ist es sehr gefährlich, den Geschmack unbekannter Stoffe zu untersuchen. Stoffeigenschaft Unterscheidungspunkte Wichtig!! Geschmack Süss, sauer, bitter, etc. Gefährlich! Da ev. giftig Geruch gilt auch als ein Beispiel. Manche Gase oder Stoffe, die Dämpfe freisetzen, haben einen für sie typischen Geruch. Viele Stoffe sind jedoch gesundheitsschädlich beim Einatmen. Daher muss man bei Geruchsproben sehr vorsichtig sein. Um kleine Stoffportionen in die Nase zu bekommen, fächelt man sie sich mit der Hand zu. Stoffeigenschaft Beispiele Richtige Anwendung Geruch Diethylether Zufächeln mit Hand
5 5 Die Verformbarkeit ist eine weitere Stoffeigenschaft, womit wir Stoffe unterscheiden können. Wachs oder Knetmasse lassen sich mit den Händen formen, sie sind verformbar. Versucht man, dünne Stäbe aus Glas oder Eisen zu biegen, zeigen sie ein unterschiedliches Verhalten: Glas ist spröde und zerbricht, Eisen dagegen ist biegsam. Gegenstände aus Gummi sind zwar verformbar, nehmen aber anschliessend wieder ihre ursprüngliche Gestalt an. Gummi ist elastisch. Stoffeigenschaft Verformbarkeit Unterschiedliche Typen mit Beispielen Verformbar => Wachs, Knetmasse / spröde => Glas Biegsam => Eisen / elastisch => Gummi Eine weitere Eigenschaft ist die Härte. Blei und Kerzenwachs lassen sich leicht ritzen; sie sind weich. Bei anderen Stoffen wie Glas oder Stahl gelingt das nicht so einfach; sie weisen eine grössere Härte auf. Stoffeigenschaft Wodurch wird unterschieden? Beispiele Härte Weich oder hart Blei, Kerzenwachs = weich Glas, Stahl = hart Welches ist der härteste Stoff, den wir kennen? Diamant Auch mit der elektrischen Leitfähigkeit lassen sich Stoffe unterscheiden. Untersucht man einen Eisendraht, einen Holzstab und eine Bleistiftmine auf ihre elektrische Leitfähigkeit, stellt man fest, dass nur der Eisendraht und die Graphitmine (Bleistift) den elektrischen Strom leiten. Die Leitfähigkeit für den elektrischen Strom ist eine typische Eigenschaft der Metalle und des Graphits. Stoffeigenschaft Wodurch wird unterschieden? Beispiele Elektrische Leitfähigkeit Elektrisch leitfähig oder Metalle, Graphit = leitfähig nicht Holz, Papier = nicht Auch mit einem Magneten lassen sich Unterschiede in den Eigenschaften der Stoffe bestimmen. Magnetisch nennt man Stoffe, die von einem Magneten angezogen werden.
6 6 Stoffeigenschaft Wodurch wird unterschieden? Beispiele Magnetismus Ob etwas vom Magneten Metalle Eisen, Cobalt und angezogen wird Nickel; Graphit = magnetisch Auch das Verhalten beim Erhitzen kann ein erster Hinweis darauf sein, um welchen Stoff es sich handelt. Manche äusserlich ähnlich aussehende Stoffe lassen sich voneinander unterscheiden, wenn sie erhitzt werden. Hält man einen Glasstab in die heisse Zone einer Flamme, glüht er nach einiger Zeit. Er wird weich und verformbar. nach dem Abkühlen zeigt sich, dass alle Stoffeigenschaften des Glases erhalten geblieben sind. Nur seine Form hat sich verändert. Einen solchen Vorgang, bei dem sich die Eigenschaften eines Stoffs nur vorübergehend ändern, bezeichnet man als physikalischen Vorgang. Ein Stab aus Plexiglas, äusserlich dem Glasstab zum verwechseln ähnlich, brennt mit russender Flamme, wenn man ihn erhitzt. Es entsteht mindestens ein neuer Stoff. Man spricht in diesem Fall von einem chemischen Vorgang. Stoffeigenschaft Wodurch wird unterschieden? Beispiele Verhalten beim Erhitzen Ändert nur die Form (physikalisch) oder entsteht min. 1 neuer Stoff (chemisch) Erhitzen von Glas (physikalisch); erhitzen von Plexiglas (chemisch) Viele Stoffe beginnen zu brennen, wenn man eine Flamme an sie hält: Ein Stück Papier entflammt auf diese Weise sofort. Nähert man einer Porzellanschale, die etwas Benzin enthält, einen brennenden Holzspan, springt die Flamme bereits über, bevor der Span die Flüssigkeit berührt. Zum Entzünden eines Stoffes ist nicht unbedingt eine Flamme nötig. Brennbare Stoffe können sich von allein entzünden, wenn sie eine bestimmte Temperatur, ihre Zündtemperatur, erreicht haben. Stoffeigenschaft Erklärung der Eigenschaft Beispiele Brennbarkeit Beginnt etwas zu brennen Benzin beginnt zu brennen, ohne direkten Kontakt mit wenn man mit dem glühenden Feuer? Holzspan nahe daran geht
7 7 2. Umgang mit dem Bunsenbrenner Das Arbeiten mit dem Brenner ist nicht ganz ungefährlich, denn unverbrannt ausströmendes Gas kann mit Luft ein explosives Gemisch bilden. Es ist deshalb wichtig, Aufbau und Wirkungsweise des Gasbrenners zu kennen, um vorschriftsgemäss mit ihm umgehen zu können. Aufgabe III Notieren Sie die von der Lehrperson diktierten Punkte zum Entzünden eines Bunsenbrenners 1. Prüfe, ob die Luftzufuhr geschlossen ist. 2. Setze eine Schutzbrille auf und halte Streichhölzer oder Funkengeber bereit. 3. Öffne zuerst die Gaszufuhr am Tisch, dann am Brenner und entzünde das ausströmende Gas sofort (!). 4. Regulierung des Brenners. Der Brenner zeigt nun eine leuchtende Flamme. Ihre Grösse kann durch die Verringerung oder Verstärkung der Gaszufuhr geregelt werden. Wird die Luftzufuhr geöffnet, entsteht eine fast farblose, nichtleuchtende Flamme mit blauem Kern. Bei dieser Einstellung ist die Flamme des Brenners am heissesten. Bei einem kurzen Unterbruch der Arbeit: Schliesse die Sauerstoffzufuhr und reduziere am Brenner die Gaszufuhr auf das Minimum (Sparflamme). Nach Abschluss der Arbeit: Schliesse die Sauerstoffzufuhr. Schliesse den Gashahn am Tisch. Aufgabe IV Beobachten Sie die Handhabung mit dem Bunsenbrenner und beschriften Sie die 6 Punkte auf der folgenden Zeichnung (Lösungen siehe Zusatzblatt)
8 8 Aufgabe V (Lösungen siehe Zusatzblatt) Kennzeichnen Sie den Weg des Gases durch Pfeile in blauer Farbe. Aufgabe VI (Lösungen siehe Zusatzblatt) Kennzeichnen Sie den Weg der Luft durch Pfeile in roter Farbe.
9 9 3. Aggregatzustände In der Chemie gibt es drei klassische Aggregatzustände. Unter diesem Begriff versteht man den physikalischen Zustand, also die Erscheinungsform eines Stoffes. Um diese drei Aggregatzustände zu unterscheiden, betrachten wir das Beispiel Wasser. Wasser kann in drei verschiedenen, von sich physikalisch unterschiedlichen Formen, auftreten. Erscheinungsform von Wasser Aggregatzustand Eis Wasser Wasserdampf Fest Flüssig Gasförmig Im Weiteren existieren in der Chemie auch bestimmte Begriffe für die jeweiligen Übergänge zwischen den Aggregatzuständen. Aus den drei Aggregatzuständen resultieren 6 verschiedene Übergänge, nämlich folgende: Übergang Benennung des Übergangs Fest-flüssig Fest-gasförmig Flüssig-fest Flüssig-gasförmig Gasförmig-fest Gasförmig-flüssig Schmelzen Sublimieren Erstarren Verdampfen Resublimieren Kondensieren Wenn wir die neu gelernten Begriffe auf das Beispiel Wasser anwenden, so erhalten wir folgendes Dreiecks-Schema :
10 10 Nicht alle Stoffe können aber in den genannten drei Aggregatzuständen vorkommen. Ein Beispiel dafür ist sicher der Zucker. Aufgabe VII: Notieren Sie alle Beobachtungen aus dem vorgezeigten Experiment und versuchen Sie zu erklären, wieso Zucker nicht in das normale Schema passt. Beobachtungen: Zucker wird braun, es riecht nach Caramel. Erklärung: Aus Zucker wird ein neuer Stoff (Caramel) und daher ändern nicht die Aggregatzustände, sondern es entstehen neue Stoffe. Ein weiteres Beispiel für einen Stoff, der nicht in allen drei Aggregatzuständen vorkommt, ist Holz. Als Kurzbezeichnungen der Aggregatzustände werden folgende Symbole verwendet: s für fest (vom englischen Wort solid ) l für flüssig (vom englischen Wort liquid ) g für gasförmig (vom englischen Wort gaseous )
11 11 Wenn wir Wasser einige Zeit in einem geöffneten Gefäss stehen lassen, stellen wir fest, dass es allmählich weniger wird. Es verdunstet. Wasser kann also, auch ohne zu sieden, in den gasförmigen Zustand übergehen. Der in der Luft enthaltene Wasserdampf wird Luftfeuchtigkeit genannt. Als Abschluss in diesem Kapitel wollen wir noch zwei Beispiele von Übergängen aus dem Alltag anschauen: Nasse Wäsche, die im Winter im Freien zum Trocknen an die Leine gehängt wird, erstarrt zuerst durch gefrierendes Wasser und trocknet dann, ohne dass das Eis schmilzt. Aus Eis ist unter Umgehung des flüssigen Zustands Wasserdampf geworden. Diesen Vorgang nennt man Sublimation. Auch Iod zeigt das gleiche Phänomen, denn die Kristalle bilden bei Erwärmung den violetten Ioddampf. (zeigen Bilder) An kalten Tagen bildet sich oft Raureif. Dieser entsteht dadurch, dass gasförmiges Wasser (Luftfeuchtigkeit) direkt zu festem Eis wird. Man bezeichnet diesen Vorgang als Resublimation. Änderungen des Aggregatzustands betreffen immer nur die Zustandsform der Stoffe. Es werden keine neuen Stoffe gebildet. Daher handelt es sich um physikalische und nicht um chemische Vorgänge. Aufgabe VIII: Wenn an manchen schönen Wintertagen die Sonne auf schneebedeckte Felder scheint, kann man beobachten, dass immer mehr Schnee verschwindet, obwohl die Temperaturen bei Tag und Nacht weit unter der Gefriertemperatur liegen. Erklären Sie, was tagsüber geschieht. Eis sublimiert unter dem Einfluss der wärmenden Sonnenstrahlen. Aufgabe IX: Erklären Sie das Auftreten von Nebel beim Ausatmen in kalter Luft. Wasserdampf kondensiert an der kalten Luft zu Wassertropfen, welche einen feinen Nebel bilden.
12 12 4. Schmelz- und Siedetemperatur In der Chemie unterscheidet man zwischen qualitativen und quantitativen Eigenschaften. Erstere Eigenschaft beruht auf die Beschaffenheit der Stoffe, die zweite Eigenschaft auf die Messbarkeit von Eigenschaften. Wir wollen im Folgenden die beiden Eigenschaften mit Beispielen belegen: Qualitative Eigenschaften können nicht immer eindeutig beschrieben werden. Als Beispiele solcher Eigenschaften gelten z.b. der Geruch oder die Farbe. Für die Kennzeichnung von Stoffen werden deshalb Eigenschaften bevorzugt, die messbar sind und mit Zahlen belegt werden können. Zu den quantitativen Eigenschaften gehören z.b. die Schmelz- und die Siedetemperatur oder die Dichte. Wir wollen uns im Folgenden mit zwei messbaren Eigenschaften auseinandersetzen, der Siede- und der Schmelztemperatur. 4.1 Die Siedetemperatur Um die Siedetemperatur des Wassers (H2O) zu bestimmen, erhitzt man dieses und verfolgt den Temperaturverlauf. Im gezeigten Experiment siedete das Wasser bei ca. 98 C. Der literarische Wert für die Siedetemperatur von Wasser liegt bei 100 C. Aufgabe X: Was könnten Gründe sein für die Abweichung in unserem Experiment? Luftdruck, ungenaues Messgerät Aufgabe XI: Wo im Bild unten ist die Siedetemperatur eingezeichnet? Versuchen Sie die wichtigsten Begriffe einzuzeichnen. Um Werte miteinander vergleichen zu können, gibt man diese bei Normdruck an. Dies entspricht dem mittleren Luftdruck auf der Höhe des Meeresspiegels (1013 hpa). In höheren Lagen ist der mittlere Luftdruck geringer als auf Meereshöhe: Schon 280m über dem
13 13 Meeresspiegel siedet das Wasser bei 99 C, und auf dem Mont Blanc (4807m.ü.M.) siedet es bereits bei 84 C. Die Siedetemperaturen anderer Flüssigkeiten werden auf entsprechende Weise ermittelt. Siedetemperatur und Kondensationstemperatur stimmen überein: Wasser z.b. siedet bei 100 C; Wasserdampf kondensiert bei der gleichen Temperatur zu flüssigem Wasser. 4.2 Die Schmelztemperatur Zur Bestimmung der Schmelztemperatur eines Feststoffes wird im Reagenzglas eine kleine Portion des Stoffs erwärmt. Bei einer bestimmten Temperatur setzt der Schmelzvorgang ein (Grafik ähnlich wie Siedetemperatur). Von da an erfolgt kein weiterer Anstieg der Temperatur, bis sämtlicher Feststoff geschmolzen ist. Erst dann nimmt die Temperatur des Stoffs weiter zu. Zur Kontrolle kann bei langsamer Abkühlung die Erstarrungstemperatur gemessen werden. Aufgabe XII: Zeichnen Sie ein vollständiges Temperatur-Zeit-Diagramm für die Umwandlung von Eis zu Wasser und zu Wasserdampf. Beschriften Sie die Grafik mit folgenden Begriffen: Schmelzvorgang, Schmelztemperatur, Siedevorgang, Siedetemperatur. (Smp(H2O) = 0 C, Sdp (H2O) = 100 C) Aufgabe XIII: Welche der aufgeführten Stoffe sind bei Zimmertemperatur (20 C) fest, flüssig und welche gasförmig? Überprüfen sie anhand der Schmelz- und Siedetemperaturen.
14 14 Stoff Schmelztemperatur Siedetemperatur Aggregatzustand bei 20 C Alkohol -117 C 78 C Flüssig Blei 327 C 1740 C Fest Butan -139 C -1 C Gasförmig Eisen 1535 C 2750 C Fest Ether -116 C 34 C Flüssig Glycerin 18 C 290 C Flüssig Kochsalz 800 C 1460 C Fest Naphthalin 80 C 218 C Fest Quecksilber -39 C 356 C Flüssig Sauerstoff -219 C -183 C Gasförmig Schwefel 119 C 444 C Fest Aufgabe XIV: Erklären Sie, wieso in Polargebieten keine Quecksilberthermometer verwendet werden können, sondern nur solche mit gefärbtem Alkohol. Quecksilber (Hg) gefriert in Polargebieten, da die Erstarrungstemperatur bei -39 C liegt. Alkohol gefriert nicht und bleibt daher flüssig.
15 15 5. Dichte Aufgabe XV: (Text siehe Beilage) Lösen Sie den folgenden Lückentext mithilfe der ausgeteilten Textunterlagen Hält man zwei gleich grosse Stücke Natrium und Platin in der Hand, so stellt man fest, dass das eine Stück viel schwerer als das andere ist. Woher kommt dieser Unterschied? Um das erklären zu können, muss man in der Chemie eine neue Grösse einführen, nämlich die Dichte. Um die Dichte berechnen zu können, braucht man Angaben über folgende zwei Grössen: Masse und Volumen. Die Dichte (griechisches Zeichen ρ) ist das Verhältnis von Masse zu Volumen. Man schreibt diese Formel abgekürzt mit folgenden Symbolen: ρ = m/v Wenn man von einem beliebigen Stoff verschiedene Volumina abfüllt und jeweils deren Gewicht misst, so entsteht eine Grafik, bei der man als Lösung eine Gerade erhält. Das Verhältnis (Quotient) der oben beschriebenen Grössen ist also konstant für einen bestimmten Stoff. Man sagt auch, dass die Gerade immer die gleiche Steigung hat. Die Einheit der Dichte ist g/cm 3. Man kann sie auch umformen z.b. in kg/dm 3 oder mg/mm Dichtebestimmung eines Feststoffes Wenn wir einen Stoff haben, der unförmig ist, so bestimmen wir die Dichte durch Wasserverdrängung. Wir gehen dabei folgendermassen vor: 1. Wir bestimmen die Masse der Stoffportion 2. Wir legen ein bestimmtes Volumen einer Flüssigkeit in einem Messzylinder vor. 3. Wir geben den unförmigen Stoff in die Flüssigkeit und messen das für ihn spezifische Volumen. 4. Wir können anschliessend die Dichte aus der berechneten Masse und dem bestimmten Volumen berechnen. 5.2 Dichtebestimmung einer Flüssigkeit Zur Bestimmung der Dichte einer Flüssigkeit nehmen wir z.b. einen Messzylinder (siehe Bild rechts) und messen das Gewicht dieses leeren Objekts. Anschliessend geben wir ein bestimmtes Volumen unserer Flüssigkeit rein und messen das Gewicht des vollen Zylinders. Wenn wir die beiden Gewichte miteinander vergleichen, so können wir auf die
16 16 Masse der Flüssigkeit schliessen, indem wir mvoll mleer berechnen. Die Dichte lässt sich dann einfach berechnen, nämlich aus dem Quotient der berechneten Masse über das bestimmte Volumen. 5.3 Dichtebestimmung eines Gases Die Dichte von Gasen wird mit einer Gaswägekugel (siehe rechts) bestimmt. Da diese Methode relativ kompliziert ist und man sie selten braucht, werden wir nicht weiter darauf eingehen. Aufgabe XVI: Ein Messzylinder mit einer Masse von 54 g wird mit 65 cm 3 Alkohol gefüllt. Die Waage zeigt nun g an. Berechnen Sie die Dichte des Alkohols. malkohol = mvoll mleer = 118.3g 54g = 64.3g VAlkohol = 65cm 3 = 65mL ρ = m/v = 64.3g / 65cm 3 = 0.99g/cm 3. Aufgabe XVII: Blei hat eine Dichte von ρ=11,4 g/cm 3. Welche Masse hat ein Bleistück mit dem Volumen 6 cm 3? Geg.: ρ = 11.4g/cm 3, V = 6cm 3 => m = ρ*v = 68.4g Aufgabe XVIII: Eine Gaswägekugel wird evakuiert (luftleer gepumpt) und gewogen. Nach dem Einsaugen von 300 cm3 Argon wird die Kugel erneut gewogen. Die Massenzunahme beträgt 0.35 g. Berechnen Sie die Dichte von Argon. Geg.: V = 300cm 3 ; m= 0.35g => ρargon = 0.35g/300cm 3 = g/cm 3.
17 17 6. Löslichkeit Aufgabe XIX: Lösen Sie die folgenden Aufgaben mithilfe der ausgeteilten Textunterlagen. a) Welche Aggregatzustände löst Wasser auf? Geben Sie je ein Beispiel an. Feststoffe (Salze); Flüssigkeiten (Alkoholische Getränke); Gase (CO2) b) Was ist ein Lösungsmittel? Flüssigkeiten, die Stoffe lösen. Sie lösen Feststoffe, Flüssigkeiten und Gase. Nicht jedes Lösungsmittel kann jeden Stoff lösen. c) Welche Stoffe lösen sich gut in Wasser, welche sind schwerlöslich und welche sind unlöslich in Wasser? Nennen Sie Beispiele. Leicht löslich (Zucker, Kochsalz); schwerlöslich (Gips, Kalk); unlöslich (Glas, Schwefel). d) Definieren Sie die Löslichkeit. Die Löslichkeit gibt an, wie viel Gramm eines Stoffs sich bei einer bestimmten Temperatur in 100 Gramm Lösungsmittel lösen. e) Was bedeutet eine gesättigte Lösung? Die Lösung nimmt keinen weiteren Stoff mehr auf. Der überschüssige Feststoff setzt sich als Bodenkörper ab. f) Sehen wir einen Unterschied, wenn wir 80g Natriumchlorid (Kochsalz) und 80g Kaliumnitrat je einmal in kaltem Wasser und einmal in heissem Wasser lösen? Erklären Sie so ausführlich wie möglich. Ja, Kochsalz löst sich immer gleich viel (ca. 36g/1006 Wasser) egal bei welchen Temperaturen. Kaliumnitrat löst sich mehr bei wärmeren Temperaturen als bei kälteren Temperaturen. g) Wie kann man grosse Kristalle, wie kann man kleine Kristalle aus Salzlösungen herstellen? Erklären Sie. Grosse Kristalle = langsames Abkühlen; kleine Kristalle = schnelles Abkühlen. h) Wie kann man Kristalle züchten? Impfkristall an einem Faden in eine gesättigte Lösung hängen. Aufgabe XX: Alkohol löst sich gut in Wasser. Warum ist in keinem Tabellenwerk seine Löslichkeit angegeben? Man kann die Löslichkeit von Alkohol nicht bestimmen. Die Löslichkeit von Alkohol würde angeben, wie viel Gramm Alkohol sich in 100g Wasser lösen. Diese Angabe ist nicht möglich, da Alkohol sich unbegrenzt in Wasser löst.
18 18 Aufgabe XXI: In 100g Meerwasser sind 3.5g Salz enthalten. Geben Sie den Massenanteil des Salzes im Meerwasser an. 3.5g Salz in 100g Meerwasser ergeben einen Massenanteil des Salzes von 3.5%. Aufgabe XXII: Nennen Sie je drei in Wasser leicht lösliche, schwerlösliche und unlösliche Stoffe. Leicht löslich: Zucker, Kochsalz, Kaliumnitrat Schwer lösliche: Gips, Löschkalk, Kalkstein Unlöslich: Sand, Schwefel, Eisen. Aufgabe XXIII: Wie viel Gramm Kaliumnitrat müssen mindestens zu 50g Wasser gegeben werden, damit man bei 40 C (bzw. 60 C) eine gesättigte Lösung erhält? Um bei 40 C (bzw. 60 C) eine gesättigte Kaliumnitratlösung zu erhalten, müssen etwa 30g (bzw. etwa 50g) Kaliumnitrat zu 50g Wasser gegeben werden. Aufgabe XXIV: Man löst Kaliumnitrat in 100g Wasser mit einer Temperatur von 60 C, bis sich ein Bodensatz bildet. Nachdem man diese gesättigte Lösung filtriert hat, lässt man sie auf 20 C abkühlen. Wie viel Kaliumnitrat wird aus der Lösung auskristallisieren? Der Löslichkeitskurve auf dem Beiblatt entnehmen wir, dass sich bei 60 C etwa 103g Kaliumnitrat in 100g Wasser lösen. Bei 20 C lösen sich nur etwa 38g. Beim Abkühlen von 60 C auf 20 C kristallisieren also 103g-38g = 65g Kaliumnitrat aus. Aufgabe XXV: Eine warmgesättigte Lösung von Alaun in Wasser wird im verschlossenen Gefäss über Nacht stehen gelassen. Am Morgen ist ein Bodensatz sichtbar. Eine daneben stehende, gesättigte Kochsalzlösung blieb unter denselben Bedingungen unverändert. Erklären Sie diesen Unterschied. Die Löslichkeit von Alaun ist temperaturabhängig, die von Kochsalz (praktisch) nicht. Da sich in der über Nach abgekühlten Alaunlösung weniger Alaun löst als in der heissen, ist das überschüssige Salz auskristallisiert.
19 19 7. Kelvin- und Celsiusskala Kelvinskala Celsiusskala Unterer Fixpunkt 0 K = tiefste mögl. Temp. 0 C = Smp Eis Oberer Fixpunkt K = Temperatur am Tripelpunkt (Wasser) 100 C = Sdp Wasser Für die Umrechnung von Kelvin in Celsius oder umgekehrt werden folgende Umrechnungsregeln angewendet: 1K = C Anders Celsius ( ) 1 C = K William Thomson ( ) Aufgabe XXVI: Rechnen Sie folgende Werte in die jeweils andere Temperaturskala um: a) 25 C = K c) -13 C = K b) 144K = C d) 290K = C 8. Zusammenfassung Stoffeigenschaften Aufgabe XXVII: Finden Sie die gesuchten Stoffe heraus. 1. Um welchen Stoff handelt es sich? 2. Um welchen Stoff handelt es sich? - Farbe: Schwarz - Klang: hell, höher als Kupfer - elektr. LF: gut - Wärmeleitfähigkeit: gut Kohle - Aggregatzustand: fest - Schmelzpunkt: 1535 C - Glanz: matt - Elektr. LF: gut Eisen - Dichte: > 5000g/cm 3 3. Um welchen Stoff handelt es sich? 4. Um welchen Stoff handelt es sich? - Farbe: gelblich, durchsichtig - Farbe: weiss - elektr. LF: mittel, zersetzt sich - Aggregatzustand: fest Zitronensäure - Aggregatzustand: flüssig - Elektr. LF: keine Porzellan - Geschmack: sauer, fruchtig - Wärmebeständigkeit: glüht beim Erhitzen, sonst nichts - Dichte: ähnlich wie Wasser
20 20 9. Stoffklassen Vergleicht man die Steckbriefe (siehe 10. Eigenschaftskombination und Steckbrief) einzelner Stoffe, findet man bei verschiedenen Stoffen gemeinsame Eigenschaftskombinationen. Diese Stoffe kann man zu einer Stoffklasse zusammenfassen. Stoffe, die niedrige Schmelz- und Siedetemperaturen haben, werden zur Gruppe der flüchtigen Stoffe gerechnet. Die meisten dieser Stoffe sind bei Zimmertemperatur flüssig oder gasförmig und leiten den elektrischen Strom nicht. In diese Stoffklasse gehören z.b. Wasser, Alkohol. Stoffe, die wie Kochsalz Kristalle bilden können, hart und spröde sind und eine hohe Schmelztemperatur haben, zählt man zur Stoffklasse der Salze. Viele Salze lösen sich in Wasser, auch wenn ihre Löslichkeiten recht unterschiedlich sind. Die wässrigen Lösungen der Salze können wie ihre Schmelzen den elektrischen Strom leiten. Ausser Kochsalz gehören in diese Klasse z.b. Kaliumnitrat, Alaun und Kupfersulfat. Eine weitere Stoffklasse bilden die Metalle. Diese Stoffe haben als kompakte Stücke einen typischen Oberflächenglanz, sie sind verformbar durch Hämmern, Biegen, Walzen oder Ziehen, sie leiten den elektrischen Strom und zeigen eine gute Wärmeleitfähigkeit. In diese Stoffklasse gehört neben den bekannten Metallen wie Eisen, Kupfer, Gold und Silber auch das Quecksilber, das einzige bei Zimmertemperatur flüssige Metall. Wichtig ist, dass nicht alle Stoffe in eine dieser drei Stoffklassen eingeteilt werden können!
21 Eigenschaftskombination und Steckbrief Wir haben bisher zahlreiche Stoffeigenschaften kennen gelernt. Manche treffen allerdings für mehrere Stoffe zu. Deshalb ist ein einzelner Stoff durch die Angabe von nur einer Stoffeigenschaft meist nicht zu identifizieren. Um einen Stoff eindeutig zu beschreiben, muss man mehrere und für den Stoff typische Eigenschaften heranziehen. Stellt man die Eigenschaften eines Stoffs zusammen, so erhält man einen Steckbrief. Mit dessen Hilfe kann man den Stoff identifizieren und ihn von anderen Stoffen unterscheiden. In einem Steckbrief sollten alle Eigenschaften aufgenommen werden, die wir bisher kennen gelernt haben: Zustandsform, Farbe, Kristallform, Geschmack, Geruch, Härte, Verformbarkeit, elektrische Leitfähigkeit, Dichte, Verhalten beim Erhitzen und Brennbarkeit. Als Beispiel soll im Folgenden der Steckbrief von Schwefel betrachtet werden:
22 Reinstoffe und Stoffgemische Wir haben bisher zahlreiche Stoffe kennen gelernt und erfahren, dass Stoffe bestimmte Eigenschaften besitzen. Dabei haben wir meist Stoffe verwendet, die nicht mit anderen Stoffen vermischt waren. In der Chemie werden solche Stoffe als Reinstoffe bezeichnet. Reinstoffe lassen sich durch ihre Eigenschaften eindeutig kennzeichnen. Die Mehrzahl von Stoffen, die uns täglich begegnen, sind jedoch Stoffgemische. Sie bestehen aus verschiedenen Reinstoffen. Steinsalz, Sandstein und Gartenerde sind Gemische von festen Stoffen, die ebenfalls in der Natur vorkommen. Für viele Zwecke im Alltag werden Stoffgemische hergestellt, beispielsweise beim Mischen von Farben und Zubereiten von Medikamenten. Die Herstellung von möglichst reinen Stoffen ist eine wichtige und oft schwierige Aufgabe der Chemie. Es gibt sechs verschiedene Arten von Stoffgemischen, welche wir in Kürze sehen werden. Reinstoffe treten in drei Aggregatzuständen auf: fest, flüssig, gasförmig. Man unterscheidet daher verschiedene Arten von Gemischen Gemenge In Gemengen (also den Gemischen fester Stoffe) bleiben die Eigenschaften der Reinstoffe erhalten. Beispiele dafür sind z.b.: Granit (Feldspat, Quarz und Glimmer) 11.2 Suspension Eine Suspension (Aufschlämmung) entsteht, wenn ein Feststoff in einer Flüssigkeit, in der er nicht löslich ist, fein verteilt wird. Eine Suspension entsteht zum Beispiel bei der Verteilung von Lehm oder Sand in Wasser. Beispiele dafür sind z.b.: Stein in Wasser / Holz in Blut
23 Emulsion Wasser und Speiseöl sind zwei nicht ineinander lösliche Flüssigkeiten. Schüttelt man Wasser mit Speiseöl, erhält man eine milchige Flüssigkeit, eine Emulsion. Emulsionen entstehen, wenn eine Flüssigkeit in feinen Tropfen in einer anderen Flüssigkeit verteilt wird. Ein Beispiel für eine über längere Zeit haltbare Emulsion ist Milch, ein Gemisch von Fetttröpfchen in Wasser. Beispiele dafür sind z.b.: Salatsauce (Essig, Öl) 11.4 Nebel Schweben feinste Flüssigkeitstropfen in einem Gas, spricht man von einem Nebel Schaum Bei einem Schaum befinden sich dagegen Gasblasen in einer Flüssigkeit.
24 Rauch Ein Gemisch aus feinen Feststoffpartikeln in einem Gas nennt man Rauch Heterogen vs. Homogen (zeigen chemische Ampel) Stoffgemische, die nicht einheitlich aufgebaut und in denen deshalb die verschiedenen Bestandteile noch zu erkennen sind, bezeichnet man als heterogen (griech. ungleichartig). Feste Stoffgemische, Suspensionen und Emulsionen sind heterogene Stoffgemische. Daneben gibt es Stoffgemische, bei denen man auch bei stärkster Vergrösserung mit dem Mikroskop keine einzelnen Bestandteile erkennen kann. Sie sehen völlig einheitlich aus. Diese Stoffgemische nennt man homogen (griech. gleichartig). Einen homogenen Bereich eines Stoffs nennt man Phase. Heterogene Gemische bestehen aus mehreren Phasen, zwischen denen es optisch erkennbare Grenzflächen (Phasengrenzen) gibt. Im Granit erkennt man beispielsweise Quarz-, Glimmer- und Feldspatkristalle.
25 25 KSO TEILCHENMODELL UND AGGREGATZUSTÄNDE Skript Teilchenmodell und Aggregatzustände V1.0 08/13 Bor
26 26 INHALTSVERZEICHNIS "TEILCHENMODELL UND AGGREGATZUSTÄNDE" 1. Stoffe bestehen aus kleinsten Teilchen Die Bewegung der kleinsten Teilchen Brown sche Bewegung Diffusion Lösen und kristallisieren Osmose Teilchenmodell und Aggregatzustände Energie und Aggregatzustandsänderungen Teilchenbewegung und Gasdruck Zusammenfassung Teilchenmodell Die Siedetemperatur Die Schmelztemperatur Übungen... 15
27 27 1. Stoffe bestehen aus kleinsten Teilchen Aufgabe I: Beobachten Sie die gezeigten Experimente und machen Sie dazu je eine Skizze. 50mL Wasser + 50mL Ethanol => Messzylinder 50mL Hirsen + 50mL Erbsen => Messzylinder Gibt man 50 ml Alkohol zu 50 ml Wasser und mischt die beiden Stoffe durch schütteln, macht man eine erstaunliche Beobachtung: Das Volumen des Gemischs beträgt nicht 100 ml, sondern nur etwa 96 ml. Eigentlich würde man erwarten, dass sich die Volumina beim Zusammengiessen addieren, wie dies beim Mischen von Alkohol mit Alkohol oder von Wasser mit Wasser der Fall ist. Doch weshalb ist das so? Nehmen wir an, dass die Stoffe Alkohol und Wasser jeweils aus kleinsten kugelförmigen Teilchen bestehen, die sich nur in ihrer Grösse voneinander unterscheiden, so könnte die Volumenverringerung dadurch zustande kommen, dass einige der kleineren Teilchen (zum Beispiel die Wasserteilchen) in die Lücken zwischen den grösseren Teilchen (zum Beispiel den Alkoholteilchen) schlüpfen, wie dies der Modellversuch mit Erbsen und Hirsen veranschaulichte. Wir können also wie folgt zusammenfassen: Alkohol und Wasser bestehen jeweils aus kleinsten kugelförmigen Teilchen mit unterschiedlichen Grössen. Volumenverringerung: kleinere Teilchen (Wasserteilchen) gehen in die Lücken zwischen den grösseren Teilchen (Alkoholteilchen). Die am Beispiel der Volumenverringerung gewonnene Teilchenvorstellung ist von ganz allgemeiner Bedeutung: Wir gehen von nun an davon aus, dass alle Stoffe aus kleinsten kugelförmigen Teilchen aufgebaut sind. Diese kleinsten Teilchen eines Reinstoffs sind untereinander gleich; sie haben die gleiche Masse und Grösse. Handelt es sich jedoch um
28 28 verschiedene Stoffe, können sie sich voneinander in Masse und Grösse unterscheiden. Wegen ihrer äusserst geringen Grösse kann man die kleinsten Teilchen mit optischen Mitteln (Lupen, Mikroskop) nicht einzeln wahrnehmen. Wir müssen uns also bewusst sein, dass wir sie nicht wirklichkeitstreu abbilden können. Wir können nur Vorstellungen und vereinfachte Darstellungen entwickeln, die bestimmte Teile der Wirklichkeit angenähert wiedergeben, niemals aber die ganze Wirklichkeit. Eine solche Vorstellung, die wir uns über den Aufbau der Stoffe machen, nennt man Modell. Eine wesentliche Vereinfachung in unserer Modellvorstellung besteht in der Annahme der kugelförmigen Gestalt der kleinsten Teilchen. Man spricht deshalb auch vom Kugelteilchenmodell. 2. Die Bewegung der kleinsten Teilchen Mit dem Kugelteilchenmodell lassen sich auch andere Erscheinungen wie die Diffusion, das Lösen und Kristallisieren sowie die Aggregatzustände erklären. Dafür muss man das Modell allerdings etwas erweitern. 2.1 Brown sche Bewegung Im Jahre 1827 beobachtete der englische Botaniker Robert Brown unter dem Mikroskop, dass Blütenpollen in einem Wassertropfen Zitterbewegungen ausführen und ihren Standort in nicht vorhersehbarer Weise ändern. Nach ihrem Entdecker wird diese Erscheinung als Brown sche Bewegung bezeichnet. Erst 1905 gelang es dem Physiker Albert Einstein, eine Erklärung für die Brown sche Bewegung zu geben: Das Wasser besteht aus unsichtbar kleinen Teilchen, die in ständiger Bewegung sind. Beim Zusammenstoss mit den sehr viel grösseren und deshalb sichtbaren Pollenkörnern versetzen sie diese in eine Zitterbewegung. Mit seiner Theorie der Brown schen Bewegung konnte Einstein den ersten allgemein akzeptierten Beweis dafür erbringen, dass die Materie aus kleinsten Teilchen aufgebaut ist.
29 Diffusion Parfüme oder andere stark riechende Stoffe in einem offenen Gefäss sind nach einiger Zeit im ganzen Raum wahrnehmbar. Man könnte vermuten, dass Luftströmungen die Geruchsstoffe im Raum verteilen. Allerdings breitet sich auch Bromdampf in einem geschlossenen Standzylinder ohne Luftströmung vom Boden her aus, obwohl seine Dichte grösser ist als die der ihn umgebenden Luft. Wir können für die Diffusion also folgende Definition aufschreiben: Diffusion = selbstständige Durchmischung verschiedener Stoffe (Gase, lösliche Flüssigkeiten) Bsp.: Parfüme oder andere stark riechende Stoffe in einem offenen Gefäss sind nach einiger Zeit im ganzen Raum wahrnehmbar. Aufgabe II: Notieren Sie sich einige Aussagen zu den gezeigten Folien / Bildern. Zeigen Folie: Stoffe bestehen aus kleinsten Teilchen (klett stoff,teilchen,reaktion 10) Nicht nur Gase, auch ineinander lösliche Flüssigkeiten vermischen sich durch Diffusion. Dies zeigt die Abbildung rechts. hier wurde eine Lösung von Kaliumpermanganat vorsichtig mit Wasser überschichtet. Zunächst bilden die Flüssigkeiten zwei Phasen mit einer etwas unscharfen Phasengrenze. Im Verlauf von einigen Stunden oder Tagen vermischen sich die Flüssigkeiten aber vollständig. Auch die Diffusion kann man mit der Eigenbewegung der Teilchen erklären: Die Durchmischung kommt dadurch zustande, dass die kleinsten Teilchen der Stoffe in Leerräume wandern, die sich zwischen ihnen befinden. Die Teilchenbewegung ist dabei regellos und ungeordnet. Aufgabe III: Beobachten Sie das gezeigte Experiment und erklären Sie das Phänomen mit den gelernten Fachausdrücken.
30 30 Kaliumpermanganatkristalle im Faltenfilter in ein Riesenstandzylinder hängen mit Metallstift (Wunderkerzen) => Diffusion der Kristalle im Wasser (dauert etwa 30min bis sichtbar) Aufgabe IV: Notieren Sie sich einige wichtige Beobachtungen zur gezeigten Animation auf dem Beamer. Elemente-CD: Diffusion (zeigen verschiedene Animationen) Aufgabe V: Füllen Sie die Lücken aus anhand des gezeigten Experiments. Beobachtung: Kaliumpermanganat-Kristall eiskaltes Wasser Kaliumpermanganat-Kristall heisses Wasser Deutung auf der Teilchenebene: Im kalten Wasser bewegen sich die Wasserteilchen weniger schnell als im heissen Wasser => daher stossen sie im kalten Wasser weniger oft mit den Salzkristallen zusammen => rechtes Gefäss verfärbt sich schneller Aufgabe VI: Notieren Sie sich das Wichtigste aus dem gezeigten Kurzfilm. Zeigen: (Brownsche Bewegung / scoyo, Dauer 10min)
31 Lösen und kristallisieren Ebenso wie die Diffusion lassen sich die Vorgänge des Lösens und Kristallisierens mit dem Kugelteilchenmodell beschreiben: Löst man Kochsalzkristalle in Wasser, kann man sich vorstellen, dass sich die kleinsten Teilchen des Wassers zwischen die kleinsten Teilchen des Kristalls schieben und deren Ablösung von der Oberfläche erleichtern. Die Eigenbewegung der Salz- und Wasserteilchen führt schliesslich dazu, dass sich die Salzteilchen im Lösungsmittel gleichmässig verteilen. Lässt man das Wasser langsam verdunsten, kann man die Salzkristalle wieder zurückgewinnen: Die Wasserteilchen entweichen aus der Lösung, die Abstände zwischen den kleinsten Teilchen des Salzes werden immer kleiner, bis sich die Teilchen zu regelmässigen Körpern zusammenlagern. So entstehen aus den kleinsten Teilchen des Kochsalzes immer wieder würfelförmige Kristalle. 2.4 Osmose Wenn man die Definition der Osmose im Internet sucht, so findet man: "...die Diffusion von Teilchen durch eine selektiv permeable Membran, wie sie eine biologische Membran darstellt." Ein anschauliches Beispiel für die Wirkung der Osmose ist das Aufplatzen reifer Kirschen nach Benetzung mit Regenwasser. Das Wasser auf der Außenseite der Frucht enthält nur sehr wenig gelöste Teilchen, hat also ein hohes chemisches Potential. Es dringt durch die äußere Haut in die Frucht ein, in der das Wasser als Lösungsmittel durch den hohen
32 32 Zuckergehalt und andere gelöste Stoffe ein niedriges chemisches Potential aufweist. Durch den Wassereinstrom steigt der Druck im Inneren der Frucht und führt zum Aufreißen ihrer äußeren Haut. Diese ist neben anderen Stoffen für Wasser durchlässig, nicht jedoch für Zuckermoleküle; aufgrund dieser Eigenschaften wirkt sie als semipermeable Membran. Wassermoleküle können diese Membran prinzipiell in beide Richtungen passieren, werden jedoch im Inneren der Frucht stärker festgehalten. Die Wassermoleküle müssen dort mit den anderen gelösten Molekülen und Teilchen um den Zugang zur Membran konkurrieren, so dass weniger Wassermoleküle pro Zeiteinheit nach außen dringen als umgekehrt. Aufgabe VII: Lösen Sie folgende Aufgabe mithilfe der oben erwähnten Theorie. Die Zellmembran ist semipermeabel: Wasserteilchen ( ) können die Membran frei passieren, Salzteilchen ( ) aber nicht. (Für Salzteilchen gibt es in der Membran spezielle Transportsysteme). Was geschieht mit den Zellen, wenn man sehr viel destilliertes Wasser trinkt? Zellen platzen, Salze werden aus den Zellen geschwemmt Was geschieht mit den Zellen, wenn man sehr viel Salz isst? Trocknet aus...zellen schrumpfen
33 33 3. Teilchenmodell und Aggregatzustände Mit der Modellvorstellung vom Aufbau der Stoffe aus kleinsten Teilchen lassen sich auch die Aggregatzustände und die Übergänge zwischen ihnen erklären. Aufgabe VIII: Notieren Sie sich einige wichtige Beobachtungen zu den gezeigten Folien. Zeigen Folie: Aggregatzustände und Teilchenmodell (klett stoffe,teil. 11) Um einen Glasstab zu zerbrechen oder einen Eisenstab zu verbiegen, muss man Kraft aufwenden. Die kleinsten Teilchen eines Feststoffs lassen sich offenbar nur schwer voneinander trennen und gegeneinander verschieben. Zwischen ihnen herrschen Anziehungskräfte. Ein Feststoff lässt sich nicht zusammenpressen, weil die Teilchen dicht nebeneinander angeordnet sind. Die Kristallform vieler fester Stoffe spiegelt die regelmässige Anordnung der kleinsten Teilchen wider. Man spricht auch von einer Gitterordnung oder kurz von einem Gitter. Flüssigkeiten lassen sich kaum zusammendrücken und haben im Unterschied zu Feststoffen auch keine bestimmte Gestalt: sie passen sich jeder Gefässform an. Die Anziehungskräfte zwischen den kleinsten Teilchen eines flüssigen Stoffes können sich offenbar weniger gut auswirken als im festen Zustand: Die Kugelteilchen nehmen keine festen Plätze mehr ein; sie sind gegeneinander beweglich. Die strenge Ordnung des festen Zustands ist aufgehoben. Ein Gas lässt sich im Gegensatz zu einer Flüssigkeit oder einem Feststoff leicht zusammendrücken; es nimmt auch jeden zur Verfügung stehenden Raum ein. Die kleinsten Teilchen eines Stoffs im gasförmigen Zustand müssen sehr weit voneinander entfernt sein. Sie besitzen keinen Zusammenhalt mehr, ihre Anziehungskräfte wirken sich kaum noch aus: Jedes Teilchen kann sich unbeeinflusst von der Anziehung anderer Teilchen fortbewegen. Bei ihrer Bewegung stossen die Teilchen ständig zusammen und ändern dadurch ihre Richtung. Sie bewegen sich somit ungeordnet im Raum.
34 34 In unserer Erklärung der Aggregatzustände mit Hilfe des Teilchenmodells spielen die Anziehungskräfte zwischen den Teilchen eine zentrale Rolle. Die Wirkung der Anziehungskräfte hängt von der Entfernung der Teilchen untereinander ab: Je weiter entfernt sie voneinander sind, desto geringer sind die Anziehungskräfte. Je geringer aber diese Kräfte sind, umso ungeordneter können sich die Teilchen bewegen. Diese Bewegung ist umso heftiger, je mehr Wärme dem Stoff zugeführt wird. Aufgabe IX: Notieren Sie sich einige wichtige Beobachtungen zur gezeigten Animation. Zeigen: Elemente CD => Animation Übergänge Aggregatzustände Im festen Zustand bewirkt die Wärmezufuhr immer heftigere Vibrationen der Teilchen; der Feststoff dehnt sich aus. Schliesslich werden die Vibrationen so stark, dass sich Gruppen von Teilchen voneinander lösen. Die Ordnung bricht zusammen; der Feststoff schmilzt. Erhitzt man die Schmelze weiter, wird die Bewegung der Teilchen so gross, dass auch noch vorhandene Gruppen zerstört werden. Durch die zugeführte Wärme vergrössern sich zudem die Teilchenabstände. Wenn die Siedetemperatur erreicht ist, lösen sich die Teilchen ganz voneinander; die Flüssigkeit verdampft. Aufgabe X: Füllen Sie mithilfe der Lehrperson die fehlenden Lücken aus. Wärme Feststoff Feststoff dehnt sich aus, Teilchen lösen sich voneinander, Ordnung bricht zusammen Teilchenabstände werden grösser => bei Siedetemp. lösen sich Teilchen ganz Wärme Feststoff schmilzt Flüssigkeit verdampft
35 Energie und Aggregatzustandsänderungen Tiefgekühltes Eis hat eine Temperatur von etwa - 20 C. Nimmt man das Eis aus dem Tiefkühler heraus, steigt seine Temperatur langsam an, bis es bei 0 C zu schmelzen beginnt. Die Temperatur beträgt nun konstant 0 C, bis das Eis geschmolzen ist. Dies lässt sich mit dem Teilchenmodell einfach erklären: Für das Schmelzen wird Energie benötigt. Sie wird von den Teilchen gebraucht, damit sie sich aus dem Gitter lösen können. Diese Energie heisst Schmelzwärme. Wenn eine bestimmte Menge Wasser zu Eis erstarrt, wird genau gleich viel Energie freigesetzt, wie zum Schmelzen der entsprechenden Menge Eis aufgebracht werden muss. Diese Energie heisst Erstarrungswärme. Wird Wasser in einer Pfanne erwärmt, beginnt es bei 100 C zu sieden. Bei dieser Temperatur bilden sich im Innern des Wassers Wasserdampfblasen. Die Temperatur des siedenden Wassers kann nicht über 100 C steigen, selbst dann nicht, wenn man die Hitze ganz aufdreht, denn die zugeführte Wärme wird benötigt, um die Anziehungskräfte zwischen den Wasserteilchen vollständig zu überwinden. Die für das Verdampfen benötigte Energie nennt man Verdampfungswärme. Bei der Kondensation einer bestimmten Menge Wasserdampf wird genau gleich viel Wärmeenergie freigesetzt, wie zum Verdampfen der entsprechenden Menge Wasser aufgebracht werden muss. Man spricht in diesem Fall von der Kondensationswärme. Aufgabe XI: Übernehmen Sie die Skizze von der Tafel. Temperatur/Energie-Diagramm von Wasser s.40 Buch (Elemente)
36 Teilchenbewegung und Gasdruck Erhitzt man ein Gas in einem verschlossenen Behälter, kann sein Druck so gross werden, dass der Behälter platzt. Die Druckerhöhung ist darauf zurückzuführen, dass sich alle Gase beim Erwärmen ausdehnen. Bei ihrer Bewegung stossen die Teilchen eines Gases nicht nur ständig untereinander, sondern auch mit der Gefässwand zusammen. Der Druck im Gefäss wird mit zunehmender Erwärmung grösser, die Stösse der Gasteilchen werden häufiger und heftiger. 4. Zusammenfassung Teilchenmodell Aufgabe XII: Suchen Sie ausführliche Erklärungen für folgende Phänomene. 1. Beobachtung: Um einen Glasstab zu zerbrechen oder ein Metallblech zu verbiegen, muss man Kraft aufwenden. Erklärung: Die kleinsten Teilchen eines Stoffes lassen sich offenbar nur schwer voneinander trennen und gegeneinander verschieben. Zwischen den kleinsten Teilchen wirken starke Anziehungskräfte, genannt Gitterkräfte, die die Teilchen auf ihren Plätzen festhalten. Die Teilchen können um ihre Plätze hin und her schwingen. Feststoffe lassen sich kaum zusammendrücken, weil die Teilchen dicht nebeneinander angeordnet sind. Je grösser die Anziehungskräfte zwischen den Teilchen eines Feststoffs sind, desto höher ist der Schmelzpunkt und desto grösser die Härte des Stoffes. 2. Beobachtung: Flüssigkeiten lassen sich kaum zusammendrücken, sind aber beweglich und passen sich jeder Gefässform an. Erklärung: Die Anziehungskräfte zwischen den Teilchen, im flüssigen Zustand Kohäsionskräfte genannt, sind also geringer als bei Feststoffen. Deshalb sind die kleinsten Teilchen leicht gegeneinander beweglich. Dass die Anziehungskräfte aber dennoch vorhanden sind, zeigt der Zusammenhalt eines Wassertropfens. Die Abstände zwischen den Teilchen sind gering, aber meist grösser als im Feststoff. Je grösser die Anziehungskräfte zwischen den Teilchen der Flüssigkeit sind, desto höher ist der Siedepunkt der Flüssigkeit.
37 37 3. Beobachtung: Ein Gas lässt sich im Gegensatz zu einer Flüssigkeit oder einem Feststoff leicht zusammendrücken, es nimmt auch jeden zur Verfügung stehenden Raum ein. Erklärung: Die kleinsten Teilchen können sich sehr weit voneinander entfernen, weil nur sehr geringe Anziehungskräfte zwischen ihnen wirken. Die Teilchen bewegen sich frei und ungeordnet im Raum. Aufgabe XIII: Füllen Sie folgende Lücken aus. Aggregatzustand fest flüssig gasförmig Eigenschaften Schwer verformbar leicht verformbar des Stoffs Abstand zwischen den Teilchen Ordnung der Teilchen Schwer teilbar Schwer komprimierbar leicht teilbar Schwer komprimierbar Klein Mittel Sehr gross Nimmt allen zur Verfügung stehenden Raum ein Leicht komprimierbar Feste Gitterordnung Wenig Ordnung Keine Ordnung mehr => regellos Bewegung der Teilchen Anziehungskräfte zwischen den Teilchen Darstellung im Modell Fast keine Bewegung Wenig Bewegung Grosse Bewegung Sehr stark Mittel Sehr schwach Übergänge zwischen den Aggregatzuständen Beobachtung: Erwärmt man einen Feststoff, so dehnt er sich aus und schmilzt schliesslich. Erklärung: Die Wärmezufuhr führt zu heftigeren Schwingungen der kleinsten Teilchen. Werden die Schwingungen so stark, dass die Teilchen ihre Plätze verlassen, geht die regelmässige Anordnung der Teilchen verloren und die Teilchen können sich gegeneinander verschieben.
38 38 Beobachtung: Erwärmt man eine Flüssigkeit, so dehnt sie sich aus. Bei Erreichen des Siedepunktes verdampft sie. Erklärung: Die kleinsten Teilchen bewegen sich immer schneller, ihre Abstände zueinander vergrössern sich. Beim Siedepunkt werden die Anziehungskräfte untereinander überwunden. Beobachtung: Während des Schmelz- und Siedevorgangs ändert sich die Temperatur eines reinen Stoffes auch bei weiterer Wärmezufuhr nicht. Erklärung: Die zugeführte Wärme dient dazu, die Teilchenabstände zu vergrössern und die Anziehungskräfte zu überwinden. Die Teilchen werden aber nicht schneller. 5. Übungen Aufgabe XIV: Erklären Sie mit Hilfe des Kugelteilchenmodells, warum eine Bromportion im gasförmigen Zustand einen grösseren Raum einnimmt als im flüssigen Zustand. Im flüssigen Zustand sind die Anziehungskräfte zwischen den Bromteilchen in der Bromportion noch so stark, dass die Bromteilchen zwar gegeneinander beweglich sind, aber eng beieinander liegen. Im gasförmigen Zustand des Broms bewegen sie sich so stark, dass sie kaum noch Anziehungskräfte aufeinander ausüben können. Da jedes Bromteilchen für die Bewegung wesentlich mehr Platz benötigt, nimmt die Bromportion einen grösseren Raum ein. Aufgabe XV: Erklären Sie die Vorgänge des Erstarrens und Kondensierens mit Hilfe des Teilchenmodells. Erstarren: Die Geschwindigkeit der Teilchen wird geringer. Die Anziehungskräfte zwischen den Teilchen können besser wirksam werden. Die Teilchen werden von so vielen anderen Teilchen angezogen, wie um sie herum passen. Die Teilchen werden auf Gitterplätzen eingebunden und können sich nur noch um ihre Ruhelage bewegen.
39 39 Kondensieren: Die Geschwindigkeit der Teilchen wird geringer. Die Anziehungskräfte zwischen den Teilchen können besser wirksam werden. Die Eigenbewegung der Teilchen ist aber immer noch so stark, dass sie sich ständig wieder voneinander lösen können. Aufgabe XVI: Betrachtet man Milch unter dem Mikroskop, kann man feststellen, dass die Fetttröpfchen in der Milch ständig kleine Zitterbewegungen ausführen. Man bezeichnet dieses Phänomen auch als Brown sche Bewegung. a) Warum hat man dieser Zitterbewegung den Namen des englischen Wissenschaftlers gegeben? b) Erklären Sie das Zittern der Fetttröpfchen mit dem Teilchenmodell. a) Man hat diese Art der Zitterbewegung nach dem englischen Botaniker ROBERT BROWN benannt, weil er als Erster die Beobachtung machte, dass Blütenpollen in einem Wassertropfen Zitterbewegungen ausführen. b) Die kleinsten Teilchen des Wassers sind in ständiger Bewegung und stossen dabei an die Fetttröpfchen, die sich dann ihrerseits bewegen. Aufgabe XVII: Beim Wachsen von Eisblumen sind keine Wassertropfen zu sehen. Aus Wasserdampf (Luftfeuchtigkeit) sind direkt Eiskristalle entstanden. Benennen Sie die Aggregatzustandsänderungen und geben Sie eine Deutung mit dem Teilchenmodell. Deutung im Teilchenmodell: Die Geschwindigkeit der Teilchen wird geringer, die Anziehungskräfte zwischen den Teilchen können besser wirksam werden, die Anziehungskräfte sind aber bereits jetzt so gross, dass sie auf Gitterplätzen eingebunden werden und sich nur noch um ihre Ruhelage bewegen können.
40 40 Aufgabe XVIII: Wie könnte man mit dem Teilchenmodell erklären, dass gewisse Flüssigkeiten (wie z.b. Alkohol und Wasser) miteinander mischbar sind, andere Flüssigkeiten (wie z.b. Öl und Wasser) dagegen nicht? Wenn die Flüssigkeiten miteinander mischbar sind (wie bei Alkohol und Wasser), so wirken zwischen ihren Teilchen ähnlich starke Anziehungskräfte. Sind die Flüssigkeiten dagegen nicht mischbar (wie Öl und Wasser), wirken zwischen den Teilchen des einen Stoffs viel stärkere Anziehungskräfte als zwischen den Teilchen des anderen Stoffs. Hier ist es so, dass zwischen den Wasserteilchen die stärkeren Anziehungskräfte wirken. Die Ölteilchen können sie nicht überwinden und sich zwischen die Wasserteilchen drängen; sie bleiben «unter sich».
41 41 KSO TRENNVERFAHREN Skript Trennverfahren V1.0 09/13 Bor
42 42 INHALTSVERZEICHNIS "TRENNVERFAHREN" 1. Vom Steinsalz zum Kochsalz Manuelle Auslese Sedimentation Dekantieren Filtration Eindampfen Trinkwasser aus Salzwasser Weitere Trennverfahren Schwimmtrennung Scheidetrichter Zentrifugation Extraktion Chromatographie Papierchromatographie Dünnschichtchromatographie Säulenchromatographie Gaschromatographie Aufgaben zum Thema Trennmethoden Rätsel zum Thema Trennen - mischen Test Trennmethoden... 14
43 43 1. Vom Steinsalz zum Kochsalz In der Natur kommt Steinsalz (Bild rechts) in grossen Lagerstätten vor. Untersucht man einen rohen Steinsalzbrocken, so erkennt man, dass Steinsalz ein Gemisch aus Kochsalz und Gestein ist. Wie lässt sich daraus der Reinstoff Kochsalz abtrennen? Wir werden im Folgenden einige Trennverfahren kennenlernen. 1.1 Manuelle Auslese Trennverfahren Wie geht man vor? Manuelle Auslese von Hand aufgrund unterschiedlicher Farben und Formen aussortieren Dieses Trennverfahren wäre beim Steinsalz aber zu mühsam und zu zeitaufwändig. Ausserdem wäre eine vollständige Trennung nicht möglich. Zur Trennung nutzt man die unterschiedliche Löslichkeit der Stoffe in Wasser aus. Kochsalz ist in Wasser gut löslich, das Gestein dagegen kaum. Gibt man Wasser zu zerkleinertem Steinsalz, erhält man eine Suspension. Das Kochsalz löst sich auf, das Begleitgestein setzt sich am Gefässboden ab. Aufgabe I: Beobachten Sie die gezeigten Experimente und notieren Sie sich die wichtigsten Erkenntnisse. Trennung von Klammern (verschiedene Farben) / Trennung von verschiedenfarbigen Blättern) 1.2 Sedimentation Trennverfahren Sedimentation Beobachtungen Wasser in Gemisch => Kochsalz löst sich, Gestein sedimentiert am Boden (Suspension)
44 44 Aufgabe II: Skizzieren Sie die Trennung eines Gemisches durch die oben genannte Trennmethode. NaCl + Sand + Wasser in Becherglas Es gibt zwei Möglichkeiten nach der oben genannten Trennmethode weiterzufahren: 1.3 Dekantieren Trennverfahren Dekantieren Vorgehen man giesst die Lösung ab und erhält eine grobe Trennung von Salz und Gestein. Durch dieses Trennverfahren erfolgt nur eine grobe Trennung von Salz und Gestein. Aufgabe III: Skizzieren Sie die Trennung eines Gemisches durch die oben genannte Trennmethode. Noch ist die Lösung allerdings durch Verunreinigungen getrübt. Deshalb wählt man besser folgende Variante: 1.4 Filtration Trennverfahren Filtration Erklärung Grössere Teilchen bleiben auf dem Filter, kleinere Teilchen wandern hindurch.
45 45 Versuchen Sie dazu noch das untenstehende Bild über diese Trennmethode zu beschriften. Ein Filter wirkt wie ein Sieb mit sehr feinen Poren. Die unlöslichen Bestandteile der Suspension verbleiben aufgrund ihrer Grösse als Rückstand auf dem Filter. Das gelöste Salz hingegen kann die Poren ungehindert passieren. Die hindurchgeflossene Lösung, das Filtrat, ist klar und schmeckt salzig. Beschriftung: Rückstand / Filter / Trichter / Becherglas / Filtrat (Lösung) Gewinnung von Kochsalz aus einer Salzlösung: Um aus dem Filtrat (aus der Filtration) das feste Kochsalz zu gewinnen, muss das Wasser entfernt werden. Eine Möglichkeit wäre, das Wasser an der Luft verdunsten zu lassen. Diese Methode ist jedoch sehr zeitraubend. Schneller geht es, wenn man die Salzlösung bis zum Sieden erhitzt. 1.5 Eindampfen Trennverfahren Eindampfen Wieso geht Trennung? Feststoff wird aus Lösung zurückgewonnen durch Verdampfen des Lösungsmittels Aufgabe IV: Skizzieren Sie die Trennung eines Gemisches durch die oben genannte Trennmethode. Eindampfen Salzlösung mithilfe Bunsenbrenner oder Rührwerk
46 46 2. Trinkwasser aus Salzwasser Lesen Sie den beiliegenden Text (aus Elemente) und beantworten Sie folgende Fragen: a) Wieso kann man Meerwasser nicht trinken? Weil der Salzgehalt im Meerwasser zu hoch ist. Ein Liter Meerwasser enthält im Durchschnitt 35g Salz. b) Erklären Sie in Worten, wie aus dem Meerwasser reines Wasser gemacht wird (siehe Abb. 11). Erstaunlicherweise sind viele Länder mit Trinkwasserknappheit diejenigen Länder, die direkt am Meer liegen und eigentlich genug Wasser hätten. Leider ist dieses Wasser nicht trinkbar. Es werden daher grosse Destillationsanlagen verwendet (siehe Bild). Das Meerwasser wird durch die Sonneneinstrahlung erwärmt, wobei das Wasser dadurch verdampft. Der gasförmige Wasserdampf kühlt sich an den kühlen Scheiben ab und kondensiert zu destilliertem Wasser. Um das Wasser trinkbar zu machen, werden noch geringe Mengen an Mineralsalzen zugefügt. c) Was ist eine Destillation? Welche Stoffe kann man damit trennen? Eine Destillation ist die Trennung eines Stoffgemischs durch Verdampfen und anschliessendem Kondensieren. Man kann damit Stoffe trennen, die unterschiedliche Siedetemperaturen haben. d) Zeichnen Sie eine Destillationsapparatur und überlegen Sie sich, weshalb es den jeweiligen Teil der Apparatur braucht. Thermometer: zum messen der jeweiligen Temperatur Bunsenbrenner: damit das Gemisch erhitzt werden kann Kühler: damit der verdampfte Wasserdampf wieder kondensieren kann Becherglas: um das Destillat aufzufangen e) Wieso ist es wichtig, dass man eine Destillationsapparatur kühlt? Erklären Sie die Vorgänge, die dabei ablaufen. Flüssig => gasförmig => flüssig (wenn man sie nicht kühlen würde, wäre das Produkt gasförmig und wenig brauchbar) f) Nennen Sie Eigenschaften von destilliertem Wasser. - Keine Salze, Mineralstoffe mehr vorhanden - Nicht trinkbar - Reinstoff g) Wie kann man destilliertes Wasser wieder trinkbar machen? Durch Zugabe von Mineralsalzen h) Wieso kann man Alkohol und Wasser nicht vollständig trennen durch Destillation?
47 47 Der Unterschied in den Siedetemperaturen von Wasser (100 C) und Alkohol (78 C) ist zu gering, um eine vollständige Trennung herbeizuführen. Als Destillat sammelt sich zwar hauptsächlich Alkohol an, jedoch enthält es geringe Teile Wasser, welches unterhalb der Siedetemperatur verdunstet ist. Aufgabe V: Vergleichen Sie destilliertes Wasser, Meerwasser und Regenwasser (Geschmack, Reinstoff oder Stoffgemisch, Entstehungsweise). Aufgabe VI: Stellen Sie zusammen, bei welchen aus dem Alltag bekannten Vorgängen die Destillation eine entscheidende Rolle spielt.
48 48 3. Weitere Trennmethoden 3.1 Schwimmtrennung Trennverfahren Wie geht Trennung? Trennung von Feststoffen verschiedener Dichten mithilfe einer Flüssigkeit => Dichte Schwimmtrennung der Flüssigkeit wird so gewählt, dass der eine Feststoff nach oben steigt, der andere zu Boden sinkt. Aufgabe VII: Skizzieren und beschreiben Sie, wie man ein Gemisch aus Plastikschnipsel und Sand mithilfe der oben genannten Trennmethode trennen kann. Zeigen Plastikschnipsel und Sand + Wasser 3.2 Scheidetrichter Trennverfahren Scheidetrichter Wie geht Trennung? Flüssigkeit mit höherer Dichte schwimmt unter und kann mittels Hahn abgelassen werden. Mit dieser Trennmethode (siehe Bild links) kann man nur Gemische trennen, welche aus flüssigen, nicht ineinander mischbaren Stoffen bestehen. Sobald Feststoffe im Gemisch vorhanden sind, wird die Trennung nicht vollständig ablaufen, da der Feststoff (oder Teile davon) im Ablauf stecken bleibt.
49 Zentrifugation Trennverfahren Wie geht Trennung? Zentrifugation Durch die Zentrifugalkraft wird das Entmischen beschleunigt Beim Zentrifugieren wird eine Emulsion oder eine Suspension in ein starkwandiges Reagenzglas gegeben und in eine Zentrifuge gehängt. Durch eine schnelle Rotation entsteht eine Fliehkraft, wobei der Stoff mit der größeren Dichte ganz außen an den Boden des Reagenzglases "flieht". Aufgabe VIII: Beim Zentrifugieren werden in schnell rotierenden Trommeln die Gemischbestandteile mit der grösseren Dichte nach aussen geschleudert. a) Welche Gemische kann man auf diese Weise trennen? Suspensionen / Emulsionen b) Nennen Sie Beispiele für Zentrifugen im Haushalt. Salatschleuder / Wäscheschleuder 3.4 Extraktion Trennverfahren Worauf basiert diese Trennung? Ausnutzen der unterschiedlichen Extraktion Löslichkeiten der Bestandteile eines Gemisches mithilfe eines geeigneten Lösungsmittels. Bei der Extraktion wird ein Stoff aus einer Flüssigkeit, aus einem Feststoff oder aus einem Gas mit einem Lösungsmittel abgetrennt. Das Lösungsmittel wird auch Extraktionsmittel genannt und ist geeignet, wenn es den zu extrahierenden Stoff löst, die anderen
50 50 Bestandteile jedoch nicht. Das Gemisch aus extrahiertem Stoff und Lösungsmittel nennt man Extrakt. 3.5 Chromatographie Die Chromatografie wurde von dem russischen Biologen Michael Tswett ( ) im ersten Jahrzehnt des 20. Jahrhunderts erstmals zur Trennung von Farbstoffen aus Pflanzen angewandt. Es handelt sich dabei um ein Stofftrennungsverfahren, bei dem sich die Stoffe aufgrund unterschiedlicher Wechselwirkungen (Löslichkeit oder Adsorption) ihrer Komponenten mit einer zugegebenen Phase auftrennen. Aufgabe IX: Führen Sie den von der Lehrperson erklärten Versuch zur Papierchromatographie durch. Filzstifte (wasserlöslich) / Papierfilter / Becherglas / Wasser => Loch in der Mitte des Rundfilters => Kreis um Loch zeichnen => Markierung mit Stiften => zusammenstecken => ins Becherglas stellen und nicht mehr bewegen! Filter Papierchromatographie Friedlieb Ferdinand Runge ( ) legte mit seinen einfachen Papierchromatogrammen die Grundlagen für die moderne Chromatografie. Bei der Papier- Chromatografie (PC) wird zum Beispiel ein Farbstoffgemisch auf einem punktförmigen Startpunkt eines Filterpapiers aufgetragen. Dann stellt man das Papier in einen Standzylinder und gibt ein geeignetes Lösungsmittel wie ein Ethanol-Wasser-Gemisch hinzu. Das Papier saugt sofort von unten her Wasser und dann Ethanol auf. Das Papier ist das Trägermaterial und stellt zusammen mit dem aufgesaugten Wasser die stationäre Phase dar. Die gelösten Farbstoffe steigen mit dem Ethanol auf. Manche Farbstoffe lösen sich besser in Ethanol, manche schlechter. Die weniger löslichen Farbstoffe werden vom Ethanol weniger
51 51 zurückgehalten und steigen schneller auf. So trennt sich das Farbstoffgemisch in seine Komponenten. Der aufsteigende Ethanol als Fließmittel wird als mobile Phase bezeichnet Dünnschichtchromatographie Bei der Dünnschicht-Chromatografie (DC) werden anstelle von Papier fein pulverisierte Materialien wie Kieselgel, Cellulose oder Aluminiumoxid auf dünne Glasplättchen aufgetragen. Sie beruht auf dem gleichen Prinzip wie die Papier-Chromatografie. Ihre Vorteile liegen in einer schnellen Laufzeit und in einer hohen Nachweisempfindlichkeit. Die Trägermaterialien sind im Handel als fertige DC-Folien erhältlich. Die Methoden der Dünnschicht-Chromatografie entwickelte der deutsche Pharmazeut Egon Stahl ( ). Mit Hilfe dieser Methode kann man beispielsweise die Farbstoffe in den Blättern von Laubbäumen bestimmen. Aufgabe X: Halten Sie das Wichtigste aus dem gezeigten Youtube-Film fest. Suchen auf Youtube: Thin Layer Chromatography (TLC) (4 46 ) + selber auf Deutsch kommentieren Säulenchromatographie Bei der von Michael Tswett entwickelten Säulen-Chromatografie (SC) dient ein Glasrohr, das mit einem Trägermaterial gefüllt ist, zum Chromatografieren. Tswett verwendete pulverisiertes Calciumcarbonat, das er in Petrolether aufschlämmte. Heute verwendet man Kieselgel, Cellulose, Stärke oder Aluminiumoxid als stationäre Trägermaterialien. Gibt man auf die Säule einen Petrolether-Extrakt von grünen Blattfarbstoffen, läuft das mobile Fließmittel nach unten, und die Pflanzenfarbstoffe trennen sich auf. Die Säulen-Chromatografie eignet sich besonders zum Auftrennen Stoffmengen. größerer
52 Gaschromatographie Nach dem Zweiten Weltkrieg wurden Verfahren entwickelt, bei denen Gase als mobile Phase bei der Chromatografie dienten. Bei der Gas-Chromatografie (GC) lassen sich Gemische aus Gasen oder verdampfbaren (in der Regel organischen) Stoffen trennen. Als mobile Trägergase dienen Helium, Argon, Stickstoff oder einfach Luft wie in unserem Beispiel. Statt einer Säule werden spiralförmige Rohre mit geringem Durchmesser (wenige Millimeter) verwendet, durch die der Gasstrom geleitet wird. Die Säulen werden mit einem Trägermaterial (meist Kieselgel mit Siliconöl) als stationäre Phase befüllt. Das zu anlaysierende Stoffgemisch wird mit Hilfe einer Mikrospritze vor der Trennsäule am Probeneinlass in den Gasstrom injiziert. 4. Aufgaben zum Thema Trennmethoden Aufgabe XI: Gib für jeden Gemischtyp geeignete Trennverfahren an und gib an, aufgrund welcher Eigenschaft die Trennung erfolgt. Gemischtyp Trennverfahren zur Trennung genutzte Eigenschaft Gemenge Extraktion Löslichkeit Schwimmtrennung Dichte Magnettrennung Magnetismus Suspension Zentrifugation Zentrifugalkraft / Dichte Eindampfen / Destillation Siedetemperaturen Filtration Partikelgrösse Emulsion Destillation Siedetemperaturen (auch noch
53 53 Zentrifugation) Rauch Ev. Filtration Partikelgrösse Lösung Destillation Siedetemperaturen Eindampfen Siedetemperaturen Aufgabe XII: In welcher Eigenschaft müssen sich die Komponenten einer Lösung unterscheiden, damit eine Trennung durch Destillation möglich ist? Untersch. Siedetemperaturen. Nenne ein Beispiel für eine Lösung, die sich durch Destillation trennen lässt. Kochsalzlösung Erkläre im Teilchenmodell, wieso die Stoffe sich in obiger Stoffeigenschaft unterscheiden. Es braucht mehr Energie beim Salz, um die Gitterplätze zu verlassen und die Kräfte zu überwinden. Aufgabe XIII: Wie kann man folgende Gemische in die einzelnen Komponenten auftrennen? Skizziere den Trenngang und gib jeweils die Art des Gemischs an. a) Gold/ Eisen / Kochsalz / Alkohol = Suspension => 1. Magnettrennung (Eisen getrennt) => 2. Filtration (Gold bleibt im Filter) => Lösung => 3. Destillation (Kochsalz und Alkohol getrennt) b) Essig / Öl = Emulsion => 1. Zentrifugation c) Iod-Pulver / Salz = Gemenge => 1. Erhitzen (Iod sublimiert => Salz bleibt zurück) d) Aceton-Wasser-Lösung = Lösung => 1. Destillation e) Butter/Salz = Suspension => 1. Leicht erwärmen (Butter wird flüssig, Salz bleibt zurück) Aufgabe XIV: Erkläre im Teilchenmodell, wie sich ein Reinstoff von einem Gemisch unterscheidet. Die Teilchen in einem Reinstoff sind durch und durch gleich. Bei einem Gemisch gibt es verschiedene Teilchensorten, welche zusammen in einem Verband sind.
54 54 Aufgabe XV: Klassiere folgende Gemische: heterogen/homogen und Gemischname bzw. Reinstoff Meerwasser Zuckerwatte Luft Wolke Styropor Salatsauce Schlamm Brunnenwasser dest. Wasser Bronze Zucker/Salz Alkohol Wein Bodylotion Nagellackentferner Gold homogen (Lösung) oder heterogen (Suspension) => je nach Sichtweise Reinstoff, da nur aus Zucker bestehend homogen (Gasgemisch) heterogen (Nebel) Reinstoff heterogen (Emulsion) heterogen (Suspension) homogen (Lösung) Reinstoff heterogen (Gemenge, Legierung) heterogen (Gemenge) Reinstoff homogen (Lösung) heterogen (Emulsion) homogen (Lösung) Reinstoff
55 55 5. Rätsel zum Thema Trennen mischen (1) D E S T I L L A T I O N (2) N E B E L (3) E I N D A M P F E N (4) Z E N T R I F U G E (5) E M U L S I O N (6) H E T E R O G E N (7) S T E I N S A L Z (8) E X T R A H I E R E N (9) R A U C H (10) F I L T R A T I O N (11) L E G I E R U N G (12) C H R O M A T O G R A P H I E (13) S U S P E N S I O N (1) Durch welches Trennverfahren erhält man Branntwein? (2) Ein Stoffgemisch, das die Autofahrer im Herbst behindert. (3) Vorgang bei der Trennung einer Kochsalz-Lösung (4) Karussell zur Trennung von Suspensionen oder Emulsionen (5) Gemisch aus Wasser und Öl (6) Stoffgemische, in denen sich einzelne Bestandteile erkennen lassen, sind... (7) Rohstoff für die Salzgewinnung (8) Fachausdruck für herauslösen (9) Feste Teilchen in Luft bilden einen... (10) Trennverfahren für Suspensionen (11) Mischung verschiedener Metalle (12) Trennverfahren für Farbstoffe (13) Lehmwasser ist eine... Gib das Lösungswort an: SEDIMENTATION Es bezeichnet ein Trennverfahren für Suspensionen.
56 56 6. Test Trennmethoden Kreuzen Sie die richtigen Aussagen an: 1. Reinstoffe A teilt man ein in homogene und in heterogene Reinstoffe, B sind reine Stoffe wie klares Meerwasser oder gereinigtes Messing, C enthalten im Prinzip nur einen Stoffbestandteil, D bestehen aus gleichartigen Teilchen, E sind streng genommen stets auch Gemische. 2. Ein Gemisch ist homogen, wenn A es nur aus einem Bestandteil besteht, B es als Suspension oder Lösung vorliegt, C eine Flüssigkeit in der Luft als Nebel verteilt ist, D es als Gemisch wie ein Reinstoff aussieht, E es als Gasgemisch vorliegt. 3. Ein Gemisch ist heterogen, A wenn es zwei oder mehr Bestandteile enthält, B wenn es als Lösung vorliegt, C wenn ein Feststoff in einem Gas verteilt ist, D wenn zwei Flüssigkeiten als Emulsion vorliegen, E wenn ein Gas so in einer Flüssigkeit verteilt ist, dass ein Schaum vorliegt. 4. Lösungen sind Stoffgemische, die A bereits getrennt worden sind, B homogen sind, C aus einer Flüssigkeit bestehen, in der ein Feststoff, eine andere Flüssigkeit oder ein gasförmiger Stoff verteilt ist, D man durch Filtration trennen kann, E durch Sedimentation entstehen. 5. Die Gewinnung von Trinkwasser aus dem Meer A erfolgt nach den üblichen Trennverfahren für Suspensionen, B wird nur in südlichen Ländern durchgeführt, weil dort der Salzgehalt des Meerwassers niedriger ist, C erfolgt am preiswertesten nach dem Verdunstungsverfahren
57 57 6. Die Gewinnung von Salz aus dem Meerwasser A erfolgt durch Verdunstung, B wird in südlichen Ländern durchgeführt, weil dort das Salz leichter verdunstet, C könnte auch durch Filtration erfolgen, D wird in Deutschland unterirdisch in Salzbergwerken durchgeführt, um Umweltbelastungen zu vermeiden. 7. Ein wichtiges Trennverfahren ist A die Sublimation, G die Emulsion, B die Destillation, H die Filtration, C die Kondensation, I die Extraktion, D die Suspension, J die Legierung, E die Chromatographie, K die Sedimentation, F die Siedetemperatur, L das Aerosol. 8. Die unterschiedliche Dichte der Bestandteile eines Gemischs A wird bei der Trennung des Gemischs durch Destillation angewandt, B spielt eine wichtige Rolle bei dem Schwimm/Sink-Verfahren, C ist die Grundlage der Sedimentation und des Dekantierens, D wird bei der Branntweinherstellung genutzt, E kann nur bei homogenen Stoffgemischen zur Trennung angewandt werden. 9. Die unterschiedliche Löslichkeit von Mischungsbestandteilen ist die Grundlage der Stofftrennung A durch Destillation, B von Farbstoffen durch Chromatographie, C von Flüssigkeitsgemischen durch Eindampfen, D durch Extraktion. 10. Bei der Destillation A werden meist Flüssigkeitsgemische getrennt, B wird die unterschiedliche Schmelztemperatur der einzelnen Bestandteile zur Trennung genutzt, C verdampft bevorzugt die Flüssigkeit mit der höheren Siedetemperatur, D kondensiert zuerst der Dampf der Flüssigkeit mit der höheren Siedetemperatur, E spielt die Sublimation eine entscheidende Rolle. 11. Bei der Extraktion A wird eine Lösung getrennt, B bildet sich eine Lösung, C erfolgt eine Trennung aufgrund der unterschiedlichen Partikelgröße, D können nur Farbstoffe getrennt werden.
58 58 KSO CHEMISCHE REAKTIONEN Skript Chemische Reaktionen V1.0 10/13 Bor
59 59 INHALTSVERZEICHNIS "CHEMISCHE REAKTIONEN" 1. Einleitung Stoffe wandeln sich um Kupfer reagiert mit Schwefel Element und Verbindung Analyse vs. Synthese Physikalische vs. Chemische Trennverfahren Chemische Reaktion und Teilchenmodell Chemische Reaktion und Energie Exothermen vs. Endotherme Reaktionen Übungen... 08
60 60 1. Einleitung Was genau ist eigentlich Chemie? Einfach ausgedrückt, behandelt dieser ganze Zweig der Wissenschaft alles über Materie, die irgendetwas ist, das Masse hat und Platz einnimmt. Chemie ist die Studie über die Zusammensetzung und die Eigenschaften der Materie und die Veränderungen, denen sie ausgesetzt ist. Chemie kommt hauptsächlich dort ins Spiel, wo Veränderungen stattfinden. Materie besteht entweder aus reinen Substanzen oder aus Mischungen davon. Die Veränderung von einer Substanz in eine andere nennen die Chemiker chemische Änderung oder chemische Reaktion. Wenn diese stattfindet, ist das ein Höhepunkt im Leben des Chemikers, denn es entsteht etwas gänzlich Neues. In diesem Skript sollen einige Grundbegriffe der chemischen Reaktionen gelehrt werden, damit der weitere Verlauf der Chemie ein wenig verständlicher wird. Einführungsexperiment I: Fischer + Frau (siehe Datenbank) Beobachten Sie das gezeigte Experiment und machen Sie sich gegebenenfalls Notizen. Woran erkennt man im gezeigten Experiment, dass es sich mit Bestimmtheit um eine chemische Reaktion handeln muss? Viele Farbänderungen ersichtlich Einführungsexperiment II: Bier brauen (siehe Datenbank) Beobachten Sie das gezeigte Experiment und machen Sie sich gegebenenfalls Notizen. Woran erkennt man im gezeigten Experiment, dass es sich mit Bestimmtheit um eine chemische Reaktion handeln muss? Farbänderung ersichtlich Einführungsexperiment III: Alufolie im Bromfeuer (siehe Datenbank) Beobachten Sie das gezeigte Experiment und machen Sie sich gegebenenfalls Notizen. Woran erkennt man im gezeigten Experiment, dass es sich mit Bestimmtheit um eine chemische Reaktion handeln muss? Wärmefreisetzung, Feuer, Farbänderung
61 61 2. Stoffe wandeln sich um In einer chemischen Reaktion werden Substanzen (Elemente und / oder Verbindungen) in andere Substanzen (Verbindungen und / oder Elemente) umgewandelt. Sie können dabei kein Element in ein anderes in einer chemischen Reaktion ändern, etwa wie bei einer Kernreaktion (siehe später im Skript "Atome, PSE, Elektronen"). Stattdessen schaffen Sie eine neue Substanz mit Hilfe chemischer Reaktionen. Wir wollen uns in diesem Kapitel mit den chemischen Reaktionen und chemischen Gleichungen befassen. Da es oft vor kommt, dass solche chemischen Gleichungen relativ kompliziert sind, beginnen wir mit einer Reaktion aus zwei Reinstoffen. 2.1 Kupfer reagiert mit Schwefel Im Folgenden wollen wir sehen, was aus den beiden Reinstoffen Kupfer und Schwefel entsteht. Experiment: Kupfer + Schwefel (siehe Datenbank) Notieren Sie sich die wichtigsten Beobachtungen / Erkenntnisse des gezeigten Experimentes. Wir können also festhalten: Wenn Schwefeldampf über einen heissen Kupferblechstreifen streicht, beobachtet man ein Aufglühen, das sich langsam durch den ganzen Streifen fortpflanzt. Nach dem Erkalten des Streifens erkennt man, dass sich kleine blauschwarz glänzende Kristalle gebildet haben. Wenn wir den blauschwarzen Stoff genauer untersuchen, stellen wir fest, dass er spröde ist und aus durch und durch einheitlichen Bausteinen aufgebaut ist. Der blauschwarze Stoff lässt sich mit keinem uns bisher bekannten Verfahren trennen. So können wir mit Sicherheit sagen, dass wir aus den Reinstoffen Kupfer und Schwefel einen neuen Stoff hergestellt haben, der keine Eigenschaften der Ausgangsstoffe mehr enthält. Der neue Stoff heisst: Kupfersulfid
62 62 Aufgabe I: Notieren Sie sich die wichtigsten Unterschiede in den Eigenschaften der Ausgangsstoffe und des Endstoffes mithilfe der gezeigten Folie(n). (siehe Folie im Ordner) Der neue Stoff ist ein Reinstoff, der eine nur für ihn typische Kombination von Eigenschaften aufweist. Wegen seiner Sprödigkeit und hohen Schmelztemperatur ordnet man ihn wohl welchen Stoffen zu? Salze Beim Zusammenbringen und Erhitzen von Schwefel und einem Metall entsteht ein völlig neuer Stoff. Das jeweilige Metall und der Schwefel sind nicht mehr vorhanden. Einen solchen Vorgang, bei dem ein neuer Stoff entsteht und gleichzeitig andere Stoffe verschwinden, nennt man eine chemische Reaktion. Es gibt einige Merkmale chemischer Reaktionen - etwas offensichtlich Neues wird produziert, ein Gas wird erzeugt oder es entsteht Wärme oder diese wird verbraucht. Die chemischen Substanzen, die schließlich verändert werden, werden als Edukte oder Reaktanden bezeichnet, die neuen Substanzen, die gebildet werden, heißen Produkte. Chemische Gleichungen zeigen sowohl die einen als auch die anderen und andere Faktoren wie Energieänderungen, Katalysatoren usw. Bei diesen Gleichungen wird ein Pfeil benutzt, um anzuzeigen, dass eine chemische Reaktion stattgefunden hat. Im Allgemeinen hat eine chemische Reaktion dieses Format: Edukte => Produkte Werfen Sie zum Beispiel einen Blick auf die Reaktion, die entsteht, wenn Sie Ihren Gasherd anzünden, um Ihre Frühstückseier zu kochen. Methan (Erdgas) reagiert mit dem Sauerstoff in der Atmosphäre, um Kohlendioxid und Wasserdampf zu produzieren. Die chemische Gleichung, die diese Reaktion darstellt, sieht so aus: (mehr dazu im kommenden Jahr) CH4 (g) + 2 O2 (g) => CO2 (g) + 2 H2O (g)
63 63 3. Element und Verbindung 3.1 Analyse vs. Synthese Viele Metallsulfide, wie das Kupfersulfid aus Kapitel 2.1, kommen in der Natur in Form von Erzen vor, aus denen die Metalle gewonnen werden. Dies sind natürlich vorkommende Mineralien, die das Salz jeweils beinhalten. Wir wollen im Folgenden sehen, wie sich aus den Metallsulfiden, also den salzartigen Stoffen, die Metalle zurückgewinnen lassen. Als Beispiel betrachten wir die Zerlegung von Silbersulfid in seine Bestandteile. Silbersulfid => Silber + Schwefel Diese Zerlegung ist eine chemische Reaktion. Sie entspricht der Umkehrung der chemischen Reaktion, die bei der Bildung von Silbersulfid aus Silber und Schwefel abläuft. Eine Reaktion, bei der eine Verbindung in die einzelnen Elemente zerlegt wird, nennt man Analyse. Die Herstellung von chemischen Verbindungen aus Elementen oder anderen Verbindungen heisst Synthese Grundsätzlich lassen sich alle Metallsulfide in ihre Elemente zerlegen. Dies gelingt aber nur selten, weil die notwendigen Temperaturen nicht erreicht werden können. Die Zerlegung einer Verbindung unter Wärmezufuhr nennt man Thermolyse. 3.2 Physikalische vs. Chemische Trennverfahren Es ist äusserst wichtig, zwischen der Zerlegung einer Verbindung und der Zerlegung eines Gemischs zu unterscheiden: Im Skript "Trennverfahren" haben wir Verfahren kennen gelernt, mit denen man Gemische in ihre Bestandteile zerlegen kann. Bei solchen Zerlegungen treten keine Stoffumwandlungen ein; man spricht deshalb von einem physikalischen Trennverfahren. Eine Verbindung lässt sich aber mittels physikalischer Verfahren nicht trennen. Die Analyse ist also eine chemische Trennung; es tritt eine Stoffumwandlung ein. Aufgrund ihrer physikalischen oder chemischen Zerlegbarkeit lassen sich die Stoffe in verschiedene Klassen einteilen.
64 64 Aufgabe II: (siehe Beiblatt; Trennbarkeit Verbindungen, Gemische, Elemente) Übernehmen Sie die Skizze von der Tafel. Aufgabe III: Stellen Sie für die Reaktion der Metalle Eisen und Kupfer mit Schwefel das jeweilige Reaktionsschema (chemische Reaktion in Worten) auf. Eisen + Schwefel => Eisensulfid Kupfer + Schwefel => Kupfersulfid 4. Chemische Reaktion und Teilchenmodell Dem Teilchenmodell zu Folge bestehen die Elemente aus kleinsten kugelförmigen Teilchen. Geht man davon aus, dass diese Teilchen bei einer chemischen Reaktion nicht zerstört werden, müssten auch im Silbersulfid die Teilchen des Silbers und des Schwefels noch enthalten sein. Bei einer chemischen Reaktion löst sich die Anordnung der Teilchen in den Ausgangsstoffen auf; die Teilchen bilden eine neue Ordnung und damit einen neuen Stoff: das Reaktionsprodukt. Aufgabe IV: Diskutieren Sie mit Ihrem Pultnachbar über die obere Graphik. Was sagt diese aus? Die Anordnung der Teilchen bestimmt aber die Eigenschaften eines Stoffs mit. In einem Stoff weisen die Teilchen immer die gleiche Anordnung auf. Es ist deshalb nicht verwunderlich,
65 65 dass ein Reaktionsprodukt andere Eigenschaften aufweist als die Stoffe, aus denen es entstanden ist. Folglich können wir den Bezug des Teilchenmodells zur chemischen Reaktion zusammenfassen: Mit dem Teilchenmodell lässt sich die chemische Reaktion als Umgruppierung der kleinsten Teilchen deuten. 5. Chemische Reaktion und Energie Erhitzt man ein Gemisch aus Eisen und Schwefel nur in einem kleinen Bereich bis zum Aufglühen, so pflanzt sich das Glühen durch die ganze Stoffportion fort. Das Reaktionsprodukt Eisensulfid ist sehr heiß. Das Glühen der Stoffportion beobachtet man auch dann noch, wenn der Brenner schon lange entfernt worden ist. Folglich kann die Wärmeenergie, die das Glühen verursacht, nicht von außen kommen. Sie wird bei der Reaktion selbst freigesetzt. Dies lässt sich wie folgt erklären: Das Gemisch der Ausgangsstoffe Eisen und Schwefel hat einen bestimmten Energieinhalt. Die aus dem Gemisch entstehende Eisensulfidportion hat ebenfalls einen bestimmten Energieinhalt, der in diesem Fall aber kleiner ist als derjenige der Ausgangsstoffe. Der Unterschied zwischen den Energieinhalten zeigt sich bei der Reaktion: Es wird Energie in Form von Wärme abgegeben. Aufgabe V: Übernehmen Sie die beiden Skizzen von der Tafel.
66 Exotherme vs. Endotherme Reaktionen Chemische Reaktionen, die unter Energieabgabe verlaufen, bezeichnet man als exotherme Reaktionen; solche, die nur unter andauernder Energieaufnahme ablaufen, als endotherme Reaktionen. Meist erfolgt die Zufuhr oder Abgabe von Energie bei chemischen Reaktionen in Form von Wärme. Bei exothermen Reaktionen sind die Produkte energieärmer als die Edukte, bei endothermen Reaktionen ist es gerade umgekehrt. Neben der Bildung neuer Stoffe ist die Abgabe oder Aufnahme von Energie ein Hinweis auf eine chemische Reaktion. Es gilt dabei folgende Regel: Die Energie, die bei der Bildung einer Verbindung aus den Elementen freigesetzt wird, ist genauso groß wie die Energie, die zur Zerlegung der Verbindung aufgebracht werden muss. Obwohl bei der Reaktion von Eisen mit Schwefel sehr viel Wärme freigesetzt wird, kommt die Reaktion nicht von allein, sondern erst durch Wärmezufuhr in Gang. Diese Energie nennt man Aktivierungsenergie. Es genügt allerdings, nur einen sehr kleinen Anteil des Gemisches zu erhitzen. Hat die Reaktion an einer Stelle eingesetzt, reicht die frei werdende Wärme dazu aus, dass die Reaktion von selbst weiterläuft. Die Aktivierungsenergie ist also diejenige Energie, die den Teilchen der Ausgangsstoffe zugeführt werden muss, damit sie in den reaktionsbereiten Zustand übergehen. Da die Reaktion von Eisen mit Schwefel exotherm verläuft, wird bei der Bildung der Teilchenanordnung des Eisensulfids insgesamt Energie freigesetzt. Diese Energie kann zur Aktivierung weiterer Teilchen der Ausgangsstoffe führen. Auch bei einer endothermen Reaktion müssen die Teilchen zuerst aktiviert werden, bevor sie miteinander reagieren können. Insgesamt sind hier die Teilchen der Produkte energiereicher als die Teilchen der Edukte. Eine endotherme Reaktion läuft
TEILCHENMODELL UND AGGREGATZUSTÄNDE (FMS)
 1 KSO TEILCHENMODELL UND AGGREGATZUSTÄNDE (FMS) Skript Teilchenmodell und Aggregatzustände (FMS) V1.0 08/13 Bor 2 INHALTSVERZEICHNIS "TEILCHENMODELL UND AGGREGATZUSTÄNDE" 1. Stoffe bestehen aus kleinsten
1 KSO TEILCHENMODELL UND AGGREGATZUSTÄNDE (FMS) Skript Teilchenmodell und Aggregatzustände (FMS) V1.0 08/13 Bor 2 INHALTSVERZEICHNIS "TEILCHENMODELL UND AGGREGATZUSTÄNDE" 1. Stoffe bestehen aus kleinsten
CHARAKTERISIERUNG VON STOFFEN (FMS)
 1 KSO CHARAKTERISIERUNG VON STOFFEN (FMS) Skript Charakterisierung von Stoffen (FMS) V1.0 07/13 Bor 2 INHALTSVERZEICHNIS "CHARAKTERISIERUNG VON STOFFEN" 1. Einfache Möglichkeiten zur Unterscheidung von
1 KSO CHARAKTERISIERUNG VON STOFFEN (FMS) Skript Charakterisierung von Stoffen (FMS) V1.0 07/13 Bor 2 INHALTSVERZEICHNIS "CHARAKTERISIERUNG VON STOFFEN" 1. Einfache Möglichkeiten zur Unterscheidung von
Lösungen (mit Aufgabenstellungen)
 Lösungen (mit Aufgabenstellungen) Aufgaben A 1 Welche der oben beschriebenen Stoffeigenschaften sind chemische Eigenschaften? Chemische Eigenschaften sind die Wärmebeständigkeit und die Brennbarkeit. A
Lösungen (mit Aufgabenstellungen) Aufgaben A 1 Welche der oben beschriebenen Stoffeigenschaften sind chemische Eigenschaften? Chemische Eigenschaften sind die Wärmebeständigkeit und die Brennbarkeit. A
Jeder Gegenstand Stoff Jeder Stoff Eigenschaften
 Stoffe Jeder Gegenstand der Welt, die euch umgibt, besteht aus einem chemischen Stoff. Jeder Stoff hat ganz spezielle Eigenschaften, die bestimmen, wie er verwendet wird. Die Chemie hat die Aufgabe die
Stoffe Jeder Gegenstand der Welt, die euch umgibt, besteht aus einem chemischen Stoff. Jeder Stoff hat ganz spezielle Eigenschaften, die bestimmen, wie er verwendet wird. Die Chemie hat die Aufgabe die
Alles was uns umgibt!
 Was ist Chemie? Womit befasst sich die Chemie? Die Chemie ist eine Naturwissenschaft, die sich mit der Materie (den Stoffen), ihren Eigenschaften und deren Umwandlung befasst Was ist Chemie? Was ist Materie?
Was ist Chemie? Womit befasst sich die Chemie? Die Chemie ist eine Naturwissenschaft, die sich mit der Materie (den Stoffen), ihren Eigenschaften und deren Umwandlung befasst Was ist Chemie? Was ist Materie?
flüssig-flüssig homogen fest-flüssig Sprudel Stoffgemisch fest-fest Weinbrand Legierung Emulsion heterogen fest-flüssig Rauch
 1. 2. dazugehörige Lies den Text Erklärung. durch. ein zweites Mal durch und unterstreiche dabei wichtige Begriffe und die Partnerpuzzle zu Reinstoffen und Mischungen 3. (Gemäßigter Vervollständigt Gruppe
1. 2. dazugehörige Lies den Text Erklärung. durch. ein zweites Mal durch und unterstreiche dabei wichtige Begriffe und die Partnerpuzzle zu Reinstoffen und Mischungen 3. (Gemäßigter Vervollständigt Gruppe
Chemie Fragenkatalog Jahrgang 8
 Chemie Fragenkatalog Jahrgang 8 - Stoffe und ihre Eigenschaften - Stoffgemische und Trennverfahren - Vom Aufbau der Stoffe - Die chemische Reaktion - Luft und Verbrennung - Gewinnung von Metallen Redoxreaktionen
Chemie Fragenkatalog Jahrgang 8 - Stoffe und ihre Eigenschaften - Stoffgemische und Trennverfahren - Vom Aufbau der Stoffe - Die chemische Reaktion - Luft und Verbrennung - Gewinnung von Metallen Redoxreaktionen
Aufgabe: Erkläre folgende Tatsache mit Hilfe des Teilchenmodells! An heißen Tagen bilden sich auf einer gekühlten Getränkeflasche Wassertropfen.
 An heißen Tagen bilden sich auf einer gekühlten Getränkeflasche Wassertropfen. Bei einem Flüssigkeitsthermometer kann die Temperatur an der Höhe des Flüssigkeitsstandes im Röhrchen abgelesen werden. 1827
An heißen Tagen bilden sich auf einer gekühlten Getränkeflasche Wassertropfen. Bei einem Flüssigkeitsthermometer kann die Temperatur an der Höhe des Flüssigkeitsstandes im Röhrchen abgelesen werden. 1827
Naturwissenschaft Vermutungswissen Alles ist Chemie!!! Analyse Synthese
 SPF 2 Chemie Was ist Chemie? - Chemie ist eine Naturwissenschaft Wie schafft eine Naturwissenschaft wissen? - Vermutungswissen; naturwissenschaftlicher Erkenntnisgang Womit beschäftigt sich die Chemie?
SPF 2 Chemie Was ist Chemie? - Chemie ist eine Naturwissenschaft Wie schafft eine Naturwissenschaft wissen? - Vermutungswissen; naturwissenschaftlicher Erkenntnisgang Womit beschäftigt sich die Chemie?
Kernaussagen zum Teilchenmodell
 Kernaussagen zum Teilchenmodell Lernbereich 2: Stoffe und ihre Eigenschaften Von beobachtbaren Stoffeigenschaften zum Teilchenmodell Kompetenzerwartung 8 (NTG) und 9 (SG): Die Schülerinnen und Schüler
Kernaussagen zum Teilchenmodell Lernbereich 2: Stoffe und ihre Eigenschaften Von beobachtbaren Stoffeigenschaften zum Teilchenmodell Kompetenzerwartung 8 (NTG) und 9 (SG): Die Schülerinnen und Schüler
LB1 Stoffe. LB1 Stoffe. LB1 Stoffe. Womit beschäftigt sich die Chemie?
 Lernkartei Klasse 7 LB1: Stoffe Womit beschäftigt sich die Chemie? LB1 Stoffe mit den Stoffen, ihren Eigenschaften und ihren Veränderungen (Stoffumwandlungen) Was sind Stoffe? LB1 Stoffe Stoffe sind die
Lernkartei Klasse 7 LB1: Stoffe Womit beschäftigt sich die Chemie? LB1 Stoffe mit den Stoffen, ihren Eigenschaften und ihren Veränderungen (Stoffumwandlungen) Was sind Stoffe? LB1 Stoffe Stoffe sind die
Unterrichtskonzept zum Themenbereich Wasser (NT 5.1.2)
 Staatsinstitut für Schulqualität und Bildungsforschung Unterrichtskonzept zum Themenbereich Wasser (NT 5.1.2) Lehrplanbezug Beim Themenbereich Wasser sollen die Schülerinnen und Schüler die drei Aggregatzustände
Staatsinstitut für Schulqualität und Bildungsforschung Unterrichtskonzept zum Themenbereich Wasser (NT 5.1.2) Lehrplanbezug Beim Themenbereich Wasser sollen die Schülerinnen und Schüler die drei Aggregatzustände
Flüssigkeitsthermometer Bimetallthermometer Gasthermometer Celsius Fahrenheit
 Wärme Ob etwas warm oder kalt ist können wir fühlen. Wenn etwas wärmer ist, so hat es eine höhere Temperatur. Temperaturen können wir im Bereich von etwa 15 Grad Celsius bis etwa 45 Grad Celsius recht
Wärme Ob etwas warm oder kalt ist können wir fühlen. Wenn etwas wärmer ist, so hat es eine höhere Temperatur. Temperaturen können wir im Bereich von etwa 15 Grad Celsius bis etwa 45 Grad Celsius recht
Textverständnis Strukturieren von Fachbegriffen Text Ggf. Demonstrationsbeispiele. Umgang mit Fachsprache Verstehendes Lesen von Fachtexten
 Methode: Aktivierung mit der Methode Partnerpuzzle Fach: Naturwissenschaften Thema des Unterrichtsbeispiels: Stoffgemisch Klassenstufe: 5-6 Kompetenzbereich: Textverarbeitung Ziele Materialien (Raum-)ausstattung
Methode: Aktivierung mit der Methode Partnerpuzzle Fach: Naturwissenschaften Thema des Unterrichtsbeispiels: Stoffgemisch Klassenstufe: 5-6 Kompetenzbereich: Textverarbeitung Ziele Materialien (Raum-)ausstattung
TIPP alle Rechenaufgaben mit Einheit, Ergebnis und Antwortsatz!
 1 Klassenarbeit Chemie 1/5 TIPP alle Rechenaufgaben mit Einheit, Ergebnis und Antwortsatz! 1 Stoffe und Stoffgemische 1.1 Ordne die Begriffe Verbindung, Element, Stoff, Mischung, Reinstoff, Metall, Nichtmetall,
1 Klassenarbeit Chemie 1/5 TIPP alle Rechenaufgaben mit Einheit, Ergebnis und Antwortsatz! 1 Stoffe und Stoffgemische 1.1 Ordne die Begriffe Verbindung, Element, Stoff, Mischung, Reinstoff, Metall, Nichtmetall,
Aggregatzustände und deren Temperaturabhängigkeit
 Name: Sissy Freund Semester: Sommersemester 2013 Klassenstufen: 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit Beschreibung des Themas und zugehörige Lernziele 2 Auf einen Blick: Dieses Protokoll
Name: Sissy Freund Semester: Sommersemester 2013 Klassenstufen: 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit Beschreibung des Themas und zugehörige Lernziele 2 Auf einen Blick: Dieses Protokoll
02. Was kann man über die Teilchen eines schmelzenden Stoffes aussagen?
 01. Nenne je beide Übergänge zwischen a) dem festen und dem flüssigen b) dem flüssigen und dem gasförmigen c) dem festen und dem gasförmigen Aggregatzustand. 02. Was kann man über die Teilchen eines schmelzenden
01. Nenne je beide Übergänge zwischen a) dem festen und dem flüssigen b) dem flüssigen und dem gasförmigen c) dem festen und dem gasförmigen Aggregatzustand. 02. Was kann man über die Teilchen eines schmelzenden
Das Kugelteilchenmodell und Aggregatzustände
 Das Kugelteilchenmodell und Aggregatzustände Wie kann man sich die drei Aggregatzustände im Teilchenmodell vorstellen? Siehe dazu S. 38 im Buch an! Feststoffe: Teilchen eng beieinander; feste Plätze; keine
Das Kugelteilchenmodell und Aggregatzustände Wie kann man sich die drei Aggregatzustände im Teilchenmodell vorstellen? Siehe dazu S. 38 im Buch an! Feststoffe: Teilchen eng beieinander; feste Plätze; keine
Versuch: In der Natur verschwindet nichts - Lösen und Auskristallisieren von Salz
 Name: Datum: Versuch: In der Natur verschwindet nichts - Lösen und Auskristallisieren von Salz Material: Kochsalz (NaCl), Leitungswasser, Mineralwasser, Becherglas, Spatel, destilliertes Wasser, Alu-Teelichtschalen,
Name: Datum: Versuch: In der Natur verschwindet nichts - Lösen und Auskristallisieren von Salz Material: Kochsalz (NaCl), Leitungswasser, Mineralwasser, Becherglas, Spatel, destilliertes Wasser, Alu-Teelichtschalen,
man sagt : Phosphor + Sauerstoff reagieren Tetraphosphorzu dekaoxid
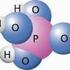 Die Luft 1.Versuch Wir entzünden eine Kerze und stülpen ein Becherglas darüber. Beobachtung : Nach kurzer Zeit erlischt die Flamme. Feststellung : Für die Verbrennung in unserer Umwelt ist Luft notwendig.
Die Luft 1.Versuch Wir entzünden eine Kerze und stülpen ein Becherglas darüber. Beobachtung : Nach kurzer Zeit erlischt die Flamme. Feststellung : Für die Verbrennung in unserer Umwelt ist Luft notwendig.
Stoffe und ihre Eigenschaften
 Stoffe und ihre Eigenschaften 1.) Welche Stoffeigenschaften kennen Sie? Zählen Sie auf. Aussehen, Geruch, Geschmack, Verformbarkeit, elektr. LF, Magnetismus, Härte, Verhalten beim Erhitzen, Brennbarkeit;
Stoffe und ihre Eigenschaften 1.) Welche Stoffeigenschaften kennen Sie? Zählen Sie auf. Aussehen, Geruch, Geschmack, Verformbarkeit, elektr. LF, Magnetismus, Härte, Verhalten beim Erhitzen, Brennbarkeit;
Naturwissenschaft Vermutungswissen Alles ist Chemie!!! Analyse Synthese
 SPF 2 Chemie Was ist Chemie? - Chemie ist eine Naturwissenschaft Wie schafft eine Naturwissenschaft wissen? - Vermutungswissen; naturwissenschaftlicher Erkenntnisgang Womit beschäftigt sich die Chemie?
SPF 2 Chemie Was ist Chemie? - Chemie ist eine Naturwissenschaft Wie schafft eine Naturwissenschaft wissen? - Vermutungswissen; naturwissenschaftlicher Erkenntnisgang Womit beschäftigt sich die Chemie?
Mikrokosmos Vorstellungen von der Welt des Kleinen
 II Stoffe im Alltag Beitrag 2 Mikrokosmos (Klassen 5 7) 1 von 32 Mikrokosmos Vorstellungen von der Welt des Kleinen Ariane Pieta, Leonberg Unterschiedliche Alltagsphänomene können durch einfache Experimente
II Stoffe im Alltag Beitrag 2 Mikrokosmos (Klassen 5 7) 1 von 32 Mikrokosmos Vorstellungen von der Welt des Kleinen Ariane Pieta, Leonberg Unterschiedliche Alltagsphänomene können durch einfache Experimente
Versuch 1. Baue ein Thermometer. Nun erwärme das Wasser im Erlenmeyerkolben auf einem Stövchen. Was geschieht?
 Versuch 1 Nun erwärme das Wasser im Erlenmeyerkolben auf einem Stövchen. Was geschieht? Baue ein Thermometer Fülle den Erlenmeyerkolben mit Wasser und verschließe ihn mit dem Stopfen. Im Stopfen befindet
Versuch 1 Nun erwärme das Wasser im Erlenmeyerkolben auf einem Stövchen. Was geschieht? Baue ein Thermometer Fülle den Erlenmeyerkolben mit Wasser und verschließe ihn mit dem Stopfen. Im Stopfen befindet
3. Stoffgemische und Ihre Zerlegung
 3. Stoffgemische und Ihre Zerlegung Aus Stoffgemischen lassen sich die einzelnen Bestandteile durch physikalische Trennverfahren isolieren. Wenn ein Stoff mittels physikalischen Methoden nicht weiter zerlegen
3. Stoffgemische und Ihre Zerlegung Aus Stoffgemischen lassen sich die einzelnen Bestandteile durch physikalische Trennverfahren isolieren. Wenn ein Stoff mittels physikalischen Methoden nicht weiter zerlegen
Das ist ja nicht normal!
 1 Das ist ja nicht normal! Warum bekommen Straßen ständig neue Schlaglöcher? Warum geht eine Wasserflasche kaputt, wenn sie vollgefüllt ins Tiefkühlfach liegt? Warum schwimmt Eis auf Wasser? Und warum
1 Das ist ja nicht normal! Warum bekommen Straßen ständig neue Schlaglöcher? Warum geht eine Wasserflasche kaputt, wenn sie vollgefüllt ins Tiefkühlfach liegt? Warum schwimmt Eis auf Wasser? Und warum
Schulversuchspraktikum. Constanze Koch. Sommersemester Klassenstufen 5 & 6. Wasser als Lösungsmittel. Kurzprotokoll
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 5 & 6 Wasser als Lösungsmittel Kurzprotokoll Auf einen Blick: In diesem Protokoll werden ein Lehrerversuch und vier Schülerversuche
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 5 & 6 Wasser als Lösungsmittel Kurzprotokoll Auf einen Blick: In diesem Protokoll werden ein Lehrerversuch und vier Schülerversuche
Buch Seite 3-5. WIW - HTL St. Pölten
 Aufbau der Materie Aggregatzustände Buch Seite 3-5 A.1.1 1 Stoffbegriff / Materie / Energie Materie ist die Gesamtheit aller Stoffe: Jeder Stoff füllt einen Raum V (Einheit: m³) aus Jeder Stoff besitzt
Aufbau der Materie Aggregatzustände Buch Seite 3-5 A.1.1 1 Stoffbegriff / Materie / Energie Materie ist die Gesamtheit aller Stoffe: Jeder Stoff füllt einen Raum V (Einheit: m³) aus Jeder Stoff besitzt
Chemische Reaktionen ergeben neue Stoffe mit neuen Eigenschaften
 1 Grundbegriffe 1.1 Die Entwicklung der Chemie Im Vergleich zu anderen Naturwissenschaften wie der Physik oder der Biologie ist die Chemie eine junge Wissenschaft. Denn erst vor etwa 200 Jahren gelangten
1 Grundbegriffe 1.1 Die Entwicklung der Chemie Im Vergleich zu anderen Naturwissenschaften wie der Physik oder der Biologie ist die Chemie eine junge Wissenschaft. Denn erst vor etwa 200 Jahren gelangten
Schulversuchspraktikum. Isabel Böselt. Sommersemester Klassenstufen 5 & 6. Aggregatzustände. und deren Temperaturabhängigkeit
 Schulversuchspraktikum Isabel Böselt Sommersemester 2014 Klassenstufen 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit 1 Konzept und Lernziele 1 Auf einen Blick: In diesem Protokoll werden einfache
Schulversuchspraktikum Isabel Böselt Sommersemester 2014 Klassenstufen 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit 1 Konzept und Lernziele 1 Auf einen Blick: In diesem Protokoll werden einfache
TU Bergakademie Freiberg Institut für Werkstofftechnik Schülerlabor science meets school Werkstoffe und Technologien in Freiberg
 TU Bergakademie Freiberg Institut für Werkstofftechnik Schülerlabor science meets school Werkstoffe und Technologien in Freiberg GRUNDLAGEN Modul: Versuch: Gießen von Metallen (Änderung von Volumen und
TU Bergakademie Freiberg Institut für Werkstofftechnik Schülerlabor science meets school Werkstoffe und Technologien in Freiberg GRUNDLAGEN Modul: Versuch: Gießen von Metallen (Änderung von Volumen und
Stoffeigenschafte n, Trennmethoden und Verbindungen
 Stoffeigenschafte n, Trennmethoden und Verbindungen Linus Metzler Stoffeigenschaften, Trennmethoden und Verbindungen L i m e n e t L i n u s M e t z l e r W a t t s t r a s s e 3 9 3 0 6 F r e i d o r
Stoffeigenschafte n, Trennmethoden und Verbindungen Linus Metzler Stoffeigenschaften, Trennmethoden und Verbindungen L i m e n e t L i n u s M e t z l e r W a t t s t r a s s e 3 9 3 0 6 F r e i d o r
Marco Kröpfl, Doris Wagner 1
 Marco Kröpfl, Doris Wagner 1 ZIELE Die Phasenübergänge anhand des Teilchenmodells beschreiben können Unter welchen Bedingungen ein Phasenübergang stattfindet & welche Größen dabei eine Rolle spielen THEMA
Marco Kröpfl, Doris Wagner 1 ZIELE Die Phasenübergänge anhand des Teilchenmodells beschreiben können Unter welchen Bedingungen ein Phasenübergang stattfindet & welche Größen dabei eine Rolle spielen THEMA
Lösungen Thema: Stoffe und ihre Eigenschaften
 Lösungen Thema: Stoffe und ihre Eigenschaften zu 1: Siedetemperatur, Schmelztemperatur, Dichte (Löslichkeit) zu 2: Brennbarkeit, Härte, Löslichkeit, Farbe, Geruch zu 3: zu 4: Bei der Flüssigkeit handelt
Lösungen Thema: Stoffe und ihre Eigenschaften zu 1: Siedetemperatur, Schmelztemperatur, Dichte (Löslichkeit) zu 2: Brennbarkeit, Härte, Löslichkeit, Farbe, Geruch zu 3: zu 4: Bei der Flüssigkeit handelt
Musterlösungen zum Schülerband. 1 Stoffe und Stoffänderungen
 1 Musterlösungen zum Schülerband 1 Stoffe und Stoffänderungen Stoffe, Teilchen, Eigenschaften Werner Eisner Paul Gietz Axel Justus Klaus Laitenberger Hildegard Nickolay Werner Schierle Bärbel Schmidt Michael
1 Musterlösungen zum Schülerband 1 Stoffe und Stoffänderungen Stoffe, Teilchen, Eigenschaften Werner Eisner Paul Gietz Axel Justus Klaus Laitenberger Hildegard Nickolay Werner Schierle Bärbel Schmidt Michael
Das sind vielleicht Zustände!
 1 Das sind vielleicht Zustände! Wasser ist der einzige Stoff auf unserem Planeten, der in drei verschiedenen Formen, sogenannten Aggregatszuständen, vorkommt: fest, flüssig und gasförmig. Das heißt, Wasser
1 Das sind vielleicht Zustände! Wasser ist der einzige Stoff auf unserem Planeten, der in drei verschiedenen Formen, sogenannten Aggregatszuständen, vorkommt: fest, flüssig und gasförmig. Das heißt, Wasser
Diffusion und Osmose. Osmose 1
 Osmose 1 Diffusion und Osmose In flüssigen oder gasförmigen Medien sind die Moleküle in ständiger Bewegung. Sie bewegen sich gradlinig, bis sie auf ein anderes Molekül stossen. Diese Bewegung führt mit
Osmose 1 Diffusion und Osmose In flüssigen oder gasförmigen Medien sind die Moleküle in ständiger Bewegung. Sie bewegen sich gradlinig, bis sie auf ein anderes Molekül stossen. Diese Bewegung führt mit
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Lernwerkstatt für die Klassen 5 bis 6: Temperatur und Wärme
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt für die Klassen 5 bis 6: Temperatur und Wärme Das komplette Material finden Sie hier: School-Scout.de SCHOOL-SCOUT Lernwerkstatt
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt für die Klassen 5 bis 6: Temperatur und Wärme Das komplette Material finden Sie hier: School-Scout.de SCHOOL-SCOUT Lernwerkstatt
4.1 Vergleich von physikalischem Vorgang und chemischer Reaktion. Aufgabe. Woran lassen sich chemische Reaktionen erkennen? (1)
 Naturwissenschaften - Chemie - Allgemeine Chemie - 4 Chemische Reaktionen (P75200) 4. Vergleich von physikalischem Vorgang und chemischer Reaktion Experiment von: Phywe Gedruckt:.0.203 2:58:37 intertess
Naturwissenschaften - Chemie - Allgemeine Chemie - 4 Chemische Reaktionen (P75200) 4. Vergleich von physikalischem Vorgang und chemischer Reaktion Experiment von: Phywe Gedruckt:.0.203 2:58:37 intertess
Bundesrealgymnasium Imst. Chemie 2010-11. Klasse 4. Einführung Stoffe
 Bundesrealgymnasium Imst Chemie 2010-11 Einführung Stoffe Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter
Bundesrealgymnasium Imst Chemie 2010-11 Einführung Stoffe Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter
Löslichkeit und Mischbarkeit von Stoffen
 Löslichkeit und Mischbarkeit von Stoffen Fragestellung: Wie lösen sich unterschiedliche Stoffe in Wasser und Benzin? Chemikalien: Zucker, Kreidepulver (Kalkstein), Kochsalz, Soda, Sand, Öl, Wasser, Benzin
Löslichkeit und Mischbarkeit von Stoffen Fragestellung: Wie lösen sich unterschiedliche Stoffe in Wasser und Benzin? Chemikalien: Zucker, Kreidepulver (Kalkstein), Kochsalz, Soda, Sand, Öl, Wasser, Benzin
Definiere den Begriff Chemischer Vorgang! Definiere den Begriff Physikalischer Vorgang!
 Chemischer Vorgang! Stoffänderung, keine Zustandsänderung, mit Energiebeteiligung Physikalischer Vorgang! Zustandsänderung, keine Stoffänderung (z.b. Lösen, Aggregatzustände,...) Erkläre die Begriffe heterogenes
Chemischer Vorgang! Stoffänderung, keine Zustandsänderung, mit Energiebeteiligung Physikalischer Vorgang! Zustandsänderung, keine Stoffänderung (z.b. Lösen, Aggregatzustände,...) Erkläre die Begriffe heterogenes
1. Skizzieren Sie, wie man in der Hauptschule die Aggregatzustände mit Hilfe eines Teilchenmodells deutet.
 Universität: Julius-Maximilians-Universität Würzburg Seminar: Klausurübung Fachdidaktik Physik Dozent: Dr. Thomas Wilhelm Referentin: Dorothée Berthold Datum: 2.12.2009 (WS 2009/10) FÄCHERGRUPPE DER HAUPTSCHULE
Universität: Julius-Maximilians-Universität Würzburg Seminar: Klausurübung Fachdidaktik Physik Dozent: Dr. Thomas Wilhelm Referentin: Dorothée Berthold Datum: 2.12.2009 (WS 2009/10) FÄCHERGRUPPE DER HAUPTSCHULE
B E I S P I E L A R B E I T / Aufgaben. Kultusministerium. Name, Vorname: Klasse: Schule: Seite 1 von 6
 B E I S P I E L A R B E I T / Aufgaben Kultusministerium Name, Vorname: Klasse: Schule: Seite 1 von 6 B E I S P I E L A R B E I T / Aufgaben Aufgabe 1: Stoffe und ihre Eigenschaften a) Die Naturwissenschaft
B E I S P I E L A R B E I T / Aufgaben Kultusministerium Name, Vorname: Klasse: Schule: Seite 1 von 6 B E I S P I E L A R B E I T / Aufgaben Aufgabe 1: Stoffe und ihre Eigenschaften a) Die Naturwissenschaft
1.11 Welcher Stoff ist es?
 L *** 1.11 Welcher Stoff ist es? Didaktisch-methodische Hinweise Im Arbeitsblatt wird der Versuch des Lösens von vier verschiedenen Salzen in Wasser in einem Labor beschrieben. Aus Zahlenangaben müssen
L *** 1.11 Welcher Stoff ist es? Didaktisch-methodische Hinweise Im Arbeitsblatt wird der Versuch des Lösens von vier verschiedenen Salzen in Wasser in einem Labor beschrieben. Aus Zahlenangaben müssen
CHEMISCHE REAKTIONEN (SEKP)
 KSO CHEMISCHE REAKTIONEN (SEKP) Skript Chemische Reaktionen (SekP) V1.0 01/15 Bor 2 INHALTSVERZEICHNIS "CHEMISCHE REAKTIONEN" 1. Einleitung...03 2. Stoffe wandeln sich um... 04 2.1 Kupfer reagiert mit
KSO CHEMISCHE REAKTIONEN (SEKP) Skript Chemische Reaktionen (SekP) V1.0 01/15 Bor 2 INHALTSVERZEICHNIS "CHEMISCHE REAKTIONEN" 1. Einleitung...03 2. Stoffe wandeln sich um... 04 2.1 Kupfer reagiert mit
Übersicht. Wasser. Zustandsformen des Wasser. Luft. Hat die Luft ein Gewicht? Feuer. Wir bauen einen Feuerlöscher.
 Übersicht Wasser Versuch 1: Versuch 2: Versuch 3: Flüssigkeitsaustausch Sprengkugelversuch Zustandsformen des Wasser Luft Versuch 4: Versuch 5: Hat die Luft ein Gewicht? Feuer braucht Luft. Feuer Versuch
Übersicht Wasser Versuch 1: Versuch 2: Versuch 3: Flüssigkeitsaustausch Sprengkugelversuch Zustandsformen des Wasser Luft Versuch 4: Versuch 5: Hat die Luft ein Gewicht? Feuer braucht Luft. Feuer Versuch
Chemie. Die Chemie beschäftigt sich mit materiellen Dingen; Sie ist die Lehre von den Stoffen.
 Chemie Die Chemie beschäftigt sich mit materiellen Dingen; Sie ist die Lehre von den Stoffen. Stoffeinteilung: Stoffdefinition: Ein Stoff liegt dann vor, wenn dieser ein Volumen einnimmt und eine Masse
Chemie Die Chemie beschäftigt sich mit materiellen Dingen; Sie ist die Lehre von den Stoffen. Stoffeinteilung: Stoffdefinition: Ein Stoff liegt dann vor, wenn dieser ein Volumen einnimmt und eine Masse
1. Klausur ist am 5.12.! Jetzt lernen! Klausuranmeldung: Bitte heute in Listen eintragen!
 1. Klausur ist am 5.12.! Jetzt lernen! Klausuranmeldung: Bitte heute in Listen eintragen! Aggregatzustände Fest, flüssig, gasförmig Schmelz -wärme Kondensations -wärme Die Umwandlung von Aggregatzuständen
1. Klausur ist am 5.12.! Jetzt lernen! Klausuranmeldung: Bitte heute in Listen eintragen! Aggregatzustände Fest, flüssig, gasförmig Schmelz -wärme Kondensations -wärme Die Umwandlung von Aggregatzuständen
Thermodynamik 1. Typen der thermodynamischen Systeme. Intensive und extensive Zustandsgröße. Phasenübergänge. Ausdehnung bei Erwärmung.
 Thermodynamik 1. Typen der thermodynamischen Systeme. Intensive und extensive Zustandsgröße. Phasenübergänge. Ausdehnung bei Erwärmung. Nullter und Erster Hauptsatz der Thermodynamik. Thermodynamische
Thermodynamik 1. Typen der thermodynamischen Systeme. Intensive und extensive Zustandsgröße. Phasenübergänge. Ausdehnung bei Erwärmung. Nullter und Erster Hauptsatz der Thermodynamik. Thermodynamische
Curriculum Chemie Klasse 8 Albert-Einstein-Gymnasium Ulm
 Curriculum Chemie Klasse 8 Albert-Einstein-Gymnasium Ulm Klasse 8 Themen Experimentieren im Chemieunterricht Grundregeln des Experimentierens 5. - mit Laborgeräten sachgerecht umgehen und die Sicherheitsmaßnahmen
Curriculum Chemie Klasse 8 Albert-Einstein-Gymnasium Ulm Klasse 8 Themen Experimentieren im Chemieunterricht Grundregeln des Experimentierens 5. - mit Laborgeräten sachgerecht umgehen und die Sicherheitsmaßnahmen
8.4.5 Wasser sieden bei Zimmertemperatur ******
 8.4.5 ****** 1 Motivation Durch Verminderung des Luftdrucks siedet Wasser bei Zimmertemperatur. 2 Experiment Abbildung 1: Ein druckfester Glaskolben ist zur Hälfte mit Wasser gefüllt, so dass die Flüsigkeit
8.4.5 ****** 1 Motivation Durch Verminderung des Luftdrucks siedet Wasser bei Zimmertemperatur. 2 Experiment Abbildung 1: Ein druckfester Glaskolben ist zur Hälfte mit Wasser gefüllt, so dass die Flüsigkeit
Geologie, Physik. Mit der Veränderung von Stoffen
 Fragen und Antworten für den ersten Physiktest der 2. Klasse Seite: 1 von 5 1. Nenne 7 Naturwissenschaften! Biologie, Chemie, Astronomie, Meteorologie, Mineralogie, Geologie, Physik 2. Womit beschäftigt
Fragen und Antworten für den ersten Physiktest der 2. Klasse Seite: 1 von 5 1. Nenne 7 Naturwissenschaften! Biologie, Chemie, Astronomie, Meteorologie, Mineralogie, Geologie, Physik 2. Womit beschäftigt
(VIII) Wärmlehre. Wärmelehre Karim Kouz WS 2014/ Semester Biophysik
 Quelle: http://www.pro-physik.de/details/news/1666619/neues_bauprinzip_fuer_ultrapraezise_nuklearuhr.html (VIII) Wärmlehre Karim Kouz WS 2014/2015 1. Semester Biophysik Wärmelehre Ein zentraler Begriff
Quelle: http://www.pro-physik.de/details/news/1666619/neues_bauprinzip_fuer_ultrapraezise_nuklearuhr.html (VIII) Wärmlehre Karim Kouz WS 2014/2015 1. Semester Biophysik Wärmelehre Ein zentraler Begriff
Verbrennung einer Kerze
 Verbrennung einer Kerze Schauen wir uns zunächst die Kerze genauer an. Aus welchen Bestandteilen besteht sie? Und wozu dienen diese? Bestandteil Stoff Funktion Der Stoff ist das Material, woraus ein Körper
Verbrennung einer Kerze Schauen wir uns zunächst die Kerze genauer an. Aus welchen Bestandteilen besteht sie? Und wozu dienen diese? Bestandteil Stoff Funktion Der Stoff ist das Material, woraus ein Körper
4.2 Reaktion von Kupfer und Schwefel. Aufgabe. Woran lassen sich chemische Reaktionen erkennen? (2)
 Naturwissenschaften - Chemie - Allgemeine Chemie - 4 Chemische Reaktionen (P75300) 4.2 Reaktion von Kupfer und Schwefel Experiment von: Phywe Gedruckt:.0.203 2:59:32 intertess (Version 3.06 B200, Export
Naturwissenschaften - Chemie - Allgemeine Chemie - 4 Chemische Reaktionen (P75300) 4.2 Reaktion von Kupfer und Schwefel Experiment von: Phywe Gedruckt:.0.203 2:59:32 intertess (Version 3.06 B200, Export
Was passiert denn genau?
 Was passiert denn genau? - Bei chemischen Reaktionen entstehen neue Stoffe, mit neuen Eigenschaften. - Im Teilchenmodell stellen wir uns vor, dass Kugelteilchen (Edukte) neu kombiniert werden. - Wenn wir
Was passiert denn genau? - Bei chemischen Reaktionen entstehen neue Stoffe, mit neuen Eigenschaften. - Im Teilchenmodell stellen wir uns vor, dass Kugelteilchen (Edukte) neu kombiniert werden. - Wenn wir
2.1 Eigenschaften von Stoffgemischen. Aufgabe. Welche Eigenschaften haben Stoffgemische?
 Naturwissenschaften - Chemie - Allgemeine Chemie - 2 Stoffgemische (P750600) 2. Eigenschaften von Stoffgemischen Experiment von: Phywe Gedruckt:.0.203 2:49:48 intertess (Version 3.06 B200, Export 2000)
Naturwissenschaften - Chemie - Allgemeine Chemie - 2 Stoffgemische (P750600) 2. Eigenschaften von Stoffgemischen Experiment von: Phywe Gedruckt:.0.203 2:49:48 intertess (Version 3.06 B200, Export 2000)
B E I S P I E L A R B E I T / Aufgaben. Kultusministerium
 B E I S P I E L A R B E I T / Aufgaben Kultusministerium Name, Vorname: Klasse: Schule: Seite 1 von 6 B E I S P I E L A R B E I T / Aufgaben Aufgabe 1: Stoffe und ihre Eigenschaften a) Die Naturwissenschaft
B E I S P I E L A R B E I T / Aufgaben Kultusministerium Name, Vorname: Klasse: Schule: Seite 1 von 6 B E I S P I E L A R B E I T / Aufgaben Aufgabe 1: Stoffe und ihre Eigenschaften a) Die Naturwissenschaft
Verbrennung einer Kerze
 Verbrennung einer Kerze Zünde eine Kerze an und notiere deine Beobachtungen: Was passiert eigentlich genau bei der Verbrennung einer Kerze? Diese Frage versuchen wir in diesem Kapitel zu beantworten. Schauen
Verbrennung einer Kerze Zünde eine Kerze an und notiere deine Beobachtungen: Was passiert eigentlich genau bei der Verbrennung einer Kerze? Diese Frage versuchen wir in diesem Kapitel zu beantworten. Schauen
Aufgaben verändern Beispiele zur Chemie
 A2-2-2 Aufgaben verändern Beispiele zur Chemie 1 Aufgaben verändern Beispiele zur Chemie Die folgenden beiden Varianten einer Aufgabe zeigen exemplarisch, wie unterschiedlich Frage- und Aufgabenstellungen,
A2-2-2 Aufgaben verändern Beispiele zur Chemie 1 Aufgaben verändern Beispiele zur Chemie Die folgenden beiden Varianten einer Aufgabe zeigen exemplarisch, wie unterschiedlich Frage- und Aufgabenstellungen,
Besteht die 5-Cent-Münze eigentlich aus Kupfer?
 Besteht die 5-Cent-Münze ERPROBUNGSFASSUNG eigentlich aus Kupfer? Die 5-Cent-Münze sieht aus, als ob sie aus Kupfer gefertigt ist. Aber ist sie das wirklich? Die Münze wird von einem Magneten angezogen.
Besteht die 5-Cent-Münze ERPROBUNGSFASSUNG eigentlich aus Kupfer? Die 5-Cent-Münze sieht aus, als ob sie aus Kupfer gefertigt ist. Aber ist sie das wirklich? Die Münze wird von einem Magneten angezogen.
Wie wirkt sich die Zugabe von Salz auf den Schmelz- und Siedepunkt von Wasser aus?
 Naturwissenschaften - Chemie - Allgemeine Chemie - 7 Chemische Bindung (P752400) 7.4 Schmelzpunktserniedrigung und Siedepunktserhöhung Experiment von: Phywe Gedruckt:.0.203 3:5:43 intertess (Version 3.06
Naturwissenschaften - Chemie - Allgemeine Chemie - 7 Chemische Bindung (P752400) 7.4 Schmelzpunktserniedrigung und Siedepunktserhöhung Experiment von: Phywe Gedruckt:.0.203 3:5:43 intertess (Version 3.06
Fachrichtung Klima- und Kälteanlagenbauer
 Fachrichtung Klima- und Kälteanlagenbauer 1-7 Schüler Datum: 1. Titel der L.E. : 2. Fach / Klasse : Fachrechnen, 3. Ausbildungsjahr 3. Themen der Unterrichtsabschnitte : 1. Zustandsänderung 2. Schmelzen
Fachrichtung Klima- und Kälteanlagenbauer 1-7 Schüler Datum: 1. Titel der L.E. : 2. Fach / Klasse : Fachrechnen, 3. Ausbildungsjahr 3. Themen der Unterrichtsabschnitte : 1. Zustandsänderung 2. Schmelzen
Wärmelehre/Thermodynamik. Wintersemester 2007
 Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 2007 Vladimir Dyakonov #12 am 26.01.2007 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 2007 Vladimir Dyakonov #12 am 26.01.2007 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
Die Brandbekämpfung (Gruppenversuche)
 Die Brandbekämpfung (Gruppenversuche) Führt die folgenden Versuche nacheinander durch. Lest die Versuchsbeschreibungen (Kopie) genau durch und klebt sie sofort in eure Haushefte ein. Notiert mit Bleistift
Die Brandbekämpfung (Gruppenversuche) Führt die folgenden Versuche nacheinander durch. Lest die Versuchsbeschreibungen (Kopie) genau durch und klebt sie sofort in eure Haushefte ein. Notiert mit Bleistift
N & T (R) 1 Stoffeigenschaften 01 Name: Vorname: Datum:
 N & T (R) 1 Stoffeigenschaften 01 Name: Vorname: Datum: Aufgabe 1: Natur und Technik wird aufgeteilt in drei Teilbereiche: diese sind jedoch nicht immer ganz klar abgetrennt: Wasser kann zum Kochen und
N & T (R) 1 Stoffeigenschaften 01 Name: Vorname: Datum: Aufgabe 1: Natur und Technik wird aufgeteilt in drei Teilbereiche: diese sind jedoch nicht immer ganz klar abgetrennt: Wasser kann zum Kochen und
Grundlagen der Wärmelehre
 Ausgabe 2007-09 Grundlagen der Wärmelehre (Erläuterungen) Die Wärmelehre ist das Teilgebiet der Physik, in dem Zustandsänderungen von Körpern infolge Zufuhr oder Abgabe von Wärmeenergie und in dem Energieumwandlungen,
Ausgabe 2007-09 Grundlagen der Wärmelehre (Erläuterungen) Die Wärmelehre ist das Teilgebiet der Physik, in dem Zustandsänderungen von Körpern infolge Zufuhr oder Abgabe von Wärmeenergie und in dem Energieumwandlungen,
Element. Verbindung. Reinstoff. homogenes Gemisch
 Element Reinstoff, der chemisch nicht mehr zersetzt werden kann dessen Teilchen (Atome oder Moleküle) aus einer einzigen Atomart (gleiche Ordnungszahl) besteht Verbindung = Reinstoff, der sich in Elemente
Element Reinstoff, der chemisch nicht mehr zersetzt werden kann dessen Teilchen (Atome oder Moleküle) aus einer einzigen Atomart (gleiche Ordnungszahl) besteht Verbindung = Reinstoff, der sich in Elemente
Physik1. Physik der Wärme. WS 15/16 1. Sem. B.Sc. Oec. und B.Sc. CH
 3 Physik1. Physik der Wärme. WS 15/16 1. Sem. B.Sc. Oec. und B.Sc. CH Physik Wärme 5 Themen Begriffsklärung Anwendungen Temperaturskalen Modellvorstellung Wärmeausdehnung Thermische Ausdehnung Phasenübergänge
3 Physik1. Physik der Wärme. WS 15/16 1. Sem. B.Sc. Oec. und B.Sc. CH Physik Wärme 5 Themen Begriffsklärung Anwendungen Temperaturskalen Modellvorstellung Wärmeausdehnung Thermische Ausdehnung Phasenübergänge
Antrieb und Wärmebilanz bei Phasenübergängen. Speyer, März 2007
 Antrieb und Wärmebilanz bei Phasenübergängen Speyer, 19-20. März 2007 Michael Pohlig, WHG-Durmersheim michael@pohlig.de Literatur: Physik in der Oberstufe; Duden-PAETEC Schmelzwärme wird auch als Schmelzenergie
Antrieb und Wärmebilanz bei Phasenübergängen Speyer, 19-20. März 2007 Michael Pohlig, WHG-Durmersheim michael@pohlig.de Literatur: Physik in der Oberstufe; Duden-PAETEC Schmelzwärme wird auch als Schmelzenergie
Sekundarschule Kilchberg / Curdin Riedi
 Sekundarschule Kilchberg / Curdin Riedi Inhaltsverzeichnis 1. Einführung... 3 2. Laborarbeit... 4 2.1 Laborregeln/Verhalten beim Experimentieren... 4 2.2 Gefahrensymbole... 6 3. Vertrag «Verhaltensregeln»...
Sekundarschule Kilchberg / Curdin Riedi Inhaltsverzeichnis 1. Einführung... 3 2. Laborarbeit... 4 2.1 Laborregeln/Verhalten beim Experimentieren... 4 2.2 Gefahrensymbole... 6 3. Vertrag «Verhaltensregeln»...
Molzahl: n = N/N A [n] = mol N ist die Anzahl der Atome oder Moleküle des Stoffes. Molmasse oder Molekularmasse: M [M ]= kg/kmol
![Molzahl: n = N/N A [n] = mol N ist die Anzahl der Atome oder Moleküle des Stoffes. Molmasse oder Molekularmasse: M [M ]= kg/kmol Molzahl: n = N/N A [n] = mol N ist die Anzahl der Atome oder Moleküle des Stoffes. Molmasse oder Molekularmasse: M [M ]= kg/kmol](/thumbs/50/26795947.jpg) 2. Zustandsgrößen 2.1 Die thermischen Zustandsgrößen 2.1.1. Masse und Molzahl Reine Stoffe: Ein Mol eines reinen Stoffes enthält N A = 6,02214. 10 23 Atome oder Moleküle, N A heißt Avogadro-Zahl. Molzahl:
2. Zustandsgrößen 2.1 Die thermischen Zustandsgrößen 2.1.1. Masse und Molzahl Reine Stoffe: Ein Mol eines reinen Stoffes enthält N A = 6,02214. 10 23 Atome oder Moleküle, N A heißt Avogadro-Zahl. Molzahl:
A Sie ist weniger als 1 kg/dm 3. B E F D A G C. Zusammengesetzte Grössen 15
 1. Richtig oder falsch? A Stoffe mit einer Dichte unter 1 kg/dm 3 schwimmen in Wasser. Richtig B Die Dichte von kleinen Körpern ist immer kleiner als die Dichte von grossen Körpern. Falsch C Schwere Körper
1. Richtig oder falsch? A Stoffe mit einer Dichte unter 1 kg/dm 3 schwimmen in Wasser. Richtig B Die Dichte von kleinen Körpern ist immer kleiner als die Dichte von grossen Körpern. Falsch C Schwere Körper
mischbar Lösung Feststoffen
 Kristalle züchten Mischen und Lösen - Nicht alle Stoffe sind miteinander mischbar. --> Hexan (Bestandteil von Benzin) und Wasser --> Hast du Beispiele aus dem Alltag? - Kann man die Stoffe nach dem Mischen
Kristalle züchten Mischen und Lösen - Nicht alle Stoffe sind miteinander mischbar. --> Hexan (Bestandteil von Benzin) und Wasser --> Hast du Beispiele aus dem Alltag? - Kann man die Stoffe nach dem Mischen
Experimente Lehrerinformation
 Lehrerinformation 1/7 Arbeitsauftrag Die SuS experimentieren mit Salz und lernen es von der chemischen Seite her besser kennen. Dabei lernen sie in Modellversuchen wichtige Merkmale von Salz kennen. Ziel
Lehrerinformation 1/7 Arbeitsauftrag Die SuS experimentieren mit Salz und lernen es von der chemischen Seite her besser kennen. Dabei lernen sie in Modellversuchen wichtige Merkmale von Salz kennen. Ziel
Stoff, Reinstoff, Gemisch, homogenes Gemisch, heterogenes Gemisch. Reinstoff, Element, Verbindung. Zweiatomige Elemente.
 1 1 Einteilung der Stoffe: Stoff, Reinstoff, Gemisch, homogenes Gemisch, heterogenes Gemisch Stoff Reinstoff Mischen Gemisch Bei gleichen Bedingungen (Temperatur, Druck) immer gleiche Eigenschaften (z.b.
1 1 Einteilung der Stoffe: Stoff, Reinstoff, Gemisch, homogenes Gemisch, heterogenes Gemisch Stoff Reinstoff Mischen Gemisch Bei gleichen Bedingungen (Temperatur, Druck) immer gleiche Eigenschaften (z.b.
Die Kleinsten unter den Kleinen. - Einführung eines Teilchenmodells
 Carl-von-Ossietzky-Universität Oldenburg Fakultät V Institut für reine und angewandte Chemie Didaktik der Chemie Arbeitsmaterialien Chemie Die Kleinsten unter den Kleinen - Einführung eines Teilchenmodells
Carl-von-Ossietzky-Universität Oldenburg Fakultät V Institut für reine und angewandte Chemie Didaktik der Chemie Arbeitsmaterialien Chemie Die Kleinsten unter den Kleinen - Einführung eines Teilchenmodells
Stoffeigenschaften: Dichte und Löslichkeit
 Grundlagenfach Chemie 4. Kl. 1/5 Stoffeigenschaften: Dichte und Löslichkeit Einleitung Chemie ist die Lehre von Stoffen. Eine wichtige Unterscheidung ist die Einteilung in Reinstoffe und Gemische. Gemische
Grundlagenfach Chemie 4. Kl. 1/5 Stoffeigenschaften: Dichte und Löslichkeit Einleitung Chemie ist die Lehre von Stoffen. Eine wichtige Unterscheidung ist die Einteilung in Reinstoffe und Gemische. Gemische
Bist Du nicht "FIT", dann musst Du nacharbeiten.
 Überlege zunächst, ob Du die gestellte Frage beantworten kannst und kreuze in der Tabelle entsprechend an. Überprüfe Deine Angabe an Hand der entsprechenden Aufgabe. (Die Nummerierung der Frage und der
Überlege zunächst, ob Du die gestellte Frage beantworten kannst und kreuze in der Tabelle entsprechend an. Überprüfe Deine Angabe an Hand der entsprechenden Aufgabe. (Die Nummerierung der Frage und der
Zweisprachiger Wettbewerb Physik 2. Schuljahr
 Zweisprachiger Wettbewerb Physik 2. Schuljahr Lieber Schüler, liebe Schülerin, Der Wettbewerb besteht aus 20 Fragen. Sie sollten von den vorgegebenen Lösungsmöglichkeiten immer die einzige richtige Lösung
Zweisprachiger Wettbewerb Physik 2. Schuljahr Lieber Schüler, liebe Schülerin, Der Wettbewerb besteht aus 20 Fragen. Sie sollten von den vorgegebenen Lösungsmöglichkeiten immer die einzige richtige Lösung
Arbeitsblatt Wasserkreislauf der Erde
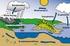 Arbeitsblatt Wasserkreislauf der Erde Aufgabe 1) Du hast im Unterricht bereits den Begriff des Aggregatzustands kennengelernt. Benenne die Übergänge zwischen den Aggregatzuständen, indem du die Pfeile
Arbeitsblatt Wasserkreislauf der Erde Aufgabe 1) Du hast im Unterricht bereits den Begriff des Aggregatzustands kennengelernt. Benenne die Übergänge zwischen den Aggregatzuständen, indem du die Pfeile
Institut für Anorganische Chemie (Materialchemie)
 1. Gib auf das Blatt Papier 2 Teelöffel Sand, 2 Teelöffel Kochsalz und einige kleine Nägel. 2. Vermische die drei Stoffe gut miteinander. Du hast jetzt ein so genanntes Gemenge hergestellt. 3. Zur Abtrennung
1. Gib auf das Blatt Papier 2 Teelöffel Sand, 2 Teelöffel Kochsalz und einige kleine Nägel. 2. Vermische die drei Stoffe gut miteinander. Du hast jetzt ein so genanntes Gemenge hergestellt. 3. Zur Abtrennung
Trenne ein Gemisch aus Sand und Kochsalz sowie ein Gemisch aus Sand und Eisen.
 Naturwissenschaften - Chemie - Allgemeine Chemie - 3 Trennverfahren (P750900) 3.2 Gemischtrennungen - Filtrieren, Magnetscheidung Experiment von: Phywe Gedruckt:.0.203 2:53:30 intertess (Version 3.06 B200,
Naturwissenschaften - Chemie - Allgemeine Chemie - 3 Trennverfahren (P750900) 3.2 Gemischtrennungen - Filtrieren, Magnetscheidung Experiment von: Phywe Gedruckt:.0.203 2:53:30 intertess (Version 3.06 B200,
Fachhochschule Flensburg. Institut für Physik
 Name: Fachhochschule Flensburg Fachbereich Technik Institut für Physik Versuch-Nr.: W 2 Bestimmung der Verdampfungswärme von Wasser Gliederung: Seite Einleitung Versuchsaufbau (Beschreibung) Versuchsdurchführung
Name: Fachhochschule Flensburg Fachbereich Technik Institut für Physik Versuch-Nr.: W 2 Bestimmung der Verdampfungswärme von Wasser Gliederung: Seite Einleitung Versuchsaufbau (Beschreibung) Versuchsdurchführung
Lösungen Serie 16: Kalorimetrie
 en Serie 16: Kalorimetrie Aufgabe 16.1 A Sie wollen in einem Kochtopf ( =0.6, =0.4 ( =4.182 k K gegeben: =0.6 =0.4 k K ) einen halben Liter Wasser ) von 10 auf 40 erwärmen. Welche Wärmemenge ist dazu notwendig?
en Serie 16: Kalorimetrie Aufgabe 16.1 A Sie wollen in einem Kochtopf ( =0.6, =0.4 ( =4.182 k K gegeben: =0.6 =0.4 k K ) einen halben Liter Wasser ) von 10 auf 40 erwärmen. Welche Wärmemenge ist dazu notwendig?
(c) Schulbedarfszentrum
 für die 7. Schulstufe Theoretischer Teil Wärmekapazität Elektrische Ladung Lückentexte Quiz Experimente Wärme und Temperatur Metalle Druck Das Ohm sche Gesetz Wissensüberprüfungen Merktexte Denkaufgaben
für die 7. Schulstufe Theoretischer Teil Wärmekapazität Elektrische Ladung Lückentexte Quiz Experimente Wärme und Temperatur Metalle Druck Das Ohm sche Gesetz Wissensüberprüfungen Merktexte Denkaufgaben
a) Welche der folgenden Aussagen treffen nicht zu? (Dies bezieht sind nur auf Aufgabenteil a)
 Aufgabe 1: Multiple Choice (10P) Geben Sie an, welche der Aussagen richtig sind. Unabhängig von der Form der Fragestellung (Singular oder Plural) können eine oder mehrere Antworten richtig sein. a) Welche
Aufgabe 1: Multiple Choice (10P) Geben Sie an, welche der Aussagen richtig sind. Unabhängig von der Form der Fragestellung (Singular oder Plural) können eine oder mehrere Antworten richtig sein. a) Welche
Was macht die Chemie??? Um die Eigenschaften von Stoffen zu untersuchen, müssen diese als reine Stoffe vorliegen.
 Was macht die Chemie??? Um die Eigenschaften von Stoffen zu untersuchen, müssen diese als reine Stoffe vorliegen. Salatsosse Ein Gemisch Ich stelle eine Salatsosse her und mische dazu: -Wasser -Essig -Öl
Was macht die Chemie??? Um die Eigenschaften von Stoffen zu untersuchen, müssen diese als reine Stoffe vorliegen. Salatsosse Ein Gemisch Ich stelle eine Salatsosse her und mische dazu: -Wasser -Essig -Öl
N & T 1 Stoffeigenschaften 01 Name: Vorname: Datum:
 N & T 1 Stoffeigenschaften 01 Name: Vorname: Datum: Aufgabe 1: Natur und Technik wird aufgeteilt in drei Teilbereiche: diese sind jedoch nicht immer ganz klar abgetrennt: Wasser kann zum Kochen und zum
N & T 1 Stoffeigenschaften 01 Name: Vorname: Datum: Aufgabe 1: Natur und Technik wird aufgeteilt in drei Teilbereiche: diese sind jedoch nicht immer ganz klar abgetrennt: Wasser kann zum Kochen und zum
1. Wärmelehre 1.1. Temperatur. Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités)
 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für die Temperatur Prinzip
1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für die Temperatur Prinzip
Versuch Nr.53. Messung kalorischer Größen (Spezifische Wärmen)
 Versuch Nr.53 Messung kalorischer Größen (Spezifische Wärmen) Stichworte: Wärme, innere Energie und Enthalpie als Zustandsfunktion, Wärmekapazität, spezifische Wärme, Molwärme, Regel von Dulong-Petit,
Versuch Nr.53 Messung kalorischer Größen (Spezifische Wärmen) Stichworte: Wärme, innere Energie und Enthalpie als Zustandsfunktion, Wärmekapazität, spezifische Wärme, Molwärme, Regel von Dulong-Petit,
WASSER. Station 1. com. N Arbeitsblatt
 Station 1 Du brauchst einen Kübel gefüllt mit etwas Wasser und die verschiedenen Materialien aus der Liste. Lege die Gegenstände einzeln ins Wasser und überprüfe, do sie auf der Oberfläche schwimmen oder
Station 1 Du brauchst einen Kübel gefüllt mit etwas Wasser und die verschiedenen Materialien aus der Liste. Lege die Gegenstände einzeln ins Wasser und überprüfe, do sie auf der Oberfläche schwimmen oder
R. Brinkmann Seite
 R. Brinkmann http://brinkmanndu.de Seite 1 26.11.2013 Der Aufbau der Atome Atommodelle. Annahme: Kleinste Teilchen als Grundbausteine aller Stoffe. Mit Hilfe der Vorstellung, dass alle Stoffe aus kleinsten
R. Brinkmann http://brinkmanndu.de Seite 1 26.11.2013 Der Aufbau der Atome Atommodelle. Annahme: Kleinste Teilchen als Grundbausteine aller Stoffe. Mit Hilfe der Vorstellung, dass alle Stoffe aus kleinsten
Schuleigener Lehrplan Chemie, Klasse 5 und 6
 Schuleigener Lehrplan Chemie, Klasse 5 und 6 Sachkenntnis S - Physikalische und chemische Phänomene auf der Modellebene von Teilchen deuten S1 - Chemische Reaktionen als Veränderung auf der Stoff- und
Schuleigener Lehrplan Chemie, Klasse 5 und 6 Sachkenntnis S - Physikalische und chemische Phänomene auf der Modellebene von Teilchen deuten S1 - Chemische Reaktionen als Veränderung auf der Stoff- und
B E I S P I E L A R B E I T / Lösungen. Kultusministerium
 Kultusministerium Name, Vorname: Klasse: Schule: Seite 1 von 6 Aufgabe 1: Stoffe und ihre Eigenschaften a) Die Naturwissenschaft Chemie untersucht u. a. die Eigenschaften der Stoffe und ordnet diese danach.
Kultusministerium Name, Vorname: Klasse: Schule: Seite 1 von 6 Aufgabe 1: Stoffe und ihre Eigenschaften a) Die Naturwissenschaft Chemie untersucht u. a. die Eigenschaften der Stoffe und ordnet diese danach.
Mischen und. Trennen. Forschertagebuch von
 Mischen und Trennen Forschertagebuch von Forscherauftrag 1 Ein Stück Zucker geht baden > 2 Gläser > zwei Zuckerwürfel > warmes und kaltes Wasser > ein Thermometer > Traubenzucker 1. Fülle beide Gläser
Mischen und Trennen Forschertagebuch von Forscherauftrag 1 Ein Stück Zucker geht baden > 2 Gläser > zwei Zuckerwürfel > warmes und kaltes Wasser > ein Thermometer > Traubenzucker 1. Fülle beide Gläser
Wie verändern sich die Eigenschaften der Alkohole bei Zunahme der Kohlenstoffzahl?
 Naturwissenschaften - Chemie - Organische Chemie - 4 Alkohole (P77200) 4.6 Eigenschaften der homologen Reihe Experiment von: Phywe Gedruckt: 20.07.206 3:58:38 intertess (Version 3.2 B24, Export 2000) Aufgabe
Naturwissenschaften - Chemie - Organische Chemie - 4 Alkohole (P77200) 4.6 Eigenschaften der homologen Reihe Experiment von: Phywe Gedruckt: 20.07.206 3:58:38 intertess (Version 3.2 B24, Export 2000) Aufgabe
Was kocht denn da? Stoffe und ihre Aggregatzustände
 en Was kocht denn da? Stoffe und ihre Aggregatzustände Ein Film von Wolfgang Voelker Beitrag: Rupert Ernhofer Inhalt Was haben Wasser, Dampf und Eis gemeinsam? Richtig: trotz unterschiedlicher Bezeichnungen
en Was kocht denn da? Stoffe und ihre Aggregatzustände Ein Film von Wolfgang Voelker Beitrag: Rupert Ernhofer Inhalt Was haben Wasser, Dampf und Eis gemeinsam? Richtig: trotz unterschiedlicher Bezeichnungen
Fragen und Antworten für den 1. Physik- und Chemietest 3. Klasse
 Fragen und Antworten für den 1. Physik- und Chemietest 3. Klasse Schreib die Fragen auf deine Karteikärtchen und beantworte sie mit Bleistift. Wenn du alle beantwortet hast, bekommst du von mir die Antworten,
Fragen und Antworten für den 1. Physik- und Chemietest 3. Klasse Schreib die Fragen auf deine Karteikärtchen und beantworte sie mit Bleistift. Wenn du alle beantwortet hast, bekommst du von mir die Antworten,
